Изобретение относится к 2-(4-морфолино)этил-Е-6-(1,3-дигидро-4-гидрокси-6-метокси-7-метил-3-оксо-5-изобензофуранил)-4- метил-4-гексеноату (далее ММ), в частности к ММ в форме его безводной кристаллической соли.
Изобретение также относится к внутривенным композициям для введения ММ и способу получения внутривенных композиций с использованием соли ММ в ее кристаллической безводной форме, где соль получают in situ и лиофилизуют. Изобретение также относится к применению таких композиций для лечения аутоиммунных нарушений, псориаза, воспалительных заболеваний (включающих, в частности, ревматоидные артриты), опухолей и вирусных заболеваний и для иммуносупрессии, в частности для лечения отторжения аллотрансплантатов, прежде всего отторжения сердечных аллотрансплантатов, отторжения панкреатических аллотрансплантатов и отторжения почечных аллотрансплантатов, а также для лечения аутоиммунных заболеваний, включая диабет.
Родственные патенты США
В патенте США 4753935, выданном 28 июня 1988 г., озаглавленном "Morpholinoethyl Esters of Mycophenolic Acid and Pharmaceutical Compositions", описан мофетил микофенолята, т.е. морфолиноэтиловый эфир микофенольной кислоты, и некоторые представители ее эфирных производных.
В патенте США 4808592, выданном 28 февраля 1989 г., озаглавленном "Method of Treating Diseases by Administering Morpholinoethyl Ester of Mycophenolic Acid and Derivatives Thereof", описан способ лечения воспалительных болезней и псориазов у млекопитающих путем введения терапевтически эффективного количества мофетила микофенолята, т.е. морфолиноэтилового эфира микофенольной кислоты, или некоторого представителя ее эфирного производного.
В патенте США 4952579, выданном 28 августа 1990 г., озаглавленном "Method of Treating Diseases by Administering Morpholinoethyl Ester of Mycophenolic Acid and Derivatives Thereof", описан способ лечения злокачественных заболеваний у млекопитающих с помощью применения терапевтически эффективного количества мофетила микофенолята, т.е. морфолиноэтилового эфира микофенольной кислоты, или некоторых представителей ее эфирных производных.
В патенте США 4786637, выданном 22 ноября 1988 г., озаглавленном "Treatment of Allograft Rejection with Mycophenolic Acid Morpholinoethyl Ester and Derivatives Thereof", описан способ лечения отторжения аллотрансплантатов у млекопитающих путем введения терапевтически эффективного количества мофетила микофенолята, т.е. морфолиноэтилового эфира микофенольной кислоты, или некоторых представителей ее эфирных производных.
В патенте США 4948793, выданном 14 августа 1990 г., озаглавленном "Treatment of Autoimmune Diseases with the Morpholinoethyl Ester of Mycophenolic Acid and Derivatives Thereof", описан способ лечения аутоиммунных заболеваний путем введения терапевтически эффективного количества мофетила микофенолята, т. е. морфолиноэтилового эфира микофенольной кислоты, или некоторых представителей ее эфирных производных.
В патенте США 4992467, выданном 12 февраля 1991 г., озаглавленном "Treatment of Autoimmune Diseases with Mycophenolic Acid and Derivatives and Formulations Thereof", описан способ лечения аутоиммунных заболеваний у млекопитающих путем введения терапевтически эффективного количества некоторых представителей фенольных эфиров микофенольной кислоты.
Все вышеуказанные патенты США включены в настоящее описание в качестве ссылок.
Предпосылки создания изобретения
Микофенольная кислота представляет собой слабый антибиотик, найденный в ферментативном бульоне Penicillium brevi-compactum. Было обнаружено, что производные микофенольной кислоты, в частности ее морфолиноэтиловый эфир [т. е. гидрохлорид 2-(4-морфолино)этил- (Е)-6-(1,3-дигидро-4-гидрокси-6-метокси-7-метил-3-оксо-5- изобензофуранил) -4-метил-4-гексеноата] и некоторые представители эфирных производных фенольной гидроксильной группы, эффективны при лечении аутоиммунных нарушений, псориаза, воспалительных заболеваний (включающих, в частности, ревматоидные артриты), опухолей, вирусных заболеваний, отторжения аллотрансплантатов, прежде всего отторжения сердечных аллотрансплантатов, отторжения панкреатических аллотрансплантатов и отторжения почечных аллотрансплантатов, а также аутоиммунных заболеваний, включая диабет. По сравнению с микофенольной кислотой эти эфирные производные проявляют улучшенные фармакокинетические свойства, которые усиливают системное введение микофенольной кислоты, например растворимость в месте поступления лекарства (например, в желудке), пик концентрации в плазме, максимум концентрации в плазме и улучшенную активность, например противовоспалительную активность.
Введение терапевтических агентов с помощью внутривенной композиции хорошо известно в фармацевтической практике. Внутривенная композиция должна обладать определенными качествами, а не являться только композицией, в которой растворим терапевтический агент. Например, композиция должна обеспечивать общую стабильность действующего вещества (в), изготовление композиции должно быть эффективным с точки зрения стоимости. Все эти факторы в конечном счете и определяют общую эффективность и полезность внутривенной композиции.
ММ в форме его моногидратной соли более стабилен, чем ММ в форме его аморфной соли, однако аморфная соль обладает лучшими характеристиками растворимости. Неожиданно обнаружено, что впервые открытая безводная кристаллическая форма соли ММ обладает примерно в два раза большей растворимостью по сравнению с моногидратной формой соли, обладая при этом такими же характеристиками стабильности, что и моногидратная форма соли.
Один предмет изобретения относится к кристаллическому безводному соединению формулы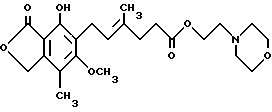
(т. е. ММ), где ММ образует комплекс в форме соли, где анион выбран из группы, включающей хлорид, сульфат, фосфат и ацетат.
Другой предмет изобретения относится к кристаллической безводной форме ММ•HCl, т. е. гидрохлориду 2-(4-морфолино)этил-(Е)- 6-(1,3-дигидро-4-гидрокси-6-метокси-7-метил-3-оксо-5- изобензофуранил)-4-метил-4-гексеноата.
Еще одним предметом изобретения является пригодный для получения водной внутривенной композиции состав, включающий ММ, т.е. соединение формулы I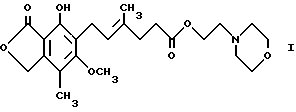
где MM образует комплекс в форме фармацевтически приемлемой соли, где анион выбран из группы, включающей хлорид, сульфат, фосфат и ацетат, а указанная фармацевтически приемлемая соль представлена в своей кристаллической безводной форме, и фармацевтически приемлемые эксципиенты.
Еще один предмет изобретения относится к способу изготовления состава, при осуществлении которого pH раствора, из которого получают данный состав, регулируют в диапазоне от 3,2 до 3,6, соль получают in situ и раствор лиофилизуют, получая соединение формулы I в его кристаллической безводной форме.
Еще одним предметом изобретения является применение вышеуказанного соединения формулы I для лечения заболеваний, таких как аутоиммунные нарушения, псориаз, воспалительные заболевания (включающие, в частности, ревматоидные артриты), опухоли, вирусные заболевания, аутоиммунные заболевания, включая диабет, отторжение аллотрансплантатов, в частности отторжение сердечных аллотрансплантатов, отторжение панкреатических аллотрансплантатов и отторжение почечных аллотрансплантатов.
Еще одним предметом изобретения является набор, применяемый для получения внутривенной композиции, включающий: а) состав, пригодный для получения водной внутривенной композиции, включающий вышеуказанное соединение формулы I, где указанное соединение образует комплекс в форме соли, где анион выбран из группы, включающей хлорид, сульфат, фосфат и ацетат, а указанная соль представлена в своей кристаллической безводной форме; и фармацевтически приемлемые эксципиенты; и б) соответствующее количество жидкой среды.
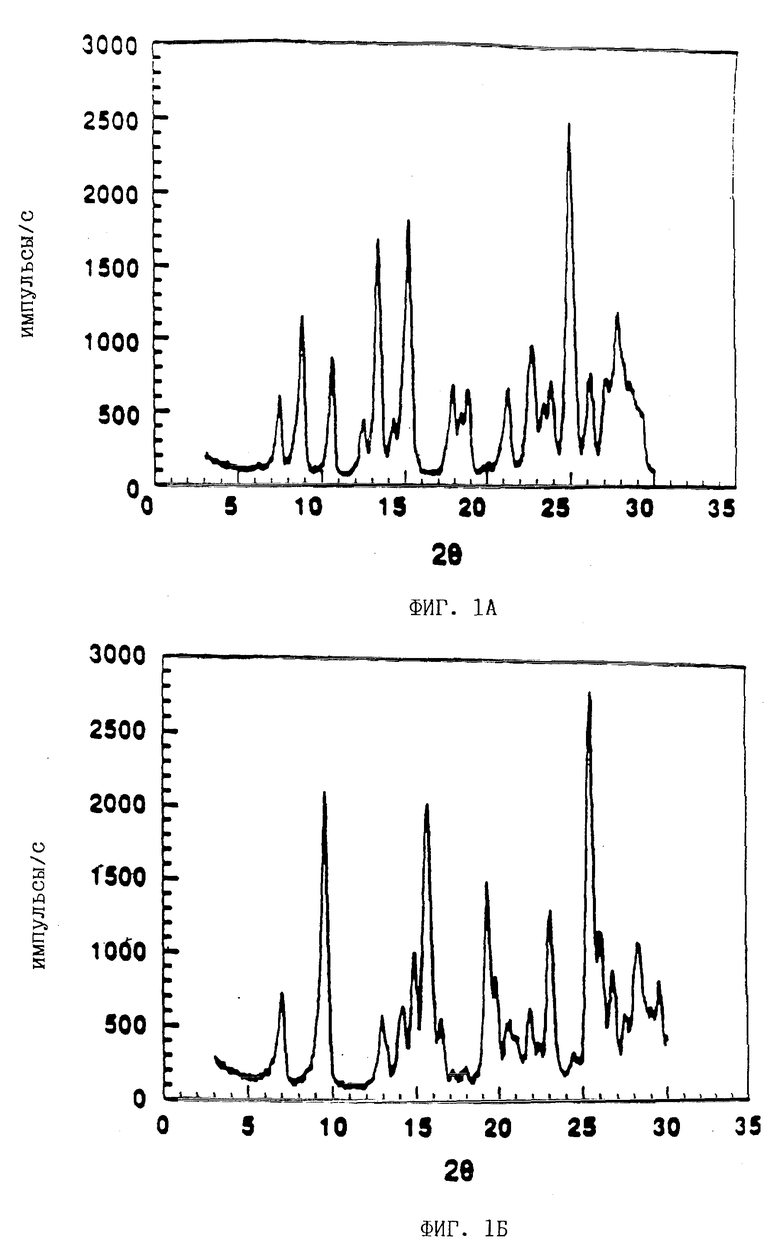
На фиг. 1А показана картина дифракции рентгеновских лучей для кристаллической моногидратной формы ММ•HCl.
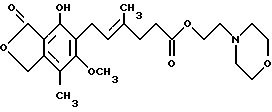
На фиг. 1Б показана картина дифракции рентгеновских лучей для кристаллической безводной формы ММ•HCl.
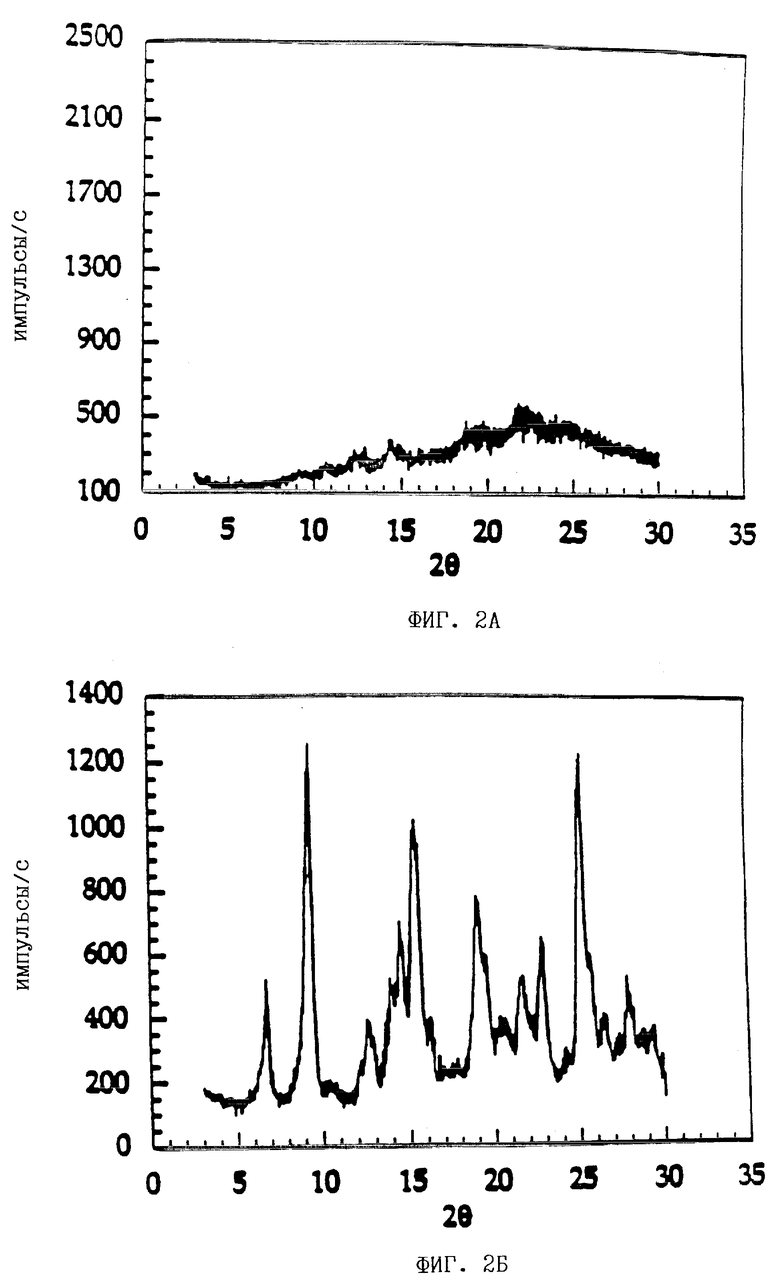
На фиг. 2А показана картина дифракции рентгеновских лучей для состава, содержащего аморфную форму ММ•HCl.
На фиг. 2Б показана картина дифракции рентгеновских лучей для состава, содержащего кристаллическую безводную форму ММ•HCl с полисорбатом 80.
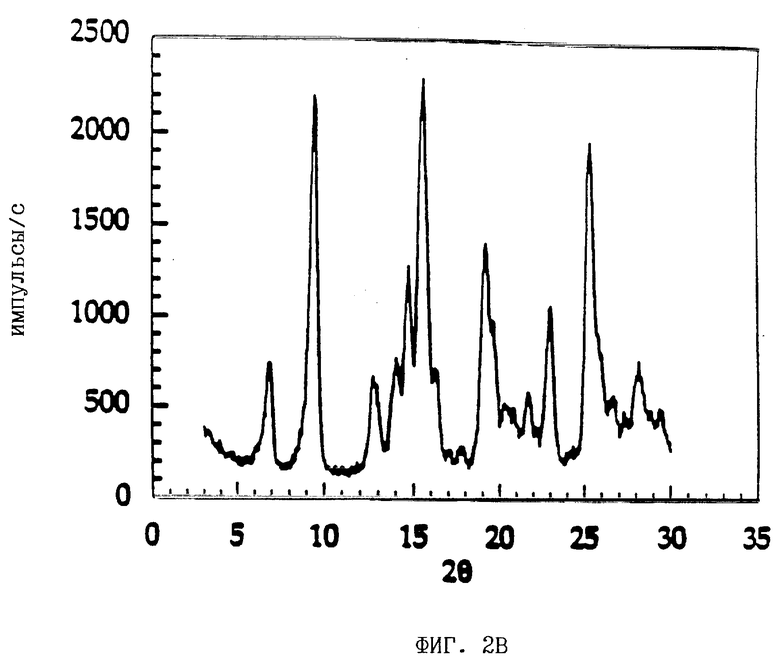
На фиг. 2В показана картина дифракции рентгеновских лучей для состава, содержащего кристаллическую безводную форму ММ•HCl без полисорбата 80.
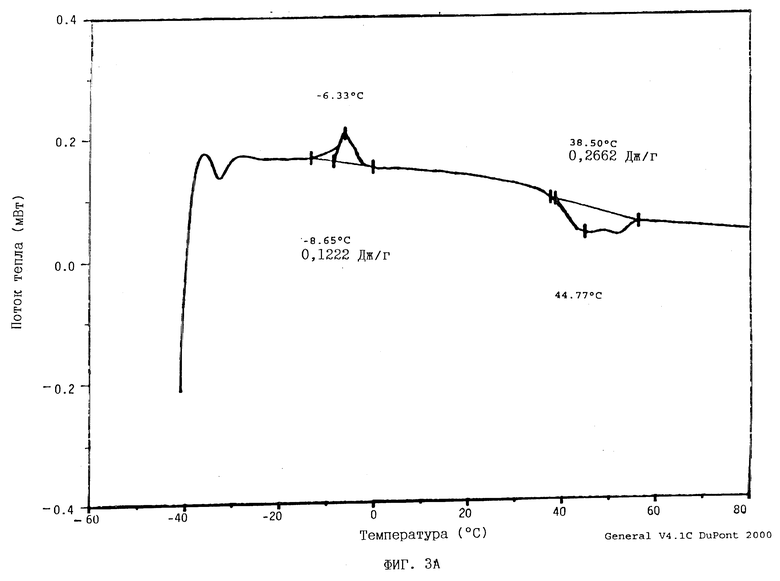
На фиг. 3А показана термограмма, полученная с помощью дифференциальной сканирующей калориметрии (далее "ДСК") для аморфной формы ММ•HCl.
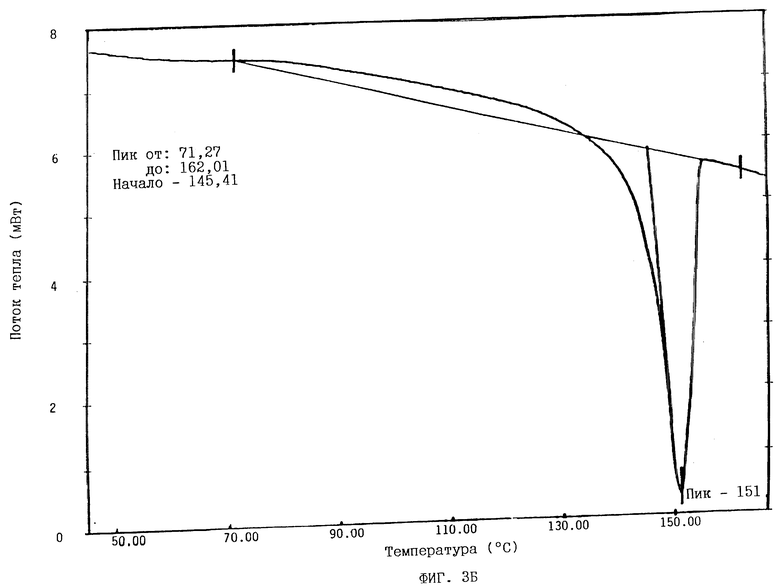
На фиг. 3Б показана термограмма, полученная с помощью ДСК для кристаллической безводной формы ММ•HCl после процесса лиофилизации.
Определения
Следующие определения приведены для иллюстрации и уточнения значения и объема различных терминов, используемых для описания настоящего изобретения.
Используемый в описании термин "фармацевтически приемлемая соль" относится к соединению, которое с помощью ионной связи образует комплекс с анионом, таким как хлорид, сульфат, цитрат, ацетат, фосфат, малеат и/или мезилат. В настоящем описании соединения формулы I могут образовывать комплекс с различными анионами, формируя соответствующую фармацевтически приемлемую соль, например, соляная кислота и морфолиноэтиловый эфир микофенольной кислоты могут образовывать фармацевтически приемлемую соль, а именно, гидрохлорид 2-(4-морфолино)этил-(Е)-6-(1,3-дигидро-4- гидрокси-6-метокси-7-метил-3-оксо-5-изобензофуранил)-4-метил-4- гексеноата.
Термин "кристаллическая форма" или "в форме кристаллов" обозначает, что конкретный материал имеет определенную форму и упорядоченное расположение структурных единиц, которые расположены в виде фиксированных геометрических конструкций или решеток.
Термин "кристаллический моногидрат" или "моногидратный кристалл" обозначает, что кристаллическая форма конкретного материала включает одну молекулу воды.
Термин "кристаллический безводный" или "безводный кристалл" обозначает, что кристаллическая форма конкретного материала не содержит молекул воды.
Термин "аморфная форма" обозначает, что конкретный материал не имеет ни определенной формы, ни упорядоченного расположения структурных единиц.
Термин "фармацевтически приемлемые эксципиенты" относится к таким материалам, которые пригодны для использования в фармацевтических композициях и которые добавляют к композиции для обеспечения стабильности и долговечности данной композиции (например, наполнители, осветляющие агенты и забуферивающие агенты).
Термин "наполнитель" относится к таким веществам, как декстроза, маннит и/или сахароза, которые применяют для придания объема, обеспечивая структурную основу, и для стабилизации композиции, т.е. для замедления или предотвращения разложения терапевтического агента.
Термин "осветляющий агент" относится к соединениям типа поверхностно-активных веществ, таким, как полисорбат 80, которые используют для снижения помутнения раствора.
Термин "забуферивающий агент" относится к соединениям, которые препятствуют изменению значения pH при добавлении H+ или ОН-. Забуферивающий агент в наибольшей степени препятствует изменению pH в точной средней точке кривой титрования, т. е. когда концентрация протонного акцептора равна таковой протонного донора и значение pH равно pK' (показателю кислотности). Забуферивающий агент может быть индивидуальным соединением, например лимонной кислотой, или комбинацией соединений.
Термин "д. к. " обозначает добавление количества, достаточного для достижения определенного состояния (например, объема, т.е. доведение раствора до требуемого объема).
Термин "д. к. до pH" обозначает добавление кислоты или основания в количестве, достаточном для доведения раствора до требуемого pH (например, д. к. до pH 3,4 обозначает добавление кислоты или основания для доведения раствора до pH 3,4).
Термин "ВИ" относится к воде для инъекций, которая удовлетворяет требованиям, изложенным в Фармакопее США (U.S.P.).
Термин "градиент скорости" обозначает скорость, с которой изменяется температура (например, увеличивается или уменьшается) в некотором диапазоне температур.
Термин "восстановление" относится к способу, при котором состав объединяют с соответствующей жидкой средой, например, водой (ВИ), 5%-ным раствором декстрозы или физиологическим раствором, для получения внутривенного раствора.
Термин "лечение" или "лечить" обозначает любое лечение болезни у млекопитающего и включает:
(I) предотвращение болезни, т.е. остановку развития клинических симптомов болезни;
(II) ингибирование болезни, т.е. задержку развития клинических симптомов; и/или
(III) облегчение болезни, т.е. обеспечение регрессии клинических симптомов.
Термин "терапевтически эффективное количество" относится к такому количеству ММ, которое при введении млекопитающему при необходимости такого введения достаточно для осуществления назначенного лечения. Количество, которое составляет "терапевтически эффективное количество", варьируется в зависимости от конкретного соединения, состояния или болезни и ее серьезности и млекопитающего, подвергающегося лечению, и может быть определено стандартным образом обычным специалистом в данной области техники на основе современного уровня знаний и настоящего описания.
Термин "% (вес/объем)" обозначает процентное соотношение веса (г) одного ингредиента к общему объему всей композиции, например 500 мг ингредиента в общем объеме 8 мл составляет 6,25% (вес/об.) или 500 мг ингредиента в общем объеме 5 мл составляет 10% (вес/об.).
Термин "об. %" обозначает процентное соотношение объема одного ингредиента к общему объему всей композиции, например, 1,17 мл ингредиента в общем объеме 8 мл составляет 14,6 об.% или 1,17 мл ингредиента в общем объеме 5 мл составляет 23,4 об.%.
Номенклатура
Структура и принятая нумерация для мофетила микофенолята "ММ", также известного как морфолиноэтиловый эфир микофенольной кислоты [т.е. 2-(4-морфолино)этил-Е-6-(1,3-дигидро-4-гидрокси-6-метокси-7- метил-3-оксо-5-изобензофуранил)-4-метил-4-гексеноат], следующие: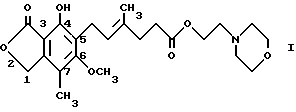
Исходные материалы
Морфолиноэтиловый эфир микофенольной кислоты и некоторых представителей ее эфирных производных получают в соответствии с патентом США 4753935, выданным 28 июня 1988 г., озаглавленным "Morpholinoethyl Esters of Mycophenolic Acid and Pharmaceutical Compositions", ранее включенным в настоящее описание в качестве ссылки, или в соответствии с описанием, изложенным в находившейся в процессе одновременного рассмотрения заявке, зарегистрированной под порядковым номером 07/993146 и поданной 18 декабря 1992 г., ныне в патенте США 5247083, включенном в настоящее описание в качестве ссылки.
Полисорбат 80 поставляется на рынок под товарным знаком "Tween 80®" (русское название "Твин 80") фирмой ICI Americas, Inc., Wilmington, Delaware.
Лимонная кислота, гидроксид натрия (NaOH) и соляная кислота (HCl) требуемой чистоты поставляется фирмой Aldrich Chemical Company.
Вода для инъекции (ВИ) обозначает воду, удовлетворяющую стандартам чистоты для инъецируемых растворов, изложенным в Фармакопее США.
Обзор способов получения композиций.
В результате процесса, с помощью которого объединяют ингредиенты композиции, известного как "смешение", получают раствор с увеличенным объемом. Раствор с увеличенным объемом подвергают лиофилизации [т.е. процессу, при котором при пониженном давлении и изменяемых температурных условиях удаляют воду и/или растворитель (например, метанол, этанол или изопропанол)], получая "состав". Внутривенную композицию восстанавливают непосредственно перед использованием из данного состава с помощью пригодной жидкой среды. Затем осуществляют введение внутривенной композиции.
Получение состава, в котором ММ•HCl находится в своей кристаллической безводной форме.
Процесс смешения.
Приблизительно 23-25,3% (вес/об. ) кислоты, предпочтительно приблизительно 24,4% (вес/об. ) 1н. HCl (если используют концентрированную HCl, то используют пропорционально меньший ее процент) и приблизительно 0,05-0,5% (вес/об.), предпочтительно примерно 0,1% (вес/об.) лимонной кислоты добавляют к объему воды, пригодной для инъекции (ВИ), приблизительно соответствующему 50% конечного объема раствора с увеличенным объемом [например, для приготовления конечного раствора с увеличенным объемом, имеющего объем 10 л, используют 5,0 л воды (ВИ)] . В этом растворе растворяют приблизительно 0,01-2,0% (вес/об.), предпочтительно приблизительно 0,5% (вес/об.) осветляющего агента, такого как полисорбат 80, и приблизительно 10% (вес/об.) ММ и приблизительно 0,10-10,0 об. %, предпочтительно приблизительно 3,2 об.% этанола. Значение pH раствора регулируют до pH, равного приблизительно 3,4, с использованием 1н. HCl или 2н. NaOH соответственно. Добавляют достаточное количество пригодной для инъекции воды (ВИ), доводя объем раствора с придающими объем наполнителями до требуемого конечного объема (например, для партии из 2000 пузырьков объемом 20 см3, содержащих по 5 см3 раствора на пузырек, конечный объем раствора с увеличенным объемом составляет 10 л). Значение pH данного раствора вновь регулируют до pH, равного приблизительно 3,4. Раствор фильтруют в стерильных условиях (например, с использованием мембранного фильтра с размером ячеек 0,2 мкм).
Раствор с увеличенным объемом разливают в отдельные пузырьки, причем объем налитого раствора составляет приблизительно 25% от объема пузырька (т. е. в пузырек объемом 20 см3 наливают приблизительно 5 мл раствора с увеличенным объемом) и пузырьки частично закрывают с помощью лиофилизационной пробки (т.е. пробки, пригодной для лиофилизации) для проведения лиофилизации раствора.
Цикл лиофилизации для кристаллической безводной формы.
Пузырьки, закупоренные лиофилизационной пробкой, содержащие раствор с увеличенным объемом, лиофилизуют в соответствии со следующей процедурой (температуру измеряют на полке, где расположены пузырьки внутри камеры для лиофилизации):
а. Перед размещением пузырьков температуру устанавливают в диапазоне от примерно 22oC до примерно 28oC, предпочтительно на уровне примерно 25oC. Указанную температуру поддерживают во время наполнения пузырьков. После завершения наполнения указанную температуру поддерживают в течение приблизительно 10-30 мин, предпочтительно приблизительно 20 мин.
б. Температуру понижают до уровня, находящегося в диапазоне приблизительно от 5oC до -15oC, предпочтительно до приблизительно -10oC, в течение приблизительно 1-3 ч, предпочтительно в течение приблизительно 2 ч 20 мин (т.е. с градиентом скорости приблизительно -0,25oC/мин).
в. Температуру поддерживают в диапазоне приблизительно от 5oC до -15oC, предпочтительно на уровне приблизительно -10oC, в течение приблизительно 1,5-3,54, предпочтительно в течение приблизительно 2 ч 30 мин.
г. Температуру понижают до уровня, находящегося в диапазоне приблизительно от -37oC до -43oC, предпочтительно до приблизительно -40oC, в течение 1-3,5 ч, предпочтительно в течение приблизительно 2 ч (т.е. с градиентом скорости приблизительно -0,25oC/мин).
д. Температуру поддерживают в диапазоне приблизительно от -37oC до -43oC, предпочтительно на уровне приблизительно -40oC, в течение приблизительно 3-7 ч, предпочтительно в течение приблизительно 5 ч.
е. Давление в камере для лиофилизации снижают до уровня, находящегося в диапазоне приблизительно от 70 до 130 мторр, предпочтительно до приблизительно 100 мторр.
ж. После достижения требуемого давления в камере для лиофилизации температуру поддерживают в диапазоне приблизительно от -20oC до -60oC, предпочтительно на уровне приблизительно -40oC, в течение приблизительно 3-7 ч, предпочтительно в течение приблизительно 5 ч.
з. Температуру повышают до уровня, находящегося в диапазоне приблизительно от -13oC до -19oC, предпочтительно до приблизительно -16oC, в течение приблизительно 6-10 ч, предпочтительно в течение приблизительно 8 ч (т.е. с градиентом скорости приблизительно 0,05oC/мин) и поддерживают эту температуру дополнительно в течение 8-12, предпочтительно в течение приблизительно 10 ч.
и. Температуру повышают до уровня, находящегося в диапазоне приблизительно от 50oC до 78oC, предпочтительно до приблизительно 70oC, в течение приблизительно 5-9 ч, предпочтительно в течение приблизительно 7 ч 10 мин (т. е. с градиентом скорости приблизительно 0,20oC/мин) и поддерживают эту температуру до завершения стадии л.
к. Температуру поддерживают до тех пор, пока все термопары, контролирующие продукт (т. е. датчики температуры, прикрепленные к пузырькам), не будут находиться в диапазоне температур приблизительно от 57oC до 63oC в течение по крайней мере 7-13 ч.
л. Температуру понижают до уровня, находящегося в диапазоне приблизительно от 22oC до 28oC, предпочтительно до приблизительно 25oC, в течение приблизительно 2-4 ч, предпочтительно в течение приблизительно 3 ч (т.е. с градиентом скорости приблизительно -0,25oC/мин) и поддерживают эту температуру в течение приблизительно 1-3 ч, предпочтительно в течение приблизительно 2 ч.
м. Давление в камере для лиофилизации медленно повышают до давления, находящегося в диапазоне приблизительно от 3 до 12 фунт/кв.дюйм, предпочтительно до давления приблизительно от 4 до 8 фунт/кв.дюйм, более предпочтительно до приблизительно 4 фунт/кв.дюйм, с использованием азота (NF) в течение периода времени, составляющим не менее приблизительно 15 минут. Пузырьки закупоривают при парциальном давлении.
н. Давление в камере для лиофилизации повышают до атмосферного давления. Если нет необходимости в разгрузке камеры после закупоривания пузырьки можно выдерживать при температуре, находящейся в диапазоне от 23 до 27oC, предпочтительно при приблизительно 25oC, максимум до 24 ч. Пузырьки герметично запечатывают обжимом.
Состав хранят в запечатанных пузырьках до восстановления непосредственно перед применением.
Получение внутривенной композиции для введения
Внутривенную композицию готовят путем восстановления описанного выше состава с помощью подходящей жидкой среды, такой как вода для инъекции (ВИ) или 5%-ный раствор декстрозы. Требуемая концентрация внутривенной композиции может быть получена путем восстановления соответствующего количества состава соответствующим объемом жидкой среды. Требуемая концентрация внутривенной композиции обеспечивает терапевтически эффективное количество ММ для животного при необходимости использования указанной внутривенной фармацевтической композиции по изобретению и поддерживает терапевтически эффективный уровень действующего вещества в животном. Доза, которая является терапевтически эффективной, зависит от скорости, с которой внутривенная композиция вводится животному, и от концентрации внутривенной композиции. Например, два пузырька, содержащие состав [например, 500 мг ММ на пузырек (что эквивалентно 542 мг ММ•HCl)] восстанавливают 5%-ным раствором декстрозы (14 мл 5%-ного раствора декстрозы на пузырек), получая в целом 28 мл раствора. Этот восстановленный раствор вводят в растворе декстрозы в емкость для вливания и доводят до объема 166 мл, получая раствор, содержащий 6 мг/мл ММ, пригодный для введения путем внутривенного вливания. Предпочтительная концентрация ММ в жидкой среде в емкости для вливания составляет от приблизительно 3 до приблизительно 10 мг/мл, предпочтительно от приблизительно 5 до приблизительно 6 мг/мл.
В растворах не происходит существенной потери указанной в маркировке концентрации (% ЭК) в течение 24 ч после приготовления и хранения при 25oC. Следует отметить, что согласно существующей фармацевтической практике восстановленные растворы должны быть введены сразу после восстановления, хотя стабильность восстановленного раствора такова, что она не оказывает нежелательных эффектов, если введение задерживается.
Состав по изобретению может поставляться специалисту по приготовлению лекарства, например, в аптеке или больнице, в пузырьке, содержащем данный состав, или в виде набора, включающего пузырек или пузырьки, содержащие данный состав и соответствующее количество жидкой среды.
Предпочтительные варианты выполнения изобретения
Наиболее предпочтительной является кристаллическая безводная форма гидрохлоридной соли морфолиноэтилового эфира микофенольной кислоты, т.е. гидрохлорид 2-(4-морфолино)этил-Е-6- (1,3-дигидро-4-гидрокси-6-метокси-7-метил-3-оксо-5- изобензофуранил)-4-метил-4-гексеноата.
Также наиболее предпочтительным является состав, содержащий ММ•HCl в кристаллической безводной форме, и фармацевтически приемлемые эксципиенты.
Предпочтительные способы
Предпочтительным способом смешения (т. е. получение раствора с увеличенным объемом) является таковой, при котором температуру поддерживают на уровне приблизительно от 21oC до 33oC.
Наиболее предпочтительным способом смешения является таковой, при котором температуру поддерживают на уровне приблизительно 25oC ± 2oC.
Предпочтительным способом смешения является таковой, при котором pH раствора с увеличенным объемом регулируют на уровне 3,4 ± 0,5.
Наиболее предпочтительным способом смешения является таковой, при котором pH раствора с увеличенным объемом регулируют на уровне 3,4 ± 0,2.
Для получения фармацевтического состава с кристаллической безводной формой ММ•HCl предпочтительным является цикл лиофилизации, при котором температуру понижают от 25oC до температуры, находящейся в диапазоне от 5oC до -15oC с градиентом скорости, равным -0,25oC/мин ± 0,1oC.
Наиболее предпочтительным диапазоном температур является диапазон от 25oC до -10oC с градиентом скорости, равным -0,25oC/мин ± 0,05oC.
Для получения фармацевтического состава с кристаллической безводной формой ММ•HCl предпочтительным является цикл лиофилизации, при котором температуру понижают от температуры, находящейся на уровне 5oC, до температуры, находящейся в диапазоне от -15oC до -40oC, с градиентом скорости, равным -0,25oC/мин ± 0,1oC.
Наиболее предпочтительным диапазоном температур является диапазон от -10oC до -40oC с градиентом скорости, равным - 0,25oC/мин ± 0,05oC.
Для получения фармацевтического состава с кристаллической безводной формой ММ•HCl предпочтительным является цикл лиофилизации, при котором температуру повышают в диапазоне от -16oC до 70oC с градиентом скорости, равным 0,20oC/мин ± 0,1oC.
Наиболее предпочтительным диапазоном температур является диапазон от -16oC до 70oC с градиентом скорости, равным 0,20oC/мин ± 0,05oC.
Применимость
Настоящее изобретение пригодно для лечения заболеваний, таких как аутоиммунные нарушения, псориаз, воспалительные заболевания (включающие, в частности, ревматоидные артриты), опухоли, вирусные заболевания, аутоиммунные заболевания, включая диабет, отторжение аллотрансплантатов, в частности отторжение сердечных аллотрансплантатов, отторжение панкреатических аллотрансплантатов и отторжение почечных аллотрансплантатов.
Примеры
Следующие примеры приведены для более ясного понимания специалистами в данной области техники настоящего изобретения и его осуществления. Они не должны рассматриваться как ограничивающие объем изобретения, а только как иллюстрирующие и характеризующие его.
Пример 1
Получение гидрохлорида мофетила микофенолята в его кристаллической безводной форме
1А. Получение кристаллического безводного ММ в виде комплекса с хлоридом
Гидрохлорид мофетила микофенолята получали аналогично описанному в патенте США 4753935. Е-6-(1,3-дигидро-4-гидрокси-6- метокси-7-метил-3-оксо-5-изобензофуранил)-4-метил-4-гексеноат (38,0 г) растворяли в изопропаноле (200 мл) и этот раствор добавляли к раствору хлористого водорода (10,0 г) в изопропаноле (150 мл). Гидрохлоридную соль отфильтровывали и сушили в вакууме (температура плавления 154-155oC).
Кристаллическую безводную форму гидрохлорида мофетила микофенолята получали путем нагревания кристаллической моногидратной гидрохлоридной формы ММ•HCl при 60oC в течение 30 мин. Кристаллическая безводная форма указанного соединения была подтверждена с помощью рентгеновской кристаллографии, как показано на фиг. 1Б.
Было обнаружено, что кристаллическая безводная форма гидрохлорида мофетила микофенолята имеет растворимость (при оценке в течение 3 дней) приблизительно 84 мг/мл в типичных растворах для внутривенных композиций (например, в 5%-ном растворе декстрозы или в воде, пригодной для инъекций), в то время как кристаллическая моногидратная форма имеет растворимость 40 мг/мл.
1Б. Получение кристаллической безводной соли ММ с различными анионами
Аналогично процедуре, описанной в примере 1А, но заменяя анион исходного материала следующими соединениями, а именно:
кристаллической моногидратной формой сульфата мофетила микофенолята,
кристаллической моногидратной формой фосфата мофетила микофенолята и
кристаллической моногидратной формой ацетата мофетила микофенолята,
получали следующие соединения:
кристаллическую безводную форму сульфата мофетила микофенолята,
кристаллическую безводную форму фосфата мофетила микофенолята и
кристаллическую безводную форму ацетата мофетила микофенолята.
Пример 2
Получение производственной партии состава гидрохлорида мофетила микофенолята в его кристаллической безводной форме
2А. Получение производственной партии, состоящей из 2000 пузырьков объемом 20 см3, с использованием 1н. HCl
Ингредиент - Количество/пузырек
Мофетил микофенолята - 500,0 мг
1н. HCl - 1220,0 мг
Безводная лимонная кислота - 5,0 мг
Полисорбат 80 - 25,0 мг
Этанол (95%) - 0,16 мл
ВИ* д.к. - 5,0 мл
1н. HCl/NaOH д.к. до pH 3,4
* Удаляется во время лиофилизации
Готовили партию (производственный масштаб, 2000 пузырьков объемом 20 см3 состава, содержащего 542 мг на пузырек ММ•HCl (т.е. 500 мг ММ) в его кристаллической безводной форме.
Ингредиенты объединяли в соответствии со следующей процедурой:
1. Объединяли 2440 г 1н. HCl и 10 г лимонной кислоты с достаточным количеством воды, пригодной для инъекции (ВИ), получая объем 7,5 л.
2. Растворяли 50 г Твин 80 в растворе, полученном на стадии 1.
3. Растворяли 1000 г MM в растворе, полученном на стадии 2.
4. Добавляли 320 мл этилового спирта к раствору, полученному на стадии 3.
5. Регулировали значение pH раствора, полученного на стадии 4, до pH 3,4 (± 0,2).
6. Добавляли достаточное количество воды (ВИ) для доведения объема раствора до 10 л.
7. В стерильных условиях раствор фильтровали, используя два фильтра 10'' Millipore Durapore с размером ячеек 0,2 мкм (CVGL).
8. Разливали по 5 мл фильтрата, полученного на стадии 7, в 2000 пузырьков для многократной дозы объемом 20 см3 (т.е. по 5 мл фильтрата на пузырек объемом 20 см3) и частично закрывали с помощью лиофилизационных пробок.
9. Пузырьки загружали в лиофилизатор, в котором температура была стабилизирована на уровне 25oC (сушилка типа Dura-Stop MP Freeze Dryer, система FTS).
10. Цикл лиофилизации
а. Измеряли температуру на полке с размещенными на ней наполненными пузырьками и оснащали термопарами различные пузырьки для измерения их температуры.
б. Температуру в камере для лиофилизации устанавливали на уровне 25oC. Заполненные пузырьки помещали в камеру для лиофилизации и температуру поддерживали на уровне 25oC в течение 20 мин.
в. Температуру на полке понижали от 25oC до -10oC в течение 2 ч 20 мин (градиент скорости: -0,25oC/мин).
г. Температуру поддерживали на уровне -10oC в течение 2,5 ч.
д. Температуру понижали до -40oC в течение 2 ч (градиент скорости: -0,25oC/мин).
е. Температуру поддерживали на уровне -40oC в течение 5,0 ч.
ж. Давление в камере для лиофилизации снижали до 100 мторр.
з. После достижения давления 100 мторр (приблизительно в течение 30 мин) температуру поддерживали на уровне -40oC в течение дополнительных 5 ч.
и. Температуру повышали до -16oC в течение 8 ч (градиент скорости: 0,05oC/мин) и поддерживали на уровне -16oC в течение дополнительных 10 ч.
к. Температуру повышали до 70oC в течение 7 ч 10 мин (градиент скорости: 0,20oC/мин) и поддерживали на уровне 65oC до тех пор, пока все термопары не показывали температуру 60oC в течение по крайней мере 7 ч (общее время приблизительно 11 ч).
л. Температуру понижали до 25oC в течение 3 ч (градиент скорости: -0,25oC/мин) и поддерживали на уровне 25oC в течение 2 ч.
м. Давление в камере для лиофилизации постепенно повышали до 7,5 фунт/кв. дюйм с использованием азота (NF) в течение периода времени не менее 15 минут.
н. Пузырьки закупоривали при парциальном давлении.
о. Давление в камере для лиофилизации повышали до атмосферного давления с использованием фильтруемого воздуха.
11. Затем пузырьки герметично запечатывали.
Характеристические аналитические данные подтверждают, что полученный состав содержит ММ•HCl в кристаллической безводной форме (в соответствии с данными рентгеновской кристаллографии, показанными на фиг. 2Б).
2Б. Получение производственной партии, состоящей из 2000 пузырьков объемом 20 см3 с использованием концентрированной HCl
Ингредиент - Количество/пузырек
Мофетил микофенолята - 500,0 мг
Концентрированная HCl - 119,25 мг
Безводная лимонная кислота - 5,0 мг
Полисорбат 80 - 25,0 мг
Этанол (95%)* - 0,16 мл
ВИ* д.к. - 5,0 мл
1н.H HCl/NaOH д.к. до pH 3,4
* Удаляется во время лиофилизации
Готовили партию (производственный масштаб, 2000 пузырьков объемом 20 см3) состава, содержащего 542 мг на пузырек ММ•HCl (т.е. 500 мг ММ) в его кристаллической безводной форме.
Ингредиенты объединяли в соответствии со следующей процедурой:
1. Объединяли 119,25 г концентрированной HCl с достаточным количеством воды, пригодной для инъекции (ВИ), получая объем 7,2 л. Растворяли 10 г лимонной кислоты в указанном растворе HCl.
2. Растворяли 50 г Твин 80 в растворе, полученном на стадии 1.
3. Растворяли 1000 г MM в растворе, полученном на стадии 2.
4. Добавляли 320 мл этилового спирта к раствору, полученному на стадии 3.
5. Регулировали значение pH раствора, полученного на стадии 4, до pH 3,4 (+0,2).
6. Добавляли достаточное количество воды (ВИ) для доведения объема раствора до 10 л.
7. В стерильных условиях раствор фильтровали, используя два фильтра 10'' Millipore Durapore с размером ячеек 0,2 мкм (CVGL).
8. Разливали по 5 мл фильтрата, полученного на стадии 7, в 2000 пузырьков для многократной дозы объемом 20 см3 (т.е. по 5 мл фильтрата на пузырек объемом 20 см3) и частично закрывали с помощью лиофилизационных пробок.
9. Пузырьки помещали в лиофилизатор, в котором температура была стабилизирована на уровне 25oC (сушилка типа Dura-Stop MP Freeze Dryer, система FTS).
10. Цикл лиофилизации
а. Измеряли температуру на полке с размещенными на ней наполненными пузырьками и оснащали термопарами различные пузырьки для измерения их температуры.
б. Температуру в камере для лиофилизации устанавливали на уровне 25oC. Заполненные пузырьки помещали в камеру для лиофилизации и температуру поддерживали на уровне 25oC в течение 20 мин.
в. Температуру на полке понижали от 25oC до -10oC в течение 2 ч 20 мин (градиент скорости: -0,25oC/мин).
г. Температуру поддерживали на уровне -10oC в течение 2,5 ч.
д. Температуру понижали до -40oC в течение 2 ч (градиент скорости: -0,25oC/мин).
е. Температуру поддерживали на уровне -40oC в течение 5,0 ч.
ж. Давление в камере для лиофилизации снижали до 100 мторр.
з. После достижения давления 100 мторр (приблизительно в течение 30 мин) температуру поддерживали на уровне -40oC в течение дополнительных 5 ч.
и. Температуру повышали до -16oC в течение 8 ч (градиент скорости: 0,05oC/мин) и поддерживали на уровне -16oC в течение дополнительных 10 ч.
к. Температуру повышали до 70oC в течение 7 ч 10 мин (градиент скорости: 0,20oC/мин) и поддерживали на уровне 65oC до тех пор, пока все термопары не показывали температуру 60oC в течение по крайней мере 10 ч.
л. Температуру понижали до 25oC в течение 3 ч (градиент скорости: -0,25oC/мин) и поддерживали на уровне 25oC в течение 2 ч.
м. Давление в камере для лиофилизации постепенно повышали до 4 фунт/кв. дюйм с использованием азота (NF) в течение периода времени не менее 15 мин.
н. Пузырьки закупоривали при парциальном давлении.
о. Давление в камере для лиофилизации повышали до атмосферного давления с использованием фильтруемого воздуха.
11. Затем пузырьки герметично запечатывали.
Характеристические аналитические данные подтверждают, что полученный состав содержит ММ•HCl в кристаллической безводной форме (в соответствии с данными рентгеновской кристаллографии, показанными на фиг. 2Б).
2В. Другие размеры партий внутривенной композиции
Аналогичным образом путем пропорционального увеличения количества ингредиентов могут быть изготовлены партии композиций, описанных в примерах 2А или 2Б, состоящие из 4000 пузырьков объемом 20 см3, 6000 пузырьков объемом 20 см3 или 8000 пузырьков объемом 20 см3.
2Г. Другие внутривенные композиции с различными кристаллическими безводными солями ММ
Аналогично примерам 2А или 2Б путем замены кристаллической безводной формы гидрохлорида мофетила микофенолята другими кристаллическими безводными формами мофетила микофенолята (например, сульфатной, фосфатной и ацетатной солями, полученными в соответствии с примером 1Б) получают соответствующие внутривенные композиции.
Пример 3
Другая композиция гидрохлорида мофетила микофенолята
Аналогично примеру 2 могут быть получены производственные партии следующих композиций, содержащих ММ•HCl в его кристаллических безводных формах.
Пример 4
Определение формы гидрохлорида мофетила микофенолята с помощью рентгеновской дифракции на порошке
Кристаллическую форму ММ*HCl определяли с помощью рентгеновской кристаллографии. Результаты рентгеновской кристаллографии получали с помощью рентгеновского дифрактометра Nicolet, оборудованного трубкой тонкой фокусировки и монохроматором дифрагированного луча. Получали картины рентгеновской дифракции на порошке соединения ММ•HCl в его кристаллической моногидратной и кристаллической безводной формах, которые представлены на фиг. 1А и 1Б соответственно.
Получали картины рентгеновской дифракции на порошке составов, содержащих ММ•HCl, в его аморфной форме, ММ•HCl в его кристаллической безводной форме (с полисорбатом 80, пример 3, композиция А) и ММ•HCl в его кристаллической безводной форме (без полисорбата 80, пример 3, композиция Б), которые представлены на фиг. 2А, 2В и 2В соответственно.
Результаты рентгеновской кристаллографии, приведенные на фиг. 2Б и 2В, показывают, что образование кристаллической формы ММ•HCl в обоих составах не зависит от присутствия полисорбата 80, т.е. образование кристаллического безводного ММ•HCl не ухудшается за счет полисорбата 80.
Результаты рентгеновской кристаллографии, приведенные на фиг. 2Б, 2В и 1Б, показывают, что ММ•HCl в составах с и без полисорбата 80 находится в его кристаллической безводной форме.
Пример 5
Определение аморфной и кристаллической безводной форм гидрохлорида мофетила микофенолята с помощью дифференциальной сканирующей калориметрии
В данном примере описан способ распознавания различных кристаллических форм ММ•HCl (например, аморфной, моногидратной и безводной) с помощью дифференциальной сканирующей калориметрии (ДСК). ДСК-термограммы регистрировали с помощью системы Perkins Elmer DSC-7 System. ДСК-термограмма представляет собой поток тепла в виде функции температуры, позволяя таким образом измерять температуру плавления соединения.
ДСК-термограмма для аморфной формы ММ•HCl (фиг. ЗА) показывает, что экзотерма начинается при -8,65oC, а эндотерма плавления начинается при 38,5oC и выходит на горизонтальный уровень при 44,77oC.
С другой стороны, ДСК-термограмма для кристаллической безводной формы ММ•HCl после процесса лиофилизации (фиг. 3Б) показывает отсутствие фазовых переходов до плавления при температуре от 145,41 до 155,0oC.
Температура плавления моногидрата ММ•HCl составляет 154-155oC (как описано в патенте США 4753935, выданном 28 июня 1988 г (пример 3)).
Таким образом, аморфная, кристаллическая моногидратная и кристаллическая безводная формы ММ•HCl легко различаются с помощью их ДСК-термограмм.
Поскольку настоящее изобретение было описано со ссылками на конкретные примеры его выполнения, специалистам в данной области техники понятно, что в него могут быть внесены различные изменения и могут быть заменены эквиваленты без отклонения от сущности и объема настоящего изобретения. Кроме того, могут быть сделаны многочисленные модификации для адаптирования конкретной ситуации, материала, состава вещества, процесса, стадии или стадий процесса к предмету, существу и объему настоящего изобретения. Подразумевается, что все указанные модификации подпадают под объем пунктов формулы изобретения, приведенных ниже.

Кристаллический безводный микофенолят мофетила формулы I, причем указанное соединение образует комплекс в виде соли, где анион выбран из группы, включающей хлорид, сульфат, фосфат и ацетат, пригодны для лечения отторжения аллотрансплантатов. 3 с. и 5 з.п. ф-лы, 1 табл., 7 ил.
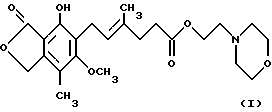
причем указанное соединение образует комплекс в виде соли, где анион выбран из группы, включающей хлорид, сульфат, фосфат и ацетат.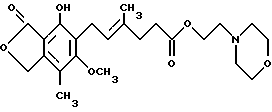
где указанное соединение образует комплекс в виде соли, где анион выбран из группы, включающей хлорид, сульфат, фосфат и ацетат, а указанная соль представлена в кристаллической безводной форме, и фармацевтически приемлемые эксципиенты.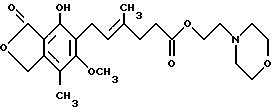
где указанное соединение образует комплекс в виде соли, где анион выбран из группы, включающей хлорид, сульфат, фосфат и ацетат, а указанная соль представлена в своей кристаллической безводной форме, и фармацевтически приемлемые эксципиенты.
| 0 |
|
SU281713A1 | |
| ДИГИДРОБРОМИД 2-(2-МОРФОЛИНОЭТИЛТИО)БЕНЗИМИДАЗОЛА, ПОВЫШАЮЩИЙ ФИЗИЧЕСКУЮ РАБОТОСПОСОБНОСТЬ И УСКОРЯЮЩИЙ ПРОЦЕССЫ ВОССТАНОВЛЕНИЯ ПОСЛЕ ФИЗИЧЕСКИХ НАГРУЗОК И ДЛИТЕЛЬНОГО СТРЕССА | 1984 |
|
SU1170760A1 |
| US 4952579 A1, 1990 | |||
| Способ получения хромсиликатного пигмента | 1970 |
|
SU427605A1 |
Авторы
Даты
1999-07-10—Публикация
1994-09-12—Подача