Фармацевтическая композиция для лечения и профилактики острых и хронических заболеваний печени, нарушения липидного обмана при атеросклерозе и сопутствующих заболеваниях, восстановления функции печени при интоксикации.
Изобретение относится к медицине, в частности, к лекарственному препарату на основе фосфолипида, его лекарственным формам и может быть использовано в медицинской практике при заболеваниях печени различной этиологии, при атеросклерозе и лечении интоксикации.
Известен ряд препаратов на основе фосфолипидов, применяемых как в виде капсул, драже или таблеток, так и в виде инъекционных форм.
Так например, препарат "Эссенциале" (форте) содержит смесь фосфолипидов из сои, ненасыщенные жирные кислоты и витамины (1).
Основным недостатком этого препарата является высокая токсичность и наличие побочных эффектов за счет использования сильного детергента (1).
Известна фармацевтическая композиция, способная восстанавливать структуру и функцию поврежденных мембран гепатоцитов, которая может быть использована при лечении заболеваний печени (2).
Указанная композиция содержит обогащенную фракцию фосфолипидов подсолнечника и детергент - тринатриевую соль глицирризиновой кислоты (2). Указанная композиция может быть выполнена, только в таблетированпой форме, которая не подлежит длительному хранению. В качестве активного ингредиента композиция содержит фосфолипиды, выделенные из семян подсолнечника, что ограничивает возможности ее изготовления и не позволяет использовать данную композицию в иных лекарственных формах, нежели таблетированная форма.
Задачей настоящего изобретения является разработка фармацевтической композиции для лечения острых и хронических заболеваний печени, нарушения липидного обмена при атеросклерозе и сопутствующих заболеваниях, восстановления функции печени при интоксикации, обладающей низкой токсичностью, высокой эффективностью, подлежащей длительному хранению при использовании фосфолипидов различного происхождения, которую можно использовать в различных лекарственных формах.
Указанная задача решается описываемой фармацевтической композицией для лечения острых и хронических заболеваний печени, нарушения липидного обмена при атеросклерозе и сопутствующих заболеваниях, восстановления функции печени при интоксикации, содержащей фосфолипиды, глицирризиновую кислоту или ее соли и вспомогательные вещества, при этом суммарное содержание фосфолипидов и глицирризиновой кислоты или ее соли составляет 2 - 80 мас.% при массовом соотношении фосфолипидов и глицирризиновой кислоты или ее соли не более 4 : 1.
В качестве фосфолипида используют фосфолипид из любого подходящего животного или растительного материала: яйца, масличные семена и масличные фрукты, например сушеное ядро кокосовых орехов, пальмовых семян, земляных орехов, семена рапса, подсолнечника, льна, пальмовое масло и/или оливковое масло. Однако наиболее подходящим является фосфолипид, выделенный из соевых бобов в соответствии с методами, описанными в Европейских патентах 0054770 и 0054769. Используемый фосфолипид является высокоочищенным и содержит как минимум 75 мас. % фосфатидилхолина, предпочтительно 90% по массе. Такие высокоочищенные фосфолипиды могут содержать другие фосфолипидные компоненты, например, до 6 мас. % лизофосфатидилхолина, до 5 мас. % фосфатидилэтаноламина, до 8 мас.% фосфатидной кислоты, а также следы фосфатидилинозитола и небольшие количества других липидов.
В качестве солей глицирризиновой кислоты используют моно- ди- или тринатриевые и/или калийные соли.
Наиболее предпочтительным является суммарное содержание в композиции фосфолипидов и глицирризиновой кислоты или ее соли 2 - 45% масс. при массовом соотношении фосфолипидов и глицирризиновой кислоты или ее соли от 2 : 1 до 3: 1.
В качестве вспомогательных фармакологически приемлемых веществ композиция содержит углеводы, в частности мальтозу и/или производные коллоидной кремневой кислоты, тальк, лактозу, крахмал, углеводы, желатин, воду, одноатомные или многоатомные спирты, натуральные или синтетические масла и/или эфиры и др.
Описываемая фармацевтическая композиция может быть выполнена в форме таблеток, порошка, капсул, гранул, драже, капель, растворов, лиофилизата, суспензий и эмульсий для инъекций.
В ряде случаев, например, при тяжелом поражении печени наиболее подходящей является форма, когда препарат согласно изобретению удобно дозирован для применения в виде инъекций.
В частности, жидкие препараты типа растворов, суспензий, эмульсий вышеупомянутых сочетаний активных ингредиентов или твердых препаратов, которые превращаются в жидкую форму, сразу же после добавления воды или другого растворителя или трис-буфера, удобны для применения в виде инъекций.
Если фармацевтический препарат согласно изобретению имеет жидкую форму, предназначенную для инъекций, желательно использовать разбавитель, который не дает неблагоприятных побочных эффектов. Это особенно применимо к воде, одноатомным спиртам, предпочтительно этанол, 2-пропанол или п-пропанол, многоатомным спиртам, предпочтительно глицерол и/или пропандиол, полигликоли, предпочтительно полиэтиленгликоль и/или миглиол, глицерол формаль, диметилизосорбитол, натуральным и синтетическим маслам и/или эфирам, причем для инъекций предпочтительны липосомно-мицелярные системы.
Наиболее подходящей формой применения препарата согласно изобретению является сочетание активных ингредиентов, содержащих фосфолипид и глицирризиновую кислоту или ее соль, в форме водной липосомно-мицелярной системы. Такая водная липосомно-мицелярная система, используемая для инъекций, имеет pH 6,0-7,5.
Настоящее изобретение относится также к фармацевтической композиции для лечения и профилактики острых и хронических заболеваний печени, нарушения липидного обмена при атеросклерозе и сопутствующих заболеваниях, восстановления функции печени при интоксикации, содержащей фосфолипиды, глицирризиновую кислоту или ее соли и углеводы, предпочтительно лактозу, мальтозу и/или изомальтозу, при суммарном содержании фосфолипидов и глицирризиновой кислоты или ее соли 2 - 80 мас.%, массовом соотношении фосфолипидов и глицирризиновой кислоты или ее соли не более 4 : 1 и выполненной в форме лиофилизата или трис-буферной или водной эмульсии.
Предпочтительно, чтобы в указанной композиции массовое соотношение фосфолипида и углевода составляло от 1 : 3 до 1 : 4.
В случае, когда композиция выполнена в виде лиофилизата, при добавлении к нему воды или трис-буфера образуется водно-липосомальная система, которая может быть использована для инъекций.
Такая водно-липосомная система также может быть стерильно отфильтрована, особенно с использованием фильтра размером 0,2 μм и содержит высокую концентрацию липосом/мицелл при сравнительно небольшом диаметре частиц от 30 нм до 90 нм.
Препарат в водном растворе предпочтительно принимает форму водной липосомно/мицелярной системы с высокой степенью прозрачности, исключительно длительным сроком хранения и возможностью отфильтровываться стерильно. Система может быть также высушена, например, лиофилизацией, с получением стабильного лиофилизированного остатка.
Сочетание активных ингредиентов, включающих фосфолипид и динатриевую соль глицирризат, с соотношением по массе фосфатидилхолина к динатрий глицирризату, находящемся в интервале от 1 : 1 до 4 : 1, и, предпочтительно, между 2 : 1 и 3 : 1, является наиболее подходящим, когда фармацевтический препарат готовится как раствор для инъекций.
Вышеупомянутый препарат согласно изобретению обладает высокой терапевтической эффективностью, в частности, против острых и хронических заболеваний печени, типа гепатита A, микст-гепатита B+C, цирроза печени, калькулезного холецистита, хронических или острых интоксикациях печени любого происхождения, в частности, хронической или острой интоксикации печени, вызванной алкоголем, органическими растворителями, медикаментами и/или тяжелыми металлами, и кроме того, против жировой инфильтрации печени, сосудистых аномалий, атеросклероза, липидных метаболических дисфункций и/или липидных метаболических нарушений и всех заболеваний и нарушений, связанных с вышеупомянутыми заболеваниями и дисфункциями.
Согласно изобретению описанная выше высокая терапевтическая активность, которая соответственно выражается в быстром излечивании при низкой дозе фармацевтического препарата, связана с синергическим эффектом сочетания в препарате активных ингредиентов фосфолипида и глицирризиновой кислоты или ее солей. Фармацевтический препарат согласно изобретению характеризуется также отсутствием побочных эффектов и особенно быстрым поступлением в печень.
Изобретение иллюстрируется следующими примерами.
Пример 1. 20,0 г (15,74%) фосфолипида из сои растворяют в 100 мл 96% спирта. К полученному раствору прибавляют смесь 20,0 г (15,74%) тринатриевой соли глицирризиновой кислоты, 45 г (35,42%) микрокристаллической целлюлозы, 0,5 г (0,39%) кальция стеарата, 20 г (15,74%) кальция карбоната тщательно перемешивают. Полученную массу пропускают через гранулятор с диаметром отверстий 3,0 мм. Влажный гранулят сушат в сушильном шкафу при температуре 30 - 35oC в течение 3,5 часов, толщина слоя 2 см. Высушенный гранулят снова пропускают через гранулятор с диаметром отверстий 1,5 мм. Сухой гранулят опудривают 0,3 г (0,23%) кальция стеарата, 20 г (15,74%) кальция карбоната, 0,25 г (0,20%) талька и 1,0 г (0,79%) аэросила.
Суммарное содержание фосфолипида и тринатриевой соли глицирризиновой кислоты составляет 31,48%. Соотношение фосфолипида и соли глицирризиновой кислоты 1 : 1.
Полученную массу передают на таблетирование. Масса таблетки 0,5 г.
Пример 2. 0,50 г (1,49%) фосфолипида из льна растворяют в 25 мл 96% спирта. К полученному раствору прибавляют смесь 3,50 г (10,44%) тринатриевой соли глицирризиновой кислоты, 10,00 г (29,84%) микрокристаллической целлюлозы, 0,165 г (0,49%) кальция стеарата, 10,00 г (10,44%) кальция карбоната тщательно перемешивают. Полученную массу пропускают через гранулятор с диаметром отверстий 3,0 мм. Влажный гранулят сушат в сушильном шкафу при температуре 30 - 35oС в течение 3,5 часов, толщина слоя 2 см. Высушенный гранулят снова пропускают через гранулятор с диаметром отверстий 1,5 мм. Сухой гранулят опудривают 0,151 г (0,45%) кальция стеарата, 7,898 г (23,5%) кальция карбоната, 0,989 г (2,95%) талька и 0,310 г (0,92%) аэросила.
Суммарное содержание фосфолипида и тринатриевой соли глицирризиновой кислоты 11,93%. Соотношение фосфолипида и соли глицирризиновой кислоты 1 : 7.
Полученную массу передают на таблетирование. Масса таблетки 0,5 г.
Пример 3. 10 г (10%) фосфолипида из сои растворяют в 50 мл 96% спирта и смешивают с 5 г (5,0%) тринатриевой соли глицирризиновой кислоты, спирт упаривают на роторном испарителе. К полученной смеси добавляют 83 г (83,0%)лактозы, 1,0 г (1,0%) стеариновой кислоты, 20,0 мл 96% спирта и тщательно перемешивают. Полученную массу пропускают через гранулятор с диаметром отверстий 3,0 мм. Влажный гранулят сушат в сушильном шкафу в течение 3,5 часов, толщина слоя 2,0 см. В высушенный гранулят добавляют 1,0 г (1,0%) кальция стеарата и пропускают снова через гранулятор с диаметром отверстий 1,5 мм.
Суммарное содержание фосфолипида и соли глицирризиновой кислоты 15%. Соотношение фосфолипида и: соли глицирризиновой кислоты 2 : 1.
Полученную массу передают на таблетирование. Масса таблетки 0,5 г.
Пример 4. 20 г (20%) фосфолипида из сои растворяют в 100 мл 96% спирта и смешивают с 20 г (20%) тринатриевой соли глицирризиновой кислоты, спирт упаривают на роторном испарителе. К полученной смеси добавляют 57,0 г (57,0%) лактозы, 1,0 г (1%) стеарата кальция, 20 мл 96% спирта и тщательно перемешивают. Полученную массу пропускают через гранулятор с диаметром отверстий 3,0 мм. Влажный гранулят сушат в сушильном шкафу 3,5 часа, толщина слоя 2,0 см. В высушенный гранулят добавляют 2,0 г (2,0%) кальция карбоната и пропускают через гранулятор с диаметром отверстий 1,5 мм.
Суммарное содержание фосфолипида и соли глицирризиновой кислоты - 40%. Соотношение фосфолипида и соли глицирризиновой кислоты 1 : 1.
Полученную массу передают на таблетирование. Масса таблетки 0,5 г.
Пример 5. 20 г (20%) фосфолипида из семян подсолнечника растворяют в 100 мл 96% спирта и смешивают с 10 г (10,0%) тринатриевой соли глицирризиновой кислоты, спирт упаривают на роторном испарителе, добавляют 67,0 г (67,0%) лактозы, 1,0 г (1,0%) стеарата кальция, 20 мл 96% спирта и тщательно перемешивают. Полученную массу пропускают через гранулятор с диаметром отверстий 3 мм. Влажный гранулят сушат на воздухе в течение 3,5 часов, толщина слоя 2 см. Высушенный гранулят пропускают через гранулятор с диаметром отверстий 1,5 мм, добавляют 1,0 г (1,0%) кальция стеарата, 1,0 г (1,0%) аэросила, 1,0 г (1,0%) талька.
Суммарное содержание фосфолипида и тринатриевой соли глицирризиновой кислоты - 30%. Соотношение фосфолипида и соли глицирризиновой кислоты 2 : 1.
Полученную массу передают на таблетирование. Масса таблетки 0,5 г.
Пример 6. 30,0 г (30,0%) фосфолипида из семян сои растворяют в 100 мл 96% спирта и смешивают с 15,0 г (15,0%) тринатриевой соли глицирризиновой кислоты, спирт упаривают на роторном испарителе, добавляют 52,0 г (52,0%) лактозы, 1,0 г (1,0%) стеарата кальция, добавляют 20 мл 96% спирта и тщательно перемешивают. Полученную массу пропускают через гранулятор с диаметром отверстий 3 мм. Влажный гранулят сушат на воздухе в течение 8,5 часов, толщина слоя 1,0 см. Высушенный гранулят пропускают через гранулятор с диаметром отверстий 1,5 мм, добавляют 1,0 г (1,0%) кальция стеарата, 2,0 г (2,0%) аэросила.
Суммарное содержание фосфолипида и тринатриевой соли глицирризиновой кислоты - 45%. Соотношение фосфолипида и глицирризиновой кислоты 2 : 1.
Полученную массу передают на таблетирование. Масса таблетки 0,5 г.
Пример 7. Раствор 0,2 г (8,0%) тринатриевой соли глицирризиновой кислоты и 1,8 г (72,0%) мальтозы в 4,5 мл воды добавляют к дисперсионной смеси, состоящей из 0,5 г (20,0%) фосфолипида из сои в 0,5 мл 96% этанола при интенсивном перемешивании в среде инертного газа.
Суммарное содержание фосфолипида и соли глицирризиновой кислоты - 28%. Соотношение фосфолипида и соли глицирризиновой кислоты 2.5 : 1.
Полученную эмульсию обрабатывают ультразвуком (MSE Souiprep 150 disintegrator, England) при 4oC в течение 30 сек с интервалом 1 мин. Образование суспензии липосом наблюдается через 10 мин.
Суспензию липосом фильтруют через фильтр размером 0,2 μм и передают на лиофилизацию.
Липосомальную суспензию (5,0 мл) подвергают замораживанию с высушиванием (лиофилизации) на установке Multi dry FTS Sistems, USA в течение 5-ти часов. Получают 2,5 г рассыпчатого порошка препарата слегка желтоватого цвета.
Для внутривенного введения 2,5 г препарата в ампуле растворяют в 9,0 мл растворителя (вода или трис-буфер).
Пример 8. Раствор 50 г очищенного фосфолипида из сои (82,5 мас.% +3,5 мас. % фосфатидилхолин, до 10 мас. % фосфатидилэтаноламин, 0,6 мас. % лизофосфатидилхолин и не более 10 мас. % других липидов) и 0,25 г фосфатидилглицерола натриевая соль) в 250 мл этанола упаривают под вакуумом.
Полученную смесь фосфолипидов (≈20%) диспергируют путем перемешивания в токе инертного газа в 500 мл воды, в которой предварительно растворено 20,0 г (7,99%) тринатриевой соли глицирризиновой кислоты и 180,0 г изомальтозы (71,92%).
Суммарное содержание фосфолипида и соли глицирризиновой кислоты - 28,07%. Соотношение фосфолипида и соли глицирризиновой кислоты 2,5 : 1.
Подготовленную дисперсионную смесь подвергают 5-ти циклам щелевой гомогенизации под высоким давлением в 600 барр. Полученную таким образом липосомную систему, фильтруют через фильтр размером 0,2 μм и под инертным газом заливают в ампулы, объемом 10,0 мл. Препарат, обозначенный как 1, обладают следующими свойствами:
Вид - прозрачная, слегка опалесцирующая жидкость.
pH - 6,5.
Прозрачность на свету (660 им) - 85%.
Средний диаметр частицы (лазерное рассеяние) - 75 нм.
Стерильность - соответствует тестам на стерильность.
Электронно-микроскопичсская характеристика (криофиксация) -30 - 90 нм,
в основном, униламеллярные липосомы, редко - биламеллярные липосомы.
Прозрачность соединения 1, находящегося в ампулах, была протестирована через 3, 6, 9 и 12 месяцев. Никаких изменений по сравнению с первоначальной прозрачностью не наблюдалось.
Пример 9. 100 ампул (по 10 мл каждая), заполненные водно-липосомной системой (приготовление см. пример 8), подвергают замораживанию с высушиванием (лиофилизации).
После 3-х месячного хранения содержимое ампулы разводят в 10,0 мл воды, встряхивают и получают липосомную систему, обозначенную ниже как соединение II. Она обладает следующими свойствами:
Вид - прозрачная, слегка опалесцирующая жидкость.
pH - 6,5.
Прозрачность на свету (660 нм) - 84%.
Средний диаметр частицы (лазерное рассеяние) - 75 нм.
Стерильность - соответствует тестам на стерильность.
Электронно-микроскопическая характеристика (криофиксация) - 30 - 90 нм,
в основном, униламеллярные липосомы, изредка - биламеллярные липосомы
Как видно из полученных результатов, нет никакого различия в свойствах соединений I и II.
Соединения I и II тестировались также в экспериментах на животных.
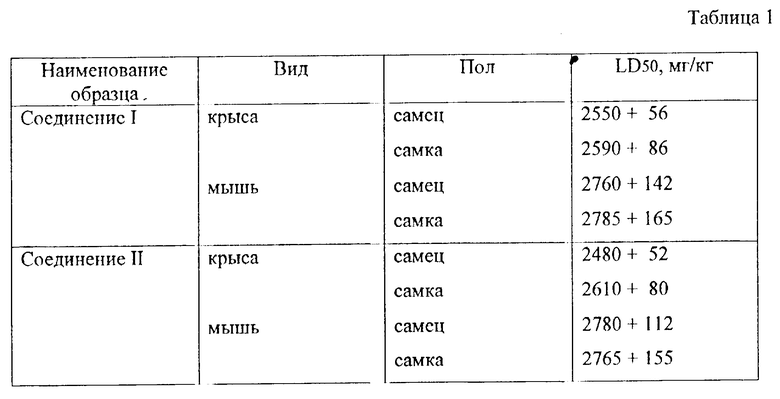
Токсикологические свойства исследовались путем введения различных доз обоих соединений мышам и крысам. После инъекций за животными велось наблюдение в течение 14 дней - для определения летальности и симптомов отравления.
После завершения токсикологического тестирования значение LD50 рассчитывалось для каждого пола и вида. Результаты представлены в таблице 1 (табл. 1 - 8 см. в конце описания).
Таким образом, в тесте острой токсичности соединения 1 и 2 были практически идентичными.
Гепатопротекторные свойства.
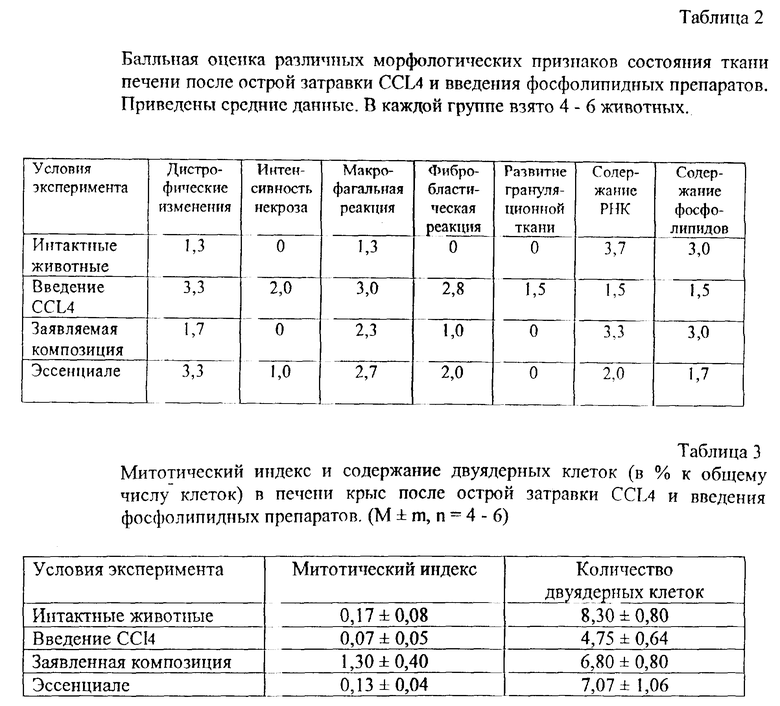
Гепатопротекторные свойства заявленной композиции в сравнении с известным препаратом "Эссенциале" исследовались в условиях острого и хронического экспериментального гепатита, вызванного введением CCL4.
Результаты проведенных исследований представлены в таблицах 2 и 3 и на фиг. 1.
Как видно из фиг. 1, у животных (крыс) с токсическим гепатитом назначение заявленной композиции приводит к более быстрому по сравнению с "Эссенциале" восстановлению синтеза альбумина. Кроме того, предотвращается развитие некротических изменений и усиливаются репаративные процессы в клетках печени.
Гистоморфологическими исследованиями установлено, что в печени животных, получавших препарат, меньше дистрофических изменений и значительно больше функционально-активных крупных гепатоцитов с повышенным содержанием РНК и фосфолипидов в цитоплазме по сравнению с теми же показателями в группе контроля и леченных "Эссенциале".
Влияние заявленной композиции на снижение уровня холестерина в эритроцитах.
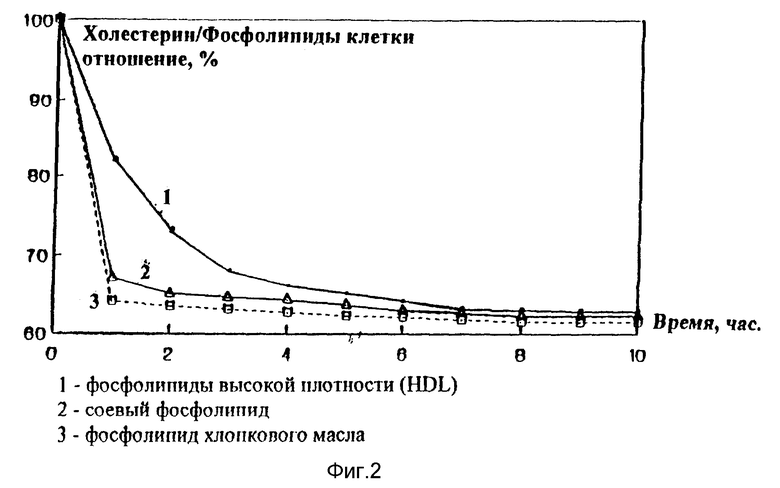
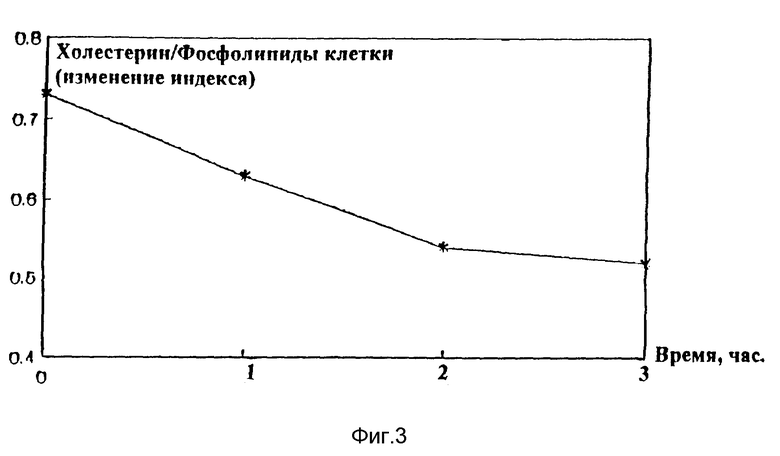
Было изучено влияние фосфолипидов, являющихся активным началом заявленной композиции, на выведение холестерина из эритроцитов и фибробластов культуры клеток. Результаты представлены на фиг. 2 и 3.
На фиг. 2 и 3 видно, что использование фосфолипидов значительно усиливает обратный транспорт холестерина липопротеинами высокой плотности из эритроцитов и фибробластов. Процентное соотношение холестерина к фосфолипидам клетки снижается более, чем в 2 раза при добавлении в среду заявленной композиции. Очевидно, введение фосфолипидов увеличивает активность лецитин - холестерин - ацилтрансферазы.
Эти данные подтверждены экспериментами на животных.
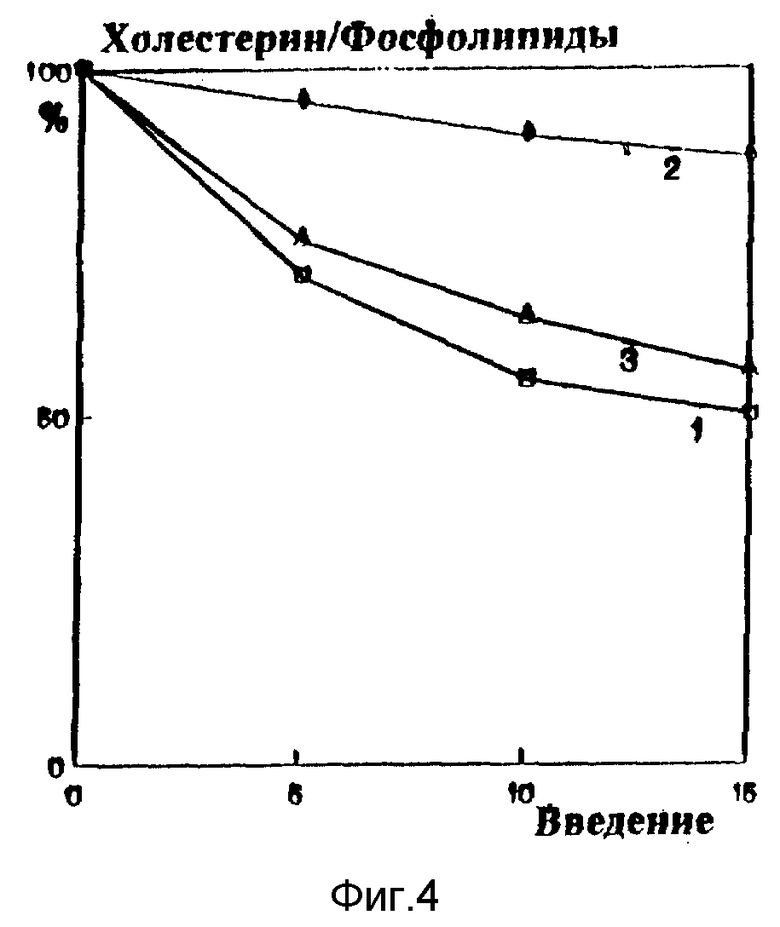
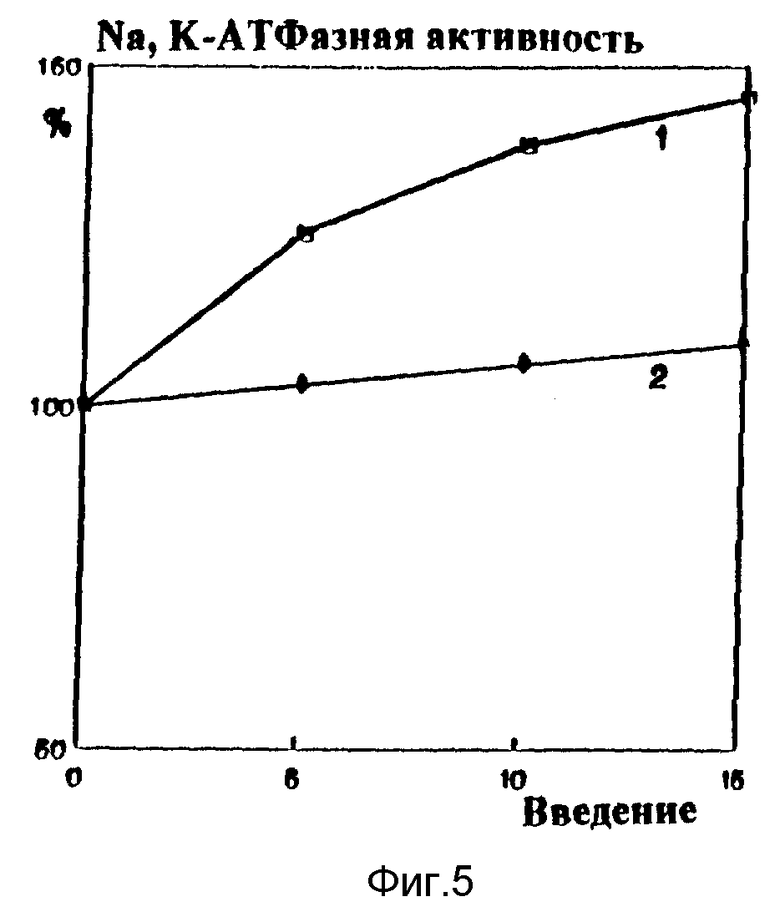
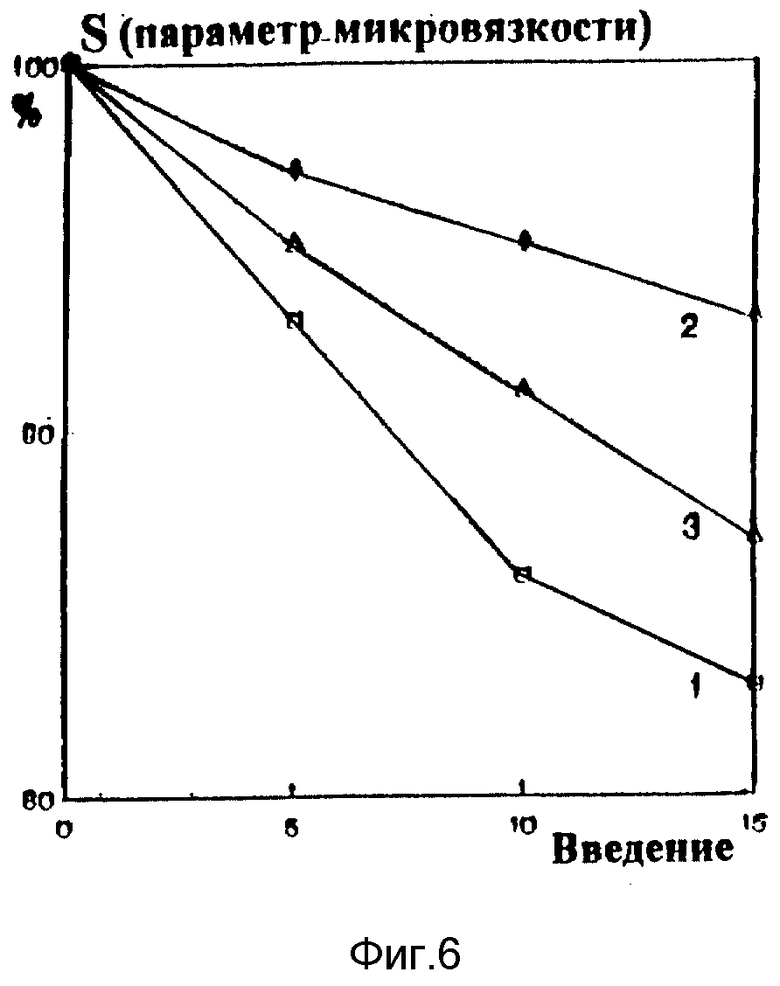
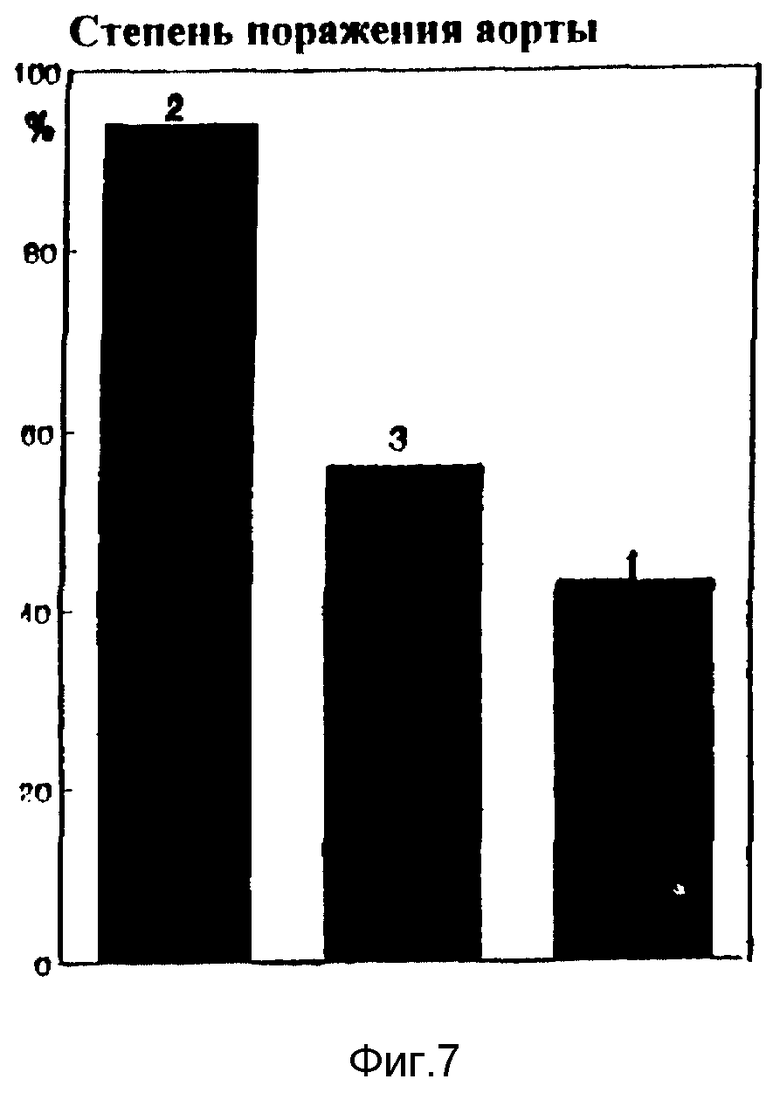
В экспериментах на кроликах с алиментарным атеросклерозом фосфолипиды вводили в ушную вену в количестве 50 мг/кг веса. Контрольные животные находились в режиме спонтанной регрессии атеросклероза, сопровождавшейся постепенным снижением концентрации холестерина в плазме. Введение кроликам с экспериментальным атеросклерозом фосфолипида снижает уровень холестерина в эритроцитах (соотношение холестерина к фосфолипидам клетки падает почти в 2 раза по сравнению с контролем, фиг. 4, кривая 1), повышает натрий - калий АТФазную активность (фиг. 5, кривая 1) и значительно снижает вялость мембран клеток (фиг. 6, кривая 1), что свидетельствует о постепенной нормализации структурно-функционального состояния клеточных мембран. Конечный антиатерогенный эффект фосфолипидных препаратов, наиболее информативно характеризующий их действие на обратный транспорт холестерина, проявился в снижении поражения аорты (фиг. 7).
Данные, полученные на автоматическом анализаторе, указывают на менее выраженное поражение аорты у животных, получавших фосфолипиды, по сравнению с контролем. Следовательно, имеет место антиатерогенный эффект фосфолипидных препаратов за счет активации обратного транспорта холестерина с помощью липопротеидов высокой плотности.
Были проведены клинические испытания эффективности заявленной композиции при различной патологии печени у людей.
Препарат назначался по схеме.
Больные с острым вирусным гепатитом принимали дополнительно к базисной терапии в течение 14 дней препарат фосфоглив (заявляемая композиция) через рот по 2 таблетки 3 - 4 раза в день, больные с хроническим гепатитом - 30 дней. Больные с хирургической патологией печени (калькулезный холецистит) принимали препарат в среднем 5 дней до операции и 5-6 дней после операции. Больные контрольной группы получали только базисную терапию (постельный режим, диета, обильное питье, поливитамины).
Испытание проводилось открытым и сравнительным способом по протоколу. Контрольные группы формировались по случайному признаку по ходу клинических испытаний. Плацебо в данном исследовании не применялось. Для объективной оценки состояния и степени тяжести больных использовалась бальная оценка (0 - отсутствие симптома, 1 - слабая, 2 - умеренная и 3 - выраженная степень проявления симптома).
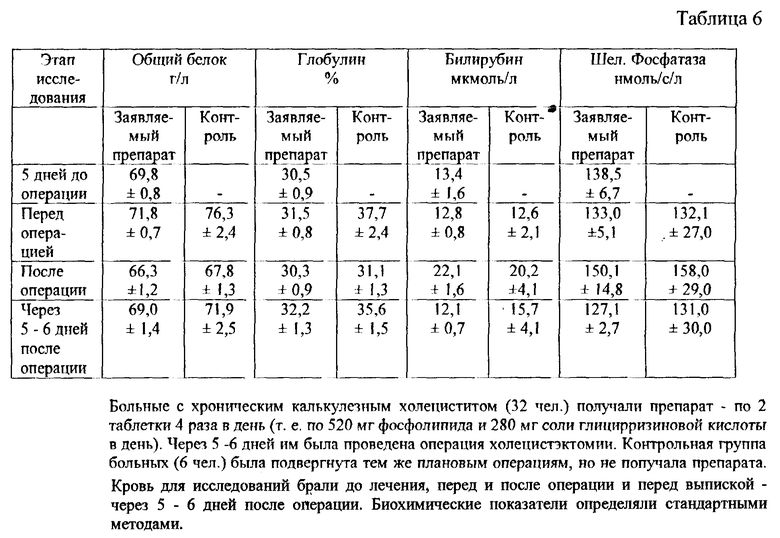
Оценка эффективности у больных калькулезным холециститом проводилась с учетом результата опроса жалоб больных и динамики биохимических показателей до начала лечения препаратом, непосредственно перед операцией, на следующий день после операции и через 5 - 6 дней после операции (перед выпиской). У больных контрольной группы исследовались только биохимические показатели непосредственно перед операцией, на следующий день после операции и через 5 - 6 суток после операции. В исследование были включены больные с хроническим калькулезным холециститом вне признаков обострения и, соответственно, с отсутствием жалоб.
Терапевтическую эффективность препарата оценивали следующим образом:
- хорошая - улучшение общего состояния больного, исчезновение симптомов интоксикации (слабости, вялости, анорексии, тошноты и рвоты), желтушности кожи, ахолии стула и темной мочи на 10-й день лечения;
- удовлетворительная - улучшение общего состояния больного, исчезновение симптомов интоксикации, желтушности кожи, ахолии стула и темной мочи на 15-й день лечения;
- отсутствие эффекта - нет изменений во всех вышеперечисленных симптомах после 15-ти дней лечения.
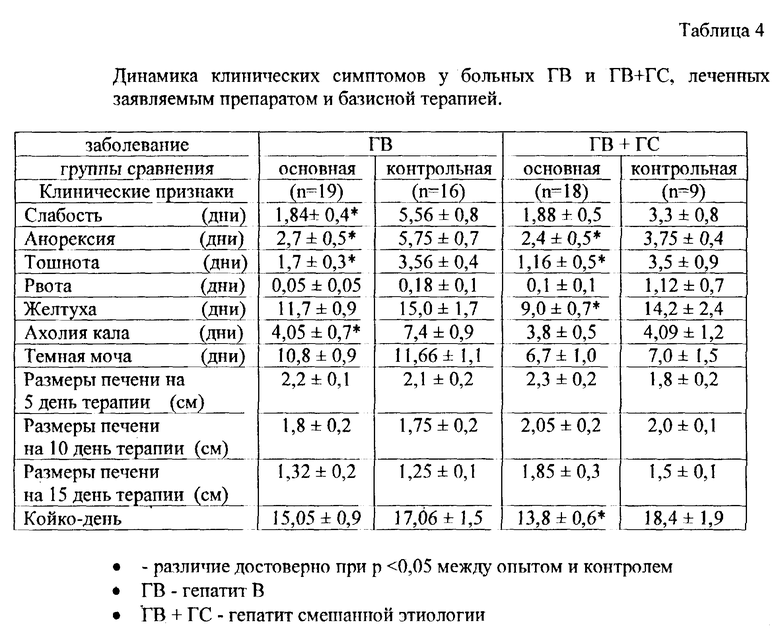
В группе больных с гепатитом B, получавших препарат, достоверно быстрее, чем в контроле, купировались симптомы интоксикации (табл. 4). Слабость, в среднем, регистрировалась в течение соответственно 1,84 ± 0,4 и 5,56 ± 0,8 дня, анорексия - 2,7 ± 0,5 и 5,8 ± 0,7 дня и тошнота - 1,7 ± 0,3 и 3,56 ± 0,4 дня. Достоверно быстрее у больных, леченных препаратом, окрашивался кал. Ахолия, в среднем, составила 4,05 ± 0,7 и 7,4 ± 0,9 дня. Быстрее разрешалась желтуха по сравнению с контрольной группой, однако это различие не было статистически достоверным.
В группе больных с микст-гепатитом B и C получены примерно аналогичные результаты (табл. 4). Хороший и удовлетворительный эффект при гепатите B отмечался, в среднем, у 79% больных, а при микст-гепатите - у 88,9% (у 16 из 18).
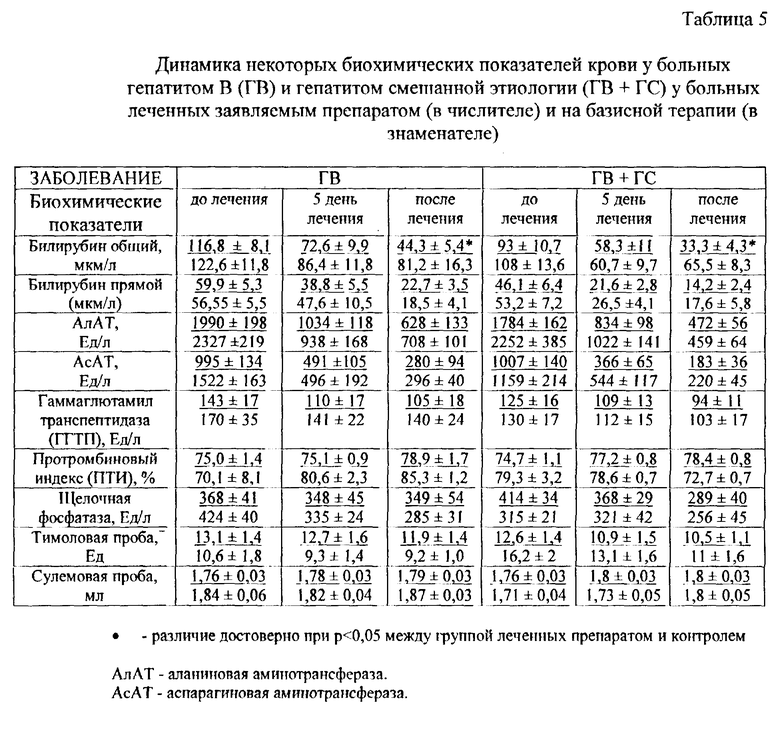
Положительные сдвиги были отмечены и при сравнении биохимических показателей. Как видно из табл. 5 у больных, получавших препарат, уровень общего билирубина и гаммаглютамилтранспептидазы (ГГТП) нормализовался достоверно быстрее, чем в контрольной группе.
По обобщенному критерию, у больных, получавших лечение, положительная динамика (нормализация и улучшение) была зарегистрирована в 79,0% случаев при вирусном гепатите В и у 88,9% - с микст-гепатитом B и C.
Выраженных побочных реакций на введение препарата фосфоглив не выявлено.
Проводилась оценка воздействия заявленной композиции при плановом хирургическом лечении хронического калькулезного холецистита у 32 больных вне признаков обострения.
Средний возраст больных 54 + 2,5 года. Контрольная группа - 6 больных с аналогичными клиническими показателями, со средним возрастом 57,2 + 2,6 года. Всем больным были проведены плановые операции в соответствии с клиническими показателями.
Препарат использовался в виде таблеток по 0,065 г фосфолипида. Больные принимали по 2 таблетки 4 раза в день - т.е. по 0,520 г фосфолипида в день - в течение 10 дней: 5 дней перед операцией и 5 дней в послеоперационном периоде. Контрольная группа препарат не принимала.
Оценку действия препарата проводили только по данным биохимических исследований.
Забор крови проводился утром натощак, 4 раза в течение курса лечения.
Определялись следующие параметры: общий белок, глобулин, билирубин, аланин- и аспарагинаминотрансферазы и щелочная фосфатаза.
Проведенный курс лечения показал, что препарат хорошо переносится больными: ни у кого из больных отрицательных эффектов не наблюдалось.
Результаты биохимических исследований крови оперированных больных (леченных и нелеченных препаратом) приведены в таблице 6.
Приведенные данные показывают, что значения всех биохимических параметров у больных, получавших заявленный препарат в течение 5 дней до операции, за это время не изменилось.
Алкогольный абстинентный синдром.
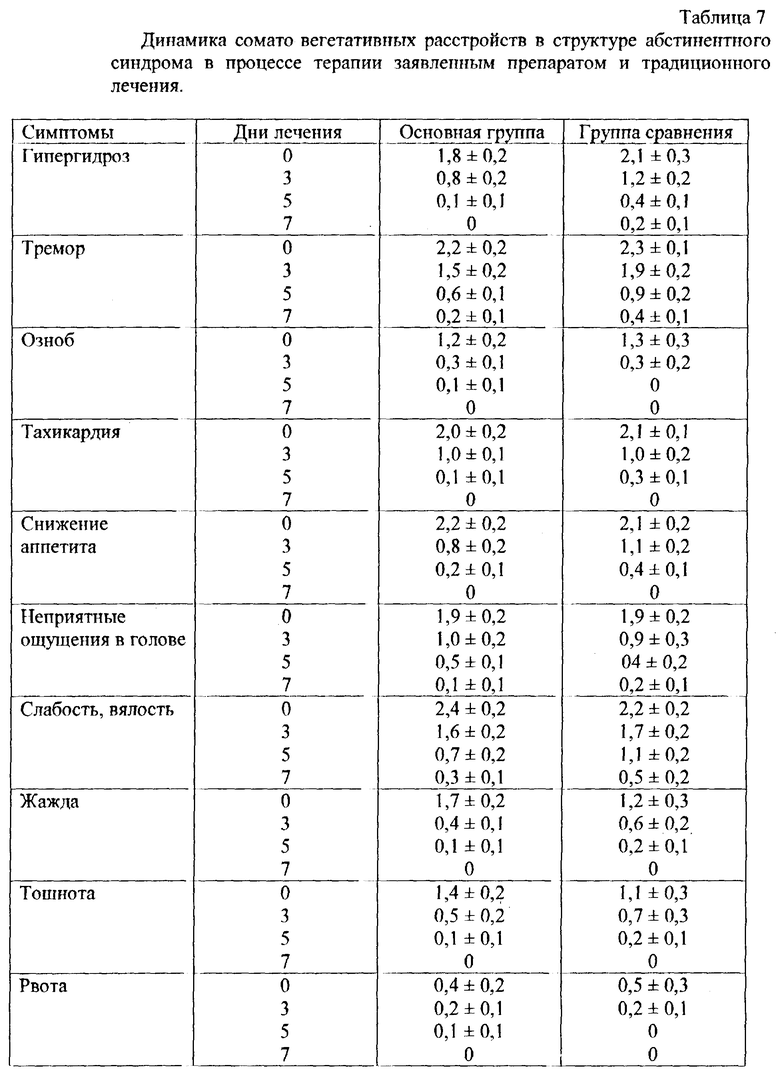
Изучены также терапевтические возможности препарата при купировании алкогольного абстинентного синдрома (ААС) в сравнении с традиционным лечением.
Открытое сравнительное исследование охватывало 34 больных алкоголизмом, находившихся на лечении в клинике НИИ наркологии Минздрава России.
Основную группу составили 24 больных алкоголизмом (19 мужчин и 5 женщин), получавших дезинтоксикационную и психотропную терапию в сочетании с препаратом фосфоглив. В группе сравнения, включавшей 10 больных (8 мужчин и 2 женщины), все пациенты получали дезинтоксикационную и психотропную терапию в комплексе с традиционно используемыми в наркологической клинике гепатопротекторными средствами.
У всех изученных больных был диагностирован хронический алкоголизм с развернутой клинической картиной болезни (2-3 стадии).
Препарат больные принимали по 1 таблетке 3 раза в день, 1,5 г в сутки. Комплекс традиционного лечения у больных группы сравнения включал лечение такими препаратами как метионин по 1 таблетке 3 раза в день, 0,75 г в сутки; липоевая кислота по 1 таблетке 3 раза в день, 0,075 г в сутки; а также карсил по 1 таблетке 3 раза в день, 0,075 г в сутки.
Состояние больных изучалось ежедневно клиническими методами на протяжении 10 дней терапии.
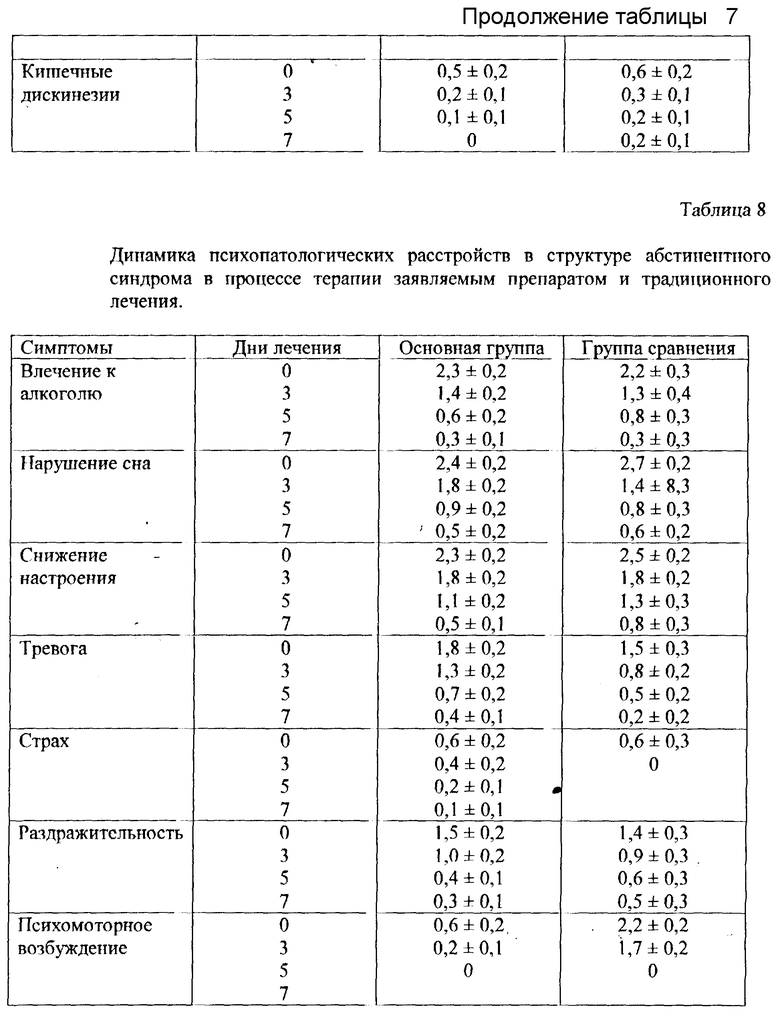
В рамках ААС были выделены и оценивались ряд соматовегетативных симптомов (табл. 7), таких как гипергидроз, тремор, озноб, тахикардия, отсутствие аппетита, неприятные ощущения в голове, слабость, тошнота, кишечные дискинезии, а также ряд психопатологических расстройств (табл. 8) в виде влечения к алкоголю, нарушений сна, пониженного настроения, тревоги, страха, раздражительности, психомоторного возбуждения.
Оценка выраженности симптомов была проведена в баллах: 0 - отсутствие симптома, 1 - легкая выраженность, 2 - умеренная выраженность, 3 - резкая выраженность.
Всем больным в первые сутки лечения и по его окончании (спустя 10 дней) проводили биохимическое исследование сыворотки крови на содержание общего билирубина, его связанной и свободной фракции, аланиновой (АлАт) и аспарагиновой (АсАт) аминотрансфераз, тимоловая проба.
Полученные данные представлены в структурно-динамических шкалах: вегето-соматической (табл. 7) и психопатологической (табл. 8), отражающих темпы редукции абстинентной симптоматики.
Анализ динамики вегетативных расстройств позволяет судить о купирующих данную симптоматику свойствах препарата.
При анализе терапевтического эффекта в отношении симптоматики психопатологического ряда обращает на себя внимание более медленная редукция фобий в структуре АСС.
При анализе терапевтического эффекта в отношении симптоматики психопатологического ряда обращает на себя внимание более медленная редукция фобий в структуре АСС.
Таким образом, заявленный препарат способствует более быстрой редукции некоторых вегетативных абстинентных расстройств, таких как гипергидроз и тремор. Кроме того, у больных несколько быстрее восстанавливается аппетит, исчезают тошнота и жажда. Выявленная тенденция к некоторому стимулирующеему эффекту препарата приводит к позитивным сдвигам в состоянии больных (исчезновение слабости, вялости, повышение общего тонуса).
Полученные результаты позволяют рекомендовать дифференцированное использование заявленной композиции (препарата фосфоглив) в комплексной терапии при купировании абстинентного синдрома у больных алкоголизмом. Является также рациональным его использование в постабстинентном периоде в качестве компонента восстановительной терапии.
Литература
1. Машковский М.Д., "Лекарственные средства", М., Медицина, 1986 г., том 2, стр. 46.
2. RU, C1, 2043110, A 61 K 35/78, 10.09.95.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО ДЛЯ КОМПЛЕКСНОГО ЛЕЧЕНИЯ ХРОНИЧЕСКИХ ДЕРМАТОЗОВ: ПСОРИАЗА, АТОПИЧЕСКОГО ДЕРМАТИТА, ЭКЗЕМЫ И КЕРАТОДЕРМИЙ И СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКИХ ДЕРМАТОЗОВ | 2001 |
|
RU2196585C2 |
| НАНОФОРМА ФОСФОЛИПИДНОГО ПРЕПАРАТА ДЛЯ ПЕРОРАЛЬНОГО ПРИМЕНЕНИЯ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2008 |
|
RU2373924C1 |
| СПОСОБ ПОЛУЧЕНИЯ КАПСУЛИРОВАННОЙ ЛЕКАРСТВЕННОЙ ФОРМЫ ФОСФОЛИПИДНОГО ПРЕПАРАТА "ФОСФОГЛИВ" ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ОСТРЫХ И ХРОНИЧЕСКИХ ЗАБОЛЕВАНИЙ ПЕЧЕНИ | 2005 |
|
RU2304431C2 |
| ОЗДОРОВИТЕЛЬНО-ПРОФИЛАКТИЧЕСКАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ КОМБИНАЦИИ СОЕВОГО ФОСФОЛИПИДНОГО КОМПЛЕКСА И ЭКСТРАКТОВ ЛЕКАРСТВЕННЫХ РАСТЕНИЙ, И БИОЛОГИЧЕСКИ АКТИВНАЯ ДОБАВКА НА ОСНОВЕ ЭТОЙ КОМПОЗИЦИИ | 2003 |
|
RU2252029C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИНЪЕКЦИОННОЙ ЛЕКАРСТВЕННОЙ ФОРМЫ ФОСФОЛИПИДНОГО ПРЕПАРАТА "ФОСФОГЛИВ" ДЛЯ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ ОСТРЫХ И ХРОНИЧЕСКИХ ЗАБОЛЕВАНИЙ ПЕЧЕНИ | 2005 |
|
RU2304430C2 |
| КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ СВОЙСТВОМ РЕПАРИРОВАТЬ МЕМБРАНЫ ГЕПАТОЦИТОВ | 1993 |
|
RU2043110C1 |
| БИОЛОГИЧЕСКИ АКТИВНАЯ КОМПОЗИЦИЯ ДЛЯ ФУНКЦИОНАЛЬНОГО ПИТАНИЯ ПРИ ЗАБОЛЕВАНИЯХ ПЕЧЕНИ | 2007 |
|
RU2362321C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ ДОКСОРУБИЦИНА И ФОСФОЛИПИДНЫХ НАНОЧАСТИЦ ДЛЯ ЛЕЧЕНИЯ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2009 |
|
RU2411935C1 |
| ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ И СПОСОБ ЛЕЧЕНИЯ РЕВМАТИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2006 |
|
RU2330664C2 |
| ФОСФОЛИПИДНАЯ ЛЕКАРСТВЕННАЯ КОМПОЗИЦИЯ С НАНОРАЗМЕРОМ ЧАСТИЦ ДЛЯ ЛЕЧЕНИЯ НАРУШЕНИЙ ЛИПИДНОГО ОБМЕНА И КОМАТОЗНЫХ СОСТОЯНИЙ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2010 |
|
RU2448715C1 |
Изобретение относится к медицине и касается фармацевтической композиции для лечения и профилактики острых и хронических заболеваний печени, нарушения липидного обмена при атеросклерозе и сопутствующих заболеваниях, восстановления функции печени при интоксикации, содержащей фосфолипиды, глицирризиновую кислоту или ее соли и вспомогательные вещества при суммарном содержании фосфолипидов и глицирризиновой кислоты или ее соли 2 - 80 мас.% и массовом соотношении фосфолипидов и глицирризиновой кислоты или ее соли не более 4 : 1. Композиция выполнена в форме гранулята, таблетированной, капсулированной или в форме для инъекций, обладает низкой токсичностью, высокой эффективностью, подлежит длительному хранению. 2 с. и 10 з.п. ф-лы, 7 ил., 8 табл.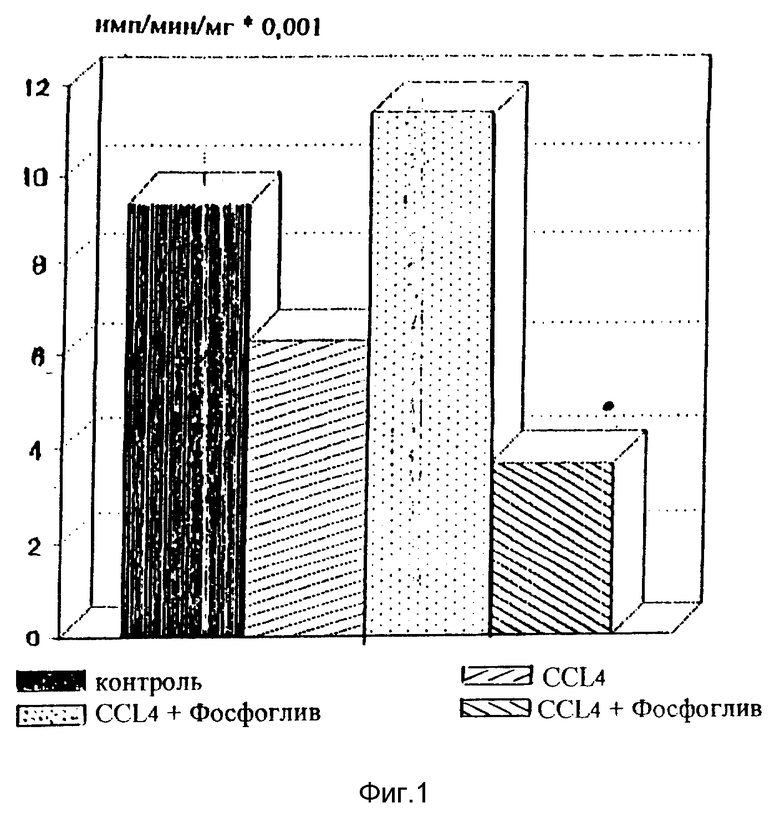
| КОМПОЗИЦИЯ, ОБЛАДАЮЩАЯ СВОЙСТВОМ РЕПАРИРОВАТЬ МЕМБРАНЫ ГЕПАТОЦИТОВ | 1993 |
|
RU2043110C1 |
| US 5461037 A, 1995 | |||
| В. И. Ульянова(Ленина) | 0 |
|
SU209037A1 |
| ВЫХОДНОЕ ОКНО УСКОРИТЕЛЯ ЗАРЯЖЕННЫХ ЧАСТИЦ | 1998 |
|
RU2137247C1 |
| US 5438044 A, 1995 | |||
| US 5262406 A, 1993 | |||
| US 5135922 A, 1992. | |||
Авторы
Даты
1999-07-20—Публикация
1998-10-14—Подача