Изобретение относится к области фармацевтической и пищевой промышленности, а именно к применению карнозина и/или гомокарнозина для стабилизации белковых и пептидных препаратов при их термической стерилизации и хранении.
Известно, что для стерилизации фармацевтических и пищевых препаратов используют разнообразные виды термической обработки, асептическую фильтрацию, а также радиационное воздействие [1].
Проводить термическую стерилизацию белковых и пептидных препаратов, как правило, невозможно из-за того, что при повышенных температурах (от 40oC) пептиды и белки могут модифицироваться и превращаться в сложные смеси [2]. Аналогичные реакции модификации и распада пептидов и белков происходят и при хранении [3].
Существенную роль в разрушении первичной структуры пептидов и белков играют усиливающиеся при нагревании в присутствии нуклеофильных и электрофильных реагентов реакции транспептидации, разрыва пептидных связей, N--->O-ацильной миграции, реакции окисления ряда аминокислот и др. Особенно интенсивно эти процессы протекают при наличии в структуре белков и пептидов трифункциональных аминокислот, таких как Asn, Asp, Gln, Glu, Ser и Thr. Так, при наличии в пептидах или белках последовательностей AspGly, AspAla, AspSer и др. происходит образование циклических имидов с последующей транспептидацией аспарагиновой кислоты и дальнейшим образованием аминосукцинильных производных или разрывом пептидных связей [4].
Побочные реакции пептидов и белков, содержащих глутаминовую кислоту, также обусловлены наличием свободной карбоксильной группы: ее способностью образовывать циклические производные [5] , сложные ЭФИРЫ и дезамидировать амидные функции других аминокислот за счет протонирования.
Амиды аспарагиновой и глутаминовой кислот, содержащиеся в пептидных и белковых препаратах, способны претерпевать дезамидирование до соответствующих кислот [4] . Кроме того, под воздействием высоких температур они могут участвовать в реакциях модификации и разрыва пептидных связей [2,5,6],
При наличии в структуре белковых и пептидных препаратов серина или треонина могут протекать реакции N--->O-ацильной миграции, которые усиливаются при повышении температуры.
На сегодняшний день неизвестно средство, позволяющее подавлять реакции транспептидации, N--->O-ацильной миграции и окисления и стабилизировать белки и пептиды при термической стерилизации и хранении.
Описываемое изобретение предлагает использовать для стабилизации в твердой фазе белковых и пептидных препаратов при их термической стерилизации и хранении карнозин и/или гомокарнозин.
При этом могут быть использованы твердые композиции пептидного или белкового препарата только с карнозином и/или гомокарнозином, или с карнозином и/или гомокарнозином совместно с одной или несколькими аминокислотами; или с карнозином и/или гомокарнозином совместно с инертными наполнителями; или с карнозином и/или гомокарнозином одновременно с одной или несколькими аминокислотами и инертными наполнителями.
В качестве аминокислот могут быть использованы, в частности, глицин, валин и др.
В качестве пептидного препарата может быть использован пептид δ- -сна или его аналоги, окситоцин, аспарагиназа и др.
Карнозин β- AlaHis) [7] и гомокарнозин γ- AbuHis) [8] являются известными соединениями. Данные об их медицинских применениях широко известны и систематизированы в обзоре (9]. Карнозин и гомокарнозин применяют при полиартритах, повышенном кровяном давлении, ишемической болезни сердца, язвенных заболеваниях, нарушениях функции надпочечников, кожных заболеваниях, как ранозаживляющее средство, в качестве противовоспалительного средства, лечебного питания, при катаракте, как бактерицидное и бактериостатическое средство, в качестве противоопухолевого средства при неоперабельном раке молочной железы и др. Описано также применение карнозина и гомокарнозина в качестве антиоксидантов, предотвращающих перекисное окисление липидов и коллагена [10, 11, 12]. Считается, однако, что биологическая роль карнозина и его аналогов неясна и по сей день [13] . Использование карнозина и гомокарнозина для стабилизации первичной структуры белковых и пептидных препаратов при их стерилизации и хранении неизвестно. Стерилизация пептидных и белковых фармпрепаратов и пищевых добавок необходима в виду того, что они легко разрушаются микроорганизмами при хранении и могут быть источником размножения последних [3].
Карнозин и гомокарнозин используются для стабилизации пептидного и белкового препарата следующим образом. Готовят композиции, которые состоят из стабилизируемых пептида или белка, карнозина и/или гомокарнозина, аминокислот(ы) и общеприменимых нейтральных наполнителей (например, стеарата натрия, бензоата натрия, талька, лактозы, крахмала, метилцеллюлозы, солей и т.д.) и используют такие композиции для термической стерилизации пептидов и белков в стандартных общепринятых для стерилизации фармпрепаратов условиях [1].
Композиции, содержащие карнозин или гомокарнозин в качестве стабилизаторов, приготавливают следующим образом. Пептид или белок, карнозин и/или гомокарнозин, аминокислоту (аминокислоты) растворяют в воде, лиофилизуют и/или упаривают, а затем стерилизуют.
Содержание основного вещества и примесей в стерилизованном препарате определяют при помощи ВЖХ или других экспериментальных методов. Композиции, обеспечивающие стабилизацию пептида или белка, используют для стерилизации и хранения.
Обычный интервал работы с пептидами и белками включает температуры 0-40oC, т. к. известно, что при более высоких температурах может происходить быстрый распад пептидов и белков. Проведенные эксперименты показали, что твердые композиции, содержащие карнозин и/или гомокарнозин, позволяют проводить термическую стерилизацию пептидов и белков вплоть до температур 120-130oC без заметной транспептидации, N--->O-ацильной миграции и окисления, а кроме того, обеспечивают их хранение.
Применение карнозина и/или гомокарнозина позволяет предотвратить типичные процессы модификации пептидных связей, протекающие с участием аминокислот Asp, Asn, Glu, Gln, Ser, Thr, и окисления.
Стабилизация пептидов и белков в присутствии карнозина, гомокарнозина и аминокислоты (аминокислот) обусловлена, по-видимому, образованием в твердом состоянии сложных молекулярных ассоциатов, включающих стабилизируемый пептид или белок, карнозин и/или его аналог и аминокислоту. Стабилизация белков и пептидов в таких ассоциатах по-видимому обусловлена образованием межмолекулярных солевых и водородных связей, препятствующих модификации пептидной цепи и разрушению аминокислот (см. фиг.1). Удивительным является тот факт, что при использовании таких композиций наряду со стабилизацией пептидных связей в твердых композициях сохраняются антиоксидантные свойства карнозина и гомокарнозина, препятствующие окислению триптофана. Полученные результаты по стабилизации пептидов и белков являются неожиданными также с учетом того, что аминокислоты, употребляемые в качестве стабилизирующих добавок, обладают амфотерным характером и имеют в своем составе нуклеофильную аминогруппу и электрофильную карбоксильную группу, способные катализировать обычные реакции, протекающие с аминокислотными остатками в присутствии нуклеофилов и электрофилов. С учетом того, что имидазольный остаток гистидина является катализатором гидролиза амидов и переноса ацильных групп [14], стабильность композиций по отношению к высоким температурам представляется неочевидной.
Более высокая стабильность композиций из нескольких компонентов, наблюдаемая в ряде случаев, по-видимому свидетельствует о необходимости для стабилизации нескольких типов водородных связей. В литературе отсутствуют данные о том, что карнозин или гомокарнозин отдельно или в смеси с аминокислотами способны стабилизировать при стерилизации при 60-130oC в течение 0,5-8 часов твердые композиции в условиях, обеспечивающих обеспложивание препаратов от микроорганизмов с сохранением структуры и необходимого качества пептидных и белковых препаратов.
В качестве наиболее яркого примера для исследования стабилизирующего действия карнозина, гомокарнозина и аминокислот был выбран пептид δ- сна, структуры TrpAlaGlyGlyAspAlaSerGlyGlu, содержащий в своем составе способные модифицироваться остатки амино кислот Trp, Asp, Ser. Остаток триптофана, содержащийся в пептиде, способен легко претерпевать окислительные превращения [6], с участием аспарагиновой кислоты легко протекают реакции образования аминосукцинильных производных и транспептидации [4], с участием остатка серина могут происходить процессы N--->О-ацильной миграции [5], совокупность этих процессов приводит к быстрому разрушению пептида под действием высоких температур.
Кроме того, интерес к изучению стабилизирующего действия карнозина и/или гомокарнозина на пептид δ- сна обусловлен и широким спектром биологической активности последнего. Так, пептид δ- сна обладает противострессорным, сомногенным, противоалкогольным, антиметастатическим, антинаркотическим, противоэпилептическим, адаптогенным действием, способен усиливать иммунный ответ [15].
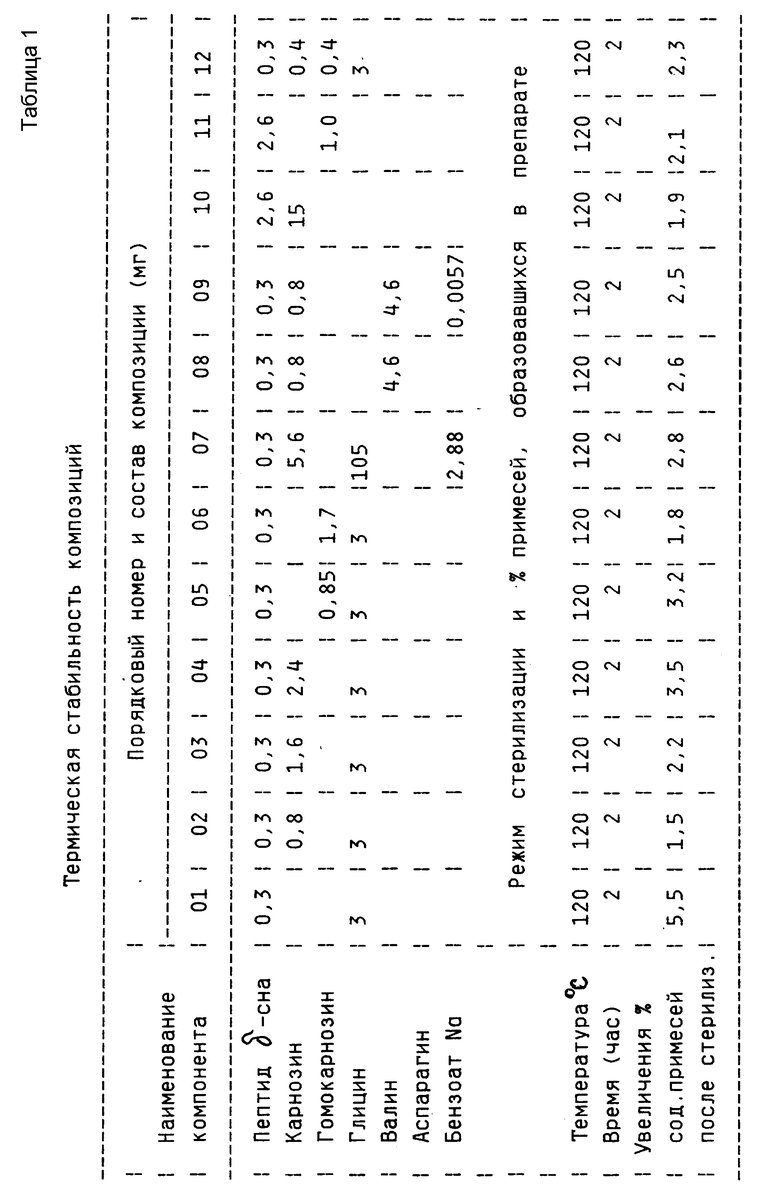
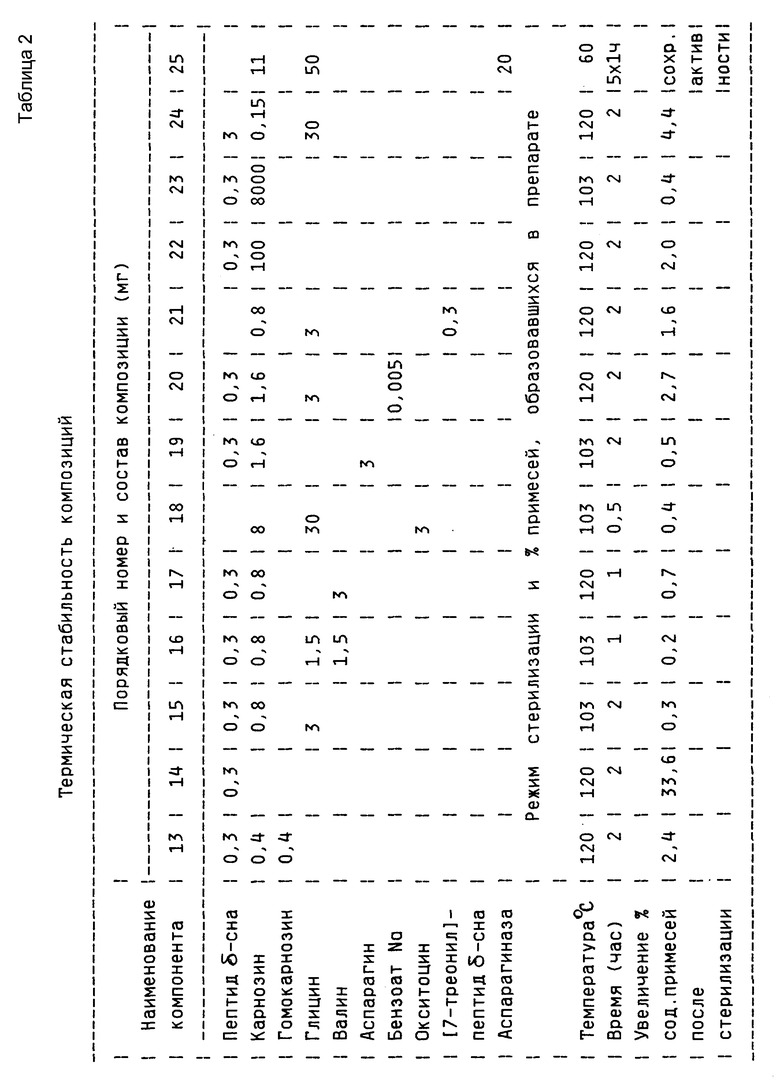
Эксперименты по подбору условий стерилизации, в которых вышеупомянутый пептид стабилен, проводились с использованием композиций, содержащих пептид δ- сна, состав которых приведен в таблице. Смеси, содержащие пептид δ- сна, нагревали до 60, 103, 120oС и выдерживали при этих температурах в течение времени, необходимого для стерилизации [1]. Для сравнения использовались пептид δ- сна (композиция 14) и его смесь с глицином (композиция 01). По данным ВЖХ на обращенной фазе при помощи интегратора определяли относительное увеличение количества примесей в каждой композиции и сравнивали его с количеством примесей в исходном пептиде δ- сна. Композиции, содержащие в своем составе глицин, карнозин и пептид δ- сна, оказались стабильными при проведении стерилизации при 105oC в течение 2 часов, количество примесей, появившихся в них при такой обработке, не превосходило 1%. В то же время, при нагреве исходного пептида δ- сна до 120oC в течение 2 часов общее количество примесей, образовавшихся в препарате, составляет 30-55%, что доказывает невозможность термической стерилизации пептидов в отсутствии стабилизаторов.
При помощи масс-спектрометрии и ЯМР 1H спектроскопии было показано, что примеси, возникающие при термической обработке композиций, включающих пептид δ- сна, карнозин и/или гомокарнозин и аминокислоты, в основном обусловлены образованием аминосукцинильных производных аспарагиновой кислоты и транспептидацией с ее участием. Модификаты, возникающие при окислении триптофана пептида δ- сна, элюируются перед основным пиком, а аминосукцинильные производные - после него.
Наилучшие результаты по стабилизации пептида δ- сна были получены при использовании препаратов, содержащих в качестве стабилизаторов карнозин и глицин. Такие же композиции были использованы для стабилизации окситоцина и аспарагиназы.
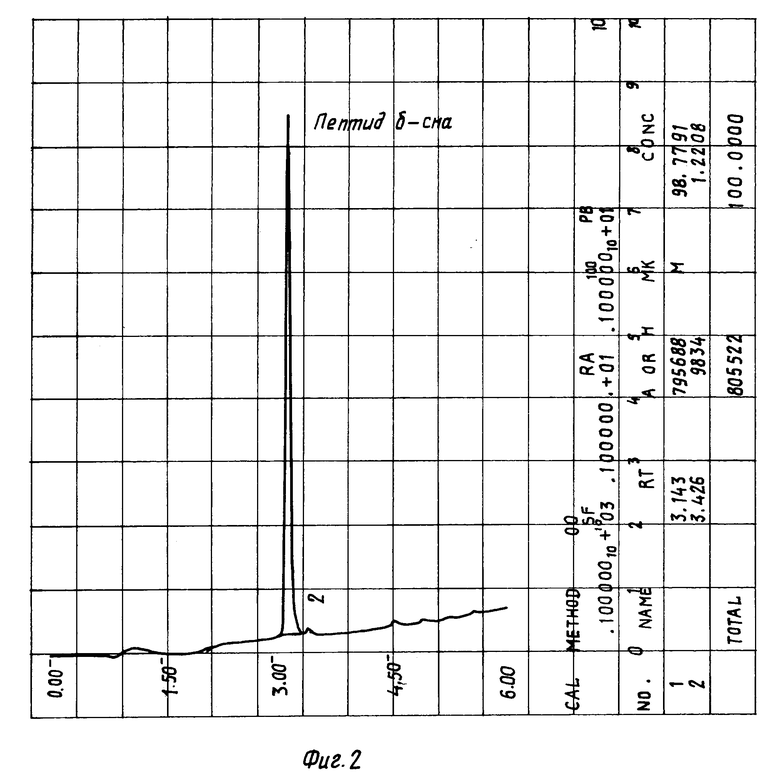
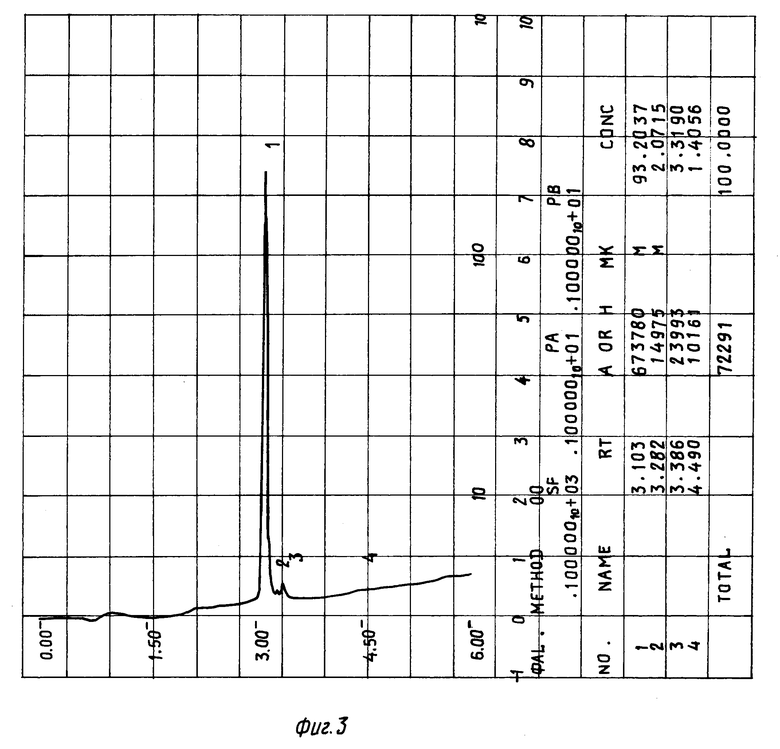
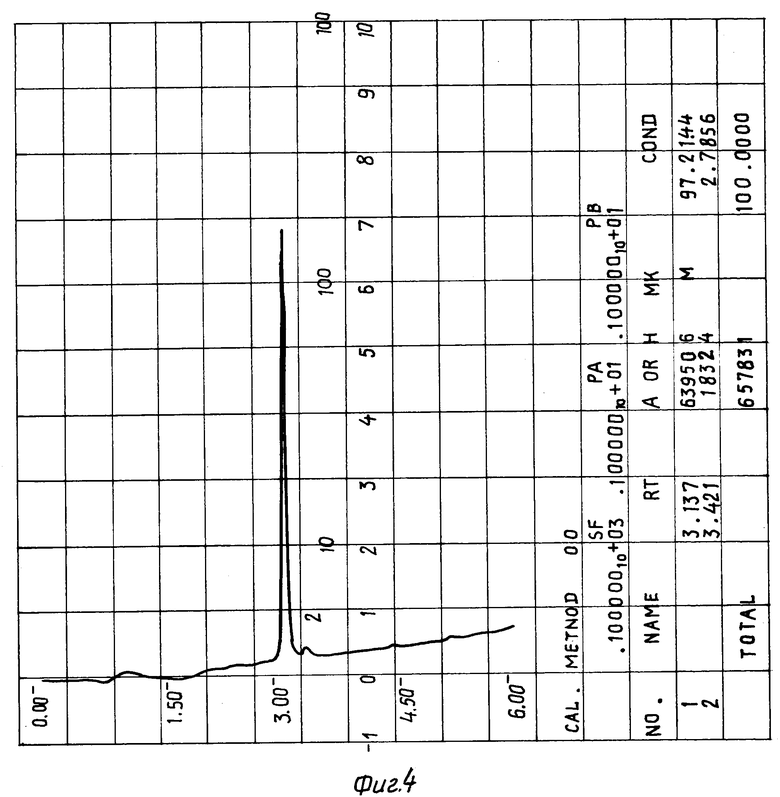
Результаты по изучению термической стабильности пептидов, полученные с помощью обращеннофазовой ВЖХ, приведены в таблице. Хроматографию осуществляют на колонке 0,46 • 4,5 см с Ultrasphere ODS, Детекцию производят при 226 нм. Пептиды элюируют в градиенте 0--->80% ацетонитрила в 0,1% трифторуксусной кислоте при скорости элюирования 1,5 мл/мин. Качество препаратов оценивают по разности площадей (в процентах) пиков, характеризующих содержание примесей, появившихся в пептидном препарате после стерилизации и имевшихся в нем до нее. Пики карнозина, гомокарнозина, аминокислот и инертных наполнителей при обсчете не учитывают. Для этого детектирование начинают после элюирования выходящих со свободным объемом аминокислот и карнозина или гомокарнозина (см. фиг. 2-4, 6).
На фиг. 1 изображены структуры, объясняющие механизм стабилизации остатков Asp и Ser в пептиде δ- сна в присутствии карнозина или гомокарнозина.
На фиг. 2 изображена хроматограмма композиции 01, содержащей пептид δ- сна и глицин до стерилизации.
На фиг. 3 помещена хроматограмма композиции 01 после стерилизации при 120oC в течение 2-х часов.
На фиг. 4 помещена хроматограмма композиции 02, содержащей пептид δ- сна, карнозин и глицин, после стерилизации при температуре 120oC в течение 2-х часов.
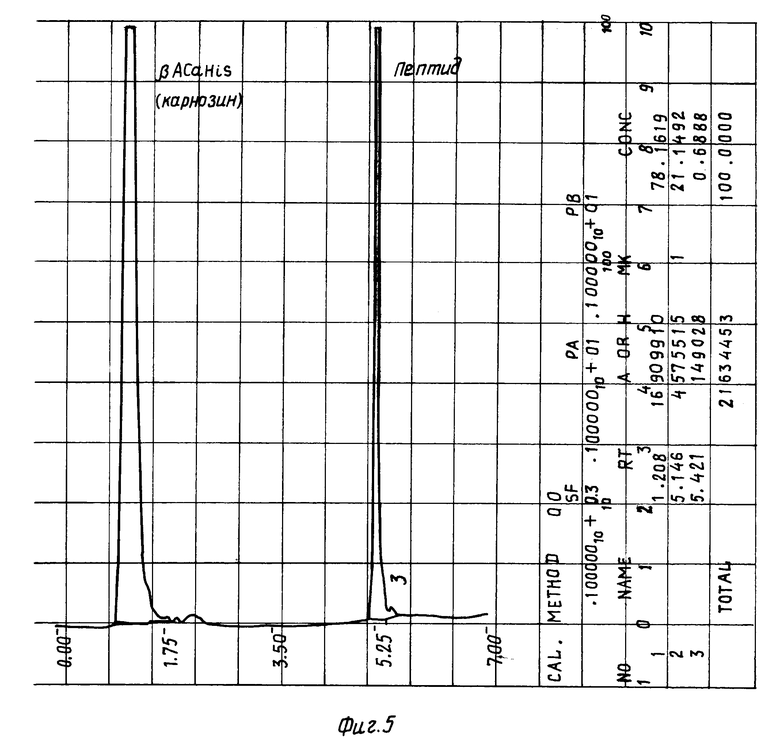
На фиг. 5 изображена хроматограмма композиции 10, содержащей пептид δ- сна и карнозин, после стерилизации при 120oC в течение 2-х часов, причем, в данном случае была произведена и детекция карнозина.
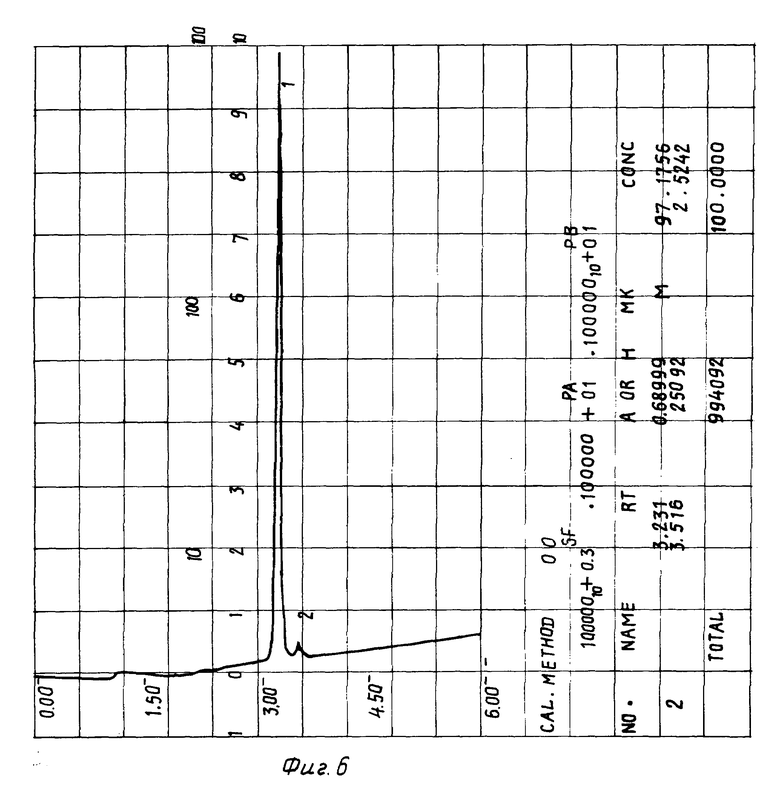
На фиг. 6 изображена хроматограмма композиции 02 после стерилизации при 120oC в течение 1 часа и хранения при +45oC в термостатируемом шкафу в течение 65 дней.
Пример 1. Готовят композицию 02. Для этого 0,3 мг пептида δ- сна (содержание основного вещества 98,8%) и 5 мг глицина растворяют в 0,5 мл воды, замораживают и лиофилизуют. Лиофилизат нагревают в сушильном шкафу на воздухе 2 часа при 120oC. Композицию анализируют с помощью ВЖХ: пептид элюируют в градиенте 0--->80% ацетонитрила в 0,1% трифторуксусной кислоте при скорости элюирования 1,5 мл/мин, как это было описано выше, и определяют увеличение содержания примесей по сравнению с исходным лиофилизатом (см. фиг. 2 и 3 и таблицу).
Пример 2. Готовят композицию 10. Для этого 2,6 мг пептид δ- сна (содержание основного вещества 98,8%) и 15 мг карнозина растворяют в 5 мл воды, затем упаривают при 22oC в вакууме и подвергают термической обработке в течение 2 часов при 119-121oC. Качество препарата анализируют аналогично примеру 1 в градиенте 0 ---> 56% ацетонитрила в 0,1%-ной трифторуксусной кислоте за 7 мин (см. фиг.5 и таблицу).
Пример 3. Готовят композицию 05. Для этого 0,5 мг пептида δ- сна, 0,85 мг гомокарнозина и 3 мг глицина растворяют в 1 мл воды, замораживают в ампуле и лиофилизуют. Нагревают 2 часа при 120oC и анализируют (см. таблицу).
Пример 4. Готовят композицию 18. Для этого растворяют в 3 мл воды 3 мг 98%-ного окситоцина, 8 мг карнозина и 30 мг глицина, замораживают и лиофилизуют. Полученный препарат стерилизуют в запаянной ампуле 0,5 часа при 103oC. Контроль качества проводят аналогично примеру 1 (см. таблицу).
Пример 5. 0,3 мг Пептида δ- сна с содержанием основного вещества 98,8%, 0,8 мг карнозина и 3 мг глицина растворяют в 1 мл воды, лиофилизуют, запаивают в 3 мл ампуле под азотом, стерилизуют при 120oC 1 час и хранят при +45oC в термостатируемом шкафу в течение 65 дней. Полученный образец хроматографируют в условиях примера 1. Содержание основного вещества в препарате составляет 97,7% (см. фиг. 6), что указывает на возможность сохранения препарата в сухом прохладном месте в течение 2 лет.
Пример 6. Готовят композицию 25. Для этого 20 мг (3000 ME) аспарагиназы, 50 мг глицина и 11 мг карнозина растворяют в 5 мл воды, лиофилизуют в ампуле и запаивают. Затем препарат подвергают тиндализации: нагревают при 60oC в течение 1 часа 5 раз. Для исходного и стерилизованного тиндализацией препарата определяют ферментативную активность аспарагиназы в 1 мг композиции в соответствии с методикой [16] . Как до, так и после тиндализации получают идентичные значения активности фермента - 34 МЕ/мг композиции.
Таким образом, как следует из данных таблицы 1, 2 и фигур, карнозин и гомокарнозин стабилизируют белковые и пептидные препараты при их стерилизации и хранении.
Источники информации
1. Государственная фармакопея СССР.- М.: Медицина 1968, с. 991 и 992.
2. Шредер Э., Любке К. Пептиды. Т.2.- М.: Мир, 1969, с.65.
3. Stewart J.M., Young J.D., Solid Phase Peptide Synthesis, Pierce Chemical Company. -1989, 48 - 50.
4. Там же, 18-27.
5. Шредер Э., Любке К. Пептиды Т.1. - М.: Мир, 1967, с. 200-280.
6. Там же, с. 36 и 204.
7. Gulewitch V.S., Amiradgibis S., Ztsch.Physiol & Chem. - 1900, v.50, p.5.
8. Pisano J.J. et.al,, J.Biol.Chem., 1961, 236, p.p. 499-502.
9. Quinn P. J, , Boldyrev A.A., Formazyuk V.E., Molec. Aspects Med. - 1992. v.13, p. 379-444.
10. Патент Японии JP 04187610-A.
11. Международная заявка WO 90/06102.
12. Boldyrev A.A., Formazyuk V.E., Sergienko V.I., Sov.Sci. Rev., D.Phisicochem.Biol. - 1994, v.13, p. 23-31.
13. Химическая энциклопедия. Т. 2. - М.: 1990, с. 332.
14. Общая органическая химия. Т. 10. - М., 1986, с.387.
15. Mendzheritsky A. M. , Mikhalyova I.I., Makletsova M.G. Delta-sleep indusing peptide. Theoretical and applied aspects. Workshop.- Rostov-on-Don: October 17-19, 1991.
Abstracts of reports.
16. L-аспарагиназа для инъекций. Фармакопейная статья ФС 42-2952-93.- М. , 1993, с.7.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ МУРАМИЛПЕПТИДОВ | 1995 |
|
RU2083588C1 |
| СПОСОБ ПОЛУЧЕНИЯ L-КАРНОЗИНА И ЕГО ГОМОЛОГОВ | 1992 |
|
RU2084457C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕПТИДА δ- СНА | 1995 |
|
RU2111215C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ СВЯЗАННЫХ СО СТРЕССОВЫМИ УСЛОВИЯМИ ЗАБОЛЕВАНИЙ И РАССТРОЙСТВ У ЧЕЛОВЕКА И ЖИВОТНЫХ, А ТАКЖЕ СПОСОБ ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ С ИСПОЛЬЗОВАНИЕМ ЭТОГО СРЕДСТВА | 2009 |
|
RU2450823C2 |
| АНТИСТРЕССОРНОЕ И НООТРОПНОЕ СРЕДСТВО С АНТИВИРУСНЫМ И ИММУНОСТИМУЛИРУЮЩИМ ДЕЙСТВИЕМ | 2001 |
|
RU2211703C2 |
| СПОСОБ ПОЛУЧЕНИЯ НИЗКОГИДРОЛИЗОВАННОЙ ПЕПТИДНОЙ КОМПОЗИЦИИ ИЗ БЕЛКОВ МОЛОЧНОЙ СЫВОРОТКИ | 2013 |
|
RU2531164C1 |
| Способ получения пищевых добавок из вторичного копченого рыбного сырья с применением термического гидролиза | 2020 |
|
RU2727904C1 |
| Средство для коррекции десинхроноза, вызванного нарушением светового режима | 2017 |
|
RU2660578C1 |
| ЭЖЕКТИРУЕМАЯ ЖИДКОСТЬ, СПОСОБ ЭЖЕКЦИИ, СПОСОБ ФОРМИРОВАНИЯ КАПЕЛЕК ЖИДКОСТИ, КАССЕТА ДЛЯ ЭЖЕКЦИИ ЖИДКОСТИ И ЭЖЕКЦИОННОЕ УСТРОЙСТВО | 2005 |
|
RU2342948C1 |
| СПОСОБ ПОЛУЧЕНИЯ СУБСТАНЦИИ РЕКОМБИНАНТНОЙ L-АСПАРАГИНАЗЫ ERWINIA CAROTOVORA | 2010 |
|
RU2441914C1 |
Изобретение относится к области медицины, а именно к стабилизации белковых препаратов при их термической стерилизации и хранении. Сущность изобретения: в качестве средства для стабилизации используют карнозин и/или гомокарнозин. Средство также может содержать одну или несколько аминокислот, а также один или несколько инертных наполнителей. Техническим результатом изобретения является расширение арсенала средств для стабилизации белково-пептидных препаратов. 2 з.п. ф-лы, 6 ил., 2 табл.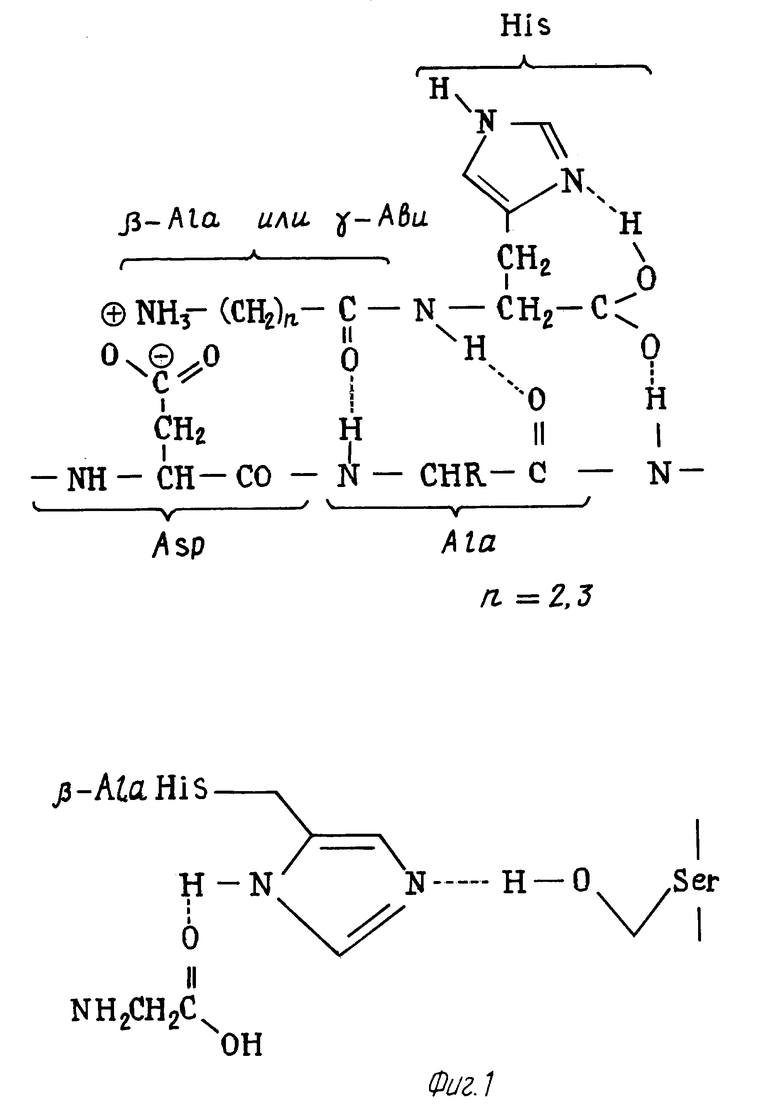
| Государственная фармакопея СССР | |||
| - М.: Медицина, 1968, с.991 и 992 | |||
| Hipkiss A.K | |||
| et al | |||
| "Carnosin protects protein...", Biochem | |||
| Soc.Frans., 1994, 22(4), 339. |
Авторы
Даты
1999-08-10—Публикация
1995-06-26—Подача