Изобретение относится к новым биоaроматическим соединениям, к использованию этих новых соединении в фармацевтических композициях, предназначенных для медицины или ветеринарии, или в косметических композициях.
Соединения, согласно изобретению, обладают активностью в области диффенциации и пролиферации клеток и могут найти применение при лечении топическим или системным путем дерматологических заболеваний, связанных с нарушением кератинизации, дерматологических (или других) заболеваний с воспалительным и/или иммуноаллергическим компонентом и дермических или эпидермических пролифераций, являющихся либо доброкачественными, либо злокачественными. Кроме того, эти соединения можно использовать при лечении заболеваний перерождения соединительной ткани, для борьбы против старения кожи, которое происходит либо вследствие фотоиндуцирования, либо за счет возрастных факторов и для лечения при нарушениях зарубцовывания. Они находят применение, кроме того, в области офтальмологии, особенно при лечении корнеопатий.
Соединения, согласно изобретению, также можно использовать для гигиены тела и ухода за волосами.
Соединения, согласно изобретению, могут быть представлены следующей общей формулой (I):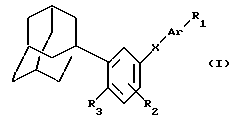
в которой:
R1 обозначает: (I) радикал -CH3, (II) радикал -(CH2)n-O-R4, (III) радикал -О- (CH2)m- (CO)n-R5, (IV) радикал -CO-R6, (V) радикал -CO-O-R7, причем значения m и n, а также значения различных радикалов R4-R7 приводятся ниже;
R2 обозначает атом водорода или галогена, линейный или разветвленный алкильный радикал с 1-20 атомами углерода, радикал - OR4 или радикал -O-CH2-O-CH2-CH2-O-CH3,
R3 обозначает: (I) радикал -Y-(CH2)p -Y-(CH2)q-R8, (II) радикал - (CH2)p-Y- (CH2)qR8; (III) радикал -Y-(CH2)q-R8; (IV) радикал -CH=CH-(CH2 r-R8, (V) радикал -(CH2)q-R8,
причем значения p,q,r и радикалов Y и R8 приводятся ниже;
X обозначает связи нижеследующих формул (a)-(k), которые могут быть связаны двояким образом: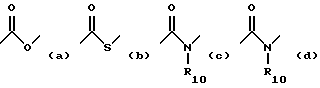
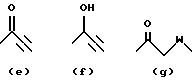
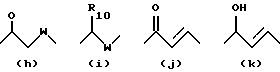
Ar обозначает радикал, выбираемый среди радикалов следующих формул (a)-(f);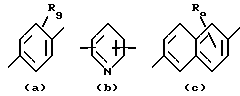
имея в виду, что в вышеуказанном:
- m обозначает целое число, равное 1, 2 или 3;
- n обозначает целое число, равное 0 или 1;.
- p обозначает целое число, находящееся в пределах 1-12 включительно;
- q обозначает целое число, находящееся в пределах 0-12 включительно;
- г обозначает целое число, находящееся в пределах 0-10 включительно;
- t обозначает целое число, равное 0, 1 или 2;,
- Y обозначает атом кислорода или радикал S (О)t;
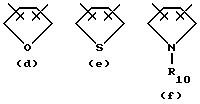
- W обозначает атом кислорода, радикал S(O)t или радикал N-R10;
- R4 обозначает атом водорода, низший алкильный радикал или радикал -CO-R11,
- R5 обозначает низший алкил или гегероцикл;
- R6 обозначает атом водорода, низший алкильный радикал или радикал:
в котором R' и R''обозначают атом водорода, низший алкильный радикал, моно- или полигидроксиалкильный радикал, возможно замещенный арильный радикал или остаток аминокислоты или пептида или сахара или же, взятые вместе, образуют гетероцикл;
- R7 обозначает атом водорода, линейный или разветвленный алкильный радикал с 1-20 атомами углерода, алкенильный радикал, моно- или полигидроксиалкильный радикал, возможно замещенный арильный или аралкильный радикал или остаток сахара или остаток аминокислоты или пептида;
- R8 обозначает атом водорода, разветвленный алкильный радикал с 1-20 атомами углерода, циклоалифатический радикал с 3-6 атомами, углерода, моногидроксиалкильный радикал или полигидроксиалкильный радикал, гидроксильные группы которого защищены в форме метокси-, ацетокси- или ацетонид-группы, арильный радикал; алкинильный радикал, радикал -CO-R6, радикал -CO-O-R7, аминоалкильный радикал, аминная функция которого возможно замещена одной или двумя низшими алкильными группами, гетероцикл; причем R7 имеет вышеуказанное значение;
- R9 обозначает атом водорода или галогена, линейный или разветвленный алкильный радикал с 1-20 атомами углерода, радикал - OR4, радикал -O-CH2-O-CH2-CH2-O-CH3;
- R10 одинаковые или различные, обозначают атом водорода или низший алкильный радикал;
- R11 обозначает низший алкильный радикал;
имея в виду, что
- когда X обозначает связь формулы (a), (b), (c), (q), (h), (j) или (k), тогда R3 отличается от радикала формулы (III), (IV) или (V), причем R3 обозначает атом водорода;
- когда X обозначает связь формулы (а), тогда R3 отличается от радикала (III);
- когда X обозначает связь формулы (Ь) и R3 обозначает радикал формулы (III), в которой Y обозначает атом серы, тогда R8 отличается от арильного радикала;
-когда X обозначает связь формулы (q), (h), (j) или (k) и R3 обозначает радикал формулы (V), тогда R8 отличается от моногидроксиалкильного или полигидроксиалкильного радикала.
Изобретение также относится к солям соединений формулы (I), когда R1 или R8 обозначает карбоксильную функцию и/или, когда R8 обозначает аминную функцию, хиральным аналогам и геометрическим изомерам вышеуказанных соединений формулы (I). Когда соединения, согласно изобретению, находятся в форме солей за счет присоединения кислоты, то речь идет о фармацевтически или косметически приемлемых солях, получаемых путем присоединения неорганической или органической кислоты, в особенности соляной кислоты, серной кислоты, уксусной кислоты, лимонной кислоты, фумаровой кислоты, гемиянтарной кислоты, малеиновой кислоты и миндальной кислоты. Когда соединения, согласно изобретению, находятся в форме солей за счет присоединения основания, то речь идет о солях щелочного или щелочноземельного металла или еще о солях цинка или органического амина.
Согласно настоящему изобретению, под низшим алкильным радикалом понимают радикал с 1-12, предпочтительно 1-9 атомами углерода, в особенности метильный, этильный, изопропильный, бутильный, третбутильный, гексильный, нонильный и додецильный радикалы.
Под линейным алкильным радикалом с 1-20 атомами углерода понимают особенно метильный, этильный, пропильный, 2-этил-гексильный, октильный, додецильный, гексадецильный и октадецильный радикалы.
Под разветвленным алкильным радикалом с 1-20 атомами углерода понимают особенно 2-метил-бутильный, 2-метил-пентильный, 1-метил-гексильный, 3-метил-гептильный радикалы.
Из моногидроксиалкильных радикалов предпочтителен радикал с 2 или 3 атомами углерода, особенно 2-гидрокси-3-этильный, 2- гидрокси-пропильный или 3-гидрокси-пропильный радикал.
Из полигидроксиалкильных радикалов предпочтителен радикал с 3-6 атомами углерода и 2-5 гидроксильными группами, как 2,3- дигидрокси-пропильный, 2,3,4-тригидрокси-бутильный, 2,3,4,5- тетрагидрокси-пентильный радикалы или остаток пентаэритритола.
Из арильных радикалов предпочтителен фенильный радикал, возможно замещенный по крайней мере одним атомом галогена, гидроксильным радикалом или нитрогруппой.
Из аралкильных радикалов предпочтителен бензильный или фенетильный радикал, возможно замещенный по крайней мере одним атомом галогена, гидроксилом или нитрогруппой.
Из алкенильных радикалов предпочтителен радикал с 1-5 атомами углерода, содержащий одну или несколько этиленовых ненасыщенностей (двойных связей), такой, как особенно аллильный радикал.
Под остатком сахара понимают остаток, происходящий особенно от глюкозы, галактозы или маннозы, или еще глюкуроновой кислоты.
Под остатком аминокислоты понимают особенно остаток, происходящий от лизина, глицина или аспарагиновой кислоты, а под остатком пептида понимают в особенности дипептидный или трипептидный остаток, образующийся в результате сочетания аминокислот.
Под гетероциклом понимают предпочтительно пиперидино-, морфолино-, пирролидино- или пиперазино-радикал, возможно замещенный в положении 4 алкильным радикалом с 1-6 атомами углерода или моно- или полигидроксиалкильным радикалом, как указанные выше.
Под аминоалкильным радикалом понимают радикал предпочтительно с 1-6 атомами углерода, особенно аминометильный, 3-амино-пропильный, 6-амино-гексильный радикалы.
Из алкинильных радикалов предпочтителен радикал с 2-6 атомами углерода, особенно пропаргильный радикал.
Из циклоалифатических радикалов с 3-6 атомами углерода можно назвать предпочтительно циклопропильный радикал и циклогексильный радикал.
Когда радикалы R2 и R9 обозначают атом галогена, то им предпочтительно является атом фтора, брома или хлора.
Из соединений вышеприведенной формулы (I), входящих в рамки настоящего изобретения, особенно можно назвать следующие:
4-[3-(1-адамантил) -4-метоксифенилтиометил] бензойная кислота,
4-[3-(1-адамантил) -4-метоксифенилсульфинилметил] бензойная кислота,
4-[3-(1-адамантил) -4-метоксифенилметилсульфонил] бензойная кислота,
4-[3-(1-адамантил) -4-метоксифенилметилсульфинил] бензойная кислота,
4-[3-(1-адамантил) -4-метоксифенилсульфонилметил] бензойная кислота,
4- [3- (1-адамантил) -4-метоксифенилтиокарбоксамидо] бензойная кислота,
4-[3-(1-адамантил) -4-метоксифенилметилтио] бензойная кислота,
4-[3-(1-адамантил) -4-метоксифенилметиламино] бензойная кислота,
4- [[3-оксо-3- [3- (1-адамантил) -4-метоксифенил] -1- пропинил]] бензойная кислота,
4-[3-(1-адамантил) -4- метоксиэтоксиметоксибензамидо] бензойная кислота,
4-[3-(1-адамантил) -4-метоксиэтоксиметоксибензоилокси] бензойная кислота,
(E)-4-[[3-оксо-3- [3- (1-адамантил) -4- метоксиэтоксиметоксифенил] -1-пропенил]] бензойная кислота,
4- [[3-гидрокси-3- [3- (1-адамантил) -4-мeтoкcиэтoкcиметоксифенил] -1-пропинил]] бензойная кислота,
4-[3-(1-адамантил) - 4-(2, 2-диметил-1, 3-диоксолан-4-метилокси) -фенилкарбоксамидо] бензойная кислота,
4-[3-(1-адамантил) -4- (2, 3-дигидроксипропилокси) фенилкарбоксамидо] бензойная кислота,
4- [3- (1-адамантил) -4-метоксикарбонилметилоксифенилкарбоксамидо) бензойная кислота,
2- [3- (1-адамантил) -4- метоксифеноксиметил] -4-тиофенкарбоновая кислота,
2-[3-(1-адамантил) -4-метоксифениламинометил] -4-тиофенкарбоновая кислота,
2- [3- (1-адамантил) -4 -метоксифенилтиометил] -4-тиофенкарбоновая кислота,
4-[3-(1-адамантил) -4-(2, 2-диметил-1, 3-диоксолан-4- метилокси) бензоилокси] бензойная кислота
4-[3-гидрокси-3-[5-(1-адамантил)-2,4-диметоксиэтоксиметоксифенил] -1-пропинил] бензойная кислота,
4-[3-(1- адамантил) -4-метоксиэтоксиметоксибензоилтио] бензойная кислота,
N-метил-4- {3- (1-адамантил) -4 -метоксиэтоксиметоксифенилкарбоксамидо] бензойная кислота,
4-[3- (1-адамантил) -4- метоксиэтоксиметоксифенилтиокарбоксамидо] бензойная кислота,
(Е)-4-[[3-оксо-3- [3- {1-адамантил) -4-метоксиметокси-фенил] -1- пропенил]] бензойная кислота;
(Е) -4-[[3-оксо-3- [3- (1-адамантил) -4-гидроксифенил] -1-пропенил]] бензойная кислота,
(Е)-4-[[3-оксо-3- [3- (1-адамантил) -4-метоксифенил] -1- пропенил]] бензойная кислота,
(Е)-4-[[3-оксо-3- [3- (1-адамантил) -4-(3-гидрокси-пропилокси) фенил] -1-пропенил]] бензойная кислота,
4-[3-(1-адамантил) -4-метоксиэтоксиметоксибензоил-окси] бензальдегил,
4-[3-(1-адамантил) -4-метоксиэтоксиметоксибензоилокси] бензолметанол,
(Е) -N-этил-4- [[З3оксо-3" [3- (1-адамантил} -4-метоксиэтоксиметоксифенил] -1-пропенил]] бензамид,
(Е) -N-гидроксифенил) -4- [[3-оксо-3- [3- (1-адамантил) -4-метоксиэтоксиметоксифенил] - 1-пропенил]] бензамид,
(Е)-4-[[3-оксо-3- [3- (1-адамантил) -4- метоксиэтоксиметоксифенил] -1-пропенил]] фенол.
Согласно настоящему изобретению, более предпочтительными соединениями формулы (I) являются такие, в случае которых выполняется одно, предпочтительно все, из следующих условий:
- R1 обозначает радикал -COO-R7 и -CO-R6;
- R3 обозначает радикал-Y-(CH2)p-Y-(CH2)q-R8;
-(CH2)p-Y-(CH2)q-R8; -Y-(CH2)q-R8;
- X обозначает связь формулы (a), (e), (f), (j) или (k);
-Ar обозначает радикал формулы (a) или (b).
Предметом настоящего изобретения также являются способы получения соединений формулы (I), в особенности согласно приводимым на фиг. 1, 2 и 3 реакционным схемам.
Так, соединения формулы I (а) могут быть получены (фиг. 1) путем введения во взаимодействие в безводной среде, в органическом растворителе, предпочтительно в ТГФ, и в присутствии третичного амина (например, как триэтиламин или пиридин), активированной формы бензойной кислоты (2), например, хлорангидрида кислоты (3), с фенолом формулы (7).
Соединения формулы I(b) могут быть получены (фиг. 1) путем введения во взаимодействие в безводной среде, в органическом растворителе, предпочтительно в ТГФ, и в присутствии третичного амина (например, как триэтиламин или пиридин), активированной формы бензойной кислоты (2), например, хлорангидрида кислоты (3); с тиофенолом формулы (8).
Соединения формулы I(с) могут быть получены (фиг. 1) путем введения во взаимодействие, в безводной среде, в органическом растворителе, предпочтительно в ТГФ, и в присутствии третичного амина (например, как триэтиламин или пиридин), активированной формы ароматической карбоновой кислоты (2), например, хлорангидрида кислоты (3), с аминосоединением формулы (9).
Соединения формулы I(d) могут быть получены (фиг. 1) из соединений формулы I (c) путем взаимодействия с реагентом Лавессона.
Соединения формулы I(e) могут быть получены (фиг. 1) из бензиловых спиртов (5) путем превращения в бромпроизводные (6) с помощью трибромида фосфора, затем введения во взаимодействие, в присутствии -карбоната калия или гидрида щелочного металла (гидрид натрия) или за счет переноса фазы, используя, например, тетрабутиламмонийбромид в качестве четвертичной соли, с соединением формулы (10), содержащим гидроксильную, или тиольную, или амино-функцию.
Соединения формулы I (f) могут быть получены (фиг. 2) из ацетофенонов (11) путем превращения в бромпроизводное (12) с помощью брома, затем путем введения во взаимодействие в присутствии карбоната калия или гидрида щелочного металла (гидрид натрия) или за счет переноса фазы, используя, например, тетрабутиламмонийбромид в качестве четвертичной соли, с соединением формулы (10), содержащим гидроксильную или тиольную или аминофункцию. Соединения формулы I (g) могут быть получены из производного формулы I (f) путем реакции с боргидридом натрия в спирте.
Соединения формулы I (h) могут быть получены (фиг. 2) из ацетофенонов (II) путем введения во взаимодействие с ароматическими альдегидами формулы (13) в присутствии метилата натрия или гидроксида натрия в спирте, таком, как метанол. Из этих соединений путем взаимодействия их с боргидридом натрия в присутствии трихлорида цезия получают соединения формулы I(i).
Соединения формулы l(j) могут быть получены (фиг. 2) из ароматических альдегидов формулы (4) путем взаимодействия их с триметилсилилацетиленидом лития, затем путем удаления защитной группы с помощью тетрабутиламмонийфторида для получения альфагидроксиацетиленовых производных (14). Затем осуществляют реакцию сочетания с галогенпроизводными (15), предпочтительно йодпроизводными, в присутствии катализатора на основе палладия (например, как бис-(трифенилфосфин) -палладий- (II) -хлорид) в растворителе, таком как триэтиламин. Окисление этих соединений с помощью либо пиридинийхромата, либо оксида марганца, или реагента Swern приводит к производным формулы 1(k).
Когда R3 обозначает радикалы -(CH2)p-Y-(CH2)q-R8 или -CH=CH-(CH2)r-R8, то соединения могут быть получены (фиг.3, где p равно 2) из фенолов формулы (16), которые превращают в трифлатные производные формулы (17), затем проводят нуклеофильное замещение в присутствии катализатора на основе палладия согласно общим условиям, описанным в следующих литературных источниках:
- S.Cacchi и др., Tetrahedron Letter, 1986, 27, 3931-3934.
- W.J. Scott и др., J.Org.Chem., 1985, 50, 2302-2308.
- J. K. Stille и др., J.Am.Chem.Soc., 1987, 109, 5478-5486.
Когда R1 обозначает радикал -COOH, соединения получают, защищая R1 защитной группой алкильного, аллильного, бензильного или трет-бутильного типа.
Удаление защитных групп (переход к свободной форме) можно осуществлять:
- в случае алкильной защитной группы - с помощью гидроксида натрия или гидроксида лития в спирте, таком как метанол, или в ТГФ;
- в случае аллильной защитной группы - с помощью катализатора, такого как некоторые комплексы переходных металлов, в присутствии вторичного амина, такого как морфолин;
- в случае бензильной защитной группы - путем дебензилирования в присутствии водорода и при использовании катализатора, такого как палладий-на-угле;
- в случае защитной группы трет-бутильного типа - с помощью триметилсилилиодида.
Предметом настоящего изобретения также являются соединения вышеуказанной формулы (I) в качестве лекарственного средства.
Эти соединения обладают активностью в тесте по дифференциации клеток (F9) эмбриональной тератокарциномы мыши (Cancer Research 43, с. 5268, 1983) и/или в тесте по ингибированию орнитиндекарбоксилазы после индуцирования с помощью ТРА у мыши (Cancer Research, 38, с. 793-801, 1978). Эти тесты показывают активности этих соединений соответственно в областях дифференциации и пролиферации клеток. В тесте по дифференциации клеток (F9) можно оценить агонистическую активность как антагонистическую активность в отношении рецепторов ретиноевой кислоты. В самом деле, антагонист является неактивным, когда он один в этом тесте, однако он ингибирует частично или полностью воздействие, оказываемое ретиноидным агонистом на морфологию и на секрецию плазминогенного активатора. Некоторые из этих соединений также обладают активностью в тесте, который заключается в идентификации молекул-антагонистов RARs, таком, который описывается в заявке на патент Франции 95-07302, поданной заявителем 19 июня 1995 г. Этот тест включает следующие стадии: (i) на участок кожи млекопитающего топически наносят достаточное количество молекулы-агониста RARs, (ii) этому же самому млекопитающему или на тот же самый участок кожи млекопитающего, до, во время или после стадии (i), системным или топическим путем вводят молекулу, которая способна обладать антагонистической активностью в отношении RARs; и (iii) оценивают ответ на таким образом обработанном участке кожи млекопитающего. Так, ответ на нанесение топическим путем на ухо млекопитающего молекулы-агониста RARs, который соответствует увеличению толщины этого уха, может быть ингибирован за счет введения системным или топическим путем молекулы-антагониста RARs.
Соединения, согласно изобретению, особенно хорошо пригодны в следующих областях лечения (обработки):
1) для лечения дерматологических заболеваний, связанных с нарушением кератинизации при дифференциации и пролиферации, особенно для лечения обыкновенных, комедоновых, полиморфных, эритематозных акне; узелковых, конглобатных (conglobata) акне, старческих акне; вторичных акне, таких, как солнечная, медикаментозная или профессиональная акне;
2) для лечения других типов нарушений кератинизации, особенно ихтиозов, ихтиозоподобных состояний, болезни Дарье, пальмоплантарных кератодермий, лейкоплазий и лейкоплазоподобных состояний, кожного лишая или лишая слизистых оболочек (как слизистая оболочка рта);
3) для лечения других дерматологических заболеваний, связанных с нарушением кератинизации с воспалительным и/или иммуноаллергическим компонентом, и особенно любых форм псориаза, как кожный, ногтевой псориаз или псориаз слизистых оболочек, и даже псориатического ревматизма, или еще кожной атопии, такой, как экзема, или респираторной атопии, или еще десенной гипертрофии; соединения также можно применять в случае некоторых воспалительных заболеваний, протекающих без нарушения кератинизации;
4) для лечения дермических или эпидермических пролифераций, как доброкачественных, так и злокачественных, вирусного или нет происхождения, таких, как обычные бородавки, плоские юношеские бородавки и бородавкообразная эпидермодисплазия, ротовые или флоридные папилломатозы; и пролифераций, которые могут быть вызваны ультрафиолетовым излучением, особенно в случае базо- и спиноцеллюлярных эпителием;
5) для лечения других дерматологических нарушений, таких, как буллезные дерматозы и коллагеновые болезни;
б) для лечения некоторых офтальмологических расстройств, особенно корнеопатий;
7) для регенерации или борьбы против старения кожи, вызываемого за счет фотоиндукции или вследствие возрастных факторов, или для уменьшения пигментаций и актинических кератозов, или любых патологий, ассоциированных с хронологическим (возрастным) или актиническим старением,
8) для профилактики или вылечивания стигматов эпидермической и/или дермической атрофии, вызываемой локальными или системными кортикостероидами, или любой другой формы кожной атрофии;
9) для профилактики или лечения нарушений зарубцовывания или для профилактики или регенерации рубцов на коже при ее растяжении;
10) для борьбы против расстройств жировой функции, таких, как гиперсеборея акне или простая себорея;
11) для лечения или профилактики канцерозных или предканцерозных состояний;
12) для лечения воспалительных заболеваний, таких, как артрит;
13) для лечения любого заболевания вирусного происхождения в случае кожи или общего типа;
14) для профилактики или лечения алопеции;
15) для лечения дерматологических или общего характера заболеваний с иммунологическим компонентом;
16) для лечения заболеваний сердечно-сосудистой системы, таких, как артериосклероз.
В вышеуказанных областях терапии соединения, согласно изобретению, можно предпочтительно использовать в сочетании с другими соединениями, обладающими активностью ретиноидного типа, с витаминами D или их производными, с кортикостероидами, с веществами против свободных радикалов, альфа-гидрокси- или альфа-кето-кислотами или их производными, или еще с блокаторами ионных каналов. Под витаминами D или их производными понимают, например, производные витамина D2 или D3 и, в особенности, 1,25-дигидрокси-витамин D3. Под веществами против свободных радикалов понимают, например, альфа-токоферол, дисмутаза-пероксид, Убиквинол или некоторые хелаты металлов. Под альфа-гидрокси- или альфа-кето-кислотами или их производными понимают, например, молочную, яблочную, лимонную, гликолевую, миндальную, винную, глицериновую или аскорбиновую кислоты или их соли, амиды или сложные эфиры. Наконец, под блокаторами ионных каналов понимают, например, Миноксидил (2,4-диамино-б-пиперидинопиримидин-3-оксид) и его производные.
Предметом настоящего изобретения также являются лекарственные композиции, содержащие по крайней мере одно соединение формулы (I), такое как указанное выше, один из его оптических или геометрических изомеров или одну из его солей.
Предметом настоящего изобретения, таким образом, является новая лекарственная композиция, предназначенная особенно для лечения вышеуказанных заболеваний, отличающаяся тем, что она включает в фармацевтически приемлемом носителе, совместимом с используемым для этой композиции способом введения, по крайней мере одно соединение формулы (I), один из его оптических или геометрических изомеров или одну из его солей.
Введение соединений, согласно изобретению, можно осуществлять энтеральным, парентеральным, топическим или окулярным путем.
При введении энтеральным путем лекарственные средства могут находиться в виде таблеток, желатиновых капсул (с лекарством), драже, сиропов, суспензий, растворов, порошков, гранулятов, эмульсий, микросфер или наносфер или липидных или полимерных пузырьков, позволяющих происходить контролируемому высвобождению лекарства. При введении парентеральным путем композиции могут находиться в форме растворов или суспензий для перфузии или для инъекции.
Соединения, согласно изобретению, обычно вводят в суточной лозе около 0,01 - 100 мг/кг массы тела, и это за 1-3 приема.
При введении топическим путем фармацевтические композиции на основе соединений, согласно изобретению, в особенности предназначены для обработки кожи и слизистых оболочек и тогда могут находиться в виде мазей, кремов, молочка, унгиентов, порошков, пропитанных тампонов, растворов, гелей, препаратов для пульверизации, лосьонов или суспензий. Они также могут быть в форме микросфер или наносфер или липидных или полимерных пузырьков или полимерных "лоскутов" и гидрогелей, которые позволяют происходить контролируемому высвобождению лекарства. Эти композиции при введении топическим путем, кроме того, могут быть в безводной форме или в водной форме, в зависимости от клинического показания.
При введении окулярным путем эти композиции представляют собой в основном глазные капли.
Эти композиции для топического или окулярного применения содержат по крайней мере одно соединение формулы (I), такое, как указанное выше, или один из его оптических или геометрических изомеров или еще одну из его солей, в концентрации предпочтительно 0,001-5 мас. %, в расчете на общую массу композиции.
Соединения формулы (I), согласно изобретению, также находят применение в области косметики, в особенности в случае гигиены тела и для ухода за волосами и особенно для обработки кожи с предрасположенностью к акне, для нового роста волос, против выпадения волос, для борьбы против жирного внешнего вида кожи или волос, при защите от вредоносных воздействий солнечных лучей и для обработки физиологически сухих кож, для профилактики и/или для борьбы против фотоиндуцируемого или возрастного старения кожи.
В области косметики соединения, согласно изобретению, кроме того, предпочтительно можно применять в сочетании с другими соединениями, обладающими активностью ретиноидного типа, с витаминами D или их производными, с кортикостероидами, с веществами против свободных радикалов, с альфа-гидрокси- или альфа-кето-кислотами или их производными, или еще с блокаторами ионных каналов, причем все эти различные продукты являются такими, как вышеуказанные.
Настоящее изобретение, следовательно, также относится к косметической композиции, отличающейся тем, что она включает, в косметически приемлемом носителе, который пригоден для топического применения, по крайней мере одно соединение вышеуказанной формулы (I) или один из его оптических или геометрических изомеров или одну из его солей, причем эта косметическая композиция может быть в виде крема, молочка, лосьона, геля, микросфер или ионосфер, или липидных или полимерных пузырьков, мыла или шампуня.
Концентрация соединения формулы (I) в косметических композициях согласно изобретению предпочтительно составляет 0,001- 3 мас.%, в расчете на всю совокупность композиции.
Лекарственные и косметические композиции, согласно изобретению, кроме того, могут содержать инертные или даже фармакологически или косметически активные добавки или сочетания этих добавок и особенно: смачиватели, депигментирующие агенты, такие, как гидрохинон, азелаиновая кислота, кафеиновая кислота или койевая кислота; пластификаторы, гидратирующие агенты, как глицерин, полиэтиленгликоль с молекулярной массой 400, тиаморфолинон и его производные или еще мочевина; антисеборейные агенты или агенты против акне, такие, как S-карбоксиметилцистеин, S-бензил-цистеамин, их соли или их производные, или бензоилпероксид; антибиотики, как: эритромицин и его сложные эфиры, неомицин, клиндамицин и его сложные эфиры, тетрациклины, противогрибковые агенты, такие, как кетоконазол или полиметилен-4,5-изотиазолил-3-оны; благоприятствующие новому росту волос агенты, как Миноксидил (2,4-диамино-6-пиперидино-пиримидин- 3-оксид) и его производные, Диазоксид (7-хлор-3-метил-1, 2, 4- бензотиадиазин-1, 1-диоксид) и Фенитоин (5, 5-дифенил- имидазолилин-2,4-дион); противовоспалительные агенты нестероидного типа; каротиноиды и особенно β- каротин; агенты против псориаза, такие, как антралин и его производные; и, наконец, эйкоза-5,8,11,14-тетраиноевая и эйкоза-5, 8, 11-трииноевая кислоты, их сложные эфиры и амиды.
Композиции согласно изобретению также могут содержать улучшающие вкус агенты, консерванты, такие, как сложные эфиры п- гидроксибензойной кислоты, стабилизаторы, регулирующие влажность агенты, регулирующие pH агенты, модификаторы осмотического давления, эмульгаторы, УФ-А и УФ-Б фильтры, антиоксиданты, такие, как альфа-токоферол, бутилгидроксианизол или бутилгидрокситолуол.
Ниже приводятся, в качестве иллюстрации и не носящие никакого ограничительного характера в отношении объема охраны изобретения, несколько примеров получения активных соединений формулы (I), согласно изобретению, также, как различных конкретных формулировок на основе таких соединений.
Пример 1 4-[3-(1-адамантил) -4-метоксифенилтиометил] бензойная кислота
(а) 0-3- (1-адамантил) -4-метоксифенилдиметил-тиокарбамат
В колбу, в токе азота, вводят 600 мг (20 ммоль) гидрида натрия (80%-ный в масле) и 50 мл ДМФ. Охлаждают до 0oC и прикалывают раствор 5,5 г (20 ммоль) 3- (1-адамантил) -4- метоксифенола в 100 мл ДМФ и перемешивают вплоть до прекращения газовыделения, затем добавляют раствор 3,3 г (26 ммоль) диметилтиокарбамоил-хлорида в 50 мл ДМФ и перемешивают в течение 8 часов при комнатной температуре. Реакционную среду выливают в воду, экстрагируют этилацетатом, органическую фазу декантируют, промывают водой, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью дихлорметана с гексаном в соотношении 70:30. После выпаривания растворителей получают 3,1 г (46%) целевого продукта с т.пл. 162-164oC.
(6) S-3- (1-адамантил)-4-мeтoкcифeнилдимeтилтиокарбамат
В колбу, в токе азота, вводят 3 г (8,7 ммоль) выше полученного продукта и в течение тридцати минут нагревают при 300oC. Реакционного среду экстрагируют дихлорметаном, промывают водой, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Получают 2,4 г (80%) целевого продукта с т.пл. 154- 155oC.
(в) 3- (1 -адамантил)-4-метоксифенилтиол
В колбу вводят 2,3 г (6,6 ммоль) вышеполученного продукта и 50 мл 2 н. метанольного раствора гидроксида натрия и кипятят с обратным холодильником в течение трех часов. Реакционную среду выпаривают, обрабатывают водой, подкисляют концентрированной соляной кислотой и отфильтровывают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью дихлорметана с гексаном в соотношении 10:90. После выпаривания растворителей получают 1,2 г (66%) целевого тиольного производного с т.пл. 149-151oC.
(г) 4-[3-адамантил)-4-метоксифенилтиометил] бензойная кислота
В трехгорлую колбу, в токе азота, вводят 1,1 г (36,6 ммоль) гидрида натрия (80%-ный в масле) и 50 мл ДМФ. Прикапывают раствор 4,2 г (15,2 ммоль) 3- (1- адамантил)-4-метоксифенилтиола в 20 мл ДМФ и перемешивают вплоть до прекращения газовыделения. Затем добавляют раствор 3,3 г (15,2 ммоль) 4-бромметил-бензойной кислоты в 20 мл ДМФ и перемешивают при комнатной температуре в течение 6 часов. Реакционного среду выливают в воду, подкисляют до pH= 1 с помощью соляной кислоты, экстрагируют диэтиловым эфиром, органического фазу декантируют, промывают водой, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью дихлорметана с диэтиловым эфиром в соотношении 95:5. После выпаривания растворителей получают 4,2 г (68%) целевого продукта с т.пл. 204-205oC.
Пример 2 4-[3-(1-адамантил) -4-метоксифенилсуль-финилметил] бензойная кислота
(а) Meтил-4-[3- (1-адамантил) -4-мeтокcифeнилтиo-метил]бензоат
В колбу вводят 5 г (12,3 ммоль) 4-[3-(1-адамантил) -4- метоксифенилтиометил] бензойной кислоты, 50 мл метанола и добавляют 330 мкмоль концентрированной серной кислоты. Кипятят с обратным холодильником в течение 8 часов, затем реакционную среду выпаривают досуха. Остаток обрабатывают водой, нейтрализуют гидрокарбонатом натрия, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью дихлорметана с гексаном в соотношении 40:60. После выпаривания растворителей получают 4,1 г (79%) метил-4- [3- (1-адамантил) -4-метоксифенилтиометил] бензоата.
(б) Метил-4-[3-адамантил) -4-метоксифенилсульфинилметил] бензоат
В колбу вводят 844 мг (2 ммоль) метил-4-[3-(1-адамантил) -4- метоксифенилтиометил] бензоата, 20 мл дихлорметана и добавляют 386 мг (1,9 ммоль) метахлор-надбензойной кислоты. Перемешивают при комнатной температуре в течение двух часов, реакционную среду выливают в воду, экстрагируют дихлорметаном, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью дихлорметана с диэтиловым эфиром в соотношении 90:10. После выпаривания растворителей получают 270 мг (30%) целевого сложного эфира с т.пл. 121-122oС.
(в) 4-3-(1-адамантил)-4-метоксифенилсульфинилметил] бензойная кислота
В колбу вводят 1,1 г (2,7 ммоль) вышеполученного сложного метилового эфира, 40 мл ТГФ и 40 мл 2 н. метанольного раствора гидроксида натрия и перемешивают при комнатной температуре в течение 8 часов. Реакционную среду выпаривают досуха, остаток обрабатывают водой, подкисляют до pH=1, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток порошкуют в гексане, отфильтровывают и высушивают. Получают 900 мг (78%) целевой кислоты с т. пл. 164-165oC.
Пример 3. 4-[3-(1-адамантил)-4-метоксифенилметилсульфонил] бензойная кислота
(а) Метил-4-[3-(1-адамантил)-4-метоксифенилметилсульфонил] бензойная кислота
Следуя методике примера 2(6), путем взаимодействия 4,22 г (10 ммоль) метил-4-[3-(1-адамантил)-4-метоксифенилметилтио]бензоата с 10,35 г (30 ммоль) мета-хлор-надбензойной кислоты получают 1,66 г (37%) целевого сложного метилового эфира с т.пл. 168-170oC.
(б) 4-[3- (1-адамантил)-4-метоксифенилметилсульфонил] бензойная кислота
Следуя методике примера 2 (в), но исходя из 3,98г (8,7 ммоль) вышеполученного сложного метилового эфиpa, получают 3,13 г (81%) целевой кислоты с т.пл. 231-232oC.
Пример 4. 4- [3-(1-адамантил)-4-метoкcифeнилмeтилсульфинил] бензойная кислота
(а) Метил-4- [3-(1-адамантил)-4-метоксифенилметилсульфинил] бензоат
Следуя методике примера 2 (б), путем взаимодействия 2,96 г (7 ммоль) метил-4-[3-(1-адамантил)-4-метоксифенилметилтио] бензоата с 1,42 г (7 ммоль) мета-хлор-надбензойной кислоты получают 2,33 г (76%) целевого сложного метилового эфира с т.пл. 151-152oC.
(б) 4-[3- (1-адамантил)-4-мeтоксифeнилмeтилcульфинил] бензойная кислота
Следуя методике примера 2 (в), но исходя из 2,7 г (6,2 ммоль) вышеполученного сложного метилового эфира, получают 2,36 г (90%) целевой кислоты с т. пл. 192-193oC.
Пример 5. 4- [3-(1-адамантил) -4-метоксифенилсульфенилметил] бензойная кислота
(а) Метил-4-[3-(1-адамантил)-4-метоксифенилсульфонилметил] бензоат
В колбу вводят 1,8 г (4,2 ммоль) метил-4-[3-(1-адамантил) -4- метоксифенилтиометил] бензоата, 20 мл дихлорметака и добавляют 3,4 г (16,9 ммоль) метахлор- надбензойной кислоты. Перемешивают при комнатной температуре в течение двух часов, реакционную среду выливают в воду, экстрагируют дихлорметаном, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью дихлорметана с гексаном в соотношении 90:10. После выпаривания растворителей получают 1,8 г (93%) целевого сложного эфира с т.пл. 166-168oC.
(б) 4-[3-(1-адамантил)-4-метоксифенилсульфонилмeтил]бeнзoйнaя кислота
Следуя методике примера 2 (а), но исходя из 2,1 г (4 ммоль) вышеполученного сложного метилового эфира, получают 1,3 г (68%) целевой кислоты с т. пл. 238-239oC.
Пример 6. 4-[3-(1-адамантил) -4-метоксифенилтиокарбоксамидо] бензойная кислота
(а) Метил-4-[3- (1 -адамантил)-4-метоксифенилтиокарбоксамидо] бензоат
В колбу вводят 6,7 г (16,6 ммоль} метил-4- [3- (1-адамантил} -4-метоксифенилкарбоксамидо] бензоата, 60 мл толуола и добавляют 4,1 г (9,9 ммоль) реагента Лавессона. Кипятят с обратным холодильником в течение трех часов, реакционную среду выпаривают досуха. Полученный остаток обрабатывают водой и дихлорметаном, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя дихлорметаном. После выпаривания растворителей получают 6 г (83%) целевого сложного эфира с т.пл. 198-200oC.
(б) 4- [3-(1-aдaмaнтил)-4-метоксифенилтиокарбоксамидо] бензойная кислота
Следуя методике примера 2 (а), но исходя из 6 г (14,3 ммоль) вышеполученного сложного метилового эфира, получают 5,6 г (92%) целевой кислоты с т. пл. 255-256oC.
Пример 7. 4-[3-(1-адамантил)-4-метоксифенилметилтио] бензойная кислота
(а) 3- (1-адамантил) -4-метоксибензолметанол.
В трехгорлую колбу, в токе азота, вводят 8 г (0,2 моль) литийалюминийгидрида и 50 мл безводного ТГФ. Прикапывают раствор 28,6 г (0,1 моль) 3-(1- адамантил) -4-метоксибензойной кислоты в 260 мл безводного ТГФ и кипятят с обратным холодильником в течение 16 часов. Реакционную среду охлаждают и гидролизуют с помощью 14,4 мл раствора калийнатрийтартрата. Соль отфильтровывают, фильтрат выпаривают, полученное твердое вещество порошкуют в гексане, отфильтровывают и высушивают. Получают 26,2 г (96%) целевого бензилового спирта с т.пл. 134-135oC.
(б) 3- (1-адамантил)-4-метоксибензилбромид
В трехгорлую колбу вводят 2,72 г (10 ммоль) вышеполученного бензилового спирта, 30 мл толуола и 800 мкл (10 ммоль) пиридина. При 0oC прикапывают раствор 940 мкл (10 ммоль) трибромида фосфора в 9 мл толуола и перемешивают при комнатной температуре в течение 4 часов. Реакционную среду выпаривают досуха, остаток обрабатывают водой и диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток порошкуют в гексане, отфильтровывают и высушивают. Получают 2,35 г (70%) целевого бензилбромида с т. пл. 95-99oC.
(в). Метил-4-[3- (1-адамантил) -4-метоксифенилметилтио] бензоат
В трехгорлую колбу, в токе азота, вводят 1,44 г (48 ммоль) гидрида натрия (80%-ный в масле) и 25 мл ДМФ. Прикапывают раствор 6,73 г (40 ммоль) метил-4-меркапто-бензоата в 60 мл ДМФ и перемешивают вплоть до прекращения газовыделения. Затем добавляют раствор 16,1 г (48 ммоль) 3-(1-адамантил)-4-метоксибензилбромида в 90 мл ДМФ и перемешивают при комнатной температуре в течение 8 часов. Реакционную среду выливают в воду, подкисляют до pH=1 с помощью соляной кислоты, экстрагируют диэтиловым эфиром, органическую фазу декантируют, промывают водой, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью дихлорметана с гексаном в соотношении 40:60. После выпаривания растворителей получают 16,75 г (99%) целевого сложного метилового эфира с т. пл. 143-145oC.
(г) 4-13- (1-адамантил)-4-мeтoкcифeнилмeтилтиo] бензойная кислота
Следуя методике примера 2 (а), но исходя из 4,22 г (10 ммоль) вышеполученного сложного метилового эфира, получают 3,15 г целевой кислоты с т. пл. 225-227oC.
Пример 8. 4-[3- (1-адамантил) -4-метоксифенилметиламино] бензойная кислота
(а) Бензил-N-трет. -бутилоксикарбонил-3- (1-адамантил) -4-мeтoкcифeнилмeтилaминo]бeнзoaт
Следуя методике примера 7 (в), путем взаимодействия 10,6 г (34,6 ммоль) 3-(1-адамантил)-4-метоксибензилбромида с 8,6 г (26,3 ммоль) бензил-4-трет. -бутилокси-карбоксамидобензоата получают 14 г (91%) целевого сложного бензилового эфира в виде масла желтого цвета.
(б) Бензил-3-(1-адамантил)-4-мeтoкcифeнилмeтиламино] бензоат
В трехгорлую колбу, в токе азота, вводят 13,96 г (24 ммоль) вышеполученного сложного бензилового эфира и 100 мл тетрахлорида углерода. Прикапывают 5 мл (48 ммоль) триметилсилилиодида и перемешивают при комнатной температуре в течение 12 часов. Реакционную среду выливают в воду, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния, выпаривают. Полученный остаток очищают путeм хроматографии на колонке с диоксидом кремния, элюируя смесью дихлорметана с гексаном в соотношении 55:45. После выпаривания растворителей получают 6,64 г (57%) целевого сложного бензилового эфира.
(в) 4-[3- (1-адамантил)-4-метоксифенилметиламино] бензойная кислота
Следуя методике примера 2 (а), но исходя из 1,44 г (3 ммоль) вышеполученного сложного бензилового эфира, получают 877 мг (75%) целевой кислоты с т. пл. 259-260oC.
Пример 9. 4-1 [3-Оксо-3-[3-(1-адамантил)-4-метоксифенил] -1-пропинил]] бензойная кислота
(a) Метил-4-триметилсилилэтинилбензоат
В трехгорлую колбу, в токе азота, вводят 21,5 г (0,1 моль) метил-4-бром-бензоата, 300 мл триэтиламина и смесь 200 мг ацетата палладия с 400 мг трифенилфосфина. Затем добавляют 20 г (0,204 моль) триметилсилилацетилена, постепенно нагревают до 90oC в течение 1 часа и выдерживают при этой температуре 5 часов. Реакционную среду охлаждают, соль отфильтровывают, а фильтрат выпаривают. Остаток обрабатывают с помощью 200 мл 5%-ной соляной кислоты и 400 мл диэтилового эфира. Эфирную фазу декантируют, промывают водой, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя дихлорметаном. После выпаривания растворителей получают 23 г (100%) целевого производного в виде бесцветного масла.
(б) Метил-4- [[3-Оксо-3-[3-(1-адамантил)-4-метоксифенил] -1-пропинил]] бензоат
В колбу вводят 3 г (10 ммоль) 3-(1-адамантил)-4-метоксибензоилхлорида, 2,3 г (10 ммоль) вышеполученного производного и 100 мл дихлорметана. При 0oC добавляют маленькими порциями 4,7 г (35 ммоль) хлорида алюминия и перемешивают при комнатной температуре в течение 8 часов. Реакционную среду выливают на лед, экстрагируют дихлорметаном, органическую фазу деканируют, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью дихлорметана с гексаном в соотношении 80:20. Получают 970 мг (23%) целевого продукта с т.пл. 156-158oC.
(в) 4-[[3-Oксо-3-[3-(1-адамантил)-4-метоксифенил] -1 -пропинил] ] бензойная кислота
В колбу вводят 962 мг (2,2 ммоль) вышеполученного сложного метилового эфира, 10 мл ТГФ и добавляют 283 мг (6,7 ммоль) гидроксида лития. Кипятят с обратным холодильником в течение 5 часов, реакционную среду выливают в воду, подкисляют до pH=1 с помощью концентрированной соляной кислоты, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученное твердое вещество порошкуют в гексане, отфильтровывают и высушивают. Получают 600 мг (85%) целевой кислоты с т.пл. 232-234oC.
Пример 10. 4-[3-( 1-адамантил ) -4-метоксиэтоксиметоксибензамидо] бензойная кислота
(а) 3-(1-адамантил)-1-бром-4-метоксиэтоксиметoкcибензoл
В трехгорлую колбу, в токе азота, вводят 3,8 г (0,13 моль) гидрида натрия (80%-ный в масле), 50 мл ДМФ, прикапывают раствор 40 г (0,13 моль) 2-(1-адамантил) -4-бром-фенола в 100 мл ДМФ и перемешивают вплоть до прекращения газовыделения. Затем прикапывают раствор 18 мл (0,15 моль) 2-метоксиэтоксиметилхлорида в 20 мл ДМФ и перемешивают в течение 4 часов при комнатной температуре. Реакционную среду выливают в воду, экстрагируют диэтиловым эфиром, органического фазу декантируют, промывают водой, сушат над сульфатом магния и выпаривают. Остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью дихлорметана с гексаном в соотношении 50: 50. После выпаривания растворителей получают 40,1 г (78%) целевого продукта с т.пл. 69-70oC.
(б) 3-(1-aдaмaнтил)-4-мeтoкcиэтoкcимeтoкcибeнзойная кислота
Вышеполученное соединение (28,5 г, 72 ммоль) растворяют в 200 мл ТГФ. Полученный раствор прикапывают к магнию (2,4 г, 100 ммоль) и добавляют кристаллик йода. По окончании введения кипятят с обратным холодильником в течение двух часов, охлаждают до -78oC и в течение 1 часа пропускают ток диоксида углерода. После повышения температуры до комнатной реакционную смесь выливают в водный насыщенный раствор хлорида аммония, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток порошкуют в гексане, отфильтровывают и высушивают. Получают 15,5 г (60%) целевой кислоты с т.пл. 115-116oC.
(в) 3-адамантил)-4-метоксиэтоксиметоксибензоилхлорид
В колбу вводят раствор 3 г (8,3 ммоль) 3-(1-адамантил) -4-метоксиэтоксиметокси-бензойной кислоты в 50 мл безводного дихлорметана, добавляют 1,7 мл (8,3 ммоль) дициклогексиламина и перемешивают в течение 1 часа. Затем добавляют 600 мкл (8,3 ммоль) тионилхлорида и перемешивают в течение часа. Выпаривают досуха, остаток обрабатывают безводным диэтиловым эфиром, соль дициклогексиламина отфильтровывают и фильтрат выпаривают. Получают 3,3 г (100%) сырого хлорангидрида кислоты, который используют таким, какой есть, в следующем синтезе.
(г) Аллил-4-[3-(1-адамантил)-4-метоксиэтоксиметоксибензамидо] бензоат
В колбу вводят 700 мг (3,95 ммоль) аллил-4-амино-бензоата, 1 мл (4,3 ммоль) триэтиламина и 50 мл ТГФ. Прикапывают раствор 1,5 г (3,96 ммоль) 3-(1-адамантил) -4-метоксиэтоксиметоксибензоилхлорида и перемешивают при комнатной температуре в течение 4 часов. Реакционную среду выливают в воду, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя дихлорметаном. Получают 1,7 г (83%) целевого аллилового сложного эфира в виде масла.
(д) 4- [3- (1-адамантил) -4-мeтoкcиэтoкcимeтoкcибензамидо]бензойная кислота
В трехгорлую колбу, в токе азота, вводят 1,7 г (3,2 ммоль) вышеполученного сложного аллилового эфира, 50 мл ТГФ и 200 мг тетракис(трифенилфосфин)-палладия-11). Прикапывают раствор диэтилмалоната натрия, полученного из 105 мг (3,5 ммоль) гидрида натрия (80%-ный в масле) и 500 мкл (3,2 ммоль) этилмалоната, и перемешивают при комнатной температуре в течение 2 часов. Реакционную среду выпаривают досуха, остаток обрабатывают водой, подкисляют до pH= 4, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя диэтиловым эфиром. Получают 1,1 г (70%) целевой кислоты с т.пл. 150-152oC.
Пример 11. 4-[3- (1-адамантил) -4-метоксиэтоксиметоксибензоилокси] бензойная кислота
(а) Аллил-4- [3- (1 -адамантил) -4-метоксиэтоксиметоксибензоилокси] бeнзoaт
Следуя методике примера 10 (г), путем взаимодействия 1,5 г (3,9 ммоль) 3-(1-адамантил)-метоксиэтоксиметоксибензоилхлорида с 705 мг (3,9 ммоль) аллил-4-гидрокси-бензоата получают 1,45 г (70%) целевого сложного аллилового эфира в виде желтого масла.
(б) 4-[3-(1-адамантил)-4-мeтoкcиэтoкcимeтoкcибензоилокси] бензойная кислота
Следуя методике примера 10 (д), но исходя из 1,45 г (2,8 ммоль) вышеполученного сложного аллилового эфира, получают 370 мг (65%) целевой кислоты с т.пл. 211-213oC.
Пример 12. (Е)-4-[[3-Оксо-3-[3-(1-адамантил)-4- метоксиэтоксиметоксифенил] -1-пропенил]] бензойная кислота
(а) 3- (1-адамантил)-4-мeтoкcиэтoкcимeтoкcиaцeтофенон
В трехгорлую колбу, в токе азота, вводят 15,5 г (43 ммоль) 3-(1-адамантил)-4-метоксиэтоксиметокси бензойной кислоты и 300 мл безводного диэтилового эфира. При - 20oC прикапывают 80 мл (0,13 моль) 1,6 М раствора метиллития в эфире, затем перемешивают в течение трех часов при комнатной температуре. Реакционную среду выливают в водный насыщенный раствор хлорида аммония, органическую фазу декантируют, сушат над сульфатом магния, выпаривают. Получают 15,4 г (100%) целевого ацетофенона в виде слегка желтоватого цвета масла.
(б) Метил-(E)-4-[[3-Оксо-3-[3- (1-адамантил) -4-метоксиэтоксиметоксифенил] -1-пропенил]]бeнзoaт
В колбу вводят 1,8 г (5 ммоль) 3- (1-адамантил) -4-метоксиэтоксиметоксиацетофенона, 820 мг (5 ммоль) метил-4-формилбензоата и 20 мл метанола. Добавляют 10 мг 18-краун-6 и 200 мг гидроксида натрия в пастилках и перемешивают при комнатной температуре в течение 4 часов. Выпаривают досуха и полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя дихлорметаном. Получают 1,4 г (55%) целевого сложного метилового эфира.
(в) (E) -4-[[3-Оксо-3-[3- (1 -адамантил) -4-метоксиэтоксиметоксифенил] -1-пропенил]]бензойная кислота
Следуя методике примера 2 (а), но исходя из 700 мг (1,4 ммоль) метил-(E)-4-[[3-оксо-3-[3-(1-адамантил) -4-метоксиэтоксиметоксифенил]-1-пропенил]] бензоата, получают 590 г (87%) целевой кислоты с т. пл. 154-156oC.
Пример 13. 4-[[3-Гидрокси-3-[3-(1-адамантил) -4-метоксиэтоксиметоксифенил]-1-пропинил]] бензойная кислота
(а) 3- (1-адамантил) -4-мeтoксиэтокcимeтoкcифeнилкарбоксальдегид
В трехгорлую колбу в токе азота, вводят 34 г (89 мысль)-3- (1-адамантил) -1-бром-4-метоксиэтоксиметоксибензола и 250 мл ТГФ. При -78oC прикапывают 43 мл. (106 ммоль) 2,5 М раствора н-бутиллития в гексане и перемешивают в течение 30 минут. Затем прикапывают 8,3 мл (106 ммоль) ДМФ. После повышения температуры до комнатной реакционную среду выливают в водный раствор хлорида аммония, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния, выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя дихлорметаном. После выпаривания растворителей получают 17,6 г (58%) целевого альдегида с т.пл. 63-64oC.
(б) α- Триметилсилилэтинил-3-(1-адамантил)-4- мeтоксиэтоксиметоксифенилметанол
В трехгорлую колбу вводят 1,7 мл (11,9 ммоль) триметилсилилацетилена и 25 мл ТГФ. При -78oC, в токе азота, прикапывают раствор 5 мл (11,9 ммоль) 2,5 М раствора н-бутиллития в гексане и оставляют стоять для повышения температуры до комнатной. Этот раствор прикапывают к раствору 3,7 г (10,7 ммоль) 3-(1-адамантил)- 4 -метокси- этоксиметоксифенилкарбоксальдегида в 50 мл ТГФ при -78oC. После повышения температуры до комнатной реакционного среду выливают в водный раствор хлорида аммония, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Получают 4,7 г (97%) целевого спирта в виде желтого масла.
(в) α- Этинил-3-(1-адамантил)-4-метоксиэтоксиметоксифенилметанол
В колбу вводят 4,7 г (10,5 ммоль) α- триметилсилилэтинил-З-(1-адамантил) -4-метоксиэтоксиметоксифенилметанола, 50 мл ТГФ и прикапывают 11,4 мл (12,6 ммоль) 1,1 М раствора тетрабутиламмонийфторида в ТГФ. Перемешивают при комнатной температуре в течение 1 часа, реакционную среду выливают в воду, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью этилацетата с гептаном в соотношении 30:70. После выпаривания растворителей получают 2,5 г (64%) α- -этинил-3-(1-адамантил)-4-метоксиэтоксиметоксифенилметанола.
(г) Метил-4-[[3-гидрокси-3-[-(1-адамантил)-4- метоксиэтоксиметоксифенил] -1-пропинил]] бензоат
В трехгорлую колбу вводят 2,5 г (6,7 ммоль) α- этинил-3-(1-адамантил)-4-метоксиэтоксиметоксифенилметанола, 1,2 г (6,7 ммоль)метил-4-иодбензоата и 50 мл триэтиламина. Реакционную среду продувают (дегазируют) азотом в течение 30 минут, затем последовательно добавляют 380 мг (0,5 ммоль) бис (трифенилфосфин) -палладий (II)-хлорида и 190 мг (0,8 ммоль) иодида меди. Перемешивают при комнатной температуре в течение 4 часов, реакционную среду выпаривают досуха, полученный остаток обрабатывают водой и диэтиловым эфиром. Органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью этилацетата с гептаном в соотношении 20:80. Получают 2,7 г (79%) метил-4-[[З-гидрокси-3-[3-(1-адамантил) -4-метокси-этоксиметоксифенил]-1-пропинил]]бензоата с т.пл. 95-96oC.
(д) 4- [ [3-Гидрокси-3- [3- (1-адамантил) -4-метокси-этoкcимeтoкcифeнил] -1-пpoпинил]]бeнзoйнaя кислота
Следуя методике примера 9 (в), но исходя из 2,66 г (5,3 ммоль) вышеполученного сложного метилового эфира, получают 1,52 г (88%) целевой кислоты с т. пл. 148-149oC.
Пример 14. 4-[3-(1-адамантил)-4-(2, 2-диметил-1, 3 диоксолан-4-метилокси)-фенилкарбоксамидо] бензойная кислота
(а) Метил-3- (1-адамантил)-4- (2,2-диметил-1-3-диоксолан-4-метилокси) бензоат
К раствору 10 г (0,0349 моль) метил-3-(1-адамантил) -4-гидроксибензоата в 100 мл ДМФ, содержащему 5,31 г (0,0384 моль) карбоната калия, прикапывают раствор 12 г (0,0419 моль) 3-тозилокси-пропан-1,2-диол-ацетонида. Реакционную среду нагревают при 100oC в течение 12 часов, затем выливают в воду со льдом и экстрагируют дизтиловым эфиром. Органическую фазу декантируют, сушат над сульфатом натрия, выпаривают. Остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью гексана с этилацетатом в соотношении 80: 20. После выпаривания растворителей получают 8,8 г (63%) целевого продукта с т.пл. 158-159oC.
(б) 3- (1-адамантил)-4- (2,2-диметил-1,3-диоксолaн-4-мeтилoкcи)бeнзoйнaя кислота
В колбу вводят 8,8 г (0,022 моль) вышеполученного сложного метилового эфира и 200 мл 2 н. метанольного раствора гидроксида натрия. Кипятят с обратным холодильником в течение 3 часов и выпаривают досуха. Остаток обрабатывают смесью диэтилового эфира с водой, подкисляют до pH=3, органическую фазу декантируют, сушат над сульфатом магния, выпаривают. Полученное твердое вещество порошкуют в гексане, отфильтровывают и высушивают. Получают 8,3 г (98%) целевой кислоты с т.пл. 224-225oC.
(в) 3- (1-адамантил)-4- (2,2-диметил-1,3-диоксолан-4-метилокси)-бензоилхлорид
В колбу вводят 8,3 г (0,0215 моль) 3-(1-адамантил)-4- (2, 2-диметил-1, 3-диоксолан-4-метилокси) бензойной кислоты, 80 мл дихлорметана и 4,3 мл (0,0216 моль) дициклогексиламина. Перемешивают в течение часа при комнатной температуре, затем вводят 1,7 мл (0,0236 моль) тионилхлорида. Перемешивают в течение 4 часов, выпаривают досуха, обрабатывают остаток диэтиловым эфиром, отфильтровывают соль дициклогексиламина, фильтрат выпаривают и получают 8,5 г (100%) хлорангидрида кислоты, который используют таким, какой есть, в следующем синтезе.
(г) Метил- 4 -[3- (1-адамантил)-4- (2,2-диметил-1, 3-диоксолан-4-метилокси) фенилкарбоксамидо] бензоат
В колбу вводят 1,62 г (10,7 ммоль) метил-4-аминобензоата, 30 мл ТГФ и 1,65 мл (11,8 ммоль) триэтиламина. Прикапывают раствор 4,3 г (10,7 ммоль) 3- (1-адамантил)-4-(2, 2-лиметил-1, 3- диоксолан-4-метилокси) -бензоилхлорила в 30 мл ТГФ и перемешивают при комнатной температуре в течение 16 часов. Реакционную среду выливают в воду, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния, выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью дихлорметана с диэтиловым эфиром в соотношении 98:2. Получают 3,1г (56%) целевого сложного метилового эфира с т. пл. 174-175oC.
(д) 4 [3- (1-адамантил) -4- (2,2-диметил-1,3-диоксолaн-4- метилoкcи)-фeнилкapбoкcaмидo]бeнзoйнaя кислота
Следуя методике примера 14(б), но исходя из 1 г (1,92 ммоль) вышеполученного сложного метилового эфира, получают 900 мг (93%) 4-[3-(1-адамантил)-4-(2,2-диметил-1, 3-диоксолан-4-метилокси) фенилкарбоксмидо] бензойной кислоты с т. пл. 245-246oC.
Пример 15. 4- [3- (1-адамантил) -4- (2, З-дигидроксипропилокси) фенилкарбоксамидо] бензойная кислота
(а) Метил-4-[3- (1-адамантил) -4- (2,3-дигидроксипропилокси) фенилкарбоксамидо) бензоат
В колбу вводят 1,96 г (3,78 ммоль) метил-4- [3-(1-адамантил) -4-(2, 2-диметил-1, 3-диоксолан-4-метилокси)фенилкарбоксамило]бензоата, 70 мл дихлорметана, 8 мл ТГФ и добавляют 7,24 г (38 ммоль) п-толуолсульфокислоты. Перемешивают при комнатной температуре в течение 4 часов, реакционную среду выливают в воду, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью этилацетата с дихлорметаном в соотношении 90:10. Получают 1,46 г (81%) целевого продукта с т.пл. 111-112oC.
(б) 4-[3- (1-адамантил) -4- (2,3-дигидроксипропилокси) фенилкарбоксамидо]бензойная кислота
Следуя методике примера 14(6), но исходя из 1,42 г (2,96 ммоль) вышеполученного сложного метилового эфира, получают 650 мг (47%) 4-[3-(1-адамантил)-4-(2, 3-дигидроксипропилокси) фенилкарбоксамидо) бензойной кислоты с т.пл. 236-237oC.
Пример 16. 4-[3-(1-адамантил) -4-метоксикарбонил- метилоксифенилкарбоксамидо] бензойная кислота
(а) Бензил-3- (1 -адамантил) -4-метоксикарбонилметилоксибензоат
В трехгорлую колбу вводят 2,1 г (5,79 ммоль) бензил-3- (1- адамантил) -4-гидроксибензоата и 20 мл ДМФ и добавляют маленькими порциями 191 мг (6,34 ммоль) гидрида натрия (80%-ный в масле). Перемешивают вплоть до прекращения газовыделения, затем добавляют 565 мкл (5,79 ммоль) метилбромацетата и перемешивают при комнатной температуре в течение 12 часов. Реакционную среду выливают в воду, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Твердое вещество порошкуют в гексане, отфильтровывают и высушивают. Получают 2,36 г (94%) целевого продукта с т.пл. 134-135oC.
(б) 3-(1-адамантил) -4-мeтoкcикapбoнилмeтилoкcибензойная кислота.
В реактор вводят 2,34 г (5,38 ммоль) бензил-3-(1-адамантил) - 4-метоксикарбонилметилоксибензоата, 40 мл диоксана, 500 мкл уксусной кислоты и 234 мг палладия (10% на угле). Гидрируют при 40oC и при давлении 7 бар в течение 3 часов. Катализатор отфильтровывают, фильтрат выпаривают досуха. Полученное твердое вещество порошкуют в гексане, отфильтровывают и выслушивают. Получают 1,74 г (94%) целевой кислоты с т. пл. 230-231oC.
(в) 3-(1 -адамантил) -4-мeтoкcикаpбoнилмeтилoкcи- бензоилхлорид
В колбу вводят 1,78 г (5 ммоль) 3- (1-адамантил) -4- метоксикарбонилметилоксибензойной кислоты, 15 мл тионилхлорида и кипятят с обратным холодильником в течение 1 часа. Выпаривают досуха и получают сырой хлорангидрид кислоты, который используют таким, какой есть, в следующем синтезе.
(г) Бензил-4-[3- (1-адамантил) -4-метоксикарбонилметилоксифенилкарбоксамидо] бензоат
Следуя методике примера 14 (г), путем взаимодействия 1,13 г (5 ммоль) бензил-4-аминобензоата с 1,8 г (5 ммоль) 3- (1- адамантил) -4-метоксикарбонилметилоксибензоилхлорида получают 1,7 г (61%) целевого сложного бензилового эфира с т.пл. 95-96oC.
(д) 4-[3- (1 -адамантил) -4-метоксикарбонилметилоксифенилкарбоксамидо] бензойная кислота
Следуя методике примера 16(6), но исходя из 1,69 г (3 ммоль)бензил- 4-[3-(1-адамантил)-4-метоксикарбонилметилоксифенилкарбоксамидо] бензоата, получают 1,13 г (80%) целевой кислоты с т.пл. 291-292oC.
Пример 17. 2- [3- (1-адамантил) -4-метоксифеноксиметил] 4- тиофенкарбоновая кислота
(а) Метил-2 [3-(1-адамантил) -4-метоксифеноксиметил] -4- тиoфeн-кapбoкcилaт
В трехгорлую колбу, в токе азота, вводят 210 мг (7 ммоль) гибрида натрия (80%-ный в масле) и 10 мл ДМФ. Прикапывают раствор 1,3 г (7 ммоль) 3-(1-адамантил) -4- метоксифенола в 20 мл ДМФ и перемешивают вплоть до прекращения газозыделения. Затем добавляют раствор 1,7 г (7,2 ммоль) метил-2- бромметил-4-тиофенкарбоксилата в 15 мл ДМФ и перемешивают при комнатной температуре в течение 2 часов. Реакционную среду выливают в воду, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученное твердое вещество порошкуют в гексане, отфильтровывают и высушивают. Получают 2,6 г (90%) целевого сложного метилового эфира с т. пл. 97-98oC.
(б) 2-[3- (1-адамантил) -4-мeтoкcифeнoкcимeтил] -4-тиофен- карбоновая кислота
Следуя методике примера 14(6), но исходя из 2 г (5,6 ммоль) вышеполученного сложного метилового эфира, получают 1,7 г (88%) 2-[3-(1-адамантил) -4-метоксифеноксиметил -4-тиофен-карбоновой кислоты с т.пл. 198-200oC.
Пример 18. 2-[3-(1-адамантил) -4-метоксифениламинометил] -4- тиофен-карбоновая кислота
(а) Meтил-2-[3-(1-адамантил) -4-метоксифениламинометил] - 4 - тиофен -карбоксилат
Следуя методике примера 17(a), путем взаимодействия 2,4 г (6,8 ммоль) 3- (1-адамантил-метокситрифторацетанилида с 1,6 г (6,8 ммоль) метил-2-бромметил-4-тиофен-карбоксилата получают 2,6 г (75%) целевого сложного метилового эфира в виде желтого масла.
(б) 2- [3- (1 -адамантил) -4-мeтoкcифeнилaминoмeтил]-4- тиофен-карбоновая кислота
Следуя методике примера 14(6), но исходя из 2,6 г (5,1 ммоль) вышеполученного сложного метилового эфира, получают 1,5 г (74%) 2-[3-(1-адамантил)-4-метоксифениламинометил] -4-тиофен-карбоновой кислоты с т.пл. 212-214oC.
Пример 19. 2-[3-(1-адамантил) -4-метоксифенилтиометил] -4-тиофен-карбоновая кислота
(а) Meтил-2-[3-(l-aдaмaнтил)-4-мeтoкcифeнилтиo- метил] -4-тиoфeн-кapбoкcилaт
Следуя методике примера I7(a), путем взаимодействия 800 мг (2,9 ммоль) 3-(1-адамантил)-4-метокситиофенола с 690 мг (2,9 ммоль) метил-2-бромметил-4-тиофен-карбоксилата получают 700 мг (56%) целевого сложного метилового эфира в виде бесцветного масла.
(б) 2- [3- (1-адамантил) -4-метоксифенилтиометил]-4- тиoфeн-кap6oнoвaя кислота
Следуя методике примера 14(6), но исходя из 700 мг (1,6 ммоль) вышеполученного сложного метилового эфира, получают 460 Mr (68%) 2-[3- (1-адамантил) -4-метоксифенилтиометил] -4-тиофен- карбоновой кислоты с т.пл. 154-156oC.
Пример 20. 4-[3-(1-адамантил)-4-(2,2-диметил-1,3-диоксолан-4- метилокси) бензоилокси] бензойная кислота
(а) Аллил-4-[3- (1-адамантил) -4- (2,2-диметил-1,3- диоксолан-4-метилокси) бензоилокси] бензоат
Следуя методике примера 14 (г), путем взаимодействия 4,3 г (10,7 ммоль) 3-(1-адамантил)-4-(2,2-диметил-1,3-диоксолан-4- метилокси) бензоилхлорида с 1,9 г (10,7 ммоль) аллил-4-гидрокси- бензоата получают 4,24 г (72%) целевого сложного аллилового эфира с т.пл. 106-107oC.
(б) 4-[3- (1-адамантил) -4- (2,2-диметил-1, 3-диоксолан-4- метилокси)бензоилокси]-бензойная кислота
В трехгорлую колбу, в токе азота, вводят 1 г (1,83 ммоль) вышеполученного сложного аллилового эфира, 10 мл ТГФ и 104 мг тетракис(трифенилфосфин)- палладия-(О). Прикапывают 1,6 мл (18,3 ммоль) морфолина и перемешивают при комнатной температуре в течение трех часов. Реакционную среду выливают в воду со льдом, подкисляют до pH=3, экстрагируют диэтиловым эфиром, органического фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью дихлорметана с этилацетатом в соотношении 50:50. После выпаривания растворителей получают 435 мг (47%) 4-[3-(1-адамантил) -4-(2, 2-диметил-1, 3-диоксолан-4- метилокси) -бензоилокси] -бензойной кислоты с т.пл. 238-240oC.
Пример 21. 4-[3-гидроки-3-[5-(1-адамантил) -2, 4- диметоксиэтоксиметоксифенил] -1-пропинил] бензойная кислота
(а) 5-(1 -адамантил) -2, 4-дигидpoкcи-бeнзaльдeгид
В колбу вводят 40 г (0,29 моль) 2,4-дигидрокси-бензальдегида, 600 мл дихлорметана, 46,4 г (0,34 моль) адамантан-1-ола и добавляют 24 мл концентрированной серной кислоты. Перемешивают при комнатной температуре в течение 12 часов, реакционную среду выливают в воду, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя дихлорметаном. Получают 50,8 г (64%) целевого альдегида с т.пл. 259-261oC.
(б) 5- (1-адамантил) -2, 4-мeтoкcиэтoкcимeтoкcи-бензальдегид
Следуя методике примера 17 (а), путем взаимодействия 25 г (91,9 ммоль) 5- (1-адамантил)-2,4-дигидрокси-бензальдегида с 26,2 мл (0,23 моль) 2-метоксиэтоксиметилхлорида получают 31 г (75%) целевого продукта в виде желтого масла.
(в) α-Триметилсилилэтинил-5- (1-aдамaнтил) -2, 4-диметоксиэтоксиметоксибензолметанол
В трехгорлую колбу вводят 450 мкл (3,2 ммоль) триметилсилилацетилена и 50 мл ТГФ. При -78oC, в токе азота, прикапывают раствор 1,3 мл (3,2 ммоль) 2,5 M раствора н-бутиллития в гексане и оставляют стоять для повышения температуры до комнатной. Этот раствор прикапывают к раствору 1,3 г (2,9 ммоль) 5-(1-адамантил) -2,4-диметоксиэтоксиметоксибензальдегила в 50 мл ТГФ при -78oС. После повышения температуры реакционной среды до комнатной ее выливают в водный раствор хлорида аммония, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния, выпаривают. Получают 1,6 г (100%) целевого спирта в виде желтого масла.
(г) α-Этинил-5- (1 -адамантил) -2, 4-ди-метоксиэтоксиметоксибензолметанол
В колбу вводят 1,6 г (2,9 ммоль) триметилсилилэтинил-5- (1-адамантил) -2,4-диметокси-этоксиметокси-бензолметанола, 50 мл ТГФ и прикапывают 3,2 мл (3,5 ммоль) 1,1 М раствора тетрабутиламмонийфторида в ТГФ. Перемешивают при комнатной температуре в течение часа, реакционную среду выливают в воду, экстрагируют диэтиловым зфиром, органическую фазу декантируют, сушат над сульфатом магния, выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя смесью дихлорметана с диэтиловым эфиром в соотношении 95:5. После выпаривания растворителей получают 760 мг (55%) целевого продукта в виде желтого масла.
(д) Метил-4-[3-гидрокси-3-[5- (1-адамантил) -2, 4- метоксиэтоксиметоксифенил] -1 -пропинил] бензоат
В трехгорлую колбу вводят 760 мг (1,6 ммоль) α-этинил-5- (1-адамантил)- 2, 4-диметоксиэтоксиметоксибензолметанола, 420 мг (1,6 ммоль) метил-4-иодбензоата и 20 мл триэтиламина. Реакционную смесь дегазируют путем пропускания азота в течение 30 минут, затем последовательно добавляют 90 мг бис (трифенилфосфин) палладий- (II) -хлорида и 37 мг иодида меди. Перемешивают при комнатной температуре в течение 4 часов, реакционную среду выпаривают досуха, обрабатывают полученный остаток водой и диэтиловым эфиром. Органического фазу декантируют, сушат над сульфатом магния, выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, злюируя дихлорметаном. Получают 800 мг (32%) целевого сложного метилового эфира в виде каштанового цвета масла.
(е) 4-[3-Гидрокси-3-[5- (1-адамантил) -2,4-диметоксиэтоксиметоксифенил] -1 -пропинил] бензойная кислота
В колбу вводят 800 мг (1,3 ммоль) вышеполученного сложного метилового эфира, 340 мг (7,8 ммоль) гидроксида лития и 50 мл ТГФ и кипятят с обратным холодильником в течение 12 часов. Выпаривают досуха, обрабатывают остаток водой, подкисляют до pH=I, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния, выпаривают. Полученный остаток очищают путем хроматографии на колонке с диоксидом кремния, элюируя диэтиловым эфиром. Получают 420 мг (54%) 4- [3-4-гидрокси-3- [3- (1-адамантил) -2, 5-диметоксизтоксиметоксифенил] -1-пропинил] бензойной кислоты с т.пл. 79-81oC.
Пример 22 4-[3-(1-адамантил) -4-метоксиэтоксиметоксибензоилтио] бензойная кислота
В колбу вводят 1,54 г (10 ммоль) 4-
меркаптобензойной кислоты и 40 мл пиридина. Прикапывают раствор 3,75 (10 ммоль) 3-(1-адамантил) -4-метоксиэтоксиметоксибензоилхлорила, полученного согласно примеру 10(в) и перемешивают при комнатной температуре в течение 6 часов. Выпаривают досуха, остаток обрабатывают водой и диэтиловым эфиром, органическую фазу декантируют, промывают водой, сушат над сульфатом магния и выпаривают. Полученный остаток перекристаллизуют из смеси диизопропилового эфира с метанолом, отфильтровывают и высушивают. Получают 2,94 г (59%) 4- [3- (1-адамантил) -4-метоксиэтоксиметоксибензоилтио]бензойной кислоты с т. пл. 187-188oC.
Пример 23. N-Метил-4- [3- (1-адамантил) -4-метоксиэтоксиметоксифенилкарбоксамидо] бензойная кислота
(а) Аллил-N-метил-4-[3- (1-адамантил) -4-метоксиэтоксиметоксибензамидо] бензоат
Следуя методике примера 16(а), путем взаимодействия 1,35 г (2,0 ммоль) аллил-4-[3-(1-адамантил)-4-метоксиэтоксиметоксибензамидо] бензоата, полученного в примере 10(г), со 190 мкл (3,1 ммоль) иодметана получают 1,38 г (100%) целевого сложного аллилового эфира.
(б) N-Meтил-4- [3- (1 -адамантил) -4-метоксиэтоксиметоксифенилкapбoкcaмидo] бензойная кислота
Следуя методике примера 20(6), но исходя из 1,32 г (2,5 ммоль) вышеполученного сложного аллилового эфира, получают 740 г (60%) N-метил-4- [3-(1-адамантил) -4-метоксиэтоксиметоксифенилкарбоксамидо] бензойной кислоты с т. пл. 159-160oC.
Пример 24. 4-[3- (1 -адамантил) -4-метоксиэтоксиметоксифенилтиокарбоксамидо] бензойная кислота
(а) Аллил-4-[3- (1-адамантил) -4-мeтoкcиэтокcимeтокcифeнилтиoкapбoкcaмидo] бензоат
Следуя методике примера 6 (а), путем взаимодействия 2 г (3,9 ммоль) аллил-4- [3- (1-адамантил) -4- метоксиэтоксиметоксибензамидо] бензоата с 940 мг (2, 3 ммоль) реагента Лавессона получают 1,93 г (92%) целевого сложного аллилового эфира.
(б) 4-[3-(1-aдaмaнтил)-4-мeтoкcиэтoкcимeтoкcифeнилтиoкарбоксамидо] бензойная кислота
Следуя методике примера 20(6), но исходя из 1,9 г (3,5 ммоль) вышеполученного сложного аллилового эфира, получают 50 мг (29%) 4- [3-(1-адамантил) -4-метоксиэтоксиметоксифенилтиокарбоксамидо] бензойной кислоты с т. пл. 98-99oC.
Пример 25. (E)-4-[[3-Оксо-3-[3-(1-адамантил) -4- метоксиметоксифенил] -1-пропенил]] -бензойная кислота
(а) Метил-3-(1-адамантил) -4-мeтoкcимeтoкcи-бeнзoaт
В трехгорлую колбу, в токе азота, вводят 9 г (0,3 моль) гидрида натрия (80%-ный в масле) и 50 мл ДМФ. Прикапывают раствор 71,6 г (0,25 моль) метил-3-(1-адамантил)-4-гидрокси-бензоата в 500 мл ДМФ и перемешивают вплоть до прекращения газовыделения. Затем добавляют 22,8 мл (0,3 моль) метоксиметилхлорида и перемешивают при комнатной температуре а течение часа. Реакционную среду выливают в воду, экстрагируют диэтиловым эфиром, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Получают 67,7 г (82%) целевого продукта в виде масла.
(б) 3- (1 -адамантил) -4-метоксиметоксибензойная кислота
Следуя методике примера 14(6), но исходя из 67,7 г (0,2 моль) вышеполученного сложного метилового эфира, получают 59 г (91%) 3- (1-адамантил) -4-метоксиметокси-бензойной кислоты.
(в) 3-(1-адамантил) -4-мeтoкcимeтокcи-aцетофeнoн
В трехгорлую колбу в токе азота вводят 58 г (0,183 моль) 3- (1-адамантил) -4- метоксиметоксибензойной кислоты и 500 мл безводного диэтилового эфира. При -20oC прикапывают 252 мл (0,4 моль) 1,6 М раствора метиллития в эфире и смесь затем перемешивают в течение трех часов при комнатной температуре. Реакционную среду выливают в насыщенный водный раствор хлорида аммония и органическую фазу отделяют путем декантации, сушат над сульфатом магния и выпаривают. Получают 59,6 г (100%) целевого ацетофенона в виде бледно-желтого масла.
(г) Метил- (E) -4 [[3-оксо-3- [3- (1-адамантил) -4- метоксиметоксифенил] -1-пропенил]] бензоат
В круглодонную колбу вводят 40,9 г (0,13 моль) 3- (1- адамантил) -4-метоксиметоксиацетофенона, 23,47 г (0,143 моль) метил-4-формилбензоата и 600 мл метанола. Добавляют 24,8 мл (0,13 моль) 5,25 М раствора метоксида натрия и смесь перемешивают при комнатной температуре в течение 18 часов. Смесь выпаривают досуха, остаток обрабатывают смесью воды с этилацетатом и органическую фазу отделяют путем декантации, сушат над сульфатом магния и выпаривают. Полученный остаток очищают путем порошкования в смеси гексана с этилацетатом, отфильтровывают и высушивают. Получают 46,1 г (77%) метил- (E)-4-[[3-оксо-3- [3- (1-адамантил) - 4-метоксиметоксифенил] -1-пропенил]] бензоата с т. пл. 170-171oC.
(д) (E) -4- [[3-Оксо-3- [3- (1-адамантил) -4-метокси-мeтoкcифенил-l-пpoпeнил]]бeнзoйнaя кислота
Следуя методике примера 2(а), но исходя из 5 г (10,8 ммоль) метил-(Е)-4-[[3-оксо-3-[3-(1-адамантил)-4 -метоксиметоксифенил] - 1-пропенил]] бензоата, получают 3 г (62%) целевой кислоты с т. пл. 205-206oC.
Пример 26. (E)-4-[[3-Оксо-3-[3-(1-адамантил)-4- гидроксифенил]-1-пропенил]] бензойная кислота
(а) Метил- (E) -4- [[3-оксо-3- [3- (1-адамантил) -4- гидроксифенил] -1 -пропенил]]бензоат
В колбу вводят 40,2 г (87,4 ммоль) метил-(E)-4-[[3-оксо-3- [3- (1-адамантил) -4-метоксиметоксифенил] -1-пропенил]]бензоата, 1 л метанола и 300 мл ТГФ. Добавляют 50 мл концентрированной серной кислоты и кипятят с обратным холодильником в течение 4 часов. Реакционную среду выпаривают, остаток обрабатывают смесью этилацетата с водой, органическую фазу декантируют, сушат над сульфатом магния и выпаривают. Полученное твердое вещество порошкуют в смеси этилацетата с гексаном в соотношении 30:70. Получают 32,1 г (88%) целевого сложного метилового эфира с т. пл. 256-257oC.
(б) (E) -4-[[3-Оксо-3- [3-(1 -адамантил) -4-гидроксифенил]- 1-пропенил]] -бензойная кислота
Следуя методике примера 2(а), но исходя из 5 г (12 ммоль) вышеполученного сложного метилового эфира, получают 4,8 г (100%) (E)-4-[[3-оксо-3-(1-адамантил)-4-гидроксифенил] -1-пропенил] ] бензойной кислоты с т.пл. выше 300oC с разложением.
Пример 27.
В этом примере иллюстрируют различные конкретные формулировки на основе соединений, согласно изобретению.
А - Для введения оральным путем
(а) Таблетка весом 0, 2 г:
- соединение примера 1 - 0,001 г
- крахмал - 0,114 г
-дикальцийфосфат - 0,020 г
- диоксид кремния - 0,020 г
- лактоза - 0,030 г
- тальк - 0,010 г
- стеарат магния - 0,005 г
(б) Суспензия для питья в ампулах по 5 мл:
- соединение примера 2 - 0,001 г
- глицерин - 0,500 г
- 70%-ный сорбитол - 0,500 г
- сахаринат натрия - 0,010 г
-метил-парагидроксибензоат - 0,040 г
- ароматизирующий агент - достаточное количество
- очищенная вода - достаточное количество до 5 мл
в) Таблетка весом 0,8 г:
соединение примера 6 - 0,500 г
предварительно желатинизированный крахмал - 0,100 г
микрокристаллическая целлюлоза - 0,115 г
- лактоза - 0,075 г
- стеарат магния - 0,010 г
(г) Суспензия для питья в ампулах по 10 мл:
- соединение примера 4 - 0,05 г
- глицерин - 1,000 г
- 70%-ный сорбитол - 1,000 г
- сахаринат натрия - 0,010 г
- метил-парагидроксибензоат - 0, 080 г
- ароматизирующий агент - достаточное количество
- очищенная вода - достаточное количество до 10 мл
Б- Для введения топическим путем:
(а) Мазь (унгиент):
- соединение примера 1 - 0,020 г
- изопропилмиристат - 81,700 г
- жидкое вазелиновое масло - 9,100 г
- диоксид кремния
("Аэросил 200", выпускаемый фирмой ДЕГУССА) - 9,180 г
(б) Мазь (унгиент):
- соединение примера 6 - 0,300 г
- медицинский вазелин - 100 г
(в) Крем вода-в-масле, неионный:
- соединение примера 1 - 0,100 г
- смесь эмульсионных ланолиновых спиртов, восков и масел ("Eucerine anhydre ", выпускаемый фирмой BDF) - 39,900 г
метил-парагидроксибензоат - 0,075 г
пропил-парагидроксибензоат - 0,075 г
- деминерализованная стерильная вода: - достаточное количество до 100 г
(г) Лосьон:
- соединение примера 1 - 0,100 г
-полиэтиленгликоль(ПЭГ 400) - 69,900 г
- 95%-ный этанол - 30,000 г
(д) Гидрофобная мазь (унгиент):
- соединение примера 2 - 0,300 г
- изопропилмиристат - 36,400 г
- силиконовое масло ("Rhodorsil 47 V 300", выпускаемый фирмой РОН-ПУЛЕНК) - 36,400 г
- пчелиный воск - 13,600 г
- силиконовое масло ("Abil 300 000 cst", выпускаемый фирмой ГОЛЬДШМИДТ) - 100 г
(е) Крем масло-в-воде, неионный:
- соединение примера 4 - 0,500 г
- цетиловый спирт - 4,000 г
- глицеринмоностеарат - 2,500 г
- стеарат ПЭГ 50 - 2,500 г
- масло сального дерева (масло каритэ) - 9,200 г
- пропиленгликоль - 2,000 г
- метил-парагидроксибензоат - 0,075 г
- пропил-парагидроксибензоат - 0,075 г
деминерализованная стерильная вода - 100 г
ФРАГМЕНТ ПРОТОКОЛА О РЕЗУЛЬТАТАХ НЕКЛИНИЧЕСКИХ ИССЛЕДОВАНИЙ
S. Strickland и V. Mahdavi установили, что ретиноевая кислота вызывала дифференцировку клеток F9 (клетки эмбриональной карциномы, происходящие из тератомы мыши) в эндодермические клетки.
Эти же авторы также привлекли внимание к тому, что "ретиноиды", содержащие карбоксильную группу с 15 атомами углерода, гораздо более активны. Указанная дифференцировка сопровождается усиленным синтезом активатора плазминогена. Мера этой активности была выбрана в качестве критерия для количественной оценки морфологического эффекта "ретиноидов" на дифференцировку клеток F9.
Антагонист должен ингибировать синтез активатора плазминогена, вызываемый кретиноидом.
1. ЦЕЛИ
Обнаружить среди CDX (неактивных в тесте F9 ретиноидного скрининга 2 CG. 03. SPR.020) активность, антагонистичную по отношению к CD 2043 (агонист RAR α,β,ψ, очень активный в тесте F9) по дифференцировке клеток F9. Молекула-антагонист будет частично или полностью ингибировать эффект, оказываемый CD 2043 на морфологию и на секрецию активатора плазминогена клетками F9. В этом тесте первичного скрининга CD X тестируют в 10-6 М, a CD 2043 тестируют в 10-8 М.
1.1. Оценивают действие CD X, одного и в присутствии CD 2043, на морфологию клеток.
1.2. Количественно определяют это действие дозированием активатора плазминогена (PA), выделенного клетками в соответствующую среду.
2. ПРОДУКТЫ
2.Продукты для культуры
жидкий DMEM (4,5 г глюкозы) Gibco 041-01965М L-глутамин 200 мМ Gibco 043-05030 H
Пируват натрия 100 мМ Gibco 043-01360 H
Зародышевая телячья сыворотка Eurobio: протестированная партия
Триглин - EDTA (IX) Gibco 043-05300
2.2 Продукты для дозирования РА
DMEM без фенольного красного Gibco 041-01880 H
Плазминоген Biogenic SA 810663
S 2251 Biogenic SA 820332
DMSO Merck 2931
2. 3 Приготовление сред
2.3.1 Для культуры клеток
Среда DMEM 15% сыворотки:
500 мл жидкого DMEM
6 мл пирувата натрия
10 мл глутамина 200 мМ (равные частя, замороженные при -20oC)
90 мл зародышевой телячьей сыворотки
2.3.2 Для дозирования PA
Среда DMEM без фенольного красного,
без сыворотки
500 мл жидкого DMEM
10 мл глутамина 200 мМ
Плазминоген:
Раствор 1 ед/мл: готовят со средой DMEM без фенольного красного, без сыворотки) разливают по 0,5 мл в стерильные пробирки Эппендорфа, сохраняют при -20oC.
Хромогенный субстрат: S 2251: 1 флакон готовят непосредственно перед экспериментом с 3 мл среды без фенольного красного, без сыворотки.
2.4 Получение ретиноидов для тестирования
2.4.1 Заказывают навески 1 мг тестируемых продуктов и одну навеску 3 мг CD 2043 в стерильных пробирках 5 мл
Качество продуктов гарантирует служба развески. По взвешивании продуктов точные навески и проведенные разбавления заносят в лабораторный журнал.
2. 4. 2 Приготовление
Его проводят непосредственно перед постановкой эксперимента в DMSO, при желтом свете, прямо а пробирках с навесками для CD X, который растворяют до 10-3 М. Для CD 2043 проводят, начиная с раствора 10-2 М, серию 10-кратных растворений: 10-3, 10-4, 10-5 М.
Все растворы тщательно взбалтывают и растворение проверяют на глаз.
3. ОБОРУДОВАНИЕ И МАТЕРИАЛЫ
3.1 Малый вспомогательный материал
Желатинированные чашки (100 мл) Согniпg 25020
Плашки Costar 12 ячеек
Плашки Costar 96 ячеек
Стерильные комбитипы 2,5 мл
Профессиональный Polaroid с кассетами 667; 607063
3.2 Оборудование
Терминальная камера для культур с 5% CO2 и 95% влажности
Микроскоп, оборудованный фотоаппаратом
Плашечный вибратор
Сушильный шкаф
Прибор для анализа Elisa Titerkek
4. ЗАПАС КЛЕТОК F9 - КУЛЬТУРА КЛЕТОК F9
4.1 Происхождение клеточной линии
Клетки F9 поставляются Лабораторией Ф.Якобса (F.Jacobs) Института Пастера в Париже.
4.2 Запас клеток
Клетки хранят в жидком азоте s пробирках для замораживания Nine 1,8 мл (Polylabo, 363401) из расчета 1,5 млн. клеток в 1 мл: C F 9 PS3 1990 J.Baily и F9 PSA (1990), F9 PS5 (12/92) С.Cabhelinean. в контейнере 5, колонка 3, ящик 6. Четыре ампулы хранятся в клеточной коллекции Gird Gaiderma: контейнер 1, колонка F, ящик 3. Клетки были заморожены в DMEM 70%, FCS 20%, DMSO 10%, согласно следующей процедуре: контакт со средой замораживания 30 минут при комнатной температуре, затем перемещение на полистирольном носителе в холодильник -70oC на 24 часа, затем консервация в контейнере с жидким азотом.
4.3 Размораживание
Ампулу размораживают приблизительно 1 раз в триместр и поддерживают линию в течение примерно 40 пассажей (до снижения активности клеток). Размораживание проводят быстро до 37oC (не встряхивать пробирку). Размороженную суспензию разводят в 10 мл среды.
После центрифугирования в течение 5 минут при 2000 об/мин, осадок отбирают в 10 мл среды и высеивают в 100 мм желатинированную чашку, которую помещают в термальную камеру при 37oC, 4,5% CO2. Дожидаются образования четких островков, прежде чем провести первый пассаж (среду можно изменить на J2).
Тестирование начинают только после 3 или 4 пассажей и включают в первый тест дозу-ответ контрольного продукта (CD14 или CD2043), чтобы проверить активность клеток и подтвердить результаты первого эксперимента,
4.4 Содержание
Клетки F9 требуют бережного обращения. Необходимо неукоснительно соблюдать правила содержания. Проводят три пассажа в неделю (в понедельник, среду, пятницу). Растворы и среды предварительно инкубируют при 37oC. После микроскопического анализа клеток, отсасывают среду из одной коробки, затем промывают (не отделяя клетки) 10 мл PBS без Ca++, Mg++; добавляют 1,5 мл трипсин - EDTA. Чашку помещают на 5 минут в термальную камеру. Затем добавляют 10 мл среды с сывороткой, чтобы остановить трипсинизацию, тщательно отделяют клетки и центрифугируют суспензию, которую помещают в корнинг на 50 мл, в течение 5 мин при 2000 об/мин. После удаления надосадочной жидкости собирают осадок в 5 мл культурной среды. Проводят пассаж в 1/15, при этом берут 1 мл полученной суспензии на 30 мл среды, разделенной на три чашки 100 мм. Вне периода тестов можно выбрать ритм 2 пассажей в неделю (понедельник и четверг): в этом случае собирают клеточный осадок в 10 мл среды и высеивают 1 мл на 30 мл среды (1/30). Культуры держат при 37oC и 95 гигрометрических %.
5. ПРОВЕДЕНИЕ ТЕСТА
Тест начинают в понедельник или в пятницу.
5.1 Высеивание на плашках
Проводят расчет с помощью одной клетки Malassey клеточной суспензии после трипсинизации одной чашки 100. Затем в корнингах 50 мл готовят суспензии с 1 млн. клеток на 36 мл культурной среды (засеивание 3 плашек.).
Суспензии тщательно гомогенизируют. Очень важно гомогенно засеять все 6 плашек с 12 лунками, применяемые в тесте, из расчета 1 мл на лунку, т.е. 28000 клеток на лунку, с помощью пипетки на 5 мл. Плашки помещают в термальную камеру при 37oC.
Приготовление CD (см. п.2.4.2)
5.3 Распределение CD
Как правило, тестируют 11 CD X в одном тесте. Следует засеять 6 плашек. В каждую плашку вносят отрицательный контрольный препарат DMSO и положительный контрольный препарат CD 2043 (10-8 М). На одной из плашек тестируют CD 633, являющийся антагонистичным положительным контрольным препаратом.
Вносят 1 мкл CD выбранной концентрации в каждую лунку с помощью микропипетки (10 мкл) с наконечником Eurctips (10 мкл). Наконечник меняют при каждом внесении.
Плашки идентифицируют следующим образом:
DMSO - 2043
CD1 - CD1+2043
CD2 - CD2+2043
1;1; - 4;4;
2;2; - 5;5;
3;3; - 6;6;
Добавляют: 2 мкл DM SO в лунки (1): контрольные DMSO
1 мкл (2)(3)(4)
1 мкл CD X (2)(5),(3)(6)
1 мкл CD 2043(4)(5)(6)
Концентрация DMSO в каждой лунке составляет таким образом 2%.
Плашки снова помещают в термальную камеру при 37oC на 3 дня.
Их накрывают алюминиевой фольгой для защиты от света.
5.4 Микроскопические наблюдения
После трех дней обработки плашки изучают под обращенным микроскопом для оценки морфологического эффекта: дисперсия клеток внутри островков, появление треугольных клеток, демонстрирующих цитоплазматические выросты. На каждую концентрацию выставляется одна оценка: (+) - активная) (-) - неактивная.
С каждой плашки получают 6 поляроидных фотографий, характеризующих внешний вид клеток при разных обработках.
5. 5 Дозирование активатора плазминогена
После микроскопических наблюдений клетки осторожно промывают (нельзя их отделять) два раза 1 мл нефенольного DMEM на лунку.
Их инкубируют с 1 мл нефенольного DMEM (вносимого пипеткой на 5 мл) на лунку в термальной камере при 37oC.
По истечении 3 час 30 мин среды из лунок собирают и помещают в пробирки Эппендорфа, помеченные соответствующими этикетками) затем центрифугируют 5 минут при 15000 g (13000 об/мин) центрифуга Heracus).
Специально готовят реакционную среду для n образцов, смешивая (n x 50 мкл) плазминогена 0,3 единицы казеина/мл (разбавление имеющегося раствора 1 ед/мл в нефенольной среде DMEM; т.е. на 3 мл раствора: 0,9 мл имеющегося готового начального раствора + 2,1 мл DMEM) с (n x 50 мкл) S 2251 15 мМ (см. п. 2.3.2).
Ферментативную реакцию проводят в плашке Microtest Ш, Falcon 3072, С 96 лунками, обозначенной соответствующей этикеткой.
Вносят с помощью многоканальной пипетки Eppendorf 4780 и стерильного комбитипа на 2,5 мл 100 мкл реакционной смеси. Затем в каждую лунку вносят 150 мкл надосадка среды. Лунки накрывают парафильмом во избежание испарения и закрывают планку крышкой. Плашку взбалтывают несколько секунд на плашечном вибраторе, затем помещают на 16 часов в сушильный шкаф при 37oC.
Проводят измерения на приборе для анализа микроплашек с длиной волны 405 мм.
Нулевой коэффициент поглощения (Abs) получен на контрольных DMSO.
Примечание:
Если активность клеток невелика, можно инкубировать клетки с 0,5 мл DMEM, затем осoществить дозирование FA на 75 мкл среды (т.е. добавляют 75 мкл DMEM в каждую лунку).
6.РЕЗУЛЬТАТЫ
6.1 Заводят карточки результатов
В них заносят:
Наблюдаемые морфологические эффекты (+) - дифференцирована, (-) - отсутствие дифференцировки. Значения коэффициента поглощения для каждой тестируемой концентрации, в отсутствие или в присутствии CD 2043.
Подсчитывают:
средние коэффициенты поглощения двойных образцов
значения коэффициента поглощения в % от коэффициента поглощения CD 2043 соответствующей планки.
6.2 Результаты (выраженные в % от коэффициента поглощения CD 2043)
Объединяют в таблице, показывающей для каждого тестируемого CD, его активность в отсутствие и в присутствии CD 2043.
Какой-либо CD считают антагонистом, если он снижает более чем на 60% активность CD 2043 в описанных в данном тесте экспериментальных условиях.
6.3 В лабораторный журнал заносят данные для каждого опыта о тестированных CD, их серии, навесках и объеме DMSO, добавленного для получения стартовых растворов. Уточняют пассирование клеток.
Подтверждают качество эксперимента согласно следующим критериям:
Контрольные образцы DMSO: слабый основной уровень должен быть ниже 0,1.
Контрольные образцы СЕD 2043 (10-8 М): средний Abs выше или равен 0,25.
Хорошая корреляция между морфологическим аспектом и значениями коэффициента поглощения.
6.4 Листинг
Для каждого протестированного CD приводят значения коэффициента поглощения (выраженные в % от коэффициента поглощения CD 2043) в отсутствие или в присутствии CD 2043.
7. ДОСЬЕ РЕЗУЛЬТАТОВ И АРХИВИРОВАНИЕ
7.1 Досье результатов
Все карточки с результатами и фотографии хранят в картотеке в кабинете руководителя исследований.
7.2 Архивирование
Оригинал протокола, первичные данные, лабораторные журналы с записями, касающимися данного исследования будут архивированы в GIRD GALDERMA.
8. БИБЛИОГРАФИЯ
S.STRICKLAND и MAHDAVI (Cell:1978, 15, 393-403).
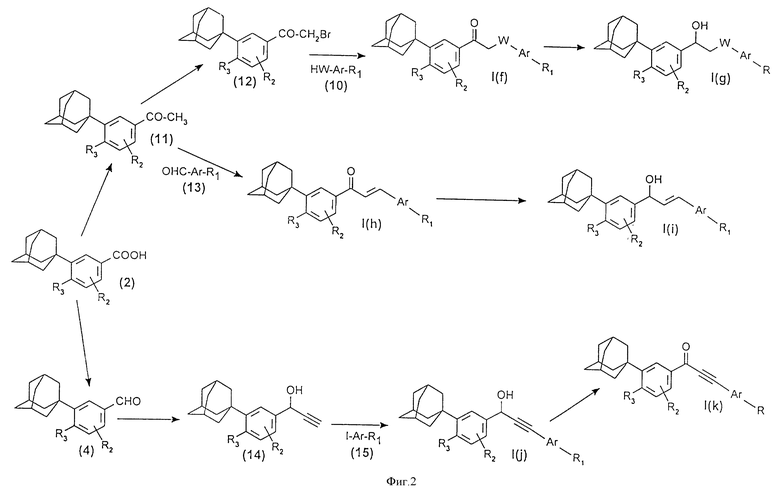
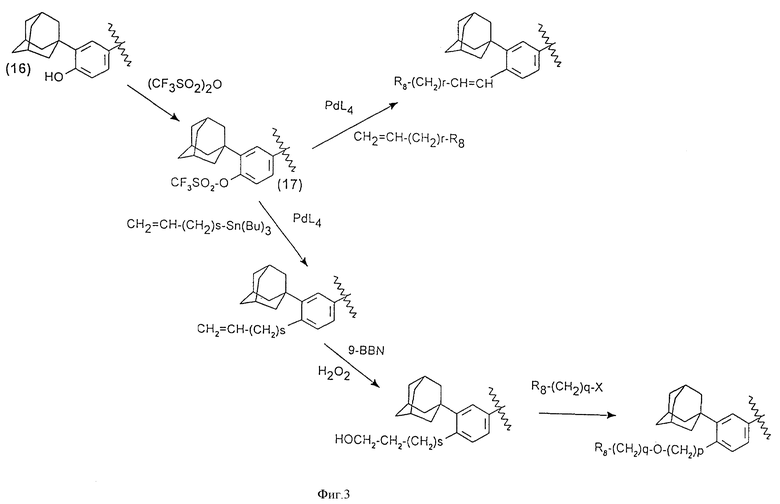
Изобретение относится к новым бициклическим ароматическим соединениям, которые отвечают общей формуле I, где значения R1, R2, R3, Х и Ar указаны в п.1 формулы. Соединения обладают активностью в области дифференции и пролиферации клеток и могут найти применение при лечении топическим или системным путем дерматологических заболеваний, связанных с нарушением кератинизации. Соединения формы I можно использовать для гигиены тела и ухода за волосами. Описывается фармацевтическая композиция, проявляющая активность в области дифференциации и пролиферации клеток, а также косметическая композиция для гигиены тела и для ухода за волосами. 3 с. и 13 з.п. ф-лы, 3 ил.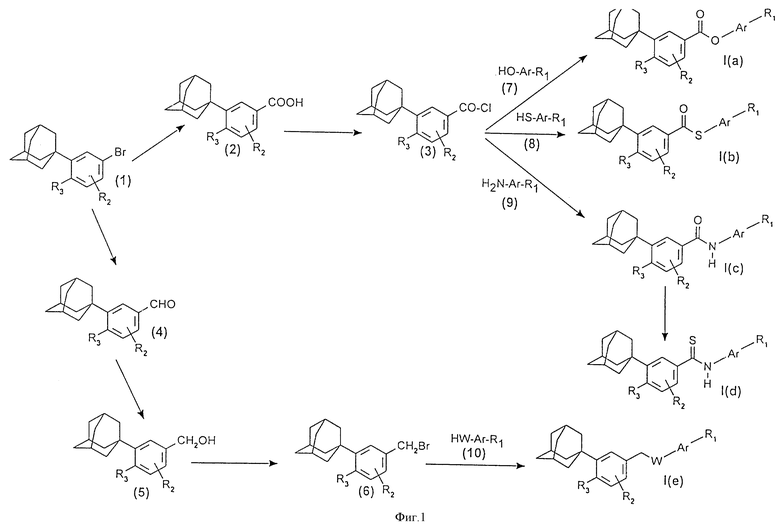
в которой R1 обозначает радикал -СО-R6, радикал -CO-O-R7, причем значения радикалов R6-R7приводятся ниже;
R2 обозначает атом водорода или галогена, линейный или разветвленный алкильный радикал с 1-20 атомами углерода, радикал OR4 или радикал -O-СН2-О-СН2-СН2-О-СН3;
R3 обозначает радикал -Y(CH2)p-Y-(CH2)q-R8; радикал - -Y-(CH2)q-R8; радикал (CH2)q-R8; причем значения p, q, радикалов Y и R8 приводятся ниже;
Х обозначает связи нижеследующих формул (а)-(f), (i-k) которые могут быть связаны двояким образом;
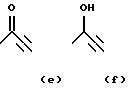
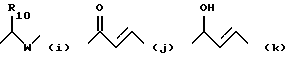
Ar обозначает радикал, выбираемый среди радикалов следующих формул (а) и (е)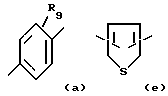
имея в виду, что в вышеуказанном
р - целое число, находящееся в пределах 1-12 включительно;
q - целое число, находящееся в пределах 0-12 включительно;
t - целое число, равное 0,1 или 2;
y - атом кислорода или радикал S(O)t;
W - атом кислорода, радикал S(O)t или радикал N-R10;
R4 - атом водорода, низший алкильный радикал;
R6 - атом водорода, низший алкильный радикал;
R7 - атом водорода, линейный или разветвленный алкильный радикал с 1-20 атомами углерода;
R8, который может быть одинаковый или различный, обозначает атом водорода, разветвленный алкильный радикал с 1-20 атомами углерода, моногидроксиалкильный радикал или полигидроксиалкильный радикал, гидроксильные группы которого возможно защищены в форме метокси-, ацетокси- или ацетонид-группы, радикал COOR7, причем R7 имеет вышеуказанное значение;
R9, который может быть одинаковый или различный, обозначает атом водорода или галогена, линейный или разветвленный алкильный радикал с 1-20 атомами углерода, радикал -OR4 или радикал -O-CH2-O-CH2-CH2-O-CH3;
R10, который может быть одинаковый или разный, обозначает атом водорода, низший алкильный радикал;
имея в виду, что когда Х обозначает связь формулы (а), (b), (с), (j) или (к), тогда R3 отличается от радикала формулы Y-(CH2)q-R8 и R8 обозначает атом водорода; когда Х обозначает связь формулы (j) или (к) и R3 обозначает радикал формулы (CH2)q-R8, тогда R8 отличается от моногидроксиалкильного или полигидроксиалкильного радикала,
или их соли, или их оптические и геометрические изомеры.
4[3-(1-адамантил)-4-метоксифенилтиометил]бензойная кислота,
4-[3-(1-адамантил)-4-метоксифенилсульфинилметил]бензойная кислота,
4-[3-(1-адамантил)-4-метоксифенилметилсульфонил]бензойная кислота,
4-[3-(1- адамантил)-4-метоксифенилметилсульфинил]бензойная кислота,
4-[3-(1-адамантил)-4-метоксифенилсульфонилметил]бензойная кислота,
4-[3-(1-адамантил)-4-метоксифенилтиокарбоксамидо]-бензойная кислота,
4-[3-(1-адамантил)-4-метоксифенилметилтио]бензойная кислота,
4-[3-(1-адамантил)-4-метоксифенилметиламино]бензойная кислота,
4-[[3-оксо-3-[3-(1-адамантил)-4-метоксифенил]-1-пропинил]бензойная кислота,
4-[3-(1-адамантил)-4-метоксиэтоксиметоксибензамидо]-бензойная кислота,
4-[3-(1-адамантил)-4 метоксиэтоксиметоксибензоилокси]бензойная кислота,
(Е)-4-[[3-оксо-3-[3-(1-адамантил)-4-метоксиэтоксиметоксифенил] -1-пропенил]]бензойная кислота,
4-[[3-гидрокси-3-[3-(1-адамантил)-4-метоксиэтоксиметоксифенид] -1-пропинил]]-бензойная кислота,
4-[3-(1-адамантил)-4-(2,2-диметил-1,3-диоксолан-4-метокси] -фенилкарбоксамидо]-бензойная кислота,
4-[3-(1-адамантил)-4-(2,3-дигидрсксипропилокси)-фенилкарбоксамидо] -бензойная кислота,
4-[3-(1-адамантил)-4-метоксикарбонилметилоксифенилкарбоксамидо]бензойная кислота,
2-[3-(1-адамантил)-4-метоксифеноксиметил]-4-тиофенкарбоновая кислота,
2-[3-(1-адамантил)-4-метоксифениламинометил]-4-тиофенкарбоновая кислота,
2-[3-(1-адамантил)-4-метоксифенилтиометил]-4-тиофенкарбоновая кислота,
4-[3-(1-адамантил)-4-(2,2-диметил-1,3-диоксолан-4-метилокси)бензоилокси] бензойная кислота,
4-[3-гидрокси-3-[5-(1-aдaмaнтил)-2,4-димeтoкcиэтоксиметоксифенил]-1-пропинил]бензойная кислота,
4-[3-(1-адамантил)-4-метоксиэтоксиметоксибензоилтио]-бензойная кислота,
N-метил-4-[3-(1-адамантил)-4-метоксиэтоксиметоксифенилкарбоксамидо]бензойная кислота,
4-[3-(1-адамантил)-4-метоксиэтоксиметоксифенилтиокарбоксамидо] бензойная кислота,
(Е)-4-[[3-оксо-3-[3-(1-адамантил)-4-метоксиметоксифенил] -1-пропенил] ] бензойная кислота,
(Е)-4-[[3-оксо-3-[3-(1-адамантил)-4-гидроксифенил]-1-пропенил]]бензойная кислота,
(Е)-4-[[3-оксо-3-[3-(1-адамантил)-4-метоксифенил] -1-пропенил]]бензойная кислота,
(Е)-4-[[3-оксо-3-[[3-(1-адамантил)-4-(3-гидроксипропилокси)фенил]-1-пропенил]]бензойная кислота,
4-[3-(1-адамантил)-4-метоксиэтоксиметоксибензоилокси] бензальдегид, 4-[3-(1-адамантил)-4-метоксиэтоксиметоксибензоилокси]бензолметанол, (Е)-N-этил-4-[[3-оксо-3-[3-(1-адамантил)-4-метоксиэтоксиметоксифенил] -1-пропенил] ] бензамид, (Е)-N-(4-гидроксифенил)-4-[[3-оксо-3-[3-(1-адамантил)-4-мeтoкcиэтoкcимeтoкcифeнил] -1-пpoпeнил] ] бензамид, (Е)-4-[[3-оксо-3-[3-(1-адамантил)-4-метоксиэтоксиметоксифенил]-1-пропенил]]фенол.
| SU, 413134, A, 1974 | |||
| SU, 1201279, A, 1985 | |||
| US, 5160731, A, 1992 | |||
| FR, 2720634, A, 1994. |
Авторы
Даты
1999-09-27—Публикация
1996-11-29—Подача