Изобретение относится к соединению, выбираемому среди метионаля диальдегида малоновой кислоты и любого фактора, оказывающего влияние на внутриклеточное содержание метионаля или диальдегида малоновой кислоты, с целью использования в качестве лекарственного средства. Это лекарственное средство преимущественно предназначается для модулирования явления запрограммированной гибели клеток (апоптоз).
Изобретение также относится к модулирующей апоптоз композиции. Наконец, объектом изобретения также является способ предотвращения и/или борьбы против фотоиндуктируемого или возрастного старения кожи.
Существуют два типа механизмов, принимающих участие в гибели клеток. Первый классический тип называют некрозом. Морфологически некроз характеризуется чрезмерным увеличением митохондрий и цитоплазмы и нуклеарным изменением (повреждением) с последующим разрушением клетки и ее аутолизом, причем это сопровождается явлением воспаления. Некроз возникает пассивно и случайно. Тканевой некроз обычно является, например, следствием физической травмы клеток или химического яда.
Другую форму гибели клеток называют апоптозом (Kerr J.F.R. и Wyllie А.Н. , Br.J. Cancer, 265, 239 (1972)), однако, в противоположность некрозу, апоптоз не имеет следствием явление воспаления. Описывается, что апоптоз может возникать в различных физиологических условиях. Это высокоселективная форма клеточного самоубийства (суицида), которая характеризуется легко обнаруживаемыми морфологическими и биохимическими явлениями. Так, в особенности наблюдают конденсацию хроматина, ассоциированную или нет с эндонуклеазной активностью, образование апоптических тел и фрагментацию дезоксирибонуклеиновой кислоты (ДНК) за счет активации эндонуклеаз до фрагментов ДНК величиной 180-200 пар оснований (эти фрагменты можно обнаруживать с помощью электрофореза на геле агарозы).
Апоптоз можно рассматривать как запрограммированную гибель клеток, принимающую участие в развитии, дифференциации и гомеостазе тканей. Следовательно, считают, что дифференциация, рост и созревание клеток тесно связаны с апоптозом. Так, у человека с хорошим здоровьем существует равновесие между совокупностью этих явлений.
В области медицины, ряд патологических ситуаций связан с модифицированным, даже беспорядочным, механизмом апоптоза или механизмом апоптоза, который не способствует дерегуляции другого биологического явления для достижения равновесия. Так, описывается, что свободная модуляция апоптоза за счет его индуктирования или за счет его подавления может позволить лечить многочисленные заболевания, преимущественно заболевания, связанные с клеточной гиперпролиферацией, такие, как в случае рака, аутоиммунные заболевания или аллергий, или, напротив, заболевания, связанные с отмиранием клеток, такие, как в случае синдрома иммунодефицита, вызываемого вирусом иммунодефицита человека (ВИЧ), нейродегенеративные заболевания (болезнь Альцгеймера), чрезмерные повреждения, вызванные во время инфаркта миокарда или церебрального ишемического поражения.
Конкретно, в онкологии констатировано, что многочисленные противораковые лекарства, такие, как адриамицин и циклофосфамид, способны индуктировать апоптоз.
В области косметики, признаки старения кожи являются результатом, главным образом, дисфункции основных биологических механизмов, протекающих в коже, особенно с подключением механизма апоптоза. Следовательно, можно полагать, что любой продукт, способный модулировать механизм апоптоза, является продуктом, пригодным для предотвращения и/или борьбы против появления старения и имеющихся признаков старения, как морщины и морщинки.
Однако, связь между экзогенными или эндогенными продуктами в клетке и их клеточной ответной реакцией, индуктирующей или подавляющей апоптоз, неизвестна.
Заявитель нашел, что апоптоз может быть вызван повышением внутриклеточного содержания природного метаболита, метионаля (3-метилтиопропаналь) или диальдегида малоновой кислоты. Заявитель также раскрыл, что превращение in vivo метионаля в диальдегид малоновой кислоты может быть дерегулировано экспрессией канцерогенов, таких, как ген bcl2. Этот ген bcl2 описывается как особенно способный ингибировать апоптоз, вызываемый реакционноспособными оксигенированными видами, в клетках и преимущественно в нейронных клетках (Kane D.J. и др. Science, 262, 1274-1277 (1993)).
Следовательно, настоящее изобретение относится к соединению, выбираемому среди метионаля, диальдегида малоновой кислоты и любого фактора, оказывающего влияние на внутриклеточное содержание метионаля или диальдегида малоновой кислоты, с целью использования в качестве лекарственного средства. Это лекарственное средство преимущественно предназначается для модулирования явления запрограммированной гибели клеток.
Объектом настоящего изобретения является также модулирующая апоптоз, фармацевтическая или косметическая композиция, отличающаяся тем, что она содержит в качестве активного агента соединение, выбираемое среди метионаля, диальдегида малоновой кислоты и любого фактора, оказывающего влияние на внутриклеточное содержание метионаля или диальдегида малоновой кислоты, в сочетании с фармацевтически или косметически приемлемой основой.
Метиональ, диальдегид малоновой кислоты и любой фактор, оказывающий влияние на внутриклеточное содержание метионаля, могут быть использованы в настоящем изобретении индивидуально или предпочтительно в виде смеси. Разумеется, выбор продуктов зависит от искомой цели, то есть, либо для индуктирования апоптоза, либо для подавления апоптоза.
Так, согласно особому варианту осуществления изобретения, индуктирующая апоптоз композиция отличается тем, что она содержит в качестве активного агента соединение, выбираемое среди метионаля, диальдегида малоновой кислоты и любого фактора, повышающего внутриклеточное содержание метионаля или диальдегида малоновой кислоты, в сочетании с фармацевтически или косметически приемлемой основой.
И, согласно другому особому варианту осуществления изобретения, подавляющая апоптоз композиция отличается тем, что она содержит в качестве активного агента любой фактор, снижающий внутриклеточное содержание метионаля или диальдегида малоновой кислоты, в сочетании с фармацевтически или косметически приемлемой основой.
В случае метаболизма метионаля известно, что 4-метилтио-2-оксобутановая кислота может быть метаболизирована in vivo с помощью комплекса дегидрогеназа-оксо-кислота с разветвленной цепью, присутствующего в митохондриях клеток печени, сердца и скелетной мышцы, через метиональ для получения метилтиопропионил- CoA (см. Wu G. и Yeaman S.J., Biochem. J., 257, 281-284 (1989); Haussinger D. , Stehle Т. и Gerok W., J. Biol. Chem., 366, 527-536 (1985); Jones S.M.A. и Yeaman S.J., Biochem. J., 237, 621-623 (1986)). Также описывается, что 4-метилтио-2-оксобутановая кислота может быть метаболизирована in vivo путем трансаминирования в метионин (см. Ogier G., Chantepie J., Deshayes C., Chantegrel В., Charlot C., Doutheau A. и Quash G., Biochem. Pharmacol., 45, 1631-1644 (1993)). Метиональ, при необходимости, также может быть восстановлен или окислен, соответственно, до метионола с помощью альдегид-редуктазы или до метилтиопропионовой кислоты с помощью альдегид-дегидрогеназы. Метиональ в сочетании с радикалом HO., наконец, может давать диальдегид малоновой кислоты и метантиол за счет реакции β-гидроксилирования. Так, для того, чтобы лучше определить место метионаля, диальдегида малоновой кислоты и факторов, которые могут оказывать влияние на их внутриклеточное содержание, на чертеже иллюстрируется метаболизм метионаля, что, однако, не ограничивает объема охраны изобретения.
На чертеже:
МТОБ означает 4-метилтио-2-оксобутановую кислоту;
МТПК означает метилтиопропионовую кислоту;
Е1 означает декарбоксилазу комплекса дегидрогеназа-оксо-кислота с разветвленной цепью, кофактором которой является тиаминпирофосфат (ТПФ);
Е2 означает трансацилазу комплекса дегидрогеназа-оксо-кислота с разветвленной цепью, кофактором которой является липоевая кислота (ЛК);
АЛДР означает альдегид-редуктазу;
АЛДГ означает альдегид-дегидрогеназу.
Под фактором, оказывающим влияние на внутриклеточное содержание метионаля или диальдегида малоновой кислоты, согласно изобретению понимают соединения, выбираемые среди предшественников, продуктов метаболизма метионаля или диальдегида малоновой кислоты, ингибиторов и активаторов ферментов, принимающих участие в метаболизме метионаля или диальдегида малоновой кислоты. Так, рассматривая проиллюстрированный на чертеже метаболизм метионаля или диальдегида малоновой кислоты, легко понять, как эти соединения, метиональ или диальдегид малоновой кислоты, введенные в клеточную систему, могут модифицировать внутриклеточное содержание метионаля или диальдегида малоновой кислоты, временно или на длительный период.
Предшественники или продукты метаболизма метионаля или диальдегида малоновой кислоты могут представлять собой предшественники или продукты внутриклеточного метаболизма метионаля, такие, как 4-метилтио-2-оксобутановая кислота, метионин, метионол, метилтиопропионовая кислота и метилтиопропионилCoA.
Предшественники или продукты метаболизма метионаля или диальдегида малоновой кислоты также могут представлять собой продукты, которые in situ обладают способностью высвобождать метиональ или диальдегид малоновой кислоты или высвобождать фактор, оказывающий влияние на внутриклеточное содержание метионаля или диальдегида малоновой кислоты, такие, как сложные эфиры и сложные тиоэфиры метионаля или диальдегида малоновой кислоты, которые in situ могут выделять метиональ, диальдегид малоновой кислоты или 4-метилтио-2-гидроксибутановую кислоту, которая в свою очередь затем может быть метаболизована in situ в 4-метилтио-2-оксобутановую кислоту. В фармацевтической области эти продукты обычно называют "пропрепаратами".
В случае, где хотят индуктировать апоптоз, метиональ, диальдегил малоновой кислоты, предшественник или продукты метаболизма метионаля или диальдегида малоновой кислоты предпочтительно используют в сочетании с ингибиторами ферментов, которые принимают участие в метаболических реакциях, благоприятствующих удалению метионаля, других, чем реакция β- гидроксилирования, указанная выше (вследствие которой метиональ превращается в диальдегид малоновой кислоты), или в сочетании с активаторами β- гидроксилазы, которая представляет собой фермент, принимающий участие в превращении метионаля в диальдегид малоновой кислоты. Так, в качестве примера, можно назвать сочетание 4-метилтио-2-оксобутановой кислоты с ингибитором трансаминазы, принимающей участие в превращении 4-метилтио-2-оксобутановой кислоты в метионин, таким, как нижеуказанные ингибиторы.
Можно также использовать ассоциацию метионаля или повышающего внутриклеточное содержание метионаля фактора с соединениями, увеличивающими содержание свободного радикала HO.. Можно также назвать БХНМ (N,N-бис(2-хлорэтил)-N-нитрозомочевина), так как она является ингибитором глутатион-редуктазы, которая позволяет повышать внутриклеточное содержание реакционноспособных оксигенированных видов, таких, как радикал HO., который является одним из субстратов реакции β- гидроксилирования с целью получения диальдегида малоновой кислоты.
Эта ассоциация представляет особенно интерес в случае патологий, которые характеризуются сверхэкспрессией гена bcl2. Такими патологиями являются особенно раковые заболевания молочной железы, лимфомы B-клеток, лейкемии, нейробластомы, аденокарциномы простаты, пролактиномы и другие гипофизарные аденомы. Сверхэкспрессия гена bcl2 придает клеткам устойчивый к химиотерапии характер. Эта ассоциация, таким образом, позволяет частично, даже полностью, ингибировать этот устойчивый к химиотерапии характер.
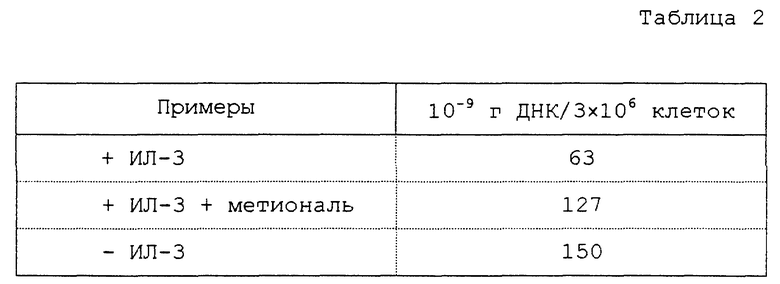
К этой ассоциации предпочтительно можно добавлять, по крайней мере, один ингибитор трансаминазы, принимающей участие в превращении 4-метилтио-2-оксобутановой кислоты в метионин, такие, как описанные ниже и в особенности соединение формулы (9).
Из ингибиторов или активаторов ферментов, принимающих участие в метаболизме метионаля, особенно можно назвать ингибиторы или активаторы комплекса дегидрогеназа-оксокислота с разветвленной цепью, принимающего участие в превращении 4-метилтио-2-оксобутановой кислоты в метилтиопропионилCoA через метиональ, или ингибиторы или активаторы трансаминазы, принимающей участие в превращении 4-метилтио-2-оксобутановой кислоты в метионин, или ингибиторы или активаторы альдегид-редуктазы, ответственной за восстановление метионаля в метионол, или альдегид-дегидрогеназы, ответственной за окисление метионаля в метилтиопропионовую кислоту, или еще активаторы или ингибиторы β- гидроксилазы, которая представляет собой фермент, принимающий участие в превращении метионаля в диальдегид малоновой кислоты.
Таким образом, в качестве ингибитора комплекса дегидрогеназа-оксокислота с разветвленной цепью и, следовательно, в качестве фактора, снижающего внутриклеточное содержание метионаля или диальдегида малоновой кислоты, можно назвать 2-оксобутират, который представляет собой хорошо известный субстрат этого комплекса (см. Jones S.M.A. и Cederbaum A.I., Arch. of Biochem and Biophys., 199, 438-447 (1980)), так же, как кетолейцин, кетоизолейцин и кетовалин, которые являются другими субстратами этого комплекса.
Также, в качестве ингибиторов трансаминазы, принимающей участие в превращении 4-метилтио-2-оксобутановой кислоты в метионин и, следовательно, в качестве факторов, повышающих внутриклеточное содержание метионаля или диальдегида малоновой кислоты, можно назвать продукты, описанные Ogier G., Chantepie J., Deshayes C., Chantegrel В., Charlot C., Doutheau A. и Quash G. , Biochem. Pharmacol., 45, 1631-1644 (1993).
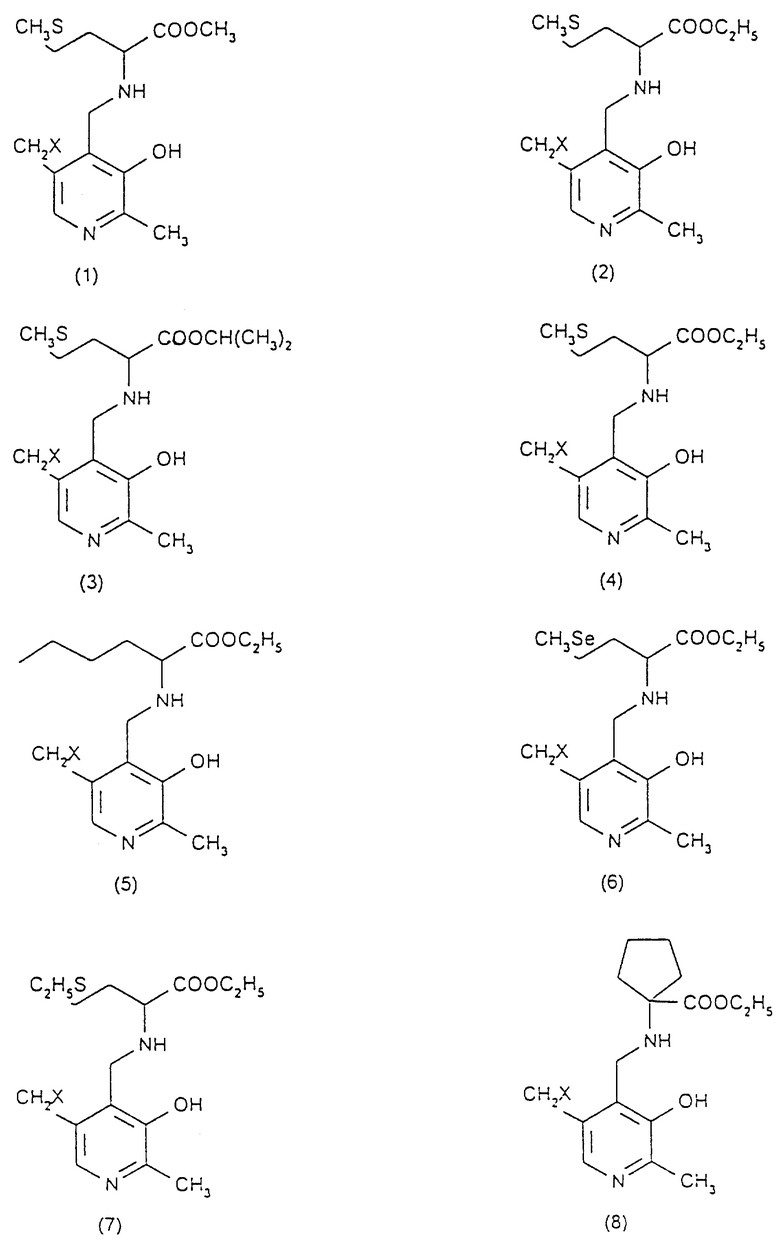
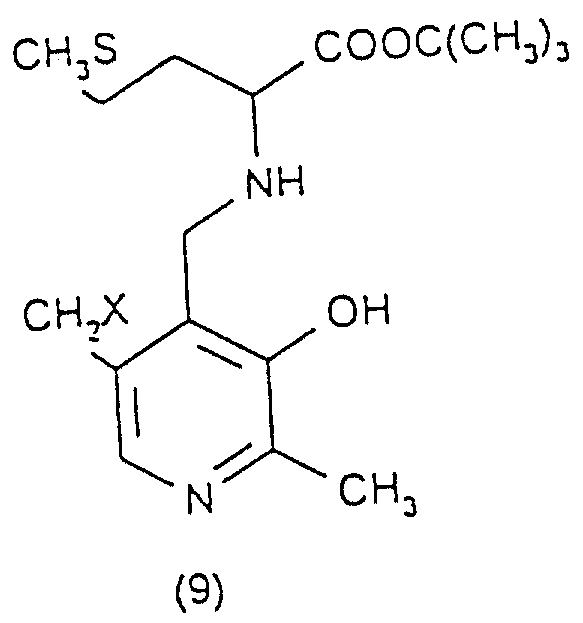
Преимущественно ингибиторы трансаминазы, принимающей участие в превращении 4-метилтио-2-оксобутановой кислоты в метионин, выбирают среди продуктов формул (1)-(9) (в конце описания), в которых X означает радикал -OH или радикал -OPO3H2.
Особенно предпочтительным является соединение формулы (9), когда X означает радикал -OH. В качестве ингибиторов трансаминазы, принимающей участие в превращении 4-метилтио-2-оксобутановой кислоты в метионин и, следовательно, в качестве факторов, повышающих внутриклеточное содержание метионаля или диальдегида малоновой кислоты, можно еще назвать гидроксаматы амидов аминокислот, такие, как D-аспарагин-гидроксамат формулы CONHOHCH2CHNH2COOH и L-глутамин-гидроксамат формулы CONHOHCH2CH2CHNH2COOH.
Когда хотят индуктировать апоптоз, то согласно изобретению, предпочтительно используют соединение, выбираемое среди метионаля, диальдегида малоновой кислоты, продуктов, которые in situ обладают способностью высвобождать метиональ или диальдегид малоновой кислоты, таких, как сложные эфиры и сложные тиоэфиры метионаля или диальдегида малоновой кислоты, или активаторов фермента, принимающего участие в превращении метионаля в диальдегид малоновой кислоты.
Из представляющих особенно интерес для индуктирования апоптоза смесей можно в особенности назвать ассоциацию метионаля по крайней мере с одним ингибитором трансаминазы, принимающей участие в превращении 4-метилтио-2-оксобутановой кислоты в метионин, и предпочтительно с соединением формулы (9).
Когда хотят подавить апоптоз, то согласно изобретению предпочитают использовать ингибиторы ферментов, принимающих участие в продуцировании метионаля или диальдегида малоновой кислоты, например, как 2-оксобутират, и/или активаторы ферментов, принимающих участие в удалении метионаля, другим путем, чем по реакции β- гидроксилирования, указанной выше.
Композиция согласно изобретению преимущественно предназначается для следующих видов лечений:
1) Для лечения дерматологических заболеваний, связанных с нарушением кератинизации, приводящим к дифференциации и гиперпролиферации, особенно для лечения обыкновенных (юношеских), полиморфных, красных угрей; узелковых, шаровидных угрей; сенильных акне, вторичных акне, таких, как солнечная, медикаментозная или профессиональная акне.
2) Для лечения других типов нарушений кератинизации, особенно ихтиозов, ихтиозоподобных состояний, болезни Дарье, ладонно-подошвенных кератодермий, лейкоплазий и лейкоплазоподобных состояний, кожного лишая или лишая слизистых оболочек (ротовой лишай).
3) Для лечения других дерматологических заболеваний, связанных с нарушением кератинизации с воспалительным и/или иммуно-аллергическим компонентом, и, особенно, для лечения любых форм псориаза, который бывает кожным, слизистых оболочек или ногтевым, и точно также для лечения псориатического артрита, или еще для лечения кожной атопии, такой, как экзема или респираторная атопия или еще десневая гипертрофия.
4) Для лечения любых дермальных или эпидермических гиперпролифераций, которые бывают злокачественные или доброкачественные, вирусного происхождения или нет, таких, как обыкновенные простые бородавки, плоские бородавки и напоминающая бородавку эпидермодисплазия, оральные или внутрипротоковые папилломы, и гиперпролифераций, которые могут быть вызваны ультрафиолетовыми лучами, особенно в случае базалиом и спинноклеточных эпителиом.
5) Для лечения других дерматологических нарушений, таких, как пузырчатые дерматозы и коллагеновые болезни.
6) Для лечения некоторых офтальмологических нарушений, особенно корнеопатий.
7) Для восстановления или борьбы против старения кожи, которое является фотоиндуцированным или возрастным, или для уменьшения пигментаций и актиновых кератозов, или для борьбы с любыми патологиями, связанными с возрастным или актиновым старением.
8) Для предотвращения или вылечивания стигматов эпидермической и/или дермической атропии, вызванной локальными или системными кортикостероидами, или любой другой формы кожной атрофии.
9) Для предотвращения или лечения нарушений заживления или для предотвращения или восстановления рубцов на коже при ее растяжении.
10) Для лечения нарушений жировой функции, например, таких, как гиперсеборея акне или обыкновенная себорея.
11) Для лечения или профилактики канцерозных или предканцерозных состояний.
12) Для лечения воспалительных болезненных состояний, таких, как аритрит.
13) Для лечения любого болезненного состояния вирусного происхождения, на уровне кожи или общего, такого, как гепатиты.
14) Для предупреждения или лечения алопеции.
15) Для лечения дерматологических или общих заболеваний с иммунологическим компонентом.
16) Для лечения заболеваний сердечно-сосудистой системы, таких, как артериосклероз и тромбоцитопения.
17) Для лечения нейродегенеративных заболеваний, таких, как болезнь Альцгеймера.
При применении в вышеуказанных областях терапии композиция согласно изобретению предпочтительно может включать другие активные агенты, такие, как ретиноиды, агенты против свободных радикалов, производные витамина D, кортикостероиды или эстрогены, антиоксиданты, α- гидрокси- или α- кето-кислоты и их производные, или еще блокаторы калиевых каналов.
Объектом настоящего изобретения также является применение композиции согласно изобретению в или для получения косметической или фармацевтической композиции, предназначенной для модулирования апоптоза и преимущественно предназначенной для вышеописанных предохранительных и/или лечебных обработок.
Ретиноиды могут быть природного или синтетического происхождения. Из ретиноидов можно назвать 9-цис-ретиноевую кислоту, полностью транс-конфигурации ретиноевую кислоту.
Из витаминов D или их производных особенно можно назвать производные витамина D2 или D3 и, в особенности, 1,25-дигидрокси-витамин D3.
Из агентов против свободных радикалов особенно можно назвать α- токоферол, дисмутазапероксид, убиквинол или некоторые агенты образования хелатных соединений металлов.
Из α- гидрокси- или α- кето-кислот или их производных особенно можно назвать кетолейцин, кетоизолейцин, кетовалин, 2-оксобутират, 4-метилтио-2-оксобутановую кислоту; молочную, яблочную, лимонную, гликолевую, миндальную, винную, глицериновую, аскорбиновую кислоты или производные салициловой кислоты или их соли, амиды или эфиры.
Из блокаторов калиевых каналов особенно можно назвать миноксидил (2,4-диамино- σ - пиперидинопиримидин-3-оксид) и его производные.
Композицию согласно изобретению можно вводить энтеральным, парентеральным, локальным или окулярным путем. Предпочтительно композиция упакована в форме, пригодной для применения системным путем (для инъекции или вливания).
Для введения энтеральным путем, композиция, преимущественно фармацевтическая композиция, может находиться в формах таблеток, желатиновых капсул, драже, сиропов, суспензий, растворов, порошков, гранулятов, эмульсий, микросфер или наносфер или липидных или полимерных пузырьков, которые позволяют происходить контролируемому высвобождению лекарства. Для введения парентеральным путем композиция может находиться в форме растворов или суспензий для вливания или для инъекции.
Лекарственное средство согласно изобретению обычно вводят в суточной дозе около 0,001- 100 мг/кг массы тела в 1-3 приема.
При введении топическим путем композиция согласно изобретению преимущественно предназначена для обработки кожи и слизистых оболочек и может находиться в форме мазей, кремов, молочка, помад, пудр, пропитанных тампонов, растворов, гелей, спреев, лосьонов или суспензий. Она также может находиться в форме микросфер или наносфер или липидных или полимерных пузырьков или полимерных "лоскутов" и гидрогелей, позволяющих происходить контролируемому высвобождению лекарственного средства. Для введения локальным путем эта композиция может находиться либо в безводной форме, либо в водной форме.
Для введения окулярным путем пригодны, главным образом, примочки для глаз.
Фармацевтическая композиция, предназначенная для введения локальным или окулярным (глазным) путем, содержит метиональ, диальдегид малоновой кислоты или любой фактор, оказывающий влияние на внутриклеточное содержание метионаля или диальдегида малоновой кислоты, в концентрации предпочтительно 0,001-5% в расчете на общую массу композиции.
Композиция согласно изобретению также находит применение в области косметики, в особенности для ухода за телом и волосами и особенно для обработки склонной к акне кожи, для отращивания волос, против выпадения волос, для защиты от вредоносных воздействий солнца или для обработки физиологически сухой кожи, для предотвращения и/или борьбы с фотоиндуктируемым или возрастным старением.
Наконец, объектом настоящего изобретения является способ предотвращения и/или борьбы против фотоиндуктируемого или возрастного старения кожи, отличающийся тем, что на кожу наносят косметическую композицию, вызывающую апоптоз, такую, как описанная выше.
В области косметики, композиция согласно изобретению предпочтительно может содержать ретиноиды, витамины D или их производные, кортикостероиды, агенты против свободных радикалов, α- гидрокси или α- кето-кислоты и их производные, или еще блокаторы ионных каналов. Эти различные продукты, используемые в композиции настоящего изобретения, являются такими, как описанные выше.
Косметическая композиция согласно изобретению может находиться особенно в форме крема, молочка, лосьона, геля, микросфер или наносфер или липидных или полимерных пузырьков, мыла или шампуня.
Концентрация метионаля, диальдегида малоновой кислоты или любого фактора, оказывающего влияние на внутриклеточное содержание метионаля или диальдегида малоновой кислоты, в косметической композиции предпочтительно составляет 0,0001-3 мас.% в расчете на массу композиции.
Косметическая или фармацевтическая композиция согласно изобретению, кроме того, может содержать инертные или также фармакодинамически или косметически активные добавки или сочетания этих добавок и в особенности следующие: смачиватели; депигментирующие агенты, такие, как гидрохинон, азелаиновая кислота, кофейная кислота или койевая кислота; мягчители; гидратирующие агенты, как глицерин, полиэтиленгликоль с молекулярной массой 400 (ПЭГ 400), тиаморфолин и его производные или мочевина; антисеборейные агенты или агенты против акне, такие, как S-карбоксиметилцистеин, S-бензилцистеамин, их соли и их производные, или бензоилпероксид; антибиотики, такие, как эритромицин и его сложные эфиры, неомицин, клин-дамицин и его сложные эфиры, тетрациклины; противогрибковые агенты, такие, как кетоконазол или полиметилен-4,5-изотиазолин-3-оны; агенты, благоприятствующие отрастанию волос, такие, как миноксидил (2-,4-диамино-6-пиперидино-пиримидин-3-оксид) и его производные, диазоксид (7-хлор-3-метил-1,2,4-бензотиадиазин-1,1-диоксид) и фенитоин (5,4-дифенил-имидазолидин-2,4-дион); противовоспалительные агенты нестероидного типа, каротиноиды и особенно β- каротин; антипсориатические агенты, такие, как антралин и его производные и, наконец, эйкоза-5,8,11,14-тетрановая кислота и эйкоза-5,8,11-три-новая кислота, их эфиры и амиды.
Композиция согласно изобретению также может содержать улучшающие вкус агенты; консерванты, такие, как эфиры парагидроксибензойной кислоты, стабилизаторы, регулирующие влажность агенты, регулирующие pH агенты, модификаторы осмотического давления, эмульгаторы, УФ-А- и УФ-Б - фильтры, антиоксиданты, такие, как α- -токоферол, бутилгидроксианизол или бутилгидрокситолуол.
Ниже приводятся примеры, данные в качестве иллюстрации и никоим образом не ограничивающие объема охраны изобретения.
Пример 1
Воздействие метаболитов на рост клеток HeLa
Клетки HeLa (0,5 • 106 на чашку Петри) культивируют в 3 мл минимальной поддерживающей среды Игла, содержащей 10 мас.% диализованной плодной телячьей сыворотки. Спустя 4 часа в каждую из трех чашек добавляют метиональ (от 10 мкмоль до 1 ммоль), метионол (от 10 мкмоль до 20 ммоль), метилтиопропионовую кислоту (МТПК, от 1 мкмоль до 20 ммоль), L-метионин (от 1 мкмоль до 20 ммоль) или 4-метилтио-2-оксобутановую кислоту (МТОБ, от 1 мкмоль до 20 ммоль). После выдерживания в течение трех дней при 37oC клетки промывают два раза в забуференном фосфатом физиологическом растворе (ЗФР) с pH 7,5 и выделяют из того же типа буфера.
Рост клеток оценивают путем определения содержания протеинов (см. метод, описанный Lowry О. Н., Rosebrouch N.J., Farr A.L. и Randall R.J., J. Biol. Chem. , 193, 265-275 (1951)) или содержания ДНК в лизатах, используя раствор бисбензимидтригидрохлорида (ХЕХСТ 33258) (см. Jarvis W.D., Kolesnick R.N., Fornari F.A., Traylor R.S., Gewirtz D.A. и Grant S., Proc. Natl. Acad. Sci. U. S.A., 91, 73-77 (1994)), или путем определения активности молочной дегидрогеназы, используя 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолий-бромид (МТТ) (см. Mosmann Т., J. of Immunology Methods, 65, 55-63 (1983)).
Результаты представлены в табл. 1. Каждая приведенная величина представляет собой среднее из трех или четырех экспериментов для оценки по содержанию протеинов.
ИК50 соответствует концентрации продукта, необходимой для достижения ингибирования роста клеток на 50%.
Оценочные результаты по измерению содержания ДНК или по определению активности молочной дегидрогеназы сравнимы с таковыми, указанными в табл. 1.
В табл. 1 показано отличие ИК50 для метионаля по сравнению с ИК50 его продуктов или предшественников.
Пример 2
Клетки HeLa (0,5 • 106 на чашку Петри) культивируют в 3 мл минимальной поддерживающей среды Игла без метионина (Met), содержащей 10 мас.% диализованной плодной телячьей сыворотки. Спустя 4 часа добавляют 2-оксобутират (от 10 ммоль до 40 ммоль) в присутствии 2 ммоль 4-метилтио-2-оксобутановой кислоты (МТОБ). После выдерживания в течение трех дней при температуре 37oC клетки промывают два раза в забуференном фосфатом физиологическом растворе (ЗФР) с pH 7,5 и извлекают из того же типа буфера. Рост клеток определяют таким же образом, как и в предыдущем примере.
2-Оксобутират представляет собой хорошо известный субстрат комплекса дегидрогеназа-оксокислота с разветвленной цепью (BCOADC) (Km 18 мкмоль). Используемая индивидуально в концентрации 2 ммоль МТОБ вызывает подавление роста на 72%. Результаты показывают, что 2-оксобутират способен уменьшать это ингибирование роста. Исходя из 10 ммоль 2-оксобутирата ингибирование уменьшается в 2-3 раза. Таким образом, устанавливают, что активность BCOADC в отношении превращения МТОБ в метиональ смещается к другому субстрату, такому, как 2-оксобутират, который уменьшает ингибирование роста.
Пример 3
Воздействие метионаля на фрагментацию ДНК в клетках BAF3
Используемые клетки соответствуют лимфоцитарной клеточной линии мыши BAF3, которая требует интерлейкин-3 (ИЛ-3) для роста и которая подвергается апоптозу (более 80% клеток) в отсутствие ИЛ-3 в течение 16 часов (см. Collins M. K.L., Marvel J., Malde P. И Lopez-Rivas A., J. Exp. Med., 176, 1043-1051 (1992)).
3 • 10 6 Клеток BAF3 культивируют в 6 мл культуральной среды, содержащей ИЛ-3, в чашках Петри в присутствии различных концентраций (от 200 до 800 мкмоль) метионаля или пропаналя, который представляет собой субстрат альдегид-дегидрогеназы. После контактирования в течение 8 часов клетки промывают три раза в ЗФР с pH 7,5. Клетки лизируют в 2 мл 0,1% Тритона X-100, 20 ммоль ЭДТК (этилендиаминтетрауксусная кислота), 5 ммоль ТРИС с pH 8 и затем центрифугируют при ускорении 30000 g при 4oC в течение 30 минут. Супернатанты отделяют путем декантации и подвергают следующим анализам:
В качестве сравнения те же самые культивирования осуществляют в среде либо только с ИЛ-3 (+ ИЛ-3), либо без ИЛ-3 (- ИЛ-3).
Качественный анализ полученных фрагментов ДНК осуществляют по методу, особенно описанному в публикации Jarvis W.D., Kolesnick R.N., Fornari F.A., Traylor R. S. , Gawirtz D.A. и Grant S., Proc. Natl. Acad. Sci. U.S.A., 91, 73-77 (1994). Супернатанты обрабатывают с помощью рибонуклеазы A (20 мкг/мл) в течение 1 часа при 37oC и с помощью протеиназы K (100 мкг/мл). ДНК очищают путем экстракции фенолом и осаждения этанолом. В конечном экстракте, фрагменты ДНК с низкими молекулярными массами анализируют путем электрофореза на 1%-ном геле агарозы. После электрофореза (60 вольт, 3 часа) гели окрашивают этидиумбромидом.
Результаты ясно показывают, что апоптоз индуктируется метионалем; полученный гель имеет вид "лестницы" из множественных фрагментов ДНК размерами от 180 до 200 пар оснований, типичных для индукции апоптоза. В случае пропаналя гель не имеет этой характеристики.
Анализ осуществляют с помощью спектрофлюорометрии для определения количества полученных фрагментов ДНК (величиной менее 3 тысяч нуклеотидов). К 2 мл супернатанта добавляют 1 мл раствора бисбензимидтригидрохлорида (XEXCT 33258) (1 мкг/мл) в 3 ммоль хлорида натрия, 1 ммоль ЭДТК, 10 ммоль ТРИС с pH 8. Полученные растворы анализируют путем флюорометрии (λ возбуждения = 365 нм, λ эмиссии = 460 нм). Количества ДНК рассчитывают относительно высокоочищенной ДНК (0,1-1 мкг в 2 мл буфера для лизиса), обработанной как указано выше, и выражают в 10-9 г ДНК, извлеченной из 3 • 106 клеток.
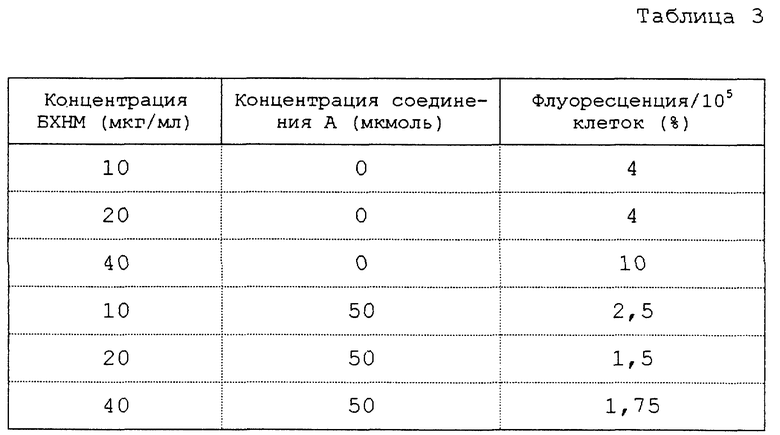
Получают результаты, представленные в табл. 2.
Таким образом, повышение количества фрагментов ДНК, обнаруженных в клетках, которые обработаны ИЛ-3 и метионалем, подобно таковому, обнаруженному в том случае, когда клетки были помещены в среду без ИЛ-3.
Пример 4
Воздействие N, N-бис(2-хлорэтил)-N-нитрозомочевины (БХНМ) и ингибитора трансаминазы, принимающей участие в превращении 4-метилтио-2-оксобутановой кислоты в метионин, нa продуцирование реакционноспособных оксигенированных видов (H2O2 и HO.)
1,5•105 клеток BAF3 (клеточная линия, такая, как описанная выше), высеянных в 3 мл культуральной среды, содержащей ИЛ-3 (модифицированная по способу Дульбекко среда Игла, содержащая 6% плодной телячьей сыворотки и 5% среды, кондиционированной клетками Wehi-3В, которую используют в качестве источника ИЛ-3, описанной Collins и др. , J. Exp. Med, 176, 1043-1051 (1992)), обрабатывают с помощью 10 мкмоль 2',7'-дихлорфлуоресцеиндиацетата (обычно называемого DCFH-DA и полученного Molecular Probes Inc.). После инкубации в течение 1 часа при 37oC клетки промывают с помощью ЗФР. За 10 минут до анализа по флуоресценции дихлорфлуоресцеина (ДХФ) с помощью проточной цитометрии добавляют 3 мкг/мл пропидиумиодида. Инкубацию осуществляют в присутствии различных концентраций БХНМ и в присутствии или нет соединения A в концентрации 50 мкмоль (которое соответствует соединению формулы (9), когда X означает радикал -OH). Этот метод позволяет получить процент флуоресценции, достигаемый за счет реакции реакционноспособных оксигенированных видов (H2O2 и HO.) с DCFH-DA. Проточную цитометрию реализуют с помощью проточного цитометра FA-Cscan (Becton Dickinson, San Jose, CA, США). Результаты представлены в табл. 3.
Таким образом, эти результаты показывают, что соединение A, которое позволяет увеличивать содержание метионаля, подавляет увеличение количества HO., возникающее вследствие повышения концентрации БХНМ. Таким образом, является вероятным тот факт, что в этом случае происходит реакция метионаля с имеющимися радикалами HO., приводящая к образованию диальдегида малоновой кислоты, который тогда вызывает апоптоз.
Пример 5
Воздействие БХНМ и ингибитора трансаминазы, принимающей участие в превращении 4-метилтио-2-оксобутановой кислоты в метионин, на апоптоз
Разрывы нитей ДНК маркируют с помощью биотинилированного dUTP (уридинтрифосфата) (определяемого с помощью авидинфлуоресцеина) in situ в пермеабилизированных и фиксированных клетках, используя тест концевой дезоксинуклеотидил-трансферазы ДНК (TdT), такой, как описанный Gorczyca и др. Cancer Res., 53, 1945-1951 (1993).
1,5 • 106 Клеток BAF3 (клеточная линия, такая, как описанная выше) высевают в 3 мл культуральной среды, содержащей ИЛ-3 (модифицированная по способу Дульбекко среда Игла, содержащая 6% плодной телячьей сыворотки и 5% кондиционированной клетками Wehi-3В среды, используемой в качестве источника ИЛ-3). Клетки инкубируют в присутствии 50 мкмоль соединения A, 40 мкг/мл БХНМ, смеси этих двух продуктов (50 мкмоль соединения A+40 мкг/мл БХНМ) или в отсутствие этих двух соединений (контроль). После инкубации в течение 24-х часов, клетки промывают с помощью ЗФР и фиксируют в формальдегиде, затем в этаноле, и оставляют на 3 дня при температуре -20oC. Затем клетки повторно суспендируют в 50 мкл раствора, содержащего 0,1 мкмоль какодилата натрия, pH 7,5, 1 ммоль хлорида кобальта, 0,1 ммоль дитиотреитола, 0,05 мг/мл бычьего сывороточного альбумина, 10 единиц TdT (из тимуса теленка; Боерингер), 0,5 нмоль биотин-16 dUTP (из тимуса теленка; Боерингер), 0,5 нмоль аденозинтрифосфата (АТФ), 0,5 нмоль цитидинтрифосфата (ЦТФ) и 0,5 нмоль гуанозинтрифосфата (ГТФ), и инкубируют в течение 1 часа при 37oC. После промывки с помощью ЗФР клетки снова суспендируют в 100 мкл четырехкратного объема буфера SSC (0,15 моль хлорида натрия, 0,015 моль цитрата натрия), содержащего 2,5 мкг/мл авидин-флуоресцеин-изотиоцианата (Сигма), 0,1% (масса/объем) рибонуклеазы A, 0,1% ТРИТОНа • 100 и 5% (масса/объем) обезжиренного молока, и выдерживают в течение 30 минут при комнатной температуре в темноте. Эти клетки промывают, затем суспендируют в 1 мл ЗФР, содержащего 3 мкг/мл пропидиумиодида. Проточную цитометрию реализуют с помощью проточного цитометра FACScan (Becton, Dickinson, San Jose, CA, США).
Результаты представлены в табл. 4.
В этих дозах индивидуальные продукты вызывают в слабой степени апоптоз, напротив, их смесь индуктирует в высокой степени апоптоз (синергизм). Этот результат подтверждает приведенные в табл. 3 результаты и относящиеся к ним выводы.
Пример 6
Установление наиболее эффективной терапевтической композиции для лечения мышей, которым пересажены клетки меланомы
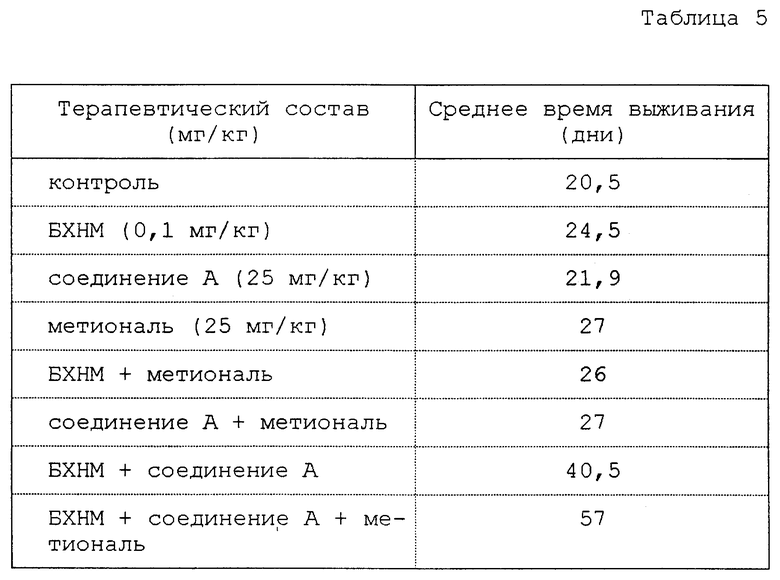
В день 0,105 мышиных меланомных клеток B16F1 инъецируют мышам B6D2F1 (фирма IFFA CREDO, Франция). В день 1, и это непрерывно в течение 15 дней, один раз в день этим мышам вводят путем инъекции различные терапевтические составы, указанные в табл. 3. Контроль соответствует мышам, которым не вводят терапевтического состава.
В табл. 5 представлены результаты, которые соответствуют средним величинам, получаемым в случае трех обработанных мышей.
Для составов из нескольких соединений, используемые дозы каждого из соединений идентичны таковым дозам, когда соединения используют индивидуально.
Время выживания считают начиная со дня 0, указанного выше, и оно соответствует среднему для мышей, не проживших более 60 дней.
БХНМ соответствует N,N-бис(2-хлорэтил)-N-нитрозомочевине.
Соединение A соответствует соединению формулы (9), когда X означает радикал -OH.
Таким образом, замечают, что два последних состава особенно эффективны, поскольку они в значительной степени увеличивают время выживания этих мышей. Из этих двух составов последний (дополненный метионалем) позволяет трети мышей жить более 60 дней.
Пример 7
Поступают как и в предыдущем примере, изменяя составы и число обработанных мышей. В табл. 6 представлены эти данные и полученные результаты.
Время выживания считают, начиная со дня 0, указанного выше, и оно соответствует среднему для мышей, не проживших более 60 дней.
Для последнего состава, дозы соответствуют таковым соединений, используемых индивидуально. Процент выживших с самым длительным сроком жизни соответствует проценту мышей, проживших свыше 60 дней. Таким образом, замечают, что два последних состава и особенно последний, очень эффективны.
Пример 8
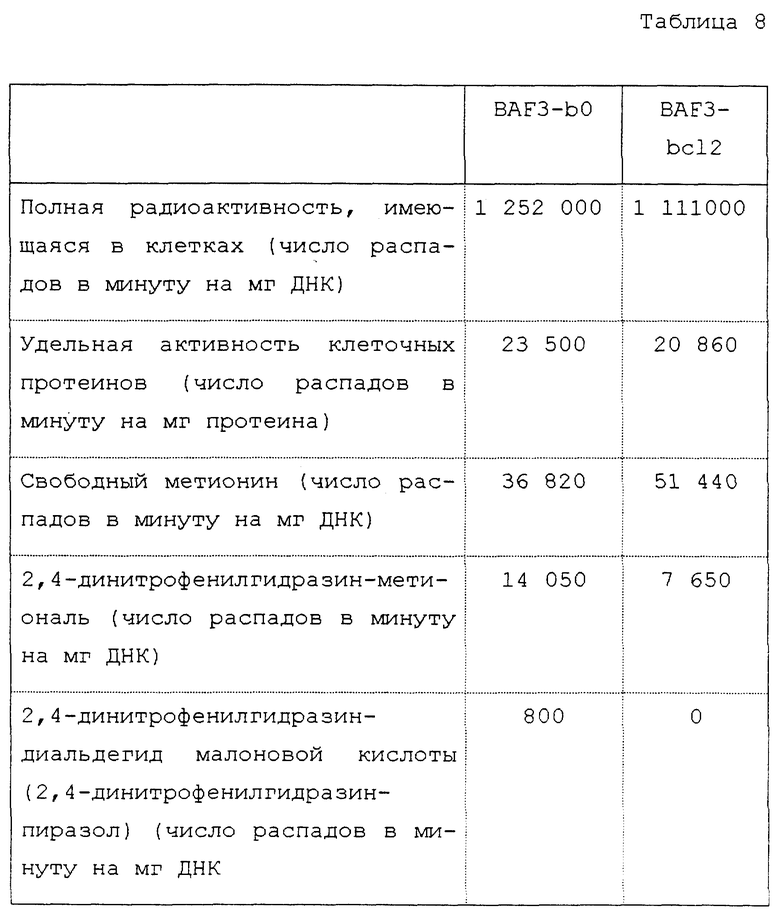
Воздействие метионаля на индукцию апоптоза в клетках BAF3-b0 и BAF3-bcl2
Используемые клетки соответствуют лимфоцитарной клеточной линии BAF3, такой, как описанная выше. Клетки BAF3-bcl2 соответствуют клеткам BAF3, трансфектированным с помощью гена bc12; клетки BAF3-b0 соответствуют клеткам BAF3, нетрансфектированным с помощью гена bcl2. Как уточнено выше, клетки BAF3-b0 подвергаются апоптозу (более 80% клеток) в отсутствие ИЛ-3 за 16 часов. Напротив, клетки BAF3-bcl2, которые, следовательно, трансфектированы с помощью гена bcl2, не показывают никакого признака апоптоза в отсутствие ИЛ-3. Поэтому они представляют собой хорошую модель для установления этапа апоптоза, блокируемого в этих клетках, и его возможной корреляции с ингибированием синтеза диальдегида малоновой кислоты.
Клетки BAF3-b0 или BAF3-bcl2 маркируют согласно методу, описанному Wright S. и др., J. of Cell. Bio-chem., 48, 344-355 (1992), инкубируя 2,5 • 105 клеток/мл с 0,5 микрокюри [3H]-тимидина в течение 40 часов при 37oC. После двух промывок культуральной средой 2,5 • 106 клеток культивируют в присутствии метионаля.
После инкубации в течение 8 часов эти клетки извлекают путем центрифугирования при ускорении 400 g в течение 5 минут и промывают 3 раза с помощью ЗФР. Извлеченные в виде осадка после центрифугирования клетки лизируют в 2 мл раствора, содержащего 0,1% ТРИТОНа X-100, 20 ммоль ЭДТК, 5 ммоль ТРИС с pH 8, и центрифугируют при ускорении 30 000 g при 4oC в течение 30 минут. Супернатанты отделяют и осадки после центрифугирования растворяют в 0,3 мл 0,5 н раствора гидроксида натрия. Аликвоты культуральной среды (1 мл), супернатанта (0,3 мл) и растворенного осадка после центрифугирования (0,1 мл) анализируют в сцинтилляционном счетчике. Процент фрагментов ДНК рассчитывают следующим образом:
число распадов в минуту для культуральной среды +
число распадов в минуту для супернатанта, деленное на
число распадов в минуту для культуральной среды +
число распадов в минуту для супернатанта +
число распадов в минуту для растворенного осадка.
Результаты:
добавление возрастающего количества метионаля (0; 50; 100; 200; 300; 400 мкмоль) в инкубационную среду повышает процент фрагментов ДНК вплоть до максимума, для 400 мкмоль метионаля, 26% по сравнению с 7% для клеток BAF3-b0, не обработанных метионалем (контроль). Для клеток BAF3-bcl2, обработанных эквивалентными количествами метионаля, фрагменты ДНК достигают максимума 7%, для 400 мкмоль метионаля, по сравнению с 3% для контроля.
Эти результаты ясно показывают, что добавка метионаля не позволяет устранять ингибирование апоптоза, вызванного геном bc12 в клетках BAF3-bcl2.
Во время индукции апоптоза вследствие отсутствия (недостатка) ИЛ-3 обнаруживают, что метиональ превращается в диальдегид малоновой кислоты за счет реакции β- гидроксилирования с помощью HO.. Следовательно, было осуществлено определение H2O2 и HO. в клетках BAF3-b0 и BAF3- bcl2.
Пример 9
Определение реакционноспособных оксигенированных видов (H2O2 и OH.) методом проточной цитометрии
Используемые клетки соответствуют лимфоцитарной клеточной линии BAF3, такой, как описанная выше. Клетки BAF3-bcl2 соответствуют клеткам BAF3, трансфектированным с помощью гена bc12; клетки BAF3-b0 соответствуют клеткам BAF3, не трансфектированным с помощью гена bc12.
1,5 • 106 Клеток BAF3-b0 или -bc12, высеянных в 3 мл культуральной среды, содержащей ИЛ-3, обрабатывают с помощью 10 мкмоль дихлорфлуоресцеиндиацетата (DCFH-DA). После инкубации в течение 1 часа при 37oC клетки промывают с помощью ЗФР; за 10 минут до анализа по флуоресценции дихлорфлуоресцеина (ДХФ) путем проточной цитометрии добавляют 3 мкг/мл пропидиумиодида, как в примере 4. Проточную цитометрию реализуют с помощью проточного цитометра FACScan (Becton Dickinson, San Jose, CA, США).
Результаты представлены в табл. 7
Следовательно, даже если для клеток BAF3-bcl2 существует тенденция к большему количеству реакционноcпособных оксигенированных видов, чем в случае клеток BAF3-b0, то это различие незначительное.
Следовательно, возможно, что клетки BAF3-bcl2 обладают дефектом в синтезе метионаля и/или диальдегида малоновой кислоты.
Пример 10.
Анализ маркированных 14C продуктов, производных [14C] МТОБ, в клетках BAF3-b0 и BAF3-bcl2
Используемые клетки, следовательно, идентичны таковым предшествующего примера.
[14C] -МТОБ получают путем окислительного дезаминирования [14C]-метионина, такого, как описанный Ogier G. и др., Biochem. Pharmacol., 45, 1631-1644 (1993). [14C]-МТОБ (5 • 106 распадов в минуту, что соответствует 38,2 нмоль) добавляют к суспензии клеток BAF3-b0 или BAF3-bcl2 (2,4 • 106 клеток/мл) в модифицированной по способу Дульбекко среде Игла, содержащей 6% плодной телячьей сыворотки и 5% ИЛ-3. Спустя 39 часов, клетки промывают два раза в ЗФР и снова суспендируют по 9•105 клеток на мл. К 108 клеток добавляют [U14C]-MTOБ (1,9•106 распадов в минуту, что соответствует 14,5 нмоль) и спустя 8 часов клетки извлекают путем центрифугирования при ускорении 400 g в течение 5 минут. Осадки клеток после центрифугирования солюбилизируют в 1,5 мл 0,5 н раствора гидроксида натрия в течение 30 минут при 60oC. Имеющуюся в клетках полную радиоактивность определяют на аликвотах по 10 мкл. После этого к полученному щелочному гидролизату добавляют хлорную кислоту в конечной концентрации 0,5 н, затем 200 мкмоль 2,4-динитрофенилгидразина (выпускается фирмой МЕРК). Смесь нагревают при 70oC в течение 30 минут, затем центрифугируют при ускорении 400 g в течение 5 минут. Осадок растворяют в 1 мл 0,5 н раствора гидроксида натрия, затем определяют радиоактивность и содержание протеинов. К супернатанту добавляют гидроксид натрия до достижения pH 10. Маркированные метаболиты экстрагируют этилацетатом и органическую фазу сушат, подкисляют и экстрагируют дихлорметаном. Маркированные метаболиты в органической фазе отделяют и идентифицируют с помощью высокоэффективной тонкослойной хроматографии, сравнивая с производными 2,4-динитрофенилгидразина стандартных соединений, затем квантифицируют путем хроматографии с радиометрическим детектированием и продувкой.
Результаты представлены в табл. 8.
Таким образом, оказывается, что полная радиоактивность, отнесенная к идентичному количеству ДНК, подобная в двух типах клеток после инкубации в течение 47 часов. То же самое имеет значение для активности метионина клеточных протеинов. В том, что касается свободного метионина, то увеличение на 40% радиоактивности обнаруживают в клетках BAF3-bcl2 по сравнению с таковой в клетках BAF3-b0. Присутствующая в метионале радиоактивность на 80% больше в клетках BAF3-b0, чем в клетках BAF3-bcl2. Это позволяет подчеркнуть, что в клетках BAF3-bcl2 уменьшение образования метионаля из МТОБ сопровождается увеличением образования метионина. Когда определяют образование маркированного диальдегида малоновой кислоты, то оно соответствует 800 распадов в минуту на мг ДНК в клетках BAF3-b0, тогда как никакой радиоактивности для диальдегида малоновой кислоты не обнаруживают в экстрактах клеток BAF3-bcl2. Клетки BAF3-bcl2, следовательно, также снижают образование диальдегида малоновой кислоты из метионаля. Пример 8 четко демонстрирует, что это снижение не является вызванным вследствие уменьшения реакционноспособных оксигенированных видов в клетках BAF3-bcl2 по сравнению с клетками BAF3-b0. Следовательно, можно сделать вывод, что ген bcl2 кроме того, что вызывает уменьшение трансформации МТОБ в метиональ, также отрицательно влияет на реакцию β-гидроксилирования, в результате которой метиональ превращается в диальдегид малоновой кислоты. Следовательно, любой продукт, который модулирует внутриклеточное содержание метионаля или продукта его метаболизма, диальдегида малоновой кислоты, можно считать модулятором апоптоза.




Изобретение относится к области медицины и касается соединения - метионаля, диальдегида малоновой кислоты - и любого фактора, оказывающего влияние на внутриклеточное содержание метионаля или диальдегида малоновой кислоты в качестве лекарственного средства для модулирования явления запрограммированной гибели клеток (апоптоз). Изобретение также относится к фармацевтической или косметической модулирующей апоптоз композиции, содержащей в качестве активного агента соединение, выбираемое среди метионаля, диальдегида малоновой кислоты и любого фактора, оказывающего влияние на внутриклеточное содержание метионаля или диальдегида малоновой кислоты, в сочетании с фармацевтически или косметически приемлемой основой. Наконец, объектом изобретения является способ предотвращения и/или борьбы против фотоиндуктируемого или возрастного старения кожи. Предложенные композиции более эффективны для лечения различных дерматологических поражений. 3 с. и 16 з.п.ф-лы, 8 табл., 1 ил.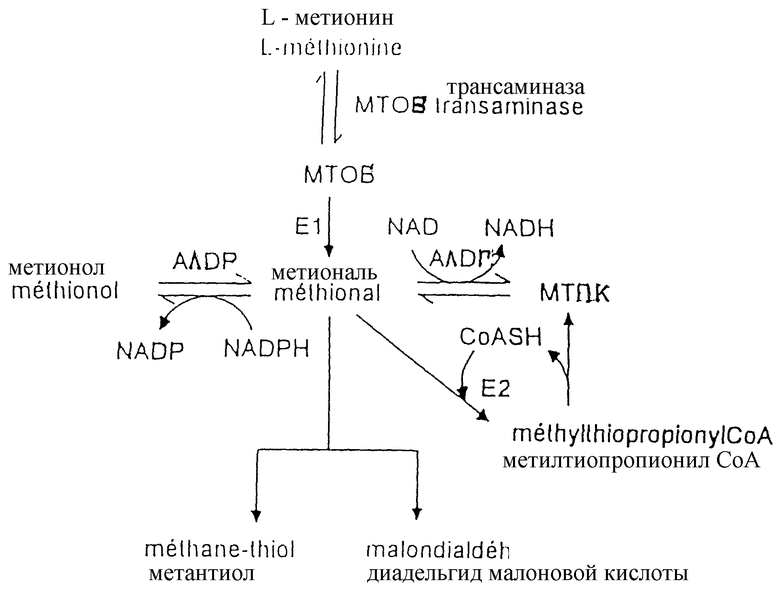
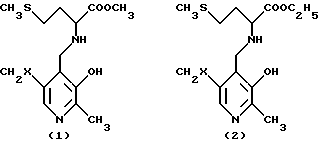
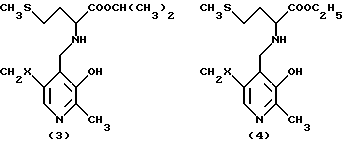
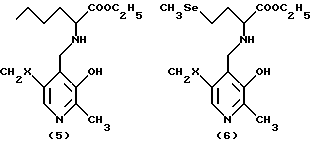
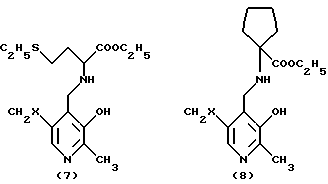
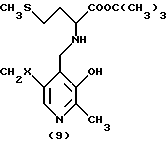
в которых Х - -ОН или -ОРО3Н2.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Фотопротектор для лечения ожогов сетчатой оболочки глаза | 1983 |
|
SU1375259A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Антигеморрагическое средство "Эмоксипин" для рассасывания внутриглазных кровоизлияний | 1980 |
|
SU1537247A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| УСТРОЙСТВО ДЛЯ ОТБОРА ПРОБ ЖИДКОСТИ ИЗ ТРУБОПРОВОДА | 2016 |
|
RU2673530C2 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Способ ликвидации напорной водозаборной скважины | 2015 |
|
RU2612396C1 |
Авторы
Даты
2000-12-10—Публикация
1995-12-22—Подача