Изобретение относится к области исследования свойств воды, используемой в системах водоснабжения, и может быть применено при эксплуатации охлаждающих систем, систем горячего водоснабжения и теплоснабжения.
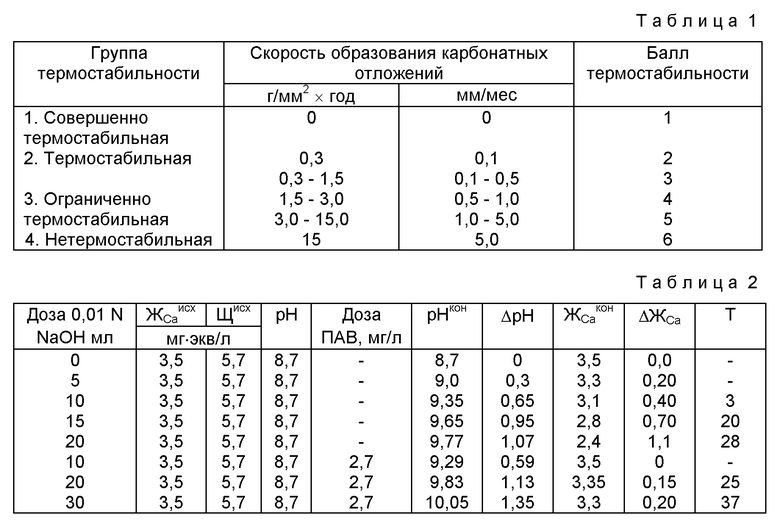
Известно свойство воды выделять из своего объема в кристаллическом виде соли жесткости, в частности карбонат кальция. Это происходит при превышении ионами кальция и карбонат-ионами произведения растворимости карбоната кальция. При повышении температуры способность воды к выделению из своего объема кристаллической фазы карбоната кальция увеличивается. В природных водах, используемых в системах водоснабжения, соединения угольной кислоты присутствуют в виде недиссоциированных молекул H2CO3. бикарбонатных ионов HCO3 - и карбонатных ионов CO3 2-. Количественные соотношения между отдельными составляющими определяются уравнениями первой и второй ступеней диссоциации угольной кислоты. Константы диссоциации угольной кислоты и произведение растворимости карбоната кальция зависят от температуры, и при ее увеличении растворимость карбоната кальция уменьшается, а концентрация карбонатных ионов увеличивается, как за счет термического разложения бикарбонатов, так и за счет увеличения значений констант диссоциации соединений угольной кислоты. При этом способность воды к осаждению из своего объема кристаллической фазы карбоната кальция увеличивается. Для характеристики способности воды выделять из своего объема карбонат кальция используется термин "термостабильность". В источнике (В. Е. Терновцев. Магнитные установки в системах оборотного водоснабжения. Киев. 1976 г., 88 с., стр.17) приведена шестибальная шкала термостабильности воды.
Таким образом под термостабильностью понимается такое свойство воды, которое характеризует способность воды при ее нагреве в системе водоснабжения выделять из своего объема и откладывать на поверхностях трубопроводов или теплообменников соли жесткости. Термостабильность воды может быть оценена количественно как скоростью образования отложений, так и баллами.
Существует также понятие стабильная вода (В.А. Клячко, И.Э. Апельцин. Подготовка воды для промышленного и городского водоснабжения. М.: Стройиздат, 1962, 819 с.). Это вода с таким химическим составом, при котором произведение концентрации накипеобразующих ионов кальция и карбонат иона равно произведению растворимости карбоната кальция и из воды не будет выделяться осадок карбоната кальция к она не будет растворять CaCO3.
Известен способ оценки стабильности води (ГОСТ 3313-46. Вода хозяйственно-питьевого и промышленного водоснабжения. Методы технологического анализа: Определение стабильности воды), при котором исследуемую воду оценивают но ее поведению при контакте с карбонатом кальция. По этому методу сначала определяют общую щелочность воды, затем воду помещают в сосуд с карбонатом кальция в кристаллической форме, после чего воду встряхивают в течение одного часа. После встряхивания снова определяют щелочность воды. По величине щелочности исследуемой воды до и после встряхивания с карбонатом кальция определяют показатель стабильности Co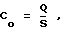
где Co - величина общей щелочности воды до ее встряхивания с карбонатом кальция,
S - величина общей щелочности воды после ее встряхивания с карбонатом кальция.
Если Co больше 1, то вода способна к осаждению карбоната кальция из своего объема, а если меньше, то вода растворяет карбонат кальция.
Использование данного способа для оценки свойства воды отлагать карбонат кальция в системах горячего водоснабжения или системах охлаждения затруднено или даже невозможно в силу следующих причин.
Показатель стабильности характеризует способность воды отлагать или растворять карбонат кальция, и не характеризует скорость или объем образовавшейся кристаллической фазы. Испытываемая вода должна быть термостатирована, т. е. иметь ту же температуру, что и вода в реальной системе, кроме этого в испытываемой воде должно быть выдержано содержание углекислого газа как и в реальной системе. В то же время при способности испытываемой води отлагать карбонат кальция полученный результат будет занижен на величину образовавшейся кристаллической фазы.
Таким образом вода, добавляемая в систему, при испытании ее на стабильность не характеризует скорость образования отложений в тех системах водоснабжения, где она будет подвергнута нагреву, т.к. углекислотно-кальциевое равновесие исследуемой воды отличается от углекислотно- кальциевого равновесия воды в реальной системе, а циркулирующая в системе вода при ее исследовании на способность к осаждению карбоната кальция не вполне характеризует скорость или величину отложений ввиду протекания процесса осаждения.
Существует также способ оценки термостабильности воды (а.с. СССР N 1318901, кл. G 01 N 27/50), при котором исследуемую воду помещают в катодную камеру электролизера, в течение одного часа пропускают электрический ток плотностью
i=0,33 (T-283), A/м2
где T - температура, для которой оценивают массу осадка, отложившегося на катоде, по величине которого судят о термостабильности анализируемой воды (определяют массу осадка, отложившегося на катоде).
Этот способ позволяет оценить накипеобразующие свойства воды для разных температур ее предполагаемого нагрева. Однако этот способ не позволяет оценить стабильность воды при ее нагреве в системах охлаждения, т.к. не учитывает упаривание воды в системе и связанное с этих повышение концентраций накипеобразующих ионов.
Существует также расчетный способ (Миклашевский Н.Б. Применение индекса насыщения для оценки свойства воды отлагать карбонат кальция в системах оборотного водоснабжения. Инженерное обеспечение объектов строительства. Экспресс-информация. Отечественный опыт N 10, 1987 г., с. 12- 15) оценки термостабильности води. В соответствии с этим способом определяют кальциевую жесткость воды ЖCa, ее щелочность Щ, водородный показатель pH и ионную силу раствора, кратность упаривания воды в системе оборотного водоснабжения Ку (для систем горячего водоснабжения и теплоснабжения Ку=1), и в соответствии с расчетной формулой определяют степень насыщения (СН) воды карбонатом кальция при ее нагреве до температуры T и кратности упаривания Ку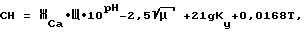
где μ - это ионная сила раствора и с достаточной для практики точностью может быть определена по приближенной эмпирической формуле в зависимости от солесодержания Р (мг/л)
μ = 0,000022P.
Если степень насыщения воды карбонатом кальция будет больше 1, то вода способна к осаждению карбоната кальция. Из анализа данной расчетной формулы следует, что при увеличении как температуры, так и водородного показателя, степень насыщения воды карбонатом кальция увеличивается, и вода становится более склонной к образованию карбоната кальция. Данный способ также не свободен от недостатков, т.к. не учитывает возможность ингибирования процессов кристаллизации поверхностно-активными веществами. Известно, что введение в воду ингибиторов кристаллизации, например фосфатов, стабилизирует ее и снижает величину осаждающейся фазы. Фактически вода может быть пересыщена накипеобразователями в десятки раз относительно произведения растворимости и при этом быть стабильной. Таким образом, точность оценки накипеобразующих свойств воды становиться неприемлемой для практики.
Технический результат, который может быть получен при осуществлении изобретения, заключается в повышении точности оценки термостабильности воды, используемой в системах водоснабжения, путем определения фактически образовавшейся кристаллической фазы карбоната кальция, соответствующей планируемой температуре нагрева воды T и коэффициенту упаривания Ку.
Для достижения этого технического результата определяется кальциевая жесткость воды ЖCa исх, ее водородный показатель pHисх, коэффициент упаривания солей в системе Ку, после чего исследуемая вода титруется децинормальным раствором едкого натра, определяется ее новый водородный показатель pHКОН и после встряхивания пробы с кристаллами карбоната кальция вновь определяется кальциевая жесткость воды ЖCa КОН, по изменению которой судят о термостабильности воды при температуре T и коэффициенте упаривания Ку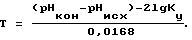
Коэффициент упаривания солей характеризует конструктивные особенности систем оборотного водоснабжения. Охлаждение воды на градирне связано с ее испарением и повышением концентрации солей в циркулирующей воде. Поэтому коэффициент концентрирования солей определяется как отношение концентрации хорошо растворимых солей, например хлоридов, в циркулирующей воде к концентрации этой соли в добавочной воде. Для систем горячего водоснабжения и теплоснабжения Ку=1. Для систем оборотного водоснабжения эта величина более 1. Выполнение титрования исследуемой воды децинормальным раствором едкого натра сдвигает углекислотно-кальциевое равновесие в сторону образования карбоната кальция, повышает значение водородного показателя, при этом бикарбонаты переходят в карбонаты, которые при взаимодействии с ионами кальция образуют кристаллическую фазу карбоната кальция, кальциевая жесткость исследуемой воды снижается на величину образовавшейся кристаллической фазы, что позволяет получить новое свойство, заключающееся в возможности оценки термостабильности воды при температуре ее нагрева T и коэффициенте упаривания Ку.
Пример определения термостабильности воды. Проводится оценка термостабильности воды, предназначенной для использования в системе оборотного водоснабжения. Исследованию подвергалась модельная вода следующего состава. ЖCa исх= 3,5 мг•экв/л, Щ=5,7 мг•экв/л, pH=8,7, общее солесодержание 850 мг/л. Термостабильность воды определялась как для случая использования воды без поверхностно-активных веществ (ПАВ), так и в присутствии ПАВ. В качестве ПАВ использовался раствор суперфосфата концентрации 2,7 мг/л.
Предполагается, что в системе оборотного водоснабжения коэффициент концентрирования солей, не выпадающих в осадок, Ку=2.
Общий порядок испытаний следующий. Определяется водородный показатель воды pHисх. Затем определяется кальциевая жесткость модельного раствора. Затем производится титрование исследуемой воды 0,01 N раствором NaOH, После титрования исследуемой воды децинормальным раствором едкого натра определяется водородный показатель pHКОН. Затем в течение 7-10 минут проводится энергичное перемешивание пробы в присутствии мраморной крошки. После перемешивания пробы определяется конечное значение кальциевой жесткости. По разнице исходной и конечной величины кальциевой жесткости определяется термостабильность воды в системе оборотного водоснабжения с коэффициентом концентрирования солей, не выпадающих в осадок Ку=2 для температуры T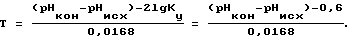
Результаты испытаний представлены в таблице 1.
Предложенный способ оценки термостабильности воды позволяет повысить точность оценки свойств воды отлагать карбонат кальция в системах водоснабжения при нагреве и упаривании воды, а также в присутствии ПАВ. Данный способ оценки термостабильности воды позволяет так же оценить эффективность ингибирования кристаллизации в случае использования различных ингибиторов.
Литература
1. В. Е. Терновцев. Магнитные установки в системах оборотного водоснабжения, Киев. 1976 г., 88 с., стр. 17.
2. В.А.Клячко, И.Э.Апельцин. Подготовка воды для промышленного и городского водоснабжения. М.: Стройиздат - 1962, 819 с.
3. ГОСТ 3313-46. Вода хозяйственно-питьевого и промышленного водоснабжения. Методы технологического анализа: Определение стабильности воды.
4. А. С. СССР N 1318901, М.кл. 4 G 01 N 27/50. Способ оценки термостабильности воды. Авторы Зайцев В.М. и Миклашевский Н.В.
5. Миклашевский Н. В. Применение индекса насыщения для оценки свойства воды отлагать карбонат кальция в системах оборотного водоснабжения. Инженерное обеспечение объектов строительства. Экспресс-информация. Отечественный опыт, N10, 1987 г., с. 12-15 - прототип.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЧУВСТВИТЕЛЬНЫЙ ЭЛЕМЕНТ УСТРОЙСТВА ДЛЯ ИЗМЕРЕНИЯ ЛИНЕЙНОГО УСКОРЕНИЯ | 1997 |
|
RU2147751C1 |
| УСТРОЙСТВО ДЛЯ УМЯГЧЕНИЯ ВОДЫ | 2000 |
|
RU2166690C1 |
| УЧЕБНЫЙ ПРИБОР ПО ФИЗИКЕ ДЛЯ ДЕМОНСТРАЦИИ УРАВНЕНИЯ МАКСВЕЛЛА | 1998 |
|
RU2130204C1 |
| УЧЕБНЫЙ ПРИБОР ПО ФИЗИКЕ | 1998 |
|
RU2130203C1 |
| УСТРОЙСТВО ДЛЯ ОПРЕДЕЛЕНИЯ ЦИРКУЛЯЦИИ ВЕКТОРА НАПРЯЖЕННОСТИ ЭЛЕКТРИЧЕСКОГО И МАГНИТНОГО ПОЛЯ | 1998 |
|
RU2137209C1 |
| АКСЕЛЕРОМЕТР С ПРЕОБРАЗОВАТЕЛЯМИ НА ПОВЕРХНОСТНОЙ АКУСТИЧЕСКОЙ ВОЛНЕ | 1998 |
|
RU2139546C1 |
| АВТОНОМНАЯ ЭНЕРГЕТИЧЕСКАЯ УСТАНОВКА С ДВИГАТЕЛЯМИ "ФЛЮИДАЙН" | 1998 |
|
RU2133362C1 |
| АВТОНОМНАЯ ЭНЕРГОУСТАНОВКА С ДВИГАТЕЛЯМИ "ФЛЮИДАЙН" | 1998 |
|
RU2133857C1 |
| АВТОНОМНЫЙ ЭЛЕКТРОГЕНЕРАТОР НА ОСНОВЕ ДВИГАТЕЛЕЙ "ФЛЮИДАЙН" | 1998 |
|
RU2133858C1 |
| МНОГОЦИЛИНДРОВЫЙ ЖИДКОПОРШНЕВОЙ ЭЛЕКТРОГЕНЕРАТОР | 1998 |
|
RU2133860C1 |
Способ применим для исследования свойств воды, используемой в системах водоснабжения, в частности в системах водяного охлаждения и горячего водоснабжения. Это достигается путем изменения водородного показателя воды путем ее титрования децинормальным раствором едкого натра в зависимости от коэффициента концентрирования (упаривания) солей, не выпадающих в осадок, предполагаемой температуры нагрева и последующего осаждения карбоната кальция. О термостабильности воды судят по изменению кальциевой жесткости воды. Достигается повышение точности оценки накипеобразующих свойств воды, добавляемой в системы водоснабжения. 2 табл.
Способ оценки термостабильности воды путем определения исходных водородного показателя и кальциевой жесткости пробы, коэффициента Кy упаривания солей в системе, отличающийся тем, что исследуемая проба титруется децинормальным раствором едкого натра, затем определяются ее конечные водородный показатель и кальциевая жесткость после встряхивания пробы с кристаллами карбоната кальция, и по изменению кальциевой жесткости судят о термостабильности воды при температуре ее нагрева Т, определяемой по формуле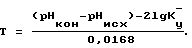
| Миклашевский Н.В | |||
| Применение индекса насыщения для оценки свойства воды отлагать карбонат кальция в системах оборотного водоснабжения | |||
| Инженерное обеспечение объектов строительства | |||
| Экспресс-информация | |||
| Отечественный опыт, N 10, 1987, с.12 - 15 | |||
| 0 |
|
SU348505A1 | |
| SU 913252 A, 15.03.82 | |||
| Устройство для определения количества накипи | 1983 |
|
SU1180770A1 |
| Устройство для анализа котловой и питательной воды | 1946 |
|
SU75409A1 |
| УСТРОЙСТВО для ОПРЕДЕЛЕНИЯ ЖЕСТКОСТИ ВОДЫ | 0 |
|
SU242481A1 |
| ВОДЯНОЕ КОЛЕСО | 1925 |
|
SU3313A1 |
| Вода хозяйственно-питьевого и промышленного водоснабжения | |||
| Методы технологического анализа: Определение стабильности воды. | |||
Авторы
Даты
1999-11-27—Публикация
1996-09-09—Подача