Изобретение относится к некоторым замещенным 6-(2-имидазолиниламино)хинолиновым соединениям. Было найдено, что эти соединения являются селективными агонистами альфа-2-адреноцепторов и пригодны для лечения одного или нескольких респираторных нарушений, в частности назальной закупорки (застоя); глазных нарушений, в частности глаукомы, и желудочно-кишечных нарушений, в частности диареи.
Информация, относящаяся к альфа-адренергическим рецепторам, агонистам и антагонистам, в общем, и относящаяся к соединениям, близким по строению к соединениям настоящего изобретения, описывается в следующих работах: Timmermans, P. B. M.W.M., F.T.Chiu and M.J.C. Thoolen, "12.1 α -Adrenergic Receptors", Comprehensive Medicinal Chemistry, Vol. 3, Membranes and Receptors, P. G.Sammes and J.B.Taylor, eds., Pergamon Press (1990), pp. 133-185; Timmermans, P. B. M.W.M. and P.A. van Zweiten, ″α- Adrenoceptor Agonist and Antagonist", Drugs of Future, Vol. 9, N 1, (January, 1984), pp. 41-55; Megens, A. A. H.P., J.E.Leysen, F.H.L.Awouters and C.J.E.Niemegeers, "Further Validation of in vivo and in vitro Pharmacological Procedures for Assessing the α1- and α2- Selectivity of Test Compounds; (2) α- Adrenoreceptor Agonist", European Lournal of Pharmacology, Vol. 129 (1986), pp. 57-64; Timmermans, P.B.M.W.M., A. de Jonge, M.J.M.C. Thoolen, B.Wiffert, H.Batink and P. A. van Zweiten, "Quantitative Relationship between α- Adrenergic Activity and Binding Affinity of α- Adrenoceptor Agonist and Antagonist", Journal of Medicinal Chemistry, Vol. 27 (19*4), pp. 495-503; van Meel, J.C.A., A. de Jonge, P. B. M. W.M. Timmermans and P.A. van Zwieten, "Selecttivity of Some Alpha α- Adrenoceptor Agonist for Peripheral α1- and α2- Adrenoceptors in the Normotensive Rat", The Journal of Pharmacology and Experimental Therapeutics, Vol. 219, N 3 (1981), pp. 760-767; Chapleo, С.В., J.C.Doxey, P.L. Myers, M.Myers, C.F.C.Smith and M.R.Stillings, "Effect of 1,4-Dioxany Substitution on the Adrenergic Activity of Some Standard α- Adrenoreceptor Agents", European Journal of Medicinal Chemistry, Vol. 24 (1989), pp. 619-622, Chapieo, C. B. , R.C.M.Butler, D.C.England, P.L., Myers, A.G.Roach/ С.F.С. Smith, M. R. Stillings and I.F.Tulloch, "Heteroaromatic Analogues of the α- Adrenoreceptor Partial Agonist Clondige", J.Med.Chem., Vol 32 (1989), pp. 1627-160; Clare, К.A., M.C. Scrutton and N.T.Thompson, "Effect α2- Adrenoceptor Agonist and of Related Compounds on Aggregation of and on Adenylat Cyclase Activity in, Human Platelets", Br.J.Pharmac., Vol. 82 (1984), pp. 467-476; U. S. Patent N 3890319 issued to Danielewicz, Snarey and Thomas on June 17, 1975; and U.S. Patent N 5091528 issued to Gluchowski on February 25, 1992. Однако много соединений, близких по строению соединениям настоящего изобретения, не обладают желаемой активностью и специфичностью при лечении респираторных, глазных и желудочно-кишечных нарушений.
К предмету настоящего изобретения имеет отношение, в частности, тот факт, что соединения, которые, как показано, являются эффективными назальными противозастойными средствами, часто оказывается обладают нежелательными побочными эффектами, например вызывают гипертензию и бессонницу. Имеется нужда в новых лекарственных средствах, которые обеспечивают облегчение назальной заложенности и не вызывают эти нежелательные побочные действия.
Целью изобретения является предложение соединений, обладающих значительной активностью в предупреждении и лечении назальной заложенности.
Дополнительной целью изобретения является предложение таких соединений, которые не вызывают гипотензию, сонливость, гипертензию, бессонницу или другие нежелательные побочные эффекты.
Целью изобретения является также предложение соединений для лечения кашля, хронического закупоривающего легочного заболевания (CODO) и/или астмы.
Целью изобретения является также предложение соединений для лечения глаукомы и/или диареи.
Еще одной целью изобретения является предложение таких соединений, которые обладают хорошей активностью при пероральном и/или местном дозированном введении.
Изобретение относится к соединениям, имеющим следующее строение: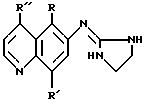
(a) R представляет собой незамещенный C1-C3-алкил или C2-C3-алкенил;
(b) R' выбирают из незамещенного C1-C3-алкила или C2-C3-алкенила; незамещенной C1-C3-алкилтио- или алкоксигруппы; гидроксигруппы; меркаптогруппы; и галогена и
(c) R'' выбирают из водорода, незамещенного C1-C3-алкила или C2-C3-алкенила; метила, монозамещенного гидрокси-, меркапто- или аминогруппой; незамещенной C1-C3-алкилтио- или алкоксигруппы; аминогруппы; незамещенного амида; незамещенной или C1-C3-замещенной амидогруппы; галогена, незамещенного сульфоксида, незамещенного сульфонила и цианогруппы;
фармацевтическим композициям, содержащим такие соединения, и применению таких соединений для предупреждения или лечения респираторных, глазных и/или желудочно-кишечных нарушений.
Используемый в изобретении термин "алкил" обозначает нормальную или разветвленную углеводородную цепь, насыщенную, незамещенную или замещенную. Если не оговорено особо, предпочтительный алкил является C1-C3-алкилом, конкретно C2-алкилом, и особенно метилом, предпочтителен алкил незамещенный.
Используемый в описании термин "алкенил" обозначает углеводородный заместитель с одной двойной связью, который имеет нормальную или разветвленную цепь и не замещен или замещен.
Используемый в описании термин "алкилтиогруппа" обозначает заместитель, имеющий строение Q-S-, где Q представляет собой алкил.
Используемый в описании термин "алкоксигруппа" обозначает заместитель, имеющий строение Q-O-, где Q представляет собой алкил.
Используемый в описании термин "амид" обозначает заместитель, имеющий формулу NH2-CO-, где один или оба атома водорода у азота могут быть замещены алкилом.
Используемый в описании термин "амидогруппа" обозначает заместитель, имеющий формулу H-CO-NH, где водород у атома углерода может быть замещен алкилом.
Используемый в описании термин "галоген" обозначает фтор, хлор, бром или иод.
Используемый в описании термин "сульфоксид" обозначает заместитель, имеющий формулу HSO, где водород может быть замещен алкилом.
Используемый в описании термин "сульфонил" обозначает заместитель, имеющий формулу HSO2-, где водород может быть замещен алкилом.
Соединения
Изобретение включает новые соединения, имеющие следующую формулу: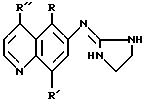
В указанной выше формуле R представляет собой незамещенный C1-C3-алкил или алкенил, имеющий от 2 до 3 атомов углерода, R предпочтительно является алкилом. R более предпочтительно является метилом или этилом, наиболее предпочтительно метилом.
В указанной выше формуле R' выбирают из незамещенного C1-C3-алкила или алкенила, имеющего от 2 до 3 атомов углерода; незамещенной алкилтио- или алкоксигруппы, имеющей от 1 до 3 атомов углерода; гидроксигруппы; тиоловой группы и галогена. R' предпочтительно является алкилом, более предпочтительно метилом или этилом, наиболее предпочтительно метилом. R', когда он представляет собой алкилтио- или алкоксигруппу, предпочтительно насыщен, также предпочтительно является C1- или C2-группой, более предпочтительно метилтио- или метоксигруппой. R', когда он является галогеном, предпочтительно представляет собой хлор или бром, более предпочтительно хлор.
В указанной выше формуле R'' выбирают из водорода; незамещенного C1-C3-алкила или алкенила, имеющего от 2 до 3 атомов углерода; метила, монозамещенного гидрокси-, меркапто- или аминогруппой; незамещенной алкилтио- или алкоксигруппы, имеющей от 1 до 3 атомов углерода; аминогруппы; галогена; незамещенного амида; амидогруппы, незамещенной или замещенной C1-C3-алкилом или алкенилом, имеющим от 2 до 3 атомов углерода; незамещенного сульфонила и цианогруппы. R'', который является алкилом или алкенилом, предпочтительно незамещен. R'' также предпочтительно является алкилом, более предпочтительно метилом или этилом, наиболее предпочтительно метилом. R'', который является алкилтио- или алкоксигруппой, предпочтительно насыщен, также предпочтительно является C1- или C2-группой, более предпочтительно является метилтио- или метоксигруппой. R'', который является галогеном, предпочтительно хлор или особенно фтор. R'', который представляет собой амидогруппу, предпочтительно незамещен или замещен метилом или этилом. R'' предпочтительно является также цианогруппой.
Предпочтительными соединениями изобретения являются соединения, имеющие формулу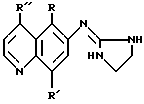
где R, R' и R'' имеют значения, указанные в таблице 1(см. в конце описания).
Соединения изобретения, в частности, пригодны для лечения назальной заложенности, связанной с аллергией, простуды и других заболеваний носа, связанных с назальной заложенностью, а также их последствий (осложнений), например синусита и отита. В то же время было найдено, что нежелательных побочных эффектов, например гипотензию, сонливость, гипертензию или бессонницу, можно избежать. Не ограничиваясь конкретным механизмом действия, полагают, что соединения настоящего изобретения имеют преимущества перед аналогичными соединениями при лечении назальной заложенности благодаря их способности взаимодействовать с альфа-2-адреноцепторами. Найдено, что соединения изобретения являются агонистами альфа-2-адреноцепторов, которые вызывают сужение периферических сосудистых каналов в носовых раковинах. Найдено, что соединения изобретения обладают только слабой активностью альфа-1-антагониста и обладают слабым действием или не обладают действием на центральную нервную систему.
Соединения изобретения пригодны также для лечения глазных нарушений, связанных с повышенным внутриглазным давлением, например глаукомы. Соединения вводят перорально или местно в виде капель, гелей или кремов непосредственно на поверхность глаза млекопитающего.
Соединения настоящего изобретения пригодны также для лечения нарушения двигательной функции жедудочно-кишечного тракта, например диареи, путем действия, направленного против сократительной и секреторной функции кишечно-желудочного тракта.
Фармакологическую активность и селективность соединений изобретения можно определить при помощи описанных методик испытания. Альфа-2-селективность данных соединений определяют путем измерения сродства к связыванию рецептора и in vitro функциональной активности в ряде тканей, которые, как известно, содержат альфа-2- и/или альфа-1-рецепторы (Смотри, например, The Alpha-2-Adrenergic Receptors. L.E.Limbird, ed., Humana Press, Cliffon, NJ). Обычно на грызунах и других видах животных проводят in vivo следующие испытания. Действие на центральную нервную систему определяют путем измерения двигательной активности в виде индекс седдативности. (Смотри, например, Spyraki, С. and H.Fibiger, "Clonidine-induced Sedation in Rats: Evidence for Mediation by Postsynaptic Alpha-2-Adreno-receptors", J.Neural Trans., Vol. 54 (1982), pp. 153-263). Активность средства против назальной заложенности измеряют при помощи риноманометра, оценивая сопротивляемость назального дыхательного пути. (Смотри, например, Salem, S. and E.Clemente, "A new Experimental Method for Evaluating Drugs in the Nasal Cavity", Arch. Otolarynng, Vol. 96 (1972), pp. 524-529). Антиглаукомную активность определяют измерением внутриглазного давления (Смотри, например, Potter, D., "Adrenergic Pharmacology of Aquous Human Dynamics", Pharmacol. Rev., Vol. 13 (1981), pp. 133-153). Антидиарейную активность определяют измерением способности соединений ингибировать индуцированную простагландинами диарею. (Смотри, например, Thollander, M., P.Hell-strom and T.Svensson, "Suppression of Castor oil-induced Diarrhea by Alpha-2-Adrenoceptor Agonist", Aliment. Pharmacol. Therap. , Vol. 5 (1991), pp. 255-262). Антиастматическую активность определяют измерением действия соединения на бронхостеноз, связанный с легочными антигенными стимулами, например вдыхаемыми антигенами (Смотри, например, Chang, J.J. Musser and J. Hind, "Effect of a Novel Leukotriene D4 Antagonist with 5-Lipoxygenase and Cyclooxygenase inhibitory Activity, Wy45911, on Leukotriene-D4- and Antigen-induced Bronchoconstriction in Guinea Pig", Int. Arch. Allergy Appl. Immun., Vol. 86 (1988), pp. 48-54 and Delehunt, J.A.Perruchound, L. Yerger, B.Marchette, J.Stevenson and W.Abraham, "The Role of Slow-Reacting Substance of Anaphylaxis in the Late Bronchial Response After Antigen Challenge in Allergic Cheep", Am. Rev. Respir. Dis., Vol. 130 (1984), pp. 784-754). Противокашлевую активность определяют измерением числа и латентности кашлевой реакции на респираторные антигенные стимулы, например вдыхаемую лимонную кислоту. (Смотри, например, Call-way, J. and R.King, "Effect of inhaled Alpha-2-Adrenoceptor and GABAβ -Receptor Agonists on Citric Acid-indused Cough and Tidal Volume Changes in Guinea Pigs", Eur. J. Pharmacol., Vol. 220 (1992), pp. 187-195).
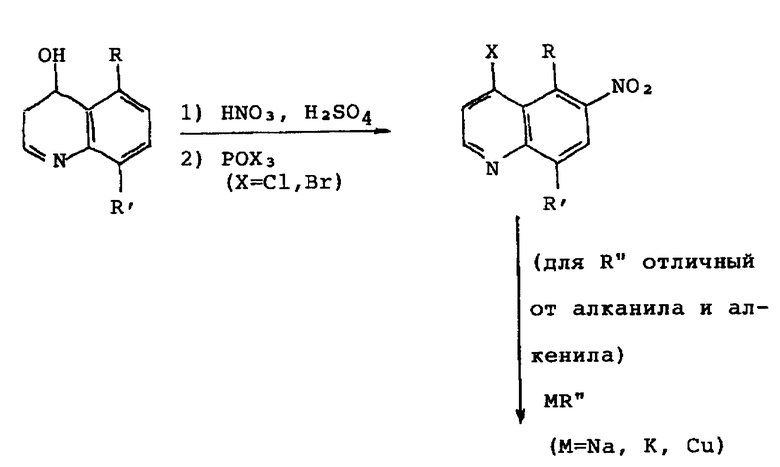
Соединения настоящего изобретения синтезируют при помощи общих способов, приведенных в конце описания.
В указанной выше схеме, где R' представляет собой алкокси- или алкилтиогруппу, соответствующие гидрокси- или меркаптосоединения получают из конечных соединений при помощи стандартных методик дезалкилирования (Bhatt, et al. , "Cleavage of Ethers", Synthesis, 1983, pp. 249-281). В указанной выше схеме, когда R'' представляет собой цианогруппу, цианогруппу можно превратить в замещенный метил или амид обычными превращениями функциональных групп (Смотри March, Advanced Organic Chemistry, 3-rd td., Wilew, 1985).
Следующие неограничивающие примеры (см. в конце описания) описывают детали синтеза соединений 6-(2-имидазолиниламино)хинолина настоящего изобретения, имеющих общую формулу: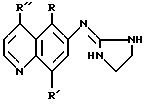
Пример 2. Дигидрохлоридная соль 5,8-диметил-6-(2-имидазолиниламино) хинолина
5,8-диметилхинолин. К смеси 5,13 г 2,5-диметиланилина (42,13 ммоль), 12,78 г глицерина (138,8 ммоль) и 8,53 г (20 ммоль) гидрата пентоксида мышьяка (As2O5•H2O, 54% As), в атмосфере аргона в 1-литровой 3-горлой круглодонной колбе, оборудованной механической мешалкой, добавляют 12,57 г (128,2 ммоль) серной кислоты (смесь разогревается). Полученный при перемешивании горячий раствор нагревают при 140-150oC в течение 4 ч. Затем реакционную смесь охлаждают до комнатной температуры и медленно подщелачивают до pH 10, добавляя 28-30%-ный раствор гидроксида аммония. Спустя 10 минут основной раствор подкисляют до pH 5, добавляя ледяную уксусную кислоту, и экстрагируют хлористым метиленом (3 раза по 300 мл). Органический слой промывают водой (2 раза по 300 мл) и рассолом (2 раза по 300 мл), сушат над сульфатом магния, фильтруют и выпаривают на роторном испарителе. Остаток очищают методом флэш-хроматографии на силикагеле, элюируя смесью этилацетат/гексан, получая 3,94 г 5,8-диметилхинолина в виде желтого масла.
Спектр протонного магнитного резонанса (ПМР) (300 МГц, дейтерометанол) δ, м.д.: 2,4 (с, 3H) 2,6 (с, 3H) 7,0 (д, 1H, J = 7,2 Гц) 7,2 (д, 1H, J = 7,2 Гц) 7,3 (дд 1H, J = 8,5 и 4,3 Гц) 8,1 (дд, 1H, J = 8,5 и 1,7 Гц) 8,7 (дд, 1H, J = 8,5 и 1,7 Гц), с - синглет; д - дублет; т - триплет; м - мультиплет; ш. - широкий
Спектр Ядерного магнитного резонанса (ЯМР 13C) (дейтерометанол) δ: 17,1 120,1 126,4 127,4 129,2 133,1 133,2 133,7 146,6 148,0
Масс-спектр (Cl), m/z 158 (M + H)+.
5,8-диметил-6-нитрохинолин. В атмосфере аргона охлаждают до 0oC 5,8-диметилхинолин (1,25 г 8,0 ммоль) в круглодонной колбе (на 250 мл) на бане со льдом и солью. Добавляют 12,57 г (128,2 ммоль) серной кислоты с такой скоростью, чтобы температура реакционной смеси не превышала 5oC. Раствор оставляют перемешиваться несколько минут, затем его охлаждают до температуры -15oC на бане с этиленгликолем и сухим льдом. По каплям из шприца добавляют 69-71%-ный раствор азотной кислоты (1,7 мл, 27,0 ммоль) в 50 мл серной кислоты с такой скоростью, чтобы температура реакционной смеси не превышала -3oC. Через 10 минут после завершения добавления реакционную смесь выливают на лед и медленно подщелачивают до pH 10, добавляя 28-30%-ный раствор гидроксида аммония. Продукт экстрагируют этилацетатом (3 раза по 500 мл). Органический слой сушат над сульфатом магния, фильтруют и выпаривают на роторном испарителе. Остаток очищают методом флэш-хроматографии на силикагеле, элюируя смесью 15% этилацетата в гексане, получая 0,61 г (38%) 5,8-диметил-6-нитрохинолина.
Спектр ПМР (300 МГц, дейтерохлороформ) δ, м.д.: 1,9 (с, 3H) 2,5 (с, 3H) 6,4 (с, 1H) 7,3 (дд, 1H, J = 7,9 и 4,7 Гц) 7,6 (дд, 1H, J = 7,9 и 1,5 Гц) 8,7 (дд, 1H, J = 4,7 и 1,5 Гц, CH).
Спектр ЯМР 13C (дейтерохлороформ) δ: 13,9 17,7 123,1 124,6 127,7 128,4 135,7 138,1 145,4 147,5 151,0
Масс-спектр (Cl), m/z 203 (M + H)+.
5,8-диметил-6-аминохинолин. К раствору 1,41 г (6,97 ммоль) 5,8-диметил-6-нитрохинолина в 20 мл этанола в атмосфере аргона добавляют 1,21 г (21,67 ммоль) порошка железа и 2,56 г (42,63 ммоль) ледяной уксусной кислоты. Смесь кипятят с обратным холодильником в течение 2 ч. В реакционную смесь добавляют другую порцию 1,23 г (22,02 ммоль) железа и 2,49 г (41,47 ммоль) ледяной уксусной кислоты и кипятят еще 1 час. Реакционную смесь выливают на лед и подщелачивают до pH 10, добавляя насыщенный раствор карбоната калия. Смесь экстрагируют хлористым метиленом (4 раза по 30 мл). Органический слой сушат над сульфатом натрия, фильтруют и выпаривают на роторном испарителе, получая 0,94 г 5,8-диметил-6-аминохинолина. Этот продукт используют на следующей стадии без дополнительной очистки.
Спектр ПМР (300 МГц, дейтерохлороформ) δ, м.д.: 2,3 (с, 3H) 2,7 (с, 3H) 3,8 (ш. с, 2H) 7,0 (с, 1H) 7,3 (дд, 1H, J = 8,6 и 4,2 Гц) 8,2 (дд, 1H, J = 8,6 и 1,5 Гц) 8,7 (дд, 1H, J = 4,2 и 1,5 Гц).
Спектр ЯМР 13С (дейтерохлороформ) δ: 11,1 18,3 109,8 120,7 122,0 128,8 130,7 135,6 141,4 143,9 144,9
5,8-диметил-6-изотиоцианатохинолин. По каплям добавляют 0,4 мл (5,25 ммоль) тиофосгена в раствор 0,85 г (4,94 ммоль) 5,8-диметил-6-аминохинолина в 50 мл воды и 0,45 мл 36-38%-ной соляной кислоты. Реакционную смесь перемешивают 10 минут, и за это время образуется желтый осадок. В реакционную смесь добавляют 52 мл 1 н. раствора гидроксида натрия, и сразу же образуется белый осадок. Реакционную смесь оставляют перемешиваться 10 минут, затем экстрагируют хлористым метиленом (3 раза по 100 мл). Органический слой концентрируют до малого объема и остаток фильтруют через слой силикагеля, который промывают 25% этилацетата в гексане. Фильтрат выпаривают, получая 0,88 г 5,8-диметил-6-изотиоцианатохинолина.
Спектр ПМР (300 МГц, дейтерохлороформ) δ, м.д.: 2,5 (с, 3H) 2,6 (с, 3H) 7,3 (с, 1H) 7,4 (дд, 1H, J = 8,6 и 4,2 Гц) 8,1 (дд, 1H, J = 8,6 и 1,7 Гц) 8,8 (дд, 1H, J = 4,2 и 1,7 Гц).
Спектр ЯМР 13C (дейтерохлороформ) δ: 13,7 17,9 121,4 127,3 127,7 127,8 132,7 136,0 137,0 146,0 149,1.
ИК-спектр (в пленке), NCS: 2122 см-1. Масс-спектр (Cl), m/z 215 (M + H)+.
N-(5,8-Диметил-6-хинолинил)-N'-2-аминоэтилтиомочевина.
В раствор 0,4 мл (5,98 ммоль) 1,2-этилендиамина в 4 мл толуола в атмосфере аргона по каплям добавляют раствор 0,18 г (0,84 ммоль) 5,8-диметил-6-изотиоцианатохинолина в 4 мл толуола. В ходе добавления образуется белый осадок. Реакционную смесь перемешивают 15 минут при комнатной температуре. Выпаривают толуол и желто-белое твердое вещество сушат в вакууме 20 минут, получая 0,34 г N-(5,8-диметил-6- хинолинил)-N'-2-аминоэтилтиомочевины. Этот продукт используют на следующей стадии без дополнительной очистки.
Спектр ПМР (300 МГц, дейтерометанол) δ, м.д.: 2,5 (с, 3H) 2,7 (с, 3H) 2,8 (т, 2H, J = 6,4 Гц) 3,6 (т, 2H, J = 6,4 Гц) 7,4 (с, 1H) 7,5 (дд, 1H, J = 8,6 и 4,3 Гц) 8,5 (дд, 1H, J = 8,6 и 1,6 Гц) 8,8 (дд, 1H, J = 4,2 и 1,6 Гц).
Спектр ЯМР 13C (дейтерометанол) δ: 13,3 18,0 45,3 47,8 121,4 128,0 128,1 128,4 130,6 133,5 134,7 148,9 181,8.
Масс-спектр (Cl), m/z 275 (M + H)+.
Дигидрохлоридная соль 5,8-диметил-6-(2-имидазолиниламино)хинолина.
Смесь 0,31 г (1,13 ммоль) N-(5,8-диметил-6-хинолинил)-N'-2- аминоэтилтиомочевины и 0,47 г (1,48 ммоль) ацетата ртути в 15 мл этанола нагревают до кипения. Спустя несколько минут кипячения с обратным холодильником реакционная смесь становится черной. Эту реакционную смесь фильтруют через Целит, промывая твердое вещество этанолом. Фильтрат выпаривают на роторном испарителе и остаток растворяют в воде и подщелачивают до pH 10, добавляя насыщенный раствор карбоната калия. Продукт экстрагируют хлороформом (3 раза по 100 мл). Органический слой выпаривают до малого объема на роторном испарителе, затем фильтруют через слой силикагеля, элюируя смесью 20% метанола (насыщен аммиаком) в хлороформе, получая 0,13 г 5,8-диметил-6-(2-имидазолиниламино)хинолина. Это твердое вещество растворяют в метаноле, замораживают в ледяной бане и обрабатывают газообразным хлористым водородом. Весь продукт растворяется при барботировании газообразного хлористого водорода в смесь. Метанол выпаривают на роторном испарителе, получая 0,08 г дигидрохлоридной кислой соли 5,8-диметил-6-(2-имидазолиниламино)хинолина. Т. пл. 150oC (разлагается).
Спектр ПМР (300 МГц, дейтерометанол) 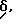 м.д.: 2,8 (с, 3H) 2,9 (с, 3H) 3,8 (с, 4H) 8,2 (с, 1H) 8,2 (дд, 1H, J = 8,7 и 5,4 Гц) 9,2 (дд, 1H, J = 5,4 и 1,4 Гц) 9,5 (дд, 1H, J = 8,7 и 1,4 Гц).
м.д.: 2,8 (с, 3H) 2,9 (с, 3H) 3,8 (с, 4H) 8,2 (с, 1H) 8,2 (дд, 1H, J = 8,7 и 5,4 Гц) 9,2 (дд, 1H, J = 5,4 и 1,4 Гц) 9,5 (дд, 1H, J = 8,7 и 1,4 Гц).
Спектр ЯМР 13C (дейтерометанол) δ: 12,2 16,1 43,0 122,9 129,5 133,9 134,1 134,3 134,4 136,9 144,2 145,3 159,0.
Масс-спектр (CI/CH4), m/z 241 (M + H)+.
Элементный анализ:
Вычислено для C14H18N4Cl2, %: C - 53,68; H - 5,79; N - 17,89
Найдено, %: C - 53,61; H - 5,55; N - 17,41.
Масс-спектр HR, m/z (M + H) вычислено - 241,1453; найдено 241,1467.
Пример 3. Дигидрохлоридная соль 6-(2-имидазолиниламино)-4,5,8- триметилхинолина, моногидрат
4,5,8-триметил-6-нитрохинолин. Смесь 2,5-диметил-4-нитроанилина (0,96 г 5,7 ммоль), гексагидрата треххлористого железа (2,5 г 9,24 ммоль), хлорида цинка (94 мг 0,69 ммоль) и 0,48 мл 12 н. соляной кислоты в 8 мл этанола нагревают до 60oC. К этой смеси по каплям, в течение 3 ч добавляют 0,73 мл (300,8 ммоль) 1,1,3-триметоксибутана в 5 мл этанола с помощью поршневого насоса. Смесь кипятят с обратным холодильником в течение 16 ч, затем смесь охлаждают до комнатной температуры. Добавляют 10%-ный водный раствор гидроксида натрия и смесь экстрагируют хлористым метиленом (6 раз по 50 мл). Объединенные органические слои промывают водой (2 раза по 200 мл), сушат над сульфатом натрия, фильтруют и выпаривают досуха на роторном испарителе. Продукт очищают на аспирационной вакуумной колонке, используя градиентное элюирование от 10% этилацетата в гексане до 25% этилацетата в гексане, получая 0,6 г 4,5,8-триметил-6-нитрохинолина в виде твердого вещества с Т.пл. 119-121oC.
Спектр ПМР (300 МГц, дейтерохлороформ) δ, м.д.: 2,77 (с, 3H) 2,8 (с, 3H) 2,93 (с, 3H) 7,29 (д, 1H, J = 4,4 Гц) 7,7 (с, 1H) 8,81 (д, 1H, J = 4,4 Гц).
Спектр ЯМР 13C (дейтерохлороформ) δ: 18,78 19,27 25,64 122,42 125,51 127,30 128,78 137,94 147,15 148,74 149,93.
Масс-спектр (Cl), m/z 217 (M + H)+.
4,5,8-триметил-6-аминохинолин. Смешивают 0,60 г (2,77 ммоль) 4,5,8-триметил-6-нитрохинолина, 40 мл этанола и 3,13 г (13,8 ммоль) дигидрата хлористого олова и нагревают до кипения. Спустя 3 ч реакционную смесь охлаждают до комнатной температуры, выливают ее на измельченный лед (50 г) и подщелачивают 24 мл концентрированного раствора гидроксида аммония. Эту смесь экстрагируют хлороформом (3 раза по 100 мл), сушат над карбонатом калия, фильтруют и выпаривают на роторном испарителе. Сырой продукт очищают методом флэш-хроматографии на колонке, элюируемой смесью 25% этилацетата в гексане, получая 0,37 г 4,5,8-триметил-6-аминохинолина в виде твердого вещества с Т. пл. 159,5-160,5oC.
Спектр ПМР (300 МГц, дейтерохлороформ) δ, м.д.: 2,51 (с, 3H) 2,68 (с, 3H) 2,82 (с, 3H) 3,82 (ш. с, 2H) 7,02 (с, 1H) 7,08 (д, 1H, J = 5,0 Гц) 8,52 (д, 1H, J = 5,0 Гц).
Спектр ЯМР 13C (дейтерохлороформ) δ: 16,48 19,0 25,82 111,2 121,73 124,44 130,2 136,2 142,48 143,16 143,94 144,56.
Масс-спектр (Cl), m/z 187 (M + H)+.
4,5,8-диметил-6-изотиоцианатохинолин. Смешивают 0,37 г (1,98 ммоль) 4,5,8-триметил-6-аминохинолина, 0,494 г (2,12 ммоль) ди-2-пиридилтионокарбоната (ДПТ), 52 мг (0,4 ммоль) 4-диметиламинопиридина (ДМАП) и 4 мл хлористого метилена и перемешивают 2 ч при комнатной температуре. Добавляют еще 0,1 г ДПТ и смесь перемешивают еще 1 ч. Реакционную смесь выпаривают на роторном испарителе и очищают на аспирационной вакуумной колонке, элюируя 10% этилацетата в гексане, получая 0,4 г 4,5,8-триметил-6-изотиоцианато-хинолина с Т.пл. 122-123oC.
Спектр ПМР (300 МГц, дейтерохлороформ) δ, м.д.: 2,71 (с, 3H) 2,83 (с, 3H) 2,89 (с, 3H) 7,20 (д, 1H, J = 5,0 Гц) 7,41 (с, 1H) 8,72 (д 1H, J = 5,0 Гц).
Спектр ЯМР 13C (дейтерохлороформ) δ: 18,86 19,43 25,81 125,14 127,42 128,63 129,02 136,32 137,68 145,91 147,18 148,50.
Масс-спектр (Cl), m/z 229 (M + H)+.
N-(4,5,8-Триметил-6-хинолинил)-N'-2-аминоэтилтиомочевина. В раствор 0,586 мл (8,67 ммоль) 1,2-этилендиамина в 2,5 мл толуола медленно добавляют раствор 0,40 г (1,75 ммоль) 4,5,8-трнметил-6-изотиоцианатохинолина в 10 мл толуола. Реакционную смесь перемешивают 2 ч при комнатной температуре и затем помещают на ночь в холодильник. Образовавшееся твердое вещество отфильтровывают, хорошо промывают толуолом и сушат, получая 0,46 г N-(6-(4,5,8-триметил-6-хинолинил)-N'-(2-аминоэтил)тиомочевины с Т.пл. 185-200oC (разлагается).
Спектр ПМР (300 МГц, дейтеродиметилсульфоксид) δ, м.д.: 2,52-2,62 (м, 8H) 2,72 (ш. т, 2H) 2,88 (с, 3H) 3,41 (ш. с, 2H) 7,32 (д, 1H, J = 5,0 Гц) 7,36 (с, 1H) 8,30 (с, 2H) 8,65 (д, 1H, J = 5,0 Гц).
Спектр ЯМР 13C (дейтеродиметилсульфоксид) δ: 18,16 18,57 25,24 47,13 79,16 124,4 129,01 129,58 134,58 135,09 145,71 146,99 147,97 181,06
Масс-спектр (Cl), m/z 289 (M + H)+.
Дигидрохлоридная соль 6-(2-имидазолиниламино)-4,5,8-триметилхинолина, моногидрат
Смесь 0,461 г (1,59 ммоль) N-(4,5,8-триметил-6-хинолинил)-N'-2- аминоэтилтиомочевины и 602 мг (1,88 ммоль) ацетата ртути (II) в 20 мл метанола перемешивают 4 ч при комнатной температуре. Реакционную смесь фильтруют через Целит, промывая твердое вещество метанолом. Фильтрат выпаривают на роторном испарителе и остаток очищают методом флэш-хроматографии, элюируя смесью 20% метанола в хлористом метилене, содержащем 1% гидроксида аммония. Получают 0,40 г 4,5,8-триметил-6-(2-имидазолиниламино)хинолина. Это твердое вещество растворяют в смеси 0,8 мл 12 н. соляной кислоты и 4 мл метанола. Добавляют 7 мл эфира и дают смеси выдержаться 3 суток при комнатной температуре. Полученное твердое вещество фильтруют, промывают эфиром и сушат, получая 0,35 г моногидрата дигидрохлоридной кислой соли 6-(2-имидазолиниламино)-4,5,8-триметилхинолина.
Спектр ПМР (300 МГц, дейтеродиметилсульфоксид) δ, м.д.: 2,71 (с, 3H) 2,78 (с, 3H) 3,10 (с, 3H) 3,64 (с, 4H) 5,0-6,0 (ш. с, 1H) 7,71 (с, 1H) 7,81 (д, 1H, J = 5,0 Гц) 8,41 (с, 1H) 8,93 (д, 1H, J = 5,0 Гц) 11,20 (с, 1H).
Спектр ЯМР 13C (дейтеродиметилсульфоксид) δ: 18,2 18,52 26,26 42,71 125,21 129,88 131,17 131,35 131,91 134,04 139,70 144,34 157,33 158,23.
Масс-спектр (Cl), m/z 255 (M + H)+.
Элементный анализ:
Вычислено для C15H18N4•2HCl•H2O, %: C - 52,18; H - 6,42; N - 16,23
Найдено, %: C - 51,94; H - 6,30; N - 16,12.
Пример 4. Дигидрохлоридная соль 5,8-диметил-6-(2- имидазолиниламино)-4-метоксихинолин, полугидрат
5,8-диметил-6-нитро-4-хинолон. Смешивают 5,8-диметилхинолон (5,0 г 28,9 ммоль) и 30 мл серной кислоты и перемешивают 10 минут при комнатной температуре. Образовавшийся темно-зеленый раствор помещают на баню с ледяной водой и по каплям добавляют 2,73 г 15,4-молярного раствора азотной кислоты (1,9 мл, 29,8 ммоль). Реакционная смесь приобретает красно-оранжевый цвет. После завершения добавления реакционную смесь оставляют перемешиваться 15 минут в бане с ледяной водой. Затем реакционную смесь выливают в перемешиваемый раствор воды со льдом (400 мл). Смесь приобретает кремово-бежевый цвет, и ей дают перемешаться до тех пор, пока она не нагреется до комнатной температуры. Светло-коричневое твердое вещество фильтруют, промывают водой, сушат в вакууме и перекристаллизуют из этанола, полная 5,8-диметил-6-нитро-4-хинолон в виде желтого твердого вещества с Т.пл. 274-300oC (разлагается).
Спектр ПМР (300 МГц, дейтеродиметилсульфоксид) δ, м.д.: 2,43 (с, 3H) 2,75 (с, 3H) 5,60 (ш. с, 1H) 6,16 (д, 1H, J = 7,4 Гц) 7,83 (д, 1Н, J = 7,4 Гц) 7,87 (с, 1H).
Спектр ЯМР 13C (дейтеродиметилсульфоксид) δ: 17,27 17,6 112,46 123,57 126,6 131,92 139,58 142,48 146,5 179,64.
Масс-спектр (Cl), m/z 219 (M + H)+.
Элементный анализ:
Вычислено для C11H10N2O3•H2O, %: C - 55,92; H - 5,12; N - 11,86
Найдено, %: C - 55,69; H - 4,81: N - 11,56.
4-Хлор-5,8-диметил-6-нитрохинолин. Смешивают 2,70 г (12,42 ммоль) 5,8-диметил-6-нитро-4-хинолона и 38,02 г (248,5 ммоль, 23,1 мл) оксихлорида фосфора и нагревают на масляной бане до температуры 95oC. Протекание реакции прослеживают методом тонкослойной хроматографии (ТСХ) по расходу исходного материала и реакционную смесь охлаждают до комнатной температуры спустя 2 ч. Реакционную смесь медленно выливают в перемешиваемый раствор воды со льдом (200 мл) и подщелачивают концентрированным гидроксидом аммония. Смесь экстрагируют хлороформом (3 раза по 75 мл) и объединенные органические слои сушат над сульфатом натрия, фильтруют и выпаривают на роторном испарителе, получая 2,4 г 4-хлор-5,8-диметил-6-нитрохинолина. Этот продукт с Т.пл. 120-121oC используют на следующей стадии без дополнительной очистки.
Спектр ПМР (300 МГц, дейтерохлороформ) δ, м.д.: 2,75 (с, 3H) 2,91 (с, 3H) 7,55 (д, 1H, J = 4,6 Гц) 7,69 (с, 1H) 8,78 (д, 1H, J = 4,6 Гц).
Спектр ЯМР 13C (дейтерохлороформ) δ: 18,96 19,24 123,57 125,13 126,14 126,97 138,62 144,09 149,87 150,69.
Масс-спектр (Cl), m/z 237 (M + H)+.
5,8-диметил-4-метокси-6-нитрохинолин. Смешивают 4-хлор-5,8-диметил-6-нитрохинолина (1,52 г, 6,44 ммоль), 2,26 г (41,83 ммоль) метоксида натрия и 25 мл метанола и кипятят с обратным холодильником в атмосфере аргона. Протекание реакции прослеживают методом ТСХ и по завершении реакции смесь разбавляют 50 мл метанола и 100 мл воды. Смесь экстрагируют хлористым метиленом (2 раза по 200 мл). Объединенные органические слои сушат над карбонатом калия, фильтруют и выпаривают на роторном испарителе. Остаток очищают методом флэш-хроматографии на колонне, элюируемой смесью 30% этилацетата в гексане, получая 1,26 г 5,8-диметил-4-метокси-6-нитрохинолина в виде твердого вещества с Т.пл. 162-164oC.
Спектр ПМР (300 МГц, дейтеродиметилсульфоксид) δ, м.д.: 2,56 (с, 3H) 2,58 (с, 3H) 3,93 (с, 3H) 7,03 (д, 1H, J = 5,2 Гц) 7,74 (с, 1H) 8,72 (д, 1H, J = 5,2 Гц).
Спектр ЯМР 13C (дейтеродиметилсульфоксид) δ: 17,93 18,17 56,27 103,42 120,01 122,72 126,27 136,50 148,37 149,07 152,40 165,55.
Масс-спектр (Cl), m/z 233 (M + H)+.
6-амино-5,8-диметил-4-метоксихинолин. В колбу загружают 1,16 г (5,0 ммоль) 5,8-диметил-4-метокси-6-нитрохинолина, 5,64 г (25 ммоль) дигидрата хлористого олова и 50 мл этанола. Смесь кипятят 1 ч, разбавляют 100 мл воды и 30 мл концентрированного гидроксида аммония и экстрагируют хлороформом (2 раза по 200 мл). Органический слой сушат над карбонатом калия, фильтруют и растворители выпаривают на роторном испарителе, получая 0,99 г 6-амино-5,8-диметил-4-метоксихинолина. Этот продукт используют на следующей стадии без дополнительной очистки.
Спектр ПМР (300 МГц, дейтеродиметилсульфоксид) δ, м.д.: 2,53 (с, 3H) 2,56 (с, 3H) 3,93 (с, 3H) 5,15 (ш. с, 2H) 6,83 (д, 1H, J = 5,0 Гц) 7,12 (с, 1H) 8,37 (д, 1H, J = 5,0 Гц).
Спектр ЯМР 13C (дейтеродиметилсульфоксид) δ: 15,90 19,06 55,72 101,79 108,60 121,91 122,04 134,24 143,84 144,34 145,11 163,00.
Масс-спектр (Cl), m/z 203 (M + H)+.
5,8-диметил-6-изотиоцианато-4-метоксихинолин. Раствор 987 мг (4,9 ммоль) 6-амино-5,8-диметил-4-метоксихинолина, 1,74 г (7,5 ммоль) ди-2-пиридилтионокарбоната в 70 мл хлористого метилена перемешивают 2 ч при комнатной температуре. Растворитель удаляют выпариванием на роторном испарителе и остаток очищают методом флэш-хроматографии на силикагеле, элюируя смесью (8/2) гексан/этилацетат, получая 0,5 г 5,8-диметил-6-изотио-цианато-4-метокси-хинолин с Т.пл. 123-124oC.
Спектр ПМР (300 МГц, дейтеродиметилсульфоксид) δ, м.д.: 2,67 (с, 3H) 2,77 (с, 3H) 3,97 (с, 3H) 6,77 (д, 1H, J = 5,0 Гц) 7,35 (с, 1H) 8,72 (д, 1H, J = 5,0 Гц).
Спектр ЯМР 13C (дейтеродиметилсульфоксид) δ: 19,54 19,63 56,46 102,59 121,81 128,11 128,75 129,66 136,49 137,09 148,89 150,94 165,71.
Масс-спектр (Cl), m/z 245 (M + H)+.
N-(5,8-Диметил-4-метокси-6-хинолинил)-N'-2-аминоэтилтиомочевина.
В 2,25 мл (37 ммоль) этилендиамина по каплям добавляют раствор 501 мг (2,1 ммоль) 5,8-диметил-6-изотиоцианато-4-метоксихинолина в 20 мл хлористого метилена. Реакционную смесь перемешивают в течение ночи при комнатной температуре. Образовавшееся твердое вещество фильтруют, промывают небольшим количеством хлористого метилена, сушат в вакууме, получая 0,49 г N-(5,8-диметил-4-метокси-6-хинолинил)-N'-2-аминоэтилтиомочевины с Т.пл. 185-186oC.
Спектр ПМР (300 МГц, дейтеродиметилсульфоксид) δ, м.д.: 2,54 (с, 3H) 2,55 (с, 3H) 2,66 (ш. т, 2H) 3,2-3,6 (м) 3,92 (с, 1H) 6,97 (д, 1Н, J = 5,2 Гц) 7,32 (с, 1H) 8,64 (д, 1H, J = 5,2 Гц).
Спектр ЯМР 13C (дейтеродиметилсульфоксид) δ: 17,48 18,39 40,48 46,82 55,72 101,91 120,67 128,83 130,32 134,01 134,67 147,90 149,7 164,46 181,24.
Масс-спектр (Cl), m/z 305 (M + H)+.
Дигидрохлоридная соль 5,8-диметил-6-(2-имидазолиниламино)-4- метоксихинолина, полугидрат.
Смесь 493 мг (1,6 ммоль) N-(5,8-диметил-4-метокси-6-хинолинил)- N'-2-аминоэтилтиомочевины и 537 мг (1,7 ммоль) ацетата ртути в 60 мл этанола перемешивают 2 ч при комнатной температуре и затем фильтруют через Целит. Фильтрат добавляют в 10%-ный водный раствор карбоната калия (100 мл), продукт экстрагируют хлороформом (3 раза по 200 мл). Органический слой сушат над карбонатом калия, фильтруют и выпаривают до остатка, который очищают методом флэш-хроматографии на силикагеле, элюируемом смесью (1/9) метанол/хлороформ, насыщенной аммиаком, получая 5,8-диметил-6-(2-имидазолиниламино)-4-метоксихинолин. Это твердое вещество растворяют в смеси 0,8 мл 12-нормальной соляной кислоты и 4 мл метанола. Добавляют 7 мл эфира и смесь выдерживают при комнатной температуре. Образовавшееся твердое вещество отфильтровывают, промывают эфиром и сушат, получая 0,304 г полугидрата дигидрохлоридной кислой соли 5,8-диметил-6-(2- имидазолиниламино)-4-метоксихинолина. Т.пл. выше 300oC.
Спектр ПМР (300 МГц, дейтеродиметилсульфоксид), δ, м.д.: 2,64 (с, 3H) 2,71 (с, 3H) 3,61 (с, 4H) 4,21 (с, 3H) 7,50 (д, 1H, J = 5,0 Гц) 7,75 (с, 1H) 8,37 (с, 2H) 8,95 (д, 1H, J = 5,0 Гц) 11,12 (с, 1H).
Спектр ЯМР 13C (дейтеродиметилсульфоксид) δ: 17,85 18,78 43,14 58,84 103,37 120,84 129,1 130,94 133,41 134,48 139,08 146,26 158,42 171,08.
Масс-спектр (CI/CH4), m/z 271 (M + H)+.
Элементный анализ:
Вычислено для C15H18N4O•2HCl•0,5H2O, %: C - 51,14; H - 6,01; N - 15,90
Найдено, %: C - 51,01; H - 6,12; N - 15,69.
Пример 5. Соль фумаровой кислоты и 6-(2-имидазолиниламино)-8- метокси-5-метилхинолина, моногидрат
8-Метокси-5-метил-6-нитрохинолин. Смесь 2-метокси-5-метил-4-нитроанилин (30,51 г 167,5 ммоль), гексагидрата треххлористого железа (91,34 г 337,9 ммоль), хлорида цинка (3,07 г, 22,5 ммоль) и 14 мл 12 н. соляной кислоты в 400 мл этанола нагревают до 60oC. К этой смеси по каплям, в течение 3 ч добавляют 40,36 г (300,8 ммоль) 1,1,3-триметоксипропана в 55 мл этанола с помощью поршневого насоса. Затем смесь оставляют перемешиваться еще в течение 2,5 ч при 60oC. Реакционную смесь охлаждают до комнатной температуры и растворитель выпаривают на роторном испарителе, оставляя небольшой объем. Смесь подщелачивают до pH 10, добавляя насыщенный раствор карбоната калия. Продукт экстрагируют хлороформом (4 раза по 500 мл) и объединенные органические слои выпаривают на роторном испарителе. Остаток очищают методом флэш-хроматографии на силикагеле, элюируемом смесью 45% этилацетата в гексане, получая 1,16 г 8-метокси-5-метил-6- нитрохинолина.
Спектр ПМР (300 МГц, дейтерохлороформ) δ, м.д.: 2,7 (с, 3H) 4,1 (с, 3H) 7,3 (с, 1H) 7,6 (дд, 1H, J = 8,7 и 4,2 Гц) 8,4 (дд, 1H, J = 8,7 и 1,6 Гц) 9,0 (дд, 1H, J = 4,2 и 1,6 Гц).
Спектр ЯМР 13C (дейтерохлороформ) δ: 13,6 56,4 102,4 121,6 122,9 128,3 134,2 141,3 147,5 151,2 154,3.
Масс-спектр (Cl), m/z 219 (M + H)+.
5-метил-6-амино-8-метоксихинолин. Смесь 6,11 г (28,0 ммоль) 5-метил-6-нитро-8-метоксихинолина, 8,69 г (137,8 ммоль) формиата аммония и каталитическое количество (0,6 г) палладия (10%) на угле в 280 мл метанола перемешивают 45 минут при комнатной температуре. Добавляют еще 0,6 г палладия (10%) на угле и смесь перемешивают еще 20 минут. Затем смесь фильтруют через Целит, промывая твердое вещество этанолом. Фильтрат выпаривают на роторном испарителе и остаток очищают методом флэш-хроматографии на силикагеле, элюируемом смесью 30% этилацетата в гексане, получая 4,13 г 5-метил-6-амино-8- метоксихинолина.
Спектр ПМР (300 МГц, дейтерохлороформ) δ, м.д.: 2,1 (с, 3H) 3,9 (с, 3H) 6,4 (с, 3H) 7,2 (дд, 1H, J = 8,7 и 4,2 Гц) 7,9 (дд, 1H, J = 8,7 и 1,6 Гц) 8,5 (дд, 1H, J = 4,2 и 1,6 Гц>.
Спектр ЯМР 13C (дейтерохлороформ) δ: 10,7 55,7 100,6 103,5 121,6 129,5 130,4 136,0 142,0 144,7 154,1.
Масс-спектр (Cl), m/z 189 (M + H)+.
5-метил-6-изотиоцианато-8-метоксихинолин. Смешивают 4,07 г (21,6 ммоль) 5-метил-6-амино-8-метоксихинолина, 1,6 мл (21,6 ммоль) тиофосгена и 1,8 мл 12 н. соляной кислоты в воде перемешивают 45 минут при комнатной температуре. Смесь обрабатывают 100 мл 1 н. гидроксида натрия и продукт экстрагируют (4 раза по 100 мл) хлористым метиленом. Объединенные органические слои выпаривают на роторном испарителе. Остаток очищают методом флэш-хроматографии на силикагеле, элюируемом смесью 50% этилацетата в гексане, получая 2,68 г 5-метил-6-изотиоцианато-8-метоксихинолина.
Спектр ПМР (300 МГц, дейтерохлороформ) δ, м.д.: 2,5 (с, 3H) 4,0 (с, 3H) 6,8 (с, 1H) 7,5 (дд, 1H, J = 8,7 и 4,2 Гц) 8,2 (дд, 1H, J = 8,7 и 1,6 Гц) 8,9 (дд, 1H, J = 4,2 и 1,6 Гц).
Спектр ЯМР 13C (дейтерохлороформ) δ: 13,3 56,2 105,9 121,7 122,4 127,3 128,4 132,6 136,1 139,4 149,1 154,4.
Масс-спектр (CI), m/z 231 (M + H)+.
N-(5-метил-8-метокси-6-хинолинил)-N'-2-аминоэтилтиомочевина. В раствор 5,5 мл (82,3 ммоль) 1,2-этилендиамина в 250 мл толуола по каплям добавляют раствор 2,68 г (11,6 ммоль) 5-метил-6-изотиоцианато-8- метоксихинолина в 380 мл толуола. Раствор перемешивают 10 минут при комнатной температуре. Образовавшийся белый осадок отфильтровывают и перекристаллизовывают из горячего метанола, получая 3,33 г N-(8-метокси-5-метил-6-хинолинил)-N'-(2-аминоэтил)-тиомочевины в виде белого твердого вещества.
Спектр ПМР (300 МГц, дейтеродиметилсульфоксид) δ, м.д.: 2,3 (с, 3H) 2,7 (ш. т, 2H) 3,4 (ш. т, 2H) 3,9 (с, 3H) 7,0 (с, 1H) 7,5 (дд, 1H, J = 8,7 и 4,2 Гц) 8,4 (дд, 1H, J = 8,7 и 1,6 Гц) 8,8 (дд, 1H, J = 4,2 и 1,6 Гц).
Спектр ЯМР 13C (дейтеродиметилсульфоксид) δ: 12,9 41,2 47,7 56,0 109,4 121,7 122,2 128,8 133,2 134,4 139,3 148,5 153,7 181,3.
Масс-спектр (Cl), m/z 291 (M + H)+.
Соль фумаровой кислоты и 6-(2-имидазолиниламино)-8-метокси-5- метилхинолина, моногидрат
Смесь 3,22 г (11,1 ммоль) N-(5-метил-8-метокси-6-хинолинил)-N'-2- аминоэтилтиомочевины и 3,99 г (20,0 ммоль) ацетата ртути (II) в 110 мл метанола нагревают до кипения в течение 30 минут. Полученную черную смесь охлаждают до комнатной температуры и обрабатывают гидратом гидросульфита натрия (NaSH•H2O, 0,67 г, 12,4 ммоль) и перемешивают 15 минут. Затем смесь подкисляют до pH 2 1н. соляной кислотой и фильтруют через Целит, промывая твердое вещество этанолом. Фильтрат подщелачивают до pH 11, добавляя 50% раствор гидроксида натрия, и продукт экстрагируют хлороформом (4 раза по 100 мл). Объединенные экстракты выпаривают на роторном испарителе. Остаток очищают методом флэш-хроматографии на силикагеле, элюируя смесью 10% метанола в хлороформе, содержащей 1% гидроксида аммония. Получают 2,22 г 5-метил-6-(2-имидазолиниламино)-8-метоксихинолина. Фумаратную соль получают, растворяя 0,51 г продукта в 50 мл метанола и обрабатывая продукт 0,23 г фумаровой кислоты в 25 мл метанола. Растворитель выпаривают на роторном испарителе и остаток перекристаллизовывают из смеси метанола и эфира, получая 0,37 г моногидрата соли фумаровой кислоты и 6-(2-имидазолиниламино)-8-метокси-5-метилхинолина с Т.пл. 232oC (разлагается).
Спектр ПМР (300 МГц, тяжелая вода) δ, м.д.: 2,4 (с, 3H) 3,7 (с, 4H) 4,0 (с, 3H) 6,4 (с, 2H) 7,1 (с, 1H) 7,7 (ш. дд, 1H, J = 8,7 и 4,2 Гц) 8,6 (ш. д, 1H, J = 8,7 Гц) 8,7 (ш. д, 1H, J = 4,2 Гц).
Спектр ЯМР 13C (тяжелая вода) δ: 11,6 42,9 56,3 109,9 122,5 124,0 128,9 132,4 132,8 134,8 140,3 145,1 150,2 158,9 172,3.
Масс-спектр (Cl), m/z 257 (M + H)+. Масс-спектр HR, m/z (M + H): расчет 257,1402; найдено 257,1397.
Элементный анализ:
Вычислено для C14H16N4• C4H4O4•0,9H2O, %: C - 55,63; H - 5,64; N - 14,42
Найдено, %: C - 55,83; H - 5,42; N - 14,73.
Пример 6. Уксуснокислая соль 4-хлор-5,8-диметил-6-(2- имидазолиниламино)хинолина, 0,25 гидрат
6-амино-4-хлор-5,8-диметилхинолин. Смешивают 1,40 г (5,94 ммоль) 4-хлор-5,8-диметил-6-нитрохинолина, 50 мл этанола и 6,68 г (29,61 ммоль) дигидрата хлористого олова и нагревают до кипения. Спустя 30 минут реакционную смесь охлаждают до комнатной температуры, выливают ее на измельченный лед (200 г) и подщелачивают 30 мл концентрированного раствора гидроксида аммония. Эту смесь экстрагируют хлороформом (3 раза по 250 мл), сушат над карбонатом калия, фильтруют и выпаривают на роторном испарителе. Сырой материал очищают методом флэш-хроматографии на колонке, элюируя смесью 20% этилацетата в гексане, получая 686 мг 6-амино-4-хлор-5,8-диметилхинолина в виде твердого вещества.
Спектр ПМР (300 МГц, дейтерохлороформ) δ, м.д.: 2,67 (с, 6H) 3,8-4,0 (ш. с, 2H) 7,07 (с, 1H) 7,34 (д, 1H, J = 4,6 Гц) 8,45 (д, 1H, J = 4,6 Гц).
Спектр ЯМР 13C (дейтеродиметилсульфоксид) δ: 16,01 18,49 106,76 122,76 123,49 126,76 135,06 137,83 142,60 143,59 145,98.
Масс-спектр (Cl), m/z 207 (M + H)+.
4-хлор-5,8-диметил-6-изотиоцианатохинолин. Смешивают 637 мг (3,08 ммоль) 6-амино-4-хлор-5,8-диметилхинолина, 1,10 г (4,76 ммоль) ди-2-пиридилтионокарбоната (ДПТ), 101 мг (0,82 ммоль) 4-диметиламинопиридина (ДМАП) и 60 мл хлористого метилена и перемешивают 5 ч. Реакционную смесь выпаривают на роторном испарителе и очищают на аспирационной вакуумной колонке, элюируя 10% этилацетата в гексане, получая 583 мг 4-хлор-5,8-диметил-6-изотиоцианатохинолина в виде светло-коричневого твердого вещества с Т.пл. 134-135oC.
Спектр ПМР (300 МГц, дейтерохлороформ) δ, м.д.: 2,69 (с, 3H), 2,94 (с, 3H), 7,42 (с, 1H), 7,46 (д, 1H, J = 4,6 Гц) 8,67 (д, 1H, J = 4,6 Гц).
Спектр ЯМР 13C (дейтерохлороформ) δ: 18,67 19,16 124,42 126,25 128,05 128,45 129,74 137,17 137,85 142,59 148,01 148,23.
Масс-спектр (Cl), m/z 249 (M + H)+.
Элементный анализ:
Вычислено для C12H9N2ClS, %: C - 57,94; H - 3,65; N - 11,27
Найдено, %: C - 58,06; H - 3,94; N - 11,09.
N-(4-хлор-5,8-диметил-6-хинолинил)-N'-2-аминоэтилтиомочевина. Раствор 1,27 г (5,12 ммоль) 4-хлор-5,8-диметил-6-изотиоцианатохинолина добавляют по каплям в перемешиваемый раствор 1,71 мл (25,60 ммоль) 1,2-этилендиамина в 10 мл толуола. Добавляют еще 20 мл толуола, чтобы смыть изотиоцианат. Реакционную смесь перемешивают в течение ночи при комнатной температуре. Образовавшийся белый осадок отфильтровывают и хорошо промывают толуолом, получая 1,60 г N-((4-хлор-5,8-диметил-6-хинолинил)- N'-(2-аминоэтил)тиомочевины. Этот продукт используют на следующей стадии без дополнительной очистки.
Спектр ПМР (300 МГц, дейтеродиметилсульфоксид) δ, м.д.: 2,58 (с, 3H) 2,66 (м, 5H) 3,43 (ш. т, 2H) 7,50 (с, 1H) 7,61 (д, 1H, J = 4,6 Гц) 8,67 (д, 1H, J = 4,6 Гц).
Спектр ЯМР 13C (дейтеродиметилсульфоксид) δ: 18,10 18,40 42,08 46,77 123,79 125,69 127,82 131,31 134,96 136,91 141,23 147,88 181,51.
Масс-спектр (Cl), m/z 309 (M + H)+.
Уксуснокислая соль 4-хлор-5,8-диметил-6-(2-имидазолиниламино)хинолина, 0,25 гидрат.
Смесь 0,401 г (1,30 ммоль) N-(4-хлор-5,8-диметил-6-хинолинил)-N'- 2-аминоэтилтиомочевины 497 мг (1,56 ммоль) ацетата ртути (II) и 50 мл метанола перемешивают при комнатной температуре. Спустя 2,5 ч черную смесь фильтруют через Целит, промывая твердое вещество метанолом. Остаток очищают методом флэш-хроматографии на силикагеле, элюируя смесью 10% метанола в хлороформе, содержащей 1% гидроксида аммония. Получают 0,24 г уксуснокислой соли 4-хлор-5,8-диметил-6-(2- имидазолиниламино)хинолина, (0,25 гидрат) с Т.пл. 134-135oC (разлагается).
Спектр ПМР (300 МГц, дейтеродиметилсульфоксид) δ, м.д.: 1,86 (с, 3H) 2,57 (с, 3H) 2,68 (с, 3H) 3,39 (с, 4H) 7,31 (с, 1H) 7,55 (д, 1H, J = 4,4 Гц) 8,56 (д, 1H, J = 4,4 Гц).
Спектр ЯМР 13C (дейтеродиметилсульфоксид) δ: 17,87 18,95 22,53 42,56 123,15 124,00 126,74 129,49 135,68 140,73 144,98 146,49 147,10 158,38, 173,81.
Масс-спектр (Cl), m/z 275 (M + H)+.
Элементный анализ. Вычислено для C14H15N4Cl•CH3CO2H•0,25H2O, %: C - 56,64; H - 5,79; N - 16,51; Cl - 10,45.
Найдено, %: C - 56,83; H - 5,69; N - 16,27; Cl - 10,49.
Пример 7. 5,8-Диметил-4-фтор-6-(2-имидазолиниламино)хинолин.
5,8-диметил-4-фтор-6-нитрохинолин. Смешивают 4-хлор-5,8-диметил-6-нитрохинолин (500 мг, 2,11 ммоль), 12 мл диметилсульфоксида и 184 мг (3,17 ммоль) фторида калия, высушенного при замораживании (получен лиофильной сушкой 5%-ного раствора фторида калия), и нагревают до температуры 165oC на масляной бане. Протекание реакции прослеживают методом тонкослойной хроматографии (ТСХ) по расходу исходного материала. Спустя 1 ч реакционную смесь охлаждают до комнатной температуры и разбавляют водой (10 мл). Реакционную смесь отфильтровывают и хорошо промывают водой и этилацетатом. Отделяют водно-органический фильтрат и водную фазу обратно экстрагируют 10 мл этилацетата. Объединенные органические слои промывают водой (4 раза по 50 мл), сушат над сульфатом натрия, фильтруют и выпаривают. Сырой материал очищают на аспирационной вакуумной колонке, элюируя 20% этилацетата в гексане, получая 128 мг 4-фтор-5,8-диметил-6-нитрохинолина в виде желтого твердого вещества с Т.пл. 136-137oC.
Спектр ПМР (300 МГц, дейтерохлороформ) δ, м. д.: 2,75 (с, 3H) 2,78 (дублет, 3H, JH-F = 6,5 Гц) 7,18 (дд, 1H, JH-F = 12,7 Гц, JH-H = 4,9 Гц) 7,74 (с, 1H) 8,92 (дд, 1H, JH-F = 7,8 Гц, JH-H = 4,9 Гц).
Спектр ЯМР 13C (дейтеродиметилсульфоксид) δ: 16,28 16,46 17,81 108,67 J08,92 118,10 118,20 123,58 124,63 137,09 148,48 149,66 153,09 153,22 165,45 169,04.
Масс-спектр (Cl), m/z 221 (M + H)+.
5,8-диметил-6-амино-4-фторхинолин. Смесь 0,8 г (3,63 ммоль) 5,8-диметил-6-нитро-4-фторхинолина, катализатор (0,242 г) палладия (10%) на угле в 100 мл этилацетата помещают в атмосферу водорода. Протекание реакции прослеживают методом тонкослойной хроматографии по расходу исходного материала. Спустя 1 ч реакционную смесь фильтруют через Целит и хорошо промывают твердое вещество этилацетатом. Фильтрат выпаривают и остаток сушат в вакууме, получая 0,65 г 5,8-диметил-6-амино-4-фторхинолина.
Спектр ПМР (300 МГц, дейтерохлороформ) δ, м.д.: 2,1 (дублет, 1H, JHF = 10,6 Гц) 2,69 (с, 3H) 3,6-4,1 (ш. с, 2H) 6,98 (дд, 1H, JHF = 13,5 и JH-H = 4,9 Гц) 7,07 (с, 1H) 8,57 (дд, 1H, JHF = 7,8 и JH-H = 4,9 Гц).
Масс-спектр (Cl), m/z 191 (M + H)+.
4-фтор-5,8-диметил-6-изотиоцианатохинолин. Смешивают 650 мг (3,41 ммоль) 6-амино-4-фтор-5,8-диметилхинолина, 1,20 г (5,1 ммоль) ди-2-пиридилтионокарбоната (ДПТ), 100 мг (0,85 ммоль) 4-диметиламинопиридина (ДМАП) и 60 мл хлористого метилена и перемешивают 5 ч. Реакционную смесь выпаривают на роторном испарителе и очищают на аспирационной вакуумной колонке, элюируя 10% этилацетата в гексане, получая 510 мг 4-фтор-5,8-диметил-6-изотиоцианатохинолина в виде твердого вещества.
Спектр ПМР (300 МГц, дейтерохлороформ) δ, м.д.: 2,73 (с, 3H) 2,79 (д, 3H, JHF = 6,4 Гц) 7,13 (дд, 1H, JHF = 12,6 Гц, JHH = 4,9 Гц), 7,46 (с, 1H) 8,83 (дд, 1H, JHF = 7,8 Гц, JHH = 4,9 Гц).
Спектр ЯМР 13C (дейтерохлороформ) δ: 16,91 17,08 18,20 107,48 107,72 119,38 119,48 126,26 126,30 128,57 137,09 137,38 149,08 150,09 150,20 165,06 168,65.
Масс-спектр (Cl), m/z 233 (M + H)+.
N-(4-фтор-5,8-диметил-6-хинолинил)-N'-2-аминоэтилтиомочевина. Раствор 0,5 г (2,15 ммоль) 4-фтор-5,8-диметил-6-изотиоцианатохинолина в 20 мл толуола добавляют по каплям в перемешиваемый раствор 1,94 г (32,2 ммоль) 1,2-этилендиамина в 10 мл толуола. Реакционную смесь перемешивают в течение ночи при комнатной температуре. Образовавшийся белый осадок отфильтровывают и хорошо промывают толуолом, получая 0,63 г N-(4-фтор-5,8-диметил-6-хинолинил)-N'-(2-аминоэтил)тиомочевины. Этот продукт используют на следующей стадии без дополнительной очистки.
Спектр ПМР (300 МГц, дейтеродиметилсульфоксид) δ, м.д.: 2,49 (д, 3H, JHF = 6,8 Гц) 2,60 (с, 3H) 2,63 (м, 2H) 3,38 (м, 2H) 7,36 (дд, 1H, JHF = 13,4 Гц,
JH-H = 4,9 Гц) 7,47 (с, 1H), 8,81 (дд, 1H, JHF = 8,1 Гц, JH-H = 4,9 Гц).
Масс-спектр (Cl), m/z 293 (M + H)+.
Соль фумаровой кислоты и 4-фтор-5,8-диметил-6-(2-имидазолиниламино) хинолина, 0,1 гидрат.
Смесь 0,63 г (2,15 ммоль) N-(5,8-диметил-4-фтор-6-хинолинил)- N'-2-аминоэтилтиомочевины и 0,82 г (2,58 ммоль) ацетата ртути (II) в 70 мл метанола перемешивают при комнатной температуре. Спустя 2,5 ч черную смесь фильтруют через Целит, промывая твердое вещество метанолом. Остаток очищают методом флэш-хроматографии на силикагеле, элюируемом смесью 20% метанола в хлористом метилене, содержащей 1% гидроксида аммония. Получают 0,42 г 5,8-диметил-4-фтор-6-(2- имидазолиниламино)хинолина. Фумаратную соль получают, растворяя этот продукт в 40 мл метанола и обрабатывая продукт 0,18 г фумаровой кислоты в 15 мл метанола. Растворитель выпаривают на роторном испарителе и остаток перекристаллизовывают из смеси метанола и эфира, получая 91 мг соли фумаровой кислоты и 5,8-диметил-4-фтор-6-(2- имидазолиниламино)хинолина (0,1 гидрат) с Т.пл. 118oC (разлагается). (Примечание: разложение происходит при хранении в метаноле).
Спектр ПМР (300 МГц, пердейтерометанол) δ, м.д.: 2,69 (д, 3H, JHF = 7,1 Гц) 2,71 (с, 3H) 3,76 (с, 4H) 6,65 (с, 2H) 7,31 (дд, 1H, JHF = 13,0 Гц, JH-H = 5,0 Гц) 7,52 (с, 1H), 8,84 (дд, 1H, JHF = 7,8 Гц, JH-H = 5,0 Гц).
Спектр ЯМР 13C (дейтеродиметилсульфоксид) δ: 16,25 16,41 18,43 43,03 107,86 108,1 119,44 119,54 126,27 129,93 134,16 135,63 136,23 149,31 149,33 150,81 150,93 159,97 165,05 168,60 169,20.
Масс-спектр (Cl), m/z 259 (M + H)+.
Элементный анализ:
Вычислено для C14H15N4F• C4H4O4•0,1H2O, %: C - 57,47; H - 5,14; N - 14,90
Найдено, %: C - 57,23; H - 5,19; N - 14,60.
Пример 8. Уксуснокислая соль 4-циано-5,8-диметил-6-(2- имидазолиниламино)хинолина, 0,75 гидрат
4-Бром-5,8-диметил-6-нитрохинолин. Смешивают 1,00 г (4,58 ммоль) 5,8-диметил-6-нитрохинолона, 15 мл толуола, 0,74 мл пиридина (9,17 ммоль) и 1,05 г (3,66 ммоль, 23,1 мл) оксибромида фосфора и нагревают в масляной бане до температуры 90oC. Протекание реакции прослеживают методом тонкослойной хроматографии по расходу исходного материала и реакционную смесь охлаждают до комнатной температуры спустя 30 минут. Реакционную смесь разбавляют в 10 мл воды и экстрагируют хлористым метиленом (3 раза по 100 мл). Объединенные органические слои промывают 2 раза водой (по 100 мл), сушат над сульфатом натрия, фильтруют и выпаривают на роторном испарителе, получая 0,7 г 4-бром-5,8-диметил-6-нитрохинолина, который используют без дополнительной очистки. Т.пл. 121-122oC.
Спектр ПМР (300 МГц, дейтерохлороформ) δ, м.д.: 2,64 (с, 3H) 2,83 (с, 3H) 7,60 (с, 1H) 7,72 (д, 1H, J = 4,56 Гц) 8,54 (д, 1H, J = 4,5 Гц).
Спектр ЯМР 13C (дейтеродиметилсульфоксид) δ: 18,91 19,56 123,40 127,10 129,32 132,52 138,61 149,50 149,65 150,63.
Масс-спектр (Cl), m/z 281 (M + H)+ и 283 (M + H (+2))+.
4-циано-5,8-диметил-6-нитрохинолин. Смешивают 0,2 г (0,71 ммоль) 4-бром-5,8-диметил-6-нитрохинолина с 4 мл N,N-диметилформамида и 190 мг (2,13 ммоль) моноцианида меди. После нагревания до кипения в течение 1 ч смесь охлаждают до комнатной температуры, фильтруют и промывают твердое вещество хлористым метиленом и водой. Водно-органический слой экстрагируют хлористым метиленом (3 раза по 100 мл). Объединенные органические слои промывают водой (1 раз 100 мл), сушат над сульфатом натрия, фильтруют и выпаривают на роторном испарителе. Остаток очищают на аспирационной вакуумной колонке, элюируя 15% этилацетата в гексане, получая 69 мг 4-циано-5,8-диметил-6-нитрохинолина в виде твердого вещества с Т.пл. 191-192oC.
Спектр ПМР (300 МГц, дейтерохлороформ) δ, м.д.: 2,80 (с, 3H) 3,02 (с, 3H) 7,83 (с, 1H) 7,92 (д, 1H, J = 4,3 Гц) 9,12 (д, 1H, JH-H = 4,3 Гц).
Спектр ЯМР 13C (дейтерохлороформ) δ: 16,25 18,28 118,04 118,78 124,48 125,02 125,89 129,18 139,45 148,60 149,63 150,48.
Масс-спектр (Cl), m/z 228 (M + H)+.
6-амино-4-циано-5,8-диметилхинолин. Смешивают 340 мг (1,51 ммоль) 4-циано-5,8-диметил-6-нитрохинолина, 15 мл этанола и 1,69 г (7,5 ммоль) дигидрата хлористого олова и нагревают до кипения. Спустя 30 минут реакционную смесь охлаждают до комнатной температуры, выливают ее на измельченный лед (3 г) и подщелачивают 30 мл концентрированного раствора гидроксида аммония. Эту смесь экстрагируют хлороформом (3 раза по 50 мл), сушат над карбонатом калия, фильтруют и выпаривают на роторном испарителе, получая 270 мг 6-амино-4-циано-5,8-диметилхинолина в виде твердого вещества. Этот продукт используют на следующей стадии без дополнительной очистки.
Спектр ПМР (300 МГц, дейтерохлороформ) δ, м.д.: 2,73 (с, 6H) 7,17 (с, 1H) 7,70 (д, 1H, J = 4,4 Гц) 8,72 (д, 1H, J = 4,4 Гц).
Масс-спектр (Cl), m/z 198 (M + H)+.
4-циано-5,8-диметил-6-изотиоцианатохинолин. Смешивают 270 мг (1,39 ммоль) 6-амино-4-циано-5,8-диметилхинолина, 480 мг (2,08 ммоль) ди-2-пиридилтионокарбоната, 42 мг (0,34 ммоль) 4-диметиламинопиридина и 30 мл хлористого метилена и перемешивают 5 ч. Реакционную смесь выпаривают на роторном испарителе и очищают на аспирационной вакуумной колонке, элюируя 10% этилацетата в гексане, получая 290 мг 4-циано-5,8-диметил-6- изотиоцианатохинолина в виде твердого вещества с Т.пл. 179-181oC.
Спектр ПМР (300 МГц, дейтерохлороформ) δ, м.д.: 2,72 (с, 3H) 2,98 (с, 3H) 7,51 (с, 1H) 7,78 (д, 1H, J = 4,3 Гц), 8,96 (д, 1H, J = 4,3 Гц).
Спектр ЯМР 13C (дейтерохлороформ) δ: 16,28 18,08 116,98 118,57 125,21 126,78 128,43 129,25 130,88 138,58 146,81 147,50.
Масс-спектр (Cl), m/z 240 (M + H)+.
N-(4-циано-5,8-диметил-6-хинолинил)-N'-2-аминоэтилтиомочевина. Раствор 0,28 г (1,17 ммоль) 4-циано-5,8-диметил-6-изотиоцианатохинолина в 20 мл толуола добавляют по каплям в перемешиваемый раствор 1,05 г (17,5 ммоль) этилендиамина в 10 мл толуола. Реакционную смесь перемешивают в течение ночи при комнатной температуре. Образовавшийся белый осадок отфильтровывают и хорошо промывают толуолом, получая 0,33 г N-(4-циано-5,8-диметил-6-хинолинил)-N'-(2-аминоэтил)тиомочевины с Т.пл. 173-174oC. Этот продут используют на следующей стадии без дополнительной очистки.
Спектр ПМР (300 МГц, дейтеродиметилсульфоксид) δ, м.д.: 2,65 (с, 3H) 2,72 (м, 5H) 3,45 (т, 2H) 7,67 (с, 1H) 8,09 (д, 1H, J = 4,3 Гц) 9,02 (д, 1H, J = 4,3 Гц).
Масс-спектр (Cl), m/z 300 (M + H)+.
Соль уксусной кислоты и 4-циано-5,8-диметил-6-(2-имидазолиниламино)- хинолина, 0,75 гидрат. Смесь 0,33 г (1,15 ммоль) N-(5,8-диметил-4-фтор- 6-хинолинил)-N'-2-амино-этилтиомочевины, 0,44 г (1,38 ммоль) ацетата ртути и 40 мл метанола перемешивают при комнатной температуре. Спустя 2,5 ч черную смесь фильтруют через Целит, промывая твердое вещество метанолом. Остаток очищают методом флэш-хроматографии на силикагеле, элюируя смесью 10% метанола в хлороформе, содержащей 1% гидроксида аммония. Получают 0,39 г ацетата 4-циано-5,8-диметил-6-(2-имидазолиниламино)хинолина (0,75 гидрат) с Т.пл. 221-232oC (разлагается).
Спектр ПМР (300 МГц, дейтеродиметилсульфоксид) δ, м.д.: 1,84 (с, 3H) 2,61 (с, 3H) 2,69 (с, 3H) 3,42 (с, 4H) 7,42 (с, 1H), 8,95 (д, 1H, J = 4,3 Гц) 9,82 (д, 1H, J = 4,3 Гц).
Спектр ЯМР 13C (дейтеродиметилсульфоксид) δ: 15,14 18,45 22,47 42,51 114,89 120,16 121,82 125,99 128,50 129,85 136,17 145,36 145,70 146,40 158,48 173,88.
Масс-спектр (Cl), m/z 266 (M + H)+.
Элементный анализ:
Вычислено для C15H15N5• CH3CO2H•0,75H2O, %: C - 60,25; H - 6,10; N - 20,67
Найдено, %: C - 60,46; H - 6,55; N - 20,34.
Композиции
Другим объектом изобретения являются композиции, которые содержат безопасное и эффективное количество соединения изобретения или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Используемый в описании термин "безопасное и эффективное количество" обозначает количество соединения изобретения, достаточное для существенного индуцирования положительной модификации в состоянии, которое нужно лечить, но достаточно низкое для того, чтобы избежать серьезных побочных эффектов (при приемлемом соотношении польза/риск) в пределах объема тщательной медицинской оценки. Безопасное и эффективное количество соединения будет изменяться с возрастом и физическим состоянием пациента, которого следует лечить, тяжестью состояния, продолжительностью лечения, природой одновременной терапии, конкретным применяемым фармацевтически приемлемым носителем и подобными факторами в пределах знания и заключения лечащего врача.
Композиции изобретения предпочтительно содержат от около 0,0001% до около 99% по массе соединения изобретения, более предпочтительно от около 0,01% до около 90%, также предпочтительно от около 10% до около 50%, также предпочтительно от около 5% до около 10%, также предпочтительно от около 1% до около 5% и также предпочтительно от около 0,1% до около 1%.
Кроме соединения изобретения композиции изобретения содержат фармацевтически приемлемый носитель. Применяемый в описании термин "фармацевтически приемлемый носитель" обозначает один или несколько совместимых твердых или жидких наполнителей-разбавителей или капсулирующих веществ, которые пригодны для введения человеку или низшему животному. Применяемый в описании термин "совместимый" обозначает, что компоненты композиции способны смешиваться с соединением изобретения и друг с другом таким образом, чтобы не было взаимодействия, которое могло бы существенно снизить фармацевтическую активность композиции при обычном применении. Фармацевтически приемлемые носители должны, конечно, быть достаточно чистыми и достаточно мало токсичными, чтобы их можно было вводить человеку или низшему животному, которых нужно лечить.
Некоторыми примерами веществ, которые могут служить фармацевтически приемлемыми носителями или компонентами их, являются сахара, например лактоза, глюкоза и сахароза; крахмалы, например кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, например натриевая соль карбоксиметилцеллюлозы, этилцеллюлоза и метилцеллюлоза; порошкообразный трагакант; солод; желатин; тальк; твердые смазывающие вещества, например стеариновая кислота и стеаринат магния; сульфат кальция; растительные масла, например арахисовое масло, хлопковое масло, кунжутное масло, оливковое масло, кукурузное масло и какао-масло; полиолы, например пропиленгликоль, глицерин, сорбит, маннит и полиэтиленгликоль, альгиновая кислота; эмульгаторы, например Tween®; смачивающие средства, например лаурилсульфат натрия; красящие средства; корригенты; таблетирующие средства; стабилизаторы; антиокислители; консерванты; вода без пирогенов; изотонический солевой раствор и фосфатные буферные растворы.
Выбор фармацевтически приемлемого носителя, который применяют в сочетании с соединением изобретения, по существу определяют тем путем, которым это соединение должно быть введено.
Если соединение изобретения нужно инъецировать, предпочтительным фармацевтически приемлемым носителем является стерильный физиологический раствор с совместимым с кровью суспендирующим средством, pH которого установлено около 7,4.
Предпочтительный метод введения соединений изобретения пероральный. Предпочтительной унифицированной лекарственной формой поэтому являются таблетки, капсулы, лепешки, жевательные таблетки и т.д. Такие унифицированные лекарственные формы содержат безопасное и эффективное количество соединения изобретения, которое присутствуют в количество предпочтительно от около 0,01 мг до около 200 мг, более предпочтительно от около 0,5 мг до около 25 мг, также предпочтительно от около 1 мг до около 10 мг. Фармацевтически приемлемые носители, пригодные для получения унифицированных лекарственных форм для перорального введения, хорошо известны в данной области. Таблетки обычно содержат фармацевтически совместимые вспомогательные средства, например инертные разбавители, такие как карбонат кальция, карбонат натрия, маннит, лактозу и целлюлозу; связующие, например крахмал, желатин и сахарозу; дезинтегрирующие средства, например крахмал, альгиновую кислоту и кроскармелозу; смазывающие вещества, например стеаринат магния, стеариновую кислоту и тальк. Для улучшения сыпучих характеристик порошкообразной смеси можно применять диоксид кремния. Для достижения требуемого внешнего вида можно добавлять красящие средства, например красители FD&C. Подслащивающие вещества и корригенты, например аспартам, сахарин, ментол, перечная мята и фруктовые корригенты, являются пригодными вспомогательными средствами для жевательных таблеток. Капсулы обычно содержат один или несколько твердых разбавителей, описанных выше. Выбор компонентов носителя зависит от второстепенных факторов, подобных вкусу, цене и устойчивости при хранении, которые не являются критичными для целей изобретения, такой выбор легко может сделать специалист данной области.
Пероральные композиции включают также жидкие растворы, эмульсии, суспензии и т. д. Фармацевтически приемлемые носители, пригодные для получения таких композиций, хорошо известны в настоящей области. Такие жидкие пероральные композиции предпочтительно содержат от около 0,001% до около 5% соединения изобретения, более предпочтительно от около 0,01% до около 0,5%. Типичные компоненты носителей для сиропов, элексиров, эмульсий и суспензий включают этанол, глицерин, пропиленгликоль, полиэтиленгликоль, жидкую сахарозу, сорбит и воду. Применяемые для получения суспензии типичные суспендирующие средства включают метилцеллюлозу, натриевую соль карбоксиметилцеллюлозы, Avicel® RC-591, трагакант и альгинат натрия; типичные смачивающие средства включают лецитин и полисорбат 80; и типичные консерванты включают метилпарабен и бензонат натрия. Пероральные жидкие композиции могут содержать также один или несколько компонентов, например подслащивающие вещества, корригенты и красящие вещества, описанные выше.
Другие композиции, пригодные для достижения системной доставки соединений изобретения в организм, включают подъязычные и буккальные лекарственные формы. Такие композиции обычно содержат одно или несколько растворимых веществ-наполнителей, например сахарозу, сорбит и маннит; связующие, например аравийскую камедь, микрокристаллическую целлюлозу, карбоксиметилцеллюлозу и гидроксипропилметилцеллюлозу. Можно также включать компоненты, придающие сыпучесть, смазывающие вещества, окрашивающие средства, антиокислители и корригенты, описанные выше.
Предпочтительным способом введения соединений изобретения является местный способ введения в место, где желательна его активность; интераназальные дозированные введения для устранения назальной заложенности, лекарственные формы для ингаляционного введения при астме, глазные капли, гели и кремы для глазных нарушений и пероральные дозы для желудочно-кишечных нарушений.
Предпочтительные композиции изобретения включают водные растворы, содержащие безопасное и эффективное количество соединения изобретения, предназначенные для местного интераназального введения. Такие композиции предпочтительно содержат от около 0,001% до около 5% соединения изобретения, более предпочтительно от около 0,01% до около 0,5%. Такие композиции обычно включают безопасное и эффективное количество консервантов, например хлорида и бензалкония и тимерозала; буферов, например фосфатных и ацетатных; агентов, регулирующих тоничность, например хлористого натрия; антиокислителей, например аскорбиновой кислоты; ароматизирующих средств и кислот и оснований для установления определенных значений pH этих водных композиций, если необходимо.
Предпочтительные композиции настоящего изобретения включают водные растворы, суспензии и сухие порошки, содержащие безопасное и эффективное количество соединения изобретения и предназначенные для распыления и местного ингаляционного введения. Такие композиции предпочтительно содержат от около 0,1% до около 50% соединения изобретения, более предпочтительно от около 1% до около 20%. Такие композиции обычно содержатся в контейнере с присоединенными средствами для распыления. Такие композиции обычно включают пропелленты (газ-носитель), например хлорфторуглероды 12/11 и 12/114; растворители, например воду, глицерин и этанол; стабилизаторы, например аскорбиновую кислоту, метабисульфит натрия; консерванты, например хлорид цетилпиридиния и хлорид бензалкония; средства, регулирующие тоничность, например хлористый натрий; и корригенты, например натриевое производное сахарина.
Предпочтительные композиции изобретения включают водные растворы, содержащие безопасное и эффективное количество соединения изобретения и предпочтительные для местного внутриглазного введения. Такие композиции предпочтительно содержат от около 0,0001% до около 5% соединения изобретения, более предпочтительно от около 0,01% до около 0,5%. Такие композиции обычно включают один или несколько консервантов, например хлорид бензалкония, тимерозал, ацетат фенил-ртути (II); наполнители, например полоксамеры, модифицированные целлюлозы, повидон и очищенную воду; средства, регулирующие тоничность, например хлористый натрий, маннит и глицерин; буферы, например ацетатный, цитратный, фосфатный и боратный; антиокислители, например метасульфит натрия, бутилированный гидрокситолуол и ацетилцистеин; кислоты и основания, которые можно применять для установления pH этих готовых лекарственных форм, если это необходимо.
Предпочтительные композиции настоящего изобретения включают твердые формы, например таблетки и капсулы, и жидкости, например растворы, суспензии и эмульсии (предпочтительно в мягких желатиновых капсулах), содержащие безопасное и эффективное количество соединения изобретения и предназначенные для местного введения в желудочно-кишечный тракт пероральным путем. Такие композиции предпочтительно содержат от около 0,01 мг до около 100 мг на дозу, более предпочтительно от около 0,1 мг до около 5 мг на дозу. Такие композиции можно покрыть оболочками обычными методиками, обычно зависимыми от pH среды и времени оболочками, благодаря чему соединение изобретения выделяется в желудочно-кишечном тракте по соседству с желаемым местом применения или в определенное время для оказания желаемого действия. Такие лекарственные формы обычно содержат (но могут содержать и другие компоненты) один или несколько из компонентов: ацетат-фталат целлюлозы, поливинилацетатфталат, фталат гидроксипропилметилцеллюлозы, этилцеллюлозу, оболочки Eudragit®, воски и шеллак.
Композиции изобретения могут дополнительно включать другие лекарственные средства. Неограничивающие примеры лекарственных средств, которые можно ввести в композиции изобретения и типичные дозированные количества их, включают: респираторные лекарственные средства: классические антигистамины, например хлорфенирамин в количестве от около 1 мг до около 4 мг на дозу и дифенгидрамин в количестве от около 10 мг до около 50 мг на дозу; неседдативные антигистамины, например терфенадин в количестве от около 30 мг до около 60 мг на дозу, лоратадин в количестве от около 5 мг на дозу до около 10 мг на дозу; отхаркивающие средства, например гуаифенезин в количестве от около 100 мг до около 200 мг на дозу; противокашлевые средства, например декстрометорфан в количестве от около 5 мг до около 30 мг на дозу; и аналгетики, например ибупрофен в количестве от около 100 мг до около 800 мг на дозу и ацетаминофен в количестве от около 80 мг до около 1000 мг на дозу; глазные лекарственные средства: ингибиторы ацетилхолинэстеразы, например эхотиофат в количестве от около 0,03% до около 0,25% в растворе для местного введения; желудочно-кишечные лекарственные средства: средства против диареи, например лоперамид в количестве от около 0,1 мг до около 1,0 мг на дозу и субсалицилат висмута в количестве от около 25 мг до около 300 мг на дозу.
Способы
Другой объект настоящего изобретения включает способы предупреждения или лечения назальной заложенности введением безопасного и эффективного количества соединения изобретения человеку или низшему животному, испытывающему назальную заложенность или с риском появления назальной заложенности. Такая назальная заложенность может быть связана с заболеваниями или нарушениями у человека, которые включают, но не ограничиваются ими, сезонные аллергические риниты, острые вирусные инфекционные заболевания верхних дыхательных путей, синуситы, хронические риниты и вазомоторные риниты. При каждом введении предпочтительно вводится доза соединения изобретения в диапазоне от около 0,001 мг/кг до около 10 мг/кг, более предпочтительно от около 0,01 мг/кг до около 5 мг/кг, еще более предпочтительно от около 0,1 мг/кг до около 1 мг/кг. Предпочтительно пероральное введение таких доз. Частота введения соединения в соответствии с изобретением предпочтительно составляет от одного до шести раз в сутки, более предпочтительно от двух до четырех раз в сутки. Такие дозы и частота их введения предпочтительны также для лечения других респираторных состояний, например отита, кашля, COPD и астмы.
Еще одним объектом изобретения являются способы предупреждения или лечения глаукомы введением безопасного и эффективного количества соединения изобретения человеку или низшему животному, страдающему глаукомой или имеющему риск появления глаукомы. При каждом введении дозы предпочтительно вводится соединение изобретения в количестве от около 0,01 мкг/кг до около 10 мг/кг, более предпочтительно от около 0,001 мг/кг до около 1 мг/кг, еще более предпочтительно от около 0,01 мг/кг до около 0,1 мг/кг. Предпочтительно внутриглазное введение таких доз. Частота введения соединения в соответствии с изобретением предпочтительно составляет от одного до шести раз в сутки, более предпочтительно от 2 раз до 4 раз в сутки.
Другой объект изобретения включает способы предупреждения или лечения функциональных кишечных нарушений, например диареи, введением безопасного и эффективного количества соединения изобретения человеку или низшему животному, страдающему диареей или имеющему риск появления диареи. При каждом введении предпочтительно соединение изобретения вводится в диапазоне от около 0,001 мг/кг до около 10 мг/кг, более предпочтительно от около 0,01 мг/кг до около 5 мг/кг, еще более предпочтительно от около 0,1 мг/кг до около 1 мг/кг. Предпочтительно пероральное введение таких доз. Частота введения соединения в соответствии с изобретением составляет от одного до шести раз в сутки, более предпочтительно от 2 до 4 раз в сутки.
Следующие неограничивающие примеры иллюстрируют композиции и способы применения изобретения.
Пример 4
Пероральная композиция в форме таблеток
Ингредиент - Количество на таблетку (мг)
Соединение 2 - 20,0
Микрокристаллическая целлюлоза (Avictl PH 102®) - 80,0
Вторичный кислый фосфат кальция - 96,0
Пирогенный диоксид кремния (Cab-O- Sil®) - 1,0
Стеарат магния - 3,0
Всего - 200,0
Одна таблетка проглатывается пациентом с назальной заложенностью. Заложенность значительно снижается.
Пример 5
Композиция в форме жевательной таблетки
Ингредиент - Количество на таблетку (мг)
Соединение 1 - 15,0
Маннит - 255,6
Микрокристаллическая целлюлоза (Avicel PH 101®) - 100,8
Декстринизованная сахароза (Di- Pac®) - 199,5
Апельсиновый корригент - 4,2
Натриевое производное сахарина - 1,2
Стеариновая кислота - 15,0
Стеарат магния - 3,0
Желтый #6 краситель FD&C - 3,0
Пирогенный диоксид кремния (Cab-O- Sil®) - 2,7
Всего - 600,0
Одна таблетка жуется и проглатывается пациентом с назальной заложенностью. Заложенность значительно снижается.
Пример 6
Подъязычная композиция в форме таблеток
Ингредиент - Количество на таблетку (мг)
Соединение 7 - 2,0
Маннит - 2,00
Микрокристаллическая целлюлоза (Avicel PH 101®) - 29,00
Мятные корригенты - 0,25
Натриевое производное сахарина - 0,08
Всего - 33,33
Одну таблетку помещают под язык пациента с назальной заложенностью и оставляют для растворения. Заложенность быстро и значительно снижается.
Пример 7
Композиция в виде раствора для интраназального введения
Ингредиент - Содержание (мас.%/об. %)
Соединение 3 - 0,20
Хлорид бензалкония - 0,02
Тимерозал - 0,002
d-Сорбит - 5,0
Глицин - 0,35
Ароматизирующие добавки - 0,075
Очищенная вода - До баланса
Всего - 100,00
Одну десятую часть мл композиции впрыскивают из сосуда под давлением в каждую ноздрю пациента с назальной заложенностью. Заложенность значительно снижается.
Пример 8
Интраназальная композиция в форме геля
Ингредиент - Содержание (мас.%/об.%)
Соединение 4 - 0,10
Хлорид бензалкония - 0,02
Тимерозал - 0,002
Гидроксипропилметилцеллюлоза (Metolose 65SH400®) - 1,06
Ароматизирующие добавки - 0,06
Хлористый натрий (0,65%) - До баланса
Всего - 100,00
Одну пятую часть мл композиции вводят в виде капель из пипетки в каждую ноздрю пациента с назальной заложенностью. Заложенность существенно снижается.
Пример 9
Аэрозольная композиция для ингаляции
Ингредиент - (Содержание (мас.%/об.%)
Соединение 6 - 5,0
Спирт - 33,0
Аскорбиновая кислота - 0,1
Ментол - 0,1
Натриевое производное сахарина - 0,2
Пропеллент (F12, F114) - До баланса
Всего - 100,0
Аэрозольную композицию вводят пациенту с астмой ингаляцией двух струй из ингалятора с дозированным выпуском. Астматическое состояние эффективно облегчается.
Пример 10
Глазная композиция для местного применения
Ингредиент - Содержание (мас.%/об.%)
Соединение 1 - 0,10
Хлорид бензалкония - 0,01
Этилендиаминтетрауксусная кислота - 0,05
Гидроксиэтилцеллюлоза (Nastrol M®) - 0,50
Метабисульфит натрия - 0,10
Хлорид натрия (0,9%) - До баланса
Всего - 100,0
Одну десятую часть мл композиции вводят непосредственно в каждый глаз пациента с глаукомой. Внутриглазное давление значительно снижается.
Пример 11
Жидкая композиция для перорального введения
Ингредиент - Количество/доза
Соединение 5 - 15 мг
Малеинат хлорфенирамина - 4 мг
Пропиленгликоль - 1,8 г
Этанол (95%) - 1,5 мл
Метанол - 12,5 мг
Эвкалиптовое масло - 7,55 мг
Корригенты - 0,05 мл
Сахароза - 7,65 г
Карбоксиметилцеллюлоза (CMC) - 7,5 мг
Микрокристаллическая целлюлоза и натриевая соль CMC (Avicel RC 591®) - 187,5 мг
Полисорбат 80 - 3,0 мг
Глицерин - 300 мг
Сорбит - 300 мг
Красный #40 краситель FD&C - 3 мг
Натриевое производное сахарина - 22,5 мг
Первичный кислый фосфат натрия - 44 мг
Моногидрат цитрата натрия - 28 мг
Очищенная вода - До баланса
Всего - 15 мл
Одну дозу в виде 15 мл жидкой композиции выпивает пациент с назальной заложенностью и хроническим насморком из-за аллергического ринита. Заложенность и насморк эффективно снижаются.
Пример 12
Жидкая композиция для перорального введения
Ингредиент - Количество/доза 15 мл
Соединение 8 изобретения - 30 мг
Сахароза - 8,16 г
Глицерин - 300 мг
Сорбит - 300 мг
Метилпарабен - 19,5 мг
Пропилпарабен - 4,5 мг
Ментол - 22,5 мг
Эвкалиптовое масло - 7,5 мг
Корригенты - 0,07 мл
Красный #40 краситель FD&C - 3,0 мг
Натриевое производное сахарина - 30 мг
Очищенная вода - До баланса
Всего - 15 мл
Одну дозу в виде 15 мл несодержащего спирт жидкого лекарственного средства выпивает пациент с назальной заложенностью. Заложенность значительно снижается.
Хотя выше описаны конкретные примеры осуществления изобретения, специалистам настоящей области очевидно, что можно сделать различные изменения и модификации в настоящем изобретении без отступления от его существа и объема. В прилагаемой формуле изобретения охватываются такие модификации, которые находятся в объеме настоящего изобретения.
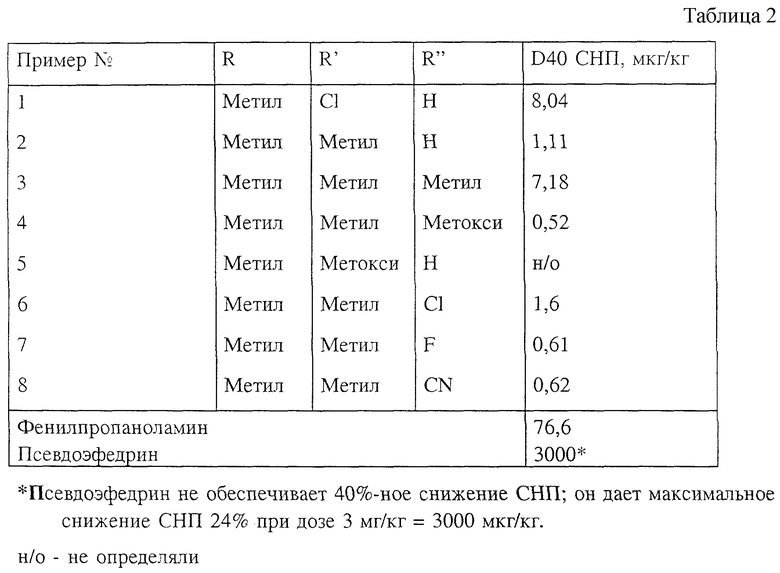
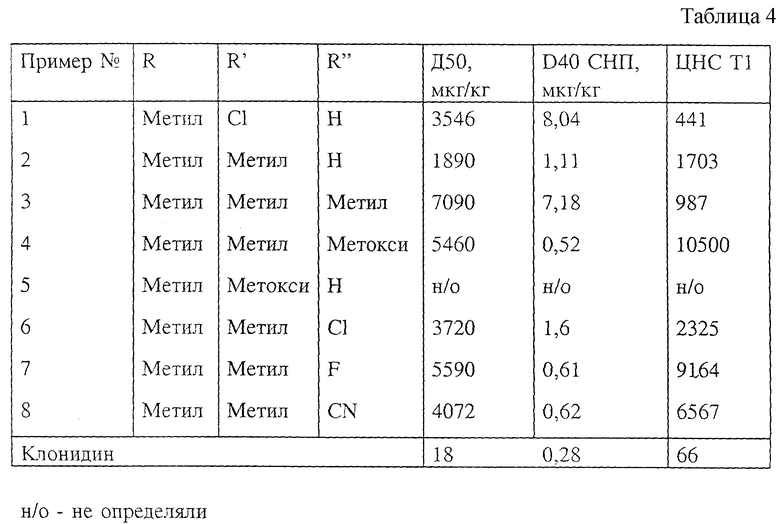
2). Данные, подтверждающие эффективность веществ в качестве агентов против заложенности носа.
В таблице 2 величина D40 СНП (сопротивление носовой полости у морской свинки) является мерой эффективности вещества против заложенности носа. Она представляет собой дозу, необходимую для достижения 40%-ного снижения сопротивления носовой полости. Таким образом, чем меньше эта величина, тем больше эффективность вещества. С целью сравнения заявители включили данные эффективности (для выбранной модели СНП) для псевдоэфедрина и фенилпропаноламина - двух широко используемых пероральных агентов против заложенности носа.
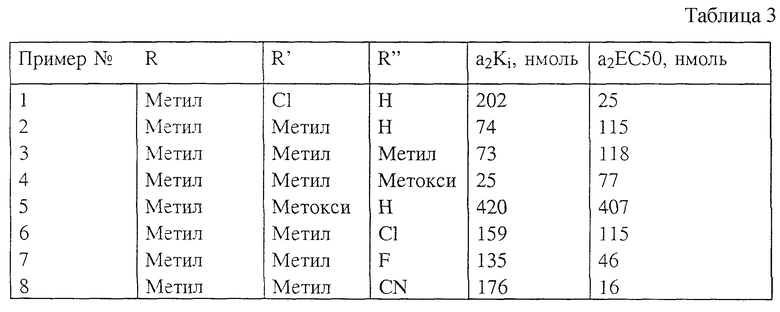
3). Данные, подтверждающие пригодность веществ при других симптомах, когда нарушения модулированы альфа-2-адренорецепторами (астма, диарея).
В таблице 3 указаны величины сродства к связыванию и ответа агониста при альфа-2-адренорецепторе. При испытании на связывание в качестве источника альфа-2-адренорецептора использовали носовые раковины свинки. Приведенные величины Ki представляют собой количество вещества, которое необходимо для замещения 50% известного радиолиганда (растертого раволесцина или RX-821002). Для оценки ответа агониста измеряли способность веществ ингибировать сокращения нижней части кишечника морской свинки, вызванные электрически. Величина EC50 представляет собой концентрацию, необходимую для обеспечения 50% от максимального отклика.
4). Данные, подтверждающие периферическую селективность веществ
В таблице 4 величина Д50 (испытание двигательной активности мышей) является мерой активности ЦНС. Величина Д50 равна дозе, которая дает 50% снижение двигательной активности мышей. Величина ЦНС Т1 указывает на разделение между кривой доза-отклик для конкретного эффекта (в данном случае СНП) и кривой доза-отклик ЦНС. Величина Т1 выражается как отношение ЦНС Д50/СНП Д40. Таким образом, чем выше эта величина, тем больше разделение между кривыми доза-отклик и тем меньше передаваемые центрально побочные эффекты при терапевтической дозе. Для сравнения приведены данные для клонидина. Клонидин является клинически применяемым альфа-2-агонистом (используется при лечении гипертонии), который, как известно, оказывает успокаивающее действие на 50% пациентов при терапевтической дозе.



Производные 6-(2-имидазолиниламино)хинолина, где R -незамещенный C1-C3алкил; R' - незамещенный C1-C3алкил, незамещенная алкоксигруппа; R'' - Н, незамещенный C1-C3алкил, незамещенная алкоксигруппа, хлор или цианогруппа, обладают антагонистической активностью в отношении α-2-адренорецепторов. 2 c. и 7 з.п. ф-лы, 4 табл.
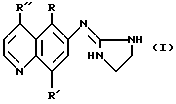
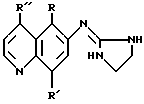
где R представляет собой незамещенный С1-С3алкил;
R' выбирают из незамещенного С1-С3 алкила, незамещенной алкоксигруппы, имеющей от 1 до 3 атомов углерода или галогена;
R" выбирают из водорода, незамещенного C1-C3 алкила, незамещенной алкоксигруппы, имеющей от 1 до 3 атомов углерода, галогена или цианогруппы.
| Способ получения производных 2-/(4-ХиНОлил)АМиНО/-5-фТОРбЕНзОй-НОй КиСлОТы или иХ СОлЕй C КиСлО-ТАМи | 1978 |
|
SU837322A3 |
| Делительное устройство | 1974 |
|
SU509402A1 |
Авторы
Даты
1999-12-27—Публикация
1994-12-15—Подача