Изобретение относится к классу молекул синтетических РНК и их производных, а в частности, к рибозимам, обладающим высокоспецифической эндорибонуклеазной активностью.
Ряд встречающихся в природе РНК-молекул, например, таких как вироид "солнечной" пятнистости авокадо /ASBV/, содержащий РНК сателлит вируса кольцевой пятнистости табака /STOBRV/ и вирус проходящего стрика люцерны посевной /SLTSV/, подвержены самокаталиризуемому расщеплению. Очевидно, такое расщепление является основной и единственной частью жизненного цикла этих и других РНК.
Реакции самокатализируемого расщепления РНК требуют наличия двухвалентных ионов металлов и нейтрального или более высокого pH и приводят в результате к продуцированию РНК с концами, имеющими 5'-гидроксильную группу и 2', 3'-циклические фосфатные группы /Prody et al., Science 231: 1577-1580 /1986/ и Buzayan et al., Virology 151: 186-199 /1986//. Реакции расщепления катализируются самими РНК, что, вероятно, обусловлено конформцией мостиковых реакционноспособных групп, находящихся в непосредственной близости. Сайты самокатализируемого расщепления в природных РНК расположены в высоко консервированных областях РНК вторичной структуры /Buzayan et al., Proc. Natl. Acad. Soc. США 83:8859-8862 /1986/ and Forster, A.C. and Symous, R.H. Cell, 50:9-16 /1987//.
Эксперименты настоящего изобретения проводили на содержащем РНК вирусе-сателлите кольцевой пятнистости табака /STORV/, с помощью которого осуществляли построение новых эндорибонуклеаз /называемых в дальнейшем "рибозимами"/, т. е. ферментов, включающих в себя РНК, которые катализуют специфическое расщепление целевых молекул РНК.
Термин "рибозим", используемый в настоящем описании, относится к молекулам, целиком состоящим из РНК для ее производных.
Рибозимы настоящего изобретения отличаются от РНК-эндорибонуклеазы, которая встречается в природе в Tetrahymena Thermophila /известная как IVS или L-19IVS РНК/ и которая подробно описана в работах: Thomas Cech et al., (Zang, A. T. et al. , Science /1984/ 224:574-578; Zang, A.T. и Cech, T.R. Science /1986/ 231:470-475; Zang, A.T., et al., Nature /1986/ 324:429-433; Публикация международной заявки N 88/04300 University Patents Inс/. Эндорибонуклеаза, описанная Cech, имеет активный сайт длиной 8 п.о., который гибридизируется с целевой последовательностью РНК, после чего происходит расщепление целевой РНК, при условии присутствия свободного гуанозина или его производных. Фрагменты, образующиеся в результате расщепления, содержат концевые 5'-фосфатную и 3'-гидроксильную группы. Лимитированное число нуклеотидов, пригодных для осуществления гибридизации с РНК - субстратом, ограничивает эффективность или продуктивность эндорибонуклеазы, описанной Cech. Олигонуклеотиды, содержащие менее 12 нуклеотидов, плохо гибридизируются с целевыми последовательностями. Очевидно также, что некоторое число нуклеотидов в активном сайте Cech-эндорибонуклеазы может потребоваться для сохранения эффективной активности эндорибонуклеазы. Это ограничивает число возможных перестановок последовательностей активных сайтов, которые могли бы быть осуществлены для повышения эффективной гибридизации с целевыми последовательностями, что, в свою очередь, ограничивает число целевых последовательностей РНК, расщепляемых Cech-эндорибонуклеазой. Cech-эндорибонуклеаза также модифицирует РНК путем добавления свободного гуанозинового нуклеотида к 5' - концу расщепленной РНК.
Напротив, рибозимы настоящего изобретения эффективно гибридизируются с широким рядом целевых РНК-последовательностей, не модифицируя при этом расщепленную целевую РНК.
Рибозимы настоящего изобретения включают в себя гибридизирующую область, которая является комплементарной в нуклеотидной последовательности, по крайней мере, части целевой РНК, и каталитическую область, которая адаптирована к расщеплению целевой РНК. Гибридизирующая область содержит 9 или более нуклеотидов.
В предпочтительном варианте настоящего изобретения рибозимы имеют область гибридизации, содержащую одну или более ветвей, образованных от однонитевой РНК и имеющую последовательность комплементарную, по крайней мере, части целевой РНК; причем указанные одна или несколько ветвей, ассоциированных с каталитической областью, обладают способностью к расщеплению указанной целевой РНК; а область гибридизации содержит одну ветвь из числа указанных ветвей РНК, которая состоит, по крайней мере, из 9 нуклеотидов, при этом указанная область гибридизации включает в себя 2 или более ветви РНК, а сумма нуклеотидов в указанных ветвях составляет более 9 нуклеотидов.
В одном варианте осуществления настоящего изобретения рассматривается получение рибозимы формулы 1: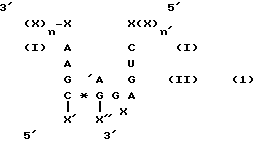
где X представляет собой любой рибонуклеотид и каждый из остатков X могут быть одинаковыми или различными;
сумма n и n' превышает 6, и n и n' могут быть одинаковыми или различными;
/*/ означает пару оснований между комплементарными рибонуклеотидами;.
X' и X'' представляют собой олигорибонуклеотиды комплементарной последовательности вдоль, по крайней мере, части их длины, так, чтобы основания между олигорибонуклеотидами спаривались; или X' и X'' вместе образуют одну последовательность РНК, причем, по крайней мере, часть указанной последовательности включает в себя стебель, образованный спариванием оснований между комплементарными нуклеотидами; и необязательно, в формуле /I/ после IA может быть введен дополнительный нуклеотид, выбранный из A, G, C или U.
Область /I/ формулы /1/ представляет собой плечи или фланкирующие последовательности рибозима, которые гибридизируются с соответствующими участками целевой последовательности РНК. Указанные плечи могут гибридизироваться вдоль полной длины целевой РНК или ее части. Каталитическая область РНК изображена в области /II/ формулы /1/. Указанная каталитическая область может содержать один или несколько дополнительных нуклеотидов, которые не оказывают неблагоприятного воздействия на каталитическую активность. Указанные добавки могут быть легко проверены на рибозимную активность способом, не требующим сложных экспериментов, который будет описан ниже. Каталитическая область может также составлять часть гибридизирующей области.
Олигорибонуклеотиды X' и X'' могут содержать до 5000 нуклеотидов или более.
В другом варианте осуществления настоящего изобретения рассматривается получение рибозимы формулы 2: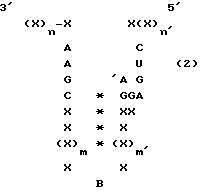
где X представляет собой любой рибонуклеотид и каждый из остатков X могут быть одинаковыми или различными;
/*/ означает пару оснований между комплементарными рибонуклеотидами;
n и n' определены выше;
m и m' имеют значение 1 или выше и могут быть одинаковыми или различными;
"B" представляет собой связь, пару оснований, рибонуклеотид или олигорибонуклеотид, содержащий, по крайней мере, 2 рибонуклеотида;
и необязательно, в формуле /2/ после IA может быть введен добавочный нуклеотид, выбранный из A, G, C или U.
Рибозимы настоящего изобретения могут быть получены способами, известными per se, использующимися для синтеза РНК-молекул. /Например, в соответствии с руководством, рекомендованным Promega, Madison, WI США/. В частности, рибозимы настоящего изобретения могут быть получены из соответствующей ДНК-последовательности /ДНК, которая при транскрипции дает рибозим и которая может быть синтезирована способами, обычно используемыми специалистами для синтеза ДНК/, активно связанной с промотором РНК-полимеразы, например промотором для РНК-полимеразы T7 или SP6. ДНК-последовательность, соответствующая рибозиму настоящего изобретения, может быть лигирована в вектор переноса ДНК, например плазмидную или фаговую ДНК. Когда вектор переноса содержит промотор РНК-полимеразы, активно связанный с ДНК, соответствующий рибозиму, то рибозим может быть продуцирован в процессе инкубации с РНК-полимеразой. Поэтому, рибозимы могут быть продуцированы in vitro путем инкубации РНК-полимеразы с промотором РНК-полимеразы, активно связанным с ДНК, соответствующей рибозиму, в присутствии рибонуклеотидов. In vivo прокариотические или эукариотические клетки /включая клетки млекопитающих и растений/ могут быть трансфецированы с соответствующим вектором внедрения, содержащим генетический материал, соответствующий рибозиму, который согласно настоящему изобретению является активно связанным с промотором РНК-полимеразы так, что указанный рибозим транскрибируется в хозяйской клетке. Векторы переноса могут быть бактериальными плазмидами или вирусными РНК или ДНК. Нуклеотидная последовательность, соответствующая рибозимам, находится, в основном, под контролем сильных промоторов, например, таких как lac, поздний промотор SV 40, ранний промотор SV 40, металлотионин, или λ- промоторы. Рибозимы могут быть транскрибированы непосредственно in vivo из вектора переноса или альтернативно они могут быть транскибированы как часть из большей РНК-молекулы. Например, ДНК, соответствующая рибозимным последовательностям, может быть лигирована в 3'-конец гена-носителя, например, после стоп-сигнала трансляции. Большие, молекулы РНК могут способствовать стабилизации рибозимных молекул против нуклеазного переваривания в клетках. При трансляции ген-носитель может способствовать образованию белка, присутствие которого можно непосредственно оценить с помощью ферментной реакции. Ген-носитепь может, например, кодировать фермент.
В еще одном варианте осуществления настоящего изобретения рассматривается получение вектора переноса ДНК, который содержит ДНК-последовательность, соответствующую рибозиму, активно связанному с промотором, в целях обеспечения транскрипции рибозима.
Один из предпочтительных способов продуцирования рибозима заключается в том, что посредством стандартных процедур получают два синтетических олигонуклеотида комплементарной последовательности и гибридизируют их, например, с помощью синтезатора ДНК Прикладной Биосистемы модели 380A /Applied Biosystems Inc. , Foster City, Калифорния 94404/. Один из олигонуклеотидов кодирует целевой рибозим. Соответствующие концы гибридизированных олигонуклеотидов соответствуют различным рестриктирующим сайтам, например Eco R1 на одном конце и Pst1 на другом конце. После расщепления подходящими рестриктазами /например, Eco R1 и Pst1/ фрагмент двухцепочечной ДНК может быть клонирован в вектор переноса. Если плазмидный вектор содержит промотор РНК-полимеразы, находящийся выше от ДНК-последовательности, соответствующей рибозиму настоящего изобретения, то РНК-транскрипты, соответствующие рибозиму, могут быть получены либо in vitro, либо in vivo. Если рибозим состоит из двух половин, которые содержатся вместе с помощью спаривания оснований между комплементарными нуклеотидами, то каждая половина рибозима может быть продуцирована в соответствии с указанными выше способами, после чего эти две половины инкубируют вместе с образованием указанного рибозима.
Предпочтительные рибозимы настоящего изобретения расщепляют целевую РНК, которая содержит последовательность XoUY, где Xo является любым рибонуклеотидом, U означает урацил, а Y - аденин, цитозин или урацил. XoU образует часть пары оснований, фланкирующих область, а Y не является спаренным основанием. Предпочтительно, но необязательно, если Xo = гуанидин, а XoUY = GUC иди CUA. Любая молекула РНК, содержащая эти последовательности, может быть расщеплена рибозимами настоящего изобретения. После того, как последовательность РНК-транскрипта, содержащая последовательность XoUY, будет определена, могут быть синтезированы плечи последовательности рибозима, которая является комплементарной /а значит и гибридизируемой/ РНК на целевой последовательности, фланкирующей последовательность XoUY. При гибридизации плечей рибозима с целевой РНК-последовательностью, фланкирующей последовательность XoUY, каталитическая область рибозима расщепляет целевую РНК внутри последовательности XoUY. РНК-расщепление облегчается в присутствии магния или другого двухвалентного катиона при pH равном приблизительно 8,0.
В соответствии с этим, предпочтительные рибозимы настоящего изобретения могут быть сконструированы для расщепления любой РНК, последовательность которой является известной.
Высокая частота остатков, расщепляемых рибозимами в РНК /1:64 для GUC в РНК со случайной или равной частотой распределения оснований/ означает, что число потенциальных сайтов для расщепления рибозима может быть предсказано с достаточно высокой степенью надежности в любой данной целевой РНК.
В следующем варианте осуществления настоящего изобретения рассматривается способ инактивации целевой РНК-последовательности, заключающийся в том, что указанную целевую РНК-последовательность подвергают взаимодействию с рибозимом настоящего изобретения.
Вектор переноса, такой как бактериальная плазмида или вирусная РНК или ДНК, кодирующие один или несколько рибозимов, может быть трансфецирован in vivo, т. е. в клетку или клетки организма /например, Leewellyn et al., F. Mol. Biol. /1987/ 195: 115-123; Hanahan et al., T. Mol. Biol./1983/166/. Попадая в клетку, вектор переноса может реплицироваться и быть транскрибирован клеточными полимеразами с образованием рибозимных РНК, которые затем инактивируют нужную целевую РНК. Альтернативно вектор переноса, содержащий одну или несколько последовательностей рибозима, может быть трансфецирован в клетки или внедрен в клетки при помощи техники микроманипулирования, такой как микроинъекция, так, чтобы вектор переноса или его часть интегрировалась в геном хозяйской клетки. Транскрипция интегрированного генетического материала приводит к продуцированию рибозимов, которые инактивируют целевую РНК.
Рибозимы настоящего изобретения имеют широкое терапевтическое и биологическое применение. Например, вирусы, вызывающие заболевания человека и животных, могут быть инактивированы путем введения в объект, инфецированный вирусом, рибозима настоящего изобретения, который является адаптированным для гибридизации и расщепления РНК-транскриптов вируса. Указанные рибозимы могут быть введены парентеральным путем или другими способами введения. Альтернативно в объект инфецированный вирусом, вызывающим заболевания, может быть введен невирулентный вирус /такой как вакцина, или аденовирус/, который может быть генетически сконструирован так, чтобы он содержал ДНК, соответствующую рибозиму, активно связанному с РНК-промотором, в результате чего рибозим транскрибируется в клетках животного-хозяина, трансфецированного сконструированным вирусом, и осуществляет расщепление и/или инактивацию транскрипта целевой РНК вируса, вызвавшего заболевание. В частности, рибозимы настоящего изобретения могут быть использованы для лечения заболеваний, вызванных такими вирусами, как вирус простого герпеса /ВГП/ или вирус СПИД'а /ВИЧ/.
Рибозимы настоящего изобретения могут быть использованы также для инактивации РНК-транскриптов в бактериях или других прокариотических клетках, в растениях и животных. В бактериях РНК-транскрипты, например бактериофага, вызывающего гибель бактериальных клеток, могут быть инактивированы путем трансфецирования клетки вектором переноса ДНК, обладающего способностью продуцировать рибозим настоящего изобретения, который инактивирует фаговую ДНК. Альтернативно рибозим сам по себе может быть введен в бактериальную клетку для осуществления расщепления фаговой ДНК.
РНК-транскрипты в растениях могут быть инактивированы с помощью рибозимов, кодированных вектором переноса, таким как Ti-плазмида, происходящая от Agrobacterium tumefaciens. Когда такие векторы трансфецируются в растительную клетку, то под действием РНК-полимеразы продуцируются рибозимы, которые осуществляют расщепление конкретной последовательности целевой РНК. В соответствии с этим растительные вирусы, РНК которых являются известными, или РНК-транскрипты растительных генов могут быть инактивированы с помощью указанных рибозимов.
Транскрипты чужеродного гена в растениях, животных или клетках другого типа могут быть инактивированы с помощью рибозимов настоящего изобретения. В результате чего могут быть модулированы нежелательные фенотипы или признаки. Можно, например, с помощью рибозимов удалять косточки из фруктов или лечить наследственные заболевания у человека, вызываемые продуцированием вредного белка или чрезмерным продуцированием какого-либо конкретного белка.
Настоящее изобретение иллюстрируется примерами и сопровождающими их чертежами, причем ни те, ни другие не ограничивают возможных вариантов осуществления настоящего изобретения.
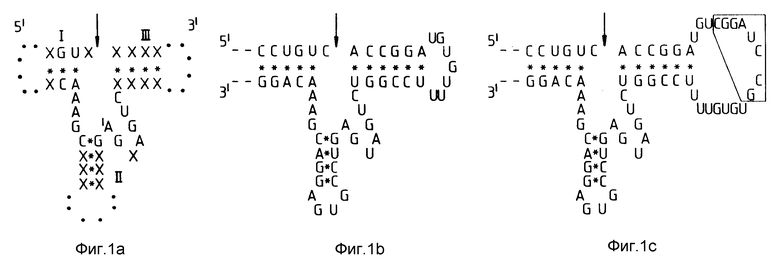
На фиг. 1 изображены сайты саморасщепления РНК дикого типа и мутированных РНК; а также профили электрофореза продуктов самокаталитического расщепления РНК.
/а/ показаны сохраненные структуры, ассоциированные с встречающимися в природе сайтами расщепления в ASBV транскриптах ДНК сателлита тритона и РНК-содержащего сателлита STOBRV, LTSV, вируса табачной мозаики, вируса мозаики паслена черного /solanum nodiflorum/ и вируса мозаики подземного клевера. На фиг. показана нуклеотидная последовательность между этими структурами, тогда как другие обозначены X. Спаривание оснований обозначено /•/, а сайты расщепления РНК указаны стрелкой.
/b/ показана сохраненная нуклеотидная последовательность, ассоциированная с расщеплением /+/ - нити РНК STOBRV. Сайт расщепления указан стрелкой.
/c/ показан in vitro - мутант STOBRV, содержащий вставку восьми нуклеотидов /обведено рамкой/ вместе с фланкирующей дупликацией трех нуклеотидов /UGU остатки 7-9/.
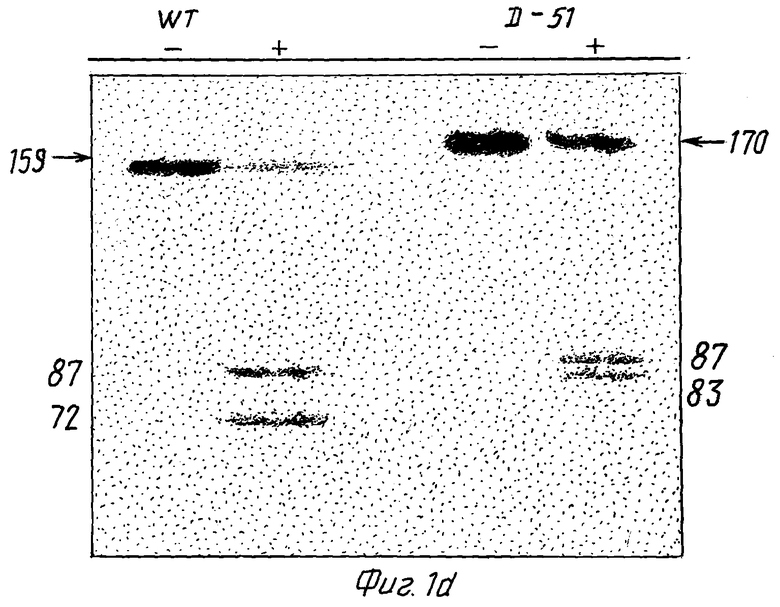
/d/ показаны субклонированные Hal III - фрагменты STOBRV дикого типа и in vitro - мутант D-51, каждый из которых транскрибированы в обеих /+/ и /-/ ориентациях, а также радиоактивно меченные транскрипты, фракционированные путем электрофореза в полиакриламидном геле. Положения нерасщепленных транскриптов оснований 159 и 170 от последовательностей дикого типа /WT/ и мутанта D-51 показаны стрелкой;
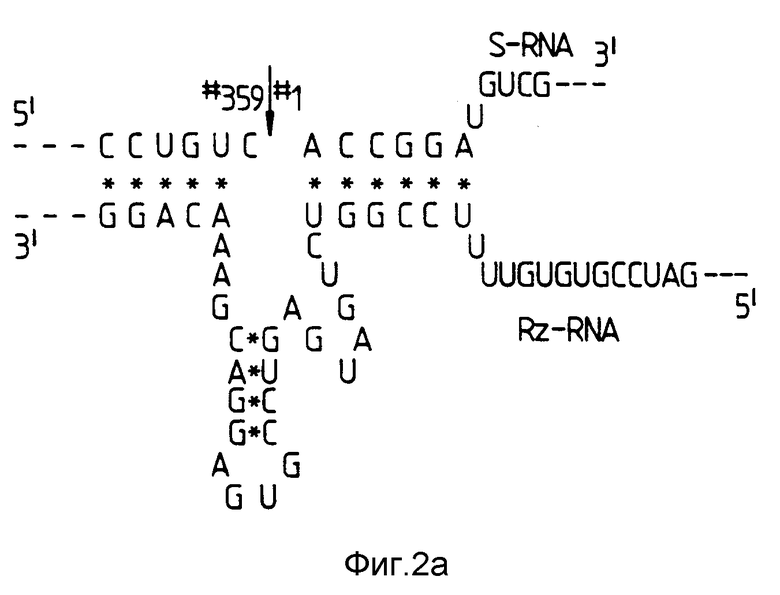
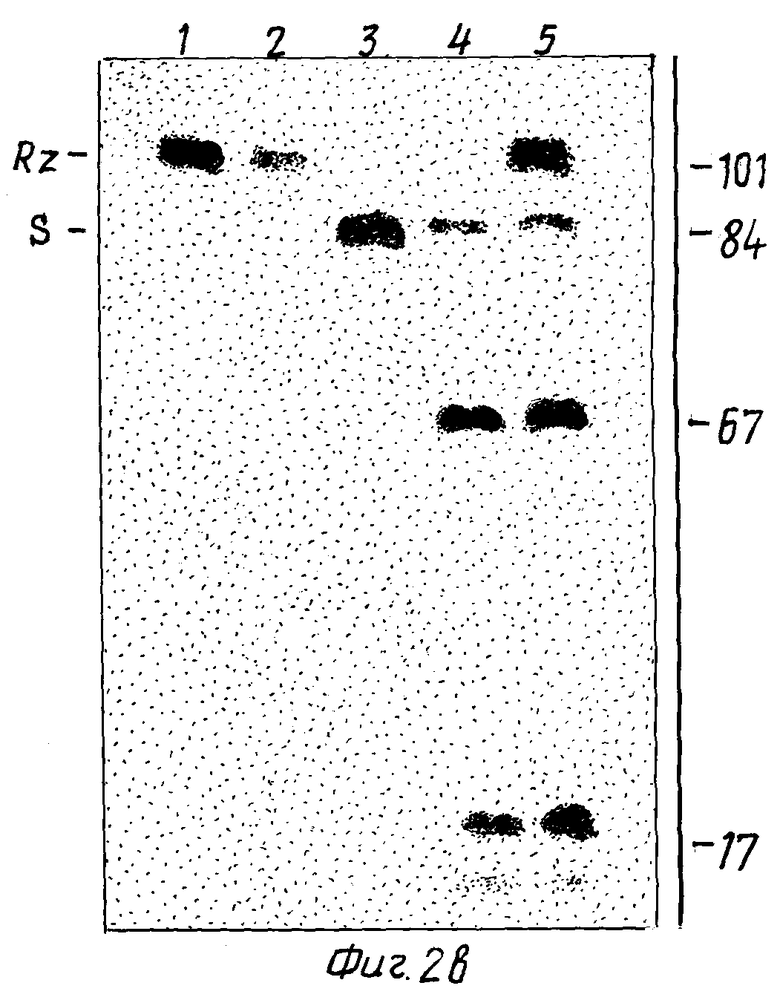
На фиг. 2 показана нуклеотидная последовательность рибозима и продуктов расщепления рибозима, выделенных с помощью гель-электрофореза.
/а/ Показаны нуклеотиды, инсертированные в D-51-мутант и содержащие сайт рестриктирующей эндонуклеазы Bam H1. Bam H1 использовался для расщепления мутантной ДНК, а две последовательности были субклонированы и транскрибированы отдельно in vitro. РНК-транскрипты показаны схематически с потенциальным спариванием оснований между указанными /•/ РНК. Фрагменты, содержащие указанный стрелкой сайт для расщепления, обозначены S-РНК; а фрагмент, содержащий рибозим, обозначен Rz-РНК.
/b/ [32P] -Rz-PHK /101 основание/ инкубировали отдельно /дорожка 1/ и с не-меченной S-РНК /дорожка 2/. [32P]-S-РНК инкубировали отдельно /дорожка 3/ и с немеченными, и с [32P]-мечеными Rz-PHK /дорожки 4 и 5 соответственно/.
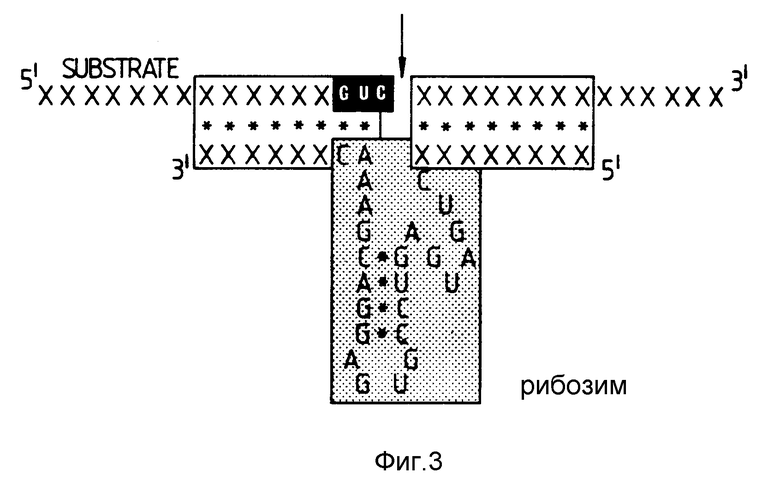
На фиг. 3 изображена схематическая модель рибозима в соответствии с одним из вариантов настоящего изобретения. Область A представляет собой последовательность расщепления в целевой РНК. Область B представляет собой каталитическую область, а область C представляет собой плечи рибозима.
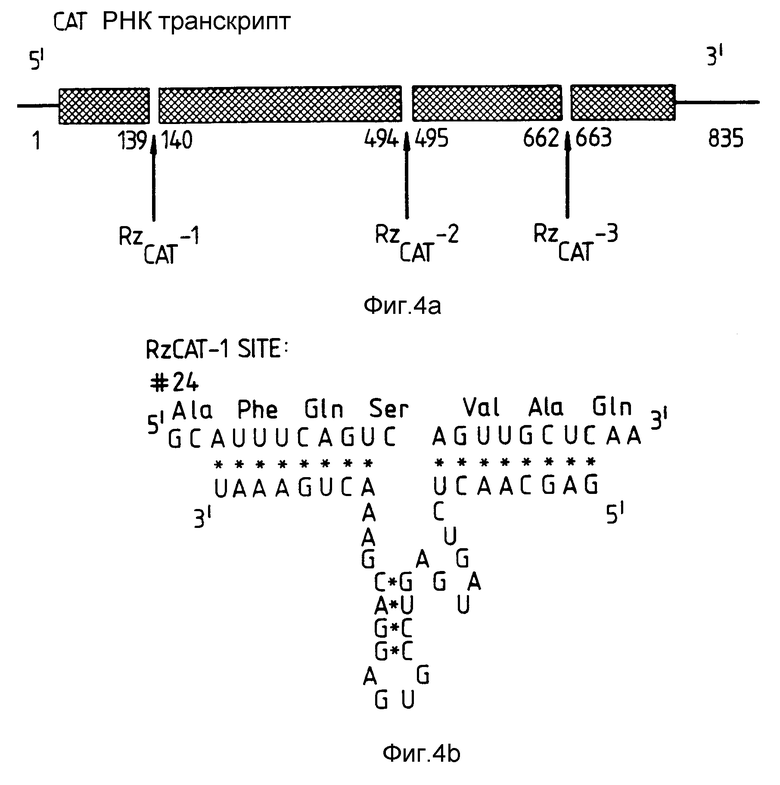
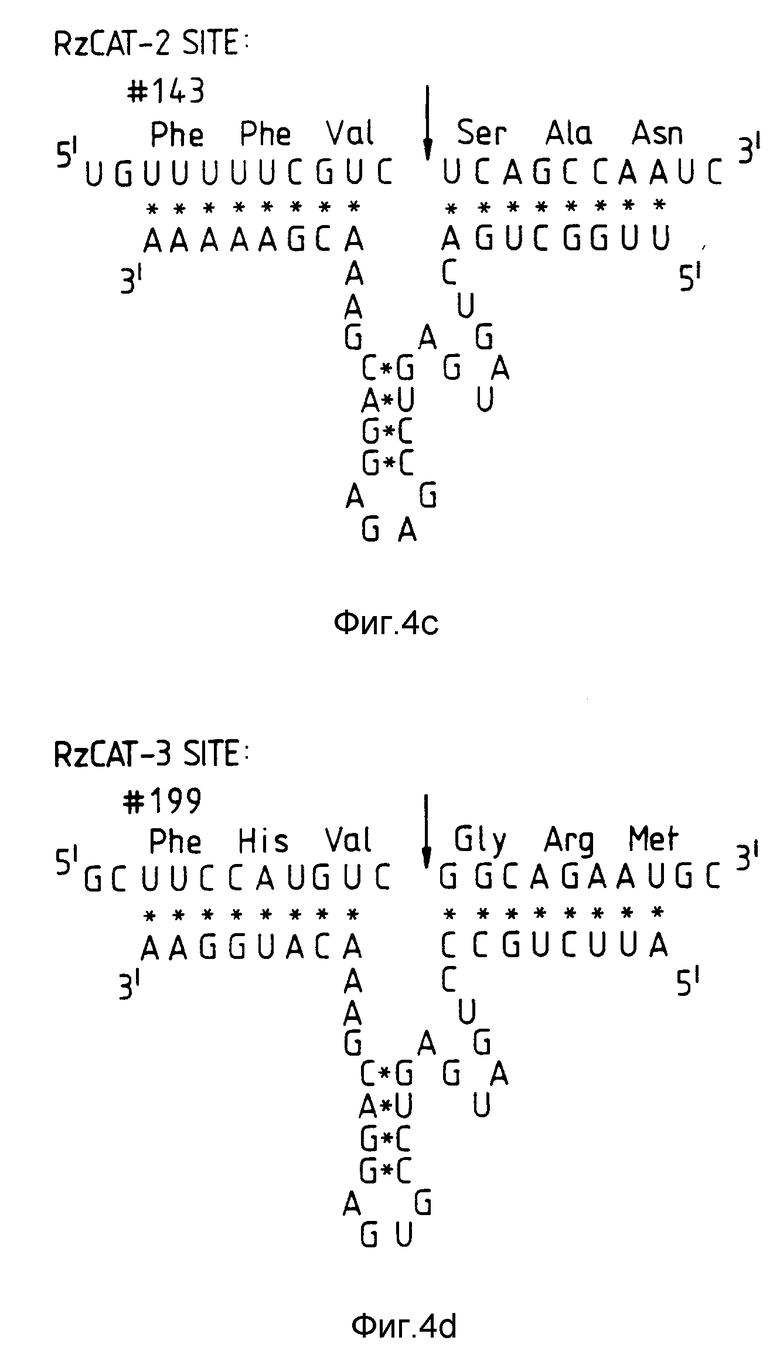
На фиг. 4 показано построение рибозимов, направленных против транскрипта гена CAT /хлорамфеникол-ацетилтрансфераза/. Рибозимы, обозначенные RzCAT-1, RzCAT-2 и RzCAT-3, направлены против трех сайтов, находящихся в in vitro - транскрипте из 835 оснований гена CAT. Относительные расположения сайтов расщепления на транскрипте схематически показаны вместе с фланкирующими пронумерованными основаниями /а/. Показаны также //b/ - /d// три последовательности рибозима с их целевыми последовательностями. Аминокислотные последовательности CAT-гена пронумерованы, а предсказанные сайты для РНК-расщепления обозначены стрелками. RzCAT-1 и RzCAT-3 содержат последовательности с 24 основаниями, происходящие от /+/ нити STOBRV /область B, фиг. 3/, a RzCAT-2 содержит одну U-A-замену в этой области.
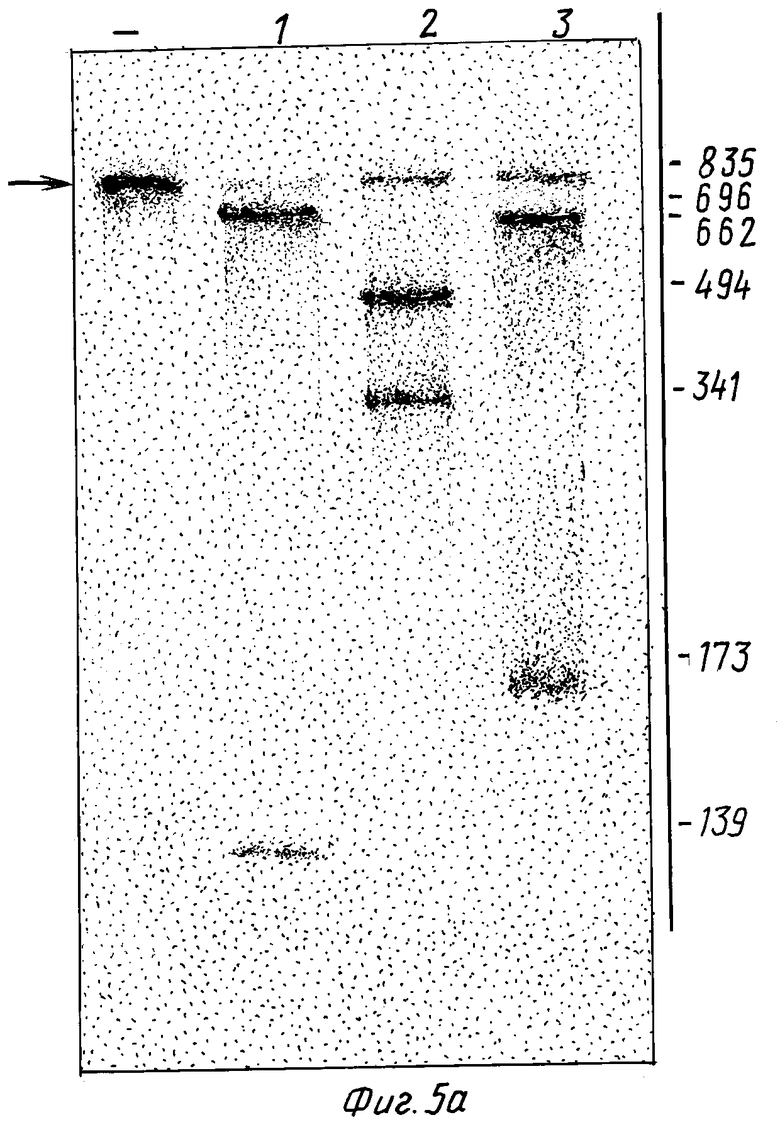
На фиг. 5 показаны результаты CAT-расщепления РНК рибозимами RzCAT-1 - RzCAT-3.
/а/ [32P] -CAT-РНК подвергали гель-фракционированию после инкубации как отдельно /-/, так и с одним из трех рибозимов RzCAT-1 - RzCAT-3 /дорожки 1, 2 и 3 соответственно/. Локализация полного транскрипта показана стрелкой.
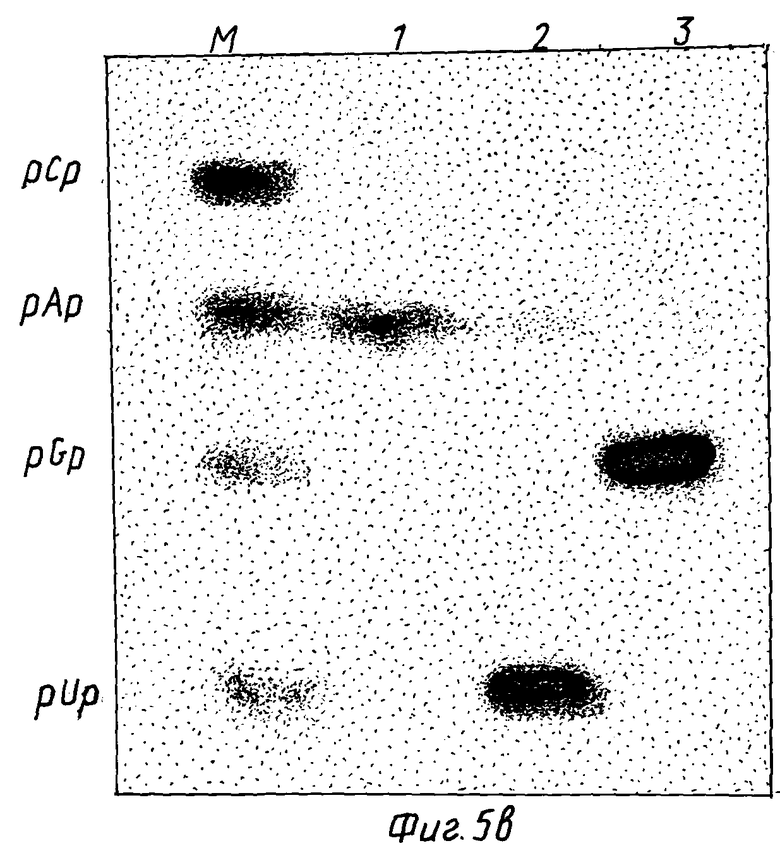
/b/ Показан анализ 5'-терминальных оснований. 3'-фрагменты, продуцированные путем расщепления рибозимом CAT-РНК, были обработаны [5'-32P]-киназой, подвергнуты гель-очистке, переварены полной нуклеазой, а выделенные терминальные остатки фракционировали с помощью электрофореза в полиакриламидном геле. 5'-концевыми нуклеотидами, определенными по маркерам /дорожка M/, являлись A, U и G для фрагментов, продуцированных с помощью Rz-CAT-1 - RzCAT-3 /дорожки 1, 2 и 3 соответственно/.
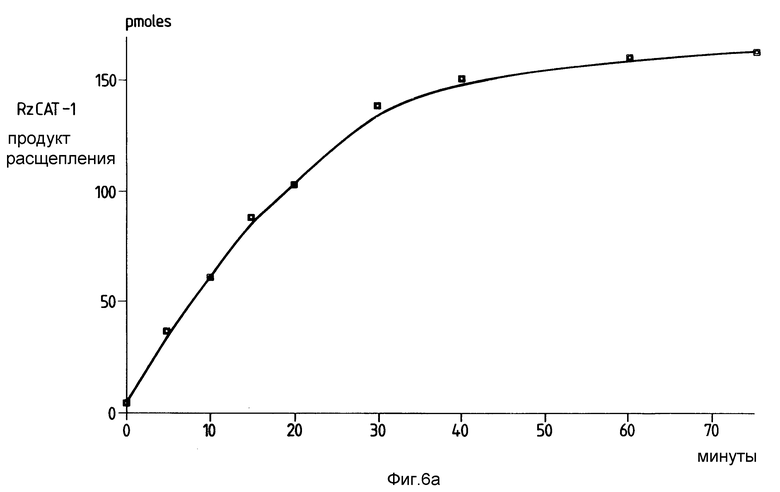
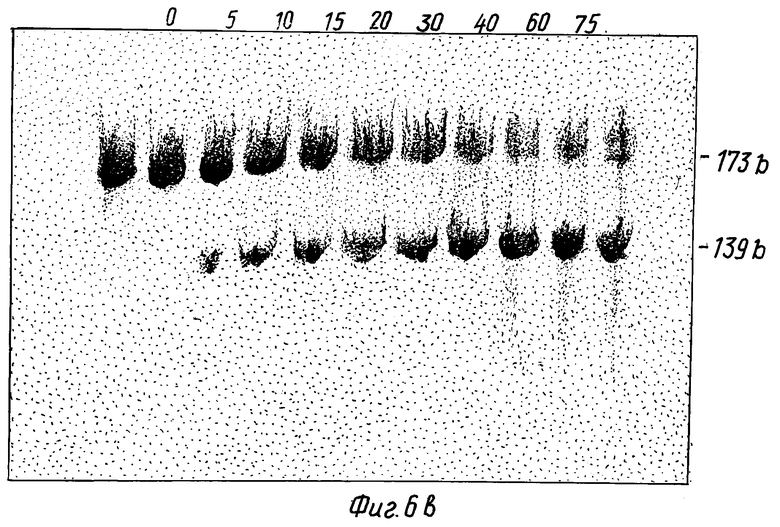
На фиг. 6 изображен временной цикл каталитической активности рибозима /RzCAT-1/ против CAT-РНК. Было вычислено количество продукта расщепления /139 нуклеотидов/ и построена диаграмма. На вставке показано аккумулирование фрагмента в 139 оснований со временем после электрофореза в полиакриламидном геле.
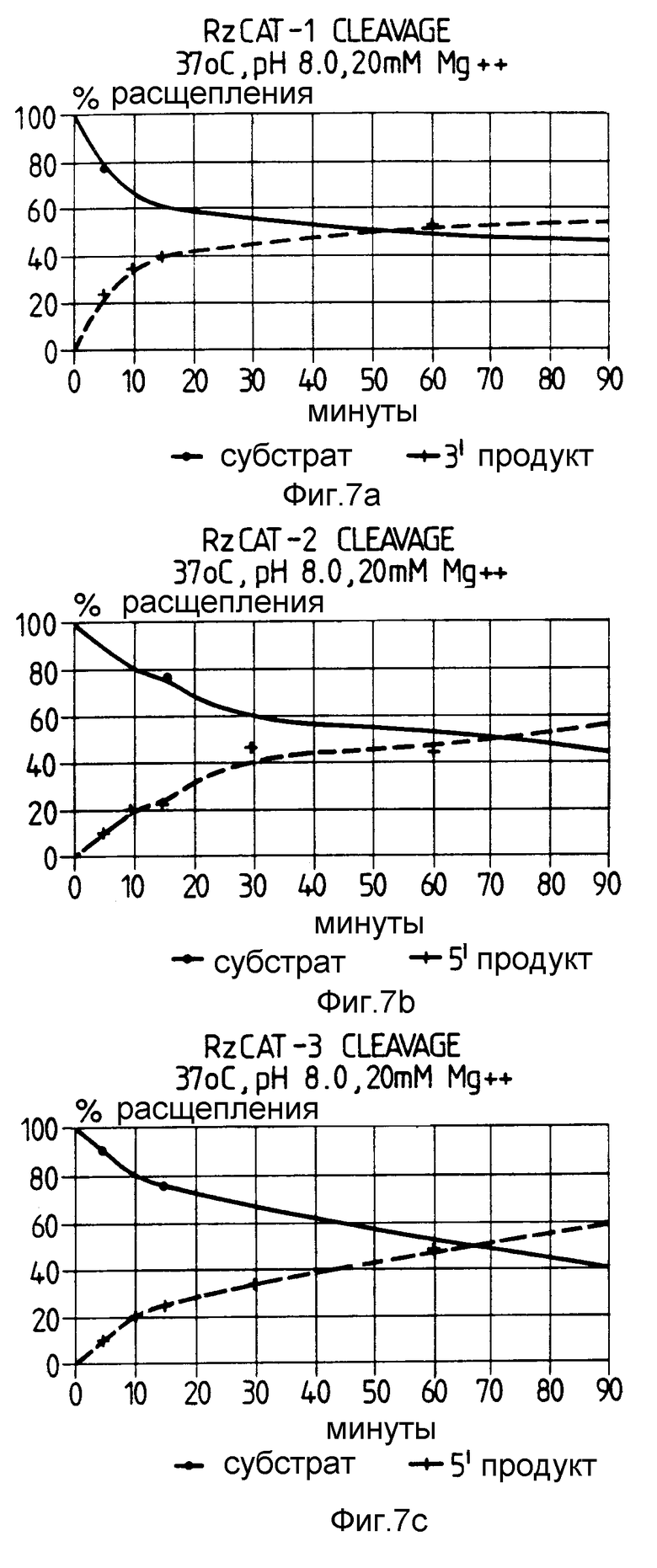
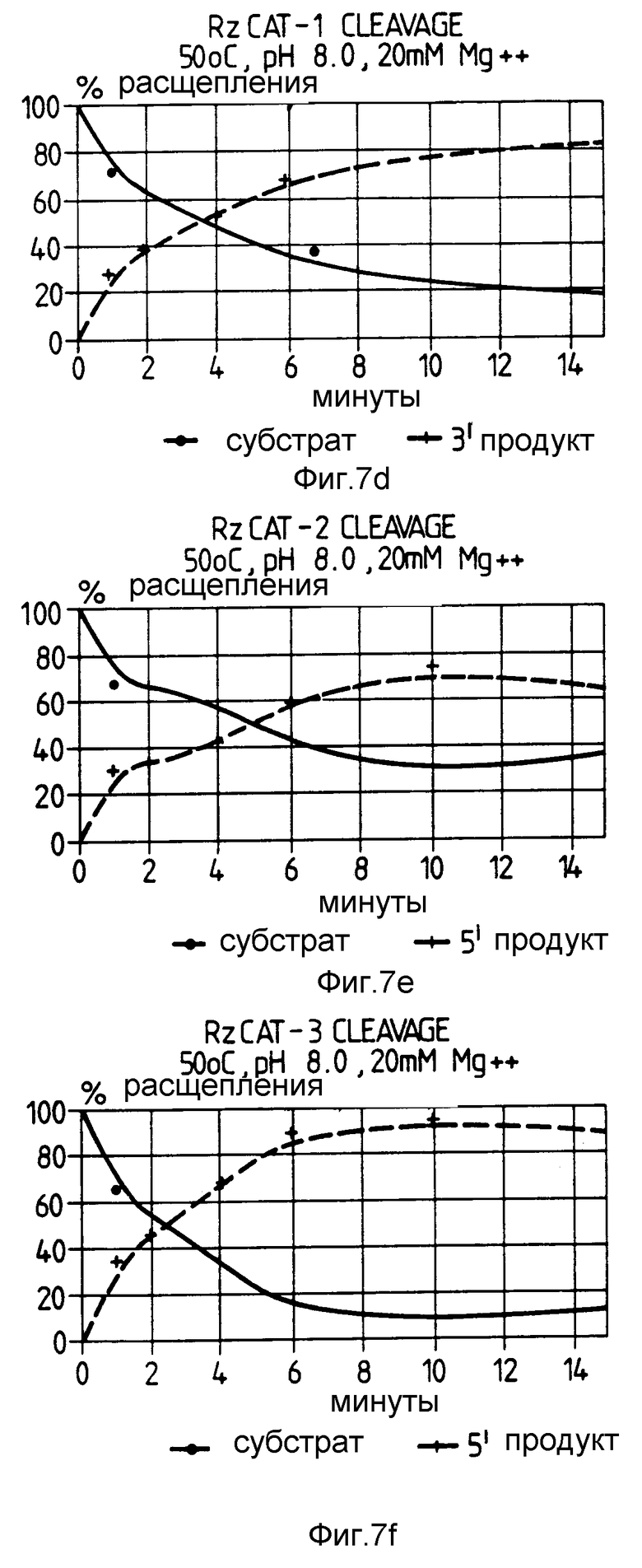
На фиг. 7 показаны относительные скорости расщепления CAT-РНК в зависимости от различных температурных условий. Субстратная РНК представлена сплошной линией. В каждом случае продукт расщепления показан прерывистой линией.
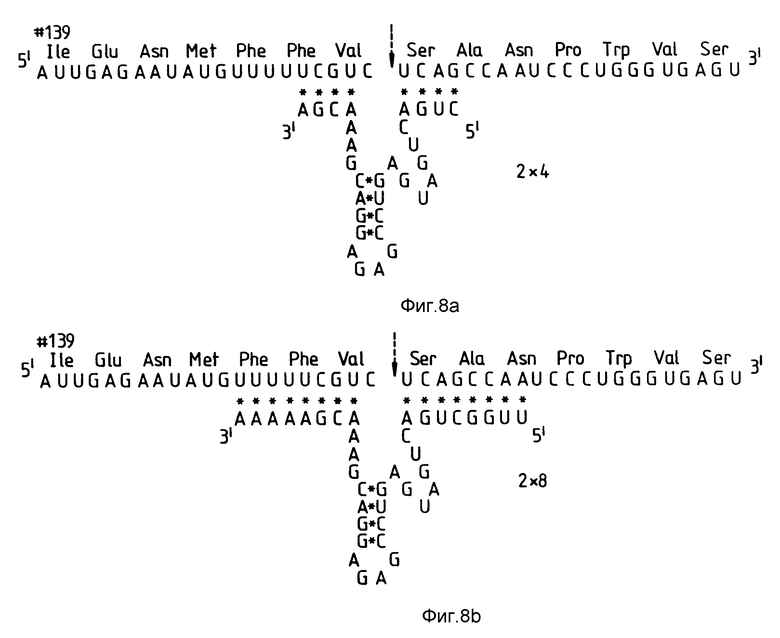
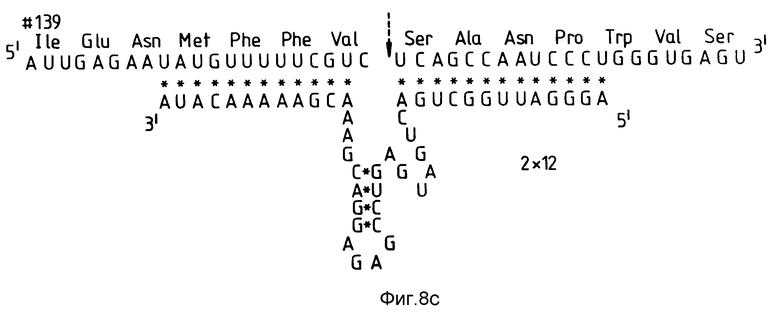
На фиг. 8 показаны три рибозима /соответствующие RzCAT-2/, имеющие плечи или фланкирующие последовательности различной длины.
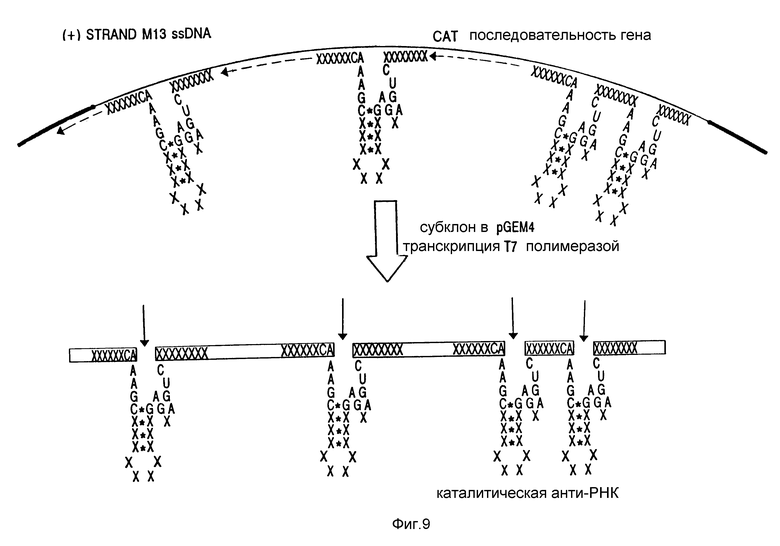
На фиг. 9 изображена схема продуцирования рибозима, включающего антисмысловую РНК, содержащую каждую из областей расщепления RzCAT-1 - RzCAT-3.
На фиг. 10 показана гибридизация рибозимов с последовательностями, содержащими GUA /10a/ и GUU /10b/ в матричной CAT-РНК.
На фиг. 11 показаны для самокаталитического расщепления РНК вироида экзокортиса цитрусовых /CEV/ и ее комплемента.
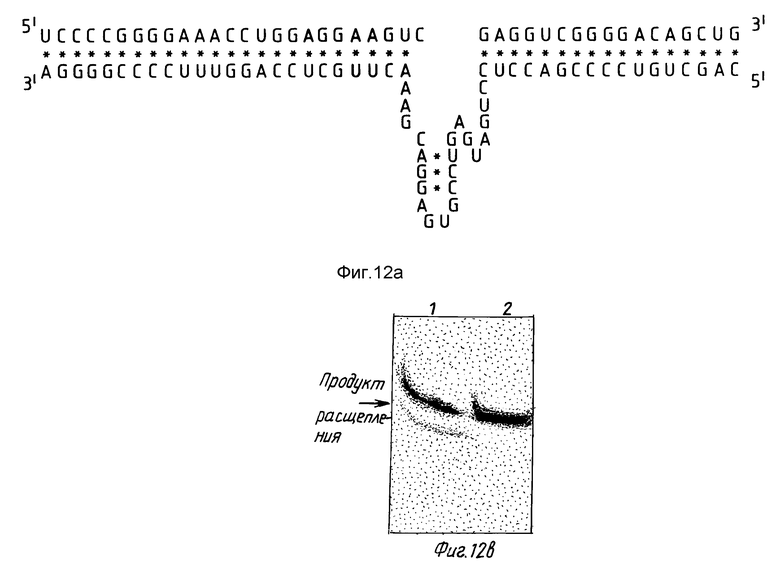
На фиг. 12 показаны рибозим RzCEV 25x/+/, гибридизированный с целевой CEV-РНК/а/, и профиль гель-электрофореза CEV-РНК и комплементарной /-/ CEV-РНК, инкубированных с RzCEV25x/+/ /b, дорожки 1 и 2 соответственно. Продукт расщепления обозначен стрелкой/.
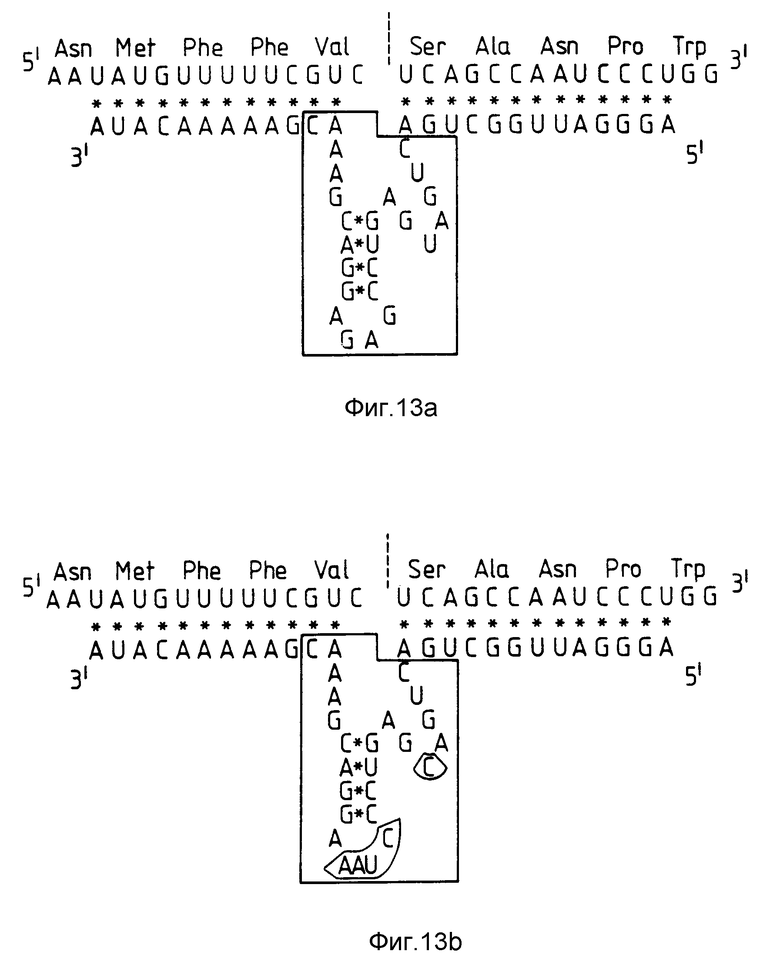
На фиг. 13 показаны рибозим RzCAT-2, гибридизированный с его последовательностью-мишенью /а/ и рибозим RzSCMoV /b/. Каталитическая область каждого домена заключена в рамку. Показаны также отличия /обведены/ каталитической области RzSCMoV по сравнению с RzCAT-2.
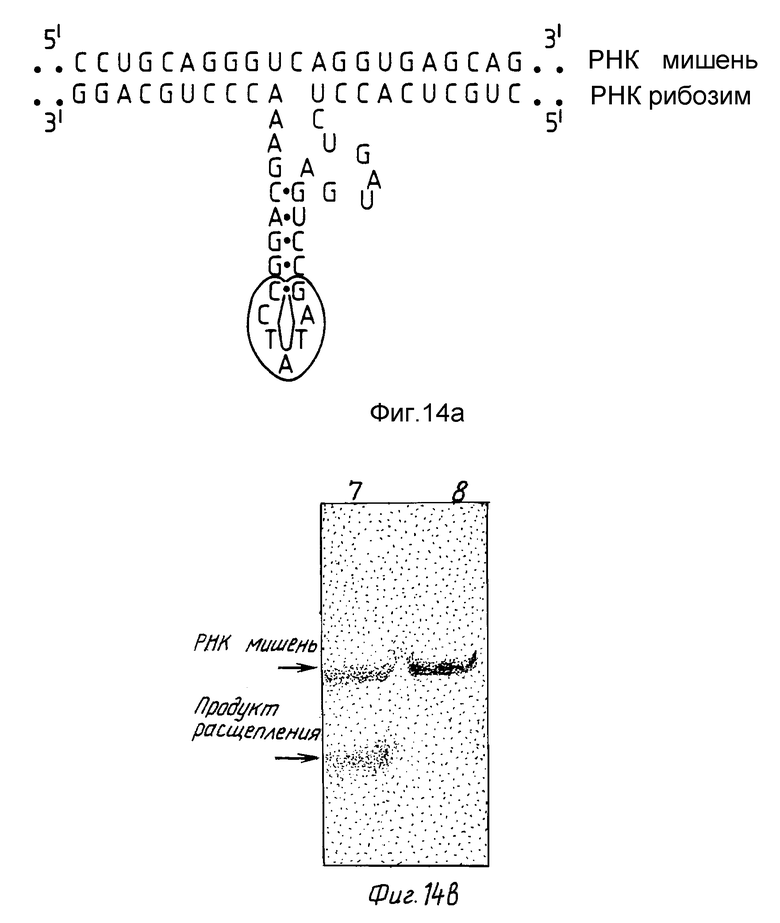
На фиг. 14 показан рибозим RzCEV-2, гибридизированный с его последовательностью-мишенью РНК вироида экзокортиса цитрусовых /CEV/. Сайт расщепления соответствует нуклеотиду 336 в РНК-последовательности CEV. Альтерация в нуклеотидной последовательности в ее каталитической области по сравнению с каталитической областью STOBRV обведена кружком /а/. На фиг. 14 /b/ показан профиль электрофореза контрольной РНК [ /-/ нить CEV], /дорожка 7/ и РНК /+/ нити CEV /дорожка 8/, после инкубации с RzCEV2.
На фиг. 15 показан рибозим RzCAT-2 /а/ в сравнении с рибозимом RzCAT-2B /b/. Каталитические области обведены в рамку. Изменения в каталитической области RzCAT-2B в сравнении с RzCAT-2 также обведены в рамку;
На фиг. 16 изображена карта плазмиды pT35SN;
На фиг. 17 изображен график, представляющий собой активность /среднюю по 4 экспериментам/ при ингибировании CAT-экспрессии в растениях /протопласты табака/.
Ниже приводятся примеры, иллюстрирующие осуществление настоящего изобретения, но не ограничивающие его возможных вариантов.
Реакции и манипуляции с ДНК, такие как лигирование, переваривание рестриктирующими ферментами, бактериальная трансформация, ДНК-секвенирование и т.п., выполнялись в соответствии со стандартной техникой, такой как, например, описана Maniatis et al., /Molecular Cloning, Cold Spring Harbour, 1982/. Манипуляции в РНК также осуществлялись стандартными способами, такими как описаны, например, Uhlenbeck/Nature 328, 596-600 /1987/ и Haseloff and Gerlach (Nature 334, 585-591 /1988/).
Пример 1. Самокатализируемое расщепление мутированной РНК STOBRV
Консенсус областей, ассоциированных с сайтами расщепления природных РНК в ASBV, транскриптах ДНК сателлита тритона, и РНК сателлита STOBRV, LSTV, вируса табачной мозаики /VMoV/, вируса мозаики паслена черного /SNMV/ и вируса мозаики клевера подземного показан на фиг. 1a. На фиг. показаны сохраненные между этими структурами нуклеотидные последовательности, а несохраненные последовательности обозначены X. Добавочные U находятся после остатка IA в /+/ нити LTSV.
Области, связанные с самокаталитическим расщеплением /+/ нити STOBRV, исследовались на активность ферментного субстрата в этой области. Сначала клонированные кДНК STOBRV подвергали мутагенезу путем инсерции олигонуклеотидного линкера /Bam H1/ в соответствии с руководством по применению этого способа.
Конструирование вектора для экспрессии STOBRV in vitro:
160 п.о. TaqI - SpeI - фрагмент кДНК STOBRV выделяли из PSP653 /Gerlach et al., 1985, Virology 151: 172-185 и лигировали с AccI-SpeI - разрезанной и обработанной фосфатазой pGEM 4 для образования сайта Acc I. Полученный в результате клон лианезировали Acc I, обрабатывали фосфатазой и вводили 359 по. TagI-фрагмента кДНК STOBRV. Полученные в результате клоны скринировали на присутствие циркулярно пермутированных 520 п.о. последовательности кДНК STOBRV, содержащей 277-81 терминально избыточных остатков /pTTS/. Последовательность STOBRV фланкирована промоторами для РНК-полимераз T7 и SP6, а в результате in vitro - транскрипции получали РНК с /+/ или /-/ ориентацией, которые содержали два сайта для саморасщепления.
Мутагенез in vitro.
Плазмиду pTTS /50 мкг/ линеаризовали BamH1, обрабатывали SI-нуклеазой и снова лигировали для удаления уникального сайта BamH1. Полученную конструкцию, pTTS-B, обрабатывали с помощью 2 • 10-4 ед. ДНазы I в 29 мМ Трис-HCl /pH 7,0/, 15 мМ MgCl2 в течение 10 мин при 37oC. Полученные линейные ДНК подгоняли, и/или обрабатывали ДНК-полимеразой T4 для наполнения концов, и очищали при помощи электрофореза на агарозном геле 0,7% LGT и при помощи экстракции. Обработанную киназой BamH1-линкерную последовательность /CGGATCGG/ лигировали с линеаризованной плазмидой в течение ночи при комнатной температуре в присутствии 5% полиэтиленгликоля. После чего реакции подвергали перевариванию BamH1, а линейные плазмидные ДНК снова очищали с помощью электрофореза на агарозном геле 0,7% LGT /это было необходимо для удаления последних остатков кольцевой плазмиды вместе с нелигированными линкерами/. Плазмиды снова замыкали при помощи ДНК-лигазы T4 и трансформировали в E. coli ДН-1. Колонии /более 1000/ соскребали с агаровых чашек, культивировали в жидкой среде до насыщения и приготавливали смешанные популяции плазмидных ДНК. Смешанные вставки ДНК STOBRV вырезали путем переваривания рестриктазой у фланкирующих EcoR1 и Pst1 - сайтов, очищали с помощью электрофореза на агарозном геле 1% СТ и субклонировали в EcoR1-Pst1 - разрезанной и обработанной фосфотазой pGEM 4. Полученные в результате трансформанты снова собирали, культивировали в жидкой среде и получали плазмидную ДНК. Плазмидные ДНК обрабатывали BamH1 для расщепления только тех плазмид, которые содержат BamH1 - линкерную последовательность, а затем линейные формы снова очищали посредством двух циклов электрофореза на агарозном геле 0,7% LGT, снова замыкали ДНК-лигазой T4 и трансформировали в E.coli ДН-1. Отдельные трансформанты скринировали на приблизительную локализацию инсертированного BamH1 - линкера в последовательности STOBRV путем переваривания рестриктирующим ферментом, субклонировали в M13 mp19 и секвенировали с помощью стандартного способа дидезокси-терминации.
В результате получали библиотеку STOBRV мутантов. Анализ нуклеотидной последовательности показал, что каждый мутант содержал инсертированную BamH1-линкерную последовательность /CGGATCGG/ вместе с фланкирующими дуплицированными или делетированными последовательностями STOBRV. Мутанты были транскрибированы in vitro, а РНК исследовали на их способность к расщеплению. В результате этих экспериментов 52-нуклеотидную последовательность идентифицировали как содержащую субстрат и участки расщепления РНК STOBRV. Эта 52-нуклеотидная последовательность, изображенная на фиг. 1b, содержит область сохраненной последовательности, необходимой для саморасщепления других РНК /фиг. 1а/. Один мутант, обозначенный D-51, содержал 8-нуклеотидную BamH1-линкерную последовательность, инсертированную между тремя дуплицированными нуклеотидами STOBRV, обозначенными 7-9. РНК этого мутанта подвергалась самокаталитическому расщеплению.
97 и 108 п.о. Hal III - фрагменты, содержащие 52-нуклеотидную последовательность расщепления дикого типа и D-51-РНК /как показано на фиг. 1b и 1c/, удаляли из секвенированных плазмидных клонов. Фрагменты лигировали в Sma1 - сайт pGEM 4 и скринировали для определения обеих ориентаций вставок. Плазмиды были линеаризованы с использованием EcoRI, а РНК с /+/ и /-/ нитями длиной 159 и 170 оснований были транскрибированы с использованием 200 ед/мл РНК-полимеразы T7 в 50 мМ Трис-HCI, pH 7,5, 10 мМ NaCl, 6 мМ MgCl2, 2 мМ спермидина, 1000 ед/мл араназина, 500 мкМ ATP, CTP и GTP с 200 мкМ O32PTP. РНК фракционировали с помощью электрофореза в 10% полиакриламиде, 7-молярной мочевине, 25% формамидном геле и осуществляли авторадиографию.
Как показано на фиг. 1d, расцепления транскриптов /-/ нити РНК не наблюдалось. Это было ожидаемым результатом, поскольку /-/ нить не содержала самокаталитического сайта расщепления. Что касается /+/ нитей последовательностей как дикого типа, так и D-51, то в данном случае расщепление имело место; причем расщепление D-51-PHK было несколько менее эффективно, чем РНК дикого типа /фиг. 1d/. Этот эксперимент показал, что область однонитевой петли с правой стороны от 52-нуклеотидной последовательности, участвующей в самокаталитическом расщеплении РНК, не играет главной роли.
Разделение ферментной и субстратной активностей:
Используя сайт рестриктирующей эндонуклеазы BamH1, введенный в D-51, были получены фланкирующие Hal III - BamH1 и BamH1 - Hal III-фрагменты и каждый из них был субклонирован в E. coli - плазмиде, подходящей для транскрипции in vitro. Это приводит к элиминации мутированной однонитевой петли из области саморасщепления и расщеплению области на два РНК-фрагмента /фиг. 2а/. Меньший Hal III - BamH1-фрагмент содержал нуклеотиды 321-9, включая фактический сайт расщепления, и был обозначен как S-фрагмент. BamH1 - Hal III - фрагмент, содержащий STOBRV - нуклеотиды 7-48, был назван рибозимом или Rz-фрагментом. E.coli - плазмидами, использованными для in vitro транскрипции, были pGEM3 и pGEM4 /Promega, Madison, WI, США/.
Указанные плазмиды экспрессии содержали:
а/ начало репликации;
b/ ген избирательной лекарственной устойчивости /Ampr/;
c/ многократно клонирующий сайт, фланкированный промоторами РНК-полимеразы, который может быть использован для продуцирования транскриптов in vitro.
Фрагменты Rz-pGEM3 и S-pGEM4, обработанные ДНК-полимеразой T7, и переваренные KpnI и XbaI, были транскибированы с помощью РНК-полимеразы при тех же условиях, что были описаны выше.
Как показано на фиг. 2, S-РНК и Rz-РНК не обнаружили значительной деградации при их отдельной инкубации /фиг. 2b/, дорожки 1 и 3/ в условиях, которые способствовали высокоэффективному саморасщеплению /50oC, 20 мМ MgCl2, pH 8,0/. Очевидно, что меченая Rz-РНК также осталась неизменной после инкубации с S-РНК /фиг. 2b, дорожки 2 и 5/. Однако при смешивании S-PHK с Rz-РНК имело место эффективное расщепление S-РНК /фиг. 2b, дорожки 4 и 5/, с образованием двух фрагментов. Размеры продуктов при расщеплении S-РНК /84 оснований/ у нормального сайта между нуклеотидами N 359 и N 1 с образованием фрагментов, расположенных у 5'-конца и 3'-конца, составляли 67 и 17 нуклеотидов соответственно. Это означает, что S-РНК действует как субстрат для рибонуклеолитического расщепления посредством Rz-РНК, которая выполняет каталитическую роль.
Модель рибозима, основанная на каталитической области РНК STOBRV, показана на фиг. 3. Этот рибозим имеет два плеча или фланкирующие последовательности однонитевой РНК /показанной в С/, гибридизирующиеся с комплементарными последовательностями на субстратной РНК, т.е. расщепляемой РНК. Каждая фланкирующая последовательность, показанная в С, содержит 8 рибонуклеотидов. Число нуклеотидов, содержащихся в области С, не является критическим. Однако это число должно быть достаточным для осуществления гибридизации рибозима с РНК-мишенью. Очевидно, что для осуществления указанной гибридизации в области С должно присутствовать как минимум 4 нуклеотида.
Каталитическая область В содержит последовательности, которые являются в высокой степени сохранившимися в областях расщепления природного происхождения /см. фиг. 1a/. По сравнению с областями расщепления известных последовательностей длина стебля II не имеет особого значения, как и присутствие ассоциированной петли у одного его конца.
Сайт расщепления в целевой РНК обозначен у A /фиг. 3/ как GUC. Исходя из экспериментов настоящего изобретения /не показано/ и других экспериментов Koizumi /FEBS LETT 288; 228-230 /1988/; и FEBS LETT 239; 285-288 /1988/, очевидно, что при сайтах в РНК природного происхождения последовательности GUA, GUC, CUC, AUC и UUC также действуют как сайты раскрепления внутри РНК.
Пример 2. Описание построения, синтеза и активности рибозимов, имеющих новую и высокоспецифическую эндорибонуклеазной активностью
В качестве иллюстрации настоящего изобретения были сконструированы три рибозима, направленные против транскрипта обычно используемого индикаторного гена, происходящего из бактерии, хлорамфенилколацетилтрансферазы Tn 9/CAT, которая сообщает устойчивость к антибиотику в бактериях, растениях и животных и которая легко поддается анализу. Эти рибозимы, обозначенные RzCAT-1 - RzCAT-3, соответствуют потенциальным сайтам расщепления GUC в CAT-РНК в положениях 139-140, 494-495 и 662-663 соответственно. Последовательности этих рибозимов изображены на фиг.4. В каждом случае, фланкирующие последовательности рибозима, которые гибридизируются с целевой CAT-РНК, имели длину в 8 нуклеотидов. Каталитические области выбирали в соответствии с областями РНК STOBRV, показанной на фиг. 3.
CAT-ген был получен из pGM4 и был субклонирован в качестве BamH1-фрагмента в pGEM-32 из Promega, Maclison, N 1. Эта плазмида была линеаризована Hind III и CAT-генные транскрипты были получены с использованием РНК-полимеразы T7 с 220 маМ [α-32P] UTP. Последовательности рибозимов синтезировали в качестве олигонуклеотидов, RzCAT-1, 2 и 3 соответственно. Они были обработаны киназой, затем их лигировали с фосфотазной обработкой, pGEM4 разрезали EcoRI-Pst1 и инкубировали с фрагментом Кленова ДНК-полимеразы 1, а затем трансформировали в бактерии. EcoRI-линеаризованную плазмиду транскрибировали с помощью РНК-полимеразы T7, в результате чего получали рибозимные РНК. Рибозимы инкубировали с CAT-транскриптом в 50 мМ Трис-HCl, pH 8,0, 20 мМ MgCl2 при 50oC в течение 60 минут, и полученные продукты фракционировали с помощью электрофореза на 5% полиакриламиде, 7М мочевины, 25% формамидном геле, а затем проводили авторадиографию.
При инкубировании 840-нуклеотидного CAT-транскрипта с любым из трех рибозимов имело место высокоэффективное специфическое расщепление последовательности /фиг. 5/ с образованием 2 РНК-фрагментов в каждой реакции. Размеры фрагментов соответствовали предсказанным сайтам для расщепления /т.е. фрагменты с основаниями 139 и 696, 494 и 341, 662 и 173 были 5'- и 3'-продуктами от расщепления, катализируемого RzCAT-1 - RzCAT-3 соответственно/. Условия, требуемые для указанных рибозим-катализируемых расщеплений, аналогичны условиям, наблюдаемым для естественных реакций расщепления /Foster, A.C. и Symons, R. H., Cell 49: 211-220 /1987/ и Foster, A.C. и Symons, R.H., Cell. 50: 9-16 /1987/ /, причем, более эффективное расщепление наблюдалось при повышенных pH, температуре и концентрациях двухвалентных катионов /данные не приводятся/. При наличии молярного избытка указанные три рибозима осуществляют полное расщепление CAT-РНК-субстрата через 60 минут в 50 мМ Трис-HCl, pH 8,0, 20 мМ MgCl2 при 50oC. При аналогичных условиях с использованием 0,1 мкМ субстрата и 3 мкМ рибозимов T1/2CAT-мРНК-субстрата составляло 3,5; 3,5 и 2,5 минут в присутствии RzCAT-1 - RzCAT-3 соответственно. Рибозимные последовательности были инактивированы по отношению к комплементу субстратной РНК /т. е. , /+/ нить/ и в форме олигонуклеотидов /данные не представлены/. 3'-концевые фрагменты расщепления от каждой реакции, катализированной рибозимом, выделяли, а 5'-концевые обрабатывали [32P]-киназой /50 мМ Трис-HCl, pH 9, 10 мМ MgCl2, 10 мМ ДТТ с 50 мкКи γ-32P-ATP и 5 ед. полинуклеотидной киназы T4, при 37oC в течение 30 минут/. Эффективная обработка фрагментов киназой показала, что они имеют 5'-концевые гидроксильные группы, аналогичные группам, образующимся при реакциях расщепления, происходящих в природе. Затем определяли концевые нуклеотиды фрагментов, продуцированных расщеплением CAT-последовательностей с помощью RzCAT-1 - RzCAT-3. Короче говоря, радиоактивно меченные фрагменты очищали на 5% полиакриламидном геле и переваривали равным объемами 500 ед/мл РНКазы T1, 25 ед/мл РНКазы T2 и 0,125 мг/мл РНКазы A в 50 мМ ацетата аммония, pH 4,5, при 37oC в течение 120 минут. Полученные продукты фракционировали на 20% полиакриламидном геле, содержащем 25 мМ цитрата натрия, pH 3,5 и 7-молярной мочевины. Из фиг. 5b видно, что расщепление CAT-последовательностей посредством RzCAT-1 - RzCAT-3 происходит точно перед нуклеотидами A, U и G соответственно.
Концевые последовательности фрагментов CAT-гена определяли непосредственно с помощью техники частичного ферментного переваривания /Donis - Keller et al. , Nucleic Acid. Res. 4: 2527-2538 /1980/, используя основно-специфическое рибонуклеотическое расщепление. Последовательности полученных фрагментов подтвердили, что расщепление в CAT-РНК происходит в ожидаемых участках /не показано/.
Ферментный катализ.
Чтобы продемонстрировать, что рибозимы настоящего изобретения вызывают расщепление CAT-мРНК-субстрата каталитическим способом, каждый из этих рибозимов инкубировали с молярным избытком субстрата в условиях, которые должны благоприятствовать эффективному расщеплению и диссоциации продуктов. На фиг. 6 показаны результаты, которые были получены после каталитического специфического расщепления 70 мин при 50oC, в 20 мМ MgCl2, pH 8,0, 10 рМ RzCAT-1 усеченного /173 оснований/ CAT-РНК-субстрата с образованием 5'- и 3'-фрагментов с 139 и 34 основаниями соответственно. В среднем, каждый рибозим участвовал в более чем 10 случаях расщепления. Через 75 мин при 50oC наблюдалось до некоторой степени неспецифическое расщепление РНК, обусловленное экстремальными условиями, но 70% оставшихся интактных РНК /163 рМ/ аккумулировались как фрагмент с 139 основаниями. Аналогичный результат был получен для RzCAT-2 и RzCAT-3 /не показаны/, в результате чего можно сделать вывод, что каждый рибозим действует как РНК-фермент.
Пример 3. Влияние температуры на активность рибозима.
Были проведены исследования влияния реакционной температуры на степень активности рибозима in vitro.
Реакцию проводили с использованием рибозимов RzCAT-1 - RzCAT-3 с субстратом CAT-РНК при 37oC и 50oC.
В этом эксперименте реакцию для каждого рибозима дублировали, используя реакционные условия для расщепления, катализируемого рибозимом, аналогично описанным в примере 2. Одну реакцию инкубировали при 37oC, а другую при 50oC. Образцы удаляли точно через 90 мин, после чего реакцию анализировали путем электрофореза в полиакриламидном геле. На фиг. 7 показано время протекания реакции для каждого рибозима RzCAT-1 - RzCAT-3 при 37oC и 50oC. Скорость реакции каждого рибозима возрастала с увеличением реакционной температуры.
Время, взятое для 50% /t1/2/ расщепления CAT-РНК, приведено в таблице 1.
Как видно из таблицы 1, скорость реакции рибозимов при 37oC приблизительно в 20 раз меньше чем при 50oC.
Пример 4. Влияние различий в длинах плечей рибозимов /или фланкирующей последовательности/ на каталитическую активность рибозимов
Плечи фланкирующих последовательностей рибозима (область /I/ формулы I) осуществляют гибридизацию рибозима с его РНК-мишенью, после чего имеет место расщепление РНК. В этом эксперименте исследовали изменение скорости расщепления целевой последовательности с изменением степени комплементарности, а затем длины комплементарного спаривания оснований плечей рибозима с целевой последовательностью.
Рибозимы были продуцированы с комплементарностью 4, 8 и 12 оснований к целевой последовательности RzCAT-2 на каждом плече /фиг. 8a/. Рибозимы получали в соответствии с описанием в примере 2. Активность рибозима определяли путем инкубирования рибозимной РНК с CAT-РНК, как было описано ранее. Рибозим, имеющий комплементарность 4 оснований на каждом плече, не расщеплял субстратную РНК. Рибозим с комплементарностью 8 оснований на каждом плече расщеплял CAT-субстрат так же, как и рибозим, имеющий комплементарность 12 оснований. Рибозимы с комплементарностью 12 оснований расщепляли целевую РНК более эффективно, чем рибозимы, имеющие меньшее число комплементарных оснований. Даже при комплементарности более чем 4 оснований скорость реакции увеличивается при увеличении длины области гибридизации.
Во втором эксперименте исследовали реакционную эффективность рибозима, имеющего /а/ комплементарность к полной длине целевой РНК транскрипта CAT, и /b/ многократно каталитические области. Для этого были выбраны четыре целевых сайта CUC в CAT-РНК-последовательностях. Каталитические области рибозима по отношению к этим сайтам инсертировали в полную антисмысловую /-/ последовательность для CAT-транскрипта, после чего определяли каталитическую активность.
Четырьмя выбранными сайтами были три точно определенные посредством RzCAT-1 - RzCAT-3 и описанные ранее сайты, а еще один сайт может быть представлен следующим образом:
Новый CAT-сайт
N 192
5′
где "192" относится к аминокислоте 192 в CAT-полипептиде, U относится к сайту расщепления.
Олигонуклеотиды, содержащие рибозимные каталитические области и включающие каждый из этих сайтов расщепления, использовались для мутагенеза М13 в целях продуцирования последовательности, содержащей полный комплемент CAT-последовательности с введенными 4-я каталитическими областями рибозима. М13-мутагенез осуществляли путем связывания олигонуклеотидов, содержащих инсерции рибозима, с однонитевыми М13-ДНК, содержащими урацил, с последующим синтезом комплементарных ДНК, содержащих инсерцию. После клонирования в соответствующем штамме Escherichia coli комплементарные ДНК выделяли /T.A. Kunkel 1985, Prog. Natl. Acad. Sci. USA. 82: 488-492/. Полученные двухнитевые кДНК клонировали in vitro в векторе экспрессии в целях продуцирования рибозимной РНК, используя при этом систему транскрипции с полимеразой T7. Активность рибозима определяли путем инкубации рибозимной РНК с CAT-транскриптом с последующим гель-электрофорезом реакционной смеси, проведенным после обработки смеси глиоксалем для денатурации нуклеиновых кислот.
Автолитическое расщепление имело место у всех ожидаемых сайтах на CAT-транскрипте. В соответствии с этим фланкирующие последовательности плечей или рибозима могут располагаться по всей длине расщепляемого РНК-транскрипта.
На фиг. 9 схематически изображено получение каталитической антисмысловой РНК, содержащей каждый из четырех рибозимов. Каталитическая антисмысловая РНК содержит около 900 оснований.
При указанных выше условиях рибозим и последовательности мишени образуют высокомолекулярные комплексы, вероятно, вследствие экстенсивного спаривания оснований. Сильная денатурирующая обработка, такая как обработка глиоксалем, необходима для растворения реакционных продуктов при осуществлении электрофореза.
Пример 5. Последовательности-мишени для рибозимного расщепления.
Для того, чтобы убедиться действительно ли рибозим осуществляет расщепление в этой последовательности, исследовали GUA-мотив в мРНК.
В CAT-мРНК выбирали специфический сайт, фиг. 10, включающий GUA-мотив, и получали соответствующую последовательность рибозима, после чего проводили тестирование на активность. Рибозим имел плечи длиной 8 рибонуклеотидов.
Затем, в соответствии с описанием, приведенным в примере 2 получали синтетические олигонуклеотиды, соответствующие рибозиму, изображенному на фиг. 10, и двухнитевую кДНК клонировали в векторе экспрессии in vitro pGEM 4 /см. выше/ в E. coli в целях продуцирования рибозимной РНК, используя при этом систему транскрипции с полимеразой T7. Активность рибозима определяли путем инкубации рибозимной РНК с CAT-мРНК с последующим гель-электрофорезом реакционной смеси, как было описано ранее.
Расщепление рибозимом осуществлялось у целевого сайта GUA /не показан/. Из этого можно заключить, что мотив GUA в РНК является субстратом для рибозимов настоящего изобретения.
Этот вывод не является полностью неожиданным, так как один из природных сайтов расщепления РНК сателлита-вируса преходящего стрика люцерны требует узнавания GUA-сайта.
Аналогичное исследование GUU-мотива в целевой последовательности CAT-РНК, проведенное с использованием соответствующего рибозима /см. фиг. 10b/, показало осуществление расщепления.
Примеру 6. Рибозимное расщепление в вирусных РНК.
Вироидную РНК, а именно, вироида экзокортиса цитрусовых, подвергали расщеплению с использованием рибозима настоящего изобретения.
Два целевых сайта выбирали в РНК вироида экзокортиса цитрусовых /CEV/. И один сайт также выбирали в комплементарной нитевой последовательности. Против этих сайтов получали рибозимы, после чего исследовали активность. Указанные рибозимы обозначали CEV9x/+/, CEV9x/-/ и CEV25/+/. На фиг. 11 показаны три сайта расщепления в CEV-РНК для каждого из этих рибозимов. Все рибозимы получали в соответствии с описанными ранее способами. Рибозим RzCEV25x/+/ показан на фиг. 12. Этот рибозим расщепляет GUC у нуклеотида 116 CEV-РНК.
На фиг. 12/b/ показано расщепление CEV-РНК рибозимом RzCEV9x/+/. С рибозимом RzCEV9x/-/ расщепления не наблюдалось.
Этот эксперимент показал, что рибозимы являются активными по отношению к последовательностям РНК, происходящим из различных источников. Этого результата можно было ожидать, так как все РНК построены на основе рибонуклеотидов, содержащих аденин, гуанин, цитозин и урацил, т.е. основания, которые входят в состав всех РНК, независимо от того, являются ли они животного, растительного или бактериального происхождения.
Пример 7. Примеры рибозимов, имеющих вариабельные каталитические области.
Получали рибозим, направленный на CAT-2-сайт, используя последовательность с каталитической областью, происходящую от РНК сателлита вируса мозаики клевера подземного /SCMoV/. Фланкирующую последовательность плеча рибозима с комплементарностью 12 оснований вводили в сконструированный рибозим RzSCMoV. Рибозимы RzCAT-2 и RzSCMoV показаны на фиг. 13a и 13 соответственно. Область петли рибозима RzSCMoV содержала 5 нуклеотидов, имеющих последовательность AAAUC. Это не так сильно отличается от области петли рибозима RzCAT-2, которая содержит 4 нуклеотида, имеющих последовательность AGAG. Кроме того, RzSCMoV содержит C в каталитической области вместо U*, которое имеется в RzCAT-2. Последовательности, отличающиеся при сравнении RzSCMoV и RzCAT-2, были помечены.
RzSCMoV получали в соответствии с описанием, приведенным в примере 2. Как и ожидалось, RzSCMoV проявил активность с образованием двух продуктов расщепления.
В другом эксперименте целевой сайт CEV при нуклеотиде -336 в кРНК расщепляли рибозимом RzCEV-2, имеющим последовательность, изображенную на фиг. 14a. Область петли, обозначенная "L" на фиг. 14, содержала 6 нуклеотидов, имеющих последовательность 3'-CCTATA-5', что отличается от области петли STOBRV, которая содержит 4 нуклеотида с последовательностью 3'-AGAG-5'. Этот рибозим расщепляет целевую комплементарную CEV-PHK в положении -336, как показано на профиле электрофореза на фиг. 14b.
Этот эксперимент показал, что число нуклеотидов и нуклеотидная последовательность области петли не играют значительной роли в активности рибозима. В указанных экспериментах рибозимы были получены способами, описанными выше.
В другом эксперименте исследовали влияние спаривания оснований в каталитической области /области стебля/ на активность рибозима.
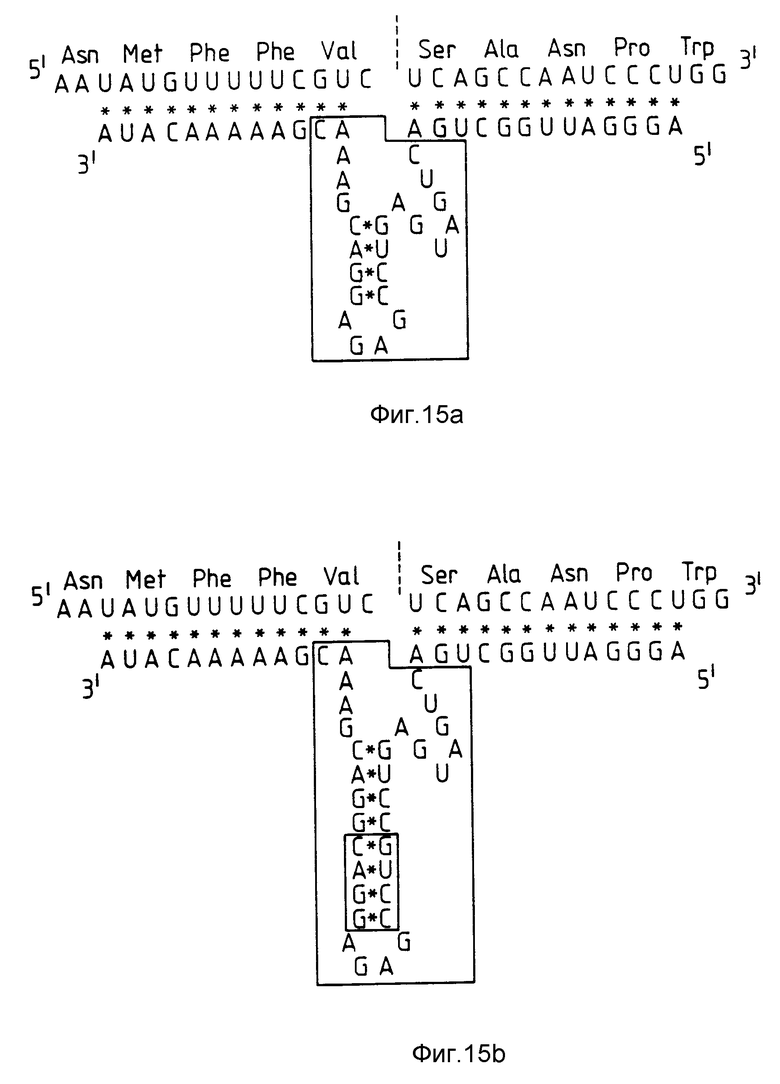
Для этого был получен модифицированный рибозим, который соответствовал RzCAT-2, но содержал 4 лишних пар оснований, который затем подвергали тестированию. На фиг. 15a показана гибридизация последовательности рибозима с целевой CAT-РНК. Исследуемый рибозим показан на фиг. 15b, где дополнительные пары оснований заключены в рамку. Активность исследуемого рибозима соответствовала активности рибозима RzCAT-2. Это означает, что участок спаренных оснований каталитической области рибозима может иметь разную длину, что не оказывает значительного влияния на каталитическую активность.
Было обнаружено /данные не приводятся/, что стабильная in vivo форма РНК-транскриптов STOBRV, экспрессированных в трансгенных растениях, является, в основном, кольцевой, что вероятно, обусловлено лигированием 5'- и 3'-концов. Поэтому использование двух сайтов автолитического расщепления, фланкирующих нужную последовательность в in vivo-РНК-транскрипте, по всей вероятности, приводит к получению кольцевого продукта, который может обладать лучшей устойчивостью, чем линейные транскрипты. Этот способ, очевидно, может послужить основой для получения стабилизированных in vivo последовательностей рибозима. Этот способ относится к замыканию молекул.
Пример 8. In vivo - активность рибозимов.
В этом примере приведено описание исследований in vivo - активности рибозимов в клетках растений.
Протокол эксперимента:
Плазмиды, содержащие анти-CAT /CAT=хлорамфениколацетилтрансфераза/ или объединенные генные конструкции анти-CAT/рибозим /см. ниже/, вводили в протопласты в одинаковом количестве и пропорциях друг относительно друга вместе с другой плазмидой, которая содержала функциональную CAT-генную конструкцию. Затем измеряли CAT-активности и сравнивали их с основным уровнем генной активности.
Материалы и методы:
/а/ Электропорация и CAT-анализ
Способ осуществляли в соответствии с описанием в работе Llewellyn et al. , T. Mol. Biol. /1987/ 195:115-123. Короче говоря, протопласты линии T5 Nicotiana plumbaginifolia получали из суспензии через два дня после того, как субкультуру суспендировали в 10 мМ HEPES pH 7,2, 150 мМ NaCl, 0,2 М маннита и доводили до плотности 3 x 106 мл. Электропорацию осуществляли с использованием одного 50 мс импульса при 250 В. Протопласты 10-кратно разбавляли и культивировали в течение 20 часов в темноте при 26oC. Затем их подвергали разрушению путем обработки ультразвуком и получали экстракты. Экстракты нормализовали на содержание белка и анализировали на CAT-активность активность in vitro с использованием 13С-хлорамфеникола и ацетил CoA. Реакционные продукты разделяли с помощью тонкослойной хроматографии и визуализировали с помощью авторадиографии. Предел реакции рассчитывали с помощью продуцирования производных радиоактивного продукта от 14C-хлорамфениколовой матрицы.
Генные конструкции
Генные конструкции вводили в 0,1 мл суспензий протопластов в качестве плазмидных ДНК, которые очищали от бактерий путем экстракции и двух циклов равновесного центрифугирования с градиентом плотности CsCl. После чего осуществляли резуспендирование в 10 мМ Трис/1 мМ ЭДТК/pH = 7,5 для дальнейшего использования.
Активные CAT-генные конструкции были внесены в плазмиду, обозначенную pCAT7/+/. Она была получена путем слияния последовательности CAT-гена /от плазмиды pGM4, см. T.T. Close и P. Rodriguez, 1982, Gene 20:305-316/ с плазмидой pT35SN /происходящей от плазмиды p35SN, W.L. Gerlach et al., 1987, Nature 328:802-805/; таким образом конструкция активного гена представляла собой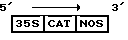
где 35S относится к 35S CaMV-промотору /CAMV- вирус мозаики цветной капусты, NOS относится к сигналу полиаденилирования нопалинсинтетазы, T/C к транскрипции.
Наряду с 0,2 мкг pCAT7+ добавляли различные генные конструкции в избыточном количестве, как описано ниже. Генные конструкции содержались в плазмидах, имеющих следующие структуры:
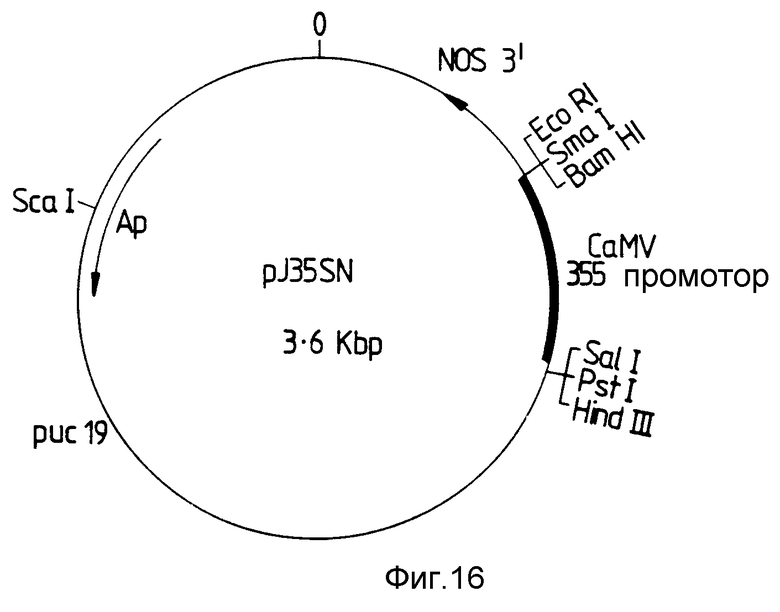
pT35SN - Эта векторная плазмида, карта которой изображена на фиг. 16, содержит 35S CaM - промотор и сигнал 3'-полиаденилирования нопалинсинтазы растения и которая может быть схематически представлена следующим образом:
pCAT7 - Эта плазмида содержит последовательность CAT-гена, инсертированную в pT35SN так, чтобы транскрипция приводила к продуцированию антисмысловой CAT-РНК, указанная плазмида может быть схематически изображена следующим образом:
pCAT19 - Эта плазмида содержит CAT-ген с четырьмя каталитическими областями рибозимы /см. пример 4 и фиг.9/, инсертированный в pT35SN так, чтобы транскрипция приводила к продуцированию антисмысловой CAT-РНК, содержащей 4 каталитические области рибозима; указанная плазмида может быть схематически изображена следующим образом: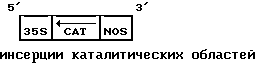
Результаты:
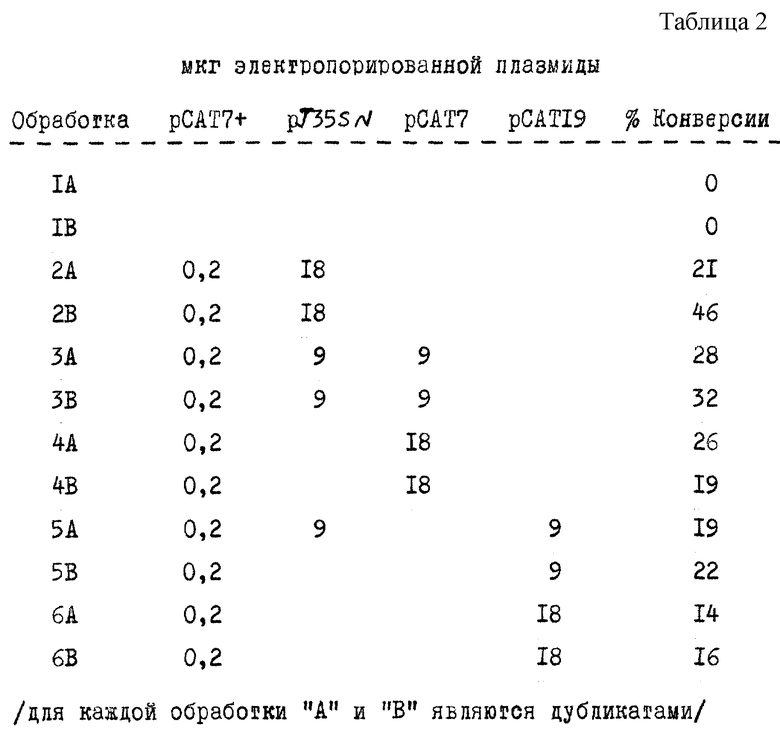
В таблице 2 представлены относительные CAT-активности в клетках через 20 часов после электропорации. Активность выражали как процент конверсии хлорамфениколового субстрата за 1 час анализа.
На основании полученных результатов можно сделать следующие выводы:
/а/ Введение CAT-генной конструкции приводит к значительной CAT-активности - ср. 2A, B с IA, B. Имеются также различия между дубликатами. Из результатов видно, что как и в других образцах /см. п. "о" и "с" ниже/, 2A показывают ненормально низкую активность.
/b/ Сопутствующее введение антисмысловой генной конструкции приводит к снижению уровня активности - ср. 3A, B и 4A, B с 2B. Степень этого снижения непосредственно связана с уровнем добавленного антисмыслового гена в виде плазмиды - ср. 3A, B и 4A, B.
/с/ Сопутствующее введение комбинированной генной конструкции антисмысловой ген/рибозим приводит к снижению генной активности - ср. 5A, B и 6A, B с 2B. Кроме того, это снижение более заметно для соответствующих уровней конструкций антисмыслового гена - ср. 5A, B с 3A, B и 6A, B с 4A, B.
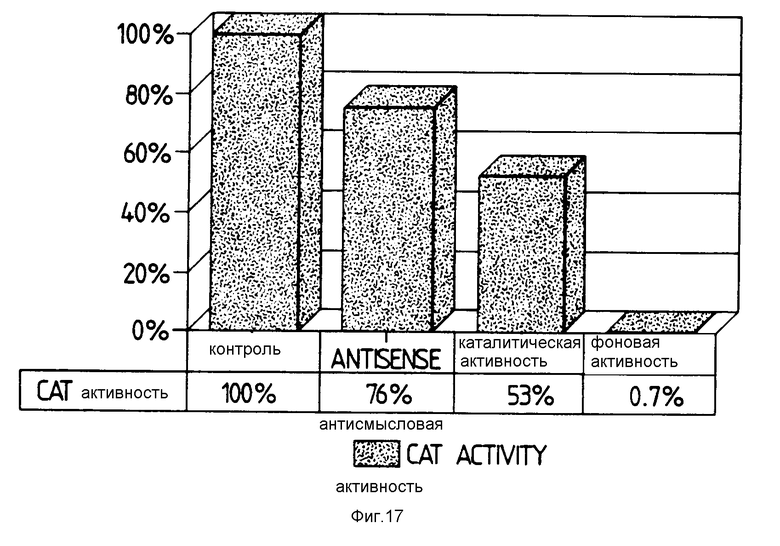
Средние результаты для четырех экспериментов in vivo представлены на фиг. 17. На этом чертеже столбец "контрольный" представляет обработку 2; столбец "антисмысловой" представляет обработку 4; столбец "каталитический" представляет обработку 6; а "фон" - обработку 1.
Каталитический рибозим ингибирует CAT-активность в среднем на 47 % и в среднем на 37% для антисмыслового рибозима.
Введение рибозимнесущих генов в растительные клетки ингибирует активность генов, против которых они направлены. Более того, это ингибирование выше, чем для соответствующих молекул антисмысловой РНК.
Эти результаты показывают, что указанные рибозимы могут быть активными в клетках животных, растений или микробов против ряда целевых РНК-молекул.
Механизмы действия рибозимов в указанных примерах не совсем ясны. Например, антисмысловой рибозим может необратимо гибридизироваться с целевой РНК и катализирует расщепление фосфодиэфирной связи в одном или нескольких целевых сайтах вдоль целевой РНК. Альтернативно клеточные ферменты могут раскручивать антисмысловую РНК из ее целевой последовательности так, чтобы целевая РНК расщеплялась на два или несколько фрагментов.
Пример 9. In vivo - активность рибозимов в клетках животных
В этом примере иллюстрируется активность рибозимов в инактировании целевой РНК в клетках млекопитающего.
Материалы и методы:
Конструкции активных генов, кодирующих рибозимы, трансфецировали в практически доступную COSI от линии клеток почки обезьяны путем электропорации. В этом способе 3 • 106/мл COSI-клеток суспендировали в солевом буфере, содержащем 10% FC /околоплодная сыворотка теленка/, подвергали взаимодействию с различными генными конструкциями и прикладывали электрический разряд для осуществления электропорации ДНК в клетках. Трансфецированные клетки инкубировали при 37oC в течение 48 часов в культуральной среде, после чего проводили анализ на CAT- и люциферазную активность.
Генные CAT-конструкции вводили в плазмиду, обозначенную pTK CAT /Miksicek et al., Cell. 46: 283-290, 1986/. Эта плазмида была образована путем введения последовательности CAT-гена в плазмиду так, чтобы она находилась под контролем промотора тимидинкиназы вируса простого герпеса.
Генные конструкции, кодирующие рибозимы, вводили в плазмиду pSV 232A /De Wet et al., Molecular and Сellular Biology 7: 725-737, 1987/, содержащую ген люциферазы, сплавленный с ранним промотором SV 40. ДНК кодирующие рибозимы лигировали в Xbal-сайт у 3'-конца гена люциферазы в соответствии со стандартными способами, описанными Maniatis et al., (Molecular Cloning, a Laboratory Manual, Cold Spring Harbour, 1982/.
С помощью стандартной техники Maniatis et al., /см. выше/ были получены следующие конструкции:
pFC58 - Этот плазмидный вектор содержал ДНК, кодирующую рибозим RzCAT-1, сплавленный с 3'-концом гена люциферазы в нефункциональной ориентации.
Схема этой плазмиды может быть представлена следующим образом: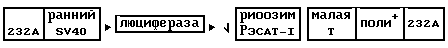
где 232A относится к последовательностям pSV232A, ранний SV40 означает ранний промотор SV40 и малая T означает ДНК, кодирующую малую промежуточную последовательность T промотора SV40. Эта конструкция позволяет продуцировать молекулу РНК, кодирующую люциферазу и рибозим RzCAT-1, причем последний находится в ориентации, при которой он не имеет каталитического действия.
pFC4 - эта плазмида является аналогичной pFC58 за исключением того, что вместо RzCAT-1 продуцируют RzCAT-3.
pFC1-6 - Эта плазмида является аналогичной pFC58 за исключением того, что рибозим RzCAT-1 заменяется рибозимом RzCAT-3 в смысловой ориентации /5'-3'/.
pFC20 - Эта плазмида является аналогичной pFC1-6 за исключением того, что RzCAT-3 заменяется рибозимом RzCAT-2, имеющим 8 нуклеотидных фланкирующих последовательностей.
pFC12 - Эта плазмида является аналогичной pFC20 за исключением того, что рибозим RzCAT-2 содержит 12 нуклеотидных фланкирующих последовательностей.
pFC50 - Эта плазмида содержит CAT-ген с 4-я каталитическими областями рибозима /см. пример 4 и фиг. 9/ в смысловой ориентации /5'-3'/, которая при транскрипции дает неактивный рибозим. Эта плазмида может быть изображена схематически следующим образом: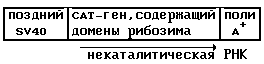
pFC54 - Эта плазмида аналогична pFC50 за исключением того, что CAT-ген и области рибозима находятся в антисмысловой /3'-5'/ активной ориентации.
pFC64 - Эта плазмида содержит промотор SV50 и сигналы полиаденилирования, являющиеся общими с pFC50, и, кроме того, содержит CAT-ген дикого типа, но без областей рибозима. Этот ген находится в антисмысловой ориентации и поэтому не может продуцировать CAT-белок.
pFC65 - Эта плазмида является аналогичной плазмиде pFC64 за исключением того, что CAT-ген дикого типа находится в смысловой /5'-3'/ ориентации и поэтому обладает способностью продуцировать CAT-белок.
Анализы:
По методам De Wet et al., /см. выше/ проводили анализ на активность люциферазы. Короче говоря, COS-клетки лизировали в течение 48 часов после трансфекции, и клеточный лизат инкубировали с люфицерином, субстратом люциферазы и определяли люминесценцию с помощью сцинтилляционного счетчика.
CAT-активность также определяли с использованием COS-клеточного лизата /клеточные лизаты делили наполовину и каждую половину использовали либо для анализа на люциферазу, либо на CAT-активность /по методу Sleing, M.T. Anal. Biochem 156: 251-256 /1986/.
In vivo - анализы показали, что pFC58 и pFC4 не влияли на CAT-активность в трансфецированных клетках. Эту активность обозначали как 100% CAT-активность и 0% CAT-ингибирование. CAT-активность в клетках, трансфецированных другими плазмидами, измеряли по отношению к pFC58. Процент CAT-ингибирования определяли по формуле: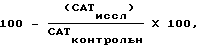
нормализованную по отношению к продуцированию люциферазы.
CATиссл. = результат CAT-анализа для исследуемых конструкций. CATконт рольн. = CAT-анализ для контрольных конструкций /pFC4 и pFC58/.
Продуцирование люциферазы является внутренним контролем для электропорации и позволяет измерять продуцирование рибозима в каждой отдельной электропорированной чашке с тканевой культурой. Результаты см. в конце описания.





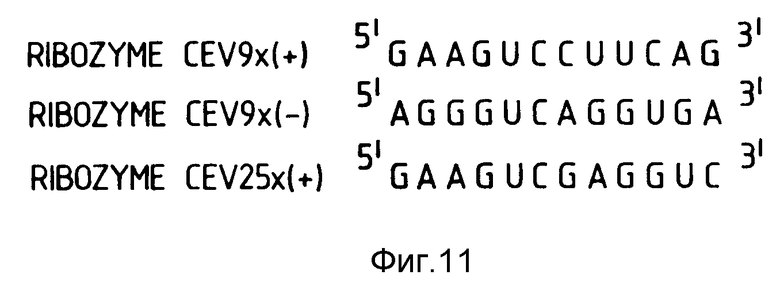
Изобретение относится к синтетическим однонитевым молекулам РНК, обладающим высокоспецифичной эндонуклеазной активностью. Рибозим содержит гибридизирующуюся и каталитическую области. Гибридизирующаяся область содержит одну или более ветвей однонитевой РНК. Предпочтительный рибозим имеет каталитическую область, включающую последовательность AAGC*GAGXAGUC в шпилечной N1-*N2-структуре, где * означает спаривание оснований между комплементарными нуклеотидами, X является любым рибонуклеотидом и N1 и N2 представляют собой рибонуклеотиды с комплементарными последовательностями по меньшей мере в части их длины. Рибозим расщепляет РНК-мишень после триплета хUy, где х является любым рибонуклеотидом, U представляет собой урацил и y является аденином, цитозином или урацилом. Получают нуклеотидную последовательность, кодирующую необходимый рибозим, лигируют ее с подходящим вектором переноса, содержащим ДНК, или РНК, или их комбинацию. Транскрибируют лигированную последовательность с использованием РНК-полимеразы. На РНК-мишень внутри клетки воздействуют рибозимом, способным осуществлять специфическое расщепление указанной РНК-мишени в сайте, выбранном таким образом, что указанная РНК-мишень гибридизуется внутри клетки с рибозимом так, чтобы вызвать инактивацию РНК-мишени. Изобретение позволяет получить рибозимы, которые эффективно гибридизируются с широким рядом целевых РНК-последовательностей, не модифицируя при этом расщепленную целевую РНК. 3 с. и 8 з.п.ф-лы, 38 ил., 2 табл.
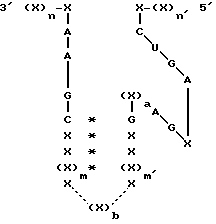
где X представляет собой любой рибонуклеотид, который может быть одинаковым или различным;
(X)n и (X)n' каждый представляет собой олигорибонуклеотид с предопределенной последовательностью, которая способна взаимодействовать посредством спаривания оснований с последовательностью РНК-мишени, которая должна быть подвергнута расщеплению, и в периоде не связана ковалентно с последовательностями X-A-A-G-C и X-C-U-G-A соответственно;
n и n' каждый представляет собой целое число, которое определяет количество рибонуклеотидов в олигонуклеотиде при условии, что сумма n + n' достаточна для реализации стабильного взаимодействия рибозима с последовательностью РНК-мишени посредством спаривания оснований;
каждая * представляет собой спаривание оснований между рибонуклеотидами, локализованными на той или иной стороне;
каждая сплошная линия представляет собой химическую связь, обеспечивающую ковалентное связывание между рибонуклеотидами, локализованными на той или иной стороне;
a = 0 или 1, и если a = 0, то A, локализованное на 5'-конце (X)a, связывается с G, локализованным на 3'-конце (X)a;
m и m' каждое представляет собой целое число, которое больше или равно 1;
b является 0 или целым числом больше 2;
каждая пунктирная линия независимо представляет собой либо (i) химическую связь, обеспечивающую ковалентное связывание между рибонуклеотидами, локализованными на той или другой стороне (X)b, когда b представляет собой целое число, большее или равное 2, либо (ii) отсутствие любой ткани химической связи, когда b = 0.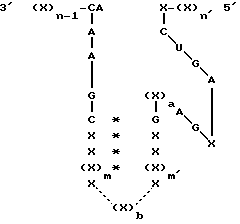
где X каждый представляет собой рибонуклеотид, который может быть одинаковым или различным;
(X)n-1 и (X)n каждый олигорибонуклеотид, имеющий предопределенную последовательность, которая способна взаимодействовать посредством спаривания оснований с последовательностью РНК-мишени, которая должна быть подвергнута расщеплению, и не связана в природе ковалентно с последовательностями C-A-A-A-G-C и X-C-U-G-A соответственно;
n и n' каждый представляет собой целое число, которое определяет количество рибонуклеотидов в олигонуклеотиде при условии, что сумма n + n' достаточна для реализации стабильного взаимодействия рибозима с последовательностью РНК-мишени посредством спаривания оснований;
каждая * обозначает спаривание оснований между рибонуклеотидами, локализованными на той или другой стороне;
каждая сплошная линия представляет собой химическую связь, обеспечивающую ковалентное связывание между рибонуклеотидами, локализованными на той или другой стороне;
a = 0 или 1 и, когда a = 0, то A, локализованное на 5'-конце (X)a, связывается с G, локализованным на 3'-конце (X)a;
m и m' каждый является целым числом, которое больше или равно 1;
b представляет собой 0 или целое число, большее или равное 2;
каждая прерывистая линия независимо представляет собой либо (i) химическую связь, обеспечивающую ковалентное связывание между рибонуклеотидами, локализованными на той или другой стороне (X)b, когда b является целым числом, большим или равным 2, либо (ii) отсутствие любой такой химической связи, когда b = 0.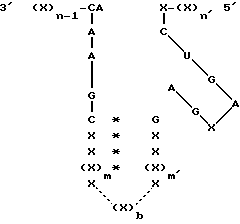
где каждый X - рибонуклеотид, который может быть одинаковым или различным;
(X)n-1 и (X)n каждый - олигорибонуклеотид с предопределенной последовательностью, которая способна взаимодействовать посредством спаривания оснований с последовательностью РНК-мишени, которая должна быть подвергнута расщеплению, и не связывается естественным образом ковалентно с последовательностями C-A-A-A-G-C и X-C-U-G-A соответственно;
n и n' каждый представляет собой целое число, которое определяет количество рибонуклеотидов в олигонуклеотиде при условии, что сумма n + n' достаточна для реализации стабильного взаимодействия рибозима с последовательностью РНК-мишени посредством спаривания оснований;
каждая * представляет собой спаривание оснований между рибонуклеотидами, локализованными на той или другой стороне;
каждая сплошная линия представляет собой химическую связь, обеспечивающую ковалентное связывание между рибонуклеотидами, локализованными на той или другой стороне;
m и m' каждый - целое число, которое больше или равно 1;
b является 0 или целым числом, большим или равным 2;
каждая прерывистая линия независимо представляет собой либо (i) химическую связь, обеспечивающую ковалентное связывание между рибонуклеотидами, локализованными на той или другой стороне (X)b, когда b является целым числом, большим или равным 2, либо (ii) отсутствие любой такой химической связи, когда b = 0.
3'-[-(Y)r-Q-(Y)S-]Z-5',
где Q - соединение, имеющее структуру по любому из пп.1 - 7;
Y каждый - рибонуклеотид, одинаковый или различный;
r и s каждый - целое число, большее или равное 0;
Z - целое число, большее или равное 1.
| Forster A.C | |||
| and Symons R.H | |||
| Cell | |||
| - v | |||
| Устройство для выпрямления многофазного тока | 1923 |
|
SU50A1 |
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Устройство двукратного усилителя с катодными лампами | 1920 |
|
SU55A1 |
| Nature, - V | |||
| Способ переработки сплавов меди и цинка (латуни) | 1922 |
|
SU328A1 |
| ВОДООТВОДЧИК ДЛЯ ПАРОПРОВОДОВ | 1921 |
|
SU596A1 |
| Uhlenbeck | |||
| A small catalytic oligoribonucleotide. | |||
Авторы
Даты
2000-01-10—Публикация
1988-12-14—Подача