Изобретение относится к медицине, в частности к фармакологии и терапии, и может быть использовано для профилактики и лечения различных заболеваний посредством регулирования эндогенной продукции цитокинов и гемопоэтических факторов и индукции механизмов апоптоза в вирус- и/или опухоле-трансформированных клетках.
Уровень техники
Известно, что ряд гуморальных факторов, эндогенно вырабатываемых в организме млекопитающих, - цитокинов и гемопоэтических факторов - обладают высокой биологической активностью и способны оказывать существенный лечебный эффект при разнообразных заболеваниях у человека [1], [2]. Многие из этих факторов оценивались в рамках клинических испытаний и сегодня используются как лекарственные препараты.
Так в онкологической практике широко изучается применение следующих цитокинов и гематопоэтических факторов: интерлейкина 2 (IL-2) [3], [4], фактора некроза опухолей (TNF-α ) [5], эритропоэтина, макрофагально-гранулоцитарного и гранулоцитарного колоние-стимулирующих факторов, (GM-CSF и G-CSF), соответственно [6] , [7]. Не менее интенсивно изучается использование цитокинов и гемопоэтических факторов для лечения инфекционных заболеваний: интерфероны (IFN -γ и IFN -α ) [8], [9], [10], колоние-стимулирующие факторы [II], [12] и другие [13]. Колоние-стимулирующие факторы и эритропоэтин активно применяются в гематологии [14], [15].
Следует отметить, что лечебное применение этих веществ, вводимых экзогенно, имеет ограничения, связанные с отсутствием приемлемых лекарственных форм или их высокой стоимостью, коротким сроком полу-жизни веществ данного класса в биологических средах, трудностями в выборе доз, а также разнообразными токсическими и аллергическими эффектами [16], [17], поскольку рекомбинантные продукты достаточно иммуногенны для человеческого организма
Известно, что уже оценивается ряд соединений, модулирующих эндогенную продукцию цитокинов и гемопоэтических факторов в экспериментальных и клинических условиях. Широко известно о применении, в том числе успешном, микробных продуктов для лечения рака, что связано со стимуляцией эндогенной продукции фактора некроза опухолей [18]. Продукты, способные вызывать одновременную продукцию различных цитокинов и гемопоэтических факторов, получили название мульти-цитокиновых индукторов (multi-cytokine inducer). К средствам подобного действия относят препарат убитых стрептококков, нокардий (Nocardia opaca) и другие бактериальные продукты [19], [20], [21]. Однако, практически все вещества, обладающие подобной способностью, это или убитые микроорганизмы, или микробные продукты, или соединения с неустановленной или переменной структурой, что существенно ограничивает возможности их медицинского применения в лечебных целях, а в ряде случаев делает такое применение невозможным.
Окисленный глутатион (также известный как глутатион дисульфид, GSSG) далее в данной заявке будет обозначаться как GSSG.
GSSG известен как димер трипептида глутатиона (γ-глутамил-цистеинил-глицина), в котором две молекулы трипептида с вышеозначенной структурой соединены друг с другом ковалентной дисульфидной связью между цистеиновыми остатками. Таким образом, как трипептид глутатион (глутатион, глутатион восстановленный, GSH; далее - GSH), так и его димер - GSSG - являются природными метаболитами и присутствуют в клетках и биологических жидкостях животных, организмов.
Известны свойства GSH, как одного из важнейших участников метаболизма аминокислот и фактора обеспечения внутриклеточного гомеостаза [22], [23]. Большое значение имеют восстановительные свойства GSH и его функция донора восстановительных эквивалентов, которую молекула GSH способна выполнять благодаря наличию сульфгидрильной группы цистеинового остатка. Этим качеством GSH определяется и его роль как принципиального элемента одной из важнейших внутриклеточных антиоксидантных систем, включающей собственно GSH и два основных фермента его метаболизма: глутатион пероксидазу и глутатион редуктазу [24] , [25] . Постоянное функционирование данной системы необходимо для инактивации или восстановления как эндогенно образующихся оксидантов, так и активных метаболитов веществ, попадающих в организм извне [26], [27].
Антиоксидантные свойства восстановленного глутатиона (GSH) являются именно тем, что делает эту молекулу особенно привлекательной с точки зрения поиска преимуществ ее медицинского использования и создания потенциальных лекарственных препаратов и методов лечения. При этом, GSH и другие фармацевтически приемлемые вещества, способные обеспечить поддержание повышенного содержания GSH в клетках и биологических средах, рассматриваются как многообещающие соединения для создания фармацевтических веществ при проведении антиоксидантной терапии, то есть, для поддержания низкого содержания прооксидантных факторов и перекисных продуктов.
Следует также отметить, что именно антиоксидантные свойства GSH используются при создании фармацевтических композиций для достижения терапевтических эффектов, описанных в подавляющем большинстве известных публикаций в том числе и патентов, предметом которых является глутатионовая (тиоловая) система.
Известно также участие GSH в обеспечении реакций детоксикации, протекающих с участием группы ферментов, объединяемых названием глутатион S-трансферазы [28]. Данные ферменты способны конъюгировать молекулу GSH с самыми разнообразными ксенобиотиками, формируя связь между ними и глутатионом через тиоловую группу цистеинового остатка трипептида. Последующая деградация конъюгата осуществляется ферментами γ- глутамильного цикла и может иметь значительные вариации, зависящие от природы ксенобиотика.
Известно изобретение [29], согласно которому окисленный глутатион (GSSG) применяют в качестве одного из компонентов композиции для лечения расстройств иммунитета у млекопитающих. Указанная композиция состоит из окисленного и неокисленного глутатиона и других фармацевтически активных компонентов, которые способны увеличивать уровень восстановленного глутатиона (GSH) в организме. Более того, присутствие окисленного глутатиона в указанной композиции не является существенным для достижения указанного эффекта, поскольку, как показано в [29], окисленный глутатион может быть заменен восстановленным глутатионом или любым иным активным соединением, способным увеличить уровень восстановленного глутатиона (GSH) в организме. Эту композицию используют в качестве пищевой добавки и дополнительного питания для медицинского использования у больных [29]. Следует отметить, что в известном изобретении [29] GSSG вводится через желудочно-кишечный тракт. Однако, будучи пептидной субстанцией, большая часть перорально вводимого GSSG расщепляется в желудочно-кишечном тракте, а оставшаяся часть восстанавливается в клетках кишечника и печени до GSH, который может частично поступать в кровоток только в виде восстановленного глутатиона. Таким образом, основной целью перорального применения GSSG согласно указанному изобретению является увеличение уровня восстановленного глутатиона (GSH) в крови и тканях.
Известно, что повышение эндогенного уровня GSH в лечебных целях предлагается для стимуляции иммунитета [30], при лечении интоксикаций, отравлений, сахарного диабета, сердечно-сосудистых, инфекционных, а также других заболеваний [31], [32], [33].
Известно также использование экзогенного GSH или его прямых (γ-глутамил-цистеин, n-ацетил-цистеин, n-ацетил-цистеинил-глицин) или непрямых (2-оксотиазолидин-4-карбоксилат) биохимических предшественников, или их солей и эфиров в качестве лекарственных средств или пищевых добавок при лечении различных заболеваний [34], [35], [36], [37], [38].
Также известно о полезности применения GSH как хемопротекторного агента, что при химиотерапии рака предотвращало нейротоксичность [39], а также о комбинации с противоопухолевыми препаратами для повышения эффективности их действия [40].
Таким образом, известный нам предшествующий уровень техники в данной области свидетельствует, что применение биологически-активных веществ тиолового ряда направлено на обеспечение уровня повышенного содержания восстановленного глутатиона (GSH), чем, по-нашему мнению, достигается цель антиоксидантного и некоторого цитопротекторного эффектов.
Известно изобретение [41], в котором окисленный глутатион (GSSG) в составе сложных композиций (цистин, N-метил-D-глюкозамин, бутил-гидроперекись) вводится парентерально с одновременным применением микроволнового электромагнитного излучения в диапазоне 432-436 МГц в целях повышения количества T-лимфоцитов у иммунодефицитных больных, в частности больных ВИЧ- инфекцией. Эффективное повышение количества T-лимфоцитов (являющееся в сравнении с настоящей заявкой единственным показателем, демонстрирующим заявляемый эффект указанного изобретения) достигается только при одновременном воздействии указанных композиций и электромагнитного излучения.
Как уже упоминалось, использование GSH и GSSG, а также цистеина предлагается в лечебных целях для стимуляции иммунитета [30]. В данной публикации на сугубо экспериментальном материале (in vitro, культура клеток - лимфоциты) рассматривается влияние экзогенных тиолов: цистеина, GSH, GSSG на активность транскриптационного фактора NFkB, который и является объектом исследования. В настоящем изобретении, заявлена ранее неизвестная группа биологических, фармацевтических и терапевтических свойств окисленного глутатиона и его производных, а именно: мультицитокинактивирующее действие GSSG, воспроизведение им эффектов цитокинов и индукция механизмов апоптоза в трансформированных клетках. В отличие от упомянутого исследования (30), в заявляемом изобретении продемонстрированы ранее неизвестные свойства окисленного глутатиона (GSSG) на основе данных in vitro, in vivo и результатов клинических испытаний на людях. Данный уровень обоснований принципиально необходим, так как результаты, полученные в опытах in vitro (30), могут не только существенно отличаться от таковых в опытах in vivo, но даже быть противоположными. Более того, следует также подчеркнуть четкое различие между активными агентами, вызывающими биологические эффекты и функциональные изменения в биологических системах в случае вышеупомянутой публикации [30] и в соответствии с настоящим изобретением. В первом случае [30], то начало, которое вызывает биологические эффекты в биологических тест-системах - это цистеин, с использованием GSSG только в качестве носителя молекулы цистеина. Согласно настоящему изобретению цельная молекула GSSG заявляется в качестве активного вещества, фармакологического и терапевтического агента, а также - как молекулярная база для разработки семейства фармацевтически приемлемых производных (новые химические формулы или композиции и комбинации), обладающие благоприятным биолого-медицинским действием.
В настоящее время, по данным общедоступных источников информации, неизвестно о применении GSSG, как самостоятельного фармацевтического средства в виде моновещества, а также фармацевтически приемлемых производных окисленного глутатиона GSSG, в качестве модулятора эндогенной продукции цитокинов и гемопоэтических факторов, а также средств для воспроизведения эффектов цитокинов, и/или индуктора механизмов апоптоза в трансформированных клетках.
Краткое описание изобретения
Согласно изобретению, заявляется применение окисленного глутатиона (GSSG), а также вещества лекарственные средства - с пролонгированным пребыванием GSSG в окисленной форме в биологических средах посредством получения его в форме лекарственных средств для достижения лечебных эффектов, на основе неизвестных ранее и выявленных нами биолого-фармацевтических свойств окисленного глутатиона: модулировать эндогенную продукцию цитокинов и гемопоэтических факторов; воспроизводить эффекты широкой группы цитокинов; осуществлять дифференцированное воздействие в отношении нормальных (регуляция метаболизма, пролиферация и дифференцировка) и трансформированных клеток (индукция апоптоза).
При этом, в зависимости от исходного биологического состояния пациента, в том числе от состояния его системы иммунитета: иммунодефицит, то есть гипореактивность; или иммуноаутоагрессия, то есть гиперреактивность; наличие опухоле- или вирусотрансформированных клеток, окисленный глутатион (GSSG), и/или его фармацевтически приемлемые производные, способны выступать, соответственно как модулятор эндогенной продукции цитокинов и/или как средство, воспроизводящее эффекты цитокинов; и/или как индуктор механизмов апоптоза.
Согласно настоящему изобретению заявляется группа фармацевтически приемлемых решений, которые будут эффективны для предотвращения восстановления GSSG до GSH и пролонгирования его существования в окисленной форме в биологических средах. Эти притязания настоящего изобретения подтверждаются биомедицинскими результатами, полученными в ходе широко масштабной и последовательной программы доклинических и клинических исследований.
В этой связи, с точки зрения достижения более стабильного и значимого лечебного эффекта, не сопровождающегося побочными явлениями, более предпочтительной является модуляция эндогенной продукции аутологичных цитокинов и гемопоэтических факторов непосредственно в организме пациента. Лечебный эффект, достигаемый при этом, естественен для организма и лишен всех недостатков, связанных с экзогенным введением цитокинов и гемопоэтических факторов.
В настоящем изобретении заявляется биолого-медицинская целесообразность безусловно отличающегося фармакологического - прооксидантного - воздействия, которое достигается посредством введения в организм стабилизированной формы окисленного глутатиона (GSSG) в качестве вещества, обладающего прооксидантным потенциалом и соответствующими благоприятными фармакологическими свойствами.
В основу заявляемого изобретения положена концептуальная модель создания фармацевтических композиций - лекарственных средств, содержащих в качестве действующего вещества производные окисленного глутатиона (GSSG) в виде: его солей: или композитных препаратов, включая комбинации GSSG с веществами, пролонгирующими или усиливающими действие окисленного глутатиона или производных GSSG в качестве новых композиций, то есть, новых формул (новых соединений), когда последние получают посредством создания ковалентной связи между GSSG и каким-то иным веществом.
Данные соединения и их лекарственные формы, полученные на основе фармацевтически приемлемых производных окисленного глутатиона (GSSG), заявляются как лекарственные средства, способные в терапевтических целях в зависимости от исходного биологического состояния субъекта, нуждающегося в этом, осуществлять регуляцию (модуляцию) эндогенной продукции цитокинов и гемопоэтических факторов, а также воспроизведение эффектов цитокинов, и/или дифференцированное воздействие в отношении нормальных (регуляция метаболизма, пролиферации и дифференцировки) и опухоле- и/или вирусо-трансформированных клеток (индукция апоптоза).
"Субъект, нуждающийся в этом" означает млекопитающее, например человека, домашних животных и скот, включая кошек, собак, крупный и мелкий рогатый скот, лошадей, имеющих одно или более проявление заболеваний, при которых стимуляция/модуляция эндогенной продукции цитокинов и гемопоэтических факторов, а также регуляция механизмов апоптоза целесообразна с позиций современных биомедицинских знаний.
Понятие "лекарственное средство", используемое в данной заявке, подразумевает использование любой лекарственной формы, содержащей различные фармацевтические производные GSSG, которые обладают терапевтическим эффектом при лечении онкологических, инфекционных, гематологических, иммунологических, нейродистрофических и других заболеваний.
Понятие "фармацевтически приемлемое производное в форме соли", используемое в данной заявке, подразумевает производное окисленного глутатиона (GSSG) в виде соли, при этом в данные формулы входят, например, катионы натрия или лития, соответственно - динатриевая или дилитиевая соль.
Понятие "фармацевтически приемлемая комбинация", используемое в данной заявке, подразумевает комбинацию (как сочетание в растворе) окисленного глутатиона (GSSG) с иными веществами, которые по отношению к окисленному глутатиону выполняют функции либо стабилизатора-пролонгатора, либо усилителя/модулятора эффектов окисленного глутатиона (GSSG). Например, фармацевтически приемлемая комбинация окисленного глутатиона с инозином, или фармацевтически приемлемая комбинация окисленного глутатиона с холином.
Понятие "фармацевтически приемлемая композиция" (дериват), используемое в данной заявке, подразумевает окисленный глутатион (GSSG), ковалентно связанный с фармацевтически приемлемым веществом из группы активных метаболитов или другим химическим соединением. Например, фармацевтически приемлемая композиция (дериват) - окисленный глутатион, ковалентно связанный с метионином, или окисленный глутатион, ковалентно связанный с цистеамином.
Под "онкологическими и инфекционными заболеваниями", "депрессией кроветворения и иммунитета различного происхождения" и "другими заболеваниями" понимаются любые онкологические или инфекционные заболевания, любые состояния, вызванные или сопровождающиеся угнетением красного или белого ростка кроветворения или депрессией количественных или функциональных показателей системы иммунитета, а также любые другие заболевания или патологические состояния, при которых модуляция эндогенной продукции цитокинов и гемопоэтических факторов, а также воспроизведение эффектов цитокинов, и/или дифференцированное воздействие в отношении нормальных (регуляция метаболизма, пролиферация и дифференцировка) и трансформированных клеток (индукция апоптоза) была бы целесообразна по соображениям, очевидным для специалиста в соответствующей области медицины.
В поисках приемлемого с точки зрения медицины и фармакологии индуктора эндогенной продукции цитокинов и гемопоэтических факторов, авторы заявляемого изобретения в ходе выполненных доклинических и клинико-экспериментальных исследований, обнаружили новые свойства известного ранее вещества - окисленного глутатиона (глутатион окисленный, глутатион дисульфид, далее - GSSG).
При парентеральном введении или действии на изолированные клетки GSSG способен модулировать эндогенную продукцию ряда цитокинов (TNF-α, IFN-γ и IFN-α, IL-1, IL-2, IL-6 и IL-10, эритропоэтина и GM-CSF) у млекопитающих (человека и животных) как в нормальных, так и в патологических условиях, а также индуцировать механизмы апоптоза в трансформированных клетках (тканях) в опытах in vitro и in vivo. Установленные авторами свойства GSSG определяют биолого-фармацевтические эффекты самого окисленного глутатиона (GSSG), а также получаемых на его основе фармацевтически приемлемых производных, в частности его солей, а значит, и лечебные эффекты лекарственных средств, в которых активным началом является GSSG и его соли.
Сущность заявляемого изобретения состоит в том, что в качестве действующего вещества (активной субстанции), обеспечивающей модуляцию эндогенной продукции цитокинов и гемопоэтических факторов, а также воспроизведение эффектов цитокинов, и/или индукцию апоптоза, у субъектов, нуждающихся в этом, предлагается использовать окисленный глутатион (GSSG) или его фармацевтически приемлемые производные, которые при парентеральном введении регулируют (модулируют) эндогенную продукцию ряда цитокинов и/или гемопоэтических факторов, чем достигается регуляция процессов метаболизма, пролиферации и дифференцировки нормальных клеток. При этом в опухоле- и/или вирусо-трансформированных клетках индуцируется механизм апоптоза.
Согласно заявляемому изобретению, авторы впервые показали и обосновали, что окисленный глутатион (GSSG) является мультицитокин-активирующим фактором, а также фактором воспроизведения эффектов цитокинов по отношению к нормальным иммунокомпетентным клеткам и индуктором механизмов апоптоза в трансформированных клетках.
Более того, авторы впервые обнаружили, что воздействие окисленного глутатиона (GSSG) на изолированные лимфоциты человека вызывает через 10 минут (пик наблюдается на 30 минуте) значимое возрастание уровня фосфорилирования по тирозину цитозольных белков лимфоцитов, что является интегративной характеристикой активности клеточных сигнал-передающих систем. Эти изменения вследствие действия GSSG (это также будет продемонстрировано в большей степени в примерах реализации изобретения благодаря действию композитных препаратов GSSG) вызывает экспрессию редокс-чувствительных генов, в первую очередь, иммунологически значимых генов, ответственных за синтез цитокинов и гемопоэтических факторов. Следовательно, применение GSSG или его производных в виде лекарственных средств в лечебных целях не только стимулирует эндогенную продукцию цитокинов и гемопоэтических факторов, но и обеспечивает воспроизведение биохимических и физиологических эффектов цитокинов, в частности, в случае потери чувствительности рецепторов, что наблюдается при онкологической и ретровирусной патологии.
Авторы также впервые показали, что фармацевтически приемлемые производные GSSG в форме его солей; или комбинации GSSG с пролонгаторами; или комбинации GSSG с усилителями/модуляторами в качестве лекарственных средств значительно эффективнее и целенаправленнее индуцируют продукцию цитокинов и гемопоэтических факторов как в нормальных, так и в патологических условиях, а также более эффективно индуцируют механизмы апоптоза в опухоле- или вирус-трансформированных клетках.
Таким образом, заявляется полученный на основе окисленного глутатиона (GSSG) новый класс лекарственных средств, лечебные эффекты которых обусловлены впервые установленными и неизвестными ранее свойствами окисленного глутатиона (GSSG) и его производных осуществлять регуляцию продукции цитокинов и гемопоэтических факторов и воспроизведение эффектов цитокинов и, следовательно, регулировать пролиферацию и дифференцировку нормальных клеток, а также селективно индуцировать механизмы апоптоза в трансформированных клетках.
В изобретении представлен метод стимуляции эндогенной продукции цитокинов и гемопоэтических факторов, а также индукции механизмов апоптоза в случае, когда стимуляция цитокинов и гемопоэтических факторов и/или индукция механизмов апоптоза, или и то, и другое, является целесообразным, что может быть достигнуто путем введения в организм млекопитающих, нуждающихся в этом, эффективного количества GSSG, его солей и других фармацевтически приемлемых производных окисленного глутатиона на достаточный период времени для достижения терапевтического эффекта.
Предпочтительно применение окисленного глутатиона и его производных парентерально или местно. Метод заключается во введении окисленного глутатиона (GSSG) или его солей совместно с веществом, которое способно продлевать период пребывания GSSG в окисленной форме в биологических средах; или с веществом, способным повышать эффект GSSG для усиления регуляторного воздействия на эндогенную продукцию цитокинов и гемопоэтических факторов; или индуцировать механизмы апоптоза в трансформированных тканях, что обеспечивает регуляцию метаболизма, пролиферации и дифференцировки в тканях и достижение соответствующего терапевтического эффекта.
В процессе экспериментальных исследований установлено, что наибольшая терапевтическая эффективность достигается, когда производные GSSG выбраны из группы соединений, представляющих собой химически измененные молекулы GSSG посредством получения его солей, а также посредством ковалентного связывания GSSG с иными химическими соединениями, в том числе активными метаболитами. В свою очередь, биолого-фармацевтические, а, следовательно, и терапевтические эффекты солей окисленного глутатиона существенным образом возрастают в случае получения комбинации солей окисленного глутатиона, в частности, Na-GSSG, с веществами, стабилизирующими молекулу окисленного глутатиона и замедляющими его восстановление в GSH в биологических средах, т.е., с пролонгаторами; или с веществами, усиливающими биолого-фармацевтические эффекты, а, следовательно, и терапевтические эффекты солей окисленного глутатиона, т.е., усилителями/модуляторами.
Особое предпочтение отдается производным GSSG в форме его натриевой, литиевой, калиевой, кальциевой, цинковой, молибденовой, ванадиевой и других, например, содержащей фтор или платину солей, а также производным окисленного глутатиона, полученным посредством ковалентного связывания GSSG с цистеамином (S-тиоэтиламин-глутатион дисульфид), или с липоевой кислотой (бис-[6,8-дитиооктанил] •глутатион дисульфид), или с карнозином ([b-аланил-гистидил]•глутатион дисульфид), или с аденозином ([9- β- D-рибофуранозиладенил] •глутатион дисульфид), или с метионином (бис- α- амино- γ- метилтиобутаноил] •глутатион дисульфид), и некоторыми другими аминокислотами, включая D- и L-формы аминокислот, упомянутых в этом документе.
Проведенными исследованиями убедительно доказано, что эффективные "пролонгаторы" относятся к группе веществ, представленных фармацевтически приемлемыми прооксидантыми соединениями, то есть окислителями, например, аскорбиновая кислота; или к группе веществ, способных формировать слабые ионные и координационные (водородные) связи, которые способствуют стабилизации молекулы GSSG (диметилсульфоксид, соли платины); или веществ, которые обладают конкурентными свойствами в отношении NADP-Н-зависимого восстановления GSSG в GSH, катализируемого глутатионредуктазой; или веществ, способных осуществлять обратимое ингибирование восстановления NADP+ в NADP-H, катализируемого глюкозо-6-фосфат- дегидрогеназой или другими NADP-Н-зависимыми ферментами.
Из "пролонгаторов" особенно предпочтительными являются инозин, аскорбиновая кислота, диметилсульфоксид, цистамин, соединения платины.
Следует подчеркнуть, что максимальная стабилизация молекулы экзогенного GSSG именно в окисленной форме, в том числе при введении в биологические среды, достигается в том случае, когда используется комбинация (смесь) молекул окисленного глутатиона, состоящая на 50% из GSSG, в котором все аминокислоты представлены в L-форме, и на 50% из GSSG, в котором две химически однозначные аминокислоты представлены в D-форме, а остальные - в L-форме.
Предпочтительно, чтобы "усилитель/модулятор" был выбран из группы веществ, являющихся донорами метильных групп (например, холин-хлорид {[2- гидроксиэтил] триметиламмониум хлорид}, или S-аденозил-метионин); и/или веществ, которые способны образовывать окислительно-восстановительные пары (липоевая/дегидролипоевая, фолиевая/дегидрофолиевая, аскорбиновая/дегидроаскорбиновая кислоты). "Усилитель" или "модулятор", или "усилитель/модулятор" в данном случае должен быть представлен веществом, которое увеличивает или целесообразно изменяет с точки зрения лечебных результатов терапевтический эффект GSSG или его производных, но посредством механизмов, отличающихся от механизмов действия пролонгаторов, которые увеличивают время пребывания GSSG в окисленной форме, то есть замедляют его восстановление в биологических средах в GSH.
В частности, наиболее предпочтительными "усилителями" или "модуляторами" являются холин-хлорид, S-аденозил-метионин, липоевая (6,8-тиооктановая) и фолиевая (птероилглутаминовая) кислоты.
Согласно предлагаемому изобретению, лекарственное средство для лечения онкологических, инфекционных, гематологических, иммунологических, ишемических, нейродегенеративных, метаболических, эндокринных и других заболеваний содержит в качестве фармацевтически активного компонента эффективное количество фармацевтически приемлемых производных окисленного глутатиона (GSSG) в форме его солей; или комбинаций с пролонгатором или усилителем/модулятором; или композиций, представляющих собой окисленный глутатион, ковалентно связанный с фармацевтически приемлемым веществом из группы активных метаболитов. Предпочтительно, чтобы фармацевтически приемлемые производные окисленного глутатиона для парентерального использования применяли в виде фармацевтически приемлемого раствора, например, водного раствора, включая воду, раствора глюкозы, изотонические растворы хлорида натрия, забуференные солевые растворы.
Обнаруженная в процессе исследований индуцированная посредством GSSG модуляция эндогенной продукции цитокинов и гемопоэтических факторов, а также индукция механизмов апоптоза в трансформированных клетках и связанная с этими эффектами регуляция метаболизма, пролиферации и дифференцировки клеток в организме, приводит к противоопухолевому, противоинфекционному, гемопоэтическому, иммуномодулирующему и другим фармакологическим эффектам, которые, в свою очередь, обеспечивают достижение в той или иной степени лечебного или профилактического эффекта при различных заболеваниях.
Является предпочтительным, чтобы фармацевтически приемлемые производные GSSG вводили в организм в дозе от 0.01 до 0.5 мг GSSG на кг массы тела в пересчете на основание или соль GSSG; или в дозе от 1 до 30 мг на 1 м2 поверхности тела, а в случаях накожного применения/введения посредством инстилляций в дозе от 1 мг до 30 мг на 1 м2 поверхности тела по крайней мере однократно в каждый период времени, состоящий из 24 часов. Также данное вещество может быть введено путем последовательных инъекций или другим способом получено организмом с целью достижения общей дозировки от 0.01 до 0.5 мг на кг массы тела - в случае введения солей GSSG, и от 1.0 до 3.0 мг на 1 кг поверхности тела в течение каждых 24 часов. Желательно, чтобы применение и введение данного вещества в организм проводили до тех пор, пока не будет получен желаемый эффект регуляции продукции цитокинов и гемопоэтических факторов и/или индукции апоптоза, и, тем самым, регуляции метаболизма, пролиферации и дифференцировки клеток, что определяет достижение соответствующего терапевтического эффекта.
Краткое описание чертежей.
Вышеупомянутые преимущества настоящего изобретения более наглядно дополняет графически представленный материал.
На фиг. 1а, 1б, 1в и 1г представлены данные цитофлуорометрического анализа клеток HL-60, цитофлуорометрического анализа клеток HL-60 в присутствии представленного в данном изобретении фармакологического средства цитофлуорометрического анализа лимфоцитов человека и цитофлуорометрического анализа лимфоцитов в присутствии представленного в данном изобретении фармакологического средства соответственно. Описание дано в обсуждении примера 4, который имеет отношение к исследованию апоптоз-индуцирующей активности препарата на культуре клеток млекопитающих.
На фиг. 2 представлено схематическое изображение молекулы GSSG с указанием участков для химической модификации молекулы данного соединения для получения фармацевтически приемлемых производных GSSG.
В структурной формуле на фиг. 2, точки X1, X2, X3, X4, X5 и X6 являются участками, в которых возможно проведение химической модификации молекулы GSSG. Динатриевые и дилитиевые соли, где X1, X4 - это катионы натрия, либо катионы лития, либо катионы цинка, являются наиболее предпочтительными для обеспечения высокой проницаемости в клетки и максимального сродства лекарства к тем или иным тканям. В каждой из точек X1, X2, X3 и X4 может быть водород, если не используются другие заместители. Могут быть использованы другие соли GSSG, в том случае, когда они фармацевтически приемлемы, т.е. не обладают неблагоприятным воздействием на организм, например, во всех (в одной или более) точках X1, X2, X3 и X4 могут быть калий, кальций, цинк, молибден, ванадий, фтор, платина или любые другие фармацевтически приемлемые заместители. В данном изобретении использование водорастворимых солей является наиболее предпочтительным.
На фиг. 3, 4, 5, 6 и 7 приведены формулы новых веществ, полученных как дериваты GSSG, где GSSG ковалентно связан с цистеамином (S-тиоэтиламин-глутатион дисульфид, фиг. 3); или с липоевой кислотой (бис-[6,8-дитиооктанил] •глутатион дисульфид, фиг. 4); или с карнозином ([b-аланил-гистидил] •глутатион дисульфид, фиг. 5); или с аденозином ([9- β- D-рибофуранозиладенил] •глутатион дисульфид, фиг. 6); или с метионином (бис-[2-амино-4-[метилтио]бутаноил]•глутатион дисульфид, фиг. 7).
В структурной формуле на фиг. 3 точка X1 (или, возможно, X1 и X2) указаны как участки ковалентного связывания с молекулой(ами) цистеамина (2-меркаптоэтиламин). В структурной формуле на фиг. 4 точки X5 и X6 отмечены как участки ковалентного связывания с молекулами липоевой кислоты (6,8-дитиооктановая кислота). В структурной формуле на фиг. 5 точка X3 отмечена как участок ковалентного связывания с молекулой карнозина (b-аланил-гистидин). В структурной формуле на фиг. 6 точка X2 указана в качестве участка ковалентного связывания с молекулой аденозина (9- β- D-рибофуранозиладенин). В структурной формуле на фиг. 7 точки X5 и X6 отмечены как места ковалентного связывания с молекулами метионина (2-амино-4- [метилтио]бутановая кислота).
Описание предпочтительного воплощения идей изобретения.
Согласно настоящему изобретению предлагается базовое лекарственное средство и группа лекарственных средств, получаемых на основе GSSG, для лечения инфекционных, онкологических, гематологических, нейродегенеративных, ишемических и других заболеваний, а также заболеваний вследствие иммунных, метаболических и эндокринных нарушений, при которых регуляция эндогенной продукции цитокинов и гемопоэтических факторов и/или индукция механизмов апоптоза является целесообразной. Указанные лекарственные средства в качестве активного начала содержат эффективное количество GSSG или его фармацевтически приемлемых производных. Целесообразно применять лекарственную форму препарата в виде инъекционного раствора, содержащего от 0.01% до 4.0% основания GSSG или его солей; и от 1.0% до 10% основания GSSG или его солей в случае применения препаратов GSSG в форме растворов для ингаляций, локальных инстилляций, глазных капель, интраназального введения или мазей для накожных аппликаций.
Согласно настоящему изобретению, целесообразно использовать GSSG и его соли совместно с такими компонентами, которые либо замедляют восстановление GSSG, то есть, продлевают пребывание окисленного глутатиона в тканях и биологических средах ("пролонгаторы)", либо увеличивают, или благоприятно модулируют выявленные биологические и терапевтические свойства GSSG ("усилители/модуляторы").
Согласно настоящему изобретению, для пролонгирования пребывания в окисленной форме, а также для целесообразной модуляции и/или усиления терапевтического эффекта GSSG, рекомендуется, чтобы лекарственная форма GSSG содержала GSSG и/или его соли, как указывалось выше, совместно с фармацевтически приемлемым компонентом ("пролонгатором" или "усилителем/модулятором"), который способен увеличивать время пребывания GSSG в окисленной форме или усиливать/модулировать биологический и терапевтический эффекты композитных составов GSSG.
В изобретении заявляется также (в отличие от фармацевтически приемлемых комбинаций с пролонгаторами и усилителями/модуляторами) целесообразность получения на основе GSSG или его солей фармацевтически приемлемых композиций, то есть, новых формул химических соединений (см. фиг. 3-7), в которых окисленный глутатион (GSSG) ковалентно связан с цистеамином (S-тиоэтиламин-глутатион дисульфид, см. структурную формулу на фиг.3), или с липоевой кислотой (бис-[6.8-дитиооктанил] •глутатион дисульфид, см. фиг. 4), или с карнозином ([b-аланил-гистидил]•глутатион дисульфид, см. фиг. 5), или с аденозином ([9- β- D-рибофуранозиладенил]•глутатион дисульфид, см. фиг. 6), или с метионином (бис[2-амино-4-[метилтио] бутаноил] •глутатион дисульфид, см. фиг. 7).
Фармацевтически приемлемые производные GSSG целесообразно использовать как лекарственные средства в виде 0.01%-4.0% инъекционного раствора со шкалой доз от 0.01 до 0.5 мг основания GSSG или его солей на кг веса тела; или в дозах от 1 до 30 мг на 1 м2 поверхности тела, один или более раз в день, однократно или последовательно до получения желаемого терапевтического эффекта. В качестве фармацевтически приемлемого компонента для продления времени существования глутатиона в окисленной форме в заявке могут быть рекомендованы: 0.003% перекись водорода или 5.0% аскорбиновая кислота. Это объясняется тем, что в присутствии перекиси водорода или аскорбиновой кислоты, которые являются донорами промежуточных активных форм кислорода (т.е., прооксидантами), GSSG восстанавливается глутатион редуктазой до GSH с меньшей скоростью, таким образом, обуславливая более медленное восстановление экзогенно введенного в биологическую среду GSSG.
Перекись водорода может быть рекомендована для использования в диапазоне от 0.03 до 0.0003% в растворах (от 1.0 до 5.0 мл раствора, независимо от того, содержит ли данный раствор GSSG или фармацевтически приемлемые соли GSSG). Предпочтительно, чтобы аскорбиновую кислоту использовали в количествах от 0.1 до 10% по весу в используемых растворах, независимо от того, содержит ли данный раствор GSSG, или фармацевтически приемлемые соли GSSG, или его фармацевтически приемлемые комбинации, и/или его производные/соли производных.
Использование фармацевтически приемлемых концентраций перекиси водорода (H2O2) или аскорбиновой кислоты в составе лекарственной формы для парентерального применения, также как и использование любых других прооксидантных компонентов (доноров активных форм кислорода), дает возможность воспользоваться только одним из доступных методов продления существования окисленного глутатиона или его производных в окисленной форме в биологических жидкостях и тканях и, таким образом, увеличить и продлить фармацевтический эффект GSSG и/или его производных.
В процессе исследований нами установлено, что некоторые другие фармацевтически приемлемые компоненты или "пролонгаторы" способствуют замедлению процесса восстановления экзогенного GSSG и его солей в GSH в биологических средах. Таковыми, в частности, являются: вещества, способные формировать слабые ионные и/или координационные связи, которые стабилизируют молекулу GSSG, например, диметил сульфоксид или соединения платины. Рекомендуется использовать соединения платины для стабилизации GSSG или его солей в окисленной форме в диапазоне концентраций от 0.3% до 0.0003% (вес/объем). Наиболее предпочтительно использовать диметилсульфоксид в качестве 3.0% (объем/объем) раствора, и рекомендуется его использовать в виде раствора от 1.0% до 30% по объему (растворы от 1.0 до 30.0 мл или более при использовании накожно/для локальных инстилляций).
Поскольку восстановленный NADP-H является ключевым кофактором глутатионредуктазной системы, катализирующей восстановление GSSG до GSH, то любые фармацевтически приемлемые компоненты, которые задерживают процесс восстановления GSSG или блокируют биологическое восстановление NADP-H глутатион редуктазой, обеспечат сохранение GSSG или солей GSSG от восстановления в биологических средах и, тем самым, будут усиливать и продлевать лечебные эффекты GSSG или солей GSSG.
Благодаря проведенным исследованиям мы впервые показали, что фармацевтические эффекты GSSG усиливаются, если GSSG используется в комбинации с веществами, обладающими конкурентными свойствами по отношению к NADP-H, а также с компонентами, обратимо ингибирующими ферментативные реакции, катализируемые глюкозо-6-фосфат- дегидрогеназой, которая опосредует восстановление окисленной формы NADP+.
В результате проведенных исследований нами впервые обнаружено, что биологический и фармацевтический эффекты GSSG и его солей усиливается при использовании в комбинации с веществами, вступающими в конкурентные отношения с NADP-H, а также с веществами, обратимо ингибирующими ферментативные реакции, катализируемые глюкозо-6-фосфат-дегидрогеназой, в результате которой происходит восстановление окисленной формы NADP+.
Помимо аскорбиновой кислоты, диметилсульфоксида, соединений платины, одним из других фармацевтически приемлемых компонентов, способных продлить пребывание окисленного глутатиона в окисленной форме в биологических средах, может быть гипоксантинрибозид (инозин, или 9- β- рибофуранозилгипоксантин), который предлагается использовать в качестве 0.1% раствора. Выполненные исследования показали, что гипоксантинрибозид оказывает потенцирующее действие в отношении фармацевтических, биологических и терапевтических эффектов GSSG. Было показано, что данное свойство гипоксантинрибозида основано на его способности вступать в конкурентные отношения с NADP-H, и, таким образом, получить замедление реакции восстановления GSSG в GSH. Более того, также нами было установлено, что данным свойством обладают и другие производные гипоксантина (в том числе нуклеозидные производные инозина).
Также помимо упомянутых выше окислителей и гипоксантинрибозида, другим фармацевтически приемлемым компонентом, предлагаемым к использованию и способным продлить пребывание глутатиона в окисленной форме, является цистамин (2,2-диаминодиэтилдисульфид). Выполненные исследования показали, что цистамин оказывает потенцирующее действие в отношении фармацевтических, биологических и лечебных эффектов GSSG. Было показано, что данное действие цистамина проявляется вследствие его способности осуществлять обратимое ингибирование пускового фермента пентозо-фосфатного цикла - глюкозо-6-фосфат- дегидрогеназы, катализирующего реакцию восстановления NADP+ в NADP-H.
В заявляемом изобретении также предлагается способ потенцирования способности окисленного глутатиона (GSSG) стимулировать эндогенную продукцию цитокинов и гемопоэтических факторов, заключающийся в том, что GSSG и его соли используют в составе фармацевтических комбинаций, содержащих компонент, способный продлить пребывание глутатиона в окисленной форме. Это достигается путем использования фармацевтически приемлемых комбинаций, содержащих лекарственные формы солей GSSG и лекарственные формы веществ, способных продлить пребывание окисленного глутатиона в биологических средах в окисленной форме, например: 0.003% раствор перекиси водорода или другие прооксидантно активные соединения; 0.1% раствор гипоксантинрибозида или другие производные гипоксантина, в том числе нуклеозидные производные инозина; а также 0.1% раствор цистамина (или другие соединения, способные осуществлять обратимое ингибирование пускового фермента пентозо-фосфатного цикла - глюкозо-6-фосфат-дегидрогеназы).
Установлено, что парентеральное (внутривенное, внутрибрюшинное, подкожное, внутримышечное и т.д.) применение GSSG в 1-5 мл 0.003% раствора перекиси водорода, GSSG в 1-5 мл 0.1% раствора гипоксантинрибозида, а также GSSG в 1-5 мл 0.1% раствора цистамина, стимулирует эндогенную продукцию TNF -α, IFN -α и IFN -γ, IFN -β, IL-1, IL-2, IL-6 и IL-10, эритропоэтина и GM-CSF у млекопитающих в большей степени, чем это наблюдается в случае применения только GSSG.
Проведенные исследования подтверждают способность вышеупомянутых соединений (прооксиданты, гипоксантинрибозида и цистамина) усиливать биологические и терапевтические эффекты GSSG и его солей, что свидетельствуют о целесообразности их сочетанного применения в целях повышения эффективности лечения онкологических, инфекционных, ишемических, гематологических и других заболеваний, при которых регуляция эндогенной продукции цитокинов и гемопоэтических факторов целесообразна по соображениям, очевидным для специалиста в соответствующей области медицины.
Таким образом, согласно заявляемому изобретению с целью усиления и продления терапевтического эффекта GSSG целесообразно, чтобы лекарственная форма данного соединения (1-5 мл инъекционного раствора) содержала дополнительные фармацевтически приемлемые компоненты-пролонгаторы, способные продлить пребывание экзогенного GSSG, введенного в биологические среды организма, в окисленной форме, например:
а) перекись водорода в концентрации 0.003% или любые другие фармацевтически приемлемые прооксидантно активные соединения, являющиеся донорами активных форм кислорода;
б) гипоксантинрибозид (инозин, 9-β- D-рибофуранозилгипоксантин) в диапазоне концентраций от 0.1% до 1.0% или любые другие фармацевтически приемлемые метаболические конкуренты NADP-H, способные тормозить восстановление GSSG в GSH, катализируемое глутатион редуктазой;
в) цистамин (β,β-диаминодиэтилсульфид) в диапазоне концентраций от 0.1% до 0.5% или любые другие фармацевтически приемлемые компоненты, способные вызывать обратимое ингибирование восстановления NADP+ в NADP-H, катализируемое глюкозо-6-фосфат-дегидрогеназой;
г) диметилсульфоксид (DMSO) в диапазоне концентраций от 0.1% до 30% или соединения платины, способные стабилизировать молекулу GSSG в окисленной форме за счет образования ионных и координационных связей в диапазоне концентраций от 0.3% до 0.0003% (вес/объем);
д) максимальная стабилизация экзогенного GSSG в окисленной форме, в том числе при введении в биологические среды достигается в случае использования комбинации (смеси) молекул окисленного глутатиона, состоящей на 50% из молекул GSSG, в которой все аминокислоты представлены в L-форме, и на 50% из молекул GSSG, в которой две химически однозначные аминокислоты представлены в D-форме, а остальные - L-форме.
Наряду с использованием "пролонгаторов", впервые обосновано применение фармацевтически приемлемых соединений, способных усиливать или благоприятно модулировать биологический и терапевтический эффект GSSG и производных GSSG. Было найдено несколько групп химических веществ, обладающих способностью усиливать или благоприятно модулировать эффекты GSSG и его солей.
Например, доноры метильных групп, такие, как холин-хлорид и S-аденозил-метионин, используемые в комбинации с GSSG или солями GSSG, более эффективны по сравнению с введением только GSSG или его солей, в случае лечения вышеуказанными комбинациями больных с иммуно- или инфекционной патологией.
В свою очередь, было показано, что соединения, которые способны образовывать внутриклеточные окислительно-восстановительные пары (липоевая, фолиевая и аскорбиновая кислоты), также усиливают эффекты GSSG или его фармацевтически приемлемого производного, в частности, его солей, при гематологических или эндокринных заболеваниях, например, при сахарном диабете. Наиболее эффективно использовать липоевую кислоту у больных в форме 0.5% раствора, но также возможно и ее использование в качестве раствора от 0.1% до 1.0% по весу (от 1.0 до 5.0 мл раствора). Рекомендуется у гематологических больных использовать фолиевую кислоту в виде 0.5% раствора, а также возможно ее использование как раствора от 0.1% до 1.0% по весу (от 1.0 до 5.0 мл раствора).
Следовательно, термин "усилитель/модулятор", использованный в данной заявке, может соответствовать холин-хлориду, который предпочтительно использовать в виде 10% раствора; S-аденозил-метионину, используемого преимущественно в виде 5.0% раствора, или другим фармацевтически приемлемым донорам метильных групп; липоевой кислоте, предпочтительно используемой в виде 0.5% раствора; фолиевой кислоте, предпочтительно в виде 0.5% раствора.
В такой же степени термин "фармацевтически приемлемые композиции" (дериваты), использованный в данной заявке, обозначает группу препаратов GSSG, полученных в виде новых формул химических соединений (фиг. 3-7): S-тиоэтиламин-глутатион дисульфид, или (бис-[6.8-дитиооктанил]•глутатион дисульфид, или [b-аланил- гистидил]•глутатион дисульфид, или ([9- β- D- рибофуранозиладенил]•глутатион дисульфид, или (бис[ α- амино- γ- [метилтио]бутаноил] •глутатион дисульфид. В вышеперечисленных препаратах одна или более L-аминокислот, входящих в состав молекулы GSSG, замещена ее D-формой. Согласно представленным ниже примерам реализации изобретения, указанные лекарственные препараты применяются в диапазоне доз от 0.01 до 0.5 мг на кг массы или от 1 до 30 мг на 1 м2 поверхности тела.
Из данных проведенных исследований (см. примеры реализации изобретения) следует, что неизвестная ранее способность GSSG регулировать эндогенную продукцию цитокинов и гемопоэтических факторов и оказывать терапевтический эффект при различных заболеваниях не связана с повышением уровня GSH, поскольку тестирование GSH в широком диапазоне доз и концентраций не выявило стимуляции и/или благоприятной модуляции эндогенной продукции цитокинов и гемопоэтических факторов. В равной мере, неизвестное ранее свойство окисленного глутатиона и его солей, и, в еще большей степени, солей окисленного глутатиона в 0.1% растворе гипоксантинрибозида индуцировать механизмы апоптоза в трансформированных клетках определяет, что терапевтические эффекты лекарственной формы окисленного глутатиона и его фармацевтически приемлемых комбинаций при онкопатологии также не связаны с повышением уровня восстановленного глутатиона (GSH), поскольку использование GSH в широком диапазоне доз и концентраций, в том числе и в 0.1% растворе гипоксантинрибозида не позволяет получить индукцию апоптоза в трансформированных клетках.
Таким образом, терапевтические эффекты препаратов, полученных на базе GSSG и его производных, основываются на их мультицитокинактивирущем действии и способности воспроизводить эффекты цитокинов и гемопоэтических факторов. Более того, действие GSSG и его производных проявляется дифференцированным эффектом относительно нормальных и опухолевых клеток. Исследование с применением нормальных и опухолевых клеток показало, что GSSG, его соли, в большей степени в случае применения GSSG в составе фармацевтически приемлемых комбинаций, обеспечивающих продление пребывания окисленного глутатиона в окисленной форме, инициирует гибель опухолевых клеток по апоптотическому механизму. При этом, в случае нормальных клеток их гибели не наблюдалось (фиг. 1).
Следует отметить, что дифференцированные эффекты лекарственных средств на основе GSSG и особенно его композиции с инозином, или цистеамином, или фолиевой кислотой, или композит GSSG с литием или с платиной вызывают максимальную индукцию механизмов апоптоза в трансформированных клетках при отсутствии подобного действия в нормальных клетках (см. примеры реализации изобретения).
Следует также отметить высокую эффективность заявляемых лекарственных средств на основе GSSG относительно индукции механизмов апоптоза в вирусо-трансформированных клетках, например, в случае вирусных гепатитов B и C, что подтверждают приведенные ниже клинические примеры.
Терапевтический эффект GSSG и его фармацевтически приемлемых производных, в частности солей, при лечении онкологических, инфекционных (вирусных) заболеваний, может быть объяснен как регуляцией продукции эндогенных цитокинов, так и уникальной способностью активировать апоптотическую гибель исключительно трансформированных клеток. Более того, согласно изобретению большинство из терапевтических эффектов GSSG и его фармацевтически приемлемых производных, как в экспериментальных, так и в клинических условиях, связано с выявленными нами свойствами GSSG и его лекарственных форм стимулировать/модулировать эндогенную продукцию цитокинов или воспроизводить их эффекты в отношении того, что касается стимуляции пролиферации и дифференцировки нормальных клеток и, в то же время, активировать апоптотическую гибель исключительно трансформированных клеток.
Резюмируя результаты выполненных, доклинических и клинических исследований группы лекарственных средств, созданных на основе GSSG, следует подчеркнуть, что парентеральное (внутривенное, внутримышечное, подкожное; инстилляции в мочевой пузырь или per rectum) введение указанных лекарственных средств обеспечивает стимуляцию/модуляцию эндогенной продукции TNF -α, IFN -α и IFN -γ, IL-1, IL-2, IL-6 и IL-10, эритропоэтина и GM-CSF; воспроизведение эффектов названных цитокинов и гемопоэтических факторов в случае десенситизации рецепторов к цитокинам; а также индукцию механизмов апоптоза исключительно в опухоле- или вирусо- трансформированных клетках, вызывая в организме субъекта, нуждающемся в этом, соответствующий терапевтический эффект, более выраженный, чем при применении только GSSG.
Применение данных фармацевтически приемлемых производных GSSG в виде его солей (см. фиг.2) или композиций (см. фиг. 3-7) означает получение лекарственных средств, обладающих преимущественным терапевтическим эффектом либо в отношении опухолевых заболеваний, либо вирусных инфекций, либо гематологических заболеваний, либо иммуноаутоагрессий; либо ишемических или эндокринных поражений; а также обладающих преимущественной тропностью (сродством) к тем или иным органам и тканям.
Приведенные ниже примеры реализации изобретения демонстрируют возможность его практической применимости и подтверждают его эффективность, а также целесообразность применения данных лекарственных средств в виде инъекционных растворов, содержащих от 0.01% до 4% основания GSSG или его солей с использованием шкалы доз от 0.01 до 0.5 мг на кг массы тела; или от 1 до 30 мг на 1 м2 поверхности тела. В случае применения препаратов GSSG в форме растворов для ингаляций, локальных инстилляций, глазных капель, интраназального введения или мазей для накожных аппликаций, или свечей, рекомендуемые концентрации находятся в диапазоне от 1% до 10% основания GSSG или его солей.
Активное вещество, пептид GSSG, обладающий способностью стимулировать эндогенную продукцию цитокинов и гемопоэтических факторов, а также индуцировать апоптоз трансформированных клеток, может быть получен известным и общепринятым методом пептидного синтеза [39]. Полученный таким образом пептид GSSG с целью его дальнейшего применения в условиях (in vivo) у людей и животных, используется в виде фармацевтически приемлемых производных GSSG в инъекционной лекарственной форме, получаемой путем растворения сухого вещества в стерильной воде для инъекций или любом фармацевтически приемлемом растворителе с конечной концентрацией 0.01-4.0%. Для исследований в условиях in vitro GSSG или его производные могут растворяться в приемлемых для проведения соответствующих экспериментов жидкостях, таких, как культуральные среды, изотонические солевые растворы, растворы глюкозы и т.д.
Предпочтительно, чтобы была использована водная основа или растворитель, в то же время, могут быть использованы другие физиологически приемлемые основы или растворители. Для местного применения, включая применение в различные полости тела, могут быть использованы органические растворители или основы в виде мазей, паст, кремов или свечей.
Приготовление лекарственной формы для применения у людей и животных должно выполняться с соблюдением условий стерильности и апирогенности и должно исключать возможность химического или бактериального загрязнения лекарственной формы.
Инъекционные лекарственные формы GSSG, его солей и композиций были исследованы в экспериментах на животных, а также в ходе широких клинических испытаний и пилотных исследований на больных людях.
Таким образом, заявляется и обосновывается метод получения на основе окисленного глутатиона (GSSG) нового класса лекарственных веществ, лечебные эффекты которых определяются впервые установленными и ранее неизвестными свойствами окисленного глутатиона (GSSG) и его производных осуществлять стимуляцию эндогенной продукции цитокинов и гемопоэтических факторов и воспроизведение их эффектов, следовательно, осуществлять стимуляцию и/или модуляцию пролиферации и дифференцировки нормальных клеток, а также целенаправленно индуцировать механизмы апоптоза в вирус- и опухоле-трансформированных клетках.
Благодаря использованию максимально достижимой концентрации инъекционного раствора натриевой соли GSSG (10.0%, 100 мг/мл) в воде для инъекций (или в физиологическом растворе, или в 0.003% растворе перекиси водорода, или в 0.1% растворе инозина или цистамина), а также благодаря использованию максимально переносимых объемов жидкости, инъецируемых мышам при внутрибрюшинном (в/б, 2.0 мл), внутривенном (в/в, 0.5 мл) и внутримышечном (в/м, 0.05 мл) введении, были достигнуты дозы GSSG, составляющие 5000 мг/кг (в/б), 1350 мг/кг (в/в) и 135 мг/кг (в/м), что превышает максимальную дозу, рекомендуемую для человека и составляющую 0.5 мг/кг, в 1000, 270 и 27 раз соответственно. Ни в одном из случаев не отмечалось гибели животных, а также каких-либо токсических проявлений, что фактически свидетельствует о нетоксичности GSSG, используемого в лекарственной форме раствора для инъекций, а также о нетоксичности применявшихся фармацевтических композиций, содержащих GSSG.
Пример 1.
Влияние GSSG и его лекарственных форм на продукцию цитокинов мононуклеарными лейкоцитами периферической крови человека in vitro.
Оценивали действие окисленного глутатиона (GSSG), а также его лекарственных форм, содержащих 0.003% раствор перекиси водорода, 0,1% раствор инозина, 0,1% раствор цистамина на продукцию цитокинов мононуклеарными лейкоцитами периферической крови человека в условиях in vitro.
Продукцию цитокинов лейкоцитами инициировали добавлением митогена, конканавалина A (ConA), который добавлялся в клеточную культуру сразу же после внесения исследуемых веществ. Супернатанты культур собирали через 24 часа после начала сочетанного воздействия ConA и исследуемых веществ и хранили до момента определения цитокинов при -70oC.
Для оценки функционального состоянии клеток и их способности отвечать на митоген в присутствии каждой из оцениваемых концентраций исследуемых веществ, контрольные культуры клеток, содержащие исследуемые вещества в идентичных концентрациях, инкубировали в течение 72 часов после начала сочетанного воздействия ConA и исследуемых веществ. За 16 часов до окончания инкубации в контрольные культуры вносили 3H-тимидин и степень включения метки в ДНК расценивали как критерий функционального состояния клеточной тест системы.
Венозную кровь от здоровых доноров, мужчин, собирали в пластиковые гепаринизированные пробирки, тестированные на отсутствие эндотоксина (endotoxin tested). Мононуклеарную фракцию лейкоцитов крови получали центрифугированием в градиенте плотности фиколл-диатризоат натрия (Histopaque-1077, Sigma).
Концентрацию клеток доводили до 2•106 клеток на 1 мл "полной" культуральной среды (RPMI 1640, Sigma), содержащей 20 mM HEPES, 2 mM глутамина, 50 мкг/мл гентамицина и 10% фетальной телячьей сыворотки. Все использованные реагенты были "для культур тканей", Sigma. Жизнеспособность клеток оценивали по методу исключения с трипановым синим и 100 μл клеточной суспензии (200.000 клеток) разносили в лунки плоскодонных 96-луночных планшетов для культур тканей. Клетки от каждого донора разносили не менее чем в 39 лунок.
Оценивали влияние 5 конечных концентраций (5000 μг/мл; 500 μг/мл; 50 μг/мл; 5 μг/мл и 0.5 μг/мл) тестируемых веществ - окисленного глутатиона (GSSG), а также GSSG в сочетании: с перекисью водорода в концентрации 0.003%; с инозином в концентрации 0.1%; с цистамином в концентрации 0.1%. Каждую из концентраций создавали не менее чем в 6 лунках, внося 50 μл "полной" культуральной среды, содержащей необходимое количество предварительно растворенных исследуемых веществ. Еще 6 лунок использовались для контроля (добавлялось 50 μл только "полной" культуральной среды или полной среды, содержащей соответственно 0.003% раствор перекиси водорода, или раствор 0.1% инозина, или раствор 0.1% цистамина).
Непосредственно после внесения исследуемых веществ во все лунки (за исключением 3-х дополнительных, которые служили для оценки спонтанного захвата 3H-тимидина (без ConA)) вносили по 50 μл "полной" культуральной среды, содержащей такое количество ConA (Sigma, для культур тканей), чтобы его конечная концентрация составляла 4.0 μг/мл.
Через 24 часа инкубации планшетов при 37oC в присутствии 5% CO2 содержимое половины лунок (по 3 лунки из каждых 6, содержащих одинаковую концентрацию исследуемых веществ) отсасывали, подвергали центрифугированию, супернатанты замораживали и хранили при -70oC до момента определения присутствия цитокинов. Содержимое всех оставшихся заполненными лунок (3-х оставшихся) продолжали инкубировать при вышеописанных условиях.
Через 56 часов от начала инкубации во все оставшиеся лунки добавляли по 1.0 μCi 3H-тимидина и продолжали инкубацию еще 16 часов, после чего содержимое лунок извлекалось и при помощи клеточного харвестера (cell harvester) наносили на стекловолокнистые фильтры, которые последовательно обрабатывали 5% трихлоруксусной кислотой и этанолом. Фильтры высушивали и их радиоактивность (импульсы в 1 мин, имп/мин) определяли с помощью жидкостного сцинтиляционного счетчика Betaplate 1205 (LKB).
Значения радиоактивности фильтров для каждого триплета лунок усредняли и рассчитывали индекс митогенной стимуляции: отношение усредненных значений имп/мин ConA-стимулированных культур к усредненным значениям имп/мин в культурах, в которые не добавлялся ConA (3 лунки без ConA). По индексу стимуляции в качестве критерия судили о функциональном состоянии клеток в лунках, где оцениваемые вещества присутствовали в различных концентрациях, и о способности клеток отвечать на митогенную стимуляцию.
Последующему анализу на содержание цитокинов подвергали клеточные супернатанты 24-часовых культур только из тех триплетов лунок, в контрольных триплетах которых при 72-часовой инкубации была выявлена митогенная реакция на ConA с индексом стимуляции в диапазоне от 15 до 50.
Концентрации интерлейкина-1b; интерлейкина-6 (IL-6); фактора некроза опухолей α (TNF -α ) и интерферона α (IFN -α ) определяли по методу ELISA с использованием коммерческих наборов фирмы Medgenix (Бельгия) и выражали в пкг/мл культуральных супернатантов.
Заметные результаты представлены в таблицах 1 - 4. Согласно данным таблиц 1 и 2, добавление GSSG в культуральную среду приводило к статистически достоверной и дозозависимой стимуляции продукции цитокинов мононуклеарными лейкоцитами человека. При этом, присутствие перекиси водорода приводило к повышению контрольных (в отсутствие GSSG) показателей уровней IL-6 и TNF -α. Кроме того, в комбинации с перекисью водорода GSSG оказывает более выраженное (в 1.5-2 раза) стимулирующее влияние на продукцию исследуемых цитокинов в исследовании: для IL-1 β - в концентрациях 5.0 - 5000 μг/мл; для IL-6 и TNF -α - во всем диапазоне концентраций; и для IFN -α - в концентрациях 500 и 5000 μг/мл.
Применение GSSG в 0.1% растворе инозина и 0.1% растворе цистамина приводит к достоверному и дозозависимому повышению продукции цитокинов, особенно в отношении IL-6 и TNF -α (таблицы 3 и 4).
Таким образом, действие GSSG на мононуклеарные лейкоциты периферической крови людей в условиях in vitro приводит к убедительной стимуляции продукции цитокинов в культуральную среду, чем подтверждается стимулирующее действие GSSG на естественную цитокин-продуцирующую способность клеток крови человека. Использование GSSG в комбинации с перекисью водорода, инозином, а также с цистамином, приводит к более выраженному проявлению эффектов GSSG в отношении индукции эндогенной продукции цитокинов.
Пример 2.
Влияние GSSG и его лекарственных форм на продукцию цитокинов и гемопоэтических факторов, а также показатели кроветворения и иммунитета при циклофосфамид-индуцированной гемо- и иммунодепрессии.
Действие окисленного (GSSG) и восстановленного (GSH) глутатиона, а также лекарственных форм GSSG в 0.003% растворе перекиси водорода, или в 0,1% растворе инозина, или в 0.1% растворе цистамина, оценивали в модели гемо- и иммунодепрессии у мышей, индуцированной однократным введением цитостатика циклофосфамида (ЦФ).
В рамках данного исследования была проведена оценка влияния 5-дневного применения вышеперечисленных веществ на способность лимфоцитов селезенки мышей, подвергнутых действию ЦФ, продуцировать IL-2 и GM-CSF в условиях in vitro. Помимо этого, оценивалась клеточность крови (число лейкоцитов и лимфоцитов) и костного мозга (число кариоцитов) на 8-й день после применения ЦФ. У части животных, получивших ЦФ и затем подвергнутых иммунизации эритроцитами барана (ЭБ), оценивали способность развивать гуморальный иммунный ответ к данному антигену.
Исследование было проведено на мышах линии СВА, самцах, массой 18-20 г, которым однократно вводился ЦФ (50 мг/кг, внутрибрюшинно). Семь групп животных (не менее 15 мышей в каждой) было сформировано в рамках проведенного исследования. Описание групп приведено ниже.
Контрольные группы:
N1 - интактные животные, получившие вместо инъекции ЦФ инъекцию растворителя исследуемых веществ (физиологического раствора);
N2 - животные, получившие инъекцию ЦФ, у которых в дальнейшем применялся растворитель исследуемых веществ (физиологический раствор) (контроль);
N3 - животные, получившие инъекцию ЦФ, у которых в дальнейшем применялось вещество сравнения (GSH в физиологическом растворе) из расчета 5 мг/кг массы тела;
Опытные группы:
N4 - животные, получившие инъекцию ЦФ, у которых в дальнейшем применялось исследуемое вещество (GSSG в физиологическом растворе) из расчета 5 мг/кг массы тела;
N5 - животные, получившие инъекцию ЦФ, у которых в дальнейшем применялся GSSG в физиологическом растворе, содержащей вариант фармацевтически активной композиции исследуемого вещества (GSSG в физиологическом растворе, содержащем 0.003% перекиси водорода) из расчета 5 мг GSSG на кг массы тела;
N6 - животные, получившие инъекцию ЦФ, у которых в дальнейшем применялся вариант фармацевтически активной композиции исследуемого вещества (GSSG в физиологическом растворе, содержащем 0,1% инозина), из расчета 5 мг GSSG на кг массы тела;
N7 - животные, получившие инъекцию ЦФ, у которых в дальнейшем применялся вариант фармацевтически активной композиции исследуемого вещества (GSSG в физиологическом растворе, содержащем 0,1% цистамина) из расчета 5 мг GSSG на кг массы тела;
Через 24 часа после применения ЦФ по 5 животных из каждой группы было подвергнуто иммунизации эритроцитами барана (ЭБ, 107 эритроцитов в 0.5 мл физиологического раствора, внутрибрюшинно).
С 3-х суток после инъекции ЦФ (через 24 часа после иммунизации) животным начинали внутрибрюшинное введение контрольных или исследуемых веществ, как описано выше. Введение веществ продолжали в течение 5 дней (ежедневно, один раз в день).
Через 24 часа после окончания 5-дневного курса применения контрольных или исследуемых веществ (на 8-й день после инъекции ЦФ) мышей эвтаназировали и в стерильных условиях готовили суспензию спленоцитов для оценки спонтанной продукции IL-2 и GM-CSF лимфоцитами селезенки в условиях in vitro.
Параллельно с этим забирали образцы крови и костного мозга для оценки их клеточности (число лейкоцитов и лимфоцитов крови, кариоцитов костного мозга).
У иммунизированных животных на 7-й день после иммунизации (8-й день после инъекции ЦФ) оценивали сывороточный титр гемагглютининов к ЭБ.
В таблице 5 приведены показатели продукции IL-2 и GM-CSF спленоцитами, показатели клеточности крови и костного мозга и уровень гуморального иммунного ответа на эритроциты барана у мышей, получавших исследуемые вещества на фоне циклофосфан-индуцированной гемо- и иммунодепрессии.
Согласно данным, представленным в таблице 5, применение GSSG и GSSG в 0.003% растворе перекиси водорода практически нормализует продукцию IL-2 и GM-CSF клетками селезенки, тогда как GSH не обладает подобным действием. При этом GSSG и GSSG в растворе перекиси водорода оказывают достоверное восстанавливающее действие на параметры крови и костного мозга и способность животных формировать иммунный ответ к ЭБ.
В таблицах 6 и 7 представлены данные влияния фармацевтически активных композиций, содержащих GSSG (в комбинации с 0.1% раствором инозина и с 0.1% раствором цистамина), на динамику исследуемых показателей в условиях ЦФ-индуцированной гемо- и иммунодепрессии. Приведенные данные свидетельствует о существенном усилении эффектов GSSG такими компонентами, как инозин и цистамин, относительно стимуляции продукции IL-2 и GM-CSF и восстановления клеточности крови и костного мозга. При этом, как можно видеть, GSH не обладал подобным действием; а максимальная стимуляция была выявлена в случае сочетания GSSG и 0.1% инозина.
Таким образом, применение заявляемого способа у животных, подвергнутых химической (циклофосфамид-индуцированной) гемо- и иммунодепрессии, приводит к выраженной стимуляции эндогенной продукции IL-2 и GM-CSF; оказывает восстанавливающее действие на параметры клеточности крови и костного мозга, а также на формирование иммунного ответа на эритроциты барана.
Пример 3.
Влияние GSSG и его лекарственных форм на продукцию цитокинов и гемопоэтических факторов, а также показатели кроветворения и иммунитета при радиационной гемо- и иммунодепрессии.
Действие окисленного (GSSG) и восстановленного (GSH) глутатиона, а также лекарственных форм GSSG, содержащих 0.003% раствор перекиси водорода, или 0.1% раствор инозина, или 0.1% раствор цистамина, оценивалось в модели радиационной гемо- и иммунодепрессии у мышей, индуцированной однократным облучением в общей дозе 1 грэй.
В рамках данного исследования была проведена оценка влияния 7-дневного ежедневного применения исследуемых веществ (первое введение препаратов через два часа после облучения) на способность спленоцитов мышей, подвергнутых радиационному воздействию, продуцировать IL-2 и GM-CSF в условиях in vitro. Помимо этого, на 8-й день после облучения оценивалась клеточность крови (число лейкоцитов и лимфоцитов), селезенки и костного мозга (число кариоцитов), а также колоние-образующая способность клеток костного мозга и селезенки.
Исследование было проведено на мышах линии СВА, самцах, массой 18-20 г, которые были подвергнуты однократному рентгеновскому облучению в общей поглощенной дозе 1 грэй (расстояние от источника - 70 см, мощность 180 kV, 15 мА, фильтр - 0.5 мм Cu, длительность облучения - 2 мин 28 сек).
Было сформировано семь групп животных (не менее 12 мышей в каждой). Описание групп приведено ниже.
Контрольные группы:
N1 - интактные животные, получившие стрессорное воздействие в виде ложного облучения, у которых в дальнейшем применялся растворитель исследуемого вещества (физиологический раствор);
N2 - контрольные животные, облученные в дозе 1 грэй, у которых в дальнейшем применялся растворитель исследуемых веществ (физиологический раствор);
N3 - животные, облученные в дозе 1 грэй, у которых в дальнейшем применялось вещество сравнения (GSH в физиологическом растворе) из расчета 5 мг/кг массы тела;
Опытные группы:
N4 - животные, облученные в дозе 1 грэй, у которых в дальнейшем применялось исследуемое вещество (GSSG в физиологическом растворе) из расчета 5 мг/кг массы тела;
N5 - животные, облученные в дозе 1 грэй, у которых в дальнейшем применялась лекарственная форма исследуемого вещества (GSSG в физиологическом растворе, содержащем 0.003% перекиси водорода) из расчета 5 мг GSSG на кг массы тела;
N6 - животные, облученные в дозе 1 грэй, у которых в дальнейшем применялся GSSG в физиологическом растворе, содержащем 0,1% инозина из расчета 5 мг GSSG на кг массы тела;
N7 - животные, облученные в дозе 1 грэй, у которых в дальнейшем применялся GSSG в физиологическом растворе, содержащем 0,1% цистамина из расчета 5 мг GSSG на кг массы тела.
Через 2 часа после облучения животным начинали внутрибрюшинное введение контрольных или исследуемых веществ, как описано выше. Введение веществ продолжали в течение 7 дней (ежедневно, один раз в день).
Через 24 часа после окончания применения контрольных или исследуемых веществ (на 8-й день после облучения) мышей эвтаназировали и в стерильных условиях готовили суспензию спленоцитов для оценки спонтанной продукции IL-2 и GM- CSF лимфоцитами селезенки в условиях in vitro.
Параллельно с этим забирали образцы крови, селезенки и костного мозга для оценки их клеточности (число лейкоцитов и лимфоцитов крови, кариоцитов селезенки и костного мозга).
Одновременно, определяли гемопоэтическую колониеобразующую способность клеток костного мозга и селезенки методом прямой подсчета колониеобразующих единиц (КОЕ) в селезенке сингенных облученных мышей СВА, которым внутривенно вводили порции исследуемых суспензий клеток костного мозга и селезенки от животных исследуемых групп.
В таблицах 8, 9, 10 приведены показатели продукции IL-2 и GM-CSF спленоцитами, показатели клеточности крови, селезенки и костного мозга, а также показатели колониеобразования (колониеобразующие единицы, КОЕ) костного мозга и селезенки облученных животных на 8 день после радиационного воздействия.
Как следует из материалов таблиц, применение GSSG и лекарственных форм GSSG в 0,003% растворе перекиси водорода, или в 0,1% растворе инозина, или в 0,1% растворе цистамина статистически достоверно восстанавливает продукцию IL-2 и GM- CSF клетками селезенки, тогда как GSH не оказывает существенного эффекта.
При этом, как GSSG, так и GSSG в составе фармацевтически активных композиций оказывали достоверное нормализующее действие на клеточность крови, селезенки и костного мозга. В ряде случаев эффект GSSG в растворе перекиси водорода оказался более существенным. Так, в случае применения только GSSG эффект данного вещества не имел статистической значимости (при сравнении с контрольной группой) для таких показателей, как продукция IL-2 спленоцитами, лейкоциты крови, и клеточность костного мозга, а также колониеобразующая активность клеток костного мозга, тогда как в случае использования GSSG в растворе перекиси водорода имели место статистически достоверные отличия. Еще более достоверными и убедительными потенцирующими эффектами действия GSSG обладают инозин и цистамин, максимальным лечебным эффектом обладает активная композиция GSSG с инозином.
Таким образом, применение заявляемого способа у животных, подвергнутых радиационной гемо- и иммунодепрессии, приводит к выраженной стимуляции эндогенной продукции IL-2 и GM-CSF; эффективному восстановлению клеточности крови, лимфоидных и кроветворных органов, а также колониеобразующей активности костного мозга и селезенки.
Пример 4.
Влияние GSSG и его лекарственных форм на процессы пролиферации и апоптотической гибели нормальных и трансформированных клеток.
Оценивали способность окисленного глутатиона (GSSG), а также его лекарственные формы: GSSG в 0.003% растворе перекиси водорода, или GSSG в 0.1% растворе инозина, или GSSG в 0.1% растворе цистамина, влиять на процессы пролиферации и/или программированной гибели нормальных и трансформированных клеток. Для этого осуществляли инкубацию GSSG или его лекарственных форм в течение 24 часов с клетками миелоидной линии HL-60 и нормальными лимфоцитами, полученными из периферической крови здоровых волонтеров, с последующей оценкой клеточного цикла методом проточной цитофлуометрии.
Венозную кровь от здоровых доноров собирали в гепаринизированные пробирки, тестированные на отсутствие эндотоксина. Мононуклеарную фракцию лейкоцитов крови получали центрифугированием в градиенте плотности фиколл-метризоат (Histopaque, Sigma). Концентрацию клеток доводили до 2•106 клеток на 1 мл полной культуральной среды (RPMI 1640), содержащей 20 мМ HEPES, 2 мМ глутамина, 50 мкг/мл гентамицина и 10% эмбриональную телячью сыворотку. Жизнеспособность клеток оценивали в тесте с трипановым синим и клеточную суспензию разносили в лунки 96- луночных планшетов из расчета 200 000 клеток на лунку.
Клетки перевиваемой миелоидной линии HL-60 выращивались в среде RPMI 1640 с добавкой 10% эмбриональной телячьей сыворотки. Культивирование проводили в закрытых флаконах, объем среды 12 мл, смену среды проводили каждые 4 дня путем центрифугирования. Характер роста клеток - суспензионный.
Оценивали влияние исследуемого раствора GSSG (5000 μг/мл), а также GSSG в 0.003% растворе перекиси водорода, GSSG в 0.1% растворе инозина, и GSSG в 0.1% растворе цистамина. Каждый из растворов оценивали по 6 пробам для нормальных лимфоцитов и клеток HL-60. Каждый из растворов тестируемых веществ в количестве 50 μл добавлялся в ту или иную культуральную среду и клетки культивировали в течение 24-96 часов. Затем они тестировались с помощью проточной цитофлуометрии на предмет содержания ДНК в клеточных ядрах. В случае наступления апоптотической гибели наблюдалось уменьшение доли клеточных ядер с нормальным содержанием ДНК и увеличивалось число ядер с существенно меньшим содержанием ДНК.
Процедура анализа заключалась в следующем: после инкубации клетки центрифугированием переводились в стандартный фосфатный изотонический буфер pH 7,4, содержащий РНК-азу A (20 мкг/мл), бромистый этидий (флуометрический индикатор двойных спиралей нуклеиновой кислоты, 10 мкг/мл) и MgCl2 (5 мМ). Затем клетки вскрывались добавлением не-ионного детергента Triton X-100 (конечная концентрация 0,1%). Полученная в результате суспензия клеточных ядер анализировалась на проточном цитофлуометре с аргоновым лазером в качестве источника света (длина волны 488 нм). Регистрируемая красная флюоресценция связанного с ДНК бромистого этидия является мерой содержания ДНК в ядрах клеток. - Параллельно визуально анализировались изменения в морфологии изучаемых клеток соответствующих образцов.
Результаты исследования представлены в таблице 11, 12 и на фиг. 1. Как можно видеть из данных таблицы 11, добавление GSSG или его лекарственных форм стимулирует пролиферацию нормальных лимфоцитов здорового человека, что приводит к увеличению их количества, при этом проточный цитофлуометрический анализ не обнаружил каких-либо изменений, характерных для процессов апоптотической гибели клеток (см. фиг. 1в-1г).
Исследования, проведенные на клеточных культурах трансформированных клеток миелоидной линии HL-60, выявили способность GSSG, а также его лекарственных форм, тормозить пролиферацию трансформированных клеток. Данные таблицы 12 показывают, что композиции GSSG с перекисью водорода, инозином и цистамином обладают большей способностью ингибировать пролиферацию клеток HL-60 в сравнении с GSSG, применяемым в монорежиме. Проведенный проточный цитофлуометрический анализ показал, что уменьшение клеточного роста клеток линии HL-60 сопровождается появлением характерных морфологических признаков апоптотической гибели: клетки из сферических становились многолопастными с множественными перетяжками; отмечалось уменьшение клеточных ядер с нормальным содержанием ДНК и увеличивалось число ядер с ненормально сниженным содержанием ДНК (фиг. 1а-1б).
Таким образом, проведенные in vitro исследования позволяют говорить о наличии бифункциональной активности GSSG, а также его лекарственных форм, которые избирательно вызывают апоптотическую гибель в опухолевых клетках и замедляет их пролиферацию, при этом отсутствует какие-либо признаки апоптоза у нормальных клеток (лимфоцитов), а пролиферация последних отчетливо ускоряется. Использование GSSG в комбинации с инозином приводит к наиболее выраженному апоптотическому эффекту GSSG в отношении трансформированных клеток.
Пример 5.
Влияние GSSG и его лекарственных форм на рост перевиваемых опухолей у мышей.
Исследовалась противоопухолевая активность окисленного глутатиона (GSSG), а также его лекарственных форм в 0.003% растворе перекиси водорода, или в 0.1% растворе инозина, или в 0.1% растворе цистамина, на двух моделях опухолевого процесса у мышей, индуцированного введением клеток лейкемии P388 и лейкемии L1210. В рамках данного исследования оценивалось влияние 7-дневного применения исследуемых препаратов на динамику содержания цитокинов (IL-I; IL-2; IL-6; IFN -α; TNF) в крови мышей с перевитыми опухолями и у контрольных животных. Параллельно оценивали опухолевую прогрессию, используя два интегральных показателя: динамику увеличения массы тела мышей вследствие накопления асцитической жидкости и среднюю продолжительность жизни после введения.
Исследование проводилось на мышах линии DBA/2 с массой тела животных 18-21 г. В начале проводили пассаж каждой из линий опухолевых клеток на 6 животных. Для этого культуры клеток, хранящиеся при температуре жидкого азота, размораживали и разводили в стерильном растворе Хенкса до концентрации 5•106 клеток/мл 0.2 мл полученной суспензии клеток каждой линии внутрибрюшинно инокулировали 6 мышам.
На 8-й день пассажа в случае клеток P388 и на 6-й день пассажа в случае клеток L1210 из брюшной полости извлекали асцитную жидкость и полученные образцы опухолевых клеток были использованы для проведения основных экспериментов. Асцитную жидкость разводили стерильным раствором Хенкса до концентрации: 5•106 клеток/мл в случае клеток P388 и до концентрации 5•105 клеток/мл в случае клеток L1210.
Для исследований с каждой из опухолевых линий были сформированы по 9 групп животных не менее 15-й мышей в каждой. Объем конечной инокулируемой суспензии составил 0.2 мл на мышь, доза инокулюма: 106 клеток/мышь - в случае клеток P388 и 105 клеток/мышь - в случае клеток L1210. Через 24 часа после инокуляции опухолевых клеток, животным начинали внутрибрюшинное введение исследуемых веществ или растворителей. Далее инъекции исследуемых веществ продолжали до 14-го дня исследования или до момента гибели животного. Объем инъекции - 0.01 мл/г массы тела животного.
Для экспериментов с каждой из опухолевых линий было сформировано по 9 групп животных, описание которых приведено ниже.
Контрольные группы:
N 1 - интактные животные, получившие имитацию инъекции опухолевых клеток (инъекцию физиологического раствора), который вводился им в дальнейшем (интактные) в течение всего исследования;
N 2 - контрольные животные, получившие инъекцию опухолевых клеток, которым в дальнейшем вводился растворитель исследуемых веществ (физиологический раствор).
Опытные группы:
N 3 - животные, получившие инъекции опухолевых клеток, которым в дальнейшем вводилось исследуемое вещество (GSSG в физиологическом растворе) из расчета 5 мг/кг массы тела;
N 4 - животные, получившие инъекцию опухолевых клеток, которым в дальнейшем вводился вариант лекарственной формы исследуемого вещества (GSSG в физиологическом растворе, содержащем 0.003% перекиси водорода) из расчета 5 мг GSSG на кг массы тела;
N 5 - животные, получившие инъекцию опухолевых клеток, которым в дальнейшем вводился вариант лекарственной формы исследуемого вещества (GSSG в физиологическом растворе, содержащем 0.1% инозина) из расчета 5 мг GSSG на кг массы тела;
N 6 - животные, получившие инъекцию опухолевых клеток, которым в дальнейшем вводился вариант лекарственной формы исследуемого вещества (GSSG в физиологическом растворе, содержащем 0.1% цистамина) из расчета 5 мг GSSG на кг массы тела;
N 7 - животные, получившие инъекцию опухолевых клеток, которым в дальнейшем вводился вариант компонента лекарственной формы исследуемого вещества (0.003% раствор перекиси водорода) без GSSG;
N 8 - животные, получившие инъекцию опухолевых клеток, которым в дальнейшем вводился вариант компонента лекарственной формы исследуемого вещества (0.1% раствор инозина) без GSSG;
N 9 - животные, получившие инъекцию опухолевых клеток, которым в дальнейшем вводился вариант компонента лекарственной формы исследуемого вещества (0.1% раствор цистамина) без GSSG.
В таблицах13 и 14 приведены результаты оценки эффективности влияния исследуемых веществ как на эндогенную продукцию цитокинов, так и данные по интегративным показателям прогрессии опухолевого процесса. Полученные результаты свидетельствует о том, что и GSSG, и его лекарственные формы обладают отчетливым цитокинактивирующим действием, достоверно (относительно контрольных групп) замедляя накопление асцитической жидкости и увеличивая среднюю продолжительность жизни. GSSG и GSSG в 0.003% растворе перекиси водорода в большей степени повышают содержание в крови IL-1 и IFN -α; тогда как GSSG в комбинации с 0.1% раствором инозина и 0.1% раствором цистамина обуславливают более высокие уровни IL-2, IL-6, TNF -α сыворотке крови.
Максимальный уровень таких показателей противоопухолевого действия исследуемых веществ, как торможение накопления асцита и продолжительность жизни получена в обеих моделях опухолевого процесса (лейкемия P388 и L1210) в случае применения GSSG в комбинации с 0.1% растворе цистамина.
Таким образом, применение заявляемого способа для лечения мышей с перевитыми опухолями приводит: к выраженному увеличению эндогенной продукции IL-2, IL-6, IFN -α и TNF -α; к достоверному торможению прогрессии перевиваемых опухолей и увеличению средней продолжительности жизни.
Неизвестные ранее свойства известного вещества - окисленного глутатиона (GSSG) и его фармацевтически активных композиций, содержащих 0.003% раствор перекиси водорода, или 0.1% раствор инозина, или 0.1% раствор цистамина - установленные в ходе доклинических исследований, позволяют утверждать, что GSSG и его лекарственные формы обладают выраженной фармакологической активностью, а также лечебным эффектом. Это обосновывает показания к применению соответствующих лекарственных форм как самого GSSG, так и GSSG в комбинации с фармацевтически приемлемыми компонентами, способными увеличить время полужизни окисленного глутатиона, для профилактики и лечения заболеваний, при которых стимуляция эндогенной продукции цитокинов и гемопоэтических факторов целесообразна и считается таковой специалистами в соответствующей области техники.
Примеры клинического применения лекарственных форм GSSG, приведенные далее (примеры NN 9-26), подтверждают идею использования GSSG как индуктора эндогенной продукции цитокинов и гемопоэтических факторов, и утверждают метод лечения заболеваний, основанного на данных свойствах GSSG.
Пример 6.
Влияние литиевой соли окисленного глутатиона и S-тиоэтиламина глутатиона и их лекарственных форм на процесс апоптоза нормальных и трансформированных клеток.
Оценивали способность литиевой соли окисленного глутатиона (Li-GSSG) и S-тиоэтиламина (дериват окисленного глутатиона - ТЭА), а также их лекарственных форм, содержащих перекись водорода (0,003%), или инозин (0,1%), или цистамин (0,1%), или диметилсульфоксид (ДМСО) (7%), влиять на процессы программированной клеточной гибели (апоптоза) в отношении нормальных и опухолевых клеток Для этих целей указанные вещества инкубировали в течение 72 часов с клетками эмбриональных фибробластов крысы (REF) и с теми же клетками, но трансформированными геном аденовируса E1A в комплементации с ras-онкогеном (клеточная линия e-ras). Последующая оценка клеточности экспериментальных моделей осуществлялась посредством подсчета количества клеток на миллилитр (для клеточной линии REF) и количества клонов в чашке (для клеточной линии e-ras).
Клетки выращивались в среде DMEM с добавкой 10% эмбриональной телячьей сыворотки и 50 μг/мл гентамицина. Культивирование проводили в чашках Петри. Клетки REF культивировались в чашках Петри с плотностью 800000 клеток на мл, оценка клеточности производилась на через 0, 24, 48 и 72 часа инкубации с исследуемыми веществами. Клетки e-ras рассевали с плотностью 300 клеток на 5-ти сантиметровую чашку. После 7 дней роста клеток e-ras определяли количество клонов, и исследуемые вещества добавляли в чашки.
Оценивали влияние исследуемых растворов Li-GSSG и ТЭА (5000 μг/мл), а также растворы Li-GSSG и ТЭА, содержащие 0,003% раствор перекиси водорода, или 0,1% раствор инозина, или 0,1% раствор цистамина, или 7% раствор ДМСО. Каждый из растворов оценивали по 6 клеточным моделям для каждой клеточной линии.
Тестируемый раствор в количестве 50 мкл добавлялся в ту или иную клеточную культуру и клетки культивировали в течение 24-72 часов. В качестве тест-системы для оценки регулирования апоптоза использовали УФ-индуцированную клеточную гибель в дозе 4 Дж. Исследуемые вещества добавляли сразу после облучения. Каждые 24 часа определяли количество клеток в мл (для клеточной линии REF) и количество клонов (для e-ras клеток). Для определения фрагментации ДНК использовали метод электрофореза в агарозном геле со стандартными установками.
Результаты исследования представлены в таблицах 15-18. Таблицы 15 и 16 показывают, что присутствие литиевой соли GSSG, ТЭА и их лекарственных форм не вызывают апоптоз нормальных клеток (клетки REF). Исследования, выполненные на клетках e-ras, показывают способность литиевой соли GSSG и ТЭА, так же как и их лекарственных форм, индуцировать клеточную гибель трансформированных клеток.
В таблицах 17 и 18 показано, что присутствие литиевой соли GSSG, ТЭА и их лекарственных форм не усиливают апоптоз, вызванный УФ-облучением, у нормальных клеток (клетки REF). Исследования, выполненные на клетках e-ras, показали способность литиевой соли GSSG, ТЭА и их лекарственных форм потенцировать гибель трансформированных клеток (клетки e-ras).
Таким образом, полученные результаты позволяют говорить о наличии бифункциональных свойств литиевой соли GSSG, ТЭА и их лекарственных форм, которые селективно индуцируют апоптоз-подобную гибель опухолевых клеток без каких-либо признаков апоптоза у нормальных клеток. Кроме того, все исследуемые вещества оказались способны уменьшить процессы апоптоза, индуцированного УФ-облучением, в нормальных клетках и потенцировать эти процессы в трансформированных клетках. Применение ТЭА в комбинации с ДМСО давало наиболее выраженный эффект, чем литиевая соль GSSG, в отношении трансформированных клеток.
Пример 7.
Влияние литиевой соли окисленного глутатиона, S-тиоэтиламина и их лекарственных форм на рост перевиваемых опухолей у мышей.
Исследовалась противоопухолевая активность литиевой соли окисленного глутатиона GSSG (Li-GSSG), S-тиоэтиламина (ТЭА), а также их лекарственных форм, содержащих 0,003% перекись водорода, или 0,1% инозин, или 0,1% цистамин, или 7% диметилсульфоксид (ДМСО) на трех моделях опухолевого процесса, индуцированного интраперитонеальной инокуляцией клеток лейкемии P388, лейкемии L1210 и аденокарциномы Эрлиха. В рамках данного исследования оценивалось влияние 7-дневного применения исследуемых препаратов на опухолевую прогрессию, которая оценивалась по двум интегральным показателям: динамике увеличения массы тела вследствие накопления асцитической жидкости и средней продолжительности жизни после инокуляции.
Исследование проводилось на мышах линии DBA/2, масса тела 18-21 г. Во-первых, осуществлялся пассаж опухолевых клеток, используя по 6 животных из каждой клеточной линии. Для этого культуры клеток, хранящиеся при температуре жидкого азота, размораживали и разводили в стерильном растворе Хенкса до концентрации 5•106 клеток/мл. Затем 0.2 мл полученной суспензии клеток каждой линии инокулировали внутрибрюшинно 6 мышам.
На 8-й день пассажа клеток P388, на 6-й день пассажа клеток L1210 и 18 день после инокуляции клеток аденокарциномы Эрлиха была собрана асцитическая жидкость. Полученные таким образом образцы асцитической жидкости были использованы для проведения основных экспериментов. Асцитическую жидкость разводили стерильным раствором Хенкса так, чтобы концентрация клеток была 5•106 клеток/мл для клеток P388 и аденокарциномы Эрлиха и 5•105 клеток/мл для клеток L1210.
Были сформированы 16 групп животных (не менее 15-й мышей в каждой) для проведения исследования с каждой линией опухолевых клеток. Мышам провели инокуляцию конечной суспензии опухолевых клеток по 0.2 мл на мышь (106 клеток на мышь - для клеток P388 и аденокарциномы Эрлиха, 105 клеток на мышь - для клеток L1210).
Через 24 часа после инокуляции опухолевых клеток, животным сделали инъекции исследуемых веществ и растворителей. Инъекции исследуемых веществ продолжали проводить ежедневно до 14-го дня исследования или до гибели животного. Объем инъекции - 0.01 мл/г массы тела животного.
Ниже приведено описание шестнадцати групп животных, сформированных для проведения эксперимента с каждой линией опухолевых клеток:
Контрольные группы:
N 1 - интактные животные, получившие имитацию инъекции опухолевых клеток (инъекции физиологического раствора), которым вводили физиологический раствор в течение всего эксперимента;
N 2 - контрольные животные, получившие инъекцию опухолевых клеток, которым в дальнейшем вводился растворитель исследуемого вещества (физиологический раствор).
Опытные группы:
N 3 - животные, получавшие инъекции опухолевых клеток, которым в дальнейшем вводилось исследуемое вещество (ТЭА в физиологическом растворе) из расчета 5 мг/кг массы тела;
N 4 - животные, получившие инъекцию опухолевых клеток, которым в дальнейшем вводился вариант лекарственной формы исследуемого вещества (ТЭА в физиологическом растворе, содержащем 0.003% перекиси водорода) из расчета 5 мг на кг массы тела;
N 5 - животные, получившие инъекцию опухолевых клеток, которым в дальнейшем вводился вариант лекарственной формы исследуемого вещества (ТЭА в физиологическом растворе, содержащем 0.1% инозина) из расчета 5 мг на кг массы тела;
N 6 - животные, получившие инъекцию опухолевых клеток, которым в дальнейшем вводился вариант лекарственной формы исследуемого вещества (ТЭА в физиологическом растворе, содержащем 0.1% цистамина) из расчета 5 мг на кг массы тела;
N 7 - животные, получившие инъекцию опухолевых клеток, которым в дальнейшем вводился вариант лекарственной формы исследуемого вещества (ТЭА в физиологическом растворе, содержащем 7% ДМСО) из расчета 5 мг на кг массы тела;
N 8 - животные, получившие инъекцию опухолевых клеток, которым в дальнейшем вводилось исследуемое вещество (Li соль GSSG, растворенная в физиологическом растворе) из расчета 5 мг/кг массы тела;
N 9 - животные, получившие инъекцию опухолевых клеток, которым в дальнейшем вводился вариант лекарственной формы исследуемого вещества (Li соль GSSG, растворенная в физиологическом растворе, содержащем 0.003% перекиси водорода) из расчета 5 мг на кг массы тела;
N 10 - животные, получившие инъекцию опухолевых клеток, которым в дальнейшем вводился вариант лекарственной формы исследуемого вещества (Li соль GSSG, растворенная в физиологическом растворе, содержащем 0.1% инозина) из расчета 5 мг на кг массы тела;
N 11 - животные, получившие инъекцию опухолевых клеток, которым в дальнейшем вводился вариант лекарственной формы исследуемого вещества (Li соль GSSG, растворенная в физиологическом растворе, содержащем 0.1% цистамина) из расчета 5 мг на кг массы тела;
N 12 - животные, получившие инъекцию опухолевых клеток, которым в дальнейшем вводился вариант лекарственной формы исследуемого вещества (Li соль GSSG, растворенная в физиологическом растворе, содержащем 7% ДМСО) из расчета 5 мг на кг массы тела;
N 13 - животные, получившие инъекцию опухолевых клеток, которым в дальнейшем вводился компонент варианта лекарственной формы исследуемого вещества (0.003% раствор перекиси водорода), без GSSG;
N 14 - животные, получившие инъекцию опухолевых клеток, которым в дальнейшем вводился компонент варианта лекарственной формы исследуемого вещества (0.1% раствор инозина), без GSSG;
N 15 - животные, получившие инъекцию опухолевых клеток, которым в дальнейшем вводился компонент варианта лекарственной формы исследуемого вещества (0.1% раствор цистамина), без GSSG;
N 16 - животные, получившие инъекцию опухолевых клеток, которым в дальнейшем вводился компонент варианта лекарственной формы исследуемого вещества (7% раствор ДМСО), без GSSG.
В таблицах 19-21 приведены результаты оценки влияния исследуемых веществ на интегральные показатели опухолевой прогрессии.
Наиболее выраженный противоопухолевый эффект, характеризующийся уменьшением накопления асцитической жидкости и увеличения средней продолжительности жизни для каждой опухолевой модели (лейкемия P388 и L1210, аденокарцинома Эрлиха), был получен при использовании ТЭА в комбинации с 0.1% инозином и 7% ДМСО.
Пример 8.
Влияние цинковой соли GSSG, S-аденозил-метионина-GSSG и их лекарственных форм на течение экспериментального аллергического энцефаломиелита (ЭАЭ).
На модели ЭАЭ, являющегося экспериментальной моделью рассеянного склероза, исследовали действие цинковой соли GSSG в 0.003% растворе H2O2 S-аденозил-метионина-GSSG в 5% растворе аскорбиновой кислоты на динамику течения патологического процесса.
В рамках данного исследования оценивали воздействие 10-дневного курса названных комбинационных лекформ GSSG на клеточный состав крови (содержание лейкоцитов, лимфоцитов, моноцитов и нейтрофилов). С целью оценки выраженности клеточной гиперчувствительности к основному белку миелина и антигену мембран нейронов исследовали in vitro миграционную активность лейкоцитов периферической крови в присутствии данных антигенов. Использован капиллярный метод реакции торможения миграции лейкоцитов (РТМЛ).
Исследование проводили на самцах морских свинок с массой тела 400-500 г.
Вещество, способствующее развитию энцефалита - основной белок миелина (ОБМ) - получали из бычьего спинного мозга с использованием метода колоночной хроматографии и эмульгировали в полном адъюванте Фрейнда. Иммунизацию животных проводили посредством подкожного введения энцефалит-индуцирующей смеси в передние лапки (ОБМ + полный адъювант Фрейнда). Латентный период клинического проявления ЭАЭ в среднем составлял 14-15 дней, минимально - 12 дней.
Контрольные группы:
N 1 - Интактные животные, которым вводили физиологический раствор;
N 2 - Животные, которым вводили энцефалит-индуцирующую смесь, затем физиологический раствор.
Экспериментальные группы:
N 3 - Животные, которые получали энцефалит-индуцирующую смесь и цинковую соль глутатиона (GSSG-Zn) в 0.003% растворе H2O2 (5 мг GSSG на кг массы);
N 4 - Животные, которые получали энцефалит-индуцирующую смесь, затем S-тиоэтиламин-GSSG в 5% растворе аскорбиновой кислоты, 5 мг основания GSSG на кг веса тела.
Показатели неврологического статуса:
1 мышечная слабость, дискоординация движений;
2 парез лапок, атония мочевого пузыря, расстройство мочеиспускания;
3 моторный и функциональный паралич тазовых органов;
4 расстройства циркуляции крови и терморегуляции;
5 агония, дыхание по Шейну-Стоксу.
Методы оценки клеточного иммунитета
1. Реакция торможения миграции лейкоцитов (РТМЛ) - вариант реакции Гиперчувствительности Замедленного Типа in vitro. Метод основан на изменении миграционной активности лейкоцитов периферической крови за время контакта с ОБМ в стеклянных капиллярах. Зоны миграции измеряют посредством микроскопа при использовании окуляр микрометра. Индекс миграции рассчитывают как отношение протяженности зоны миграции клеток под воздействием антигена к протяженности зоны спонтанной миграции (без воздействия антигена). Статистически значимым является изменение величины индекса миграции более чем в 0.2, т.е. индекс миграции меньше, чем 0.8, рассматривается как ее подавление.
2. Спонтанная адгезия лейкоцитов крови и ее изменения за время контакта с ОБМ. Миграция клеток крови через эндотелий сосудов является ключевым моментом в развитии повреждений, связанных с воспалением, при ЭАЭ. Данный процесс определяется сочетанным воздействием молекул адгезии, экспрессированных на лейкоцитах и эндотелии. Супрессия адгезивных свойств лейкоцитов антигеном указывает на специфическую сенсибилизацию иммунизированных животных; изменения в этом индексе при ингибировании характеризуют иммунотропные свойства препарата в отношении клеточного иммунитета.
3. Адгезивную активность клеток изучали посредством флуоресцентной оценки адгезии к микропанелям Flakon Plastic 3034 и выражали как число клеток, у которых произошла спонтанная адгезия или адгезия в результате антигенного воздействия к панелям.
Подсчет индекса адгезии:
(1-адгезия под воздействием антигена/спонтанная адгезия)•100 случаев адгезии
Индекс >30 показывает реакцию супрессии спонтанной адгезии.
Через 24 часа после завершения 10-дневного введения исследуемых веществ выжившие животные были умерщвлены и проведен подсчет количества спленоцитов в стерильных условиях. Одновременно проводили забор крови для подсчета ее клеточного состава.
Данные, отражающие влияние исследуемых веществ на выживаемость и неврологические показатели животных, представлены в таблицах 22 и 23. Согласно приведенным данным, использование Zn-GSSG в 0.003% растворе H2O2 увеличивает выживаемость животных и существенно снижает неврологические симптомы ЭАЭ.
В таблицах 24 и 25 представлены результаты, позволяющие выявить влияние исследуемых веществ на иммунологические параметры при ЭАЭ, которые демонстрируют значительный эффект исследуемых веществ на параметры сенсибилизации лимфоцитов крови к антигенам мозга. В то же время, происходит существенное уменьшение степени сенсибилизации лимфоцитов в РТАЛ (таблица 24) и РТМЛ (таблица 25).
Пример 9.
Влияние лекарственной формы GSSG на эндогенную продукцию цитокинов и эритропоэтина у людей, страдающих онкологическими заболеваниями.
Приведены клинические данные, свидетельствующие о регулирующем влиянии GSSG на эндогенную продукцию цитокинов и гемопоэтических факторов у людей, страдающих онкологическими заболеваниями. Композитный состав GSSG в 0.1% растворе инозина вводился внутривенно, один раз в два дня, в дозе 5 мг на одну инъекцию. Об эндогенной продукции цитокинов судили по их содержанию в крови пациентов перед первой инъекцией (кровь собирали за 24 часа до момента введения), а также после третьей и седьмой инъекций GSSG. Содержание цитокинов определяли иммуноферментным методом с использованием коммерческих наборов фирмы Medgenix (Belgium) и выражали в пкг/мл культуральной среды.
Из данных, представленных в таблице 26, следует, что уже после трех первых инъекций GSSG отмечается выраженная стимуляция эндогенной продукции цитокинов (IL-1b, IL-6, TNF -α, IFN-α ) и эритропоэтина. После 7-й инъекции (14 дней лечения) в большинстве случаев отмечается многократный прирост содержания цитокинов и эритропоэтина в крови обследуемых пациентов.
Пример 10.
Стимуляция эндогенной продукции цитокинов и эритропоэтина и лечебный эффект у больной раком сигмовидной кишки, осложненным гемодепрессией, вызванной химиотерапевтическим лечением.
Больная 44 лет была прооперирована по поводу опухоли сигмовидной кишки с прорастанием в яичник и метастатическим поражением лимфатических узлов брыжейки и большого сальника (T4N3M1). В послеоперационном периоде был проведен курс химиотерапии 5-фторурацилом (курсовая доза 5.5 г), сопровождавшийся выраженным гематотоксическим эффектом.
Через 1 месяц после проведенного курса химиотерапии больная была повторно обследована с проведением ультразвукового исследования органов брюшной полости, а также компьютерной томографии печени, которые выявили одиночный метастаз в левой доле печени, овальной формы, размером 13х10 мм. При повторных клинических анализах крови у больной было обнаружено неполное восстановление показателей крови (регистрировались различные степени лейко- и лимфопении, анемии и тромбоцитопении), что делало невозможным проведение новых курсов химиотерапии.
Лабораторные параметры до начала применения лекарственной формы окисленного глутатиона (5 мг GSSG в 1 мл 0.003% перекиси водорода) приведены в таблице 27. Лечение по заявляемому способу было начато с внутривенных инъекций по 5 мг GSSG однократно в течение 7 дней. После 3-дневного перерыва доза препарата GSSG была увеличена до 15 мг, внутривенно, однократно в течение 10 дней. После 7-дневного перерыва препарат GSSG вводили внутримышечно по 15 мг, через день (всего 20 инъекций).
Через 50 дней после начала лечения пациентке было проведено повторное ультразвуковое обследование органов брюшной полости и компьютерная томография печени, которые выявили существенную регрессию размеров одиночного метастаза в левой доле печени (более 50% от исходного). Иммунологические параметры после лечения приведены в таблице 27.
Как можно видеть, по окончании лечения значительно улучшились показатели красной и белой крови, практически нормализовалось число тромбоцитов, снизилось СОЭ, повысилось число CD4+- и CD8+-лимфоцитов, NK-клеток. Произошла убедительная стимуляция эндогенной продукции цитокинов и эритропоэтина, в том числе фактора некроза опухолей (наряду с ростом количества естественных киллеров), с чем может быть связана регрессия метастаза в печени. Данные изменения сопровождались улучшением общего состояния больной.
Приведенное клиническое наблюдение свидетельствует об очевидной лечебной эффективности заявляемого способа. Метод вызвал существенную стимуляцию эндогенной продукции цитокинов и гемопоэтических факторов, уменьшение размеров метастаза в печени, нормализацию иммунологических показателей, улучшение общего состояния пациентки.
Пример 11.
Стимуляция эндогенной продукции цитокинов у больного СПИДом, осложненным криптококковым менингитом.
Мужчина 28 лет с подтвержденным ранее диагнозом СПИД, стадия 3/4C (WHO Staging System) поступил в состоянии средней тяжести. Жалобы на приступообразную головную боль, головокружение, рвоту. Вес тела 47 кг, индекс Карновского - 60, заторможен, повышение температуры тела до 39oC, одышка в покое.
При неврологическом осмотре выявлены ригидность затылочных мышц, снижение сухожильных рефлексов верхних и нижних конечностей (коленных, ахилловых, двуглавой и трехглавой мышц). При исследовании культуры спинномозговой жидкости обнаружен Cryptococcus neoformans, на основании чего было установлено наличие криптококкового менингоэнцефалита, стадия основного заболевания (СПИД) было уточнена как 4C.
Начата активная инфузионная терапия. Помимо паллиативных средств больной получил курс лечения фунгизоном (Amphotericin В), который не дал положительного эффекта. Выраженность неврологической симптоматики и общее состояние больного продолжали ухудшаться. Сохранялась фебрильная температура тела (37.5 - 38.5oC).
К моменту начала применения окисленного глутатиона (5 мг/кг) у больного определялось резкое снижение количества CD4+ и CD8+ Т-лимфоцитов периферической крови, анемия, общая лимфопения (таблица 17).
Лечение больного по заявляемому способу проводилось в течение 3-х месяцев (по 1 мл раствора GSSG на одну инъекцию). При этом, в течение первого месяца инъекции проводились через день (первые 10 дней внутривенно, в дальнейшем в/м), в течение 2-го месяца - раз в три дня (первые 10 дней в/в, в дальнейшем п/к).
К середине первого месяца лечения состояние больного существенно улучшилось, уменьшилась выраженность неврологической симптоматики, температура тела не поднималась выше 37.5oC. В ходе проведения лечения по заявляемому способу больному дважды проводили микологическое исследование ликвора (цитологическое, культуральное, реакция латекс-агглютинации на наличие криптококкового антигена). К концу первого месяца лечения было обнаружено существенное снижение присутствия в ликворе способных к росту организмов Cryptococcus neoformans. К исходу второго месяца цитологические, культуральные и иммунологические тесты показали отсутствие возбудителя в спинномозговой жидкости. В течение 3-го месяца в связи со значительным улучшением в состоянии больного инъекции проводились 1 раз в неделю (в/м).
Результаты гематологического/иммунологического обследования больного по завершении лечения приведены в таблице 28. Как можно видеть, уменьшились проявления анемии, а также произошло существенное нарастание числа лимфоцитов и их субпопуляций, что позволяет констатировать рестадирование основного заболевания (СПИД) со стадии 4C в стадию 4B.
Обращает внимание убедительное нарастание содержания цитокинов в крови, ряд из которых (IL-2 и 6, IFN -γ) играют принципиальную роль в обеспечении механизмов защиты макроорганизма от патогенных грибов.
К моменту выписки из стационара состояние пациента расценивалось как удовлетворительное, вес тела 60 кг (прибавка в весе составила 21.7% от исходного), температура тела нормальная, индекс Карновского - 90. Неврологическая симптоматика отсутствовала.
Пример 12.
Стимуляция эндогенной продукции цитокинов и лечебный эффект у больного СПИДом, осложненным изоспориозом.
Мужчина 38 лет около 2 лет наблюдается с диагнозом СПИД, стадия 3C (WHO Staging System). В течение последнего года документированы повторные эпизоды кандидоза слизистой полости рта и пищевода, а также практически хроническое течение изоспориоза кишечника, проявляющееся в снижении аппетита, тошноте, частых эпизодах рвоты и жидкого стула с примесью слизи и крови. Периодическое применение котримоксазола (триметоприм в комбинации с сульфаметоксазолом, ТМР-SMX) давало нестойкие ремиссии с быстрым возобновлением симптоматики. Очередное обострение изоспориоза на протяжении последнего месяца перед госпитализацией. Курс терапии котримоксазолом, имодиумом (лоперамидом) улучшения не принес. Состояние постепенно ухудшалось: постоянная температура тела 38oC и выше, жидкий стул с примесью крови и слизи до 6-7 раз в сутки, рвота, прогрессирующая потеря веса (за год около 15% от своего обычного веса). Госпитализирован в связи с прогрессирующим ухудшением состояния.
При поступлении в стационар общее состояние средней тяжести, индекс по шкале Карновского - 50, температура тела 38.2oC, больной истощен (вес 42 кг), подкожно-жировой слой практически отсутствует, кожные покровы бледные. Признаки кандидоза слизистой рта и пищевода. При повторных исследованиях кала обнаруживается большое количество ооцист Isospora belli.
К моменту начала лечения пациента по заявляемому способу, у больного определялась лимфопения, резкое снижение количества CD4+ и CD8+ лимфоцитов, гипопротеинемия (таблица 29).
Лечение больного с применением лекарственной формы окисленного глутатиона (5 мг GSSG в 1 мл 0.003% перекиси водорода) проводилось в течение 2-х месяцев (по 1 мл раствора GSSG на одну инъекцию). При этом, в течение первого месяца инъекции выполнялись через день (первые 10 дней внутривенно, в дальнейшем в/м), в течение 2-го месяца - раз в три дня (первые 10 дней в/в, в дальнейшем п/к).
Состояние больного начало отчетливо улучшаться после первых 2-х недель лечения. К концу первого месяца лечения частота стула не превышала 1-2 раз в день, без примеси крови, температура тела лишь эпизодически превышала 37oC. К исходу второго месяца повторные исследования кала на наличие ооцист Isospora belli показали отсутствие возбудителя. В течение 3-го месяца в связи со значительным улучшением в состоянии проводилось профилактическое применение лекарственной формы GSSG 1 раз в неделю (в/м). Рецидивов заболевания не отмечено.
Результаты гематологического/биохимического обследования больного по завершении лечения приведены в таблице 29. Как можно видеть, уменьшились проявления гипопротеинемии, произошло существенное повышение числа лимфоцитов и их субпопуляций, что позволяет констатировать в итоге рестадирование СПИДа до 3В стадии по шкале WHO Staging System.
Также обращает внимание значительное нарастание содержания цитокинов в крови, при этом известно, что IL-2 и IFN-γ играют важную роль в защите макроорганизма от протозойных инфекций.
После проведенного курса лечения общее состояние больного значительно улучшилось, уменьшилась слабость, улучшился аппетит. Прибавка в весе составила около 30% от исходного при поступлении, индекс Карновского - 90 баллов. При физикальном осмотре состояние больного расценивалось как удовлетворительное. В ходе наблюдения за больным в течение 1.5 месяцев после выписки из стационара рецидивов диареи не отмечено.
Пример 13.
Стимуляция эндогенной продукции эритропоэтина и лечебный эффект у больного гипопластической анемией и панцитопенией.
Мужчина 37 лет наблюдается около года по поводу анемии неясного генеза, выраженность которой постепенно нарастает. В течение последних 10 месяцев постоянно беспокоят слабость, утомляемость, головокружения, частые носовые кровотечения, необычная подверженность респираторным инфекциям, трижды перенес пневмонию, при этом один раз - крупозную. Отмечает, что за год потерял около 10% своего обычного веса. Повторные амбулаторные курсы лечения пероральными и внутривенными препаратами железа, фолиевой кислоты, витаминами группы B, в том числе B12, - без эффекта. При поступлении в стационар состояние средней тяжести, одышка при умеренной физической нагрузке, отмечаются кровоподтеки на коже, отдельные петехиальные высыпания. В повторных анализах крови среднетяжелая/тяжелая нормоцитарная анемия (эритроциты 1.5 - 2.5•1012/л) с тенденцией к гипохромии (цветной показатель 0.7 - 0.9), анизо- и пойкилоцитоз, умеренная лейкопения, тромбоцитопения в пределах 50 - 80•109/л.
Активная инфузионная терапия препаратами железа, фолиевой кислоты, цианкобаламином, витаминами, преднизолоном, повторные переливания эритроцитарной массы - с незначительным улучшением.
По данным миелограммы (трепанобиопсия) клеточность костного мозга резко снижена, межбалочные пространства заполнены преимущественно жировой тканью. Как миелоидный, так и эритроидный ростки значительно угнетены, соотношение эритроидных и миелоидных клеток резко снижено. Мегакариоциты практически отсутствуют. Относительное повышение содержания недифференцированных и плазматических клеток, бластов. Запасы железа увеличены. Диагноз: гипопластическая анемия неясного генеза, панцитопения.
Результаты клинического анализа крови и уровень эритропоэтина к моменту начала применения лекарственной формы окисленного глутатиона (5 мг GSSG в 1 мл 0.003% перекиси водорода) приведены в таблице 30. Как можно видеть, лабораторные данные соответствуют картине гипопластической анемии, однако характерное для данного типа анемии нарастание уровня эритропоэтина крови отсутствует. Более того, уровень эритропоэтина оказался значительно снижен относительно нижней границы нормы (9.2 пкг/мл при норме 30 - 170 пкг/мл, что в международных единицах соответствует 3 - 17 mIU/мл).
Применение лекарственной формы окисленного глутатиона (5 мг GSSG в 1 мл 0.003% перекиси водорода) было начато с внутримышечных инъекций по 1 мг GSSG 2 раза в день в течение 3 дней. Далее дозы были увеличены до 5 мг - 2 раза в день в течение 7 дней. В анализах крови было отмечено уменьшение выраженности анемии. В дальнейшем, композиция применялась по 10 мг GSSG внутримышечно 1 раз в день в течение 10 дней, после чего на фоне отчетливой позитивной динамики картины красной крови было начато внутривенное применение композиции: по 10 мг GSSG 1 раз в три дня, в течение 30 дней. Сопутствующая терапия включала витамины и препараты железа перорально.
Результаты гематологического исследования и уровень эритропоэтина крови через 50 дней от начала лечения по заявляемому способу приведены в таблице 30. Как можно видеть, число клеток красной и белой крови существенно улучшилось, наросло число тромбоцитов, снизилась СОЭ, уровень эритропоэтина превысил верхнюю границу нормы. Клинически у больного исчезли слабость, головокружения, одышка. При осмотре петехиальные кровоизлияния и кровоподтеки не выявляются, эпизодов носовых кровотечений не отмечалось. Прибавка в весе за время лечения составила 5.5 кг (около 8% веса до болезни).
По данным повторного исследования костного мозга (трепанобиопсия по окончании лечения), миелоидная ткань занимает до 60% объема межбалочных пространств. В островках миелоидной ткани соотношение числа клеток эритроидного и миелоидного ростков превышает норму. Имеются элементы нормобластоидной гиперплазии, в скоплениях нормобластов обнаруживаются группы клеток с признаками мегалобластоидности. Встречаются тучные клетки. Мегакариоциты представлены в значительном количестве. Объем запасов железа несколько увеличен.
Это клиническое наблюдение указывает на четкий терапевтический эффект исследуемой лекарственной формы GSSG. Благодаря проведенному лечению ранее подавленная эндогенная продукция эритропоэтина была существенно усилена. В результате, гематологические параметры, фактически, восстановились, и разрешились клинические признаки анемии. Больной был выписан в удовлетворительном состоянии.
Пример 14.
Стимуляции эндогенной продукции цитокинов и лечебный эффект у больного раком желудка, осложненным канцероматозом брюшины, асцитом, спленомегалией и холестатическим гепатитом.
Мужчина 33 лет наблюдается более двух лет по поводу неоплазмы желудка (аденокарцинома умеренной степени дифференцировки). В 1993 году больной оперирован по поводу малигнизированной язвы желудка и был обнаружен конгломерат плотных узлов в воротах печени, расцененный как метастазы.
В январе 1994 года проводимая химиотерапия (5-FU) осложнилась тяжелым холестазом, по поводу которого произведено чрезкожное дренирование правого и левого печеночных протоков, а еще через 6 месяцев - холедохоеюностомия на сменных транспеченочных дренажах с брауновским анастомозом.
В ноябре 1995 года состояние ухудшилось. По данным обследования у больного - активный вторичный гепатит. Печень увеличена и болезненна, на 5-6 см выступает из-под края реберной дуги. Биохимические показатели крови патологически изменены, слабо поддаются коррекции проводимым лечением: гипербилирубинемия до 40,0 за счет непрямого билирубина (до 31,0); повышение активности трансаминаз в 6 раз; гипоальбуминемия - 26%; имеет место гипергаммаглобулинемия; гиперхолестеринемия - до 10,2 мкмоль/л.
При фиброгастродуоденоскопии (ноябрь 1995 г.) в средней трети тела желудка была обнаружена опухоль протяженностью 8 см. Опухоль плотная. Стенки желудка ригидные. Гистологически опухоль идентифицирована как аденокарцинома умеренной степени дифференцировки. В декабре 1995 года больному произведена эксплоративная лапаратомия. Обнаружен асцит с множественными высыпаниями по всей брюшине, спленомегалия. Случай признан неоперабельным.
Было принято решение использовать лекарственную форму GSSG в 0.1% растворе инозина. Препарат вводился парентерально (внутривенно и внутримышечно), и, дополнительно, использовалось локальное введение лекарственной формы посредством обкалывания опухоли через эндоскоп в трех точках. Средняя доза для внутривенного и внутримышечного введения 0,1 -0.5 мг/кг; при локальном введении до 50 мг местно. Парентеральное введение препарата 2 раза в сутки (утром внутривенно; вечером - внутримышечные инъекции), через день, в течение трех недель; затем два раза в неделю в течение 4 недель. Обкалывание через эндоскоп один раз в семь дней. Через 2 месяца после начала лечения используемой лекарственной формой картина фиброгастродуоденоскопии: пищевод проходим, слизистая розовая, розетка кардии смыкается не полностью. Натощак в желудке умеренное количество пенистого секрета, интенсивно окрашенного желчью, протяженность опухоли 5 см. Одновременно наблюдается существенное улучшение гематологических, биохимических показателей.
Через 4 месяца лечения: печень выступает из-под реберной дуги на 1 см; безболезненная при пальпации. По данным УЗИ - на месте определяемых ранее очаговых опухолевых изменений фиброзная ткань. Картина фиброгастродуоденоскопии (май 1996 г): пищевод не смыкается; в просвете желудка светлая мутная жидкость со слюной. Слизистая желудка розовая. Опухоль протяженностью 3,6 см. Стенки желудка эластичные. Двенадцатиперстная кишка свободно проходима.
По сравнению с обследованием до начала лечения с использованием вышеупомянутой лекарственной формы GSSG (ноябрь 1995) определяется уменьшение размеров опухоли на 55%. Одновременно отмечается убедительная положительная динамика печеночных проб, гематологических и иммунологических показателей (таблица 31).
Таким образом, в результате проведенного лечения по заявляемому способу наблюдается частичный регресс опухолевого процесса, с очевидными одновременными изменениями гематологических, биохимических и иммунологических параметров и существенным повышением качества жизни.
Пример 15.
Стимуляция эндогенной продукции цитокинов и лечебный эффект у больного раком кожи (карцинома Меркеля) и метастазами в местные лимфоузлы, и гемо-иммунодепрессией, вызванной химиотерапией.
Мужчина 64 лет наблюдается с августа 1995 года, когда появилось гиперемированное опухолевидное образование в левой окололопаточной области, безболезненное, постепенно увеличивающееся в размерах. По прошествии месяца процесс распространился на левую подмышечную область, увеличивался в размерах, стал болезненным. Появилась лихорадка (t= 38,9oС). Обследование (гистологическое и иммунологическое), проведенное в октябре 1995 года, уточнило диагноз - нейроэндокринная форма рака кожи (карцинома Меркеля) III стадии.
В декабре 1995 года проведен курс химиотерапии по схеме CMF (циклофосфан+метотрексат+фторурацил) без заметного лечебного эффекта. В то же время отмечается явное угнетение гемопоэза (лейкоциты 2,4•109/л) и одновременный рост шейных и надключичных лимфоузлов с локальной гиперемией кожи.
В январе - феврале 1996 года схема химиотерапии изменена: цисплатин+циклофосфамид (вместо CMF выполнен курс CP). На фоне проводимой химиотерапии осложнения: цитопения (лейкоцитов 1,4•109/л), кардиотоксичность в виде обострения ишемической болезни сердца. После 2-го курса химиотерапии - резкое прогрессирование опухоли: некроз в левой подмышечной области с образованием свища, нарастание инфильтрации мягких тканей в области левого плечевого сустава и левой подмышечной области; отек левой руки; интоксикация, стойкое повышение температуры (38,8oC). В связи с явным прогрессированием заболевания и отсутствием эффекта химиотерапии принято решение о проведении терапии лекарственной формой GSSG в 0,1% растворе цистамина, параллельно с курсом химиотерапии (схема CMF).
Через 10 ежедневных инъекций используемой формы препарата (внутривенно и внутримышечно, в дозе на одно введение 0,1 - 0.5 мг/кг) отмечаются следующие изменения в состоянии больного: улучшение качества жизни (хороший аппетит, подвижность); подсыхание изъязвленных участков; ликвидация гнойного отделяемого; рубцевание свища; уменьшение опухолевой массы на 30%; нормализация температуры тела; ограничение зон гиперемии; улучшение гематологических показателей.
Проведены 3-й и 4-й курсы химиотерапии (схема CMF) проводились с одновременным введением лекарственной формы GSSG (внутривенные и внутримышечные инъекции два раза в сутки в дозе 0.5 мг/кг внутривенно и 0,2 мг/кг внутримышечно). Парентеральное введение препарата 3 раза в неделю и один раз в неделю локальное обкалывание в двух точках около опухоли через эндоскоп: до 25 мг в каждую точку. Были получены следующие результаты: регресс опухолевого процесса; хорошая переносимость химиотерапии, исчезновение болевого синдрома; постоянное улучшение качества жизни, реставрация иммунитета и гемопоэза, повышение содержания в крови цитокинов и гемопоэтических факторов (таблица 32).
Через 2 месяца после лечения по заявляемому способу имеет место стабильный уровень эндогенной продукции цитокинов и гемопоэтических факторов; регресс левых шейных и надключичных лимфоузлов; регресс размеров опухоли по двум измерениям на 70% от исходных; положительная динамика иммунологических показателей; отсутствие угнетающего действия химиотерапии на кроветворение.
Проведенное клиническое наблюдение свидетельствует об очевидном лечебном эффекте заявляемого способа: на фоне существенной стимуляции эндогенной продукции цитокинов и гемопоэтических факторов выявлено уменьшение размеров опухоли; повышение качества жизни и благоприятные изменения гематологических, биохимических и иммунологических показателей.
Пример 16.
Лечебный эффект препаратов группы GSSG у больного тяжелой формой острого вирусного гепатита.
Мужчина 32 лет поступил в клинику инфекционных заболеваний с признаками нарушения пигментного обмена: темная моча; светлый кал; желтушность кожи и слизистых оболочек; высокое содержание уробилиногена. Состояние тяжелое: температура тела 38,8oС; астеновегетативный, гриппоподобный и артралгический синдромы. Печень увеличена более чем на 4-5 см. Был поставлен диагноз: острый вирусный гепатит. Окончательный диагноз: Острый вирусный гепатит "B". Тяжелая форма с острой печеночной недостаточностью.
Первый курс лечения препаратами группы GSSG включал внутривенные инъекции GSSG-Na2 в 0.1% растворе фолиевой кислоты один раз в день в дозе 0.1-0.5 мг/кг массы тела в течение 7-ми дней.
Второй курс лечения включал внутривенные инъекции GSSG-Zn в 0.1% растворе инозина один раз в день в течение 7-ми дней в дозе 0.1 мг/кг массы тела.
Третий курс лечения включал внутривенные инъекции GSSG-Na2 в 5% растворе аскорбиновой кислоты в течение 7- ми дней через день в дозе 0.1-0.5 мг/кг массы тела. Одновременно тот же состав вводился внутримышечно в той же дозировке один раз в день.
Данные в таблице 33 указывают на благоприятные изменения гематологических/иммунологических параметров, снижение (и/или нормализация) лабораторных маркеров гепатита. Таким образом, ликвидация патологического процесса и выздоровление больного имели место на 1.5-2 месяца ранее обычных сроков выздоровления при остром вирусном гепатите "B".
Пример 17.
Лечебный эффект препаратов группы GSSG у больного хроническим вирусным гепатитом в стадии обострения.
Женщина 56 лет была госпитализирована в клинику инфекционных болезней с жалобами на ухудшение самочувствия, слабость, утомляемость, раздражительность, анорексию, тошноту. Также наблюдались некоторые гастроинтестинальные симптомы, боли в области подреберья и повышение температуры до 38.5oC.
При осмотре: Общее состояние больной средней тяжести. При пальпации выявляется сплено- и гепатомегалия. Печень выступает на 3 см из-под края реберной дуги. Субиктеричность слизистых и склер.
УЗИ: печень заметно увеличена, портальная вена - 15 мм, стенки желчного пузыря утолщены, поджелудочная железа нормальной структуры, селезенка увеличена (578х168 мм) и утолщена. Почки без заметных структурных изменений.
В течение 2-х недель больная получала дезинтоксикационную и противовирусную терапию (Роферон-A, рекомбинантный α2- интерферон). Вследствие дальнейшей прогрессии заболевания и неэффективности проводимого лечения было принято решение о попытке применения препаратов семейства GSSG.
Внутривенные инъекции GSSG-Na2 в 10% растворе холин хлорида назначались в течение 7-ми дней (один раз в день в дозе 0.1-1.0 мг/кг массы тела).
Внутривенные инъекции бис-метионил-GSSG в 5% растворе аскорбиновой кислоты назначались в течение последующих 10-и дней (один раз в день в дозе 0.1-0.5 мг/кг массы тела). Одновременно внутримышечно вводился GSSG-Na2 в 0.1% растворе инозина в течение 10-и дней (один раз в день в дозе 0.1-0.5 мг/кг массы тела).
Состояние больной существенно улучшилось через месяц после вышеупомянутого лечения препаратами группы GSSG. Сохранялись жалобы только на слабость и утомляемость. Заметным было уменьшение болевого и диспептического синдромов, нормализовалась температура тела. Наблюдались благоприятные изменения в лабораторных показателях (см. таблицу 34). На УЗИ было выявлено сохранение степени сплено- и гепатомегалии.
Благодаря некоторому улучшению в состоянии больной, но с сохранением признаков альтерации печени, было принято решение провести еще один курс лечения с использованием препаратов группы GSSG. После второго курса полностью такой же терапии больная жалоб не предъявляла. Отсутствовали жалобы на боль и диспепсию. УЗИ показало уменьшение размеров селезенки и печени. При пальпации - печень на 1.5 см выступает из-под края реберной дуги. (Лабораторные данные - см. таблицу 34.)
Таким образом, использование комбинированной терапии с использованием препаратов группы GSSG обусловило заметный лечебный эффект, с улучшением состояния и качества жизни, стабилизацией и реверсией патологического процесса, благоприятными лабораторными изменениями.
Пример 18.
Лечебный эффект препаратов группы GSSG у больных с острым перитонитом.
1. Женщина 78 лет была госпитализирована с диагнозом ущемленной вентральной грыжи, острым сдавлением тонкого кишечника с некрозом и развитием токсической фазы острого перитонита. На операции около 800 мл мутного выпота с хлопьями и сгустками фибрина было найдено и удалено из брюшной полости. Ущемленная часть тонкой кишки была некротизирована. Была выполнена резекция части тонкого кишечника с формированием анастомоза. Через пищевод и желудок в тонкую кишку был заведен зонд и помещен в илеоцекальном углу. В послеоперационном периоде один раз в день проводилось удаление кишечного содержимого. После этого 150 мл 0.1% раствора фолиевой кислоты в диметилсульфоксиде (ДМСО), содержащее 10 мл 1% раствора динатриевой соли GSSG, вводилось в тонкую кишку. Одновременно 0.1% раствор фолиевой кислоты и 1% раствор динатриевой соли GSSG вводился внутривенно в дозе от 0.01 до 0.1 мг/кг массы тела один раз в день в течение 4-х дней.
Адекватная перистальтика восстановилась на 2-е сутки после операции. Зонд был удален на 8-е сутки. Больная была выписана из клиники на 19-е сутки.
2. Больной 16 лет был госпитализирован с диагнозом: Острая спаечная тонкокишечная непроходимость. Разлитой перитонит, токсичная фаза. При операции в брюшной полости до 600 мл мутного выпота с хлопьями и фибриновыми наложениями было выявлено и удалено из брюшной полости. Выраженный спаечный процесс. Произведено рассечение спаек. Через нос, пищевод, желудок в тонкую кишку до илеоцекального угла проведен зонд. В послеоперационном периоде после эвакуации кишечного содержимого один раз в сутки в тонкую кишку вводили по 150 мл 0.1% раствора фолиевой кислоты в диметилсульфоксиде (ДМСО), содержащем 10 мл 1% раствора натриевой соли GSSG. Одновременно внутривенно осуществлялось введение 0.1% раствора фолиевой кислоты и 1% раствора натриевой соли GSSG в дозе от 0,01 до 0,1 мг/кг; ежедневно, один раз в день, в течение 4-х дней.
Адекватная перистальтика восстановилась на 2 сутки; зонд удален на 8 сутки; больной выписан на 11 сутки.
Пример 19.
Лечебный эффект препаратов группы GSSG у больного раком простаты.
Больной 63 лет был госпитализирован в урологическое отделение с подозрением на рак простаты. При пальпации обнаруживалась увеличенная, плотная простата. При рентгенологическом обследовании грудной клетки были найдены метастазы в передние отделы 4-7 реберных костей, а также в кости черепа, позвоночник, тазовые и бедренные кости. Был поставлен диагноз: рак предстательной железы с множественными костными метастазами (T2N2M1).
Курсовое лечение длительностью 30 суток проводилось по следующей методике:
1. В течение 10 дней один раз в день внутривенно - GSSG-Zn в 1% растворе инозина в суточной дозе 0.01-0.5 мг/кг.
2. В последующие 10 дней эндолимфатически вводили S-тиоэтиламин-GSSG в суточной дозе 0.1-1.0 мг/кг один раз в день.
3. В последние 10 дней - через день внутримышечно - GSSG-Zn в 1% растворе инозина в суточной дозе 0.01 - 0.5 мг/кг.
После окончания курса лечения отмечается значительное улучшение общего состояния, уменьшение болей в области промежности, снижение учащенного мочеиспускания до 2-3 раз за ночь, уменьшение отеков нижних конечностей. При гематологическом исследовании отмечается положительная динамика ряда показателей (см. таблицу 35).
После выписки больной получал GSSG-Zn в 1% растворе инозина в суточной дозе 0.01 - 0.5 мг/кг внутримышечно два раза в неделю.
Более чем через год больной вновь поступил в урологическое отделение для обследования и проведения повторного курса терапии препаратами группы GSSG. Через 3 месяца после окончания второго курса лечения основными терапевтическими эффектами считалось следующее: повышение качества жизни; отсутствие отеков нижних конечностей; регресс увеличенных лимфоузлов; отсутствие дизурических явлений; уменьшение размеров предстательной железы; положительная рентгенологическая динамика (кальцификация отдельных метастазов в ребрах и позвоночнике); реставрация параметров системы иммунитета и гемопоэза.
Пример 20.
Лечебный эффект препаратов группы GSSG у больного раком поджелудочной железы.
В мае 1996 года больной 56 лет госпитализирован во II хирургическое отделение Центральной медико-санитарной части N 122. При поступлении состояние тяжелое. Жалобы на: постоянные острые боли в верхней половине живота опоясывающего характера, усиливающиеся при положении на спине; на потерю аппетита, тошноту, рвоту, метеоризм, послабление стула. Индекс Карновского - 40. Пальпаторно отмечается болезненность и напряжение мышц брюшного пресса в месте проекции поджелудочной железы (симптом Керте). Поджелудочная железа плотная, бугристая, увеличена в размерах. Печень плотная, выступает из-под реберной дуги на 4 см.
Ультразвуковое исследование (УЗИ): Поджелудочная железа увеличена в размерах (головка 7 см, тело 4 см, хвост 2.5 см) с нечеткими контурами, плотная. Вирсунгов проток расширен 0.7 см. Печень увеличена, толщина правой доли 18 см, левой доли 10 см. Нижний край закруглен. Контуры неровные, структура неоднородная, в паренхиме множественные гиперэхогенные образования (метастазы). Диагноз: Рак поджелудочной железы с метастазами в печень (T3N2M1).
Лечение: Детоксикационная терапия, ингибиторы протеаз, наркотические анальгетики.
В связи с тяжестью состояния пациента и отсутствием альтернативного лечения принято решение использовать препарат группы GSSG.
Схема лечения: ежедневно внутривенно утром и вечером в течение 10 дней цинковая соль GSSG (суточная доза 0.01-0.5 мг/кг). В течение последующих 10 дней эндолимфатически - цинковая соль GSSG в 7% димексиде (суточная доза 0.01-1.0 мг/кг) и внутривенное введение через день цинковой соли GSSG (суточная доза 0.01-0.5 мг/кг). В течение последующих 10 дней (третья декада) 2 раза в неделю внутривенно цинковая соль GSSG (суточная доза 0.01-0.5 мг/кг).
Через месяц лечения: состояние больного средней тяжести. Беспокоят незначительные периодичные боли в левом подреберье. Индекс Карновского - 60. Отменены наркотические анальгетики. Появился аппетит. Наметилась тенденция к нормализации показателей крови.
В течение 3-х недель после лечения в стационаре больной получал в/м один раз в неделю инъекции цинковой соли GSSG (суточная доза 0.01-0.5 мг/кг).
В июле 1996 года: больной поступил во II хирургическое отделение Центральной медико-санитарной части N 122 для обследования и проведения второго курса иммуномодулирующей терапии препаратами группы GSSG.
При обследовании отмечается выраженная положительная динамика клинической картины заболевания и показателей крови (см. таблицу 36). Состояние практически удовлетворительное. Жалобы на слабые периодично возникающие боли в левом подреберье. Индекс Карновского - 70. Пальпаторно слабая болезненность в месте проекции головки и тела поджелудочной железы, железа менее плотная, сглаженная.
При ультразвуковом исследовании: отмечается уменьшение размеров поджелудочной железы (головка 6.3 см, тело 3.2 см, хвост 2.1 см). Вирсунгов проток 0.4 см. Печень увеличена, правая доля 16.5 см, левая доля 9.5 см. Контуры неровные, структура неоднородная. В воротах печени фиброз. В паренхиме множественные гиперэхогенные тени.
Схема лечения на повторный курс терапии препаратами группы GSSG: в течение 10 дней ежедневно через катетер в печеночную артерию вводился S-тиоэтиламин-GSSG (суточная доза 0.1-1.0 мг/кг).
В последующие 10 дней ежедневно внутривенно цинковая соль GSSG (суточная доза 0.01-0.5 мг/кг). После выписки больной получал поддерживающую иммунотерапию цинковой солью GSSG однократно в неделю (суточная доза 0.01-0.5 мг/кг) в течение 1 месяца.
В сентябре 1996 г. больной госпитализирован в Центральную медико-санитарную часть N 122 для проведения третьего курса иммунотерапии. Клиническая картина без изменений. Картина периферической крови - см. таблицу 36.
На УЗИ: поджелудочная железа тех же размеров и структуры, как и при предыдущем исследовании. Печень незначительно увеличена, правая доля 15 см, левая 8 см, нижний край округлен, контуры четкие, ровные, паренхима неоднородная за счет гипо- и гиперэхогенных образований (участки фиброза и кальцификаты).
Таким образом, лечебные эффекты препаратов GSSG оценены как существенные: повышение качества жизни; стабилизация опухолевого процесса; регресс метастатических очагов; реставрация параметров системы иммунитета и гемопоэза.
Пример 21.
Лечебный эффект препаратов группы GSSG у больной сахарным диабетом.
Больная 18 лет в марте 1992 года была госпитализирована в эндокринологическое отделение больницы N 16. Диагноз: Сахарный диабет. Инсулинозависимый тип - тип 1. Тяжелая форма инсулинорезистентности, диабетическая ангиоретинопатия IV степени, начальные проявления диабетической полиневропатии. Больна с 14 лет. Заболевание началось с прекоматозного состояния, уровень сахара в крови колебался от 18,4 до 28,0 ммоль/л, кетонурия (ацетон) и глюкозурия до 12%. Доза инсулина в начале заболевания: СУ-инсулин 68 ЕД, ИЦС 269 ед. Ранее неоднократно находилась на стационарном лечении. Доза инсулина с 1994 по 1996 гг. достигала 500 ЕД. При этом сахар в крови был в пределах 19,6-24,3 ммоль/л, глюкозурия - 4-6%, наличие кетонов в моче.
В сентябре 1996 г. больная госпитализирована с курсом лечения: доза ИЦС-инсулин 500 ЕД, инсулин ИЦС-А 100 ЕД, СУ- инсулин 50 ЕД. Доза инсулина при поступлении: В-инсулин 480 ЕД, СУ-инсулин 22 ЕД.
Содержание сахара в крови:
в 9.00 11.4 ммоль/л;
в 12.00 11.1 ммоль/л;
в 14.00 13.9 ммоль/л;
в 17.00 16.7 ммоль/л;
в 6.00 10.7 ммоль/л.
Глюкозурия до 670 ммоль, реакция на ацетон +++.
В связи с тяжелой формой инсулинорезистентности принято решение об использовании препаратов группы GSSG.
Схема лечения: внутривенное введение в течение 10 дней один раз в день GSSG-Na2 (натриевая соль) в 0.5% растворе липоевой кислоты (суточная доза 0.01-0.5 мг/кг).
В течение следующих 10 дней, внутривенно один раз в два дня цинковая соль GSSG в 0.5% растворе липоевой кислоты (суточная доза 0.01-0.5 мг/кг).
В течение следующих 10 дней (третья декада) лечения внутримышечные инъекции натриевой соли GSSG в 5% растворе аскорбиновой кислоты один раз в день в течение 20 дней (суточная доза 0.1-0.5 мг/кг).
Наряду с проводимой терапией препаратами группы GSSG изменено лечение инсулином. Был назначен СУ-инсулин в нескольких инъекциях в течение суток, а пролонгированный инсулин отменен.
На фоне лечения доза инсулина постепенно уменьшена, из стационара больная выписана на следующих дозах инсулина:
в 6.00 - СУ-инсулина-4ЕД;
в 9.00 - 50 ЕД;
в 14.00 - 36 ЕД
в 19.00 - 36 ЕД;
в 23.00 - 8 ЕД (общая доза 134 ЕД).
Сахар в крови нормализовался и не превышает 8 ммоль/л после еды. С момента выписки из стационара больная получала иммунотерапию препаратами группы GSSG амбулаторно в течение месяца.
Схема лечения:
В течение одного месяца через день внутримышечные инъекции натриевой соли GSSG в 0.5% растворе липоевой кислоты (суточная доза 0.01-0.5 мг/кг).
В течение 2 последовательных месяцев лечения данным препаратом у больной 2 развивалась гипогликемия - 1.8-2.2 ммоль/л, что вынудило снизить дозы инсулина. Через 2 месяца лечения использовалась следующая схема введения инсулина:
в 6.00 - СУ-инсулина-4 ЕД;
в 9.00 - 36 ЕД;
в 14.00 - 12 ЕД
в 19.00 - 12 ЕД;
в 23.00 - 4 ЕД (общая доза 68 ЕД).
Через 2 месяца комбинированной терапии, в которой препараты группы GSSG применялись в качестве сопроводительной терапии - состояние больной удовлетворительное, жалоб нет. Динамика показателей крови приведена в таблице 37. Таким образом, получены следующие клинические эффекты: ликвидация инсулинорезистентности; снижение дозы инсулина; улучшение качества жизни и стабилизация уровня сахара в крови.
Пример 22.
Лечебный эффект препаратов группы GSSG у больного раком легких.
Диагноз: Рак верхней доли правого легкого (T3N2M0) с прорастанием верхней полой вены и легочной артерии. Метастазы в лимфоузлы средостения.
В сентябре 1995 года больной 59 лет поступил в хирургическое отделение Института Пульмонологии Министерства Здравоохранения РФ с подозрением на новообразование легких. На момент поступления в клинику жалобы на периодическое повышение температуры тела до 38.4oC, снижение аппетита, похудание на 8 кг, одышку при движении.
На серии компьютерных томограмм грудной полости от 29.08.96 г. правое легкое уменьшено в объеме за счет гиповентиляции верхней доли. Легочный рисунок правого легкого неоднороден. Верхнедолевой бронх справа сужен, деформирован, выявляется очаг размерами 4.0х5.0х6.0 см. Нельзя исключить наличие увеличенных парамедиастинальных лимфоузлов справа. Жидкости в плевральных полостях нет.
При бронхоскопии: определяется лимфангоит боковой стенки нижней трети трахеи, инфильтрация и лимфангоит боковой стенки правого главного бронха, инфильтративно-компрессионный стеноз верхнедолевого бронха справа (боковая стенка) 1-2 степени.
При диагностической торакотомии (14.09.95 г.): в области верхней доли правого легкого было выявлено бугристое образование плотной консистенции размерами 4.0х5.0х6.0 см, врастающее в париетальную плевру у верхушки легкого. При ревизии корня легкого, после вскрытия перикарда, обнаружено прорастание верхней полой вены и легочной артерии. Гистологически новообразование идентифицировано как низкодифференцированная (мелкоклеточная) карцинома. Случай признан неоперабельным.
Состояние больного продолжает ухудшаться: появляется увеличенный правый надключичный лимфоузел (3.5х4.0 см). Больной переводится в Институт Онкологии для проведения химиотерапии. После проведения первого курса химиотерапии по схеме VP-P (цисплатин, этопозид) состояние пациента существенно ухудшилось: рвота, тошнота, алопеция, гипертрансаминаземия, гиперкреатининемия, лейкопения.
В связи с тяжестью состояния пациента и отсутствием альтернативного лечения принято решение о проведении терапии препаратом литиевой соли GSSG (Li-GSSG).
На фоне терапии GSSG-Li (суточная доза 0.01-0.5 мг/кг внутривенно и внутримышечно через день в течение 14 дней), качество жизни существенно улучшилось (индекс Карновского 80 (60)), появился аппетит, несколько уменьшилась одышка.
В течение двух недель применения литиевой соли GSSG в 0.003% растворе H2O2 существенно улучшились показатели крови (лейкоциты, красная кровь, креатинин, трансаминазы), что позволило провести повторный курс химиотерапии (VP-P). В отличие от первого курса химиотерапии, на фоне приема GSSG-Li второй курс цитостатической химиотерапии больной перенес без осложнений: не было тошноты и рвоты, появился аппетит (прибавил в весе 5 кг); общие клинические и биохимические показатели крови - в пределах нормы.
После второго курса химиотерапии лечение препаратами группы GSSG было возобновлено: литиевая соль GSSG в 3% диметилсульфоксиде (DMSO) (суточная доза 0.01-0.5 мг/кг, внутривенно и внутримышечно 3 раза в неделю в течение 14 дней).
Следующий этап лечения включал курс химиотерапии плюс GSSG- Li в Институте Онкологии. После 3 курса химиотерапии осложнений нет. Показатели крови в пределах нормы. Отмечается полный регресс увеличенного правого надключичного лимфоузла и положительная рентгенологическая динамика первичного очага: отсутствуют признаки ателектаза, дополнительных теней средостения и паратрахеально нет, трахея расположена правильно, остаточная полость исчезла.
Таким образом, два курса химиотерапии (схема VP-P) в сочетании с препаратами группы GSSG (литиевая соль GSSG) обеспечили: удовлетворительное качество жизни, системный регресс опухолевого процесса, реставрацию лабораторных параметров, что было связано со стабильным повышением эндогенной продукции цитокинов и гемопоэтических факторов (см. таблицу 38). Позднее больной получал GSSG-Li в диапазоне доз 0.01-0.5 мг/кг, через день, в течение 14 дней.
Через год (14.10.96):
На томографии грудной клетки участок фиброзных изменений в правом верхнедолевом бронхе 1.5х1.5х2.0 см. В легочной ткани отсутствуют новые участки инфильтративных или фиброзных изменений. Просветы трахеи и бронхов в обоих легких не сужены и не деформированы. Отсутствует увеличение лимфоузлов средостения и корней легких. Выпота в плевральных полостях нет.
ЗАКЛЮЧЕНИЕ:
Сочетанное применение химиотерапии и GSSG-Li значительно потенцировало химиотерапевтическое воздействие с приемлемой переносимостью химиотерапии. В целом, комбинированная терапия привела к регрессу опухоли, ликвидации метастазов, восстановлению систем иммунитета и гематопоэза, улучшению качества жизни.
Пример 23.
Лечебный эффект препаратов группы GSSG у больной раком сигмовидной кишки.
Диагноз: Рак (низкодифференцированная аденокарцинома) ректо-сигмоидного отдела толстой кишки (T4N0M0), осложненный правосторонним аднекстумором, правосторонним тубоовариальным абсцессом; разлитым флегмонозно-гнойным перитонитом.
В июне 1996 года по скорой помощи поступила во II хирургическое отделение Центральной медико-санитарной части N 122 больная 48 лет с вышеизложенным диагнозом.
Произведена операция - петлевая сигмостома, санация и дренирование брюшной полости. Состояние больной тяжелое: индекс Карновского 30, лихорадка 39-40oC. Несмотря на комплексную консервативную терапию, клиническое состояние ухудшалось и осложнилось двухсторонней пневмонией. Подключение мощной антибиотикотерапии (антибиотики цефалоспоринового и пенициллинового рядов - клафоран - суточная доза 6 г, ампиокс - суточная доза 2 г) не обеспечивала желаемой положительной динамики.
В связи с неэффективностью проводимой терапии принято решение использовать препараты группы GSSG (GSSG-Zn2).
Больной в течение недели на фоне комплексной терапии проводилось лечение GSSG-Zn2 в 0.1% растворе цистамина (суточная доза 0.01-0.5 мг/кг внутривенно и внутримышечно в течение 7 дней). Через неделю лечения: клиническая картина существенно улучшилась, появился аппетит, исчезла слабость, нормализовался сон, репарация раны местно улучшилась. Наметилась тенденция к нормализации показателей крови (см. таблицу 39), рентгенологические признаки пневмонии не выявлены.
Достигнутые положительные эффекты позволили выполнить второй этап оперативного лечения: произведена реляпаротомия с резекцией ректо-сигмоидного отдела толстой кишки и правого придатка матки с яичником. Послеоперационный период охарактеризовался развитием правосторонней нижнедолевой плевропневмонии. Вновь к комплексному лечению подключен GSSG-Zn2 в 0.1% растворе цистамина (суточная доза 0.01-0.5 мг/кг ежедневно внутримышечно и внутривенно в течение недели). Клинические и рентгенологические признаки пневмонии купированы в течение 3-х дней.
Со стороны послеоперационной раны осложнений не отмечено. Швы сняты на седьмые сутки. Больная выписана в удовлетворительном состоянии под наблюдение врачей по месту жительства.
Результаты применения препаратов группы GSSG свидетельствуют об: улучшении качества жизни; потенцировании действия антибактериальной терапии;
реставрации клеточного и гуморального иммунитета; восстановлении лабораторных показателей; ускорении заживления раны; возможности проведения радикального хирургического лечения.
Пример 24.
Лечебный эффект препаратов группы GSSG у больного раком двенадцатиперстной кишки и поджелудочной железы.
Диагноз: Рак поджелудочной железы с прорастанием 12-перстной кишки (T3N2M1).
В январе 1996 года больной 67 лет поступил во II хирургическое отделение Центральной медико-санитарной части N 122 с наличием механической желтухи. Диагноз: Инфильтративная структура холедоха. Произведена операция: чрезкожно-чрезпеченочное наружно-внутреннее дренирование.
В феврале 1996 г. - холецистоэктомия, холедоходуаденоанастомоз по Юрашу. Больного беспокоят сильные боли в левом подреберье с иррадиацией в спину, в связи с чем назначены наркотические анальгетики. Отсутствует аппетит. Потеря массы тела за месяц составила 13 кг. Индекс Карновского - 40. Периодическая рвота, тошнота, стеаторея. Содержание амилазы и липазы в сыворотке крови повышено, диастазурия, анемия. Над проекцией головки поджелудочной железы пальпируется бугристое образование. При фиброгастродуоденоскопии: определяется инфильтрация слизистой 12-перстной кишки до области фатерова соска.
В связи с тяжестью состояния пациента, прогрессирующего ухудшения течения заболевания и отсутствием альтернативного лечения принято решение о применении препаратов группы GSSG, в частности GSSG-Zn2 в диметилсульфоксиде (ДМСО).
Через 2 недели лечения состояние больного явно улучшилось. Индекс Карновского - 80. Выраженность болевого синдрома уменьшилась, хотя больной испытывал периодические боли умеренной интенсивности. Отменены наркотические анальгетики. Рвоты, тошноты - нет. Прибавил в весе на 4 кг. Нормализовались показатели крови (таблица 40).
Клиническое улучшение позволило провести сочетанную высокодозную химиотерапию (5-фторурацил - 10 г на курс) и терапию препаратом GSSG-Zn2. В течение 3-х дней больной получал эндолимфатически 5-фторурацил (1 день - 3 г, 2 день - 3 г, 3 день - 4 г) и высокие дозы препарата GSSG- Zn2 в ДМСО (суточная доза 0.1-1.0 мг/кг).
Проведенное лечение пациент перенес без формирования синдрома цитопении (показатели крови - см. таблицу 40). В течение 3-х последовательных месяцев (февраль - апрель) больной получал поддерживающие дозы GSSG-Zn2 в ДМСО (суточная доза 0.01- 0.3 мг/кг внутривенно и внутримышечно 2 раза в неделю). Состояние больного хорошее. Индекс Карновского 90. Отсутствуют боли. Аппетит хороший. Прибавил в весе на 8 кг.
Через 3 месяца (май, 1996 г.): в течение 3-х дней больному проведен повторный курс высокодозной химиотерапии в сочетании с GSSG-Zn2 (общая доза 5-фторурацила 10 г, GSSG-Zn2 - суточная доза 0.1-1.0 мг/кг). Осложнений не было. Пациент выписан в удовлетворительном состоянии для амбулаторного наблюдения. Лечение препаратом GSSG-Zn2 проводилось в течение 3-х последовательных месяцев (суточная доза 0.01- 0.5 мг/кг внутривенно и внутримышечно 2 раза в неделю).
Через 6 месяцев (сентябрь, 1996 г.): проведен 3 курс высокодозной химио- и иммунотерапии в том же объеме, без осложнений. Состояние больного удовлетворительное. Индекс Карновского 90. Аппетит хороший. Рвота, тошнота не наблюдались. От начала лечения прибавил в весе на 12 кг. При ФГДС - существенное снижение инфильтрации слизистой 12-перстной кишки с признаками стабилизации опухолевого процесса.
Таким образом, могут быть выделены следующие результаты комбинированного применения GSSG-Zn2 и химиотерапии: улучшение качества жизни; отсутствие болевого синдрома; положительная динамика лабораторных показателей; стабилизация опухолевого процесса; хорошая переносимость химиотерапии.
Пример 25.
Лечебный эффект препаратов группы GSSG у больного с тяжелыми послеоперационными осложнениями.
Диагноз: Постинтубационный рубцовый стеноз трахеи, трахеопищеводный свищ, послеоперационная эмпиема плевральной полости справа.
Пациент 22 лет поступил на отделение хирургии Государственного Научного Центра Пульмонологии Министерства здравоохранения Российской Федерации в марте 1996 года после установки линейного стента трахеи. После его извлечения отмечено рецидивирование стеноза трахеи и появление признаков трахеопищеводного свища. Учитывая изложенное, в апреле 1996 года выполнена операция: циркулярная резекция трахеи, разобщение трахеопищеводного свища, оментопластика.
В послеоперационном периоде отмечено развитие правосторонней эмпиемы плевры. Несмотря на массированную антибиотикотерапию, детоксикационную терапию, дренирование плевральной полости - состояние больного тяжелое. Больной бледен. Пульс 120 ударов в минуту, ритмичный. Артериальное давление 90/50 мм ртутного столба. Частота дыхания 28 в минуту. Малейшая физическая нагрузка приводит к одышке, температура 38.8-39.6oC.
На рентгенограмме грудной клетки: выявляется снижение прозрачности всего левого легкого поля за счет диффузной инфильтрации (отеком). Паракостально в латеральных отделах вдоль грудной стенки и в задних отделах в междолевых щелях - значительное количество жидкости. Расширена срединная тень в верхних отделах.
В крови выраженный лейкоцитоз (30•109/л), нейтрофилия, ускоренное СОЭ - 58 мм/ч, гипертрансаминаземия (см. таблицу 41).
В связи с тяжестью состояния, дыхательной недостаточностью и отсутствием какой-либо альтернативной терапии принято решение о проведении терапии препаратом литиевой соли GSSG (GSSG-Li2) в составе комплексной терапии.
На фоне терапии GSSG-Li2 (в суточной дозе 0.01-0.5 мг/кг) наметился определенный положительный эффект - уменьшение признаков интоксикации (снижение температуры до 37,3oC), пульс 88 ударов в минуту, купирование дыхательной недостаточности. Достигнутый положительный эффект стабилизирован благодаря последующим введениям препарата (суточная доза 0.01-0.5 мг/кг, ежедневно, внутривенно в течение 5 дней).
Через неделю комплексного лечения препаратом GSSG-Li2 (в суточной дозе 0.01-0.5 мг/кг) и антибиотиками (клафоран в суточной дозе 6 г, ампиокс в суточной дозе 2 г) состояние больного удовлетворительное. Жалоб нет. Пульс 80 ударов в минуту, АД 115/70 мм ртутного столба. Дыхание несколько ослаблено справа, выслушивается во всех отделах.
Рубцы после операции без признаков воспаления. Гранулирующая рана в области задней торакотомии без отделяемого. При бронхоскопии - анастомоз широкий без признаков грануляции. На рентгенограмме грудной клетки - без патологических изменений.
Через месяц лечения GSSG-Liz (в суточной дозе 0.01-0.5 мг/кг, через день, внутривенно и внутримышечно в течение 3-х недель): состояние больного удовлетворительное. Показатели крови в пределах нормы (см. таблицу 41).
Лечебный эффект: регресс гнойного процесса; потенцирование эффекта антибактериальной терапии; обеспечение детоксикационного эффекта; восстановление лабораторных параметров периферической крови.
Пример 26.
Лечебный эффект препаратов группы GSSG у больных рассеянным склерозом.
Обследованы 19 больных с цереброспинальной формой рассеянного склероза (PC) в возрасте от 23 до 52 лет (таблица 42) с целью проведения терапии препаратами группы GSSG. Все больные поступили в стационар в периоде обострения заболевания. Диагноз верифицирован на основании рекомендаций Международной ассоциации по изучению рассеянного склероза (1992). По характеру течения преобладали больные с тяжелой формой прогредиентно-рецидивирующего течения. У 5 больных длительность обострения составила один месяц, у 7 - от одного до трех месяцев, у 7 - свыше трех месяцев.
Проведен 90-дневный курс лечения по следующей схеме:
1. GSSG-Na в 10% растворе S-аденозил-метионина в/в, 1 раз в день в течение 10 дней, суточная доза-0.01-0.5 мг/кг.
2. Двухнедельный перерыв.
3. GSSG-Zn в 10% растворе S-аденозил-метионина в/в, через день в течение 20 дней, суточная доза - 0.01-0.5 мг/кг.
4. Двухнедельный перерыв.
5. Бис-метионил-GSSG в 5% растворе аскорбиновой кислоты (витамин C) в/в и в/м, чередуя пути введения (один из них - 1 день), суточная доза - 0.01-0.5 мг/кг в течение 30 дней.
Обследование пациентов осуществляли до лечения, через месяц, через 3 и через 6 месяцев лечения. В периферической крови определяли: содержание CD3+, CD4+, CD8+, CD20+ - субпопуляций лимфоцитов иммунофлуоресцентным методом с использованием наборов моноклональных антител, подсчитывали соотношение CD4+/CD8+ (таблица 43). Состояние клеточного иммунитета оценивали с помощью реакции торможения адгезии лейкоцитов в присутствии нейроспецифических антигенов: белка S-100, антигена нейрональных мембран и основного белка миелина (таблица 44). Контрольную группу составили 25 доноров крови и больных с корешковыми синдромами.
Исходное состояние иммунной системы характеризовалось уменьшением общего количества CD3+, достоверным снижением уровня CD4+, увеличением уровня CD8+, дисбалансом между субпопуляциями хелперных и супрессорных клеток, повышением содержания CD20+ субпопуляции лимфоцитов.
После проведенного лечения у больных наблюдалась положительная динамика в отношении показателей клеточного иммунитета, что выражалось в нормализации содержания CD3+, CD4+ клеток, и CD8+ (Т-супрессорные) клеток. При этом наблюдался факт снижения процента сенсибилизации лимфоцитов к одному или нескольким нейроспецифическим антигенам. Отмечен описанный в литературе феномен иммунологической инверсии содержания белка S-100 и основного белка миелина (таблица 44).
Реставрация иммунной системы сопровождалась регрессом неврологической симптоматики у 84% больных.
В сыворотке крови и ликворе больных определяли эндогенное содержание ИНФ-α, ИФН-α, и TNF (таблица 45). Обращает внимание повышение ИНФ-γ в процессе лечения пациентов. При обследовании пациентов величина ТНФ. коррелировала со степенью неврологического дефицита, оцениваемого по шкале Куртцке.
Проведено определение состояния гуморальной системы иммунитета по следующим параметрам: подсчет В-лимфоцитов по методу определения поверхностных иммуноглобулинов в тесте иммунофлюоресценсии, определение уровня иммуноглобулина A, M и G методом радикальной иммунодиффузии в геле и циркулирующих иммунных комплексов (ЦИК), осажденных на полиэтиленгликоле (таблица 46). У всех больных перед лечением выявлено достоверное увеличение уровня ЦИК и IgM, снижение уровня IgG. Уровень IgG при этом был достоверно и значительно ниже показателей группы контроля.
У всех больных в процессе лечения препаратами группы GSSG наступило улучшение неврологической симптоматики, уменьшился индекс способности к передвижению по Гаузеру, повысилось качество жизни.
Хотя были описаны многие конкретные воплощения идеи изобретения, существуют возможности для множества модификаций. Например, непосредственно к GSSG или к его комбинациям с пролонгаторами либо с усилителями/модуляторами могут быть добавлены иные ингредиенты, не изменяющие действие GSSG, его производных, и/или как его пролонгаторов, так и усилителей/модуляторов, с целью введения в организм. Лекарственные формы могут помещаться в набор вместе со шприцом или аппликатором любого типа. Предпочтительно, чтобы к любому набору, включая лекарственную форму, прилагалась инструкция по применению при определенных заболеваниях. Ниже мы указали предпочтительное применение для GSSG и/или его производных как без, так и в присутствии пролонгаторов и усилителей/модуляторов в дозах от 0,01 до 0,5 мг основания GSSG на кг массы тела для GSSG и его солей (от 0,01 до 1,0 мг на кг массы тела для производных GSSG) в течение одного или более дней посредством внутривенного, внутримышечного, эндолимфатического, накожного или внутриполостного введения курсом длительностью до 6 месяцев, что показало свою эффективность при указанных ниже заболеваниях.
Может осуществляться профилактическое и терапевтическое использование методов и лекарственных средств настоящего изобретения при иммунодефицитных состояниях, возникших вследствие радиационного или химического поражения при авариях, например, при ядерных катастрофах.
Там, где упоминались разнообразные пролонгаторы и разнообразные усилители/модуляторы, могут также использоваться иные конкретные пролонгаторы, которые удлиняют полу-жизнь окисленного глутатиона или/и иные конкретные усилители/модуляторы, которые благоприятно влияют на эффекты GSSG/производных. В некоторых случаях, может использоваться комбинация как одного или более различных пролонгаторов, так и одного или более различных усилителей/модуляторов.
Хотя препарат для парентерального введения находится предпочтительно в виде раствора, в некоторых случаях могут использоваться коллоидные суспензии и им подобное. Аналогичным образом, местное применение может включать использование фармацевтически приемлемых мазей, кремов и иных основ, например, вазелиновых основ, которые не взаимодействуют с GSSG/производными, а также как с пролонгаторами, так и с усилителями/модуляторами. Такие материалы известны в данном виде техники (вазелин, ланолин, спермацет с добавлением, в частности, ацетилсалициловой кислоты).
Инфекционные и иммунопатологические болезни.
Примечание: все дозы, указанные в данной главе, приведены по GSSG и его солям для "основания GSSG". Поскольку концепция "основания GSSG" не является полностью корректной для производных GSSG, то, в целом, правильно будет определить соответствующие величины дозировок для производных в интервале от подобного нижней границе для GSSG и до уровня, который в два-три раза превосходит верхнюю границу для GSSG и его солей.
СПИД: величина дозировки - от 5 до 30 мг в день; полный курс - длительность 6 месяцев, с 2-недельными перерывами после каждого месяца.
- Режим введения на первой неделе - по одной инъекции в день, перемежающаяся схема: один день - внутривенное введение, через день - внутримышечное введение;
- На второй неделе - дважды в день: один раз внутривенно (утром), второй раз - внутримышечно (вечером);
- На третьей и четвертой неделях - три раза в неделю: 1-й раз - внутривенная инъекция, 2-й и 3-й раз - внутримышечная инъекция.
В случае энцефалопатии рекомендуются интралюмбальные инъекции препарата один раз в неделю в течение трех недель.
Гепатит: величина дозировки - от 5 до 10 мг в день; полный курс - длительность от 1 до 2 месяцев.
- В течение первых трех недель: по одной инъекции ежедневно, перемежающаяся схема: один день - внутривенное введение, через день - внутримышечное введение;
- Затем - по две или три инъекции в неделю, 1-й раз - внутривенное введение, 2-й и 3-й раз - внутримышечное введение.
Герпес: курс применения препарата совпадает с курсом при гепатите.
Туберкулез: Неактивная фаза: величина дозировки - от 5 до 10 мг в день; полный курс - длительность 6 месяцев, с 2-недельными перерывами после каждого месяца и 1 месяцем перерыва после 3-х месяцев применения препарата в качестве иммунологического сопровождения антибиотикотерапии.
- В течение 1-х трех недель - по одной инъекции ежедневно, перемежающаяся схема: один день - внутривенное введение, через день - внутримышечное введение;
- В течение 4-й недели - по две или три инъекции в неделю, 1-й раз - внутривенное введение, 2-й и 3-й раз - внутримышечное введение.
Активная фаза: величина дозировки - от 5 до 10 мг в день; полный курс - длительность 6 месяцев, схема введения в активной фазе такая же, как и в неактивной фазе.
Менингит: величина дозировки - от 5 до 90 мг в день; полный курс - длительность 2 месяца:
- В течение 1-х двух недель - одна инъекция внутривенно (утром), вторая - внутримышечно (вечером);
- Затем - по две или три инъекции в неделю, 1-й раз - внутривенное введение, 2-й и 3-й раз - внутримышечное введение.
Рекомендуются интралюмбальные инъекции препарата - один раз в день в течение трех дней.
Перитонит: курс применения препарата - как в случае менингита (кроме интралюмбального введения).
Сепсис: величина дозировки - от 5 до 60 мг в день; полный курс - не менее чем 1 месяц, до полной нормализации клинического состояния и показателей крови:
- В течение 1-х двух или трех недель - дважды в день: одна инъекция внутривенно (утром), вторая - внутримышечно (вечером);
- Затем - по две или три инъекции в неделю, 1-й раз - внутривенное введение, 2-й и 3-й раз - внутримышечное введение.
Гнойные послеоперационные инфекционные осложнения: курс применения препарата - как в случае сепсиса.
Иммунодепрессия: величина дозировки - от 5 до 20 мг в день; полный курс - длительность 6 месяцев, с 2-недельными перерывами после каждого месяца.
- В течение 1-х трех недель - по одной инъекции ежедневно, перемежающаяся схема: один день - внутривенное введение, через день - внутримышечное введение;
- В течение 4-й недели - по две или три инъекции в неделю, 1-й раз - внутривенное введение, 2-й и 3-й раз - внутримышечное введение.
Иммунодефициты инфекционного, радиационного или токсического (химического) происхождения: величина дозировки - от 5 до 30 мг в день; курс применения препарата - как в случае иммунодепрессии.
Рассеянный склероз: величина дозировки - от 5 до 20 мг в день; полный курс - длительность 3 месяца, с 2-недельными перерывами после каждого месяца; после 6 месячного перерыва - повторение полного курса.
- В течение 1-го месяца полного курса - по одной инъекции ежедневно, перемежающаяся схема: один день - внутривенное введение, через день - внутримышечное введение;
- В течение 2-го месяца полного курса - по три инъекции в неделю, 1-й раз - внутривенное введение, 2-й и 3-й раз - внутримышечное введение;
- В течение 3-го месяца полного курса - по две внутримышечные инъекции в неделю, дозировка о 5 до 10 мг.
Нейродегенеративные заболевания: курс применения препарата - как в случае рассеянного склероза.
Болезнь Альцгеймера: курс применения препарата - как в случае рассеянного склероза.
Амиотрофический боковой склероз: курс применения препарата - как в случае рассеянного склероза.
Гломерулонефрит: величина дозировки - от 5 до 30 мг в день; полный курс - длительность от 1 до 3-х месяцев, с 2-недельными перерывами после каждого месяца:
- В течение 1-х двух недель - по одной инъекции ежедневно, перемежающаяся схема: один день - внутривенное введение, через день - внутримышечное введение;
- Затем - по две или три инъекции в неделю, 1-й раз - внутривенное введение, 2-й и 3-й раз - внутримышечное введение.
Коллагенозы: курс применения препарата - как в случае гломерулонефрита.
Ревматоидный артрит: курс применения препарата - как в случае гломерулонефрита.
Системная красная волчанка: курс применения препарата - как в случае гломерулонефрита.
Аллергические заболевания: курс применения препарата - как в случае гломерулонефрита, вместе с местным применением мазей (1-3% содержания активного вещества) - в течение 2-х недель, по одной аппликации в день, затем - по 2 аппликации в неделю.
Псориаз: курс применения препарата - как в случае гломерулонефрита, вместе с местным применением мазей (1-3% содержания активного вещества) - в течение 2-х недель, по одной аппликации в день, затем - по 2 аппликации в неделю.
Новообразования: величина дозировки - от 5 до 90 мг в день; полный курс - длительность от 1 до 6 месяцев, с 2-4-недельными перерывами после каждого месяца.
- по одной инъекции в день, перемежающаяся схема: один день - внутривенное введение, через день - внутримышечное введение; как самостоятельно, так и в сочетании с эндолимфатическим введением (величина дозировки - 30-90 мг в день) в течение 10 дней, и локальное применение (региональная перфузия) с помощью катетеризации (величина дозировки - 30-90 мг в день) в течение 7 дней, три или четыре аппликации в неделю;
- рекомендуется лечебная схема совместно с полихимиотерапией.
Метастатические процессы и гемобластозы: величина дозировки - от 5 до 90 мг в день; полный курс - длительность от 1 до 6 месяцев, с 2-4-недельными перерывами после каждого месяца.
- по одной инъекции в день, перемежающаяся схема: один день - внутривенное введение, через день - внутримышечное введение; в сочетании с локальным применением (региональная перфузия) с помощью катетеризации (величина дозировки - 30-90 мг в день) в течение 7 дней, три или четыре аппликации в неделю.
Лимфопролиферативные заболевания (лимфогранулематоз и лимфома): величина дозировки - от 5 до 90 мг в день; полный курс - длительность от 1 до 6 месяцев, с 2-4-недельными перерывами после каждого месяца в качестве иммунологического сопровождения полихимиотерапии.
- В течение 1-й недели - по одной инъекции в день, перемежающаяся схема: один день - внутривенное введение, через день - внутримышечное введение; в сочетании с эндолимфатическим введением (величина дозировки - 30- 90 мг в день) в течение первых 10 дней;
- Затем - та же схема лечения в комбинации с глюкокортикоидами и цитостатиками.
Пример 27. Влияние окисленного глутатиона (GSSG) и его солей на процессы фосфатной модификации и содержание лимфоцитов, несущих рецептор IL-2, доказывающее воспроизведение эффектов цитокинов окисленным глутатионом и его производными в форме солей.
Исследовали молекулярные механизмы воспроизведения иммуно- биохимических эффектов цитокинов посредством GSSG и его солей.
Действие солей окисленного глутатиона (GSSG): натриевой (Na), литиевой (Li), магниевой (Mg) и платиновой (Pt) оценивали в модели гемо- и иммунодепрессии у мышей, индуцированной однократным введением цитостатика циклофосфамида (ЦФ).
В контексте данного исследования была проведена оценка влияния 5-ти дневного применения вышеуказанных веществ на уровень фосфорилирования цитозольных белков лимфоцитов по тирозину и содержание "активных" лимфоцитов, несущих рецептор IL-2.
Исследование проведено на мышах линии СВА, самцах, массой 18-20 г, которым однократно вводился ЦФ (50 мг/кг, внутрибрюшинно). Через 24 часа после инъекции ЦФ животным начинали внутрибрюшинное введение исследуемых веществ в дозе 5 мг/кг. Введение веществ продолжали в течение 5 дней (ежедневно, 1 раз в день). Через 24 часа после окончания применения исследуемых веществ мышей эвтаназировали и забирали образцы крови для проведения исследований.
Мононуклеарную фракцию лейкоцитов крови получали центрифугированием в градиенте плотности фиколл-метризоат (Histopaque, Sigma). Концентрацию клеток доводили до 2•105 клеток на 1 мл полной культуральной среды (RPMI 1640), содержащей 20 мМ HEPES, 2 мМ глутамина, 50 мкг/мл гентамицина и 10% эмбриональную телячью сыворотку. Жизнеспособность клеток оценивали в тесте с трипановым синим, и клеточную суспензию разносили в лунки 96-луночных планшетов из расчета 20000 клеток на лунку.
Определение содержания лимфоцитов, несущих рецептор IL-2, проводили в соответствии с Horgan A. F. (1994) на мазках мононуклеарной взвеси. В качестве первых антител использовали моноклональные антитела к цепям p55 и p75 рецептора IL-2. Для визуализации первых антител использовали поликлональные кроличьи антитела против иммуноглобулинов мыши, меченные ФИТЦ. Подсчет количества лимфоцитов, содержащих рецептор IL-2, проводили в процентном соотношении к общему числу лимфоцитов.
Для метаболического мечения лимфоциты культивировали в среде Игла с добавлением 10% сыворотки крупного рогатого скота. Метаболическое мечение лимфоцитов [32P]ортофосфорной кислотой проводили с помощью инкубации клеток в течение 10-12 ч в бесфосфорной среде ДМЕ, содержащей 100 мк Ci/мл [32P] ортофосфата. На одну пробу добавляли по 0,2 мл среды с изотопом. После инкубации клетки разрушали пипетированием и центрифугировали при 6000g в течение 30 мин. Полученный супернатант использовали для иммунопреципитации поликлональными антителами к фосфотирозину по методу Fu (1992). Для осаждения иммунных комплексов использовали протеин A-сефарозу. После преципитации осадок трижды отмывали и активность осадка просчитывали на счетчике "Гамма".
Согласно результатам выполненных исследований (таблица 47) установлено, что действие окисленного глутатиона (GSSG) на изолированные лимфоциты приводит к тому (см. таблицу 47), что уже через 10 минут наблюдается достоверное увеличение уровня фосфорилирования по тирозину цитозольных белков лимфоцитов, что является интегральным показателем активности сигнал передающих систем клеток. Данные изменения под действием GSSG, в большей степени под действием производных GSSG обусловливают модуляцию редокс-чувствительной экспрессии генов, в первую очередь, иммунологически важных генов, ответственных за синтез цитокинов и гемопоэтических факторов.
В таблице 48 приведены данные об уровне фосфорилирования по тирозину цитозольных белков лимфоцитов и процентное содержание лимфоцитов, несущих рецептор IL-2 у мышей линии СВА, получавших исследуемые вещества на фоне циклофосфамид-индуцированной гемо- и иммунодепрессии.
Применение солей GSSG приводит к увеличению процентного содержания лимфоцитов, несущих рецептор IL-2, практически нормализуя их количество (в норме -18,3±1,6%). Схожая закономерность была выявлена при исследовании уровня фосфорилирования по тирозину цитозольных белков лимфоцитов.
Применение различных солей GSSG способствует восстановлению процентного содержания лимфоцитов, несущих рецептор IL-2, в условиях иммунодефицита, моделированного циклофосфамидом. При этом происходит увеличение уровня фосфорилирования по тирозину цитозольных белков сигнал-передающих систем, что может выступать одним из факторов описанного иммуностимулирующего действия исследуемых веществ.
Таким образом, авторами установлено ранее неизвестное свойство окисленной формы глутатиона (GSSG) и его солей воспроизводить (имитировать) регуляторные эффекты ряда цитокинов, в первую очередь, IL-2. Под воспроизведением IL-2 мы имеем в виду индукцию GSSG внутриклеточных механизмов, реализующих регуляторные сигналы цитокина на систему иммунокомпетентных и гемопоэтических клеток. Приведенные исследования показали, что изменение уровня фосфорилирования по тирозину белков сигнал-передающих систем клеток органов иммуногенеза и гемопоэза в условиях иммунодефицита моделированного циклофосфамидом, приводит к эффекту динамичной нормализации содержания активных лимфоцитов.
Следовательно, использование GSSG или его производных в форме лекарственных средств в терапевтических целях не только стимулирует эндогенную продукцию цитокинов и гемопоэтических факторов, но также, особенно в случае десенситизации рецепторов, наблюдаемой, как правило, при онко- и ретровирусной патологии, обеспечивает воспроизведение иммуно-биохимических эффектов цитокинов.
Источники информации
1. Holmlund J. Т. Cytokines. Cancer Chemother Biol Response Modif. 1993. 14P 150-206.
2. Hansson M., Soderstrom Т. The colony stimulating factors. Med Oncol Tumor Pharmacother. 1993. 10(1-2). P 5-12.
3. Dillman R. O. The clinical experience with interleukin-2 in cancer therapy. Cancer Biother. 1994 Fall. 9(3). P 183-209.
4. Whittington R. , Faulds D. Interleukin-2. A review of its pharmacological properties and therapeutic use in patients with cancer. Drugs. 1993 Sep. 46(3). P 446-514.
5. Hieber U. , Heim M. E. Tumor necrosis factor for the treatment of malignancies. Oncology. 1994 Mar-Apr. 51(2). P 142-53.
6. Morstyn G. , Sheridan W. P. Hematopoietic growth factors in cancer chemotherapy. Cancer Chemother Biol Response Modif. 1993. 14P 353-70.
7. Neidhart J. A. Hematopoietic cytokines. Current use in cancer therapy. Cancer. 1993 Dee 1. 72(11 Suppl). P 3381-6.
8. Murray H. W. Interferon-gamma and host antimicrobial defense: current and future clinical applications. Am J Med. 1994 Nov. 97(5). P 459-67.
9. Cirelli R. Tyring S.K. Interferons in human papillomavirus infections. Antiviral Res. 1994 Jul. 24(2-3). P 191-204.
10. Sher A., Coffman R.L. Regulation of immunity to parasites by T-cells and T-cell derived cytokines. Annu. Rev. Immunol., 1992, 10, P. 385-409.
11. Gillan E. , Plunkett M., Cairo M. S. Colony-stimulating factors in the modulation of sepsis. New Horiz. 1993 Feb. 1(1). P 96-109.
12. Nelson S. Role of granulocyte colony-stimulating factor in the immune response to acute bacterial infection in the nonneutropenic host: an overview. Clin Infect Dis. 1994 Feb. 18 Suppl 2P S 197-204.
13. Offenstadt G., Guidet B., Staikowsky F. Cytokines and severe infections. Pathol Biol (Paris). 1993 Oct. 41(8 Pt 2). P 820-31.
14. Nemunaitis J. Use of hematopoietic growth factors in marrow transplantation. Curr Opin Oncol. 1994 Mar. 6(2). P 139-45.
15. Mittelman M. , Lessin L. S. Clinical application ofrecombinant erythropoietin in myelodysplasia. Hematol Oncol Clin North Am. 1994 Oct. 8(5). P 993-1009.
16. Forman A. D. Neurologic complications of cytokine therapy. Oncology (Huntingt). 1994 Apr. 8(4). P 105-10; discussion 113, 116-7.
17. Hack C. E., Ogilvie A. C., Eisele B., Eerenberg A. J., WagstaffJ., Thijs L. G. Cl-inhibitor substitution therapy in septic shock and in the vascular leak syndrome induced by high doses of interleukin-2. Intensive Care Med. 1993. 19 Suppl 1P S 19-28.
18. Hieber U. , Heim M. E. Tumor necrosis factor for the treatment of malignancies. Oncology.1994 Mar-Apr. 51(2). P 142-53.
19. Saito M. OK-432, a killed streptococcal preparation, in the treatment of animal and human cancer and its mechanisms of action. Forum on immunomodulators. Ed. Guenounou M. John Libbey Eurotext, Paris, 1995, P. 13-30.
20. Barot-Ciorbaru R., Bona C. Immunomodulators from Nocardia opaca. Forum on immunomodulators. Ed. Guenounou M. John Libbey Eurotext, Paris, 1995, P. 63- 77.
21. Bloy С., Morales M., Guenounou M. RU 41740 (Biostim), an immunomodulating agent from bacterial origin. Ed. Guenounou M. John Libbey Eurotext, Paris, 1995, P. 85-100.
22. Meister A. Anderson M.E. Glutathione. Annu. Rev. Biochem., 1983, 52: 711-60.
23. Beutler E. Nutritional and metabolic aspects of glutathione. Review. Annu. Rev. Nutr., 1989,9:287.
24. Textbook of biochemistry: with clinical correlations. Ed. Devlin T. M., 3rd ed. 1992, Wiley-Liss, Inc., NY. p. 522-525.
25. Kehrer J.P., Lund L.G. Cellular reducing equivalents and oxidative stress. Free Radic Biol Med. 1994 Jul. 17(1). P 65-75.
26. Michiels С., Raes M., Toussaint O., Remade J. Importance of Se-glutathione peroxidase, catalase, and Cu/Zn-SOD for cell survival against oxidative stress. Free Radic Biol Med. 1994 Sep. 17(3). P 235-48.
27. Cohen G. Enzymatic/nonenzymatic sources of oxyradicals and regulation of antioxidant defenses. Ann N Y Acad Sci. 1994 Nov 17, 738. P 8- 14.
28. Beckett G.J., Hayes J.D. Glutathine S-transferase: biomedical applications. Advan. Clin. Chem. 1993, vol. 30, P. 281- 380.
29. Composition and method for disease treatment. PCT/US/92/04653, A 61 K 37/02, C 07 K 5/08, 5/06, WO92/21368.
30. Droge W., SchuIze-Osthoff K., Mihm S., Gaiter D., Schenk H., Eck H. P. , Roth S., Gmunder H. Functions of glutathione and glutathione disulfide in immunology and immunopathology. FASEB J. 1994 Nov. 8(14). P 1131-8.
31. Sardesai V. , M. Role of antioxidants in health maintenance. Nutr Clin Pract. 1995 Feb. 10(1). P 19-25.
32. Giugliano D. , Ceriello A., Paolisso G. Diabetes mellitus, hypertension, and cardiovascular disease: which role for oxidative stress? Metabolism. 1995 Mar. 44(3). P 363-8.
33. Keusch G. T. Antioxidants in infection. J Nutr Sci Vitaminol (Tokyo). 1993. 39 Suppl 1P S23-33.
34. Dipeptide compound having pharmaceutical activity and compositions containing them. US Patent 4,761,399.
35. g-L-Glutamyl-L-cysteine ethyl ester and pharmaceutical compositions containing the same as an effective ingredient. US Patent 4,927,808.
36. Therapeutic agents for ischemic heart diseases. US Patent 4,968,671.
37. Method for insuring adequate intracellular glutathione in tissue, publication number EP 0502313 A2.
38. Composition and method for disease treatment. PCT/US/92/04653.
39. Glutathione as chemoprotective agent. PCT/EP/93/01494.
40. Pharmaceutical compositions having antineoplastic activity. US Patent 4,871,528.
41. Sokolovsky M. , Wilchek M. , Patchornik A. On the synthesis of cysteine peptides. J. Amer. Chem. Soc. 1964, Mar. 86(6), P 1202-6.
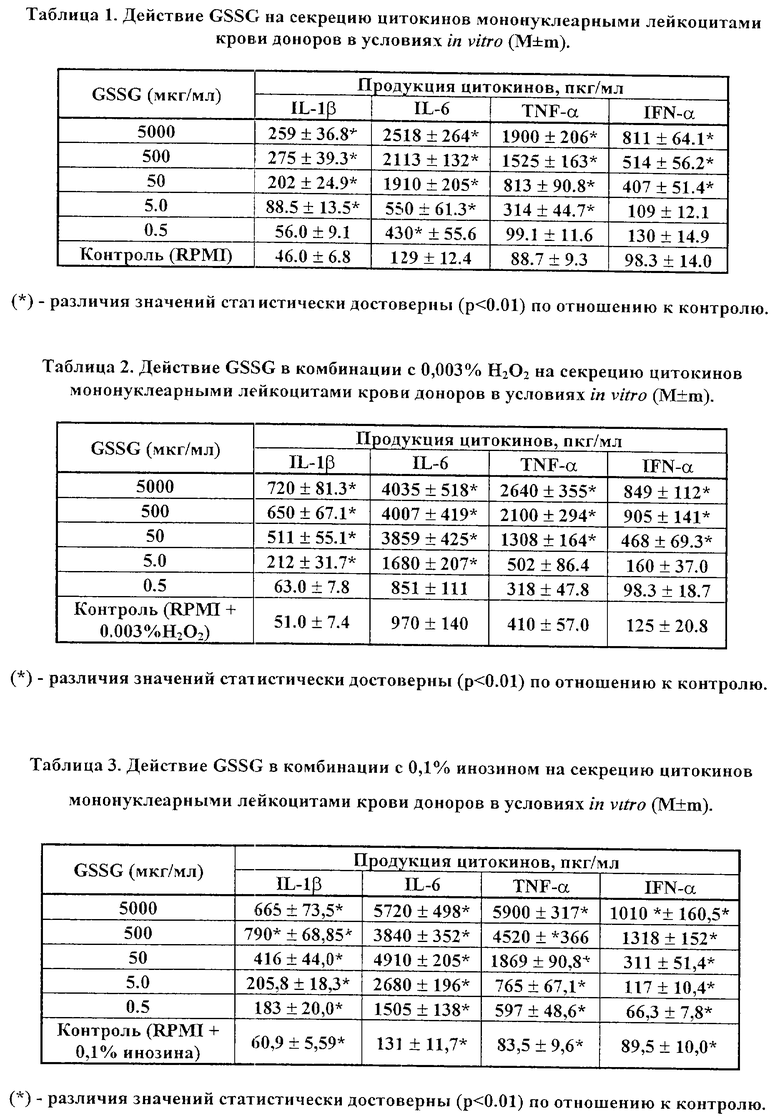
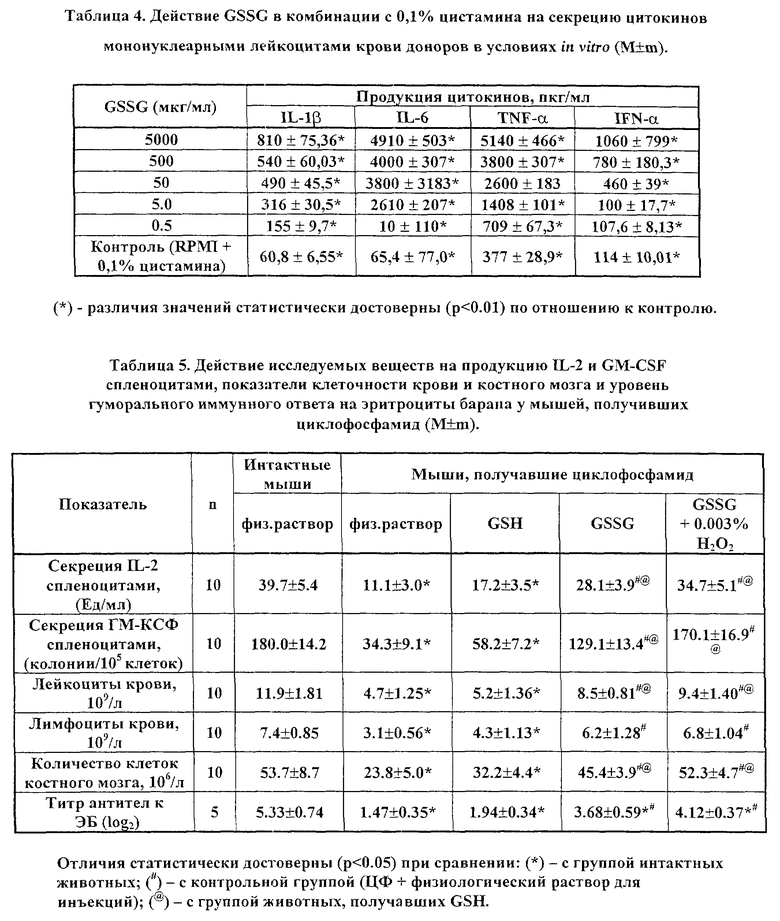
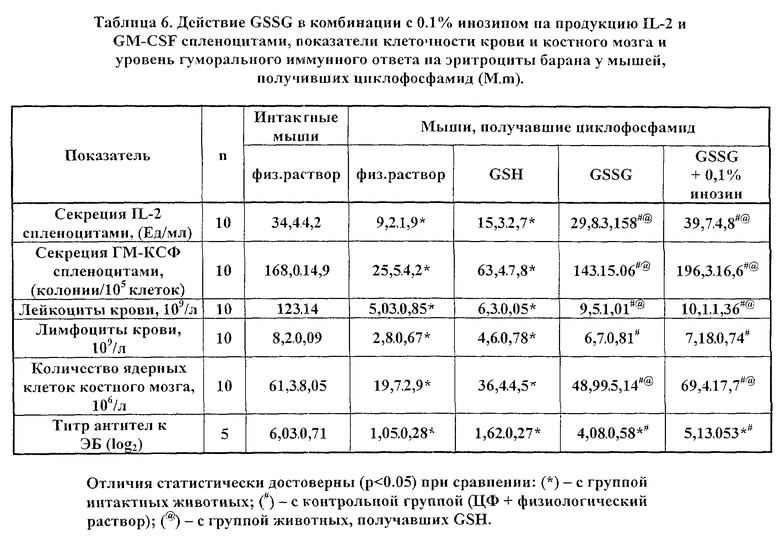
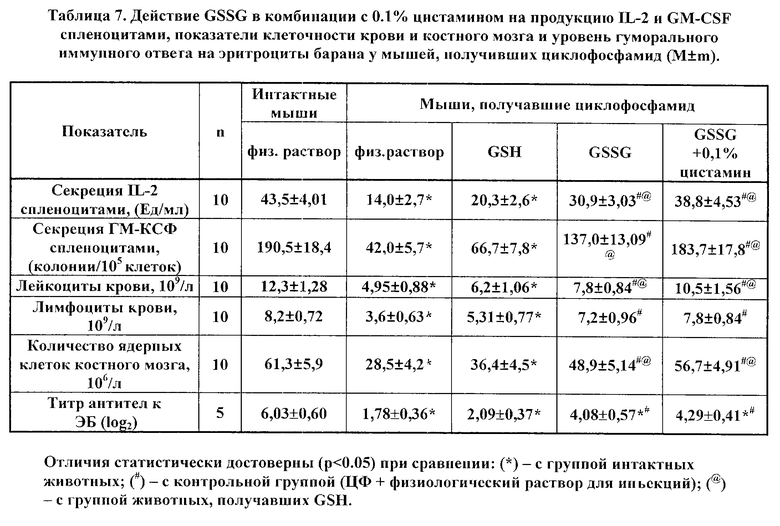
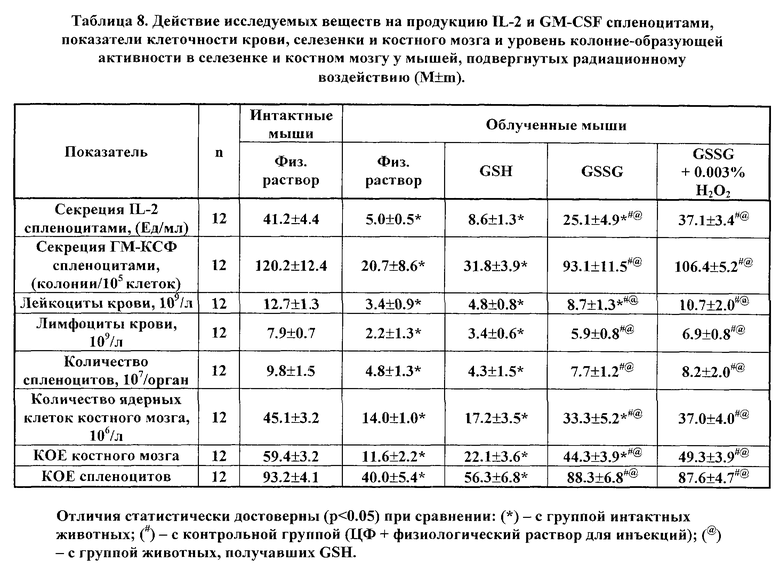
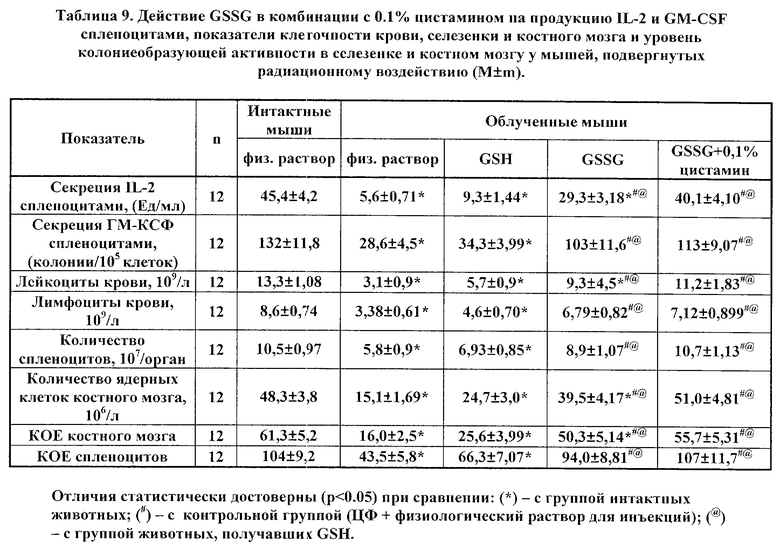
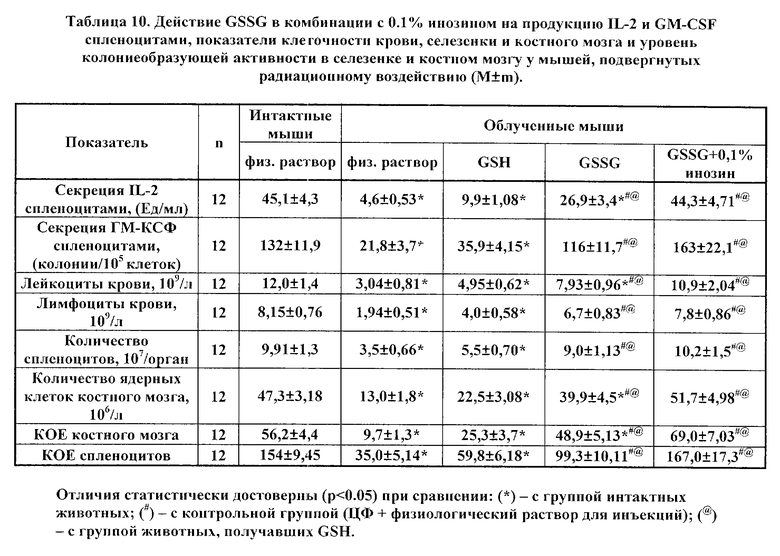
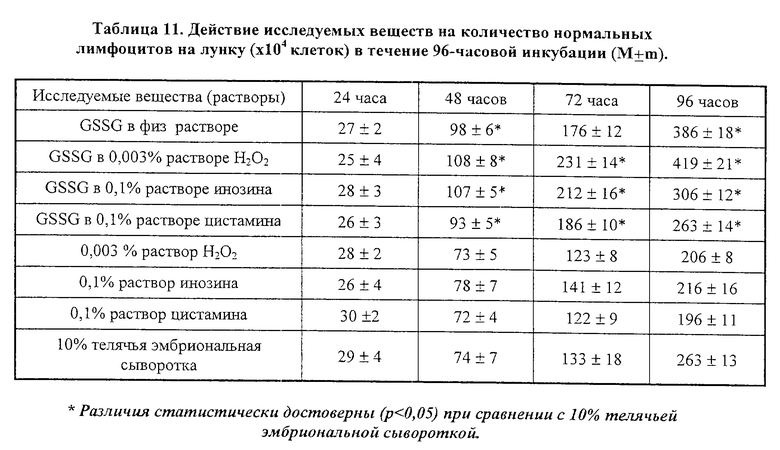
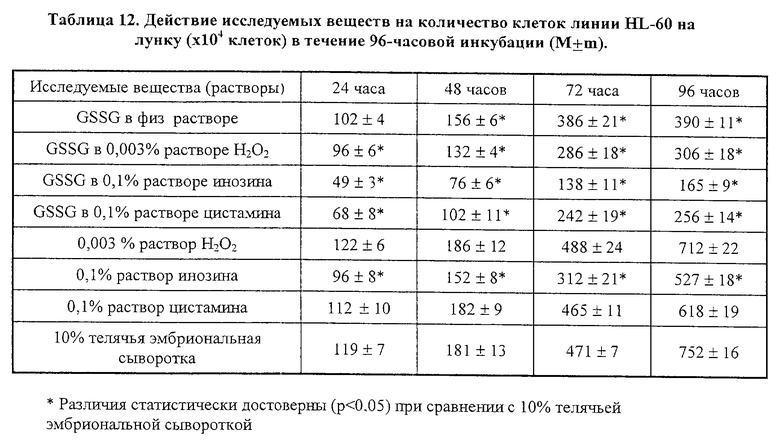
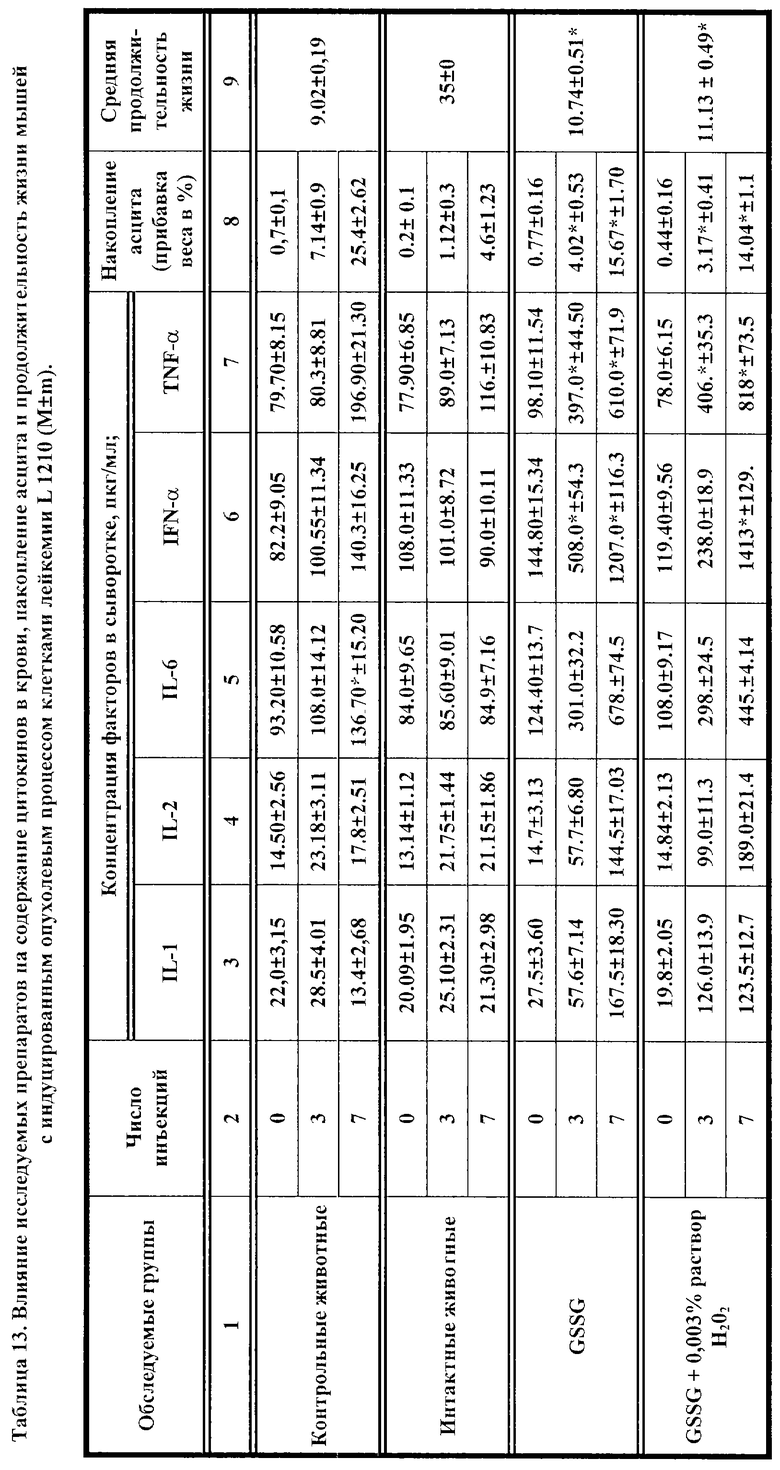
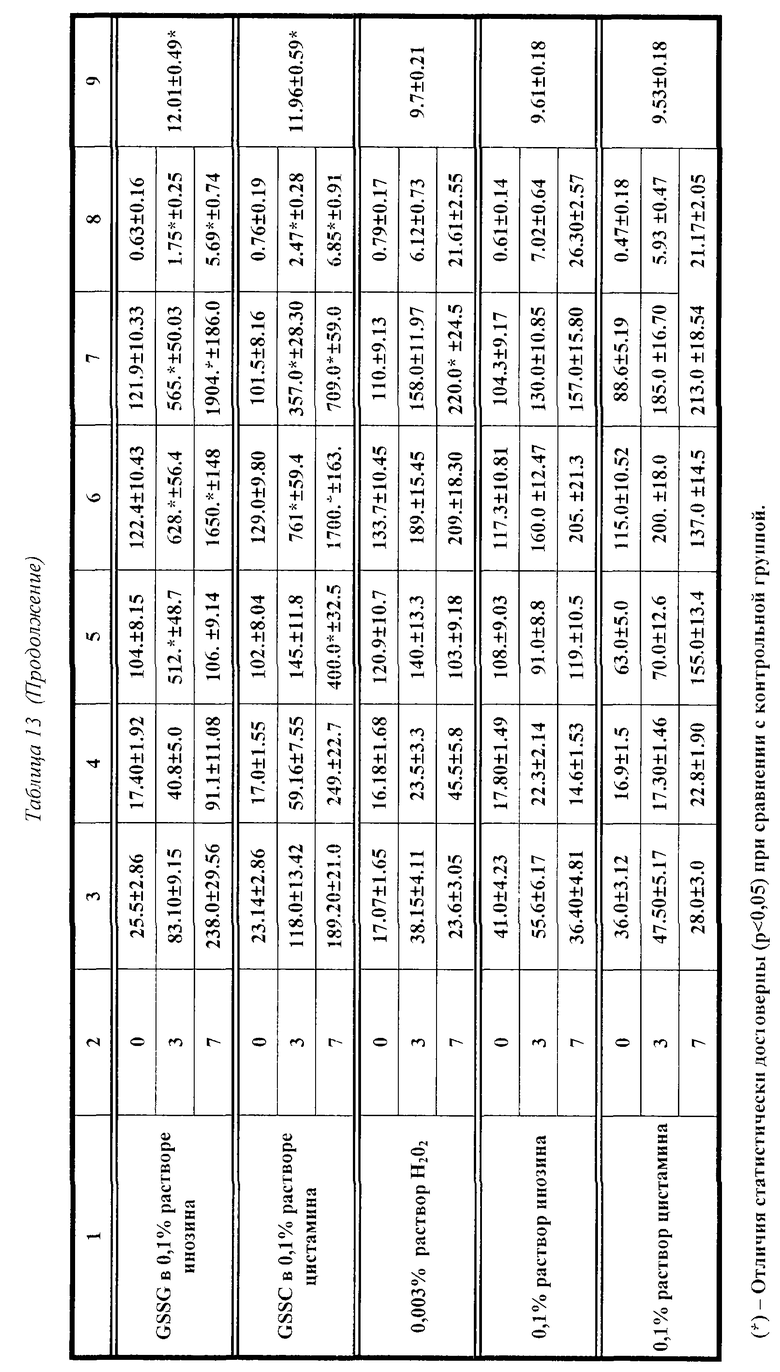
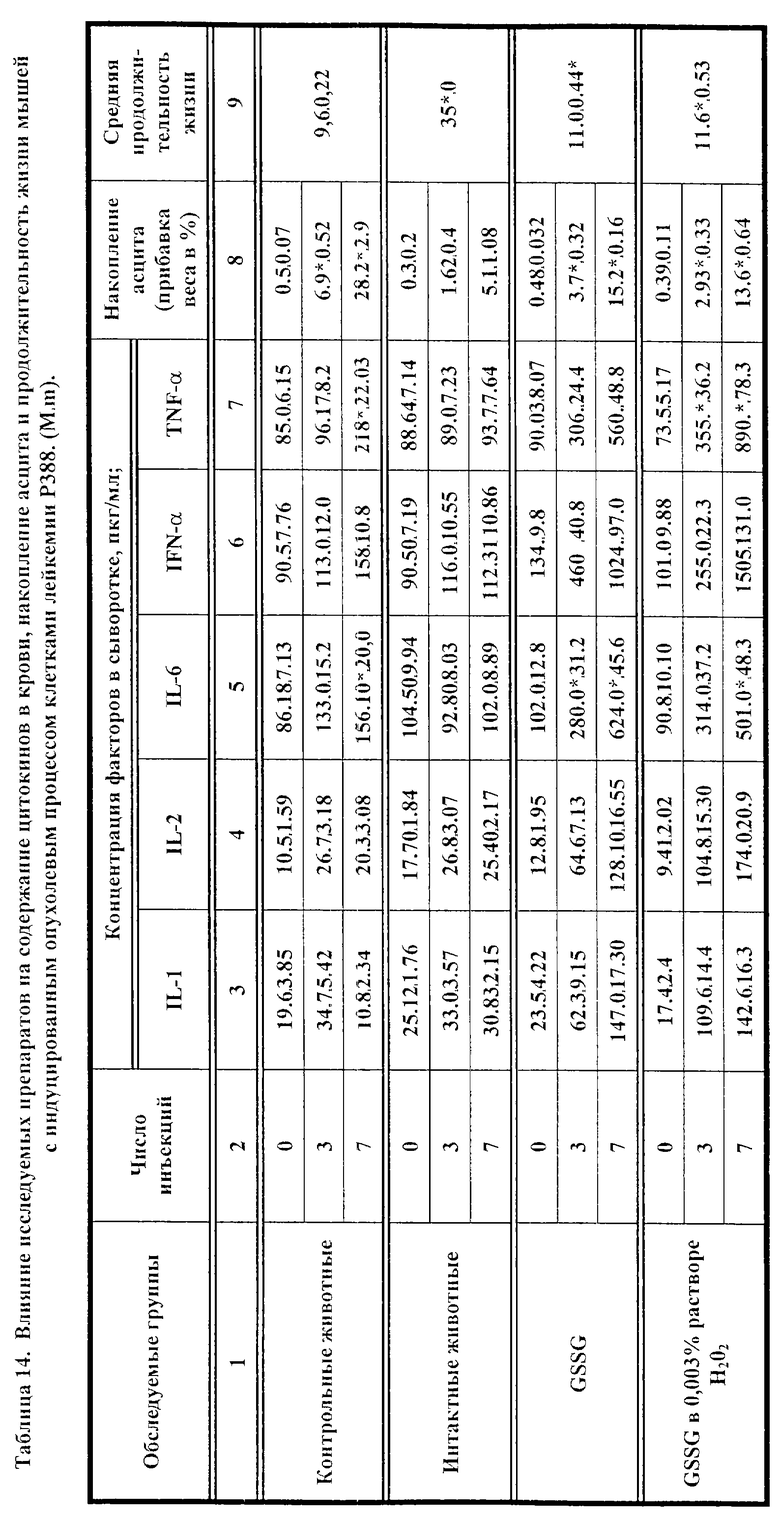
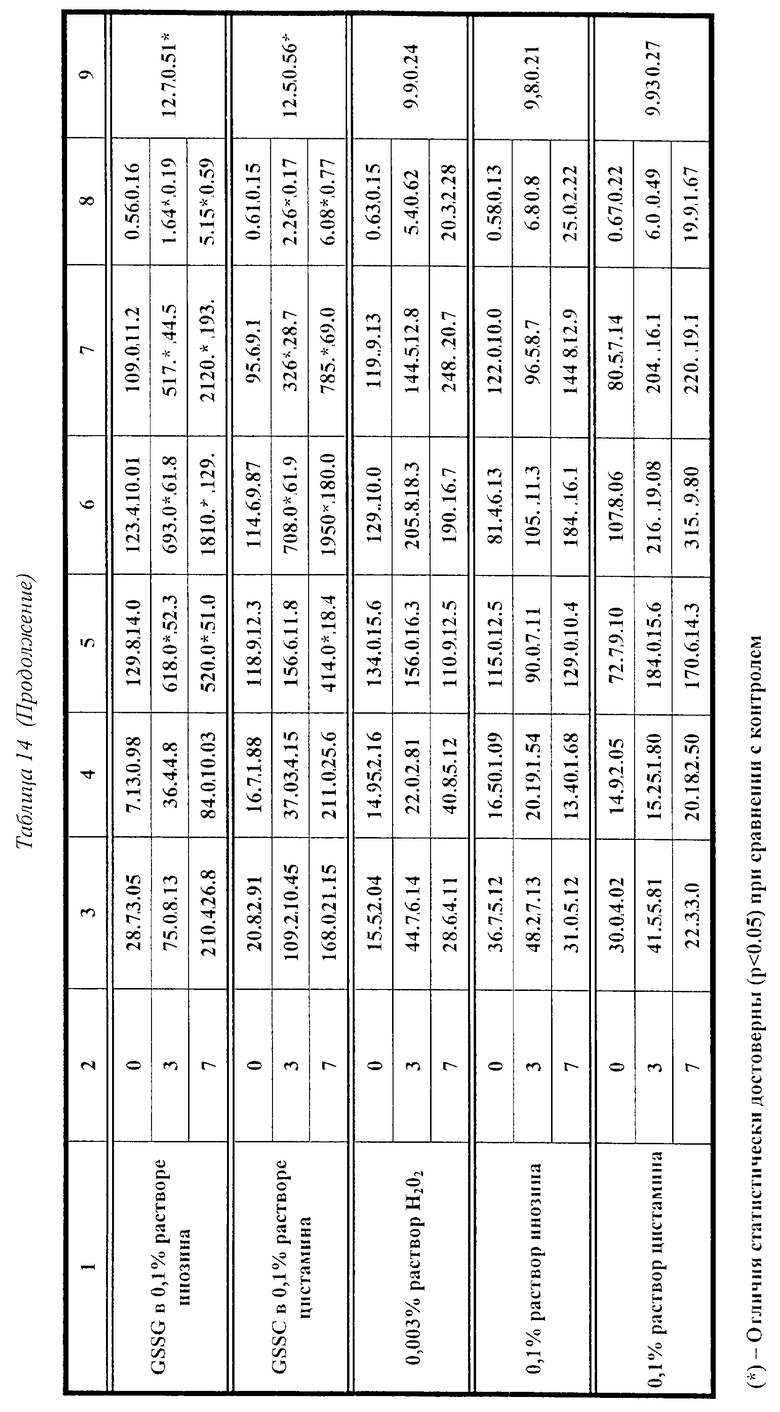
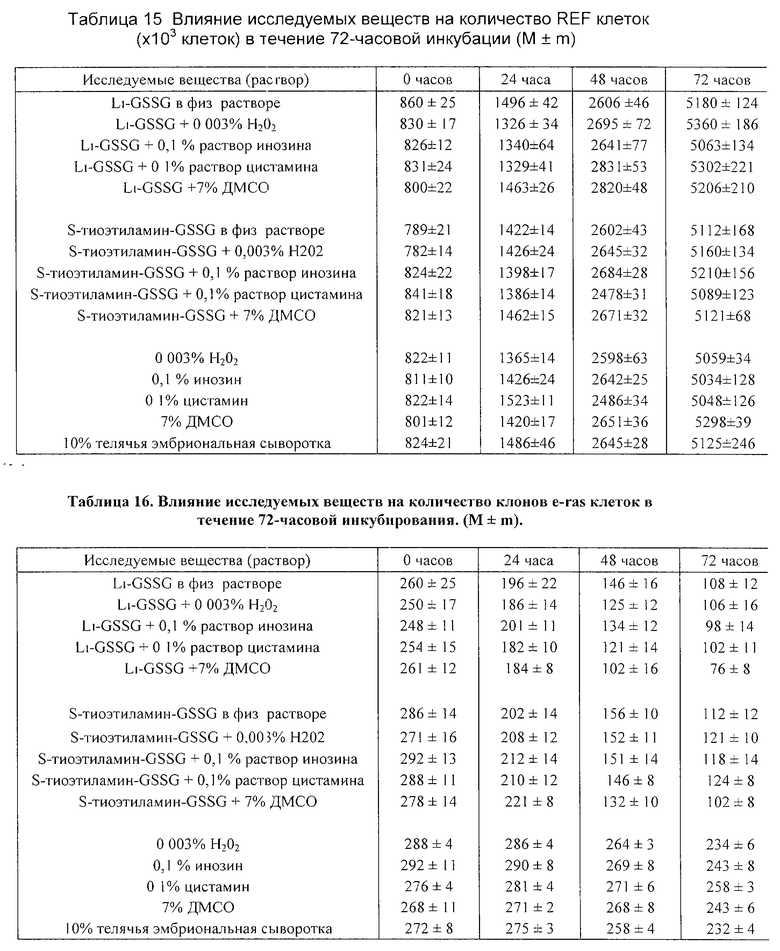
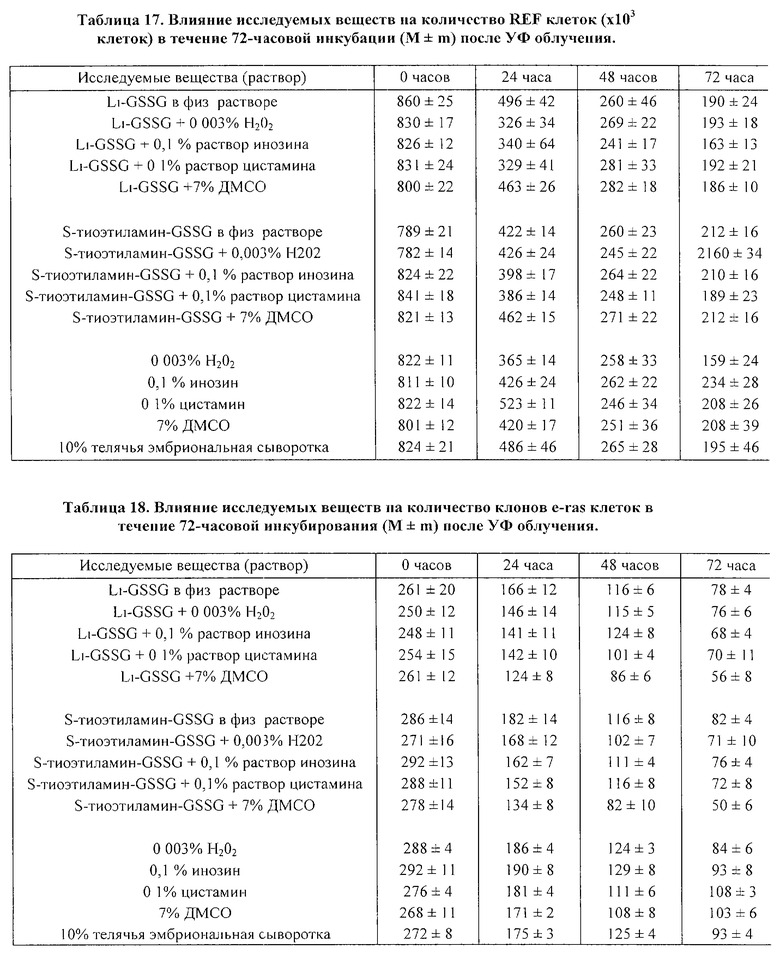
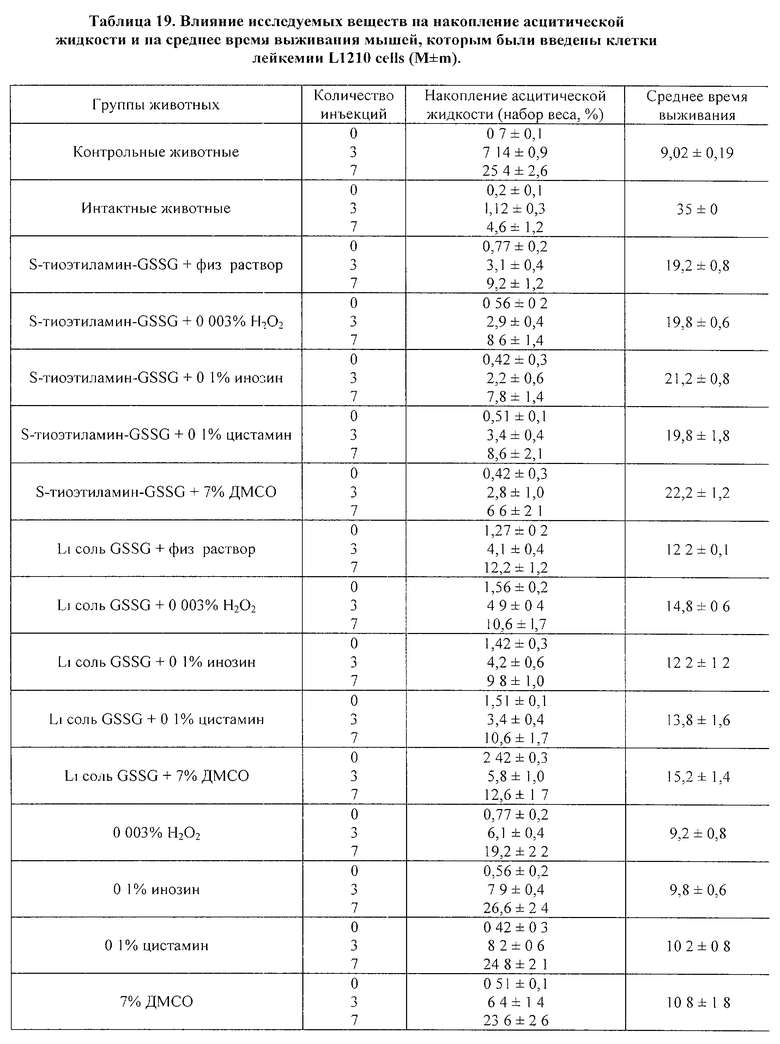
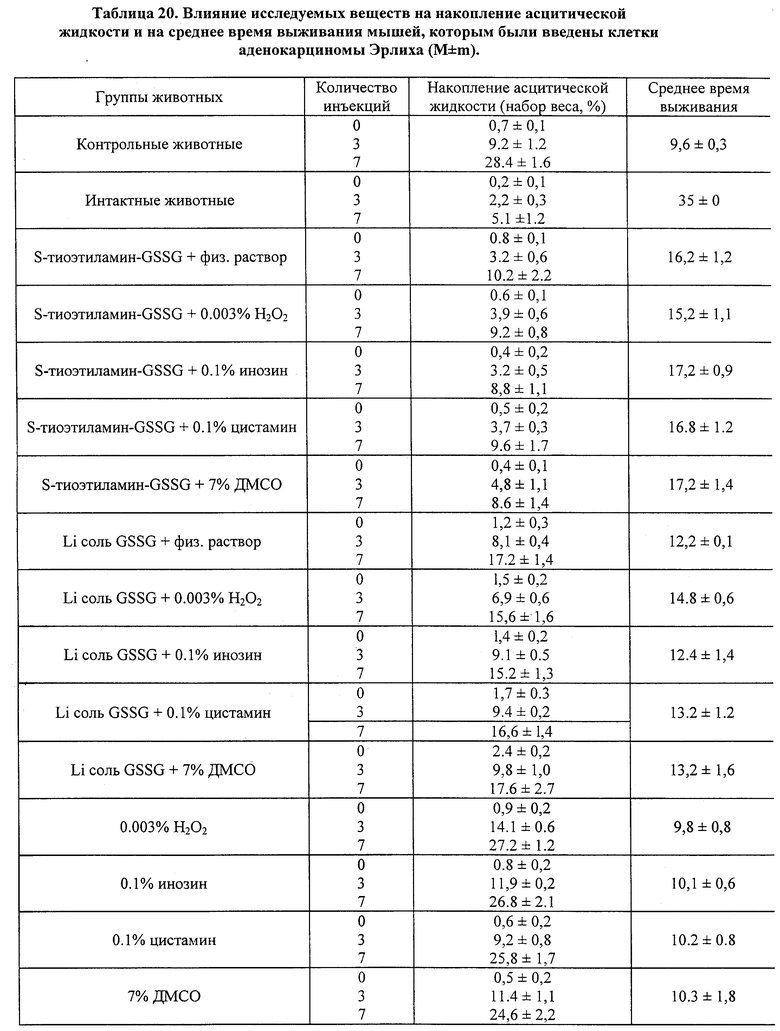
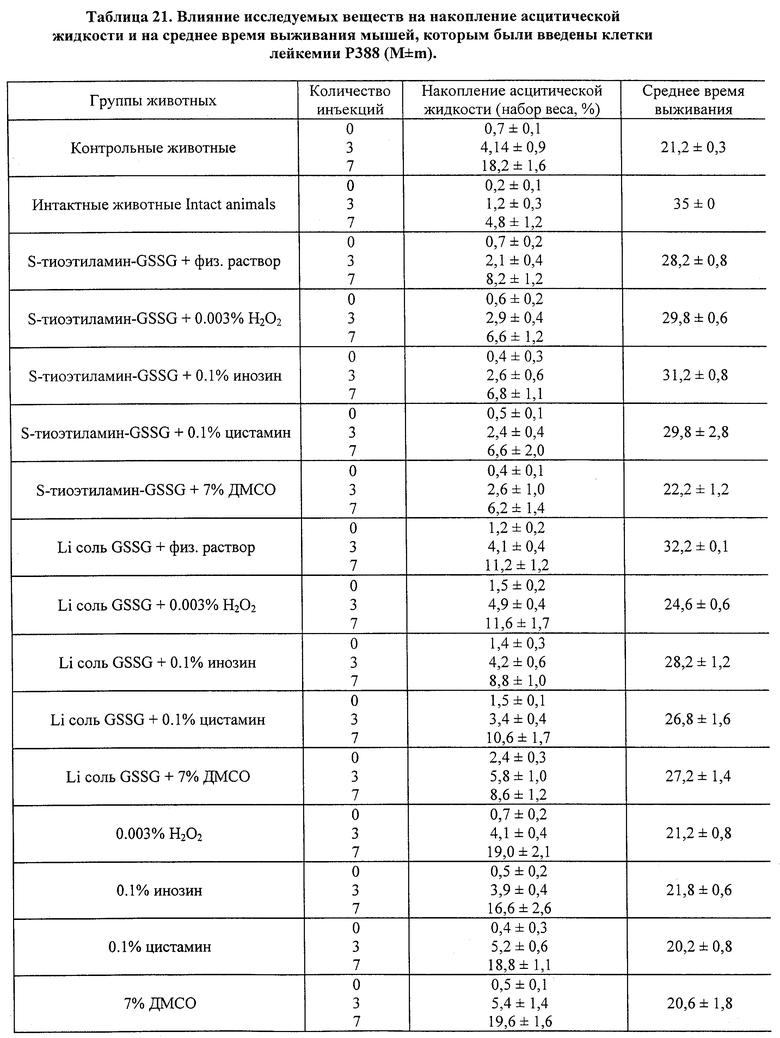

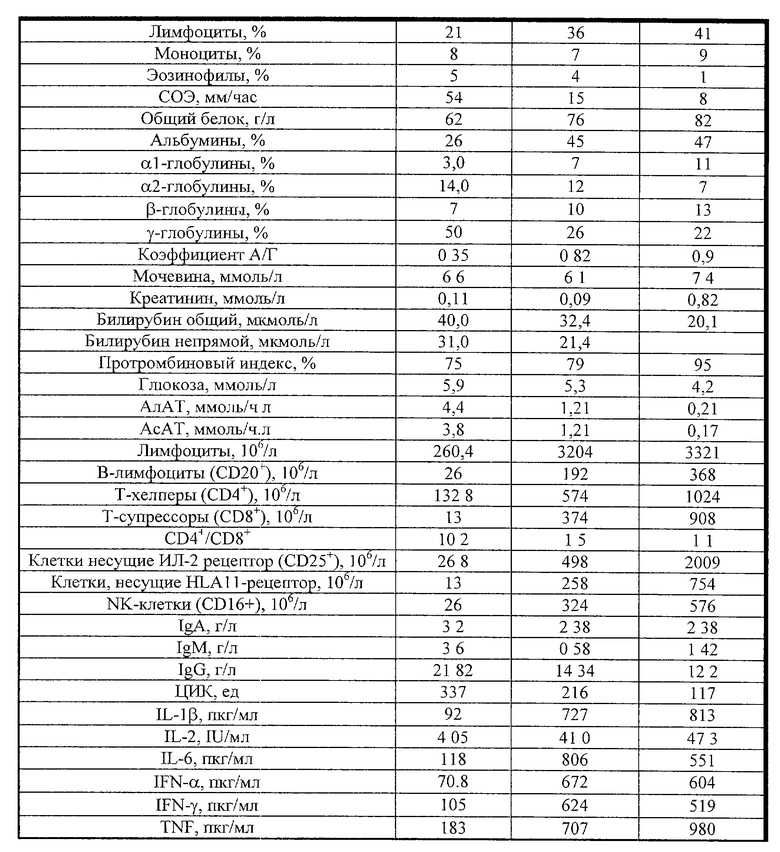
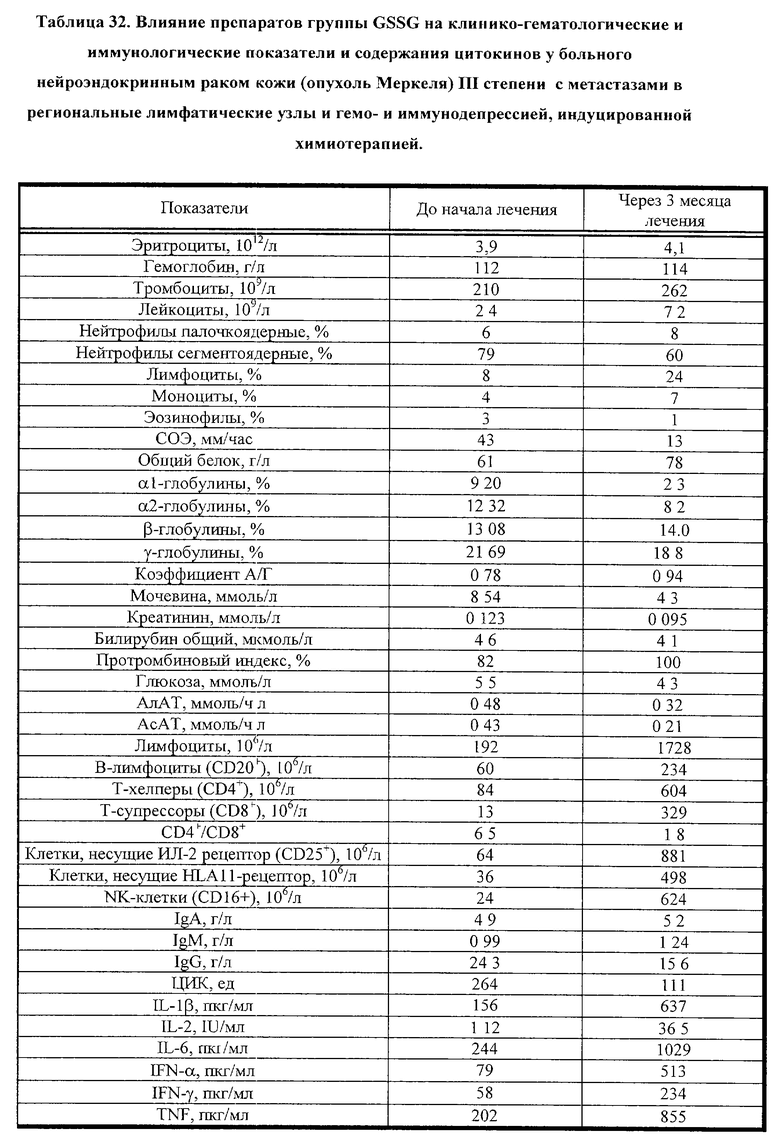
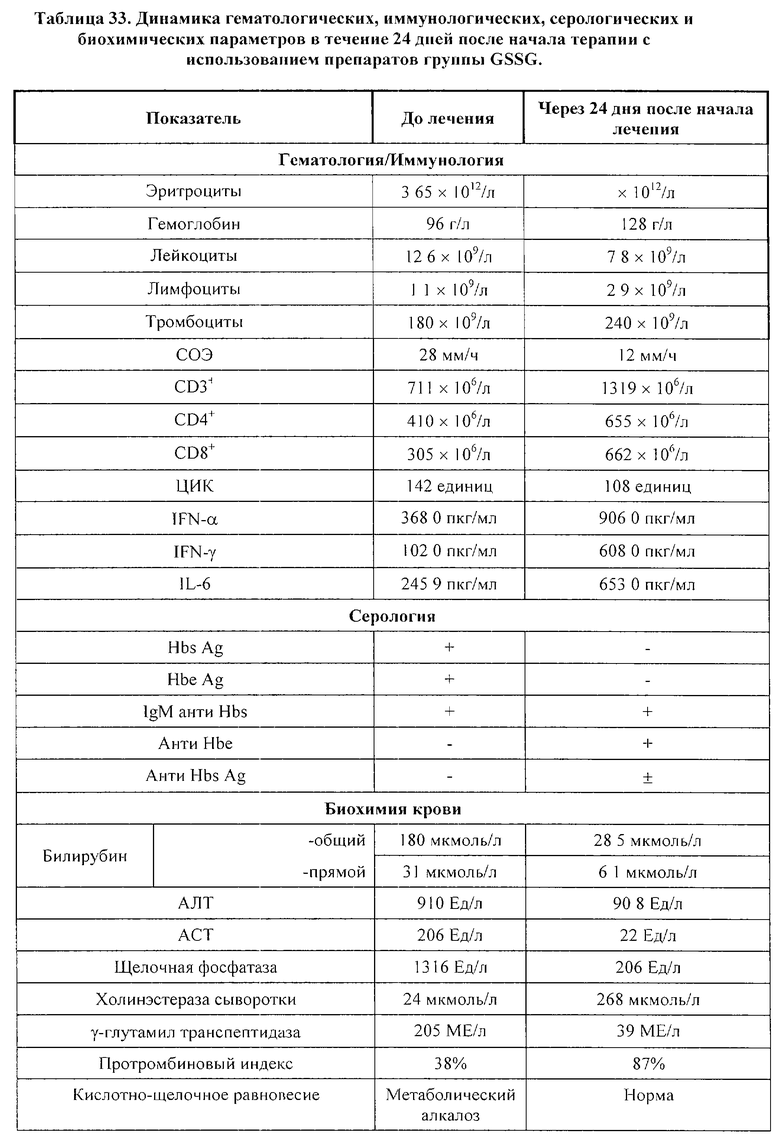
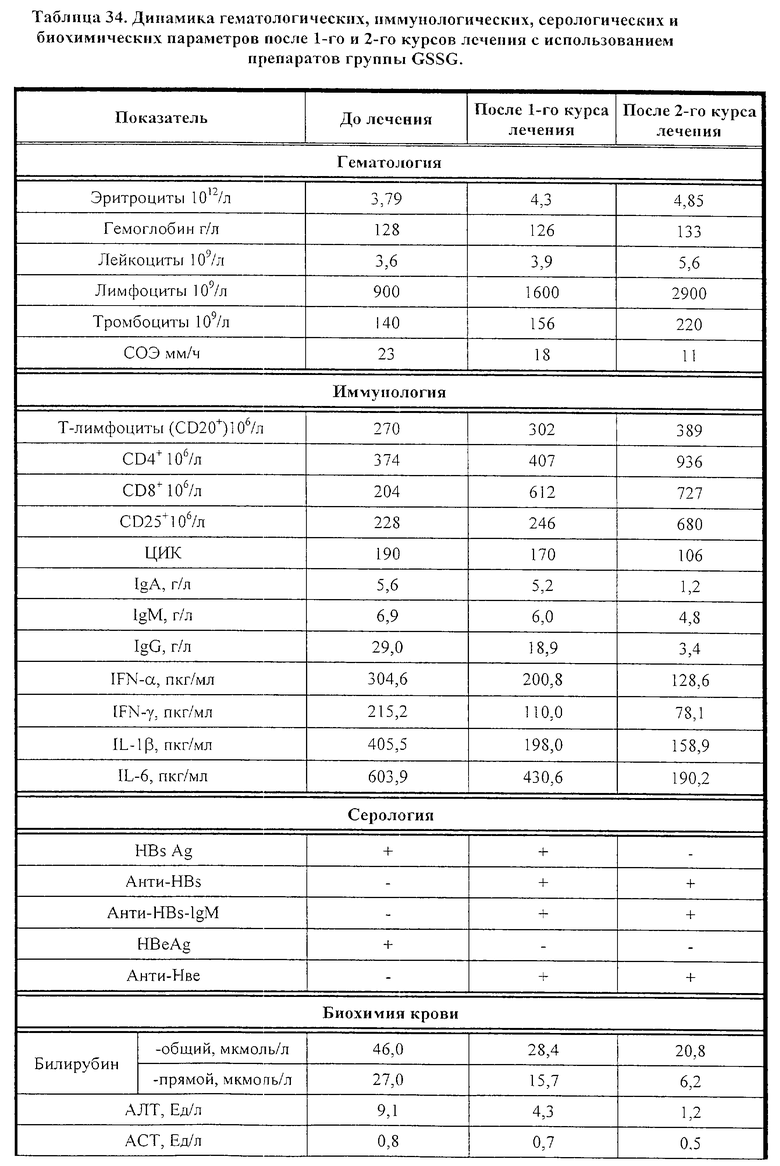
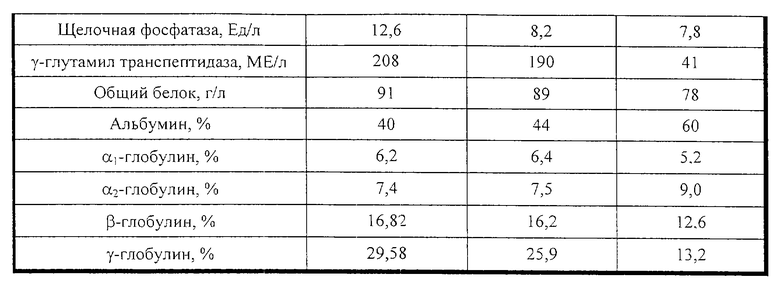
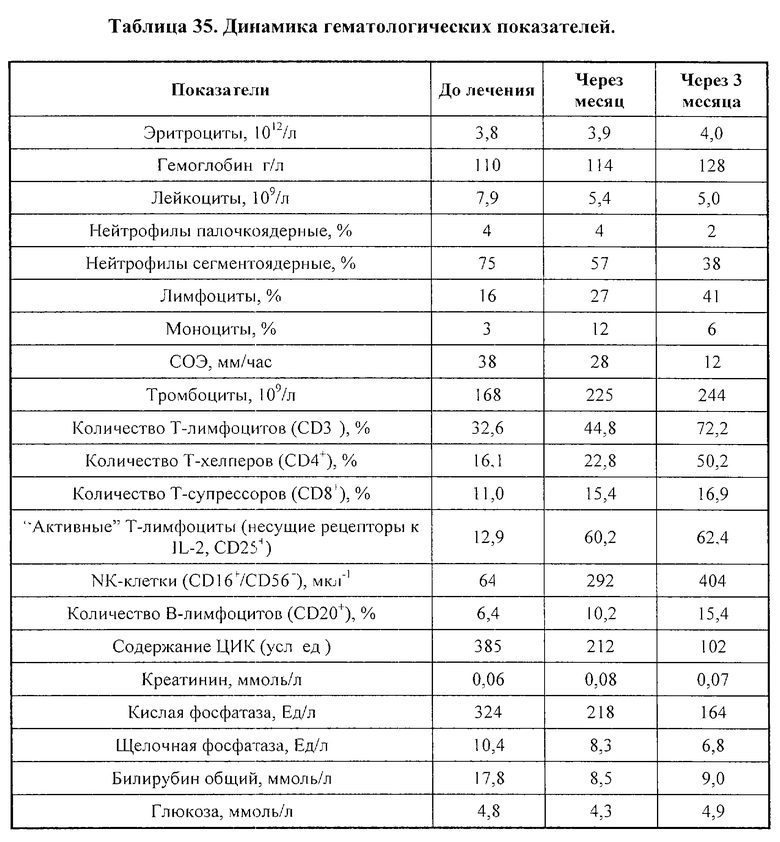
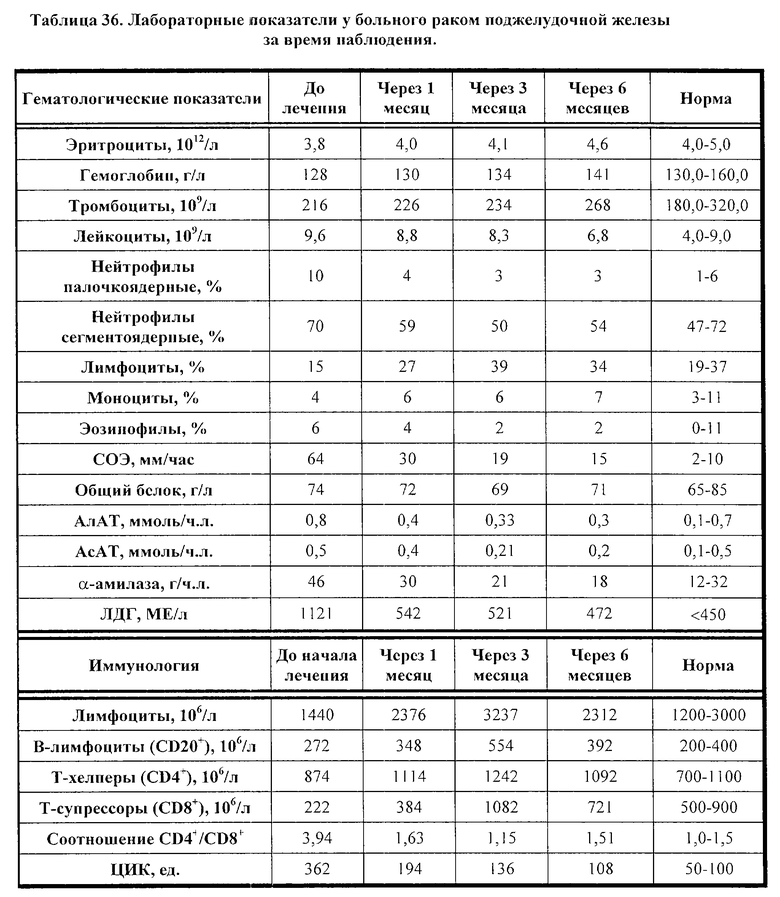
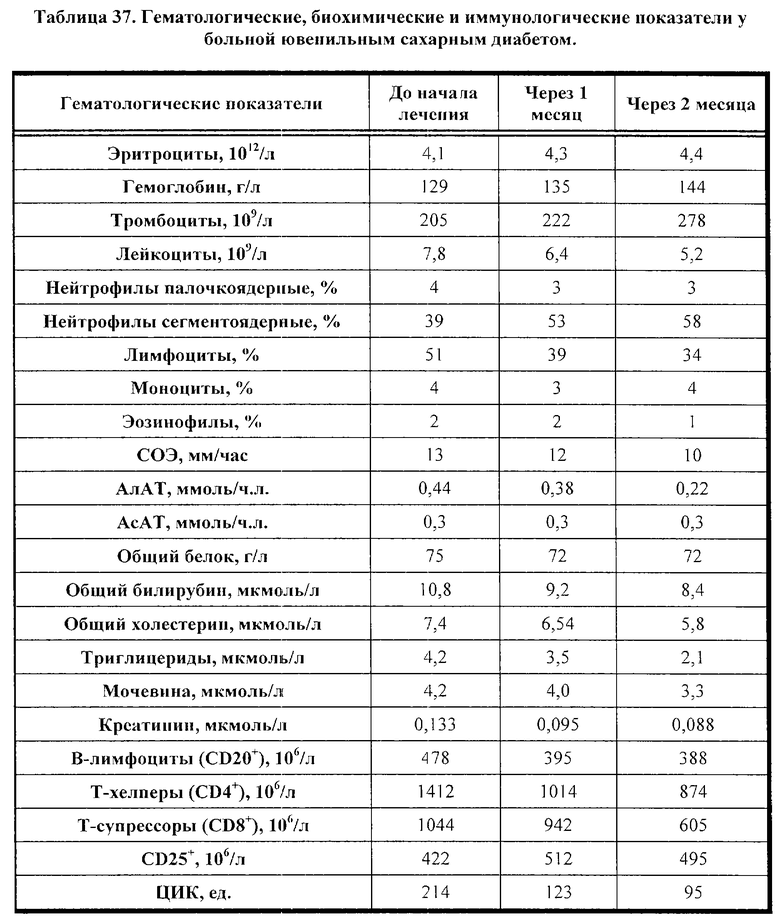
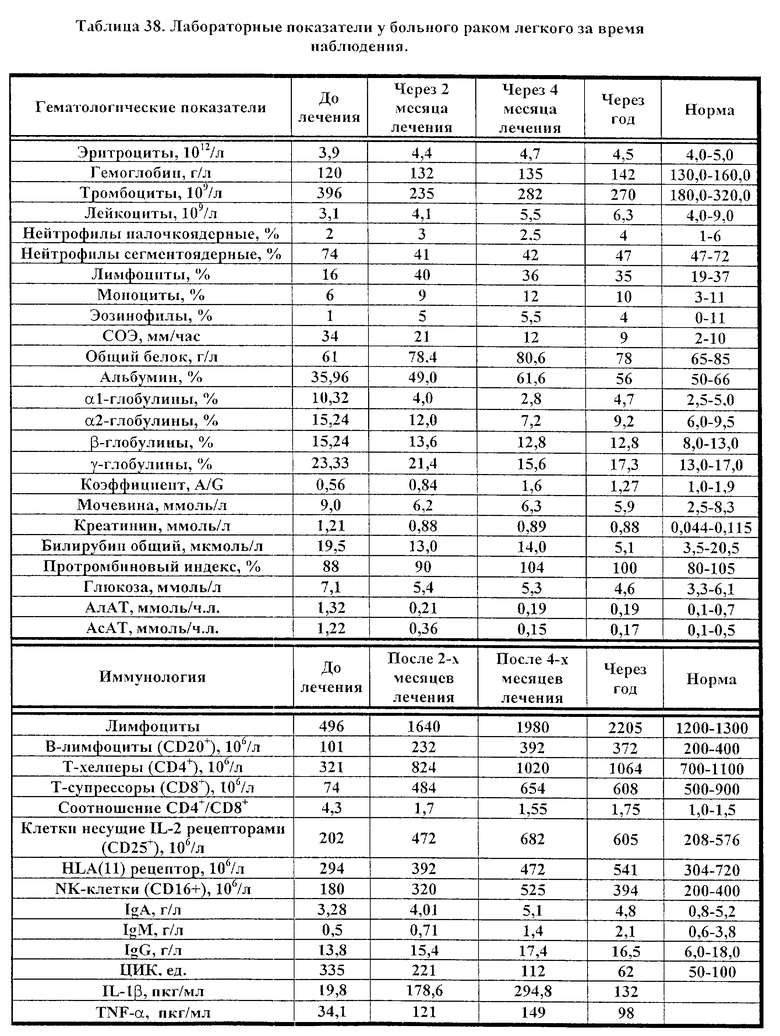
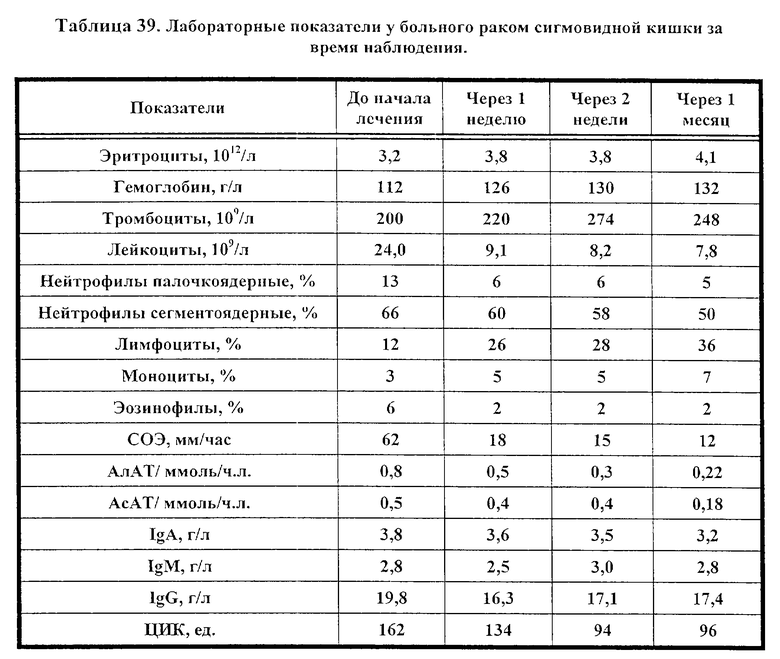
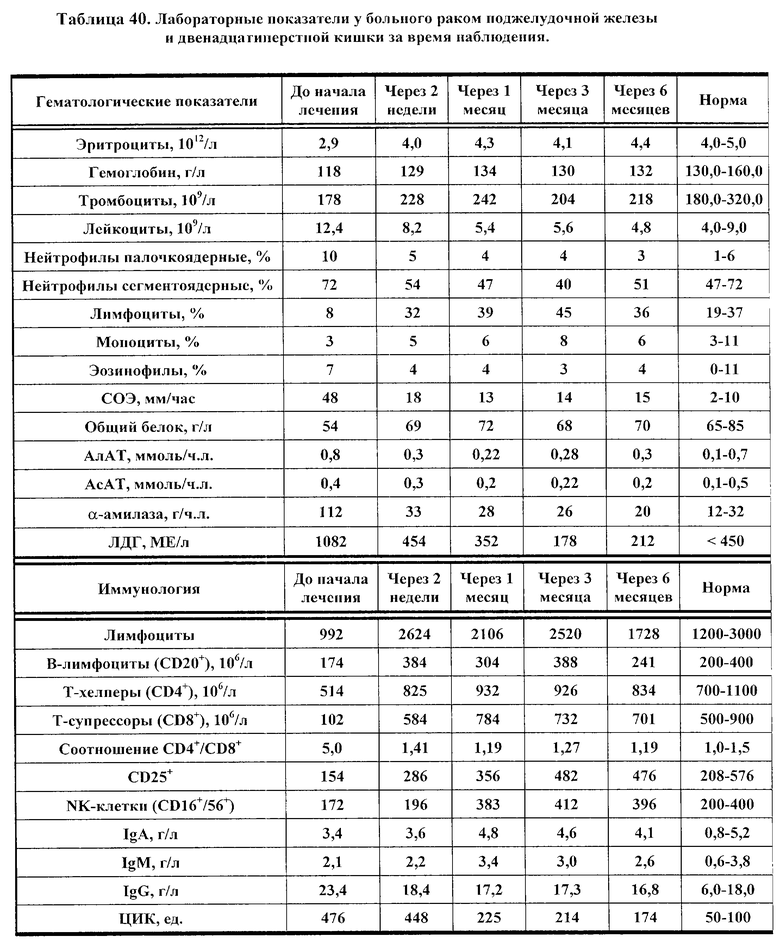
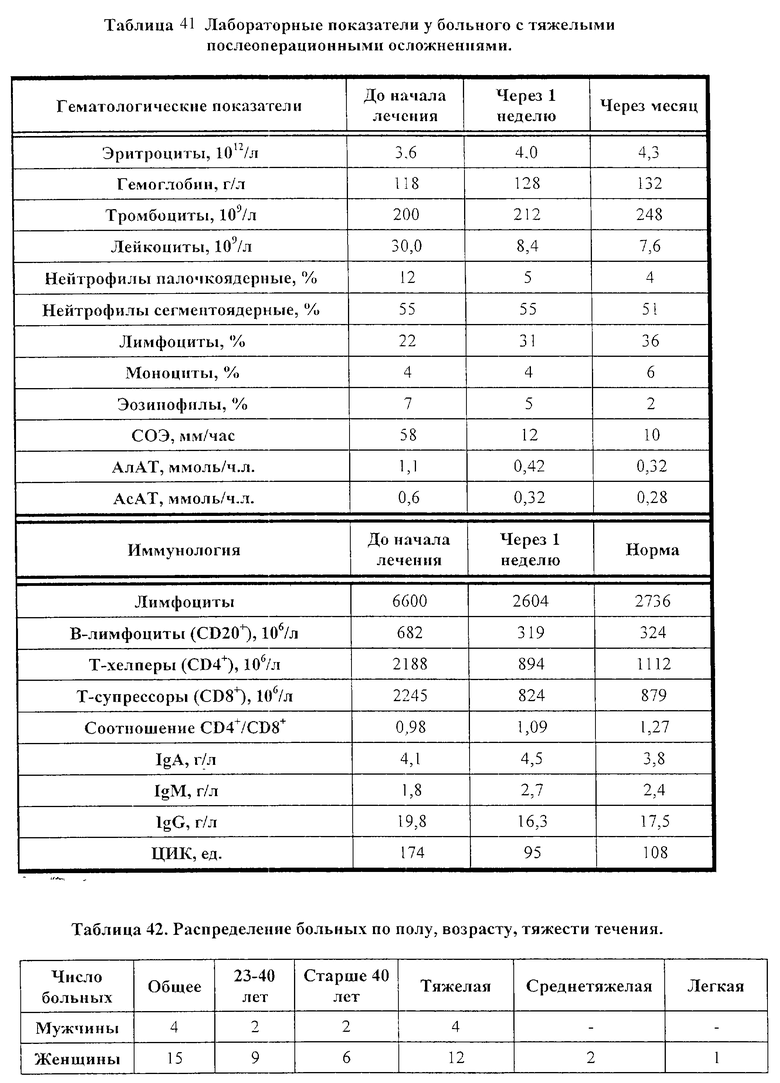
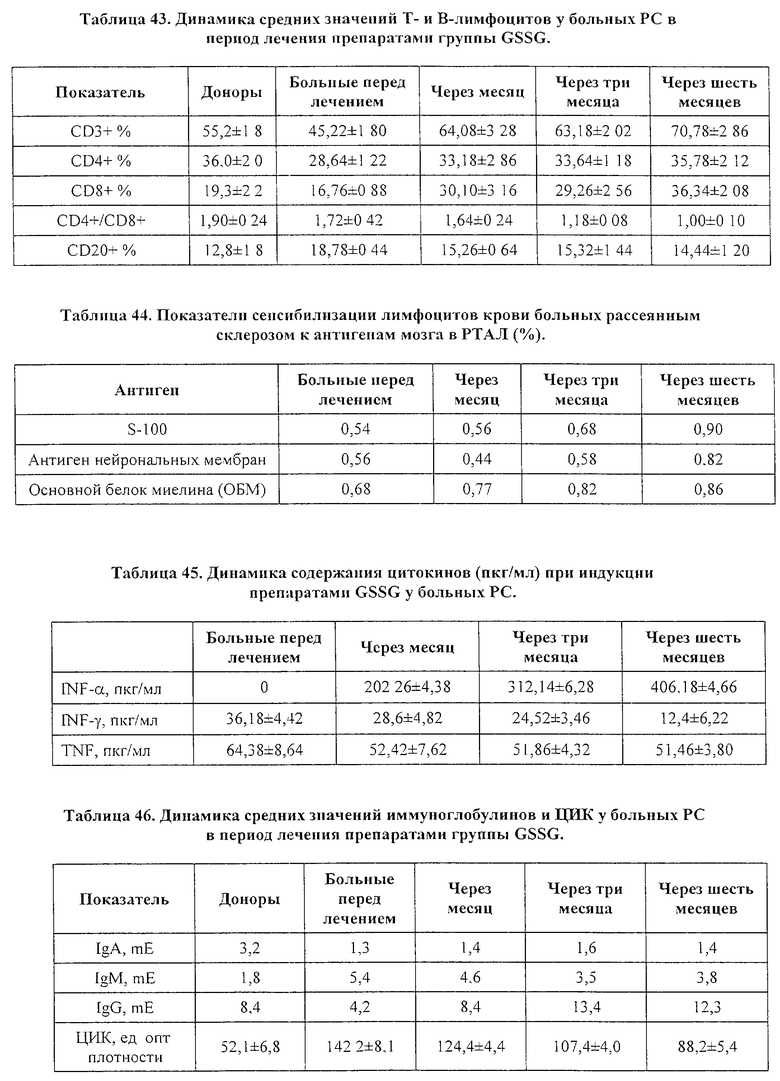
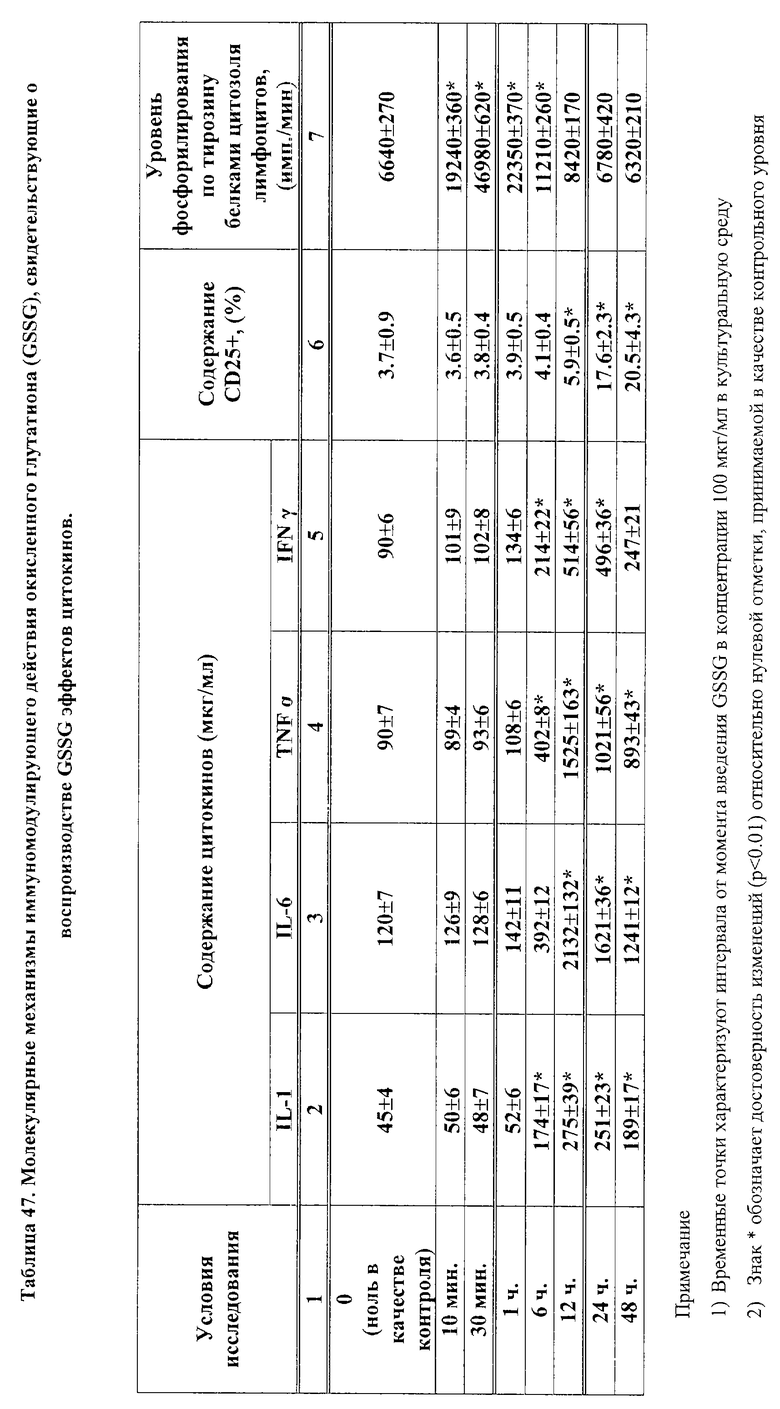

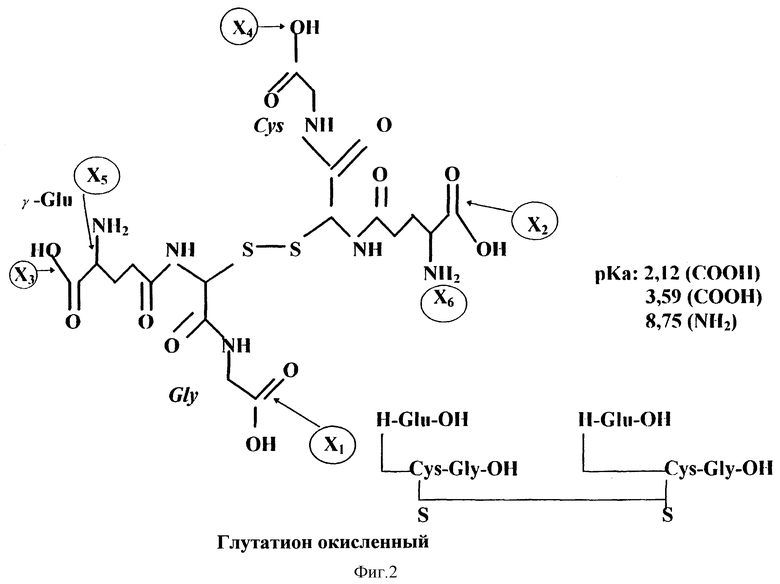
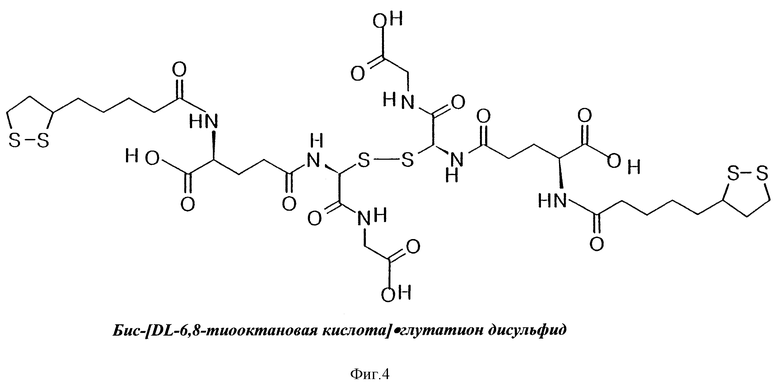
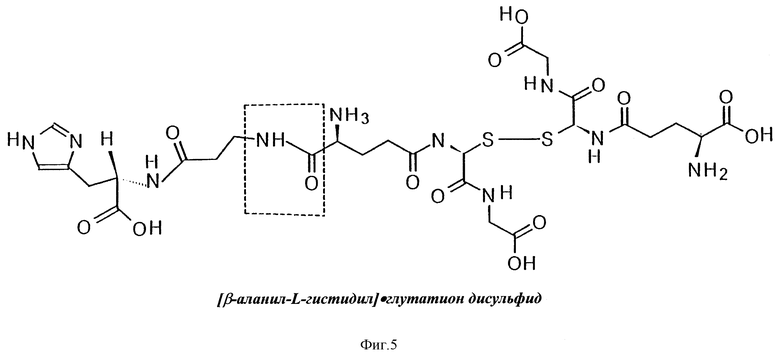

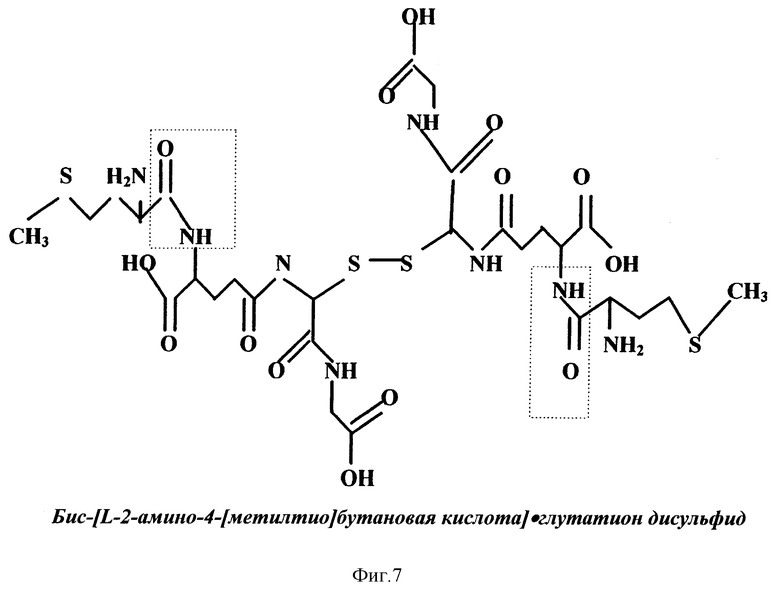
Изобретение относится к медицине, в частности к фармакологии и терапии. Способ модуляции и/или воспроизведения эффектов эндогенной продукции цитокинов и гемопоэтических факторов и/или индукции механизмов, апоптоза состоит во введении в организм млекопитающих, нуждающихся в стимуляции цитокинов или гемопоэтических факторов, или их обоих, эффективного количества окисленного глутатиона, его фармацевтически приемлемого производного, на период времени, достаточный для модуляции эндогенной продукции цитокинов и гемопоэтических факторов до достижения терапевтического эффекта, при котором указанный окисленный глутатион, или/и его фармацевтически приемлемые соли, или/и его фармацевтически приемлемые производные вводятся парентерально или локально. Согласно изобретению, окисленный глутатион, или/и его фармацевтически приемлемые соли, или/и его фармацевтически приемлемые производные вводятся совместно с пролонгатором полужизни указанного окисленного глутатиона, или/и его фармацевтически приемлемых солей, или/и его фармацевтически приемлемых производных. Технический результат: расширение спектра средств для регулирования эндогенной продукции цитокинов и гемопоэтических факторов. 6 с. и 50 з.п. ф-лы, 7 ил., 48 табл.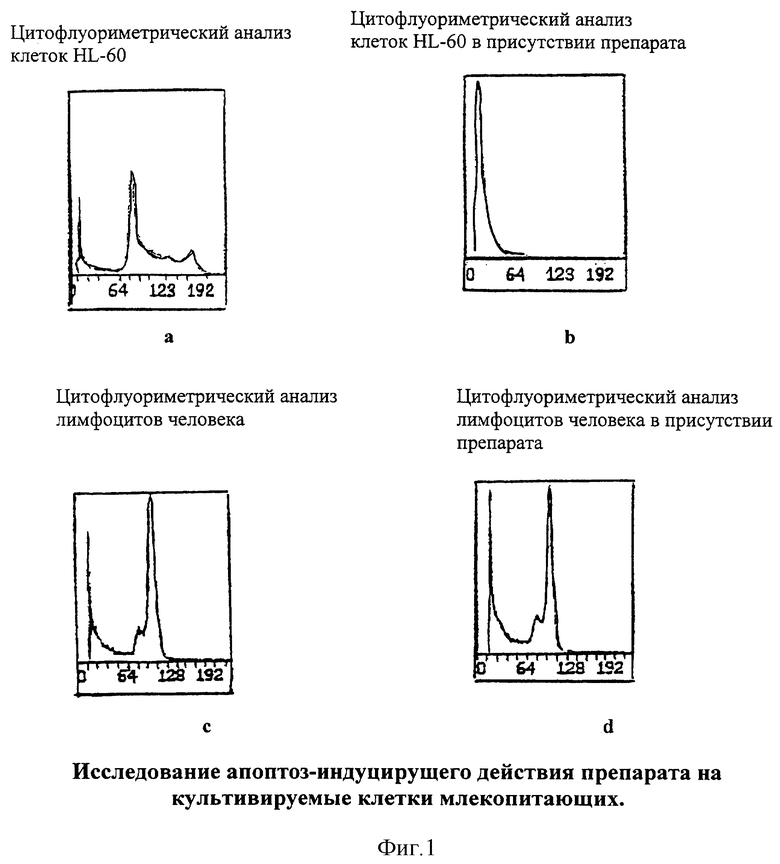
Приоритет по пунктам:
14.12.95 по пп.1, 27 и 36;
08.08.96 по пп.14 и 56;
10.12.96 по п.47.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| DROBE W | |||
| et al | |||
| Functions of glytathione and glytathione disulfide in immunology and immunopathology | |||
| FASE B J., 1994 Nov.8(14), p.1131 - 1138 | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| AUKRUST et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| US 5264418 А, 23.11.1993 | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| EP 0616803 А2, 17.02.94 | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Экономайзер | 0 |
|
SU94A1 |
Авторы
Даты
2000-07-27—Публикация
1996-12-10—Подача