Изобретение относится к фармацевтическим композициям, содержащим синтетические каталитические низкомолекулярные антиоксиданты и акцепторы свободных радикалов и предназначенным для лечения и предупреждения заболеваний; к способам использования указанных низкомолекулярных антиоксидантов для предупреждения и лечения патологических состояний; к способам использования низкомолекулярных антиоксидантов для целевой защиты тканей и/или определенных типов клеток во время противораковой химиотерапии; и к способам использования низкомолекулярных антиоксидантов для предупреждения токсикологических нарушений у индивидуумов, подвергаемых раздражающему действию оксидантов или других источников окислительного разрушения, в частности кислородных частиц, таких как супероксидный радикал. Композиции и способы настоящего изобретения могут быть также использованы для предупреждения окислительного разрушения в органах, трансплантируемых человеку, и для ингибирования повторного окислительного повреждения после реперфузии ишемических тканей. Кроме того, композиции и способы настоящего изобретения могут быть также использованы для предупреждения химического канцерогенеза и изменения лекарственного метаболизма, включая образование интермедиатов эпоксида и свободных оксирадикалов.
Молекулярный кислород является основным источником жизнедеятельности нефакультативно-аэробных организмов, включая человека. Кислород используется во многих важных процессах организма, а именно в качестве терминального акцептора электронов в окислительном фосфорилировании; во многих диоксигеназных реакциях, включая синтез простагландинов и витамина А из каротиноидов; в гидроксилазных реакциях организма, например в образовании и модификации стероидных гормонов; а также в активации и инактивации ксенобиотиков, например онкогенов. Экстенсивная система Р-450 использует молекулярный кислород в большинстве важных клеточных реакций. В природе свободные радикалы часто используются в ферментных реакциях широкого ряда.
Избыточные концентрации различных форм кислорода и свободных радикалов могут оказывать серьезное разрушающее воздействие на живые системы, включая переокисление мембранных липидов, гидроксилирование оснований нуклеиновых кислот, и окисление сульфгидрильных групп, и других реактивных групп в белках. В нерегулируемых условиях указанные процессы приводят к мутациям и гибели клеток.
Биологическими антиоксидантами являются хорошо известные ферменты, такие как супероксид-дисмутаза, каталаза, селенглутатионпероксидаза, и фосфолипид-гидропероксидглутатионпероксидаза. Неферментными биологическими антиоксидантами являются токоферолы и токотриенолы, каротиноиды, хиноны, биллирубины, аскорбиновая кислота, мочевая кислота и металлсвязывающие белки. Во всех частях клеток и тканей были обнаружены различные липидные и водорастворимые антиоксиданты, хотя каждый конкретный антиоксидант часто обнаруживает вполне определенный характер распределения свойств. Так называемые овотиолы, которые представляют собой производные меркаптогистидина, также обладают способностью к неферментному разложению пероксидов.
Свободные радикалы, в частности свободные радикалы, происходящие от молекулярного кислорода, играют фундаментальную роль в биологических процессах широкого ряда. Действительно, было высказано предположение, что большинство серьезных заболеваний может быть связано с кислородно-радикальной ("оксирадикальной") патологией (Zimmerman J. J. (1991) Chest 100: 1895). Например, оксирадикальные поражения, ответственные за патогенез токсичности легочного кислорода, респираторного дистресс-синдрома у взрослых (APDS), бронхолегочной дисплазии, сепсиса и ряда ишемическо-реперфузионных синдромов, включая инфаркт миокарда, шоковое состояние, экстракорпоральное кровообращение, трансплантации органов, некротический энтероколит, острый тубулярный некроз почек и другие заболевания. Оксирадикалы могут вступать в реакцию с белками, нуклеиновыми кислотами, липидами и другими биологическими макромолекулами, вызывая разрушение клеток и тканей, особенно у тяжело больных пациентов.
Свободные радикалы представляют собой атомы, ионы, или молекулы, которые содержат неспаренные электроны (Pryor W.A. (1976) Free Radicals in Biol. l: 1). В обычных условиях свободные радикалы, как правило, нестабильны, и не могут существовать длительное время. Атомарный кислород является в высокой степени электроотрицательным и легко акцептирует электроны от одноэлектронных переносчиков-цитохромов и других восстановленных клеточных компонентов; при этом часть O2, потребляемая клетками, участвующими в аэробном дыхании, подвергается одновалентному восстановлению до супероксидного радикала (•O2 -) (Cadenas Е. (1989) Ann.Rev.Biochem. 58 : 79). Последовательное одновалентное восстановление •O2 - приводит к образованию пероксида водорода (H2O2), гидроксильного радикала (•ОН) и воды.
Свободные радикалы могут происходить от многих источников, включая аэробное дыхание, катализируемые цитохромом Р-450, реакции монооксигенирования лекарственных средств и ксенобиотиков (например, трихлорметильные радикалы, CCl3•, образованные в результате окисления тетрахлорметана) и ионизирующее излучение. Например, при воздействии на ткани гамма-излучения большая часть энергии, накопленной в клетках, поглощается водой, в результате чего происходит разрыв ковалентных связей "кислород-водород" в воде, что приводит к отрыву одного электрона от водорода и одного от кислорода, и тем самым к созданию двух радикалов Н• и •ОН. Известно, что гидроксильный радикал •ОН является наиболее реакционноспособным радикалом. Он вступает в реакцию с биологическими молекулами и инициирует цепные реакции, и, кроме того, он способен взаимодействовать с пуриновыми или пиримидиновыми основаниями нуклеиновых кислот. Фактически индуцированный излучением канцерогенез может быть инициирован свободно-радикальным повреждением (Breimer LH (1988) Brit. J. Cancer 57 : 6). Так, например, "окислительный взрыв" активированных нейтрофилов продуцирует чрезмерное количество супероксидных радикалов, которое, очевидно, является главным фактором в индуцировании цитотоксичного действия активированных нейтрофилов. Реперфузия ишемических тканей также способствует продукцированию больших концентраций оксирадикалов, обычно супероксидных радикалов (Gutteridge JMS and Halliwell В (1990) Arch. Biochem. Biophys. 283 : 223). Кроме того, супероксид может быть продуцирован in vivo эндотелиальными клетками в результате реакции с окисью азота (физиологическим регулятором) с образованием пероксинитрита, ONOO-, который может разлагаться, образуя при этом гидроксильный радикал •ОН (Marletta М.А. (1989) Trends Biochem. Sci. 14 : 488;; Moncada et al., (1989) Biochem. Pharmacol. 38: 1709; Saran et al., (1990) Free Rad. Res. Commun. 10 : 221 Beckman et al., (1990) Proc. Natl. Acad. Sci. (U.S.A.) 87 : 1620). Дополнительными источниками оксирадикалов являются "утечка" электронов в результате разрыва цепи переноса электронов из митохондрий или эндоплазматического ретикулума, синтез простагландинов, окисление катехоламинов и активация тромбоцитов.
Многие реакции свободных радикалов оказывают значительное разрушающее действие на клеточные компоненты; они способствуют структурированию белков, мутагенезу ДНК и переокислению липидов. Свободные радикалы после образования могут взаимодействовать друг с другом с образованием других свободных радикалов и нерадикальных оксидантов, таких как синглетный кислород (1O2) и перекиси. Распад некоторых из продуктов свободно-радикальных реакций может также способствовать образованию потенциально вредных химических соединений. Например, таким соединением является малондиальдегид, который представляет собой реакционный продукт пероксидированных липидов и который реагирует фактически с любой аминосодержащей молекулой. Кроме того, свободные радикалы кислорода вызывают окислительную модификацию белков (Stadtman Е.Р. (1992) Science 257: 1220).
Аэробные клетки в основном обладают различными механизмами защиты от повреждающего действия оксирадикалов и их реакционных производных. Супероксид-дисмутаза, (SOD) катализирует реакцию 2O2 -+2H+--->O2+H2O2, в результате которой удаляется супероксид и образуется перекись водорода. H2O2 не является радикалом, но, тем не менее, она является токсичной для клеток и может быть удалена с помощью ферментной активности каталазы и глутатионпероксидазы (GsH-Px).
Каталаза катализирует реакцию 2H2O2--->2H2O+O2, а GsH-Px удаляет перекись водорода путем использования ее для окисления восстановленного глутатиона (GsH) с образованием окисленного глутатиона (GSSG) в соответствии с нижеследующей реакцией 2GSH+H2O2--->GSSG+2H2O.
Другие ферменты, например фосфолипид-гидроперекись-глутатионпероксидаза (PLOOH-GSH-Px), превращают реактивные гидроперекиси фосфолипидов, гидроперекиси свободных жирных кислот и гидроперекиси фосфолипидов, гидроперекиси свободных жирных кислот и гидроперекиси холестерина в соответствующие безвредные спирты жирных кислот. Глутатион -S-трансферазы также участвуeт в детоксикации органических перекисей. В отсутствии указанных ферментов и в присутствии переходных металлов, таких как железо или медь, супероксид и перекись водорода могут участвовать в нижеследующих реакциях, в результате которых генерируется в высокой степени реактивный гидроксильный радикал •ОН-:
•O2 -+Fe3+--->O2+Fe2+;
H2O2+Fe2+--->•OH+OH-+Fe3+.
Помимо ферментной детоксикации свободных радикалов и оксидантов, в качестве природных физиологических антиоксидантов могут служить низкомолекулярные антиоксиданты, такие как глутатион, аскорбат, токоферол, убихинон, биллирубин и мочевая кислота (Krinsky N.I. (1992) Proc. Soc. Exp. Biol. Med. 200 : 248-54) Другой класс низкомолекулярных антиоксидантов представляют каротиноиды, которые играют роль защитных агентов против окислительного шока и хронических заболеваний. В своей работе Canfield и др. (Proc.Soc.Exp. Biol. Med. 200 : 260 (1992)) приводят обобщенные данные относительно взаимосвязи между каротиноидами и различными хроническими заболеваниями, такими как сердечно-сосудистые заболевания, катаракта и рак. Так, например, каротиноиды способствуют резкому снижению случаев возникновения предраковых состояний (таких, как лейкоплакия) у некоторых пациентов.
В попытках предупреждения неблагоприятных эффектов, возникающих в результате образования оксирадикалов в процессе реоксигенации ишемических тканей, были использованы различные антиоксиданты.
Один из способов предупреждения индуцированных оксирадикалами нарушений заключается в ингибировании образования оксирадикалов, таких как супероксиды. Агенты, образующие хелатные комплексы с ионами железа, например, такие как десферриоксамин (называемый также дефероксамин или Десферол) и др., ингибируют зависимое от ионов железа продуцирование •ОН, а потому являются ингибиторами образования свободных радикалов (Gutteridge et аl. (1979) Biochem. J. 184 : 469; Halliwell В (1989) Free Radikal Biol. Med. 7 : 645; Van der Kraaij et аl. (1989) Curculation 80 : 158). В качестве ингибиторов образования оксирадикалов было также предложено использовать антиоксиданты на основе аминостероидов, такие как 21-аминостероиды, называемые "лазароиды" (например, U74006F). Кроме того, были исследованы десферриоксамин, аллопуринол и другие пиразолопиримидины, такие как оксипиранол, на их способность предупреждать образование оксирадикалов в системе модели инфаркта миокарда (Bolli et аl. (1989) Circ. Res. 65 : 607) и после геморрагического и эндотоксинового шока (De Garavilla et аl. (1992) Drug Devel. Res. 25 : 139). Однако каждое из этих соединений при его использовании в терапевтических целях имеет значительные недостатки. Например, дефероксамин не является идеальным Fe-хелатором, и его клеточная проницаемость весьма ограничена.
Другой способ предупреждения оксирадикал-индуцированных нарушений заключается в каталитическом удалении оксирадикалов после иx образования, например, таких радикалов, как супероксид. Во многих экспериментах в качестве защитных агентов при добавлении к реперфузатам или добавлении в целях предупреждения ишемии (Gutteridge J.M.S. & Halliwell В (1990), см. выше) широко использовались супероксид-дисмутаза и каталаза. Возможность использования рекомбинантной супероксид-дисмутазы позволяет с большей эффективностью оценить действие SOD при лечении или предупреждении различных патологических состояний, таких как реперфузионные повреждения головного и спинного мозга (Uyama et аl. (1990) Free Radic. Biol. Med. 8 : 265; Lim et al. (1986) Ann. Thorac. Surg. 42 : 282); эндотоксикоз (Scyneider et al. (1990) Circ. Shock 30: 97; Scneider. et al. (1989) Prog. Clin. Biol. Res. 308 : 913; инфаркт миокарда (Patel et al. (1990) Am. J. Physiol. 258 : H369; Metha et al. (1989) Am. J. Physiol. 257 : H 1240; Nejima et al. (1989) Circulation 79 : 143; Fincke et al. (1988) Arzneimittelfor- schung 38 : 138; Ambrosio et al. (1987) Circulation 75 : 282); остеоартрит и кишечная ишемия (Vohra et al. 1989) J. Pediatr. Surg. 24 : 893; Flohe L. (1988) Moll.Cell.Biochem. 84 : 123). Кроме того, сообщалось, что супероксид-дисмутаза оказывает положительное действие при лечении системной красной волчанки, болезни Крона, язвы желудка, кислородного токсикоза, ожогов, почечной недостаточности, связанной с трансплантацией, и инфекций, вызванных вирусом простого герпеса.
Альтернативный способ предупреждения оксирадикал-индуцированных нарушений предусматривает захватывание оксирадикалов, например супероксидов, после их образования, обычно путем использования молекулярных акцепторов, которые действуют не каталитически, а схематически. Для ослабления повреждающего действия оксирадикалов в различных in vivo-моделях были использованы соединения, родственные глутатиону. Так, например, было обнаружено, что N-2-меркаптопропионилглицин обладает защитным действием в модели ишемии миокарда и реперфузии у собак (Mitsos et аl. (1986) Circulation 73 : 1077), a N- ацетилцистеин ("Мукомист") был использован для лечения эндотоксикоза у овец (Bernard et аl., (1984) J.CIin.Invest. 73 : 1772). Было показано, что димелтиомочевина (DMTU) и бутил-а-фенилнитрон (BPN) являются акцепторами гидроксильного радикала ОН и тем самым способствуют снижению ишемическо-реперфузионных повреждений в миокарде крыс и кроликов (Vander Heide et аl. (1987) J. Mol. Gell. Cardiol. 19: 615; Kennedy et аl. (1987) J. App. Phisiol. 63: 2426). Для уменьшения повреждения органов в процессе реоксигенации, в качестве акцептора свободных радикалов был также использован маннит (Fox Р.В. J. Clin. Invest. 74 : 1456; Ouriel et аl. (1985) Cirkulation 72 : 254). В одной работе сообщалось, что низкомолекулярный хелат обладает активностью, имитирующей активность глутатионпероксидазы (Spector et аl. (1993) Proc. Natl. Acad. Sci. (U.S.A.) 90 : 7485).
Таким образом, было показано, что для предупреждения поражений, связанных с реоксигенацией тканей и возникающих в ряде ишемических патологических состояний, а также для лечения и предупреждения различных патологических состояний, ассоциируемых с присутствием свободных радикалов, могут быть с успехом использованы ингибиторы образования оксирадикалов, и/или ферменты, способствующие удалению супероксидов и пероксидов водорода, и/или низкомолекулярных акцепторов оксирадикалов. Однако все из вышеназванных соединений имеют определенные недостатки. Так, например, ингибиторы образования оксирадикалов обычно образуют хелатные комплексы с переходными металлами, используемыми в основных ферментных процессах жизнедеятельности организма и дыхании; и, кроме того, даже при очень высоких дозах эти ингибиторы полностью не подавляют образование оксирадикалов. Супероксид-дисмутазы и каталаза представляют собой крупные полипептиды, которые являются весьма дорогостоящими для промышленного производства и которые не проникают в клетки или не преодолевают гематоэнцефалический барьер, и, кроме того, пригодны в основном для парентерального введения. Акцепторы свободных радикалов действуют стехиометрически, в результате чего их количество быстро истощается, а поэтому для получения нужного эффекта они должны быть введены в высоких дозах.
В соответствии с вышесказанным было необходимо разработать такие антиоксиданты, которые были бы эффективны для удаления опасных оксирадикалов, в частности супероксидов и пероксидов водорода, которые были бы недорогостоящими для их промышленного производства и которые обладали бы стабильностью и хорошими фармакокинетическими свойствами, такими как способность преодолевать гематоэнцефалический барьер и проникать в ткани. Такие универсальные антиоксиданты можно было бы использовать в качестве химиотерапевтических средств, а, возможно, и в качестве диетических добавок. Целью настоящего изобретения является получение класса новых соединений, которые обладают нужными фармакологическими свойствами и которые каталитически и/или стехиометрически удаляют супероксид и/или перекись водорода.
Работы, обсуждаемые выше, приводятся для пояснения предпосылок создания настоящего изобретения. Все публикации, цитированные выше, приведены в настоящем описании в качестве ссылок.
В соответствии с вышеуказанными целями одним из объектов настоящего изобретения является фармацевтическая композиция, которая обладает антиокисляющими свойствами и/или свойствами, способствующими удалению свободных радикалов, и которая действует как in vivo-антиоксидант. Фармацевтическая композиция настоящего изобретения содержит эффективное количество по крайней мере одного вида саленового комплекса переходных металлов, в основном комплекса "сален-марганец", такого как комплекс "сален-Mn" (III). В одном варианте осуществления настоящего изобретения фармацевтическая композиция содержит комплекс "сален-Mn", который представляет собой хелатный комплекс Mn (III) с диаминовым производным, таким как этилендиамин, связанный с двумя замещенными салицилальдегидами. Указанные фармацевтические композиции обладают способностью к дисмутации супероксида (т.е. обладают супероксид-дисмутазной активностью), а также способностью превращать перекись водорода в воду (т.е. обладают каталазной активностью). Фармацевтическая композиция является эффективным средством для снижения патологических нарушений, связанных с образованием оксирадикалов, таких как супероксиды и пероксиды, и других видов свободных радикалов.
Настоящее изобретение также относится к способам лечения и предупреждения патологических состояний путем нанесения или введения композиций, содержащих саленовые комплексы переходных металлов в терапевтически или профилактически эффективных дозах. В способах настоящего изобретения используются в основном комплексы "салена-марганца", такие как Mn (III)-саленовые комплексы. Настоящее изобретение относится к способам предупреждения или снижения ишемических/реперфузионных повреждений жизненно важных тканей организма, таких как ткани миокарда и центральной нервной системы. Настоящее изобретение также относится к способам предупреждения или уменьшения разрушения клеток, обусловленного действием различных химических соединений, которые продуцируются потенциально опасными видами свободных радикалов; при этом указанные способы предусматривают введение терапевтически или профилактически эффективного количества по крайней мере одного вида саленового комплекса переходных металлов, предпочтительно комплекса "сален-марганец", обладающего значительной SOD-активностью, а также предпочтительно значительной каталазной активностью. Антиокислительные саленовые комплексы переходных металлов настоящего изобретения могут быть введены различными способами, например парентерально, местно или перорально.
В одном из вариантов настоящего изобретения комплекс "сален-переходный металл", взятый в терапевтической или профилактической дозе, может быть введен отдельно или в комбинации (1) с одним или несколькими антиокислительными ферментами, такими как Mn-SOD, Cu, Zn-SOD, или каталаза, и/или (2) с одним или несколькими акцепторами свободных радикалов, такими как токоферол, аскорбат, глутатион, DMTV, N-ацетилцистеин, или N-2- меркаптопропионилглицин, и/или (3) с одним или несколькими ингибиторами оксирадикалов, таким как десферриоксамин или аллопуринол, и/или с одним или несколькими биологическими модифицирующими агентами, такими как ингибиторы кальпаина. Состав указанных композиций зависит от конкретного патологического состояния, на которое направлено лечение или профилактические меры, от способа введения, а также от возраста, пола и состояния пациента. Эти композиции имеют различные показания, например они могут быть использованы (1) для предупреждения повреждений ткани у пациента, обусловленных ишемией/реоксигенацией, (2) для хранения органов-трансплантатов до их трансплантации в бескислородном, гипоксическом или гипероксидном состоянии, (3) для защиты нормальных тканей от повреждающего действия свободных радикалов, обусловленного воздействием ионизирующего излучения и/или химиотерапии, например с использованием блеомицина, (4) для защиты клеток и тканей от повреждающего действия свободных радикалов, обусловленного воздействием ксенобиотиков, которые образуют свободные радикалы либо непосредственно, либо в результате монооксигенации посредством системы цитохром Р-450, (5) для улучшения криоконсервации клеток, тканей, органов и организмов путем повышения жизнеспособности восстановленных препаратов и (6) в качестве профилактических мер для предупреждения канцерогенеза, старения клеток, образования катаракты, образования аддуктов малондиальдегида, ВИЧ-патологии, и макромолекулярного перекрестного сшивания, например коллагенового сшивания.
В одном из вариантов настоящего изобретения комплексы "сален-переходный металл" могут быть изготовлены в виде лекарственных форм, предназначенных для перорального введения, содержащих наполнитель и не менее чем 1 мкг и не более чем 10 г по крайней мере одного антиокислительного комплекса "сален-переходный металл" настоящего изобретения. Указанные пероральные композиции предназначены для лечения индуцированных свободными радикалами заболеваний, и/или предупреждения неоплазии, и/или оксигенного повреждения, ассоциированного с нормальным аэробным метаболизмом.
В другом варианте настоящего изобретения, композиции изготавливают в виде забуференных водных растворов, которые содержат по крайней мере один противоокислительный комплекс "сален-переходный металл" настоящего изобретения в концентрации от 1 нМ до около 100 мМ и которые предназначены для введения (в основном в концентрации от около 0,1 до 10 мМ обычно внутривенно) пациенту, подвергающемуся, или пациенту, который может быть подвергнут (1) ишемическому приступу, такому как инфаркт миокарда; приступу церебральной ишемии; операции по трансплантации, операции на открытом сердце; элективной пластической операции на сосудах; операции по артериокоронарному шунтированию; операции на головном мозге; инфаркту почек; травматическому кровотечению; наложению жгута; (2) противоопухолевой и антигельминтной химиотерапии с использованием химиотерапевтического агента, генерирующего свободные радикалы; (3) эндотоксиновому шоку или сепсису; (4) воздействию ионизирующего излучения; (5) воздействию экзогенных химических соединений, которые представляют собой свободные радикалы либо продуцируют свободные радикалы; (6) термическим или химическим ожогам или изъязвлениям; (7) воздействию кислорода под повышенным давлением; или (8) апоптозу данной клеточной популяции (например, апоптозу лимфоцитов). Забуференные водные растворы настоящего изобретения могут быть также использованы (обычно в сочетании с другими традиционными методами) для получения культур органов, клеточных культур, сохранения трансплантатов и ирригации миокарда. Кроме того, могут быть использованы и безводные композиции, например композиции на липидной основе, такие как стабилизированные эмульсии. Антиокислительные композиции настоящего изобретения могут быть введены различными способами, например в виде внутривенных инъекций, подкожных инъекций, интраперикардиальных инъекций, хирургических ирригаций, местных аппликаций, глазных капель, в виде препаратов для лаважа, чреззондового питания, клизм, внутрибрюшинного вливания, аэрозольных ингаляций, промывания полости рта и других препаратов в зависимости от конкретных целей использования в медицине или ветеринарии.
В другом варианте настоящего изобретения антиокислительные комплексы "сален-переходный металл" используются для модуляции экспрессии природных генов или других полинуклеотидных последовательностей, находящихся под транскрипционным контролем элемента, ответственного за реакцию на окислительный стресс (например, антиокислительный реактивный элемент, ARE), такого как антиокислительный реактивный элемент гена глутатион-S-трансферазы или гена NAD (Р)Н: хинонредуктазы. Антиокислительные сален-металлические комплексы могут быть использованы для модуляции транскрипции ARE-регулируемых полинуклеотидных последовательностей в клеточных культурах (например, ES-клеток) и в интактных животных, в частности в трансгенных животных, где трансген содержит один или несколько ARE в качестве последовательностей, регулирующих транскрипцию.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим антиокислительные комплексы "сален-марганец"; к использованию указанных антиокислительных комплексов; к способам и композициям указанных сален-марганцевых комплексов для использования в диагностических, терапевтических и в исследовательских целях в области медицины и ветеринарии.
Кроме того, настоящее изобретение относится к способам предохранения пищевых продуктов от порчи и окисления путем обработки этих продуктов эффективным количеством по крайней мере одного из противоокислительных сален-металлических комплексов. Настоящее изобретение также относится к композициям, предназначенным для предохранения пищевых продуктов от порчи и содержащим эффективное количество по крайней мере одного вида противоокислительного сален-металлического комплекса в сочетании по крайней мере с одним пищевым консервантом (например, таким, как бутилированный гидрокситолуол, бутилированный гидроксианизол, сульфаты, нитрит натрия, нитрат натрия). Так, например, противоокислительный сален-металлический комплекс может быть введен в пищевой продукт, подверженный прогорканию (например, окислению), в целях снижения скорости окислительного разложения пищевого продукта под воздействием молекулярного кислорода.
На фиг. 1 показана общая структура саленового производного настоящего изобретения.
На фиг. 2 показано саленовое производное, имеющее структуру, представленную на фиг. 1, где n = 0.
На фиг. 3 показаны структуры предпочтительных соединений настоящего изобретения.
На фиг. 4 схематически показано влияние ишемического/реоксигенационного приступа на синаптическую передачу в выделенных срезах головного мозга.
На фиг. 5 показано влияние комплекса "сален-Mn" на амплитуду ВПСП после приступа ишемии/реокисления.
На фиг. 6 показано влияние комплекса "сален-Mn" на начальную крутизну ВПСП после шока, вызванного ишемией/реокислением.
На фиг. 7 показано влияние комплекса "сален-Mn" на жизнеспособность срезов головного мозга после повторных приступов ишемии/реокисления.
На фиг. 8 показано защитное действие комплекса "сален-Mn" с использованием модели животных с ятрогенной болезнью Паркинсона.
На фиг. 9 показано, что С7 защищает срезы аммонова рога от липидного переокисления, индуцированного молочной кислотой.
На фиг. 10 показано, что С7 защищает допаминергические нейроны полосатого тела мозга мыши от 6-OHDA-индуцированной дегенерации.
На фиг. 11 показано, что С7 защищает допаминергические нейроны полосатого тела мозга мыши от МРТР-индуцированной дегенерации.
Если это не оговорено особо, то все технические и научные термины, используемые в данной заявке, имеют значения, обычно подразумеваемые специалистами в области науки, к которой принадлежит настоящее изобретение. При осуществлении или испытании настоящего изобретения могут быть использованы любые методы и материалы, аналогичные или эквивалентные описанным в данной заявке; ниже приводится описание предпочтительных материалов и методов. Термины, используемые для описания настоящего изобретения, имеют значения, определенные ниже.
Используемый в настоящем описании термин "антиоксидант" означает вещество, присутствие которого в смеси или структуре, содержащей окисляемую субстратную биологическую молекулу, способствует значительному снижению или предупреждению окисления указанной субстратной биологической молекулы. Антиоксиданты могут действовать путем захвата биологически важных реакционноспособных свободных радикалов или других реакционноспособных кислородных групп (•O2 -, H2O2, •OH, HOCl, ферил, пероксил, пероксинитрит и алкоксил) либо путем предупреждения их образования, либо путем каталитического превращения свободного радикала или других реакционноспособных кислородных молекул или ионов в менее реактивные молекулы или ионы. В соответствии с настоящим изобретением антиокислительный саленовый комплекс переходного металла обычно обладает значительной SOD-активностью. Комплекс "сален-переходный металл" настоящего изобретения обладает антиокислительной активностью в том случае, если указанный комплекс при его добавлении к клеточной культуре или аналитической реакционной смеси продуцирует значительное уменьшение количества свободных радикалов, таких как супероксид, или других реакционноспособных кислородных молекул, таких как пероксид водорода, по сравнению с параллельной клеточной культурой или аналитической реакцией, которые не были обработаны данным комплексом. Нужные концентрации (т.е. эффективные дозы) могут быть определены различными методами, включая построение эмпирической кривой зависимости "доза-эффект", предварительную оценку эффективности соединения того же типа с использованием QSAR-методов (QSAR-количественная взаимосвязь строения и активности) или молекулярного моделирования, либо другими методами, обычно используемыми в фармацевтической практике. Поскольку окислительное повреждение является в основном кумулятивным, то минимальный пороговый уровень (или доза) в отношении эффективности антиоксиданта отсутствует, хотя минимальные дозы для продуцирования обнаружимого терапевтического или профилактического эффекта при каждом конкретном заболевании могут быть установлены. Антиокислительные саленовые металлические комплексы настоящего изобретения могут обладать глутатионпероксидазной активностью.
Используемый в настоящем описании термин "комплекс сален-переходный металл" относится к соединению, имеющему структуру, соответствующую cтруктурам I-IX (см. ниже), либо любой структуре из С1, С4, С6, С7, С9, С10, С11, С12, С15, С17, С20, С22, С23, С25, С27-С30, показанным на фиг. 3 и ниже; а предпочтительно структуру, соответствующую одной из структур, показанных на фиг. 3 и выбранных из С6, С7 и С12; и более предпочтительно структуру, соответствующую структурам С7 или С12, предназначенным для каталитического удаления супероксида. Переходный металл в основном выбирают из группы, включающей в себя Mn, Mg, Со, Fe, V, Cr и Ni; а более предпочтительно, если таким металлом является Mn или Mg.
Используемый в настоящем описании термин "заболевание, ассоциированное со свободными радикалами" относится к патологическому состоянию индивидуума, являющемуся по крайней мере отчасти результатом продуцирования или действия свободных радикалов, в частности оксирадикалов или других реакционноспособных кислородных молекул или ионов, присутствующих в организме. Каждому специалисту известно, что большинство патологических состояний обусловлено многими факторами, и определить или идентифицировать доминирующий этиологический фактор для любого конкретного заболевания часто представляет серьезные трудности. Исходя из этого термин "заболевание, ассоциированное со свободными радикалами" включает в себя такие заболевания, о которых специалистам в данной области известно, что их патология является результатом воздействия свободных радикалов или реакционноспособных кислородных молекул или частиц; и при которых введение ингибитора свободных радикалов (например, десферриоксамин), акцептора свободных радикалов (например, токоферола, глутатиона), или катализатора (например, SOD, каталазы) продуцирует заметное уменьшение симптомов, увеличивает продолжительность жизни или оказывает другое благоприятное воздействие при лечении или предупреждении указанных патологических состояний. Примерами таких заболеваний могут служить, но не ограничиваются ими, патологические состояния, рассматриваемые в данной заявке как заболевания, обусловленные присутствием свободных радикалов, такие как ишемическо-реперфузионные повреждения, воспалительные заболевания, системная красная волчанка, инфаркт миокарда, шок, травматические кровотечения, травмы спинного мозга, болезнь Крона, аутоимунные заболевания (например, ревматоидный артрит, диабет), образование катаракты, увеит, эмфизема, язвы желудка, кислородный токсикоз, неоплазия, нежелательный апоптоз клеток, лучевая болезнь и другие патологические состояния, обсуждаемые в описании.
Используемые в настоящем описании термины "SOD-имитатор", "имитатор супероксид-дисмутазы" и "супероксидный катализатор" относятся к соединениям, обладающим обнаружимой каталитической активностью в отношении дисмутации супероксида, определяемой с помощью анализа. Обычно SOD-активность SOD-имитатора составляет по крайней мере около 0,001% по отношению к SOD-активности чел. Mn-SOD или Zn, Cu-SOD (исходя из молярного соотношения), как было определено с помощью стандартных аналитических методов; и/или указанная активность составляет по крайней мере 0,01 ед. SOD-активности/мМ в соответствии с SOD-анализом, описанным ниже, а предпочтительно по крайней мере 1 ед. SOD-активности/мМ.
Термин "алкил" относится к циклической, разветвленной или линейной алкильной группе, состоящей лишь из углерода и водорода и содержащей, если это не указано особо, от 1 до 12 атомов углерода. Примерами таких групп являются метил, этил, н-пропил, изобутил, трет-бутил, пентил, пивалил, гептил, адамантил и циклопентил. Алкильные группы могут быть незамещенными или замещенными одним или несколькими заместителями, такими как галоген, алкил, алкокси, алкилтио, трифторометил, ацилокси, гидрокси, меркапто, карбокси, арилокси, арил, арилалкил, гетероарил, амино, алкиламино, диалкиламино, морфолино, пиперидино, пирролидин-1-ил, пиперазин-1-ил или другими функциональными группами.
Термин "низший алкил" относится к циклическому разветвленному или линейному моновалентному алкильному радикалу с 1-6 атомами углерода. Примерами таких радикалов являются метил, этил, н-пропил, изо-пропил, н-бутил, трет-бутил, изо-бутил (или 2-метилпропил), циклопропилметил, изо-амил, н-амил и гексил.
Термин "арил" или "Ar" относится к одновалентной ненасыщенной ароматической карбоциклической группе, имеющей одно кольцо (например, фенил) или несколько конденсированных колец (например, нафтил или антрил), которые могут быть незамещенными или замещенными, например такими группами, как галоген, алкил, алкокси, алкилтио, трифторометил, ацилокси, гидрокси, меркапто, карбокси, арилокси, арил, арил-алкил, гетероарил, амино, алкиламино, диалкиламино, морфолино, пиперидино, пирролидин-1-ил, пиперазин-1-ил или другими функциональными группами.
Термин "замещенная алкокси-группа" относится к группе, имеющей структуру -O-R-, где R является алкилом, замещенным инертным заместителем. Термин "арилалкокси" относится к группе, имеющей структуру -O-R-Ar, где R является алкилом, а Ar является ароматическим заместителем. Арилалкокси-группы представляют собой подгруппу замещенных алкокси-групп. Примерами предпочтительных замещенных алкокси-групп являются бензилокси-, нафтилокси- и хлоробензилокси-группы.
Термин "арилокси" относится к группе, имеющей структуру -O-Ar, где Ar представляет собой ароматическую группу. Предпочтительной арилокси-группой является фенокси-группа.
Термин "гетероцикл" относится к одновалентной, насыщенной, ненасыщенной, или ароматической карбоциклической группе, имеющей одно кольцо (например, морфолино, пиридил или фурил) или несколько конденсированных колец (например, индолизинил, или бензо[b]тиенил) и по крайней мере один гетероатом (например, N, О, Р или S) внутри этого кольца, которое может быть незамещенным или замещенным, например, галогеном, алкилом, алкокси, алкилтио, трифторометилом, ацилокси, меркапто, гидрокси, карбокси, арилокси, арилом, арилалкилом, гетероарилом, амино, алкиламино, диалкиламино, морфолино, пиперидино, пирролидин-1-ил, пиперазин-1-илом или другой функциональной группой. Термин "гетероарил" или "HetAr" относится к ароматическому гетероциклу.
Термин "арилалкил" относится к группам -R-Ar и -R-HetAr, где Ar представляет собой арильную группу, HetAr представляет собой гетероарильную группу, а R представляет собой прямую или разветвленную алифатическую группу. Примерами арилалкильных групп являются бензильная и фурфурильная группа. Арилалкильные группы могут быть незамещенными или замещенными, например, галогеном, алкилом, алкокси, алкилтио, трифторометилом, ацилокси, гидрокси, меркапто, карбокси, арилокси, арилом, арилалкилом, гетероарилом, амино, алкиламино, диалкиламино, морфолино, пиперидино, пирролидин-1-илом, пиперазин-1-илом или другой функциональной группой.
Используемый в настоящем описании термин "галогено" или "галоид" относится к фторо-, бромо-, хлоро- и иодо-заместителям.
В формулах, приведенных ниже, обозначение "OBn" означает бензилокси.
Используемый в настоящем описании термин "амино" относится к химической функциональной группе -NR' R'', где R' и R'' независимо представляют собой водород, алкил или арил. Термин "четвертичный амин" относится к положительно заряженной группе -N+R'R''R''', где R', R'',R''' независимо представляют собой алкил или арил. Предпочтительной амино-группой является -NH2.
Термин "силил", используемый в настоящем описании, относился к металлоорганическим заместителям, где по крайней мере один атом кремния связан по крайней мере с одним атомом углерода. Примером силильного заместителя является триметилсилильный заместитель (CH3)3Si-.
Используемый в настоящем описании термин "фармацевтический агент или лекарственное средство" относится к химическому соединению или композиции, которые при их введении пациенту способны продуцировать нужный терапевтический эффект.
Другие химические термины, используемые в настоящем описании, имеют общеупотребительные значения, см. , например, The McGraw-Hill Dictionary of Chemical Terms (ed. Parker, S., 1985), McGraw-Hill, San Francisco).
В основном используемая в настоящей заявке номенклатура, а также описанные лабораторные процедуры с использованием клеточных культур, аналитической химии, химии синтеза органических соединений и процедуры по изготовлению фармацевтических препаратов хорошо известны специалистам и широко применяются на практике. Для химического синтеза, химических анализов, изготовления фармацевтических препаратов и лечения пациентов использовали стандартные методы.
В основу настоящего изобретения было положено неожиданное обнаружение того факта, что представители класса соединений, описанных первоначально как катализаторы эпоксидирования, т.е. так называемые саленовые комплексы переходных металлов, также обладают сильной супероксид-дисмутазной активностью и/или каталазной активностью и действуют как катализаторы in vitro- и in vivo-удаления свободных радикалов. Указанные саленовые комплексы переходных металлов были описаны как хиральные катализаторы эпоксидирования, используемые для синтеза различных химических соединений (Fu et аl., (1991) J. Org. Chem. 56 : 6497; Zhang W. & Jacobsen E.N. (1991), J. Org.Chem. 56 : 2296; Jacobsen et al., (1991) J.Am.Chem.Soc. 113 : 6703; Zhang et al., (1990) J. Am. Chem. Soc. 112 : 2801; Lee N.H. & Jacobsen E.N. (1991) Tetrahedron Lett. 32 : 6533; Jacobsen et аl., (1991) J.Am.Chem.Soc. 113 : 7063; Lee et al. (1991) Tetrahedron Lett. 32 : 5055). Однако комплексы "сален-переходный металл" могут быть также использованы в биологических целях как сильные антиоксиданты, например они могут быть использованы в качестве фармацевтических средств для предупреждения или лечения заболеваний, ассоциированных с присутствием свободных радикалов.
Фармацевтические композиции, пищевые добавки, улучшенные культуральные среды для клеток и органов, улучшенные среды для криоконсервации, мази для наружного применения и композиции для противохимической и противолучевой защиты могут содержать эффективные количества или концентрации по крайней мере одного противоокислительного комплекса "сален-переходный металл".
Сален-металлические комплексы, способные катализировать взаимопревращения эпоксидов, могут быть также использованы для удаления или предупреждения in vivo-образования цитотоксичных и/или канцерогенных эпоксидов, например таких, которые могут быть образованы в результате действия монооксигеназной системы окисления цитохрома Р-450 (например, бензо-[a]-пирендиолэпоксид). Каталитические сален-металлические комплексы могут быть с успехом использованы в виде пищевых добавок (или в других формах) для введения индивидуумам, подверженным риску воздействия полициклических углеводородных канцерогенов, например индивидуумам, занятым в нефтехимической промышленности и в производстве красителей. Кроме того, каталитически активные сален-металлические комплексы могут быть введены курильщикам (включая пассивных курильщиков) для дезинтоксикации реактивных эпоксидов, образующихся в результате курения сигарет.
Антиокислительные металлосаленовые комплексы настоящего изобретения могут быть использованы для частичного или полного прекращения прогрессирования нейродегенеративных заболеваний. Например, имеются сведения, что амиотрофический боковой склероз в значительной степени связан с мутациями у Cu-Zn-супероксид- дисмутазы (Rosen et аl. (1993) Nature 362 : 59; Deng et al. (1993) Science 261 : 1047). Аналогичные дефекты в эндогенной противоокислительной защите могут быть ответственны за возникновение рассеянного склероза, периферических нейропатий и т.п., для лечения и профилактики таких нейродегенеративных заболеваний (например, амиотрофический боковой склероз (AlS), рассеянный склероз (MS)).
Саленовые комплексы переходных металлов
В соответствии с первым вариантом настоящего изобретения комплекс "сален-переходный металл" имеет следующую структуру:
Структура 1
где M представляет собой ион переходного металла, предпочтительно Mn; A - анион, обычно C1; а n = 0, 1 или 2. X1 - X4 независимо выбирают из группы, включающей водород, силилы, арилы, арилалкилы, первичные алкилы, вторичные алкилы, третичные алкилы, алкокси-группы, амино-группы, четвертичные амины, гетероатомы и водород; причем в основном X1 и X3 являются одинаковыми функциональными группами, выбранными из группы водород, четвертичный амин и третичный бутил, а X2 и X4 обычно представляют собой водород. Y1 - Y6 независимо выбирают из группы, включающей водород, галоиды, алкилы, арилы, аралкилы, силильные группы, амино-группы, алкилы или арилы, несущие гетероатомы; арилокси-группы, алкокси-группы; и галоид; при этом предпочтительно, если Y1 и Y4 являются одинаковыми. R1 - R4 независимо выбирают из группы, включающей H, CH3, С2H5, C6H5, O-бензил, первичные алкилы, сложные эфиры жирных кислот, замещенные алкоксиарилы, ароматические группы, содержащие гетероатомы; арилалкилы, вторичные алкилы и третичные алкилы.
В соответствии с одним аспектом осуществления первого варианта настоящего изобретения по крайней мере одно из положений X1 и X3, а предпочтительно оба положения X1 и X3 занимает заместитель, выбранный из группы блокирующих заместителей, включающей в себя вторичные или третичные алкильные группы, арильные группы, силильные группы, гетероциклы и алкильные группы, имеющие заместители гетероатомов, такие как алкокси или галоид. Предпочтительно, если в положениях X1 и X3 находится один и тот же заместитель, предпочтительно третичная алкильная группа, такая как третичный бутил. В том случае, если X1 и X3 представляют собой блокирующий заместитель, то предпочтительно, чтобы X2 и X4 были выбраны из группы неблокирующих заместителей, таких как H, CH3, С2H5 и первичные алкилы, а более предпочтительно Н. Альтернативно либо три из X1-X4, либо все четыре могут быть выбраны из группы блокирующих заместителей.
В соответствии с первым вариантом настоящего изобретения обычно по крайней мере один, в основном не более чем два из R1 - R4, выбирают из группы, включающей H, CH3, C2H5 и первичные алкилы. Для удобства эта группа будет далее именоваться "неблокирующей группой". Если R1 выбирают из неблокирующей группы, то R1, R3 предпочтительно выбирают из блокирующей группы, а обычно R2, R3 являются одинаковыми и представляют собой фенил или бензилокси-группу. Если R2 выбирают из неблокирующей группы, то R1 и R4 предпочтительно выбирают из блокирующей группы. Кроме того, если R3 выбирают из неблокирующей группы, то R1 и R4 предпочтительно выбирают из блокирующей группы. И, наконец, если R4 выбирают из неблокирующей группы, то R2, R3 предпочтительно выбирают из блокирующей группы. Предпочтительными блокирующими группами для замещения в любом из R1 - R4 являются фенил и бензилокси. Обычно выбранные блокирующие группы являются идентичными. В предпочтительном варианте осуществления настоящего изобретения R1 и R4 являются бензилоксифенилом, a R2 и R4 являются водородом.
Другими словами, в одном аспекте осуществления первого варианта настоящего изобретения требуется, чтобы из четырех положений для замещения на двух атомах углерода, смежных с атомом азота, по крайней мере одно или два из этих положений имели заместителя, выбранного предпочтительно из неблокирующей группы.
Предпочтительным неблокирующим заместителем является водород или метил, а более предпочтительно водород. Предпочтительным блокирующим заместителем является фенильная группа или бензилокси-группа или третичная бутильная группа, более предпочтительно фенильная группа или бензилокси-группа, а наиболее предпочтительно фенильная группа.
Предпочтительно, если Y3 и Y6 являются водородом, метилом, алкилом или арилом, более предпочтительно водородом или метилом, а наиболее предпочтительно водородом.
Предпочтительно, если в независимо выбранных положениях Y1, Y2, Y4 и Y5 находится водород, хотя в указанных положениях могут также находиться заместители, независимо выбранные из группы, включающей водород, галоиды, алкилы, арилы, алкокси-группы, замещенные алкокси-группы, нитро-группы и амино-группы. Предпочтительно, если положения Y1 и Y4 занимают метокси-, этокси-, хлоро-, бромо- и иодо-группы, первичный алкил, третичный бутил, первичный амин, вторичный амин или третичный амин, а более предпочтительно метокси-группа, хлоро-группа, третичный бутил или метил.
В соответствии со вторым вариантом настоящего изобретения комплекс "сален-переходный металл" имеет следующую структуру:
Структурa II
где M - ион переходного металла, предпочтительно Mn; A - анион, обычно C1; по крайней мере один из X1 и X2 выбирают из группы, включающей арилы, первичные алкилы, вторичные алкилы, третичные алкилы и гетероатомы; по крайней мере один из X1 и X3 выбирают из группы, включающей арилы, первичные алкилы, вторичные алкилы, третичные алкилы, арилалкилы, гетероатомы и водород, а предпочтительно третичный бутил или водород; и Y1 - Y6, Z1 - Z12 независимо выбирают из группы, включающей водород, галоиды, алкилы, арилы, амины, алкокси-группы, замещенные алкокси-группы, арилалкилы, арилокси-группы и алкильные группы, содержащие гетероатомы. Y1 и
Y4 предпочтительно выбирают из низших алкилов, алкокси-групп, галоида и амино-групп, а более предпочтительно из метокси-групп, хлора и первичного амина. В предпочтительном осуществлении указанного второго варианта настоящего изобретения Y1 и Y4 представляют собой метокси-группу; X1 и X3 независимо выбирают из водорода или третичного бутила, а остальные заместители являются водородом.
В соответствии с третьим вариантом настоящего изобретения комплекс "сален-переходный металл" имеет следующую структуру:
Структура III
где М - ион переходного металла, обычно Mn; А - анион, обычно C1; n = 4, 5 или 6; X1 - X4 независимо выбирают из группы, включающей арилы, арилалкилы, арилокси-группы, первичные алкилы, вторичные алкилы, третичные алкилы, алкокси-группы, замещенную алкокси-группу, гетероатомы, амино-группы, четвертичные амины и водород; при этом предпочтительно, если по крайней мере один из X1 и X3 выбирают из группы, включающей арилы, первичные алкилы, вторичные алкилы, третичные алкилы, четвертичные амины, арилалкилы, гетероатомы и водород; а более предпочтительно, если X1 и X3 являются одинаковыми и представляют собой водород или третичный бутил; и Y1 - Y6 выбирают из группы, включающей арилы, арилалкилы, первичные алкилы, вторичные алкилы, третичные алкилы, алкокси-группы, замещенные алкокси-группы, арилокси-группы, галоиды, гетероатомы, амино-группы, четвертичные амины и водород; при этом предпочтительно, чтобы по крайней мере один из Y1 и Y4 представлял собой арил, первичный алкил, вторичный алкил, третичный алкил, замещенную алкокси-группу, гетероатомы, амины и галоиды; а более предпочтительно, если Y1 и Y4 являются идентичными и представляют собой метокси-группу, хлор, бром, иод, третичный бутил или амин. R1 и R4 независимо выбирают из группы, включающей водород, галоиды, первичные алкилы, вторичные алкилы, третичные алкилы, сложные эфиры жирных кислот, алкокси-группы или арилы. Предпочтительно, если R1 и R4 являются идентичными, а более предпочтительно, если они оба являются водородом.
Предпочтительные сален-металлические антиоксиданты
Для использования в композициях и методах настоящего изобретения предпочтительными являются нижеследующие виды противоокислительных сален-металлических комплексов, где заместители, которые не указаны, являются водородом.
Структура IV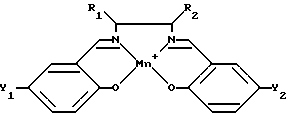
где Y1 и Y2 независимо выбирают из группы, включающей метокси-группу, этокси-группу, метил, этил, трет-бутил, хлор, бром, иод, амино-группу, четвертичный амин, алкиламино-группу, диалкиламино-группу и водород; R1 и R2 независимо выбирают из группы, включающей фенил, бензилокси-группу, хлоробензилокси-группу, водород, амино-группу, четвертичный амин или сложный эфир жирных кислот. Предпочтительно, если Y1 и Y2 являются одинаковыми.
Структура V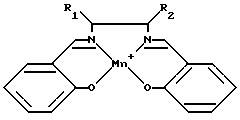
где R1 и R2 независимо выбирают из группы, включающей фенил, бензилокси-группу, хлоробензилокси-группу, водород, аминогруппу, четвертичный амин или сложный эфир жирных кислот. Предпочтительно, если R1 и R2 являются одинаковыми.
Структура VI
где Y1 и Y2 независимо выбирают из группы, включающей метокси-группу, этокси-группу, метил, этил, трет-бутил, хлор, иод, бром, амино-группу, четвертичный амин, алкиламино-группу, диалкиламино-группу и водород; R1 и R2 независимо выбирают из группы, включающей фенил, бензилокси-группу, хлоробензилокси-группу, водород, амино-группу, четвертичный амин или сложный эфир жирных кислот. Предпочтительно, если Y1 и Y2 являются одинаковыми и R1 и R2 являются одинаковыми.
Структура VII
где X выбирают из группы, включающей метокси-группу, этокси-группу, метил, этил, трет-бутил, хлор, бром, иод, амино-группу, четвертичный амин, алкиламино-группу, диалкиламино-группу и водород, а Y выбирают из группы, включающей трет-бутил, четвертичный амин, амино-группу и водород.
Структура VIII
где R1 и R2 независимо выбирают из группы, включающей арилокси-группы, алкокси-группы, арилы и водород; R' и R'' независимо выбирают из группы, включающей в себя алкилы, арилы и водород. При этом предпочтительно, если по крайней мере одна из амино-групп является протонированной при физиологическом pH (т.е. pH 7,3-7,8). Предпочтительно также, если алкильные группы, представленные R' и R'', являются, но не ограничиваются ими, метилом, этилом и пропилом. Предпочтительными арилокси-группами, представленными R1 и R2, являются (но не ограничиваются ими) бензилокси- и хлоробензилокси-группы. Предпочтительными алкокси- группами, представленными R1 и R2, являются (но не ограничиваются ими) этокси- и метокси-группы.
Предпочтительным подклассом соединений структуры YIII являются, но не ограничиваются ими, следующие соединения:
Структура IX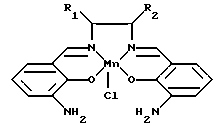
где R выбирают из алкильных групп и водорода. Предпочтительно, чтобы по крайней мере одна из амино-групп была протонирована при физиологическом pH (т.е. pH 7,3-7,8).
Предпочтительными противоокислительными саленовыми комплексами переходных металлов, используемыми для получения фармацевтических композиций, диетических добавок, пищевых консервантов, косметических средств, средств для предохранения от загара и других композиций настоящего изобретения являются соединения, структура которых для удобства обозначается символами C1-C30 (см. в конце описания).
Фармацевтические композиции
Предпочтительные фармацевтические композиции настоящего изобретения включают в себя терапевтически или профилактически эффективную дозу по крайней мере одного комплекса, содержащего ион переходного металла и саленовое производное. Термин "сален", используемый в настоящей заявке, относится к лигандам, обычно образованным посредством реакции конденсации двух молекул производного салицилальдегида с одной молекулой диаминового производного. Хотя саленовые производные получают из этилендиаминовых производных, однако для получения аналогов и производных салена могут быть также использованы пропил- и бутилдиамины. Предпочтительные саленовые производные имеют общую формулу, представленную на фиг. 1. Саленовое производное, где n = 0, показано на фиг. 2.
Как показано на фиг. 1, два атома азота и два атома кислорода располагаются вокруг центра саленового лиганда, обеспечивая тем самым место для комплексообразователя, иона переходного металла М. Ион указанного металла предпочтительно выбирают из Mn, Cr, Fe, Ni, Со, Ti, V, Ru, Os. Более предпочтительно, если ион переходного металла выбирают из Mn, Mg, Cr, Fe, Ni, Со. Наиболее предпочтительно, если ионом металла является Mn.
Анион предпочтительно выбирают из группы, включающей в себя PF6, (арил)4, BF4, B(арил)4, галоид, ацетат, трифтороацетат, тозилат; при этом более предпочтительным анионом является галоид или PF6, а наиболее предпочтительным - хлорид.
На фиг. 1 также показано множество положений, подходящих для замещения в саленовом лиганде. Из этих положений в указанном первом саленовом комплексе переходного металла наиболее важными являются R1 - R4 и X1 - X4, Y3 и Y6.
Структуры I, III, IY, YI, YII и YIII могут иметь в качестве независимо выбранных заместителей группы сложных эфиров жирных кислот в положениях R1 - R4. Если указанные сложные эфиры жирных кислот присутствуют, то обычно они занимают не более чем два положения заместителей и являются идентичными.
Примеры жирных кислот, подходящих для получения соединений настоящего изобретения, представлены в таблицах I, II, III.
Следует отметить, что присутствие ненасыщенных кислот в изомерных формах обусловлено наличием одного или нескольких ненасыщенных положений. При этом подразумевается, что к соединениям настоящего изобретения относятся отдельные изомеры с двойными связями, а также их смеси. Сложные эфиры жирных кислот настоящего изобретения могут быть получены с использованием известной техники ацилирования (cм. , например, March, Advanced Organic Chemistru, 3-rd Ed., John Wiley & Sons, New York (1985), p. 299, 348-351 и 353-354).
Предпочтительные антиокислительные комплексы "сален-переходный металл"
На фиг. 3 показаны предпочтительные антиокислительные комплексы "сален-переходный металл" настоящего изобретения. Примеры антиокислительных комплексов "сален-переходный металл" представлены на фиг. 3. Для получения фармацевтических и других антиокислительных композиций настоящего изобретения особенно предпочтительными являются соединения C1, C4, C6, C7, C9, C10, C11 и C12. Очевидно, что особенно предпочтительным является соединение C7, поскольку благодаря своей гидрофильной природе оно наиболее пригодно для использования в качестве фармацевтического средства, и, кроме того, оно является достаточно простым для получения.
Предпочтительным комплексом "сален-переходный металл", обладающим высокой супероксид-дисмутазной активностью, является соединение C12, имеющее следующую структуру: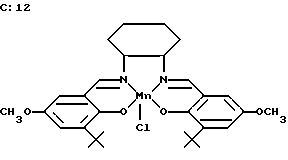
и, кроме того, предпочтительными являются соединения, принадлежащие к тому же классу соединений, что и соединение C12, а именно
Особенно предпочтительным антиокислительным сален-металлическим комплексом настоящего изобретения является соединение C7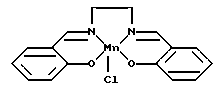
Антиокислительные комплексы "сален-переходный металл" обычно обладают значительной супероксид-дисмутазной активностью, а предпочтительно также и каталазной активностью. Преимущество соединения C7 заключается в том, что его легко получить, и, кроме того, оно обладает гидрофильными свойствами, что делает его особенно пригодным для использования в качестве фармацевтического средства и для изготовления композиций в водном растворе. Относительно гидрофильная природа соединения C7 позволяет получать антиокислительные сален-металлические комплексы, которые легко абсорбируются и транспортируются в организме человека. Одним из преимущественных фармакокинетических свойств C7 является, очевидно, его способность эффективно преодолевать гематоэнцефалический барьер.
Получение антиокислительных комплексов "сален-переходный металл"
Получение комплексов "сален-переходныи металл" осуществляют в основном как описано в US91/01915, поданной 21 марта 1991; в работах Fu et аl. (1991) J. Org. Chem. 56 : 6497; Zang W. & Jacobsen E.N. (1991) J.Org.Chem. 56 : 2296; Jacobsen et аl. (1991) J.Am.Chem.Soc. 113 : 6703; Zhang et аl. (1990) J.Am.Chem.Soc. 112 : 2801; Lee N.H. & Jacobsen E.N. (1991) Tetrahedron Lett. 32 : 6533; Jacobsen et аl. (1991) J.Am.Chem.Soc. 113 : 7063; Lee et аl. (1991) Tetrahedron Lett. 32 : 5055.
В основном предпочтительным способом получения антиокислительных комплексов "сален-переходный металл" настоящего изобретения является проведение реакции конденсации замещенного салицилальдегида с замещенным диамином. Молярное отношение количеств указанных соединений в абсолютном этаноле составляет в основном 2: 1. Полученный раствор нагревают в сосуде с обратным холодильником обычно в течение 1 ч, после чего саленовый лиганд либо осаждают путем добавления воды с образованием аналитически чистой формы, либо металлический комплекс получают непосредственно путем добавления металла в виде его ацетата, галоида или трифторацетатной соли.
Для получения антиокислительного комплекса "сален-Mn", имеющего формулу
осуществляют следующие процедуры.
Саленовый лиганд растворяют в горячем абсолютном этаноле с образованием 0,1 М раствора. Затем одной порцией добавляют твердый Mn (OAc)2 4H2O (2,0 экв.) и полученный раствор нагревают с обратным холодильником в течение 1 ч. После этого добавляют приблизительно 3 эквивалента LiCl, и полученную смесь нагревают с обратным холодильником еще полчаса. После охлаждения смеси до 0oC получают Mn (III)-комплекс в виде темно-коричневых кристаллов, которые затем тщательно промывают водой и выделяют путем фильтрации с выходом приблизительно 75%. Дополнительный сбор может быть осуществлен путем добавления по капле воды к маточному раствору. В целом выходы катализатора для каждой стадии обычно составляют около 80-95%, а всего по крайней мере около 80-90% от оптически чистого 1,2-дифенилэтилендиамина.
Другой пример способа получения антиокислительного комплекса "сален-Mn" приводится ниже. При этом наиболее предпочтительным исходным диамином является R, R- или S,S-1,2-диамино-1,2-дифенилэтан, а наиболее предпочтительным исходным салицилальдегидом является 3-трет-бутилсалицилальдегид. Для получения вышеуказанного комплекса раствор 2,0 мМ 3-трет-бутилсалицилальдегида в 3 мл абсолютного этанола по капле добавляют к раствору 1,0 мМ (R,R)-1,2-диамино-1,2-дифенилэтана в 5 мл этанола. Реакционную смесь нагревают в течение 1 ч с обратным холодильником, а затем к горячему раствору (60oC) одной порцией добавляют 1,0 мМ Mn (OAc)2 4H2O. После добавления желтый раствор сразу окрашивается в коричневый цвет. Затем смесь нагревают с обратным холодильником еще 30 мин, после чего ее охлаждают до комнатной температуры. После этого по капле добавляют раствор 10% NaCl (5 мл), и смесь размешивают в течение получаса. Затем растворители удаляют в вакууме, и остаток растирают с 50 мл CH2-Cl2 и 50 мл H2О. Органический слой отделяют, а коричневый раствор промывают насыщенным NaCl. После выделения органической фазы и удаления растворителя получают неочищенный материал, который может быть перекристаллизован из CH6H6/C6H14 с получением комплекса "(R,R)-сален-Mn".
Синтез антиокислительных сален-металлических комплексов настоящего изобретения может быть осуществлен традиционными способами в соответствии с методиками, приведенными в цитированных публикациях.
SOD-активность полученных сален-Mn-комплексов определяют стандартными методами в соответствии с анализами, которые обычно используют для оценки SOD-активности, и примеры которых приводятся ниже. Антиокислительными сален-металлическими комплексами являются сален-металлические комплексы, имеющие по крайней мере 0,01 ед. SOD-активности на мМ/л в водном растворе, предпочтительно по крайней мере около 1 ед. SOD-активности на мМ/л; более предпочтительно по крайней мере около 100 ед. SOD-активности на мМ/л; а чаще всего указанные сален-металлические комплексы имеют более чем 500-100 ед. SOD-активности на мМ или даже более. В некоторых медицинских применениях, где желательно также наличие каталазной активности, предпочтительно, чтобы сален-металлический комплекс, имитирующий SOD-активность, обладал, кроме того, заметной каталазной активностью (например, C4, C7, C9, C10, C11, C12), составляющей по крайней мере 10 ед./мМ, а в основном по крайней мере 100 ед./мМ.
Фармацевтические композиции, содержащие антиокислительный комплекс "сален-переходный металл" настоящего изобретения, могут быть использованы для местного применения и парентерального введения, т.е. подкожного, внутримышечного или внутривенного введения. Тот факт, что сален-металлические комплексы обладают SOD-активностью in vitro, а также функционируют in vivo, свидетельствует о том, что антиокислительные сален-металлические комплексы могут быть с успехом использованы в фармацевтических целях в качестве имитаторов SOD-активности. Антиокислительные сален-металлические комплексы могут быть введены млекопитающим, включая человека и домашних животных.
Композиции для парентерального введения обычно представляют собой раствор антиокислительного комплекса "сален-переходный металл" или смеси указанных комплексов, растворенных в приемлемом носителе, предпочтительно в водном носителе. Поскольку многие комплексы "сален-Mn" настоящего изобретения являются липофильными, то предпочтительно, чтобы указанный носитель содержал гидрофобное основание (например, полиэтиленгликоль, Твин 20). В этих целях могут быть использованы различные водные носители, например вода, забуференная вода, 0,4% физиологический раствор, 0,3% глицин и т.п. Эти растворы должны быть стерильными и в основном не должны содержать макрочастиц. Указанные композиции могут быть стерилизованы с использованием стандартной техники стерилизации. Эти композиции могут также содержать фармацевтически приемлемые добавки, необходимые для создания условий, по возможности наиболее приближенных к физиологическим, например, такие как агенты, корректирующие pH, и забуферивающие агенты, а также агенты, корректирующие тоничность, и т.п., например, такие как ацетат натрия, хлорид натрия, хлорид калия, хлорид кальция, лактат натрия и т.п. Концентрация антиокислительного сален-металлического комплекса (или комплексов) может широко варьировать (т.е. от менее чем > 1 нМ, а обычно по крайней мере от около 0,1 мМ до не менее чем 100 мМ), и в первую очередь зависит от нужного объема жидкости, вязкости и т.п., соответствующих выбранному способу введения. В большинстве случаев концентрация антиокислительного сален-металлического комплекса составляет от 0,1 до 10 мМ. Например, типичная композиция для внутривенных инъекций представляет собой стерильный раствор антиокислительного сален-металлического комплекса (например, C7), присутствующего в концентрации 5 мМ в растворе Рингера. В основном гидрофобная природа некоторых предпочтительных антиокислительных сален-металлических комплексов указывает на то, что в композиции может быть использован гидрофобный наполнитель либо водный наполнитель, содержащий детергент или другой липофильный агент (например, Твин, NP-40, PEG); альтернативно антиокислительные саленовые комплексы могут быть введены в виде суспензии в водном носителе или в виде эмульсии.
Так, например, типичная фармацевтическая композиция для внутримышечных инъекций может содержать 1 мл стерильной забуференной воды и около 1-100 мг антиокислительного комплекса (или комплексов) "сален-переходный металл". Типичная композиция для внутривенного вливания может содержать 250 мл стерильного раствора Рингера и около 100-1000 мг антиокислительного комплекса (комплексов) "сален-переходный металл". В композиции липофильных сален-металлических комплексов могут быть включены липофильные агенты. Методы получения парентеральных композиций хорошо известны специалистам и описаны подробно, например, в работе Remington's Pharmaceutical Science, 15 th Ed., Mack Publishing Company, Easton, Pennsylvania (1980). Типичная фармацевтическая композиция для местного применения может быть изготовлена с использованием подходящих кожных мазей, кремов, лосьонов, глазных мазей и растворов, аэрозолей для ингаляций и других наполнителей. Эти наполнители должны быть химически совместимыми с антиокислительными сален-металлическими комплексами, которые являются активными ингредиентами данных композиций, и не должны способствовать усилению разложения, денатурации или агрегации активного ингредиента или ингредиентов. В большинстве случаев наполнители состоят из липофильных компонентов, таких как масла и липидные эмульсии.
Антиокислительные сален-металлические комплексы настоящего изобретения могут быть лиофилизованы в целях хранения с последующим их восстановлением в подходящем носителе непосредственно перед использованием. При этом следует отметить, что лиофилизация и последующее восстановление могут привести к изменению уровней антиокислительной активности в сторону ее потери, что может потребовать соответствующих мер для компенсации этих потерь.
Композиции, содержащие антиокислительный комплекс или комплексы "сален-переходный металл", или их смеси могут быть применены в профилактических и/или терапевтических целях. При терапевтическом использовании указанные композиции вводят пациенту, страдающему конкретным заболеванием, ассоциированным с присутствием свободных радикалов, в количестве, достаточном для излечения или по крайней мере для прекращения дальнейшего развития данного заболевания и его осложнений. Количество, адекватное для осуществления указанных целей, определяется как "терапевтически эффективная доза" или "эффективная доза". Указанная эффективная доза зависит от тяжести заболевания, общего состояния пациента и способа введения, однако в основном эта доза составляет от около 1 мг до около 10 г антиокислительного сален-металлического комплекса или комплексов, а обычно используются дозы в пределах от 10 до 2000 мг для одного пациента. Например, для лечения острых приступов ишемии/реоксигенации миокарда, может быть введено путем внутривенного вливания от около 100 до 1000 мг указанного антиокислительного комплекса (например, C7); а для повышения локальных концентраций SOD-активности в миокарде может быть введено путем интераперикардиальной инъекции по крайней мере от около 10 до 500 мг указанного комплекса или комплексов.
Для профилактических целей композиции, содержащие антиокислительный сален-металлический комплекс или комплексы или их смеси, вводят пациентам, пока еще не страдающим данным заболеванием, в целях повышения сопротивляемости организма пациента данному заболеванию или для подавления развития этого заболевания. Количество, адекватное для осуществления профилактических целей, определяется как "профилактически эффективная доза". Точное количество такой дозы зависит от состояния здоровья и общего уровня иммунитета пациента, однако в основном эта доза составляет от 1 мг до 10 г, а в частности, 10-1000 мг для одного пациента. Типичная композиция антиокислительного сален-металлического комплекса, такого как C7, представляющая собой разовую стандартную лекарственную форму, обычно содержит от около 25 до 250 мг указанного антиокислительного комплекса.
Разовое или многократное применение композиций настоящего изобретения может быть осуществлено путем подходящих доз и режима введения в соответствии с назначением лечащего врача. Однако в любом случае фармацевтические композиции должны содержать определенное количество антиокислительного комплекса или комплексов настоящего изобретения, достаточное для эффективного лечения пациента.
В целях профилактики для лечения заболеваний, ассоциированных с присутствием свободных радикалов, могут быть также использованы наборы для конкретного применения указанных антиокислительных комплексов. Так, например, композиция настоящего изобретения может быть получена в лиофилизованной форме, либо в виде водного раствора в контейнере, как отдельно, так и в сочетании с другим антиокислительным комплексом или комплексами "сален-переходный металл" нужного типа. Антиокислительные сален-металлические комплексы могут быть включены в указанные наборы вместе с буферами, такими как трис, фосфат, карбонат и т.п.; стабилизаторами; биоцидами; инертными белками, такими, как альбумин сыворотки; или т.п.; и инструкциями по их использованию. Обычно указанные материалы должны присутствовать в количестве, составляющем примерно менее чем 5 мас.% исходя из количества антиокислительного комплекса, а в основном их общая концентрация составляет по крайней мере около 0,001%. Часто оказывается желательным использовать разбавитель или наполнитель для разведения активных ингредиентов, который может присутствовать в количестве от около 1 до 99,999 мас.% по полной массе композиции.
Сален-Mn-комплексы, предпочтительно соединения C12 или C7, могут быть введены в раствор для гипотермической кардиоплегии в концентрации по крайней мере около 1 мМ, при этом указанный раствор получают в соответствии с методикой по Amano и др., (1982) Jpn.J.Surg. 12 : 87. Наиболее предпочтительно, если в раствор для кардиоплегии вводят соединение C7.
Доза комплекса "сален-металл", имитирующего SOD-активность, может варьировать для каждого конкретного применения. Композицию настоящего изобретения используют в основном путем системного или путем местного применения. Методы системного применения предусматривают пероральное или парентеральное введение, а методы местного применения предусматривают in situ-употребление лекарственного препарата. Термин in situ означает, что введение SOD-имитурующего комплекса "сален-металл" может быть осуществлено, например, с использованием эндоскопических болюсов и/или околовенных инъекций либо в случае лечения нижнего отдела кишечника с использованием клизм. Парентеральные способы применения предусматривают подкожное, внутрикожное, внутримышечное или внутривенное введение. В зависимости от способа введения количество SOD-имитирующего сален-металлического комплекса может варьировать от около 2 до 5000 мг или более, а в основном от 10 до 1000 мг; причем для перорального, парентерального и/или наружного применения указанное количество может быть введено в виде однократной дозы или в виде дробных доз в течение нескольких дней или в течение более чем 5 недель. Эти дозы могут варьировать в зависимости от тяжести заболевания.
In vitro- и экспериментальное введение
В другом варианте настоящего изобретения антиокислительные комплексы "сален-переходный металл" настоящего изобретения могут быть использованы для модуляции экспрессии природных генов или других полинуклеотидных последовательностей, находящихся под транскрипционным контролем элемента, ответственного за реакцию на окислительный стресс (например, антиокислительного реактивного элемента, ARE), такого как антиокислительный реактивный элемент гена глутатион-а-трансферазы или гена NAD (P)H:хинон-редуктазы (Rosen et аl. (1992), Arch. Biochem. Biophys. 292 : 589; Favreau & Pickett (1991) J.Biol. Chem. 266 : 4556; Rushmore & Pickett (1991) Methods Enzymol. 206 : 409; Rushmore & Pickett (1990) J.Biol. Chem. 265 : 14648; Keyse et аl. (1992) Nature 359: 644). Трансгены, гомологичные рекомбинантные конструкции и эписомные системы экспрессии (например, экспрессирующие векторы на основе вирусов), содержащие полинуклеотидную последовательность, находящуюся под транскрипционным контролем одного или нескольких ARE, соединенных с промотором; а также трансформированные клетки и трансгенные животные, не относящиеся к человеку и содержащие указанные полинуклеотидные структуры, могут быть получены каждым специалистом в соответствии с известными методами и руководствами. Антиокислительные сален-металлические комплексы могут быть использованы для модуляции транскрипции ARE-регулируемых полинуклеотидных последовательностей в клеточных культурах (например, в клетках ES) и в интактных животных, особенно в трансгенных животных, где трансген содержит один или несколько ARE в качестве последовательностей, регулирующих транскрипцию. Для трансформированных или трансгенных клеточных культур строят кривую "доза-ответ" путем титрования скорости транскрипции ARE-регулируемой полинуклеотидной последовательности против возрастающих концентраций антиокислительных сален-металлических комплексов, которые способствуют снижению скорости транскрипции, индуцированной агентами окисления (например, перекисью бензоила глутатион-элиминирующим агентом) или окислительным стрессом. И, наоборот, высокие уровни SOD-имитирующих сален-металлических комплексов могут продуцировать окислительный стресс и генерирование свободных радикалов. Аналогичное дозозависимое титрование может быть осуществлено в трансгенных животных, таких как трансгенные мыши, содержащие ARE-контролируемую трансгенную последовательность.
In vivo-введение
В соответствии с настоящим изобретением, терапевтически или фармацевтически эффективное количество антиокислительного комплекса "сален-переходный металл" вводят пациенту в целях лечения или предупреждения заболеваний, ассоциированных с присутствием свободных радикалов. Необходимые для этого дозы зависят от природы заболеваний, обусловленных свободными радикалами, от тяжести и характера течения данного заболевания, от предшествующей терапии, от состояния здоровья пациента и его восприимчивости к введению антиокислительного комплекса, и определяются лечащим врачом. В основном пациенту вводят по крайней мере один антиокислительный сален-Mn-комплекс в качестве единственного активного ингредиента либо в сочетании с одним или несколькими другими активными ингредиентами, обычно выбираемыми из группы следующих соединений: N-2-меркаптопропионилглицин, N-ацетилцистеин, глутатион, диметилтиомочевина, десферриоксамин, маннит, а-токоферол, аскорбат, аллопуринол, 21-аминостероиды, ингибиторы кальпаина, антагонисты рецептора глутамата, тканевый активатор плазминогена, стрептокиназа, урокиназа, нестероидный противовоспалительный агент, кортизон и каротеноиды. Антиокислительные сален-Mn-комплексы могут быть также введены в сочетании с полипептидами, обладающими SOD- и/или каталазной активностью; и поскольку в отличие от SOD-полипептидов указанные сален-Mn-комплексы обладают способностью преодолевать гематоэнцефалический барьер, то они могут служить важным дополнением при системном SOD-введении.
Настоящее изобретение также относится к способу лечения пациентов, страдающих заболеваниями, связанными с присутствием свободных радикалов, путем введения этим пациентам профилактически или терапевтически эффективного количества указанного антиокислительного комплекса, обычно сален-Mn-комплекса, а предпочтительно C7. Этот способ может быть использован для лечения пациентов на различных стадиях указанных заболеваний, а также для предупреждения развития у пациентов заболеваний, обусловленных присутствием свободных радикалов. Кроме того, этот способ может быть использован как профилактическая мера для предупреждения или снижения вероятности возрастного развития опухолей и/или снижения коэффициента смертности от старости, и/или снижения степени физиологического старения организма.
Антиокислительные сален-металлические комплексы настоящего изобретения могут быть также введены пациентам, инфицированным вирусом иммунодефицита человека (например, ВИЧ-1), или пациентам, относящимся к группе риска инфицирования вирусом иммунодефицита человека. Антиокислительные сален-металлические комплексы, типичным примером которых служит C7, могут предупреждать или ингибировать репликацию ВИЧ-1 в CD4 + - лимфоцитах, индуцированную фактором некроза опухоли (ФНО) и/или предупреждать разрушение или гибель CD4 +-клеток в результате ВИЧ-1-инфекции. Не претендуя на какую-либо конкретную теорию относительно репликации или патогенеза ВИЧ-1, следует признать, что введение антиокислительного сален-металлического комплекса, такого как C7, способствует ингибированию и/или замедлению развития ВИЧ-1-ассоциированной патологии, и/или снижению скорости уменьшения популяции CD4 + - лимфоцитов у ВИЧ-инфицированных индивидуумов. Антиокислительные комплексы, такие как C7, могут также ингибировать патологию, обусловленную чрезмерными или нежелательными уровнями ФНО, при заболеваниях СПИДом и других состояниях (например, при септическом шоке). Во многих случаях для снижения или замедления развития патологии и клинических симптомов у пациентов, инфицированных BИЧ, и/или у пациентов с избыточными или нежелательными уровнями ФНО, этим пациентам могут быть введены дозы от 50 до 5000 мг в виде однократной дозы или дробных доз. Терапевтические дозы антиокислительных сален-металлических комплексов могут быть также введены пациентам для лечения других, не связанных с ВИЧ заболеваний.
Поскольку окислительное повреждение пропорционально количеству свободных радикалов и других видов реактивного кислорода, то, очевидно, что введение антиокислительных сален-металлических комплексов даже в очень небольших дозах будет продуцировать защитный эффект против окислительного повреждения; а поэтому можно ожидать, что нижнего предела дозы, ниже которого указанный антиокислительный комплекс является неэффективным, не существует.
В основном для лечения заболеваний, ассоциированных с присутствием свободных радикалов, эффективная доза антиокислительного сален-Mn-комплекса составляет в пределах от 0,01 до 1000 миллиграммов (мг) на килограмм (кг) веса тела реципиента в день, а предпочтительно от 1 до 100 мг/кг в день. Предпочтительными являются однократная доза или дробные, т.е. двух-, трех-, четырехкратные дозы или более мелкие дозы, вводимые через соответствующие интервалы времени в течение суток. Указанные дробные дозы могут быть введены в виде стандартных лекарственных форм, содержащих, например, 5-10000 мг, а предпочтительно 10-1000 мг активного ингредиента на одну унифицированную лекарственную форму.
Композиция, используемая в вышеуказанных терапевтических целях, может быть изготовлена в виде различных лекарственных форм. Такими формами являются, например, твердые, полутвердые и жидкие лекарственные формы, например таблетки, пилюли, жидкие растворы или суспензии, липосомные препараты и растворы для инъекций и вливаний. Выбор предпочтительной формы зависит от способа введения и целей терапевтического применения. В основном используется стерильный раствор сален-металлического комплекса в водном растворителе (например, в физиологическом растворе), вводимый внутривенно. Предпочтительно также, если композиция включает в себя стандартные фармацевтически приемлемые носители и адъюванты, хорошо известные специалистам (cм., например, Remington's Pharmaceutikal Sciences, Mack Publishing Co., Easton, PA 17 th Ed. (1985)). Вообще говоря, указанные композиции могут быть введены перорально или парентерально (например, подкожно, внутримышечно, внутривенно и чрезкожно) либо путем местного применения, путем вливания в соответствующие полости организма, или в виде раствора для промывания тканей во время хирургической операции.
При этом следует отметить, что композиции настоящего изобретения могут быть использованы в сочетании с другими антиоксидантами, обладающими SOD-активностью, каталазной активностью, GSH-Рх-активностью; с акцепторами свободных радикалов; или с ингибиторами образования свободных радикалов. Хотя активный ингредиент настоящего изобретения может быть введен отдельно, однако предпочтительно, если этот активный ингредиент является частью фармацевтической композиции. Композиции настоящего изобретения включают в себя по крайней мере одно соединение настоящего изобретения, взятое в терапевтически или фармацевтически эффективной дозе, в сочетании с одним или несколькими фармацевтически или терапевтически приемлемыми носителями, и необязательно с другими терапевтическими ингредиентами. Терапевтическая ценность различных лекарственных средств описана, например, в работах Gilman et аl., (изд.) (1990) Goodman and Gilman's: The Pharmacological Bases of Therapeutigs 8 th Ed. , Pergamon Press; и Remington's (см. выше). В этих работах также обсуждаются способы введения лекарственных средств, например, пероральное, внутривенное, внутрибрюшинное или внутримышечное введение и др. Фармацевтически приемлемыми носителями являются вода, физиологический раствор, буферы и другие соединения, описанные, например, в работе Merck Index, Merck & Co., Rahway, NJ.
В профилактических и/или терапевтических целях фармацевтические композиции могут быть введены парентерально или перорально. В зависимости от способа введения фармацевтические композиции могут быть изготовлены в виде различных унифицированных лекарственных форм. Например, лекарственными формами, подходящими для перорального введения, являются порошки, таблетки, пилюли, капсулы и драже.
Часто фармацевтические композиции вводятся внутривенно. Так например, настоящее изобретение предусматривает получение композиций для внутривенного введения, которые представляют собой раствор или суспензию соединения в приемлемом носителе, предпочтительно в водном носителе. Для этих целей могут быть использованы различные водные носители, например вода, забуференная вода, 0,4% физиологический раствор и т.п. В основном антиокислительный сален-металлический комплекс (или комплексы), такой как C7 или C12, может быть растворен в органическом растворителе (например, в диметилсульфоксиде), а затем либо использован непосредственно в таком виде, либо разведен в водном
растворителе. Обычно указанные антиокислительные комплексы, которые являются относительно липофильными (например, C9, C12), растворяют в органическом растворителе, таком как ДМСО, а затем, если это необходимо, разводят в более полном растворителе, таком как вода. Иногда эти композиции стерилизуют с использованием стандартной техники стерилизации, либо, что предпочтительно, их подвергают стерильной фильтрации. Полученные водные растворы могут быть упакованы в готовом для использования виде либо они могут быть лиофилизованы с последующим их разведением стерильным водным раствором непосредственно перед использованием. Указанные композиции могут содержать фармацевтически приемлемые добавки, необходимые для создания условий, наиболее приближенных к физиологическим, например, такие как pH-корректирующие агенты и забуферивающие агенты; а также добавки, корректирующие тоничность; смачивающие агенты; и т.п., например, такие как ацетат натрия, лактат натрия, хлорид натрия, хлорид калия, хлорид кальция, сорбитанмонолаурат, триэтаноламинолеат и т.п.
Для получения твердых композиций могут быть использованы стандартные нетоксичные твердые носители, например фармацевтически приемлемые виды маннита, лактозы, крахмала, стеарата магния, натриевой соли сахарина, талька, целлюлозы, глюкозы, сахарозы, карбоната магния и т.п. Фармацевтически приемлемые нетоксичные композиции для перорального введения содержат любой из обычно используемых наполнителей, например, таких как носители, перечисленные выше; и 0,001-95% активного ингредиента, а предпочтительно около 20% активного ингредиента.
Композиции, содержащие вышеуказанные соединения, могут быть введены в профилактических и/или терапевтических целях. При терапевтическом использовании указанные композиции вводят пациенту, страдающему заболеванием, описанным выше, в количестве, достаточном для излечения или по крайней мере для частичного подавления симптомов заболевания и его осложнений. Количество, адекватное для осуществления указанных целей, определяется как "терапевтически эффективное количество или терапевтически эффективная доза". Указанная эффективная доза зависит от тяжести заболевания, а также от веса и общего состояния пациента.
Для профилактических целей композиции, содержащие соединения настоящего изобретения, вводят пациентам, восприимчивым к конкретному заболеванию, или пациентам, принадлежащим к группе риска данным конкретным заболеванием. Количество, адекватное для осуществления профилактических целей, определяется как "профилактически эффективное количество или профилактически эффективная доза". Точное количество такой дозы зависит от состояния здоровья пациента и веса его тела.
Для получения твердых композиций могут быть использованы стандартные нетоксичные твердые носители, например фармацевтически приемлемые виды маннита, лактозы, крахмала, стеарата магния, талька, целлюлозы, глюкозы, сахарозы, карбоната магния и т.п. Активное соединение, определенное выше, может входить в состав суппозиториев, изготовленных с использованием в качестве носителя, например триглицеридов, например Witepsols. Жидкие фармацевтические композиции могут быть получены, например, путем растворения, диспергирования и т.п. активного соединения, определенного выше, и необязательно фармацевтических адъювантов в наполнителе, таком как вода, физиологический раствор, водная декстроза, глицерин, этанол и т.п., с получением раствора или суспензии. Если необходимо, то фармацевтическая композиция может также содержать небольшие количества нетоксичных добавок, таких как смачивающие или эмульгирующие агенты, pH-корректирующие буферные агенты, и т.п., например ацетат натрия, сорбитанмонолаурат, триэтаноламин, ацетат натрия, триэтаноламинолеат и т.п. Практические методы получения указанных лекарственных форм хорошо известны специалистам и широко описаны в литературе; см., например, Remington's Pharmaceutikal Sciences, Mack Publishing Co., Easton, Pennsylvania, 17 th Ed. (1985). В любом случае вводимая композиция или препарат должны содержать эффективное количество активного соединения или соединений.
Для перорального введения фармацевтические нетоксичные композиции могут быть изготовлены с использованием стандартных наполнителей, например, таких как фармацевтически приемлемые сорта маннита, лактозы, крахмала, стеарата магния, талька, целлюлозы, глюкозы, сахарозы, карбоната магния и т.п. Указанные композиции могут содержать 0,01-95%, а предпочтительно 1-70% активного ингредиента.
Парентеральное введение обычно предусматривает подкожные, внутримышечные или внутривенные инъекции. Инъецируемые лекарственные формы могут быть получены либо в виде жидких растворов или суспензий; в виде твердых форм, пригодных для их последующего разведения перед непосредственным использованием для инъекции; или в виде эмульсий. Примерами подходящих наполнителей являются вода, физиологический раствор, декстроза, глицерин, этанол и т.п. Кроме того, если необходимо, то фармацевтические композиции могут также содержать небольшие количества нетоксичных добавок, таких как смачивающие или эмульгирующие агенты, pH-корректирующие забуферивающие агенты и т.п., например, такие как ацетат натрия, сорбитанмонолаурат, триэтаноламинолеат и т.п.
В последнее время для парентерального введения широко используется имплантация системы замедленного или пролонгированного высвобождения лекарственного средства, например, системы, способствующей поддержанию постоянного уровня высвобождаемой дозы. См., например, патент США N 3710785, который вводится в настоящее описание посредством ссылки. Антиокислительные комплексы "сален-металл" могут быть введены чрезкожно с использованием пластыря (например, путем ионотофореза) для местного или системного применения.
После того как состояние пациента заметно улучшится, может быть введена поддерживающая доза, если это необходимо. Затем дозы или частота их введения, либо то и другое, могут быть уменьшены в зависимости от симптомов до уровня, при котором достигнутое улучшенное состояние будет оставаться неизменным. Когда улучшение симптомов достигнет желаемого уровня, курс лечения может быть прекращен. Однако пациенту может потребоваться прерывистое лечение в течение продолжительного периода времени после любого рецидива симптомов заболевания либо как профилактическая мера для предупреждения рецидива симптомов заболевания.
Антиокислительные сален-металлические комплексы могут быть также добавлены к крови, предназначенной для переливания, в целях ингибирования оксирадикального повреждения клеток крови и ее компонентов во время хранения; причем указанные антиокислительные комплексы способствуют также снижению оксирадикального повреждения клеток крови in vivo.
Антиокислительные сален-металлические комплексы могут быть также добавлены в растворы для промывки или хранения органов и тканей для трансплантации или в растворы для промывки тканей во время хирургических операций. Например, извлеченные органы перед их трансплантацией реципиенту часто помещают в консервирующий раствор. Для снижения повреждения, обусловленного ишемией во время хранения, и реперфузионного повреждения после ремплантации реципиенту, в указанный консервирующий раствор желательно включить по крайней мере один из антиокислительного сален-металлического комплекса в концентрации около 0,01 до 10 мМ. Растворы, подходящие для введения сален-металлического комплекса, описаны в патенте США N 5145771; Beyersdorf (91990) Chem.Abst. l13 : 84849; в патентах США N 4879283; 4873230; 4798824.
Обычно в раствор для промывки или хранения антиокислительный комплекс вводят в концентрации от около 10 мкМ до 10 мМ, а в основном, в концентрации 1 мМ. Примерами (не ограничивающими настоящего изобретения) подходящего раствора являются раствор Рингера (102 мМ NaCl, 4 мМ KCl, 3 мМ CaCl2, 28 мМ лактата натрия, pH 7,0), или раствор Рингера с 0,1 мМ аденозина, содержащие антиокислительный комплекс C7 в конечной концентрации 1 мМ. Кроме того, промывочный раствор может содержать дополнительные антиоксиданты (например, глутатион, аллопуринол). Консервирующие или промывочные растворы, содержащие антиокислительный сален-металлический комплекс, могут быть использованы для более эффективного хранения или промывки органов (например, почек, печени, поджелудочной железы, легких, фетальной нейтральной ткани, сердца, сосудистых трансплантатов, костей, связок, сухожилий и кожи), что будет способствовать большей жизнеспособности тканей и повышению их сопротивляемости окислительному повреждению (например, вследствие ишемии/реперфузии).
Не претендуя на какую-либо конкретную теорию механизма антиокислительного или каталитического действия акцепторов оксирадикалов, следует отметить, что избыточные дозы или концентрации каталитических сален-металлических комплексов настоящего изобретения фактически могут способствовать продуцированию свободных радикалов, таких как супероксиды, очевидно, по аналогии с присутствием больших количеств свободного железа в крови. Исходя из этого при антиокислительной терапии желательно избегать введения избыточных доз сален-металлических комплексов. Введение избыточных доз каталитически активного сален- металлического комплекса может быть также использовано в целях генерирования свободных радикалов, таких как супероксид, на локальных участках тела (например, для лечения угрей, рака кожи, папилом), в клеточных культурах или в трансгенных животных, содержащих трансген под транскрипционным контролем ARE. Для усиления продуцирования свободных радикалов (например, супероксида) может оказаться предпочтительным подвергать локальные участки тела, клеточные культуры, или трансгенных животных воздействию низких давлений, и/или воздействию среды обогащенной кислородом (например, среды, содержащей примерно более 21% молекулярного кислорода).
Альтернативно способность антиокислительных сален-металлических комплексов катализировать разложение соединений, содержащих реактивный кислород, может быть использована в целях ингибирования или уменьшения повреждений биологических тканей и клеток. Так, например, перекись бензоила широко используется для лечения угревой сыпи, а избыточное или нежелательное введение бензоилпероксида (например, случайное попадание на глаза) может быть нейтрализовано путем локальной обработки (или, если необходимо, путем системного введения) антиокислительным сален-металлическим комплексом (например, C7). Аналогично индуцированное оксирадикалами повреждение соединительных тканей (например, коллагена) в результате воздействия УФ-излучения, курения и физиологического старения может быть уменьшено благодаря введению антиокислительного сален-металлического комплекса, осуществляемому в основном одновременно с УФ-облучением, курением или другим оксирадикал-генерирующим процессом (например, в процессе старения клеток).
Защита от воздействия химических соединений и противолучевая защита
Антиокислительные сален-металлические комплексы, в основном антиокислительные сален-Mn-комплексы, такие как соединение C7, используются для защиты клеток и тканей от агентов, продуцирующих свободные радикалы, таких как ионизирующее излучение и химиотерапевтические агенты (например, блеомицин). Предпочтительно, если защитная доза, составляющая по крайней мере около 1 мкг сален-Mn-комплекса на 1 кг веса тела вводится одним или несколькими путями (например, перорально, внутривенно, внутрибрюшинно, путем промывания желудка, с помощью клизмы, путем вливания через воротную вену, путем накожной аппликации или путем аэрозольных ингаляций), а предпочтительно путем инъекции липосом или иммунолипосом для направленной доставки антиокислительного сален-Mn-комплекса к нормальным клеткам в целях их защиты от свободнорадикальной токсичности, ассоциированной с химиотерапией или лучевой терапией опухолей. Предпочтительно также, если антиокислительные сален-металлические комплексы вводятся пациенту до начала химиотерапии и/или лучевой терапии, обычно примерно за 24 ч, а предпочтительно примерно за 3-6 ч до начала химиотерапии и/или радиотерапии. Антиокислительный сален-Mn-комплекс может непрерывно вводиться пациенту в течение всего курса лечения.
Например, раствор антиокислительного сален-металлического комплекса может быть инкапсулирован в мицеллы с образованием иммунолипосом (патенты США N 5043164, 4957735, 4925661; Connor & Huang (1985) J.Cell.Biol. 101 : 582; Lasic O.D. (1992) Nature 355 : 279; Novel Drug Delivery (eds/Prescott L.F. & Nimmo W. S. : Wiley, New York, 1989); Reddy et al. (1992) J.Immunol. 148 : 1585). Иммунолипосомы, содержащие антиокислительный сален-металлический комплекс, будут включать часть молекулы - мишень (например, моноклональное антитело), которая обеспечивает направленную доставку указанных иммунолипосом к неопухолевым клеткам, являющимся так или иначе восприимчивыми к лучевой терапии или химиотерапии. Например, иммунолипосомы, содержащие моноклональное антитело, специфически связанное с антигеном кроветворной стволовой клетки, который отсутствует в раковых клетках индивидуума, могут быть использованы для направленной доставки антиокислительных сален-металлических комплексов к кроветворным стволовым клеткам в целях защиты указанных стволовых клеток от радиотерапии или химиотерапии, используемых для лечения рака. Описанный способ предпочтительно использовать в том случае, если применяемое химиотерапевтическое средство образует свободные радикалы in vivo (например, блеомицин).
Антиокислительные сален-Mn-комплексы могут быть также введены пациентам для предупреждения радиационного или химического повреждения тканей, обусловленного образованием свободных радикалов. Указанные сален-Mn-комплексы могут быть введены в профилактических целях военным и людям, работающим в области медицинской радиологии, а также в ядерной и/или химической промышленности. Антиокислительные сален-металлические комплексы могут быть также использованы в качестве химиотерапевтических средств для предупреждения химического канцерогенеза; в частности, канцерогенеза, обусловленного образованием реактивных эпоксидных интермедиатов (например, бензо[а]-пирена, бензантрацена), и канцерогенеза, обусловленного агентами, прямо или косвенно стимулирующими образование свободных радикалов (например, такими как фенобарбитал, ТРА, бензоилпероксид, пролифераторы пероксисом, а именно кипрофибрат, клофибрат). Для снижения риска образования опухолей у индивидуумов, подвергающихся воздействию указанных химических канцерогенов, этим индивидуумам могут быть заранее введены антиокислительные сален-металлические комплексы.
Антиокислительные сален-металлические комплексы могут быть также получены с использованием липофильной основы (или, если необходимо, водного носителя) в целях местного применения в косметике или для изготовления кремов и лосьонов от загара. Типичные косметические или солнцезащитные кремы или лосьоны могут содержать примерно 1-50 мг антиокислительного сален-металлического комплекса на 1 г косметического или солнцезащитного крема или лосьона.
Антиокислительные сален-металлические комплексы могут быть также введены водолазам или индивидуумам, работающим в условиях низкого давления окружающей среды, где кислородная токсичность представляет значительный риск для здоровья человека. Введение эффективной дозы антиокислительного сален-металлического комплекса обеспечивает вдыхание газов, находящихся под давлением, и/или кислород-обогащенных газов с меньшим риском кислородной интоксикации. Очевидно, что введение эффективной дозы указанного антиокислительного комплекса позволит уменьшить токсичность и биологические повреждения, связанные с воздействием озона на организм. Профилактическое введение антиокислительного сален-металлического комплекса людям, которые подвергаются воздействию озона, или людям, которые могут быть подвергнуты воздействию озона, может способствовать повышению стойкости организма к озоновой токсичности, например, к озон-индуцированному повреждению легких у людей, проживающих в регионах с высоким содержанием озона (например, в Лос-Анджелесе).
Использование, испытание и введение
Соединения настоящего изобретения, антиокислительные комплексы "сален-переходный металл", а предпочтительно сален-Mn-комплексы могут быть использованы для защиты от ишемического недуга при заболеваниях сердца и других заболеваниях, например, таких как инфаркт миокарда, застойная сердечная недостаточность, стенокардия, аритмия, нарушения кровообращения и шок. Соединения настоящего изобретения ингибируют разрушительное действие ишемии (например, вследствие инфаркта и реперфузии сердца; или преходящей ишемии-ЦНС или ишемии миокарда во время хирургической операции), не оказывая при этом угнетающего действия на сократительную способность миокарда. Таким образом, соединения настоящего изобретения являются эффективными для лечения сердечно-сосудистых заболеваний и заболеваний центральной нервной системы (ЦНС) у животных, и могут быть использованы для лечения инфаркта миокарда; шока; и повреждений головного мозга; при трансплантации органов и тканей, в частности с реперфузией ишемических участков; для лечения аритмии; застойной сердечной недостаточности; шока и других нарушений кровообращения у млекопитающих, а особенно у человека. Сален-Mn-комплексы могут быть также введены в консервирующие растворы, используемые для промывания иссеченных органов (например, сердца, почек, поджелудочной железы, печени, легких) во время их транспортировки и для хранения извлеченного органа перед его трансплантацией, например при пересадке кожи или роговицы. Консервирующие растворы могут содержать в основном по крайней мере около 1 мМ антиокислительного сален-металлического комплекса.
Введение активного соединения и его солей, описанных в настоящей заявке, может быть осуществлено любыми приемлемыми способами, обычно используемыми для введения терапевтических средств. Такими способами являются пероральное, парентеральное, чрезкожное, подкожное введение и другие методы системного введения. Предпочтительным способом является пероральное введение, за исключением тех случаев, когда пациент не способен самостоятельно проглатывать лекарственное средство. В этих случаях лекарственная композиция может быть введена парентерально. Если данная композиция включает в себя антиокислительный сален-металлический комплекс, содержащий амино-заместитель, который может быть протонирован при физиологическом pH, то обычно предпочтительно, чтобы этот антиокислительный комплекс был растворен или суспендирован в растворе, имеющем pH, при котором данный амино-заместитель является протонированным.
Количество вводимого активного соединения зависит от конкретного пациента, его веса, тяжести заболевания, способа введения и назначения лечащего врача. Однако в основном эффективная доза составляет 0,01-50 мг/кг/день, а предпочтительно 0,5-25 мг/кг/день. В среднем для человека, имеющего вес 70 кг, эта доза составляет 0,7-3500 мг в день, а предпочтительно около 35-1750 мг в день.
Поскольку механизмы действия всех сален-Mn-соединений, описанных в настоящей заявке, являются одинаковыми, то для всех применений указанных соединений используются в основном одинаковые и предпочтительные диапазоны доз и способы их введения.
Представленные ниже примеры приводятся лишь в целях иллюстрации настоящего изобретения и не должны рассматриваться как его ограничение.
Экспериментальная часть
Каталитическая активность in vitro
Антиокислительную каталитическую активность, супероксид-дисмутазную активность и каталазную активность сален-Mn-комплексов C1, C4, C6, C7, C9, C10, C11 и C12 (см. фиг. 3) определяли в соответствии с нижеописанным методом.
Анализ
SOD-активность указанных соединений определяло путем оценки степени ингибирования восстановления цитохрома C, продуцируемого системой, генерирующей образование свободных радикалов, а именно системой "ксантин + ксантиноксидаза". Восстановление цитохрома С может быть проконтролировано спектрофотометрически при 550 нм в соответствии с методом, описанным Darr и др. ((1987) Arch. Biochem. Biophys. 258 : 351). Концентрация ксантиноксидазы корректируется таким образом, чтобы скорость восстановления цитохрома С соответствовала 0,25 ед. оптической плотности (ОП)/мин при 550 нм. В этих условиях за одну единицу активности принимается количество SOD-активности, необходимое для ингибирования скорости восстановления цитохрома C на 50% (т. е. до скорости достижения О.П. 0,0125 ед./мин). Сален-металлические комплексы идентифицируются как антиоксиданты в том случае, если они имеют по крайней мере 0,1 ед. активности при концентрации 1 мМ в условиях, соответствующих стандартным аналитическим условиям.
Каталазную активность измеряли с использованием спектрофотометрического метода, по которому разложение перекиси водорода контролировали при 240 нм по методу Aebi и др. ((1984) Methods Enzymol. 105 : 121). За единицу каталазной активности принимают такое количество фермента (или сален-металлического комплекса), которое необходимо для разложения 1 мкМ перекиси водорода за 1 мин.
Каждое из соединений разводят в физиологическом растворе, в результате чего оно сохраняет стабильность без потери активности в течение нескольких недель хранения при комнатной температуре. Во многих случаях оказывается желательным сначала растворять сален-металлический комплекс в органическом растворителе (например, в ДМСО), а затем разводить в более полярном растворителе, таком как вода. Это особенно предпочтительно в случае использования относительно гидрофобных сален-металлических комплексов (например, C12).
В таблице IY представлены данные in vitro SOD- и каталазной активностей для различных сален-Mn-комплексов. SOD - и каталазная активности выражены в ед./мМ.
Биологическая активность in vivo
Широко используемый анализ для определения терапевтической ценности данных молекул при ишемии головного мозга (шок) заключается в оценке их способности предупреждать необратимые нарушения, индуцированные гипоксическим стрессом в срезах головного мозга, поддерживаемых в физиологических условиях. Срезы головного мозга крысы поддерживали при 35oC в камере с перегородками в искусственной цереброспинальной жидкости, содержащей 124 мМ NaCl, 3 мМ KCl, 1,25 мМ KH2PO4, 3 мМ СаСl2, 1 мМ MgCl2, 26 мМ NaHCO3, 10 мМ D-глюкозы и 2 мМ L-аскорбата и непрерывно насыщаемой газообразной смесью O2 : CO2 (95 : 5). Атмосферу камеры также непрерывно насыщали смесью O2 : CO2 (95 : 5) за исключением периода гипоксического стресса, когда эту смесь заменяли N2. Аксоны стимулировали электротоком, и индуцированные возбуждающие постсинаптические потенциалы ВСПС регистрировали с использованием микроэлектродов.
На фиг. 4 схематически показаны EPSP, зарегистрированне в нормальных условиях (А), через 5 мин после замены O2 на N2 (ишемический стресс, В); и через 30-40 мин после реокисления (С). Степень перманентного повреждения может быть количественно определена путем измерения амплитуды (в мВ) и начальной крутизны (в мВ/мс) ВПСП.
На фиг. 5 и 6 показано защитное действие антиокислительного сален-Mn-комплекса, обозначенного C7, в ишемической системе ВПСП срезов мышиного головного мозга. Срезы головного мозга инкубировали в отсутствии или в присутствии 50 мкМ C7 и подвергали ишемическому реокислительному стрессу. Через 5 мин после регистрации базовой линии O2 заменяли на N2 в течение примерно 5 мин. Затем снова подавали O2 и продолжали регистрацию еще в течение 50 мин. Эксперименты с образцами, испытываемыми в присутствии 50 мкМ C7, показали, что амплитуда и крутизна ВПСП восстанавливались до предышемических уровней. В противоположность этому необработанные срезы головного мозга обнаруживали восстановление лишь на 40% от предышемического уровня.
В качестве дополнительного анализа эффективности оценивали процент жизнеспособных срезов после повторного ишемического шока. На фиг. 7 показано, что при отсутствии обработки этот процент очень низок (6%), тогда как для срезов, обработанных 50 мкМ C7, этот процент составляет 70%. При этом срезы считались жизнеспособными, если ВПСП с амплитудой 3 мВ может быть достигнут путем увеличения интенсивности стимуляции.
Испытания на in vivo-модели
Для оценки защитного действия C7 на повреждения, индуцированные свободными радикалами, была использована in vivo-модель болезни Паркинсона, включая ятрогенное продуцирование гидроксильных радикалов с помощью нейротоксина МРТР (Chiueh и др. (1992) Synapse 11 : 346). Было показано, что нейротоксин МРТР приводит к дегенерации допаминэргических нейронов в головном мозге, обеспечивая таким образом хорошую модель экспериментально индуцированной болезни Паркинсона (например, ятрогенная токсичность). В настоящее время эта модель широко используется специалистами для оценки эффективности терапевтических средств при лечении этого заболевания.
Ряд допаминергических нейронов головного мозга мыши, либо обработанных (1) только МРТР, (2) только антиокислительным сален-металлическим комплексом C7, (3) сначала комплексом C7, а затем МРТР; либо (4) необработанных (контроль), был проанализирован путем измерения связывания допамин-поглощающего лиганда, мазиндола. Меченный тритием мазиндол использовали для исследования связывания на образцах бледного шара (globus pallidus), хвостатого ядра (caudata nucleus) и полосатого тела (striatum) головного мозга мыши в соответствии со стандартными методами; при этом специфическое связывание меченного тритием мазиндола определяли авторадиографически или путем мембранного связывания (специфического связывания с мембранной фракцией). Эксперимент проводили в течение 7 дней. Мышам в МРТР-группе внутрибрюшинно вводили только МРТР (40 мг/кг каждый день на 1-й и 2-й дни). Мышам в МРТР + C7-группе вводили сначала C7 (33 мг/кг, j.p.), а затем сразу вводили МРТР на 1-й и 2-й день, а после этого на третий день вводили только C7 (33 мг/кг). Затем через 7 дней животных умерщвляли.
Результаты, представленные на фиг. 8, иллюстрируют значительное защитное in vivo-действие сален-Mn-комплекса C7. Как видно из фиг. 8, на допаминергические нейроны, присутствующие в различных областях мышиного головного мозга, не оказывает вредного воздействия антиокислительный сален-металличеекий комплекс С7; у мышей, обработанных одним МРТР, количество допаминергических нейронов снизилось примерно до 15% от контрольных значений; однако предварительная обработка комплексом С7 способствовала удвоению числа жизнеспособных допаминергических нейронов, присутствующих в головном мозге мыши, которые были затем обработаны МРТР. Нетоксичность С7 была проиллюстрирована отсутствием ухудшения здоровья животных, обработанных соединением С7, в течение 7-дневного периода испытаний.
Полученные данные показали, что сален-Mn-комплексы являются терапевтически эффективными для in vivo-модели человеческого заболевания, испытанной на грызунах. Кроме того, эти данные показали, что сален-Mn-комплексы с успехом преодолевают гематоэнцефалический барьер. Таким образом, полученные данные в целом продемонстрировали высокую степень эффективности сален-Mn-комплекса в предупреждении индуцированного свободными радикалами нарушения и ишемического реокислительного повреждения головного мозга.
Действие С7 в выделенных перегруженных железом крысиных сердцах, подвергнутых ишемии и реперфузии
Для достижения значительной перегрузки сердечной ткани железом мыши получали внутримышечную инъекцию 0,25 мл железо-декстранового раствора (100 г гидроксида железа, 99 г декстрана, вода до 1 л) каждый третий день в течение 5 недель. По окончании этой обработки крыс анестезировали пентобарбиталом натрия (40 мг/кг), и через бедренную вену вводили гепарин (1000 МЕ/кг). Затем сердца удаляли и быстро подвергали перфузии через аорту в соответствии с техникой, описанной Langendorff (Langendorff О., Pflugers Arch. 61 : 291, 1895), при постоянной скорости потока 11 мл/мин. В качестве жидкости для перфузии использовали модифицированный буфер Кребса-Хенселейта, содержащий (в мМ/л): NaCl 118, KCl 5,9, NaHCO3 25, MgCl2 1,2, NaH2PO4 0,6, CaCl2 2,4, глюкоза 1 л. При насыщении реперфузионной среды O2-CO2 (95%-5%) при 37oC, pH поддерживали при 7,4±0,05. Аппарат для перфузии был снабжен термостатом, так чтобы температура перфузионной среды составляла 37,0±0,5oC в тот момент, когда она достигнет аорты. После начала перфузии через аорту сразу в левый желудочек вводили сверхтонкий баллон и наполняли так, чтобы конечное диастолическое давление составляло 5 мм рт.ст. Сразу после введения баллона выдерживали 15-минутный период стабилизации. По окончании этого периода с помощью датчика давления, присоединенного к вентрикулярному баллончику, регистрировали систолическое и диастолическое давление в желудочке и частоту сердечных сокращений (ЧС). Фактическое давление в левом желудочке (ДЛЖ) вычисляли как разность между систолическим и диастолическим давлением, а произведение ЧС х ДЛЖ принимали за показатель потребления кислорода. Затем сердца подвергали 15-минутной полной ишемии при нормальной температуре с последующей 15-минутной реперфузией с использованием среды, описанной выше. Во время указанной 15-минутной реперфузии следили за сердечными сокращениями и диастолическим и систолическим давлением. Через 1 мин после начала реперфузии анализировали ранние фибрилляции желудочков.
При этом исследовали три экспериментальные группы: группу 1 (n = 7), где сердца перфузировали стандартным раствором для перфузии (контрольная группа); группу 2 (n = 8), где сердца перфузировали в присутствии диметилтиомочевины (DMTM, 10 мМ) и группу 3 (n = 8), где сердца перфузировали в присутствии С7 (50 мкМ).
После 15-минутной реперфузии 3 сердца из каждой группы подготавливали для последующей электронной микроскопии с помощью перфузии 2,5 глутаральдегидом. Полученные в результате сверхтонкие (500-600 А) срезы подвергали исследованию.
Результаты
В таблице Y представлены частота сердечных сокращений (ЧС), систолическое давление (СД), диастолическое давление (ДД) и произведение ЧС х ДЛЖ для трех экспериментальных групп, через 15 мин после перфузии, перед ишемией (перед), через 1 мин после реперфузии (1 после), и через 15 мин после реперфузии (15 после). В этой таблице также указано количество сердец, в которых наблюдалась фибрилляция желудочков через 1 мин после реперфузии (ФЖ).
В таблице YI систематизированы результаты оценки, полученные с помощью электронной микроскопии сердец. Митохондрии были классифицированы как Тип A (нормальные), Тип B (набухшие, неповрежденные) и Тип C (с поврежденными мембранами). Саркомеры были классифицированы так Тип A (нормальный) и Тип B (контактируемые и/или некрозированные). Результаты выражали в процентах. Число проанализированных митохондрий составляло 1293, 1632 и 1595 для контроля, DMTU-группы и C7-группы соответственно. Число проанализированных саркомеров составляло 1046, 1173 и 1143 для контроля, DMTU-группы и C7-группы соответственно.
Полученные данные показали, что С7 обладает эффективным защитным действием, предохраняющим сердце, как его структуру, так и его функцию от повреждений, вызываемых ишемией/реоксигенацией. Кроме того, С7 является гораздо более эффективным антиоксидантом, чем DMTM, даже если он используется в концентрации в 200 раз ниже концентрации DMTM.
Экспериментальный аутоиммунный энцефалит (ЭАЭ)
ЭАЭ представляет собой модель рассеянного склероза у животного. 30 мышей самок (SJL) в возрасте около 10 недель, распределяли на две группы из 20 мышей (контрольных) и 10 мышей (обработанных С7).
Мышей обеих групп иммунизировали энцефалитогенным пептидом PSP в полном адъюванте Фрейнда (подкожно), а затем токсином Petrussis (IV). Иммунизацию токсином Petrussis повторяли через 3 дня после иммунизации.
Мышей из С7-группы обрабатывали ежедневно (1 мг/мышь, примерно 40 мг/кг) путем внутрибрюшинной инъекции, начиная за 2 дня до иммунизации и в течение последующих 14 дней после иммунизации.
Животных оценивали следующим образом.
Стадия 1: синдром кончика хвоста
Стадия 2: паралич задней лапы
Стадия 3: паралич задней лапы - волочение лапы
Стадия 4: паралитическая неподвижность, потеря веса.
Результаты
В течение третьей недели после иммунизации у 8 из 2 мышей в контрольной группе наблюдалась развернутая симптоматическая картина ЭАЭ: 2 - Стадия 1, 4 - Стадия 2/3 и 2 - Стадия 4.
В тот же самый период лишь у одной из 10 мышей С7-обработанной группы наблюдалась симптоматическая картина ЭАЭ (Стадия 2).
В течение пятой недели, т.е. через три недели после прекращения С7-обработки, у шести мышей из С7-группы наблюдались симптомы ЭАЭ: 4 - Стадия 2 и 2 - Стадия 4.
Эти результаты показали, что С7-обработка способствует предупреждению развития симптоматического ЭАЭ и что это заболевание может развиваться после прекращения обработки.
Переокисление липидов
От крыс Sprague-Dawley (150-200 г) получали срезы аммонова рога (толщиной 400 мкм) и собирали в предварительно насыщенную кислородом (95% O2/5% CO2) фосфатную среду Кребса-Рингера (pH 7,4), содержащую 120 мМ NaCl, 5 мМ KCl, 1,3 мМ CaCl2, 1,2 мМ MgCl2, 16 мМ Na-фосфат (pH 7,4) и 10 мМ глюкозы. После 15-минутного предварительного инкубирования в водяной бане при 35oC в условиях перемешивания этот буфер заменяли тем же самым буфером (контроль) или модифицированным буфером (лактатный буфер), содержащим 90 мМ NaCl, 5 мМ KCl, 1,3 мМ CaCl2, 1,2 мМ MgCl2, 16 мМ Na-фосфата и 30 мМ молочной кислоты (pH 0,5). С7, если он присутствовал (50 мкМ), добавляли в период предварительного инкубирования и в период инкубирования. Через 100 мин срезы собирали и гомогенизировали в 0,9 мл TCA (5%); при этом 0,35 мл TCA 5% добавляли к 0,5 мл инкубационной среды. Переокисление липида измеряли путем добавления 0,25 мл реагента тиобарбитуровой кислоты (ТБК) к 0,85 мл TCA-экстрактов, и полученную смесь инкубировали в течение 60 мин при 85-93oC. Затем липиды экстрагировали 2 х 0,5 мл 1-бутанола путем перемешивания их смеси в течение 10 с с последующим центрифугированием при 2000 об/мин, в течение 10 мин. Оптическую плотность переокисленных липидов в спиртовой фазе измеряли на спектрофотометре при 532 нм. Данные выражали в наномолях малондиальдегида (MDA) с использованием аутентичного MDA для построения стандартной кривой. Количество белка измеряли исходя из аликвоты ТСА-экстрактов по методу Бредфорда, и конечные результаты получали как нМ образованного MDA/мг белка.
Результаты
На фиг. 9 показано переокисление липидов в момент времени 0 (сразу после изготовления срезов) и через 100 мин после инкубирования при pH 7,4 (контроль), при pH 5,0 (лактат) в отсутствии (ЛО) или в присутствии (ЛО+С7) 50 мкМ С7, в гомогенатах срезов (столбцы, заштрихованные косыми штрихами) и в инкубационной среде (столбцы, заштрихованные точками). Данные выражали как средние величины + ср.кв.ош., причем экспериментальная С7-группа показала более высокую статистическую значимость по сравнению с контрольной (р < 0,01), тогда как небольшие различия между ЛО и ЛО+С7 не обнаруживали такой высокой статистической значимости. После инкубирования срезов аммонова рога с 30 мМ лактаты при конечном pH 5,0 наблюдалось значительное усиление переокисления липидов, измеренное при помощи теста с использованием тиобарбитуровой кислоты. Инкубирование срезов в присутствии С7 (50 мкМ) полностью отменяло увеличение переокисления липидов. Индуцированное лактатом увеличение концентрации малондиальдегида в обеих инкубационных средах (точечные столбцы) и в гомогенатах срезов (заштрихованные столбцы) было блокировано соединением С7. Инкубирование в течение 100 мин в отсутствие лактата и либо в присутствии, либо в отсутствии С7 не дало какого-либо заметного увеличения в периокислении липидов.
Полученные данные свидетельствуют о том, что С7 предотвращает переокисление липидов, вызванное ацидозом. Известно, что ацидоз индуцирует обширные окислительные повреждения. Переокисление липидов является следствием такого окислительного нарушения и, как было установлено, ассоциируется со многими заболеваниями человека.
In vitro-модели повреждений
Гипоксия в срезах аммонова рога. Для электрофизиологических экспериментов использовали срезы аммонова рога (400 мкм), полученные от взрослых крыс Sprague-Dawley, выдерживаемых при 35oC в двух камерах с перегородкой в присутствии (50 мМ) и в отсутствии С7. Стеклянную измерительную микропипетку устанавливали в лучистый слой СА1 для регистрации постсинаптического потенциала возбуждения (ВПСП), генерированного путем электростимуляции коммиссурального пути Шеффера с использованием биополярного стимулирующего электрода при частоте 0,033 Гц. Во время гипоксических стрессов поставляемый кислород заменяли 100%-ным газообразным N2. После того как электрические сигналы прекращались, в течение 90 с подавали N2. Восстановление ВПСП (крутизны и амплитуды) регистрировали в течение 50 мин, и за это время определяли конечную жизнеспособность срезов, которую выражали как способность среза генерировать 3 мВ EPSP.
Ацидоз в срезах гиппокампа. Срезы гиппокампа собирали в заранее оксигенированный фосфатный буфер Кребса-Рингера, не содержащего или содержащего 50 мкМ С7 при 35oC в водяной бане, установленной на шейкере. Через 15 мин после предварительного инкубирования срезы переносили в тот же самый буфер или в буфер, содержащий 30 мМ лактата (в присутствии или отсутствии С7). Через 100 мин после инкубации срезы от всех групп собирали и оценивали на переокисление липидов, на что указывала реакция малондиальдегида с тиобарбитуровой кислотой.
In vivo-модель нейронного повреждения
МРТР в мышах. Взрослым мышам (CFW) (самцам - 25-33 г) вводили две инъекции МРТР, растворенного в нормальном физиологическом растворе (40 мг/кг, s. c. ) через промежуток времени в 24 ч. Группа животных также получала три инъекции С7 (33 мг/кг, s.c.), которые вводились через промежутки времени 24 ч, начиная за 1 день до начала введения МРТР. Затем через 7 дней после первой МРТР-инъекции животных умерщвляли и анализировали на нейронную патологию путем связывания H3- мазиндола (лиганда для допаминового переносчика) в 10 мм замороженных срезах головного мозга или в стриарных гомогенатах.
6-OHDA в мышах. Взрослых мышей самцов (CFW) анестезировали кетамином и румпуном и иммобилизовали в стереотаксическом устройстве. 6-OHDA в виде гидробромидной соли растворяли в нормальном физиологическом растворе, содержащем 1% аскорбата, и 50 мкг этого раствора вводили в боковой желудочек с помощью 10-мкл шприца Гамильтона. С7 (66 мг/кг, s.p.) вводили ежедневно в течение 4 дней. Через 7 дней животных умерщвляли и оценивали нейронную патологию путем измерения связывания 3H-мазиндола в стриарных гомогенатах.
Результаты
С7-комплекс защищает срезы аммонова рога от повреждений, индуцированных гипоксией
Срезы аммонова рога выдерживали в условиях гипоксии в присутствии или в отсутствии С7 (50 мкМ). С7 обеспечивает значительный уровень защиты от индуцированного гипоксией уменьшения синаптического ответа в СА1. С7 способствует предупрежедению снижения ВПСП (крутизны (А) и амплитуды (В)). Очищенная бычья SOD, используемая в том же самом анализе, не показала защитного эффекта.
На фиг. 10 показано, что инъекция (i.c.v) 6-OHDA (50 мкг) привела к 60-70%-ному уменьшению связывания мазиндола в гомогенатах полосатого тела, взятого с одной стороны от места инъекции, и к 30%-ному уменьшению в гомогенатах полосатого тела, взятого с противоположной стороны (фиг. 10). Обработка С7-соединением (4 х 66 мг/кг) способствовала значительному уменьшению в ипсилатеральной части и полной защите в контрлатеральной части.
МРТР-обработка (2 х 40 мг/кг, s.h.) обеспечивала значительную (p < 0,05) степень защиты от снижения связывания 3H-мазиндола в бледном шаре и в хвостатом ядре (фиг. 11А). Обработка лишь одним С7 не оказала значительного влияния на связывание 3H-мазиндола. Аналогичная обработка также обнаруживала значительный защитный эффект, направленный против снижения связывания 3H-мазиндола в гомогенатах полосатого тела (фиг. 11В).
Заключение
Полученные результаты проиллюстрировали защитное действие синтетического каталитического акцептора (СКА), С7, в различных моделях нейронного повреждения. С7 обладает способностью защищать нейроны от острых ранних проявлений нейронного повреждения, например, таких как переокисление липидов и потеря синаптической жизнеспособности, а также от более поздних проявлений нейронного повреждения, таких как потеря нейронов через 7 дней после введения токсина.
Исходя из положительных результатов, полученных в экспериментах с использованием периферических инъекций С7 в in vivo-моделях нейронного повреждения, мы пришли к заключению, что указанный комплекс является стабильным in vivo и способен преодолевать гематоэнцефалический барьер, а также нейронные мембраны.
Положительное действие С7 в различных моделях нейронного повреждения свидетельствует о том, что соединения, содержащие реакционноспособный кислород, а в частности супероксидный радикал, играют важную роль в индуцированных ишемией и ацидозом патологиях, а также в МРТР- и 6-OHDA-индуцированных потерях ингростриарных допаминергических нейронов.
И, наконец, учитывая наличие широкого диапазона патологических состояний, ассоциированных со сверхпродуцированием оксирадикалов, можно сделать вывод, что антиокислительные сален-металлические комплексы, такие как С7, могут быть широко использованы для лечения различных заболеваний.
Вышеприведенное описание предпочтительных вариантов осуществления настоящего изобретения представлено в целях иллюстрации и не должно рассматриваться как ограничение объема изобретения, а поэтому могут быть допущены различные изменения и модификации, не выходящие, однако, за пределы объема формулы изобретения.

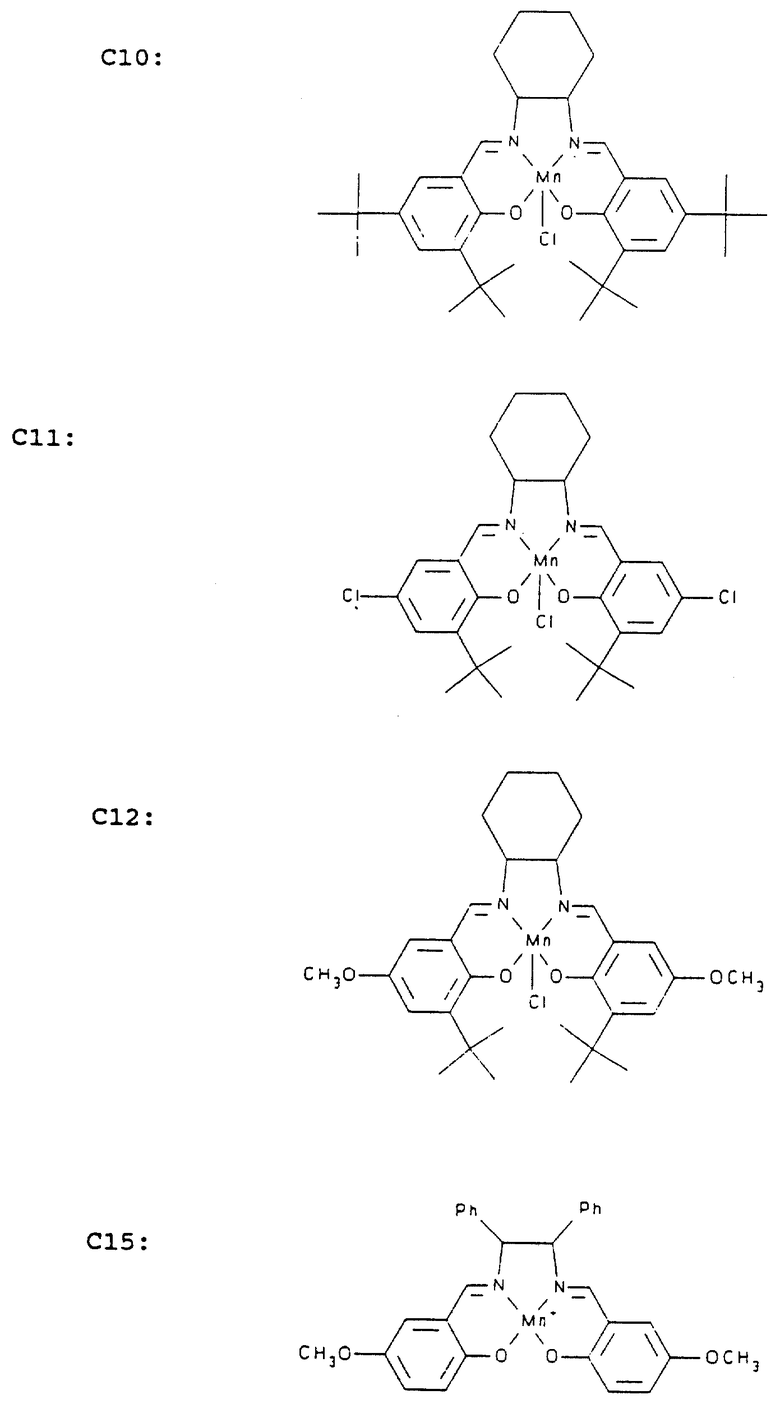











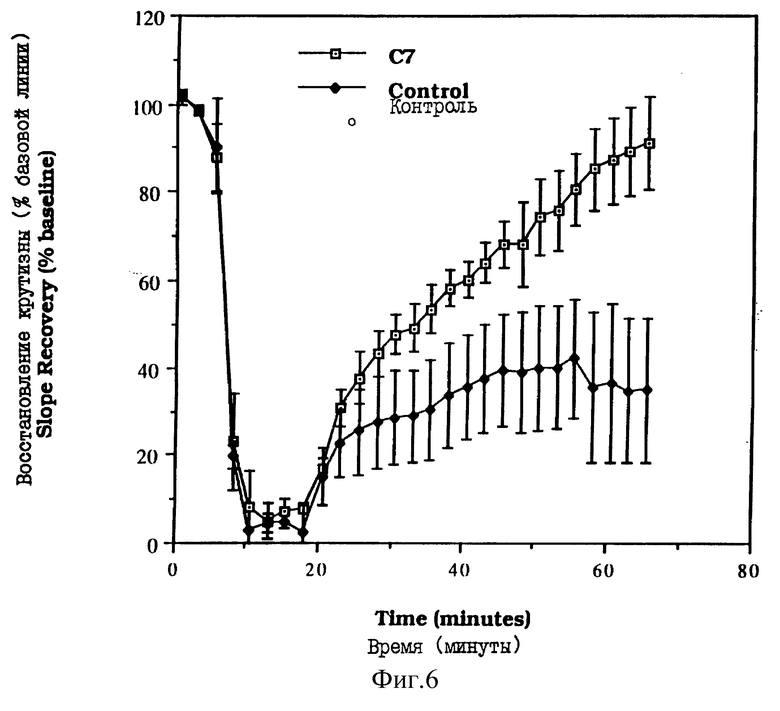





Изобретение относится к медицинe, в частности к антиокислительным сален-металлическим комплексам в форме, приемлемой для фармацевтического введения в целях предупреждения или лечения заболеваний, ассоциированных с поражением клеток или ткани, вызванным присутствием свободных радикалов, таких как супероксид. Сущность изобретения: представлены фармкомпозиция на основе сален-металлического комплекса определенной структуры, способ профилактики или лечения заболеваний, ассоциированных с присутствием свободных радикалов, клетка, содержащая упомянутый комплекс. Изобретение расширяет арсенал средств борьбы с заболеваниями, связанными с присутствием свободных радикалов. 2 с. и 26 з.п. ф-лы, 6 табл., 11 ил.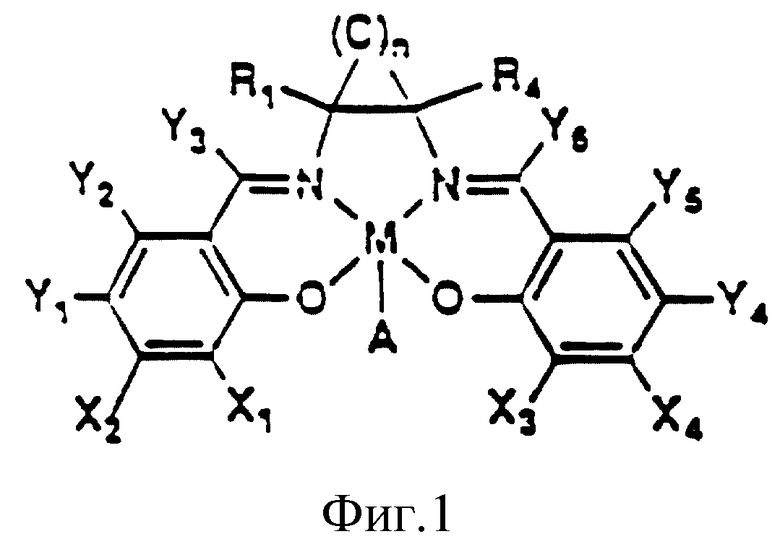

где М выбирают из группы, включающей Mn, Со, Fe, V, Cr, Ni;
А - анион;
n = 0, 1 или 2;
Х1 - Х4 независимо выбирают из группы, включающей водород, силилы, арилы, арилалкилы, первичные алкилы, вторичные алкилы, третичные алкилы, алкокси, амины, четвертичные амины, гетероатомы и водород;
Y1 - Y6 независимо выбирают из группы, включающей водород, галоиды, алкилы, арилы, арилалкилы, силилы, амины, алкилы или гетероарилы и галоид;
R1 - R4 независимо выбирают из группы, включающей водород, арил, сложные эфиры жирных кислот; замещенные алкоксиарилы; ароматические группы, содержащие гетероатом; алкиларилы; первичные алкилы; вторичные алкилы и третичные алкилы.
где М, который является ионом переходного металла, выбирают из группы, включающей Mn, Со, Fe, V, Cr, Ni;
А - анион;
n = 4, 5 или 6;
Х1 - Х4 независимо выбирают из группы, включающей арилы, арилалкилы, арилокси, первичные алкилы, вторичные алкилы, третичные алкилы, алкокси, замещенную алкокси, гетероатомы, амины, четвертичные амины и водород;
Y1 - Y6 независимо выбирают из группы, включающей в себя арилы, арилалкилы, первичные алкилы, вторичные алкилы, третичные алкилы, алкокси, замещенные алкокси, арилокси, галоиды, гетероатомы, амины, четвертичные амины и водород;
R1 и R4 независимо выбирают из группы, включающей водород, галоиды, первичные алкилы, вторичные алкилы, третичные алкилы, сложные эфиры жирных кислот, алкокси или арилы.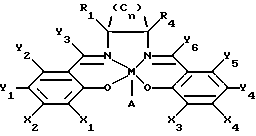
где М - марганец;
А - Н или галоген;
n = 0, 4, 5 или 6, где Сn отсутствует, если n = 0, и Сn - насыщенный углеводород, если n = 4, 5 или 6;
R1 и R4 независимо выбирают из группы, включающей Н, фенил, низший алкокси- и сложноэфирную группу низших кислот;
Х1 и Х3 независимо выбирают из группы, включающей водород, низший алкил, амин, низшую алкиламиногруппу и галоген;
Х2 и Х4 - Н;
Y1 и Y4 независимо выбирают из группы, включающей водород, низший алкил, галоген и низшую алкоксигруппу; Y2, Y3, Y5 и Y6 - Н,
все остальные положения заместителя заняты Н.
| Пожарный двухцилиндровый насос | 0 |
|
SU90A1 |
| ОХЛАЖДАЮЩЕЕ УСТРОЙСТВО ДЛЯ ЭЛЕКТРИЧЕСКОГО УСТРОЙСТВА И ЭЛЕКТРИЧЕСКОЕ УСТРОЙСТВО, В ЧАСТНОСТИ АВТОМАТИЧЕСКИЙ ВЫКЛЮЧАТЕЛЬ, СОДЕРЖАЩИЙ ТАКОЕ ОХЛАЖДАЮЩЕЕ УСТРОЙСТВО | 2013 |
|
RU2650183C2 |
| US 4540573 А, 21.04.92. | |||
Авторы
Даты
2000-10-10—Публикация
1993-12-06—Подача