Изобретение обеспечивает способы нацеливания белка, такого как антитело, во внутриклеточные компартменты эукариотической клетки, способы усиления поглощения органами белков, фармацевтические композиции модифицированных белков для лечения человека и способы приготовления модифицированных белков. Модифицированные белки настоящего изобретения включают связанный с липидом белок, в котором одна или более ацильных групп связаны с белком посредством боковой углеводной цепи и различными ковалентными связями.
Предпосылки к созданию изобретения
Множество естественно встречающихся или модифицированных белков предлагается в качестве диагностических и/или терапевтических агентов для человека и домашних животных. Однако белки, в основном, очень плохо проходят через сосудистые эндотелиальные мембраны, если вообще проходят, и обычно не могут преодолеть клеточные мембраны, чтобы получить доступ к внутриклеточным компартментам. Так, например, можно получить антитела против очищенных внутриклеточных белков, таких как факторы транскрипции, внутриклеточные ферменты и структурные белки, но такие антитела, в основном, не способны проникать в интактную клетку и связываться с внутриклеточными антигенными мишенями, пока клеточная мембрана не повреждена.
Создание методики моноклональных антител в середине 1970-х годов провозгласило новую эру в медицине. В первое время исследователи и клиницисты имели доступ к практически неограниченным количествам стандартных антител, способных связываться с предопределенными антигенными сайтами и обладающих разнообразными иммунологическими эффекторными функциями. Эти белки, известные как "моноклональные антитела", казалось, подавали большие надежды, например, для удаления вредных клеток, микробных патогенов и вирусов in vivo. Способы, делающие возможным разработку специфичных моноклональных антител, обладающих специфичностью связывания, направленной против практически любого желательного антигенного эпитопа, включая антитела, которые расположены во внутриклеточных компартментах, обещали настоящий рог изобилия лекарственных "волшебных пуль".
К несчастью, разработка подходящих лекарственных продуктов, основанных на моноклональных антителах, а также поликлональных антисыворотках, серьезно затруднялась рядом недостатков, связанных с химическим строением натуральных антител. Первое, антитела, в основном, не способны эффективно проникать внутрь клеток, поскольку иммуноглобулины не способны преодолеть плазматическую мембрану клеток, и обычно только интернализируются, если это вообще происходит, как следствие неэффективных эндоцитотических механизмов. Второе, антитела, в основном, не пересекают сосудистые оболочки (например, субэндотелиальную базальную мембрану), что затрудняет эффективное включение антител в органы и интерстициальные пространства. Следовательно, можно было бы разработать лекарства для лечения многих серьезных заболеваний, если бы существовал эффективный способ доставки специфичных биологически активных молекул иммуноглобулинов через капиллярные барьеры и во внутриклеточные участки. Например, жизненный цикл ретровируса, такого как ВИЧ, включает внутриклеточную репликацию, при которой несколько закодированных вирусом полипептидов, имеющих важное значение для продукции контагиозных вирионов в инфицированной клетке, могли бы быть угнетены или блокированы, если бы специфичные моноклональные антитела против кодируемых вирусом белков могли легко проникать во внутриклеточные участки, где наблюдается репликация ретровируса.
Иммунолипосомы были разработаны как потенциальная нацеливающая система доставки различных молекул, содержащихся в липосоме, в клетку-мишень. Иммунолипосомы используют иммуноглобулины в качестве нацеливаемых агентов, причем ацилированный иммуноглобулин закреплен на липидном бислое липосомы, чтобы нацелить липосому на определенные клеточные типы, которые имеют внешние антигены, которые связываются ацилированным иммуноглобулином (иммуноглобулинами) иммунолипосом (Connor и Huang (1985) J. Cell Biol. 101: 582; Huang, L. (1985) Biochemistry 24:29; Babbitt и др., (1984) Biochemistry 23: 3920; Connor и др. (1984) Proc. Natl. Acad. Sci. (U.S.A.) 81:1715; Huang и др. (1983) J. Biol. Chem. 258:14034; Shen и др. (1982) Biochim. Biophys. Acta 689:31; Huang и др. (1982) Biochim. Biophys. Acta 716:140; Huang и др. (1981). J.Immunol. Methods 46:141; и Huang и др. (1980) J. Biol. Chem. 255: 8015). Иммунолипосомы, в основном, содержат иммуноглобулины, которые присоединены к ацильным заместителям липосомного бислоя посредством поперечно-связывающего агента, такого как N-гидроксисукцимид, и которые, таким образом, закрепляются на липидном бислое липосомы. Следовательно, поперечно-связанный иммуноглобулин зафиксирован на липосоме и служит для нацеливания липосом на специфичные типы клеток, которые несут определенный заведомо внешний антиген, путем присоединения к внешнему клеточному антигену. В то время как такие способы могут служить для нацеливания липосом на определенные клеточные типы, иммунолипосомы обладают несколькими существенными недостатками, которые ограничивают их использование в качестве средств доставки лекарственных агентов, в частности для доставки белков внутрь клетки.
Были предприняты попытки модифицировать белки так, чтобы облегчить их транспорт через капиллярные барьеры и внутрь клеток (ЕР 0329185), однако до сих пор не сообщалось о создании всесторонне удовлетворительного способа. Сообщалось о химической модификации белков, таких как антитела, посредством неспецифической "катионизации", для облегчения трансваскулярной и внутриклеточной доставки белков (U.S.S.N. 07/693, 872). Однако существующие в настоящее время способы получения катионизированных иммуноглобулинов приводят к значительной утрате связывающего сродства (приблизительно 90%) катионизированного иммуноглобулина к его предопределенному эпитопу, по сравнению с некатионизированным иммуноглобулином. В общих чертах, катионизация включает присоединение диамина, такого как путресцин или гександиамин, посредством карбодиимидной связи к карбоксильным группам остатков аспарагиновой и глутаминовой кислот в полипептидной цепи иммуноглобулина. Эти химические модификации первичных аминокислот, вероятно, нарушают вторичную и третичную структуру иммуноглобулина в степени, достаточной для потери связывающего сродства. Также настоящие способы производят некоторую степень катионизации остатков глутаминовой и аспарагиновой кислот, расположенных в различных доменах иммуноглобулиновой цепи, что приводит к значительной утрате связывающего сродства и/или специфичности.
Химическая модификация малых молекул также была предложена в качестве способа усиления транспорта малых биологически активных соединений. Felgner (W 091/17242) описывает формирование липидных комплексов, состоящих из липидных пузырьков и заключенных в них биологически активных веществ. Felgner и др. (W 091/16024) описывают катионные липидные соединения, которые, как утверждается, пригодны для усиления переноса малых биологически активных молекул в растениях и животных. Липосомы и поликатионные нуклеиновые кислоты были предложены в качестве способов доставки полинуклеотидов в клетки. Липосомы часто демонстрируют узкий спектр клеточной специфичности, и когда ДНК покрывает их снаружи, она зачастую чувствительна к действию клеточных нуклеаз. Новейшие поликатионные липосперминовые соединения подвергают воздействию широкий спектр клеток (Behr и др. (1989) Proc. Natl. Acad. Sci. USA 86:6982) и ДНК покрывают этими соединениями. В добавление, комбинация нейтрального и катионного липидов рассматривается как способ трансфекции животных клеток (Rose и др., (1991), Bio-Techniquer 10:520).
Другие подходы к усилению доставки лекарств, в частности, через гематоэнцефалический барьер, применяют фармакологически обоснованные процедуры, включающие перевод лекарств в инертное состояние или превращение гидрофильных лекарств в жирорастворимые. Большинство подходов по переводу в инертное состояние включают блокирование гидроксильных, карбоксильных и первичных аминогрупп лекарства, чтобы сделать его более жирорастворимым и, таким образом, облегчить его транспорт через гематоэнцефалический барьер. Pardridge и Schimmel, U. S. Patent 4902505 раскрывают химерные пептиды для усиления транспорта посредством рецептор-опосредованного трансцитоза.
Таким образом, в данной области существует потребность в методах облегчения транспорта специфичных белков, таких как антитела, через капиллярные барьеры и внутрь клетки и в фармацевтических композициях таких иммуноглобулинов для лечения заболеваний человека и животных, которые поддаются лечению внутриклеточными белками и прицельными агентами, такими как моноклональные антитела.
Краткое изложение изобретения
Существующий ранее способ увеличения транспорта антител внутрь клеток посредством соединения катионного заместителя с первичной полипептидной цепью иммуноглобулина относительно неспецифичным связующим реагентом производит пагубные изменения во вторичной, третичной и/или четвертичной структуре белка. Эти структурные изменения однозначно вызывают потери в связывающем сродстве катионизированных антител. Чтобы преодолеть это явление, настоящее изобретение создает способы, при которых липидные заместители связываются с белком, таким как иммуноглобулин, обычно ковалентной связью с углеводной боковой цепью белка, таким образом, что липидный заместитель не наносит существенного вреда биологической активности белка (например, связыванию с антигеном).
Настоящее изобретение обеспечивает способы приготовления липидизированных белков, в основном, посредством липидизирования углеводной части гликопротеина или гликопептида. В целом, способы настоящего изобретения используют для присоединения липида, такого как липоамин, к полипептиду, обычно ковалентной связью липида и углеводной части белка, причем углеводная часть в общем случае химически окислена и реагирует с липоамином, образуя липидизированный белок. Получающийся в результате липидизированный белок, в основном, обладает выгодными фармакокинетическими характеристиками, такими как возросшая способность преодолевать сосудистые барьеры и достигать паренхимных клеток различных органов и возросшая способность достигать внутриклеточных компартментов. В одном аспекте настоящего изобретения липидизирование белков, таких как антитела, направленные против факторов транскрипции (например, Fos, Jun, AP-1, OCT-1, NF-AT), облегчает внутриклеточную локализацию липидизированного белка (белков).
Изобретение также обеспечивает способы приготовления липидизированных антител, которые эффективно транспортируются через капиллярные барьеры и интернализируются в клетки млекопитающих in vivo. Способы настоящего изобретения относятся к способам для химического присоединения по крайней мере одного липидного заместителя (например, липоамина) к углеводной части иммуноглобулина с целью получения липидизированного через углеводную часть иммуноглобулина, при которых липидизированный иммуноглобулин способен к внутриклеточной локализации. В альтернативных вариантах осуществления изобретения, по крайней мере, один липидный заместитель (например, липоамин) ковалентно связан с неуглеводной частью белка или полипептида (например, путем образования амидной связи с остатком аспарагиновой или глутаминовой кислоты карбоксильного заместителя боковой цепи или тиоэфирной связи с остатком цистеина). Также можно присоединить жирную кислоту к остатку аргинина или лизина с помощью аминозаместителей боковой цепи.
Подобно этому липидные заместители могут быть ковалентно присоединены к пептидомиметическим соединениям. Пептидные аналоги широко применяют в фармацевтической промышленности в качестве непептидных лекарств, обладающих свойствами, аналогичными свойствам матричных пептидов. Эти виды непептидных соединений называют пептидомиметиками (Fauchere, J. (1986) Adv. Drug Res. 15:29; Veber и Freidinger (1985) TINS стр. 392; и Evans и др. (1987) J. Med. Chem. 30: 1229, включенные в настоящий документ в качестве ссылки) и обычно разрабатывают с помощью компьютерного молекулярного моделирования. Пептидомиметики, которые по структуре сходны с лекарственными пептидами, можно применять для получения эквивалентного терапевтического или профилактического эффекта. В целом, пептидомиметики структурно сходны с типичными полипептидами (т.е. с полипептидами, обладающими биологической или фармакологической активностью), но имеют одну или более пептидных связей, факультативно замещенных связями, выбранными из следующей группы:
-CH2NH-, -CH2S-, -CH2-CH2-, -CH=CH-(цис и транс),
-COCH2, -CH(OH)-CH2 и -CH2SO-, с помощью способов, известных в данной области, и кроме того описанных в следующих ссылках: Spatola, A.F. в "Chemistry and Biochemistry of Amino Acids, Peptider, and Proteins", B. Weinstein, eds. , Marcel Dekker, New York, стр. 267 (1983); Spatola, A.F. Vega Data (March 1983), vol.1, Issue 3, "Peptide Backbone Modifications" (общий обзор); Morley, J.S., Trends Pharm. Sci (1980) стр. 463-468 (общий обзор); Hudson, D. и др., Int. J. Pept.Prot Res. (1979) 14:177 - 185 (-CH2NH-, CH2-CH2-); Spatola, A.F. и др., Life Sci. (1986) 38:1243 - 1249 (-CH2-S); Hann, M. M., J. Chem. Soc. Perkin Trans I (1982) 307-314 (-CH-CH-, цис и транс); Almquist, R,G и др., J. Med. Chem. (1980) 23:1392 - 1398 (-COCH2-); Iennings -Wtite, C. и др., Tetrahedron Lett. (1982) 23:2533 (-COCH2); Szelke, М. и др. , European Appln. ЕР 45665 (1982) CA: 97:39405 (1982) (-CH(OH)-CH2-); Holladay, M.W. и др., Tetrahedron Lett. (1983) 25: 4401 - 4404 (-C(ОН)CH2-); и Hruby, V.J., Life Sci. (1982) 31:189 - 199 (-CH2-S-); каждый из этих источников включен в настоящий документ в качестве ссылки. Особенно предпочтительной непептидной связью является - CH2NH-. Такие пептидомиметики могут иметь значительные преимущества перед полипептидами, включающими, например, более экономичное производство, большую химическую стабильность, усиленные фармакологические свойства (полупериод жизни, адсорбцию, мощность, эффективность и т. д. ), измененную специфичность (например, широкий спектр биологического действия), уменьшенная антигенность и другие. Липидизирование пептидомиметиков обычно включает ковалентное присоединение одной или более ацильных цепей непосредственно или через спейсер (например, амидогруппу), к неинтерферирующим позициям пептидомиметика, которые предсказаны количественными данными структуры-активности и/или молекулярным моделированием. Такие неинтерферирующие позиции, в целом, являются позициями, которые не образуют прямых контактов с макромолекулой (например, рецептором), с которой пептидомиметик связывается, производя таким образом терапевтический эффект. Липидизирование пептидомиметиков не должно существенно мешать желаемому биологическому или фармакологическому действию пептидомиметика.
Настоящее изобретение относится также к лекарственным и диагностическим композициям липидизированных белков, которые могут преодолевать сосудистые мембраны и проникать во внутриклеточные компартменты, в частности, липидизированных антител, которые присоединяются к внутриклеточным иммунотерапевтическим мишеням, таким как кодируемые вирусным геном продукты, являющиеся главными компонентами жизненного цикла вируса (например, ВИЧ-1 Tat белок), к внутриклеточным антигенам, которые активны биологически (например, онкогенный белок, такой как c-fos, c-src, c-myc, c-lck (p 56), c-fyn (p 59) и c-abl), и/или к трансмембранным или внеклеточным антигенам (например, рецепторы гормонов полипептидной природы, такие как 1-2 рецептор; рецептор фактора роста, полученного из тромбоцитов; рецептор фактора роста эпидермиса; рецептор фактора роста нервной ткани, рецептор фактора роста или TNF рецептор).
Другие белки, на которые можно нацеливать липидизированные антитела, включают, но не исчерпываются следующим списком: с-rasp21, с-her-2 белок, с- raf, любые из разных G белков и/или белки, активирующие G белки (GАБ), факторы транскрипции, такие как NF-AT, кальцинейрин, цис-транс пролилизомеразы. Липидизированные антитела можно применять, чтобы поместить диагностический реагент, такой как рентгеноконтрастное вещество, компонент магнитного резонанса, дающий изображение, в специфический участок тела, такой как специфический орган, ткань, участок тела, тип клеток, неоплазма или другие анатомические структуры (например, патологическое поражение). Липидизированные антитела также можно применять, чтобы поместить связанные с ними лекарственные агенты, такие как химиотерапевтические препараты, радиосенсибилизирующие агенты, радионуклиды, антибиотики и другие агенты, в специфические участки тела. И наоборот, липидизированные антитела настоящего изобретения могут быть использованы в терапии для нейтрализации (т.е. для связывания и, таким образом, инактивации) внутриклеточного антигена-мишени, такого как ВИЧ-1 Tat белок, трансмембранный или связанный с мембраной антиген-мишень (например, γ-глутамилтранспептидаза, c-rasH p21, rasGAP), или внеклеточный антиген-мишень (например, отложения β-амилоидного белка в мозгу при болезни Альцгеймера). Липидизированные антитела могут пересекать гематоэнцефалический барьер и реагировать с внеклеточным антигеном-мишенью, который обычно недоступен для действия иммуноглобулинов, циркулирующих в крови или лимфатической системе. Липидизированные антитела также могут реагировать с внутриклеточной частью трансмембранных белков, такими как цитоплазматический конец гликопротеинов вирусной оболочки или домены протеинкиназы протоонкогенных белков (с-srс, c-abl), и, таким образом, ингибировать продукцию инфективного вируса в оболочке или активность киназы соответственно.
Краткое описание чертежей
Фиг. 1 показывает структурные формулы, представляющие различные липоамины, которые можно использовать в настоящем изобретении. Правая колонка приводит примеры липоаминов с разветвленной цепью, левая колонка приводит примеры липоаминов с прямой цепью.
Фиг. 2 схематически представляет (1) гликозилированное антитело, включающее тетрамер иммуноглобулина (две легкие цепи, соединенные с двумя тяжелыми цепями) и (2) липидизированные через углевод иммуноглобулины настоящего изобретения. В качестве примера показаны липоамидные заместители с разветвленной цепью, присоединенные к частично окисленным углеводным боковым цепям тетрамера иммуноглобулина. Такие углеводные боковые цепи могут быть расположены в участках CH, VH, CZ и/или VZ.
Фиг. 3 показывает благоприятное воздействие липидизированного анти-Tat иммуноглобулина на выживание in vitro клеток, зараженных ВИЧ-1, по сравнению с отсутствием эффекта у нативного (т.е. нелипидизированного) анти-Tat иммуноглобулина. Фиг. 4 показывает, что липидизированные антитела анти-Tat значительно ингибировали активность хлорамфеникол- ацетилтрансферазы (приблизительно на 75%), в то время как нативные (нелипидизированные) анти-Tat антитела, липидизированные анти-гп 120 антитела или rs CD4 были значительно менее эффективными в ингибировании активности этого фермента в клетках HZCD4-ХАТ.
Подробное описание
Определения
Все технические и научные термины, применяемые в настоящем документе, имеют общепринятый смысл, если не было дано иного определения, и будут легко поняты специалистами в данной области, для которых предназначено настоящее изобретение. Несмотря на то, что любые способы и материалы, подобные или эквивалентные описанным в настоящем документе, могут применяться в практике или испытаниях настоящего изобретения, описываются предпочтительные материалы и методы. Ниже приводятся определения терминов настоящего изобретения.
В том виде, в котором они используются здесь, названия аминокислот и их аббревиатуры являются общепринятыми (Immunology-A Synthesis, 2-е издание, E. S. Golub и D.R. Gren, Eds., Sinauer Associates, Sunderland, Massachusetts (1991), включены в настоящий документ в качестве ссылки).
Термин "соответствует" означает, что полинуклеотидная последовательность является гомологичной (т. е. является идентичной, но не строго эволюционно родственной) всей или части полинуклеотидной последовательности, на которую ссылаются, или что полинуклеотидная последовательность является идентичной полипептидной последовательности, на которую ссылаются. В отличие от этого, термин "является комплементарной" означает, что комплементарная последовательность является гомологичной всей или части полинуклеотидной последовательности, на которую ссылаются. Для иллюстрации нуклеотидная последовательность "ТАТАЦ" соответствует последовательности "ТАТАЦ", на которую ссылаются, и является комплементарной последовательности "ГТАТА".
Термины "значительное сходство" или "значительная идентичность", как они применяются в настоящем документе, означают характеристику полипептидной последовательности или последовательности в нуклеиновой кислоте, при которой полипептидная последовательность имеет по крайней мере 59% идентичной последовательности с последовательностью, на которую ссылаются, а последовательность в нуклеиновой кислоте имеет по крайней мере 70% последовательности, идентичной той, на которую ссылаются. Процент идентичности вычисляется, исключая малые делеции или добавки, которые в сумме составляют менее 25% последовательности, на которую ссылаются. Последовательность, на которую ссылаются, может быть частью большей последовательности, такой как константная область домена константной области гена иммуноглобулина; однако последовательность, на которую ссылаются, по крайней мере на 18 нуклеотидов длиннее в случае полинуклеотидов, и по крайней мере на 6 аминокислотных остатков длиннее в случае полипептидов.
Термин "естественно встречающийся" применяется здесь к объекту, который может быть обнаружен в природе. Например, полипептидная или полинуклеотидная последовательность, присутствующая в организме (включая вирусы), которая может быть выделена из природного источника и которая не была намеренно модифицирована человеком в лаборатории, является естественно встречающейся. Липопротеин (например, естественно встречающийся белок, содержащий изопрен или миристимовую кислоту), который может быть выделен из организма, встречающегося в природе, а не был изготовлен человеком, является естественно встречающимся липопротеином.
"Участки гликозилирования" относятся к аминокислотным остаткам, которые распознаются эукариотической клеткой в качестве участков присоединения остатков сахаров. Аминокислотами, к которым углевод, такой как олигосахарид, обычно присоединяется, являются остатки аспарагина (N-связь), серина (O-связь) и треонина (O-связь). Аминокислотная последовательность, которая обычно является сигналом специфического сайта присоединения, обозначается здесь как "последовательность участка гликозилирования". Последовательность участка гликозилирования для гликозилирования N-связью - Aсн-X-Cур или - Aсн-X-Tре, где X может быть любой из обычных аминокислот, кроме пролина. Предоминантная последовательность участка гликозилирования для гликозилирования O-связью - (тре или сер)-X-X-про, где X - любая из обычных аминокислот. Последовательность узнавания для гликозаминогликанов (специфического типа сульфатированного сахара) - -сер- гли-X-гли-, где Х является любой обычной аминокислотой. Термины "N-связь" и "О-связь" относятся к химическим группам, которые служат участками присоединения между молекулой сахара и аминокислотным остатком. N-связанные сахара присоединяются через аминогруппу; O-связанные сахара присоединяются через гидроксильную группу.
Однако не все последовательности участка гликозилирования белка обязательно гликозилированы; некоторые белки секретируются как в гликозилированной, так и в негликозилированной формах, в то время как другие полностью гликозилированы по одной последовательности участка гликозилирования, но имеют другую последовательность участка гликозилирования, которая не гликозилирована. Следовательно, не все последовательности участков гликозилирования, которые присутствуют в полипептиде, являются обязательно участками гликозилирования, к которым действительно присоединены остатки сахаров. Начальное N-гликозилирование во время биосинтеза включает "стержневой углевод" или "стержневой олигосахарид" (Proteins, Structures and Molecular Principles, (1984) Creighton (ed.), W.H. Freeman and Company, New York, включенный здесь в качестве ссылки).
Применяемый здесь термин "гликозилирующая клетка" обозначает клетку, способную гликозилировать белки, в частности эукариотическую клетку, способную прибавлять N-связанный "стержневой олигосахарид", содержащий, по крайней мере, один остаток маннозы и/или способную прибавлять О-связанный сахар к, по крайней мере, одному участку гликозилирования, по крайней мере, одного полипептида, экспрессируемого названной клеткой, в частности, секретируемого белка. Так, гликозилирующая клетка обладает, по крайней мере, одной ферментативной активностью, которая катализирует присоединение остатка сахара к последовательности гликозилирующего участка белка или полипептида, и эта клетка действительно гликозилирует, по крайней мере один экспрессируемый полипептид. Для примера, но не ограничения, клетки млекопитающих являются типичными гликозилирующими клетками. Другие эукаристические клетки, такие как клетки насекомых или дрожжи, могут быть гликозилирующими клетками.
Применяемый здесь термин "антитело" относится к белку, состоящему из одного или более полипептидов, главным образом кодируемых генами надсемейства иммуноглобулинов (например, см. The Immunoglobulin Gene Superfamily, A. F. Williams and A.N. Barclay, в Immunoglobulin Genes, T. Honjo, F.W. Alt, и T. H. Rabbitts, eds. , (1989) Academic Press: San Diego, CA, стр. 361-387, которая включена здесь в качестве ссылки). Для примера, но не ограничения, антитело может включать часть или целую тяжелую цепь, часть или всю легкую цепь, или может включать только часть или целую тяжелую цепь. Ген узнавания иммуноглобулина включает каппа-, лямбда-, альфа-, гaммa(IgG1, IgG2, IgG3, IgG4), дельта-, эпсилон- и мю-гены константной области, а также бесчисленные гены вариабельных областей иммуноглобулина. "Легкие цепи" иммуноглобулинов (около 25 кДа или 214 аминокислот) кодируются вариабельным участком гена NH2-конца (около 110 аминокислот), а каппа- или лямбда константные области генов на COOH-конце. "Тяжелые цепи" иммуноглобулинов (около 50 кДа или 446 аминокислот) также кодируются вариабельной областью гена (около 116 аминокислот) и одной из ранее упомянутых констант областей гена, например гамма (кодирует около 330 аминокислот). Антитела включают, но не исчерпываются следующим перечнем: фрагменты иммуноглобулинов (например, Fab, F(ab)2, Fv), иммуноглобулины, состоящие из одной цепи, химерные иммуноглобулины, гуманизированные иммуноглобулины, приматизированные иммуноглобулины и различные комбинации легкая цепь-тяжелая цепь. Антитела могут вырабатываться в гликозилирующих клетках (например, в лимфоцитах человека, клетках гибридомы, дрожжевых клетках и т.д.), в негликозилирующих клетках (например, Е. coli) или синтезироваться химическими способами или производиться системами трансляции in vitro с использованием полинуклеотидной матрицы для прямой трансляции.
Применяемый здесь термин "липидизированное антитело" означает антитело, модифицированное таким образом, что получается липидное производное (например, ковалентное присоединение липоамина, такого как глицилдиоктадециламид, дилауроилфосфатидилэтаноламин или диоктадециламидоглицилспермидин) по одной или более углеводной доле, соединенной с иммуноглобулином в участке гликозилирования. В основном, липидный заместитель, такой как липоамин, ковалентно соединен через естественно встречающуюся углеводную часть в естественно встречающемся участке гликозилирования. Однако возможно получить иммуноглобулины с измененной последовательностью участка гликозилирования (в типичном случае, путем сайт-направленного мутагенеза полинуклеотидов, кодирующих цепи иммуноглобулина) и/или измененным характером гликозилирования (например, путем экспрессии кодирующих иммуноглобулин полинуклеотидов в гликозилирующих клетках, иных чем лимфоциты или в лимфоцитах других видов). Липидные заместители могут быть присоединены к одной или более естественно встречающейся или не естественно встречающейся углеводной части цепи иммуноглобулина. В случае, когда антитело производится путем прямого полипептидного синтеза или путем биосинтеза в негликозилирующих клетках (например, демонстрационной библиотеки фагов), в основном необходимо присоединение углеводного заместителя путем химической или энзимной модификации для последующего липидизирования (напротив, углевод можно липидизировать до присоединения к иммуноглобулину).
Применяемый здесь термин "липидизированный белок" относится к белку (включая мультимерные белки, гликопротеины и полипептиды различной длины), который был модифицирован путем присоединения липида (например, липоамина), в основном, через углеводную часть. Липидизированный белок приготовляется путем получения такого производного белка, в результате которого липидизированный белок отличается от естественно встречающихся связанных с липидами белков и липопротеинов. Для белков, обладающих биологической активностью (например, ферментов, рецепторов, факторов транскрипции), липидизирование не должно существенно уменьшать биологическую активность (например, по крайней мере 15% нативной биологической активности должны быть сохранены в липидизированном белке). Липидизированные пептидомиметики должны сохранять, по крайней мере, от 25 до 95% фармакологической активности соответствующего нелипидизированного пептидомиметика.
"Алкил" относится к полностью насыщенной алифатической группе, которая может быть прямой, разветвленной или циклической. Алкильные группы включают группы, примерами которых могут быть: метил, этил, циклопропил, циклопропилметил, sec-бутил, гептил и додецил. Все вышеперечисленные группы могут быть как незамещенными, так и замещенными неинтерферирующими заместителями, например галогеном; C1-C4 алкокси; C1-C4 ацилокси; формил; алкилендиокси; бензилокси; фенил или бензил, каждый из которых факультативно замещен от 1 до 3 заместителями, выбранными из галогена, C1-C4 алкокси или C1-C4 ацилокси. Термин "неинтерферирующий" характеризует заместители как не оказывающие вредного влияния на любые реакции, которые будут выполняться в соответствии с процедурой настоящего изобретения. Если в данной молекуле присутствует более одной алкильной группы, каждую из них можно независимо выбирать из группы "алкил", если не оговорено иное.
"Алкилен" относится к полностью насыщенному двухвалентному радикалу, содержащему только углерод и водород, и который может быть разветвленным или с прямой цепью. Этот термин в дальнейшем иллюстрируется такими примерами, как метилен, этилен, n-пропилен, t-бутилен, i-пентилен, n-гептилен и им подобными. Все перечисленные выше радикалы могут быть незамещенными или замещенными одним или более неинтерферирующими заместителями, например галогеном; C1-C4 алкокси; C1-C4 ацилокси; формил; алкилендиокси; бензилокси; фенил или бензил, каждый из которых факультативно замещен от 1 до 3 заместителями, выбранными из следующей группы: галоген, C1-C4 алкокси или C1-C4 ацилокси. Термин "неинтерферирующий" характеризует заместители, как не оказывающие неблагоприятного влияния на любые реакции, которые должны быть выполнены в соответствии с процедурой настоящего изобретения. Если в данной молекуле присутствует более одной алкиленовой группы, каждая из них может независимо избираться из группы "алкилены", если не оговорено иное.
"Арил", обозначаемый Ar, включает моноциклические или конденсированные карбоциклические ароматические группы из 6-20 атомов углерода. Арильные группы включают приведенные здесь в качестве примера фенил и нафтил. Эти группы могут быть замещены одним или более неинтерферирующими заместителями, например, выбранными из следующей группы: низший алкил, низший алкенил, низший алкинил, низший алкокси, низший алкилтио, низший алкилсульфинил, низший алкилсульфонил, диалкиламин, галоген, гидрокси, фенил, фенилокси, бензил, бензоил и нитро. Каждый заместитель может быть факультативно замещен добавочными неинтерферирующими заместителями.
"Амино" относится к группе -NH2.
"Алкилкарбонил" относится к группе -(CHR1)-CO-, в которой R1 является дополнительно обозначенной α-позицией. R1 может быть водородом, алкилом или аминогруппой. Предпочтительно R1 является аминогруппой.
Описание предпочтительных вариантов осуществления изобретения
В соответствии с настоящим изобретением созданы новые способы для облегчения химически модифицированным белкам, таким как антитела, прохождения через капиллярные барьеры и внутрь клеток. В целом, способы включают ковалентное присоединение по крайней мере одного неинтерферирующего липидного заместителя (например, глицилдиоктадециламида, глицилдигептадециламида, глицилдигексадециламида, дилауроилфосфатидилэтаноламина и глицилдиоктадекадиеноиламида) к реактивному участку молекулы белка (например, к окисленной периодатом углеводной части). Различные неинтерферирующие липидные заместители могут быть присоединены к белкам для получения липидизированных белков, таких как липидизированные антитела настоящего изобретения. Для примера, но не для ограничения, можно привести примеры липидов, которые можно присоединять к белкам, представляющим интерес, для получения липидизированного белка: липоамины, липополиамины, жирные кислоты (например, стеариновая кислота, олеиновая кислота и другие). В общих чертах, липид должен быть присоединен ковалентной связью к углеводу, связанному с белком (например, к углеводной боковой цепи гликопротеина). Предпочтительно использовать естественно встречающиеся углеводные боковые цепи для присоединения липоамина, хотя могут быть созданы и новые участки гликозилирования в полипептиде посредством манипуляций генетического характера с кодирующим полинуклеотидом и экспрессии кодирующего полинуклеотида в гликозилирующей клетке для получения гликозилированного полипептида.
Гликозилированные белки можно липидизировать для усиления его транссосудистого транспорта, поглощения органом и внутриклеточного проникновения, включая проникновение внутрь ядра клетки. В целом, гликозилированный полипептид, такой как антитело, окисляют посредством химического окислителя (например, периодата) для получения дополнительных карбоксильных и/или альдегидных групп, и он реагирует с липоамином для формирования ковалентной (амидной или имидной, соответственно) связи липоамина и белка.
В типичном случае, окисление углеводной боковой цепи является частичным окислением, в результате которого образуется по крайней мере одна реактивная карбоксильная или альдегидная группа, хотя, в основном, методы химического окисления производят некоторое количество молекул, которые окислены частично, и некоторое количество молекул, которые не окислены или окислены полностью. Однако, чтобы быть липидизированным реакцией с липоамином, белку необходимо быть окисленным для получения по крайней мере одной дополнительной альдегидной группы, которая может прореагировать с липоамином, несмотря на то, что возможно получить липидизированные белки путем связи также с дополнительными карбоксильными группами. Дополнительная карбоксильная или альдегидная группа окисленного гликопротеина является карбоксильной или альдегидной группой с карбонильным углеродом, полученным от окисленного олигосахарида, и который ковалентно связан с белком, как непосредственно, так и через вставку (например, неокисленную часть N- или O-связанного углеводной боковой цепи). Предпочтительно, N-связанные или O- связанные углеводные цепи должны быть окислены неполностью, чтобы получить множество реактивных альдегидных и карбоксильных групп в каждой позиции гликозилирования для дальнейшей реакции с липоаминами. Чаще гликопротеины, имеющие один или более сложных N-связанных олигосахаридов, имеющие, например, разветвленный (манноза)3 (β-N-ацетилглюкозамино) стержень, частично окисляют ограниченной реакцией с подходящим оксидантом, в основном, периодатом. Связанные олигосахариды, содержащие N-ацетилглюкозамин (NAG), маннозу, галактозу, фукозу (6-дезоксигалактозу), N-ацетилнейраминовую кислоту (сиаловую кислоту), глюкозу, N-ацетилмурамовую кислоту, N-ацетилгалактозамин, ксилозу, или комбинации этих моносахаридов, могут быть окислены и реагируют с липоаминами для получения липидизированных белков, в частности липидизированных через углевод. Гликопротеины, содержащие олигосахариды из моносахаридных единиц, иных, чем перечисленные выше в качестве примеров, включая не встречающиеся в природе моносахариды, также могут быть окислены и ковалентно присоединены к липоамину для получения липидизированного белка.
Липоамины являются молекулами, имеющими, по крайней мере, одну ацильную группу и, по крайней мере, один свободный амин (т.е. первичный или вторичный амин). Предполагается, что в практике настоящего изобретения можно использовать также липоамины, которые имеют третичные амины, обладающие, по крайней мере, одним заместителем, который может быть заменен реакцией с окисленным углеводом. Примеры липоаминов, обладающих первичным амином, приведены на фиг. 1. Например, способ настоящего изобретения позволяет получать липидизированные белки посредством реакции гликопротеина с липоамином, обладающим прямой цепью, следующей формулы:
NH2-R-(CH2)n-CH3,
где R - двузамещенный алкил (алкилен), предпочтительно, метилен (-CH2-); 1,4-двузамещенный циклогексил; двузамещенный арил (арилен), предпочтительно 1,4-двузамещенный фенил (фенилен); амидогруппа формулы -(CHR1)-CO-NH-, где R1 является водородом или аминогруппой; алкилкарбонил, предпочтительно α-аминозамещенный алкилкарбонил; или фосфат диэфир, предпочтительно формулы -CH2-O-PO2-O-. n - целое число, обычно от 1 до 50, предпочтительно от 5 до 30, наиболее предпочтительно - от 0 до 25, чаще от 15 до 20. В целом, выбор осуществляется на усмотрение практика, которому необходимо руководствоваться следующим соображением: если молекула, которую необходимо липидизировать, велика (т. е. белок более 10 кДа), предпочтительно, чтобы было по меньшей мере 8-12 или более, для увеличения гидрофобности получающегося липидизированного белка; если молекула, которую необходимо липидизировать, мала (например, олигопептид), в типичном случае будет от 2 до 18, но может быть и больше, если желательна дополнительная гидрофобность липидизированной молекулы.
В практике настоящего изобретения можно применять также липоамины с разветвленной цепью, которые включают, например, липоамины следующей формулы: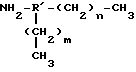
где R' - трехзамещенный алкил, предпочтительно - CH2CH< или 1,2,4-трехзамещенный циклогексил; трехзамещенный арил, предпочтительно 1, 2, 4-трехзамещенный фенил; амидогруппа формулы -(CHR1)-CO- N<, где R1 является водородом или аминогруппой; иминогруппа формулы -CHR2-NH-CH<, где R2 является водородом или аминогруппой, или иминогруппа формулы -CH2-N<; или фосфат диэфир, предпочтительно формулы -CH2-CH2-O-PO2-O-CH2-CH(CO2-)2, m и n независимо избираются и являются целыми числами, обычно от 1 до 50, предпочтительно от 5 до 30, более предпочтительно от 10 до 25, чаще от 15 до 20. В общих чертах, выбирается на усмотрение практика, который руководствуется следующими соображениями: если молекула, которую необходимо липидизировать, велика (т.е. белок более 10 кДа), предпочтительно, чтобы и/или были по меньшей мере 8-12 и более, для увеличения гидрофобности получающегося липидизированного белка; если молекула, которую необходимо липидизировать, мала (например, олигопептид), обычно составляет от 2 до 18, но может быть и больше, если желательна добавочная гидрофобность липидизированной молекулы.
По существу, любой гликопротеин можно липидизировать по способу настоящего изобретения посредством реакции между липоамином и окисленной углеводной боковой цепью. Фиг. 2 схематически изображает гликозилированное антитело и липидизированное через углерод антитело настоящего изобретения, соответственно. Негликозилированные белки можно конъюгировать с липидами посредством подходящего поперечно связывающего агента (например, посредством карбодиимидной связи).
В соответствии с настоящим изобретением, созданы новые липидизированные антитела, способные специфично связываться с предопределенными внутриклеточными эпитопами с сильным сродством. Эти антитела без труда проникают во внутриклеточный компартмент и обладают связующим сродством по крайней мере около 1 • 106 M-1 предпочтительно 1 • 107 M-1 до 1 • 108 M-1 более предпочтительно по меньшей мере 1 • 109 M-1 или более. В типичном случае липидизированные антитела имеют липидные заместитель, присоединенный к естественно встречающейся углеводной боковой цепи исходной цепи иммуноглобулина, что составляет антитело, специфично реагирующее с внутриклеточным, трансмембранным или внеклеточным эпитопом. Поскольку углеводы расположены в Fc части иммуноглобулинов, маловероятно, чтобы химическая модификация углеводных остатков путем липидизирования приводила к существенной утрате сродства антител к их антигенам (Rodwell и др., (1986) Proc. Natl. Acad. Sci. (U.S.A) 83:2632). Липидизированные антитела в целом сохраняют существенное сродство к своим антигенам, а их авидность можно без труда измерить с помощью известных анализов связывания антиген-антитело. Эти антитела можно достаточно экономично производить в больших количествах и использовать, например, для лечения различных заболеваний человека с помощью разнообразных методик.
Основную структурную единицу антитела составляет определенная форма иммуноглобулина. Эта форма - тетрамер и состоит из двух идентичных пар цепей иммуноглобулина, каждая пара имеет одну легкую и одну тяжелую цепь. В каждой паре различные участки легкой и тяжелой цепей совместно ответственны за связывание антигена, и константные области являются ответственными за эффекторные функции антител. Дополнительно к антителам, иммуноглобулины могут существовать во множестве разнообразных форм, например Fv, Fab и (Fab')2, а также в форме бифункциональных гибридных антител, слитых белков и в других формах (например, Lanzavecchia и др., Eur. J. Immunol. 17, 105 (1987)) и в виде одиночных цепей (например, Huston и др., Proc. Natl. Acad. Sci. U.S.A., 85, 5879-5883 (1988) и Bird и др., Science, 242, 423-426 (1988)). (Cм. Hood. и др., "Immunology", Benjamin, N.Y., 2-е изд. (1984) и Hunkapiller and Hood, Nature, 323, 15-16 (1986)).
Антитела могут вырабатываться в гликозилирующих клетках (например, лимфоцитах человека, клетках гибридомы, дрожжах и т.д.), в негликозилирующих клетках (например, Е. coli), или синтезироваться химическими способами или вырабатываться vi vitro трансляционными системами с применением полинуклеотидной матрицы для прямой трансляции. Одним из источников гибридомных клеточных линий и кодирующих иммуноглобулины полинуклеотидов является Американская коллекция тканевых культур (АТСС), Rockville, MD. Способы экспрессии ксеногенных белков в рекомбинантных хозяевах, химического синтеза полипептидов и трансляции in vitro хорошо известны специалистам в данной области и описаны далее в Maniatis и др. , Molecular Cloning: A Laboratory Manual (1989), 2-е издание. Cold Spring Harbor, N.Y; Berger and Kimmel, Methods in Enzymology, Volume 152, Guide to Molecular Cloning Techniques (1987), Academic Press, Inc., San Diego, CA; Merrifield, J. (1969) J. Am. Chem. Soc. 91: 501; Chaiker J. M. (1981) CRC Crit. Rev. Biochem. 11: 255; Kaiser и др., (1989) Science 243:187; Merrifield, В. (1986) Science 232:342; Kent, S.B.H. (1988) Ann. Rev. Biochem. 57:957; и Offord, R.E. (1980) Semisynthetic Proteins, Wiley Publishing, которые включены в настоящий документ в качестве ссылки). Антитела, которые вырабатывают в негликозилирующих клетках, могут быть присоединены к липиду посредством бифункционального поперечносвязывающего агента или, предпочтительно, посттрансляционно гликозилированы в гликозилирующей системе, такой как очищенные микросомы поджелудочной железы собаки (Mueckler and Lodish (1986) Cell 44: 629 и Walter, P. (1983) Meth. Enzymol. 96: 84, которые включены в настоящий документ в качестве ссылки). В другом варианте полинуклеотиды, кодирующие антитела, могут быть выделены путем скрининга из библиотек экспрессии прокариотических клеток, таких как библиотеки фрагментов антител и впоследствии экспрессироваться в гликозилирующих клетках для выработки гликозилированных антител. В соответствии с этими способами могут быть получены гликозилированные антитела, обладающие естественно встречающимся или неестественно встречающимся характером гликозилирования. Такие гликозилированные антитела можно липидизировать в соответствии со способами настоящего изобретения.
Показано, что гликозилирование иммуноглобулинов значительно воздействует на их эффекторные функции, структурную стабильность и скорость секреции из антител продуцирующих клеток (Leatherbarrow и др. , Md. Immunol. 22:507 (1985)). Углеводные группы, ответственные за эти свойства, в основном, присоединены к константным (C) областям антител. Например, требуется гликозилирование IgG по аспарагину 297 в домене CH2 для достижения полной мощности IgG в отношении активации классического комплемент-зависимого цитолиза (Taoо and Morrison, J. Immunol. 143:2595 (1989)). Гликозилирование lgM по аспарагину 402 в домене CH3 необходимо для получения должной упорядоченной структуры и цитолитической активности антитела (Muraoka and Shulman, J. Immunol. 142: 695 (1989)). Удаление участков гликозилирования по позициям 162 и 419 в доменах CH1 и CH3 IgA антитела приводит к внутриклеточной деградации и по крайней мере 90% подавления секреции (Taylor and Wall, Mol. Cell. Biol. 8: 4197 (1988)).
Также было рассмотрено гликозилирование иммуноглобулинов в вариабельной области (V). Sox and Hood. Proc. Natl. Acad. Sci. U. S. A.66: 975 (1970) сообщают, что около 20% антител человека гликозилированы по области. Предполагают, что гликозилирование по домену происходит вследствие случайной встречаемости сигнала N-связанного гликозилирования асн-Хаа-сер-тре в последовательности области и не играет существенной роли для функции иммуноглобулинов.
Таким образом, в основном, предпочтительно, чтобы липидизированию подвергались антитела с естественным характером гликозилирования. Если участки гликозилирования встроены в антитело, предпочтительно, чтобы новый участок гликозилирования был внедрен в константную область или в вариабельную область каркасного участка, которые с меньшей вероятностью оказывают неблагоприятное воздействие на антигенсвязывающую активность антитела. В целом, самым предпочтительным вариантом является встраивание новых участков гликозилирования в антитело в константной области.
В другом варианте полипептидные фрагменты, содержащие только часть первичной структуры антитела и углеводную боковую цепь, которую можно преобразовать с помощью липидного заместителя, могут быть получены, причем эти фрагменты будут обладать одной или более активностью иммуноглобулина (например, антиген-связывающей активностью). Эти полипептидные фрагменты можно произвести посредством протеолитического расщепления интактных антител способами, хорошо известными специалистам, или посредством сайт-направленного мутагенеза в желательных участках экспрессирующих векторов, содержащих последовательности, кодирующие иммуноглобулиновые белки, например, после CH1 для получения Fab фрагментов или после шарнирной области для получения (Fab')2 фрагментов. Антитела с одной цепью можно получить соединением VZ и VH ДНК линкером (см. Hustor и др., цит. Bird и др., цит.). Так же, поскольку, как и множество других генов, гены, связанные с кодированием иммуноглобулинов, содержат отдельные функциональные участки, каждый из которых обладает одной или более различающихся биологических активностей, гены могут быть слиты по функциональным участкам с другими генами, имеющими новые свойства. Полинуклеотидные последовательности для выработки иммуноглобулинов настоящего изобретения способны, в конечном счете, экспрессировать желаемые антитела и могут быть сформированы из множества различных полинуклеотидов (геномные, кДНК, РНК, синтетические олигонуклеотиды и т.д.) и компонентов (например, V, J, D и C участки), а также с применением множества различных методик. Соединение подходящих синтетических и геномных последовательностей в настоящее время является наиболее распространенным способом, однако могут применяться также последовательности кДНК (см. European Patent Publication 0239400 и L. Reichmann и др., Nature, 332,323-327 (1988)).
Иммуноглобулины и/или последовательности ДНК, кодирующие иммуноглобулиновые цепи, могут быть получены, например, посредством гибридомных клонов, которые можно получить с помощью методик, хорошо известных специалистам (Kohler and Milstein (1976) Eur. J. Immunol. 6: 511, включенные в настоящий документ в качестве ссылки), или могут быть получены из различных источников ("ATCC Catalog of Cell Lines and Hybridomas", ATCC, Rockville, MD, включенные в настоящий документ в качестве ссылки). Последовательности ДНК, кодирующие иммуноглобулиновые цепи, могут быть получены стандартными методиками клонирования, хорошо известными специалистам и описанными в различных публикациях, например Maniatis и др., Molecular Cloning: A Laboratory Manual, 2-е изд. , (1989), Cold Spring Harbor, N.J. и Berger and Kimmel, Methods in Enzymology, Volume 152, Guide to Molecular Cloning Techniques (1987), Academic Press, Inc. , San Diego, CA, которые включены в настоящий документ в качестве ссылки.
Как сказано выше, последовательности ДНК будут экспрессированы в хозяевах, в типичном случае, в гликозилирующих клетках, после того, как они будут присоединены к последовательности контроля экспрессии. Эти экспрессирующие векторы обычно реплицируются в организме-хозяине как в качестве эписом, так и в качестве целой части хромосомной ДНК хозяина. В общем случае, экспрессирующие векторы будут содержать маркеры селекции, например, устойчивость к тетрациклину или устойчивость к G418, чтобы сделать возможным обнаружение тех клеток, которые будут трансформированы желаемыми последовательностями ДНК (см., например, U.S. Patent 4,704,362).
E.coli является одним из прокариотических хозяев, подходящих, в частности, для клонирования последовательностей ДНК настоящего изобретения. Другие микроорганизмы-хозяева, подходящие для этих целей, включают бациллы, такие как Bacillus Subtilis, и другие Enterobacteriaceae, такие как Salmonella, Serratia и различные виды Pseudomonas. В этих прокариотических хозяевах также можно создать экспрессирующие векторы, которые будут содержать последовательности контроля экспрессии, совместимые с клеткой-хозяином (например, репликатор). В добавление, там будет присутствовать и множество хорошо известных промоторов, таких как лактозная промоторная система, триптофановая промоторная система, β-галактозидазная промоторная система или промоторная система из фага лямбда. Промоторы будут контролировать экспрессию факультативно с помощью последовательности оператора и будут содержать последовательности участка связывания рибосомы и им подобные, для инициации и полного завершения транскрипции и трансляции. Белки, такие как антитела, которые экспрессируются негликозилирующими клетками, можно посттрансляционно гликозилировать в гликозилирующей системе (Mueckler and Lodish, цит.).
Другие микроорганизмы, такие как дрожжи, также можно использовать для экспрессии. Saccharomycer является предпочтительной гликозилирующей клеткой-хозяином при наличии подходящих векторов, имеющих последовательности контроля экспрессии, такие как промоторы, включающих 3-фосфоглицераткиназу или другие гликолитические ферменты, репликатор, терминальную последовательность и другие, если это желательно.
Помимо микроорганизмов, клетки культур тканей млекопитающих также можно использовать для экспрессии и выработки полипептидов настоящего изобретения (см. Winnacker, "From Genes to Clones", VCH Publishers, N.Y., N.Y. (1987)).
Эукариотические клетки вообще являются более предпочтительными, поскольку создано множество подходящих линий клеток-хозяев, способных секретировать интактные иммуноглобулины, и включают CHO клеточные линии, различные COS клеточные линии, клетки HeLa, предпочтительно, миелоидные клеточные линии и т. д. и транфсформированные B-клетки или гибридомы. Экспрессирующие векторы для этих клеток могут включать последовательности контроля экспрессии, такие как репликатор, промотор, усилитель (Gueen и др., Immunol. Rev., 89, 49-68 (1986)), и необходимые сайты процессинговой информации, такие как участки связывания рибосомы, участки сплайсинга PHK, сайты полиаденилирования и последовательности, терминирующие транскрипцию. Предпочтительными последовательностями контроля экспрессии являются промоторы, выделенные из генов иммуноглобулинов, SV40, аденовирусов, цитомегаловирусов, вируса бычьей папилломы и пр.
Векторы, содержащие сегменты ДНК, представляющие интерес (например, последовательности, кодирующие легкую и тяжелую цепи, и последовательности контроля экспрессии), могут быть внедрены в клетку-хозяин с помощью хорошо известных специалистам методик, которые варьируют в зависимости от типа клетки-хозяина. Например, для прокариотических клеток обычно используют трансфекцию посредством хлорида кальция, в то время как для других клеток-хозяев можно использовать обработку фосфатом кальция или электропорацию (см. Maniatis и др., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Press, (1982)).
Будучи экспрессированными, целые антитела, их димеры, отдельные легкие и тяжелые цепи или другие формы иммуноглобулинов настоящего изобретения, могут быть выделены в соответствии со стандартными процедурами, такими как преципитация сульфатом аммония, аффинные колонки, колоночная хроматография, электрофорез в геле и подобными (см. R.Scopes, "Protein Purification", Springer-Verlag, N. Y. (1982)). Предпочтительны существенно очищенные иммуноглобулины с гомогенностью по меньшей мере от 90 до 95%, для фармацевтических целей наиболее предпочтительна гомогенность 98-99% и более. Будучи очищены, частично или до полной гомогенности по желанию, полипептиды затем можно применять в терапевтических целях (включая экстракорпоральное применение) или для разработки и постановки аналитических процедур, иммунофлюоресцентного окрашивания и пр. (см. Immunological Methods, Vols. 1 и 11, Lefkovits and Pernis, eds. Academic Precc, New York, N.Y. (1979 и 1981).
В способах настоящего изобретения предпочтительно применяют интактные иммуноглобулины или их связывающие фрагменты. В типичном случае липидизированные антитела будут изотипами IgM или IgG человека, однако другие константные области млекопитающих могут применяться, если потребуется. Могут быть получены липидизированные антитела классов IgA, IgG, IgM, IgE и IgD. Предпочтительно, липидизированные антитела настоящего изобретения являются антителами человека, мыши, крупного рогатого скота, лошади, свиньи или приматов, наиболее предпочтительны антитела человека или мыши. Настоящее изобретение можно применять для получения липидизированных антител различных типов, включая, но не ограничиваясь следующим перечнем: химерные антитела, гуманизированные антитела, приматизированные антитела, Fv фрагменты, конъюгаты токсин-антитело, конъюгаты изотоп-антитело и конъюгаты томографический агент-антитело. Для томографии in vivo липидизированные антитела метят диагностической меткой, вводят пациенту и их локализацию определяют в различные периоды времени после введения. Различные способы мечения антител диагностическими препаратами (например, Tc99, другими радиолигандами, радиоконтрастными агентами, рентгенонепроницаемыми красителями) хорошо известны специалистам в данной области.
Белки и олигопептиды (т.е. полипептиды, включающие от 2 до 50 аминокислотных остатков, связанных посредством пептидной связи), иные нежели иммуноглобулины, можно липидизировать согласно способам настоящего изобретения. Естественно встречающиеся гликопротеины (например, γ-глутамилтранспептидаза, тромбомодулин, белки транспорта глюкозы) являются предпочтительными субстратами для липидизирования через углевод, хотя, по существу, любой полипептид можно липидизировать ковалентным присоединением через поперечно связывающий агент (например, N-гидроксисукцимид) к подходящей боковой аминокислотной цепи. В других вариантах осуществления изобретения, по крайней мере, один липидный заместитель (например, липоамин) ковалентно присоединен к неуглеводной части белка или полипептида (например, образованием амидной связи с остатком асп или глу карбоксильного заместителя боковой цепи или тиоэфирной связи с остатком цис). Также можно присоединить жирную кислоту к арг или лиз остаткам посредством аминных заместителей боковой цепи. Примерами негликозилированных белков, которые можно липидизировать для усиления трансваскулярного или внутриклеточного транспорта, являются, но не исчерпываются следующим перечнем: c-for, c-myc, c-src, NF-AT и HMG CoA редуктаза. Естественно встречающиеся липопротеины, такие как нативные белки, претерпевающие физиологическое фарнесилирование, геранилгеранилирование и пальмитилирование, являются натуральными продуктами и не называются в настоящем документе "липидизированными белками".
Липидизированные антитела и фармацевтические композиции на их основе являются, в частности, полезными для парентерального применения, т.е. подкожного, внутримышечного или внутривенного. Композиции для парентерального применения включают чаще всего раствор иммуноглобулина или коктейль из него, растворенный в приемлемом носителе, предпочтительно в водном. Можно использовать множество водных носителей, например воду, буферную воду, 0,4% раствор хлорида натрия, 0,3% глицин и пр. Эти растворы должны быть стерильными и свободными от твердых частиц. Эти композиции можно стерилизовать стандартными, хорошо известными способами стерилизации. Эти композиции могут содержать фармацевтически приемлемые добавочные вещества, если это требуется для приближения к физиологическим условиям, например подгонка pH и буферные агенты; агенты, снижающие токсичность и подобные, например ацетат натрия, хлорид натрия, хлорид калия, хлорид кальция, лактат натрия, альбумин человека и т.д. Концентрация антител в этих рецептурах может широко варьировать, т.е. от менее чем 0,5%, обычно по меньшей мере 1%, до 15-20% по весу и выбирается, основываясь на объеме жидкости, вязкости и т.д., в соответствии с конкретным избранным способом введения пациенту.
Так, типичная фармацевтическая композиция для инъекций содержит 1 мл стерильной воды с буфером и 1-10 мг липидизированного иммуноглобулина. Типичная композиция для внутривенных вливаний содержит 250 мл стерильного раствора Рингера и 150 мг антитела. Актуальные способы приготовления композиций для парентерального применения хорошо известны специалистам в данной области и описываются в подробностях, например, в Remington's Pharmaceutical Science, 15-е издание, Mack Publishing Company, Easton, Pennsylvania (1980), включенном в настоящий документ в качестве ссылки.
Липидизированные белки и антитела настоящего изобретения можно замораживать или лиофилизировать для хранения и восстанавливать в подходящем носителе непосредственно перед употреблением. Эти методики проявили себя эффективными в отношении стандартных иммуноглобулинов, поэтому можно применять известные в данной области методики лиофильной сушки и последующего восстановления. Специалистам ясно, что лиофилизация и восстановление могут привести к различным степеням потери активности (например, что касается стандартных глобулинов, известно, что IgM теряют активность более, чем IgG) и что уровни использования надо корректировать с целью компенсировать потерю активности.
Композиции, содержащие настоящие липидизированные белки (например, антитела), или коктейль из них можно применять с профилактическими и/или терапевтическими целями. Для терапевтических целей композиции вводятся пациенту в количестве, достаточном для лечения или, по крайней мере, приостановки заболевания и его осложнений. Количество, адекватное для выполнения этих задач, определяется здесь как "терапевтически эффективная доза". Количества, эффективные для этих целей, будут зависеть от тяжести заболевания и общего состояния иммунной системы пациента, но, в основном, варьируют в пределах от приблизительно 1 до приблизительно 200 мг антител на дозу, наиболее часто применяют дозы от 5 до 25 мг. Нужно иметь в виду, что материалы настоящего изобретения могут, в основном, применяться при серьезных болезненных состояниях, то есть в угрожающих жизни или потенциально угрожающих жизни ситуациях.
В профилактических целях композиции, содержащие настоящие иммуноглобулины или коктейль из них, вводятся пациенту, который не находится еще в болезненном состоянии, для усиления его сопротивляемости. Такое количество определяется здесь как "профилактически эффективная доза". Для этих целей, точные количества также зависят от состояния здоровья пациента и общего уровня иммунной защиты, но, в основном, варьируют от 0,1 до 25 мг на дозу.
Однократные или множественные введения пациенту настоящих композиций выполняются при уровнях доз и характере применения, определяемых лечащим врачом. В любом случае, фармацевтические рецептуры обеспечат количество липидизированных белков и/или антител(а), достаточное для эффективного лечения пациента.
Для диагностических целей липидизированные антитела могут быть как мечеными, так и немеченными. Немеченные антитела можно использовать в сочетании с другими мечеными антителами (вторичные антитела), которые вступают в реакцию с липидизированными антителами, например антитела, специфичные в отношении константных областей иммуноглобулинов человека. В другом варианте, липидизированные антитела можно метить непосредственно. Можно использовать целый ряд меток, таких как радионуклиды, ферменты, ферментные субстраты, кофакторы ферментов, ингибиторы ферментов, лиганады (особенно, гаптены), радиоконтрастные агенты, хелаты металлов и т.д. Многочисленные виды топографических применений являются доступными и хорошо известны специалистам в данной области. Для примера, но не ограничения, антитела, которые связывают опухолевые антигены (например, антитела против карциноэмбриональных антигенов), могут быть липидизированы и соединены с радиоконтрастным агентом или материалов для ядерно-магнитно-резонансной томографии, введены пациенту и определены для установления мест локализации опухоли или метастатических поражений.
Липидизированные иммуноглобулины настоящего изобретения можно использовать для диагностики и лечения. Для иллюстрации, но не ограничения, назовем применение для лечения рака, аутоиммунных заболеваний или вирусных инфекций. Для лечения рака антитела будут специфично связываться с антигенами, которые экспрессируют определенные раковые клетки, такими как c-myc продукт гена и другие, хорошо известные специалистам. Предпочтительно, липидизированное антитело будет связываться с мутантным белком, таким как c-ras онкогенный продукт, имеющий патогенную (например, неопластическую) последовательность, такую как замена позиции 12, 13, 59 или 61 белка (например, замена серина на позиции 12 p21ras). Для лечения аутоиммунного заболевания антитела в типичном случае должны связываться с главным регуляторным белком, который первично экспрессируют активированные T-клетки, таким как NF-AT, и многими другими внутриклеточными белками, хорошо известными специалистам (например, см. Fundamental Immunology, 2-е изд., W.E. Paul. ed., Raven Press: New York, N.Y. включенный в настоящий документ в качестве ссылки). Для лечения вирусных заболеваний антитела в типичном случае должны связываться с белком, который экспрессируют клетки, зараженные определенным вирусом, таким как кодируемые вирусом полимеразы и ВИЧ-1 Tat, и многими другими вирусными белками, хорошо известными специалистам (см. , например, Virology, 2-е изд., B.N. Fields и др. , eds. , (1990), Raven Press: New York, N.Y. включенный в настоящий документ в качестве ссылки).
Также могут составляться наборы для использования конкретных липидизированных антител для защиты или определения клеточной активности или для определения присутствия внутриклеточного белка определенных клеток или для диагностики заболеваний. Так, можно создать определенную композицию настоящего изобретения, обычно в лиофилизированной форме в контейнере, как отдельно, так и в сочетании с добавочными антителами, специфичными в отношении желательного клеточного типа. Липидизированные антитела, которые могут быть конъюгированы с меткой или токсином, или неконъюгированы, включают в наборы вместе с буферами, такими как Трис, фосфатный буфер, карбонатный буфер и т. д. , стабилизаторами, биоцидными агентами, инертными белками, например сывороточным альбумином или ему подобными, и с инструкциями по применению набора. В основном, эти материалы присутствуют в количестве, менее чем 5% от веса активных антител, и, обычно, в количестве 0,001% от общего веса, снова на основе концентрации антител. Часто бывает желательным включение инертного наполнителя для разведения активных ингредиентов, в количестве приблизительно от 1 до 99% от веса всей композиции. Если применяются дополнительные антитела, способные связываться с липидизированными антителами, они должны находиться в отдельных сосудах. Эти вторые антитела могут быть конъюгированы с меткой и находиться в такой же рецептуре, как и описанные выше рецептуры для основных антител, а также и сами могут быть липидизированными.
Липидизированные антитела настоящего изобретения также подходят для применения в усовершенствованных диагностических методах и в методах очистки и выделения белков. Например, множество внутриклеточных белков являются нестабильными (например, обладают коротким полупериодом выделения или чувствительны к протеолизу) или склонными к агрегированию (например, β-амилоидный белок), что делает выделение и/или диагностическое определение затруднительными. Липидизированные антитела способны проникать внутрь клетки и связываться со специфичными внутриклеточными антигенами-мишенями; такое связывание антиген-антитело может стабилизировать антиген-мишень и блокировать ферменты, участвующие в расщеплении антигена-мишени (например, протеазы, убиквитин-связывающие ферменты, гликозидазы), облегчая определение и/или выделение антигена-мишени.
В одном варианте осуществления изобретения, липидизированное антитело, которое специфично связывается с внутриклеточным антигеном-мишенью, контактирует с живыми клетками, содержащими внутриклеточный антиген-мишень, при физиологических условиях (например, в условиях культуры клеток, в условиях организма), и инкубация происходит в течение периода времени, подходящего для связывания (например, от 10 минут до нескольких часов). Липидизированное антитело специфически связывается с антигеном-мишенью, образуя комплекс антиген-антитело, который менее подвержен деградации и/или агрегации, чем сам антиген-мишень. В типичном случае клетки затем фиксируют, делают проницаемыми, и определяют комплекс антиген-антитело, включающий мишень-антиген, связанный с липидизированным антителом, обычно с помощью дополнительного меченого антитела, которое специфически связывается с липидизированным антителом. Примерами предпочтительных меток, соединяемых с дополнительными антителами, являются: FITC, родамин, конъюгаты пероксидазы хрена обыкновенного, конъюгаты щелочной фосфатазы, конъюгаты β--галактозидазы, биотинил, радиоизотопы и подобные. В некоторых вариантах осуществления изобретения вторичное антитело может быть липидизировано, а этапы фиксации и/или повышения проницаемости могут быть опущены и заменены тщательным отмыванием клеточного образца для удаления неспецифичного окрашивания. Также является возможным непосредственное применение липидизированного и помеченного первичного антитела без использования дополнительных, вторичных антител. Меченый белок А также может заменить вторичное антитело для определения первичного (липидизированного) антитела.
Липидизированные антитела также можно применять для внутриклеточной терапии, например для связывания предопределенного внутриклеточного антигена-мишени и модифицирования биохимических свойств антигена-мишени. Например, мультимерные белки, такие как гетеромультимерные белки (например, факторы транскрипции, G-белки) или гомодимерные белки (например, полимеризованный тубулин) могут обладать биохимической активностью (например, ГТФ-азной активностью) или иной активностью, требующей внутриклеточных взаимодействий, которые могут быть блокированы липидизированным антителом, которое специфично связывается с одной или более субъединицами и предотвращает функциональное взаимодействие субъединиц. Например, липидизированное антиFos антитело, которое связывается с частью Fos (например, с "застежкой-молнией" лейцина), которая требуется для связывания с Jun для образования транскрипционно активного фактора транскрипции AP-1 (Fos/Jun гетеродимер), может блокировать образование функциональной AP-1 и ингибировать AP-1-опосредованную генную транскрипцию. Также для примера липидизированные анти-ras антитело может связываться с эпитопом ras, что требуется для его функции сигнальной трансдукции (например, с участком связывания ГТФ/ГДФ, частью ras, которая связывает добавочный белок, такой как GAP или подобный ему), таким образом, модифицируя активность внутриклеточного ras в живых клетках.
Следующие примеры предлагаются в качестве иллюстрации, но не для ограничения.
ЭКСПЕРИМЕНТАЛЬНЫЕ ПРИМЕРЫ
Пример 1
Приготовление липидизированного бычьего IgG
Был получен глицилдиоктадециламид путем присоединения остатка глицина к диоктадециламину, согласно способу, описанному Behr и др., (1989) Proc. Natl, Acad. Sci. (U.S.A.) 86:6982, который включен в настоящий документ в качестве ссылки. 1 эквивалент бензилоксикарбонил-глицил-р-нитрофенола и 1,1 эквивалента триэтиламина в CH2-Cl2 реагировали в течение 5 часов, затем добавляли H2, 10% Pd/C в CH2 Cl2/этиловом спирте, и реакция продолжалась еще 1 час.
Два мг бычьего IgG (Sigma) растворяли в 400 мкл 300 мМ NaHCO3 в 1,5 мл флаконе Эппендорфа. Пятьдесят мкл свежеприготовленного NaIO4 (42 мг/мл в воде) добавляли в флакон, заворачивали его в алюминиевую фольгу и осторожно оттрясывали 90 мин при комнатной температуре. Реакционную смесь затем загружали в колонку PD-10 (Pharmacia), предварительно уравновешенную 10 мМ Na2CO3 (фракция 1) и из колонки вымывали 500 мкл фракции. Фракция 7 (между 3 мл и 3,5 мл) содержала приблизительно 1,6 мг бычьего IgG, что измерялось с помощью анализа Брэдфорда.
Раствор глицилдиоктадециламида в диметилсульфоксиде приготавливался следующим образом: 5 мг липида помещались в 1 мл диметилсульфоксида и перемешивался вихревым движением жидкости путем вращения флакона, интенсивно в течение нескольких минут. При этих условиях липид полностью не растворялся. Пятьдесят мкл этого раствора осторожно отбирали так, чтобы не попал нерастворенный липид, и прибавляли к 350 мкл фракции 7, полученной, как описано выше, в флакон Эппендорфа. Флакон заворачивали в алюминиевую фольгу и смесь осторожно встряхивали в течение 20 часов при комнатной температуре.
Сто мкл раствора NaBH4 (10 мг/мл в воде) прибавляли на следующем этапе. Спустя один час, 40 мкл раствора этаноламина (15 мкл в 1 мл Р2O) прибавляли к смеси. Спустя еще один час, реакционную смесь загружали в колонку PD-10, предварительно уравновешенную 100 мМ буфера HEPES, pH 8,5. Фракцию, содержащую липидизированный IgG (между 3 и 3,5 мл), собирали и хранили во льду.
Мечение 14C-уксусным ангидридом
Использовали 14C-уксусный ангидрид (500 мкCi, Amersham) в бензоле (10 • 106 имп. в мин/л). Две 5 мкл аликвоты добавляли к 500 мкл фракции, содержащей липидизированный IgG, с 10 мин интервалами во флакон Эппендорфа. Реакционную смесь оставляли во льду. 500 мкл раствора нативного IgG (800 мкг в 100 мМ HEPES, pH 8,6) обрабатывали подобным же образом.
Спустя 30 мин, флаконы подогревали до 20-25oC, 14C-меченые IgG отделяли от свободного 14C-эцетата на колонке PD-10, уравновешенной физиологическим раствором с фосфатным буфером. Инкорпорированная радиоактивность составляла приблизительно 10 • 106 имп./мин для 500 мкг.
Изучение органного поглощения
Мыши-самцы, швейцарские альбиносы, (20 г) использовались в настоящем исследовании. Внутривенно (через хвостовую вену) вводили 100 мкл 14C-меченых IgG в качестве контроля или 100 мкл 14C-меченых липидизированных IgG в физиологическом растворе с фосфатным буфером (приблизительно 400000 распадов/мин). Спустя 30 мин или 3 часа, мышей убивали, кровь собирали в пробирки, содержащие этилендиаминтетрауксусную кислоту (ЭДТК), мозг (исключая ствол и мозжечок), селезенку, одну почку и одну долю печени измельчали. Органы гомогенизировали в 1 мл 10 мМ ТРС буфера, pH 7,4 и 500 мкл аликвоты считали в сцинтилляционном счетчике Beckman. Концентрацию белка в этих гомогенатах определяли анализом Брэдфорда (кумасси синий). Кровь центрифугировали и считали 20 мкл фракции плазмы. Таблица 1 показывает поглощение 14C мозгом, печенью, селезенкой и почкой, выраженное частным от деления радиоактивности 1 мкг белка органа на радиоактивность 1 мкл плазмы (данные выражены в мкл/мкг белка).
Контрольные группы состояли из 4 и 6 мышей на 30 мин и 3 часа соответственно. Группы мышей, получавших липидизированные IgG, везде составляли 6 особей. Данные являются средним ± средняя квадратичная погрешность среднего.
Пример 2
Ингибирование цитотоксичности ВИЧ-1 липидизированным анти-Tat антителами
Моноклональное антитело, которое специфично связывается с Tat белком ВИЧ-1, липидизировали согласно методике, описанной в примере 1, supra, включая окисление периодатом углеводной части антитела, в последующем ковалентным присоединением глицилдиоктадециламида для получения липидизированного антитела (через углеводную часть); антитела вымывались из конечной колонки PD-10 физиологическим раствором с фосфатным буфером.
Sup T1 клетки содержали в 24-луночных планшетах (100000 клеток на мл, в 2 мл модифицированной RPM1 среде 1640). Клетки культивировали: (1) без дополнительной обработки (два контроля), (2) в присутствии нативных анти-Tat антител (15 мкг/мл) или (3) в присутствии липидизированных анти-Tat антител (11,7 мкг/мл), в течение первых пяти дней эксперимента. В конце первого дня в одну лунку контрольных клеток добавили ВИЧ-1 IIIВ и в лунки с культурами, содержащими клетки, обработанные нативным анти-Tat антителом и липидизированным анти-Tat антителом. Жизнеспособные клетки считали ежедневно. Необработанные ВИЧ-инфицированные клетки росли до плотности приблизительно 500000 клеток на мл, и их число начало уменьшаться, спустя приблизительно восемь дней, вследствие цитотоксического эффекта вируса.
Неинфицированные клетки росли до плотности приблизительно 1000000 клеток на мл. Воздействие на инфицированные клетки нативными анти-Tat антителами не защитило клетки от цитотоксического эффекта вируса. Напротив, липидизированные анти-Tat антитела обеспечили почти полную защиту клеток от цитопатического эффекта вируса. Эта защита длилась, по крайней мере, почти 5 дней после того, как воздействие антителами прекратили. Результаты представлены на фиг. 3.
В другом эксперименте клетки содержали, как описано выше в предыдущем примере, без какого-либо воздействия и без заражения, зараженными ВИЧ-1 и без лечения, с воздействием нативными анти-Tat антителами (1 мкг/мл) и зараженными, или с воздействием липидизированными анти-Tat антителами (1 мкг/мл) и зараженными. В последних трех вариантах вирус добавляли в конце первого дня культивирования. В последних двух вариантах нативные или липидизированные антитела присутствовали с первого до седьмого дня.
Данные, представленные в таблице 2, показывают, что в то время, как нативные анти-Tat антитела оказывали незначительное воздействие, если оказывали его вообще, на количество жизнеспособных клеток и активность обратной транскриптазы, липидизированные антитела создавали значительную защиту клеток в культуре от цитопатического эффекта вируса и значительное снижение активности обратной транскриптазы. Последний факт наводит на мысль о том, что липидизированные антитела угнетали внутриклеточную репликацию ВИЧ-1.
ВИЧ-1-инфицированные SupT1 клетки ежедневно обрабатывали анти-Tat антителами в нативной и липидизированной формах или rsCD4 (все белки использовали при концентрации 1 мкг/мл), начиная с первого дня перед добавлением ВИЧ-1 содержащих надосадочных жидкостей, до истечения 10 дней после инфекции. Количество клеток и активность обратной транскриптазы (ОТ) в культуральной среде определяли каждый день, начиная со второго дня после заражения. Вплоть до десятого дня, нативные анти-Tat антитела не оказывали существенного влияния как на количество клеток, так и на активность ОТ, в то время как липидизированные анти-Tat антитела повышали выживаемость клеток по сравнению с необработанными этими антителами, зараженными клетками приблизительно на 70%, и понижали активность ОТ примерно на такую же величину. Культивирование продолжали еще три дня без дальнейшего добавления антител. Эффект липидизированных анти-Tat антител продолжался эти три дня, что указывает на аккумуляцию липидизированных антител в клетках, в количествах, достаточных для обеспечения поддержания защитного эффекта против вирусной инфекции/репликации. Величины воздействий липидизированных анти-Tat антител на выживаемость клеток и активность ОТ были весьма сходны с теми, которые наблюдаются с теми же дозами rsCD4. Повышение концентрации липидизированных антител до 10 мкг/мл не вызывало дальнейшего снижения активности ОТ.
Пример 3
Способность липидизированных анти-Tat антител ингибировать транскрипционную активность Tat на ВИЧ-1 LTR-последовательности
Клеточная линия HeLa была подвергнута устойчивой трансфекции полинуклеотидом, экспрессирующим CD4, мембранный рецептор, опосредующий ВИЧ-1 инфекцию, и также содержащим ВИЧ-1 длинный концевой повтор (LTR-последовательность) и побуждающим транскрипцию связанного с ней гена (хлорамфеникол ацетилтрансфераза, ХАТ). Эти клетки (HLCD4-ХАТ) чувствительны к ВИЧ-1 инфекции, которая производит функциональный Tat белок; связывание вновь синтезированным Tat ВИЧ-1 LTR-последовательности приводит к транскрипции связанного ХАТ гена. Таким образом, величина экспрессии ХАТ приблизительно пропорциональна тяжести ВИЧ-1 инфекции и активности Tat белка в клетках.
Культуру клеток HeLa (3 • 105 клеток/мл в модифицированной по способу Дульбекко среде Игла) подвергали воздействию одинаковых концентраций (1 или 10 мкг/мл) различных антител (в нативной или липидизированной форме) или рекомбинатного растворимого CD4 (rsCD4) в течение одного часа и продолжительно отмывали перед добавлением ВИЧ-содержащих культуральных надосадочных жидкостей (100 мкл). Спустя 24 часа, клетки собирали и экспрессию ХАТ измеряли по способу Ho и др. (1984). Каждый эксперимент выполняли в четырех повторностях и в течение четырех различных периодов времени. Фиг. 4 показывает, что липидизированные анти-Tat антитела значительно ингибировали активность ХАТ (приблизительно на 75%), в то время, как нативные (нелипидизированные) анти-Tat антитела, липидизированные анти-gp120 антитела или rsCD4 были значительно менее эффективными в угнетении активности ХАТ. Эти данные показывают, что липидизированные анти-Tat антитела были способны специфично связываться с их внутриклеточной мишенью, Tat, и ингибировать активности мишени, как активатора транскрипции LTR- последовательности.
Более того, данные, демонстрирующие пассаж липидизированных анти-Tat антител внутрь клеток HeLa, показывают, что механизм транспорта, вероятно, не требует образования эндосом, поскольку сообщалось о том, что клетки HeLa не обладают или обладают малой фагоцитирующей способностью.
Пример 4
Приготовление липидизированных иммуноглобулинов, реагирующих с внутриклеточным белком
Глицилдиоктадециламид получали присоединением остатка глицина к диоктадециламину, согласно способу, описанному Behr и др. (1989) Proc. Natl. Acad. Sci. (U. S. A. ) 86:6982, включенный в настоящий документ в качестве ссылки. 1 эквивалент бензилоксикарбонил-глицил-p-нитрофенола и 1,1 эквивалента триэтиламина в CH2Cl2 реагировали в течение 5 часов, затем к ним добавляли H2, 10% Pd/C в CH2Cl2/этаноле, и реакция продолжалась еще 1 час.
Ig против c-myc человека
Гликозилированные иммуноглобулины мыши, которые специфично связывают белок с-mус человека, приготавливали путем раздельного культивирования гибридомных клеточных линий MУC CT9-B7.3 (ATCC CRL1725), MУC CT 14-G4.3 (ATCC CRL 1727) и MУC 1-9E10.2 (ATCC CRL 1729) в среде RPM1 1640 с 10% фетальной бычьей сыворотки в специфических условиях (Evan и др. (1985) Mol. Cell. Biol 5: 3610, включенный в настоящий документ в качестве ссылки); секретируемые моноклональные антитела собирали и очищали стандартными способами, хорошо известными в данной области.
Около 2 мг каждого очищенного моноклонального антитела растворяли в 400 мкл 300 мМ NaHCO3 в 1,5 мл флаконах Эппендорфа. Добавляли по 50 мкл свежеприготовленного раствора NaIO4 (42 мг/мл в воде), флаконы заворачивали в алюминиевую фольгу и осторожно трясли в течение 90 мин при комнатной температуре. Реакционную смесь затем загружали в колонку PD-10 (Pharmacia), предварительно уравновешенную 10 мМ Na2CO3 (фракция 1), и из колонки элюировали 500 мкл фракции. Собирали фракции, содержащие по крайней мере приблизительно 500 мкг IgG, что измерялось посредством белкового анализа Брэдфорда.
Приготавливали раствор глицилдиоктадециламида в диметилсульфоксиде (5 мг липида в 1 мл ДМСО, интенсивно перемешивали воронкообразным движением жидкости при вращении флакона в течение нескольких минут). При этих условиях липид полностью не растворился. Пятьдесят мкл этого раствора осторожно отбирали и добавляли к 350 мкл очищенных фракций IgG, полученных, как описано выше, во флаконах Эппендорфа. Флаконы заворачивали в алюминиевую фольгу и смесь осторожно встряхивали в течение 20 часов при комнатной температуре.
Сто мкл раствора NaBH4 (10 мг/мл в воде) добавляли к реакционной смеси. Спустя один час, добавляли 40 мкл раствора этаноламина (15 мкл в 1 мл воды). Спустя еще один час, реакционную смесь загружали в колонку PD-10, предварительно уравновешенную физиологическим раствором с фосфатным буфером. Фракцию, содержащую липидизированный мышиный IgG против myc человека, собирали и хранили во льду.
Ig против HMG CoA редуктазы
Гликозилированные иммуноглобулины мыши, которые специфично связываются с внутриклеточным ферментом HMG CoA редуктазой, приготавливали путем раздельного культивирования гибридомной клеточной линии A9 (ATCC CRL 1811) в модифицированной по способу Дульбекко среде Игла с 4,5 г/л глюкозы, 5% лошадиной сыворотки и 2,5% фетальной бычьей сыворотки, как описано (Goldstein и др. , (1983) J. BioL Chem. 258:8450, включенный в настоящий документ в качестве ссылки), и секретируемые моноклональные антитела собирали и очищали стандартными способами, хорошо известными в данной области.
Около 2 мг каждого очищенного моноклонального антитела растворяли в 400 мкл 300 мМ NaHCO3 в 1,5 мл флаконе Эппендорфа. Пятьдесят мкл свежеприготовленного раствора NaIO4 (42 мг/мл в воде) прибавляли к раствору, флакон заворачивали в алюминиевую фольгу и осторожно трясли 90 мин при комнатной температуре. Реакционную смесь затем загружали в колонку PD-10 (Pharmacia), предварительно уравновешенную 10 мМ Nа2CO3 (фракция 1), и из нее элюировали 500 мкл фракции. Собирали фракции, содержащие по меньшей мере приблизительно 500 мкг IgG, измеренного посредством анализа Брэдфорда.
Приготавливали раствор глицилдиоктадециламида в ДМСО (5 мг липида в 1 мл ДМСО, интенсивно перемешивали несколько минут вращением флакона). При этих условиях липид полностью не растворялся. Осторожно отбирали 50 мкл этого раствора и прибавляли к 350 мкл фракций IgG, полученных, как описано выше, во флакон Эппендорфа. Флакон заворачивали в алюминиевую фольгу, и смесь осторожно трясли при комнатной температуре в течение 20 часов.
Затем прибавляли сто мкл раствора NaBH4 (10 мг/мл в воде). Спустя час прибавляли 40 мкл раствора этаноламина (15 мкл в 1 мл воды). Спустя еще один час, реакционную смесь загружали в колонку PD-10, предварительно уравновешенную физиологическим раствором с фосфатным буфером. Фракцию, содержащую липидизированный IgG против HMG CoA редуктазы (между 3 и 3,5 мл), собирали и хранили во льду.
Пример 5
Приготовление липидизированных иммуноглобулинов, реагирующих с трансмембранным белком
Глицилдиоктадециламид получали посредством присоединения остатка глицина к диоктадециламину, согласно методике, описанной Behr и др. (1989) Proc. Natl. Acad. Sci. (U.S.A.) 86:6982, включенный в настоящий документ в качестве ссылки. Один эквивалент бензилоксикарбонил-глицил-з-нитрофенола и 1,1 эквивалента CH2Cl2 реагировали в течение 5 часов, затем прибавляли Н2, 10% Pd/C в CH2Cl2/этаноле, и реакция продолжалась еще один час.
Анти-Ras иммуноглобулин
Гликозилированные мышиные иммуноглобулины, которые специфично связываются с ras онкогенным белком, приготавливали путем раздельного культивирования гибридомной клеточной линии 142-24E5 (ATCC HB 8679; U.S. Pats. 5015571 и 5030565, включенные в настоящий документ в качестве ссылки) в модифицированной по способу Дульбекко среде Игла с 4,5 г/л глюкозы, 2 мМ L-глутамина, 1 мМ пирувата натрия, неосновными аминокислотами, 1 х ВМЕ витаминами, 0,1 мМ гипоксантина, 0,032 мМ тимидина, 0,05 мг/мл гентамицина и 10% фетальной бычьей сыворотки; и гибридомной клеточной линии MX (ATCC HB 9158) в Iscove's модифицированной по способу Дульбекко среде Игла с 1% L- глутамина и HT и 10% фетальной бычьей сыворотки при специальных условиях (U. S. Patent 4820631, включенный в настоящий документ в качестве ссылки); моноклональные антитела, секретируемые гибридомными клетками, собирали и очищали с помощью стандартных методик, хорошо известных в данной области.
Около 2 мг каждого очищенного моноклонального антитела растворяли в 400 мкл 300 мМ NaHCO3 в 1,5 мл флаконе Эппендорфа. Добавляли пятьдесят мкл свежеприготовленного раствора NaIO4 (42 мг/мл в воде), флакон заворачивали в алюминиевую фольгу и осторожно трясли 90 мин при комнатной температуре. Реакционную смесь затем загружали в колонку PD-10 (Pharmacia), предварительно уравновешенную 10 мМ Na2CO3 (фракция 1), и собирали фракции по 500 мкл. Фракцию или фракции, содержащие по меньшей мере приблизительно 500 мкл IgG, измеренные с помощью анализа Брэдфорда, собирали из колонки.
Приготавливали раствор глицилдиоктадециламида в ДМСО (5 мг липида в 1 мл ДМСО, интенсивно перемешивали путем вращения флакона в течение нескольких минут). При этих условиях липид растворялся неполностью. Осторожно отбирали 50 мкл этого раствора и прибавляли к 350 мкл очищенных фракций IgG, полученных, как описано выше, во флакон Эппендорфа. Флакон заворачивали в алюминиевую фольгу и смесь осторожно трясли 20 часов при комнатной температуре.
Затем прибавляли 100 мкл раствора NaBH4 (10 мг/мл в воде). Спустя час, прибавляли 40 мкл раствора этаноламина (15 мл в 1 мл в воде). Спустя еще один час, реакционную смесь загружали в колонку PD-10, предварительно уравновешенную физиологическим раствором с фосфатным буфером. Фракцию, содержащую липидизированный мышиный IgG-анти-ras, собирали и хранили во льду.
Гибридомные клеточные линии, о которых упоминалось в приведенных выше примерах, можно получить в Американской Коллекции Тканевых культур, Rockville, MD (ATCC Cell Lines and Hybridomas (1992), 7-е издание, включенное в настоящий документ в качестве ссылки).
Пример 6
Липидизирование трансмембранного фермента
Фермент гамма-глутамилтранспептидаза (ГГТ: EC-2.3, 2.2) является широко распространенным ферментом, который катализирует расщепление глутатиона и других γ-глутамил соединений посредством гидролиза γ-глутамил части или его переносом на подходящий акцептор. ГГТ является гетеродимерным гликопротеином, который синтезируется в виде белка-предшественника, который в свою очередь гликозилируется и распадается на две субъединицы зрелого фермента. ГГТ прикреплена к клеточной мембране посредством N-терминальной части тяжелой цепи. Активный участок фермента находится на внеклеточной части молекулы, которая обильно гликозилирована.
ГГТ выделяли отдельно из почек крыс и культуры клеток гепатомы человека, согласно процедуре, описанной ранее (Barouki и др., (1984) J. Biol. Chem. 259:7970; Curthoys and Hughey (1979) Enzyme 24:383; Matsuda и др., (1983) J. Biochem. 93: 1427; Taniguchi и др., (1985) J. Natl. Cancer Inst. 75:841; Tate and Meister (1985) Methods Enzymol 113:400; and Toya и др., (1983) Ann. N. Y.Acad. Sci 417:86, которые включены в настоящий документ в качестве ссылки).
Около 1 мг каждого препарата очищенной ГГТ крысы и человека растворяли в 400 мкл 300 мМ NaHCO3 в 1,5 мл флаконе Эппендорфа. Добавляли 50 мкл свежеприготовленного раствора NaIO4 (42 мг/мл в воде), флакон заворачивали в алюминиевую фольгу и осторожно трясли 60 мин при комнатной температуре. Затем реакционную смесь загружали в колонку PD-10 (Pharmacia), предварительно уравновешенную 10 мМ Na2CO3 (фракция 1), и из нее элюировали 500 мкг фракции. Собирали фракции, содержащие по меньшей мере приблизительно 100 мкг ГГТ, измеренные посредством анализа Брэдфорда.
Приготавливали раствор глицилдиоктадециламида в ДМСО (5 мг липида в 1 мл ДМСО, тщательно перемешивали несколько минут вращением флакона). При этих условиях липид полностью не растворялся. Осторожно отбирали 50 мкл этого раствора и прибавляли к 350 мкл очищенных фракций ГГТ, полученных, как описано выше, во флаконы Эппендорфа. Флакон заворачивали в алюминиевую фольгу, смесь осторожно трясли 20 часов при комнатной температуре.
Затем добавляли 100 мкл раствора NaBH4 (10 мг/мл в воде). Спустя час добавляли 40 мкл раствора этаноламина (15 мкл в 1 мл воде). Спустя еще один час, реакционную смесь загружали в колонку PD-10, предварительно уравновешенную физиологическим раствором с фосфатным буфером. Фракцию, содержащую липидизированные ГГТ человека и крысы, собирали и хранили во льду.
Фракции липидизированных ГГТ человека и крысы исследовали на активность γ-глутамилтранспептидазы посредством стандартных методик (Tate and Meister (1983), цит., включенный в настоящий документ в качестве ссылки) и определяли специфичную активность липидизированной ГГТ человека и липидизированной ГГТ крысы.
Липидизированные ГГТ человека и крысы метили иодированием 125I с применением хлорамина T, и приблизительно 50 мкг радиоактивной липидизированной ГГТ вводили интраперитонеально крысам. Спустя 24 часа, крыс убивали и отбирали образцы тканей для ауторадиографии, чтобы определить характер распределения липидизированной ГГТ в различных органах.
Пример 7
Липидизирование антиактиновых антител и внутриклеточное окрашивание с использованием иммунной метки
Для того, чтобы продемонстрировать, что липидизированные антитела могут проникать внутрь живых клеток и связываться с внутриклеточными мишенями, антиактиновое антитело липидизировали и определили его способность проникать в фибробласты культуры Swiss ЗТЗ и связываться актином, белком цитоскелета. В качестве контроля использовали нативные (нелипидизированные) антиактиновые антитела.
Протеин-A-очищенные антиактиновые поликлональные антитела кролика липидизировали в соответствии со следующей процедурой: Липоамин, глицилдиоктадециламид, был ковалентно присоединен к углеводной части антиактинового антитела посредством окисления периодатом/восстановления боргидридом. Антитела растворяли в 0,8 мл 300 мМ NaHCO3 до концентрации приблизительно 0,2 - 1,0 мг/мл. Добавляли 50 мкл свежеприготовленного водного раствора NaIO4 (42 мг/мл), флаконы заворачивали в алюминиевую фольгу и осторожно трясли 90 минут при комнатной температуре. Реакционную смесь затем очищали на колонке PD-10 (Pharmacia, Piscataway, NJ), уравновешенной и элюированной 10 мМ NaCO3. Пятьдесят мкл 10 мг/мл раствора глицилдиоктадециламида в бензоле добавляли к фракции, содержавшей антитела (например, как было определено посредством A280 мониторинга, анализа Брэдфорда), затем реакционную смесь инкубировали при комнатной температуре 20 часов при легком встряхивании. Затем добавляли 100 мкл свежеприготовленного водного раствора NaBH4 (10 мг/мл) и оставляли при комнатной температуре на один час, затем добавляли 50 мкл раствора этаноламина (15 мкл этаноламина в 1 мл воды). Спустя еще один час, при комнатной температуре полученные липидизированные антитела очищали посредством хроматографии на колонке PD-10, уравновешенной физиологическим раствором с фосфатным буфером.
Твердофазный иммуноферментный анализ (ELISA)
Липидизированные антиактиновые и липидизированные анти-Tat антитела (supra) оценивали на их способность связываться со специфичными антигенами, по сравнению с нативными (нелипидизированными) антиактиновыми и анти-Tat антителами с помощью исследования ELISA. Липидизирование как антиактиновых, так и анти-Tat антител не вызывало измеримой потери сродства антител к их специфичным антигенам, по сравнению с нативными (нелипидизированными) антителами.
Внутриклеточное окрашивание с использованием иммунной метки
Чтобы продемонстрировать, что липидизированные антиактиновые антитела способны связываться с внутриклеточным актином в живых клетках, липидизированные антиактиновые антитела или нативные антиактиновые антитела контактировали с культурой клеток Swiss ЗТЗ в течение часа, затем клетки продолжительно отмывали для удаления несвязанных антиактиновых антител. Затем клетки фиксировали, повышали их проницаемость и антиактиновые антитела определяли с помощью вторичных антител с флюоресцентной меткой. В то время как в клетках, предварительно инкубированных с нативными (нелипидизированными) антителами, не определяли специфического окрашивания, в клетках, предварительно инкубированных с липидизированными антиактиновыми антителами, совершенно очевидным было специфическое окрашивание актина. Характер окрашивания, наблюдаемый в случае липидизированных антиактиновых антител, примененных до фиксации, был аналогичен тому, что наблюдается при использовании нативных (нелипидизированных) антител, инкубированных с клетками после их фиксации и повышения проницаемости. Эти данные свидетельствуют о том, что липидизированные антиактиновые антитела были способны достигать внутриклеточного актина и связываться с ним и что они, тем не менее, могли узнаваться и связываться мечеными вторичными антителами, что указывает на их структурную и функциональную интактность.
Несмотря на то, что настоящее изобретение было детально описано для большей его ясности и понимания, является очевидным, что в рамках настоящей формулы изобретения могут практиковаться определенные изменения и модификации.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ ОПУХОЛЕЙ | 2011 |
|
RU2595389C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ ОПУХОЛИ | 2011 |
|
RU2636461C2 |
| ВЕКТОР ДЛЯ ЭКСПРЕССИИ ПОЛИПЕПТИДОВ С СИАЛИДАЗНОЙ АКТИВНОСТЬЮ, СПОСОБ ОБЕСПЕЧЕНИЯ СИАЛИДАЗНОЙ АКТИВНОСТИ В КУЛЬТУРЕ КЛЕТОК И СПОСОБ РЕГУЛИРОВАНИЯ СВОЙСТВ Fc-СОДЕРЖАЩИХ МОЛЕКУЛ, ЭКСПРЕССИРУЕМЫХ В ЛИНИИ КЛЕТОК | 2007 |
|
RU2466189C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ДИАГНОСТИКИ И ЛЕЧЕНИЯ ОПУХОЛИ | 2010 |
|
RU2563359C2 |
| АНТИТЕЛА ПРОТИВ ИНТЕРФЕРОНА-АЛЬФА | 2002 |
|
RU2314317C2 |
| ГИПЕРГЛИКОЗИЛИРОВАННЫЕ СВЯЗЫВАЮЩИЕ ПОЛИПЕПТИДЫ | 2014 |
|
RU2708314C2 |
| АНТИТЕЛА К РЕЦЕПТОРУ КОНЕЧНЫХ ПРОДУКТОВ ГЛУБОКОГО ГЛИКИРОВАНИЯ (RAGE) И ИХ ПРИМЕНЕНИЯ | 2009 |
|
RU2518351C2 |
| САЙТ-СПЕЦИФИЧЕСКАЯ КОНЪЮГАЦИЯ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО ПОСРЕДСТВОМ ГЛИКОИНЖЕНЕРИИ | 2014 |
|
RU2711935C2 |
| ГЛИКОЗИЛИРОВАННЫЕ КОНЪЮГАТЫ МОЛЕКУЛ С ПОВТОРЯЮЩИМСЯ МОТИВОМ | 2010 |
|
RU2574201C2 |
| КОМБИНИРОВАННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ АУТОИММУННЫХ ЗАБОЛЕВАНИЙ С ИСПОЛЬЗОВАНИЕМ КОМБИНАЦИИ ЭЛИМИНИРУЮЩЕГО В-КЛЕТКИ/ИММУНОРЕГУЛЯТОРНОГО АНТИТЕЛ | 2001 |
|
RU2285541C2 |
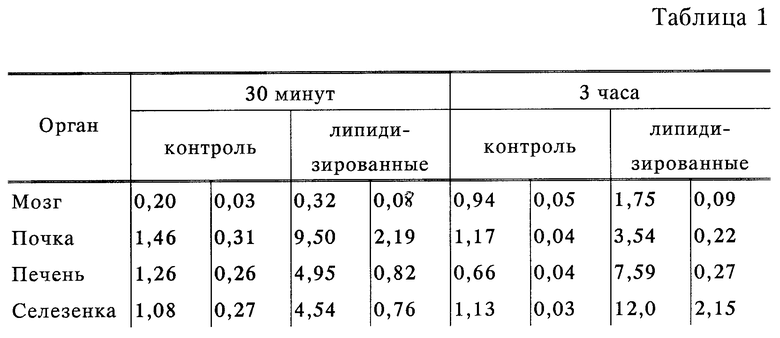

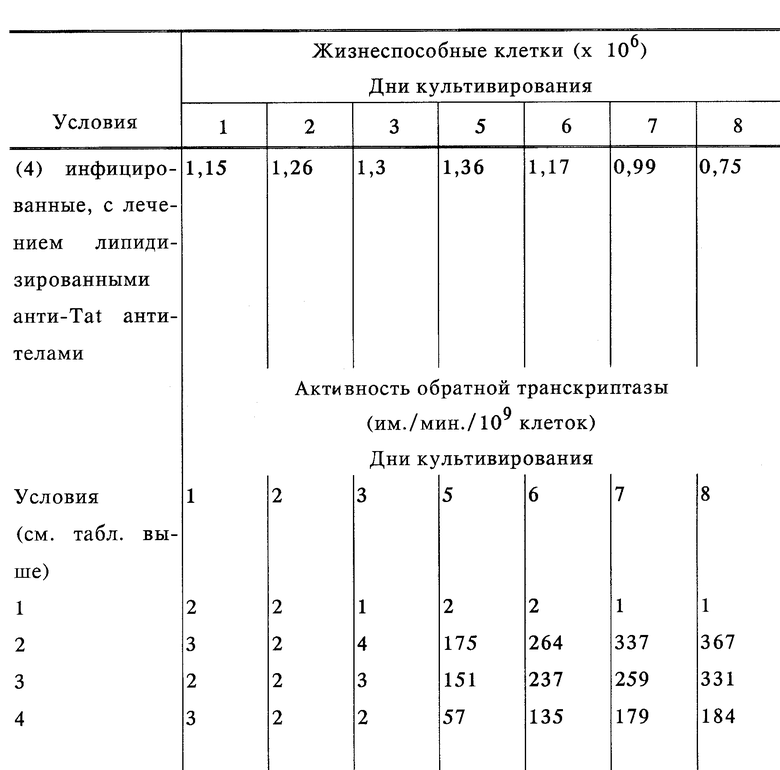
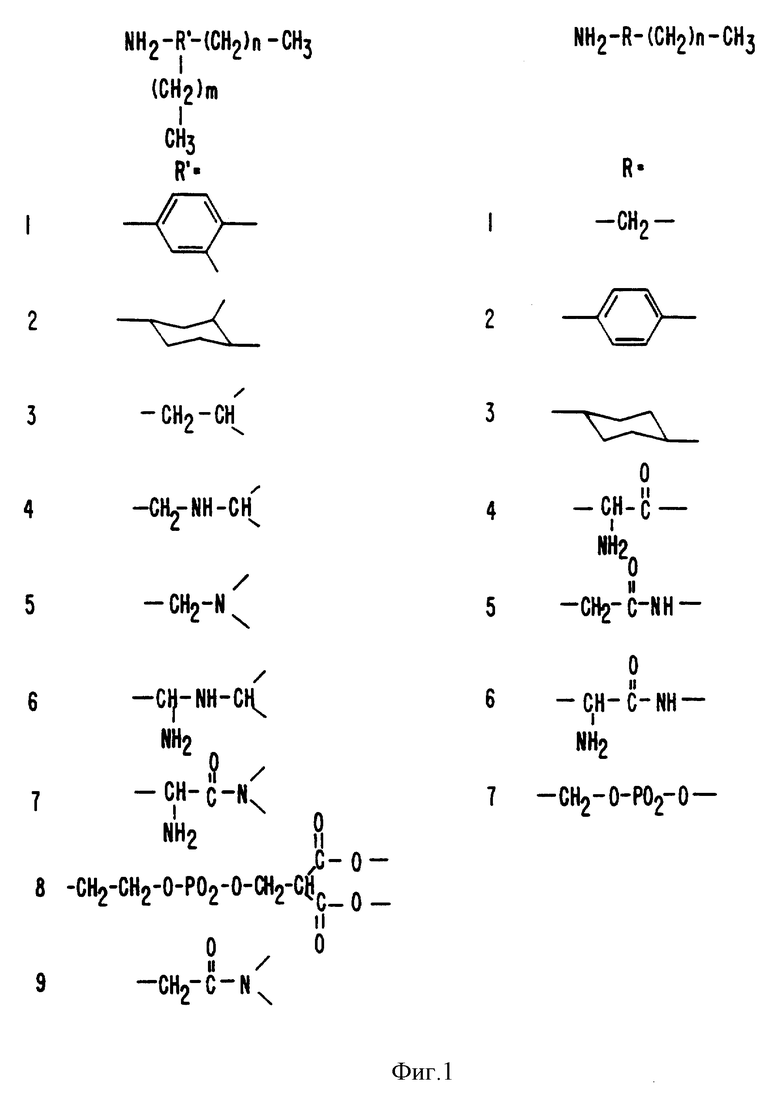


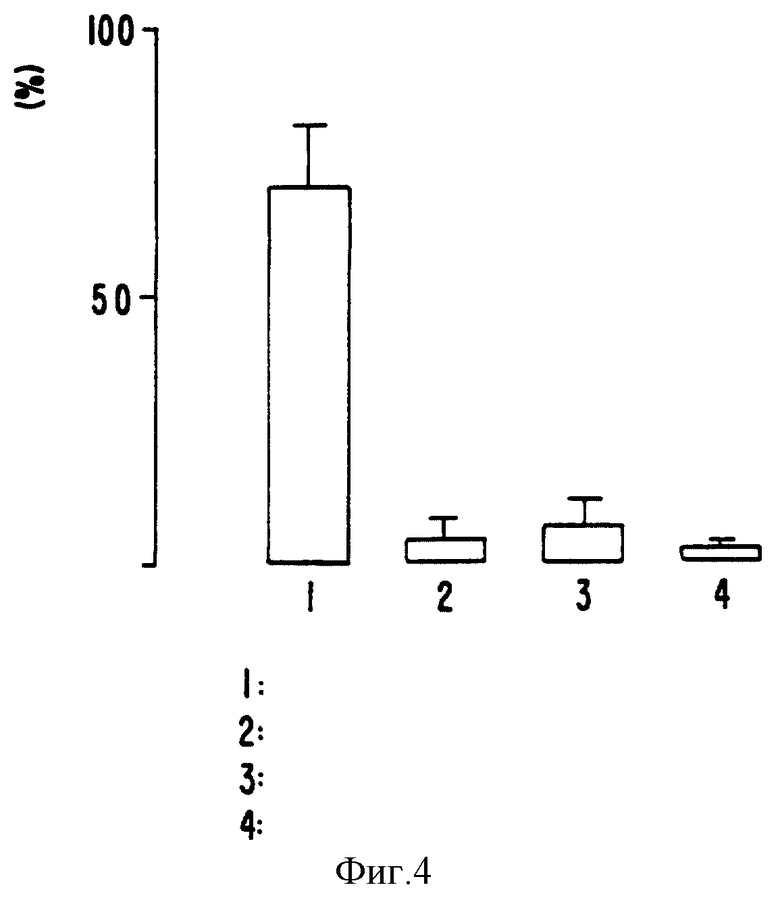
Изобретение относится к медицине и касается способа модификации белка, такого как антитело, способа обеспечения связывания белка с антителом, фармацевтических композиций модифицированных белков для лечения человека. Сущность изобретения включает связанный с липидом белок, в котором одна или более ацильных групп связаны с белком посредством боковой углеводной цепи и различными ковалентными связями. Липидизированные антитела могут применяться в лечебных и диагностических целях. Преимущество изобретения заключается в усилении проникновения модифицированных белков в клетки. 7 с. и 13 з.п. ф-лы, 4 ил., 2 табл.
NH2 - R - (CH2)n - CH3
где R - выбирают из группы, состоящей из двузамещенного алкила (алкилена); 1,4-двузамещенного циклогексила; двузамещенного арила (арилена); аминогруппы формулы - (CHR1) - CO - NH-, где R1 является водородом или аминогруппой; алкилкарбонила и фосфат диэфира; n = 1 - 50.
где R' - трехзамещенный алкил; трехзамещенный арил; амидогруппа формулы -(CHR1-CO-N<, где R1 является водородом или аминогруппой; иминогруппа формулы -CHR2-NH-CH<, где R2 является водородом или аминогруппой или иминогруппой формулы -CH2-N<; или фосфат диэфир; m = 1 - 50; n = 1 - 50; m и n выбирают независимо.
| Пожарный двухцилиндровый насос | 0 |
|
SU90A1 |
| BANGHAM A.D | |||
| Liposomes in biological Systems | |||
| ed G.Gregoriagis | |||
| A.Allisson, 1980, NewYork - Brisbane-Toronto, pp.13 - 30 | |||
| GREGORIADIS G | |||
| Liposomes for drugs and vaccins | |||
| J | |||
| "Trend | |||
| Пневматический водоподъемный аппарат-двигатель | 1917 |
|
SU1986A1 |
Авторы
Даты
2000-10-10—Публикация
1993-07-13—Подача