Предпосылки изобретения
Данное изобретение касается условно-летательных мутантов вируса псевдобешенства (PRV), также называемого вирусом болезни Ауески (ADV). PRV представляет собой высоконейротропный вирус герпеса, вызывающий болезнь Ауески у домашних и диких животных (см. обзоры Мettenleiter, Comp. Immun. Microbiol. Infect. Dis, 14, 151 - 163 (1991); Wittmann and Rzina. in (G.Wittmann ed.) Herpesvirus Diseases of Cattle, Horses and Pigs, Kluwer, Bosten, 230 - 325 (1989); Pensaert and Kluge, in (M. B. Pensaert ed.) Virus infections of porcines, Elsevier Science Publishers B. V. Amsterdam, 39 - 64 (1989)). Свиньи относительно устойчивы против PRV и поэтому их считают природным хозяином этого вируса. Природными воротами инфекции является носоглоточная зона. Вирус способен размножаться в клетках назальной и фарингеальной слизистой оболочки и после инфицирования периферических нервов он переносится в центральную нервную систему, где вызывает тяжелый энцефалит, который часто является летальным в случае молодых свиней. Более старые свиньи обычно переносят инфекцию, но у них может развиться лихорадочное состояние и пневмония. Инфекция сенсорных ганглиев, как правило, приводит к латентности.
Для ограничения экономических потерь, вызываемых смертностью и задержкой в росте инфицированных животных, проводят вакцинацию против болезни Ауески. Для этой цели пригодны вакцины на основе аттенуированного (ослабленного) вируса и инактивированного вируса. Предпочтительны вакцины на основе ослабленного живого вируса, так как их более легко готовить и, следовательно, они менее дорогие, чем инактивированные вакцины. Кроме того, аттенуированный вирус можно вводить интраназально, что обеспечивает лучшую защиту, чем парентеральное введение либо ослабленной живой вакцины, либо инактивированного вируса.
Прежние вакцины на основе ослабленных живых вирусных штаммов, полученные после серийного пассирования в клеточной культуре, обладали несколькими недостатками. Такие вакцины не были гомогенными и в смеси были включены вирусные разновидности неизвестной вирулентности и иммуногенности. Кроме того, такие вакцины таили в себе опасность возврата к вирулентности. Более недавно развитие знаний на молекулярном уровне о структуре и репликации вирусов и доступность тонких молекулярно-биологических способов позволили ученым конструировать аттенуированные вакцины, не полагаясь на случай. Вирусная генетика и анализ последовательностей ДНК сделали возможной идентификацию районов в вирусном геноме, изменения в которых могут способствовать ослаблению вирусной патогенности. Технология рекомбинантных ДНК делает возможными изменения или делецию таких районов, что приводит к получению аттенуированного вируса с определенными и стабильными изменениями. Этот подход был применен впервые успешно Kit and coworkers (Am. J. Vet. Res. 46, 1359 - 1367 (1985)) для ослабления PRV. Инактивация гена тимидинкиназы (TK) PRV приводила к значительно уменьшенной вирулентности для свиней (EP-A-141458). В дополнение к повреждению в TK гене делеции были введены в гены гликопротеинов таких, как gI, gIII и gX (Kit et al., Am. J. Vet. Res. 48, 780 - 793 (1987); Marchioli et al., Am. J. Vet. Res. 48, 1577 - 1583 (1987); Quint et al., J. Gen. Virol. 68, 523 - 534 (1987); Moormann et al., J. Gen. Virol. 71, 1591 - 1595 (1990); WO-A-9102795), что приводило к дальнейшему уменьшению вирулентности вируса и к возможности серологического распознавания вакцинированных животных и инфицированных животных (Platt et al., Vet. Microbiol. 11, 25 - 40 (1986); Van Oirschot et al., J. Gen. Virol. 67, 1179 - 1182 (1986); Van Oirschot et. al., J. Virol. Meth. 22, 191 - 206 (1988); Eloit et. al., Vet. Rec. 128, 91 - 94 (1989)).
Новым подходом к разработке вакцин является экспрессия генов чужеродных патогенов с применением живых ослабленных вирусных вакцинных штаммов в качестве носителя (вирусные вакцинные векторы). Экспрессия антигенов живым векторным вирусом имитирует экспрессию после природной инфекции и может стимулировать как гуморальную, так и клеточную иммунную ответную реакцию. Вакцинные векторы можно применять для иммунизации против болезней, для которых в настоящее время нет доступных адекватных вакцин, или, если такие вакцины не могут быть безопасно и легко получены.
Получение вакцинных векторов было сфокусировано, в основном, на вирусе осповакцины (Moss and Flexner, Ann. Rev. Immunol. 5, 305 - 324 (1987); Piccini and Paoletti, Adv. Virus Res. 34, 43 - 64 (1988)). Вирус осповакцины был интенсивно использован для искоренения оспы человека и оказался высоко эффективным и относительно безопасным. Широкий диапазон хозяев и способность к аккомодации больших количеств чужеродных ДНК позволили выбрать вирус осповакцины для испытания его в качестве вакцинного вектора (Hruby, Clin. Microbiol. Rev. 3, 153 - 170 (1990); Tartaglia et al., Crit. Rev. Immunol. 10, 13 (1990)). В качестве альтернативы вирусу осповакцины другие поксвирусы такие, как поксвирус анота, вирусы птичьей оспы, capri-поксвирус и sui-поксвирус были использованы в качестве вакцинных векторов (Tayor et al., Vaccine 6, 504 - 508 (1988); Lodmell et al., J. Virol. 65, 3400 - 3405 (1991); Letellier et al., Arch. Virol. 118, 43 - 56 (1991)).
Другими вирусами, которые могут быть использованы в качестве вакцинных векторов, являются аденовирусы (Berkner, BioTechniques 6, 6003 - 6020 (1988)) и герпервирусы (Shih et al., Proc, Natl. Acad. Sci, U.S.A. 81, 5867 - 5870 (1984); Thomsen et al., Gene 57, 261 - 265 (1987); Lowe et al., Proc. Natl. Acad. Sci. U.S.A. 84, 3896 - 3900 (1987); Cole et al., J. Virol. 64, 4930 - 4938 (1990); van Zijl et al., J. Virol, 65, 2761 - 2765 (1991); Kit et al. , Vaccine 9, 564 - 572 (1991)). Пригодность надежных и эффективных живых герпесвирусных вакцин в сочетании с их способностью к аккомодации больших количеств чужеродных ДНК делает эти вирусы очень привлекательными кандидатами для развития вакцинных векторов. Применение PRV в качестве вакцинного вектора является очень многообещающим. PRV был хорошо охарактеризован и были разработаны надежные и эффективные живые вакцины при помощи нацеленных делеций (см. выше). Этот вирус имеет широкий диапазон хозяев, но безвреден для человека. Применение PRV в качестве эффективной вакцины-носителя было недавно продемонстрировано van Zijl et al., (J. Virol. 65, 2761 - 2765 (1991), WO-A-9100352), которые показали, что рекомбинанты PRV, экспрессирующие гликопротеин E1 оболочки вируса холеры свиней, защищали свиней как против псевдобешенства, так и против холеры свиней (классической чумы свиней).
Одним из наиболее важных свойств вакцин является их безопасность. Поскольку точные молекулярные изменения, которые приводят к измененному фенотипу ослабленных обычными способами живых вакцин, как правило, неизвестны, всегда имеется небольшой шанс того, что они могут снова стать вирулентными. Эта проблема может быть исключена путем применения рекомбинантных вакцин, которые несут определенные и стабильные делеции. Однако конструирование стабильно ослабленных вакцин иногда очень затруднительно, если не возможно. В этом случае можно рассчитывать на убитые вакцины или на применение надежных вакцинных векторов. Хорошо приготовленные и испытанные, живые ослабленные делеционные вакцины и вакцинные векторы, как правило, надежны в иммунокомпетентном хозяине. Однако в хозяевах с дефектной системой иммунной защиты могут наблюдаться тяжелые осложнения. Поскольку живые ослабленные вакцины и вакцинные векторы способны размножаться, они могут высвобождаться в среду, в которой они могут создавать угрозу для хозяев с ослабленным иммунитетом. Кроме того, вакцина, которая безопасна для применения в видах-мишенях для вакцины, может быть все еще вирулентной для других видов.
Гены-кандидаты для включения в вакцинные векторы часто кодируют структурные белки вирионов, которые могут обладать высокой иммуногенностью. К таким белкам относятся вирусные гликопротеины, слитные белки и гемагглютинин-нейраминидазы (Hruby, Clin. Microbiol. Rev. 3, 153 - 170 (1990)). Такие белки часто участвуют во взаимодействиях вирус - клетка, которые определяют тропизм вируса в направлении хозяина и(или) клетки. Поэтому экспрессия таких генов вирусом-носителем может теоретически изменять его биологические свойства, такие как патогенность, тканетропизм и специфичность в отношении хозяина. Кроме того, эти измененные биологические свойства могут переноситься посредством гомологичной рекомбинации от ослабленного векторного вируса к вирулентному вирусу дикого типа.
Приведенные выше соображения являются аргументом в пользу развития живых вакцин и вакцинных векторов, которые являются самоограниченными, т.е. которые не распространяются вакцинированными организмами. В идеале такая вакцина должна продуцировать неинфекционное потомство и должна быть неспособной генерировать инфекционный вирус после рекомбинации с соответствующим вирусом дикого типа. Здесь мы описываем изобретение, которое удовлетворяет этим требованиям.
Краткое содержание изобретения
Данное изобретение обеспечивает условно-летальные мутанты вируса псевдобешенства (PRV), которые можно применять для вакцинации против болезни Ауески и которые можно применять в качестве надежных вакцинных векторов. Штаммы изобретения неспособны экспрессировать gp 50, белок оболочки вируса, который существенен для инфекционности вируса. Ген gp 50 был инактивирован либо путем инсерции (вставки) чужеродного олигонуклеотида, либо при помощи делеции или при помощи того и другого (замещения). В частности, ген gp 50 был инактивирован инсерцией синтетического олигонуклеотида, который содержит стоп-кодоны трансляции во всех трех рамках считывания, или делецией части генома PRV, которая содержит как ген gp 50, так и ген gp 63. Эти мутантные вирусы выращивали на комплементирующей клеточной линии, которая экспрессирует вирусный ген gp 50. Потомство вирионов, продуцируемое этими клетками, фенотипически комплементировано, т.е. они обладают gp 50, который обеспечивается комплементирующей клеточной линией. Такие фенотипически комплементированные мутантные вирионы способны инфицировать клетки как in vitro, так и in vivo и способны размножаться и распространяться прямой передачей от клетки к клетке. Однако вирионы потомства, высвобождаемые этими инфицированными клетками, не являются инфекционными, поскольку они не содержат gp 50. Т.к. они не могут инициировать новый цикл инфекции, эти вирусы не могут распространяться из вакцинированного животного к невакцинированному животному. Это ограничение делает (носители) вакцины на основе этих вирусов очень надежными (безопасными).
Таким образом, изобретение касается применения gp 50 мутантов вируса псевдобешенства для приготовления вакцин против болезней животных либо для приготовления вакцины против болезни Ауески, либо для приготовления векторных вакцин против других болезней животных путем включения нуклеотидных последовательностей, кодирующих антигены или часть антигенов из других относящихся к обсуждаемому вопросу патогенов, в эти мутанты.
Изобретение далее касается вакцин для контролирования болезни животных, содержащих вирус псевдобешенства с гликопротеином gp 50 и мутацией в гене gp 50. Такая вакцина может предназначаться для защиты против болезни Ауески, если мутация представляет собой делецию, или для защиты против других болезней животных, если мутация представляют собой инсерцию, содержащую гетерологичную нуклеотидную последовательность, кодирующую антиген или часть антигена из другого патогена, индуцирующего другую болезнь животных. Вирус псевдобешенства может содержать другие мутации в его геноме такие, как делеции и(или) инсерции в генах gp 63, gI, gIII, gX, 11K, в гене тимидинкиназы (TK) рибонуклеотидредуктазы (RR) протеинкиназы или 28K гене, особенно, в генах gI или gp 63.
Детальное описание изобретения
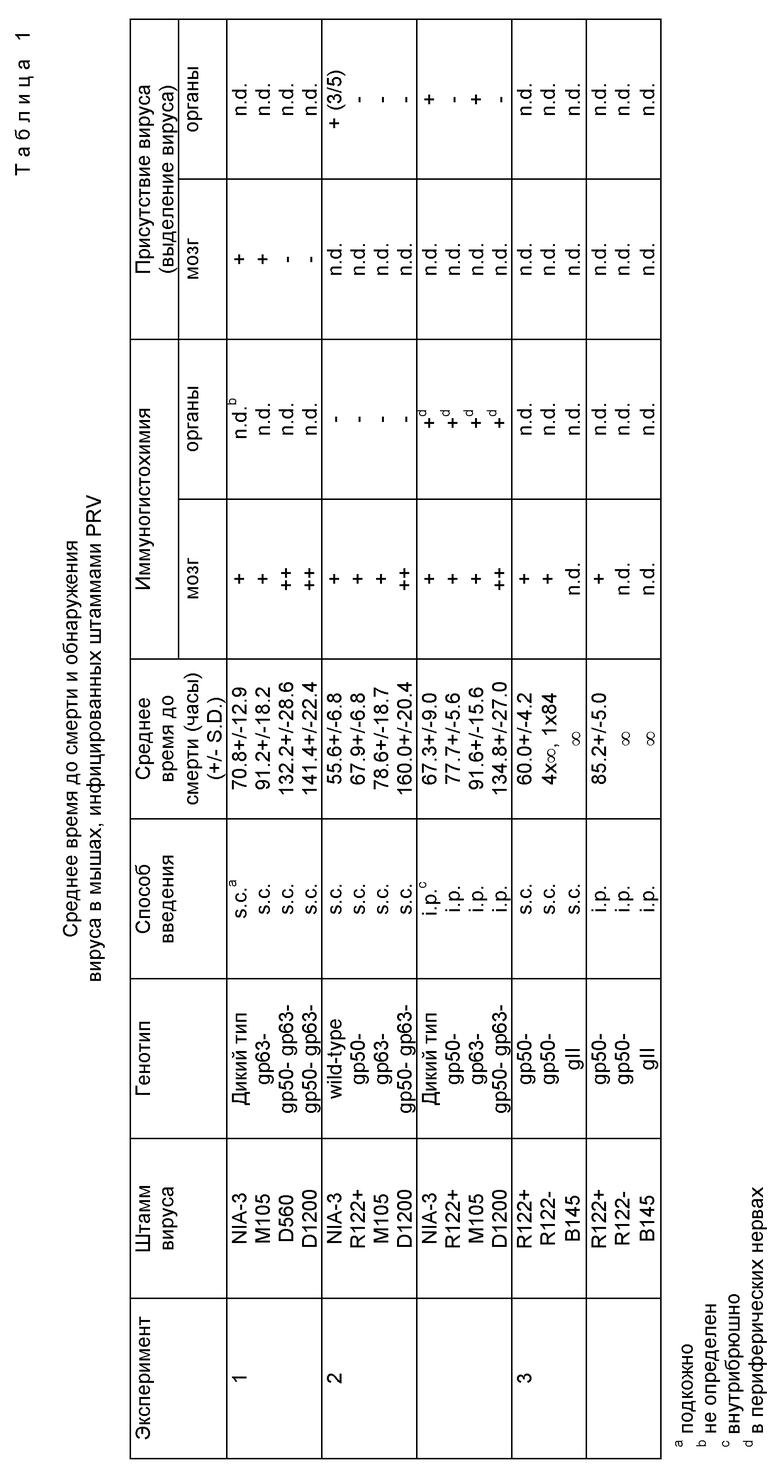
Изобретение касается gp 50 мутантов PRV, представленных штаммами R122, R332, D560 и D 1200 (см. фиг. 1). Штаммы R122 и R332 неспособны экспрессировать функциональный gp 50, тогда как штаммы D560 и D1200 неспособны экспрессировать либо функциональный gp 50, либо функциональный gp 63. Поскольку gp 50 является важным для проникновения вируса, эти мутанты выращивают на комплементирующей клеточной линии, экспрессирующей gp 50. Хотя все штаммы способны завершать полный цикл репликации в некомплементирующих клетках, потомство вирионов, выделяющееся из таких клеток, неинфекционно, т.к. они не содержат gp 50. Наблюдение, что мутанты gp 50 способны образовывать бляшки (стерильные пятна) на некомплементирующих клеточных линиях, свидетельствует о том, что этот вирус может передаваться от инфицированных клеток к неинфицированным.
Синтетический олигонуклеотид с последовательностью 5'-TAGGTAGAATTCTAGCCTA-3' (SEQ 1D N 1), который содержит сайт рестрикции EcoRI (GAATTC) и стоп-кодоны трансляции во всех трех рамках считывания, был встроен в двух разных положениях в ген gp 50 плазмиды pN3HB, как описано de Wind et al. (J. Virol. 64, 4691 - 4696 (1990)) (см. фиг. 1), для получения штаммов PRV R122 и R332. Плазмида pN3HB состоит из фрагмента PRV Hind III - B, клонированного в плазмиде pBR322 (van Zijl et al., J. Virol. 65, 2761 - 2765 (1988)). Полученные плазмиды, в которых олигонуклеотид был встроен между нуклеотидами 366 - 367, 996 - 997 гена gp 50, были названы R1 и 322, соответственно. Мы применяем нумерацию нуклеотидных последовательностей gp 50 последовательности PRV штамма Rice (фиг. 2 Petrovskis et al., J. Virol. 59, 216 - 223 (1986)). Следует заметить, однако, что нуклеотидная последовательность gp 50 гена штамма NIA-3 PRV отличается от последовательности штамма Rice в положении 364 (G вместо A), что приводит к присутствию сайта рестрикции Bgl II в gp 50 гене штамма NIA-3.
Реконституирование (воссоздание) вирусных геномов выполняли посредством перекрывающейся рекомбинации (van Zijl et al., J. Virol. 65, 2761 - 2765 (1988)) с применением комбинации мутагенизированного фрагмента (RI или 322) и трех перекрывающихся субгеномных фрагментов PRV дикого типа, полученных из космид c-178, c-27 и c-443, вместе содержащих полный вирусный геном. Перекрывающуюся рекомбинацию проводили в комплементирующей клеточной линии (клеточная линия G-5), конститутивно экспрессирующей gp 50 (Peeters et al., J. Virol. 66, 894 - 905 (1992)). Полученные вирусные штаммы были названы, соответственно, R122 и R332.
Для получения штамма D560 мы применяли плазмиду 322 (см. выше) и другое производное плазмиды pN3HB, названное 149 (de Wind et al., J. Virol. 64, 4691 - 4696 (1990)), в котором олигонуклетид был вставлен в gp 50 ген между нуклеотидами 352 - 353 (нумерация в соответствии с фиг. 5 Petrovskis et al., J. Virol. 60, 185 - 193 (1986)) (см. фиг. 1). Путем замены Bgl II-EcoRI фрагмента плазмиды 149 Bgl II-EcoRI фрагментом плазмиды 322 получали новую плазмиду, в которой нуклеотидная последовательность между положениями 996 gp 50 гена и 353 gp 63 гена была заменена последовательностью SEQ ID N 1 (т.е., последовательностью мутагенного олигонуклеотида). Эту плазмиду применяли вместе с перекрывающимися фрагментами дикого типа для регенерации вируса перекрывающейся рекомбинацией в G5 клетках. Полученный вирус был назван D560.
Для получения штамма D1200 плазмиду 149 переваривали рестриктазами Bgl II и EcoRI и полученный большой фрагмент делали кольцевым при помощи T4 ДНК-лигазы после обработки концов фрагментов Кленова ДНК-полимеразы I E. coli. В полученной плазмиде нуклеотидная последовательность между положениями 336 gp 50 гена и 353 gp 63 гена была заменена последовательностью AATTCTAGCCTA (SEQ ID N 2; т.е. остатком мутагенного олигонуклеотида). Эту плазмиду применяли вместе с перекрывающимися фрагментами дикого типа для регенерации вируса перекрывающейся рекомбинацией в G5 клетках. Полученный вирус был назван D1200.
gp 50 мутанты R122 и R332 и gp 50 - gp 63 мутанты D560 и D1200 способны образовывать бляшки (стерильные пятна) на некомплементирующих SK6 клетках. Бляшки, образованные на SK6 клетках штаммами R122 и R332, похожи по размерам на бляшки, образованные родительским штаммом дикого типа NIA-3. Бляшки, образованные на SK6 клетках штаммами D560 и D1200, меньше по размеру, что указывает на участие gp 63 в цикле репликации PRV.
Хотя передача от клетки к клетке не зависит от gp 50, не ожидали, что gp 50 мутантные вирусы могут размножаться в заметной степени в живых животных. Вирулентность вирусов обычно является результатом репликации в первичных сайтах инфекции с последующим распространением потомства в виде вирионов к другим частям тела и интенсивным размножением при помощи множественных циклов инфицирования. Поскольку gp 50 мутанты способны реплицироваться только в первичном сайте инфекции, мы ожидали, что эти мутанты не будут вирулентными. Кроме того, были сомнения, являются ли эти мутанты иммуногенными, так как сам gp 50 имеет высокую иммуногенность, что доказано обнаружением того, что gp 50 способен индуцировать защитную иммунную ответную реакцию в свиньях (Marchioli et al., J. Virol. 61, 3977 - 3982 (1987); Mukamoto et al., Vet. Microbiol. 29, 109 - 121 (1991); Riviere et al., J. Virol. 66, 3424 - 3434 (1992)). Поэтому инактивация gp 50 может значительно уменьшать иммуногенные свойства gp 50 и gp 50 + gp 63 мутантов. Также не предполагали, что мутантные вирусы могли бы быть способными достигать центральной нервной системы, т.к. при этом должна была бы происходить передача вируса от инфицированной ткани к периферическим нервам с последующим транспортом к центральной нервной системе. Если транс-синаптический транспорт вируса включает повторную инфекцию пост-синаптических нейронов инфекционными вирионами потомства (Lycke et al., J. Gen. Virol. 65, (1984); Card et al., J. Neurosci. 10, 1974 - 1994 (1990)), то транспорт мутантного вируса к центральной нервной системе может быть блокирован в месте синапсов. Это предотвращало бы вхождение вируса в центральную нервную систему, мешая его уничтожающему действию на патогены в мозгу.
Для определения способности gp 50 мутантных вирусов распространяться в ткани животных мы изучали репликацию gp 50 мутантов R122 и R332 и gp 50 + gp 63 мутантов D560 и D1200 в эксплантатах назальной слизистой оболочки свиней при помощи иммуногистохимии. Кроме того, мышей инфицировали подкожно или внутрибрюшинно для определения, происходит ли репликация и распространение этих вирусов in vivo. Наши результаты показали, что все мутанты способны реплицироваться в назальной слизистой оболочке свиней.
К нашему удивлению gp 50 мутанты и gp 50 + gp 63 мутанты оказались летательными для мышей после внутрибрюшинной или подкожной инокуляции. Вирулентность (выраженная как среднее время до смерти инфицированного животного) штамма R122 была лишь умеренно снижена по сравнению со штаммом дикого типа NIA-3. Однако вирулентность штаммов D560 и D1200 была гораздо больше снижена, свидетельствуя об участии gp 63 в вирулентности для мышей. Исследование post mortem (посмертное) инфицированных животных показало, что мутанты были способны размножаться в мозгу. Иммуногистохимическое исследование органов инфицированных внутрибрюшинно животных показало, что вирус реплицировался преимущественно в периферических нервах. При выращивании штамма R122 на некомплементирующих клетках, не содержащих gp 50, инфекция внутрибрюшинным путем была безуспешной. Это открытие указывает на то, что gp 50 необходим для первичной инфекции. Наблюдение, что фенотипически комплементированный g 11 мутант PRV (который также образует неинфекционное потомство, но не образует бляшек на некомплементирующих линиях) совершенно безвреден для мышей, указывает на то, что после первичной инфекции успешное распространение вируса зависит от переноса его от клетки к клетке. Открытие, что инфекционный вирус не удается выделить из животных, инфицированных gp 50 или gp 50 + gp 63 мутантами, показывает, что вирионы потомства, продуцируемые в живых животных этими мутантами, неинфекционны.
Взятые вместе эти результаты показывают, что gp 50 необходим для первичной инфекции, но не для последующей репликации и передачи вируса, указывая, что прямая передача от клетки к клетке является основным механизмом распространения вируса in vivo. Кроме того, эти результаты указывают на то, что транс-синаптический транспорт вируса не зависит от gp 50 и не приводит к инфекции de novo пост-синаптических нейронов внеклеточными вирионами. Открытие, что инфекционный вирус нельзя было выделить из животных, инфицированных gp 50 или gp 50 ÷ gp 63 мутантами, показывает, что вирионы потомства, продуцируемые в живых животных gp 50 мутантами, неинфекционны. Следовательно, репликация этих мутантов происходит лишь в инфицированных/вакцинированных животных. Применение gp 50 мутанта в качестве основы вакцины против болезни Ауески или в качестве рекомбинатного вируса-носителя для экспрессии гетерологичных генов будет давать очень надежную вакцину, которая реплицируется только в вакцинированном животном и не передается другим животным, в том числе, другим видам. Кроме того, при встраивании гетерологичного гена в положении gp 50 гена в вирусе-носителе рекомбинация с вирусом дикого типа всегда будет приводить к получению неинфекционных рекомбинантов.
Свиньи, вакцинированные gp 50 мутантом R122, были полностью защищены против клинических признаков болезни Ауески после заражения вирулентным штаммом дикого типа NIA-3. Свиньи, вакцинированные gp 5 + gp 63 мутантами D560 и D1200, обнаружили короткие периоды лихорадочного состояния и замедление в росте, но не обнаружили нейрологических признаков после инокуляции NIA-3. Эти результаты показывают, что мутанты PRV, способные распространяться только путем передачи от клетки к клетке, все еще являются высокоимунногенными. Далее эти результаты показали впервые, что экспрессия gp 50, представляющего собой один из наиболее иммуногенных белков PRV (см. выше), не является необходимой для эффективной защиты свиней против болезни Ауески. Этот результат был неожиданным.
Вакцина данного изобретения для предотвращения или контролирования инфекций вируса псевдобешенства (болезни Ауески) содержит PRV, имеющий gp 50 в оболочке вируса и имеющий утративший свою функцию ген gp 50, описанный выше, в качестве активного ингредиента. Кроме того, она содержит обычные компоненты такие, как подходящий носитель, иногда стабилизаторы, адъюванты, солюбилизаторы, эмульгаторы и т.д. Введение этой вакцины может выполняться разными способами, например, интрадермально, подкожно, внутримышечно, внутривенно или интраназально. Предпочтительно интраназальное введение. Вакцина может также содержать другие иммуногены, относящиеся к другим болезням, для получения мультивалентной вакцины.
При применении gp 50 мутанта PRV в качестве вирусного вектора он содержит, кроме мутации в его gp 50 гене, и предпочтительно в виде инсерции (вставки) в его gp 50 ген, генетическую информацию, произведенную из других патогенов, в том числе, вирусов, таких как вирус холеры свиней (чумы свиней), парвовирус, трансмиссивный вирус гастроэнтерита, синдром эпидемического аборта свиней и респираторного синдрома (REARS или MSD "таинственная" болезнь свиней), свиной респираторный вирус (PRCV), вирус свиной эндемической диареи и вирус гриппа, бактерий, таких как Pasteurella multocida, Bordetella bronchiseptiсa, Actinobacillus pleuropneumoniae Streptococcus suis, Treponema hyodysenteria, Escherichia coli и Leptospira, и микоплазм, таких как M.hyopneumoniae и M.lyorhinis. Способы клонирования последовательностей нуклеиновых кислот патогенов в субгеномные фрагменты PRV и последующей интеграции их в геном PRV, в основном, известны. Пример описан van Zijl et al., J. Virol. 62, 2191-2195 (1988).
В то время, как gp 50 мутанты PRV все еще способны распространяться путем трансмиссии от клетки к клетке, мутации в гомологичных генах вируса простого герпеса типа 1 (HSV-1) и вируса герпеса типа 1 быка (BHV-1) приводят к получению вирусных мутантов, которые не способны распространяться передачей от клетки к клетке (Ligas and Johnson, J. Virol. 62, 1486-1494 (1988); Fehler et al., J. Virol, 66, 831-839 (1992)). Это свидетельствует о том, что существуют различия в функции gp 50, с одной стороны, и gD HSV-1 и gIV BHV-1, с другой стороны. При помощи способов рекомбинантных ДНК можно модифицировать HSV-1, BHV-1 и другие вирусы герпеса таким образом, что они будут способны распространяться трансмиссией от клетки к клетке без производства инфекционного потомства, подобно gp 50 мутантам PRV. Это могло бы дать ряд надежных герпесвирусных (носителей) вакцин, которые можно применять для ликвидации очагов инфекции и контроля многих болезней животных и человека.
Описание рисунков
Фиг. 1
Физическая карта части генома PRV. Стрелки указывают положения ранних стоп-кодонов, введенных мутагенезом с инсерцией при помощи линкера, в ген gp 50 и ген gp 63 плазмиды pN 3HB и соответствующие вирусные мутанты R122, R332, M102 и M105 (Peeters et al., J.Virol. 66, 894-905 (1992); de Wind et al. , J.Virol, 64, 4691-4696 (1990)). Горизонтальные полосы показывают положения и уровень делеций в мутантах D560 и D1200. Верхняя линия показывает BstXI-StuI фрагмент PRV, который присутствует в G5 клетках, конститутивно экспрессирующих gp 50 (Peeters et al., J. Virol. 66, 894-905 (1992)).
Фиг. 2
Плазмида pEVhis13HCVEI, содержащая ген E1 вируса холеры свиней (классической чумы свиней) вместе с энхансером/промотором человеческого цитомегаловируса, примененная для конструирования gp 50 мутанта PRV, содержащего гетерологичный ген (см. пример 6).
Фиг. 3
Плазмида pBP53E1, содержащая ген E1 вируса холеры свиней (классической чумы свиней) вместе с энхансером/промотором человеческого цитомегаловируса внутри части генома PRV в сайте делетированного гена gp 50, примененная для конструирования gp 50 мутанта PRV, содержащего гетерологичный ген (см. пример 6).
Пример 1
Клонирование гена gp 50 штамма NIA-3 PRV и конструирование клеточных линий, экспрессирующих gp 50
Все способы рекомбинантных ДНК выполняли согласно стандартным способам (Maniatis et al., Molecular cloning: a laboratory manual. Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York (1982)). Плазмиду pEVhis 14 получали из плазмиды psV2his (Hartman and Mulligan, Proc. Natl, Acad, Sci. USA 85, 8047-8051 (1988)) путем замещения EcoRI-BamHI фрагмента фрагментом, содержащим самый ранний энхансер/промотор человеческого цитомегаловируса (hCMV) (Bernard et al. , EMBNO J. 6, 133-138 (1987)), за которым следует синтетический олигонуклеотид, содержащий стоп-кодоны во всех трех рамках считывания и сайт полиаденилирования. Плазмиду pEVhis 10 получали из плазмиды pEVhis 14 делеций BamHI фрагмента, содержащего энхансер/промотор hCMV. Ген gp 50 PRV клонировали в виде BstXI-Stu 1 франмента (не содержащего промотор gp 50) в сайт EcoRV, расположенный справа от промотора hCMV в pEVhis 14, получая плазмиду pEVhis14 gp 50. Конструирование и характеристика космид с179, с27 и с443, содержащих перекрывающиеся субгеномные фрагменты PRV, и плазмиды pN3HB, содержащей HindIII-B фрагмент PRV в HindIII сайте производного pBR322, описаны (van Zijl et al., J. Virol. 65, 2761-2765 (1988)). Инактивация экспрессии gp 50 при помощи линкерной инсерции в двух различных положениях в гене gp 50 pN3HB (инсерции R1 и 322) описана (de Wind et al., J. Virol. 64. 4691-4696 (1990)).
SK-6-клетки трансфицировали плазмидой pEVhis 14 gp 50 с применением электропорации. SK-6-клетки собирали трипсинизацией, промывали один раз солевым раствором с фосфатным буфером (PBS) при комнатной температуре и ресуспендировали при концентрациях 2 •107 клеток/мл в охлажденном льдом PBS. 10 мкг плазмиды pEVhis 14 gp 50 добавляли к 0,5 мл клеток, хранящихся при 0oC, в стерильную одноразовую кювету для электропорации (0,4 см расстояние внутреннего электрода; BioRad Laboratory), и на установку емкостного сопротивления 25 мкF подавали разряд 1000 вольт при помощи Biorad GenePulser. Клетки оставляли при 0oC в течение 15 минут, переносили в колбу на 75 см3, содержащую 50 мл среды и инкубировали в течение ночи. Затем трансфицированные клетки трипсинизировали и пересевали при нескольких разведениях на чашки Петри (100 мм) в среду, содержащую 2,5 мМ гистидинол. Среду заменяли каждые 3-4 дня, пока колонии не становились отчетливо видимыми (7-10 дней). Отдельные колонии выскребали и выращивали на микротитрационных культуральных планшетах. Экспрессию gp 50 определяли при помощи иммунопероксидазного теста и радиоиммунопреципитацией с применением моноклональных антител G50N2. Клеточная линия, экспрессирующая большие количества gp 50, определенные радиоиммунопреципитацией, назвали G5 (Peeters et al., J. Virol, 66, 894-905 (1992)).
Пример 2
Конструирование мутантных вирусов
Мутантные вирусы R122 и R322 конструировали при помощи перекрывающейся рекомбинации в клетках G5 с применением 3 космид (с-179, с-27 и с-443, описанных van Zijl et al., J. Virol, 65, 2761-2765 (1988)), содержащих перекрывающиеся последовательности PRV дикого типа, и HindIII-B фрагменты производных плазмиды pN3HB RI или 322 (de Wind et al., J. Virol. 64, 4691-4696 (1990)), содержащих мутагенный олигонуклеотид 5'-TAGGCTAGAATTCTAGCCTA-3' (SEQ ID N 1) между положениями нуклеотидов 366-367 и 996-997 в гене gp 50, соответственно (фиг. 1). Вирусные фрагменты выделяли из плазмид перевариванием EcoRI (космид) или перевариванием Hind III (клонов RI и 322) и далее не отделяли от векторных последовательностей. Трансфекцию проводили при помощи электропорации (см. выше) с применением BioRad Gene-Pulser и Capacitance Extender при 250 вольт и 960 мкF соответственно. Клетки высевали на 6-луночные планшеты и после инкубирования в течение 3 часов при 37oC среду заменяли минимальной основной средой Игла, содержащей 2% плодной сыворотки теленка, 1% метилцеллюлозу и инкубировали при 37oC пока не появлялись бляшки (2-3 дня).
Для получения штамма D560 BglII-EcoRI фрагмент плазмиды 149 (производное pN3HB, содержащее мутагенный олигонуклеотид между нуклеотидами 352-353 гена gp 63 (de Wind et al., J.Virol. 64, 4691-4696 (1990); нумерация согласно фиг. 5 Petrovskis et al., J. Virol, 60, 185-193 (1986)) был заменен BglII-EcoRI фрагментом плазмиды 322 (см. фиг. 1). Полученную плазмиду, в которой нуклеотидная последовательность между положениями 996 гена gp 50 и 353 гена gp 63 была заменена последовательностью TAGGCTAGAATTCTAGCCTA (SEQ ID N 1; последовательность мутагенного олигонуклеотида), применяли вместе с перекрывающимися фрагментами дикого типа для регенерации вируса перекрывающейся ремомбинацией в G5 клетках, как описано выше.
Для получения штамма D1200 плазмиду 149 переваривали рестриктазами BglII и EcoRI и полученный больший фрагмент обрабатывали фрагментом Кленова ДНК-полимеразы I E. coli для образования тупых концов с последующим самосшиванием. Полученную плазмиду, в которой нуклеотидную последовательность между положениями 336 гена gp 50 и 353 гена gp 63 заменяли последовательностью AATTCTAGCCTA (SEQ ID N 2; т.е., остаток мутагенного олигонуклеотида), применяли вместе с перекрывающимися фрагментами дикого типа для регенерации вируса посредством перекрывающейся рекомбинации в G5 клетках, как описано выше.
Пример 3
Репликация gp 50 и gp 50 + gp 63 мутантов в эксплантатах назальной слизистой оболочки свиней
Для определения, способны ли эти мутанты также распространяться в ткани животного, мы применяли эксплантаты назальной слизистой оболочки свиней. Эти эксплантаты предоставляют природную комбинацию эпителиальных клеток и стромальных фибробластов, и было показано, что инфицирование таких эксплантатов близко имитирует инфекцию in vivo назальной слизистой оболочки (Pol et al. , Res. Vet. Sci, 50, 45-53 (1991)). Эксплантаты инфицировали штаммом NIA-3 PRV дикого типа, gp 50 мутантами с линкерными инсерциями R122 и R332 и gp 50 + gp 63 мутантами с делециями D1200 и D560.
Иммуногистохимическое исследование через 24 часа после инфицирования с применением кроличьей сыворотки против PRV (Pol et al., Res. Vet. Sci. 50, 45-53 (1991)) инфицированных эксплантатов слизистой оболочки показало, что вирус NIA-3 дикого типа распространялся на большие зоны эпителиальных клеток. Подобные результаты были получены с gp 50 мутантами R122 и R322 и gp 50 + gp 63 мутантами D1200 и D560. После 24 часов инфекции репликация вирусов была почти исключительно в эпителиальных клетках. Однако все штаммы были способны инфицировать подстилающие фибробласты после длительных периодов инкубации. Дифференциальное иммунологическое окрашивание с применением кроличьей антисыворотки против PRV и моноклональных антител (G50N2, специфических для gp 50) подтвердило, что gp 50 не экспрессировался gp 50 + gp 63 мутантами или gp 50 мутантами. Эти наблюдения показывают, что gp 50 неважен для распространения вируса в назальной слизистой оболочке свиней.
Пример 4
Вирулентность gp 50 и gp 50 + gp 63 мутантов в мышах
a. gp 50 + gp 63 null мутанты летальны для мышей
Наблюдение, что gp 50 мутанты были способны реплицироваться и распространяться в тканевых эксплантатах, позволило предположить, что они также способны реплицироваться и распространяться в живых животных. В качестве тест-животных были выбраны мыши, поскольку они высокочувствительны к герпес-вирусам и часто применялись в качестве модельной системы для исследования вирулентности и нейронного распространения (Fraser and Ramachandran, J. Comp. Path, 79. 435-444 (1969); Cook and Stevens, Infect. Immun. 7, 272-288 (1973); Field and Hill, J.Gen. Virol. 23, 145-157 (1974), Field and Hill, J. Gen Virol. 26, 145-148 (1975); Kristenson et al., Brain Res. 69, 189-201 (1978); Platt et al., Arch. Virol, 63, 107-114 (1980); Dix et al., Infect. Immun. 40, 103-112 (1983)).
В первом эксперименте мы применяли gp 50 + gp 63 мутанты с делециями D560 и D1200 вместо мутантов R122 или R332 с линкерными инсерциями для исключения присутствия ревертантов дикого типа в инокуляте. Такие ревертанты могут появляться в линиях мутантов с линкерными инсерциями в результате гомологичной рекомбинации вирусных последовательностей, присутствующих в комплементирующей клеточной линии и вирусном геноме (Cai et.al., J. Virol. 62 2596-2604 (1988); Peeters et al., J. Virol. 66, 3388-3892 (1992)). Поскольку последовательности на 3'-стороне gp 50 + gp 63 делеции штаммов D560 и D1200 не имеют гомологичной копии в комплементирующих G5 клетках (фиг. 1), образование ревертантов дикого типа должно быть невозможным во время репликации этих мутантов в комплементирующих G5 клетках.
Пять 6-8-недельных самок BALB/c мышей (Charles River, Suldzfeld, FRG) инфицировали подкожно в шею 105 бляшкообразующих единиц штаммов NIA-3, D560, D-1200 и gp 63 мутанта М105. Мыши, инокулированные штаммом NIA-3, обнаружили тяжелые симптомы болезни Ауески, такие как сильное расчесывание задними ногами, "умывание лица" и паралич, и умирали приблизительно через 70 часов после инфицирования. Животные, инфицированные штаммом M105, не обнаружили сильного зуда, но сидели далеко друг от друга с согнутой спиной и увеличенной скоростью дыхания. Эти животные умерли приблизительно через 90 часов после инфицирования. Мыши, инфицированные штаммами D560 или D1200, обнаружили симптомы, подобные симптомам животных, инфицированных штаммов M105. Они стали апатичными и обнаруживали признаки паралича перед вступлением в агонирующее состояние, которое иногда длилось до 42 часов, пока животные не умирали приблизительно через 130-140 часов после инфицирования (таблица 1, эксперимент 10). Эти результаты показывают, что gp 50 + gp 63 nu11 мутанты все еще летальны для мышей. Их вирулентность однако значительно снижена по сравнению с вирусом дикого типа или gp 63 мутантом вируса.
b. gp 50 + gp 63 null мутанты способны доходить до центральной нервной системы и реплицироваться в ней
Поскольку симптомы нейрологических нарушений были гораздо менее очевидны в мышах, зараженных gp 63 или gp 50 + gp 63 мутантами, по сравнению с мышами, инфицированными штаммом NIA-3, мозг инфицированных животных исследовали на присутствие вируса при помощи иммуногистохимии. Криостатные срезы мозга и органов инфицированных мышей фиксировали и обрабатывали для иммуногистохимии, как описано ранее (Pol et al., Microb Path. 7, 361-371 (1989)). При применении моноклональных антител против gp 50 в качестве первичных антител во втором инкубировании использовали козьи антимышиные IgG антитела, конъюгировали с пероксидазой (Peeters et al., J. Virol. 66, 894-905 (1992)).
К нашему удивлению, мы наблюдали большие количества инфицированных нейронов в срезах мозга мышей, инфицированных D1200 и D560, тогда как лишь небольшие количества инфицированных нейронов присутствовали в срезах мозга мышей, инфицированных NIA-3 или M105. Вирус, который присутствовал в мозгу животных, инфицированных D1200 и D560, не экспрессировал gp 50, как определено дифференциальным окрашиванием с применением кроличьей антисыворотки против PRV (Pol et al., Res. Vet. Sci, 50, 45-53 (1991)). При выделении вируса из мозга и титровании на SK-6 клетках инфекционный вирус легко извлекался из животных, инфицированных NIA-3 или M105, но не из животных, инфицированных D560 или D1200 (таблица 1, эксперимент 1). Эти результаты показывают, что gp 50 + gp 63 null мутанты, которые неспособны продуцировать инфекционное потомство, все еще способны достигать центральной нервной системы и реплицироваться в ней.
c. gp 50 null мутанты обладают высокой вирулентностью
Хотя gp 63 необязателен для вирусного роста (Petrovskis et al., J. Virol. 60, 1166-1169 (1986)), бляшки, продуцируемые на комплементирующих G5 клетках и некомплементирующих
SK-6 клетках gp 50 + gp 63 мутантами, были гораздо меньше, чем бляшки, образуемые gp 50 мутантами. Кроме того, gp 63, как было показано, участвовал в вирулентности в свиньях (Kimman et al., J. Gen Virol. 73, 253-251 (1992)). Поскольку эти открытия предполагают, что gp 50 мутанты более вирулентны, чем gp 50 + gp 63 мутанты, мы также хотели исследовать вирулентность gp 50 мутантов в мышах. Однако для применения gp 50 мутанта для инфицирования мышей мы должны были быть абсолютно уверены в том, что инокулят не содержит ревертантов дикого типа (см. выше). Культуру фенотипически комплементированного вируса R122, которая была фактически свободна от ревертантов дикого типа, готовили инфицированием SK-6 клеток одной бляшкой, образуемой R122 на G5 клетках. Вирусную ДНК выделяли из инфицированных SK-6 клеток и применяли для трансфекции монослоев G5 клеток (которые имеют значительно сниженную эффективность для засева PRV (Peeters et al., J. Virol. 66, 894-905 (1992)). Из трансфицированных клеток готовили вирусную культуру, которая содержала 2,1•107 бляшкообразующих единиц pfu/мл, как определено титрованием на SK-6 клетках. Эта культура была названа R122-, что указывает, что она произведена из некомплементирующих клеток, содержащих 150 pfu/мл. Однако, когда мы проводили иммунопероксидазное окрашивание с применением моноклональных антител против gp 50 (Peeters et al., J. Virol. 66, 894-905 (1992)), оказалось, что эти бляшки были gp 50-отрицательны. Это открытие указывало на то, что эта вирусная линия не содержала вируса дикого типа, но все еще содержала какое-то количество инфекционных вирусных частиц. Возможно, что эти частицы происходили из инокулята (R122+), который применяли для получения культуры R122-. Альтернативно, потомство вирионов может быть способно повторно включать gp 50, который был депонирован в плазменной мембране SR-6 клеток инфицирующими R122+ вирионами. Другая возможность заключается в том, что вирионы, не содержащие gp 50, поглощаются в результате эндоцитоза (Campadelli-Fiume et al., J. Virol. 62, 159-167 (1988)) и случайно избегают деградации, приводя к продуктивному инфицированию. Физический титр R122+- и R122--линий определяли при помощи электронной микроскопии с применением гранул из латекса (диаметр 91 нм; Serva) в качестве внутреннего стандарта.
Кроме исследования вирулентности R122+, мы также определяли, зависит ли вирулентность различных вирусов от пути введения инфекции. Группы из пяти мышей инокулировали 105 pfu штаммов NIA-3, M105, R122+ и D1200 подкожной или внутрибрюшинной инъекцией. Мыши, инфицированные штаммом R122+, обнаружили признаки болезни Ауески, которые были подобны признакам, обнаруженным у животных, инфицированных NIA-3 (см. выше). В животных, инфицированных подкожно NIA-3, первые симптомы становились видимыми приблизительно при 34-40 часах после инфицирования, а в животных, инфицированных подкожно R122+, - при 42 часах после инфицирования. Животные умерли приблизительно через 56 и 68 часов после инфицирования, соответственно (таблица 1, эксперимент 2). Эти результаты показали, что gp 50 мутант R122+ был все еще высоковирулентным для мышей и был гораздо более вирулентным, чем gp 50 + gp 63 мутант D1200 или gp 63 мутант M105. Внутрибрюшинная инъекция штаммов NIA-3, R122+ и M105 приводила к среднему времени до смерти, которое было приблизительно на 10-13 часов больше по сравнению с таковым для подкожной инъекции (таблица 1, эксперимент 2). Для всех испытанных штаммов симптомы и клинические признаки не зависели от способа инфицирования. Таким образом, хотя существуют различия во временном ходе инфекции, оба способа инокулирования приводят к летальной инфекции. Вирус детектировали иммуногистохимией в срезах мозга все животных, примененных в эксперименте 2 (таблица 1). Опять-таки, репликация вируса была гораздо более интенсивней в мозгу животных, инфицированных D1200 по сравнению с животными, инфицированными NIA-3, R122+ или M105.
d. Предпочтительная репликация вируса в периферических нервах инфицированных органов
При исследовании органов на присутствие вирусных антигенов при помощи иммуногистохимии вирусные антигены могли быть обнаружены только в животных, которых инфицировали внутрибрюшинно. Вирус обнаруживали в печени, селезенке, почках, кишечнике и надпочечниках, но не в легких. Вирусная инфекция в органах полностью ограничивалась нервными волокнами. Это наблюдение указывает на то, что нервная ткань является предпочтительным местом инфекции и репликации PRV, и предполагает, что вирус транспортируется из органов к центральной нервной системе при помощи катаболического транспорта по аксонам, как это было показано ранее (Cook and Stevens, Infect. Immun. 7, 272-288 (1973); Field and Hill, J. Gen Virol, 23, 145-157 (1974), Field and Hill J. Gen Virol. 26, 145-148 (1975); MeCracken et al., J. Gen Virol. 20, 17-28 (1973); Strack and Loewy, J. Neurosci, 10, 2139-2147 (1990); Сard et al. , J. Neurosci. 10,1974-1994 (1990)). Наблюдение, что gp 50 null мутант эффективно транспортируется к центральной нервной системе, свидетельствует о том, что нейронный транспорт не зависит от присутствия gp 50.
Инфекционный вирус был извлечен из экстрактов органов животных, которые были инфицированы внутрибрюшинно штаммами NIA-3 и M105. Как и ожидалось, инфекционный вирус не был выделен из животных, инфицированных R122+ или D1200, что еще раз доказывает неэффективность потомства этих вирусов. Неожиданно 3 из 5 животных, подкожно инфицированных штаммом NIA-3, дали инфекционный вирус после титрования экстрактов органов (таблица 1, эксперимент 2). Это могло бы означать, что этот вирус транспортируется из центральной нервной системы в эти органы. Отсутствие инфекционного вируса в органах мышей, инфицированных подкожно штаммом M105, возможно, указывает на то, что произошла задержка в транспорте этого вируса.
e. gp 50 необходим для первичной инфекции in vivo
Наши результаты in vitro, которые показали, что gp 50 необходим для проникновения, но не для распространения от клетки к клетке (Peeters et al., J. Virol. 66, 894-905 (1992)), предполагают, что то же самое имеет место в случае инфекции in vivo. Хотя возможность того, что gp 50 не важен для проникновения in vivo, очень маловероятна, мы должны были доказать формально, что и в этом случае gp 50 также необходим для первичной инфекции. Для исследования участия gp 50 применяли линию R122, росшую на некомплементирующих SR-6 клетках и, поэтому, не содержащую gp 50 (R122-; см. выше). Т.к. 105 pfu R122+ соответствовали 3,3 • 106 физических частиц, мы применяли такое же количество частиц R122- для инокулирования мышей. Как и ожидалось, все мыши, инъецированные внутрибрюшинно или подкожно, R122+, умерли (таблица 1, эксперимент 3). Однако все мыши, инфицированные R122-, выжили после внутрибрюшинной инфекции, тогда как одна из пяти мышей умерла после подкожной инфекции. Эти результаты указывают на то, что присутствие gp 50 в оболочке вируса необходимо для успешного инфицирования животных.
Исследование животного, которое умерло после инфицирования R122-, показало, что вирус присутствовал в мозгу, т.е. инфекционный вирус все еще присутствовал в инокуляте. При титровании инокулята в двух повторностях на некомплементирущих SK-6 клетках мы обнаружили 9 и 16 бляшек, соответственно. Как было определено иммуногистохимией, эти бляшки были образованы gp 50 мутантами. Возможное происхождение этих инфекционных вирионов обсуждалось выше. Т. к. LD50 штамма NIA-3 PRV после внутрибрюшинной инфекции составляет приблизительно 70 pfu (бляшкообразующих единиц), возможно, что частицы инфекционного вируса, присутствующие в инокуляте R122-, ответственны за летательную инфекцию одной умершей в этом варианте мыши.
f. Вирус, неспособный продуцировать инфекционное потомство и неспособный распространяться трансмиссией от клетки к клетке, является невирулентным для мышей
Ранее мы показали, что подобно gp 50 null мутантам репликация gII или gH null мутантов PRV в некомплементирующих клеточных линиях приводила к образованию неинфекционных вирионов (Peeters et al., J. Virol. 66, 894-905 (1992); Peeters et al., J. Virol. 66, 3388-3892 (1992)). Однако в противоположность gp 50 мутантам gII и gH мутанты не были способны образовывать бляшки на некомплементирующих клетках. Это открытие указывает на то, что gII и gH необходимы для трансмиссии этого вируса от клетки к клетке. Для выяснения, является ли трансмиссия от клетки к клетке также необходимым условием для успешного распространения вируса in vivo, мы использовали фенотипически комплементированный gII null мутант B145 PRV (Peeters et al., J. Virol. 66, 894-905 (1992)) для инфицирования мышей. При инъецировании мышей внутрибрюшинно или подкожно 105 pfu B145 вируса ни одно из животных не обнаружило какого-либо из симптомов болезни Ауески (таблица 1, эксперимент 3). Этот результат свидетельствует о том, что вирус, который неспособен продуцировать инфекционное потомство и неспособен распространяться трансмиссией от клетки к клетке, является невирулентным для мышей.
Пример 5
Вирулентность и иммуногенность gp 50 мутантов и gp 50 + gp 63 мутантов в свиньях
Для исследования вирулентности и иммуногенности мутантных штаммов свиней инокулировали штаммами R122+, D560 и D1200. Штамм M209 дикого типа и gp 63 мутант M102 (фиг. 1) (Kimman et al., J. Gen Virol, 73, 243-251 (1992)) служили в качестве контроля. После иммунизации животных заражали вирулентным штаммом NIA-3 PRV.
Группы из 5 4-6-недельных свиней (Dutch landrace свиньи из несодержащего специфических патогенов стада Центрального Ветеринарного института) инфицировали интраназально 105 pfu вируса путем медленного введения 0,5 мл суспензии вируса в каждую ноздрю при вдохе. Через 4 недели после вакцинации свиней заражали интраназально 105 pfu вирулентного штамма NIA-3 PRV. Свиней обследовали на присутствие клинических признаков дважды в день и измеряли ректальную температуру ежедневно. Три раза в неделю свиней взвешивали. Для каждой свиньи определяли число дней угнетения роста, лихорадочного состояния и нейрологические признаки. Период угнетения роста определяли как число дней, необходимое для восстановления веса животного в день заражения. Лихорадочное состояние определяли как ректальную температуру, превышающую 40oC. Нейрологическими признаками считали зуд, атаксию, паралич, тремор и конвульсии (судороги).
Свиньи, инфицированные штаммом M209 дикого типа, развили признаки, типичные для болезни Ауески, такие как лихорадочное состояние, потеря аппетита, задержка роста и нейрологические признаки, такие как атаксия и паралич (таблица 2). Мутанты R122+ и M102 вызвали короткие периоды лихорадочного состояния и задержки роста, но не вызвали нейрологические симптомы. Мутанты D560 и D1200 не вызвали появления нейрологических признаков, а также жара или задержки роста. Эти результаты указывают, что gp 50 - gp 63 мутанты D560 и D1200 были совершенно авирулентны для свиней, тогда как gp 50 мутант R122+ и gp 63 мутант M102 имели значительно уменьшенную вирулентность по сравнению с PRV дикого типа.
Свиньи, вакцинированные штаммами R122+ и M102, не обнаружили жара или задержки роста и не обнаружили никаких клинических признаков после заражения NIA-3 (таблица 3). Свиньи, вакцинированные D1200, обнаружили короткие периоды лихорадочного состояния и задержки роста, но не обнаружили нейрологических признаков, хотя животные были вялыми в течение нескольких дней и двух свиней рвало. Свиньи из невакцинированной контрольной группы обнаружили тяжелые признаки болезни Ауески и относительно длительные периоды лихорадочного состояния и задержки в росте; две свиньи умерли (таблица 3). Эти результаты показывают, что свиньи, вакцинированные gp 50 мутантом R122+ и gp 63 мутантом M102, были полностью защищены против клинических признаков болезни Ауески, тогда как свиньи, вакцинированные gp 50 + gp 63 мутантами D560 и D1200, были частично защищены против клинических признаков болезни Ауески.
Эти примеры показывают, что gp 50 PRV имеет значение для инфекционности вируса (проникновения), но не для трансмиссии от клетки к клетке. Фенотипически комплементированные gp 50 мутанты и gp 50 + gp 63 мутанты были способны реплицироваться и распространяться в инфицированных животных. Однако потомство вируса, выделяющееся из инфицированных клеток, является неинфекционным и, следовательно, инфицированные животные неспособны распространять инфекционный вирус. Это свойство вместе с широким диапазоном хозяев PRV и способностью переносить большие количества чужеродной ДНК делает gp 50 мутанты PRV идеально пригодными для приготовления надежных вакцин-носителей против болезни Ауески и других болезней животных.
Пример 6
Конструирование gp 50 мутанта с делецией, экспрессирующего гликопротеин оболочки EI вируса холеры свиней (чумы свиней)
Для испытания, может ли gp 50 мутант с делецией быть применен в качестве векторного вируса для экспрессии гетерологических генов, gp 50 ген штамма NIA-3 PRV был заменен фрагментом ДНК, содержащим ген EI Hоg Cholera Virus (HChV= классическая чума свиней) под транскрипционным контролем промотора hCMV.
Фрагмент ScaI-DraI (сайт ScaI в положении 317-322 гена gX, нумерация нуклеотидной последовательности Rea et al., J. Virol. 54, 21-29 (1985); сайт Dral в положении 1181-1186 между генами gp 63 и gI, нумерация нуклеотидной последовательности Petrovskis et al., J. Virol. 60, 185-193 (1986)) из Us района PRV клонировали в затупленном NdeI сайте плазмиды pVC19M (Clontech). При помощи сайт-специфического мутагенеза in vitro (Transformer kit, Clontech) были созданы сайты узнавания уникальными рестриктазами непосредственно впереди гена gp 50 и сразу же позади гена gp 50. С применением мутагенных праймеров 5'-AGGTTCCCATACACTAGTCCGCCAGCGCCATGC-3'(SEQ ID N 3) и 5'-CCCGGTCCGTAGCCTAGGCAGTACCGGCGTCG-3' (SEQ ID N 4) были созданы последовательности узнавания для рестриктаз SpeI (ACTAGT) и AvrII (CCTAGG) в положениях от -17 до -12 и от 1210 до 1215, соответственно (нумерация нуклеотидной последовательности гена gp 50 согласно Petrovskis et al., J. Virol. 59, 216-223 (1986)). Ген gp 50 был делетирован перевариванием плазмидной ДНК рестриктазами SpeI и AvrII и был заменен синтетическим фрагментом SpeI-AvrII, содержащим последовательности узнавания для рестриктаз EcoRI, EcoRV и HindIII (синтетический фрагмент ДНК был получен отжигом (гибридизацией) эквимолярных количеств двух одноцепочечных олигонуклеотидов с последовательностями 5'-CTAGTAATTCGATATCAAGCTTC-3' (SEQ ID N 5) и 5'-CTAGGAAGCTTGATATCGAATTCA-3' (SEQ ID N 6), соответственно. Затем NcoI-PstI фрагмент (NcoI сайт в положении 883-888 гена) gX, нумерация нуклеотидной последовательности Rea et al. , J. Virol. 54, 21-29 (1985); PstI сайт в положении 439-444 гена gp 63, нумерация нуклеотидной последовательности Petrovskis et al., J. Virol. 60, 185-193 (1986)), содержащий делецию gp 50, был клонирован в плазмиде pG EM5Zf(+) (Promega) после переваривания последней плазмиды NcoI и PstI. Полученная плазмида была названа pBP53.
EI ген HChV был получен из кДНК клона штамма Brescia HChV (Moormann et al. , Virology 177, 184-198 (1990)). Этот ген клонировали в виде DsaI-EcoRV фрагмента Dsal сайт заполняли фрагментом Кленова ДНК-полимеразы IE. coli; нуклеотиды 2337-3804 согласно нумерации нуклеотидной последовательности Moormann et al., Virology 177, 184-198 (1990)) между сайтом EcoRI (заполненным фрагментом Кленова ДНК-полимеразы IE. coli) и сайтом EcoRV плазмиды pEVhis 13. Последняя плазмида произведена из плазмиды pSV2his (Hartman and Mulligan, Proc. Natl. Acad. Sci. USA 85, 8047-8051 (1988)), которая содержит промотор hCMV, за которым идет стартовый кодон ATG, и ряд уникальных сайтов рестрикции и стоп-кодоны трансляции во всех трех рамках считывания (Peeters et al. , J. Virol. 66, 894-905 (1992); также см. пример 1). В полученной плазмиде EI ген слит в одной рамке считывания со стартовым кодоном pEVhis13. Эта плазмида была названа pEVhis13 HCVEI (фиг. 2). После переваривания плазмиды pEVhis13 HCVEI рестриктазами HpaI и PstI, выделяли фрагмент, который содержал промотор hCMV, EI ген и стоп-кодоны трансляции. HpaI-PstI фрагмент обрабатывали T4 ДНК-полимеразой для образования тупых концов и затем клонировали в EcoRV сайт pBP53. Плазмида, в которую этот фрагмент был встроен в такой ориентации, что направление транскрипции EI гена было подобно направлению транскрипции gX и gp 63 генов pBP53, была выделена и названа pBP53 EI (фиг. 3).
Для выяснения, правильно ли клонирован EI ген, проводили временную экспрессию EI в G5 клетках. Клетки трансфицировали плазмидой pBP5XEI или плазмидой pEVhis13 HCVEI с применением липофектина (GIBCO BRL). После 2 дней монослои клеток фиксировали и экспрессию EI тестировали иммунологическим окрашиванием с применением моноклональных антител 3 и 4, конъюгированных с пероксидазой хрена, специфических для гликопротеина EI HChV (Wensvoort, J. Gen. Virol. 70, 2685-2876 (1989)). Экспрессия EI клетками, трансфицированными pBP53 EI, была ясно видимой и окрашивание было даже более интенсивным, чем окрашивание клеток, трансфицированных pEVhis13 HCVEI. Эти результаты показали, что EI эффективно экспрессировался внутри pBP53 EI, т.е., при фланкировании последовательностями PRV.
Плазмиду pBP53 EI переваривали плазмидами PvuII и PstI и ко-трансфицировали вместе с вирусной ДНК штамма NIA-3 PRV в G5 клетки с применением липофективна. Через два дня, когда бляшки были хорошо видимыми, монослои фиксировали и иммунологически окрашивали, как описано выше, для теста временной экспрессии. Присутствие окрашенных бляшек показало, что EI ген переносился в вирусный геном посредством гомологичной рекомбинации, и что EI ген экспрессировался рекомбинантными вирусами. Для выделения рекомбинантного вируса эксперимент с трансфекцией повторяли и выделили 400 отдельных бляшек. Для идентификации рекомбинантов, экспрессирующих EI, часть этих изолятов переносили на микротитрационные планшеты, содержащие SK-6 клетки. После инкубирования в течение 2 дней бляшки были видимыми и инфицированные монослои фиксировали и тестировали на экспрессию EI иммунологическим окрашиванием. Наконец, рекомбинантный вирус, экспрессирующий EI, был очищен из бляшек из исходных изолятов, которые давали окрашенные бляшки на SK-6 клетках.
Было показано, что рекомбинантный вакцинный штамм PRV, экспрессирующий EI HChV, защищает свиней от классической чумы свиней после заражения HChV (van Zijl et al., J. Virol. 65, 2761-2765 (1991)). На основе этих открытий нетрансмиссивный экспрессирующий EI gp 50 мутант с делецией, описанный выше, также будет способен индуцировать защитную иммунную ответную реакцию против классической чумы свиней в свиньях.


Изобретение обеспечивает получение вакцины для предотвращения и контролирования болезней животных, включающих вирус псевдобешенства. Вакцина пригодна для применения против болезни Ауески (псевдобешенства) или против других болезней животных, если мутация представляет собой инсерцию (вставку), содержащую гетерологичный ген, кодирующий антиген, соответствующий данной болезни животного. Вирус псевдобешенства может дополнительно иметь, по меньшей мере, одну мутацию в одном из его других генов, таких как ген gp63 или ген gl. Этот вирус не может передаваться от вакцинированных к невакцинированным животным. Аттенуированный вирус можно вводить интраназально, что обеспечивает лучшую защиту животного. 3 с. и 1 з.п. ф-лы, 3 ил., 3 табл.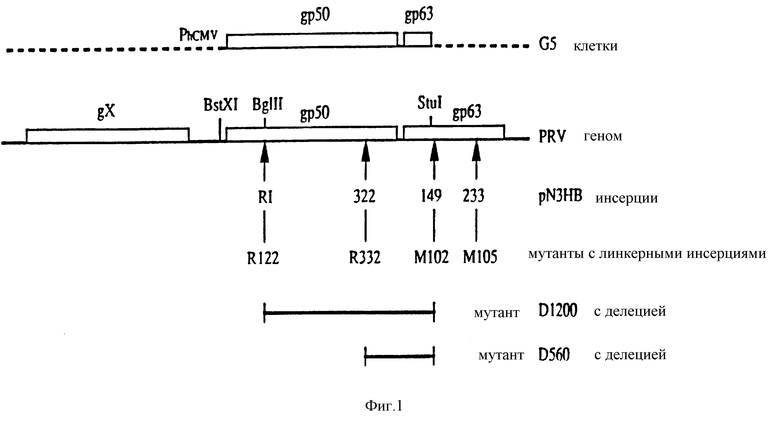
| СИСТЕМА ИЗМЕРЕНИЯ ПОЛОЖЕНИЯ ПОРШНЯ ГИДРОЦИЛИНДРА НАЖИМНОГО УСТРОЙСТВА ПРОКАТНОЙ КЛЕТИ | 1998 |
|
RU2152279C1 |
| EP 0243155 A2, 28.10.1987 | |||
| WO 9207945 A, 14.05.1992 | |||
| WO 9102795 A, 07.03.1991. | |||
Авторы
Даты
2000-10-27—Публикация
1993-07-08—Подача