Изобретение относится к способам борьбы со злокачественными опухолями, в частности, оно касается способа подавления роста раковой опухоли.
Одним из известных способов подавления роста злокачественных опухолей является так называемая фотодинамическая терапия (ФДТ) [1]. ФДТ осуществляется следующим образом: опухоленосителю системно или местно вводят фотосенсибилизатор (ФС), например сульфированный фталоцианин алюминия в дозе 0,25-6,0 мг/кг массы тела в условиях полузатемненного помещения. Через 48-72 ч осуществляют лазерное облучение при длине волны до 675 нм. В зависимости от локализации и размеров опухоли могут быть применены три способа подведения лазерного облучения к пораженному участку ткани: поверхностное облучение, внутритканевое облучение с внедрением специально сконструированного диффузора в опухолевую ткань, смешанное облучение (сочетание поверхностного и внутритканевого).
Этот способ довольно результативен, но имеет ряд существенных недостатков:
- системное введение фотосенсибилизатора может привести к его накоплению в здоровых органах, что чревато возникновением солнечных ожогов;
- эндоскопическая транспортировка источника лазерного облучения может быть причиной механического повреждения биологических тканей, в том числе больного органа;
- при фотодинамическом воздействии in vivo при облучении тканей опухоли пациент часто чувствует боль, что требует дополнительной местной анестезии;
- фотодинамическое воздействие in vivo не дает возможности разработать воспроизводимую процедуру в силу неравномерного накопления фотосенсибилизатора в тканях, неравномерности собственно светового облучения из-за механического смещения световода во время процедуры.
Задачей предлагаемого изобретения являлось изыскание такого способа подавления роста раковой опухоли, который сочетал бы результативность с достаточной безопасностью для опухоленосителя.
Для решения этой задачи предложен способ подавления роста раковой опухоли, в соответствии с которым у опухоленосителя берут часть опухоли, подвергают ее фотодинамическому воздействию in vitro с применением в качестве ФС сульфированного фталоцианина алюминия и после этой обработки вводят в организм опухоленосителя.
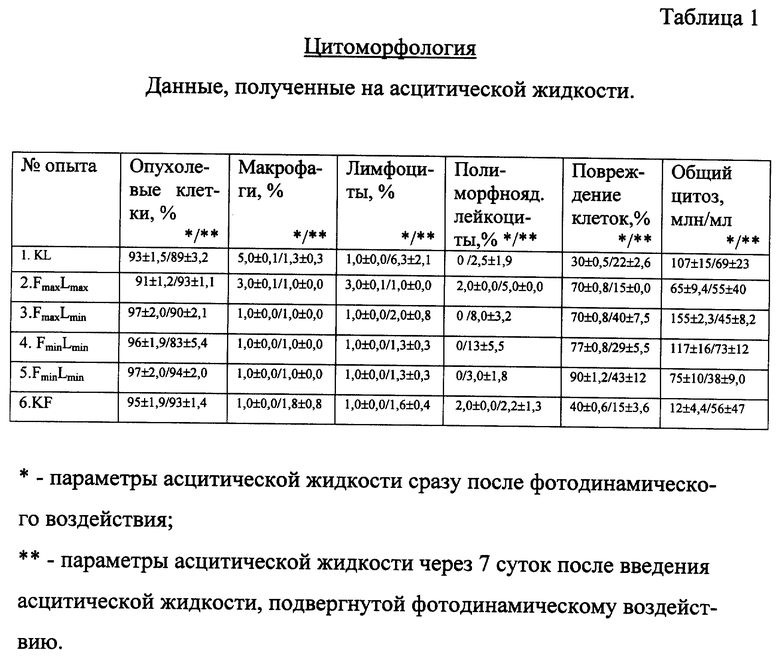
Эффективность предложенного воздействия на карциному Эрлиха (как в асцитной, так и в солидной форме) проверялась по двум основным группам показателей: цитоморфологическим и иммунологическим, методики осуществления которых приведены ниже.
Методика осуществления цитоморфологических исследовании
Мазок для микроскопической оценки цитоза и патоморфологических исследований готовился из цельной асцитической жидкости с добавлением гепарина 15-30 ед/мл и крови с добавлением ЭДТА 1,5 мг/мл. Окраска осуществлялась азурэозином (по Романовскому). Общее количество асцитической жидкости определялось в мерной пробирке. Цитоз подсчитывался в камере Горяева. Подсчитывался процент опухолевых клеток, макрофагов, лимфоцитов, нейтрофилов и поврежденных клеток.
Подготовка образцов из солидной опухоли включала в себя консервацию образцов в парафине, нарезку их на микротоме и окраску гематоксилинэозином.
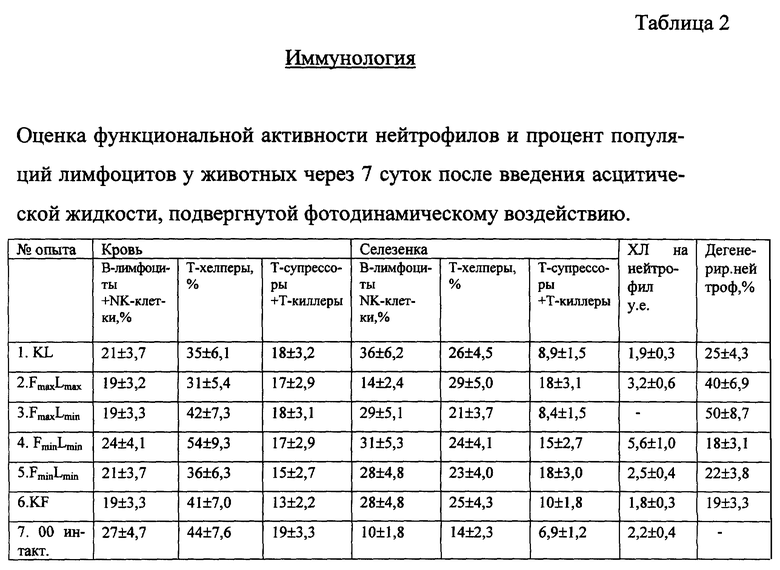
Методика проведения иммунологических исследований
Определение популяций лимфоцитов
Для анализов от лабораторных животных была взята венозная кровь 2 мл (ЭДТА 1,5 мг/мл) и селезенка (отфильтрованный гомогенат 0,5-1 мл, PBS буфер до 10-15 мл).
Суспензию белых клеток из периферической крови донора готовили следующим образом: 0,5 мл крови, взятой на ЕДТА (5 мМ), добавляли в центрифужную пробирку с 50 мл лизирующего раствора (8,26 г/л хлорида аммония, 1 г/л бикарбоната натрия, 0,037 г/л ЭДТА, pH 7.5). Через 10 мин инкубации при комнатной температуре после завершения лизиса эритроцитов пробирку центрифугировали при 200g в течение 10 мин. Осадок клеток отмывали один раз 50 мл изотонического раствора хлорида натрия с фосфатным буфером pH 7,5 и 5 ммоль/л ЭДТА (отмывающий раствор), а затем ресуспензировали в том же растворе с добавкой 1% бычьего альбумина и 0.1% азида натрия (раствор для инкубации) до концентрации лимфоцитов 1 млн/мл. Инкубацию клеток с антителами проводили в полиэтиленовых пробирках объемом 1,2 мл.
На одну пробу брали 20 мкл суспензии клеток, по 5 мкл антител и тестируемого образца. Клетки инкубировали с первичными антителами в течение 40-60 мин при 37oC. Для отмывания добавляли в каждую пробирку 1 мл отмывающего раствора и центрифугировали в течение 5 мин при 200g, надосадочную жидкость отсасывали, К осадку добавляли 100 мкл отмывающего раствора, встряхивали, добавляли 100 мкл 2% раствора параформальдегида.
Анализ флуоресценции клеток проводили на лазерном проточном цитометре АТС-3000 фирмы "Bruker-ODAM" (ФРГ - Франция) с возбуждением аргоновым лазером (длина волны 488 нм, мощность 200 мВт). Регистрируемые параметры рассеяния света под малыми углами (FALS), рассеяние света под большими углами (WALS), объем, измеренный по электрическому сопротивлению (VOLUME), "зеленая" флуоресценция с длиной волны от 510 до 530 нм (GREENPK) -для регистрации флуоресценции флуоресцеина.
Результаты измерений представляются как двумерная цитограмма распределения белых клеток периферической крови человека по параметрам WALS и VOLUME. Лимфоциты, моноциты и гранулоциты расположены отдельными кластерами, что позволяет анализировать флуоресценцию каждого вида клеток отдельно. Благодаря этому можно анализировать полную популяцию белых клеток периферической крови, что значительно упрощает и ускоряет приготовление образцов по сравнению с методиками выделения лимфоцитов с использованием различных градиентов.
Для подсчета популяции лимфоцитов использовали моноклональные антитела на соответствующие клетки, меченные флуоресцеином (маркеры). Для B-лимфоцитов и N-киллеров - GAM, для T-лимфоцитов - THY 1, для T-хелперов - L3T4, для T-киллеров и T-супрессоров - LYT2.
Измерение хемилюминесценции нейтрофилов периферической крови мышей.
Тест отражает количество и функциональную активность нейтрофилов (состояние неспецифического клеточного иммунитета). В качестве источника нейтрофилов использовали венозную кровь мышей, взятую в ЭДТА (1,5 мг/мл). Образцы крови в объеме 200 мкл лизировали добавлением лизирующего раствора (NH4Cl 8.26 г/л и NaHCO3 1 г/л, pH 7.2) после 7 минутной экспозиции при комнатной температуре и центрифугировании (9 мин при 200g), гемолизат удаляли. Осевшие клетки ресуспендировали в 1 мл буферного раствора (pH 7.2), приготовленного из раствора Хэнкса (без фенолового красного), дополненного 5 mM глюкозы, 10 mM HEPES-буфера, 0,62•10-3 М люминола (Sigma Chemical Co). По 100 мкл суспензии помещали в пробирки для хемолюминесценции, добавляли 0,5 мл упомянутого буферного раствора с добавлением люминола и помещали в ячейки хемолюминометра. Анализ хемолюминесценции проводили на автоматизированном 36-канальном хемолюминометре "Люцифер-Б" ("Диалог"), Москва) при 37oC.
Для активации хемолюминесцентной реакции нейтрофильных гранулоцитов использовали зимозан (Sigma Chemical Co), опсонизированный мышиной сывороткой. Образцы клеток инкубировали в течение 15 мин. Затем добавляли 20 мкл опсонизированного зимозана (10 мг/мл) и регистрировали уровень и кинетику хемолюминесценции в течение 30 мин. Интенсивность хемилюминесцентного ответа оценивали по максимальному значению на кинетической кривой. Среднее значение интенсивности хемолюминесценции определяли по данным четырех идентичных измерений. Результаты оценивались количественно по числу импульсов в минуту на 1 мкл крови и количество нейтрофилов в 1 мкл.
При сравнении различных экспериментальных групп между собой в различных комбинациях произведен расчет коэффициентов Стьюдента и проверка нулевой гипотезы, которая осуществлялась сравнением с соответствующим табличным значением по уровню доверительной вероятности 95%.
Пример 1.
Берут белых мышей чистой линии Balb/C. Средний вес интактных животных составлял 25±3 г. Мышам проводят прививку карциномы Эрлиха путем внутрибрюшинного введения каждой мыши 0,2 мл цельной асцитической жидкости, взятой от предварительно привитых мышей этой же линии. Через 7 дней после прививки у мышей шприцом отбирают максимальное количество асцитической жидкости из брюшной полости. В среднем это количество составляет 1,5 мл на одно животное. Затем всю асцитическую жидкость от одной группы сливают в чашку Петри, составляя пул, и подвергают фотодинамическому воздействию. Для консервации асцитической жидкости используют гепарин 15-30 ед/мл. Длина волны облучения 660-680 нм. Опыт проводят в затемненной комнате без попадания прямого солнечного света. В качестве фотосенсибилизатора используют сульфированный фталоцианин алюминия в концентрации 11-57 мг/л. Контроль осуществляют в вышеописанных условиях за исключением добавления фотосенса или лазерного облучения.
Сразу после фотодинамического воздействия асцитическую жидкость из пула берут на анализы (1,5 мл), Таблица 1*, а оставшуюся вводят обратно в брюшную полость экспериментальных животных соответствующей группы. Каждой мыши вводят 1 мл асцитической жидкости. Сразу после опыта животных помещают в темную комнату. Асцитическая жидкость от животных различных экспериментальных групп для анализов берется через 7 дней после такого введения, Таблица 1**.
Для исследований берут следующие группы животных:
1. Контроль лазер (KL), поглощенная доза облучения - 2,16 Дж/см2, средний вес животных в группе - 30±3 г.
2. Контроль фотосенсибилизатор [ФС] (KF), концентрация ФС-57 мг/л; средний вес животных в группе 28±2,8 г.
3. ФС max/доза обл. max(FmaxLmax); концентрация ФС - 57 мг/л, поглощенная доза облучения - 4,5 Дж/см2.
4. ФС max/доза обл. min(FmaxLmin); концентрация ФС - 57 мг/л; поглощенная доза облучения - 2,7 Дж/см2; средний вес животных в группе 27 ± 2,9 г.
5. ФС min/доза обл. max (FminLmax); концентрация ФС - 11 мг/л; поглощенная доза облучения - 2,7 Дж/см2; средний вес животных в группе 27±2,9 г.
6. ФС min/доза обл. min (FminLmin); концентрация ФС - 11 мг/л; поглощенная доза облучения - 1,6 Дж/см2; средний вес животных в группе 28,4±2,84 г.
Через пять суток после облучения берут образцы для повторного анализа. Мышей всех шести опытных и контрольных групп забивают, из брюшной полости по возможности извлекают всю находящуюся там асцитическую жидкость на анализ.
Для абсолютного контроля иммунологических и морфологических характеристик берут также 9 мышей полностью интактных, которым вообще не прививалась опухоль. Они образуют контрольную интактную группу "00".
Результаты представлены в нижеследующих таблицах.
При сравнении одноименных показателей из таблицы 1 видно, что после фотодинамического воздействия существенно увеличен процент повреждения клеток: в опытных группах по сравнению с контролем в 2-3 раза.
При сравнении одноименных показателей из таблицы 1, соответствующих опытам с введением асцитической жидкости после фотодинамического воздействия, видно увеличение доли неопухолевых клеток асцитической жидкости по сравнению с опухолевыми, особенно лимфоцитов и полиморфноядерных лейкоцитов (нейтрофилов), что говорит о торможении роста опухоли и развитии реакций неспецифического иммунитета.
Анализ таблицы 2 указывает на наличие реакции нейтрофилов в опытных группах по сравнению с контрольными, что выражено в росте функциональной реакции нейтрофилов в 2 раза и увеличении количества нейтрофилов в 1,4 раза. Это говорит о стимуляции неспецифического иммунитета.
Пример 2
Способ осуществляют по методике примера 1, но берут мышей с привитой солидной формой карциномы Эрлиха.
Результаты цитоморфологических исследований по определению воздействия внутрибрюшинной прививки асцитической жидкости, подвергнутой фотодинамическому воздействию, на развитие солидной опухоли Эрлиха приведены в таблице 3.
Сравнивая различные экспериментальные группы видно, что статистически достоверные отличия опыта и контроля в 1,4-4,6 раза получены прежде всего по выраженности воспалительной и десмопластической реакции. В случае опыта, в отличие от обеих контрольных групп, вокруг опухолевой ткани формируются гранулы воспаления, приобретая продуктивный характер десмопластической реакции с образованием макрофагальных гранулем, что может свидетельствовать о возможности становления противоопухолевого клеточного иммунитета. Особенно эта реакция была выражена в проксимальной части солидной опухоли, т.е. части, прилегающей к брюшине (с наличием в брюшной полости асцитической жидкости).
Таким образом, предложенный способ обладает рядом преимуществ по сравнению с известной ФДТ:
- отпадает необходимость системного введения фотосенсибилизатора в организм опухоленосителя;
- исключается внутритканевое облучение и, соответственно, возможность механического повреждения, а также облучения здоровой ткани;
- отпадает необходимость применения местной анестезии при осуществлении фотодинамического воздействия;
- обеспечивается воспроизводимость процедуры фотодинамического воздействия.
Результаты цитоморфологических и иммунологических исследований свидетельствуют о достаточной результативности предложенного способа для подавления роста опухоли и формирования противоопухолевого иммунитета.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЦЕНКИ ПРОТИВООПУХОЛЕВОЙ ЭФФЕКТИВНОСТИ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2020 |
|
RU2738301C2 |
| ФОТОСЕНСИБИЛИЗАТОРЫ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2005 |
|
RU2282646C1 |
| Способ проведения фотодинамической терапии солидной карциномы Эрлиха мышей | 2021 |
|
RU2774589C1 |
| СПОСОБ МОДИФИКАЦИИ ФОТОДИНАМИЧЕСКОГО ЛЕЧЕНИЯ | 2010 |
|
RU2449821C1 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ПЕРЕВИВНОЙ ОПУХОЛИ КАРЦИНОМА ЭРЛИХА МЫШЕЙ С ФОТОСЕНСИБИЛИЗАТОРОМ ХЛОРИНОВОГО РЯДА | 2022 |
|
RU2788766C2 |
| СПОСОБ ПОДАВЛЕНИЯ РОСТА ОПУХОЛЕЙ | 2008 |
|
RU2383370C1 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 1998 |
|
RU2136278C1 |
| СПОСОБ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ МЕТОДОМ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 1994 |
|
RU2113254C1 |
| СПОСОБ ПРЕДУПРЕЖДЕНИЯ И ПОДАВЛЕНИЯ РОСТА РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ В ЭКСПЕРИМЕНТЕ | 2005 |
|
RU2301073C2 |
| АМИНОАМИДЫ В РЯДУ БАКТЕРИОХЛОРОФИЛЛА A, ОБЛАДАЮЩИЕ ФОТОДИНАМИЧЕСКОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2548675C9 |

Изобретение относится к медицине, в частности оно касается способа подавления роста раковой опухоли. Используют фотодинамическое воздействие с применением в качестве фотосенсибилизатора сульфированного фталоцианина алюминия. У опухоленосителя берут часть асцитной жидкости, подвергают ее фотодинамическому воздействию in vitro, а затем вводят в организм опухоленосителя. Способ безопасен для опухоленосителя и обладает достаточной результативностью для подавления роста опухоли и формирования противоопухолевого иммунитета. 3 табл.
Способ подавления роста опухоли с использованием фотодинамического воздействия и применением в качестве фотосенсибилизатора сульфированного фталоцианина алюминия, отличающийся тем, что у опухоленосителя берут часть асцитной жидкости, подвергают ее фотодинамическому воздействию in vitro, а затем вводят в организм опухоленосителя.
| СОКОЛОВ В.В., СТРАНАДКО Е.Ф | |||
| и др | |||
| Фотодинамическая терапия злокачественных опухолей основных локализаций с препаратами фотогем и фотосенс | |||
| Вопросы онкологии, т | |||
| Механический грохот | 1922 |
|
SU41A1 |
| Халат для профессиональных целей | 1918 |
|
SU134A1 |
| СЕЙЛАНОВ А.С | |||
| и др | |||
| Железобетонный фасонный камень для кладки стен | 1920 |
|
SU45A1 |
| Экспериментальная онкология, 1993, 15, N 1, с | |||
| Термосно-паровая кухня | 1921 |
|
SU72A1 |
| БРЮСОВ П.Г | |||
| и др | |||
| Фотодинамическая терапия при злокачественных опухолях | |||
| Вопросы онкологии, 1994, т | |||
| Приспособление с иглой для прочистки кухонь типа "Примус" | 1923 |
|
SU40A1 |
| Способ подпочвенного орошения с применением труб | 1921 |
|
SU139A1 |
Авторы
Даты
2000-11-27—Публикация
1998-07-02—Подача