Изобретение относится к области медицины, в частности к клинической биохимии.
Актуальность предлагаемого способа обусловлена необходимостью исследования в биологических жидкостях человека состояния катехоламиновой системы, что необходимо для диагностики, прогноза течения и подбора патогенетической фармакотерапии больных с различными психическими расстройствами.
Современное развитие клинической биохимии диктует необходимость разработки методов одновременного определения адреналина (А), норадреналина (НА), дофамина (ДА), предшественника катехоламинов в цепи биосинтеза - 3,4-диоксифенилаланина (ДОФА), продукта метаболизма норадреналина - 3,4-диоксифенилэтиленгликоля (ДОФЕГ) и дофамина - 3,4-диоксифенилуксусной кислоты (ДОФУК) в плазме крови и моче.
Наиболее близким к заявленному является способ определения катехоламинов, ДОФА и ДОФЕГ в плазме крови, предложенный Eisenhofer G. et al. (Simultaneous LC Determination of 3,4-Dihydroxyphenilglycol, CA, and DOPA in Plasma// Clin. Chem., 1986. - 32(11)-2030-2033).
Однако недостатком указанного метода является трудоемкость, высокая стоимость определения и длительность (45 мин) одного определения.
Известно, что КА в определенных условиях хорошо адсорбируются и на катионообменной смоле Bio Rex 70, и на специально обработанной Al2O3, а ДОФА и ДОФУК связываются только с окисью алюминия. Использование сочетания ионообменной смолы и окиси алюминия позволяет, во-первых, очистить КА от мешающих их дальнейшему определению веществ, и, во-вторых, сконцентрировать КА в малом объеме, что повышает чувствительность метода.
Мы использовали высокоэффективную хроматографию с добавлением ионпарного компонента в подвижную фазу. Система ВЭЖХ состояла из насоса высокого давления Gilson, модель 305 (Франция), инжектора Reodyne 7125 с петлей на 50 мкл, колонки Sherisorb ODS 5 микрон 150х4.6 мм фирмы Alltech (США), детектора LC4B фирмы BAS (США), интегратора на базе персонального компьютера IBM. Потенциал рабочего электрода (углеродный, стекло) составлял +0,65 V против Ag/AgCl электрода сравнения. Скорость протока - 0,6-1 мл/мин, температура комнатная. Рабочее давление при этих режимах было в пределах 140-250 атм. Перед рабочей колонкой была установлена преколонка фирмы Alltech с материалом, аналогичным материалу колонки.
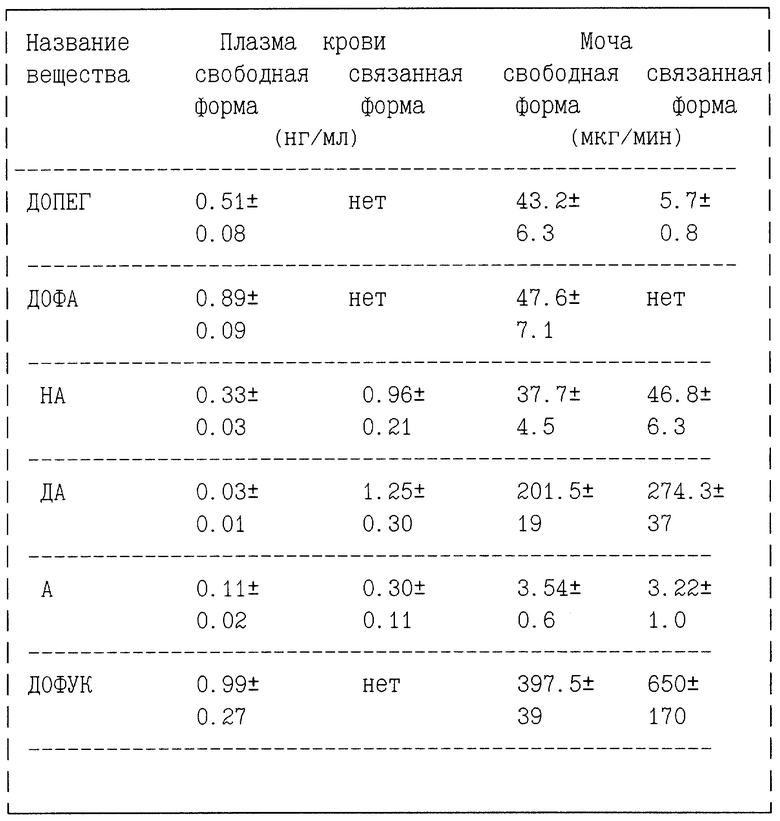
Способ иллюстрируется таблицей.
Заявленный способ осуществляется следующим образом.
Мочу, собранную за определенный временной интервал, подкисляют до pH 3 6М HCl, отбирают 20 мл, добавляют 200 мкл 5% раствора Na2ЭДТА и хранят до исследования при -20oC не более двух недель. После размораживания 5 мл мочи доводят до pH 6,2-6,6 1М NaOH, затем добавляют 7,4 мл фосфатного буфера pH 6,5 и 50 мкл раствора ДГБА и наносят на колонку с ионообменной смолой, собирая эффлюент, содержащий ДОФА, ДОФУК и КА-S. Колонку промывают 5 мл воды и 0,8 мл 0,7М H2SO4, после, чего свободные формы катехоламинов элюируют 4 мл (NH4)2SO4. 5 мл эффлюента доводят до pH 1 6М HCl и помещают в кипящую водяную баню на 25 минут для гидролиза конъюгированных форм исследуемых веществ. Пробы охлаждают, доводят pH до 6,5 1М NaOH, разводят фосфатным буфером pH 6,5 до 12,5 мл, добавляют 50 мкл ДГБА и наносят на колонку с Bio Rex 70, собирая эффлюент и элюат. К 3 мл эффлюента добавляют 0,5 мл Трис/ЭДТА буфера pH 8,6, а к 2 мл элюата - 1,5 мл Трис/ЭДТА буфера pH 8,6, во все образцы вносят по 50 мг активированной окиси алюминия, интенсивно (в вортекс-миксере) встряхивают 15 минут, центрифугируют 30 сек при 3000 об/мин и убирают надосадочную жидкость с помощью водоструйного насоса. Окись алюминия дважды промывают 0,05 М фосфатным буфером pH 8,5, после чего добавляют 500 мкл 0,1 М HClO4 для элюции катехоламинов, ДОФА и ДОФУК. После интенсивного встряхивания в течение 10 минут, центрифугирования и микрофильтрации на фильтрах 0,2 мкм кислотный экстракт вносят в хроматографическую систему высокого давления. Кислотный экстракт катехоламинов и метаболитов можно хранить в холодильнике (4oC) в течение суток.
Кровь из локтевой вены (антикоагулянт - 0,27 М раствор ЭДТА, pH 7,4, 10 мкл на 1 мл крови) центрифугируют при 5000 g 10 минут и отбирают плазму, которую хранят до эксперимента при -30oC не более месяца. После размораживания, к 1,5-2 мл плазмы последовательно добавляют 50 мкл раствора внутреннего стандарта и 1 мл 2,5М HClO4, пробы интенсивно встряхивают в вортекс-миксере, выдерживают 30 минут при комнатной температуре и центрифугируют 15 минут при 10000 g. Супернатант отбирают в стеклянный стаканчик и помещают в кипящую водяную баню на 20 минут. Пробы охлаждают, доводят pH до 8,0-8,5 4 М раствором триса и добавляют 1 мл 1,5 М трис/ЭДТА буфера pH 8,5 и 40-50 мг активированной Al2O3. Для определения свободных форм исследуемых веществ к 2 мл плазмы добавляют 50 мкл внутреннего стандарта, 1 мл 1,5М трис/ЭДТА буфера pH 8,5 и 40-50 мг активированной окиси алюминия. Адсорбция катехоламинов, ДОФА, ДОФУК и их элюция проводится так же, как при анализе мочи. После адсорбции веществ на окиси алюминия последнюю 3 раза промывают 3 мл 0,15 М трис-буфером pH 8,5. Элюцию КА, ДОФА и ДОФУК с окиси алюминия проводят 200 мкл 0,1 М HClO4. После фильтрации и центрифугирования 50-100 мкл кислотной фазы вносят в хроматограф.
Подвижная фаза (pH 3,0) содержала NaH2PO4 (70 мМ), лимонную кислоту (10 мМ), Na2ЭДTA (2 мМ), этанол (1,5-3%, v/v). В качестве ионпарного компонента использовали гептансульфоновую кислоту в концентрации 0,5-2 мМ. После приготовления подвижную фазу дегазировали в ультразвуковой бане под ваккуумом со встряхиванием 10 минут.
При определении содержания общей фракции ДА в плазме мы встретились с затруднениями при хроматографической регистрации дофаминового пика, поскольку после горячего кислотного гидролиза плазмы крови на хроматограмме обнаруживался большой пик неидентифицированного вещества с очень близким к дофамину временем выхода с колонки и полностью маскирующий пик ДА. Для того, чтобы не вводить лишнюю стадию очистки, мы проводили определение дофамина, используя другую подвижную фазу с меньшим содержанием гептансульфоновой кислоты (0,5 мМ). При этом дофамин выходил раньше неидентифицированного пика, время удерживания которого на колонке не зависело от концентрации ионпарного реагента, однако в этих условиях пики НА и ДОФА сливались с пиками незадерживаемых колонкой веществ. Таким образом, каждая проба вносилась в хроматографическую систему дважды - с фазами, содержащими 0,5 мМ и 1,5 мМ гептансульфоновую кислоту - для определения всех исследуемых веществ.
Содержание веществ в плазме крови и моче рассчитывали с учетом процента выхода внутреннего стандарта (ДГБА). Средний процент выхода стандартов НА, А, ДА, ДОФА и ДОПЕГ с окиси алюминия составлял 65-70% для проб без гидролиза. После гидролиза процент выхода катехоламинов был несколько меньше - 30-40%. Процент выхода ДОФУК примерно в 2 раза меньше, чем КА и ДОФА. Детектор калибровали по стандартным растворам каждого из веществ 3-5 раз в день. Среднее время выхода ДОПЕГ, НА, ДОФА, А, ДГБА, ДА, ДОФУК в стандартных условиях составляло соответственно 2,5; 3,0; 3,5; 4,5; 5,8; 9,8; 10,2 минут. При определении количества "суммарного" ДА в плазме крови время его выхода с колонки равнялось 6,8 мин, а время выхода ДГБА - 4,3 мин.
Предлагаемым способом было проведено определение веществ в плазме крови и моче 24 психически и соматически здоровых мужчин в возрасте от 28 до 43 лет, результаты которого представлены ниже.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ ранней доклинической диагностики болезни Паркинсона | 2015 |
|
RU2606591C1 |
| СПОСОБ ДИАГНОСТИКИ НАРУШЕНИЙ СЕКСУАЛЬНЫХ ПРЕДПОЧТЕНИЙ ПО ОБЪЕКТУ | 2001 |
|
RU2215474C2 |
| СПОСОБ ЛЕЧЕНИЯ ТАБАЧНОЙ ЗАВИСИМОСТИ У ЖЕНЩИН | 2009 |
|
RU2428163C2 |
| СПОСОБ НИЗКОИНТЕНСИВНОЙ ЛАЗЕРНОЙ ТЕРАПИИ ФАРМАКОРЕЗИСТЕНТНЫХ ДЕПРЕССИВНЫХ РАССТРОЙСТВ | 2003 |
|
RU2243010C1 |
| СПОСОБ ЛЕЧЕНИЯ ТАБАЧНОЙ ЗАВИСИМОСТИ У МУЖЧИН | 2009 |
|
RU2428164C2 |
| СПОСОБ ОЦЕНКИ КАЧЕСТВА ЖИЗНИ ДЛЯ ДИАГНОСТИКИ ПСИХИЧЕСКОГО СОСТОЯНИЯ ЧЕЛОВЕКА | 2004 |
|
RU2261045C1 |
| ТЕСТ-СИСТЕМА ДЛЯ ОПРЕДЕЛЕНИЯ НИЗКОМОЛЕКУЛЯРНЫХ МАРКЕРОВ НЕЙРОМЕДИАТОРНОГО ОБМЕНА В ОБРАЗЦАХ БИОЛОГИЧЕСКИХ ЖИДКОСТЕЙ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И СПОСОБ ОПРЕДЕЛЕНИЯ КАТЕХОЛАМИНОВ И ИХ МЕТАБОЛИТОВ С ЕЕ ИСПОЛЬЗОВАНИЕМ | 2017 |
|
RU2708917C2 |
| СПОСОБ РАННЕЙ ДИАГНОСТИКИ ТЕЧЕНИЯ И ИСХОДА НЕВРОТИЧЕСКИХ, СВЯЗАННЫХ СО СТРЕССОМ, СОМАТОФОРМНЫХ И НЕВРОЗОПОДОБНЫХ РАССТРОЙСТВ | 2009 |
|
RU2427841C2 |
| СПОСОБ КУПИРОВАНИЯ ПАТОЛОГИЧЕСКОГО ВЛЕЧЕНИЯ К КУРЕНИЮ ТАБАКА | 1995 |
|
RU2074733C1 |
| СПОСОБ НИЗКОИНТЕНСИВНОЙ ЛАЗЕРНОЙ ТЕРАПИИ НЕВРОТИЧЕСКИХ РАССТРОЙСТВ | 2009 |
|
RU2440161C2 |
Способ может быть использован в медицине, а именно в клинической биохимии для определения свободных и конъюгированных форм катехоламинов. Способ одновременного определения количества норадреналина, адреналина, дофамина, 3,4-диоксифенилаланина, 3,4-диоксифенилуксусной кислоты и 3,4-диоксифенилэтиленгликоля в плазме крови и моче включает адсорбцию определяемых веществ из биологических жидкостей путем нанесения их на смолу Bio Rex 70, затем на активированную окись алюминия, элюцию 0,1 М НСlO4 с последующим определением количества веществ по калибровочной кривой с помощью высокоэффективной жидкостной хроматографии. Причем в качестве подвижной фазы при хроматографии используют 70 мM раствор NaH2PO4, 10 мM гептансульфоновой кислоты с рН указанного раствора 3,0 и общим временем хроматографирования - 10 мин. Способ информативен и, по сравнению с известными, является более быстрым и простым в исполнении. 1 табл.
Способ одновременного определения количества норадреналина, адреналина, дофамина, 3,4-диоксифенилаланина, 3,4-диоксифенилуксусной кислоты и 3,4-диоксифенилэтиленгликоля в плазме крови и моче, включающий адсорбцию определяемых веществ из биологических жидкостей при нанесении биологического материала на смолу BioRex 70, затем на активированную окись алюминия, элюцию регистрируемых молекул 0,1 М раствором HClO4, высокоэффективную жидкостную хроматографию полученного элюата с последующим определением количества веществ по калибровочной кривой, отличающийся тем, что в качестве подвижной фазы при хроматографии используют 70 мМ раствор NaH2PO4, 10 мМ раствор лимонной кислоты, 2 М раствор Na2 ЭДТА, 1, 5 - 3% (v/v) раствор этанола, 0,5 - 2 М раствор гептансульфоновой кислоты, с pH описанного раствора 3,0 и общим временем хроматографирования - 10 мин.
| Eisenhofer G | |||
| Et al., Simultaneous LC Determination of 3,4-Dihydroxyphenilglycol, CA, and DOPA in Plasma // Clin.Chem., 1986, N 32 (11), p.2030 - 2033 | |||
| СПОСОБ ВАСИЛЬЕВА В.Н. ЛЕЧЕНИЯ У ЖИВОТНЫХ ПАРАЛИЧЕЙ И ЭПИЛЕПСИЙ | 1992 |
|
RU2028801C1 |
| СПОСОБ ДИАГНОСТИКИ И ЛЕЧЕНИЯ НЕРВНО-МЫШЕЧНЫХ ЗАБОЛЕВАНИЙ ДОФАМИНОВОЙ ЭТИОЛОГИИ | 1992 |
|
RU2061962C1 |
| Васильев В.Н | |||
| Диагностика и лечение двигательных расстройств, обусловленных нарушением дофаминового обмена (синдром Шошиной Л.М | |||
| - Васильева В.И.), информационное письмо | |||
| - М., 1987, с.12-17). | |||
Авторы
Даты
2001-01-20—Публикация
1997-12-08—Подача