Настоящая заявка является частичным продолжением заявки США N 08/374406, поданной 17 января 1995 г. под названием "усовершенствованные химиотерапевтические композиции", которая, в свою очередь, является продолжением заявки США N 07/957998, поданной 8 октября 1992 г.
Настоящее изобретение относится, среди прочих, к (1) фармацевтическим композициям и способам получения химиотерапевтических агентов и (2) к фармацевтическим композициям, включающим биологические агенты, в особенности к тем, которые нацелены на клетки и ткани, устойчивые к действию биологического агента.
Ряд химиотерапевтических агентов обладает низкой растворимостью и низкой стабильностью в физиологических жидкостях. Зачастую химиотерапевтические агенты плохо проходят через клеточные мембраны. Кроме того, многие из таких агентов связываются с белками плазмы, а также вступают в другие неспецифические взаимодействия в кровотоке, прежде чем достигают пораженной раком мишени.
Помехой эффективной химиотерапии является устойчивость к биологическим агентам, которую развивают многие опухоли и микробные инфекции. Чувствительность опухолевых клеток к противораковым средствам может снижаться до 103 раз в ходе химиотерапии. И когда такая устойчивость развивается в отношении одного агента, часто такие подлежащие лечению клетки становятся устойчивыми и к множеству других биологических агентов, действию которых они ранее не подвергались (см. Goldstein et al., Crit. Rev. Oncol. Hematol., 12: 243-253, 1992; Goodman and Gilman's, The Pharmacological Basis of Therapeutics, 8th Ed., McGraw-Hill, New-York, 1994). Считается, что один из механизмов, посредством которого развивается такая устойчивость, включает мембранный насасывающий белок gp-170 (гликопротеина P или P-gp белка). (См. Goldstein et al., Crit. Rev. Oncol. Hematol., 12: 243-253, 1992).
Было обнаружено, что такие трудности могут быть преодолены введением биологического агента в состав композиции, содержащей мицеллы одного или более блоксополимеров с описанными ниже характеристиками. Кроме того, было показано, что определенный набор таких блоксополимеров может особенно эффективно доставлять лекарственное средство и восстанавливать чувствительность к биологическому агенту.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В одном своем аспекте изобретение относится к фармацевтической композиции, включающей:
(а) биологический агент; и
(б) полиэфирный блоксополимер, включающий линейный полимерный сегмент типа А, соединенный одним концом с линейным полимерным сегментом типа В, при этом сегмент типа А имеет относительно гидрофильный характер, повторяющиеся звенья которого вносят вклад в среднее значение фрагментальной константы Хэнша-Лео (Hansch-Leo fragmental constant) на уровне примерно -0,4 или меньше и вносят вклад в молекулярный вес на уровне от 30 до 500, тогда как сегмент B-типа имеет относительно гидрофобный характер, повторяющиеся звенья которого вносят вклад в среднее значение фрагментальной константы Хэнша-Лео на уровне примерно -0,4 или больше и вносят вклад в молекулярный вес на уровне от 30 до 500, и при этом по меньшей мере 80% связей, соединяющих повторяющиеся звенья каждого из полимерных сегментов, включает эфирную связь. В предпочтительном варианте реализации изобретения полиэфирный блоксополимер выбирают из группы, состоящей из полимеров следующих формул:
A-B-A'(I),
A-B (II),
B-A-B' (III),
или
L(R1)(R2)(R3)(R4) (IV)
где A и A' обозначают линейные полимерные сегменты типа A, B и B' обозначают линейные полимерные сегменты типа B и R1, R2, R3 и R4 представляют собой или блоксополимеры формул (I), (II) или (III) или водород, a L является связующей группой, при условии, что не более чем два из R1, R2, R3 и R4 являются водородом.
В предпочтительном варианте осуществления изобретения композиция включает мицеллы блоксополимера или приводит к образованию мицелл блоксополимеров в процессе введения композиции или впоследствии. Предпочтительно, по меньшей мере около 0,1% биологического агента включается в мицеллы, более предпочтительно - по меньшей мере около 1 % биологического агента, и еще более предпочтительно - около 5 % биологического агента.
В предпочтительном варианте осуществления изобретения гидрофобная доля сополимера в настоящей композиции составляет по меньшей мере около 50%, более предпочтительно - по меньшей мере около 60%, и еще более предпочтительно - 70%.
В другом предпочтительном варианте осуществления изобретения вес гидрофобной части составляет по меньшей мере около 900, более предпочтительно, по меньшей мере около 1700, и еще более предпочтительно, по меньшей мере около 2300.
В еще одном предпочтительном варианте осуществления изобретения вес гидрофобной части составляет по меньшей мере около 2000, а гидрофобная доля составляет по меньшей мере около 20%, предпочтительно 35%; или вес гидрофобной части составляет по меньшей мере около 2300, а гидрофобная доля составляет по меньшей мере около 20%, предпочтительно 35%.
В еще одном предпочтительном варианте осуществления изобретения сополимер или сополимеры, входящие в состав настоящей композиции, характеризуются значениями критической концентрации мицеллообразования [ККМ(СМС)] не более чем 0,5% (вес/объем) при температуре 37oC в изотоническом водном растворе, предпочтительно, не более чем примерно 0,05% (вес/объем), более предпочтительно, не более чем примерно 0,01% (вес/объем) и еще более предпочтительно, не более чем примерно 0,003 % (вес/объем).
Предпочтительно, сополимеры по настоящей композиции соответствуют формуле (V), которая приведена ниже в тексте. Особенно предпочтительными среди них являются такие, которые имеют вес гидрофобной части от примерно 1500 до примерно 2000, предпочтительно, от примерно 1710 до примерно 1780, а процентную долю гидрофобной части - от примерно 85% до примерно 95%, предпочтительно, от примерно 88% до примерно 92%. К числу наиболее предпочтительных среди указанных сополимеров относятся также такие, которые имеют вес гидрофобной части от примерно 3000 до примерно 3500, предпочтительно, от примерно 3200 до примерно 3300, а процентную долю гидрофобной части - от примерно 15% до примерно 25%, предпочтительно, от примерно 18% до примерно 22%. Кроме того, в дополнение к числу наиболее предпочтительных среди указанных сополимеров относятся также такие, которые имеют вес гидрофобной части от примерно 3500 до примерно 4000, предпочтительно, от примерно 3700 до примерно 3800, а процентную долю гидрофобной части - от примерно 25% до примерно 35%, предпочтительно, от примерно 28% до примерно 32%.
В предпочтительном варианте композиция включает химиотерапевтический агент.
Во втором своем аспекте изобретение относится к фармацевтической композиции, включающей цитотоксичное лекарственное средство, растворимое в полимерных мицеллах.
В другом аспекте изобретение относится к способу лечения микробной инфекции или опухоли посредством введения фармацевтической композиции по первому или второму варианту настоящего изобретения.
В еще одном аспекте изобретение относится к способу лечения пораженной ткани, проявляющей устойчивость к биологическому агенту в курсе лечения этим или другим биологическим агентом, при этом указанный метод включает введение композиции, включающей (а) второй биологический агент, который может быть тем же самым или отличным от биологического агента, в отношении которого ткань демонстрирует устойчивость, и (б) композицию с мицеллообразующим сополимером, описанную для первого или второго вариантов осуществления изобретения.
В другом своем варианте изобретение относится к методу профилактики или ограничения образования метастаз посредством введения одной из противораковых композиций по настоящему изобретению.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 иллюстрирует цитотоксичность для SK-устойчивых клеток или SK-клеток, подвергшихся обработке даунорубицином в свободной или мицеллярной форме.
Фиг. 2 демонстрирует кинетику накопления даунорубицина SK-устойчивыми клетками или SK-клетками, соответственно, подвергшимися обработке даунорубицином в свободной или мицеллярной форме.
Фиг. 3А и 3Б иллюстрирует ингибирование MCF7-ADRc клеток, инкубированных различными концентрациями доксорубицина и Плуроника L61 (Pluronic L61).
Фиг. 3В иллюстрирует цитотоксичность Плуроника L61 в отношении MCF7-ADRc клеток.
Фиг. 4 показывает период наступления клиренса крови от [3H]-Плуроника Р85 и накопления его в печени.
На фиг. 5 приведены сравнительные данные по концентрации в крови [3H]-Плуроника Р85 при введении его, соответственно, в/в или перорально.
На фиг. 6А приведены данные по концентрации даунорубицина в печени.
На фиг. 6Б приведены данные по концентрации в крови даунорубицинола в течение периода времени после его инъекции.
На фиг. 6В приведены данные по концентрации в крови даунорубицина в течение периода времени после его инъекции.
Фиг. 7 показывает изменения в ходе лечения в объекте миеломных опухолей с множественной лекарственной устойчивостью Sp2/Odnr у мышей линии BALB/c. Объем определяют как среднее значение отношения объема опухоли в данный день (V) к среднему значению в первый день лечения (Vo).
Фиг. 8 показывает изменения в ходе лечения в объеме миеломных опухолей с множественной лекарственной устойчивостью Sp2/0dnr у мышей линии BALB/c.
Фиг. 9 показывает ингибирование метастаз опухоли у мышей, которым вводили доксорубицин в сочетании с Плуроником Р85, в сравнении с мышами, которым вводили только доксорубицин.
ОПРЕДЕЛЕНИЯ:
Термины и фразы, перечисленные ниже, имеют следующие значения в контексте настоящего описания:
биологический агент - агент, используемый для диагностики или получения снимков, который может действовать на клетку, орган или организм, включая, но не ограничиваясь ими, те лекарственные средства (фармацевтические), которые приводят к изменениям в функционировании клетки, органа или организма. Такие агенты включают, не ограничиваясь ими, нуклеиновые кислоты, полинуклеотиды, антибактериальные средства, антивирусные средства, противогрибковые средства, противопаразитарные средства, средства, уничтожающие опухоли, или противораковые средства, белки, токсины, ферменты, гормоны, нейротрансмиттеры, гликопротеины, иммуноглобулины, иммуномодуляторы, красители, радиоактивные метки, рентгеноконтрастные вещества, флуоресцентные вещества, полисахариды, молекулы, связывающиеся с клеточными рецепторами, противовоспалительные средства, противоглаукомные средства, мидриатические средства и местные анестетики.
химиотерапевтическое средство - биологический агент, который ингибирует рост или снижает уровень выживания опухолевых или патогенных микробных клеток или ингибирует размножение (что включает неограниченную репликацию, сборку вирусов или клеточную инфекцию) вируса.
цитотоксичное лекарственное средство - химиотерапевтическое средство, используемое для лечения рака, которое является цитотоксичным, в частности для быстро делящихся клеток.
гидрофобный процент - процентная доля по молекулярному весу блоксополимера, который построен из блоков B-типа. Эта величина обозначается также как "гидрофобный весовой процент".
гидрофобный вес - вклад в значение молекулярного веса блоксополимера, содержащего блоки типа В. Эта величина обозначается также как "гидрофобный молекулярный вес".
ИК50 - концентрация, при которой достигается 50% цитотоксичность. Значение цитотоксичности может быть измерено по методу Alley et al., Cancer Res. , 48: 589-601, 1988 или Scudiero et al. Cancer Res., 48: 4827, 1988. В частности, оно может быть определено на основании той концентрации лекарственного средства, при которой наблюдается 50% снижение активности митохондриальных ферментов.
липофильная часть - липофильный заместитель, который присоединен к целевой части и который распределяется в липофильной части сополимерных мицелл для связывания целевой части с такими мицеллами.
микроб - бактерия, микоплазма, дрожжи или грибы, вирус или паразит (такой, например, как малярийный паразит).
МЛУ (MDR) - клетки обладают множественной лекарственной устойчивостью, если они устойчивы к биологическим агентам, которые действуют на клеточные линии, которые являются родительскими по отношению к МЛУ клеткам.
целевая часть - молекулярная структура, которая распознается клетками, тканями, вирусными или субстратными компонентами, такими, например, как рецептор клеточной поверхности или акцепторная молекула.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Было показано, что эффективность блоксополимеров по настоящему изобретению по повышению действенности химиотерапевтических средств и обратимости МЛУ в высшей степени зависит (а) от процента гидрофобной части и (б) от веса гидрофобной части. При этом указанная эффективность повышается либо с увеличением процента (а), либо с увеличением веса (б), либо при повышении значения обоих факторов. Отмеченное повышение процента гидрофобной части и веса гидрофобной части коррелирует также с улучшением мицеллообразующих свойств, в соответствии с чем образование мицелл для таких сополимеров происходит при более низких концентрациях. (См. Hurter et al. Macromolecules 26:5030; Hurter et al. Macromolecules 26: 5592, 1993; Alexandris et al., Maromolecules 27: 2414, 1994). He желая ограничиваться какой-то определенной теорией, можно только отметить, что образующиеся мицеллы выполняют роль суррогата, пригодного для измерения физических свойств, которые ведут к улучшению свойств биологического агента, важных для его доставки организму. И снова, не ограничиваясь конкретной теорией, следует отметить, что повышение эффективности биологического агента и обратимость множественной лекарственной устойчивости не связаны с мицеллами как таковыми. Если, используя в качестве модельного биологического агента доксорубицин, нанести на график коэффициент отношения (а) при ИК50 (как меру эффективной цитотоксичной концентрации) для содержащей сополимер композиции к (б) при ИК50 для свободного доксорубицина против концентрации сополимера, получится двухфазный график, с быстрым снижением коэффициента, наблюдаемым по мере повышения концентраций сополимера, но которая остается в пределах значения ККМ для сополимера. Выше значения ККМ происходит быстрое падение коэффициента. См. фиг. 6Б. Максимальное повышение активности биологического агента происходит при значениях концентрации выше ККМ, хотя повышение активности отмечается уже при таких низких концентрациях, например, сополимера Плуроника L61, как 0,0001 % (вес/объем) и ниже. Наличие мицеллярной формы рассматривается в качестве важного фактора в использовании сополимеров для доставки лекарств по организму также и по другим причинам, которые будут обсуждены далее в описании.
Схема, приведенная в конце описания, позволяет понять связь, существующую между процентом гидрофобной части и весом гидрофобной части сополимера с различными аспектами настоящего изобретения. На схеме значения веса гидрофобной части (поли(оксипропилена)) и сополимера приведены непосредственно под каждым обозначенным сополимером. Рядом со значениями гидрофобного веса для каждого сополимера даются значения гидрофобного процента.
Было показано, что Плуроник F68 обладает умеренной активностью повышения действия биологических агентов. Плуроник L61, который имеет тот же самый вес гидрофобной части, что и Плуроник F68, но более высокий гидрофобный процент, представляет собой наиболее эффективный блоксополимер из указанных на схеме. Плуроник F108, который имеет тот же самый процент гидрофобной части, что и Плуроник F68, но более высокий гидрофобный вес, является также эффективным сополимером, хотя и менее эффективным, чем Плуроник L61. Плуроник Р85 имеет более высокий гидрофобный вес и более высокий гидрофобный процент, чем Плуроник F68, но различия по каждому из факторов здесь ниже, чем в случае Плуроников F108 и L61 соответственно. Эффективность Плуроника Р85 повышения действия биологических агентов является средней по значению между эффективностью Плуроника F108 и Плуроника L61. Указанные различия по эффективности хорошо видны, когда различные сополимеры при концентрации выше ККМ и доксорубицина инкубируют in vitro с клетками, обладающими лекарственной устойчивостью. Значение коэффициента ИК50 для доксорубицина в отсутствие сополимера к соответствующему коэффициенту в присутствии сополимера характеризует "индекс обратимости устойчивости". В табл. 1 приведены значения индексов устойчивости к обратимости для различных сополимеров.
Значение мицеллярной формы для доставки лекарственных средств выявляется также в экспериментах in vivo. В мицеллярной форме биологические агенты локализованы в гидрофобном ядре мицелл, закрытые таким образом гидрофильной пленкой (состоящей из сегментов типа А), которая окружает мицеллы. Такая защита снижает взаимодействия с белками печени, плазмы, другими нецелевыми тканями и другими молекулами, которые могут связывать или инактивировать агент или превращать его в токсичный метаболит. Так, например, быстрый метаболизм антрациклиновых антибиотиков в печени ведет к образованию кардиотоксичных метаболитов, которые несут модификацию в положении C13 (Cм. Mushlin et al., Br.J. Pharmacol. 110: 975-982, 1993). При использовании в качестве модельного лекарственного средства доксорубицина было показано, что наличие мицеллярной формы снижает его поглощение печенью, снижает уровень превращения в доксорубицинол и снижает тот его уровень, при котором происходит снижение концентрации доксорубицин в крови. См. фиг. 4 и 5.
Эффективность сополимеров (а) при образовании мицелл (где большая эффективность определяется в пониженной ККМ) и (б) при способствовании распределению биологических агентов скорее в мицеллярной форме, чем в свободном виде, возрастает в том же порядке (т.е. с увеличением гидрофобного веса или гидрофобного процента). Таким образом, иерархия эффективностей выглядит снова следующим образом: L61 > Р85 > F108 > F68. Наличие мицелл в низких концентрациях дает основание считать, полагая, что биологический агент остается в контакте с мицеллами, что биологический агент и сополимер вместе достигают целевой ткани. Коэффициенты распределения, соответствующие мицеллярной форме, действительно дают основание считать, что биологический агент будет оставаться связанным с мицеллами. Считается также, что мицеллярная форма биологического агента защищает биологический агент от поглощения нецелевыми тканями, которые могут метаболизировать биологический агент до неактивного или токсического метаболита, а также от неспецифической адсорбции компонентами крови, клеточными компонентами и др.
Тот же самый характер эффективности сополимеров применим, как это видно из примеров, и к обработке экспериментальных опухолей противораковыми средствами.
При высоких концентрациях блоксополимеры могут становиться токсичными для печени, почек или других клеток организма (Cм. BASF Corp., Pluronic Material Safety Data Sheet and Drug Master Files). Было показано, что токсичность блоксополимеров повышается в соответствии с параметрами гидрофобности блоксополимеров при повышении эффективности потенцирования биологических агентов. К счастью, уровень повышения действенности при изменении параметров гидрофобности значительно превосходит уровень повышения токсичности сополимера. Так, например, как показано, в Примере 8, значение ЛД50 для L61 у мышей линии BALB/c в 10 раз ниже, чем значение ЛД50 для Плуроника F108. Однако различие в терапевтической дозе в 100 раз более благоприятно у Плуроника L61, чем у Плуроника F108 (см. Пример 9Б). Таким образом, диапазон концентраций, при которых эффективность потенцирования активности биологического агента может поддерживаться без сопутствующей, связанной с полимером токсичности, больше для Плуроника L61, чем для Плуроника F108.
Считается, что за множественную лекарственную устойчивость многих опухолей ответственны представители семейства гликопротеинов P мембранных протеинов, чью устойчивость можно реверсировать с использованием композиции по настоящему изобретению (См. Goldstein et al. Cancer Treatment Res., 57: 101-119, 1991). Предполагается, что указанные белки функционируют в качестве насосов, которые выкачивают биологический агент, в отношении которого опухоли приобретают устойчивость. Предполагается также, что представители того же семейства белков оседают на мембранах эндотелиальных клеток, выстилающих кровеносные сосуды мозга, определяя существование гематоэнцефалического барьера (ГЭБ), который исключает попадание многих биологических агентов в мозг. (См. , например, Tatsuta et al., J. Biol. Chem., 267: 20383-20391). Композиции по настоящему изобретению могут использоваться для усиления проницаемости лекарства в мозг, что рассматривается более детально в заявке на Патент США, поданной одновременно с настоящей 7 июня 1995 г., и озаглавленной "Композиции, содержащие биологические агенты для целевого воздействия" ("Compositions for Targeting Biological Agents"), досье поверенного N 313257-103A, полное описание которой приведено в настоящей работе в качестве ссылки. Кроме того, представители указанного семейства белков отвечают, по всей видимости, за появление лекарственной устойчивости у некоторых представителей Candida, возбудителей малярии и других микробных инфекций. Не ограничивая свое описание какой-либо конкретной теорией, следует отметить, что композиции по настоящему изобретению реверсируют механизмы, способствующие выбросу представителей семейства гликопротеинов P, а также другие механизмы, имеющие отношение к лекарственной устойчивости.
Изобретение описывается далее со ссылками на фрагментарные константы, разработанные Хэншем и Лео (Hansch and Leo). (См. Hansch and Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology, Wiley, New York, 1979; James, Solubility and Related Properties, Marcel Dekker, New York, 1986, pp. 320-325). Указанные константы были разработаны для использования их с целью оценки вклада части молекулы и способность всей молекулы распределяться между фазами, образованными смесями октанол-вода. Такие константы обычно обозначают как фрагментарные константы распределения Хэнша-Лео (в настоящем описании как "фрагментарные константы Хэнша-Лео").
Композиции по настоящему изобретению в основном либо включают в свой состав уже подготовленные к формированию мицеллы с наличием значительной части растворенного в них биологического агента, либо они представляют собой сополимерные композиции, которые образуют мицеллы с включением значительной части биологического агента, который растворяется в них в ходе введения биологического агента пациенту или несколько позже. В вариантах осуществления настоящего изобретения в том случае, когда целевые, пригодные для лечения части связаны с мицеллами, указанная целевая часть может находиться либо в состоянии, подготовленном для такого связывания с мицеллами или может соединяться с мицеллами непосредственно в ходе введения. В особо предпочтительном варианте в качестве блоксополимеров используют такие, которые имеют низкое значение ККМ в изотопных растворах при физиологических температурах. Такие блоксополимеры могут выполнять роль мицеллярного носителя при доставке биологических агентов даже после значительного разбавления их физиологической жидкостью, такой, например, как кровь того пациента, который проходит данный курс лечения. Указанные низкие значения ККМ позволяют применять сниженные количества блоксополимеров в лекарственной композиции по настоящему изобретению.
Полное раскрытие заявки США N 08/374406, поданной 17 января 1995 г., включено в настоящее описание в качестве ссылки.
Число повторяющихся звеньев общего гидрофильного блока (A-типа) или общего гидрофобного блока (B-типа) в полиэфирном сополимере составляет предпочтительно от примерно 4 до примерно 400. Более предпочтительно, число повторяющихся звеньев составляет от примерно 4 до примерно 200, еще более предпочтительно - от примерно 5 до примерно 80. Повторяющиеся звенья, которые образуют блоки: блоки A-типа и блоки B-типа - имеют в основном молекулярный вес от примерно 30 до примерно 500, предпочтительно, от примерно 30 до примерно 100 и еще более предпочтительно, от примерно 30 до примерно 60. В основном в каждом блоке A-типа или B-типа по меньшей мере около 80% связей, имеющихся между повторяющимися звеньями, являются эфирными связями, предпочтительно, по меньшей мере около 90% будут представлять собой эфирные связи и более предпочтительно, по меньшей мере около 95% будут представлять собой эфирные связи. В контексте настоящего изобретения, термин "эфирные связи" относится к гликозидным связям (т.е. к сахарным связям). Однако в одном из аспектов изобретения предпочтительны простые эфирные связи.
Предпочтительно, чтобы все повторяющиеся звенья, которые составляют блок A-типа, имели константы Хэнша-Лео для фрагментов менее чем примерно -0,4, более предпочтительно, менее чем примерно -0,5, еще более предпочтительно, менее чем примерно -0,7. Предпочтительно, чтобы все повторяющиеся звенья, которые составляют блок B-типа, имели константы Хэнша-Лео для фрагментов примерно -0,30 или более и более предпочтительно, примерно -0,20 или более.
В качестве примеров полимеров по первому варианту осуществления настоящего изобретения могут быть приведены блоксополимеры, имеющие следующую формулу: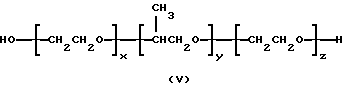
или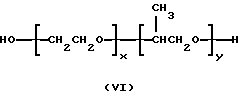
или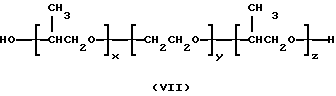
или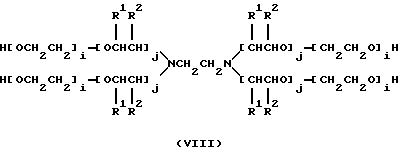
в которых x, y, z, i и j имеют значения, соответствующие описанным выше параметрам полиэфирных сополимеров, и в которых для каждой пары R1, R2 один из компонентов должен быть водородом, другой должен быть метильной группой. Формулы от (V) до (VII) упрощены, поскольку на практике ориентация изопропиленовых радикалов в В блоке будет случайной. Такая случайная ориентация и указана в формуле (VIII), которая является в этой связи более полной. Указанные поли (оксиэтилен)-поли (оксипропилен)овые соединения были описаны Сантоном (Santon, Am. Perfumer.Cosmet., 72(4): 54-58, (1958); Schmolka, Loc. cit. 82(7): 25-30 (1967); Nonionic Surfactants, Schick ed. (Dekker, NY, 1967), pp. 300- 371). Множество таких соединений коммерчески доступно под такими родовыми торговыми названиями, как "полиоксамеры", "плуроники" и "синпероники". Полимеры типа плуроников в рамках формулы B-A-B часто называют как "обращенные" плуроники, "плуроник R" или "мероксапол". "Полиоксаминовый" полимер формулы (VIII) доступен от компании БАСФ (BASF, Wyandotte, MI) под торговой маркой ТетроникTM (TetronicTM). Порядок следования полиоксиэтиленовых и полиоксипропиленовых блоков, указанный в формуле (VIII), может быть изменен на обратный, что дает Тетроник RTTM (Tetronic RTTM), который также доступен от компании БАСФ (Cм. Schmolka, J. Am. Oil Soc. , 59: 110 (1979)). Полиоксипропилен-полиоксиэтиленовые блоксополимеры могут быть также получены с участием гидрофильных блоков, включающих случайную смесь повторяющихся звеньев этиленоксида и пропиленоксида. Для поддержания гидрофильности блока количество этиленоксида делают доминирующим. Аналогично, гидрофобный блок может представлять собой смесь этиленоксидных и пропиленоксидных повторяющихся единиц. Такие блоксополимеры доступны от компании БАСФ под торговой маркой ПлурадотTM (PluradotTM).
Создано множество плуроников, которые соответствуют следующей формуле: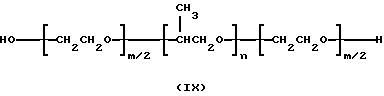
Несомненно, любой специалист со средним уровнем знаний в данной области определит, что параметры m и n в указанной формуле обычно обозначают среднестатистические значения и что количество повторяющихся единиц в первом блоке данной молекулы не будет точно соответствовать количеству повторяющихся единиц в третьем блоке. В табл. 2 в соответствии с формулой (IX), приведены характеристики для ряда плуроников.
Приведенные значения ККМ были вычислены по методу определения поверхностного натяжения, описанному в работе Кабанова с соавт. (Kabanov et al. Macromolecules 28: 2303-2314, 1995).
Дополнительные специфические поли(оксиэтилен)- поли(оксипропилен)овые блоксополимеры в соответствии с настоящим изобретением включают плуроники, представленные в табл. 3.
Диамин-подобный плуроник формулы (VIII) может также относиться к семейству диамин-связанных полиоксиэтилен - полиоксипропиленовых полимеров формулы: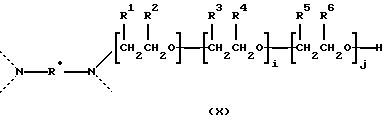
где пунктирная линия обозначает симметричные копии полиэфира, простирающиеся до второго атома азота, R* обозначает алкилен, включающий от примерно 2 до примерно 6 атомов углерода, циклоалкилен, включающий от примерно 5 до примерно 8 атомов углерода, или фенилен, для R1 и R2: либо (а) оба они являются водородами, либо (б) один обозначает водород, а другой - метил, для R3 и R4: либо (а) оба они являются водородами, либо (б) один обозначает водород, а другой - метил, и, если оба из R3 и R4 являются водородами, то один из R5 и R6 обозначает водород, а другой - метил, и если оба из R3 и R4 являются метилами, то оба R5 и R6 обозначают водород. Группа -NH2-CH2CH2-NH2- в формуле (VIII) и группа N-R*-N в формуле (X) представляют собой примеры связующих групп L в формуле (IV).
Любой специалист со средним уровнем знаний в данной области определит в свете высказанных в описании положений что, если при практической реализации изобретение ограничивается, например, поли (оксиэтилен)-поли (оксипропилен)овыми соединениями, в вышеприведенные формулы тоже вводятся соответствующие ограничения. Наиболее важным параметром является то, что среднее значение константы Хэнша-Лео для фрагментов в мономерах, составляющих блок A-типа, составляет около -0,4 или меньше. Таким образом, единицы, составляющие первый блок, не обязательно состоят только из этиленоксида. Аналогично, не весь блок B-типа состоит только из пропиленоксидных единиц. Вместо этого указанные блоки могут включать мономеры, отличные от тех, что определены для формул (V)-(X), так что параметры первого варианта сохраняются. Так, в простейших примерах по меньшей мере один из мономеров в блоке А может быть замещен боковой линейной группой из числа описанных выше групп.
В другом аспекте настоящее изобретение относится к лекарственной композиции, состоящей из блоксополимера по меньшей мере одной из формул (I)-(X), где блоки A-типа и B-типа состоят по существу из повторяющихся единиц формулы -O-R5, где R5 обозначает:
(1) -(CH2)n-CH(R6)-, где n обозначает нуль или целое число от примерно 1 до примерно 5 и R6 обозначает водород, циклоалкил, включающий от примерно 3 до примерно 8 атомов углерода, алкил, включающий от примерно 1 до примерно 6 атомов углерода, фенил, алкилфенил, в котором алкил содержит от примерно 1 до примерно 6 атомов углерода, гидрокси, гидроксиалкил, в котором алкил содержит от примерно 1 до примерно 6 атомов углерода, алкокси, включающий от примерно 1 до примерно 6 атомов углерода, алкилкарбонил, включающий от примерно 2 до примерно 7 атомов углерода, алкоксикарбонил, в котором алкокси содержит от примерно 1 до примерно 6 атомов углерода, алкоксикарбонилалкил, в котором алкокси и алкил, каждый, включают независимо друг от друга от примерно 1 до примерно 6 атомов углерода, алкилкарбоксиалкил, в котором каждый алкил включает, независимо друг от друга, от примерно 1 до примерно 6 атомов углерода, аминоалкил, в котором алкил включает от примерно 1 до примерно 6 атомов углерода, алкиламин или диалкиламино, в котором каждый алкил включает независимо друг от друга от примерно 1 до примерно 6 атомов углерода, моно- или диалкиламиноалкил, в которых каждый алкил включает независимо друг от друга от примерно 1 до примерно 6 атомов углерода, хлор, хлоралкил, в котором алкил включает от примерно 1 до примерно 6 атомов углерода, фтор, фторалкил, в котором алкил включает от примерно 1 до примерно 6 атомов углерода, циано или цианоалкил, в котором алкил включает от примерно 1 до примерно 6 атомов углерода, или карбоксил;
(2) карбоциклическую группу, имеющую в составе кольца от примерно 3 до примерно 8 атомов углерода, примером которой могут быть такие группы, как циклоалкильные или ароматические группы, которые могут включать алкил, содержащий от примерно 1 до примерно 6 атомов углерода, алкокси, включающий от примерно 1 до примерно 6 атомов углерода, алкиламино, включающий от примерно 1 до примерно 6 атомов углерода, диалкиламино, в котором каждый алкил, независимо, включает от примерно 1 до примерно 6 атомов углерода, амино, сульфонильные, гидрокси, карбоксильные, фтор или хлор-заместители или
(3) гетероциклическую группу, имеющую в составе кольца от примерно 3 до примерно 8 атомов углерода, которая может включать гетероциклоалкильные или гетероароматические группы, которые включают от примерно 1 до примерно 4 гетероатомов, выбранных из группы, состоящей из кислорода, азота, серы и их смесей, и которые могут включать алкил, содержащий от примерно 1 до примерно 6 атомов углерода, алкокси, включающий от примерно 1 до примерно 6 атомов углерода, алкиламино, включающий от примерно 1 до примерно 6 атомов углерода, диалкиламино, в котором каждый алкил, независимо, включает от примерно 1 до примерно 6 атомов углерода, амино, сульфонильные, гидрокси, карбоксильные, фтор или хлор-заместители.
Предпочтительно, n обозначает целое число от примерно 1 до примерно 3. Карбоциклические или гетероциклические группы, включающие R5, предпочтительно содержат в кольце от примерно 4 до примерно 7 атомов углерода, более предпочтительно - примерно 5 или примерно 6. Гетероциклы предпочтительно включают от примерно 1 до примерно 2 гетероатомов, более предпочтительно, гетероциклы содержат один гетероатом. Предпочтительно, гетероцикл представляет собой углевод или аналог углевода.
Для любого специалиста со средним уровнем знаний в данной области очевидно, что мономеры, необходимые для создания таких полимеров, можно синтезировать (См. Vaughn et al., J. Am. Oil Chem. Soc., 28: 294, 1951). В некоторых случаях, как это может заметить любой специалист со средним уровнем знаний в данной области, для проведения полимеризации может потребоваться использование подходящих защищающих групп. В основном блоки A-типа и B-типа состоят по меньшей мере примерно на 80% из -OR5-повторяющихся единиц, более предпочтительно - по меньшей мере примерно на 90%, и еще более предпочтительно, по меньшей мере примерно на 95%.
В другом аспекте настоящее изобретение относится к лекарственной композиции, состоящей из блоксополимера одной из формул (I)-(X), в которых блоки A-типа и B-типа состоят по существу из повторяющихся единиц -O-R7-, где R7 обозначает C1-C4 алкиленовую группу.
Коэффициент (P) Хэнша-Лео для оценки характера распределения органической молекулы в смеси октанол-вода вычисляется с помощью следующей формулы:
Log P = ∑anfn+∑bmFm
где значение fn представляют собой константы для фрагментов от различных групп в молекуле, значения an обозначают количества групп любого вида в молекуле, значения Fm представляют собой коэффициенты, относящиеся к определенным молекулярным характеристикам, таким как ординарные связи или двойные связи, и значения bm определяют количество таких характеристик. Так, например, константа Хэнша-Лео для фрагмента в повторяющейся этиленоксидной единице (-CH2CH2O-) составляет:
2fс+4fн+fо+(4-1)Fb= 2(0,20)+4(0,23)+(-1,82)+3(-0,12)=-0,86
Константа Хэнша-Лео для фрагмента в повторяющейся пропиленоксидной единице (-CH2CH(CH3)O-) составляет: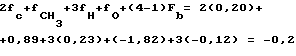
Специалист со средним уровнем знаний в данной области определит, что подход Хэнша-Лео для оценки констант распределения, в котором используются константы Хэнша-Лео для фрагментов, не дают точных эмпирических значений констант распределения (См. Hansch and Leo, Substituent Constants for Correlation Analysis in Chemistry and Biology, Wiley, New York, 1979; James, Solubility and Related Properties, Marcel Dekker, New York, 1986, pp. 320-325). Однако этот подход достаточно точен для определения гидрофобности используемого для доставки полимерного носителя.
Блоксополимеры, используемые в настоящем изобретении, будут предпочтительно образовывать мицеллы в изотонических водных растворах при физиологической температуре с диаметром от примерно 10 нм до примерно 100 нм. Мицеллы представляют собой надмолекулярные комплексы, которые образуют в водных растворах некоторые амфифильные молекулы в результате микрофазного разделения неполярных частей амфифилов. Мицеллы образуются в том случае, если концентрация амфифильных молекул достигает при данной температуре значения ККМ,
характерной для данного амфифила. За счет вариаций в размерах гидрофильных и гидрофобных сегментов блоксополимеров можно менять как способность сополимеров образовывать в физиологических условиях мицеллы, так и средний размер образуемых в физиологических условиях мицелл. Указанную способность можно корректировать при смешивании сополимеров с разным соотношением гидрофобных и гидрофильных блоков. Мицеллы содержат плотное ядро, образуемое водонерастворимыми повторяющимися единицами B блоков и липофильными частями растворенного в них биологического агента, а гидрофильная оболочка образуется из A блоков и гидрофобных частей биологического агента. Мицеллы характеризуются свободой трансляции и вращения в водной среде, а водная среда, содержащая мицеллы, имеет низкую вязкость, близкую к воде. Мицеллообразование происходит в типичном случае при концентрациях сополимера от примерно 0,0001% до 5% (вес/объем).
Считается, что малый размер мицелл, образуемых блоксополимерами по настоящему изобретению, приводит к тому, что такие мицеллы могут проникать в малые капилляры и захватываться клетками. Указанные мицеллы могут также включать большие количества соответствующего биологического агента. Так, например, мицеллы, образуемые Плуроником L61, могут включать по меньшей мере 1 мг доксорубицина на 2 мг сополимера.
Эффективное удерживание лекарственного средства внутри мицелл по настоящему изобретению может быть количественно выражено с привлечением коэффициента распределения (P), определяемого по формуле:
P = [Агент]m/[Агент]aq
где [Агент] aq обозначает концентрацию биологического агента в водной среде за пределами мицеллы, а параметр [Агент]m - концентрацию агента в мицеллах. В некоторых случаях P легко и точно подсчитывается с привлечением различий в флюоресцентных свойствах, которые имеют некоторые агенты в водной и более гидрофобной среде.
В некоторых случаях может возникнуть потребность включить, с помощью нековалентного связывания, целевые молекулы. См., например, работу Кабанова с соавт. (Kabanov et al., J. Controlled Release, 22: 141 (1992)) и заявку на патент США, поданную одновременно с настоящей 7 июня 1995 г. и озаглавленную "Композиции, содержащие биологические агенты для целевого воздействия" ("Compositions for Targeting Biological Agents"), досье поверенного N 313257-103A. Целевые молекулы, которые могут быть связаны с композицией, имеют в типичном случае целевую часть, которая обладает аффинностью к определенному клеточному сайту, и липофильную часть. Целевые молекулы спонтанно ассоциируют с мицеллами и "заякориваются" на них через липофильную часть. Такие целевые молекулы составляют в типичном случае примерно 10% или меньше от композиции.
В целевых молекулах липофильная часть может представлять собой, кроме прочих структур, липидную группу, такую как жирная ацильная группа. В предпочтительном варианте липофильная часть представляет собой углеводород, включающий от примерно 3 до примерно 41 атомов углерода, более предпочтительно - от примерно 5 до примерно 25 атомов углерода и еще более предпочтительно - от примерно 9 до примерно 17 атомов углерода. Альтернативно, это может быть блоксополимер или другой натуральный или синтетический полимер. Целевая группа целевой молекулы часто включает антитело, специфичное, в типичном случае, к определенному антигену на клеточной поверхности. Она может также представлять собой гормон со специфичным характером взаимодействия с рецептором клеточной поверхности, или это может быть лекарственное средство, несущее рецептор для клеточной поверхности. Так, например, гликолипиды могут служить для целей достижения полисахаридного рецептора. В качестве неограничивающего примера целевой части можно назвать антитело к a2-GP в глиальных клетках мозга (a2 - гликопротеину), описанное Чехониным с соавт. (Chekhonin et al., FEBS Lett., 287: 149-152, 1991).
В случае полиэтиленоксид-полипропиленоксидного сополимера его гидрофильные/гидрофобные свойства и мицеллообразующие свойства связаны со значением коэффициента n. Коэффициент n определяется по следующей формуле:
n = (|B|/|A|)•(b/a) = (|B|/|A|)•1,32
где |B| и |A| обозначают количество повторяющихся единиц соответственно в гидрофобном и гидрофильном блоках сополимера, в значения b и а представляют собой молекулярные веса соответствующих повторяющихся единиц. Значение параметра n в типичном случае составляет от примерно 0,2 до примерно 0,9, более предпочтительно - от примерно 0,2 до примерно 1,5. При использовании смесей блоксополимеров используется параметр N, который представляет собой средневзвешенное значение n для каждого сополимера из числа входящих в смесь, при этом среднее значение определяется весом частей компонентов-сополимеров. Величина N может использоваться для оценки мицеллообразующих свойств смеси сополимеров. При использовании сополимеров, отличных от полиэтиленоксид-полипропиленоксидных сополимеров, могут быть разработаны аналогичные подходы для соотнесения гидрофобных/гидрофильных свойств одного представителя класса полимеров к свойствам другого представителя класса.
По второму варианту настоящего изобретения полимерные мицеллы предпочтительно образуются из токсичных, фармацевтически приемлемых полимеров.
Фармацевтические композиции по настоящему изобретению могут вводиться с применением различных способов, включая, но не ограничиваясь ими, пероральный, местный, ректальный, вагинальный, легочный с использованием, например, аэрозоля, или парентеральный, который включает, не ограничиваясь ими, внутримышечный, подкожный, внутрибрюшинный или внутривенный способы. Композиции можно вводить по отдельности или можно объединять их с фармацевтически приемлемыми носителем или наполнителем, обычно применяемыми в фармацевтической практике. Для целей перорального введения композиция может иметь форму таблеток, капсул, леденцов, пастилок, порошков, сиропов, эликсиров, водных растворов и суспензий и др. В случае таблеток в качестве носителей могут использоваться лактоза, цитрат натрия и соли фосфорной кислоты. В таблетки обычно включают также различные дезинтегрирующие вещества, такие как крахмал, и замасливатели, такие как стеарат магния, лаурилсульфат натрия и тальк. В состав капсул для перорального применения включают в качестве наполнителей лактозу и высокомолекулярные полиэтиленгликоли. В том случае, когда для перорального ввода необходимы водные суспензии, композиции могут быть объединены с эмульгаторами и суспендирующими агентами. При желании могут также добавляться подсластители и/или вкусовые вещества. Для парентерального введения обычно готовят стерильные растворы конъюгата, подводят соответствующим образом pH растворов /и забуферивают их. При внутривенном введении следует контролировать общую концентрацию растворенного вещества, чтобы препарат был изотоническим. Для глазного введения мази или закапываемые жидкости могут вводиться с помощью известных специалистам систем, таких как аппликаторы или глазные капельницы. Указанные композиции могут включать мукомиметики, такие как гиалуроновая кислота, хондроитинсульфат, гидроксипропилметилцеллюлоза или поли (виниловый спирт), консерванты, такие как сорбиновая кислота, ЭДТА или хлоридбензилхрония, а также обычные количества разбавителей и/или носителей. Для осуществления введения через легочный путь выбирают такие разбавители и/или носители, которые пригодны для получения аэрозоля.
Композиции по настоящему изобретению могут иметь форму суппозиториев для вагинального, уретрального и ректального введения. Такие суппозитории обычно готовят из смеси веществ, которая при комнатной температуре находится в твердом состоянии, а при температуре тела расплавляется. Обычно применяемые для получения таких носителей вещества включают теобромное масло, глицериновый желатин, гидрогенизированное растительное масло, смеси полиэтиленгликолей разного молекулярного веса и эфиры жирных кислот и полиэтиленгликоля. Для получения дополнительной информации о суппозиторных стандартных формах см издание Ремингтона (Remington's Pharmaceutical Sciences, 16th Ed., Mack Publishing, Easton, PA, 1980, pp. 1530-1533). Аналогичные гели могут также применяться для введения вагинальным, уретральным и ректальным способами.
Химиотерапевтические агенты, пригодные для использования по настоящему изобретению, включают, не ограничиваясь ими, алкалоиды винки, такие как винкристин и винбластин, антибиотики типа митомицина, такие как митомицин C и N-метил-митомицин C, антибиотики типа блеомицина, такие как блеомицин A2, антифоляты, такие как метотрексат, аминоптерин и дидеаза-тетрагидрофолиевая кислота, колхицин, демеколин, этопозид, таксаны, такие как паклитаксел (ТаксолR), антрациклиновые антибиотики и др. Антрациклиновые антибиотики представляют собой пример лекарственных средств, для которых имеются проблемы с доставкой в организм, связанные с их низкой стабильностью, развитием в целевых тканях устойчивости к этим антибиотикам или с их быстрым метаболизмом. Указанные антибиотики включают в типичном случае слитую тетрациклиновую агликоновую кольцевую систему, соединенную в 7-ом положении с даунозамином. Они включают, например, соединения, имеющие следующую формулу:
где R1 обозначает гидрокси или метокси группу; R2 обозначает водород или гидрокси и R3 обозначает этил, ацетил, гидроксиацетил или эфир гидроксиацетила. Указанные тетрациклиновые, антибиотики, как и многие другие противоопухолевые средства, действуют скорее всего путем интеркаляционного встраивания между плоскостями ароматических кольцевых структур ДНК и таким образом препятствуют репликации ДНК (CM. Neidle and Waring, Molecular Aspects of Anti-Cancer Drug Action, Pitman Press, 1983). Опухолевые клетки в целом являются особенно чувствительными, поскольку они активно реплицируются и таким образом синтезируют копийные реплики своей ДНК. Указанные антибиотики включают, не ограничиваясь ими, доксорубицин, даунорубицин, краминомицин, эпирубицин, идарубицин, митоксантрон, 4-деметокси-дауномицин, 11-дезоксидаунорубицин, 13-дезоксидаунорубицин, адриамицин-14-бензоат, адриамицин-14- октаноат или адриамицин-14-нафталинацетат.
Предпочтительные классы биологических агентов (включая химиотерапевтические агенты) включают противоопухолевые средства, антибактериальные средства, противопаразитарные средства, противогрибковые средства, CNS агенты, иммуномодуляторы и -цитокины, токсины и нейропептиды. Предпочтительны также те биологические агенты, в отношении которых клетки имеют склонность развивать механизмы устойчивости. Особенно предпочтительные биологические агенты включают антрациклины, такие как доксорубицин, даунорубицин, эпирубицин, идарубицин, митоксантрон или карминомицин, алкалоиды винки, антибиотики типа митомицина, антибиотики типа блеомицина, азоловые противогрибковые средства, такие как флуконазол, полиеновые противогрибковые средства, такие как амфотерицин B, таксановые противоопухолевые средства, такие как паклитаксел, и иммуномодуляторы, такие как фактор некроза опухолевых клеток альфа (TNE α ), интерфероны и цитокины.
Предпочтительные биологические агенты (включая химиотерапевтические агенты) включают, не ограничиваясь ими, противогрибковые средства, такие как амфотерицин B, флуцитозин, кетоконазол, миконазол, итраконазол, гризеофульвин, клотримазол, эконазол, терконазол, бутоконазол, циклопирокс оламин, галопрогин, толнафтат, нафтифин, нистатин, натамицин, ундециленовая кислота, бензойная кислота, салициловая кислота, пропионовая кислота и каприловая кислота. Кроме того, такие агенты включают, не ограничиваясь ими, противовирусные средства, такие как зидовудин, ацикловир, ганцикловир, видарабин, идоксуридин, трифлуридин, фоскарнет, амантадин, римантадин и рибавирин. Такие агенты также включают, не ограничиваясь ими, антибактериальные средства, такие как соединения, близкие к пенициллину, включая β-лактамные антибиотики, пенициллины широкого спектра действия и пенициллины, устойчивые к пенициллиназе (такие как метициллин, нафциллин, оксациллин, клоксациллин, диклоксациллин, амоксициллин, ампициллин, ампициллин-сульбактам, азоциллин, бакампициллин, карбенициллина инданил, циклациллин, мезоциллин, пенициллин G, пенициллин V, пиперациллин, тикарциллин, имипенем и азтреонам), цефалоспорины (цефалоспорины включают цефалоспорины первого поколения, такие как цефапирин, цефаксолин, цефалексин, цефрадин и цефадроксил; второго поколения цефалоспоринов, такие как цефамандол, цефокситин, цефаклор, цефуроксим, цефуроксима аксетил, цефоницид, цефолетан и цефоранид; третьего поколения цефалоспоринов, такие как цефотаксим, цефтизоксим, цефтриаксон, цефоперазон и цефтазидим), тетрациклины (такие как демеклоцитетрациклин, доксициклин, метациклин, миноциклин и окситетрациклин), ингибиторы бета-лактамазы (такие как клавулановая кислота), аминогликозиды (такие как амикацин, гентамицин C, канамицин A, неомицин B, нетилмицин, стрептомицин и тобрамицин), хлорамфеникол, эритромицин, клиндамицин, спектиномицин, ванкомицин, бацитрацин, изониазид, рифампин, этамбутол, аминосалициловая кислота, пиразинамид, этионамид, циклосерин, дапсон, натрий-сульфоксон, клофазимин, сульфонамиды (такие как сульфаниламид, сульфаметоксазол, сульфацетамид, сульфадиазин и сульфизоксазол), триметопримсульфаметоксазол, хинолоны (такие как налидиксовая кислота, циноксацин, норфлоксацин и ципрофлоксацин), метенамин, нитрофурантоин и феназопиридин. Кроме того, такие агенты включают средства, активные в отношении протозойных инфекций, такие как хлорохин, дилоксанида фуроат, эметин или дегидроэметин, 8- гидроксихинолины, метронидазол, хинакрин, меларсопрол, нифуртимокс, пентамидин, натрий-стибоглюконат и сурамин.
Дозировка биологического агента в мицеллярной композиции часто составляет примерно ту же величину, что и в случае одного биологического агента; дозировка устанавливается и предписывается пациенту специалистом-медиком, который учитывает множество факторов, включая возраст, вес и состояние здоровья больного, а также фармакокинетику применяемого агента. Часто количество биологического агента в мицеллярной форме, нужное для эффективного лечения, бывает меньше, чем его количество, применяемое в качестве свободного биологического агента. Для даунорубицина, используемого при лечении рака, типичная дозировка составляет примерно 1 мг на кг веса тела. Винбластин вводится в типичном случае в дозе от примерно 0,1 мг до 0,2 мг на кг веса тела. В основном биологические агенты, используемые по настоящему изобретению, вводятся животным в эффективном количестве. При определении эффективного количества следует учитывать влияние на эффективность сополимера, используемого в композиции. В целом, эффективное количество представляет собой то количество, которое является эффективным либо (1) в плане снижения симптомов заболевания, подлежащего лечению, либо (2) по индуцированию фармакологических изменений, релевантных лечению рассматриваемого заболевания. В случае рака эффективное количество означает количество, эффективное для: снижения размера опухоли; замедления роста опухоли; предупреждения и ингибирования образования метастаз; увеличения ожидаемой продолжительности жизни пораженных животных.
Во многих случаях метаболиты различных биологических агентов создают или повышают уровень нежелательных реакций, возникающих в результате введения лекарственного средства. Это относится, несомненно, к антрациклиновым препаратам, метаболиты которых, по всей видимости, обладают кардиотоксичностью. (См. Mushlin et al. , Br.J. Pharmacol., 110: 975-982, 1993). Сополимерные композиции по настоящему изобретению позволяют снижать скорость метаболизма биологических агентов, снижая, таким образом, их способность оказывать неблагоприятное побочное действие.
Различные противогрибковые средства успешно лечат грибковые инфекции у человека. Однако терапевтическая доза должна зачастую представлять собой компромисс между достижением эффективного уровня лекарственного средства и избежанием токсичного побочного действия. В последнее время появление лекарственной устойчивости у наследственно чувствительных видов, таких как Candida albicans, и повышение частоты наследственной лекарственной устойчивости у ряда видов, таких как Candida kruset, предопределили потребность в поисках новых противогрибковых средств.
Несмотря на то, что флуконазолу свойственна низкая частота побочных реакций, частота устойчивости представляет собой все более возрастающую проблему. Поэтому для таких агентов, как и для других противомикробных средств, желательно иметь доставляющие носители, которые были бы эффективными как в повышении активности химиотерапевтических средств, так и в реверсировании устойчивости к таким агентам.
Ниже изобретение иллюстрируется рядом неограничивающих примеров.
Пример 1. Жирноацильные конъюгаты
Раствор 50 мкл с содержанием 2 мг/мл антитела в α2GP; специфичного к α2- гликопротеину глиальных клеток (Chekhomin et al., FEBS Lett., 287: 149-152, 1991) в 0,1 М боратном буфере (pH 8,5) перемешивают в 2-мл 0,1 М AOT® [натрий бис(2-этилгексил)сульфосукцинат, доступный от Серва Кемикалз Германия (Serva Chemicals)] в октане. Реакция запускается добавлением к смеси двухкратного молярного избытка (относительно полипептида) хлористой соли стеариновой кислоты в 0,2 мл 0,1 М AOT® в октане. Хлорид стеариновой кислоты получают из стеариновой кислоты (доступной от Реахим, Россия) по методу, описанному Кабановым с соавт. (Kabanov et al., Molek. Biologiya (Russian), 22: 473-484 (Engl. Edn.: 382-391), 1988). Реакцию проводят в течение ночи при температуре 25oC. Продукт трижды осаждают холодным ацетоном, растворяют в среде RPMI 1640 и стерильно фильтруют через фильтр с диаметром пор 0,22 мкм. (Поликлональные антитела, используемые в этом эксперименте, взаимодействуют также с кислым фибриллярным глиальным белкой).
Пример 2. Иодинированные целевые части молекулы
Антитело к α2GP метят 125I с использованием реагента Болтон-Хантера (Bolton-Hunter) в системе обращенных мицелл AOT® в октане по методу, описанному Слепневым с соавт. (Slepnev et al. Bioconjugate Chem., 3, 273-274 (1992)). Удельная радиоактивность 125I-меченных белков варьирует от 19 до 21 Ci/моль.
Крысам Вистар (вес тела 80 г, по 8 животных на группу) инъецируют в/в (0,1 мл/10 г веса тела) композицию, включающую 125I-меченное антитело к α2GP (1 MCi/мл), растворенное в смеси 1,5% (вес/объем) сополимера Плуроник Р85 и 2,5% (вес/объем) сополимера Плуроник L64, растворенной в среде RPMI 1640. Эти сополимеры и все другие указанные в примерах сополимеры получены от компании Серва Кемикалз (Германия). 125I-меченный полипептид, растворенный в среде RPMI 1640, вводят в той же концентрации. Через три дня животных забивают и анализируют на радиоактивность отобранные образцы тканей с целью определения распределения ее по ткани, как описано в работе Чехонина с соавт. (Chekhonin et al. , FEBS Lett., 287: 149-152 (1991)). Распределение радиоактивности количественно оценивают с помощью жидкостно-сцинтилляционного счета. Эксперимент повторяют как минимум два раза и получаемые при этом результаты воспроизводятся с наличием менее 10% вариаций.
В табл. представлены результаты, выраженные в виде коэффициенты отношения радиоактивности в мозге к радиоактивности в данной анализируемой ткани (±C.O.).
Пример 3А. Цитотоксичность для устойчивых раковых клеток
Плуроник Р85 растворяют в среде RPMI 1640 [ICN Байокемикалз, Инк., (ICN Biomedicals Inc. , Costa Mesa, CA)] для конечной концентрации 1% и затем стерилизуют полученный раствор фильтрованием для удаления бактериального или грибкового загрязнения. Указанный раствор Плуроника Р85 используют для получения подходящих разведений стерильных лекарственных растворов, применяемых в описанных ниже экспериментах с клеточными культурами.
В исследованиях цитотоксичности используют линию трансформированных клеток SKOV3 (в настоящем описании - SK-клетки) и полученную из них клеточную линию SKVLB (в настоящем описании - SK-устойчивые клетки). Обе указанные линии клеток было предоставлены Д-ром Лингом (V. Ling) из Университета в Торонто. SK-устойчивая клеточная линия представляет собой клеточную линию с множественной лекарственной устойчивостью, которую получают из SK-клеточной линии при длительном культивировании ее в присутствии винбластина.
В среде RPMI или в растворе Плуроника Р85, описанном выше, делают различные разведения множества противораковых агентов. Для этого эксперимента готовят клетки, помещая равные объемы клеточной суспензии (2000-3000 клеток) в ячейки 96-гнездного микротитрационного планшета [Костар Кембридж, МА (Costar Cambridge, MA)] и культивируя их в течение 2 дней. Все процессы культивирования проводят при температуре 37oC и при содержании в атмосфере 5% CO2. После этого добавляют по 100 мкл на каждую ячейку свежей среды (среды RPMI 1630 с добавлением 10% околоплодной сыворотки теленка). Затем в ячейки вносят 100-мкл объемы свободного антиракового агента или сополимера плюс разведения антиракового агента. Клетки подвергают действию указанного лекарства в свободной или мицеллярной форме в течение двух часов. После инкубации клетки промывают три раза свежей средой. Затем уже промытые клетки культивируют в свежей среде еще в течение четырех дней.
Количество жизнеспособных клеток в каждой культуре оценивают методом стандартного ХТТ анализа, который позволяет определять активность митохондриальных ферментов. (См. Scudiero et al. Cancer Res., 48: 4827 (1988)). К клеткам добавляют по 50 мкл в расчете на каждую ячейку стерильного ХТТ в концентрации 1 мг/мл (2,3-бис[2-Метокси-4-нитро-5-сульфофенил] - 2H-тетразолий-5-карбоксианилидная внутренняя соль. Сигма (Sigma, St. Louis, MO) в среде RPMI-1640, содержащей 5 мкл/мл феназина метасульфата (Сигма) в ФБР в концентрации 1,54 мг/мл. Клетки инкубируют в течение 16 часов, после чего в каждой ячейке определяют уровень поглощения при 450 нм. Для каждого значения определяют SEM (среднее значение из трех определений), которое всегда остается в пределах 10% значения. Величину MK50 (т.е. концентрацию, при которой достигается 50% ингибирование) определяют экстраполяцией по графику, на котором число жизнеспособных клеток (т.е. активность митохондриальных ферментов) нанесена в соответствии с концентрацией внесенного в клетки лекарственного средства. Для SK-устойчивых клеток были получены результаты, представленные в табл. 5.
Данные в первом приближении, полученные из вышеприведенных результатов с использованием даунорубицина, представлены в графическом виде на фиг. 1, где концентрация лекарственного средства нанесена на график против активности митохондриальных ферментов в SK-устойчивых клетках, причем как для свободного лекарства (линия 1), так и для его мицеллярной формы (линия 2). На фиг.1 приведены также соответствующие данные для SK-клеток и также для свободной формы даунорубицина и его мицеллярной формы (линия 3 и 4 соответственно).
Пример 3Б - Обработка SK-устойчивых клеток разными агентами.
В эксперименте с SK-устойчивыми клетками применяют процедуры, описанные в примере 3А. Клетки были предоставлены д-ром Лингом (Dr. V. Ling) из Университета с Торонто. Были получены результаты, представленные в табл. 6.
Пример 3В - Кинетика накопления даунорубицина
Кинетику накопления даунорубицина в SK-клетках и SK-устойчивых клетках при обработке их даунорубицином в концентрации 10 нг/мл определяют, измеряя флюоресценцию аккумулированного клетками даунорубицина (λех= 471 нм, λеm= 556 нм). На фиг. 2 представлены данные по накоплению указанного лекарственного средства в SK-устойчивых клетках (линия 1: свободное лекарство; линия 2: мицеллярная форма); на фиг. 2 представлены также данные и для SK клеток (линия 3: свободное лекарство; линия 4: мицеллярная форма).
Пример 3Г - Титрование доксорубицина с использованием различных Плуроников
В этих экспериментах используют CHr C5 линию клеток карциномы яичника китайского хомячка (представленных д-ром Лингом из Университета в Торонто) и методику примера 3А. При использовании Плуроника L61 концентрация вносимого в клетки сополимера составляет 0,01% (вес/объем); при использовании Плуроника Р85 эта концентрация составляет 0,01% (вес/объем); при использовании Плуроника F108 эта концентрация составляет 0,01% (вес/объем); и при использовании Плуроника F68 эта концентрация составляет 5,0 % (вес/объем). Были получены значения ИК50, представленные в табл. 7.
Пример 3Д - Титрование сополимера
Была использована методика примера 3А за исключением двух деталей. Первое отличие состояло в том, что вместо SК клеток используют доксорубицин-устойчивые MCF7 клетки (MCF7- ADRc клетки, которые будут описаны дальше в примере 21). Второе отличие состояло в том, что помимо вариаций в концентрациях доксорубицина в этом эксперименте использовали также различные концентрации сополимера. На фигуре 3А показан процент ингибирования в культурах, в которых имеются различные концентрации Плуроника L61 в ответ на изменения концентрации доксорубицина. Линия 1 относится к доксорубицину; линия 2 относится к доксорубицину в присутствии 0,61 • 10-6 М Плуроника L61; линия 3 относится к доксорубицину в присутствии 0,3 • 10-5 М Плуроника L61; линия 4 относится к доксорубицину в присутствии 0,16 • 10-4 М Плуроника L61; линия 5 относится к доксорубицину в присутствии 0,8 • 10-4 Плуроника L61; линия 6 относится к доксорубицину в присутствии 0,4 • 10-3 M Плуроника L61; и линия 7 относится к доксорубицину в присутствии 0,4 • 10-1 Плуроника L61. На фиг. 3Б эти данные объединены таким образом, что фигура иллюстрирует значение MK50 для доксорубицина, вносимого в клетки в присутствии указанных варьирующих концентраций Плуроника L61.
Пример 4 - Цитотоксичность сополимера
Клетки MCF7- ADRс (клетки, устойчивые к доксорубицину, которые будут описаны позже в примере 21) инкубируют с Плуроником L61 при различных его концентрациях и по методу примера 3А определяют цитотоксичность. Полученные результаты представлены на фиг. 3В.
Пример 5А - Распределение полимера в организме
Из Института атомной энергии им. Курчатова (Москва, Россия) получают радиоактивные меченные тритием производные Плуроника Р85. Вводят в/в по 100 мкл на 20 г веса тела 1% (вес/объем) изотонический раствор радиоактивного сополимера (2•107 имп./мин/20 г веса тела) (а) мышам линии BALB/c (полученным из Ветеринарного отделения Российской Академии Медицинских наук в Крюково, Москва, Россия) и (б) мышам линии BALB/c, которым за 6 недель до эксперимента инъецировали 3•106 мышиных миеломных клеток SP2/0dnr (описанных в примере 9А). Распределение полимера в организме в различные периоды времени после инъекции радиоактивного полимера измеряют после умерщвления в разные временные точки обработанных животных, иссечения тканей, перечисленных ниже в таблице, и количественного определения распределения радиоактивности с помощью жидкостно-сцинтилляционного счета. Для подготовки образцов к жидкостно-сцинтилляционному счету такие образцы помещают в 1 мл солюбилизатора тканей (доступного от компании Серва Кемикалз, Германия) и гомогенизируют на холоде. Полученные гомогенаты инкубируют в течение 14 часов при комнатной температуре, обесцвечивают добавлением 50 мкл 30% перекиси водорода и инкубируют в течение ночи при комнатной температуре. Для мышей BALB/c, которым не были инъецированы опухоли, были получены результаты, представленные в табл. 8.
Для мышей BALB/с с инъецированной опухолью были получены результаты, представленные в табл. 9.
Из этой серии экспериментов были получены дополнительные наблюдения, касающиеся того, что (1) продукты деградации полимеров не обнаруживаются вплоть до 24-часового момента времени после введения полимера и (2) полный клиренс полимера у мышей наступает в период от 250 до 300 часов после введения.
Пример 6А - Концентрации сополимера в крови
6-недельным мышам линии BALB/c инъецируют в/в 100 мкл/20 г веса тела [3H]- Плуроника Р85 из примера 4. На фиг. 4 показан уровень радиоактивности, обнаруженный в крови мышей в разные временные точки после инъекции (темная линия) и в печени (пунктирная линия).
Пример 6Б - Концентрация сополимера в крови
6-недельным мышам линии BALB/c вводят в/в инъекцией или перорально 100 мкл/20 г веса тела [3H]-Плуроника Р85 из примера 4. На фиг. 5 показан уровень радиоактивности, обнаруженный в крови мышей в разные временные точки после инъекции, где первая стрелка в каждой паре указывает на в/в инъецированный полимер, а вторая стрелка - на перорально введенный полимер.
Пример 7 - Фармакокинетика даунорубицина и даунорубицинола
Метаболизм даунорубицина отслеживают с помощью метода ВЭЖХ. Даунорубицин (сигма, Сан Луи, МО) вводят в/в 7 недельным мышам линии С57В1/6 в количестве 10 мг/кг веса тела с использованием в качестве носителя физиологического раствора или физиологического раствора, содержащего 1% (вес/объем) Плуроника 85. Инъецируемые объемы составляют 100 мкл/20 г веса тела. В разное время после инъекции животных умерщвляют и проводят экстракцию смесью хлороформ: метанол (9: 1) крови и гомогената печени. Экстракты высушивают и перерастворяют в водной 0,1% трифторуксусной кислоте (ТФУ). Солюбилизированный экстракт вносят на колонку для проведения ВЭЖХ с обращением фаз размером 4,6х150 мм С18 [15 микрон Ультрасфер, Бекман, США (Ultrasphere, Beckman)]. Через колонку пропускают градиент ацетонитрила от 0 до 40 в 0,1% ТФУ, идентифицируют и количественно определяют пики даунорубицина и его метаболита - даунорубицинола. На фигуре 6А показана концентрация даунорубицина в печени на 150 минуте после инъекции, при этом стрелка А указывает на уровень свободного даунорубицина (мкг на 10 мг ткани печени), а стрелка В указывает на уровень в композиции с сополимером. Фиг. 6Б иллюстрирует временные параметры накопления в крови мышей введенных свободного даунорубицинола (линия 1) и его сополимерной формы (линия 2). Фиг. 6В иллюстрирует временные параметры накопления в крови мышей введенных свободного даунорубицина (линия 1) или его сополимерной формы (линия 2).
Пример 8 - Острая токсичность
Острую токсичность Плуроников F108, Р85 и L61 изучают на 5-недельных самцах мышей линии BALB/c. Каждая экспериментальная группа включает по 6 мышей. Внутрибрюшинно вводят различные дозы изотонических растворов Плуроника. Ежедневно в течение 14 дней отслеживают смертность животных. Значение ЛД50 и максимально переносимую дозу ("МПД", т.е. дозу, при которой ни одно из 6-ти животных, принимавших эквивалентные дозы, не умирает) вычисляют с помощью пробитанализа. (CM. Chan and Hayes in Principles and Methods of Toxicology, Hayes, A. W., ed. Raven Press, New York, 1989, pp. 169-189). Были получены результаты, представленные в табл. 10.
Пример 9A - Обработка опухоли
Линию опухолевых клеток с множественной лекарственной устойчивостью получают серией пассажей линии клеток мышиной миеломы SP2/0 в присутствии 100 нг/мл даунорубицина. Было показано, что устойчивая клеточная линия SP2/0dnr в 10 раз более устойчива к эпирубицину (ИК50 = 0,7 мкг/мл - для родительской линии клеток; ИК50 = 8,0 мкг/мл для линии SP2/0dnr). И когда такие клетки используют для образования опухолей у мышей и через 50 дней после развития твердых опухолей выделяют клетки из опухолей, такие выделенные клетки проявляют такую же устойчивость.
6-недельным мышам линии BALB/c инъецируют подкожно клетки SP2/0drr (3 • 105 клеток). При обработке на день 0, которую начинают через 14 дней после инъецирования опухолевых клеток, мышам вводят в/в инъекцией 20 мкл/20 г веса тела (1) физиологический раствор, (2) изотонический раствор эпирубицина (5 мг/кг веса тела) или (3) изотонический раствор эпирубицина, растворенного в 1% Плуронике Р85 (1 мг/кг веса тела). На фиг. 7 приведены результаты, выраженные в виде изменения коэффициента соотношения среднего объема опухолей (V) к среднему объему опухолей на день лечения 0 (V0) в течение 60-дневного курса лечения. Аналогичные результаты были получены при использовании даунорубицина и Плуроников L61 и F108.
Пример 9Б - Оптимальная терапевтическая доза
Была использована та же самая процедура, что и в примере 9А, с тем исключением, что в ней была взята родительская клеточная линия (SP2/0, нерезистентная линия клеток), а сополимер и его концентрации представлены в табл. 11.
В случае Плуроника F108 оптимальная противоопухолевая эффективность была достигнута при использовании 10% сополимера. Для Плуроника Р85 оптимальная противоопухолевая эффективность была достигнута при использовании 1% сополимера. Для Плуроника L61 оптимальная противоопухолевая эффективность была достигнута при использовании 0,1% сополимера. Эти величины были взяты в качестве оптимальных терапевтических доз (ОТД) для соответствующих сополимеров.
Пример 9В - Курс лечения с использованием сополимеров в количествах, соответствующих ОТД
По процедуре примера 9Б количество каждого: Плуроника F108, Плуроника Р85 и Плуроника L61 - были взяты равными ОТД в качестве носителей для эпирубицина. Полученные результаты представлены на фигуре 8 (ордината показывает соотношение V/Vo).
Пример 10
Плуроник разбавляют средой RPMI 1640 до конечной концентрации 2,0% при температуре 4oC. Смесь инкубируют в течение 30 минут при 37oC и затем стерилизуют фильтрованием через фильтр 0,22 мкм. К указанной смеси добавляют равный объем раствора 200 мкг даунорубицина в среде RPMI 1640 и полученную смесь инкубируют в течение 30 минут при 37oC.
Человеческие клетки карциномы яичника (клетки CRL157) прекультивируют в 1% растворе Плуроника F68 в среде RPMI 1640, содержащей 10% околоплодную сыворотку теленка. Добавляют раствор даунорубицина в Плуронике и смесь инкубируют в течение 60 минут при 37oC, после чего клетки промывают три раза средой RPMI 1640 и культивируют в среде RPMI 1640, содержащей 10% околоплодную сыворотку теленка, в течение 3 дней. Определяют цитотоксичность как для этого препарата, так и для параллельного препарата свободного даунорубицина, с использованием метода Аллея с соавт. (Alley et al. Cancer Res., 48, 589-601 (1988)). Были получены результаты, представленные в табл. 12.
С помощью той же процедуры определяют цитотоксичность для клеток человеческой Т-лимфомы (Jurkat) (см. табл. 13).
С помощью той же процедуры определяют цитотоксичность для мелкоклеточной карциномы легкого человека (Н-69) (см. табл. 14).
Пример 11
Блоксополимеры поли(оксиэтилен)-поли(оксипропилена), характеризующиеся коэффициентами отношения поли (оксипропилена) к поли(оксиэтилену), указанными ниже, диспергируют в среде RPMI 1640 в указанных ниже концентрациях. Смеси инкубируют в течение 40 минут при 30oC. Средний диаметр мицелл измеряют методом квазиупругого светорассеяния. (См. Kabanov et al. Macromolecules 28: 2303-2314, 1995). При этом были получены результаты, представленные в табл. 15.
Пример 12
Смесь Плуроника P85 и Плуроника L64 в соотношении 1:1,5, которые имеют индивидуальные коэффициенты (n) отношений (оксипропиленовых) блоков к (оксиэтиленовым) в диапазоне от 1,00 до 1,50, соответственно, и объединенное значение N, равное 1,30, разбавляют средой RPMI 1640 до конечной концентрации 2,0 % при 4oC. Смесь инкубируют в течение 30 минут при 37oC и затем стерилизуют фильтрованием через фильтр с размером пор 0,22 мкм. Добавляют равный объем раствора 200 мкг даунорубицина в среде RPMI 1640 и инкубируют эту смесь в течение 30 минут при 37oC.
Определяют цитотоксичность для человеческих клеток рака яичника (CRL157) как для данного препарата, так и параллельно для свободного даунорубицина, как было описано в примере 3А. Были получены результаты, представленные в табл. 16.
Композиции даунорубицина оценивают на цитотоксичность для (i) клеток человеческой Т-лимфомы (Jurkat) и (ii) нормальных моноядерных клеток человека. Были получены результаты, представленные в табл. 17.
Пример 13
Для даунорубициновой композиции из примера 12 определяют значения ИК50 относительно (i) клеток человеческой Т-лимфомы (Jurkat) и (ii) нормальных моноядерных клеток человека и сравнивают их с соответствующими значениями для свободного даунорубицина. Измерения проводят в указанные временные интервалы контакта лекарственного средства с клетками. При этом получают результаты, представленные в табл. 18.
Пример 14
Противоопухолевый агент винбластин включают в блоксополимерную смесь, описанную в примере 12. Значение ИК50 для этого препарата относительно SK клеток было определено как 0,121 мкг/мл; значение ИК50 против SK-устойчивых клеток составляет 0,0012 мкг/мл. Значение ИК50 для свободного винбластина относительно SK клеток было определено в размере 0,095 мкг/мл и в размере 0,615 против SK-устойчивых клеток.
Пример 15
Противоопухолевый агент митомицин C включают в блоксополимерную смесь, описанную в примере 12. Значение ИК50 для этого препарата относительно SK клеток было определено как 0,265 мкг/мл; значение ИК50 против SK-устойчивых клеток составляет 0,005 мкг/мл. Значение ИК50 для свободного митомицина C относительно SK клеток было определено в размере 0,320 мкг/мл; значение ИК50 против SK-устойчивых клеток составляет 1,120 мкг/мл.
Пример 16
Противоопухолевый агент метотрексат включают в блоксополимерную смесь, описанную в примере 12. Значение ИК50 для этого препарата относительно SK клеток было определено как 0,880 мкг/мл; значение ИК50 против SK-устойчивых клеток составляет 0,0175 мкг/мл. Значение ИК50 для свободного
метотрексата относительно SK клеток было определено в размере 1,090 мкг/мл; и против SK-устойчивых клеток составляет 1,340 мкг/мл.
Пример 17
Противоопухолевый агент колхицин включают в блоксополимерную смесь, описанную в примере 12. Значение ИК50 для этого препарата относительно SK клеток было определено как 0,720 мкг/мл; значение ИК50 против SK-устойчивых клеток составляет 0,045 мкг/мл. Значение ИК50 для свободного колхицина относительно SK клеток было определено в размере 0,950 мкг/мл; и против SK-устойчивых клеток составляет 7,450 мкг/мл.
Пример 18
Противоопухолевый агент даунорубицин включают в блоксополимерную смесь, описанную в примере 12. Значение ИК50 для этого препарата относительно SK клеток было определено как 0,600 мкг/мл; значение ИК50 против SK-устойчивых клеток составляет 0,0068 мкг/мл. Значение ИК50 для свободного даунорубицина относительно SK клеток было определено в размере 0,620 мкг/мл; и против SK-устойчивых клеток составляет 5,850 мкг/мл.
Пример 19
К 30 мл раствора бычьего сывороточного альбумина в фосфатно-буферном растворе с концентрацией 20 мг/мл добавляют 30 мкл раствора даунорубицина в смеси блоксополимера, описанной в примере 12. Параллельно готовят вторую композицию на основе свободного даунорубицина.
Препараты инкубируют в течение 10 мин при 25oC и затем анализируют методом ВЭЖХ на колонке TSK-3000 SW для гель- фильтрации в ФБР, содержащем 0,3 М хлорида натрия и 5% ацетонитрила. Обнаружение проводят при 280 нм и 470 нм. Часть, связанную с БСА, определяют из формулы:
Db = Sb/Sf
где Sb - обозначает относительную площадь пика при 470 нм (соответствующего даунорубицину), который совпадает с временем удерживания для пика при 280 нм (соответствующего БСА); и
Sf - обозначает относительную площадь пика (или пиков), соответствующих даунорубицину, который(ые) не совпадает (ют) по времени удерживания с пиком БСА.
Получены результаты, представленные в таблице. 19.
Пример 20
Мицеллярный даунорубицин, полученный по методу примера 12, и свободный даунорубицин инкубируют в темноте при 37oC и с помощью приведенного в примере 1 метода определяют цитотоксичность для клеток CRL157 (клеток человеческой карциномы яичника).
Были получены результаты, представленные в табл. 20.
Пример 21
Даунорубициновую композицию по примеру 12 и свободный даунорубицин оценивают против даунорубицино-чувствительных клеток рака молочной железы человека (клеток MCF7) и двух клеточных линий, устойчивых к лекарственным средствам: даунорубицин/верапамил-устойчивых клеток (MCF-7AU), не экспрессирующих Р-170, и даунорубицин-устойчивых, верапамил-чувствительных (MCF7-ADRc), экспрессирующих Р-170. Указанные клетки были получены из банка клеток Московского Исследовательского Центра молекулярной диагностики, Москва, Россия. Были получены результаты, представленные в табл. 21.
Свободный даунорубицин демонстрирует более высокие ИК50 (т.е. является менее токсичным) в отношении обеих устойчивых линий. А Даунорубицин, включенный в блокосополимерную композицию, демонстрирует более низкие ИК50 (т.е. является более токсичным) в отношении обеих устойчивых линий.
Пример 22
Животным в группах (по 6 животных на каждую дозировку), включающих 7-недельных самок мышей линии C57 В1/6 инокулируют внутрибрюшинно даунорубицин, свободный и мицеллярный, полученный по методу примера 12. За мышами ведут наблюдение в течение 14 дней. Концентрации лекарства подбирают таким образом, чтобы каждой мыши инъецировать объем, составляющий максимум 0,5 мл.
Определяют МПД как максимальную дозу, которая не ведет к летальности от даунорубицина (любая более высокая доза ведет к смерти, связанной с введением даунорубицина, по меньшей мере одного животного на группу). Эксперимент повторяют дважды. Результаты воспроизводятся с менее чем 10% вариациями.
Было показано, что МПД для свободного и мицеллярного даунорубицина составляют соответственно 2,0 и 1,0 мкг/кг веса тела.
Пример 23
Даунорубицин вызывает репрессию костного мозга и приводит к развитию обратимой лейкопении, т.е. снижению числа лейкоцитов (низкому уровню лейкоцитов), в ходе введения лекарства. Супрессия костного мозга, равно как и антираковое действие даунорубицина, связаны, как считается, с его ДНК-интеркалирующей активностью, тогда как такое наиболее пагубное побочное действие антрациклинов, как кардиотоксичность, связывают в основном с появлением метаболитов (которые обладают низкой антираковой активностью и не оказывают заметного воздействия на костный мозг). По этой причине уровень лейкоцитов при введении in vivo МПД даунорубицина позволяет оценить соотношение между специфической (ДНК-интеркалирующей) активностью лекарственного средства и его неспецифической токсичностью.
Животным в группах (по 6 животных на группу), включающих 7-недельных самок мышей линии С57 В1/6 инокулируют внутрибрюшинно даунорубицин, свободный и мицеллярный, полученный по методу примера 12. Фармацевтическую композицию, включающую МПД для соответствующего состава, корректируют таким образом, чтобы каждой мыши инъецировать объем, составляющий максимум 0,5 мл. Отбирают образцы крови и подсчитывают количество жизнеспособных лейкоцитов, как описано в работе Михиша с соавт. (Michisch et al., Proc. Natl. Acad. Sci. USA 88, 547-551 (1991)). Число лейкоцитов, определенное после введения 0,1 мл ФБР, используют как контрольное значение. Это значение составляет 15-16 миллионов клеток/мл. Эксперимент повторяют дважды. Результаты воспроизводятся с менее чем 10% вариациями.
Полученные результаты представлены в табл. 22.
Пример 24
Исследуют воздействие свободного и мицеллярного даунорубицина, полученного по методу примера 12, на количество лейкоцитов через три дня после введения, как описано в примере 23.
Были получены результаты, представленные в табл. 23.
Данные, приведенные в примерах 22-24, показывают, что солюбилизация даунорубицина в блоксополимерных мицеллах не влияет в заметной степени на общую токсичность лекарства (что составляет МПД в 2 мг/кг и 1 мг/кг для свободного и мицеллярного лекарственного средства соответственно), тогда как указанная солюбилизация повышает супрессию костного мозга, что приводит к повышению противоракового действия.
Пример 25
Противоопухолевую активность определяют, оценивая цитотоксичную активность плазмы млекопитающих, которым были инокулированы исследуемые композиции (см. Valeriola et al., Cancer Chemother. Pharmacol., 29, 133-140, 1991).
Животным в группах (по 6 животных на группу), включающих 7-недельных самок мышей линии С57 В1/6 инокулируют в/в (через хвостовую вену) даунорубицин, свободный и мицеллярный, полученный по методу примера 12. Лекарственную композицию, включающую МПД для соответствующего состава, корректируют таким образом, чтобы каждой мыши инъецировать объем, составляющий максимум 0,1 мл. Эксперимент повторяют дважды. Результаты воспроизводятся с менее чем 10% вариациями.
Для получения образцов плазмы кровь (10 мкл), отобранную из хвостовой артерии через час после введения лекарственного средства, разбавляют стерильной средой RPMI 1640 в соотношении 1:10 и затем центрифугируют при 400g в течение 15 минут. Полученные супернатанты разбавляют, как указано в таблице, с помощью плазмы, полученной аналогичным способом из мышей, которым не инокулировали лекарственное средство (плазма мышей, которым не было инокулировано лекарственное средство, не оказывает заметного цитотоксического действия на Н-69 клетки), и смешивают с равным объемом суспензии Н-69 клеток в среде RPMI 1640, содержащей 10% околоплодной сыворотки теленка. Клетки инкубируют в течение двух часов при 37oC и 5% CO2 и затем промывают три раза средой RPMI 1640. Предварительно обработанные клетки инкубируют в среде RPMI 1640, содержащей 10% околоплодной сыворотки теленка, при 37oC и 5% CO2 в течение трех дней, после чего определяют цитотоксичность по методу примера 10.
Получают результаты, представленные в табл. 24.
Таким образом, сыворотка мышей, которым вводили мицеллярную композицию, характеризуется более высокой цитотоксичностыо.
Пример 26
Повторяют процедуру примера 25 с использованием SK-клеток и SK-устойчивых клеток. Результаты, полученные при этом, сводятся к следующему:
а) Когда мышам вводят композицию с даунорубицином в дозе, равной МПД, и измеряют цитотоксичность в получаемой при этом плазме, то результаты выглядят таким образом, как в табл. 25.
б) Когда каждой мыши вводят 10 мг/кг даунорубицина, цитотоксичности в получаемых при этом плазмах имеют значения, представленные в табл. 26.
Пример 27 - Обработка Candida флуконазолом Культуральная среда
Используемая для тестирования чувствительности среда представляет собой среду высокого разрешения (HR). Эта среда является оптимальной для тестирования, и готовится она из двух частей следующим образом. Часть A включает 0,2 М фосфатный буфер, pH 7,5, приготовленный с использованием Na2HPO4, стерилизованного автоклавированием. Часть Б включает 2,93 г HR порошка (Unipath) и 0,2 г бикарбоната натрия, растворенного в 100 мл деионизированной воды, которую затем подвергают стерилизации фильтрованием и хранят при 4oC. Перед использованием смешивают равные количества части А и части Б.
Организмы
Используемые в данном исследовании организмы представляют собой свежие клинические изоляты видов Candida или контрольные организмы, применяемые в рутинных исследованиях чувствительности к противогрибковым агентам. Отобранные изоляты охватывают диапазон чувствительности флуконазола, варьирующий от чувствительности к флуконазолу (минимальная ингибирующая концентрация (МИК) составляет 0,2 мкг/мл) до устойчивости к флуконазолу (МИК составляет 100 мкг/мл). Все изоляты подвергают субкультивированию на агаре Сабуро и инкубируют в течение 48 часов перед определением чувствительности.
Подготовка дрожжевых суспензий
Суспензии дрожжей готовят, отбирая пять индивидуальных колоний и суспендируя их в стерильной воде с получением слегка мутной суспензии. Затем суспензию разбавляют в соотношении 1:100 в среде HR с получением суспензии, которая содержит 2 • 104 организмов/мл.
Комплексы полимер/флуконазол
Полимеры получают от компании Серва Кемикалз, Германия. Готовят комплексы полимера с флуконазолом. Перед использованием каждый раствор фильтруют через фильтр с размером пор 0,4 мкм (Сарториус) для гарантированной стерильности.
Приготовление разведений флуконазола/полимера
Вначале оценивают пять полиэфирных блоксополимеров на эффективность флуконазола в присутствии полимера и в его отсутствие. Для разведения растворов флуконазола/полимера используют растворы, содержащие тот же самый полимер. Путем такого разбавления получают стандартный раствор, содержащий 1250 мкг/мл флуконазола. Из стандартного раствора далее делают разведения в полимере с получением концентраций флуконазола в диапазоне от 1250 до 2,5 мкг/мл. В качестве контроля используют растворенный в воде флуконазол в концентрациях от 1250 до 2,5 мкг/мл.
Определение минимальной ингибирующей концентрации (МИК)
Для определения МИК добавляют по 8 мкл каждого разведения флуконазола в полимере к ячейке на стерильном микротитрационном плато. Готовят два набора контролей, которые содержат либо 8 мкл воды, либо 8 мкл флуконазола без полимера. Первый служит контролем на отсутствие лекарства, а второй позволяет оценить любое воздействие полимера на дрожжевые клетки. Затем к каждой ячейке до объема 100 мкл добавляют среду HR. И в конце добавляют по 100 мкл каждой дрожжевой суспензии к соответствующему ряду разведений флуконазола. Каждую дрожжевую суспензию инокулируют на кровяной агар и агар Сабуро для доказательства чистоты и для того, чтобы выверить нужный размер инокулята. Каждую дрожжевую суспензию затем исследуют против флуконазола при конечных концентрациях 50 - 0,1 мкг/мл в пяти различных полимерах или в воде. Конечная концентрация каждого полимера в каждой ячейке составляет 4%, а конечная концентрация дрожжевых клеток составляет 1 • 104 организмов/мл. Микротитрационные плато осторожно перемешивают и затем инкубируют в течение 48 часов при 37oC во влажной атмосфере. Через 24 часа плато оценивают визуально. По прошествии 48 часов плато помещают на качалку для перемешивания в течение пяти минут с целью суспендирования дрожжевых клеток в среде и затем измеряют ОП490 с использованием стерильной культуральной среды в качестве слепой пробы.
Интерпретация МИК
В случае каждого организма оценивают его рост в ячейке с положительным контролем, свободным от лекарственного средства, и полученный результат сравнивают затем с ячейкой, содержащей контроль на полимер, и если ОП490 полимерсодержащей ячейки составляет < 90% от значения ОП490 для контрольной ячейки, делают заключение о том, что полимеру свойственна ингибирующая способность в отношении организма и МИК оценить нельзя. Если же ОП490 полимерного контроля составляет > 90% от положительного контроля, то делается вывод о наличии ингибирующего воздействия, интерпретируют оставшиеся результаты.
Для каждого полимера и каждого организма в качестве значения МИК берут самую низкую концентрацию флуконазола, которая снижает рост (ОП490) на ≥ 50% от ОП490 положительного контроля. Были использованы следующие оценочные допущения для исследования изолятов: < 6,2 мкг/мл - чувствительные; 6,2 и 15,2 мкг/мл - промежуточная чувствительность; и > 12,5 мкг/мл - устойчивые. Полученные результаты представлены в табл. 27.
Пример 28 - Активность TNF α
Цитотоксическую активность TNE α относительно устойчивых SK-клеток определяют с применением ХТТ анализа, как описано в примере 3А. TNE α добавляют к клеткам на 24 часа в различных концентрациях: 1) свободный TNF α ; 2) TNF α в 0,1% Плуронике P85 и 3) TNF α в 0,01% Плуронике L61. После 24 часов инкубации анализируют с TNE α клетки промывают средой RPM1 и анализируют с помощью метода ХТТ. Все экспериментальные точки исследуют в тройном повторе. Данные представляют собой средние значения ± стандартная ошибка. Полученные результаты приведены в табл. 28.
Пример 29 - Лечение экспериментальной опухоли-глиомы
Антитела (Ab) к GFAP и d2-гликопротеину модифицируют остатками стеариновой кислоты, как описано в примере 1. Их также ковалентно связывают с Плуроником Р85, как описано в работе Кабанова с соавт. (Kabanov et al., J. Controlled Release, 22:141 (1992)).
Исследуют терапевтическую эффективность доксорубицина в лечении глиомы. Клетки глиомы С6 инокулируют внутрицеребрально группам (n=25) самцов мышей линии Спрэг-Доли (Sprague-Dawley) (весом 280-300 г), полученных из питомника в Крюково Российской Академии Наук. Через 10, 15, 20 и 25 дней после инокуляции вводят внутрибрюшинно (в объеме 1 мл/300 г веса тела) (а) 10 мг/кг свободного доксорубицина, (б) доксорубицин в 1% Плуронике Р85, (в) доксорубицин в 10% Плуронике Р85, содержащем 0,1 мг/мл Ab, модифицированного хлоридом стеариновой кислоты, и (г) доксорубицин в 10% Плуронике Р85, содержащем 0,1 мг/мл Ab, связанного с Плуроником. Контролям делают внутрибрюшинные инъекции равного объема физиологического раствора. Ежедневно проводят клинические наблюдения. Животных взвешивают еженедельно в течение первых двух месяцев и ежемесячно после этого срока. Проверяют основные жизненные признаки, чтобы удостовериться в том, что животное умерло, и в течение 5 минут после смерти животного проводят некропсию. Анализируют данные по выживаемости животных для того, чтобы ранжировать воздействие лекарственного средства на частоту и латентность опухоли. Приведенные ниже данные представляют собой коэффициент отношения среднего времени выживания в группе лечения (Т) и в контрольной группе (С). Для некропсии берут все важнейшие органы и полностью фиксируют. Хвост (используют в исследовании животных во время жизни) помещают в формалин вместе с тканями животного. Весь мозг удаляют и надрезают в трех разных положениях. Отбирают три разных среза спинного мозга на шейном, грудном и поясничном уровнях. Надрезанные образцы помещают в кассеты для тканей Tissue Tek и обрабатывают в процессоре для тканей. Срезы тканей разрезают на участки толщиной 4-6 мм с помощью микротома и окрашивают их гематоксилин-эозином. С помощью гистопатологических исследований мозга оценивают: (i) общее количество опухолей у животных; (ii) количество животных с опухолью; и (iii) проводят гистопатологическую классификацию и градацию опухолей. Полученные результаты представлены в табл. 29.
Гистопатологические исследования выявили также, что 1) свободный доксорубицин не воздействует на размер и количество опухолей в сравнении с контролем; 2) все 3 мицеллярные композиции вызывают значительное снижение размера и числа опухолей; 3) наиболее выраженный эффект наблюдается в случае мицеллярного доксорубицина + стеароилированные антитела, и в этом случае опухоли практически не наблюдаются.
Пример 30 - Ингибирование процессов образования метастаз
Клетки Н59 карциномы легкого Льюиса (2•105) инъецируют подкожно 6-недельным самцам мышей линии С57В1/6. Мышей умерщвляют на 21 день в атмосфере избыточного количества CO2 и определяют размеры метастазированных опухолей по методу, описанному в литературе (Wilmanns, C.; Fan, D; O'Brian, C.A. et al., (1992) Int. J. Cancer. Inst., 52, 98-104). Инъекция раковых клеток приводит к образованию твердой опухоли на месте инъекции и метастазированных опухолей в легком и печени. Отбирают образцы опухолей от двух мышей и адаптируют для культивирования по описанному в литературе методу (Dong, Z.; Radinsky, R.; Fan, D.; Tsan, R; Bucana, C.D.; Wilmans, C. and Fidler, I.J. (1994) Int. J. Cancer Inst., 86, 913 - 920). Чувствительность in vitro клеточных образцов к свободному и мицеллярному доксорубицину (в 0,01% Плуронике L61) определяют с помощью ХТТ анализа, как было описано в примере 3А. Результаты представлены на фиг. 9. Клетки метастазы в печени характеризуются устойчивостью к свободному доксорубицину. В случае мицеллярного лекарства эта устойчивость реверсирует. Клетки метастазы печени, чувствительные к свободному лекарственному средству, имеют значение ИК50 приблизительно равное ИК50, отмечаемой у родительской клеточной линии Н59. При этом, однако, цитотоксичность в отношении клеток метастазы печени у мицеллярного лекарственного средства остается значительно выше, чем цитотоксичность свободного препарата.
Пример 31
Композицию, пригодную для парентерального введения, готовят растворением 400 мг Плуроника Р-85 и 600 мг Плуроника L-64 в 50 мл среды RPMI 1640 при 4oC. Смесь инкубируют в течение 30 минут при 37oC и затем стерилизуют фильтрованием через фильтр с размером пор 0,22 мкм. Профильтрованный раствор смешивают с раствором 10 мг стерильного лиофилизированного порошка даунорубицина, растворенного в 50 мл среды RPMI, и инкубируют в течение 30 минут при 37oC.
Композицию можно хранить в темноте при комнатной температуре в течение 7 дней без потери активности, или она может быть лиофилизирована и храниться в течение по меньшей мере 1 года в темноте при комнатной температуре.
Пример 32
Еще одну композицию, подходящую для парентерального введения, готовят растворением 400 мг Плуроника Р-85 и 600 мг Плуроника L-64 в 50 мл ФБР при 4oC. Смесь инкубируют в течение 30 минут при 37oC и затем стерилизуют фильтрованием через фильтр с размером пор 0,22 мкм. Профильтрованный раствор смешивают с раствором 1 мг стерильного лиофилизированного порошка даунорубицина и 5 мг глюкозы, растворенных в 50 мл ФБР, и смесь инкубируют в течение 30 минут при 37oC.
Композицию можно хранить в темноте при комнатной температуре в течение 7 дней без потери активности, или она может быть лиофилизирована и храниться в течение по меньшей мере 1 года в темноте при комнатной температуре.
Пример 33
Еще одну композицию, подходящую для парентерального введения, готовят растворением 100 мг аскорбата натрия в 100 мл 9% водного раствора хлорида натрия. К половине раствора добавляют при 4oC 400 мг Плуроника Р-85 и 600 мг Плуроника L-64. Смесь инкубируют в течение 30 минут при 37oC и затем стерилизуют фильтрованием через фильтр с размером пор 0,22 мкм. Отдельно в оставшемся аскорбат-натриево-хлоридном растворе растворяют 10 мг стерильного лиофилизированного порошка даунорубицина и 50 мг глюкозы, оба раствора смешивают и инкубируют в течение 30 минут при 37oC.
Композицию можно хранить в темноте при комнатной температуре в течение 30 дней без потери активности, или она может быть лиофилизирована и храниться в течение по меньшей мере 1 года в темноте при комнатной температуре.
Пример 34
Еще одну композицию, подходящую для парентерального введения, готовят растворением 100 мг аскорбата натрия в 100 мл 9% водного раствора хлорида натрия. К этому раствору добавляют при 4oC 10 мг Плуроника L-61. Смесь инкубируют в течение 30 минут при 37oC и затем стерилизуют фильтрованием через фильтр с размером пор 0,22 мкм. Раствор фасуют вместе с контейнером, содержащим 10 мг доксорубицина.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПОЛИНУКЛЕОТИДНЫЕ КОМПОЗИЦИИ | 1995 |
|
RU2175337C2 |
| СПОСОБ И КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2011 |
|
RU2541100C2 |
| СРЕДСТВО ДЛЯ ДОСТАВКИ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ В КЛЕТКИ И ТКАНИ ОРГАНИЗМА И ЕГО ПРИМЕНЕНИЕ | 2015 |
|
RU2637633C2 |
| ТРЕХФУНКЦИОНАЛЬНЫЕ БЛОКСОПОЛИМЕРЫ ЭТИЛЕНОКСИДА И ПРОПИЛЕНОКСИДА ДЛЯ ДОСТАВКИ АКТИВНЫХ ВЕЩЕСТВ В ЖИВЫЕ КЛЕТКИ | 2012 |
|
RU2501570C1 |
| ПОЛИМЕРНЫЕ СИСТЕМЫ ДОСТАВКИ ДЕЙСТВУЮЩИХ ВЕЩЕСТВ | 2009 |
|
RU2523714C2 |
| СЫПУЧИЙ ПРЕССУЕМЫЙ ПОРОШОК РАПАМИЦИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ | 2012 |
|
RU2557919C1 |
| ВОДОДИСПЕРГИРУЕМЫЕ ПЕРОРАЛЬНЫЕ, ПАРЕНТЕРАЛЬНЫЕ И МЕСТНЫЕ КОМПОЗИЦИИ ДЛЯ ПЛОХО РАСТВОРИМЫХ В ВОДЕ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ, ВКЛЮЧАЮЩИЕ УЛУЧШАЮЩИЕ ИХ СВОЙСТВА ПОЛИМЕРНЫЕ НАНОЧАСТИЦЫ | 2007 |
|
RU2492872C2 |
| СЕЛЕКТИВНЫЕ АНТАГОНИСТЫ РЕЦЕПТОРА EP4 ДЛЯ ЛЕЧЕНИЯ РАКА | 2010 |
|
RU2563817C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ СУПЕРГИДРОФИЛЬНЫЙ АМФИФИЛЬНЫЙ СОПОЛИМЕР И МИЦЕЛЛЯРНЫЙ ЗАГУСТИТЕЛЬ | 2010 |
|
RU2575853C2 |
| КОМПОЗИЦИИ ПОЛИМЕРНЫХ МИЦЕЛЛ | 2001 |
|
RU2308943C2 |
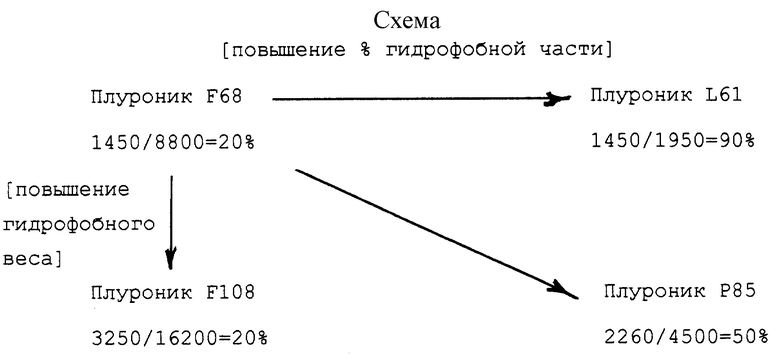
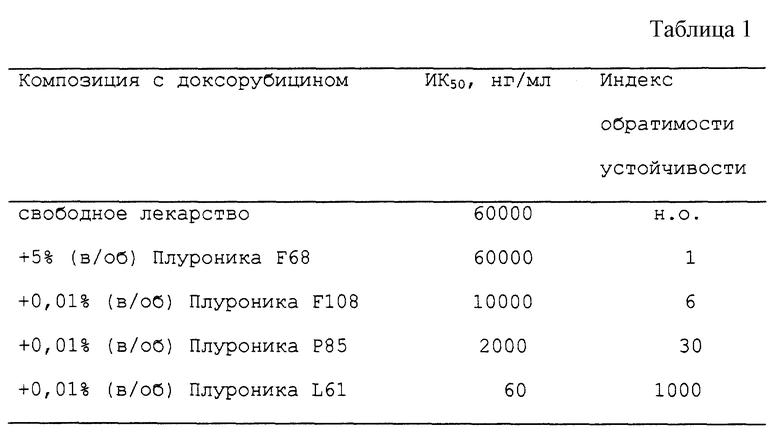

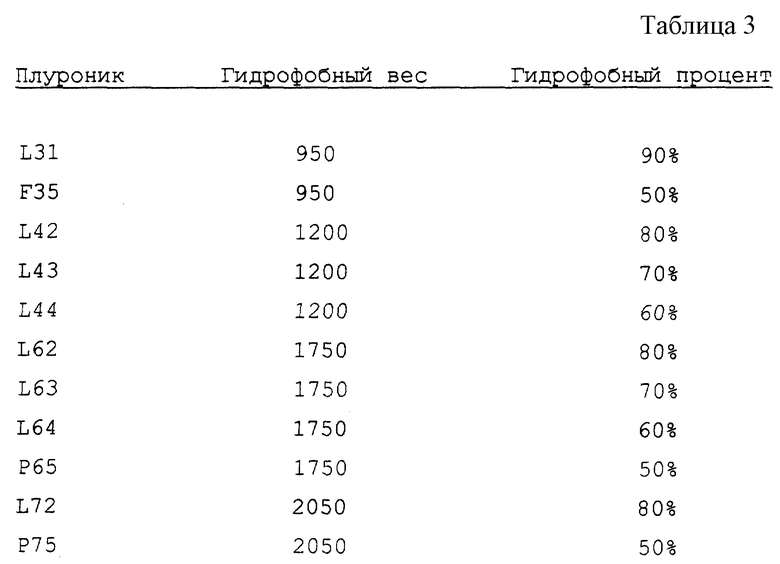


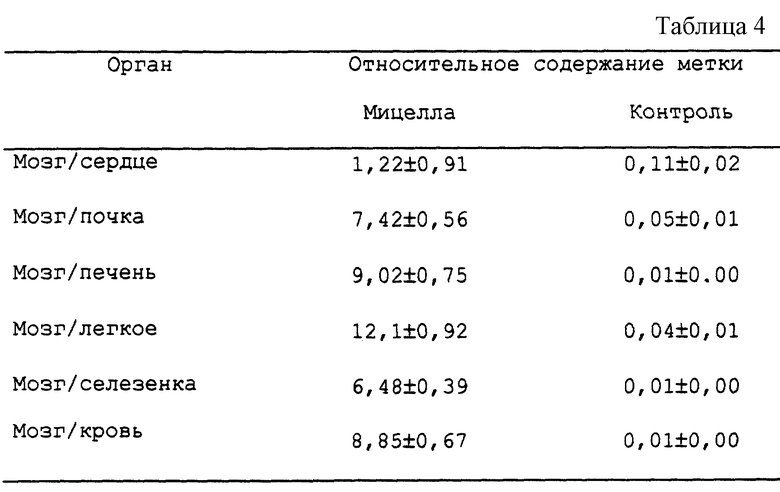
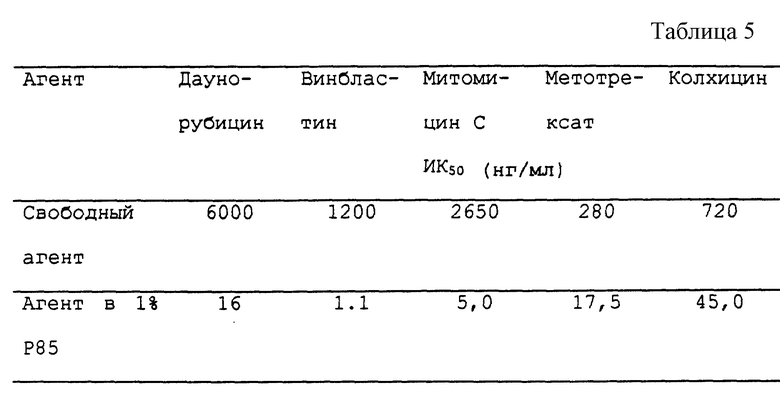


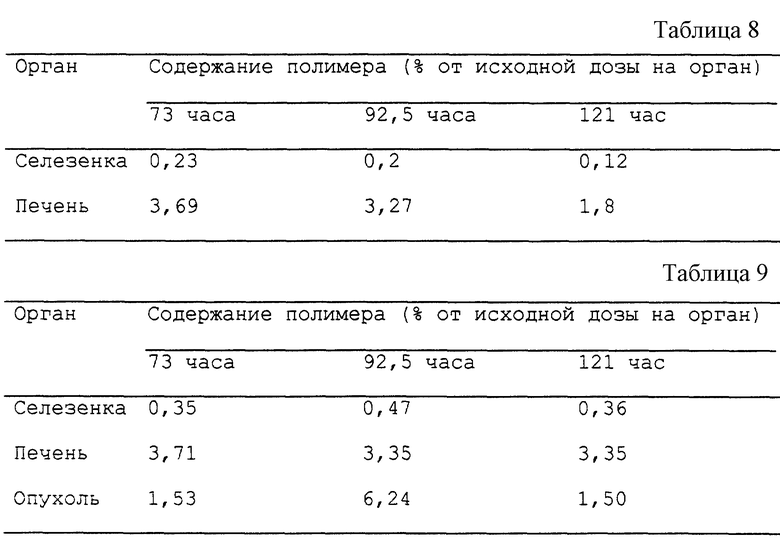
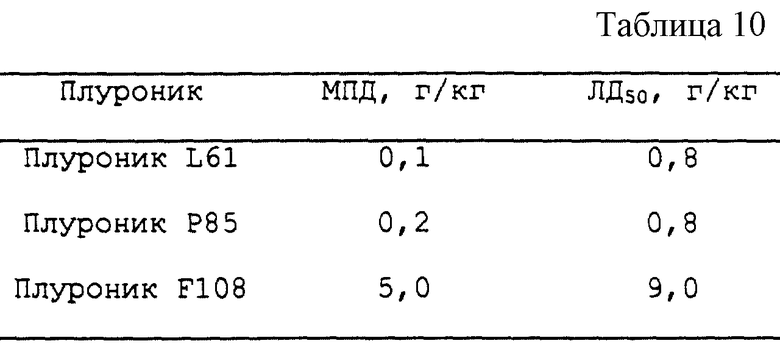


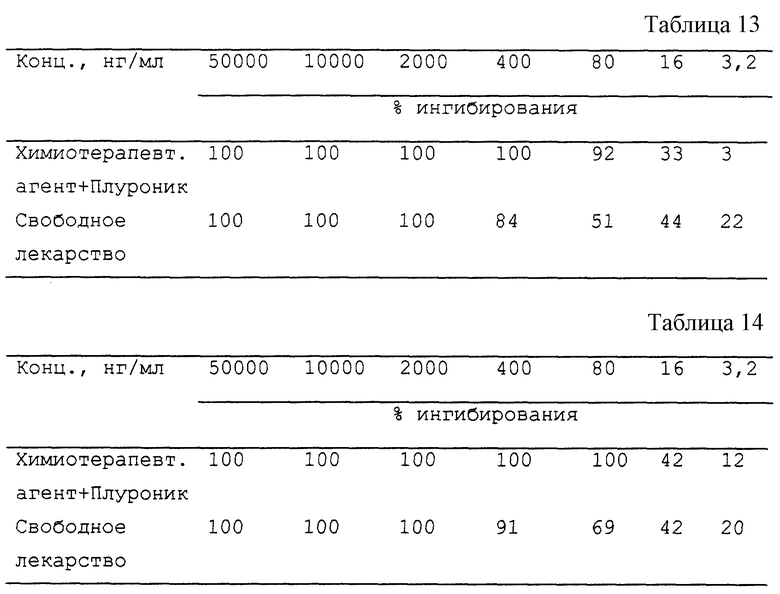
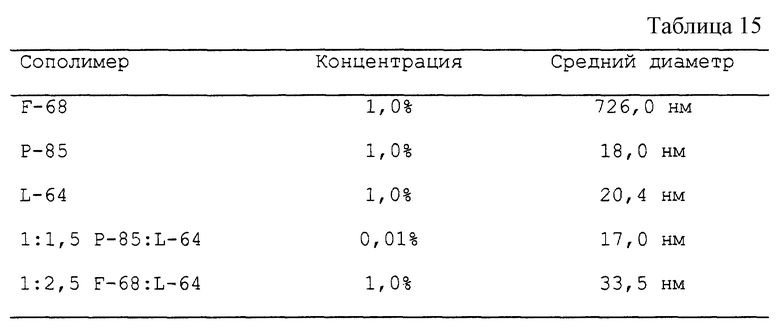

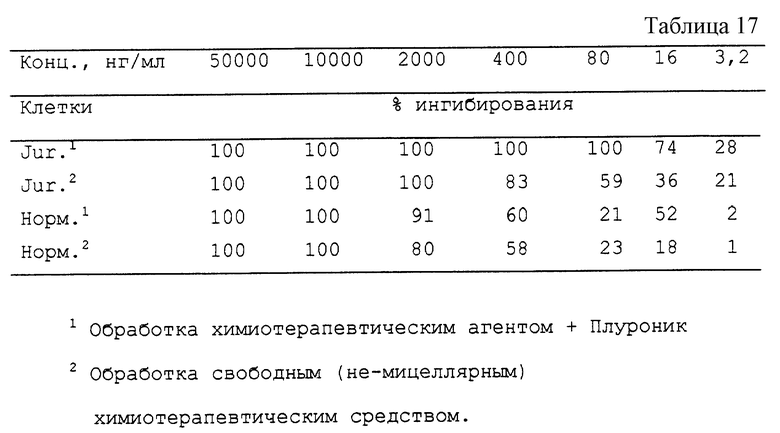
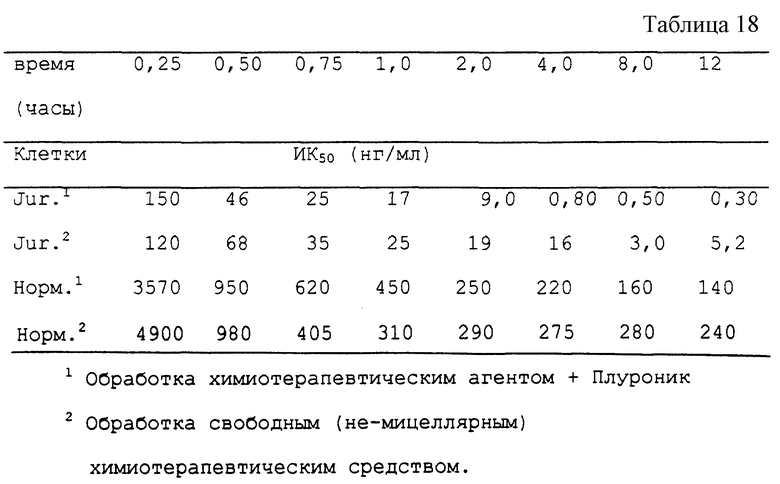
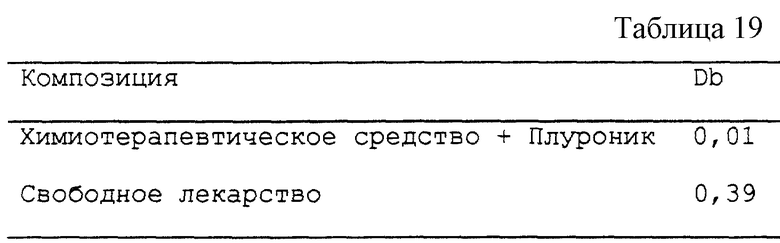

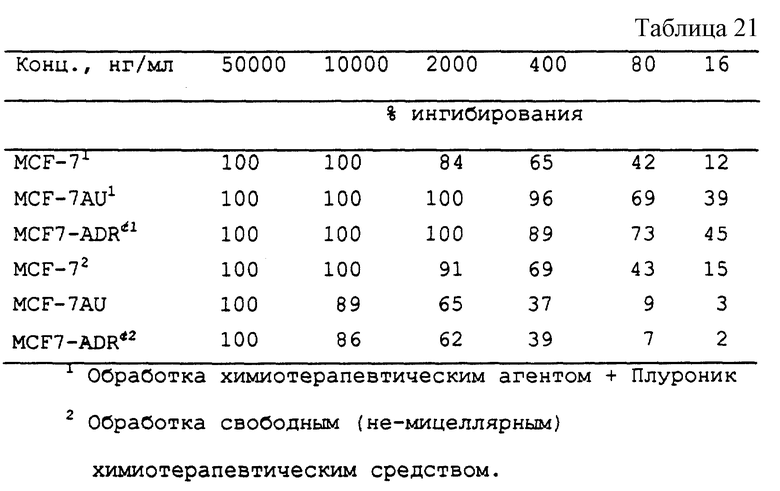



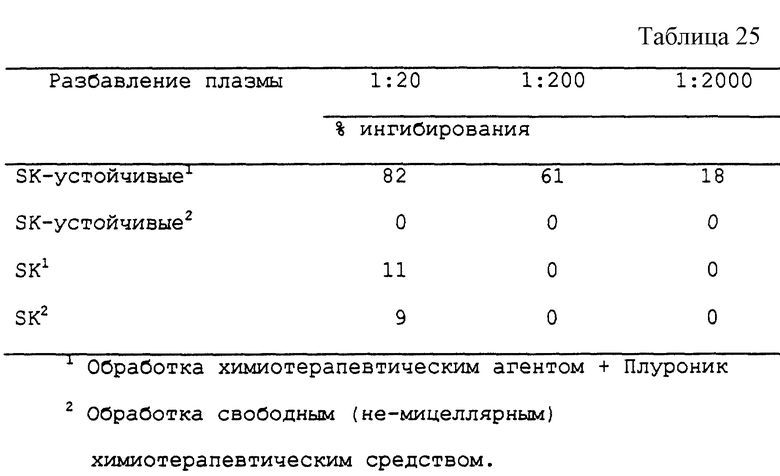
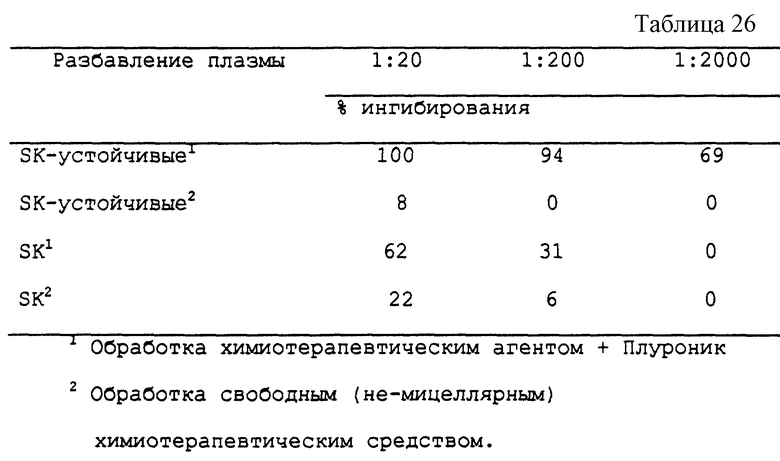
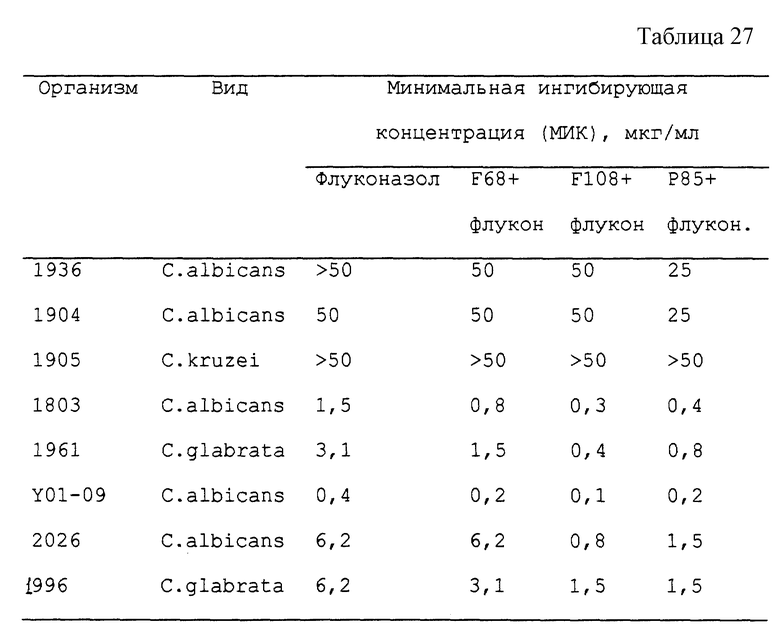
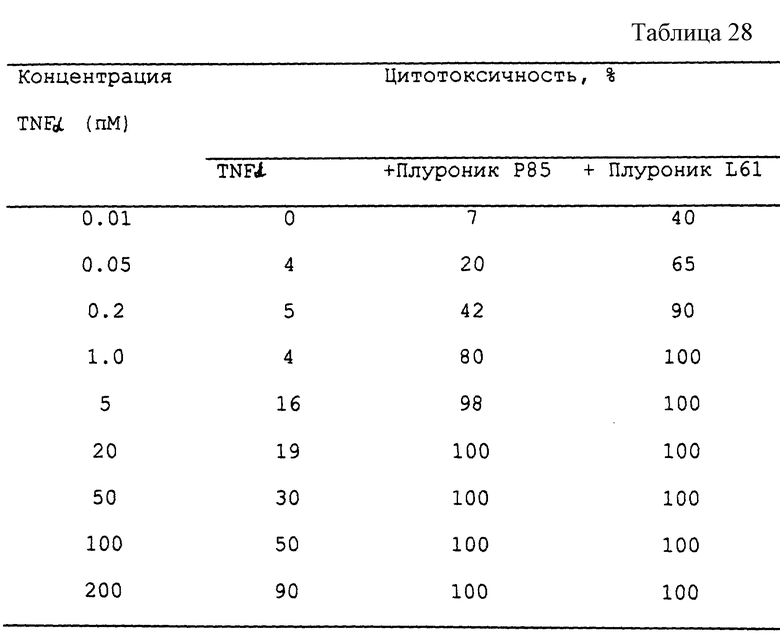
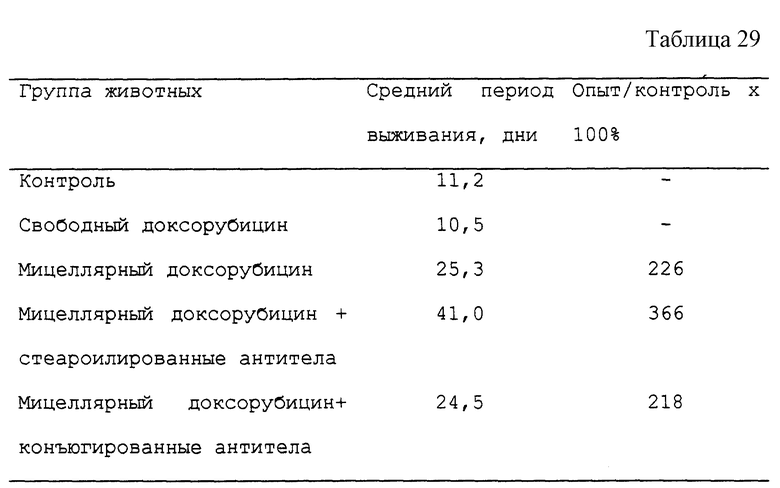
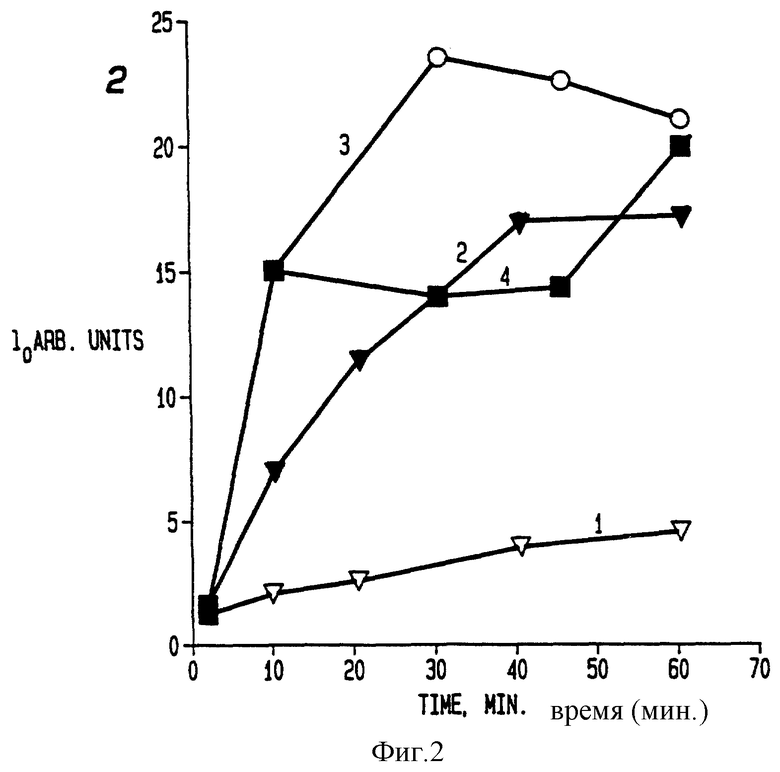
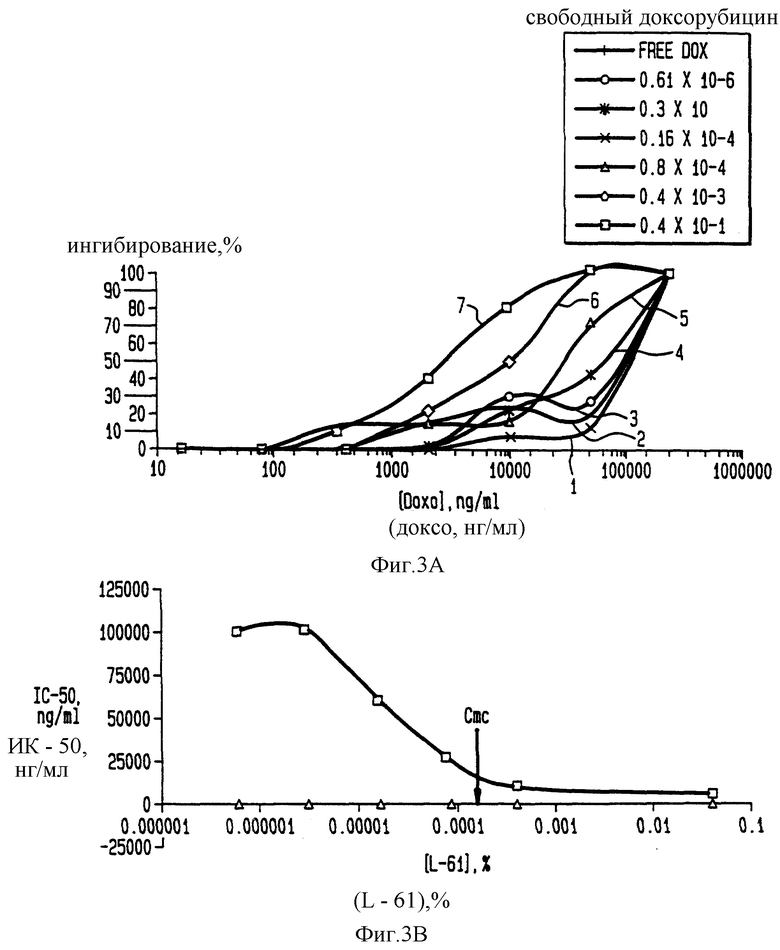
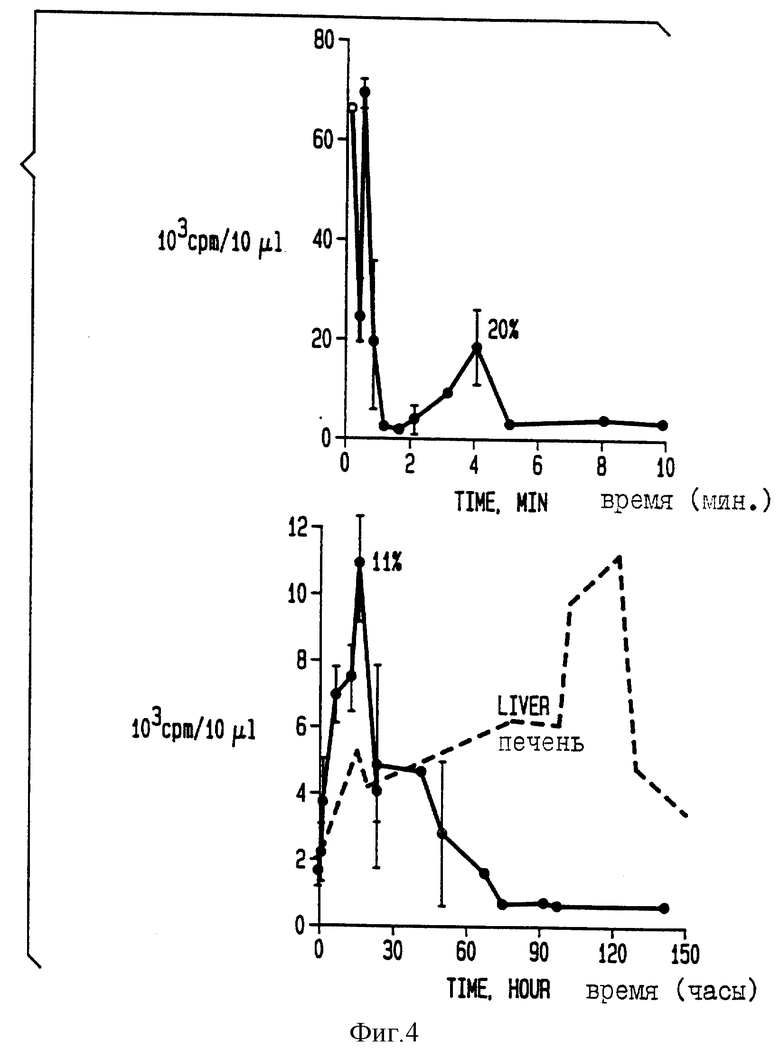
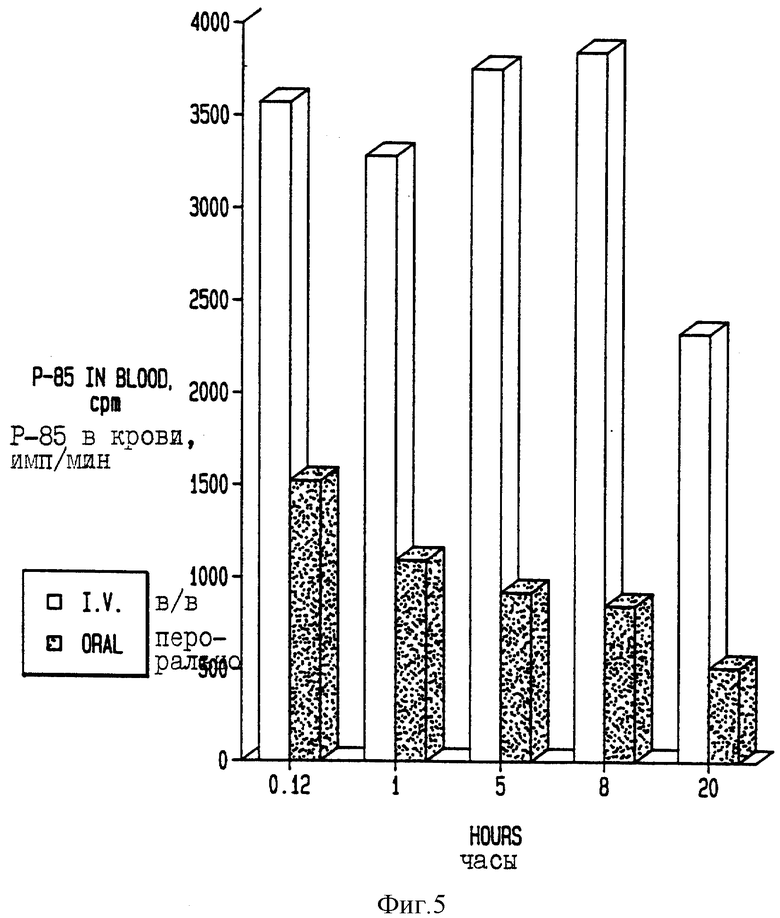
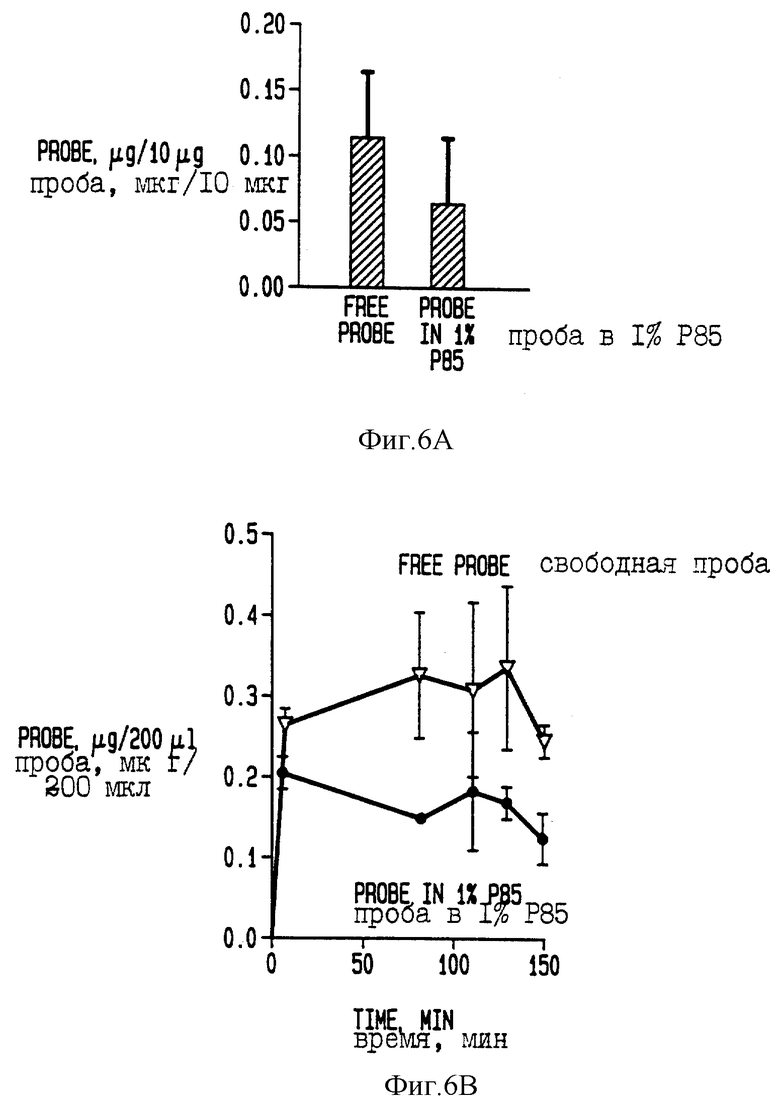
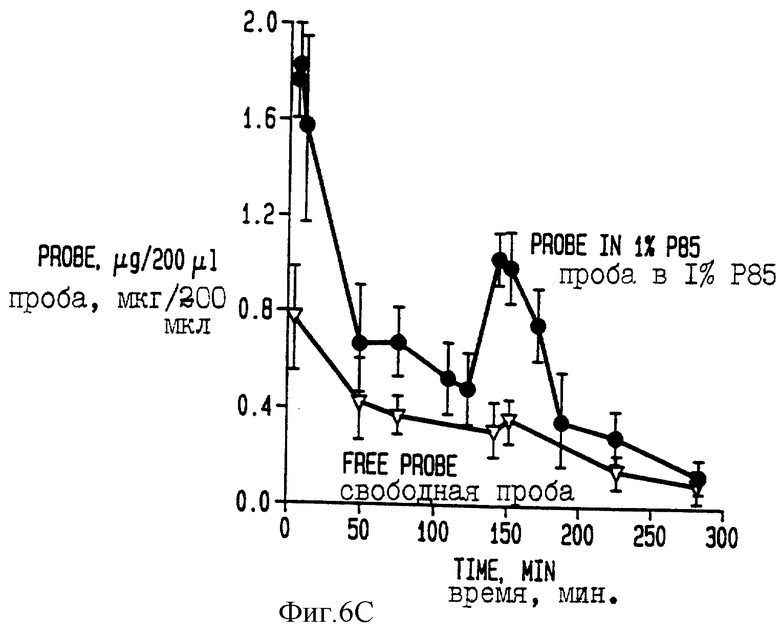
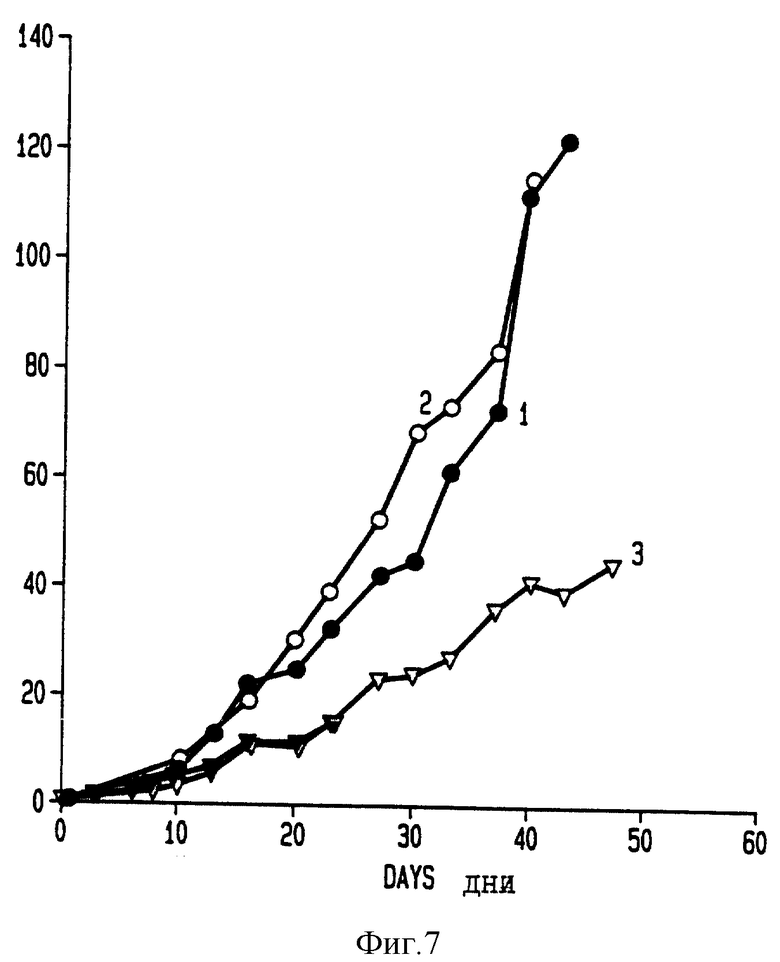
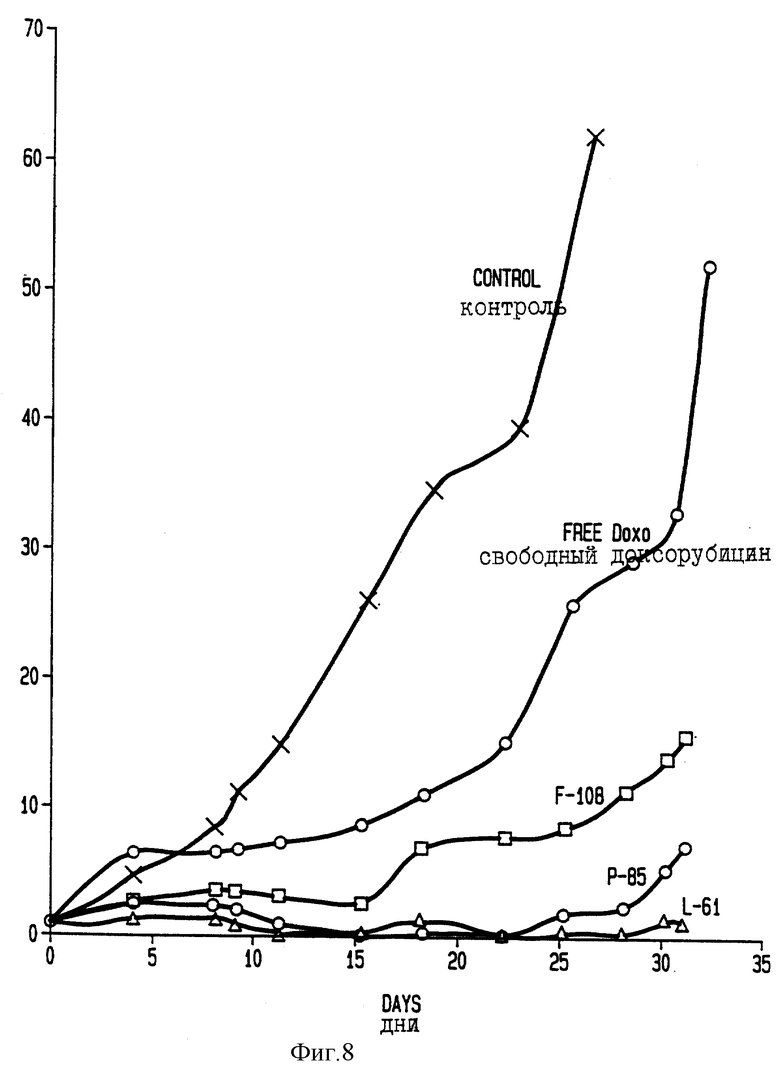
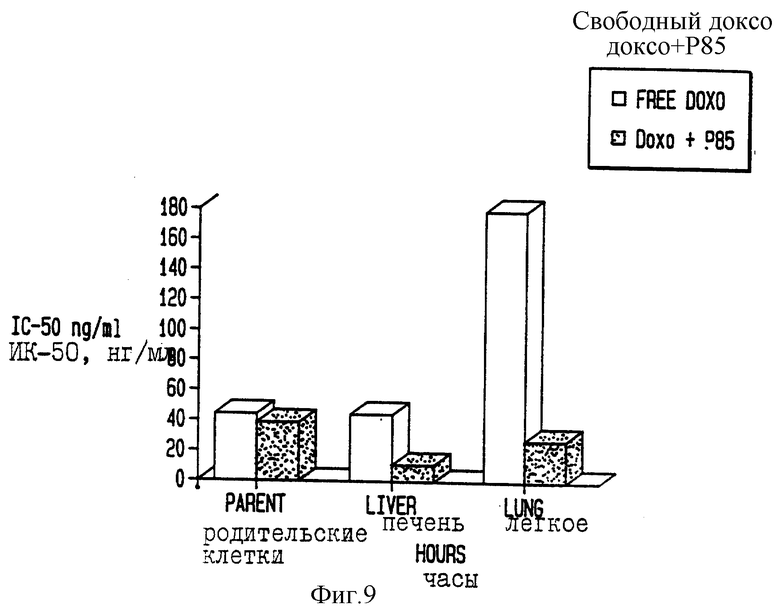
Изобретение может быть использовано в медицине для лечения опухолей. Заявлена композиция, содержащая антираковый агент и полиэфирный блоксополимер, который способен образовывать жидкую композицию при смешении с водой. Блоксополимер включает множество линейных полимерных сегментов с молекулярной массой 30-500. При этом не менее 80% связей, соединяющих повторяющиеся звенья каждого сегмента, являются простой эфирной связью. Блоксополимер имеет критическую концентрацию мицеллообразования (ККМ) от 0,000001 до 0,5% (вес/об. ) или менее 37oС в изотоническом водном растворе. Вторая композиция содержит указанные выше компоненты, при этом блоксополимер имеет весовой процент гидрофобной части не менее 50% и имеет молекулярный вес не менее 900, или ККМ около 0,5% (вес/об.) или менее при указанных выше условиях. Заявлены: способ лечения объекта, обладающего устойчивостью к биологическому агенту, способ лечения рака (животных), способ лечения микробной инфекции, способ ингибирования или предотвращения роста раковых метастаз, способ лечения рака и способ преодоления множественной лекарственной устойчивости раковых клеток. Все эти способы осуществляются введением первой заявленной композиции. Изобретение позволяет получить препараты, эффективно доставляющие лекарственное вещество к опухоли, и восстанавливать чувствительность опухолей к лекарственному воздействию. 8 с. и 49 з.п. ф-лы, 9 ил., 29 табл.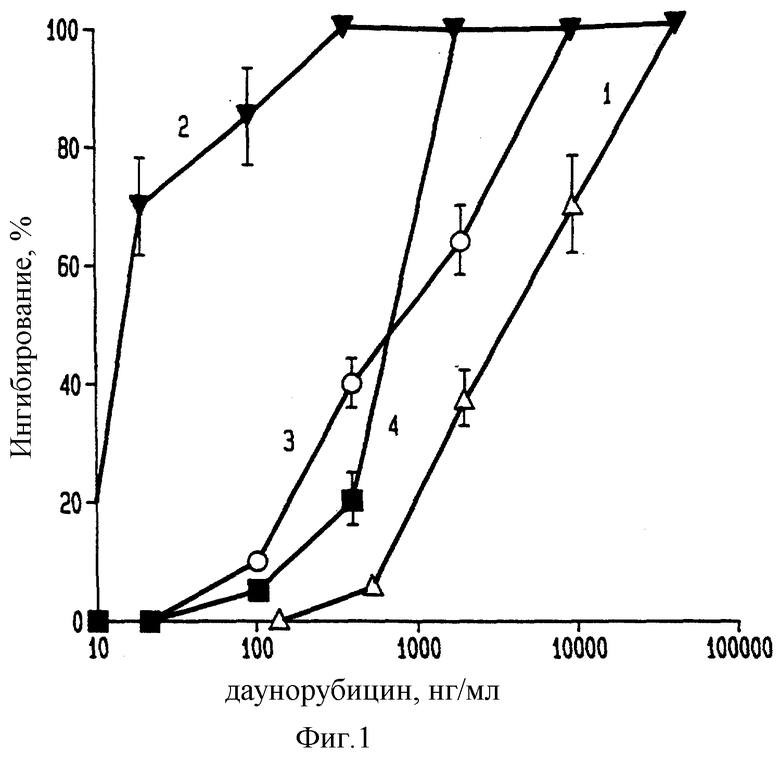
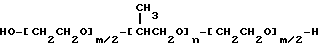
где n и m обозначают целые числа примерно от 4 до 400.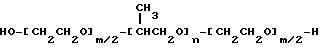
где n и m обозначают целые числа примерно от 4 до 400.
| Экономайзер | 0 |
|
SU94A1 |
| EP 0219922 A2, 29.04.1987 | |||
| ПРИВОД МЕТАЛЛОРЕЖУЩЕГО СТАНКА | 0 |
|
SU397307A1 |
| RU 94011820 A1, 27.12.1995. | |||
Авторы
Даты
2001-05-20—Публикация
1996-06-07—Подача