Изобретение относится к соединениям аминогидрогенизированного хиназолина и их производным, в частности к их новому применению для лечения наркотической зависимости от алкалоидов и синтетического неаминокислотного азота.
Исследования аминогидрохиназолина и его производных проводились на основе известного кристаллического тетродотоксина (ТТХ).
ТТХ - это широко известный аминопергидрохиназолин с молекулярной формулой C11H17N3O8 и молекулярным весом 319,27. Химическую структуру ТТХ можно представить следующим образом: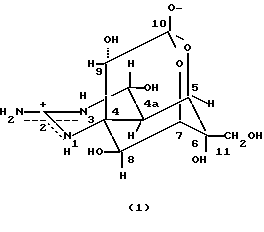
ТТХ был обнаружен в организмах почти сотни видов иглобрюхих, в частности, тетродонтидов, диодонтидов, молидов, триодонтидов и других семейств иглобрюхих. Иглобрюхие относятся к подклассу костистых рыб, классу рыб. Ткани иглобрюхих богаты содержанием ТТХ, включая яичники, печень и органы желудочно-кишечного тракта. Способы экстракции ТТХ из этих тканей описаны T. Goto et al. (Tetrohedron, 21.2059, 1965) и E.F.Murtha (Expte. Therap. 122.246, 1958). Синтез ТТХ описан Y. Kishi et al. в J.Am.Chem.Soc., 94 (26)9217, 9219, 1972. Более поздние исследования показали, что ТТХ и его производные могут быть обнаружены у амфибий, таких как саламандры, моллюсков, таких как осьминоги, панцирных водных животных, морских слизней, членистоногих таких как крабы, в морских звездах и в растениях типа красных водорослей. Совсем недавно было обнаружено, что ТТХ продуцируют также некоторые виды бактерий, например, vibros, pseusdomona, streptomyces josamycetinus и другие. ТТХ является очень сильным ядом, токсичность которого в 1250 раз выше токсичности цианистого натрия. Было определено, что доза ТТХ всего 0,5 мг может вызвать смертельный исход у человека весом 70 кг. В другом источнике информации сообщается, что подкожное введение 300 мкг ТТХ достаточно, чтобы вызвать смертельный исход у человека весом 50 кг.
Хотя ТТХ давно известен, его клинические показания ограничены следующими аспектами:
1. Аналгезия
(1) ТТХ дает явный болеутоляющий эффект при разных болях, вызванных ожогами, травмами, ушибами при падениях, переломами, контузиями и перегрузками, особенно при невралгиях, миалгиях и артралгиях. Если эти заболевания не являются хроническими, ТТХ является сильным аналгетиком.
(2) Местная анестезия
ТТХ может использоваться как средство для местного обезболивания, и он в десять тысяч раз сильнее, чем широко используемые лекарственные средства для местного обезболивания (Kao CY and Fuhrman FA, J.Pharmacol, 140, 31-40, 1965). О комбинированных препаратах ТТХ с широко известными местными обезболивающими средствами сообщалось в патентах США 4022899 и 4029793.
(3) Как потенциальный аналгетик для больных раковыми заболеваниями на поздней стадии ТТХ оказывает удовлетворительное обезболивающее действие при раковых заболеваниях, при этом не сообщалось о том, что он вызывает лекарственную зависимость (Kao CY, Pharm. Rev. 18(2):997, 1966).
2. Седативное действие
(1) Как противозудное средство при зимнем кожном зуде, пруриго, тилаците, чесоточном клеще.
Также способствует выздоровлению от упомянутых дерматозов.
(2) Успокоительное действие при астме и коклюше
(3) Ингибитор при энурезах.
3. Спазмолитическое действие
ТТХ является эффективным спазмолитическим средством при миоспазме, гастроспазме и других видах спазмов, в частности, при тетаноспазме.
4. Понижение кровяного давления
ТТХ дает сильный понижающий кровяное давление эффект, например, введение кошке 2-3 мкг/кг ТТХ (в/в) может резко понизить артериальное давление на две трети от нормального значения, причем это действие очень кратковременное, что, возможно, делает данное средство полезным в качестве первой помощи при гипертоническом кризе в клиниках.
5. Прочее
(1) Сообщалось об эффективности ТТХ для снятия боли у прокаженных (Nomiyama S:Fed.Proc. 31:1117, 1972).
(2) Благодаря своему конгестивному действию, ТТХ может давать терапевтический эффект при мужской импотенции и женской асексуальности.
До настоящего времени не было сообщений о применении ТТХ, соединений аминогидрогенизированного хиназолина и их производных для снятия наркотической зависимости. В данном контексте под наркотической зависимостью подразумевается такое физическое (или психологическое) состояние пациентов, которое называется абстинентный синдром, вызванный продолжительным взаимодействием организма с наркотиком, симптомами которого являются потоотделение, слезотечение, зевота, озноб, гусиная кожа, мидриаз, рвота, диарея, тахикардия, повышенное кровяное давление, бессоница, маниакальный синдром, тремор и другие. Пациенты обязаны постоянно принимать наркотики не в терапевтических целях, а из-за симптомов, возникающих, когда их прием прекращается. Под наркотиками в данном контексте подразумеваются алкалоидные части лекарственных средств, такие как опиум, морфин, кокаин, амфетамин и другие синтетические неаминокислотные нитросоединения, такие как героин, долантин, дигидроэторпин, метадон и т.п.
Угрожающие последствия наркомании требуют от общества поиска новых средств против наркотической зависимости, которые бы отличались высокой эффективностью и отсутствием побочных действий.
До настоящего времени лечение зависимости основывается, главным образом, на заменяющих лекарственных средствах. Коротко это можно резюмировать следующим образом:
1. Прием небольших доз лекарственных средств, содержащих опиум. В ходе лечения содержание опиума постепенно уменьшают до тех пор, пока его применение вообще не прекратится. Такой режим длится достаточно долго (16 дней) и его терапевтическое действие не очень эффективно.
2. Прием метадона перорально. Метадон используется как заменитель вызвавших зависимость лекарственных средств, таких как опиум. На сегодняшний день - это стандартный метод лечения наркотической зависимости, причем многие пациенты могут сами избавиться от наркотической зависимости за 10 дней.
3. Прием дегидроэторфина (ДНЕ). Согласно клиническим испытаниям терапия с уменьшением дозы ДНЕ может ослабить абстинентный синдром в течение 7-10 дней, однако за этот период обычно возникает зависимость от ДНЕ.
4. Прием бупренорфина.
5. Прием других лекарственных средств, в частности, клинидина.
В последнее время появились сообщения о применении комбинаций упомянутых выше лекарственных средств, например, ДНЕ с метадоном использовали для лечения героиновой зависимости (Sha Lijun et al. Xinyao he Lichuang (New Drugs and Clinical Remedies) 13(6), 337-339, 1994), а также небольшие дозы ДНЕ в комбинации с анизодамином дали такой же терапевтический эффект в отношении героиновой зависимости (Su Mujing et al. Chinese Drug Dependence Bulletin, 2 (1): 48-51, 1992). Кроме того, один анизодамин или вместе с хлорпромазином также применяли для лечения наркотической зависимости.
Среди прочих лекарств метадон и ДНЕ сами по себе вызывают привыкание, если их использовать длительное время. Анизодамин, хотя и не вызывает привыкания, может вызывать серьезные побочные действия, такие как помутнение зрения, сухость дыхательных путей, жажду, энурез и т.п.
Следовательно, существует необходимость в новых, не вызывающих привыкания средствах против наркотической зависимости, которые бы отличались высокой эффективностью, не вызывали привыкания и побочных реакций.
Цель изобретения - обеспечить новое применение соединений аминогидрогенезированного хиназолина и их производных, включая ТТХ, для лечения лекарственной зависимости от алкалоидов.
Еще одна цель изобретения - разработать фармацевтическое средство, содержащее соединения аминогидрогенизированного хиназолина и их производные для упомянутого выше терапевтического применения.
Следующая цель изобретения - разработать способы лечения человека от алкалоидной зависимости путем назначения соединений аминогидрогенизированного хиназолина и их производных.
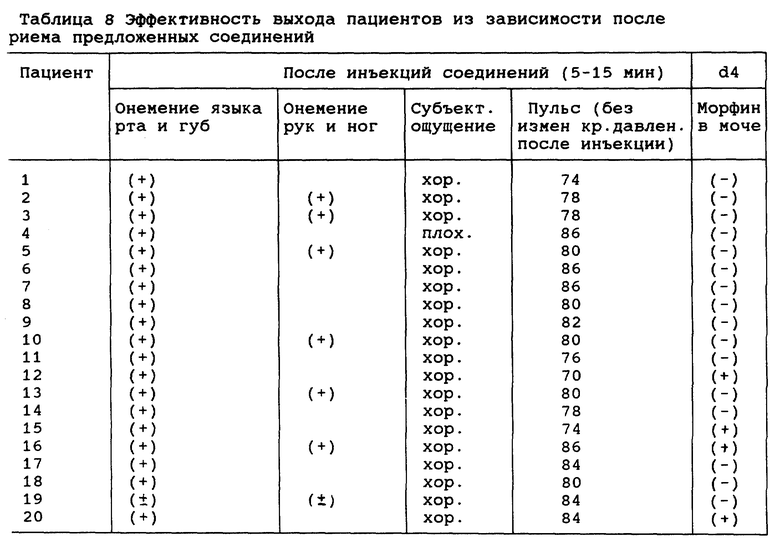
Изобретение относится к применению соединений аминогидрогенизированного хиназолина и их производных, имеющих общую формулу I, для приготовления лекарственного средства от наркотической зависимости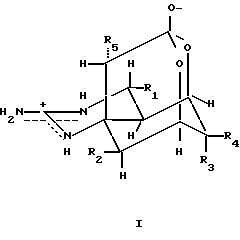
где R2 и R5 выбирают из группы, включающей в себя Н, OH, OAC, соответственно; R1 может быть H или алкилом с C1-C4, OH, OR, OC(О)R', NH2, NHR'', NR''R'', из них R может быть алкилом с C1-C6, R может быть алкилом с C1-С3 и R'', R''' могут быть алкилом с C1-C4, соответственно.
R3 и R4 может быть = 0 или
если R3 является H, R4 выбирают из группы, включающей в себя
-ROH, и R является алкилом с разветвленной или нормальной цепью с C1-C7,
CH(OH)NHOMe,
-NAP-gly,
-NAP-en,
-CH2NH2,
-CH2NHCH3,
-AAG,
-NMAG и
-ANT;
если R3 является OH или OC(0)R и R является алкилом с C1-C3, R4 выбирают из группы, включающей в себя
-CHO,
-CH2-gly,
-CH2-β-Ala,
-CH2-Lys,
-CH2-en,
-CH2-NAP-Lys,
-CH2-NAP-en,
-CH(OH)CH(NH2)COOH;
и -NH (CH2)nCOOH,
-NH(CH2)nNH2; и
-NH(CH)2COOHn
-NH(CH2)nNH2;H и
-NH(CH2)nCH(NH2)COOH,
где n=1-6.
en - этилен;
NAP-4-триазо-2-нитробензамид с формулой (а);
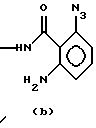
AAG-1-триазо-О-аминобензамид с формулой (b);
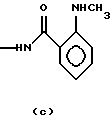
NMAG-О-метиламинобензамид с формулой (с);
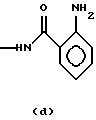
ANT-О-аминобензамид с формулой (d)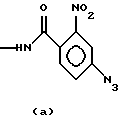
Из них предпочтительными являются три вида соединений с общей формулой II, III, IV.
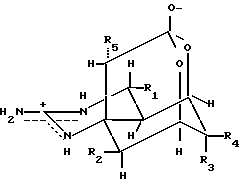
Соединения аминогидрогенизированного хиназолина и их производные являются соединениями со следующей общей формулой II
где R1 может быть выбран из группы, включающей в себя OH, H, алкил или оксиалкил с C1-C4, NH2, NHR'', NR''R'', из них R'' и R''' может быть алкилом с С1-С4.
Из них наиболее предпочтительными соединениями являются
тетродотоксин R1 = OH (1),
деокситетродотоксин R1 = H (2).
Соединения аминогидрогенизированного хиназолина и их производные являются соединениями со следующей общей формулой III:
где R3, R4 = 0 или
если R3 является H, R4 выбирают из группы, включающей в себя
-CH2OH,
-CH(OH)NHOMe,
-NAP-gly,
-NAP-en,
-CH2NH2,
-CH2NHCH3,
-AAG,
-NMAG и
-ANT.
Из них наиболее предпочтительными соединениями являются
тетродотоксин с разлагающимся AAG R4 = AAG (3);
тетродотоксин с разлагающимся NMAG R4 = NMAG (4);
тетродотоксин с разлагающимся ANT R4 = ANT (5) и
разлагающийся тетродотоксин R3, R4=0 (6).
Соединения аминогидрогенизированного хиназолина и их производные являются соединениями со следующей общей формулой IV: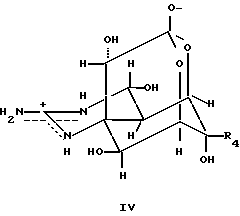
где R4 выбирают из группы, включающей в себя
-CHO,
-CH2-gly,
-CH2-β-Ala,
-CH2-Lys,
-CH2-en,
-CH2-NAP-Lys,
-CH2-NAP-en,
-CH(OH)CH(NH2)COOH;
-NH(CH2)4CH(NH2)COOH;
-NHCH2COOH,
-NHCH2CH2COOH; и
-NHCH2CH2NH2.
Из них наиболее предпочтительными соединениями являются
окситетродотоксин R4 = CHO (7)
хирихитоксин R4 = CH(ОН)CH(NH)COOH (8)
и соединения с замещенными группами R4
-NH(CH2)4CH(NH2)COOH (9)
-NHCH2COOH (10)
-NHCH2CH2COOH (11) и
-NHCH2CH2NH2 (12).
Перечисленные выше соединения аминогидрогенизированного хиназолина и их производные, включая тетродотоксин, могут тормозить абстинентный синдром, вызванный морфиновой зависимостью, и не вызывают привыкание к веществам-антагонистам. Они могут эффективно и быстро тормозить и подавлять абстинентный синдром и вызывать успокоение у пациентов, принимающих соответствующие дозы этих соединений при наиболее резкой реакции абстинентного синдрома. Абстинентный синдром у пациентов подавлялся и исчезал через 5-30 мин после упомянутой терапии. Пациенты успокаиваются и даже чувствуют онемение во рту, на языке и губах, однако не испытывают никаких неприятных ощущений. Онемение противодействует желанию пациентов принять наркотик, такой как героин. Через несколько дней приема (2-8 дней, обычно 2-3 дней) наступает клиническое выздоровление от наркотической зависимости, о чем свидетельствуют полное исчезновение симптомов абстинентного синдрома и отрицательный тест на морфин в моче. После применения описанных выше соединений аминогидрогенизированного хиназолина и их производных не возникает зависимости от них, а также отрицательных и побочных эффектов. При применении соединений аминогидрогенизированного хиназолина и их производных для лечения пациентов ни у одного из пациентов не наблюдалось тошноты, рвоты, коллапса или комы, как это бывает при приеме других лекарственных средств. Не было также замечено побочных эффектов, как при лечении метадоном и ДНЕ.
Предложены также лекарственные составы, которые, если они содержат эффективную дозу перечисленных выше соединений аминогидрогенированного хиназолина и их производных, снимают наркотическую зависимость. Предложенные соединения аминогидрогенизированного хиназолина и их производные могут быть получены с помощью современных технологий при использовании фармакологически приемлемых компонентов, наполнителей и других добавок к разным формам, таким как инъекции (включая подкожные, внутримышечные или внутривенные) или пероральные формы (включая подъязычную) и т.п. Однако ввиду того, что эффективная доза перорального приема намного выше (приблизительно в 20 раз), чем доза для инъекций, предпочтительными являются инъекции. Вышеупомянутые соединения аминогидрогенизированного хиназолина и их производные предпочтительно растворяют в слабокислом водном растворе, например, бензойной или уксусной кислоты с pH 4-5.
При применении для лечения наркотической зависимости эффективная доза вышеупомянитых соединений аминогидрогенизированного хиназолина с формулой cn и их производных составляет от 5 до 300 мкг для подкожных, внутримышечных или внутривенных инъекций.
Предлагается также способ лечения наркотической зависимости путем применения эффективной дозы упомянутых выше соединений аминопергидрохиназолина и их производных посредством приема их перорально или в виде подкожных, внутримышечных или внутривенных инъекций.
Хотя все предложенные для применения соединения для лечения наркотической зависимости являются сильными ядами, их применяемая доза намного ниже токсичной внутривенной дозы, т.к. токсичная доза ТТХ составляет 300 мкг для одного человека.
При применении предложенных соединений аминопергидрохиназолина и их производных отдельно или в комбинации с другими лекарственными средствами против наркотической зависимости требуется 3-5 дней, чтобы снять наркотическую зависимость от опиума, героина, морфина, кокаина, амфетамина, доландина, дигидроэторпина и метадона и других вызывающих привыкание алкалоидов такого типа. Сами они не вызывают привыкания, но излечивают наркотическую зависимость в короткий срок с незначительными токсичным и побочными эффектами при быстром восстановлении здоровья (7-10 дней).
Предпочтительный способ реализации изобретения
Пример 1
3 мг соединения ТТХ (1) растворяли в 200 мл воды, содержащей 9,4 г бензойной кислоты (pH 4), и делили на 100 частей. Каждая часть содержала 30 мкг соединения (1) и вводилась в форме инъекций (1).
Пример 2
15 мг соединения (2) растворяли в 200 мл раствора бензойной кислоты (pH 4) и делили на 100 частей. Каждая часть содержала 150 мкг соединения (2) и вводилась в форме инъекций (2).
Примеры 3-5
10 мг соединения (3)-(5) растворяли отдельно в 200 мл уксусной кислоты (pH 4) и делили раствор на 100 частей для приготовления инъекций (3)-(5), так что каждая инъекция содержала 100 мкг соединений (3)-(5).
Пример 6
15 мг соединения (6) растворяли в 200 мл бензойной кислоты (pH 4) и делили раствор на 100 частей для приготовления инъекции (6), так что каждая инъекция содержала 150 мкг соединения (6).
Пример 7
3 мг соединения (7) растворяли в 200 мл бензойной кислоты (pH 5) и делили раствор на 100 частей для приготовления инъекции (7), так что каждая инъекция содержала 30 мкг соединения (7).
Пример 8
3 мг соединения (8) растворяли в 200 мл уксусной кислоты (pH 4) и делили раствор на 100 частей для приготовления инъекции (8), так что каждая инъекция содержала 30 мкг соединения (8).
Примеры 9-12
6 мг соединений (9)-(12) отдельно растворяли в 200 мл уксусной кислоты с pH 5 и делили раствор на 100 частей для приготовления инъекций (9)-(12), так что каждая инъекция содержала 60 мкг соединения (9)-(12).
Экспериментальная часть
Эксперимент 1: Сравнительный
Материалы и методика
1. Отбор проб
Для лечения наркотической зависимости с применением ТТХ было отобрано 2768 пациентов с наркотической зависимостью, из них 2500 прошли полный курс лечения, а 228 прекратили лечение, т.к. 206 не смогли выдержать абстинентный синдром в первые 3 дня и отказались от лечения, у 17 пациентов были обнаружены серьезные инфекционные заболевания, и еще 5 пациентов были переведены в другие клиники.
Возраст указанных выше 2500 пациентов: от 13 до 45 лет, в среднем 23,5. Период употребления наркотиков: от 0,25 до 20 лет, в среднем 1,8 года. 2125 (85%) пациентов составляли мужчины, остальные 375 (15%) - женщины.
Виды принимавшихся наркотиков: 831 пациент принимал опиум, 1570 - героин, 41 - морфин, 50 - ДНЕ, 5 - долантин, 2 - кокаин и 1 - амфетамин.
Способы приема наркотиков: 930 - внутривенно, 1570 - вдыхали.
Дневная доза приема наркотиков была 5,0-0,1 г. По степени зависимости предварительно пациенты были разделены на легких (группа А) - 1050 пациентов, из них, за вычетом 50, 1000 пациентов прошли полный курс лечения; средних (группа В) - 1100 пациентов, из них, за вычетом 100, 1000 прошли полный курс лечения; тяжелых (группа С) - 569 пациентов, из них, за вычетом 68, 500 прошли полный курс лечения; контрольную группу (группу Д) - 60 произвольно выбранных пациентов, из них, за вычетом 10, 50 пациентов прошли полный курс лечения.
2. Выбор принятых пациентов
2.1 Места проведения эксперимента и пациенты
Местом эксперимента были реабилитационный госпиталь и наркологический центр, одобренные правительством Китая. В эксперименте приняли участие добровольцы с зависимостью от опиума, морфина, долантина, героина, ДНЕ и т.п. Все формальности были добровольно выполнены пациентами или их родными. Пациенты были абсолютно свободны за исключением приема наркотиков в период лечения.
2.2 Диагностический критерий
Диагностирование пациентов проводилось в соответствии с определением наркотической зависимости, данным ВОЗ, и критериями DSM-111-R (США). Перед лечением у пациентов были положительные анализ мочи и тест на зависимость на налоксон и сильно выраженный абстинентный синдром.
3. Программа лечения зависимости
3.1 Деление на группы
Принятые пациенты были тщательно обследованы, затем в зависимости от периода приема наркотиков, их количества, видов, а также физического и умственного состояния, они были разделены на 3 группы: легких, средних и тяжелых, и им была обеспечена общая, интенсивная и специальная терапия.
4. Методика
4.1 Методика наблюдения
4.1.1 В зависимости от клинического абстинентного синдрома, интенсивности и критериев, пациенты были разделены на три категории.
4.1.2 Оценки по частоте возникновения абстинентного синдрома до и после лечения
Категория I 2х5; категория II 3х6; категория III 4х8.
4.1.3 Оценки по отрицательным реакциям до и после лечения.
"1" - известно из опроса;
"2" - терпимое по главным жалобам;
"3" - невыносимое, потребовалось уменьшение количества лекарства;
"4" - прекращено лечение.
4.1.4 Эффект торможения оценивался как сумма приведенных выше двух оценок. Чем ниже оценка, тем лучше эффект торможения, и наоборот.
Принятых пациентов систематически обследовали, включая системное обследование. Абстинентный синдром оценивался по основной жалобе и физической картине синдрома. Лабораторные обследования включали анализ крови, мочи, функции печени, электрокардиограмму, рентген сердца и легких и тест на наличие наркотика в моче. Пациенты с физическими жалобами, психозами и сердечно-сосудистыми заболеваниями были исключены после начала лечения. Велись ежедневные наблюдения и регистрация результатов лечения. Ежедневно, после приема лекарства, пациентам измеряли кровяное давление, пульс и регистрировали отрицательные реакции. Каждый период лечения составлял 3-8 дней. Эффективность лечения оценивали сразу после его окончания и результаты подвергали статистическому анализу.
4.2 Методика лечения
Группа А: лечение ТТХ (начиная с пациента 1);
Группа В: лечение ТТХ + диазепам;
Группа С: лечение ТТХ + вещество-агонист;
Группа Д: контрольная.
Из них в группе А пациенты, принимавшие меньшие дозы наркотиков в течение более короткого периода и имевшие лучшее физическое состояние и более сильную волю, принимали ТТХ внутримышечно по 1 инъекции в день в течение 3-х дней.
В группе В пациенты, принимавшие большие дозы наркотиков в течение более длительного периода и имевшие худшее физическое состояние и более слабую волю, принимали ТТХ с диазепамом. В первые 3 дня ТТХ вводили внутримышечно или внутривенно 1-2 инъекции в день, bid, и внутривенно через капельницу диазепам по 10-20 мг в 500 мл физиологического раствора с 5-10% глюкозы через 4-6 часов после первого приема ТТХ, bid. Пациентам, которые страдали бессонницей, дополнительно давали 50-100 мг винтермина.
В группу С были включены пациенты, принимавшие более 2 г наркотиков ежедневно в течение более двух лет и с зависимостью от опиума, ДНЕ, диазепама, винтермина и т.п. Их физическое и умственное состояние было наихудшим. Для них цель заключалась в снижении наркотической зависимости, а не в полном отказе от наркотиков. Для лечения этих пациентов применялись две методики.
Методика С1: в дни 1-5 вводили ТТХ внутримышечно и в дни 1-3 добавляли вещество-агонист, такое как метадон; в день 1 - 30-40 мг, день 2 - 20-30 мг; дни 3-4 - 20 мг; день 5 - 10 мг перорально. В дни 6-8 - симптоматическое лечение.
Методика С2: в дни 1-5 вводили ТТХ внутримышечно, через 2 часа перорально диазепам 10 мг, клозапин 25 мг. Более тяжелым пациентам назначали внутривенно через капельницу 50-100 мг винтермина в физиологическом растворе с 5-10% глюкозы после первых двух инъекций ТТХ. Было также предложено принимать перорально эстазолам по 3-4 мг/д или перорально клонозепам по 6-10 мг/д в течение 3-4 дней, затем с постепенным снижением дозы до 7 дня.
Группа Д была разделена по двум методикам:
Д1: метадон перорально;
Д2: ДНЕ внутривенно или перорально
Дневные дозы для каждой группы см. в таблице 1.
Результаты
1. Критерий
В данной программе все наблюдения за эффективностью лечения регистрировались ежедневно в одно и то же время и заносились в таблицу для выставления оценок с учетом главных жалоб для подтверждения критерия эффективности лечения.
1.1 Особенно эффективно: Физические симптомы исчезли, психическое состояние существенно улучшилось. Оценки были ниже 25 через 72 часа и ниже 10 в конце курса лечения.
1.2 Эффективно: Физические и психические симптомы улучшились. Оценки были ниже 60 через 72 часа и ниже 25 в конце курса лечения.
1.3 Неэффективно: У пациентов не наблюдалось никакого или очень небольшое улучшение физического состояния. Психическое состояние осталось практически без изменения. Оценки были выше 60 через 72 часа и выше 25 в конце курса лечения или прекращения приема лекарства во время курса лечения.
2. Оценка эффективности
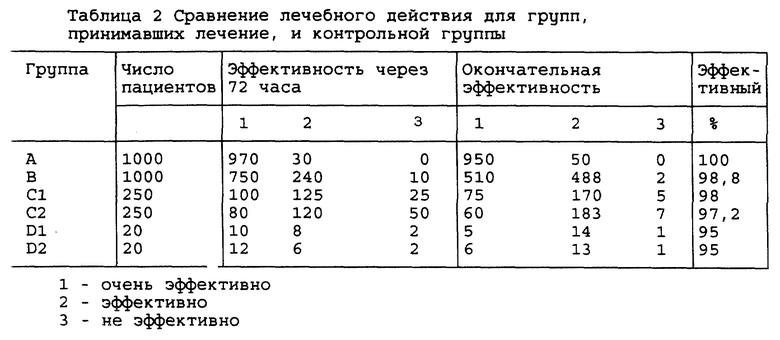
2.1 После приема лекарства группы, проходившие лечение, продемонстрировали значительный эффект торможения возникновения и интенсивности реакции абстинентного синдрома. Терапевтический эффект очень сильно отличался от контрольной группы через 72 часа и в конце лечения (р<0,0 1) (см. таблицу 2).
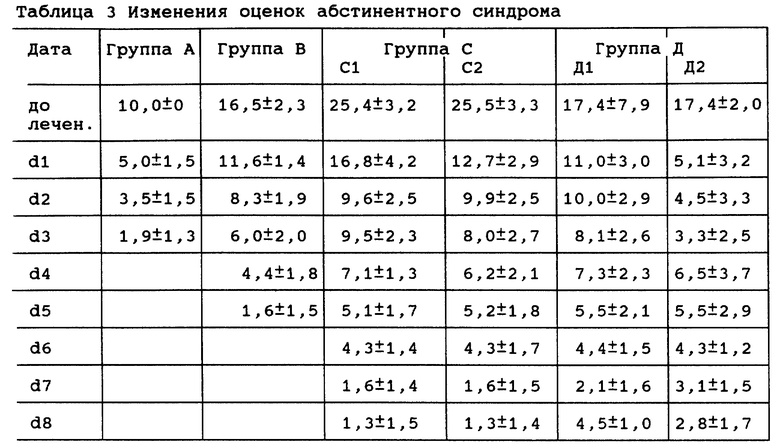
2.2 Эффект торможения при разной интенсивности абстинентного синдрома
См. таблицу 3. Общие оценки синдрома для 6 групп статистически не отличались до лечения (р>0,05), но через 72 часа лечения были отмечены существенные различия в снижении оценок (р<0,01), и не было различия в общем снижении оценок у групп А, В и С1, С2 через 72 часа лечения (р>0,05).
2.3 Эффект торможения при разных симптомах абстинентного синдрома
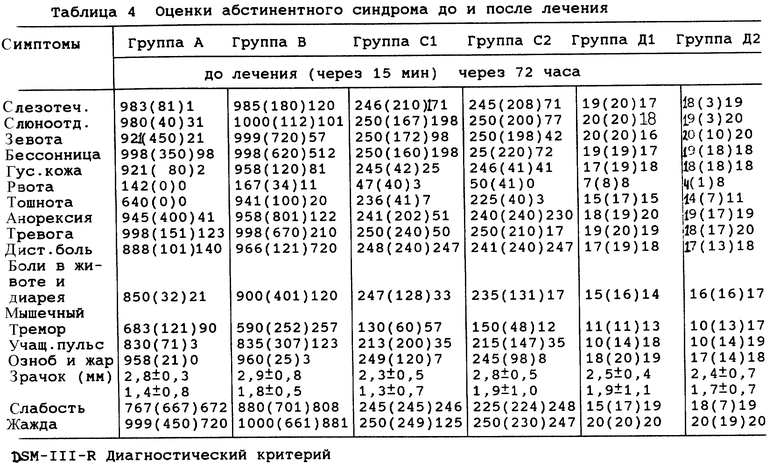
При сравнении частоты разного абстинентного синдрома до и после лечения группы лечения продемонстрировали существенное снижение через 15 мин и через 72 часа лечения, особенно в группах А и В. Результаты лечения разных абстинентных синдромов показаны в таблице 4.
3. Сравнение времени начала действия лекарства
Всем принятым пациентам давали лекарства, когда разные абстинентные синдромы достигали своего пика (оценка синдрома выше 20). Отмечалось время существенного облегчения или исчезновения абстинентного синдрома. Результаты таковы:
ТТХ в/м 3-20 м В среднем: 8,00 ± 2,00 м
ТТХ в/в кап. 2-25 м В среднем: 5,40 ± 1,20 м
ДНЕ в/м 7-25 м В среднем: 10,54 ± 4,50 м
ДНЕ в/в кап 5-20 м В среднем: 13,11 ± 4,12 м
Метадон перор. 50-90 м В среднем: 71,00 ± 21,86 м
ТТХ проявлял свой эффект быстрее, чем контрольное лекарственное средство независимо от способа приема.
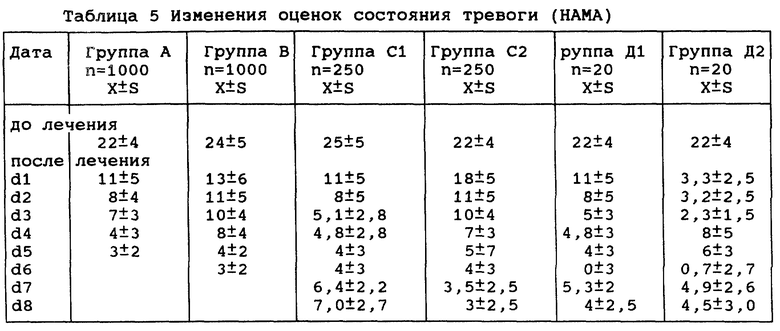
4. Постепенное изменение состояния тревоги
Результаты см. в таблице 5.
Тенденция к изменению состояния тревоги была тесно связана с абстинентным синдромом в каждой группе. Оценки всех 6 групп снизились после лечения, в группах А, В, С1 и С2 наступила стабилизация; в группе Д2 на 4-5-й день состояние тревоги усилилось, но затем постепенно снизилось; в группе Д1 наблюдалось усиление на 8-10-й день после прекращения приема. Все группы А, В и С существенно отличались от группы Д (р<0,05 или р<0,01).
5. Отрицательные реакции на лекарство
Никаких отрицательных реакций не было обнаружено в группе А, В, С1, С2, Д1 и Д2. Никаких аномалий не наблюдалось в крови, печени, функции почек и электрокардиограмме до и после лечения. Анализ мочи на наркотик и тест на зависимость от налоксона были у всех отрицательными после лечения.
Большинство пациентов в группе А после лечения ТТХ испытывало онемение кончика языка и на губах. Это же отмечалось у небольшого числа пациентов группы В и только у нескольких из группы С.
У некоторых пациентов в группах Д2 и Д1 после лечения ДНЕ и метадоном наблюдались головокружение, учащенное сердцебиение, тошнота, потоотделение и т.п.
Почти все тяжелые пациенты систематически испытывали боль и усталость на последней стадии лечения абстинентного синдрома.
6. Количество выбывших из эксперимента
Некоторые пациенты вышли из эксперимента в процессе лечения. В группе А их число составило 5%, группе В - 10%, группе С1 - 12%, группе С2 - 15%, группе D1 - 15% и группе D2 - 35%.
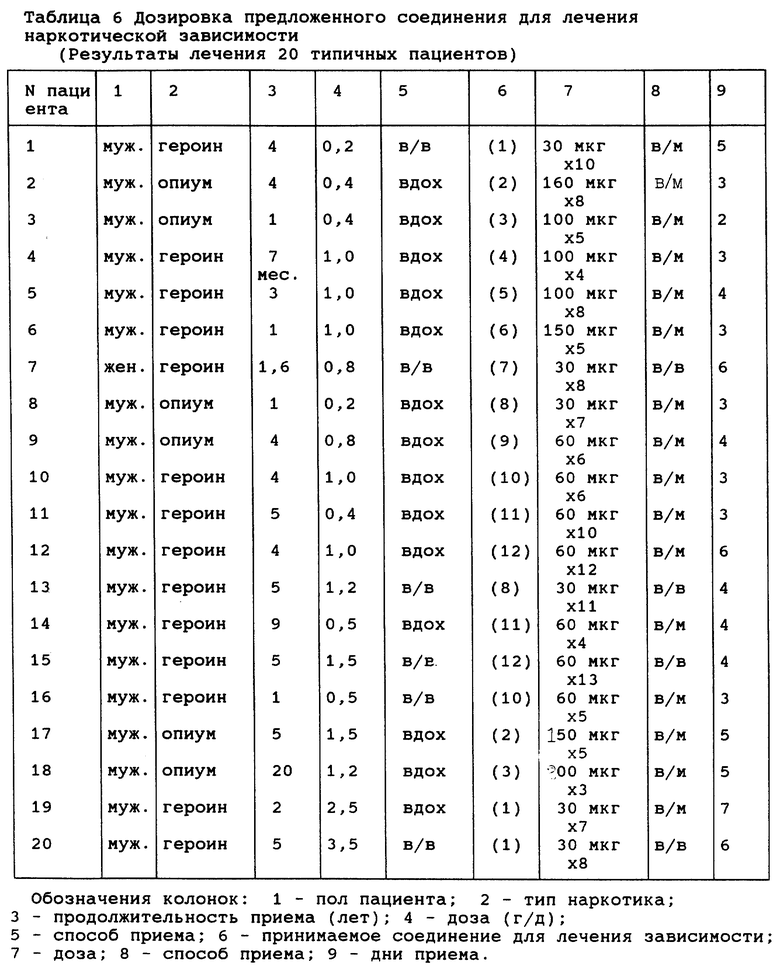
Эксперимент 2: Типичные пациенты
Пациенты 1-20
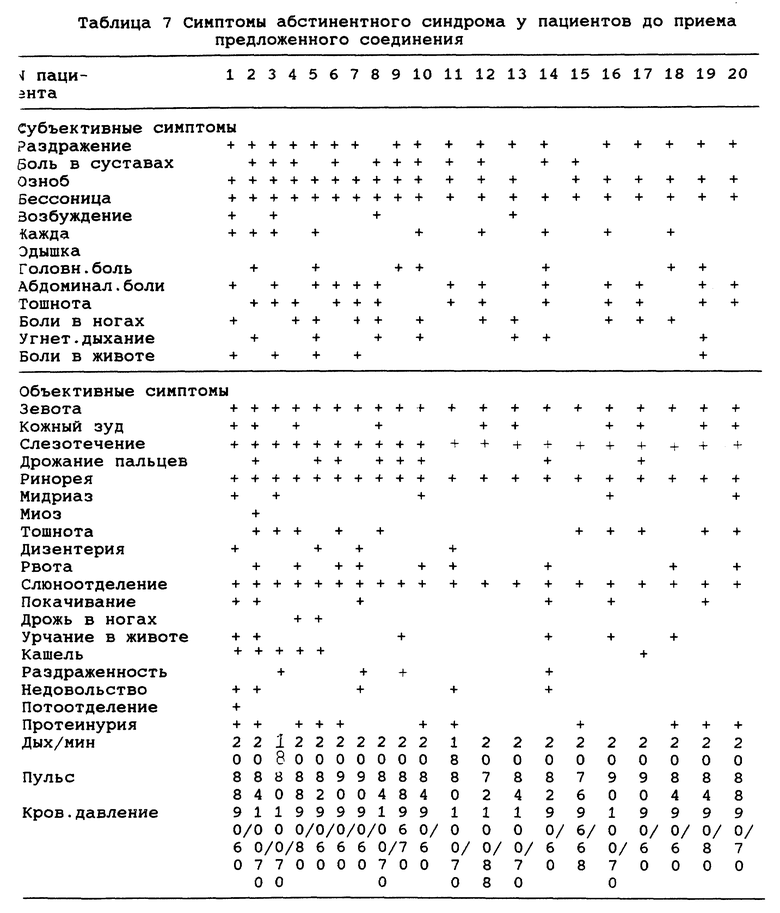
В таблице 6 показаны пол, зависимость от разных видов наркотиков, продолжительность приема наркотиков и пути их приема для типичных пациентов 1-20, а также дозы и дни приема инъекций (пример 1-8) согласно данному изобретению. В таблице 7 показаны оценки абстинентного синдрома до лечения, включая субъективную и объективную оценку синдрома.
В таблице 8 показаны состояния снятия наркотической зависимости через 5-15 мин и 4 дня после приема соединений. Предполагается, что предложенные соединения могут быстро снимать зависимость с меньшими побочными эффектами.
Промышленная применимость
Согласно изобретению предложенные соединения можно использовать для приготовления лекарств для лечения наркотической зависимости.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИРИДИЛ- И ПИРИМИДИЛ-ПИПЕРАЗИНЫ В ЛЕЧЕНИИ БОЛЕЗНЕЙ, ВЫЗЫВАЕМЫХ ЗЛОУПОТРЕБЛЕНИЕМ ЛЕКАРСТВЕННЫМИ И/ИЛИ НАРКОТИЧЕСКИМИ ВЕЩЕСТВАМИ | 1997 |
|
RU2197245C2 |
| СПОСОБ ЛЕЧЕНИЯ НАРКОМАНИИ | 2005 |
|
RU2302227C2 |
| НОВЫЕ ЛИГАНДЫ ВАНИЛОИДНЫХ РЕЦЕПТОРОВ И ИХ ПРИМЕНЕНИЕ ДЛЯ ИЗГОТОВЛЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2008 |
|
RU2498982C2 |
| СИНТЕТИЧЕСКОЕ АНАЛЬГЕТИЧЕСКОЕ СРЕДСТВО И СПОСОБ ЛЕЧЕНИЯ НА ОСНОВЕ ЭТОГО СРЕДСТВА | 2006 |
|
RU2322977C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОПИЙНОГО АБСТИНЕНТНОГО СИНДРОМА | 2000 |
|
RU2185849C2 |
| НОВОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ | 2019 |
|
RU2758255C1 |
| СПОСОБ ЛЕЧЕНИЯ НАРКОМАНИЙ | 2000 |
|
RU2197250C2 |
| СПОСОБ ЛЕЧЕНИЯ НАРКОТИЧЕСКИХ ЗАВИСИМОСТЕЙ | 2003 |
|
RU2288717C2 |
| АНАЛЬГЕТИЧЕСКОЕ СРЕДСТВО И СПОСОБ ЛЕЧЕНИЯ БОЛЕВОГО СИНДРОМА РАЗЛИЧНОЙ ЭТИОЛОГИИ С ПОМОЩЬЮ ЭТОГО СРЕДСТВА | 2007 |
|
RU2367432C2 |
| СПОСОБ ЛЕЧЕНИЯ ОПИЙНОЙ НАРКОМАНИИ | 2005 |
|
RU2290947C1 |
Изобретение относится к медицине. Предложены применение соединений аминогидрогенезированного хиназолина и их производных для лечения наркотической зависимости, а также фармацевтическая композиция и способ лечения наркотической зависимости. Изобретение расширяет арсенал средств указанного назначения. 3 с. и 16 з.п. ф-лы, 8 табл.
где R2 и R5 выбирают из группы, включающей в себя H, OH, OAC, соответственно;
R1 может быть H или алкилом с C1-C4, OH, OR, OC(O)R', NH2, NHR'', NR''R''', из них R может быть алкилом с C1-C6, R' может быть алкилом с C1-C3, и R'', R''' могут быть алкилом с C1-C4, соответственно;
R3 и R4 может быть = O, или, если R3 является H, R4 выбирают из группы, включающей в себя -ROH, и R является алкилом с разветвленной или нормальной цепью с C1-C7, -CH(OH)NHOMe, -NAP-gly, -NAP-en, -CH2NH2, -CH2NHCH3, -AAG, -NMAG и ANT; если R3 является OH или OC(O)R и R является алкилом с C1-C3, R4 выбирают из группы, включающей в себя -CHO, -CH2-gly, -CH2-β-Ala, -CH2-Lys, -CH2-en, -CH2-NAP-Lys, -CH2-NAP-en, -CH(OH)CH(NH2)COOH, -NH(CH2)nCOOH, -NH(CH2)nNH2 и -NH(CH2)nCH(NH2)COOH, где n = 1 - 6; en - этилен; NAP - 4-триазо-2-нитробензамид; AAG - 1-триазо-O-аминобензамид; NMAG - O-метиламинобензамид; ANT - O-аминобензамид,
в качестве средства для лечения наркотической зависимости.
где R1 может быть выбран из группы, включающей в себя OH, H, алкил или оксиалкил с C1-C4, NH2, NHR'', NR''R''', из них R'' и R''' может быть алкилом с C1-C4.
где R3, R4 = O или, если R3 является H, R4 выбирают из группы, включающей в себя -CH2OH, -CH(OH)NHOMe, -NAP-gly, -NAP-en, -CH2NH2, -CH2NHCH3, -AAG, -NMAG и ANT, причем en, NAP, AAG, NMAG и ANT имеют те же определения, что и выше.
где R4 выбирают из группы, включающей в себя -CHO, -CH2-gly, -CH2-β-Ala, -CH2-Lys, -CH2-en, -CH2-NAP-Lys, -CH2-NAP-en, -CH(OH)CH(NH2)COOH, -NH(CH2)4CH(NH2)COOH, -NHCH2COOH, NHCH2CH2COOH и -NHCH2CH2NH2, причем NAP имеет то же определение, что и выше.
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| GB А 1370905, 16.10.1974 | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| US А 3898339, 05.08.1975 | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| ДУНАЕВСКИЙ В.В | |||
| и др | |||
| Наркомания и токсикомания | |||
| - М.: Медицина, 1990. | |||
Авторы
Даты
2001-06-10—Публикация
1995-03-11—Подача