Предметом данного изобретения является фармацевтическая композиция, которая ингибирует рост злокачественных новообразований и опухолей у млекопитающих, в частности у человека и теплокровных животных. Композиция содержит смесь (1) N-хлорфенилкарбаматов или N-хлорфенилтиокарбаматов и (2) производных N-фосфоноглицина, которые являются системными гербицидами. Данную композицию можно также применять для лечения вирусных инфекций.
Предпосылки изобретения
Раковые опухоли являются причиной смерти животных и людей. Точная причина появления раковых опухолей не известна, но ряд исследователей демонстрируют связь между определенным видом деятельности, например курением или подверженностью действию канцерогенов, и появлением определенных типов раковых образований и опухолей.
Показано, что химиотерапевтические агенты многих типов эффективны против раковых и опухолевых клеток, но не все типы раковых образований и опухолей реагируют на эти агенты. К сожалению, многие из этих агентов разрушают также нормальные клетки. Точный механизм действия этих химиотерапевтических агентов не всегда известен. Несмотря на успехи в области лечения рака на сегодняшний день первостепенное значение имеют хирургия, облучение и химиотерапия. Считают, что химиотерапевтические способы борются с раковыми метастазами или особо агрессивными его формами. Такие цитоцидные (разрушающие клетки) или цитостатические агенты наилучшим образом работают на раковых образованиях с большими факторами роста, то есть таких, клетки которых быстро делятся. На сегодняшний день набор терапевтических средств, имеющихся в распоряжении онкологов, включает гормоны, в частности эстроген, прогестерон и тестостерон, и некоторые антибиотики, производимые различными микробами, алкилирующие агенты и антиметаболиты. В идеале крайне необходимы цитотоксические агенты, обладающие специфичностью относительно раковых и опухолевых клеток и не действующие на обычные клетки. К сожалению, таких не обнаружено, а вместо этого используют агенты, поражающие особо быстро делящиеся клетки (как опухолевые, так и обычные).
Ясно, что прорывом в данной области была бы разработка материалов, которые поражают опухолевые клетки вследствие некоторой уникальной специфичности к ним. С другой стороны, желательны были бы материалы, цитотоксичные относительно опухолевых клеток и оказывающие мягкое воздействие на обычные клетки.
Следовательно, предметом настоящего изобретения является обеспечение фармацевтической композиции, эффективной в ингибировании роста опухолей и злокачественных новообразований у млекопитающих при мягком воздействии на обычные клетки или при отсутствии такового.
Более подробно предметом настоящего изобретения является обеспечение противораковой композиции, включающей фармацевтический носитель и определенные в данной работе производное N-хлорфенилкарбамата или N-хлорфенилтиокарбамата в комбинации с производными N-фосфоноглицина, наряду со способом лечения таких раковых заболеваний.
Эти композиции эффективны также против вирусов.
Следовательно, еще одним предметом настоящего изобретения является обеспечение композиции для и способа лечения вирусных инфекций, таких как герпес, ВИЧ, грипп и риновирусы. Эти и другие цели изобретения будут очевидны из последующего подробного описания данного изобретения.
Краткое описание изобретения
Фармацевтическая композиция для лечения млекопитающих и, в частности, теплокровных животных и человека, отличающаяся тем, что включает фармацевтический носитель и эффективное количество противоракового соединения, выбранного из группы, состоящей из смеси (1) и производных N-фосфоноглицина формулы: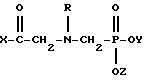
где X выбирают из группы, состоящей из гидрокси-группы, алкокси-группы или хлоралкокси-группы длиной до 12 атомов углерода; низшей алкенокси-группы, циклогексилокси-группы, морфолино, пирролидинила, пиперидино и NHR'; Y и Z каждый независимо выбирают из водорода и низшего алкила; и R выбирают из группы, состоящей из водорода, формила, ацетила, бензоила, нитробензоила и хлорированного бензоила; а R' выбирают из группы, состоящей из водорода, низшего алкила и низшего алкенила, циклогексила, феналкила длиной до 8 атомов углерода, фенила, хлорированного фенила и анизила; и определенных солей этих соединений, при этом соли выбирают из группы, состоящей из солей металлов I и II Групп с атомными номерами до 30, гидрохлорида, ацетата, салицилата, пиридина, аммония, низшего алифатического углеводородного амина, низшего алканоламина и анилина; и
(2) N-хлорфенилкарбаматов или N-хлорфенилтиокарбаматов формулы: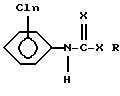
где X является кислородом или серой; n равно от 1 до 3; R выбирают из группы, состоящей из водорода, низшего алкила и низшего алкенила, циклогексила, феналкила длиной до 8 атомов углерода, фенила и фармацевтически приемлемых солей этих соединений органических и неорганических кислот.
Эти композиции можно использовать для ингибирования роста рака и других злокачественных опухолей у людей или животных посредством введения эффективного количества производных N-фосфоноглицина и N- хлорфенилкарбаматов или N-хлорфенилтиокарбаматов перорально, ректально, локально или парентерально, внутривенно или путем прямой инъекции рядом с опухолью или в опухоль. Эти композиции эффективно убивают или замедляют рост опухолей, а для обычных здоровых клеток они безопаснее, чем адриамицин.
Эти композиции эффективны также против вирусов, таких как ВИЧ, герпес, грипп и подобные.
Подробное описание изобретения
А. Определения
Использованное здесь выражение "фармацевтически приемлемый" компонент обозначает компонент, подходящий для применения людьми и/или животными без чрезмерных вредных побочных эффектов (таких как токсичность, раздражение и аллергическая реакция), соответственно разумному соотношению пользы/риска.
Использованное здесь выражение "безопасное и эффективное количество" относится к количеству компонента, которое при использовании в соответствии со способом данного изобретения достаточно для произведения желаемого терапевтического действия без чрезмерных вредных побочных эффектов (таких как токсичность, раздражение и аллергическая реакция), соответственно разумному соотношению пользы/риска. Конкретное "безопасное и эффективное количество", очевидно, варьируют в зависимости от таких факторов как конкретные симптомы, подлежащие лечению, физическое состояние пациента, вид подлежащего лечению млекопитающего, продолжительность лечения, основные характеристики совместно проводимого лечения (если таковое проводится) и конкретно применяемые препараты и структуры соединений или их производных.
Использованный здесь термин "фармацевтические соли присоединения" включает фармацевтически приемлемые соли противораковых соединений. Они включают соли аминов и щелочных или щелочноземельных металлов с карбоновыми кислотами. Использованный здесь термин "фармацевтический носитель" обозначает фармацевтически приемлемый растворитель, суспендирующий агент или наполнитель для доставки противоракового агента в организм животного или человека. Носитель может быть жидким или твердым, его выбирают в соответствии с планируемым способом введения. Использованный здесь термин "рак" относится ко всем типам злокачественных новообразований, или неоплазмы, или опухолей, обнаруженных у млекопитающих. Использованный здесь термин "противораковые соединения" обозначает N-фосфоноглицины в комбинации с N-хлорфенилкарбаматами или N-хлорфенилтиокарбаматами.
Использованный здесь термин "вирусы" включает вирусы, которые вызывают болезни вирусные инфекции) у теплокровных млекопитающих, например, ВИЧ, герпес, грипп, риновирусы и подобное.
Б. Противораковые соединения
Противораковыми соединениями являются комбинации (1) N-фосфоноглицинов и (2) N-хлорфенилкарбаматов или N-хлорфенилтиокарбаматов, которые известны своим гербицидным действием. Они являются системными гербицидами, применяемыми для профилактики и искоренения определенных растений или семян или для регулирования роста растений. Карбаматы имеют следующую структуру: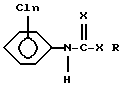
где n равно от 1 до 3; R выбирают из группы, состоящей из водорода, низшего алкила и низшего алкенила, циклогексила, феналкила длиной до 8 атомов углерода, фенила, и фармацевтических солей присоединения этих соединений, а X является серой или кислородом.
Предпочтительными соединениями являются те, в которых R является алкилом длиной от 1 до 4 атомов углерода, предпочтительно изопропилом, и X является кислородом.
Эти соединения получают способами, описанными в патенте США 2 695 225, Witman (1954) и Патенте США 2 734 911, Strain (1956).
N-фосфоноглицины имеют формулу: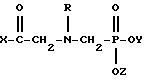
X выбирают из группы, состоящей из гидрокси-группы, алкокси-группы или хлоралкокси-группы длиной до 12 атомов углерода;
низшей алкенокси-группы, циклогексилокси-группы, морфолино, пирролидинила, пиперидино и NHR'; Y и Z каждый независимо выбирают из водорода и низшего алкила; и R выбирают из группы, состоящей из водорода, формила, ацетила, бензоила, нитробензоила и хлорированного бензоила; а R' выбирают из группы, состоящей из водорода, низшего алкила и низшего алкенила, циклогексила, феналкила длиной до 8 атомов углерода, фенила, хлорированного фенила и анизила; и определенных солей этих соединений, при этом соли выбирают из группы, состоящей из солей металлов I и II Групп с атомными номерами до 30, гидрохлорида, ацетата, салицилата, пиридина, аммония, низшего алифатического углеводородного амина, низшего алканоламина и анилина.
R-фосфоноглициновое соединение получают согласно способу, найденному в Патенте США 3799758, Franz (1974).
Смесь соединений (1) N-фосфоноглицинов и (2) N-хлорфенилкарбаматов или N-хлорфенилтиокарбаматов имеет соотношение компонентов относительно друг друга от 10:1 до около 1:10 на основании молекулярной массы. Предпочтительно использовать соотношение от 5:1 до 1:5, наиболее предпочтительна смесь 1:1.
В. Дозировка
В способе данного изобретения можно давать любую подходящую дозу. Тип соединения и носителя и количество широко варьируют в зависимости от вида теплокровного животного и конкретного человека, веса тела и подлежащей лечению опухоли. Обычно подходящей является доза от около 2 миллиграмм (мг) на килограмм (кг) веса тела до около 400 мг на кг веса тела. Предпочтительно применяют от 15 мг до около 150 мг/кг веса тела. Обычно доза для человека ниже, чем для маленьких теплокровных млекопитающих, таких как мышь. Стандартная доза может включать одно соединение или смесь с другими соединениями или другими ингибирующими злокачественные новообразования соединениями. Стандартная доза может также включать разбавители, наполнители, носители и подобное. Форма может быть твердой или гелеобразной, такой как пилюли, таблетки, капсулы и подобное, или жидкой, подходящей для перорального, ректального, локального или парентерального введения или внутривенного введения или инъекции в опухоль или вокруг нее.
Г. Дозированные препаративные формы
Обычно противораковые соединения смешивают с фармацевтически приемлемым носителем. Этот носитель может быть твердым или жидким, и тип обычно выбирают на основании предполагаемого способа введения. Активный агент можно принимать в виде таблетки или капсулы как аггломерированный порошок или в виде жидкости. Примеры подходящих твердых носителей включают лактозу, сахарозу, желатин и агар. Капсулы или таблетки можно легко составлять и изготавливать в форме для легкого проглатывания или пережевывания; другие твердые формы включают гранулы и объемные порошки. Таблетки могут содержать подходящие связующие, смазывающие вещества, разбавители, дезинтеграторы, подкрашивающие агенты, вкусовые агенты, агенты для придания текучести и агенты для придания мягкости. Примеры подходящих жидких дозированных форм включают водные растворы, растворы или суспензии в воде, фармацевтически приемлемых жирах или маслах, спиртах или других органических растворителях, включая эфиры, эликсиры, сиропы, эмульсии, суспензии, растворы и/или суспензии, воссоздаваемые из не выделяющих пузырьков газа гранул, и выделяющие газ препаративные формы, воссоздаваемые из гранул, выделяющих пузырьки газа. Такие жидкие дозированные формы могут содержать, например, подходящие растворители, консерванты, эмульгаторы, суспендирующие агенты, разбавители, подслащивающие агенты и агенты для придания мягкости. Дозированные формы для перорального приема должны содержать вкусовые добавки и подкрашивающие агенты. Формы для парентерального и внутривенного введения должны также включать минеральные вещества и другие материалы для обеспечения совместимости с типом инъекции или выбранной системы доставки.
Конкретные примеры фармацевтически приемлемых носителей и наполнителей, которые можно применять для составления дозированных форм для перорального приема настоящего изобретения, описаны в патенте США 3903297 (Robert) от 2 сентября 1975. Технологии и композиции для изготовления дозированных форм, применяемых в настоящем изобретении, описаны в следующих работах: 7 Modern Pharmaceutics, Главы 9 и 10 (Banker & Rhodes, редакторы, 1979); Lieberman et al. Pharmaceutical Docage Forms: Tablets (1981); и Ansel, Introduction to Pharmaceutical Dosage Forms, издание 2-е (1976).
Д. Способ лечения
Способом лечения может быть любой подходящий способ, эффективный при лечении конкретного типа вируса, ракового образования или опухоли, подлежащих лечению. Лечение можно проводить перорально, ректально, локально, парентерально, внутривенно или путем инъекции в опухоль или вокруг нее и подобными способами. Способ применения эффективного количества меняют также в зависимости от подлежащей лечению опухоли. Считают, что предпочтительным способом применения данных соединений для теплокровных животных является парентеральное применение путем внутривенного, подкожного или внутримышечного введения препаратов с подходящим носителем, дополнительным соединением, или соединениями, ингибирующими рак, или разбавителем для облегчения введения.
Способ лечения вирусных инфекций может также включать пероральное, ректальное, парентеральное, локальное или внутривенное введение. Фактическое время лечения и применяемая доза зависят от типа вирусной инфекции, типа введения активного компонента и требуемого уровня показателей крови.
Приведенные далее примеры являются иллюстративными и не считаются ограничительными для данного изобретения.
Исследование опухолевых клеток толстой кишки, молочной железы и легкого
Описанные далее исследования клеточных культур проводили для проверки токсичности соединений N-хлорфенилкарбаматов и N-хлорфенилтиокарбаматов на опухолевых клетках толстой кишки, молочной железы и легкого человека. Жизнеспособность клеток тестировали, следя за восстановлением МТТ (3-[4,5-димeтилтиaзoл-2-ил] -2,5-дифенилтетразолийбромид). ММТ исследование является хорошо известным способом определения жизнеспособности клеток.
Опухолевые клетки толстой кишки (НТ29 из Американской Коллекции Культур Типов (АТСС)) и клетки молочной железы (MX1 из клеточных линий из АТСС) культивировали в минимальной эссенциальной среде Игла (Eagle's Minimal Essential Medium) с 10% плодной коровьей сывороткой. Опухолевые клетки легкого (А549 из АТСС клеточных линий) культивировали в среде Хэма F12 (Ham's F12 medium) с 10% плодной коровьей сывороткой.
Опухолевые клетки переносили и высевали в склянку с культурой при необходимой плотности клеток. Культуральную среду декантировали и пласт клеток, дважды промывали фосфатным буферным физиологическим раствором (PBS). До высевания в склянки клетки обрабатывали трипсином и растирали в порошок. Если не указано по-другому, культуры инкубировали при 37±1oC в увлажненной атмосфере 5 ± 1% диоксида углерода в воздухе. Культуры инкубировали до тех пор, пока они не стали конфлюэнтными на 50-80%.
Клетки пересевали, когда склянки становились субконфлюэнтными. Среду отсасывали из склянок, пласты клеток дважды ополаскивали PBS. Затем в каждую склянку добавляли раствор трипсина, чтобы покрыть пласт клеток. Раствор трипсина удаляли через 30-60 с и склянки инкубировали при комнатной температуре в течение 2-6 мин. Когда было удалено 90% клеток, добавляли среду для роста. Клетки удаляли путем растирания в порошок и переноса в стерильную пробирку центрифуги. Определяли концентрацию клеток в суспензии и производили соответствующее разбавление для получения плотности 5000 клеток/мл. Клетки пересевали в предназначенные для этого ячейки пластин (на 96 ячеек каждая) для биологических исследований (200 мкл суспензии клеток на ячейку). Во все оставшиеся ячейки добавляли PBS для поддержания влажности. Пластины инкубировали в течение ночи перед обработкой тестируемыми образцами.
Каждую дозу тестируемого образца исследовали посредством обработки четырех ячеек культуры с 100 мкл каждого разбавления. В ячейки, предназначенные для контроля с растворителем, добавляли дополнительно 100 мкл метанольного контроля; в ячейки для негативного контроля добавляли дополнительно 100 мкл среды для обработки. В оставшиеся ячейки, не обработанные тестируемым соединением или средой, добавляли PBS.
Затем пластины инкубировали в течение приблизительно 5 дней.
По окончании 5 дней инкубирования каждую группу с определенной дозой исследовали на микроскопе для определения токсичности. Производили 0,5 мг/мл разбавление МТТ в среде и разбавленный раствор фильтровали через 0,45-микронный фильтр для удаления нерастворенных кристаллов. Среду декантировали из ячеек пластин для биологических исследований. Непосредственно после этого 2000 мкл отфильтрованного раствора МТТ добавляли ко всем тестовым ячейкам, за исключением двух необработанный пустых тестовых ячеек. В две пустые ячейки добавляли 200 мкл среды для обработки. Пластины возвращали в инкубатор примерно на 3 ч. После инкубирования декантировали среду, содержащую МТТ. В каждую ячейку добавляли избыток среды и пластины встряхивали при комнатной температуре в течение примерно 2 ч.
Измеряли абсорбцию каждой ячейки при 550 нм (OD550) при помощи прибора Molecular Devices (Menlo Park, CA) Vmax plate reader.
Рассчитывали значение OD550 ячеек с контрольным растворителем, ячеек с каждым разбавлением тестируемого образца, каждой пустой ячейки и ячеек с позитивным контролем. Значение OD550 пустых ячеек вычитали из значений для ячеек контроля с растворителем и ячеек с тестируемым образцом, получая соответствующие значения OD550:
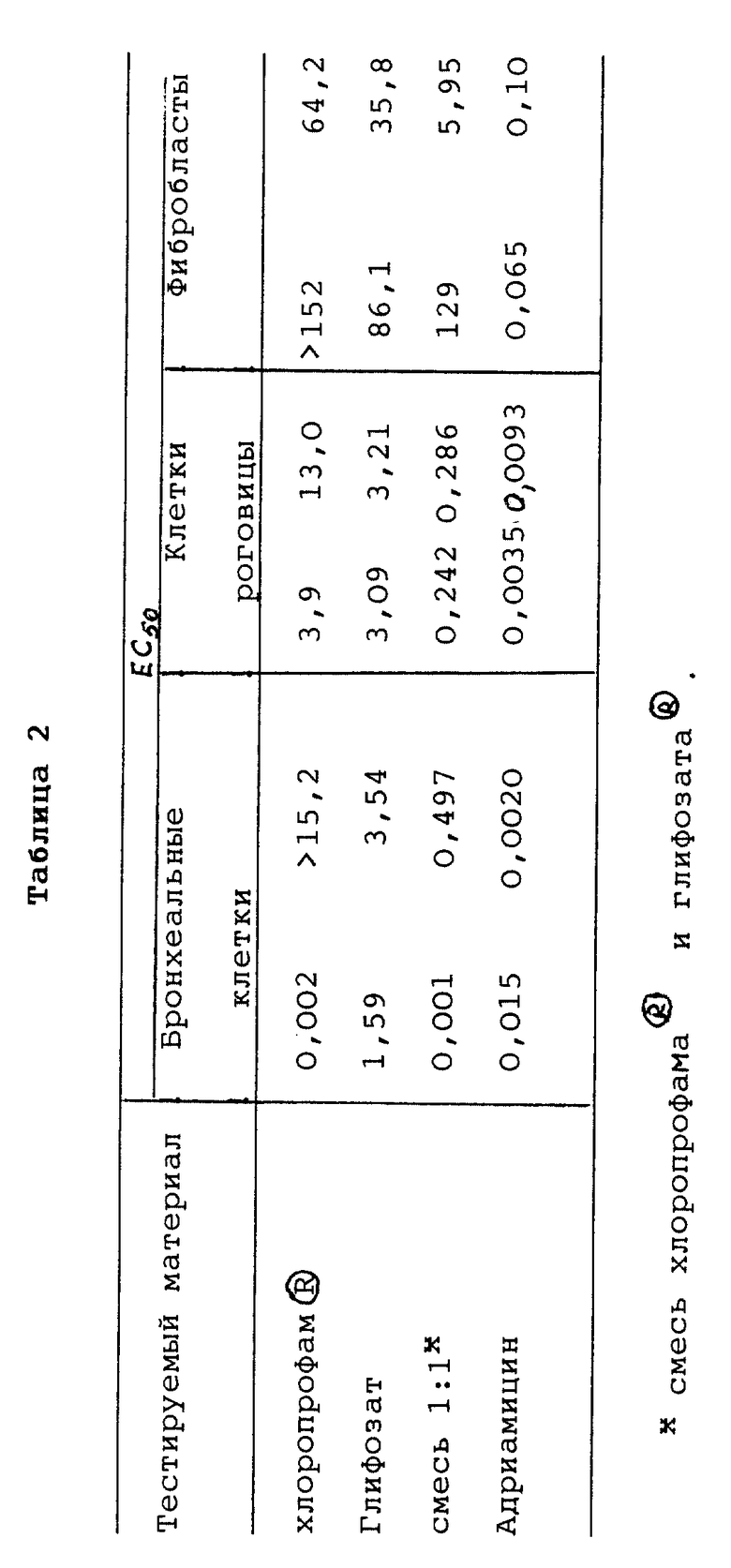
Кривую отклика на дозу получали в виде полулогарифмического графика, на котором по оси ординат отложены % от контроля (линейно), а по оси абсцисс - концентрация тестируемого образца (логарифм). Из графика для каждого тестируемого образца интерполировали значение EC50.
Для тестируемых образцов, вводимых в метанол, получали отдельные отклики с целью корректировки данных в метаноле.
В качестве позитивного контроля использовали адриамицин. Во всех случаях он являлся более токсичным, чем любое из тестируемых соединений, на единицу или две в логарифмическом выражении. Адриамицин является одним из наиболее сильнодействующих агентов в современной практике, но дает значительные побочные эффекты. Пик концентрации плазмы других очень эффективных химиотерапевтических агентов может быть в 10-50 раз выше, чем у адриамицина. EC50 - это концентрация, при которой половина клеток убиты (см. табл.1 и 2).
Эти эксперименты показывают, что данные соединения эффективно убивают опухолевые клетки без существенного влияния на здоровые клетки.
Можно полагать, что многие системные гербициды сами по себе или в комбинации с другими гербицидами и фунгицидами будут демонстрировать такой полезный противоопухолевый эффект.
Смесь (1) N-фосфоноглицинов и (2) N-хлорфенилкарбаматов или N- хлорфенилтиокарбаматов также эффективна против вирусов, включая риновирусы, ВИЧ, герпес и грипп.

Изобретение относится к медицине и касается фармацевтической композиции, ингибирующей рост злокачественных новообразований и опухолей у млекопитающих, и к способу лечения рака, а также к способу лечения вирусной инфекции у млекопитающих. Композиция содержит смесь, содержащую N-хлорфенилкарбаматов или N-хлорфенилтиокарбаматов и производных N-фосфоноглицина, являющиеся гербицидами, при соотношении от 10:1 до 1:10. Композиция эффективно убивает или замедляет рост опухолей, а для здоровых клеток она безопасна. 4 с. и 15 з.п.ф-лы, 2 табл.
(1) N-хлорфенилкарбамата или N-хлорфенилтиокарбамата формулы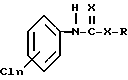
где n = 1 - 3,
Х выбирают из группы, состоящей из кислорода и серы;
R выбирают из группы, состоящей из водорода, низшего алкила, низшего алкенила, циклогексила, феналкила длиной до 8 атомов углерода, или их фармацевтически приемлемой соли,
(2) N-фосфоноглицина формулы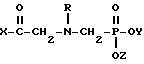
где Х выбирают из группы, состоящей из гидроксигруппы, алкоксигруппы или хлоралкоксигруппы длиной до 12 атомов углерода, низшей алкеноксигруппы, циклогексилоксигруппы, морфолино, пирролидинила, пиперидино и NHR', где R' выбирают из группы, состоящей из водорода, низшего алкила и низшего алкенила, циклогексила, феналкила длиной до 8 атомов углерода, фенила, хлорированного фенила и анизила;
Y и Z каждый независимо выбирают из водорода и низшего алкила;
R выбирают из группы, состоящей из водорода, формила, ацетила, бензоила, нитробензоила и хлорированного бензоила;
или их соли, при этом соль выбирают из группы, состоящей из солей металлов I и II групп с атомными номерами до 30, гидрохлорида, ацетата, салицилата, пиридина, аммония, низшего алифатического углеводородного амина, низшего алканоламина и анилина; и где соотношение (1) и (2) составляет от 10:1 до 1:10 на основании молекулярной массы.
(1) N-хлорфенилкарбамата или N-хлорфенилтиокарбамата формулы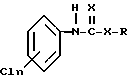
где n = 1 - 3;
Х выбирают из группы, состоящей из кислорода и серы;
R выбирают из группы, состоящей из водорода, низшего алкила низшего алкенила, циклогексила, феналкила длиной до 8 атомов углерода или их фармацевтически приемлемой соли,
(2) N-фосфоноглицина формулы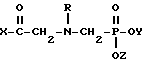
где Х выбирают из группы, состоящей из гидроксигруппы, алкоксигруппы или хлоралкоксигруппы длиной до 12 атомов углерода, низшей алкеноксигруппы, циклогексилоксигруппы, морфолино, пирролидинила, пиперидино и NHR', где R' выбирают из группы, состоящей из водорода, низшего алкила и низшего алкенила, циклогексила, феналкила длиной до 8 атомов углерода, фенила, хлорированного фенила и анизила;
Y и Z каждый независимо выбирают из водорода и низшего алкила: и
R выбирают из группы, состоящей из водорода, формила, ацетила, бензоила, нитробензоила и хлорированного бензоила;
или их соли, при этом соль выбирают из группы, состоящей из солей металлов I и II групп с атомными номерами до 30, гидрохлорида, ацетата, салицилата, пиридина, аммония, низшего алифатического углеводородного амина, низшего алканоламина и анилина; и где соотношение (1) и (2) составляет от 10:1 до 1:10 на основании молекулярной массы.
| US 3799758 A, 26.03.1974 | |||
| МАШКОВСКИИ М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1993, ч.2, C.499. |
Авторы
Даты
2001-07-20—Публикация
1996-04-11—Подача