Изобретение относится к фармацевтической композиции, которая ингибирует рост рака, лейкоза и опухолей у млекопитающих, особенно у человека и теплокровных животных. Композиция содержит производное 1H-1,2,4-триазола. Композиции также можно применять для лечения вирусных инфекций.
Предпосылки к созданию изобретения
Злокачественные опухоли (рак) являются главной причиной смерти животных и человека. Точная причина рака неизвестна, однако ряд исследователей показали наличие связи между определенной деятельностью, такой как курение или подвергание воздействию канцерогенов и частотой возникновения определенных типов рака и опухолей.
Было показано, что множество типов химиотерапевтических агентов эффективны против рака и опухолевых клеток, однако не все типы рака и опухолей поддаются лечению этими агентами. К сожалению, многие из этих агентов разрушают также и нормальные клетки. Точный механизм действия этих химиотерапевтических агентов не всегда известен.
Несмотря на успехи в области лечения рака, ведущими средствами лечения в настоящее время являются оперативное вмешательство, облучение и химиотерапия. Химиотерапевтические подходы предназначены для борьбы со злокачественными опухолями, которые метастазированы или которые особенно агрессивны. Такие цитоцидные или цитостатические агенты лучше всего действуют на раковые опухоли, обладающие большими факторами роста, т.е. на те из них, чьи клетки быстро делятся. В настоящее время в арсенале лекарств, доступных онкологам, имеются гормоны, в частности эстроген, прогестерон и тестостерон и некоторые антибиотики, которые вырабатываются различными микроорганизмами, алкилирующие агенты и антиметаболиты. В идеале наиболее желательными являются такие цитотоксические агенты, которые обладают специфичностью в отношении раковых и опухолевых клеток, не повреждая при этом нормальных клеток. К сожалению, такие агенты не были найдены и не заменили собой агенты, которые особо нацелены на быстро делящиеся клетки (как опухолевые, так и нормальные).
Совершенно очевидно, что разработка материалов, которые будут нацелены на опухолевые клетки, благодаря некоторой уникальной специфичности по отношению к ним, станет прорывом в данной области. Альтернативно, материалы, которые обладают цитотоксичностью в отношении опухолевых клеток при мягком воздействии на нормальные клетки, были бы желательны. Таким образом, целью настоящего изобретения является обеспечение фармацевтической композиции, которая эффективно ингибирует рост опухолей и рака у млекопитающих при мягком воздействии или отсутствии воздействия на нормальные клетки.
Более конкретно, целью настоящего изобретения является обеспечение противораковой композиции, включающей фармацевтический носитель и производное 1H-1,2,4-триазола, как определено в настоящем изобретении, а также способа лечения раковых опухолей.
Эти и другие цели будут понятны из последующего подробного описания настоящего изобретения.
Краткое изложение существа изобретения
Предлагается фармацевтическая композиция для лечения млекопитающих, в частности теплокровных животных и человека, включающая фармацевтический носитель и эффективное количество противоракового соединения, выбранного из группы, состоящей из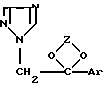 (I)
(I)
где Z представляет алкилен, выбранный из группы, состоящей из CH2-CH2-, -CH2-CH2-CH2-, -CH(CH3)-CH(CH3)- и CH2- CH(алкил), где указанный алкил имеет от 1 до приблизительно 10 атомов углерода; и Ar является членом, выбранным из группы, состоящей из фенила, замещенного фенила, тиенила, галотиенила, нафтила и флуоренила, где "замещенный фенил" означает фенильный радикал, имеющий от 1 до 3 заместителей, независимо выбранных из группы, состоящей из галогена, низшего алкила, низшего алкокси, циано и нитро. Терапевтически активные кислотно-аддитивные соли упомянутого соединения (I) также входят в объем настоящего изобретения.
В упомянутом определении Z термин "алкил" включает прямые и разветвленные углеводородные радикалы, имеющие от 1 до приблизительно 10 атомов углерода, такие как, например, метил, этил, 1-метилэтил, пропил, 1,1-диметилэтил, бутил, пентил, гексил, гептил, октил, децил и т.п.; упомянутый "низший алкил" может представлять собой прямые или разветвленные насыщенные углеводороды, имеющие от 1 до 6 атомов углерода, такие как, например, метил, этил, пропил, 1-метилэтил, бутил, 1,1-диметилэтил, пентил, гексил и подобные алкилы; и термин "галоген" относится к атомам галогена с атомным весом менее 127, т.е. к фтору, хлору, брому и иоду.
Такие композиции можно применять для ингибирования роста раковых опухолей и других опухолей у человека или животных путем введения эффективного количества либо перорально, ректально, местно, либо парентерально, внутривенно, либо путем инъекции в опухоль. Эти композиции не влияют значительным образом на здоровые клетки по сравнению с адриамицином, который обладает вредным действием на здоровые клетки.
Эти композиции используются также для лечения вирусных заболеваний.
Подробное описание изобретения
А. Определения:
Используемый в настоящем описании термин "включающая" означает, что в фармацевтической композиции настоящего изобретения могут совместно применяться различные компоненты. Соответственно, термины "состоящая, по существу, из" и "состоящая из" входят в термин "включающая".
Используемый в настоящем описании термин "фармацевтически приемлемый" компонент представляет собой компонент, который является подходящим для применения у человека и/или животных, без чрезмерных неблагоприятных побочных эффектов (таких как токсичность, раздражение и аллергические реакции), соразмерных с приемлемым соотношением благоприятного действия и риска.
Используемый в настоящем описании термин "безопасное и эффективное количество" относится к такому количеству компонента, которое является достаточным для получения желаемого терапевтического ответа, без чрезмерных неблагоприятных побочных эффектов (таких как токсичность, раздражение или аллергические реакции), соразмерными с приемлемым соотношением благоприятного действия и риска, при условии применения в соответствии с настоящим изобретением. Конкретное "безопасное и эффективное количество" будет, очевидно, меняться в зависимости от таких факторов, как конкретное состояние, которое подвергается лечению, физическое состояние пациента, тип млекопитающего, которое подвергается лечению, продолжительность лечения, характер сопутствующей терапии (если она проводится) и конкретные составы, которые применяются, а также структура соединений или их производных.
Используемый в описании термин "фармацевтические соли присоединения" представляет собой соль противоракового соединения с органической или неорганической кислотой. Эти предпочтительные кислотно-аддитивные соли являются хлоридами, бромидами, сульфатами, нитратами, фосфатами, сульфонатами, формиатами, тартратами, малеатами, малатами, цитратами, бензоатами, салицилатами, аскорбатами и т.п.
Используемый в описании термин "фармацевтический носитель" представляет собой фармацевтической приемлемый растворитель, суспендирующий агент или носитель для доставки противоракового агента животному или человеку. Носитель может быть жидким или твердым и выбирается с учетом планируемого способа введения.
Используемый в настоящем описании термин "рак" относится ко всем типам раковых опухолей или неоплазмы или злокачественных опухолей, включая лейкоз, которые обнаруживают у млекопитающих.
Используемый в настоящем описании термин "противораковые соединения" представляет собой 1H-1,2,4-триазолы и их соли. Конкретные 1H-1,2,4-триазолы подробно описаны ниже. Предпочтительными веществами являются продукты, продаваемые компанией Janssen Pharmaceutica NV (Бельгия) под торговыми наименованиями "propiconazole®" (пропикоказол).
Используемый в настоящем описании термин "вирусы" включает вирусы, которые вызывают заболевания (вирусные инфекции) у людей и других теплокровных животных, такие как ВИЧ, вирусы герпеса, гриппа и риновирусы.
В. Противораковые соединения
Противораковые соединения представляют собой производные 1Н-1,2,4-триазола, которые известны своими противогрибковыми активностями. Они являются системными веществами, которые применяются для предотвращения и уничтожения грибков. Эти соединения имеют следующую структуру: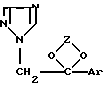
где Z представляет алкилен, выбранный из группы, состоящей из CH2-CH2-, -CH2-CH2-CH2-, -CH (CH3)-CH(CH3)- и CH2-CH(алкил), где указанный алкил имеет от 1 до приблизительно 10 атомов углерода; и Ar является членом, выбранным из группы, состоящей из фенила, замещенного фенила, тиенила, галотиенила, нафтила и флуоренила, где "замещенный фенил" означает фенильный радикал, имеющий от 1 до 3 заместителей, независимо выбранных из группы, состоящей из галогена, низшего алкила, низшего алкокси, циано и нитро. Терапевтически активные кислотно-аддитивные соли упомянутого соединения (I) также входят в объем настоящего изобретения.
В упомянутом определении Z термин "алкил" включает прямые и разветвленные углеводородные радикалы, имеющие от 1 до приблизительно 10 атомов углерода, такие как, например, метил, этил, 1-метилэтил, пропил, 1,1-диметилэтил, бутил, пентил, гексил, гептил, октил, децил и т.п.; упомянутый "низший алкил" может представлять прямые или разветвленные насыщенные углеводороды, имеющие от 1 до 6 атомов углерода, такие как, например, метил, этил, пропил, 1-метилэтил, бутил, 1,1-диметилэтил, пентил, гексил и подобные алкилы; и термин "галоген" относится к атомам галогена с атомным весом менее 127, т. е. к фтору, хлору, брому и иоду. Могут использоваться также их фармацевтически приемлемые кислотно-аддитивные соли с как органическими, так и неорганическими кислотами.
Предпочтительные производные включают
1-[2-(2,4-дихлорфенил)-1,3-диоксолан-2-илметил]-1H-1,2,4-триазол;
1-[2-(2,4-дихлорфенил)-4-метил-1,3-диоксолан-2-илметил] -1H-1,2,4-триазол;
1-[2-(2,4-дихлорфенил)-4-этил-1,3-диоксолан-2-илметил]-1H-1,2,4-триазол;
1-[2-(2,4-дихлорфенил) -4-пропил-1,3-диоксолан-2-илметил]-1H-1,2,4-триазол;
1-[2-(2,4-дихлорфенил)-4-пентил-1,3-диоксолан-2-илметил] -1H-1,2,4-триазол и их терапевтически активные кислотно-аддитивные соли.
Эти соединения готовят в соответствии со способом, описанным в патенте США N 4079062, выданном 14 марта 1978 г. Van Reet et al.
Считается, что эти конкретные вещества обладают способностью уменьшать опухоли или значительно снижать их рост, в силу своей способности ингибировать синтез стеролов.
С. Дозировка
В способе настоящего изобретения могут применяться любые подходящие дозировки. Тип заболевания (рак, лейкоз или вирус), соединение, носитель и количество будут широко изменяться в зависимости от вида теплокровного животного или человека, веса тела и опухоли, подвергаемой лечению. Обычно являются подходящими дозы между приблизительно 2 миллиграмма (мг) на килограмм (кг) веса тела и приблизительно 400 мг/кг веса тела. Предпочтительно используются дозы от 15 мг до приблизительно 150 мг/кг веса тела. В общем, дозы для человека являются более низкими, чем для маленьких теплокровных млекопитающих, таких как мыши. Стандартная форма может включать одно соединение или его смеси с другими соединениями или другими соединениями, ингибирующими рак. Стандартная форма может также включать разбавители, наполнители, носители и т. п. Эта единица может быть в твердой форме или в форме геля, такой как пилюли, таблетки, капсулы и т.п. или в жидкой форме, подходящей для перорального, ректального, местного, внутривенной инъекции или парентерального введения или для инъекции в опухоль или окружающие опухоль ткани.
D. Формы доставки дозы
Противораковые соединения обычно смешивают с фармацевтически приемлемым носителем. Этот носитель может быть твердым или жидким, и его тип обычно выбирают с учетом используемого способа введения. Активный агент может вводиться совместно в форме таблетки или капсулы, в виде агломерированного порошка или в жидкой форме. Примеры подходящих твердых носителей включают лактозу, сахарозу, желатин и агар. Капсулы или таблетки могут быть легко изготовлены и таким образом, чтобы их было легко глотать или жевать; другие твердые формы включают гранулы и нерасфасованные порошки. Таблетки могут содержать подходящие связующие агенты, смазывающие агенты, разбавители, разрыхляющие агенты, красители, ароматизирующие агенты, агенты, вызывающие сыпучесть, и агенты плавления. Примеры подходящих жидких лекарственных форм включают растворы или суспензии в воде, фармацевтически приемлемых жирах и маслах, спиртах или других органических растворителях, включая сложные эфиры, эмульсии, сиропы или эликсиры, суспензии, растворы и/или суспензии, заново составленные из нешипучих гранул, и шипучие препараты, заново составленные из шипучих гранул. Такие жидкие лекарственные формы могут содержать, например, подходящие растворители, консерванты, эмульгирующие агенты, суспендирующие агенты, разбавители, подсластители, загустители и агенты плавления. Пероральные лекарственные формы необязательно содержат ароматизирующие агенты и красители. Парентеральные и внутривенные формы будут включать также неорганические вещества и другие материалы, которые делают их совместимыми с выбранным типом инъекции или системой доставки.
Конкретные примеры фармацевтически приемлемых носителей и наполнителей, которые можно использовать для создания пероральных лекарственных форм настоящего изобретения, описаны в патенте США N 3903297, выданном Robert 2 сентября 1975 г. Технология и композиции для изготовления лекарственных форм, пригодных для настоящего изобретения, описаны в следующих ссылках: 7 Modern Pharmaceutics, главы 9 и 10, (Banker & Rhodes, Editors, 1979); Lieberman et al. Pharmaceutical Dosage Forms: Tablets (1981); и Ansel, Introduction to Pharmaceutical Dosage Forms, 2-е издание (1976).
E. Способ лечения
Способом лечения может быть любой подходящий способ, который является эффективным для лечения конкретного типа рака или вируса, которые нуждаются в лечении. Лечение может представлять собой пероральное, ректальное, местное, парентеральное или внутривенное введение, или путем инъекции в опухоль и т.п. Способ использования эффективного количества также изменяется в зависимости от опухоли, которую лечат. Считают, что предпочтительным способом введения соединений теплокровным животным будет парентеральное лечение путем внутривенного, подкожного или внутримышечного введения соединений 1H-1,2,4- триазола, изготовленных с подходящим носителем, дополнительным ингибирующим рак соединением или соединениями, или разбавителем для облегчения использования.
Способом лечения вирусных инфекций также может быть пероральное, ректальное, местное, парентеральное или внутривенное введение.
Данные исследований in vitro.
Следующие примеры являются иллюстративными и не подразумевают ограничения настоящего изобретения.
Тесты с клетками опухолей толстой кишки, молочной железы и легкого
Для проверки токсичности производных 1H-1,2,4-триазола в отношении клеток опухолей толстой кишки, молочной железы и легкого человека были осуществлены следующие исследования на клеточных культурах. Жизнеспособность клеток исследовали по снижению МТТ (3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолибромид). Тест МТТ является хорошо известным способом оценки жизнеспособности клеток.
Клетки опухоли толстой кишки (НТ29 из Американской коллекции типовых культур (АТСС) и молочной железы (МХ1 из клеточных линий из АТСС) культивировали на минимальной необходимой среде Игла (Eagle) с 10% сыворотки плода коровы. Клетки опухоли легкого (A549 из клеточных линий ATCC) культивировали в среде Ham F12 (Хэма F12) с 10% сыворотки плода коровы.
Опухолевые клетки пассировали и засевали в культуральные колбы при желательных плотностях клеток. Культуральную среду декантировали и клеточные слои дважды промывали физиологическим раствором с фосфатным буфером (ФФБ). Клетки трипсинизировали и растирали в порошок перед посевом в колбы. Если не указывается иное, культуры инкубировали при 37±1oC в увлажненной атмосфере, содержавшей 5±1% диоксида углерода в воздухе. Культуры инкубировали до тех пор, пока не достигалось 50-80% конфлюентности.
Клетки пересевали, когда слой во флаконе становился сабконфлюентным (subconfluent). Среду из колб аспирировали и клеточные слои дважды промывали ФФБ. Затем в каждую колбу добавляли раствор трипсина, чтобы покрыть клеточный слой. Раствор трипсина удаляли спустя 30-60 минут и колбы инкубировали при комнатной температуре от двух до шести минут. Когда 90% клеток становились смещенными, добавляли ростовую среду. Клетки удаляли растиранием и переносили в стерильную центрифужную пробирку. Определяли концентрацию клеток в суспензии и должным образом ее разбавляли, чтобы получить плотность 5 000 клеток/мл. Клетки пересевали в надписанные лунки 96-луночных планшетов для биологических исследований (200 микролитров клеточной суспензии на лунку). Во все оставшиеся лунки добавляли ФФБ для поддержания влажности. Планшеты затем инкубировали в течение ночи перед обработкой испытуемым соединением.
Каждую дозу испытуемого соединения исследовали путем обработки учетверенных лунок культуры 100 микролитрами каждого разведения. Лунки, обозначенные как контроли растворителя, получали дополнительные 100 микролитров контроля метанола; лунки отрицательного контроля получали дополнительные 100 микролитров обрабатывающей среды. К оставшимся лункам, которые не обрабатывались испытуемым соединением или средой, добавляли ФФБ. Планшеты затем инкубировали в течение приблизительно 5 дней.
К концу 5 дня инкубации каждую дозированную группу изучали микроскопически для оценки токсичности. В обрабатывающей среде разбавляли МТТ до 0,5 мг/мл и это разведение фильтровали через фильтр 0,45 микрометров для удаления нерастворившихся кристаллов. Среду декантировали из лунок планшетов для биологических исследований. Немедленно после этого во все экспериментальные лунки, за исключением двух необработанных пустых лунок, добавляли 2 000 микролитров профильтрованного раствора МТТ. В две пустые лунки добавляли 200 микролитров обрабатывающей среды. Планшеты возвращали в инкубатор приблизительно на 3 часа. После инкубации среду, содержащую МТТ, декантировали. В каждую лунку добавляли избыток среды, и планшеты трясли при комнатной температуре в течение приблизительно 2 часов.
В каждой лунке измеряли поглощение при 550 нм (OD550) с помощью аппарата для прочтения планшетов Мах фирмы Molecular Devices (Menio Park, CA).
Рассчитывали среднюю величину OD550 для лунок и контроля растворителя и для каждого разведения испытуемого соединения, а также для каждой из пустых лунок и положительного контроля. Среднюю величину OD550 для пустых лунок вычитали из средней величины для лунок контроля растворителя и лунок испытуемого соединения, соответственно получая соответствующее среднее значение OD550.
% от контроля = [(скорректированная средняя величина OD550 разведения испытуемого соединения): (скорректированная средняя величина OD550 контроля растворителя)] x 100.
Кривые ответа на дозу получали как полулогарифмические графики с % контроля на оси ординат (линейные) и концентрации испытуемого соединения на оси абсцисс (логарифмические). ЕС50 интерполировали из графиков для каждого испытуемого соединения.
Для каждого испытуемого соединения, которое вводилось в метаноле, получали отдельные ответы для коррекции данных по метанолу.
В качестве положительного контроля использовали адриамицин. Во всех случаях он оказался более токсичным, чем любое из испытывавшихся веществ, на один или два логарифма. Адриамицин является одним из наиболее сильнодействующих агентов, которые применяются в настоящее время, и имеет значительные побочные эффекты. Пиковые концентрации в плазме других, достаточно эффективных химиотерапевтических агентов, могут в 10-50 раз превышать концентрацию адриамицина. ЕС50 представляет собой концентрацию, при которой погибает 50% клеток.
Эти эксперименты показали, что эти композиции эффективно убивают опухолевые клетки, не влияя значительным образом на здоровые клетки. Они более безопасны, чем адриамицин.
Изобретение относится к фармакологии, касается фармацевтической композиции для лечения рака и вирусных заболеваний, способа лечения рака и способа лечения вирусных инфекций на ее основе. Фармацевтическая композиция включает производное 1Н-1,2,4-триазола формулы I, где Z представляет алкилен, выбранный из группы, состоящей из СН2-СН2, СН2-СН2-СН2-, СН(СН3)-СН(СН3)-, СН2-СН(алкил), где указанный алкил имеет от 1 до 10 атомов углерода; Ar является представителем, выбранным из группы, состоящей из фенила, замещенного фенила, тиенила, галогентиенила, нафтила и флуоренила, и эффективно ингибирует рост опухолей и рака у млекопитающих при мягком воздействии или отсутствии воздействия на нормальные клетки. 4 с. и 7 з.п. ф-лы, 1 табл.
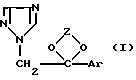
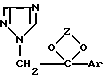
где Z представляет алкилен, выбранный из группы, состоящей из СН2-СН2-, СН2-СН2-СН2-, СН(СН3)-СН(СН3)-, СН2-СН(алкил), где указанный алкил имеет от 1 до 10 атомов углерода;
Ar является представителем, выбранным из группы, состоящей из фенила, замещенного фенила, тиенила, галогентиенила, нафтила и флуоренила,
и фармацевтически приемлемый носитель.
1-[2-(2,4-дихлорфенил)-1,3-диоксолан-2-илметил]-1Н-1,2,4-триазола,
1-[2-(2,4-дихлорфенил)-4-метил-1,3-диоксолан-2-илметил] -1Н-1,2,4-триазола,
1-[2-(2,4-дихлорфенил)-4-этил-1,3-диоксолан-2-илметил] -1Н-1,2,4-триазола,
1-[2-(2,4-дихлорфенил)-4-пропил-1,3-диоксолан-2-илметил] -1Н-1,2,4-триазола,
1-[2-(2,4-дихлорфенил)-4-пентил-1,3-диоксолан-2-илметил] -1Н-1,2,4-триазола,
и их фармацевтически приемлемых солей присоединения кислот.
| US 4079062 А, 14.03.1978 | |||
| МАШКОВСКИЙ М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1993, ч.2, с.496. |
Авторы
Даты
2001-12-27—Публикация
1996-05-22—Подача