Изобретение основывается на открытом в 1987-89 годах "Плазмохимотронном эффекте" [1].
Условия, необходимые для существования в высоковольтном электролизере устойчивой химотронной плазмы - проточная подкисленная или подщелоченная деионизованная вода в межэлектродном пространстве, неоднородное электрическое поле, позволяющее создать высокую плотность тока на катоде.
При достижении в межэлектродном пространстве потенциалов от 115±5 до 57 ± 3 В (2 М раствор H2SO4) спонтанно в прикатодном пространстве появляется устойчивая химотронная плазма, излучающая монохроматический свет. Цвет, а следовательно, и длина волны монохроматического света в плазмотроне изменяется плавно при снижении потенциала от потенциала зажигания плазмы (115 ± 5 В) до потенциала ее затухания (57 ± 3 В).
Цвет изменяется в следующей последовательности: красно-розовый, голубой, фиолетовый, невидимый ультрафиолет, т.е. полностью воспроизводится Бальмаровская серия спектральных линий атомарного водорода, что подтверждается спектрометрическим анализом.
Появление в межэлектродной камере высоковольтного электролизера устойчивой химотронной плазмы, представляющей собою биполярный плазменный электрод, сформированный в неоднородном электрическом поле ионизированным атомарным водородом и молекулами химически чистой воды на межфазной границе водородосодержащий катодный газ - водный раствор электролита, изменяет традиционные представления об электрохимических процессах синтеза H2O2+O2 в плотном элекролитическом веществе.
В ходе выполнения НИОКР теория и модель биполярного плазменного электрода получили дальнейшее развитие. На их основе установлены причинно-следственные связи механизма образования предельно энергонасыщенной для водных растворов электролитов перекиси водорода в химотронной плазме, позволяющие усовершенствовать известные технические решения [1-7].
Предлагаемое изобретение относится к области обработки растворов физико-химическими и электрохимическими технологиями и технике для их осуществления.
Изобретение может быть использовано во всех отраслях промышленности, сельском хозяйстве, медицине, коммунальном и водном хозяйствах, нетрадиционных энергетических установках.
Конкретное внедрение изобретения планируется в производствах получения кислородонасыщенных вод для пищевой промышленности.
Наиболее энергоемкой в парогазовой смеси H2O2+O2 является перекись водорода.
В водных растворах перекись водорода имеет два характерных потенциала:
- окислительный потенциал 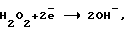 со значением εo= 1,8±0,1 В;
со значением εo= 1,8±0,1 В;
- восстановительный потенциал 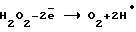 со значением εв= 0,7±0,1 В;
со значением εв= 0,7±0,1 В;
Окислительный потенциал должен соответствовать анодному образованию H2O2, восстановительный - образованию ее при самоокислении на катоде. Механизм процесса получения катодной перекиси водорода очень сложен и является малоизученным.
Единственным электродным материалом, позволяющим достигнуть необходимых для электрохимических процессов получения H2O2+O2 при высоких потенциалах, являются платина или платиносодержащие материалы.
Известны электрохимические способы получения H2O2+O2 на платиносодержащих анодах в растворах кислородосодержащих кислот или щелочей [2].
В промышленных электролизерах используется раствор H2SO4 или подкисленных H2SO4 сульфатов. При потенциалах 4-6 В они окисляются на платиновых анодах до надсерной кислоты H2S2O8 или ее солей. Из надсерной кислоты (или ее солей) путем гидролиза образуется H2SO4 и перекись водорода. Круговой процесс для серной кислоты может быть представлен в виде следующей схемы: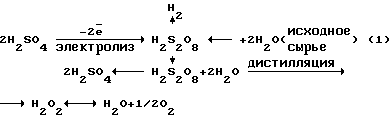
В результате кругового процесса образуется H2O2+O2, расходуется только электрическая энергия и вода. Выход H2O2+O2 по току составляет 70±20%. Выход по энергии при электрохимическом синтезе H2O2 составляет ≈ 10% от теоретического выхода (1250 г H2O2 на 1 кВт • ч).
Недостатки известного метода:
- высокие затраты электроэнергии, 10-15 кВт • ч на 1 кг 100% H2O2
- необратимый расход драгметаллов
- высокие капитальные затраты для осуществления способа
Известны электрохимические способы получения H2O2+O2 катодным восстановлением кислорода [3].
Теоретически установлено, что для хороших выходов H2O2 на катоде необходимы: высокая концентрация кислорода в католите и низкая плотность тока (≈ 10-4 - 10-3 А/см2).
Механизм процесса описывается уравнениями:

По уравнению (2) каталитическое восстановление растворенного в электролите кислорода выделяющимся с катода атомарным водородом идет при малых концентрациях H2O2. С повышением концентрации H2O2 (более 0,7%) включается механизм реакции (3), сопровождающийся резким снижением выхода по току H2O2.
Для промышленной реализации метода предложено вести электролиз под давлением (≈ 30-100 атм), предварительно насыщая раствор электролита кислородом.
При этих условиях напряжение в межэлектродных камерах достигает 2 В, плотность тока - 0,05 А/см2.
Применяется альмагамированные катоды и платинированные аноды. Выход по току H2O2 составляет 60 ± 20%.
Недостатки известного способа:
- высокие затраты электроэнергии, 10-20 кВт • ч на 1 кг 100% H2O2;
- применение высокого давления для осуществления способа;
- низкая концентрация H2O2 в водном растворе;
- применение амальгам и драгоценных металлов.
Известен электрохимический способ [4], согласно которому для получения H2O2 + O2 применяются как анодный, так и катодный процессы. Благодаря двойному использованию тока количество электричества, затраченное на синтез целевого продукта уменьшается вдвое. Разработанному способу присущи недостатки перечисленные в технологиях [2, 3].
Известны физико-химические методы получения парогазовой смеси H2O2 + O2 при электрических разрядах (тлеющем, электродуговом, электроискровом) [5].
Смесь получается в качестве промежуточного продукта реакций между ионизированным водородом и кислородом. Выход H2O2 при этом зависит от температуры охлаждения стенок физико-химического реактора. Так, если при температуре 20oC выход H2O2 составляет 6,4%, то при температуре жидкого воздуха - 87,5%.
Недостатки известных физико-химических методов:
- высокая энергоемкость, 30- 60 кВт • ч на 1 кг 100% H2O2;
- применение вакуума;
- интенсивная эрозия материалов электродов;
- применение драгоценных и редкорассеянных металлов.
Известен метод получения H2O2 + O2 воздействием на газовую смесь H2+O2 атомарным водородом [6].
Газовую смесь H2+O2 облучают ультрафиолетовым светом длиной волны 2537А в присутствии сенсибилизатора (паров ртути). Поглощая свет, молекулы сенсибилизатора активизируются и передают избыток энергии молекулам водорода, заставляя их диссоциировать. Водородные атомы реагируют с кислородом с образованием преимущественно H2O2. Вода является вторичной реакцией, бурно протекающей при неохлажденной ртутной дуге. Процесс идет с аномально высокими скоростями, механизм которого основывается на цепных физико-химических реакциях.
Максимальное количество смеси образуется в глубоком вакууме (P≈ 0,035 мм рт. ст.).
Выход H2O2 на 1 квант УФ-света превышает 100%.
Недостатки метода:
- высокая энергоемкость, 30-50 кВт • ч. на 1 кг 100% H2O2;
- применение вакуума;
- использование паров ртути;
- необходимость создания высоких скоростей в камере для газовой смеси H2+O2.
Известен способ синтеза H2O2 из газовой смеси с предварительной атомизацией H2 в ионизационной камере (между конденсаторными пластинами из покрытого алюминием кварца, питаемый током с частотой 104 Гц и напряжением 12000 В) [7].
Пары конденсируются в колонне и дают 10% H2O2.
Недостатки метода:
- высокие затраты на ионизацию, 30 - 40 кВт • ч на 1 кг 100% H2O2;
- высокие капитальные затраты на реализацию метода.
Необходимость создания высоких скоростей для газовой смеси и использования вакуума.
Наиболее близким из перечисленных выше аналогов является плазмохимотронный способ получения H2O2 + O2 в водных растворах электролитов [1].
В указанном способе H2O2 получается на межфазной границе водородосодержащий катодный газ - водный раствор электролита в химотронной плазме, спонтанно образующейся из ионизированных в неоднородном электрическом поле атомов водорода и молекул химической чистой воды. H2O2 в химотронной плазме синтезируется с аномально высокими скоростями. Механизм синтеза основан на взаимосогласованных ионно-атомных и ионно-молекулярных цепных реакциям.
Для плазмохимотронного реактора [1] баланс материальных и энергетических потоков.

Баланс материальных энергетических потоков в адекватных условиях для электрохимического реактора (представлен для сравнения):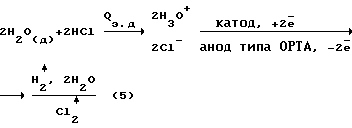
где Qэ.д. - энергия электролитической диссоциации
Qhv - энергия монохроматического (красно-розового) излучения химотронной плазмы
(Д) - индекс относится к деионизированной воде.
H2O2 выделяется в раствор электролита из внешней (обращенной к аноду, отрицательно заряженной) обкладки биполярного плазменного электрода за счет электродонорной реакции, происходящей в химотронной плазме.
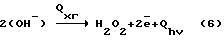
где Qхп - энергия химотронной плазмы
Из анализа экспериментальных данных следует, что выход H2O2 по энергии составляет ~50±20%, т.е. составляет ~3 кВт•ч на 1 кг 100% H2O2.
Недостатки известного метода:
- низкий выход парогазовой смеси H2O2 + O2 из химотронной плазмы и, как следствие, повышенные затраты электрической энергии на синтез целевого продукта.
Техническим решением задачи является увеличение выхода парогазовой смеси H2O2 + O2 в плазмохимотронном реакторе и снижение затрат электроэнергии на ее получение.
Решение задачи достигается:
1. за счет формирования химотронной плазмы в межзлектродной камере при потенциалах от 220±10 до 140±5 В в газожидкостном потоке, исходящем от дырчатого анода, смешивающимся в прикатодном пространстве с газожидкостным потоком, выходящим из полого катода, расположенного в центре цилиндрического отверстия межэлектродной камеры;
2. расширенным применением компонентов в водном растворе электролита;
3. оптимальным интервалом температуры, необходимой для выхода парогазовой смеси H2O2+O2 из водного раствора электролита при синтезе;
4. эжекциoннoгo ввода через полый катод газожидкостной смеси за счет избыточного давления сжатого газа, неразрушающего парогазовую смесь.
На чертеже представлены вольт-амперные характеристики заявляемого способа и известного технического решения, снятые в адекватных условиях. Смещение вольт-амперной характеристики в область высоких потенциалов изменяет механизм реакций синтеза H2O2 + O2 в химотронной плазме по отношению к реакциям (4,6) известного способа.
Теории предсказывает, что при достижении в межэлектродном пространстве потенциалов 142±2 В биполярный плазменный электрод формирует на ионно-атомном и ионно-молекулярном уровнях материальные и энергетические потоки согласно уравнению (7):
где ±Δε(τ)/ реверсивный потенциал таутомерного энергетического поля активированного вещества;
(хп) - индекс, относящийся к химотронной плазме;
(г) - индекс, относящийся к гидратированному протону и гидратированному электрону;
(д) - индекс, относящийся к деионизованной воде.
Уравнение (7) раскрывает физический смысл химотронной плазмы в биполярном плазменном электроде.
Биполярный плазменный электрод состоит из биполярных кластерныx комплексов, образующихся в неоднородном электрическом поле высокой напряженности на межфазной границе водородосодержащий газ - водный раствор электролита, которые обладают способностью как к разделению протонно-электронных зарядов, так и связанного с ними вещества, используя неизвестное ранее явление "таутомерного энергетического поля активированного вещества".
Химически чистая перекись водорода получается в парогазовой смеси H2O2 + O2 при распаде отрицательно заряженных кластеров внешней обкладки биполярного плазменного электрода по уравнению: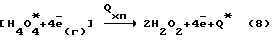
где Q* - дополнительная энергия, выделяющаяся в водный раствор электролита при распаде электронизированных кластеров химически чистой перекиси водорода; - электроны низкой энергии, участвующие в электрохимических; процессах на дырчатом аноде.
- электроны низкой энергии, участвующие в электрохимических; процессах на дырчатом аноде.
С учетом электрохимических реакций, происходящих по уравнению (9) на дырчатом аноде, выход целевых продуктов по энергии в заявляемом способе должен в два раза превышать выход парогазовой смеси H2O2+O2 в известном техническом решении.
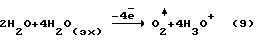
где (эх) - индекс, относящийся к адсорбированным дырчатым анодом молекулам H2O.
Механизм синтеза вещества в заявляемом способе имеет биотический аналог - фотосинтез вещества в клетках.
Признаки, совпадающие в механизме синтеза вещества заявляемым способом и в его биотическом аналоге:
- энергия H4O
- в синтезе вещества клетками, также как и в заявляемом способе, участвуют от 4 до 8 молекул H2О [8];
- аномально высокие выходы целевых продуктов по энергии [8];
- в механизме синтеза вещества растительными и животными клетками используется дополнительная энергия от источника энергии, возникающем в активированном веществе, природа происхождения которого до сих пор была неизвестна [9].
Учитывая сказанное выше, полученная заявленным способом парогазовая смесь H2O2+O2 является экологически чистым продуктом для живых организмов.
При нормированной дозировке смесь H2O2 + O2 может быть широко использована для приготовления кислородонасыщенной воды и напитков, способствующих стабилизации синхронных обменных процессов в клетках растений, животных и человека.
На основе разработанной выше технологии планируется выпуск (широкой гаммы продукции с этикеткой "Супервода".
В таблицах 1-4 представлены экспериментальные данные, снятые на стендовой установке, позволяющей в адекватных условиях испытать заявленный способ и известное техническое решение.
В опытах были использованы методики проведения эксперимента и анализов [1].
Выход парогазовой смеси H2O2+O2 по энергии определены прямым методом по разнице между весом раствора на входе в реактор и на выходе из него с использованием диагностического стенда, включающего:
- систему одновременного взвешивания водного раствора электролита, входящего в реактор и выходящего из него (вес пропускаемого раствора - 6000 грамм, точность взвешивания ±10 грамм);
- счетчика злектроэнергии, установленного на входе в блок питания реактора;
- систему одновременного замера температуры водного раствора электролита, входящего в реактор и выходящего из него;
- систему наличия в парогазовой смеси H2O2+O2 водорода, использующей нижнию границу взрыва гремучей смеси (4±1% Н2 в смеси H2 + O2 при нормальных условиях);
- часы и секундомеры для фиксирования времени работы реактора.
Точность показания диагностического стенда при определении активной и нейтральной форм кислорода в парогазовой смеси проверялась методом поглощения парогазовой смеси в 60 литрах подкисленной деионизованной воды, находящейся в закрытом циркуляционном контуре в термостатированных условиях при t = 20+2oC, герметично соединенном с барабанным счетчиком газа. Содержание растворенных в подкисленной деионизованной воде форм кислорода замеряли с использованием проточного датчика растворенного кислорода и методами титрования по стандартным методикам.
Выход парогазовой смеси H2O2+O2 по энергии (ηв) определяли по уравнению (10)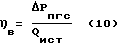
где Δ Pпгс = Рисх - Ркон;
Δ Рпгс - вес парогазовой смеси H2O2+O2 в граммах (кг);
Рисх - вес водного раствора электролита, входящего в реактор, в граммах (кг);
Ркон - вес водного раствора электролита, выходящего из реактора, в граммам (кг);
Qист - количество электроэнергии от внешнего источника на синтез парогазовой смеси, замеренное по счетчику электроэнергии за промежуток времени работы реактора, кДж (кВт•ч).
Точность определения ηв с помощью приборов систем диагностического стенда (с учетом погрешностей, вносимых приборами и методами проверки стенда) находилась в пределах ±20%.
Количество дополнительной энергии, выделяемой химотронной плазмой при взаимосогласованных цепных реакциях синтеза и распада биполярных энергетических комплексов, спонтанно возникающим на межфазной границе водородосодержащий газ - раствор электролита в таутомерном энергетическом поле активированного вещества, определяли по уравнению (11):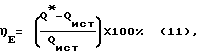
где Q* = Qпгс min + Qp;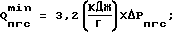
Qp = Pисх • Cp • (tp k - tp н
Q* - энергия, затраченная на синтез парогазовой смеси H2O2+O2 в реакторе, кДж (кВт•ч);
Qпгс min - минимальная энергоемкость 1 г парогазовой смеси, определяемая по выходу 100% H2O2 (1125 г на 1 кВт•ч), кДж;
Qр - затраты энергии на нагрев раствора в реакторе до температуры выхода парогазовой смеси H2O2+O2, кДж;
Cр - теплоемкость исходного раствора Дж/г oC;
t р к и tр н - соответственно температура раствора на выходе из реактора и на входе в реактор, oC;
Точность определения ηE адекватна точности определения ηВ.
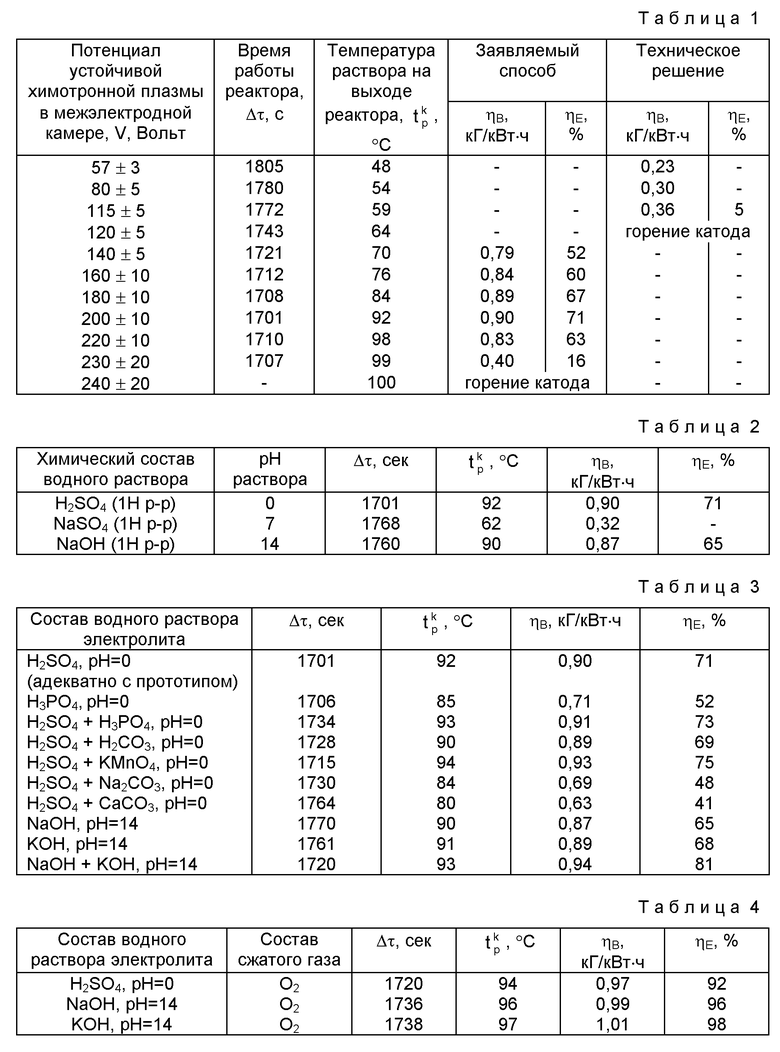
В таблице 1 представлены экспериментальные данные по влиянию потенциала устойчивой химотронной плазмы в межзлектродной камере заявляемого и известного способов на выход парогазовой смеси H2O2 + O2 (ηВ) и количество дополнительной энергии, генерируемой химотроной плазмой в таутомерном энергетическом поле активированного вещества (ηE).
Условия проведения испытаний:
- состав раствора - H2SO4 (хч) + деионизованная вода;
- концентрация раствора - 2 М (2H раствор H2SO4);
- массовая скорость раствора, проходящего через работающий реактор - 3,3 ± 0,3 г/с;
- температура исходного раствора - 20 ± 1oC;
- масса пропускаемого раствора - 6000 г.
Данные табл. 1 показывают, что при V от 220±10 до 140±5 В (tр - от 70 до 98oC) выход H2O2+O2 по энергии увеличивается в 1,8 - 2,5 раза, а энергозатраты на ее получение снижаются в 1,5 - 1,8 раза по отношению к известному способу [1].
Влияние показателя среды pH водного раствора электролита в заявляемом способе представлено экспериментальными табл. 2.
Условия проведения испытаний:
- общая концентрация ионов приведена к 1Н раствору H2SO4;
- реактивы чистотой ЧДА, ХЧ;
- растворители - деионизованная или дистилированная вода ( ρ ≥ 200 кОм•см);
- потенциал устойчивый химотронной плазмы в межэлектродной камере - 200±10 В;
- массовая скорость раствора, проходящего через реактор, температура, масса - см. табл. 1.
Данные табл. 2 экспериментально подтверждают, что для существования в межэлектродном пространстве реактора химотронной плазмы необходимо присутствие в водном растворе ионов гидроксония (H3O+) или ионов гидроксила (OH-), обладающих аномально высокой подвижностью (превышающих на порядок подвижность ионов Na+, SO4 - и других).
Влияние химического состава водного раствора электролита на ηВ, ηE в заявляемом способе представлены данными табл. 3.
Условия проведения испытаний:
- общая концентрация ионов приведена к 1Н раствора H2SO4;
- реактивы чистотой ЧДА, ХЧ;
- растворители - деионизованная или дистилированная вода ( ρ ≥ 200 кОм•см);
- массовая скорость раствора, проходящая через реактор, температура, масса - см. условия табл. 1.
Экспериментальные данные табл. 3 доказывают возможность применения в заявляемом способе широкого спектра кислородосодержащих химических соединений в водном растворе электролита, применяемых для синтеза парогазовой смеси H2O2+O2. При этом наблюдается незначительное отклонение ηВ, ηE от данных, полученных в табл. 1 при оптимальных V.
В таблице 4 представлены данные по влиянию эжекционного ввода водного раствора электролита через полый катод в виде газожидкостной смеси в межэлектродную камеру за счет избыточной энергии сжатого газа.
Условия проведения испытаний:
- концентрация ионов в водном растворе электролита - 1 Н раствор;
- реактивы чистотой ЧДА, ХЧ, растворенные в деионизованной воде;
- потенциал устойчивой химотронной плазмы - 200 ± 10 В;
- массовый расход, температура и масса пропускаемого раствора, см. условия в табл. 1.
Эжекционный ввод водного раствора электролита через полый катод в виде газожидкостной смеси в межэлектродную камеру за счет избыточной энергии сжатого газа обеспечивает повышение не менее чем на 10%. ηВ и ηE.
Т.о., на основании экспериментальных данных, подтверждающих теорию механизма формирования химотронной плазмы и модель биполярного плазменного электрода, заявляемый способ по выходу целевых продуктов и по затратам электроэнергии в 1,5 - 2,0 раза более эффективен, чем технология получения H2O2+O2 в техническом решении [1].
Источники информации
1. Отчет о НИР "Разработка и испытание инженерно-энергетических комплексов обработки бытовых и агропромышленных сточных вод с использованием возобновляемых источников энергии" N Гос. регистрации 01890007585, Инв N - 2890055415, 1989, 143 с.
2. Перекись водорода и перекисные соединения. Под ред. Проф. Позина М.Е. М-Л, Изд-во ГНТИ Химической литературы 1951, с. 162-207.
3. Перекись водорода и перекисные соединения, М. - Л., Изд-во ГНТИ Хим. лит. 1951, с. 140-144.
4. Перекись водорода и перекисные соединения, М. - Л., Изд-во ГНТИ Хим. лит. 1951, с. 145-146.
5. Перекись водорода и перекисные соединения, М. - Л., Изд-во ГНТИ Хим. лит. 1951, с. 43-44.
6. Перекись водорода и перекисные соединения, М. - Л., Изд-во ГНТИ Хим. лит. 1951, с. 140-144.
7. Перекись водорода и перекисные соединения, М. - Л., Изд-во ГНТИ Хим. лит. 1951, с. 135 - 136.
8. Бергельсон Л.Д. Мембраны, молекулы, клетки. М., Наука, 1982, 182 с.
9. Ясайтис А. А. Молекулярная биоэнергетика. М., ВИНИТИ, 1973 (итоги науки и техники. Биофизика; т. 3).
Изобретение относится к области обработки растворов физико-химическими и электрохимическими технологиями. Способ заключается в пропускании асимметричного по плотности выпрямленного электрического тока между анодом и стержневым катодом с одновременным продавливанием через дырчатый анод и полый катод, создающими газожидкостную смесь в межэлектродной камере, подкисленного или подщелоченного водного раствора электролита. В этих условиях, при потенциалах в межэлектродной камере от 220 ± 10 до 140 ± 5 В, в прикатодном пространстве спонтанно образуется химотронная плазма, в которой при температуре выходящего из реактора раствора, находящейся в интервале от 70 до 98° С, происходит синтез парогазовой смеси H2O2+O2 с выходом по энергии, приближающимся к теоретически возможному. Технический результат - повышение выхода по энергии парогазовой смеси H2O2+O2 при одновременном снижении затрат электроэнергии на синтез целевых продуктов, возможность достижения экологической чистоты продуктов синтеза. 3 з.п.ф-лы, 1 ил., 4 табл.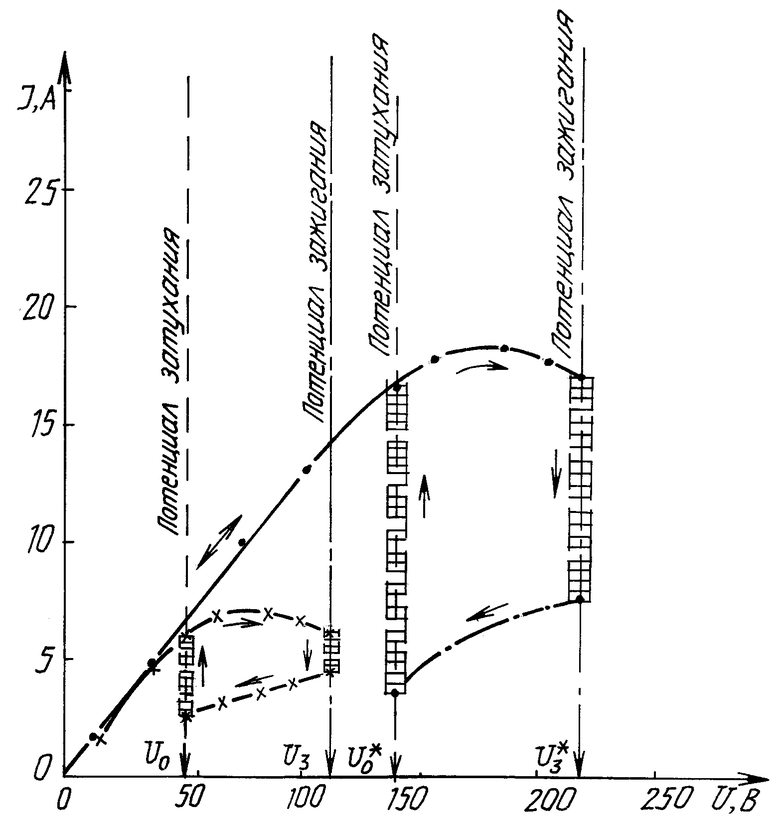
| Перекись водорода и переписные соединения | |||
| М | |||
| - Л.: Изд-во ГНТИ Хим.лит., 1951, с.145 - 146 | |||
| Устройство для электролитической обработки водных растворов | 1984 |
|
SU1176067A1 |
| US 4430176 A, 07.02.1984 | |||
| US 5112702 A, 12.05.1992. | |||
Авторы
Даты
2001-08-10—Публикация
1998-07-30—Подача