Настоящее изобретение относится к применению некоторых 1,2,3,4-замещенных производных нафталина в качестве пестицидов, обладающих активностью против белокрылки и некоторых грибков; к способам получения этих соединений; к композициям, содержащим указанные соединения; а также к применению соединений и композиций для борьбы с белокрылкой, Lepidoptera и грибками-вредителями.
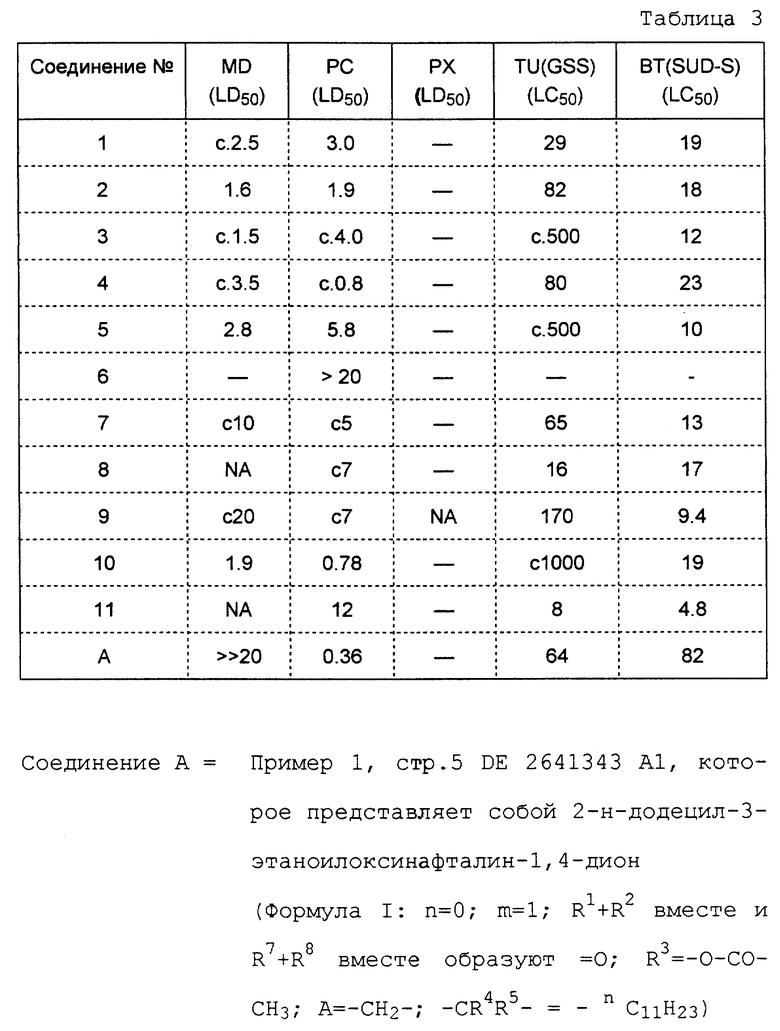
В патенте США N 2572946 раскрывается композиция для борьбы с клещами и тлями, содержащая в качестве активного ингредиента соединение общей формулы (P1):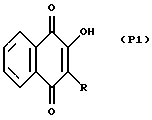
где R обозначает радикал, содержащий от 6 до 15 атомов углерода, и выбранный из алкильных, циклогексильных и циклогексилалкильных групп, например таких как н-алкильная, изоалкильная, алкилциклоалкильная и аралкильная группы. Каких-либо конкретных данных об акарицидной или афицидной активности этих соединений не приводится, а поэтому также отсутствуют какие-либо указания относительно того, которые из множества соединений являются наилучшими, и являются ли они действительно пригодными для борьбы не только с клещами и тлями, но и с другими вредителями.
В DE 2641343, в общих чертах, раскрываются соединения общей формулы (P2):
где R1 обозначает прямую, разветвленную или циклическую C8-14-алкильную группу; R2 обозначает прямую или разветвленную C1-17-алкильную, C2-17-алкенильную, C3-6-циклоалкильную, C1-4-алкокси-, -CH2OCH3-, -CH2OCH2CH3- или -CH=CH-COOH-группу; а X и Y обозначают водород, атом фтора, хлора или брома, либо метильную или метокси-группу. Указывается, что эти соединения обладают акарицидной и афицидной активностью, однако было показано, что такой активностью обладают только соединения, в которых R1 является линейной C8- или C11-14-алкильной группой.
В патенте США N 4110473 раскрывается способ защиты растений от клещей (акаридов) путем обработки растения соединением общей формулы (P3):
где Y обозначает водород, фтор, хлор или бром; R12 обозначает C8-14-алкил с разветвленной, циклической или прямой цепью; R2 обозначает прямой или разветвленный насыщенный C1-12-алкил или ненасыщенный C3-12-алкил, необязательно замещенный одним или двумя заместителями, такими как атом хлора, атом брома метокси- или этокси-группа; или C3-6-циклоалкил.
В GB 1553424 раскрывается соединение общей формулы (P3), где R2 обозначает H, а R1 обозначает необязательно замещенный циклогексил, которое предназначено для использования в качестве активного агента для лечения инфекций у крупного рогатого скота, зараженного тейлериозом, а в ЕР 0123238 и ЕР 0123230 раскрываются аналогичные соединения, используемые в качестве агентов против заражения простейшими микроорганизмами и кокцидиозом.
В DE 3801743 A1 в общих чертах раскрываются соединения общей формулы (P4):
где n = 0-12; R1 обозначает водород или необязательно замещенную алкильную, аралкильную, алкилкарбонильную, (гетеро)арилкарбонильную, алкоксикарбонильную, алкилсульфонильную или арилсульфонильную группу; a R2 обозначает галогеналкильную, необязательно замещенную (гетеро)арильную или замещенную циклоалкильную группу. Указывается, что эти соединения обладают акарицидной и фунгицидной активностью.
Более конкретно, было раскрыто 10 соединений формулы (P4), в которых n = 0; R1 обозначает атом водорода; a R2 обозначает 4-(трет-бутил) циклогексильную, 4-(триметилсилил)циклогексильную, 4-(циклогексил)циклогексильную, 2-трифторметил циклогексильную или 3,5-ди(трифторметил) циклогексильную группу; либо n = 0, R1 обозначает этаноильную группу, a R2 обозначает 4-(трет-бутил)циклогексильную, 4- (циклогексил)циклогексильную, 2- или 3-трифторметилциклогексильную, или 3,5-ди(трифторметил)циклогексильнуго группу. Из этих соединений акарицидная активность была продемонстрирована для двух соединений формулы (P4), где n = 0, R1 обозначает атом водорода, a R2 обозначает 4-(трет-бутил)циклогексильную или 4-(триметилсилил)-циклогексильную группу.
В ЕР 0077550 раскрываются соединения общей формулы (P5)
где R обозначает алкильную группу, имеющую от 1 до 10 атомов углерода; и описывается их использование в ветеринарных препаратах, в частности, для профилактики инфекций, вызываемых протозойными микроорганизмами.
В одновременно рассматриваемой международной заявке N PCT/GB 95/00953 описаны натуральные соединения общей формулы (P6):
где R обозначает атом водорода или гидроксильную или этаноилокси-группу, а также описано их использование в качестве пестицидов, а в частности, в качестве фунгицидов, инсектицидов и/или акарицидов. Ранее эти соединения были описаны как растительные метаболиты (см., Chamy et al., (1993) Bol. Soc. Chil. Quim. 38, 187-190).
В DE 2520793 A1 в общих чертах описаны соединения общей формулы (P7):
где R1 обозначает прямую, разветвленную или циклическую C8-14алкильную группу, a R2 обозначает прямую или разветвленную C1-6-алкильную группу или C3-6-циклоалкильную группу. Было показано, что эти соединения обладают акарицидной и афицидной активностью, однако, при этом, было показано, что такой активностью обладают лишь соединения, где R1 является линейной C11 или C12-алкильной группой.
В ЕР 0002228 в общих чертах раскрываются соединения общей формулы (P8):
где R1 обозначает замещенную или незамещенную C3-12 циклоалкильную группу. Указывается, что эти соединения обладают активностью против Theileria у крупного рогатого скота и овец, однако было показано, что такой активностью обладает лишь соединение, в котором R1 является циклогептилом.
Fieser и др., а также другими сотрудниками были раскрыты различные 2-гидрокси- или 2-алкокси-3-замещенный нафталин-1,4-дионовые соединения, которые могут быть использованы для лечения малярии (см., например, US 2553647, US 3578685 и JACS (1948) Vol. 70, pp. 3156-3165), либо в качестве противоопухолевых агентов (см., FP 2085660). К этим соединениям относится ряд 3-изоалкил-замещенных соединений. В патенте США N 2398418 (Fieser) описан способ получения 2,3-дизамещенный нафталин-1,4-дионовых соединений из соответствующего 2-замещенного соединения.
Авторами настоящего изобретения было установлено, что многие из раскрытых ранее нафтохинонов не обладают высокой активностью против белокрылки, а в частности, было установлено, что большинство афицидных и акарицидных соединений, конкретно раскрытых в предшествующих работах, не обнаруживали ожидаемой эффективности при их тестировании против резистентных и восприимчивых типов белокрьлки.
В настоящее время авторами настоящего изобретения было установлено, что некоторые синтетические нафтохиноны и родственные 1,4-дериватизированные соединения обладают более высокой пестицидной активностью, чем ранее раскрытые соединения, предназначенные для использования в качестве пестицидов, а особенно для борьбы с белокрылкой. Предпочтительные соединения настоящего изобретения обладают прекрасной пестицидной активностью против, inter alia, белокрылки и/или грибков, а наиболее предпочтительные соединения обладают также хорошей активностью против клещей и/или тли. Соединения, описанные в настоящем изобретении, могут быть, в частности, использованы против таких штаммов белокрылки и грибков, которые выработали резистентность к одному или нескольким коммерчески доступным пестицидам, широко применяемым в настоящее время.
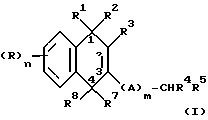
В своем первом аспекте настоящее изобретение относится к применению соединения общей формулы (I):
или его соли в качестве пестицида против белокрылки, Lepidoptera и/или грибков-вредителей,
где n представляет целое число от 0 до 4;
m представляет целое число 0 или 1;
каждый из R независимо представляет атом галогена или нитро-, циано-, гидроксильную, алкильную, алкенильную, галогеналкильную, галогеналкенильную, алкокси-, галогеналкокси-, галогеналкенокси-, амино-, алкиламино-диалкиламино-, алкоксикарбонильную, карбоксильную, алканоильную, алкилтио-, алкилсульфинильную, алкилсульфонильную, карбамоильную, алкиламидо-, циклоалкильную, арильную или аралкильную группу,
каждый из R1 и R2 независимо представляет необязательно замещенную алкокси-группу, либо взятые вместе R1 и R2 представляют группу =O, =S или = N-OR9, где R9 обозначает атом водорода или необязательно замещенную алкильную группу;
R3 представляет гидроксильную группу или группу -OL, где L обозначает уходящую группу, или группу, которая in vivo трансформируется в группу -OL1, где L1 обозначает уходящую группу;
R7 и R8 независимо представляют необязательно замещенную алкокси-группу, либо взятые вместе, они представляют группу =O, =S или =N-OR9, где R9 является таким, как он был определен выше;
R4 и R5 независимо представляют атом водорода или галогена; необязательно замещенную алкильную или алкенильную группу; либо взятые вместе с атомом углерода, находящимся между ними, R4 и R5 образуют необязательно замещенное C4-8-циклоалкильное или циклоалкенильное кольцо; а A представляет прямую или разветвленную алкильную или алкенильную группу, которая является необязательно замещенной, предпочтительно, галогеном, и ациклическая углеродная цепь которой связана с нафталиновым кольцом в 3-положении и с группой -CHR4R5; причем в этой цепи A не является четвертичным атомом углерода, а общее число атомов углерода в самой длинной углеродной цепи, идущей от 3-положения указанного нафталинового кольца составляет не более 8.
Предпочтительно, чтобы общее число атомов углерода в самой длинной цепи, идущей от 3-положения нафталинового кольца составляло от 4 до 8, а более предпочтительно от 5 до 7. В случае, если число атомов углерода ограничено 1 или 2, то такое соединение теряет свою активность против белокрылки, однако его фунгицидная активность остается достаточно высокой. В случае, если -CHR4R5 образует карбоциклическое кольцо, то предпочтительно, чтобы эта группа была непосредственно присоединена к нафталину в 3-положении, поскольку возрастание числа атомов углерода между нафталиновым кольцом и карбоксильным кольцом приводит к снижению активности против белокрылки.
Соединения, описанные выше, предпочтительно использовать против белокрылки, особенно против вида Bemisia, и/или против грибков, особенно против видов Rhizoctonia, Aspergillus и Pyricularia, например, R.solani, P.oryzae и A. niger, которые выработали устойчивость к одному или нескольким коммерческим препаратам, не относящимся к нафтохиноновым пестицидам, а наиболее предпочтительно использовать эти соединения против белокрылок вида Bemisia tabaci таких штаммов, как Ned 1/2, Ned 7, и Pak, причем авторами настоящего изобретения было установлено, что указанные виды белокрылок особенно восприимчивы к пестицидному действию соединений, описанных в настоящей заявке, по сравнению, например, с соединениями, конкретно испытанными в US 2572946, US 4110473 и DE 2641343. Хотя в DE 38001743 упоминаются некоторые из соединений, используемых per se в настоящем изобретении, и указывается, что эти соединения могут быть использованы против многих видов насекомых и грибков, однако в упомянутой работе не приводится каких-либо указаний относительно преимущественного применения этих соединений для борьбы с белокрылкой.
Если соединение формулы I содержит группу, определенную как алкильная, алкенильная или алкинильная замещающая группа (если это не определено особо), то эта группа может быть линейной или разветвленной, и может содержать до 12, предпочтительно до 4, а более предпочтительно до 4 атомов углерода. Циклоалкильная или циклоалкенильная группа может содержать от 3 до 10, а наиболее предпочтительно от 5 до 8 атомов углерода. Арильной группой может быть любая ароматическая углеводородная группа, а особенно фенильная или нафтильная группа. Аралкильной группой может быть любая алкильная группа, определенная выше, которая замещена арильной группой, определенной выше, в частности, бензильной группой; либо арильная группа, замещенная алкильной группой.
В случае, если вышеуказанные заместители определены как необязательно замещенные, то их необязательно присутствующими замещающими группами могут быть любые одна или несколько стандартных групп, обычно используемых при разработке пестицидных соединений и/или при модификации таких соединений в целях повышения их активности, выносливости, проницаемости или улучшения других свойств. Конкретными примерами таких заместителей являются атомы галогена, нитро-, циано-, гидроксильная, алкильная, алкенильная, галогеналкильная, галогеналкенильная, алкокси-, галогеналкокси-, амино-, алкиламино, диалкиламино-, алкоксикарбонильная, карбоксильная, алканоильная, алкилтио-, алкилсульфинильная, алкилсульфонильная, карбамоильная, алкиламидо-, циклоалкильная, фенильная и бензильная группы. В основном, могут присутствовать 0-3 заместителя. В случае, если любой из вышеуказанных заместителей представляет собой или содержит алкильную замещающую группу, то такая группа может быть линейной или разветвленной и может содержать до 12, предпочтительно до 6, а наиболее предпочтительно до 4 атомов углерода. В случае, если любой из вышеуказанных заместителей представляет собой или содержит арильную или циклоалкильную группу, то такая арильная или циклоалкильная группа может быть сама замещена одним или несколькими атомами галогена, или одной или несколькими нитро-, циано-, алкильной, алкенильной, галогеналкильной, галогеналкенильной, алкокси- или галогеналкокси-группами. При этом предпочтительно, чтобы арильной группой была фенильная группа, а циклоалкильная группа содержала от 3 до 8, а предпочтительно от 4 до 7 атомов углерода.
Предпочтительно, чтобы R, если он присутствует, представлял атом галогена или нитро-, циано-, гидроксильную, C1-4 алкильную, C2-4 галогеналкильную, C2-4 алкенильную, C2-4 галогеналкенильную, C1-4 алкокси-, C1-4галогеналкокси-, C1-4 алкиламино-, ди-C1-4 алкиламино, C1-4 алкоксикарбонильную, C1-4 алкилтио-, C1-4 алкилсульфинильную или C1-4 алкилсульфонильную группу.
Более предпочтительно, чтобы R, если он присутствует, представлял атом галогена, или C 1-4 алкильную, C1-4 галогеналкильную, C2-4 алкенильную, C2-4 галогеналкенильную, C1-4 алкокси или C1-4 галогеналкокси-группу.
Предпочтительно также, чтобы n = 0, 1 или 2, а особенно предпочтительно, чтобы n = 0.
Кроме того, предпочтительно, чтобы R1 и R2 независимо представляли C1-4 алкокси-группу, в частности метокси-группу либо предпочтительно, чтобы R1 и R2, взятые вместе, представляли группу =O или =N-OR9, где R9 представляет атом водорода или C1-4 алкильную группу, а в частности метильную группу. При этом предпочтительно, чтобы оба R1 и R2 представляли метокси-группу, либо, взятые вместе, они представляли группу =O.
В случае, если R3 является группой -OL, где L - уходящая группа, либо группой, которая превращается in vivo в группу -OL1, где L1 - уходящая группа, то указанной уходящей группой может быть любая группа, которая обычно используется в качестве уходящей группы. При этом предпочтительной является такая уходящая группа, при которой значение pKa кислоты LOH или L1OH в воде составляет от 1 до 7, более предпочтительно от 1 до 6, а особенно предпочтительно от 1 до 5.
В случае, если R3 представляет группу, которая превращается in vivo в группу -OL1, где L является уходящей группой, то предпочтительно, чтобы такое превращение происходило в защищенном растении или во вредителе, против которого осуществляют защиту, предпочтительно под действием ферментов, присутствующих в растении или во вредителе. Так, например, если R3 представляет β-кислотную группу, такую как -O-CH2CH2CO-OH, где -CH2CH2CO-OH не является уходящей группой, то эта группа может быть подвергнута ферментативному окислению in vivo, например, под действием β-оксидазы, с образованием группы -O-CO- CH2-CO-OH, где -CO-CH2-CO-OH является уходящей группой.
Предпочтительно, R3 представляет группу -OR10, где R10 обозначает атом водорода, необязательно замещенную алкильную, алкенильную, арильную или аралкильную группу; или группу -CO-R11, -CO-O-R11, -SOR11, -SO-R11, -P(X) (OR12)(OR13), -R(X)(R12) (OR13), -P(OR12)(OR13) или -P(R12)(OR13), где R11 обозначает атом водорода, необязательно замещенную алкильную, алкенильную, арильную или аралкильную группу, или группу -NR12R13, где R12 и R13 независимо представляют атом водорода или необязательно замещенную алкильную группу, а X представляет атом кислорода или серы. Если R10 или R11 представляют необязательно замещенную арильную или аралкильную группу, то предпочтительно, чтобы арильной группой или частью была фенильная группа или часть, а необязательными заместителями были атомы галогена, нитро-группа и C1-4 алкильная группа. Особенно предпочтительным является замещение в 4-положении фенильного кольца. Термин "необязательно замещенный", используемый в отношении R3, означает, например, замещение кремнийсодержащими группами, например, триалкилсилильными группами, такими как триметилсилил, используемыми в качестве заместителя на R10, R11 или R12.
Предпочтительно R3 представляет гидроксильную группу или группу -O-CO-R11 или -O-CO-OR11, где R11 представляет атом водорода или C1-12 алкильную, C1-12 галогеналкильную, C1-12 гидроксиалкильную, C1-12 карбоксиалкильную, фенильную или бензильную группу.
Особенно предпочтительно, если R3 представляет группу -OH или -O-CO-R11, где R11 представляет атом водорода или C1-6 алкильную, C1-6 галогеналкильную, фенильную или бензильную группу. При этом наиболее предпочтительно, если R11 представляет метильную, этильную, пропильную или бутильную группу.
Предпочтительно, если R7 и R8 независимо представляют C1-4 алкокси-группу, либо, взятые вместе, они представляют группу =O или =N-OR9, где R9 является атомом водорода или C1-4 алкильной группой, а особенно предпочтительно, если каждый из R7 и R8 являются метокси-группой, либо взятые вместе они образуют группу =O.
При этом следует отметить, что соединения, где каждый из R1 и R2, и R7 и R8 являются алкокси-группой, либо каждая из пар, взятых вместе R1 и R2, и R7 и R8 образуют = S или группу NOR9, являются потенциальными биологическими предшественниками соответствующих нафтохинонов, которые относятся к предпочтительным соединениям настоящего изобретения.
Предпочтительно, каждый из R4 и R5 независимо представляет водород, или C1-7 алкильную, C1-7 галогеналкильную, C2-7 алкенильную или C2-7 галогеналкенильную группу, либо R4 и R5, взятые вместе со смежным и находящимся между ними атомом углерода, образуют C4-8 циклоалкильное или циклоалкенильное кольцо, которое является необязательно замещенным заместителями, выбранными из галогена и метильной, этильной, этенильной, галогенметильной, галогенэтильной и галогенэтенильной групп. Более предпочтительно, если R4 и R5 независимо выбирают из C1-4 алкильной, C1-4 галогеналкильной, C2-4 алкенильной и C2-4 галогеналкенильной групп, либо, если R4 и R5, взятые вместе, образуют кольцо.
Соединения формулы I могут образовывать соли, если, например, R3 является гидроксильной группой. Подходящими основаниями для образования таких солей являются неорганические основания, такие как гидроксид натрия, гидроксид калия или карбонат натрия; и органические основания, например, третичные амины, такие как триэтиламин, и циклические амины, такие как пирролидин.
При этом следует отметить, что многие соединения, используемые в целях настоящего изобретения, могут существовать в виде различных геометрических изомеров и диастереомеров. Таким образом, объем настоящего изобретения охватывает как отдельные изомеры, так и их смеси.
В первой предпочтительной группе соединений, используемых в соответствии с первым аспектом настоящего изобретения, часть -CHR4R5 непосредственно примыкает к нафталеновому кольцу, где R4 и R5 независимо представляют водород, галоген, или необязательно галоген-замещенную алкильную или алкенильную группу.
Указанная первая предпочтительная группа соединений, используемая в целях настоящего изобретения, включает соединения общей формулы (II):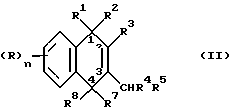
или его соль, где R, R1, R2, R3, R7 и R8 и n являются такими, как они были определены выше для формулы (I), а R4 и R5 независимо представляют водород или галоген, либо алкильную или алкенильную группу, которая является галогензамещенной, при этом длина ее углеродной цепи остается в пределах, установленных выше для формулы (I).
Более предпочтительными являются соединения формулы (II), где n=0; R1 с R2 и R7 с R8 образуют =O; и где один из R4 и R5 представляет атом водорода, либо C1-7 алкильную, C1-7 галогеналкильную, C2-7 алкенильную или C2-7 галогеналкенильную группу, а другой независимо выбирают из C1-7 алкильной, C1-7 галогеналкильной, C2-7 алкенильной и C2-7 галогеналкенильной групп. R3 представляет предпочтительно -OH, -O-CO-R11 или -O-CO-OR11, где R11 обозначает C1-3 алкил; а наиболее предпочтительно -OH. Наиболее предпочтительная часть -CHR4R5 содержит от 2 до 5 атомов углерода.
Авторами настоящего изобретения было обнаружено, что эта первая предпочтительная группа соединений обладает, в основном, хорошей активностью против белокрылки, а в случае, если самая длинная цепь в 3-положении состоит из 7 атомов углерода или менее, то эта группа соединений также обладает хорошей активностью против грибков, например таких как R. solani, P. oryzae и A. niger, и сохраняет при этом активность против клещей.
Во второй предпочтительной отдельной группе соединений, используемой в первом аспекте настоящего изобретения, группа -CHR4R5 является частью циклоалкильного или циклоалкенильного кольца, а поэтому эта вторая группа предпочтительных соединений формулы (I) имеет предпочтительно формулу (III):
где n, A, R, R1, R2, R3, R7 и R8 являются такими, как они были определены выше для общей формулы (I); m обозначает целое число 0 или 1; a R4 и R5, взятые вместе со смежным и расположенным между ними атомом углерода, образуют необязательно замещенное C5-7 циклоалкильное или циклоалкенильное кольцо.
Более предпочтительно, соединения этой группы являются соединениями формулы (III), где R1 с R2 и R7 с R8 образуют =0; n и m равны 0; a R4 и R5, взятые вместе со смежным атомом углерода, образуют полностью насыщенное C5-7 циклоалкильное кольцо, которое является необязательно замещенным.
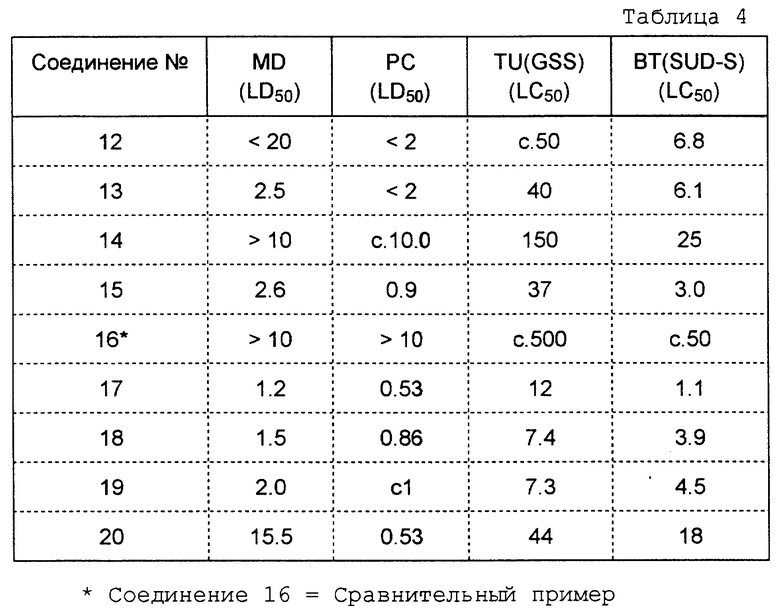
Еще более предпочтительно, если R4 и R5, взятые вместе со смежным и расположенным между ними атомом углерода, образуют насыщенное C5-7 циклоалкильное кольцо, замещенное галогеном, предпочтительно хлором или фтором, или C1-4 алкильной, галогеналкильной, C2-4 алкенильной или галогеналкенильной группой R20. Наиболее предпочтительно, если R4 и R5, взятые вместе со смежным атомом углерода, образуют циклопентильное или циклогексильное кольцо, замещенное в одном или нескольких из 2-3- или 4-положений группой R20.
Предпочтительные соединения этой второй предпочтительной группы настоящего изобретения являются исключительно эффективными против белокрылки, особенно против вида В. tabaci, в том случае, если в этих соединениях циклоалкильное или циклоалкенильное кольцо непосредственно связано с нафталиновым кольцом, т.е. m = 0.
В третьей отдельной группе соединений первого аспекта настоящего изобретения часть -CHR4R5 не образует циклоалкильное или циклоалкенильное кольцо, и отстоит от нафталинового кольца на расстоянии длиной 1-6 атомов углерода, а наиболее предпочтительно длиной в 2-4 атомов углерода.
Таким образом, соединения формулы (I), относящиеся к этой третьей группе соединений, используемых в целях настоящего изобретения, имеют предпочтительно формулу (IV):
где n, A, R, R1, R2, R3, R7 и R8 являются такими, как они были определены выше для общей формулы (I); a R4 и R5, каждый независимо представляет атом галогена или необязательно замещенную алкильную или алкенильную группу.
Более предпочтительными соединениями этой группы являются соединения формулы (IV), где n = 0; R1 с R2 и R7 с R8 образуют =0; а A представляет C1-6 алкильную, C1-6 галогеналкильную, C2-6 алкенильную или C2-6 галогеналкенильную цепь, которая может быть замещена галогеном; либо разветвленную цепь, которая может быть галогенирована. R4 и R5 являются предпочтительно C2-6 алкилом, C2-6 галогеналкилом, C2-6 алкенилом, или C2-6 галогеналкенилом. R3 является предпочтительно -OH, -O-CO-R11 или -O-CO-O-R11, где R11 обозначает C1-3 алкил, а наиболее предпочтительно OH.
Предпочтительными соединениями этой группы являются соединения, где A обозначает группу -(CH2)a, где a является целым числом от 1 до 6, а более предпочтительно от 1 до 4; или -(CH2)a-CH=CH-(CH2)b где а и b являются целыми числами, которые в сумме составляют от 0 до 4; а также аналоги этих соединений, где один или несколько атомов углерода замещены алкилом, галогеналкилом, алкенилом, галогеналкенилом или галогеном.
Особенно эффективными для использования в настоящем изобретении являются соединения формулы (III), в которых один или несколько из A, R4 и R5 представляют галогеналкильную или галогеналкенильную группу, а особенно трифторметильную группу. Предпочтительными являются соединения, в которых -A-CHR4R5 представляет собой изофторалкильную группу, например такую как 2-трифторметилпропил или 2,2-ди-трифторметилэтил. При этом как незамещенные, так и галогенированные соединения обладают хорошей активностью против вышеуказанных грибков, в том случае, если самая длинная цепь в 3-положении составляет до 7 атомов углерода.
Во втором своем аспекте настоящее изобретение относится к новым соединениям формулы (I), в которых -CHR4R5 образует 2-замещенное циклоалкильное кольцо, предпочтительно 2-замещенное C1-4 алкилом или C1-4 галогеналкилом; либо -(A)m CHR4R5 является изогалогеналкильной группой.
Предпочтительные 2-замещенные циклоалкильные соединения, такие как 2-гидрокси-3-(2-метил-циклогексил)-нафталин-1,4-дион, являются не только новыми соединениями, но и обладают по сравнению с 3- и 4-замещенными циклоалкильными соединениями неожиданно высокой степенью активности против белокрылки.
Таким образом, в этом своем аспекте, настоящее изобретение относится к соединению формулы (VI):
где n, m, A, R, R1, R2, R3, R7 и R8 являются такими, как они были определены выше для общей формулы (I), a R20 выбирают из C1-4 алкила, C1-4 галогеналкила, C2-4 алкила и C2-4 галогеналкила.
В частности, в этом аспекте настоящее изобретение относится к соединению формулы (VII)
где n, m, A, R, R1, R2, R3, R7 и R8 являются такими, как они были определены выше для общей формулы (I), а один или более из A, R4 и R5 представляет или включает галогеналкильную группу. В предпочтительных соединениях A представляет C1-4 алкиленовую группу, а один из R4 и R5 представляет трифторметил.
Предпочтительные изогалогеналкиловые соединения формулы (VI), такие как 2-гидрокси-3-(2-трифторметилпропил)-нафталин-1,4-дион, являются не только новыми, но также обладают высокой степенью активности как против клещей, так и против белокрылки.
Другими новыми соединениями настоящего изобретения являются соединения формулы (I), в которых R1 с R2 и/или R7 c R8 не образуют оба =O.
В своем третьем аспекте настоящее изобретение относится к способу борьбы с белокрылкой, Lepidoptera и/или грибками-вредителями в очагах их распространения, заключающемуся в обработке этих очагов соединением общей формулы (I), а предпочтительно соединением общей формулы (II), (III) или (IV).
Предпочтительными очагами являются места обитания вредителей, т.е. белокрылки, Lepidoptera и/или грибков, как таковых, или окружающая среда, подвергаемая или подвергнутая поражению вредителями. Более предпочтительными являются очаги распространения вредителей как таковых, пищевые продукты, находящиеся на хранении, растения или животные, подвергающиеся или которые могут быть подвергнуты поражению вредителями, семена указанных растений, или среда, в которой произрастают или в которой могут быть выращены эти растения. В частности, соединения формулы I могут быть использованы в домашних условиях для обработки жилых комнат в целях борьбы с комнатными мухами или другими насекомыми, с клещами или грибками паразитами; на садовых или земледельческих угодьях для обработки выращиваемых культур, таких как хлопчатник или рис, либо культур, находящихся на хранении, особенно зерновых культур, в целях их защиты от поражения вредителями, особенно белокрылкой и родственными видами, а также в медицинской или ветеринарной практике, например для обработки крупного рогатого скота в целях его защиты или лечения от поражения вредителями.
В своем четвертом аспекте настоящее изобретение также относится к способу получения соединений формулы (I), а в частности, соединений формул (II), (III) и (IV), определенных выше.
В предпочтительном способе получения соединений формулы (I), (II), (III) и (IV), соединение общей формулы (V):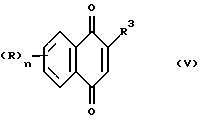
где n, R и R3 определены выше, подвергают реакции с карбоновой кислотой CHR4R5-(A)m-COOH, где R4 и R5 определены выше, в присутствии инициатора свободнорадикальной реакции, такого как пероксисульфат аммония или нитрат серебра в подходящем растворителе, таком как водный ацетонитрил, в результате чего получают соединение общей формулы (I), (II), (III) или (IV). Соединения формулы (V) являются коммерчески доступными, но в любом случае они могут быть получены из соответствующих доступных бензохинонов и замещенных алканов, например, с помощью реакции Дильса-Альдера.
В еще одном способе получения соединений настоящего изобретения соединение формулы (V) подвергают реакции с соединением формулы X-(A)mCHR4R5, где R4, R5 A и m являются такими, как они были определены выше для формулы (I), а X является уходящей группой, которая может быть, например, атомом галогена или тозильной группой, и которая затем отщепляется от соединения с образованием заряженного радикала +(A)m-CHR4R5. Эту реакцию осуществляют в присутствии кислоты, например кислоты Льюиса, такой как хлорид алюминия, в условиях, широко описанных Fieser и Gates (J. Am. Chem. Soc. (1941) 63, 2943-2953).
Соединения формулы (I), полученные этими способами, могут быть затем подвергнуты реакциям дериватизации, описанным выше, их комбинациям, с получением, если это необходимо, других соединений формулы (I).
В этом альтернативном способе, в случае, когда R4 и R5, взятые вместе со смежным атомом углерода, образуют циклоалкильное или циклоалкенильное кольцо из 3-10 атомов углерода, могут быть использованы многие коммерчески доступные циклоалкил- и циклоалкиленкарбоновые кислоты, а присутствующие на них карбоново-кислотные группы могут быть удлинены с использованием стандартной техники с образованием более длинных углеродных цепей, а затем защищены, если это необходимо, с использованием техники, хорошо известной специалистам. Так, например, для получения -CH2-удлинения может быть осуществлена реакция Арнста-Эльстерта (см., например, Meier и Zeller (1975), Anqew. Chem. Int. Ed. Ewgl., 14, 32). Альтернативно, соединения, в которых m=1, могут быть получены посредством реакции соответствующего циклоалканона с этилцианоацетатом, а затем реакции с реактивом Гриньяра и последующего гидролиза с образованием циклоалкилуксусной кислоты (см., например, Amsterdamsky et al. (1975) Bull. Soc. Chim. Fr. (3-4 Part 2), p. 635-643; и Muhs M.A. PhD Thesis. University of Washington. Diss Abst., 14, 765 (1954), в результате чего длина цепи возрастает на 1.
Для получения соединений, содержащих R4R5 - кольца, имеющие большее число атомов углерода, соответствующие монобромзамещенные циклоалкиловые или циклоалкениловые соединения могут быть превращены в карбоксилаты путем получения соединения Гриньяра с использованием магния, а затем его обработки двуокисью углерода (CO2), взятой, например, в виде сухого льда. Образованная таким образом карбоновая кислота может быть превращена в алкилкарбоксилат путем алкилирования с использованием, например, соединения R6-1, такого как метилиодид, в присутствии бутиллития, где R6 обозначает группу, определенную выше, которая является стабильной в этих условиях.
Реакция замещения, например алкилирования, циклоалкильного/циклоалкиленового кольца в положениях, не являющихся 1-положением, с образованием карбоксилата может быть осуществлена известными методами. С использованием алкиловых сложных эфиров мононенасыщенной в кольце циклоалкиленкарбоновой кислоты в качестве исходных соединений, алкилирование может быть осуществлено в нужном положении, как описано ранее, а затем с использованием светового излучения в качестве инициатора может быть осуществлена реакция, например, с CF3X, которая протекает в восстановительных условиях в присутствии катализатора "палладий-на-угле", и которая позволяет ввести CF3-группы, в результате чего происходит насыщение ненасыщенной связи. Для получения других соединений формулы (I) может быть использовано множество других операций, известных каждому специалисту.
Соединения формулы (I), в которых R3 является уходящей группой, определенной выше, могут быть получены посредством реакции соединения формулы (I), в котором R3 является гидроксильной группой, с соединением X-L, где X является атомом галогена, в присутствии органического основания, предпочтительно третичного амина, такого как триэтиламин, или неорганического основания, такого как карбонат натрия. Так, например, соединения формулы (I), в которых R3 представляет группу -O-CO-R11, где R11 является таким, как он определен выше, могут быть получены путем ацилирования гидрокси-группы в соответствующем соединении формулы I, например, с использованием ацилхлорида R11-CO-Cl в подходящем растворителе, таком как дихлорметан, в присутствии основания, такого как триэтиламин. Альтернативно, соединения формулы (I), в которых R3 представляет гидроксильную группу, могут быть подвергнуты реакции с соединением HO-L, где L определен выше и включает кислотную группу C=О, в присутствии дегидратирующего агента, такого как дициклогексилкарбодиимид. Другой способ получения таких соединений предусматривает осуществление реакции металлической соли соединения формулы (I), в котором R3 представляет гидроксильную группу, то есть R3 представляет группу -OM, где М обозначает ион металла, с
соединением X-L, определенным выше.
Соединения формулы (I), в которых R1 с R2 и/или R7 с R8 независимо представляют необязательно замещенную алкокси-группу, могут быть получены путем кетализации одной или обеих карбонильных групп в соответствующем соединении формулы (I) или (V), например, путем использования подходящего спирта в основных или кислотных условиях, например, путем использования раствора гидроксида калия в метаноле.
Соединения формулы (I), в которых R1 и R2, взятые вместе, и/или R7 и R8, взятые вместе, образуют тиокарбонильную группу =S, могут быть получены путем обработки соответствующего соединения формулы (I), где обе пары R1 с R2 и/или R7 с R8 образуют =O, тиатирующим агентом, таким как реагент Лавессона (2,4-бис(4-метоксифенил)-1,3-дитиа-2, 4-дифосфетан-2,4-дисульфид), с использованием защитных групп, там, где это необходимо.
Соединения формулы (I), в которых R1 и R2, взятые вместе, и/или R7 с R8, взятые вместе, образуют оксимовую группу =N-OR9, где R9 определен выше, могут быть получены путем обработки соответствующего соединения формулы (I), где оба R1 и R2, и R7 и R8 образуют =O, гидроксиламином или алкоксиламином формулы R9O-NH2, где R9 определен выше, в присутствии основания, такого как пиридин.
Для получения нужного соединения формулы (I) может быть осуществлена комбинация вышеописанных способов дериватизации.
В своем пятом аспекте настоящее изобретение относится к инсектицидной и/или фунгицидной композиции, содержащей соединение формулы (I), а предпочтительно соединение формулы (II), (III) или (IV), определенное выше, в сочетании, по крайней мере, с одним носителем. Указанная композиция может содержать одно соединение или смесь нескольких соединений настоящего соединения. Было также установлено, что различные изомеры или смеси изомеров могут иметь различные уровни или спектры активности, а поэтому композиции могут содержать отдельные изомеры или смеси изомеров.
Композиции настоящего изобретения могут содержать, в основном, от 0,001 до 95 мас.% активного ингредиента формулы (I). Предпочтительные композиции содержат от 0,001 до 25 мас.% активного ингредиента в случае, если эти композиции присутствуют в уже готовой для использования форме. Однако композиции, изготовленные в виде концентратов, разводимых непосредственно перед использованием, могут содержать более высокие концентрации активного ингредиента, например до 95%.
Композиции настоящего изобретения могут быть смешаны с различными инертными носителями, такими как растворители, разбавители и/или поверхностно-активные вещества с образованием дустов, гранулированных твердых препаратов, смачивающихся порошков, спиралей от комаров или других твердых препаратов; либо эмульсий, эмульгируемых концентратов, растворов для опрыскивания, аэрозолей или других жидких препаратов. Подходящими растворителями и разбавителями являются вода, алифатические и ароматические углеводороды, такие как ксилол или другие нефтяные фракции, и спирты, такие как этанол. Поверхностно-активные вещества могут быть анионогенными, катионогенными или неионогенными. Кроме того, композиции могут также содержать антиоксиданты или другие стабилизаторы, а также ароматизаторы и красители. Типы указанных инертных носителей и их соотношения могут быть использованы в соответствии со стандартной практикой, обычно применяемой при изготовлении пестицидных композиций, и поэтому эти носители являются, в основном, инертными по отношению к физиологии обрабатываемого растения.
Примеры носителей, которые, как известно, являются подходящими для использования в пестицидных композициях, содержащих нафталин-1,4- дионы, приводятся в описаниях, а в частности, в примерах патентов США 2572946, 4110473, 4970328 и патента Японии 90/152943 (последний патент Agro-Kanesho KK).
Помимо указанных инертных носителей композиции настоящего изобретения могут также содержать один или более других активных ингредиентов. Такими активными ингредиентами могут быть другие соединения, которые обладают пестицидной активностью, и которые могут оказывать синергическое действие вместе с соединениями настоящего изобретения.
Более подробно, настоящее изобретение описано в нижеследующих примерах и сравнительных примерах, которые приводятся лишь в иллюстративных целях и не должны рассматриваться как ограничение настоящего изобретения. Исходя из этих примеров, могут быть осуществлены и другие варианты изобретения.
Таблицы 1-6 поясняют предлагаемое изобретение.
ПРИМЕРЫ
Пример 1
Получение 2-циклогексил-3-гидрокси-нафталин-1,4-диона
К размешанному раствору 2-гидроксинафталин-1,4-диона (1,00 г, 5,74 ммоль), циклогексанкарбоновой кислоты (1,10 г, 8,61 ммоль), нитрата серебра (520 мг) в ацетонитриле (15 мл) и воды (20 мл), нагретой при 65-70oC, добавляли водный раствор персульфата аммония (1,77 г, 7,77 ммоль) в воде (10 мл). После нагревания в течение 1 часа смесь охлаждали, разбавляли водой (50 мл) и экстрагировали эфиром (3 х 40 мл). Объединенные эфирные фракции промывали водой (3 х 25 мл), насыщенным раствором хлорида натрия (25 мл) и осушали сульфатом магния. После фильтрации, выпаривания растворителей при пониженном давлении и хроматографии на силикагеле получали целевое соединение (354 мг, т. пл. 133oC). Это соединение указано в таблице как соединение 12.
Пример 2
Получение 2-гидрокси-3-(4-метилциклогексил)-нафталин-1,4-диона
Методом, описанным в примере 1, и с использованием лаусона (т.е. 2-гидроксинафталин-1,4-диона) (1,00 г) и 4-метилциклогексанкарбоновой кислоты (1,23 г) получали целевое соединение (100 мг, т.пл. 101oC). Это соединение указано в таблице как соединение 19.
Пример 3
Получение 2-гидрокси-3-(1-метилбутил)-нафталин-1,4-диона
Методом, описанным в примере 1, с использованием 2-ацетилоксинафталин-1,4-диона (1,24 г, 5,74 ммоль) и 2-метилпентановой кислоты (1,00 г) получали целевое соединение (608 мг) после гидролиза в 30 мл ТГФ с использованием гидроксида калия (в 5-кратном избытке) в воде (8 мл) (т. пл. 82-83oC). Это соединение указано в нижеприведенной таблице как соединение 3.
Пример 4
Получение 2-гидрокси-3-(2-трифторметилпропил)-1,4-нафтохинона
2-ацетилоксинафталин-1,4-дион (1,24 г) и 3-трифторметилбутановую кислоту (1,08 г) подвергали реакции, как описано в примере 3, в результате чего получали целевое соединение (353 мг) (т. пл. 168oC). Это соединение указано в нижеприведенной таблице как соединение 11.
Другие соединения, представленные в таблицах, были получены вышеописанными общими методами. Соединение 20 соответствует примеру 1 в таблице 1 (DE 3801743 A1) и представляет собой 2-гидрокси-3-(4-трет-бутилциклогексил)нафталин-1,4-дион (Формула I: n = 0; m = 0; R1 и R2, взятые вместе, и R7 + R8, взятые вместе, представляют =O; R3 =-OH; и -CHR4R5- = 4-трет-бутилциклогексил).
Пестицидная активность
С использованием нижеописанных методов оценивали пестицидную активность против комнатных мух, блошек горчичных, клещей и белокрылок.
Комнатные мухи (MD) (Musca domestica)
Самки комнатных мух были обработаны в области торакса одной микролитровой каплей испытуемого соединения, растворенного в ацетоне. Для испытания каждой дозы было использовано 15 мух в двух дубликатах, при этом было использовано 6 доз различной мощности для каждого испытуемого соединения. После обработки мух выдерживали при температуре 20 ± 1oC и через 24 и 48 часов после обработки оценивали количество погибших мух. Величины LD50 были вычислены в микрограммах испытуемого соединения на одну муху (см., Sawicki et al. , Bulletin of the World Health Organisation, 35, 893 (1966) и Sawicki et al. , Entomologia and Exp. Appli. 10, 253 (1967)).
Блошки горчичные (PC) (Phaedon cochleariae Fab)
Одну микролитровую каплю ацетонового раствора испытуемого соединения наносили на брюшко взрослых горчичных блошек с помощью микрокапельного аппликатора. Обработанных насекомых выдерживали в течение 48 часов, после чего оценивали число погибших насекомых. Для испытания каждого уровня дозы было использовано 20-25 горчичных блошек в двух дубликатах, при этом сравнительную обработку проводили пятью уровнями доз. Величины LD50 вычисляли таким же образом, как и в случае комнатных мух.
Клещи (TU) (Tetranychus urticae)
25 взрослых самок клещей погружали на 30 сек в 35 мкл раствора испытуемого соединения в смеси ацетона и воды (1:4). Обработанных насекомых выдерживали при 21 ± 2oC и через 72 часа после обработки подсчитывали число погибших насекомых. Клещи с судорожным (нерефлекторным) движением более чем одной двигательной конечности, обнаруживаемым по истечении указанного периода времени, считались живыми. Для каждой испытуемой дозы использовали три дубликата из 25 клещей, при этом каждое испытуемое соединение использовали в 5 или 6 различных дозах. Величины LD50 выражали в млн.д. раствора испытуемого соединения на одно насекомое. Испытания проводили с использованием восприимчивого штамма клещей (GSS), поставляемого Schering, AG, Berlin.
Белокрылка (ВТ) (Bemisia tabaci)
Ацетоновые растворы (0,100 мл) испытуемых соединений помещали в 10-миллилитровые стеклянные сосуды и выпаривали путем вращения до образования пленки осажденного соединения. После этого 30 взрослых белокрылок помещали вовнутрь сосудов, а затем, через 60 минут, обработанные насекомые были перенесены на необработанные диски листьев хлопчатника, которые поддерживались во влажном состоянии на слое агарового геля. При этом температуру поддерживали при 25oC. Через 48 часов оценивали степень гибели насекомых. Для каждого из 5-7 уровней доз каждого испытуемого соединения было использовано три дубликата. Величины LC50 были вычислены на компьютере с использованием соответствующей системы программного обеспечения ("Polo-PC", поставляемого от LeOra Software, Berkeley, California). (Cм., M.P. Cahill и В. Hackett в "Proceedings Brighton Crop Protection Conference", 1992). Испытания проводили с использованием восприимчивого штамма белокрылки (SUD-S), которая была собрана с хлопчатника в Судане в 1978 г.
Результаты этих испытаний представлены ниже в таблицах 3 и 4. Если это не оговорено особо, то приведенные в таблицах данные представлены в виде LD50 (мкг/насекомое) или в виде LC50 (млн.д. раствора испытуемого соединения).
Активность против резистентной белокрылки (ВТ) (Bemisia tabaci)
Повторяли описанный выше эксперимент с белокрылками (ВТ) (Ned-s), за исключением того, что в данном случае, был использован резистентный штамм белокрылки Ned 1/2. Штамм Ned 1/2 представляет смешанный сбор, собранный с герберы (Gerbera) и с бувардии (Bouvardia) в Нидерландах (ICI, Нидерланды) в 1991 году, и обнаруживает высокую степень устойчивости к пиретроидным инсектицидам, таким как циперметрин, к фосфорорганическим и карбаматным инсектицидам, а также к регулятору роста насекомых бупрофецину.
Результаты этих испытаний приведены ниже. Данные представлены в виде величин LC50 (млн.д. раствора испытуемого соединения).
Соединение - BT (Ned 1/2) LC50
12 - 6.4
20 - 100
Кроме того, было обнаружено, что помимо активности против белокрылки исследуемые соединения обладали также активностью против Diabrotica (блошка длинноусая) и Lepidoptera, например Spodoptera, например S. littoralis и S. frugiperda. Так, например, соединение 4 при локальной обработке имеет величину LC50 (млн. д.) порядка 5, 10 и 20 для этих трех видов, а соединение 13 имеет величины LC50, составляющие приблизительно 20, 12 и 20 для Diabrotica, S. littoralis и S. frugiperda соответственно. В отношении конкретных видов насекомых наблюдалась также антифидинговая активность.
Фунгицидная активность
Были проведены in vitro испытания на фунгицидную токсичность рассматриваемых соединений по отношению к изолятам Aspergillus niger, Pyricularia oryzae (=Magnaporthe grisea) и Rhizoctonia solani.
Каждое соединение вводили в картофельный агар с декстрозой в растворителе (этанол/ацетон = 50/50) в соотношении 0,5 мл растворителя на 250 мл агара; при этом автоклавированный агар был расплавлен и охлажден до 50oC. Каждое соединение испытывали лишь в одной концентрации (100 мг/л).
Каждое испытание, обычно двух соединений, включало три контрольных обработки: стандартным фунгицидом (карбендазимом в концентрации 1 или 5 мг/л, или прохлоразом в концентрации 1 мг/л); лишь одной смесью этанола/ацетона, и без добавок. Фунгициды, использованные в качестве стандартов, могут рассматриваться как характерные представители активных коммерческих соединений.
Каждый грибок был протестирован на агаре в четырех чашках Петри на каждую обработку; при этом три грибковые колонии-реплики на одну чашку (одна колония для R. solani). A. niger и R. solani инкубировали в течение 4 дней при 20-25oC, a P. oryzae инкубировали в течение 7 дней. Затем измеряли увеличение диаметра колоний и полученные данные использовали для определения активности.
Результаты этих тестов представлены ниже в таблице 5. Эти результаты даны как% ингибирования роста колоний (т.е. увеличения их диаметра) при данной концентрации агента.
Помимо соединений, представленных выше, приводятся также данные для соединения 21 (2-метил-3-гидроксинафталин-1,4-дион) и для соединения 22 (2-этил-3-гидроксинафталин-1,4-дион). Для сравнения в таблице 5 представлены данные ингибирования стандартными агентами.
Кроме того, испытания показали, что соединения формулы I обладают хорошей фунгицидной активностью против широкого спектра грибков, вызывающих болезни как зерновых, так и лиственных культур. Так, например, хорошая активность наблюдалась против грибков рода Erysiphe, в частности Erysiphe graminis, и рода Botrytis, в частности Botrytis fabae и Botrytis cinerea, а также рода Rhizoctonia, Pyricularia и Aspergillus, как было продемонстрировано выше.
Пример 5
Получение 2-гидрокси-нафталин-1,4-дионов, используемых в качестве исходного материала для получения соединений, в которых n = 1 или более
В результате реакции Дильса-Альдера, проведенной с использованием соответствующих хиноновых соединений, получали соответствующие 2-гидрокси-нафталин-1,4-дионы, используемые в качестве исходных соединений для получения соединений, где n = 1 или более. Ниже приводятся конкретные примеры.
(а) Получение 6-метил-нафталин-1,4-диона
Раствор 1,4-бензохинона (13,9 г, 128 ммоль) и изопрена (13,1 мл, 131 ммоль) размешивали в ледяной уксусной кислоте (44 мл) в течение 68 часов при комнатной температуре. Полученную смесь разбавляли водой (44 мл) и нагревали с обратным холодильником в течение полутора часов. Затем смесь охлаждали до комнатной температуры и последовательно добавляли уксусную кислоту (84 мл) и хромовую кислоту (триоксид хрома (29,4 г) в воде (30 мл)), после чего смесь нагревали с обратным холодильником еще 1,5 часа. После охлаждения смесь разбавляли водой (200 мл) и экстрагировали эфиром (3 х 50 мл). Объединенные эфирные фракции промывали разбавленным раствором гидроксида натрия (2М; 2 х 50 мл), водой (2 х 50 мл), насыщенным раствором хлорида натрия (50 мл) и осушали сульфатом магния. После фильтрации, выпаривания растворителя при пониженном давлении и повторной перекристаллизации из петролейного эфира получали целевое соединение (7 г).
(b) 2-Амино-6- и 7-метил-1,4-нафталин-1,4-дионы
К перемешанному раствору 6-метилнафталин-1,4-диона (2,1 г, 12 ммоль) в ледяной уксусной кислоте (60 мл) при комнатной температуре добавляли раствор азида натрия (1,58 г) в воде (5 мл). Полученную смесь размешивали в течение 2 дней, а затем разбавляли водой (200 мл) и после размешивания еще в течение 15 минут смесь фильтровали. Фильтрат нейтрализовали бикарбонатом натрия и экстрагировали хлороформом (3 х 25 мл). Объединенные хлороформные экстракты промывали насыщенным раствором бикарбоната натрия и солевым раствором, а затем осушали (CaSO4). После фильтрации, выпаривания растворителя при пониженном давлении и хроматографии на силикагеле получали целевое соединение (100 мг) в виде смеси (3:2) изомеров.
(с) 2-Гидрокси-6- и 7-метилнафталин-1,4-дионы
Смесь изомеров аминометилнафталин-1,4-диона (200 мг), полученную, как описано в части (b), нагревали с обратным холодильником в воде (20 мл) и концентрированной серной кислоте (10 мл) в течение 20 минут. Охлажденную смесь выливали в воду со льдом (50 г) и экстрагировали эфиром (3 х 25 мл). Объединенные эфирные экстракты промывали водой, насыщенным бикарбонатом натрия (NaHCO3), водой и насыщенным раствором NaCl, а затем осушали сульфатом магния (MgSO4). После фильтрации, выпаривания растворителя и очистки с помощью колоночной хроматографии на силикагеле получали целевое соединение (68 мг).
| название | год | авторы | номер документа |
|---|---|---|---|
| 1,2,3,4-ЗАМЕЩЕННЫЕ НАФТАЛИНОВЫЕ СОЕДИНЕНИЯ, СПОСОБ ИХ ПОЛУЧЕНИЯ, СПОСОБ БОРЬБЫ С ВРЕДИТЕЛЯМИ, ПЕСТИЦИДНАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2180330C2 |
| ПРОИЗВОДНЫЕ НАФТОХИНОНА, ИНСЕКТИЦИДНОАКАРИЦИДНАЯ И/ИЛИ ФУНГИЦИДНАЯ КОМПОЗИЦИЯ, СПОСОБ БОРЬБЫ С ГРИБКАМИ, И/ИЛИ НАСЕКОМЫМИ, И/ИЛИ АКАРИДАМИ | 1996 |
|
RU2174981C2 |
| СОЕДИНЕНИЯ ТЕТРАЗОЛИНОНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПЕСТИЦИДОВ | 2013 |
|
RU2646759C2 |
| СТАБИЛЬНЫЕ ЖИДКИЕ ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ | 2002 |
|
RU2313218C2 |
| ХИМИОТЕРАПИЯ РАКА С ПРИМЕНЕНИЕМ АЗАБИЦИКЛОСОЕДИНЕНИЯ | 2018 |
|
RU2821034C2 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО И СПОСОБ ЛЕЧЕНИЯ ПОВЫШЕННОГО ГЛАЗНОГО ДАВЛЕНИЯ И/ИЛИ ГЛАУКОМЫ | 1995 |
|
RU2123847C1 |
| Полимерное соединение и его применение в фотовольтаических устройствах | 2013 |
|
RU2640810C2 |
| КОМПЛЕКСЫ | 2015 |
|
RU2682680C2 |
| Полимерное соединение и его применение в фотовольтаических устройствах | 2013 |
|
RU2641103C2 |
| КОМПЛЕКСЫ | 2015 |
|
RU2684934C2 |



Описываются новые замещенные нафталин-1,4-дионы, обладающие пестицидными свойствами, которые могут найти применение в качестве инсектицида против белокрылки, общей формулы (I), где n равно 0, m равно 0, R1 и R2, взятые вместе, представляют группу = O, R3 представляет гидроксильную группу или группу -OCOR11 , где R11 обозначает С1-алкил, R7 и R8, взятые вместе, представляют группу = O, R4 и R5 независимо представляют атом водорода или метил или взятые вместе со смежным атомом углерода, с которым они связаны, представляют C4-8-циклоалкильное кольцо, 4-трет-бутилциклогексильное кольцо, при этом полное число атомов углерода в наиболее длинной углеродной цепи, идущей от нафталинового цикла в указанном положении 3, составляет не более 2. Описывается также способ их получения, их применение в качестве пестицидов, способ борьбы с вредителями с применением таких соединений и содержащие их пестицидные композиции. Технический результат - повышение пестицидной активности, а особенно активности против белокрылки. 9 с. и 28 з.п. ф-лы, 6 табл. 
где n = 0; m = 0;
R1 и R2 взятые вместе, представляют группу =O,
R3 представляет гидроксильную группу или группу -OCOR11, где R11 обозначает C1-алкил(метил);
R7 и R8 взятые вместе, представляют группу =O;
R4 и R5 независимо представляют атом водорода или метил или, взятые вместе со смежным атомом углерода, с которым они связаны, представляют С4-8-циклоалкильное кольцо, 4-трет-бутилциклогексильное кольцо, при этом полное число атомов углерода в наиболее длинной углеродной цепи, идущей от нафталинового цикла в указанном положении 3, составляет не более 2.
где n, m, R1, R2, R3, R7 и R8 определены для общей формулы (I); a R4 и R5 вместе со смежным атомом углерода, с которым они связаны, представляют С4-8-циклоалкильное кольцо, 4-трет-бутилциклогексильное кольцо.
где n = 0; m равно целому числу 0 или 1;
R3 представляет гидроксильную группу или группу -OCOR11, где R11 обозначает C1-6-алкил;
R20 представляет С1-4-алкил;
А представляет неразветвленную или разветвленную алкильную группу, которая связывает нафталиновое кольцо в указанном положении 3 с группой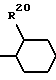
где А не содержит в цепи четвертичного атома углерода, при этом полное число атомов углерода в наиболее длинной углеродной цепи, идущей от нафталинового цикла в указанном положении 3, составляет не более 8.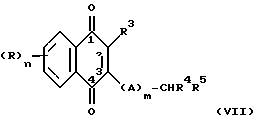
где n = 0; m равно целому числу 0 или 1;
R3 представляет гидроксильную группу или группу -OCOR11, где R11 обозначает C1-6-алкил;
R4 и R5 независимо представляют C1-7-алкильную или C1-7-галогеналкильную группу, в которой, по меньшей мере, один из R4 и R5 представляет собой C1-7-галогеналкильную группу;
А представляет неразветвленную или разветвленную алкильную группу, которая связывает нафталиновое кольцо в указанном положении 3 с группой -CHR4R5, где А не содержит в цепи четвертичного атома углерода, при этом полное число атомов углерода в наиболее длинной углеродной цепи, идущей от нафталинового цикла в указанном положении 3, составляет не более 8.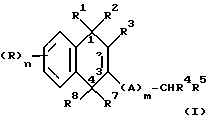
где n = 0; m равно целому числу 0 или 1;
R1 и R2 взятые вместе, представляют группу =O,
R3 представляет гидроксильную группу или группу -OCOR11, где R11 обозначает C1-6-алкил;
R7 и R8 взятые вместе, представляют группу =O;
R4 и R5 независимо представляют атом водорода или C1-7-алкильную группу, необязательно замещенную атомом галогена, цианогруппой, C1-4-алкоксигруппой, ди-(С1-4)-алкиламиногруппой, фенилом; C2-7-алкенильную группу; или R4 и R5 вместе со смежным атомом углерода представляют С4-8 циклоалкильное кольцо, необязательно замещенное C1-4-алкилом, или циклоалкенильное кольцо; а А представляет неразветвленную или разветвленную алкильную или алкенильную группу, необязательно замещенную атомом галогена, которая связывает нафталиновое кольцо в указанном положении 3 с группой - CHR4R5, где А не содержит в цепи четвертичного атома углерода, при этом полное число атомов углерода в наиболее длинной углеродной цепи, идущей от нафталинового цикла в указанном положении 3, составляет не более 8.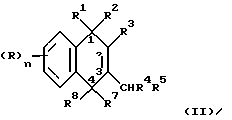
где R, R1, R2, R3, R7 и R8 и n определены как указано в п.11, а R4 и R5 независимо представляет необязательно замещенную C1-7-алкильную или С2-7-алкенильную группу.
где R, R1, R2, R3, R7 и R8, А, m и n определены как указано в п.11, a R4 и R5 вместе со смежным атомом углерода представляют С4-8 циклоалкильное кольцо, необязательно замещенное С1-4-алкилом, или циклоалкенильное кольцо.
где R, R1, R2, R3, R7, R8, А и n определены, как указано в п.11, a R4 и R5 независимо представляют необязательно замещенную C1-7-алкильную или С2-7-алкенильную группу.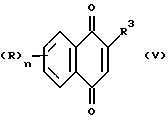
где n, R и R3 определены как указано в пп.8 и 9, с карбоновой кислотой формулы CHR4R5-(A)m-COOH, где R4, R5, m и А определены как указано в п.9 или R4 и R5 вместе образуют группу
как определено в п.8.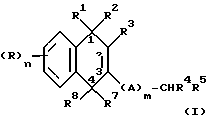
где n = 0; m равно целому числу 0 или 1;
R1 и R2 взятые вместе, представляют группу =O,
R3 представляет гидроксильную группу или группу -OCOR11, где R11 обозначает С1-6-алкил;
R7 и R8 взятые вместе, представляют группу =O;
R4 и R5 независимо представляют атом водорода или C1-7-алкильную группу, необязательно замещенную атомом галогена, цианогруппой, C1-4-алкоксигруппой, ди-(C1-4)-алкиламиногруппой, фенилом; C2-7-алкенильную группу; или R4 и R5 вместе со смежным атомом углерода представляют C4-8 циклоалкильное кольцо, необязательно замещенное C1-4-алкилом, или циклоалкенильное кольцо;
А представляет неразветвленную или разветвленную алкильную или алкенильную группу, необязательно замещенную атомом галогена, которая связывает нафталиновое кольцо в указанном положении 3 с группой -CHR4R5, и где А не содержит в цепи четвертичного атома углерода, при этом полное число атомов углерода в наиболее длинной углеродной цепи, идущей от нафталинового цикла в указанном положении 3, составляет не более 8, в сочетании, по меньшей мере, с одним носителем.
где n = 0; m = 0;
R1 и R2 взятые вместе, представляют группу =O,
R3 представляет гидроксильную группу;
R7 и R8 взятые вместе, представляют группу =O;
R4 и R5 независимо представляют атом водорода или метил.
где n = 0; m = 0;
R1 и R2 взятые вместе, представляют группу =O,
R3 представляет гидроксильную группу или группу -OCOR11, где R11 обозначает C1-6-алкил;
R7 и R8 взятые вместе, представляют группу =O;
R4 и R5 независимо представляют атом водорода или C1-7-алкильную или C1-7-галогеналкильную группу; или R4 и R5 вместе со смежным атомом углерода представляют C4-8 циклоалкильное кольцо, необязательно замещенное С1-4-алкилом.
где R, R1, R2, R3, R7 и R8 и n определены как указано в п.27, а R4 и R5 независимо представляют C1-7-алкильную или C1-7-галогеналкильную группу.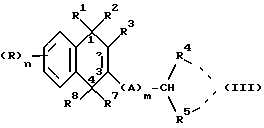
где n, m, R, R1, R2, R3, R7 и R8 определены как указано в п.27,
R4 и R5 вместе со смежным атомом углерода представляют C4-8 циклоалкильное кольцо, необязательно замещенное C1-4-алкильной группой.
где n = 0; m = 0;
R1 и R2 взятые вместе, представляют группу =O,
R3 представляет гидроксильную группу или группу -OCOR11, где R11 обозначает C1-6-алкил;
R7 и R8 взятые вместе, представляют группу =O;
R4 и R5 независимо представляют атом водорода или С1-7-алкильную или C1-7-галогеналкильную группу; или R4 и R5 вместе со смежным атомом углерода представляют C4-8 циклоалкильное кольцо, необязательно замещенное С1-4-алкилом,
в сочетании, по крайней мере, с одним носителем.
Приоритет по пунктам:
10.01.95 - по пп.1 - 3, 5, 11, 12, 19 - 21;
04.07.95 - по пп.22 - 24, 27, 28, 33, 34, 35;
10.01.96 - по пп.4, 6 - 10, 13, 14 - 18, 25, 26, 29 - 32, 36, 37.
| ДВУХОСНАЯ ПЛАТФОРМА ДЛЯ ИСПОЛЬЗОВАНИЯ В БЕСПИЛОТНОМ ЛЕТАТЕЛЬНОМ АППАРАТЕ, ТРЕХОСНАЯ ПЛАТФОРМА ДЛЯ ИСПОЛЬЗОВАНИЯ В БЕСПИЛОТНОМ ЛЕТАТЕЛЬНОМ АППАРАТЕ И МНОГОВИНТОВОЙ ЛЕТАТЕЛЬНЫЙ АППАРАТ | 2011 |
|
RU2572946C2 |
| DE 3801743, 19.01.1989 | |||
| ЦЕНТРОБЕЖНЫЙ КЛАССИФИКАТОР | 0 |
|
SU300218A1 |
| Устройство для регистрации на расстоянии скорости вращения | 1925 |
|
SU2228A1 |
| СПОСОБ ВЫРАБОТКИ КОНСЕРВОВ "ПЛОДЫ, ПРОТЕРТЫЕ С САХАРОМ" | 2009 |
|
RU2398418C1 |
| Способ получения производных 3-гидрокси-1,4-нафтохинона | 1982 |
|
SU1324585A3 |
Авторы
Даты
2001-09-10—Публикация
1996-01-10—Подача