Изобретение относится к микологии и физиологии растений, а именно к эндомикоризным грибам, образующим микоризу везикулярно-арбускулярного типа с растением.
Известен способ микоризации растений см. Gianinazzi-Pearson V. Plant cell responses to arbuscular mycorrhizal fungi: Getting to the roots of the symbiosis // Plant Cell. 1996. V. 8, N 10. P. 1871-1883.
Известный способ предусматривает активацию симбиоза только за счет инокуляции.
Известен способ получения субстратно-корневой смеси см. Ferguson J., Woodhead S. Production of Endomycorrhizal inoculum // Method and Princip Mycorrhizal Research. St. Paul. 1982. P. 47-54.
Известна субстратно-корневая смесь, имеющая большое число инфекционных пропагул, см. Manjunath A., Bagyaraj D. Components of VA mycorrhizal inoculum and their effects on growth of onion // New Phytol. 1981. V. 87. P. 355-363.
Известен способ стимуляции эндомикоризных грибов, образующих микоризу везикулярно-арбускулярного типа с растением, см. патент США N 5002603, A 01 H 17/00, 1991.
Известен регулятор роста β-индолил-уксусная кислота (ИУК)-природный ауксин, см. Шевелуха В.С., Калашникова Е.А., Дегтярев С.В., Кочиева Е.3., Прокофьев М.И., Новиков Н.Н., Ковалев В.М. Калашников Д.В. Сельскохозяйственная биотехнология. М.: Высш. шк. 1998. С. 416.
Физиологический эффект при использовании этого регулятора проявляется в регуляции растяжения, деления и дифференцировки на клеточном уровне.
Известен способ инокуляции растений с везикулярно-арбускулярной микоризой в лаборатории и в поле, включающий получение инокуляционного материала и проведение микровегатиционных опытов, см. Menge J.A., Timmer I. Procedures for inoculation of plants with vesicular-arbuscular mycorrhizae in laboratory, greenhouse and field // Method and Princip Mycorrhizai Research. St. Paul. 1982. P. 59-68.
Известен способ активации симбиоза растений с эндомикоризным грибом путем воздействия на биохимические процессы растений см. И.В. Зольникова, И.В. Серебренникова, Т.Г. Леонова, Г.С. Муромцев. Использование фузикокцина и эндомикоризного гриба Glomus mosseae в биологической рекультивации мелиорированных сульфидсодержащих грунтов // Микология и фитопатология. 1997. Т. 31, вып. 6. С. 31-36.
В качестве регулятора роста использован фузикокцин - биосинтетический регулятор роста терпеноидной природы.
Данный способ принят за прототип настоящего изобретения.
Однако он обладает рядом недостатков.
Фузикокцин - прототип получен биотехнологическим способом из культуральной жидкости и биомассы гриба. При использовании фузикокцина содержание структур микоризации (F, М, B, A) довольно высокие, особенно на сульфидсодержащих почвах, но широкое применение неэкономично из-за слишком большой стоимости (1 мг до 50$).
В основу настоящего изобретения положено решение задачи получения эффективного и экономичного регулятора, обеспечивающего увеличение продуктивности, улучшение фотосинтеза, повышение сахаров в корнях и усиление интенсификации микосимбиотрофизма растений.
Согласно изобретению эта задача решается за счет того, что способ активации симбиоза растений с эндомикоризным грибом осуществляют путем воздействия регулятором роста на биохимические процессы растений, образующих симбиоз с эндомикоризными грибами арбускулярного типа, в качестве регулятора роста берут раствор гидроптерина при концентрации 10-7 - 10-6 г/л.
Заявителем не выявлены источники, содержащие информацию о технических решениях, идентичных настоящему изобретению, что позволяет сделать вывод о его соответствии критерию "новизна".
За счет реализации отличительных признаков изобретения (в совокупности с признаками, указанными в ограничительной части формулы) достигаются важные новые свойства объекта. В предложенном техническом решении проводят обработку посадочного материла (семян, черенков) перед внесением в инокулированную грибом почву раствором гидроптерина при концентрации 10-7-10-6 г/л, что обуславливает интенсификацию микосимбиотрофизма растений, увеличение продуктивности, повышение сахаров в корнях, улучшение фотосинтеза.
Заявителю не известны какие-либо публикации, которые содержали бы сведения о влиянии отличительных признаков изобретения на достигаемый технический результат. В связи с этим, по мнению заявителя, можно сделать вывод о соответствии заявляемого технического решения критерию "изобретательский уровень".
Сущность изобретения поясняется примером получения гидроптерина. Гидроптерин экологически безопасен для человека и биосферы. Острая токсичность гидроптерина исследована в опытах на белых мышах и белых крысах. После подкожного введения мышам гидроптерина в дозе 2 г/кг никаких симптомов интоксикации не наблюдалось. У белых крыс после введения им через зонд в желудок взвеси или подкисленного теплого водного раствора гидроптерина в дозе 0.5 г/кг никаких проявлений интоксикации не обнаружено, даже в течение трехнедельного введения с суммарной дозой 1400 мг. Исследование влияния гидроптерина в динамике на функциональное состояние различных физиологических систем (сердечно-сосудистая, нервная система) и органов (селезенка, сердце, легкие, почки, мозг, печень) животных с регистрацией массы тела, записью электрокардиограммы, анализом мочи, крови, определением активности ферментов холинэстеразы, аланин- и аспартатамино-трансферазы не выявило статистически значимой разности между крысами и мышами, получавшими гидроптерин, и животными контрольной группы. Таким образом, гидроптерин может быть отнесен к V классу практически нетоксичных веществ.
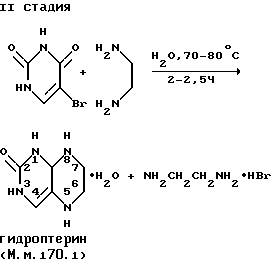
Изобретение включает оригинальную технологию получения гидроптерина, которая описывается следующей химической схемой: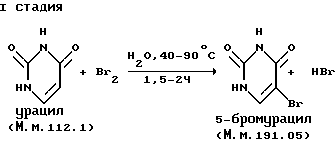
Пример 1 (синтез)
I стадия - 5-бромурацил:
- урацил 504 г (4.5 моль) и 1800 мл воды загружают в трехгорлую колбу объемом 4 л, снабженную обратным холодильником, термометром, эффективной мешалкой и капельной воронкой;
- смесь нагревают до 40oC на водяной бане и при интенсивном перемешивании прикапывают 232 мл (4.5 моль) жидкого брома в течение 45 мин, при этом наблюдается небольшой тепловой эффект, подъем температуры до 55-60oC и почти полное растворение исходного урацила;
- смесь перемешивают при температуре 80-85oC в течение 1.5 часа, при этом происходит полное обесцвечивание массы и выпадает обильный осадок продукта;
- реакционную массу охлаждают сначала до комнатной температуры, затем выдерживают в ледяной воде в течение 2 часов и в холодном состоянии отфильтровывают белый кристаллический осадок;
- осадок отжимают от маточного раствора и промывают водой до отрицательной реакции на ион брома и отсутствия примесей 5,5-дибром-6-окси-5,6-дигидроурацила;
- осадок отжимают и сушат в сушильном шкафу при температуре 70-75oC до постоянного веса;
- получают 816,7 г (95%) 5-бромурацила в виде бесцветных кристаллов с т. пл. 303-305oC с разл.; хроматографически однороден - Rf=0.45 в системе метанол-хлороформ - 1: 4, силуфол УФ 254. Вычислено для C5H3BrN2O2 (М. м. 191.05),%: Br - 41.83, N - 14.66. Найдено, %: Br - 41.67, N - 14.59;
- ПМР-спектр, ДМСО-d6, δ м.д.: 7.75 (C6-H, д, 1H); 11.15 (NH, д, 1H), 11.50 (NH, с, 1H); УФ-спектр: 0.1 н HCl -λмакс275 нм (lg ε 3.88); 0.1 н NaOH λмакс290 нм (lg ε 3.86).
II стадия - 2-оксо-(3H)-5,6,7,8-тетрагидроптеридин (гидроптерин)
- 1410 мл 70% водного раствора этилендиамина (d=0.975) загружают в трехгорлую колбу объемом 4 л, снабженную обратным холодильником, термометром, эффективной мешалкой;
- смесь нагревают до 70-75oC на водяной бане и прибавляют небольшими порциями 860 г (4.5 моль) 5-бромурацила в течение 1 часа. При этом температура реакционной массы не должна превышать 85oC;
- наблюдается растворение исходного 5-бромурацила. а затем происходит кристаллизация продукта реакции;
- смесь перемешивают при 80-85oC в течение 1.5 часов до исчезновения на хроматограмме исходного урацила;
- реакционную массу охлаждают до 50-60oC и приливают при перемешивании 1.5 л метилового спирта;
- смесь нагревают при 70-75oC и перемешивают в течение 1 часа;
- смесь охлаждают ледяной водой в течение 3 часов и осадок отфильтровывают;
- осадок хорошо отжимают от раствора, промывают 450 мл 70% метанола, маточный раствор отделяют для регенерации метанола и этилендиамина, отжимают от растворителя и сушат до постоянного веса;
- получают 651 г (85%) 2-оксо-(3H)-5,6,7,8-тетрагидроптеридина моногидрата (гидроптерина) в виде сетло-желтых кристаллов с т. пл. 200-205oC с разл. ; хроматографически однороден Rf=0.8 в системе 5% NH4Cl, силуфол УФ - 254. Вычислено для C6H10N4O2 (М. м. 170.18), %: C - 42.31, H - 5.87, N - 32.94. Найдено, %: C - 42.26, H - 5.81, N - 32.89.
Препарат стандартизирован по физико-химическим показателям:
- ПМР-спектр, ДМСО-d6, δ , м. д.: 6.45 (C4-H, с, 1H); 2.80 (CH2CH2, с, 4H); УФ-спектр: вода- λмакс1= 233 нм (lgε = 4.01), λмакс2= 300 нм (lg ε 3.77), 0.1 н HCl - λмакс299 нм (lg ε 3.60); 0.1 н NaOH λмакс292 нv (lgε 3.55); ИК-спектр (KBr): νC=01645 см-1, νкольца1600 см-1.
Гидроптерин растворяется в разбавленных щелочах, минеральных кислотах с образованием солей, не растворим в хлороформе, бензоле, эфире. Растворимость в кипящем спирте 1 г/50 мл, в кипящей воде - 1 г/30 мл (хорошо кристаллизуется).
Процесс получения 5-бромурацила может быть совмещен со стадией его конденсации с этилендиамином, то есть технологический процесс получения гидроптерина из урацила упрощается и проводится в одном реакторе. Затраты на производство гидроптерина невелики и стоимость продукта определяется лишь ценой недорогого исходного сырья (урацила, брома, этилендиамина).
Данная технология пригодна для реализации в промышленном масштабе с использованием стандартного оборудования и отечественного сырья. Способ получения гидроптерина высокопроизводителен, экономичен и стоимость целевого продукта значительно ниже по сравнению с импортными препаратами аналогичного действия.
Пример 2
В обработанные спиртом сосуды емкостью 5 кг помещают стерильный субстрат (песчано-глинистая смесь в пропорции 3:1). Вносят 50 г инокуляционного материала (на основе гриба Glomus fasciculatum и Glomus mosseae), высевают семена сорго и выращивают 2.5 месяца, поддерживая постоянный уровень влажности (60% от полной влагоемкости). Поливают 1 раз в неделю по 10 мл на сосуд следующими питательными растворами:
Раствор 1: (NH4)2SO4 - 0.12; H2O - 1000 мл;
Раствор 2: Ca(NO3)2 2H2O - 4; H2O- 1000 мл;
Раствор 3: K2SO4 - 3.5; MgSO4 7H2O - 4.9; CaSO4 2H2O - 29;
Раствор 4: CuSO4 • 5H2O - 0.04; ZnSO4 2H2O - 0.11; FeSO4 - 40; MnCl2O - 0.09; CoSO4 • 6H2O - 26; H3BO3 - 1.3; NaMoO4 • 3H2O - 0.0135; H2O - 5000 мл;
Раствор 5: Ca(H2PO4)2H2O; H2O - 1000 мл.
Наземную часть срезают, а субстратно-корневая смесь является инокляционным материалом, содержащим инфекционные зачатки эндомикоризного гриба.
Такой иноколюм сохраняет микоризоинфицирующую способность в течение 6 месяцев при комнатной температуре при хранении в темном месте.
Примечание: Микоризообразующие грибы класса Zygomycetes: Glomus mosseae и Glomus fasciculatum предоставлены лабораторией почвенной микологии Всероссийского научно-исследовательского института сельскохозяйственной микробиологии.
Пример 3
Готовят субстрат: почву (дерново-подзолистая, легкосуглинистая) и песок берут в равном соотношении.
Вносят субстрат в сосуды объемом 500 мл.
Помещают в сосуд на глубину 7-8 см эндомикоризный иноколюм на основе гриба Glomus mosseae.
Готовят водный раствор гидроптерина концентрации 10-6 г/л.
Берут семена овса экспериментального сорта "Теремок" (Кировская обл.) и замачивают в водном растворе гидроптерина на 1 час.
Высаживают семена овса на глубину 2 см и выращивают в сосудах при поддержании постоянной влажности, равной 60% от полной влагоемкости.
Поливают семена овса 1 раз в неделю в течение 4-6 недель питательным раствором Прянишникова следующего состава: NH4О3 - 0.084; CaHPO4 • 2H2O - 0.07; MgSO4 (безводный) - 0.06; KCl - 0.1; FeCl3 - 0.025; CaSO3 • 2H2O - 0.344.
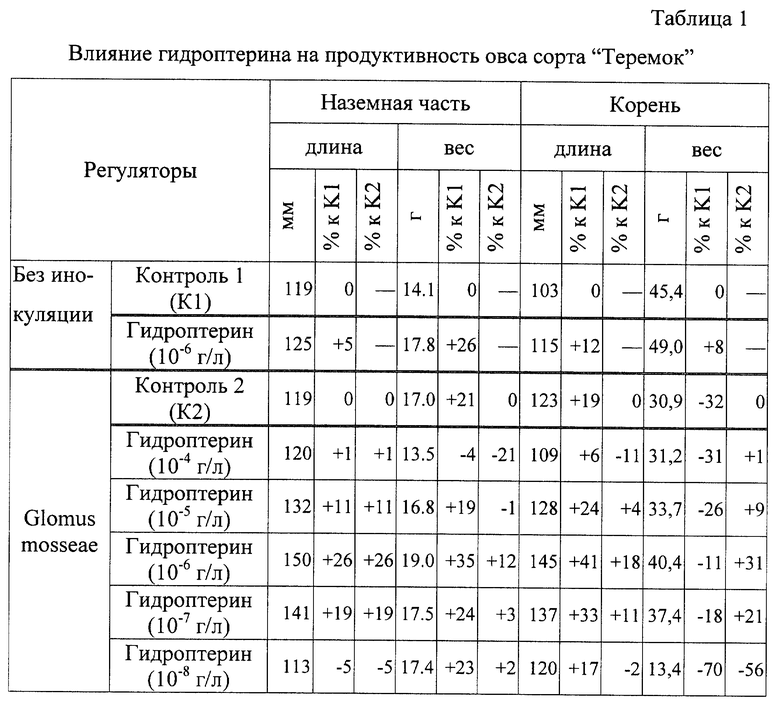
Определяют влияние гидроптерина на продуктивность овса:
наземная часть - длина 150 мм, вес 19 г;
корень - длина 145 мм, вес 40.4 г.
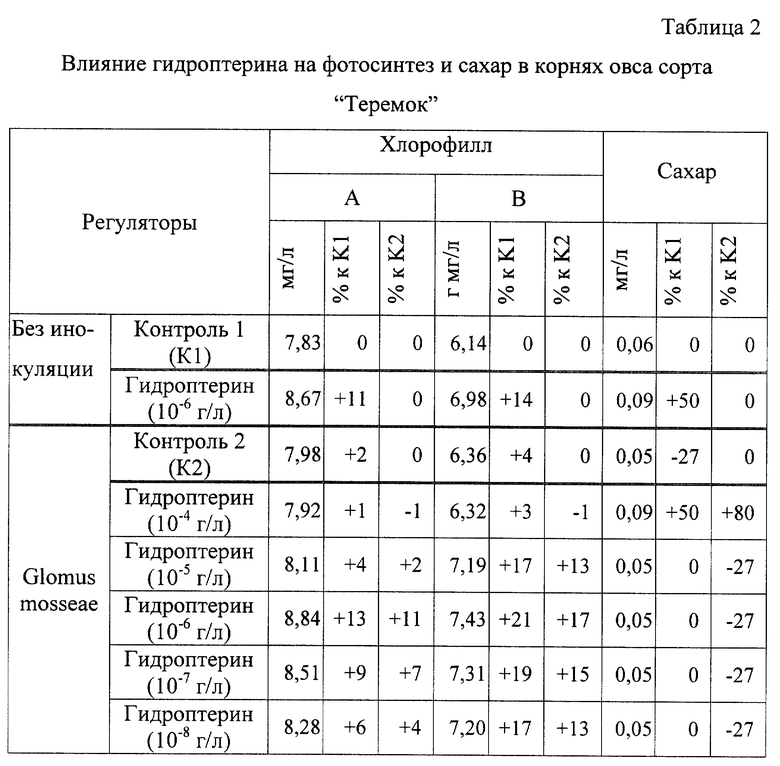
Определяют влияние гидроптерина на фотосинтез и сахара в корнях:
хлорофилл: A - 8.84 мг/л; B - 7.43 мг/л;
сахара - 0.05 мг/л.
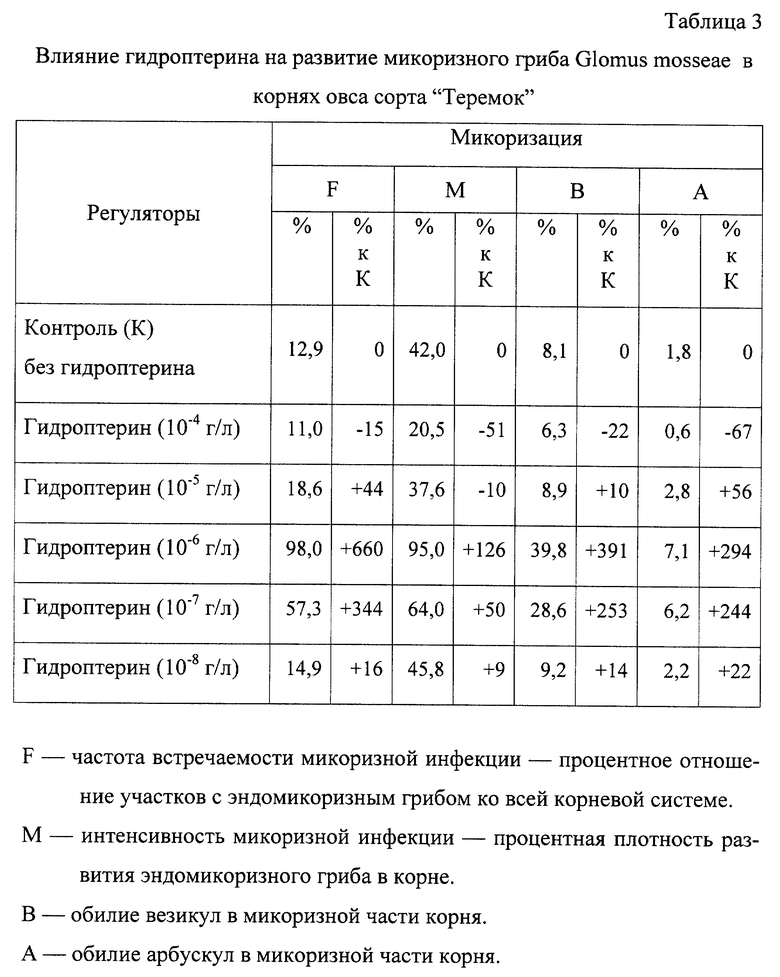
Определяют влияние гидроптерина на развитие эндомикоризного гриба в корне: F - 98%; М - 95%; В - 39.8%; A - 7.1%.
Результаты опыта представлены в таблицах 1, 2 и 3.
Из таблицы 1 видно, что гидроптерин положительно влияет на продуктивность овса:
- увеличивается на 26% вес при постоянной длине (в варианте без инокуляции) - контроль 1;
- увеличивается на 21% вес наземной части и на 19% длина корня (в варианте с инокуляцией) - контроль 2 по сравнению с контролем 1.
Наиболее эффективная концентрация гидроптерина 10-7-10-6 г/л.
Из таблицы 2 видно, что гидроптерин увеличивает хлорофилл A на 13-9%, а хлорофилл В на 21-13% по сравнению с контролем 1.
Наиболее эффективная концентрация гидроптерина 10-7-10-6 г/л.
Из таблицы 3 видно, что гидроптерин значительно повлиял на микоризацию корней, если при концентрации гидроптерина 10-4 г/л содержание микоризных структур снизилось от 15 до 67%, тогда как при концентрации 10-7-10-6 г/л частота встречаемости микоризной инфекции (F) увеличилась на 660-344% по сравнению с контролем 2.
Наиболее эффективная концентрация гидроптерина 10-7-10-6 г/л.
Пример 4
Готовят субстрат: почву (дерново-подзолистая, легкосуглинистая) и песок берут в равном соотношении.
Вносят субстрат в сосуды объемом 500 мл.
Помещают в сосуд на глубину 7-8 см эндомикоризный инокулюм на основе гриба Glomus fasciculatum.
Готовят водный раствор гидроптерина концентрации 10-6 г/л.
Берут черенки комнатного растения плектрантус (Plectrantus austrelis) и проращивают в воде до образования двух междоузлий и корней.
Погружают черенки в водный раствор гидроптерина и выдерживают в течение 1 часа.
Поливают плектрантус 1 раз в неделю в течение 4-6 недель питательным растовром Прянишникова следующего состава: NH4NO3 - 0.084; CaHPO4 • 2H2O - 0.07; MgSO4 (безводный) - 0.06; KCl - 0.1; FeCl3 - 0.025; CaSO4 • 2H2O - 0.344.
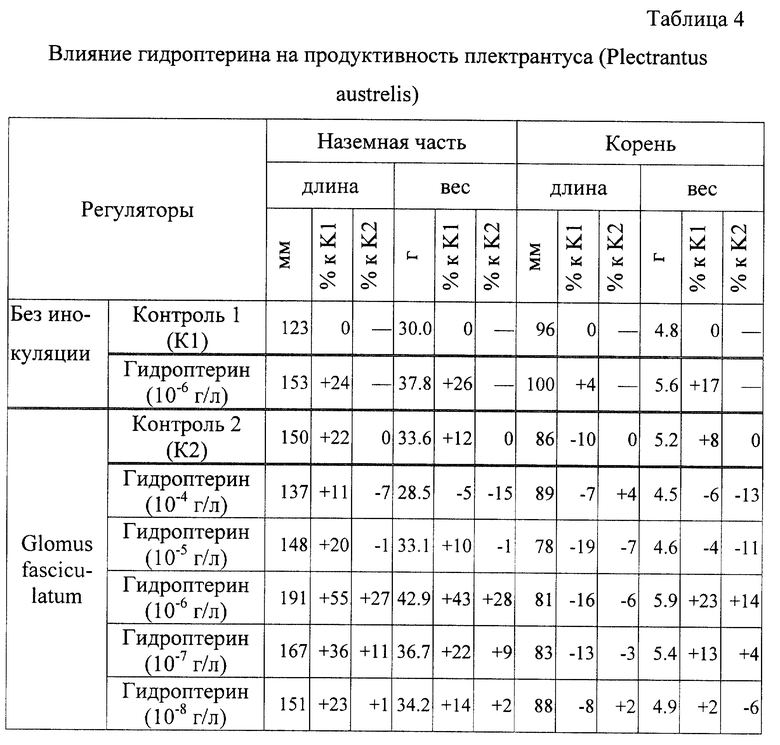
Определяют влияние гидроптерина на продуктивность плектрантуса:
наземная часть - длина 191 мм; вес 42.9 г;
корень - длина 81 мм; вес 5.9 г.
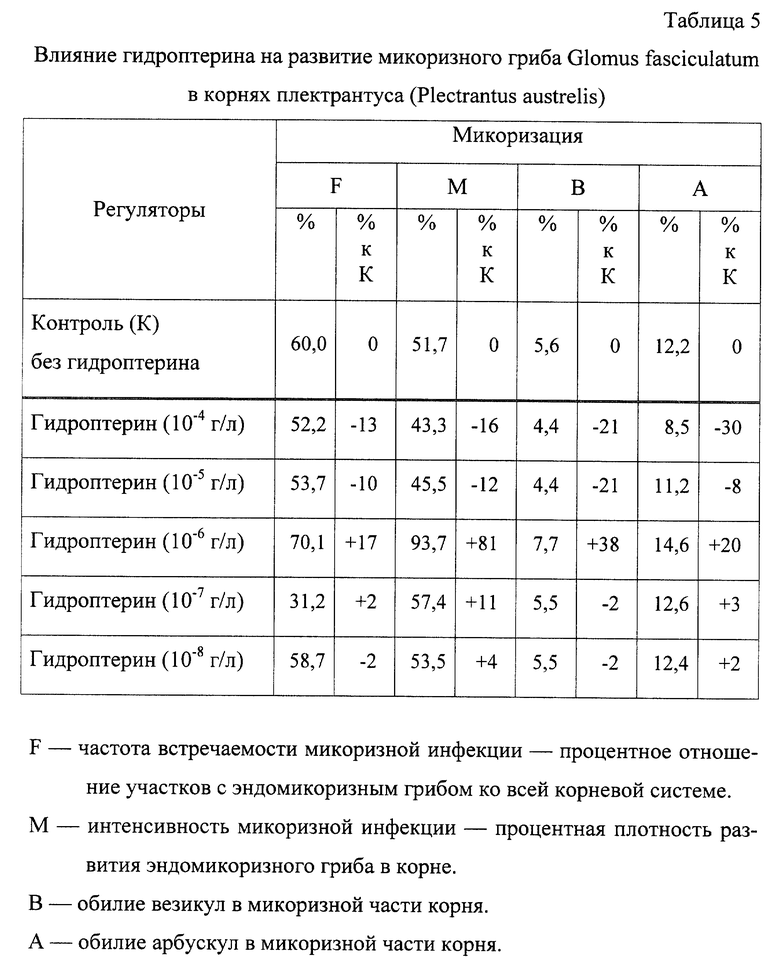
Определяют влияние гидроптерина на развитие эндомикоризного гриба в корне: F - 70.1%; М - 93.7%; B - 7.7%; A - 14.6%.
Результаты опыта представлены в таблицах 4 и 5.
Из таблицы 4 видно, что гидроптерин увеличил длину и вес наземной части на 24-26% (в варианте без инокуляции) по сравнению с контролем 1 и повысил вес на 43-22% наземной части, длину на 55-36% и вес корня на 23-13% (в варианте с инокуляцией) - контроль 2.
Наиболее эффективная концентрация гидроптерина 10-6-10-7 г/л.
Из таблицы 5 видно, что гидроптерин увеличивает развитие эндомикоризного гриба в корнях растений, содержание микоризных структур возрастает на 81% по сравнению с контролем 2.
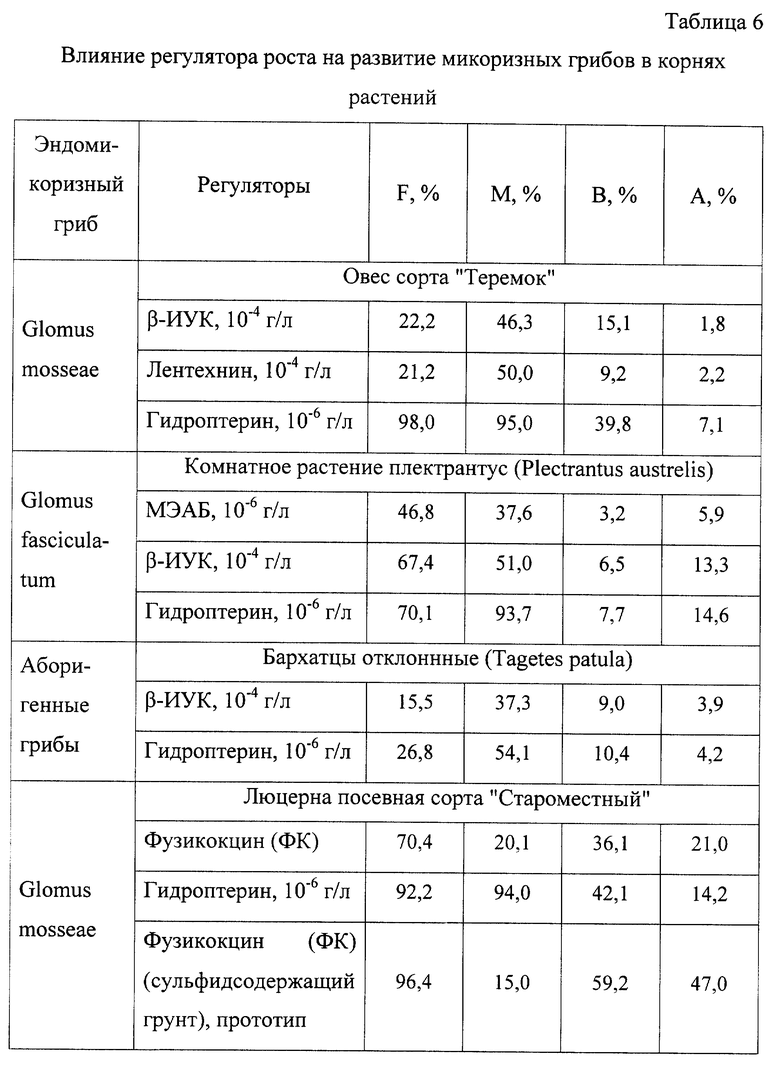
Проведено сравнение использования гидроптерина с известными регуляторами роста.
Влияние β-индолил-уксусной кислоты (β-ИУК), лентехнина, моноэтаноламмониевой соли барбитуровой кислоты (МЭАБ), фузикокцина (ФК) и гидроптерина на развитие микоризных грибов в корнях овса, плектрантуса, бархатцев и люцерны представлены в таблице 6.
Из таблицы 6 видно, что наиболее эффективным регулятором роста является гидроптерин.
Гидроптерин увеличивает содержание основных структур микоризного гриба в корнях растений на 20% F, на 70% М, на 6% B по сравнению с фузикокцином на субстрате в приведенных примерах.
Предложенный способ активации симбиоза растений с эндомикоризным грибом путем обработки семян, черенков растений раствором гидроптерина, являющимся высокоэффективным, технологичным и экономичным регулятором роста, апробирован и подтверждается результатами опытов для различных растений, что обуславливает, по мнению заявителей, его соответствие критерию "промышленная применимость".
Использование гидроптерина для активации симбиоза растений с эндомикоризным грибом позволяет:
- усилить интенсификацию микосимбиотрофизма растений;
- увеличить продуктивность (длину, вес наземной части и корня);
- улучшить фотосинтез (хлорофилл в листьях);
- увеличить накопление сахаров в корнях.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЭКСПРЕСС-ОПРЕДЕЛЕНИЯ СИМБИОТИЧЕСКОЙ ЭФФЕКТИВНОСТИ ГРИБОВ АРБУСКУЛЯРНОЙ МИКОРИЗЫ И ИНДЕКСОВ МИКОРИЗАЦИИ | 2012 |
|
RU2528864C2 |
| Биотехнологический способ оптимизации производства привитых саженцев винограда на основе применения гриба Glomus intraradices Shenck & Smith, штамм RCAM02146 | 2017 |
|
RU2672381C2 |
| РЕГУЛЯТОР РОСТА И СПОСОБ ПОВЫШЕНИЯ БИОХИМИЧЕСКОЙ АКТИВНОСТИ МИКРООРГАНИЗМОВ И РАСТЕНИЙ | 2000 |
|
RU2171577C1 |
| СПОСОБ БИОРЕМЕДИЗАЦИИ ЗАГРЯЗНЕННЫХ КАДМИЕМ ПОЧВ | 2012 |
|
RU2515691C1 |
| Способ оценки качества биопрепаратов на основе грибов арбускулярной микоризы | 2021 |
|
RU2776652C1 |
| КОМПОЗИЦИЯ ДЛЯ СТИМУЛИРУЮЩЕЙ ОБМАЗКИ КОРНЕЙ РАСТЕНИЙ | 2013 |
|
RU2636168C2 |
| НОВЫЙ ШТАММ GLOMUS IRANICUM ВИДА TENUIHYPHARUM VAR. NOV. И ЕГО ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ БИОСТИМУЛЯНТА | 2014 |
|
RU2671174C2 |
| ЛИПОХИТООЛИГОСАХАРИДЫ, СТИМУЛИРУЮЩИЕ АРБУСКУЛЯРНО-МИКОРИЗНЫЙ СИМБИОЗ | 2009 |
|
RU2539028C2 |
| Способ внесения микоризных грибов в почву с использованием промежуточной культуры-хозяина | 2023 |
|
RU2824763C1 |
| ШТАММ GLOMUS IRANICUM VAR. TENUIHYPHARUM VAR. NOV. И ЕГО ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ БИОНЕМАТОЦИДА | 2014 |
|
RU2699518C2 |
Изобретение относится к микологии и физиологии растений, а именно к эндомикоризным грибам, образующим микоризу везикулярно-арбускулярного типа с растением. Предложен способ активации симбиоза растений с эндомикоризным грибом путем воздействия регулятором роста на биологические процессы растений, образующих симбиоз с эндомикоризными грибами арбускулярного типа. В качестве регулятора роста использует раствор гидроптерина при концентрации 10-7-10-6 г/л. Применение гидроптерина для активации симбиоза растений с эндомикоризным грибом позволяет усилить интенсификацию микосимбиотрофизма растений, увеличить длину и вес наземной части и корня растений, повысить содержание хлорофилла в листьях. 6 табл.
Способ активации симбиоза растений с эндомикоризным грибом путем воздействия регулятором роста на биохимические процессы растений, образующих симбиоз с эндомикоризными грибами арбускулярного типа, отличающийся тем, что в качестве регулятора роста берут раствор гидроптерина при концентрации 10-7 - 10-6 г/л.
| ЗОЛЬНИКОВА Н.В | |||
| и др | |||
| Использование физикокцина и эндомикоризного гриба Glomus mosseae в биологической рекультивации мелиорированных сульфидсодержащих грунтов, Микология и фитопатология, 1997, т | |||
| Способ очистки нефти и нефтяных продуктов и уничтожения их флюоресценции | 1921 |
|
SU31A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Способ очистки нефти и нефтяных продуктов и уничтожения их флюоресценции | 1921 |
|
SU31A1 |
| GNEKOW M.A | |||
| и др | |||
| In Huence of the fungicide pentachloronitrobenzene on VA-mycorrhiral and total root length and phosph orus uptake of outs (Avena sativa), Plant Soil, 1989, т | |||
| Способ получения борнеола из пихтового или т.п. масел | 1921 |
|
SU114A1 |
| Огнетушитель | 0 |
|
SU91A1 |
| LEINHOS V | |||
| и др | |||
| Effect of amino alcohol application, rhizobacteria and mycorrhira inoculation on the growth, the content of protein and phenolics and protein pattern of drought, stressed lettuce (lactuca sativa L.cv | |||
| "Amerikanisher Brauner"), Angew Bot., 1995, vol | |||
| Способ приготовления пищевого продукта сливкообразной консистенции | 1917 |
|
SU69A1 |
| Паровозный золотник (байпас) | 1921 |
|
SU153A1 |
Авторы
Даты
2001-12-10—Публикация
2000-05-25—Подача