Настоящее изобретение касается способа окисления циклогексана в адипиновую кислоту и более конкретно обработки реакционных смесей, образующихся в результате этой реакции окисления.
Прямое окисление циклогексана в адипиновую кислоту является способом, который был разработан много лет назад, в связи с очевидными преимуществами, которые он дает при превращении циклогексана в адипиновую кислоту, в одну стадию и без использования такого окислителя, как азотная кислота, соединения, генерирующего оксиды азота, которые затем надо обрабатывать, чтобы избежать любого загрязнения.
Международная заявка на патент 94/07833 описывает окисление циклических углеводородов в соответствующие дикислоты в жидкой фазе, содержащей растворитель, при температуре, по меньшей мере, 60oС при помощи газа, содержащего кислород, в присутствии катализатора окисления, такого как соединение кобальта, точно указывая, что растворитель присутствует в количестве меньше 1,5 моля на моль циклического углеводорода, что вышеупомянутый растворитель содержит органическую кислоту, содержащую только первичные или вторичные атомы водорода, и что реакцию проводят в присутствии, по меньшей мере, 0,002 молей катализатора на основе кобальта на 1000 г реакционной смеси. В конце реакции образовавшуюся дикислоту выделяют.
Международная заявка на патент 94/07834, поданная в тот же день, что и предыдущая, также описывает тот же самый способ, но развивает стадии обработки конечной реакционной смеси. Эта обработка заключается в выделении образовавшейся кислоты путем охлаждения смеси, чтобы вызвать осаждение вышеупомянутой дикислоты, отделении путем фильтрования дикислоты от двух жидких фаз, одной неполярной, которую возвращают в цикл, и одной полярной, которую также возвращают в цикл после возможного гидролиза и выделения дополнительного количества дикислоты.
Эти изобретения предлагают растворы, позволяющие окислять циклогексан в адипиновую кислоту в одну стадию с промышленно приемлемой селективностью, но они не дают промышленно пригодного раствора для обработки реакционной смеси, образующейся в результате окисления, принимая во внимание разделение различных продуктов и побочных продуктов реакции, непрореагировавших продуктов и катализатора.
Настоящее изобретение предлагает способ обработки реакционной смеси, образующейся в результате прямого окисления циклогексана в адипиновую кислоту кислородом в органическом растворителе и в присутствии катализатора, отличающийся тем, что вышеупомянутый способ состоит из:
- перегонки, позволяющей выделить, с одной стороны, дистиллят, содержащий, по меньшей мере, часть наиболее летучих соединений, таких как непрореагировавший циклогексан, органический растворитель, циклогексанон, циклогексанол, сложные циклогексиловые эфиры, лактоны, вода, и, с другой стороны, остаток перегонки, содержащий образовавшиеся дикислоты, катализатор;
- добавления воды к остатку перегонки для получения водного раствора;
- кристаллизации адипиновой кислоты из водного раствора остатка перегонки.
Органический растворитель, более конкретно, выбирают среди алифатических карбоновых кислот.
Катализатор содержит, предпочтительно, кобальт, марганец или смесь кобальта и марганца.
Перегонку проводят таким образом, чтобы большая часть и, по меньшей мере возможности, практически все количество непрореагировавшего циклогексана и растворителя, особенно предпочтительно используемой карбоновой кислоты, было отделено от адипиновой кислоты.
Способ позволяет, таким образом, особенно в результате перегонки растворителя и более конкретно используемой в качестве растворителя карбоновой кислоты осуществлять кристаллизацию адипиновой кислоты в воде, растворителе, который обладает многочисленными преимуществами по сравнению с другими растворителями, кристаллизации, такими, например, как уксусная кислота. В самом деле, не только избегают последующего удаления, часто трудного, следов этих растворителей, но также меньшая растворимость адипиновой кислоты в воде при охлаждении позволяет лимитировать и даже, если это экономически приемлемо, подавить получение второго потока менее чистой адипиновой кислоты из растворов, образующихся при первой кристаллизации. Кроме того, в промышленном способе таким образом избегают дополнительных опасностей коррозии установки, создаваемых продолжительным присутствием алифатической карбоновой кислоты, когда ее используют в качестве растворителя.
Стадию перегонки обычно осуществляют при температуре от 25oС до 250oС и при абсолютном давлении, заключенном между 10 Па и атмосферным давлением. Предпочтительно температура смеси во время перегонки будет поддерживаться между 70oС и 150oС.
Если необходимо, перегонка может быть проведена в несколько последовательных стадий, в частности, в предпочтительном варианте, когда хотят удалить наибольшую часть, например более 90% и даже более 99% растворителя, такого как алифатическая карбоновая кислота.
Предпочтительно реакционную смесь, образующуюся при прямом окислении циклогексана в адипиновую кислоту, перед стадией перегонки подвергают декантации, приводящей к образованию двух жидких фаз: верхней фазы, по существу, циклогексановой и нижней фазы, содержащей, главным образом, растворитель, такой как алифатическая карбоновая кислота, образовавшиеся дикислоты, катализатор и часть других продуктов реакции.
Циклогексановую фазу наиболее часто вновь вводят в процесс окисления циклогексана, либо непосредственно, либо после возможной обработки, заключающейся, по существу, в удалении воды, которую она содержит. Эта обработка, в частности, может заключаться в азеотропной перегонке.
Нижнюю фазу подвергают перегонке, упоминавшейся перед этим.
Интересный вариант осуществления способа согласно изобретению заключается во введении водяного пара в реакционную смесь перед перегонкой или во время стадии перегонки. Эта операция может позволить лучше вовлечь в процесс некоторые соединения, присутствующие в смеси, подвергающейся перегонке. Она сможет также привести к частичному или полному гидролизу сложных эфиров карбоновых кислот, которые также могут находиться в перегоняемой смеси.
Дистиллят, полученный в процессе перегонки, описанной перед этим, содержит различные летучие соединения и воду. Эти летучие соединения могут быть облагорожены и, следовательно, могут быть вновь введены в новую реакцию окисления циклогексана после, по меньшей мере частичного, удаления из них воды любым известным способом, особенно азеотропной перегонкой.
Количество воды, добавляемой к остатку перегонки, в 0,01-5 раз отличается от массы смеси, полученной после вышеупомянутой перегонки. Предпочтительно количество добавляемой воды отличается от этой массы в 0,1-3 раза.
Вариант реализации способа согласно изобретению заключается в том, что водный раствор, полученный перед этим, перед осуществлением кристаллизации адипиновой кислоты подвергают экстракции жидкость/жидкость.
Эту экстракцию осуществляют при помощи растворителя или смеси растворителей, не смешивающихся с водой. В качестве примеров таких растворителей можно назвать алифатические, циклоалифатические или ароматические углеводороды, как, например, гексан, циклогексан, бензол, толуол, сложные эфиры, как, например, бутилацетат, циклогексилацетат, галоидированные углеводороды, как, например, трихлорметан, дихлорбензолы, простые эфиры, как, например, диизопропиловый эфир. Для его эффективности и чтобы не усложнять способ, предпочитают использовать циклогексан. В рамках промышленного способа непрерывного действия для экстракции жидкость/жидкость можно использовать весь циклогексановый слой или часть циклогексанового слоя, выделенного декантацией из реакционной смеси перед стадией перегонки. В предпочтительном случае использования циклогексана для осуществления экстракции полученный циклогексановый раствор наиболее часто вновь вводят в процесс окисления циклогексана, либо непосредственно, либо предпочтительно после обработки, заключающейся, по существу, в удалении воды, которую он содержит. Как и прежде, эта обработка может, в частности, заключаться в азеотропной перегонке.
Другой вариант осуществления способа заключается в нагревании водного раствора, полученного после добавления воды к остатку перегонки, таким образом, чтобы гидролизовать сложные эфиры, которые также могут присутствовать в этом растворе. Циклогексан, образующийся в результате этого гидролиза, отделяют азеотропной перегонкой. Этот гидролиз может быть осуществлен в присутствии сильно кислотного катализатора, либо растворенного, такого как протонная кислота, либо нерастворенного, такого как гетерогенный кислотный катализатор.
Кристаллизацию адипиновой кислоты из водного раствора осуществляют согласно обычным способам кристаллизации. После нее может быть проведена перекристаллизация полученной адипиновой кислоты, если чистота последней считается недостаточной для намеченных применений.
Водный раствор, остающийся после кристаллизации адипиновой кислоты, содержит еще некоторое количество растворенной адипиновой кислоты, которую можно выделить во втором потоке после концентрирования вышеупомянутого водного раствора. Он содержит также другие дикислоты, образующиеся при окислении циклогексана в меньших количествах, в основном глутаровую кислоту и янтарную кислоту, которые могут быть выделены известными способами, и, наконец, катализатор. Выделение катализатора осуществляют, обычно, путем экстракции жидкость/жидкость или мембранного электродиализа. Катализатор, выделенный таким способом, после добавления дополнительного количества, если это необходимо, возвращают в цикл в новую реакцию окисления циклогексана в адипиновую кислоту.
Сырая реакционная смесь, которую используют в способе согласно изобретению, образуется в результате окисления, самого по себе известного, циклогексана газом, содержащим кислород, в жидкой среде, содержащей органический растворитель, предпочтительно карбоновую кислоту, и в присутствии катализатора, особенно катализатора, содержащего кобальт, марганец или смесь кобальта и марганца.
Что касается получения этой сырой реакционной смеси, можно сослаться на способы, описанные в уровне техники, особенно в американской заявке на патент 2223493. Так начальное массовое отношение циклогексан/карбоновая кислота может находиться, например, между 0,1/1 и 10/1, предпочтительно между 0,2/1 и 4/1. Катализатор содержит предпочтительно соединение кобальта, растворимое в реакционной среде, выбираемое, например, среди карбоксилатов кобальта (как четырехводный ацетат кобальта), хлорида кобальта, бромида кобальта, нитрата кобальта и/или растворимое соединение марганца, выбираемое, например, среди карбоксилатов марганца (как ацетат марганца), хлорида марганца, бромида марганца, нитрата марганца.
Количество катализатора, выраженное в массовом процентном содержании кобальта и/или марганца по отношению к реакционной смеси, находится, обычно, между 0,01% и 5%, предпочтительно, между 0,05% и 2%, без того, чтобы эти величины были критическими. Между тем, речь идет о том, чтобы иметь достаточную активность, не используя слишком значительных количеств катализатора, который затем надо выделять из конечной реакционной смеси и возвращать в цикл.
Помимо кобальта и марганца катализатор может, равным образом, содержать другие соединения на основе металлов, таких как никель, и/или железо, и/или медь, и/или церий, и/или ванадий, и/или гафний, и/или цирконий.
Благоприятно использовать также соединение, инициирующее реакцию окисления, такое как, например, кетон или альдегид.
Циклогексанон, который является промежуточным реакционноспособным продуктом, указывается совершенно особо. Обычно, инициатор составляет от 0,01 до 20 мас. % от массы используемой реакционной смеси, без того, чтобы эти количества имели критическую величину. Инициатор всегда используют при запуске окисления и когда осуществляют окисление циклогексана при температуре ниже 120oС. Он может быть введен с момента начала реакции.
Карбоновая кислота, используемая предпочтительно в качестве растворителя в реакции окисления циклогексана, представляет собой, более конкретно, насыщенную алифатическую карбоновую кислоту, содержащую от 2 до 9 атомов углерода и содержащую только первичные или вторичные атомы водорода.
В качестве растворителя реакции окисления циклогексана предпочтительно используют уксусную кислоту. В настоящем описании для удобства иногда будут ссылаться на уксусную кислоту, как на карбоновую кислоту, используемую на различных стадиях способа.
Окисление может быть также осуществлено в присутствии воды, вводимой, начиная с начальной стадии способа.
Реакцию окисления циклогексана обычно осуществляют при температуре от 60oС до 180oС, предпочтительно от 70oС до 120oС.
Давление не является критическим параметром реакции и находится обычно между 10 кПа (0,1 бар) и 10000 кПа (100 бар).
Пример, следующий ниже, иллюстрирует изобретение.
Пример 1
В автоклав объемом 1,5 литра с титановой рубашкой, снабженный шестилопастной турбиной и различными отверстиями для введения реагентов и жидкостей или для извлечения продуктов реакции и жидкостей, предварительно продутый азотом, при комнатной температуре загружают:
Четырехводный ацетат кобальта - 4,0 г (16 ммоль)
Уксусная кислота - 359 г (5,98 моль)
Циклогексан - 289,7 г (3,45 моль)
Циклогексанон - 3,2 г (32,7 ммоль).
После закрытия автоклава давление азота поднимают до 20 бар, начинают перемешивание со скоростью 1000 оборотов/ минуту и за 20 минут доводят температуру до 105oС. Тогда азот заменяют обедненным (5% кислорода) воздухом под давлением 20 бар. Расход газа на входе устанавливают 250 литров/час.
После индукционного периода продолжительностью около 10 минут, во время которого не происходит потребления кислорода, температура поднимается на 2-3oС и кислород начинает потребляться. Содержание кислорода в воздухе на входе в автоклав постепенно доводят до 21% в зависимости от потребления кислорода в процессе окисления.
Содержание кислорода на выходе из реактора остается ниже 5% в течение всего опыта. Температура в автоклаве колеблется между 104,9 и 105,1oС.
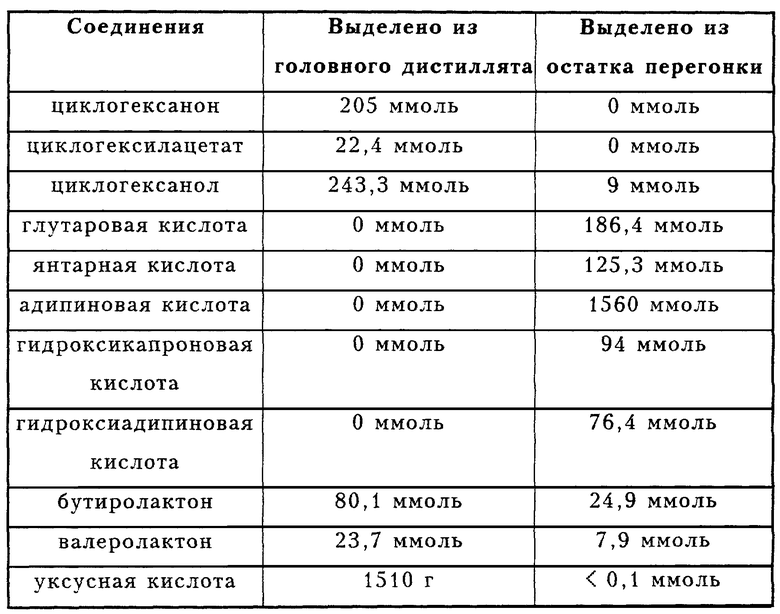
После того, как было потреблено 50 литров кислорода (степень превращения циклогексана около 20%), начинают непрерывно инжектировать жидкую фазу: инжекция раствора уксусной кислоты, содержащего 1,1 мас. % четырехводного ацетата кобальта, с производительностью 3,7 мл/мин и инжекция циклогексана с производительностью 4,1 мл/мин. Жидкий продукт непрерывно накапливают в отстойнике объемом 7 литров при 70oС. По истечении 400 минут с момента начала реакции воздух постепенно заменяют азотом, содержимое автоклава переносят в отстойник. Содержимое отстойника представляет собой двухфазную смесь. Верхнюю фазу, по существу, циклогексановую, которая содержит мало продуктов и кобальта, отделяют. Нижняя уксусная фаза (2164 г) содержит основное количество продуктов окисления и кобальт. Уксусную фазу подвергают перегонке в следующих условиях:
Давление - 45 кПа, затем 30 кПа
Температура - 135oС
Получают результаты, собранные в таблице.
Дистиллят составляет 1860 г и остаток перегонки приблизительно 300 г.
К остатку перегонки добавляют 1000 г воды. Все вместе нагревают до 85oС, затем постепенно охлаждают до комнатной температуры.
После фильтрования и промывки водой получают 205 г необогащенной адипиновой кислоты, имеющей среднюю гранулометрию 300 мкм и содержащей (в% масса на массу):
Янтарная кислота - 0,1850%
Глутаровая кислота - 0,0020%
Кобальт - 0,0080%
Вода - 7%
Перекристаллизация в воде этой необогащенной адипиновой кислоты приводит к адипиновой кислоте, имеющей среднюю гранулометрию 300 мкм и содержащей (в % масса на массу):
Янтарная кислота - 0,0002%
Глутаровая кислота - <0,0001%
Кобальт - <0,0001%
Вода - 7%
Катализатор на основе кобальта находится в кристаллизационных водах.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ АЛИФАТИЧЕСКИХ ДИКИСЛОТ, В ЧАСТНОСТИ АДИПИНОВОЙ КИСЛОТЫ | 1997 |
|
RU2186054C2 |
| СПОСОБ РЕЦИРКУЛЯЦИИ КАТАЛИЗАТОРА В ПРОЦЕССАХ ПРЯМОГО ОКИСЛЕНИЯ ЦИКЛОГЕКСАНА ДО АДИПИНОВОЙ КИСЛОТЫ | 1995 |
|
RU2146240C1 |
| СПОСОБ ВЫДЕЛЕНИЯ КАТАЛИЗАТОРА НА ОСНОВЕ ПАЛЛАДИЯ | 1996 |
|
RU2163509C2 |
| СПОСОБ ОКСИКАРБОНИЛИРОВАНИЯ БУТАДИЕНА | 1996 |
|
RU2178406C2 |
| СПОСОБ ОТДЕЛЕНИЯ КАТАЛИЗАТОРА МЕТОДОМ МЕМБРАННОГО ЭЛЕКТРОДИАЛИЗА | 1997 |
|
RU2181303C2 |
| СПОСОБ ОКИСЛЕНИЯ УГЛЕВОДОРОДОВ | 1998 |
|
RU2210562C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЛАКТАМА | 1996 |
|
RU2167860C2 |
| СПОСОБ ЭЛЕКТРОХИМИЧЕСКОГО ПОЛУЧЕНИЯ КАТАЛИЗАТОРОВ | 1995 |
|
RU2154529C2 |
| СПОСОБ ОЧИСТКИ АДИПИНОВОЙ КИСЛОТЫ ПУТЕМ ПЕРЕКРИСТАЛЛИЗАЦИИ | 1997 |
|
RU2178407C2 |
| СПОСОБ ГИДРОКСИКАРБОНИЛИРОВАНИЯ ПЕНТЕНОВЫХ КИСЛОТ | 1997 |
|
RU2177936C2 |
Изобретение относится к обработке реакционных смесей, образующихся при окислении циклогексана в адипиновую кислоту. Окисление циклогексана в адипиновую кислоту ведут кислородом воздуха в органическом растворителе и в присутствии катализатора, образующуюся реакционную смесь после декантации водной фазы подвергают перегонке с отделением дистиллята, содержащего, по меньшей мере, часть наиболее летучих соединений, таких как непрореагировавший циклогексан, растворитель, циклогексанон, циклогексанол, сложные циклогексиловые эфиры, лактоны, вода, и остатка перегонки, содержащего образовавшиеся дикислоты, катализатор. Затем к остатку перегонки добавляют воду для получения водного раствора, проводят экстракцию органическим растворителем и ведут кристаллизацию адипиновой кислоты из водного раствора остатка перегонки. Технический результат - возможность осуществлять кристаллизацию адипиновой кислоты из водного раствора, что значительно упрощает процесс и улучшает экономические показатели. 12 з. п. ф-лы, 1 табл.
| Экономайзер | 0 |
|
SU94A1 |
| Способ переработки отходов производства адипиновой кислоты | 1982 |
|
SU1086718A1 |
| СПОСОБ ПОЛУЧЕНИЯ АДИПИНОВОЙ КИСЛОТЫ | 0 |
|
SU366182A1 |
| УСТРОЙСТВО ДЛЯ ПОДБОРКИ СЕЙСМИЧЕСКИХ КОС | 1993 |
|
RU2054701C1 |
Авторы
Даты
2002-01-10—Публикация
1997-12-11—Подача