Данная заявка является частичным продолжением находящихся в одновременном рассмотрении заявок США N 411238, поданной 27 марта 1995 г. и N 442035, поданной 15 мая 1995 г.
Предпосылки создания изобретения
1. Область техники, к которой относится изобретение
Данное изобретение относится к сухой индикаторной полоске для измерения концентрации анализируемого вещества в жидкости биологического происхождения и, более конкретно - к индикаторной полоске, которая измеряет концентрацию непосредственно, без необходимости в измерительном приборе.
2. Описание предшествующего уровня техники
Разработано много аналитических устройств с визуальным контролем для измерения концентрации определенных анализируемых веществ в жидкостях биологического происхождения. Эти устройства измеряли, например, содержание глюкозы, холестерина, белков, кетонов, фенилаланина или ферментов в крови, моче или слюне.
Индикаторные полоски с сухой фазой, включающие в себя композиции на основе ферментов, широко используются в клинических лабораториях, врачебных кабинетах, больницах и домах для анализа проб жидкостей биологического происхождения на концентрацию глюкозы. В действительности, индикаторные полоски стали каждодневной необходимостью для многих из нескольких миллионов диабетиков нации, так как диабет может вызвать опасные аномалии в химии крови, он может вносить вклад в потерю зрения, почечную недостаточность и иметь другие серьезные медицинские последствия. Для того чтобы свести к минимуму риск этих последствий, большинство диабетиков должно периодически проверять себя, а затем соответственно регулировать концентрацию глюкозы, например путем диетического контроля и/или с помощью инъекций инсулина. Некоторые пациенты должны определять концентрацию глюкозы в своей крови даже четыре раза в день или более.
Иметь быстродействующие, недорогие и точные индикаторные полоски для определения глюкозы особенно важно для диабетиков, которые должны контролировать свой рацион для того, чтобы регулировать поступление сахара и/или вводить инъекции инсулина, и которые должны в этом отношении руководствоваться частыми проверками концентрации глюкозы в крови.
Известны индикаторные полоски, которые содержат индикатор, проявляющий различный оттенок цвета, зависящий от концентрации глюкозы в жидкости биологического происхождения, нанесенной на полоску. Хотя в некоторых из этих полосок используют восстановление, более часто они включают окисляемый краситель или пару красителей. Некоторые из полосок включают фермент, например глюкозооксидазу, которая способна окислять глюкозу в глюконовую кислоту и перекись водорода. Они также содержат окисляемый краситель и вещество, обладающее пероксилительной активностью, которое способно избирательно катализировать окисление окисляемого красителя в присутствии перекиси водорода, (см. например патент США N 5306623, выданный 26 апреля 1994 г. Кизеру (Kiser) и др.
В патенте США N 3964871, выданном 22 июня 1976 г. Хохштрассеру (Hochstrasser), описана одноразовая индикаторная полоска для непосредственного измерения таких веществ, как глюкоза, в жидкостях биологического происхождения. Индикатор регистрирует концентрацию вещества посредством того, что он включает как индикаторный реактив, который окисляется и изменяет цвет при его реакции с веществом, так и "антагонист", который неким образом предотвращает накопление окисленного индикатора до тех пор, пока он не будет полностью израсходован.
В публикации Европейской патентной заявки N 0317070, опубликованной 24 мая 1989 г. , Пальмер (Palmer) и др. описывают "цифровую" систему количественного анализа на глюкозу и другие анализируемые вещества (см. также патент США N 5036000 от 30 июля 1991 г. ). Эта система измеряет концентрацию органического соединения в жидкости биологического происхождения путем первоначального окисления соединения ферментом - специфичной к субстрату оксидазой - с получением перекиси водорода. Система включает хромоген, который является восстановителем перекиси водорода, и стабильный на воздухе восстановитель перекиси водорода, который имеет большой восстановительный потенциал. Больший восстановительный потенциал вызывает задержку какого-либо обнаружимого изменения цвета хромогеном до тех пор, пока не будет израсходован устойчивый на воздухе первый восстановитель перекиси водорода. Таким образом, не происходит изменения цвета, если измеряемой перекиси водорода меньше, чем предварительно определенное ее содержание, соответствующее концентрации устойчивого на воздухе восстановителя перекиси водорода. В результате система количественно измеряет концентрацию вне зависимости от величины изменения цвета.
В патенте США N 4738823 от 19 апреля 1988 г. Энгльманн (Englemann) описывает индикаторную полоску для определения анализируемых веществ, которая имеет деталь в виде подложки с абсорбирующим материалом, расположенным для того, чтобы удалить избыточную пробу, нанесенную на полоску. Полоска также может включать покрытие, которое имеет отверстие, через которое можно ввести пробу.
В патенте США N 4810470 от 7 марта 1989 г. Буркхардт (Burkhardt) и др. описывают устройство для измерения концентраций анализируемых веществ в жидких пробах. Устройство включает одну или несколько гигроскопичных основ, покрытых не проницаемым для жидкостей покрытием или пленкой. Пробу наносят на часть гигроскопичной основы, и она отмеривается в основу хроматографически. Под действием всасывания проба перемещается к аналитическому участку, который содержит аналитический реактив для анализируемого вещества.
В патенте США N 4994238 от 19 февраля 1991 г. Дафферн (Daffern) и др. описывают устройство для химического анализа, которое содержит слой абсорбента, водонепроницаемый барьерный слой и слой реактива, который имеет заданный объем. Пробу наносят на слой реактива через установленные в линию отверстия в лежащий над ним слой абсорбента и барьерный слой.
Точность и воспроизводимость определения глюкозы крайне важны, проводится ли анализ дома, в кабинете врача, клинике или больнице. В случае индикаторной полоски с цветовой индикацией желательно, чтобы изменение цвета было значительным и нечувствительным к вариациям компонентов жидкости биологического происхождения, отличных от глюкозы. В случае индикаторной полоски с визуальным отсчетом особенно важно, чтобы диабетики, которые могут иметь ухудшенное зрение, обладали полоской, проявляющей значительное изменение цвета, зависящее от концентрации глюкозы, хотя для точности полосок с отсчетом с помощью измерительного прибора также важно изменение цвета, проявляющееся посредством изменения оптической плотности при данной длине волны.
Поскольку изменение цвета включает ряд химических реакций, оно не происходит мгновенно. Таким образом, пользователь должен подождать определенный промежуток времени - обычно минуту или меньше - чтобы прошли реакции. Когда измерительное устройство делает отсчет с полоски, цепь таймера может подать сигнал, который указывает, что реакция завершилась. Однако, когда отсчет с полоски делают визуально, без измерительного устройства, пользователь может недооценить требуемое время, снять отсчет с полоски преждевременно и получить неверный результат. В альтернативном случае пользователь может чувствовать необходимость выждать в течение излишнего времени перед снятием показаний с полоски, чтобы быть уверенным в завершении реакции, что приводит к лишний задержке и неудовлетворенности пользователя. Таким образом, есть необходимость в "химическом" таймере, то есть в элементе на полоске, который изменит цвет независимо от концентрации глюкозы (или иного представляющего интерес анализируемого вещества) в пробе, однако сделает это только после того, как прошло время, достаточное для завершения образующих цвет реакций в пробе.
Краткое изложение сущности изобретения
В соответствии с настоящим изобретением вытянутая многослойная индикаторная полоска для измерения концентрации анализируемого вещества в пробе жидкости биологического происхождения, которую наносят на полоску, содержит:
а) нижний слой со сквозным отверстием для приема пробы;
б) мембранный слой, имеющий сторону пробы, обращенную к нижнему слою, и аналитическую сторону, противоположную ей и содержащую реактив, который может входить в реакцию с анализируемым веществом, обеспечивая изменение цвета, включающий:
i) первый компонент, который взаимодействует с анализируемым веществом с образованием перекиси водорода;
ii) второй компонент, который взаимодействует с перекисью водорода и претерпевает изменение в цвете; и
iii) третий компонент, который ингибирует изменение в цвете второго компонента;
в) промежуточный слой между нижним и мембранным слоями; и
г) средство отмеривания для распределения пробы вдоль полоски, причем средство отмеривания содержит:
i) негигроскопичный участок в мембранном слое; и
ii) канал для транспортировки жидкости, образованный в промежуточном слое для направления пробы по поверхности негигроскопичного участка к множеству дискретных гигроскопичных аналитических зон, упорядоченных вдоль длины мембранного слоя;
причем концентрация ингибитора увеличивается заданным образом с расстоянием от первого конца полоски так, что для осуществления изменения цвета в пробе должна содержаться соответствующим образом увеличивающаяся концентрация анализируемого вещества, посредством чего при нанесении пробы на полоску могут изменить цвет одна или несколько аналитических зон, и зона изменения цвета, наиболее отдаленная от первого конца, указывает на концентрацию анализируемого вещества в пробе.
При работе способ измерения концентрации анализируемого вещества в пробе жидкости биологического происхождения включает стадии:
(а) нанесения пробы на индикаторную полоску, которая содержит:
(i) множество гигроскопичных аналитических зон, причем каждая из них изменяет цвет при контакте с жидкостью, содержащей по меньшей мере заданное количество анализируемого вещества, большее, чем количество анализируемого вещества, которое вызывает изменение в цвете аналитических зон, расположенных ближе к первому концу полоски, и
(ii) средство отмеривания для распределения образца вдоль заданной негигроскопичной дорожки к каждой из аналитических зон и
(б) обнаружение аналитической зоны, которая изменяет цвет и наиболее удалена от первого конца полоски.
Тип полоски таков, что обеспечивается видимая индикация концентрации анализируемого вещества, которое содержится в жидкости биологического происхождения, нанесенной на "сторону пробы" полоски. Видимая индикация появляется на противоположной (или "аналитической") стороне полоски.
Конечно, химический состав индикаторной полоски зависит от анализируемого вещества/жидкости биологического происхождения, для которых должны быть проведены измерения. Индикаторные полоски могут быть разработаны для того, чтобы обнаруживать такие анализируемые вещества, как глюкоза или другие сахара, спирт, холестерин, белки, кетоны, мочевая кислота, фенилаланин или ферменты, в таких жидкостях биологического происхождения, как кровь, моча и слюна, а также в воде. Для удобства и краткости индикаторные полоски, описанные наиболее подробно в данном описании, обнаруживают глюкозу в крови. Обычный специалист мог бы легко адаптировать информацию из данного описания для обнаружения в иных комбинациях анализируемое вещество/жидкость биологического происхождения.
Индикаторная полоска по настоящему изобретению обеспечивает относительно простое и быстрое определение концентрации глюкозы в неотмеренном образце крови. Полоска содержит нижний слой с отверстием, через которое пробу можно ввести на сторону пробы пористой основы, противоположной стороной которой является аналитическая сторона. Основа обычно является мембраной, и эти два термина попеременно используются в настоящем описании и в прилагаемой формуле изобретения. На основу наносят реактив анализа, и он в большей или меньшей степени пропитывается через поры основы. Для простоты в данном описании и в прилагаемой формуле изобретения иногда называют реактив на основе "покрытием", осознавая при этом то, что покрытие из реактива проникает в основу.
Между нижним слоем и основой лежит промежуточный слой. Вырезы в промежуточном слое совмещены с негигроскопичными зонами мембраны, чтобы направить пробу в ряд гигроскопичных аналитических зон, расположенных в линию вдоль полоски. (В данном описании и прилагаемой формуле изобретения "гигроскопичный" понимается как абсорбирующий). Ряд вдавлений в промежуточном слое окружает пространство вокруг аналитических зон и над ними, чтобы ограничить поток пробы в эти зоны.
Таким образом, фиксируемый объем пробы - обычно цельной крови, содержащей эритроциты и глюкозу - направляется на сторону пробы мембраны в каждую аналитическую зону из их ряда. Нижний слой предпочтительно имеет выпускные отверстия, совмещенные с зонами, чтобы облегчить равномерное заполнение объемов. Пористость основы позволяет жидкости пройти от стороны пробы к аналитической стороне, например, путем капиллярного действия. Таким образом аналитический реактив может реагировать с глюкозой в крови, чтобы вызвать изменение цвета на аналитической стороне или рядом с ней. Так как сильно окрашенные эритроциты могут затруднить обнаружение изменения цвета, основа предпочтительно является анизотропной, с размерами пор, постепенно изменяющимися от больших пор на стороне пробы, до меньших пор на аналитической стороне, для того, чтобы путем захвата отделить эритроциты от аналитической стороны. Для различных компонентов индикаторной полоски и таймера по данному изобретению можно использовать множество материалов. Некоторые из этих материалов описаны в патентах США 5306623 и 5418142, выданных соответственно 26 апреля 1994 г. и 23 мая 1995 г. Кизеру и др. и включенных сюда как ссылки.
Аналитический реактив содержит компонент для превращения глюкозы в перекись водорода, такой как глюкозооксидаза, один или несколько компонентов для обнаружения перекиси водорода, полученной из присутствующей в пробе глюкозы; и ингибитор. Компонентами для обнаружения перекиси водорода могут быть пероксидаза, предпочтительно пероксидаза из хрена, вместе с "индикатором", который изменяет цвет во время реакции. Индикатор может быть окисляемым красителем или парой красителей. Пероксидаза катализирует окисление индикатора в присутствии перекиси водорода. Последним элементом реактива является ингибитор, который замедляет изменяющее цвет окисление индикатора.
Полоска вдоль своей длины разделена на сегменты таким образом, что прилегающие сегменты мембраны имеют различные концентрации ингибитора. Каждый сегмент имеет гигроскопичную аналитическую зону, которая изменяет цвет только если и когда присутствует достаточное количество глюкозы, чтобы вначале привести к расходу всего ингибитора, а затем окислить индикатор и посредством этого вызвать характерное изменение цвета. Таким образом, изменение цвета в конкретной зоне свидетельствует о пороговой концентрации глюкозы в исходной пробе крови. В конкретном направлении вдоль полоски каждый последующий сегмент имеет на одну ступень большую концентрацию ингибитору, которая соответствует ступенчатому увеличению пороговой концентрации глюкозы. Концентрация индикатора одинакова для всех сегментов. В принципе, также возможны другие изменяющиеся балансы ингибитор/индикатор.
Если сегменты имеют концентрации ингибитора в надлежащем диапазоне для конкретной анализируемой пробы, прилегающие аналитические зоны реагируют с анализируемым веществом таким образом, что одна зона окрашена, а прилегающая - нет. Этот результат указывает на то, что концентрация глюкозы в пробе по меньшей мере равна пороговой концентрации, необходимой для того, чтобы изменить цвет одной зоны, но не так велика, как требуется для изменения цвета прилегающей зоны.
Для контроля глюкозы в крови необязательное таймерное сегментное покрытие содержит элементы индикаторной полоски - пористую основу с покрывающим ее аналитическим реактивом и, кроме того, глюкозу. В сухом состоянии химия реактива не активируется глюкозой, когда пробу нанесли на полоску, таймерное покрытие гидратируется, и через заданное время глюкоза в покрытии приводит к тому, что индикатор изменяет цвет. Предпочтительно, чтобы глюкоза присутствовала в таймере в количестве, значительно превышающем количество, требуемое для преодоления ингибитора. В этом случае требуется большее или меньшее время в зависимости от большего или меньшего количества присутствующего ингибитора. Изменения цвета в полоске и в таймере можно наблюдать либо непосредственно визуально, либо с помощью оптического инструмента, который обнаруживает изменения в коэффициенте отражения.
Краткое описание чертежей
Фиг. 1 представляет собой перспективное изображение основы индикаторной полоски с непосредственным отсчетом по настоящему изобретению.
Фиг. 2 представляет собой горизонтальный вид снизу с разрезом стороны пробы индикаторной полоски с непосредственным отсчетом по настоящему изобретению.
Фиг. 3 представляет собой увеличенное частное перспективное изображение внутренности индикаторной полоски по фиг. 2 с частичным разрезом.
Фиг. 4 представляет собой поперечное сечение полоски по фиг. 2 вдоль линии 4-4.
Фиг. 5 представляет собой горизонтальный вид снизу индикаторной полоски по данному изобретению.
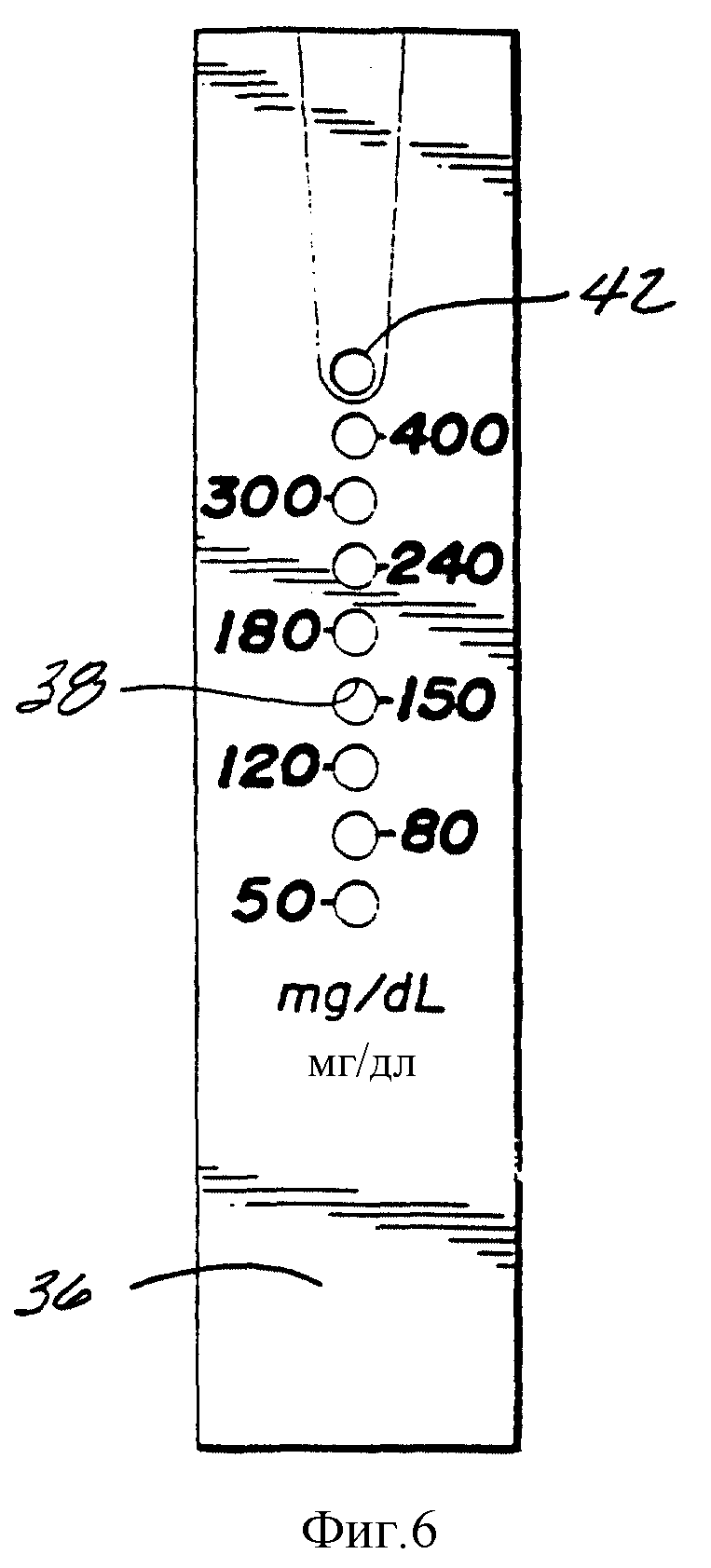
Фиг. 6 представляет собой горизонтальный вид сверху, изображающий аналитическую сторону индикаторной полоски по фиг. 5.
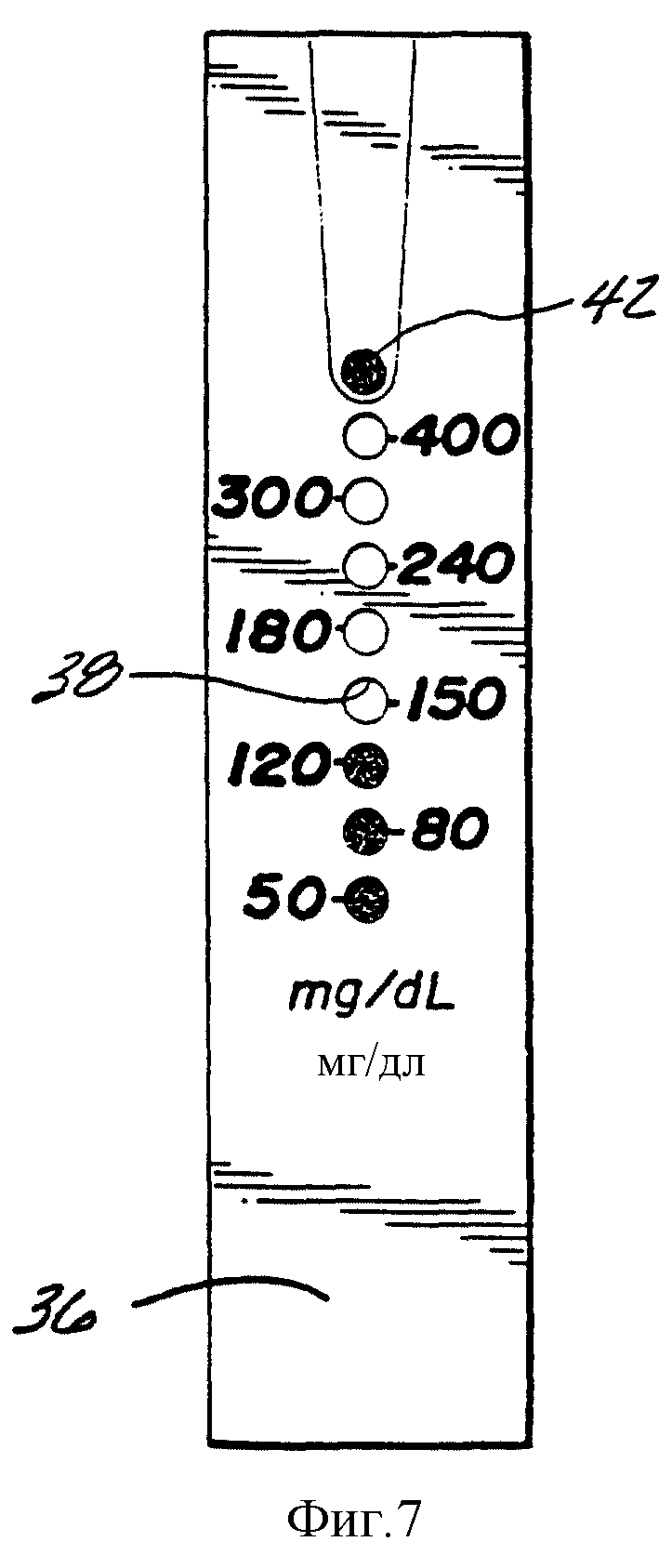
Фиг. 7 представляет собой полоску по фиг. 6 после того, как на нее нанесли пробу.
Подробное описание изобретения
Предметом настоящего изобретения является индикаторная полоска с непосредственным отсчетом для измерения концентрации анализируемого вещества в жидкости биологического происхождения. Ключевым элементом такой индикаторной полоски является пористая основа, включающая внутри себя аналитический реактив, который изменяет цвет в ответ на анализируемое вещество в пробе жидкости биологического происхождения, которую наносят на полоску.
Основа может быть однородной композицией или может быть покрыта подложкой, и она может быть как изотропной, так и анизотропной. Она имеет сторону пробы, на которую наносят пробу, и аналитическую сторону, где наблюдают изменение цвета. Основа предпочтительно является анизотропной мембраной; а более предпочтительно - анизотропной мембраной, имеющей широкий диапазон размеров пор. Например, через мембрану может распространяться градиент размеров пор от примерно 0.1 микрометра до примерно 150 микрометров. Со стороны с большими порами размер пор предпочтительно находится в диапазоне от примерно 30 микрометров до примерно 40 микрометров. С той стороны мембраны, где размер пор самый маленький, объем пустот относительно мал и материал мембраны, как правило, является довольно плотным внутри слоя, который обычно может составлять до 20% от толщины мембраны. Внутри этого слоя размер пор предпочтительно находится в диапазоне от примерно 0.1 микрометра до примерно 0.8 микрометров, с номинальным размером пор предпочтительно около 0.3 микрометра. Когда жидкость биологического происхождения наносят на сторону пробы, на пути пробы встречаются все меньшие и меньшие поры по мере того, как она проникает в мембрану. Наконец, твердые вещества, такие как эритроциты, достигают такого положения в мембране, где они не могут проникать дальше. Остальная проба, все еще содержащая растворенную глюкозу, проникает насквозь к аналитической стороне. Анизотропная природа мембраны и/или применение разделяющего компонента (обсуждаемого ниже) позволяет добиться относительно быстрых скоростей потока через мембрану, даже когда происходит фильтрование твердых веществ.
Когда проба проходит через основу, реакция с реактивом вызывает образование или разложение поглощающего свет красителя в объеме полостей около аналитической стороны, существенно влияя таким образом на коэффициент отражения от основы.
Примерами подходящих материалов основы являются полисульфоны и полиамиды (найлоны). Также можно использовать другие полимеры, имеющие сравнимые свойства. Полимеры можно модифицировать для введения других функциональных групп, которые обеспечивают заряженные структуры, так что поверхности основы могут быть нейтральными, положительными или отрицательными.
Предпочтительный способ изготовления пористого материала, который образует основу, заключается в том, чтобы отлить полимер без поддерживающего каркаса. Такой основой является, например, анизотропная полисульфоновая мембрана, доступная от Memtec, Inc, Timonium, MD. Обычно используют основу толщиной менее примерно 200 микрометров, причем предпочтительно с толщиной от примерно 115 до 155 микрометров. Наиболее предпочтительна толщина от примерно 130 до 140 микрометров, особенно когда основа является найлоном или анизотропным полисульфоном.
Мембрану можно обработать аналитическим реактивом путем погружения ее в смесь компонентов, насыщая таким образом мембрану. Предпочтительно наносить на мембрану последовательно по меньшей мере некоторые из компонентов. Излишний реактив может быть удален механическими средствами, например воздушным ножом, ракелем или стеклянной палочкой. После этого мембрану сушат. Реактив стремится концентрироваться около стороны мембраны с малыми порами (аналитической).
Аналитический реактив содержит (i) компонент для превращения глюкозы в перекись водорода, (ii) компонент для обнаружения перекиси водорода и (iii) компонент для ингибирования компонента, который обнаруживает перекись водорода. Кроме того, реактив может необязательно содержать разделяющий компонент, который вызывает захват твердых веществ, таких как эритроциты, в основе, эффективно удаляя твердые вещества из жидкости биологического происхождения. Также можно включить дополнительные компоненты, как описано ниже и в примерах. Предпочтительные компоненты для превращения глюкозы в перекись водорода включают глюкозооксидазу. Фермент, который обычно получают из Aspergillus niger или Penicillium. Глюкозооксидаза реагирует с глюкозой и кислородом с образованием глюконолактона и перекиси водорода. Оптимальная концентрация глюкозооксидазы зависит от состава индикаторной системы. Например, если индикаторной системой является МБТГСБС-АНС (которая описана ниже), тогда подходит глюкозооксидаза в диапазоне от примерно 500 - 10000 ед. /мл, более предпочтительно от примерно 700 - 2000 ед. /мл, и наиболее предпочтительно около 1000 ед. /мл. Как правило, более высокие концентрации глюкозооксидазы приводят к тому, что реакция протекает более быстро, а более низкие концентрации - к менее быстрой реакции.
Полученная таким образом перекись водорода реагирует с компонентом для определения перекиси водорода, который включает пероксидазу, селективно катализирующую реакцию между перекисью водорода и индикатором. Пероксидаза использует перекись водорода как окислитель, который способен удалять атомы водорода от различных субстратов. Подходящая пероксидаза может содержать феррипротопорфирин, красный гемин, получаемый из растений. Также пригодны пероксидазы, полученные из животных, например из щитовидных желез животных. В качестве составляющего для компонента для обнаружения перекиси водорода особенно предпочтительна пероксидаэа из хрена (ПХ).
Перекись водорода, предпочтительно катализируемая пероксидазой, либо прямо, либо опосредованно реагирует с образованием или разложением индикаторного красителя, который поглощает свет в заданном диапазоне длин волн. Предпочтительно, чтобы индикаторный краситель сильно поглощал при длине волны, отличной от длины волны, при которой сильно поглощает аналитический реактив. Окисленная форма индикатора может быть окрашенным, слегка окрашенным или бесцветным конечным продуктом, который дает изменение в цвете аналитической стороны основы. То есть аналитический реактив может указывать на присутствие анализируемого вещества в пробе посредством окрашенной зоны, которая обесцвечивается, или, альтернативно, посредством бесцветной зоны, которая приобретает цвет.
Индикаторы, пригодные в настоящем изобретении, включают
(а) гидрохлорид гидразона 3-метил-2-бензотиазолинона (МБТГ), объединенный с 3-диметиламинобензойной кислотой (ДМАБК);
(б) МБТГ, объединенный с 3,5-дихлор-2-гидроксибензолсульфоновой кислотой (ДХГБСК);
(в) 4-аминоантипирен (4-ААП) и 5-оксо-1-(п-сульфофенил)-2-пиразолин-3-карбоновую кислоту (ОПСФ);
(г) 4-ААП и N-(м-толил)-диэтаноламин (НДА);
(д) 2,2'-азино-ди(3-этилбензтиазолин)сульфоновую кислоту (АБТСК);
(е) 4-ААП и 4-метоксинафтол;
(ж) пирогаллоловый красный (ПГК);
(з) бромпирогаллоловый красный (БПГК);
(и) Кислый Зеленый 25 (КЗ) или
(к) мононатриевую [3-метил-2-бензотиазолинонгидразон] -N-сульфонилбензолсульфонатная соль (МБТГСБС), объединенную с аммонийной солью 8-анилино-1-нафталинсульфоновой кислоты (АНС).
Предпочтительным является МБТГСБС-АНС. Дополнительная информация, касающаяся МБТГСБС-АНС имеется в находящейся на одновременном рассмотрении патентной заявке США N 302575, поданной 8 сентября 1994 г. и включенной сюда как ссылка.
Ингибирующий компонент замедляет реакцию между перекисью водорода и индикатором, например, путем восстановления перекиси водорода или путем восстановления окисленного индикатора. В принципе, для ингибитора существует несколько различных режимов работы. Во-первых, ингибитор может конкурировать с индикатором и таким образом снижать скорость, с которой происходит изменение цвета в индикаторе. Во-вторых, ингибитор может быть неконкурирующим, так что по существу весь ингибитор расходуется перед тем, как происходит какое-либо существенное изменение цвета в индикаторе. Возможны также другие режимы работы индикатора. Предпочтительно, чтобы ингибиторы в данном изобретении были неконкурирующими.
К числу подходящих ингибиторов относятся 2,3,4-гидроксибензойная кислота, пропилгаллат, 3,4-дигидроксикоричная кислота, 3,4-дигидроксибензальдегид, галловая кислота, 5,6-диаминоурацил, аскорбиновая кислота и изоаскорбиновая кислота. Предпочтительна аскорбиновая кислота; однако аскорбиновая кислота окисляется в растворе и должна быть стабилизирована, чтобы позволить нанести покрытие реактива. Предпочтительными стабилизаторами являются первичные спирты, такие как этиловый, метиловый или пропиловый спирт. Предпочтителен этиловый спирт, в особенности концентрированные растворы, то есть растворы с 50% и более этанола.
Хотя анизотропная мембрана, которая является предпочтительной основой, отфильтровывает эритроциты и удерживает их отдельно от аналитической стороны, аналитический реактив может также необязательно содержать разделяющий компонент. Разделяющий компонент должен быть способным получать из содержащей эритроциты жидкости, например цельной крови, относительно прозрачную бесцветную жидкость путем изоляции эритроцитов в основе. Разделяющие компоненты для применения в настоящем изобретении включают полиэтиленгликоль, поли(метилвиниловый эфир/малеиновый)ангидрид, полипропиленгликоль, полистиролсульфоновую кислоту, полиакриловую кислоту, поливиниловый спирт и поливинилсульфоновую кислоту при pH примерно между 4.0-8.0, но не ограничены ими. Такие разделяющие компоненты присутствуют в основе в количествах, которые будут изменяться в зависимости от их заряда и молекулярного веса, других компонентов, помещенных в основу, pH и размера пор основы, а также от оставшейся влаги в основе после сушки. Специалист может легко определить эти параметры. Например, когда в качестве разделяющего компонента используют полипропиленгликоль (например PPG-410 от BASF Wyandotta, MI), он предпочтительно присутствует в количестве примерно 2-30% по отношению веса к объему (в/о), а более предпочтительно - 8-10% в/о. Другие разделяющие компоненты можно также использовать в концентрации около 2-30% в/о. Полимерные разделяющие компоненты можно пропитать, или залить в основу, или отлить в мембране во время производства.
Некоторые водорастворимые соли также могут вызвать разделение крови. К числу солей, пригодных для разделения компонентов крови, относятся цитраты, формиаты и сульфаты, а также определенные кислоты, такие как аминокислоты, лимонная кислота, фитиновая кислота и яблочная кислота (см. , например, патент США 3552928, выданный 5 января 1971 г. М. К. Феттеру (M. C. Fetter)). Преимущество включения разделяющего компонента заключается в том, что при существенном удалении твердых веществ, таких как эритроциты, из жидкости биологического происхождения, на аналитической стороне меньше фонового цвета, который скрывает изменение в окрашивании, вызванное аналитическим реактивом.
В основу можно вводить другие компоненты, чтобы усилить окрашивание и считываемость индикаторных полосок и сохранить однородность и целостность основы. Например, аналитический реактив может включать соли и/или буферы, чтобы способствовать отделению красителя в основе. Такие буферы могут содержать, например, цитрат, присутствующий е растворе от примерно 0.01М до примерно 1.0М и предпочтительно около 0.1М. Можно использовать также другие буферы.
Также можно использовать соединения, которые делают основу гидрофильной, или соединения, которые могут действовать как стабилизаторы, такие как гидролизованные белки. Такие соединения включают, например, бычий сывороточный альбумин, полипептиды и низкомолекулярный белок, доступный как Кротеин SPA (Crotein SPA) (КРОДА, Инк. , Нью Йорк, Н. Й. (CRODA, Inc. New York, N. Y. )), но не ограничены ими. Такие соединения используют, например, при концентрациях от около 1 мг/мл до около 100 мг/мл. В случае Кротеина предпочтительна концентрация около 30 мг/мл.
В покрытие для основы также можно ввести другие стабилизаторы и консервирующие средства. Например, можно использовать этилендиаминтетрауксусную кислоту (ЭДТУК), диэтилентриаминлентауксусную кислоту (ДТПУК) и родственные соединения, например, в концентрациях от около 0.01 мг/мл до около 10 мг/мл. Одна из цепей консервирующих средств заключается в том, чтобы помочь стабилизировать ингибитор.
Некоторые индикаторы (например, БПГК) обладают нежелательной тенденцией мигрировать в основу. Когда используют такой индикатор, для предотвращения такой миграции включают вещество, способствующее образованию ионных пар. Например, особенно пригодны производные полиэтиленгликоля, доступные в продаже как Поликварт (H) (Polyquart (H)) (Henkel, Inc. , Ambler, PA), благодаря их способности облегчать образование ионных пар между индикатором и другими заместителями в основе.
Когда на присутствие анализируемого вещества указывает образование цвета (например, МБТГСБС-АНС), можно добавить поверхностно-активные вещества для того, чтобы сделать цвет ярче и увеличить контраст с неокрашенным окружающим пространством.
В практике данного изобретения также можно использовать органические растворители и их можно включить в рецептуру аналитического реактива для основы, конечно, если они совместимы с композициями основы и аналитического реактива. Потенциально пригодные органические растворители включают хлороформ, ацетон, спирты, хлористый метилен, диэтиловый и петролейный эфиры, ацетонитрилы и их смеси. В практике настоящего изобретения особенно предпочтителен 70% этанол в воде.
Аналитический реактив, которым покрыта основа или который импрегнирован в нее, неоднороден на поверхности индикаторной полоски. Вместо этого реактив предпочтительно наносят на основу в виде ряда параллельных полос или "сегментов", которые проходят через узкое направление полоски. В составе прилегающих сегментов концентрация ингибитора ступенчато увеличивается. Каждый сегмент имеет гигроскопичную аналитическую зону. Именно в аналитических зонах аналитический реактив реагирует с глюкозой в крови, вызывая изменения цвета, при условии, что концентрация глюкозы достаточно велика для того, чтобы превзойти содержание ингибитора в данной аналитической зоне. Таким образом, для каждой последующей аналитической зоны требуется ступенчато большая концентрация глюкозы в пробе, чтобы вызвать изменение цвета этой зоны.
Одна из аналитических зон необязательно приспособлена к тому, чтобы служить в роли таймера, для того чтобы указывать, что прошло достаточно времени для реакции реактива с глюкозой в каждой из аналитических зон. Таймерный сегмент основы покрыт или импрегнирован (пропитан) композицией, которая состоит из аналитического реактива и, кроме того, глюкозы. Так как цель аналитического реактива заключается в том, чтобы изменить цвет в ответ на глюкозу, соединение этих двух компонентов без того, чтобы вызвать изменение цвета, требует определенной осторожности. Для компенсации этого эффекта должно присутствовать большее количество ингибитора, чем требуемое для функции отсчета времени. Регулируют скорость, с которой сушат таймерный сегмент после того, как нанесен раствор, содержащий глюкозу. На практике мембрану вначале покрывают раствором, содержащим буферы, стабилизаторы и ферменты, а затем покрытие сушат для образования первого слоя. После этого на втором этапе покрытия наносят раствор, содержащий индикатор, ингибитор и глюкозу. Предварительно должны быть зафиксированы такие параметры, как скорость полотна, температура печи и воздушного потока, и количество наносимых покрывающих растворов, и нужно сделать надлежащие регулировки концентраций ингибитора и/или глюкозы. Вместо непосредственного нанесения второго покрытия альтернативный, менее предпочтительный процесс включает изготовление второго покрытия на отдельном полотне и последующее нанесение его на первый слой.
Когда пробу наносят на полоску, гидратация композиции таймерного сегмента позволяет протекать реакции с образованием цвета. Таким образом, время, нужное для измерения цвета таймерного сегмента, определяется температурой и характеристиками аналитического реактива, в частности концентрацией ингибитора, количеством глюкозы и скоростями гидратации и диффузии кислорода.
Можно сделать так, что время изменения цвета таймера зависит от концентрации глюкозы в пробе или, альтернативно, не зависит от этой концентрации. При введении большого избытка глюкозы в таймер это время по существу не зависит от концентрации глюкозы в пробе. Путем введения меньшего количества глюкозы в таймер можно сделать это время зависящим от глюкозы в пробе; то есть таймер изменит цвет скорее, если концентрация глюкозы в образце больше. Предпочтительно концентрация глюкозы в таймере выше примерно 1500 мг/дл, что делает таймер по существу не зависящим от концентрации глюкозы в пробе в диапазоне от примерно 40-400 мг/дл. Композиция таймерного сегмента включает избыточные количества компонента (такого как глюкозооксидаза), который превращает глюкозу в перекись водорода, и глюкозы. Следовательно, композиция таймера должна содержать по меньшей мере такое же или большее количество ингибитора, что и сегмент, показывающий результаты, который имеет наивысшую концентрацию ингибитора (что соответствует наибольшему показанию по глюкозе).
Таймер также выполняет важную функцию контроля качества путем очевидного указания, когда индикаторная полоска испорчена за счет воздействия влаги. Индикаторная полоска должна оставаться сухой вплоть до момента применения, поскольку компоненты, которые превращают глюкозу в перекись водорода (как правило ферменты), имеют тенденцию разрушаться под действием влаги. Таким образом, если полоску преждевременно подвергнуть воздействию влаги, она будет испорчена. Но порча индикаторной полоски не видна пользователю, который поэтому может использовать такую полоску и получить ошибочный результат. Однако, если полоска включает таймерный сегмент, воздействие влаги заставляет таймер изменить цвет, что предупреждает пользователя о том факте, что полоска испорчена и ее не следует использовать.
Кроме содержащей реактив основы полоска по настоящему изобретению включает нижний слой, который поддерживает основу. Нижний слой предпочтительно является термопластичным листом, более предпочтительно - полиэфиром и имеет отверстие, через которое проба может быть нанесена на сторону пробы основы. Из отверстия для пробы проба крови распределяется по длине основы. Если нижний слой является в основном непрозрачным, на надлежащем расстоянии от отверстия для пробы может быть расположено одно или несколько прозрачных секций-окошек, причем внешний вид пробы в окошке (окошках) подтверждает, что на полоску нанесена надлежащая проба.
При распределении крови от отверстия для пробы к аналитическим зонам используют промежуточный слой, который лежит между нижним слоем и мембраной и необязательно приклеен к ним обоим. Промежуточный слой предпочтительно является листом термопласта, более предпочтительно - полиэфиром. Он имеет вырезы, которые направляют пробу вниз по длине полоски вдоль негигроскопичных дорожек на мембране, которые направляют пробу в каждую из аналитических зон. Вдавливания в промежуточном слое совмещены с аналитическими зонами так, что каждая аналитическая зона по существу окружена стенками из промежуточного слоя.
Предпочтительная структура негигроскопичных дорожек на мембране образуется путем закрывания пористой структуры мембраны. Это можно осуществить путем нагрева, либо прямого, либо с применением лазера или ультразвука и предпочтительно с использованием давления. Однако предпочтительным способом является раздавливание. Таким образом, мембрану раздавливают, чтобы сделать ее негигроскопичной (но все еще гидрофильной) везде, кроме аналитических зон.
Для предпочтительных мембран по данному изобретению раздавливание предпочтительно осуществляют путем воздействия высокого давления - по меньшей мере 6 тонн/кв. дюйм (80000 кПа) и, необязательно, тепла (по меньшей мере 110oC) на зоны мембраны, которые нужно раздавить. Конечно, предпочтительные давления и температуры зависят от раздавливающего механизма и времени выдержки под давлением, а также от параметров мембраны. Оптимальные величины можно определить проведением рутинных экспериментов.
Для точных измерений важно, чтобы объем крови, обеспеченный в каждой аналитической зоне, был воспроизводимым. Если вдавливания полностью окружают аналитические зоны, тогда, предполагая не проницаемое для жидкости уплотнение между промежуточным слоем и как нижним слоем, так и раздавленной мембраной, каждую аналитическую зону можно ассоциировать с замкнутым (цилиндрическим) объемом, чьи стенки образованы промежуточным слоем, а концы образованы мембраной и нижним слоем. Однако распределительные каналы проходят вдоль полоски и подают пробу к каждой аналитической зоне. Высокая точность требует, чтобы распределительный канал обеспечивал постоянный объем пробы в каждой аналитической зоне, а затем не подавал ее больше по меньшей мере в рамках времени измерения - около 1 или 2 минут. Так как начальный объем пробы может изменяться, на каждом конце мембраны предпочтительно присутствие слоя абсорбента, чтобы уносить избыток пробы от концов распределительного канала. Слои абсорбента на концах канала также повышают впитывание пробы вдоль длины полоски. Предпочтительные слои абсорбента образованы неткаными тканями, хорошо известными на уровне техники.
Вызванное глюкозой изменение цвета в анализируемой пробе проявляется на аналитической стороне мембраны. Удобно покрыть эту сторону мембраны верхним слоем, который имеет отверстия, совмещенные с аналитическими зонами. Эти отверстия делают видимыми изменения в цвете, а также позволяют кислороду достичь мест реакции. Верхний слой может быть прикреплен к мембране, например, с помощью клея. Предпочтительно, чтобы клей был ограничен применением к негигроскопичным зонам мембраны, если он мешает реакциям измерения содержания глюкозы. Однако, если клей не мешает реакциям, его расположение менее важно.
Поскольку аналитические зоны медленно изменяют цвет при воздействии света или кислорода, когда они содержат предпочтительный реактив, и поскольку необязательный таймер чувствителен к влаге, полоски предпочтительно упаковывают в прозрачную оболочку, не проницаемую для кислорода и влаги, такую как запаянная пленочная обертка. Если полоски упаковывают раздельно, полоска во время применения может оставаться в обертке, открываемой путем отслаивания.
Далее изобретение будет дополнительно описано со ссылками на чертежи.
Фиг. 1 изображает основу 10 по настоящему изобретению для измерения количества анализируемого вещества в жидкости биологического происхождения. Хотя она и показана в согнутом положении, основа 10 является гибкой и, как правило, находится в плоскости при применении. Основа включает сторону пробы 12, на которую наносят пробу жидкости биологического происхождения, и аналитическую сторону 14, на которой или рядом с которой изменение в цвете указывает на присутствие анализируемого вещества. Изменение цвета происходит в результате взаимодействия анализируемого вещества с реактивом, внедренным в поры 16. Предпочтительно, чтобы для измерения концентрации глюкозы в крови размеры пор были относительно велики около стороны пробы 12 и уменьшались в размере по мере достижения аналитической стороны 14. Градиент размера пор служит для того, чтобы захватить эритроциты около стороны пробы 12 так, чтобы их цвет не мешал способности видеть изменение цвета, которое указывает на присутствие анализируемого вещества.
Схематически показаны три параллельных сегмента a, b и c. Каждый последующий сегмент имеет ступенчато большее количество ингибитора, чем предыдущий. В предпочтительном варианте воплощения изобретения после того, как реактив был нанесен на мембрану в параллельные сегменты, как показано, мембрану раздавливают везде, кроме аналитических зон, где происходят реакции анализируемое вещество - реактив. Такая картина гигроскопичных аналитических зон - единственная зона, расположенная в каждом из параллельных сегментов - и негигроскопичных раздавленных зон, показана на горизонтальном виде сверху на фиг. 2 и на увеличенном частном перспективном изображении на фиг. 3.
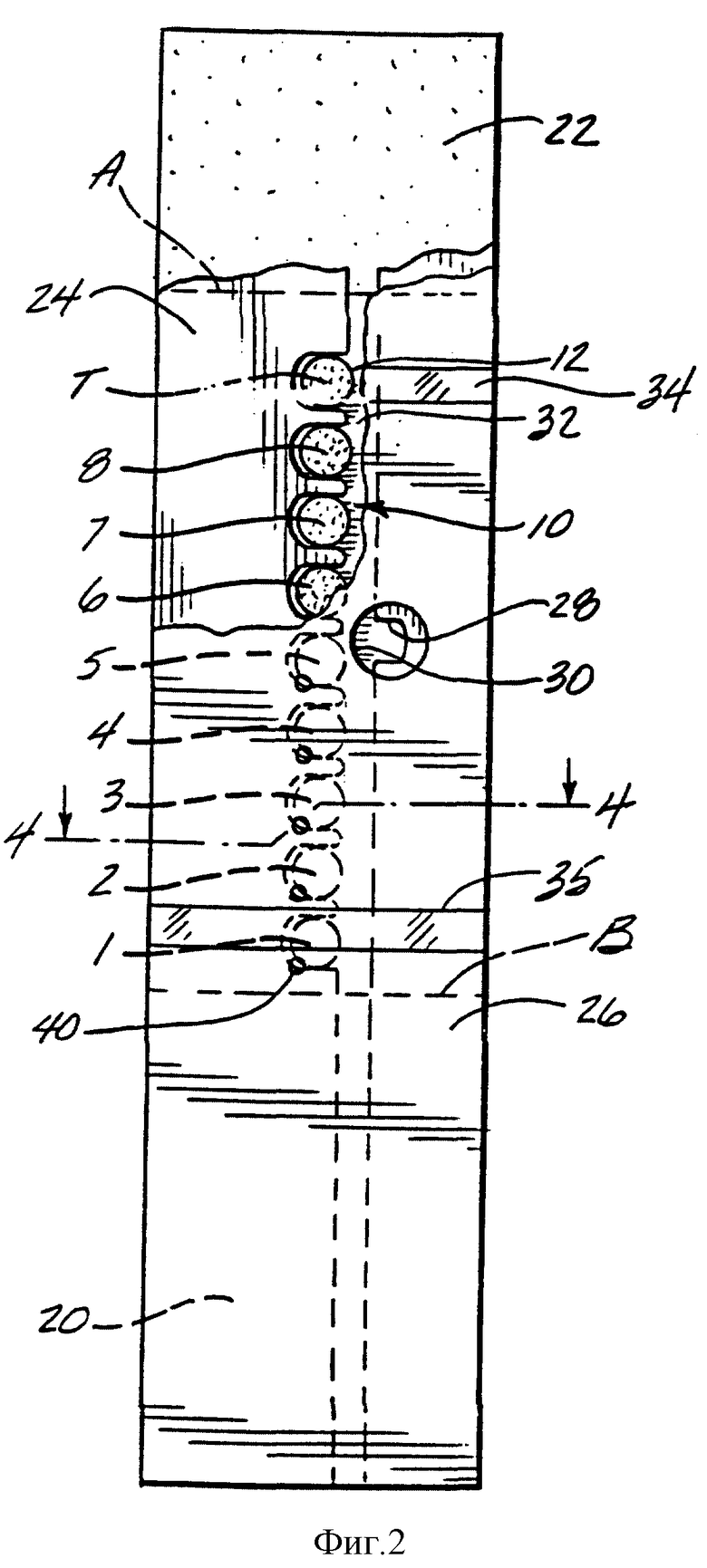
Фиг. 2 представляет собой горизонтальный вид снизу с частичным разрезом стороны пробы 12 мембраны 10 и слоев абсорбента 20 и 22, покрытых сверху промежуточным слоем 24 и нижним слоем 26. Мембрана 10 и слои абсорбента 20 и 22 предпочтительно поддерживаются верхним слоем, который не показан. Слои абсорбента 20 и 22 предпочтительно расположены у концов мембраны (за пунктирными линиями A и B), чтобы поглощать пробу крови, которая превышает объем, необходимый для измерения. Объем должен быть достаточным, чтобы подать пробу в каждую из аналитических зон, а также в таймерную зону, если она присутствует. Как правило, полоска с меньшим количеством аналитических зон не требует много пробы, однако она обеспечивает меньший диапазон определения концентраций глюкозы и/или меньшую точность. На фиг. 2 показаны 9 гигроскопичных зон, представляющих 8 аналитических зон (пронумерованы как 1-8) и таймер (Т), которые обеспечивают адекватный диапазон и точность, но в то же время не требуют неприемлемо большого объема пробы. Промежуточный слой 24 имеет вдавливание 28, которое совпадает с отверстием для пробы 30 в нижнем слое 26. Пробу вводят черед отверстие пробы 30, и она направляется за счет капиллярного действия вдоль центрального канала 32 промежуточного слоя 24 в каждую из аналитических зон и в таймерную зону, причем любое избыточное количество пробы поглощается в слоях абсорбента 20 и 22. Внешний вид пробы через необязательные прозрачные окошки 34 и 35 подтверждают то, что обеспечено достаточное количество пробы для измерений. Промежуточный слой 24 предпочтительно образует уплотнение со стороной пробы 12 мембраны, так что проба не может протекать, например, прямо между соседними аналитическими зонами.
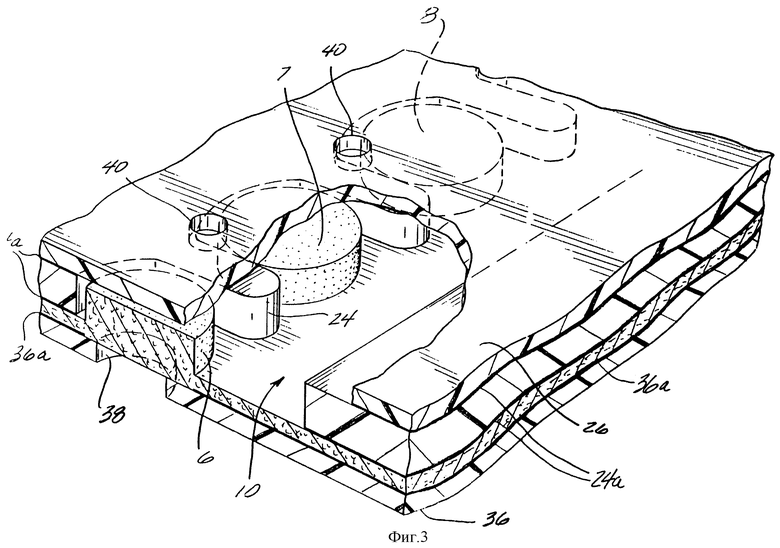
Фиг. 3 представляет собой увеличенное частное перспективное изображение, показывающее части 3 аналитических зон 6, 7 и 8, видимых через нижний слой 26 и разделенных выступами в промежуточном слое 24. Необязательные слои клея 24A присоединяют промежуточный слой 24 к нижнему слою 26 и мембране 10. Выпускные отверстия 40 в слое 26 способствуют протоку пробы в полоску. В верхнем слое 36 такие отверстия, как 38, выстроены вдоль гигроскопичных зон, что делает видимым любое изменение цвета в гигроскопичной зоне, а также позволяет доступ кислорода, необходимого для реакций с изменением цвета. Необязательный слой клея 36A присоединяет верхний слой 36 к аналитической стороне мембраны 10.
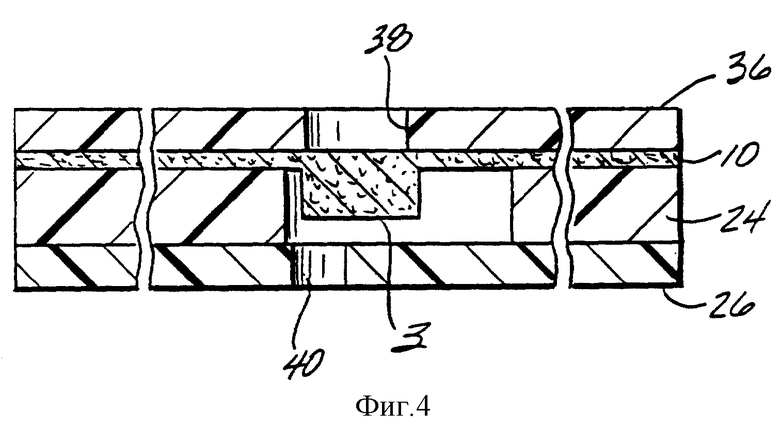
Фиг. 4 представляет собой поперечный разрез вдоль линии 4-4 фиг. 2, который изображает верхний слой 36, кроме слоев, показанных на фиг. 2. Выпускные отверстия в нижнем слое 26, такие как 40, расположены вдоль аналитических и таймерных зон и облегчают заполнение пробой объема, окружающего каждую из этих зон. Объемы, которые нужно заполнить, ограничены мембраной 10, промежуточным слоем 24 и нижним слоем 26. Обратите внимание на то, что зазор между верхом аналитической зоны 3 и нижним слоем 26 составляет только около 12 микрометров, однако он изображен в большем масштабе для ясности.
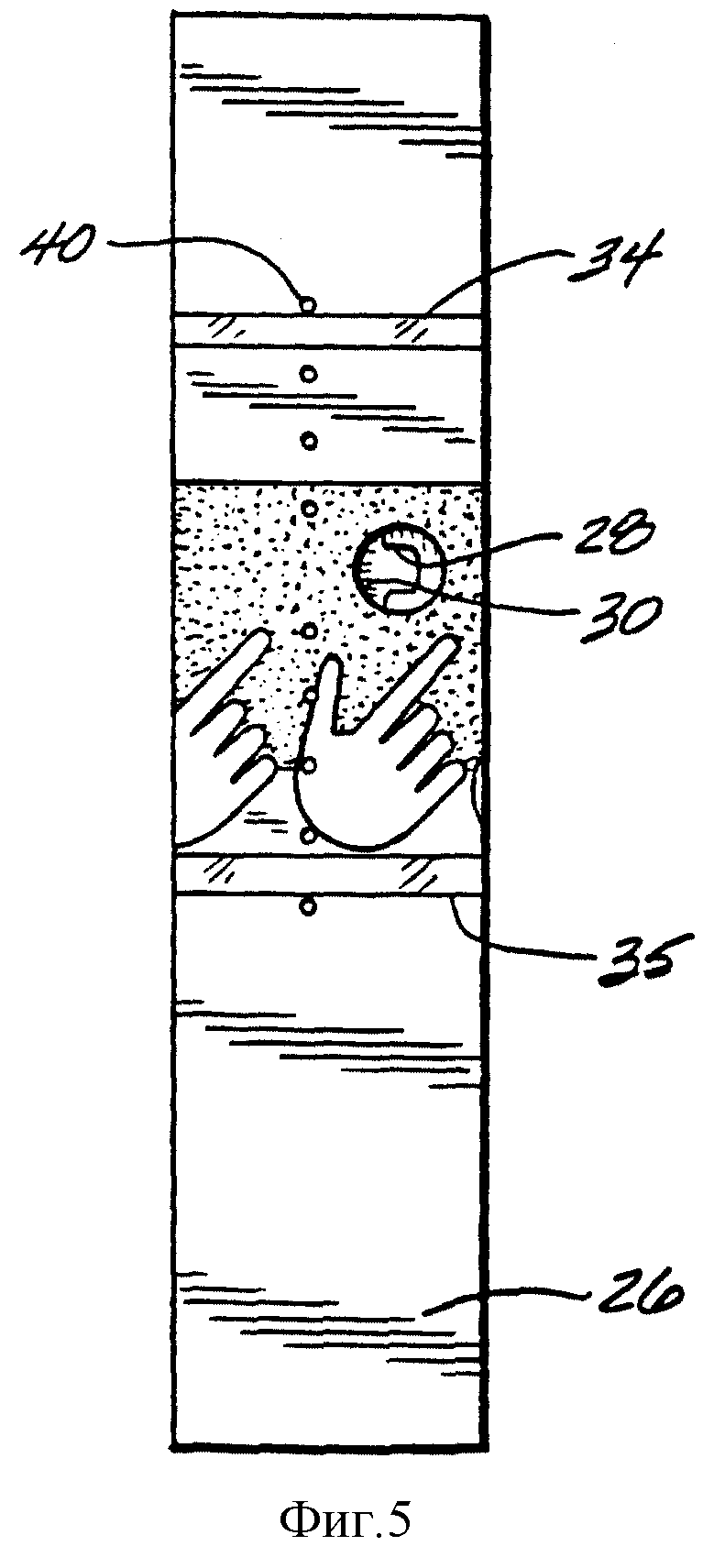
Фиг. 5 представляет собой горизонтальный вид снизу полоски по настоящему изобретению, на котором изображено отверстие для пробы 30 и рисунки, которые показывают пользователю, как вводить пробу через это отверстие. Когда проба видна через прозрачные окошки 34 и 35, это подтверждает то, что на полоску нанесли надлежащую пробу.
Фиг. 6 представляет собой горизонтальный вид сверху верхнего слоя 36 полоски, которая была откалибрована для того, чтобы соотнести аналитические зоны с концентрацией глюкозы.
На фиг. 7 показана полоска с фиг. 6 после того, как проба крови была внесена в отверстие 30 (фиг. 2), проба распространилась вдоль центрального канала 32 и глюкоза в пробе прореагировала с реактивом в аналитических зонах. Так как нижняя аналитическая зона содержит наименьшее количество ингибитора, она изменила цвет в первую очередь. После этого изменили цвет вторая, а затем третья зоны. Верхние кружки не изменили цвет, потому что в пробе было слишком мало глюкозы. Так как прошло время, достаточное для того, чтобы таймерная зона 42 изменила цвет, с полоски можно снимать показания. Так, результат, показанный на фиг. 7, указывает на то, что концентрация глюкозы в пробе составляет не менее 120 мг/дл, но меньше, чем 150 мг/дл. Отсчет может быть сделан в любое время после того, как таймерная зона 42 изменит цвет. Отмечено, что на фиг. 7 цвет за счет реакции с глюкозой изменяется от белого до окрашенного. Однако в альтернативном случае система может функционировать с индикаторным красителем, который разрушается путем индуцированного глюкозой окисления с соответствующим изменением цвета от окрашенного до белого.
Для лучшего понимания настоящего изобретения, примеры 1 и 2 (см. в конце описания) дополнительно иллюстрируют различные варианты его воплощения, которые ни в коем случае не предполагаются быть ограничивающими.
Мембрана Мемтек BTSH 55 (Mеmtek BTSH 55) была покрыта погружением в этот раствор (пример 1), и избыток снимали стеклянными палочками. Покрытую мембрану высушивали в флотационном сушильном аппарате при 180F и умеренных воздушных потоках так, что полотно по существу высыхало в течение 20 секунд. Полотно наматывали в препарате для описанного ниже второго покрытия.
Были приготовлены следующие растворы (см. таблицу).
Были приготовлены следующие разбавления концентрированного раствора, представленного в таблице: 0.0405: 1, 0.108: 1, 0.236: 1, 0.369: 1, 0.569: 1, 1.260: 1. Такое ступенчатое увеличение концентрации ингибитора соответствует ступенчато большим концентрациям глюкозы, о которых свидетельствуют аналитические зоны. Вместе с раствором таймера эти растворы наносили в ряд в виде покрытия на сторону заполненной ферментом мембраны с большим размером пор, так чтобы нанести их в количестве примерно 1.2•10-4 мл на квадратный миллиметр мембраны. Перед тем как подвергнуть мембрану тем же условиям сушки, что были описаны выше для стадии покрытия ферментом, ее смачивали в течение примерно пятнадцати секунд. Результаты показали, что таймер реагировал в течение примерно 70 секунд, причем 95% результатов попадало в диапазон между 64 и 79 секундами.
Мембрану Мемтек BTS 35 (Memtec BTS 35) в примере 2 (см. в конце описания) покрывали в ванночке так, что с покрывающим раствором контактировала поверхность с большими порами; избыточный раствор удаляли, как и раньше, с помощью стеклянных палочек. Мембрану сушили и наматывали так же, как в примере 1. Были приготовлены следующие растворы: .
Раствор А (индикатор)
70% (об. /об. ) этанол - 2819 мл
МБТГСБС - 2.98 г
(NH4) АНС - 25.83 г
Раствор Б - 205 мл
2% ДТПУК - 51.25 мл
Раствор Б (смачивающее вещество)
Мафос 60A (Maphos ® 60A) - 41 г
70% (об. /об. ) этанол - 205 мл
Раствор В (концентрированный раствор аскорбата)
Вода - 115
Аскорбиновая кислота - 4.85 мл
Этанол - 267 мл
Раствор Г (Таймер)
Вода - 53 мл
Аскорбиновая кислота - 8.75 г
Этанол - 123 мл
Доведение объема 70% этанолом - До 175 мл
Раствор глюкозы - 40.5 мл
Для каждого раствора ингибитора был зафиксирован объем раствора А 263 мл. Для различных аналитических зон отношение 70% EtOH: раствор В изменяли от 58.9 до 0.200, так что объем 70% EtOH + раствор В, добавленный к раствору А, был 87.5 мл для всех растворов ингибитора. Это, по существу, изменяло только концентрацию ингибитора в каждом растворе. Растворами, содержащими ступенчатую увеличивающуюся концентрацию ингибитора, и раствором таймера (Раствор Г) покрывали в ряд стороны мембраны с большими порами. Скорость нанесения регулировали так, чтобы достичь ~ 8•10-5 мл ингибитора на квадратный миллиметр мембраны. Мембрану сушили, как было описано выше, за исключением того, что задержка между покрыванием и высушиванием была около 1.6 минуты. Результаты показали, что таймер реагирует в течение примерно 60 секунд и они мало зависели от гематокритичного числа крови от 30 до 55% или от глюкозы от 78 до 420 мг/дл.
Специалистам будет понятно то, что предшествующее описание и примеры являются иллюстрацией практики настоящего изобретения и ни в коем случае не являются ограничивающими. Можно произвести изменения представленных здесь подробностей без отклонения от объема и сущности настоящего изобретения.



Изобретение относится к области медицины, в частности к лабораторным методам исследования. Многослойная индикаторная полоска измеряет концентрацию анализируемого вещества в жидкой пробе, которая на нее нанесена. Проба направляется к нескольким аналитическим зонам, упорядоченным вдоль полоски, где анализируемое вещество может реагировать с реактивом и вызывать изменение цвета. Каждая аналитическая зона также включает ингибитор реакции с изменением цвета. Концентрация ингибитора увеличивается в последовательных аналитических зонах. Таким образом, число зон, которые изменили цвет, является мерой концентрации анализируемого вещества. Индикаторная полоска особенно приспособлена для измерения глюкозы в пробе цельной крови. В предпочтительном варианте воплощения изобретения пробу направляют к аналитическим зонам вдоль дорожки, образованной путем раздавливания выбранных участков мембраны, и аналитические зоны являются неразделенными участками мембраны. 2 с. и 23 з. п. ф-лы, 7 ил. 1 табл.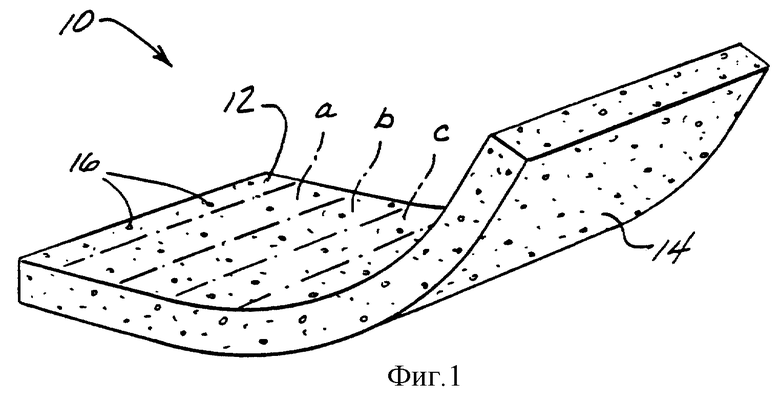
| US 4810470 А, 07.03.1989 | |||
| Преобразователь светового сигнала в электрический | 1963 |
|
SU475692A1 |
| Л ВСЗСи;3'.!'чг..и Е. В. Булдыгин]-^.^ ПАЛГИТьО ' ««&>& | 0 |
|
SU327934A1 |
| ГРУЗОВАЯ ТЕЛЕЖКА ПОДВЕСНОГО ТОЛКАЮЩЕГО КОНВЕЙЕРА | 0 |
|
SU407800A1 |
Авторы
Даты
2002-01-20—Публикация
1996-08-02—Подача