Это изобретение относится к диагностическим композициям, которые позволяют проводить измерение концентрации анализируемого вещества в биологических жидкостях, содержащих гемоглобин. Композиции основаны на предшественниках тетразолиевого красителя и включают подавление их восстановления, вызванного гемоглобином.
Жировая ткань является одной из самых многочисленных форм сохранения энергии в организме. Она высвобождает запас жирных кислот в систему циркуляции для обмена в первую очередь печенью. В ходе процесса жир потребляется, и энергия высвобождается и становится доступной для организма. Обычно потребляется небольшое количество жира, жирные кислоты полностью метаболизируются в диоксид углерода и воду, и превращение не нарушает тонкий баланс рН организма. Однако, если в организме присутствует недостаточное количество углеводородов вследствие, например, соблюдения диеты, то потребление жира и выработка жирных кислот могут увеличиться до потенциально вредных уровней. Кроме пациентов, соблюдающих диету, уязвимыми являются пациенты с инсулинозависимым сахарным диабетом вследствие нарушения у них углеводного обмена. Когда избыточная жирная кислота используется для удовлетворения энергетической потребности организма, вырабатываются большие количества ацетоацетата, ацетона и бета-оксибутирата. Эти промежуточные соединения именуются кетоновыми телами, а состояние известно как кетоацидоз.
Обычно кетоновые тела могут подвергаться повторному циклу обмена с образованием организмом других форм при условии, если нет их избытка. Поэтому у здоровых людей накапливается такое количество этих анализируемых веществ, которым можно пренебречь. Когда в течение относительно короткого периода метаболизируется большое количество жиров или когда большая часть энергии получена из жиров, вырабатываются большие количества кетоновых тел. Если эта проблема своевременно не корригируется, то избыточная выработка этих продуктов метаболизма жиров может вызвать определенные неврологические расстройства.
Кетоновые тела присутствуют в крови и при превышении порогового уровня выделяются с мочой. Они легко выявляются с помощью современного клинического анализатора. Процентное содержание бета-гидроксибутирата, ацетоацетата и ацетона составляет в среднем соответственно 78%, 20% и 2%. Ввиду относительно низкой концентрации и высокой летучести ацетона его содержание определяется редко. Вместо этого количественное определение ацетоацетата проводится с помощью реакции с нитропруссидом, а количественное определение бета-гидроксибутирата осуществляется с помощью ферментативного метода. В течение десятилетий имелись полоски для определения ацетоацетата. Они основаны на реакции соединения ионов нитропруссида с альдегидами и кетонами. Щелочной пробе мочи или образцу сыворотки крови дают возможность в течение нескольких минут участвовать в реакции с нитропруссидом, и образуется фиолетовый цвет. Интенсивность цвета показывает концентрацию ацетоацетата. Однако в исследование вмешивается ацетон, что приводит к более высоким показаниям прибора. Кроме того, по мере восстановления пациента после эпизода кетоацидоза уровень ацетоацетата в моче и в крови возрастает, затрудняя таким образом диагноз.
Исследование содержания бета-гидроксибутирата больше подходит для контроля за концентрацией кетоновых тел. Оно основано на окислении бета-гидроксибутирата соответствующей дегидрогеназой в присутствии кофактора никотинамид-аденин-динуклеотида (NAD). (Строго говоря, в естественных условиях присутствует и окисляется только D-бета-гидроксибутират, но во всем описании и прилагаемой формуле изобретения мы для краткости опускаем D). После окисления образуется NADH, и проводится прямое измерение его концентрации с помощью УФ-спектрофотометра. Следовательно, соответствующее изменение спектра сигнала пропорционально концентрации анализируемого вещества. К сожалению, возбуждение NADH происходит в УФ-области; таким образом, этот способ выявления подходит только для лабораторных приборов. Другой способ контроля за бета-гидроксибутиратом состоит в окислении NADH соединением тетразолия.
Соединения тетразолия играли важную роль в исследованиях тканевого метаболизма. Например, этот класс соединений использовался при исследовании реакций анаэробного окисления и восстановления в клетках. Кроме того, они обычно используются в клинических диагностических композициях. Соединения обычно представляют собой светлоокрашенные или бесцветные соединения, подвергающиеся реакции восстановления в присутствии восстановителя для получения интенсивно окрашенного формазана. Образовать краситель могут такие восстановители как аскорбаты, меркаптаны или разновидности NADH и NADPH.
Было обнаружено, что в клинических диагностических композициях эти красители неоценимы для контроля за образованием NAD(P)H из их родительских соединений, NAD(P)+, в аэробных реакциях. Окислительно-восстановительная реакция протекает быстро и не чувствительна к кислороду. Полученный в результате краситель имеет очень интенсивный цвет и низкую растворимость в воде.
В принципе, для измерения содержания кетоновых тел и глюкозы в цельной крови могут использоваться предшественники тетразолиевого красителя. Однако тетразолий может быть восстановлен не ферментативно с помощью гемоглобина (Fe(II)) с образованием окрашенного формазана, если гемоглобин не содержится внутри эритроцитов крови. Таким образом, свободный гемоглобин обусловливает серьезные помехи при измерениях. В действительности, вследствие гемолиза и полученного в результате избытка свободного гемоглобина относительно интересующего анализируемого вещества в типичном клиническом образце, сигнал помехи от гемоглобина может превысить предполагаемый сигнал. Это особенно справедливо при образцах с высоким содержанием гемоглобина или когда реакция проводится при более высокой температуре, при которой реакция окисления гемоглобина протекает быстрее. Поскольку гемолиза эритроцитов, который вызывает присутствие свободного гемоглобина, избежать нелегко, то в случае предполагаемого использования тетразолия для анализа эритроциты нужно удалять из образцов перед исследованием.
Эритроциты можно удалить из образцов с помощью фильтрации через мембраны и фильтры, с помощью захвата химическими реактивами или с помощью комбинации обоих способов. Способы фильтрации для отделения эритроцитов от цельной крови дорогостоящие и требуют достаточно больших объемов образца. Примером исследования крови на содержание кетона (бета-гидроксибутирата), в котором для удаления эритроцитов из образца цельной крови используется фильтрация, является исследование с использованием набора KetoSite®, имеющегося в продаже у GDS Diagnostics, Elkhart, IN. (Cм. Tietz Textbook of Clinical Chemistry, 2nd Ed., ed. by C. Burtis et al., W.B. Saunders Co., Philadelphia, PA, 1994, p. 974). Используемая в этом исследовании "Test Card" имеет два фильтрующих слоя, что делает карту достаточно дорогой и требует использования большого (25 мкл) образца крови. Кроме того, кровь не должна гемолизироваться.
Комбинация фильтрации и химического захвата используется в полоске для определения содержания глюкозы в крови Ames® Glucometer Encore™, имеющейся в продаже у Miles. В этой полоске для устранения помех от эритроцитов используется слой фильтрующего материала и средство, способствующее агглютинации (картофельный лектин). (См. Сhu et al., European Pat. Appl. 0638805 А2, publ. Feb. 15, 1995).
Другим путем уменьшения помехи гемоглобина является введение в систему окисляющего средства для окисления гемоглобина в метгемоглобин. Хотя известно, что феррицианиды преобразуют гемоглобин в метгемоглобин, они также разрушают желательный продукт, NADH.
Настоящее изобретение предоставляет собой реактив для измерения концентрации анализируемого вещества в содержащей гемоглобин биологической жидкости. Реактив включает
a) фермент дегидрогеназу, имеющую специфичность по отношению к анализируемому веществу,
b) никотинамид-аденин-динуклеотид (NAD) или производное NAD,
c) предшественник тетразолиевого красителя,
d) фермент диафоразу или его аналог и
e) нитрит.
Реактив особенно подходит для покрытия одного или более субстратов с целью образования полоски сухого реактива для измерения содержания анализируемого вещества. Особенно предпочтительная полоска включает
a) опорный слой;
b) тестирующую накладку на опорном слое, имеющую покрытие, которое включает
i) фермент дегидрогеназу, имеющую специфичность по отношению к анализируемому веществу,
ii) никотинамид-аденин-динуклеотид (NAD) или производное NAD,
iii) предшественник тетразолиевого красителя и
iv) фермент диафоразу или его аналог;
c) на тестирующей накладке гигроскопичный верхний слой, который покрыт нитритом.
Краткое описание чертежей.
Фиг. 1 представляет собой вид в перспективе тестирующей полоски согласно изобретению.
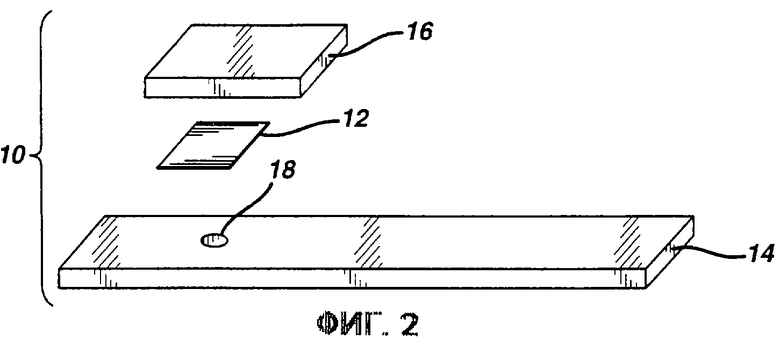
Фиг. 2 представляет собой перспективное изображение с пространственным разделением деталей другой тестирующей полоски согласно изобретению.
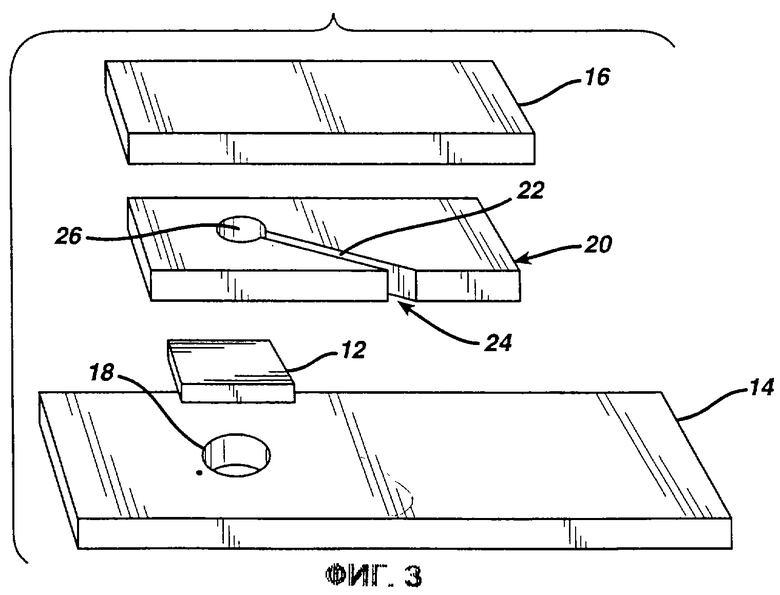
Фиг. 3 представляет собой перспективное изображение с пространственным разделением деталей еще одной тестирующей полоски согласно изобретению.
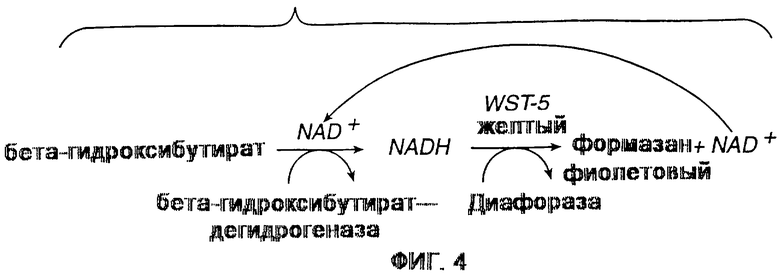
Фиг. 4 представляет собой иллюстративное изображение химического процесса количественного определения кетона согласно изобретению.
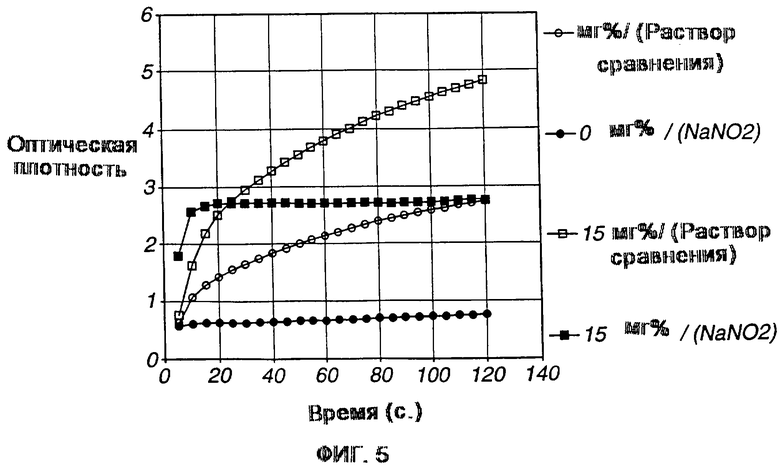
Фиг. 5 представляет собой график, показывающий эффект нитрита в качестве супрессора гемоглобина.
Настоящее изобретение обеспечивает реактив для измерения концентрации анализируемого вещества в содержащих гемоглобин биологических жидкостях (таких как цельная кровь) путем создания концентрации NADH, которая является показателем концентрации анализируемого вещества. Включение нитрита в реактив помогает преодолевать помехи гемоглобина при измерении концентрации NADH. Он может, в частности, использоваться для определения содержания кетоновых тел, но не ограничивается им.
Фиг. 1 изображает типичную тестирующую полоску 10 изобретения, которая состоит из тестирующей накладки 12, прикрепленной к опоре 14. Опора может представлять собой пластик, например полистирол, нейлон или полиэфирный пластик, или металлический лист, или любой другой материал, известный в предшествующем уровне техники. Тестирующая накладка покрыта реактивом, который вступает в реакцию с анализируемым веществом, для того чтобы вызвать изменение цвета. Тестирующая накладка предпочтительно включает гигроскопичный материал, такой как фильтровальная бумага или полимерная мембрана. Однако поскольку реакция не требует кислорода, тестирующая накладка может быть изготовлена из негигроскопичного материала, такого как пластиковая пленка. Реактив включает в себя фермент, который специфичен для анализируемого вещества, средство переноса гидрида, предшественник тетразолиевого красителя, кофактор подходящего фермента и супрессор гемоглобина. Необязательно для повышения устойчивости включаются буфер и стабилизатор.
Как показано на фиг.2, тестирующая полоска может также представлять собой многослойную конструкцию с верхним слоем 16, перекрывающим тестирующую накладку 12. В этой конструкции реактив может быть разделен между двумя слоями. Например, супрессор гемоглобина может наноситься на необязательный верхний слой 16, а оставшийся реактив нанесен на тестирующую накладку 12. Предпочтительно верхний слой 16 является гигроскопичным и служит в качестве распространяющего слоя и в качестве поглощающего слоя для впитывания избытка образца. Образец наносится на верхний слой 16 и проходит через него к тестирующей накладке 12. Концентрация анализируемого вещества определяется с помощью измерения изменения цвета через опорный слой 14 или, если слой 14 непрозрачный в участке, примыкающем к зоне реакции, через необязательное окно или сквозное отверстие 18.
В альтернативном варианте реализации, показанном на фиг.3, верхний слой 16 и тестирующую накладку 12 разделяет прокладка 20. Прокладка 20 представляет собой предпочтительно негигроскопичную пластиковую пленку, имеющую на обеих поверхностях клеевое покрытие (не показано). Канал 22 в прокладке 20 обеспечивает капиллярный канал для стока образца из отверстия 24 к измерительной зоне 26. Поток зависит от подвода воздуха между поверхностью тестирующей накладки 12 и примыкающим слоем или альтернативно через необязательное выпускное отверстие 18. Изменение цвета в измерительной зоне 26 контролируется через необязательное выпускное отверстие/окно 18. Реактив может находиться весь на тестирующей накладке 12 или альтернативно может быть разделен между тестирующей накладкой и одним или обоими негигроскопичными слоями 14 и 16. Когда мы именуем реактив как "покрывающий" или находящийся "на" слое, мы предполагаем включение возможности того, что реактив будет впитываться в слой, в частности, если он гигроскопичен.
Ферментами, которые подходят для количественных определений при этом изобретении и соответствующими анализируемыми веществами являются: алкогольдегидрогеназа для спирта, формальдегид дегидрогеназа для формальдегида, глюкозодегидрогеназа для глюкозы, глюкозо-6-фосфатдегидрогеназа для глюкозо-6-фосфата, глютаматдегидрогеназа для глутаминовой кислоты, глицеролдегидрогеназа для глицерина, бета-гидроксибутиратдегидрогеназа для бета-гидроксибутирата, гидроксистероиддегидрогеназа для стероида, L-лактатдегидрогеназа для L-лактата, лейциндегидрогеназа для лейцина, малатдегидрогеназа для яблочной кислоты и пируватдегидрогеназа для пировиноградной кислоты.
Для активации фермента необходим подходящий ферментный кофактор. В зависимости от фермента могут использоваться следующие кофакторы: бета-никотинамид-аденин-динуклеотид (бета-NAD), бета-никотинамид-аденин-динуклеотидфосфат (бета-NADP), тионикотинамид-аденин-динуклеотид, тионикотинамид-аденин-динуклеотидфосфат, никотинамид-1N6-этонаденин-динуклеотид и никотинамид-1N6-этонаденин-динуклеотидфосфат. В присутствии фермента анализируемое вещество восстанавливает кофактор.
Следующим этапом в процессе образования красителя является извлечение гидрида из восстановленного кофактора. Это может осуществляться либо с помощью диафоразы, такой как дегидрогеназа липоевой кислоты, ферредоксин-NADР-редуктаза, липоамиддегидрогеназа или с помощью синтетического аналога, такого как феназинметосульфат (ФМС) или мелдолова синь (Meldola Blue). Кинетика реакции и устойчивость являются первостепенными факторами отбора средства переноса гидрида или "извлекателя". Например, универсальным извлекателем гидрида является ФМС, потому что он имеет относительно быструю кинетику реакции с большинством из перечисленных ниже соединений тетразолия. Он, однако, более чувствителен к свету, чем извлекатели гидрида на основе ферментов. Диафораза более устойчива и по этой причине является предпочтительной.
Захваченный гидрид переносится на соединение тетразолия (предшественник красителя) для образования окрашенного формазана. Соединениями тетразолия, которые больше всего подходят для этого устройства, являются: 2-(2'-бензотиазолил)-5-стирил-3-(4'-фталгидразидил)тетразолий (BSPT), 2-бензотиазолил-(2)-3,5-дифенилтетразолий (BTDP), 2,3-ди(4-нитрофенил)тетразолий (DNP), 2,5-дифенил-3-(4-стирилфенил)тетразолий (DPSP), дистирил- нитросиний-тетразолий (DS-NBT), 3,3'-[3,3'-диметокси-(1,1'-бифенил)-4,4'-диил]-бис-[2-(4-нитрофенил)-5-фенил(-2Н-тетразолий (NBT), 3-(4,5-диметил-2-тиазолил)-2,5-дифенил-2Н-тетразолий (МТТ), 2-фенил-3-(4-карбоксифенил)-5-метилтетразолий (РСРМ), тетразолий синий (ТВ), тиокарбамил-нитросиний-тетразолий (TCNBT), тетранитросиний тетразолий (TNBT), тетразолий фиолетовый (TV), 2-бензотиазотиазолил-3-(4-карбокси-2-метоксифенил)-5-[4-(2-сульфоэтилкарбамоил)фенил] -2Н-тетразолий (WST-4) и двунатриевая соль 2,2'-дибензотиазолил-5,5'-бис-[4-ди(2-сульфоэтил)карбамоилфенил] -3,3'-(3,3'-диметокси-4,4'-бифенилен)дитетразолия (WST-5). Предпочтительна WST-5, потому что она легко растворяется в водной среде, которая наиболее совместима с биологическими образцами. Кроме того, полученное в результате соединение формазана проявляет сильное спектральное поглощение в сине-фиолетовой области, уменьшая таким образом необходимость в коррекции фонового сигнала от гемоглобина.
Наконец, для устранения нежелательной образующей краситель реакции между гемоглобином и соединением тетразолия в реактиве присутствует супрессор гемоглобина. Ролью супрессора гемоглобина является оксиление гемоглобина в метгемоглобин, который не вступает в реакцию с тетразолием. Удивительно, что нитриты, такие как нитрит натрия, нитрит калия и их производные, очень эффективны в подавлении гемоглобина, в то же самое время не разрушая NADH. Нитриты также эффективны при повышенной температуре и при образцах с высоким содержанием гемоглобина. Предпочтителен нитрит натрия, потому что он имеет высокую растворимость в воде, нетоксичен и относительно недорог.
Хотя реактив согласно изобретению может использоваться во влажной химической форме, например в кювете, в предпочтительном варианте реализации изобретение представляет собой сухую полоску для количественного определения бета-гидроксибутирата в цельной крови. Она состоит из мембранной тестирующей накладки, предпочтительно из нейлона, которая размещена между опорой и верхним слоем. Опора предпочтительно изготовлена из листа полиэфирного пластика. Верхний слой может представлять собой любой гигроскопичный материал, известный в предшествующем уровне техники. Предпочтительный материал представляет собой пористый полиэтилен, обработанный метилолеилтауратом натрия, имеющимся в продаже у Porex Corp. of Fairburn, GA. Мы именуем этот материал "Porex". Тестирующая накладка содержит реактив, включающий бета-гидроксибутират-дегидрогеназу, NAD, дифоразу и WST-5 (см. табл.1). Верхний слой из Porex содержит нитритный реактив (см. табл.2).
При работе пользователь наносит каплю цельной крови на верхнюю поверхность верхнего слоя Porex. Когда цельная кровь или гемолизированная кровь вступает в контакт с Porex, нитрит натрия восстанавливается и вступает в реакцию с доступным свободным гемоглобином, делая таким образом гемоглобин безвредным для количественного определения. Полученный в результате существенно лишенный гемоглобина образец переносится на расположенную ниже тестирующую накладку через капилляр или под действием силы тяжести. На тестирующей накладке образец инициирует каскадную реакцию, изображенную на фиг.4, для получения цветного красителя, концентрация которого пропорциональна содержанию бета-гидроксибутирата в образце, и может непосредственно определяться с помощью фотометра.
На фиг. 5 изображено влияние нитрита на цветообразующую реакцию в этой системе с использованием образцов крови, содержащих 0 и 15 мг%. В отсутствие нитрита гемоглобин восстанавливает тетразолий с образованием постоянно увеличивающейся концентрации красителя с соответствующим увеличением оптической плотности. Нитрит путем удаления гемоглобина (с помощью окисления) ограничивает образование цвета, которое происходит только вследствие наличия кетоновых тел (т.е. бета-гидроксибутирата) в образце.
Следующий пример демонстрирует предпочтительный вариант реализации настоящего изобретения, в котором анализируемое вещество представляет собой бета-гидроксибутират, а фермент представляет собой бета-гидроксибутират-дегидрогеназу. Композицию можно легко изменить для применения к другим перечисленным выше комбинациям анализируемого вещества-фермента. (См., например, Tietz Textbook of Clinical Chemistry, 2nd Ed., ed. by C. Burtis et al., W.B. Saunders Co., Philadelphia, PA, 1994, pp.976-978 and 1174-1175). Пример ни в коей мере не является ограничивающим.
ПРИМЕР
Нейлоновую мембрану толщиной 0,8 мкм, приобретенную у компании Cuno (Meriden, CT, USA), погружают в реактив, представленный в табл. 1, до полного насыщения. Избыток реактива осторожно соскребают с помощью стеклянного стержня. Полученную в результате мембрану подвешивают для сушки на 10 мин в печи при 56oС. Роrех (толщиной 0,6 мм) пропитывают раствором нитрита, представленным в табл. 2, а затем подвешивают для сушки на 10 ч в печи при 100oС. Наконец мембрану помещают между слоем полиэфирного сырьевого материала (полиэфирный пластик Melenex® толщиной 0,4 мм, приобретенный у ICI America, Wilmington, DE) и слоем Роrех, пропитанным нитритом.


Изобретение относится к диагностике с помощью реактива на основе тетразолия для измерения концентрации анализируемого вещества в содержащей гемоглобин биологической жидкости, такой как цельная кровь. Реактив включает фермент дегидрогеназу, который обладает специфичностью по отношению к анализируемому веществу, NAD или производное NAD, предшественник тетразолиевого красителя, фермент диафоразу или его аналог и нитрит. Реактив обусловливает образование красителя, что является показателем концентрации анализируемого вещества. Нитрит подавляет помехи образованию красителя, неферментативно обусловленные гемоглобином. Реактив предпочтительно используется в сухой полоске для определения содержания кетоновых тел, таких как бета-гидроксибутират и др. Изобретение позволяет проводить реакцию быстро, при этом она не чувствительна к кислороду. 4 с. и 14 з.п. ф-лы, 2 табл., 5 ил.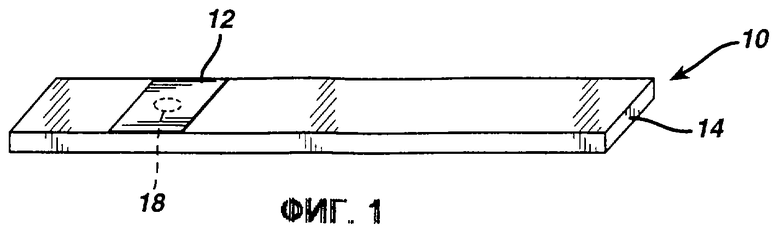
| Форсунка | 1975 |
|
SU638805A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ОБЩЕГО СОДЕРЖАНИЯ ГЛЮКОЗЫ В ЦЕЛЬНОЙ КРОВИ И КОМПОЗИЦИЯ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1990 |
|
RU2050546C1 |
| СРЕДСТВО ДЛЯ КОЛОРИМЕТРИЧЕСКОГО ОПРЕДЕЛЕНИЯ АНАЛИТА | 1989 |
|
RU2015513C1 |
| RU 9401174 А, 27.11.1997 | |||
| СПОСОБ УМЕНЬШЕНИЯ ДЕФОРМАЦИЙ ВОДОЗАЩИТНОЙ ТОЛЩИ И ЗЕМНОЙ ПОВЕРХНОСТИ | 1996 |
|
RU2118455C1 |
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| DE 4205876 А1, 03.09.1992. | |||
Авторы
Даты
2004-02-27—Публикация
1999-03-10—Подача