Изобретение относится к технологии неорганических материалов, а именно к способу получения аморфного материала заданного в настоящей заявке состава после отжига переходящего в материал со структурой гидроксиапатита, используемого как профилактическая составляющая зубных паст, а также как медицинский материал для заполнения костных дефектов. Таким образом, мы предлагаем группу изобретений: новый материал и конкретный способ его получения, отличительные признаки которого жестко связаны с отличительными признаками материала. Предлагаемый материал должен быть полностью биосовместим с тканями человеческого организма и по химическому составу близок к составу зубной эмали человека. Костная ткань, с точки зрения материаловедения, является композиционным материалом, состоящим из органической матрицы, неорганического вещества и жидкости. Компактная (кортикальная) кость содержит, вес.%: ~ 69% неорганического вещества, ~20% белков и ~11% жидкости. В зубной эмали количество неорганического вещества значительно выше: ~97%, содержание органического вещества составляет ~1,7%, жидкости ~1,3%. Химический состав зубной эмали [1,2] был определен ориентировочно [1] как: Са - 36,1%; Р - 17,3%; СО2 - 3%; Mg - 0,5%; Na - 0,2%; K - 0,3%; Cl - 0,3%; F - 0,016%; S-0,1%; Сu - 0,01%; SiO2 - 0,03%; Fe - 0,025%; Рb - 0,0071%; эти данные позволяют определить требования к чистоте используемых для синтеза материалов, но не могут дать исчерпывающей информации ни о фазовом составе костной ткани, ни, тем более, о химическом составе фаз в костной ткани, тем более, что общее содержание некоторых элементов меняется с возрастом и зависит от окружающей среды, а один и тот же элемент может одновременно присутствовать в нескольких фазах. Рентгенофазовый анализ (РФА) показывает, что костная ткань представляет собой аморфную (слабокристаллизованную) апатитную фазу. Значительная доля вещества присутствует в виде рентгеноаморфной фазы, что может быть обусловлено и микроскопическими (десятки HМ) размерами кристаллов, дающими на рентгенограмме размытые (диффузные) линии. В связи с вышеизложенным определение фазового и отчасти химического состава образца возможно лишь после высокотемпературного (600-800oС) отжига исследуемых образцов.
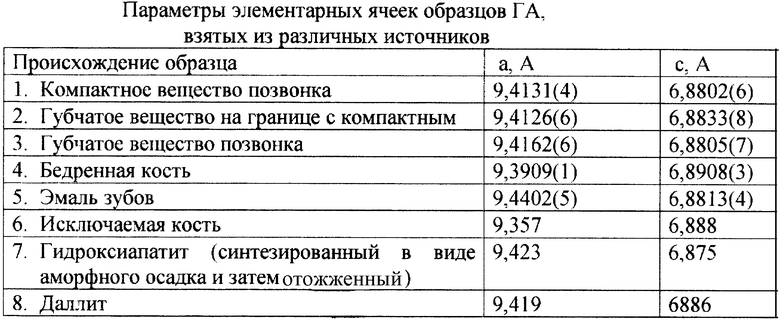
В таблице приведены параметры решетки различных образцов, качественно определяющих пределы вариации состава гидроксиапатита (ГА), биосовместимого с тканями человеческого организма. Дополнительные сведения для контроля состава можно получить из анализа ИК-спектров отожженных образцов. Для решетки ГА полосы поглощения СО3 -2, относящиеся к симметричным валентным колебаниям, лежат в области 1450-1410 см-1, к деформационным - 870 см-1; (OН)- ионов - 3572 см-1 (валентные) и 630 см-1 - деформационные; (PО4)-3-aниoнoв - 571 cм-l и 474 см-1.
Если в материале имеется примесь трикальцийфосфата, в ИК-спектре появляется полоса при 550 см-1, характерная для колебаний (РО4)-3 -аниона в этой решетке. Примесь карбоната кальция вызывает появление полосы при 714 см-1 соответствующей колебаниям ионов (СО3)-2. Отметим, что карбонат-ионы в структуре ГА могут занимать две позиции А и В, замещая позиции (ОН)-1 и (РО4)-3 ионов соответственно [3], вызывая изменения как величин постоянных решетки, так и вида ИК-спектров. Меняя условия синтеза, можно управлять распределением ионов (СО3)-2 по этим позициям [1, 3, 4]. Исходя из вышеизложенного, задача поиска материала, близкого к составу ГА зубной эмали, была решена следующим образом: для синтеза был выбран аморфный ГА с изоморфно введенными в него ионами фтора (F-1) и карбонильными ионами (СО3)-2 на место типа А. Количество изоморфно введенных ионов варьируется в пределах, которые дают анализы зубной эмали здоровых людей различных возрастных категорий и отвечают формуле Са10(РO4)6(ОН)2-x-y(СО3)x/2 Fy (где х=0,01-0,3 и у=0,01-0,4), причем грансостав этого материала должен характеризоваться кривой распределения размеров частиц с максимумом в области 300А - 500А.
Известен материал, используемый для производства зубных паст и заполнения костных дефектов [1, 5, 6, 7, 8, 9]. Речь идет о чистом гидроксиапатите, полученном осаждением. В отличие от предлагаемого в данной заявке этот материал по своему составу отличается от естественного состава костной ткани: не содержит ни карбонатных групп, ни групп фтора. Приведенные в работе данные свидетельствуют о наличии кристаллической структуры применяемых материалов.
Вторым изобретением в предлагаемой группе является способ получения материала, рассмотренного в первой части описания, причем отличительные признаки способа получения целиком определяются отличительными признаками самого материала: аморфной структурой, равномерным распределением примесных групп СО3 -2 и F-, при изоморфном вхождении последних в структуру ГА. Известны следующие способы синтеза ГА [1,5 - 10].
1. Получение ГА осаждением из водных растворов.
1.1. Реакции обмена с участием фосфат-ионов и ионов кальция растворимых солей в щелочной среде
10Са(NО3)2+14KOH+6KH2PO4-->Ca10(PO4)6(OH)2+20KNO3+12H2O, (1); 10Ca(NO3)2+6(NH4)2HPO4+8NH4OH-->Ca10(PO4)6(OH)2+20NH4NO3 +6H2O, (2).
1.2. Нейтрализация гидроксида кальция фосфорной кислотой
10Са(ОН)2+6Н3РO4-->Са10(РO4)6(OH)2+18H2O, (3)
или взаимодействие солей со щелочью или кислотой.
1.3. Гидролиз нерастворимых фосфорно-кальциевых солей с добавлением ионов или гидроксил-ионов:
3Са3(РO4)2+СаСl2+2Н2O-->Ca10(РO4)6(OH)2+2НСl, (4);
6СаНРO4+4Са(ОН)2-->Са10(РO4)6(ОН)2+ 3Н2O, (5).
2. Осаждение ГА из растворов органических растворителей.
Получение ГА растворов органических растворителей достаточно известно. Большинство этих методик заключаются в проведении реакции в среде органического растворителя, хорошо смешивающегося с водой, между растворимыми в этом растворителе соединениями кальция и фосфора. Органический растворитель удаляют из сферы реакции посредством сушки и отжига. В качестве соединений кальция используют четырехводный нитрат, двухводный ацетат, хлорид, бромид, дигидрофосфат кальция; в качестве соединений фосфора - NH4H2PO4, NH4H2PO3, NH4H2PO2, Н3РO4, Н3РO2, (СН3О)3Р, (СН2Н5O)зР, (СН3)2СHO3Р, (СН3)(CH2)3О5P, (С6Н5)3Р, (С2Н2O)2 РОH, (С6Н5)3РО. В качестве органических растворителей - низкие спирты C1-C5, включая двухатомные, трехатомные, оксиалканомы, диалкилкетоны, оксикетоны, карбоновые кислоты, диметилацетамид и 2-этоксиэтилацетат.
Иногда используют способ, отличающийся от предыдущих тем, что органический растворитель не отжигают, а проводят гидролиз смеси растворов фосфорной кислоты и этилата кальция, добавляя воду или водный раствор аммиака. ГА, выпавший в осадок, отделяют фильтрованием и сушат в вакуумной сушилке.
3. Твердофазный синтез.
Твердофазный синтез заключается в термообработке на воздухе или в инертной атмосфере тщательно измельченных смесей, состоящих из солей, содержащих кальций, фосфор и улетучивающиеся при отжиге компоненты, которые не входят в состав конечного продукта. Это могут быть различные комбинации из фосфатов кальция, сложных оксидов и т.д.
4. Гидротермальный синтез, использующий процессы, происходящие в растворах при больших величинах температуры и давления. Обычно в качестве исходного сырья применяют как ранее синтезированный ГА, так и смеси, содержащие исходные вещества для синтеза ГА. В результате гидротермального синтеза получают стехиометрический, чистый, кристаллический ГА с размерами кристаллов до 3,5 мм.
Итак, для получения аморфного ГА с размером частиц порядка 350-600 не могут применяться твердофазный и гидротермальный синтезы ГА, а также любые методики, связанные с повышенными температурами. Повышение температуры ведет к росту размеров зерна, что недопустимо в свете требований, предъявляемых к материалу. Любые методики, связанные с наличием в системе посторонних ионов, например применение аммиачных солей, хлоридов, нитратов, также недопустимы ввиду невозможности удаления их из водной эмульсии без нагрева.
не могут применяться твердофазный и гидротермальный синтезы ГА, а также любые методики, связанные с повышенными температурами. Повышение температуры ведет к росту размеров зерна, что недопустимо в свете требований, предъявляемых к материалу. Любые методики, связанные с наличием в системе посторонних ионов, например применение аммиачных солей, хлоридов, нитратов, также недопустимы ввиду невозможности удаления их из водной эмульсии без нагрева.
Решением данной задачи является способ нейтрализации оксида кальция кислотой в водном растворе при соблюдении следующих условий. Необходимость изоморфного вхождения в структуру осадка карбонат и фтор-ионов требует модификации этого метода, заключающегося в применении в качестве осадителя смеси кислот (Н3РO4+НF) и поддержания постоянного состава раствора за счет отдельной равномерной подачи в него раствора, содержащего карбонат-ионы.
Особенностью синтеза, патентуемого в данной работе, является практическая возможность полного контроля получаемого продукта современными методами [6-10] . Так, химический анализ получаемого гелеобразного продукта не дает ответа на вопрос о химической формуле синтезированного материала и о его фазовом составе. Они могут быть различными при одном и том же химическом составе продукта и зависеть от методики приготовления образцов для анализа: температур и времени сушки и последующего отжига.
Контроль за качеством данного аморфного материала современными методами возможен лишь при отборе проб из конечного продукта, их сушки, последующего высокотемпературного отжига, переводящие пробы из аморфного в кристаллическое состояние и исследований полученных кристаллических образцов методами РФА и ИК-спектроскопии.
Итак, отличительными признаками предлагаемого способа получения ГА являются: осаждение продукта смесью ортофосфорной и фтористоводородной кислот, поддержание концентрации карбонатных ионов в растворе постоянным добавлением Са(НСО3)2 в раствор, низкие температуры синтеза, обеспечивающие нужный размер частиц, требование перевода аморфных проб в кристаллическое состояние и лишь затем проведение анализов. Итак, отличительными признаками предлагаемого способа получения ГА являются: осаждение продукта смесью ортофосфорной и фтористоводородной кислот и поддержание концентрации карбонатных ионов в растворе постоянным добавлением Са(НСО3)2 в раствор, низкие температуры синтеза, обеспечивающие нужный размер частиц, требование перевода аморфных проб в кристаллическое состояние и лишь затем проведение анализов.
Известны способы получения гидроксиапатита методом нейтрализации гидроксида кальция ортофосфорной кислотой при последовательном прохождении реакционной смеси через две зоны [8, 9, 10]. Отличие предлагаемого способа заключается в другом составе реагентов и реакционной смеси, отдельном введении в реакционную смесь карбонат-ионов, что приводит к равномерному и изоморфному введению этих ионов в молекулы гидроксиапатита, температурному режиму, обеспечивающему получение аморфной структуры и заданному распределению частиц по размерам (350-600 ).
).
Следующие примеры иллюстрируют возможность осуществления изобретения и описывают достигнутые технические результаты, получаемые при применении материала при изготовлении зубной пасты.
Пример 1. Для получения 1 кг материала состава Са10(РО4)6(ОН)1,97(СО3)0,01F0,01 взято 480 г оксида кальция, который помещается в термостатическую емкость объемом 40 л. Оксид кальция гасится водой и общий объем доводится до 10 л. Готовится раствор Н3PO4 объемом 25 л с концентрацией Н3РO4 50 г/л, куда добавляется 0,2 г HF. Готовится 2 л раствора Са(HСО3)2, содержащего 10 г соли. Процесс осаждения проводится при 7-10oС. Процесс нейтрализации проходит при интенсивном перемешивании и подаче со скоростью 10 мл/мин. Скорость подачи Са(НСО3)2 коррелируется с подачей кислоты, что обеспечивает равномерное поступление карбонатных ионов в течение всего процесса. Окончание процесса фиксируется по величине рН 7,2-7,5. Последней стадией процесса является созревание осадка, заключающееся в перемешивании в течение 6 ч с последующей коррекцией рН раствора. Полученный продукт содержит заданное нами соединение в количестве 2,5-3% по сухому остатку.
Материал может концентрироваться до 10-12% по сухому остатку после отстаивания и декантации прозрачного раствора. Окончательный продукт представляет собой водную суспензию (пасту) аморфного материала заданного состава. В случае необходимости получения более высоких концентраций материала в пасте применяется вакуумная откачка.
Из полученной пасты брались пробы для анализа. Они высушивались при 200oС, затем обжигались при 600o, после чего производились: химический анализ, рентгенофазовый анализ и снимались ИК-спектры для подтверждения состава материала, его фазовой частоты и характера изоморфного замещения. После стерилизации γ-облучением в замкнутой пластмассовой емкости аморфный материал использовался для изготовления зубной пасты.
Пример 2. Для получения материала состава Ca10(PO4)6(OH)2-x-y(COx/2)Fy процесс проводится аналогично процессу примера 1, а необходимые количества карбонат-ионов и фтора рассчитываются по стехиометрическим коэффициентам.
Литература
1. П.А. Арсеньев и др. "Медицинские биоматериалы".- М.:изд.МЭИ, 1999, 73 стр.
2. G.P.Brophy, J.P.Nash.Amer. Miner,1968, v.53, p. 445-482.
3. C.W.Schmidt, W. Leusche,Z.Klin.Med., 1986, v.41, p. 223-234.
4. G. Bonel, G. Montel. Reactivity of Solids 5-th Symp. Int., 1964, p. 667.
5. Патент Японии 62-29366, С 01 В 25/32, 1987.
6. Патент Японии 61-46492, С 01 В 25/32, 1986.
7. Патент Японии 62-4324, С 01 В 25/32, 1987.
8. RU, 2077475 С1, кл. 6 С 01 В 25/32, 20.04.97.
9. RU, 2122520 С1, кл. 6 C 01 В25/32, 27.11.98.
10. RU, 2077329 С1, кл. 6 А 61 К 33/06, 20.04.97.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОДУКТ ДЛЯ ИЗГОТОВЛЕНИЯ ЗУБНЫХ ПАСТ И ПОРОШКОВ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2011 |
|
RU2465886C2 |
| МОДИФИЦИРОВАННЫЙ ГИДРОКСИАПАТИТ | 2003 |
|
RU2245152C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОРАЗМЕРНОГО КАЛЬЦИЙ-ДЕФИЦИТНОГО КАРБОНАТСОДЕРЖАЩЕГО ГИДРОКСИАПАТИТА | 2014 |
|
RU2588525C1 |
| БИОРЕЗОРБИРУЕМЫЙ МАТЕРИАЛ НА ОСНОВЕ АМОРФНОГО ГИДРОКСИАПАТИТА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2012 |
|
RU2510740C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ПРИМЕСЕЙ СОЕДИНЕНИЙ АЗОТА В ГИДРОКСИАПАТИТЕ | 2011 |
|
RU2465573C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОКРИСТАЛЛИЧЕСКОГО КРЕМНИЙЗАМЕЩЕННОГО ГИДРОКСИАПАТИТА | 2012 |
|
RU2500840C1 |
| СПОСОБ ПОЛУЧЕНИЯ НА ПОДЛОЖКЕ КАЛЬЦИЙ-ФОСФАТНОГО ПОКРЫТИЯ | 2008 |
|
RU2372101C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОРОШКОВОГО МАТЕРИАЛА НА ОСНОВЕ КАРБОНАТГИДРОКСИАПАТИТА И БРУШИТА | 2014 |
|
RU2546539C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОКСИЛАПАТИТА КАЛЬЦИЯ | 1992 |
|
RU2014846C1 |
| СПОСОБ ПОЛУЧЕНИЯ НАНОРАЗМЕРНОГО КАЛЬЦИЙДЕФИЦИТНОГО СИЛИКАТ- И ФТОРЗАМЕЩЕННОГО ГИДРОКСИАПАТИТА | 2024 |
|
RU2835237C1 |
Изобретение относится к технологии получения неорганических материалов, используемых в стоматологии. Аморфный, карбонированный и фторированный гидроксиапатит для зубных паст включает синтезированный материал со структурой гидроксиапатита, при этом он дополнительно содержит карбонатные группы и фтор группы в соответствии с формулой Ca10(PO4)6(OH)2-x-y(CJ3)x/2Fx, где x= 0,01-0,3; y-0,01-0,4, а также способ его получения, заключающийся в медленной нейтрализации в инертной атмосфере водного раствора гидроксида кальция смесью ортофосфорной и фтористоводородной кислот при 8-10oС при отдельном и непрерывном введении в реакционный раствор Са(НСО3)2, а образцы для контроля качества готовой продукции готовят в инертной атмосфере путем сушки и последующего высокотемпературного отжига. Материал полностью совместим с тканями человеческого организма и по химическому составу близок в составу зубной эмали человека, используется в качестве состава для зубных паст. 2 с.п. ф-лы, 1 табл.
Оксид кальция - 480
Ортофосфорная кислота - 576
Кислый углекислый кальций - 0,3-12,0
Фтористый водород - 0,2-8,0
| СРЕДСТВО ДЛЯ СТИМУЛЯЦИИ РОСТА КОСТНОЙ ТКАНИ | 1993 |
|
RU2077329C1 |
| АРСЕНЬЕВ П.А | |||
| и др | |||
| Медицинские биоматериалы | |||
| - М.: изд | |||
| МЭИ, 1999, с.73. | |||
Авторы
Даты
2002-02-20—Публикация
1999-08-19—Подача