Настоящее изобретение относится к пищевым добавкам для усиления иммунного ответа у домашних животных, в частности кошек и собак. Более подробно оно касается включения в пищевой рацион животных целебных количеств β-каротина.
Каротиноиды представляют собой растительные пигменты природного происхождения, которые абсорбируются разными видами животных в различной степени. К простым каротиноидам относят: β-каротин, ликопен, лютеин, зеаксантин и астаксантин. Эти каротиноиды (наиболее изученным из которых является β-каротин), как известно, играют важную роль в настройке иммунной системы и в улучшении здоровья определенных видов животных.
Известно, что β-каротин является предшественником витамина А и что он превращается в этот витамин под действием ферментов, присутствующих в организме некоторых животных (включая людей и собак). Однако у кошек такие ферменты отсутствуют, и они не способны преобразовывать β-каротин в витамин А.
Также известно, что β-каротин обладает потенциальной антиоксидантной активностью и способствует защите мембран и органелл клеток некоторых видов животных от вреда, причиняемого окислением. Однако для большей эффективности β-каротин должен присутствовать в наиболее ответственных органеллах клетки, таких, как митохондрия, ядро и плазматическая мембрана.
Предупреждение заболевания немаловажно как для человека, так и для домашних животных. Здоровая иммунная система играет важную роль и в предотвращении заболевания, и в борьбе с ним. Некоторые исследования сообщают о наличии в циркулирующей крови и органах собак β-каротина, количество которого было от низкого до не выявляемого. Кроме того, так как известно, что кошки неспособны преобразовывать β-каротин в витамин А, то их пищевой рацион не включает добавок β-каротина. Следовательно, остается необходимость в технологиях, способствующих оздоровлению иммунной системы домашних животных (таких, как собаки и кошки).
Известны кормовые витаминные добавки для животных, например в патенте Российской Федерации 2034497, Левицкий и др., заявлена кормовая витаминная добавка для сельскохозяйственных животных и птицы. Эта кормовая добавка на основе шлама кофейного сухого дополнительно содержит жирорастворимые витамины A, D, Е, В2, В3 и β-каротин. Используемая доза β-каротина может варьировать от 40 до 200 мг на 1 кг добавки. Добавка, заявленная в указанном патенте, повышает питательность корма и предназначена для использования в производстве продуктов для животноводства, например, для сельскохозяйственных животных и птицы. Эта кормовая добавка не предназначена для усиления иммунного ответа у домашнего животного, например собаки или кошки.
Известна также добавка к кукурузному корму для сельскохозяйственных животных и птицы (Патент Российской Федерации 2050145, Левицкий и др.). Указанная добавка на основе минеральных, витаминных и белковых компонентов содержит от 0,080 до 0,500 мас.% β-каротина. Эта добавка улучшает пищевой баланс кукурузной смеси. Почти так же как в вышеуказанном патенте РФ 2034497, изобретение, раскрываемое в патенте 2050145, предназначено для использования в производстве продуктов для животноводства, например для сельскохозяйственных животных и птицы.
Достигаемая задача указанного изобретения состоит в сбалансировании кукурузных кормов по аминокислотному составу, микро- и макроэлементам.
Это изобретение также не предназначено для повышения иммунитета домашнего животного, например собаки или кошки.
Кроме того, известна кормовая добавка "Элита" для домашних животных (Патент РФ 2070397). Указанная добавка состоит из белкового компонента, наполнителя, минерального компонента (микроэлементов), витаминов и вводится в пищевой рацион домашних животных. Указанная добавка содержит витамины А, Е, С, группы В, которые улучшают качество корма и способствуют повышению иммунитета у животных. Однако, указанная добавка не содержит дополнительного β-каротина и не может обеспечить достаточную степень повышения иммунитета животных для оздоровления иммунной системы у домашних животных (таких, как кошки и собаки).
В основу изобретения положена задача путем включения эффективного количества β-каротина в пищевой рацион домашних животных, в частности кошек и собак, разработать состав, который позволяет усилить иммунный ответ у домашних животных и улучшает состояние здоровья животных в целом.
Задача решена тем, что состав для усиления иммунного ответа у домашних животных, в частности кошек и собак, включающий пищевой рацион, содержащий источник белков, источник жиров, источник пищевых волокон, согласно изобретению, содержит от 6 до 315 мг β-каротина на килограмм этого пищевого рациона.
Заявляемый состав предпочтительно включает пищевой рацион, содержащий 30 мас.% неочищенного белка, 20 мас.% жира и 10 мас.% пищевых волокон.
Пищевой рацион включает от 6 до 315 мг β-каротина на 1 кг пищевого рациона. Такой пищевой рацион обеспечивает достаточное количество абсорбируемого животными β-каротина и поступление его в кровь, в лейкоциты и нейтрофилы крови этих животных.
Таким образом, настоящее изобретение обеспечивает процесс усиления иммунного ответа и улучшения в целом состояния здоровья домашних животных (таких, как кошки и собаки) путем введения эффективного количества β-каротина в их пищевой рацион.
Это, а также и другие характеристики и преимущества настоящего изобретения, будут разъяснены дальнейшим детальным описанием изобретения и прилагаемыми чертежами, на которых:
Фиг. 1 иллюстрирует собой график концентрации β-каротина в плазме крови собак (мкг/л) от времени, прошедшего после получения ими орально однократной дозы β-каротина.
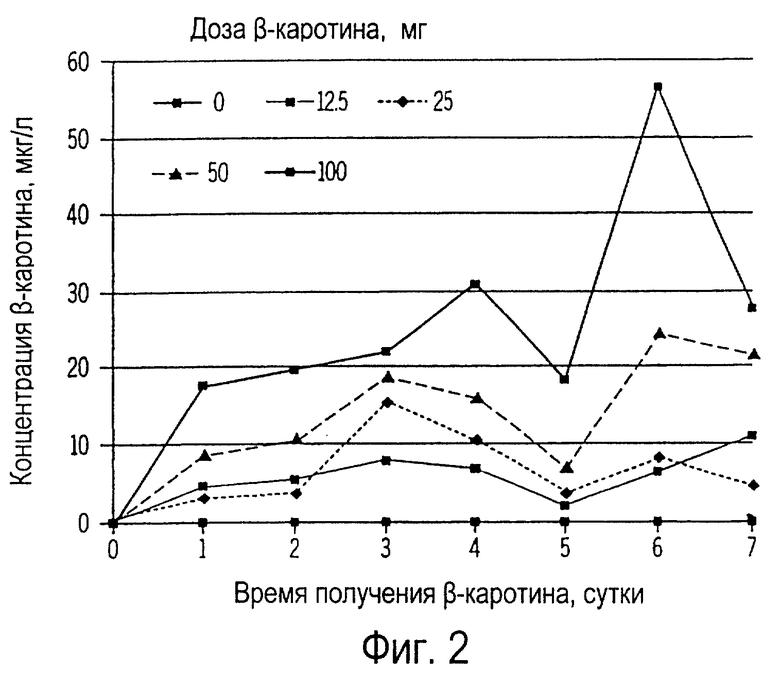
Фиг. 2 иллюстрирует собой график концентрации β-каротина в плазме крови собак (мкг/л) от времени, прошедшего после получения ими повторных доз β-каротина.
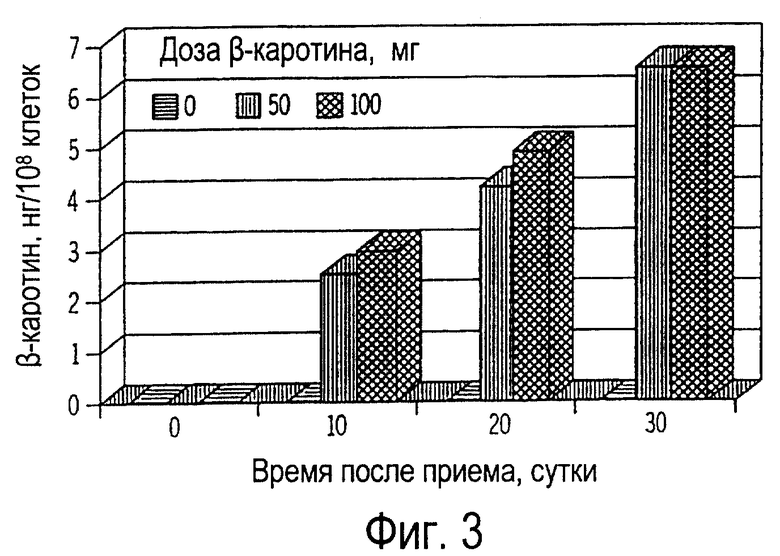
Фиг. 3 иллюстрирует собой график всасывания пищевого β-каротина лимфоцитами крови (нг/108 клеток) собак от времени получения ими β-каротина ежедневно в течение 30 дней.
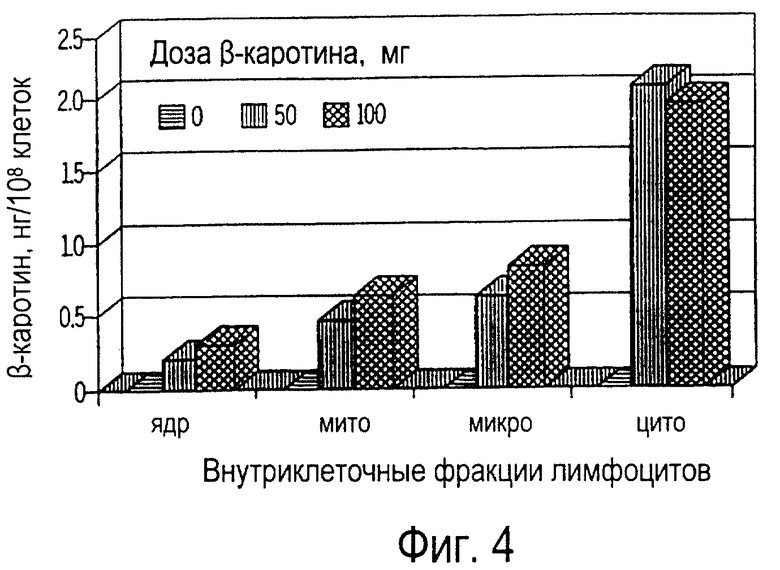
Фиг. 4 иллюстрирует собой график всасывания пищевого β-каротина ядрами, митохондриями, микросомами и цитозолями лимфоцитов крови (нг/108 клеток) собак от времени получения ими β-каротина ежедневно в течение 30 дней.
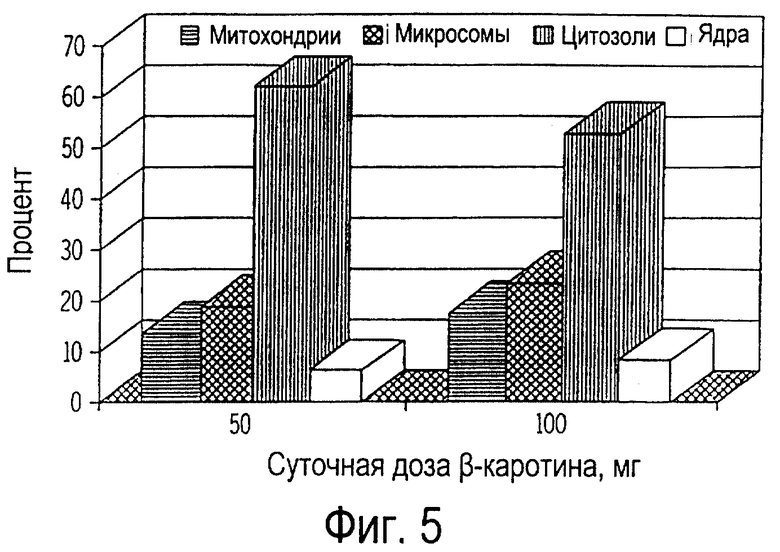
Фиг.5 иллюстрирует собой график относительного (%) всасывания β-каротина внутриклеточными фракциями лимфоцитов (митохондриями, микросомами, цитозолями и ядрами) собак, получавших ежедневно β-каротин на протяжении 30 дней.
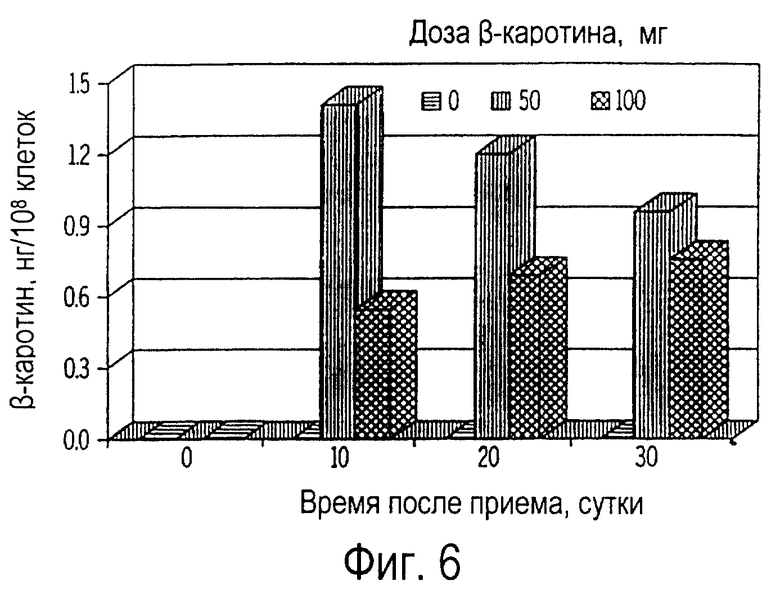
Фиг. 6 иллюстрирует собой график всасывания пищевого β-каротина нейтрофилами крови (нг/108 клеток) собак, получавших ежедневно β-каротин на протяжении 30 дней.
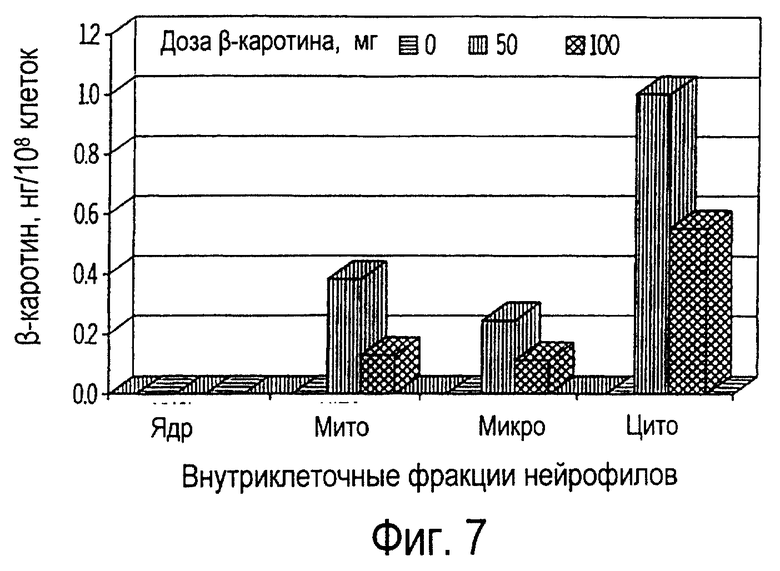
Фиг. 7 иллюстрирует собой график всасывания пищевого β-каротина ядрами (ядр), митохондриями (мито), микросомами (микро) и цитозолями (цито) нейтрофилов крови собак, получавших ежедневно β-каротин на протяжении 30 дней.
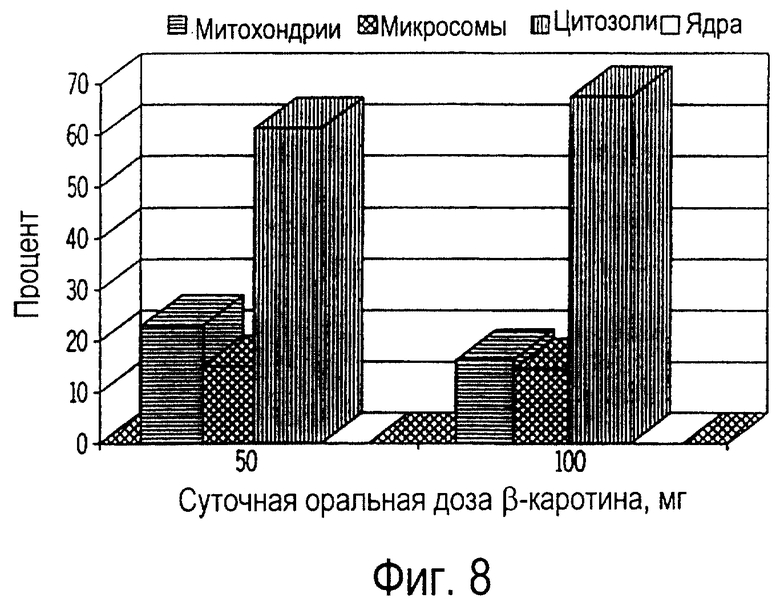
Фиг. 8 иллюстрирует собой график относительного (%) всасывания пищевого β-каротина ядрами (ядр), митохондриями (мито), микросомами (микро) и цитозолями (цито) нейтрофилов крови собак, получавших ежедневно β-каротин на протяжении 30 дней.
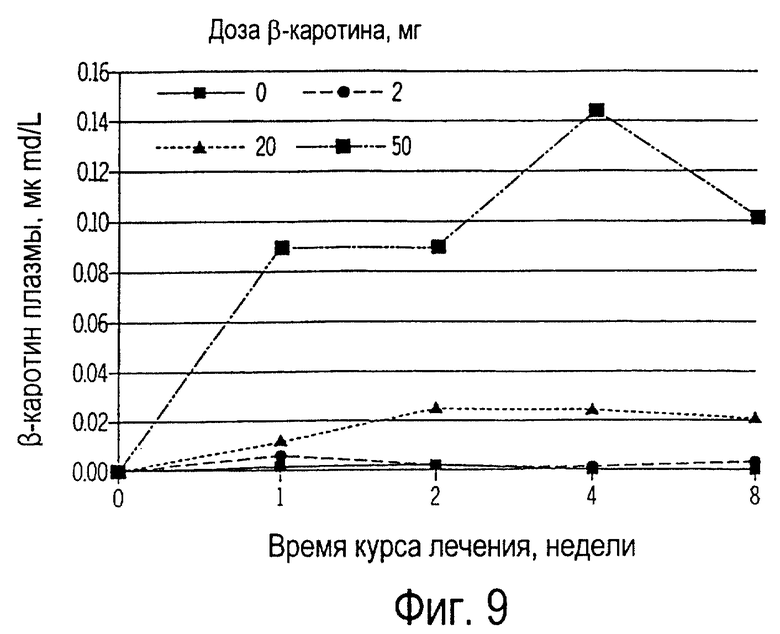
Фиг. 9 иллюстрирует собой график изменений концентраций β-каротина в плазме собак, получавших 0, 2, 20 или 50 мг β-каротина ежедневно на протяжении 8 недель.
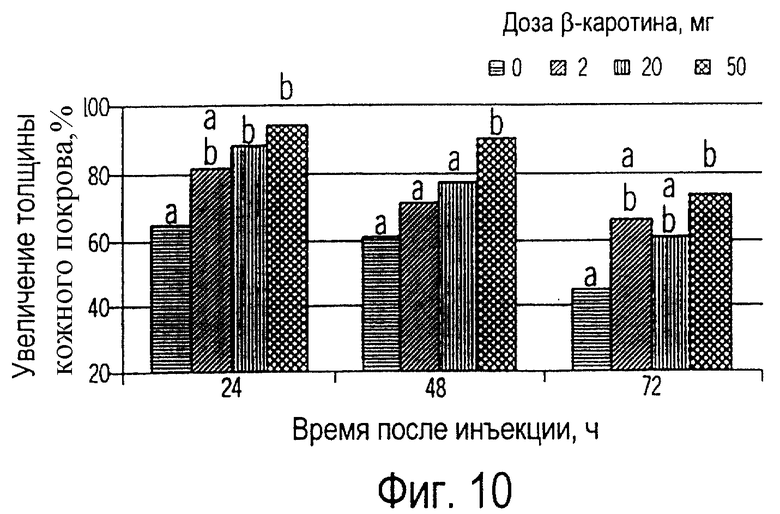
Фиг.10 иллюстрирует собой график аллергической реакции замедленного типа на фитогеммаглютинин у собак, получавших 0, 2, 20 или 50 мг β-каротина ежедневно на протяжении 7 недель.
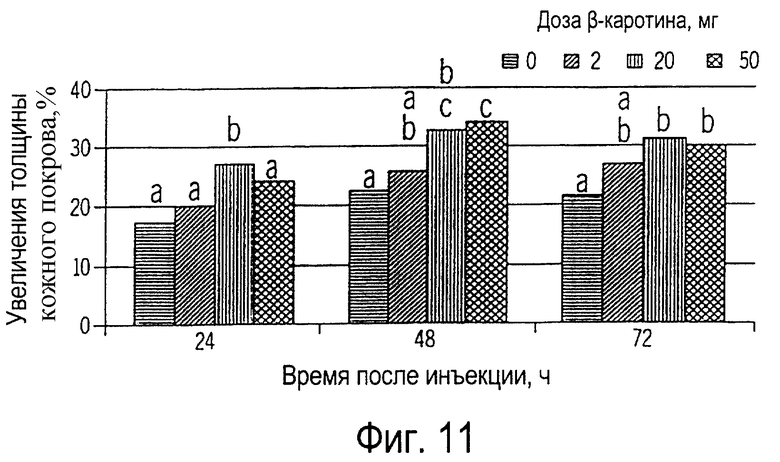
Фиг.11 иллюстрирует собой график аллергической реакции замедленного типа на вакцину у собак, получавших 0, 2, 20 или 50 мг β-каротина ежедневно на протяжении 8 недель.
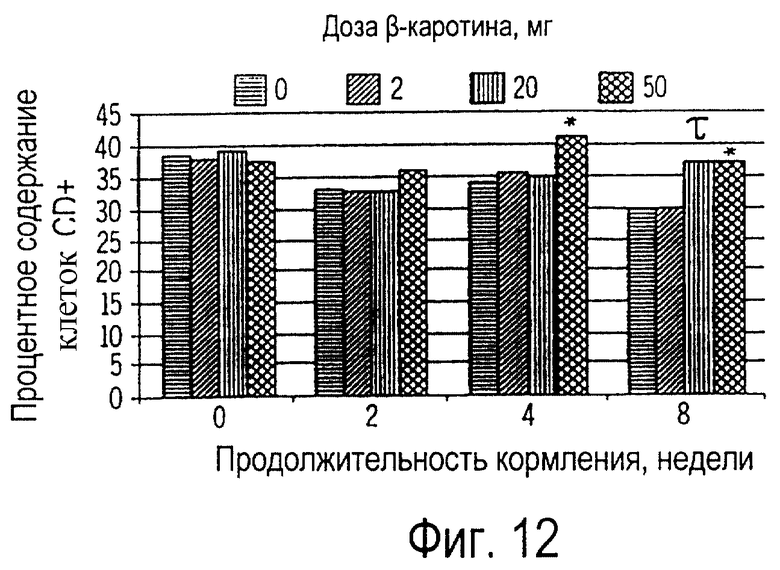
Фиг. 12 иллюстрирует собой график изменений в лимфоцитах подкласса CD4 у собак, получавших 0, 2, 20 или 50 мг β-каротина ежедневно на протяжении 8 недель.
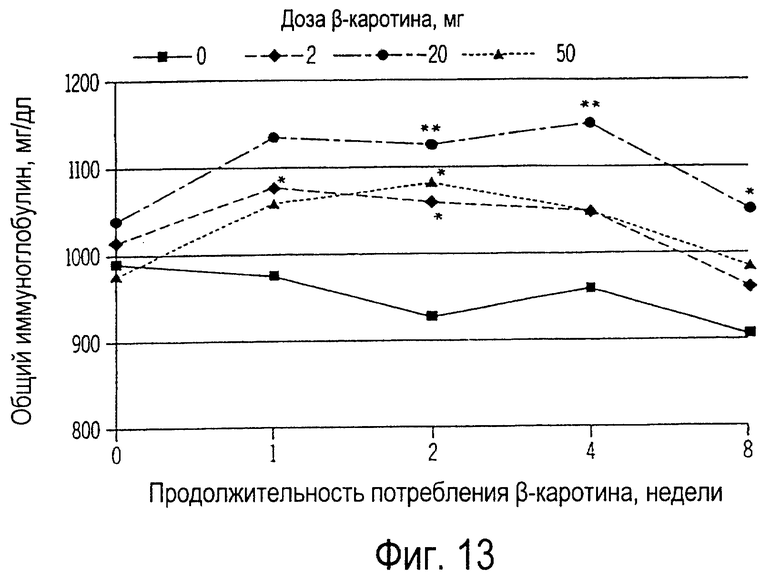
Фиг. 13 иллюстрирует собой график изменений общего иммуноглобулина в плазме собак, получавших ежедневно на протяжении 8 недель 0, 2, 20 или 50 мг β-каротина.
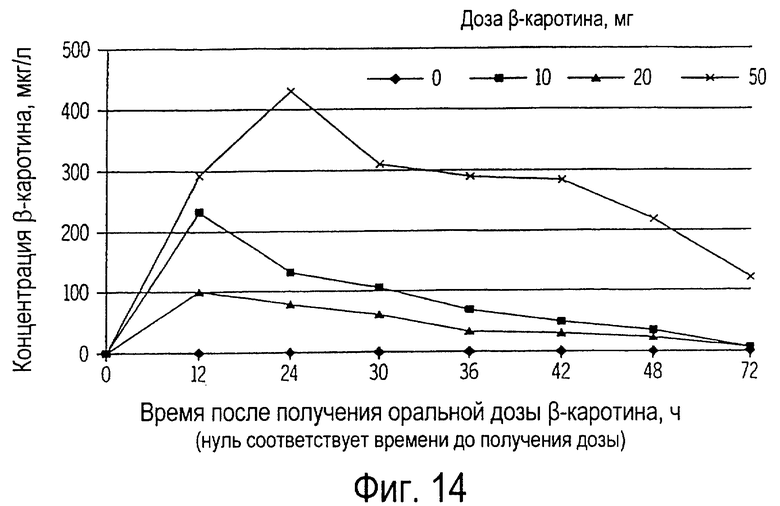
Фиг. 14 иллюстрирует собой график концентрации β-каротина в плазме крови кошек (мкг/л) от времени после получения ими орально однократной дозы β-каротина.
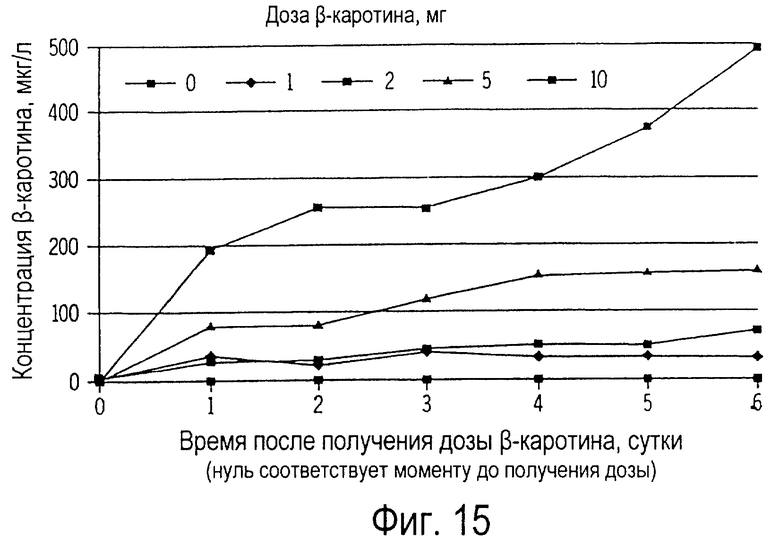
Фиг. 15 иллюстрирует собой график концентрации β-каротина в плазме крови кошек (мкг/л) от времени получения ими повторных доз β-каротина.
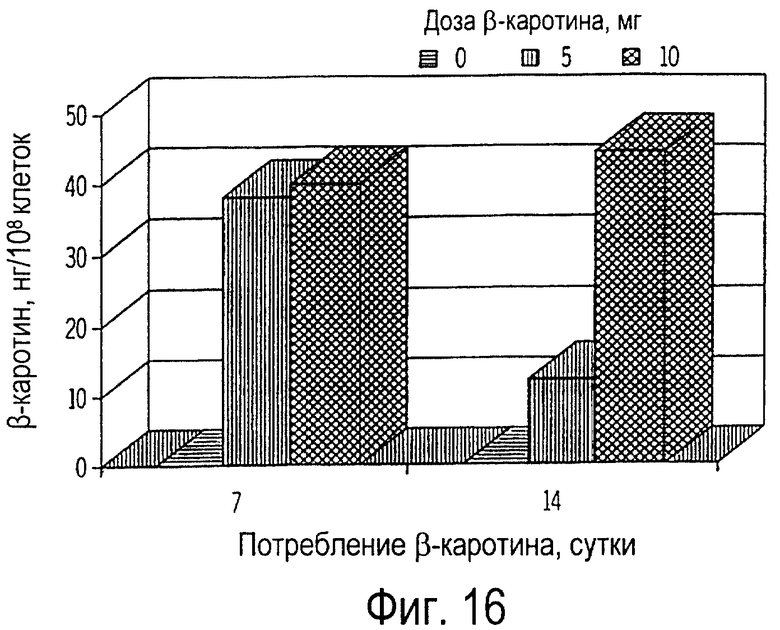
Фиг. 16 иллюстрирует собой график всасывания пищевого β-каротина лимфоцитами крови (нг/108 клеток) кошек от времени получения ими β-каротина ежедневно в течение 14 дней.
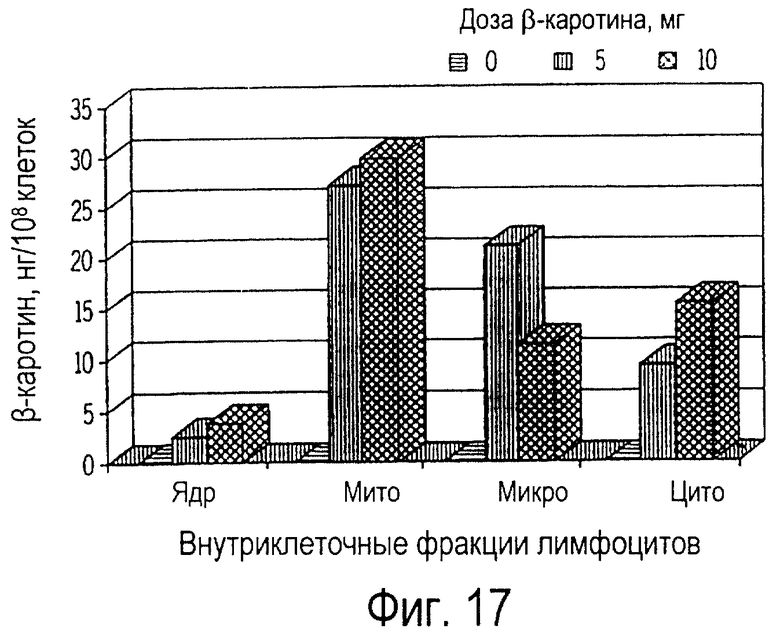
Фиг. 17 иллюстрирует собой график всасывания пищевого β-каротина ядрами (ядр), митохондриями (мито), микросомами (микро) и цитозолями (цито) лимфоцитов крови кошек, получавших ежедневно β-каротин в течение 7 дней.
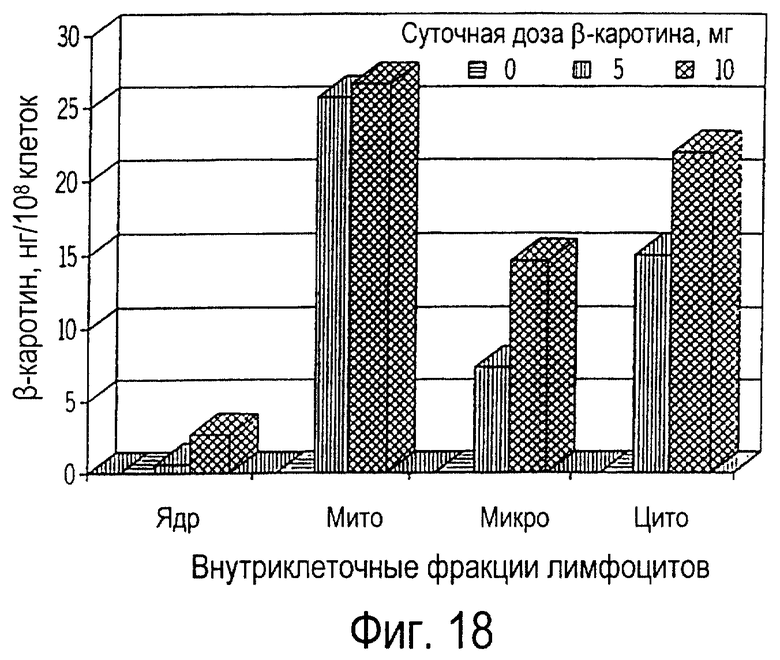
Фиг. 18 иллюстрирует собой график всасывания пищевого β-каротина ядрами (ядр), митохондриями (мито), микросомами (микро) и цитозолями (цито) лимфоцитов крови кошек, получавших ежедневно β-каротин на протяжении 14 дней.
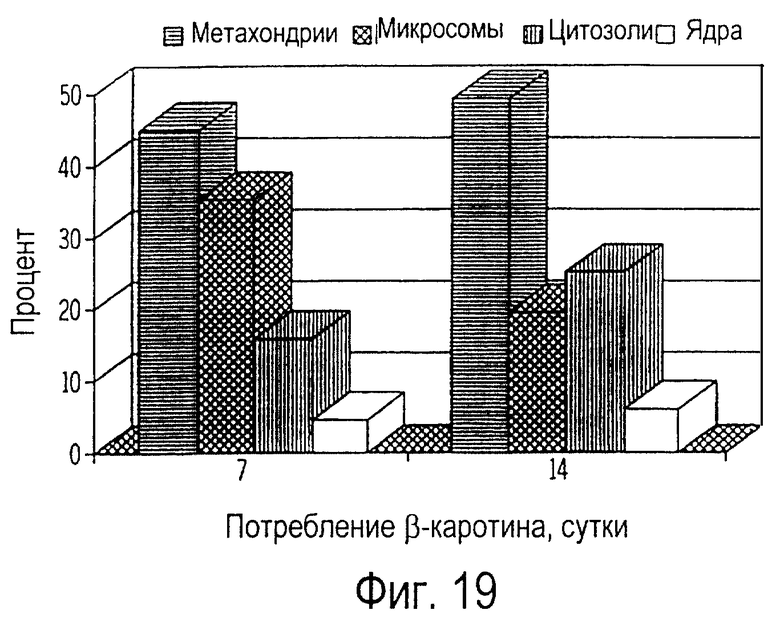
Фиг. 19 графически иллюстрирует изменения относительных (%) долей β-каротина во внутриклеточных фракциях лимфоцитов кошек, получавших ежедневно по 5 мг β-каротина в течение 7 и 14 дней; и
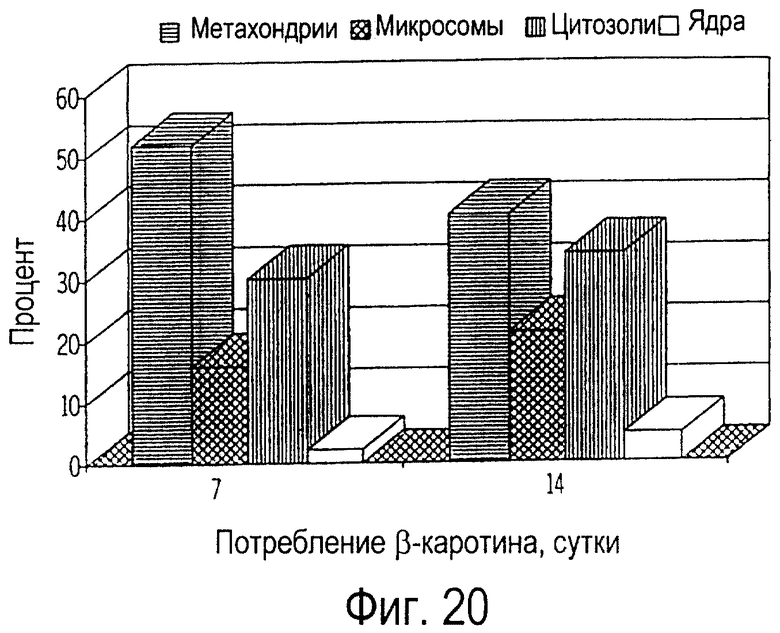
Фиг. 20 графически иллюстрирует изменения относительных (%) долей β-каротина во внутриклеточных фракциях (митохондриях, микросомах, цитозолях и ядрах) лимфоцитов кошек, получавших ежедневно по 10 мг β-каротина в течение 7 и 14 дней.
В настоящем изобретении используют кормовую смесь для домашних животных, содержащую в качестве добавки источник β-каротина, его количество составляет от 1 до 50 мг β-каротина в день (примерно от 6 мг до 315 мг β-каротина на 1 кг пищевого рациона). Такой пищевой рацион обеспечивает достаточное количество абсорбируемого животными β-каротина и поступление его в кровь, в лейкоциты и нейтрофилы крови. При этом было обнаружено, что как домашние собаки, так и кошки могут абсорбировать пищевой β-каротин. Более того, β-каротин в процессе кровообращения в значительной степени всасывается как лимфоцитами, так и нейтрофилами периферической крови этих животных, β-каротин распределяется также в разных внутриклеточных органеллах клетки. Как полагают, β-каротин, находящийся в разных органеллах лейкоцитов:
1) защищает эти клетки от действия свободных радикалов кислорода и/или
2) непосредственно регулирует внутриядерные превращения.
Таким образом, при кормлении собак и кошек эффективным количеством β-каротина обеспечивается поступление β-каротина в наиболее ответственные части клеток тканей организма этих животных, что может способствовать улучшению регулировки иммунных функций и улучшению общего состояния здоровья таких животных.
Указанная кормовая смесь для комнатных животных может представлять собой любой подходящий пищевой состав, который также обеспечивает адекватное питание этих животных. Например, типичный пищевой рацион собак, используемый в настоящем изобретении, может содержать примерно 30% неочищенных белков, примерно 20% жиров и примерно 10% пищевых волокон. Однако определенные пропорции или процентные соотношения между этими или другими нутриентами не являются необходимыми. β-каротин можно смешать с такой кормовой смесью для домашних животных, чтобы обеспечить их оптимальным количеством β-каротина.
В целях более ясного толкования настоящего изобретения приводятся следующие примеры, которые иллюстрируют настоящее изобретение, но не ограничивают границы его применения.
Пример 1.
Всасывание β-каротина в кровь собак после его однократной дозы
В примерах 1-3 были использованы самки гончих собак в возрасте от 18 до 19 месяцев и весом от 7 до 9 кг, их содержали на базовом пищевом рационе (The Iams Co., Lewisburg, ОН), который соответствует требованиям по всем основным нутриентам или даже превышает их. Животные содержались в терморегулируемом помещении при следующем световом режиме: 14 ч при освещении и 10 ч в темноте. Цель исследования состояла в изучении профиля всасывания β-каротина после перорального введения его однократной дозы.
Для того чтобы изучить усвоение β-каротина собаками, получавшими его однократную дозу пероральным введением, собакам (n=6/ курс лечения) однократно перорально давали 0, 50, 100 или 200 мг β-каротина (10%, растворимый в холодной воде, BASF, Copr. , Ludwigshafen, Germany). Соответствующую дозу β-каротина, растворенную в 5 мл воды, вводили перорально, используя дозировочный шприц. Чтобы установить подходящее время для отбора проб, в предварительном исследовании использовали двух собак. Этим собакам однократно вводили 50 мг β-каротина и их кровь проверяли через 0 (немедленно после введения β-каротина), 3, 6, 9, 12, 15, 18, 21 и 24 ч.
Плазму крови отделяли центрифугированием, а концентрацию β-каротина определяли методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Все манипуляции проводили при затемнении. Однотипные аликвоты плазмы, каждый лейкоцитарный гомогенат и каждую внутриклеточную фракцию экстрагировали смесью диэтилового эфира с петролейным эфиром в соотношении 1:1 и в присутствии 2,6-ди-трет-бутил-п-крезола. Эфирную фазу удалили и высушили в токе азота. Остаток перенесли в подвижную фазу для определения β-каротина с помощью ВЭЖХ. Образцы (50 мкл) впрыскивали в сферическую С-18 5 мкм колонку с обращенной фазой (3,9•150 мм; Resolve) и экстрагировали смесью ацетонитрила, метанола и хлороформа (47:47:6 по объему) при ее расходе 1,0 мл/мин.
Результаты этого примера проиллюстрированы на фиг.1, и они показывают, что пик концентрации β-каротина находится в интервале между 3 и 6 ч после введения дозы β-каротина и что концентрация становится неопределяемой через 24 ч после введения. Потом в эти же периоды времени проводили отбор проб крови у остальных собак. Плазму крови отделяли аналогично и анализировали ее с помощью ВЭЖХ.
Концентрация β-каротина в плазме крови была не выявляемой у собак, которым не вводили пищевые добавки на протяжении всего времени исследования. Наоборот, у собак, получивших перорально дозу β-каротина, в плазме крови наблюдалось увеличение концентрации β-каротина (фиг.1) в зависимости от введенной дозы (Р<0,01). Пик концентрации наблюдался через 6 ч после введения дозы, и он оставался стойким во всех группах. После этого наблюдалось быстрое уменьшение концентрации (Р<0,01) β-каротина в плазме крови всех собак, получавших пищевую добавку; концентрация становилась неопределяемой через 24 ч. Период полураспада β-каротина в плазме крови приблизительно составлял от 3 ч (при дозе от 50 до 100 мг) до 4 ч (при дозе 100 мг). Пик концентрации β-каротина в плазме крови собак наблюдался раньше, чем у кошек (см. ниже примеры 4 и 5). Кроме того, концентрация β-каротина в плазме крови собак была приблизительно в 10-16 раз ниже, чем концентрация, наблюдаемая у кошек, с учетом разницы в их весе.
Пример 2.
Всасывание β-каротина в кровь собак после его повторных доз
В этом примере собакам (n=6/ курс лечения) ежедневно в 8.00 часов последовательно в течение 7 дней вводили 0; 12,5; 25; 50 или 100 мг β-каротина. Этот β-каротин был подкормкой к основному рациону, и его давали с утренней порцией еды. Кровь отбирали на проверку однократно и ежедневно: в 0 день (непосредственно перед первой дозой), а затем по истечении 6 ч после каждой дозы (с первого по седьмой день). Время отбора проб крови было выбрано на основе результатов, полученных в примере 1, где показано наличие пика концентрации β-каротина через 6 ч после приема. Плазму отделяли и анализировали на содержание β-каротина.
Ежедневное введение собакам β-каротина в течение 7 дней вызывало зависимое от дозы увеличение (Р<0,01) циркулирующего β-каротина, что проиллюстрировано на фиг.2. У собак, получавших 100 мг β-каротина, выявлено наиболее быстрое увеличение суточной концентрации β-каротина в плазме крови. Пик концентрации (18 мкг/л) β-каротина в плазме крови собак, получивших 100 мг β-каротина в первый день, в настоящем примере аналогичен пику, наблюдаемому в примере 1 (фиг.1). Концентрация β-каротина в плазме крови после последней дозы обычно была в 2,5-4 раза выше, чем та, которая наблюдалась после первой дозы.
Результаты этого примера позволяют предположить, что собаки могут получать β-каротин из своего пищевого рациона. Эти данные опровергают более ранние исследования, в которых сообщалось о наличии небольшого количества β-каротина (если он вообще имеется) в крови, печени и молоке собак. Однако в других исследованиях сообщалось о присутствии β-каротина в крови собак при его концентрации от низкой до умеренной.
Пример 3.
Всасывание β-каротина лейкоцитами крови собак
Этот пример предполагал исследование всасывания β-каротина лимфоцитами крови собак. Собакам (n=8/ курс лечения) вводили 0, 50 или 100 мг β-каротина ежедневно, в течение 30 дней. Отбор крови проводили у всех собак через яремную вену на 10, 20 и 30 день. Лимфоциты и нейтрофилы крови отделяли центрифугированием в градиенте плотности. Подсчитали число клеток. Лимфоциты и нейтрофилы повторно суспендировали в фосфатно-солевом буфере, содержащем 3% аскорбат натрия в качестве антиоксиданта. Аликвоту клеточной суспензии обрабатывали ультразвуком в течение 30 с до разрушения клеток. Гомогенаты лейкоцитов экстрагировали для проведения анализа на β-каротин методом ВЭЖХ.
На 30 день отобрали большую аликвоту крови и, как описано выше, приготовили суспензию лейкоцитов для ее последующего внутриклеточного фракционирования. Клетки разрушили, обрабатывая их ультразвуком в течение 20 с в 5 объемах 0,25 М сахарозы. В качестве антиоксиданта добавили аскорбат натрия. Полученный гомогенат центрифугировали (600 g в течение 10 мин при 4oС), в результате чего ядро отделили от супернатанта. Супернатант, полученный после отделения ядра, центрифугируют (17300g в течение 20 мин при 4oС), чтобы отделить фракцию митохондрий. Супернатант, полученный после отделения митохондрий, центрифугируют (102000 g в течение 60 мин при 4oС), чтобы разделить фракцию микросом от цитозольной фракции. В каждой внутриклеточной фракции методом ВЭЖХ определяли содержание β-каротина.
На 0 день (до приема добавки β-каротина) концентрация β-каротина в лимфоцитах периферической крови была не выявляемой у всех собак, что показано на фиг.3. Уровень β-каротина в лимфоцитах собак, не получавших эту пищевую добавку, оставался не выявляемым на протяжении всего времени исследования. Напротив, концентрация β-каротина в лимфоцитах собак, получавших β-каротин, обычно возрастал (Р<0,01) со временем приема. Концентрации β-каротина в лимфоцитах собак, получавших 50 мг β-каротина и 100 мг β-каротина, не привели к значительной разнице лечебного воздействия. Концентрация β-каротина в лейкоцитах собак в этом примере была в 20-30 раз ниже, чем у кошек (см. ниже примеры 4 и 5).
Фиг. 4-8 иллюстрируют всасывание β-каротина внутриклеточными фракциями лимфоцитов и нейтрофилов. β-каротин не выявлялся в различных внутриклеточных фракциях лимфоцитов собак, не получавших пищевую добавку (фиг.4). Напротив, β-каротин всасывали все внутриклеточные фракции лимфоцитов крови, выделенной у собак, получавших β-каротин как добавку к рациону. Количество β-каротина во фракции цитозолей составило от 52 до 62% от его общего содержания в лимфоцитах (фиг. 5), в то время как наименьшее количество β-каротина (от 6 до 8%) от его общего содержания находилось в ядрах. Содержание β-каротина в митохондриях (от 14 до 17%) и микросомах (от 16 до 23%) являлось промежуточным между содержанием в цитозолях и ядрах клеток. Доза пищевого β-каротина на 30 день приема β-каротина не оказывала существенного влияния на его всасывание внутриклеточными фракциями. Результаты исследования показали, что β-каротин всасывался всеми внутриклеточными фракциями. Однако наибольшее содержание β-каротина у собак было замечено в цитозолях, а у кошек - в митохондриях (см. ниже примеры 4-6). Кроме того, концентрация β-каротина во всех внутриклеточных фракциях лимфоцитов собак была значительно ниже, чем аналогичная концентрация у кошек (см. ниже примеры 4-6).
Нейтрофилы крови, так же, как и лимфоциты, поглощают β-каротин (фиг.6). Однако, в отличие от лимфоцитов, максимальное поглощение нейтрофилами происходило на 10 день, причем на 30 день не происходило дальнейшего повышения концентрации β-каротина. Цитозоли, митохондрии и микросомы нейтрофилов крови также продемонстрировали значительное всасывание β-каротина (фиг.7). Напротив, в ядрах β-каротин не был обнаружен. Так же, как и в случае внутриклеточных фракций лимфоцитов, наибольшее количество β-каротина (61-68%) обнаружили в цитозольной фракции нейтрофилов крови (фиг.8). Не было выявлено никакого существенного влияния дозы β-каротина.
Результаты показали, что собаки способны абсорбировать пищевой β-каротин. Этот результат представляется неожиданным, поскольку более ранние исследования выявили лишь ничтожное количество β-каротина в печени и молоке собак, а в крови количество β-каротина было только от следового до умеренного. Более того, обнаружили, что в процессе кровообращения β-каротин в значительной степени поглощается как лимфоцитами, так и нейтрофилами крови собак, β-каротин распределяется по различным внутриклеточным органеллам. β-каротин, находящийся в разных органеллах лейкоцита, как полагают, должен: 1) защищать эти клетки от действия свободных радикалов кислорода и/или 2) непосредственно регулировать внутриядерные превращения. Таким образом, введение собакам эффективного количества β-каротина, приводящее к наличию β-каротина в ответственных участках клеток тканей их организма, обеспечивает улучшение состояния здоровья этих животных.
Пример 4.
Влияние пищевого β-каротина на иммунный ответ у собак.
Для изучения роли пищевого β-каротина в повышении клеточного и гуморального иммунных статусов собак, самкам гончих (в возрасте от 4 до 5 месяцев) ежедневно добавляли в рацион 0, 25, 50 или 100 мг β-каротина. У всех животных или в лимфоцитах их периферической крови оценивали следующие параметры: (1) аллергическую реакцию замедленного типа (АРЗТ) на фитогемагглютинин (неспецифический иммунитет) и вакцину (специфический иммунитет), (2) пролиферацию лимфоцитов, (3) содержание лимфоцитов и (4) иммуноглобулины (Иг).
Как показано на фиг.9, добавка к рациону β-каротина увеличивала его концентрацию в плазме в зависимости от применяемой дозы, но не оказывала влияния на концентрацию в плазме ретинола или αтокоферола. Эти изменения обычно отражают аллергическую реакцию замедленного типа как на специфические антитела (вакцина), так и на неспецифические (фитогемагглютинин, ФГА); это показано на фиг.10 и 11 соответственно. Наибольший иммунный ответ на ФГА наблюдался у собак, получивших 50 мг β-каротина, в то время как у собак, получивших 20 или 50 мг β-каротина, АРЗТ была более сильной на вакцину. Аллергическая реакция замедленного типа является строго клеточной реакцией, в которую вовлечены Т-лимфоциты и макрофаги и не вовлечены антитела. Клетки, представляющие антиген (например, макрофаги), являются антигеном или аллергеном по отношению к Т-лимфоцитам, которые, активируясь, высвобождают лимфокины (медиаторы клеточного иммунитета). Эти лимфокины активизируют макрофаги и делают их "беспощадными киллерами" чужеродных веществ. Таким образом, приведенные данные свидетельствуют, что у собак, получавших β-каротин, усиливается реакция клеточного иммунитета.
Потребление β-каротина приводит также к существенным изменениям в подгруппах лимфоцитов. По сравнению с контрольными, у собак, получавших 20 или 50 мг β-каротина, через 8 недель наблюдалось повышенное содержание клеток CD4+; это показано на фиг.12. Повышенное содержание клеток CD8 наблюдалось также через 2 и 4 недели у собак, получавших 20 мг β-каротина. Т-лимфоциты можно классифицировать по их экспрессии сквозь молекулярную мембрану CD4. Функции клеток CD4 состоят в соединении молекул и в действии как ко-сигнальный ко-рецептор. Это играет роль при активации Т-лимфоцитов. Т-лимфоциты клеток CD4+ распознают антиген вместе с классом II молекул тяжелых цепей и в значительной степени действуют как "клетки-помощницы". В нашем случае именно ростом числа Т клеток-помощниц можно объяснить соответствующее увеличение АЗТ у собак, получавших 20-50 мг β-каротина.
Концентрации иммуноглобулина IgG, иммуноглобулина IgM и общего иммуноглобулина у собак, получавших β-каротин, существенно возрастают уже спустя 1 неделю после его применения в качестве пищевой добавки. У собак, получавших от 0 до 20 мг β-каротина, прирост иммуноглобулинов зависит от применяемой дозировки препарата. Самый высокий уровень β-каротина (50 мг) не вызывает дальнейший прирост иммуноглобулинов. Собаки, получавшие последовательно по 20 мг β-каротина, обладали
самой высокой чувствительностью антител обоих иммуноглобулинов. Одной из главных функций иммунной системы является выработка свободно циркулирующих антител, предназначенных для защиты организма от чужеродных веществ. Антитела служат для нейтрализации токсинов, иммобилизации некоторых микроорганизмов, нейтрализации вирусной активности, агглютинации микроорганизмов или частиц антигена и для преципитации растворимых антигенов.
Потребление β-каротина не влияет на индуцируемый митогеном бластогенез лимфоцитов и на выработку IL-2. Лимфоциты вовлекаются в клеточный иммунитет. Распознав антиген, лимфоциты должны быстро делиться, и при этом образуют клон таких же клеток, представляющих собой средство для борьбы с потенциальной инвазией. При гуморальном иммунном ответе, в качестве реакции на антигены, IL-2 стимулирует пролиферацию как Т "клеток-помощниц", так и В-клеток. Это необходимо для распространения клона антиген- или митоген-активированных Т-клеток. При клеточном иммунном ответе IL-2 активирует собственные "клетки-киллеры", стимулирует пролиферацию тимоцитов и индуцирует цитотоксическую активность Т-лимфоцитов. Удивительно, что потребление β-каротина не оказало влияния на оба эти иммунные параметры, в то время как на другие параметры такое воздействие наблюдалось.
На основании результатов этих экспериментов можно сказать, что значительное количество β-каротина собаки получают из рациона питания и передают этот β-каротин во внутриклеточные органеллы иммунокомпетентных клеток и фагоцитов. В этих клетках, как оказалось, β-каротин активирует иммунную систему собаки за счет усиления клеточных иммунных реакций (аллергическая реакция замедленного типа, сдвиг в подгруппе лимфоцитов) и гуморальных реакций (выработка IgG и IgM иммуноглобулинов). Таким образом, добавка пищевого β-каротина в рацион способствует оздоровлению иммунной системы собак, которое, по-видимому, приводит к улучшению их состояния здоровья в целом.
Пример 5.
Всасывание β-каротина в кровь кошек после его однократной дозы.
В примерах 4-6 использовались взрослые короткошерстные полосатые кошки (в возрасте от 7 до 8 месяцев и весом от 1,5 до 2.0 кг), которые получали базовый пищевой рацион (The Iams Co., Lewisburg, ОН), соответствующий требованиям по всем основным нутриентам или даже превышающий их. Животные размещались группами в помещении, при контролируемом световом и температурном режиме. Исследовался профиль всасывания β-каротина после перорального введения его однократной дозы.
Для того чтобы изучить всасывание β-каротина кошками при пероральном введении его однократной дозы, кошкам (n=6/ курс лечения) однократно перорально давали 0, 10, 20 или 50 мг β-каротина (10%, растворенный в холодной воде, BASF, Copr., Ludwigshafen, Germany). Соответствующую дозу β-каротина растворяли в 0,6 мл воды и вводили перорально, используя дозировочный шприц. Для того чтобы установить подходящее для отбора проб время, в предварительном исследовании использовали двух кошек. Этим кошкам однократно вводили 50 мг β-каротина, а пробы крови проводили через 0 (немедленно после введения β-каротина), 3, 6, 10, 16, 24, 30 и 36 ч.
Плазму крови отделяли центрифугированием, и концентрация β-каротина в ней определялась методом ВЭЖХ, как было описано выше. Результаты этого примера проиллюстрированы на фиг. 14, и они показывают, что пик концентрации β-каротина обычно приходится на время между 10 и 16 ч после введения дозы β-каротина. Потом делали отбор проб крови у оставшихся кошек через 0, 12, 24, 30, 36, 42, 48 и 72 ч после приема β-каротина. Плазму их крови отделяли и анализировали аналогично.
Концентрация β-каротина в плазме крови кошек, не получавших пищевые добавки на протяжении всего времени исследования, оказалась не выявляемой. Напротив, в плазме крови кошек, получивших перорально дозу β-каротина, наблюдалось увеличение его концентрации (Р<0,01), в зависимости от введенной дозы (фиг. 14). Концентрация была наиболее высокой (Р<0,01) у кошек, получивших 50 мг β-каротина. Концентрация β-каротина в плазме кошек, получивших 10 или 20 мг β-каротина, была одинаковой (Р>0,01). Пик концентрации β-каротина после введения 10 или 20 мг его был обнаружен у кошек спустя 12 ч, в то время как у кошек, получивших 50 мг β-каротина, пик концентрации наблюдался спустя 24 ч. Потом, к 72 ч после приема β-каротина, его концентрации уменьшались (Р<0,01) до не выявляемых уровней (у группы кошек, получавших 10 и 20 мг) у всех животных, получивших добавку β-каротина. Однако у кошек, получивших 50 мг β-каротина, и через 72 ч после приема β-каротина в плазме крови все еще выявлялся (выше 100 мкг/мл). В группе кошек, получивших 10 или 20 мг, период полураспада β-каротина в плазме крови составлял приблизительно от 12 до 18 ч, а у кошек, получивших 50 мг β-каротина, - около 24 ч.
Пример 6.
Всасывание β-каротина в кровь кошек при его повторных дозах.
В данном примере кошкам (n=6/курс лечения) в 8.00 часов вводили ежедневно последовательно в течение 6 дней 0, 1, 2, 5 или 10 мг β-каротина. Отбор проб крови проводили ежедневно: в 0 день (непосредственно перед первой дозой), а затем, с первого по шестой день, - спустя 12 ч после каждой дозы. Выбор времени для отбора проб крови основывался на результатах, полученных в примере 5. Плазму отделяли и анализировали на содержание β-каротина.
Ежедневное введение кошкам дозы β-каротина в течение 6 дней вызвало зависимое от дозы увеличение (Р<0,01) циркулирующего β-каротина, что проиллюстрировано на фиг.15. У кошек, которым вводили 10 мг β-каротина, обнаружено наиболее резкое увеличение суточной концентрации β-каротина в плазме крови. В этом примере концентрация β-каротина в плазме крови спустя 12 ч после введения первой дозы (192±58 мкг/л) была такой же, как наблюдаемая в примере 5 (230±26 мкг/л; см. фиг. 14). Концентрация β-каротина в плазме крови после последней дозы обычно была в 1,5-2 раза выше, чем та, которая наблюдалась после одной дозы.
Опираясь на результаты этого примера, можно сказать, что прирост концентрации β-каротина может продолжаться при дальнейшем введении добавки. Результаты этого примера означают, что домашние кошки легко могут абсорбировать пищевой β-каротин. Это открытие противоречит предыдущим исследованиям, в которых указывалось, что кошки не способны усваивать оральный β-каротин. У кошек отсутствуют кишечные ферменты, необходимые для превращения β-каротина в витамин А. Это предположение было выдвинуто рядом исследователей для объяснения высоких концентраций β-каротина в общем кровотоке. Однако весьма маловероятно, чтобы это физиологическое различие имело непосредственное отношение к способности кошек усваивать β-каротин, так как несмотря на то, что свиньи и грызуны обладают кишечными ферментами, расщепляющими β-каротин, концентрация β-каротина у них очень низкая. Поэтому более вероятно, что выявленная в этом примере способность кошек усваивать пищевой β-каротин объясняется наличием у них механизма транспортировки β-каротина к слизистой кишечника.
Пример 7.
Всасывание β-каротина лимфоцитами периферической крови кошек.
В этом примере исследовалось всасывание β-каротина лимфоцитами крови кошек. Кошкам (n=8/ курс лечения) ежедневно, в течение 14 дней вводили 0, 5 или 10 мг β-каротина. Отбор проб крови у животных, получивших седативное средство (10 мг кетамина и 0,1 мг ацепромазина на 1 кг веса тела) производили на 7 и 14 день; для этого использовали специальное устройство сбора крови (Becton Dickenson, Franklin Lakes, NJ). Лейкоциты и нейтрофилы крови отделяли центрифугированием в градиенте плотности и подсчитывали количество клеток. Лейкоциты и нейтрофилы повторно суспендировали в солевом фосфатном буфере, содержащем 3% аскорбата натрия в качестве антиоксиданта. Аликвоту клеточной суспензии обрабатывали ультразвуком в течение 30 с до разрушения клеток. Гомогенат лимфоцитов экстрагировали, чтобы провести анализ на β-каротин методом ВЭЖХ. Адекватное количество нейтрофилов получить не удалось, поэтому данные о количественной оценке всасывания β-каротина циркулирующими нейтрофилами крови отсутствуют.
Большую аликвоту крови использовали для получения внутриклеточных фракций лимфоцитов. Лимфоциты разрушали обработкой ультразвуком в течение 20 с в 5 объемах 0,25 М сахарозы. В качестве антиоксиданта добавили аскорбат натрия. Полученный гомогенат центрифугировали (600 g в течение 10 мин при 4oС), и неочищенный осадок, содержащий ядро клеток, отделяли от супернатанта. Супернатант, полученный после отделения ядер, центрифугировали, чтобы отделить фракцию митохондрий (17300 g в течение 20 мин при 4oС). Полученный в результате этого супернатант с отделенными митохондриями центрифугировали (102000 g в течение 60 мин при 4oС), чтобы разделить фракции микросом и цитозолей. Каждая внутриклеточная фракция была проанализирована с помощью ВЭЖХ на содержание в ней β-каротина.
На 0 день (до приема добавки β-каротина) у всех кошек концентрация β-каротина в лейкоцитах периферической крови была невыявляемой (фиг.16). На 7-й день было выявлено значительное всасывание (Р<0,01) β-каротина лимфоцитами крови, причем на 14-й день не было обнаружено дополнительного прироста. В лимфоцитах кошек, получавших 10 мг добавку β-каротина, не было обнаружено более высокого накопления β-каротина. Таким образом, при пероральном введении 5 мг β-каротина или его меньшей дозы максимальное всасывание пищевого β-каротина происходит на 7-й день.
При внутриклеточном фракционировании лимфоцитов периферической крови было обнаружено, что β-каротин накапливается во всех клеточных фракциях, что проиллюстрировано на фиг. 17 и фиг.18. Концентрация β-каротина была самой высокой в митохондриях (от 40 до 52%), средней в микросомах (от 20 до 35%) и в цитозолях (от 15 до 34%), а наиболее низкая - в ядрах (от 1,5 до 6%), как это иллюстрируется на фиг.19 и 20. Относительные профили β-каротина во внутриклеточных фракциях лимфоцитов обычно не зависят от лечебной дозы или от длительности получения пищевой добавки. Однако всасывание β-каротина ядрами лимфоцитов кошек, получавших добавку β-каротина, оставалось существенным по сравнению с контрольной группой, не получавшей добавку. У кошек, получавших 10 мг β-каротина, не наблюдалась более высокая концентрация β-каротина (фиг. 20) по сравнению с кошками, получавшими 5 мг (фиг.19). Кроме того, на 14-й день не было обнаружено дополнительного накопления β-каротина во всех фракциях (фиг.18) по сравнению с состоянием на 7-й день (фиг.17).
Эти результаты в целом согласуются с данными по лимфоцитам (фиг.16), согласно которым максимальное всасывание происходит на 7-й день после получения β-каротина, и 5 мг доза β-каротина при пероральном введении достаточна, чтобы вызвать его максимальное всасывание лимфоцитами. В этом примере максимальное всасывание β-каротина лимфоцитами кошек также наблюдалось на 7-й день, и самая высокая доля общего β-каротина также содержалась в митохондриях.
Полученные результаты показали, что домашние полосатые кошки способны абсорбировать пищевой β-каротин. Более того, циркулирующий β-каротин в значительной степени поглощается лимфоцитами периферической крови и распределяется в разных внутриклеточных органеллах, особенно в митохондриях. β-каротин, находящийся в разных органеллах лимфоцитов, как полагают: 1) защищает эти клетки от действия свободных радикалов кислорода и/или 2) непосредственно регулирует внутриядерные превращения. Таким образом, введение домашним кошкам эффективного количества β-каротина обеспечивает его поступление в наиболее важные части клеток тканей этих животных, в результате чего возможно усиление иммунной функции и улучшение общего состояния здоровья у таких кошек.
Несмотря на то, что некоторые воплощения и детали приведены в целях иллюстрации настоящего изобретение, для людей, квалифицированных в этой области, очевидно, что, не выходя за рамки настоящего изобретения (сущность которого определена прилагаемыми пунктами патентной формулы), возможны замены описанных здесь методики и приборов.
Состав для усиления иммунного ответа у домашних животных, в частности кошек и собак, включающий пищевой рацион, содержащий источник белков, источник жиров, источник пищевых волокон, содержит от 6 до 315 мг β-каротина на килограмм этого пищевого рациона. Такой пищевой рацион обеспечивает достаточное количество абсорбируемого животными β-каротина и поступление его в кровь животных, в лейкоциты и нейтрофилы крови, что способствует усилению иммунного ответа и улучшению общего состояния здоровья этих животных. 1 з.п. ф-лы, 20 ил.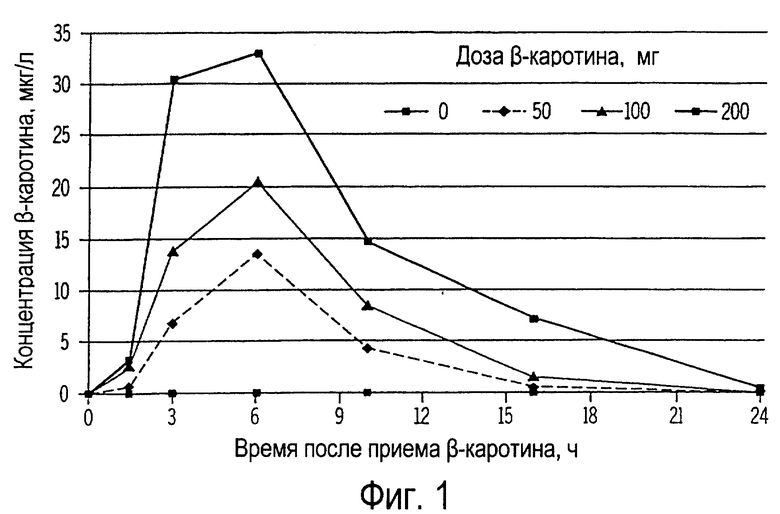
| СПОСОБ ПРИГОТОВЛЕНИЯ КОРМОВОЙ ДОБАВКИ "ЭЛИТА" ДЛЯ ДОМАШНИХ ЖИВОТНЫХ | 1994 |
|
RU2070397C1 |
| КОРМОВАЯ ДОБАВКА К КУКУРУЗНОМУ КОРМУ | 1992 |
|
RU2050145C1 |
| КОРМОВАЯ ВИТАМИННАЯ ДОБАВКА ДЛЯ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ И ПТИЦЫ | 1991 |
|
RU2034497C1 |
Авторы
Даты
2002-03-10—Публикация
1998-04-08—Подача