Изобретение относится к медицине, а именно к экспериментальной кардиологии.
Экспериментальные исследования составляют неотъемлемую часть медицинских исследований. Экспериментальные модели болезней человека широко используются для изучения механизмов формирования и развития патологии, выяснения роли различных факторов внешней и внутренней среды в становлении патологических процессов, дают возможность подробно изучить патогенез на тканевом, клеточном уровнях и изыскать средства для активного терапевтического вмешательства и профилактики.
Существует множество методов моделирования на животных болезней человека. Надежным и лучшим может быть лишь такой способ экспериментального воспроизведения болезни, который при достаточном постоянстве получаемых результатов, создает модель, наиболее близкую соответственному заболеванию человека в патогенетическом отношении.
Изучение патогенетических и саногенетических аспектов сердечно-сосудистых заболеваний обычно проводится с использованием экспериментальных моделей, сопровождающихся изменениями сосудов, сходными с атеросклеротическими изменениями у человека. Это может быть экспериментальный атеросклероз либо экспериментальные дислипидемии. Воспроизведение таких моделей достигается путем кормления животных пищей, богатой холестерином, с повышенным содержанием углеводов, жиров или чистым холестерином. У крыс как биологического вида низка чувствительность к спонтанному и экспериментальному атеросклерозу, в связи с чем при моделировании экспериментального атеросклероза используются другие биологические виды (в первую очередь кролики), что увеличивает стоимость эксперимента. Крысы чаще используются для моделирования различных типов дислипидемий. Развитие дислипидемий вызывают разбалансированным питанием, степень тяжести дислипидемий определяется длительностью содержания крыс на атерогенной диете [2-4]. Для изучения механизмов формирования и развития кардиальных заболеваний, разработки новых подходов в лечении с применением современных достижений науки и техники экспериментаторам часто требуется модель инфаркта миокарда. Последний может развиваться на фоне экспериментального атеросклероза. Однако инфаркт миокарда наиболее часто встречающееся, но не обязательное осложнение атеросклероза. Для моделирования экспериментального инфаркта миокарда могут быть использованы как крысы, так и другие биологические виды. Развитие экспериментального инфаркта миокарда у крыс вызывают окклюзией нисходящей ветви левой коронарной артерии по методу Г. Селье [1, 6, 14]. Данная модель технически сложна в исполнении, сопровождается высокой летальностью животных во время оперативного вмешательства, что ведет к значительному удорожанию экспериментальных исследований. Кроме того, в 100% случаев крысы погибают в течение 7-10 суток от инфаркта миокарда, в связи с чем такая модель может быть использована только для оценки динамики метаболических изменений в сердечной мышце в острый период инфаркта миокарда. Для решения научных и прикладных задач довольно часто требуется создание экспериментальной модели с инфарктоподобными изменениями в сердце животных, но с минимальной их смертностью, что позволило бы осуществлять длительные во времени манипуляции. Примером таких научных задач может быть изучение механизмов наследования нарушений любых метаболических процессов в клетках, клеточных структурах, органах и тканях, наблюдаемых при инфаркте миокарда, для чего необходимо скрещивание и получение потомства от больных животных; изучение закономерностей постнатального развития потомства больных животных; изучение механизмов действия лекарственных препаратов, разнообразных биологически активных веществ и др. Такие модели практически отсутствуют.
В литературе 50-70-х годов имеются разрозненные сведения о том, что изменения в миокарде могут быть вызваны использованием патогенной (гиперлипидемической, склеротической, Mg-дефицитной) диеты, введением инсулина, адренокортикоидных гормонов после односторонней нефрэктомии, нагрузки животных натрий-фосфатными солями на фоне употребления высокоактивных стероидов или стресса и т.д. Описанные патогенные факторы, способствующие формированию некрозов сердца у различных биологических видов, суммированы в монографии Шош Й. и др. (1976) [8]. Конкретных рекомендаций по моделированию нарушений в миокарде крыс посредством влияния перечисленных факторов или их сочетаний в литературе нет. Вероятно, достичь наиболее выраженных повреждений можно воздействием комбинации перечисленных патогенных факторов. Так, известно, что отрицательное действие на сердечную мышцу оказывает дефицит магния и калия. Поражения миокарда, вызываемые дефицитом калия, усиливаются при высоком потреблении натрия в диете, при дефиците калия натрий становится токсичным. Потеря калия может быть вызвана нарушением функции надпочечников. Альдостерон осуществляет свое первичное действие на внутриклеточное содержание магния и вторично действует на концентрацию калия [8]. Экспериментальными исследованиями на животных доказана связь между дефицитом магния в диете и атеросклеротическими изменениями в сосудах, функциональными нарушениями сердечного ритма [9, 11-13]. Известны клинические исследования, в которых установлено, что дефицит магния всегда сопровождается гиперлипидемией [7, 10] . Описанные данные показывают, что баланс минерального обмена, обусловленный соотношением K/Na и Mg/Ca, должен рассматриваться как важный фактор, оказывающий влияние на инфарктоидные повреждения сердечной мышцы. Перечисленные выше известные данные позволяют подойти к созданию полиэтиологической модели инфарктоидной кардиовазопатии (ИКП), имеющей электролитно-стероидную основу.
Задача изобретения - создание экспериментальной модели, наиболее точно отражающей инфарктоподобные изменения в сердце крыс при наименьшей смертности животных для изучения механизмов формирования, развития и ремиссии кардиальной патологии.
Для решения поставленной задачи использовались белые крысы линии Вистар, выведенные в питомнике РАМН "Столбовая" (ветеринарное свидетельство 17 от 12.09.96). При разработке модели отрабатывалось воспроизведение нескольких аналогичных экспериментальных состояний, все варианты модификаций воспроизводимых моделей анализировались на основании морфологических исследований. Отобраны те из них, при воспроизведении которых достигались устанавливаемые повреждения сердца при наименьшей смертности экспериментальных животных.
Сенсибилизация миокарда крыс вызывалась оперативным удалением одной почки, заменой питьевой воды на 1% раствор хлорида натрия и назначением животным специального питания, представляющего собой полусинтетическую кардиовазопатогенную диету, насыщенную электролитами. Обуславливающим фактором служили внутримышечные инъекции гидрокортизона ацетата, а разрешающим агентом - холодовое воздействие. Надпочечники сохранялись, т.к. повышение активности их коркового слоя в условиях стресса является не только интегральной частью общего адаптационного синдрома, но и играет патогенетическую роль, инициируя "болезни адаптации". Одним из результатов последних, по мнению Г. Селье, являются некрозы сердца [5]. Время экспозиции патогенных факторов и характер развития патологического процесса определялись результатами морфологических исследований сердца крыс, выводимых из эксперимента для проверки развития модели. Исключение из диеты наиболее патогенных факторов способствовало улучшению течения патологического процесса и снижению смертности животных. Из стандартной полусинтетической диеты [8] нами был исключен холестерин как один из факторов, влияющих на смертность животных. Среди неблагоприятных факторов солевая нагрузка была наиболее патогенной. Когда этот фактор отсутствовал, процент инфарктоидных изменений резко снижался. Что касается качества солевых нагрузок, то кроме частичного дефицита калия и магния, значительную роль играло патологическое отношение K/Na (1:14 в сравнении с нормальным 1:0,6) и Mg/Ca (1:17 в сравнении с нормальным 1:7). Состав солевой смеси заимствован из экспериментальных исследований Г. Селье [8] . Таким образом, удалось получить модель электролитно-стероидной кардиопатии, характеризующейся некрозами, но с минимальной смертностью подопытных крыс. Состав полусинтетической диеты, используемой при моделировании ИКП, представлен в таблицах 1 и 2. Этапы моделирования даны в таблице 3.
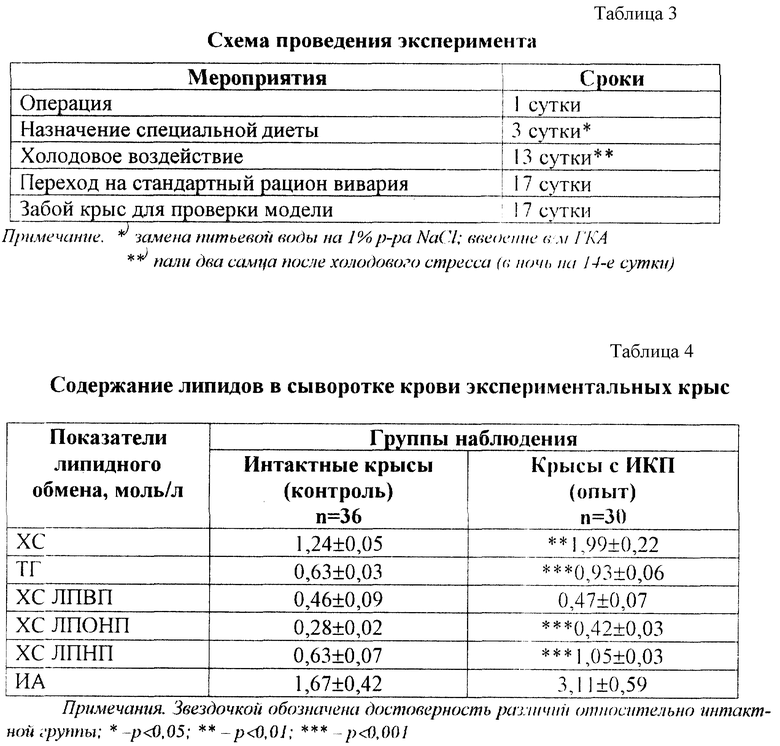
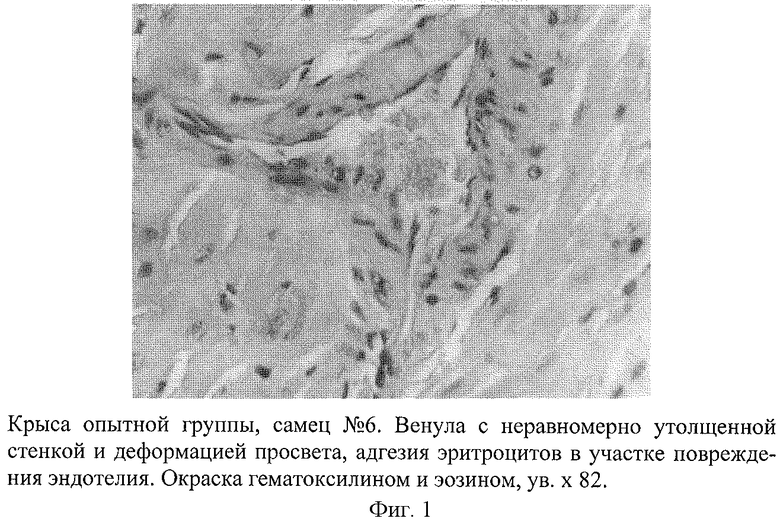
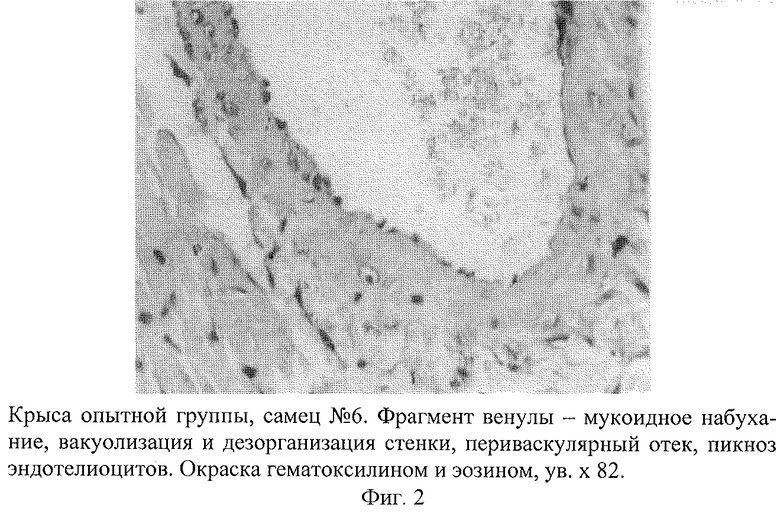
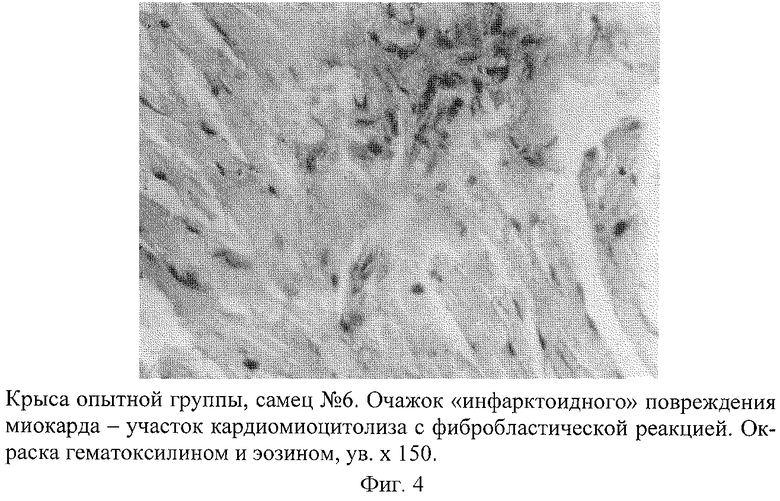
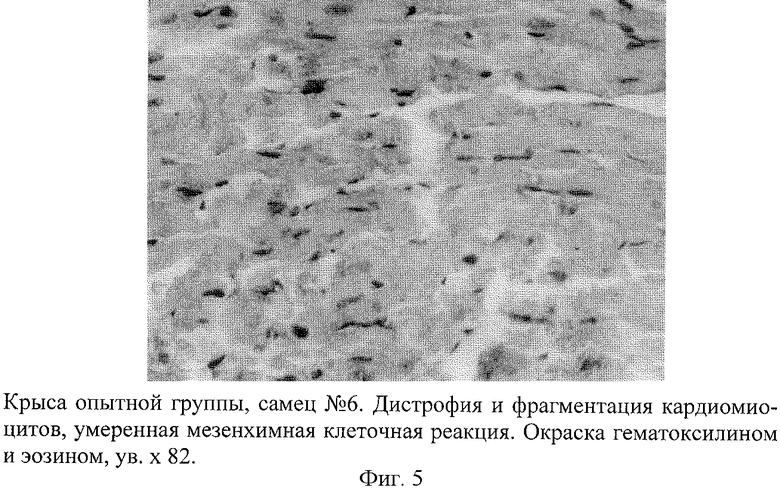
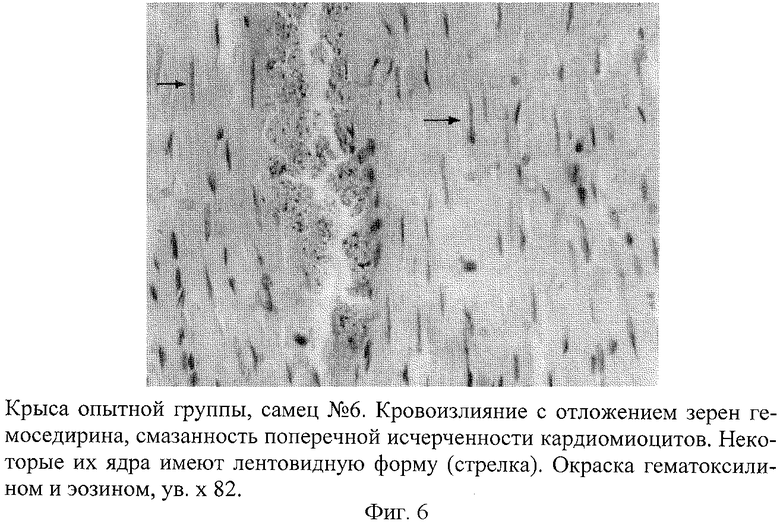
Развитие такой модели сопровождается появлением инфарктоподобных изменений в коронарных сосудах крыс, подтвержденных данными морфологических исследований. В коронарных сосудах крыс обнаружены отчетливые изменения, которые проявлялись в неравномерности толщины стенки артериол и венул, сужении их просвета, деформации и дезорганизации ее строения на отдельных участках с нарушением целостности эндотелия (фиг.1). На поверхности поврежденных эндотелиоцитов наблюдалась адгезия эритроцитов, что свидетельствовало о начинающемся тромбообразовании. В участках повреждения отмечалась "изъеденность" эндотелия, пикноз ядра эндотелиоцитов (фиг.2). Определялось мукоидное и фибриноидное набухание стенки сосудов. В части венул был виден тромбоз, гомогенизация и вакуолизация мышечной оболочки сосудистой стенки с явлениями ангиосклероза (фиг.3). Вокруг подобных сосудов наблюдались дистрофия и цитолиз кардиомиоцитов с потерей ими поперечной исчерченности (фиг.4 и 5). В миокарде определялись мелкие диапедезные кровоизлияния (фиг.6). Под эпикардом имелось полнокровие сосудов. Явления мукоидного набухания в отдельных сосудах сочетались с образованием рыхлых периваскулярных инфильтратов, состоящих из лимфоцитов и гистоцитов.
Появление морфологических изменений в сердце крыс при моделировании ИКП сочеталось с нарушением липидного обмена в сыворотке крови. Результаты анализа показателей липидов сыворотки крыс представлены в таблице 4. У животных с ИКП наблюдалось повышение уровня общего холестерина (ХС) в сравнении с интактными животными (р<0,01). Гипертриглицеридемия у некоторых крыс достигала значений 1,13 ммоль/л, среднее значение по группе составляло 0,93±0,06 в сравнении с 0,63±0,03 в интактной группе (р<0,001). Увеличены показатели ХС в липопротеидах очень низкой плотности (ЛПОНП) (р<0,001). Наиболее высокие цифры выявлены для уровня ХС липопротеидов низкой плотности (ЛПНП). Наблюдалось и увеличение индекса атерогенности (ИА). Содержание ХС антиатерогенного класса липопротеидов у животных с ИКП - ХС липопротеидов высокой плотности (ЛПВП) - не изменялось.
Таким образом, данные гистоморфологических и биохимических исследований свидетельствуют, что воспроизводимая в эксперименте модель инфарктоидной кардиовазопатии сопровождается патологическими изменениями в сердце крыс, которые заключаются в развитии альтеративно-пролиферативных повреждений коронарных сосудов с явлениями тромбообразования, появлении периваскулярных очажков кардиодистрофии и/или кардиомиоцитолиза, образование которых имеет непосредственную связь с нарушением коронарного кровообращения, а также нарушением липидного обмена по показателям сыворотки крови.
Способ моделирования инфарктоидной кардиовазопатии осуществлялся следующим образом. В течение одного дня у крыс под эфирным наркозом по общепринятой методике проводилась односторонняя нефрэктомия. Второй этап эксперимента начинался с третьих суток и включал содержание животных на специальной полусинтетической диете с добавлением солевой смеси, нагруженной солями натрия и кальция на фоне дефицита калия и магния (табл. 1, 2). В период содержания на полусинтетической диете у животных питьевая вода заменялась на 1% раствор хлорида натрия, проводилось ежедневное однократное внутримышечное введение суспензии гидрокортизона ацетата (из расчета 1,5 мг на 100 г массы животного, что соответствует фармакологической дозе). На 13-е сутки эксперимента, когда развитие модели практически было завершено, о чем свидетельствовали данные морфологических исследований сердца крыс, выведенных из эксперимента для проверки модели, животные подвергались холодовому стрессу содержанием их при 4oС в течение 4 часов. Температура и длительность холодового воздействия являются оптимальными и были подобраны экспериментально. Отсев животных на данном этапе составил 2%. Патологоанатомическое исследование внутренних органов умерших в результате холодового стресса крыс обнаружило характерные для некроза миокарда обширные четко ограниченные неравномерные белесые пятна, располагавшиеся на передних стенках сердец в области левого и правого желудочков. Следующие 4 суток опыт был продолжен согласно вышеописанным условиям, на 17-е сутки животные переведены на стандартные условия содержания их в виварии.
Предлагаемый способ моделирования ИКП несложен в техническом исполнении и наиболее полно отражает патологические изменения в сердце при кардиальных заболеваниях (фиг. 1-6). Операцию по односторонней нефрэктомии крысы переносили удовлетворительно, отсева животных на данном этапе не наблюдалось. В техническом отношении операция доступна любому биологу-экспериментатору. Экономически развитие данной модели является выгодным. Во-первых, для создания модели могут быть использованы крысы - наиболее доступный биологический вид; во-вторых, отсева животных в процессе моделирования практически не наблюдается; в третьих - животные с некрозами сердца могут быть использованы достаточно долго для последующих исследований, что является наиболее важным и соответствует достижению поставленной цели. Подтверждением приоритетности разработанной модели явились дальнейшие экспериментальные исследования, проведенные на животных с моделированной ИКП. Для решения задач, не входящих в рамки описываемого изобретения, больные животные скрещивались, в результате чего неоднократно от одних и тех же особей было получено потомство. То есть при наличии инфарктоподобных изменений в сердце крыс в наших исследованиях незапланированного падежа животных в течение 12 месяцев не наблюдалось. Учитывая вышеописанные приоритеты и экономическую эффективность, разработанная модель инфарктоидной кардиовазопатии может быть использована в динамике для изучения механизмов формирования, развития и ремиссии кардиальных заболеваний.
Таким образом, проведенные нами исследования позволили получить новую экспериментальную модель инфарктоподобной патологии сердца у крыс, в основу которой положена электролитно-стероидная кардиопатия. Предложенная модель технически проста в исполнении, отличается хорошей воспроизводимостью, низкой летальностью экспериментальных животных в процессе моделирования и после развития модели.
Источники информации
1. Белкина Л.М., Корчажкина Н.Б., Камскова Ю.Г., Фомин Н.А. Кардиопротекторное действие противосудорожного препарата вальпроата натрия при нарушениях сократительной функции сердца, вызванных острым инфарктом миокарда // Патолог. физиология и эксперим. терапия. - 1997. - 2. - С. 18-21.
2. Виварец О.В., Соколов А.И., Гаппаров М.М. Особенности влияния сахарозы на метаболизм липидов у крысы: подтверждение дисахаридного эффекта // Вопросы питания. - 1990. - 4. - С. 48-53.
3. Горанов И., Аврамова К., Дончев Н и др. Влияние трех типов модифицированных жиров на массу тела и отдельных органов и тканей у белых крыс // Вопросы питания. - 1990. - 4. - С. 71-73.
4. Нестерин М.Ф., Маркемова В.Ф., Ляпков Б.Г. и др. Влияние рационов с качественно различными углеводами на некоторые показатели липидного обмена в печени, крови и желчи // Вопросы питания - 1979. - 1. - С. 32-36.
5. Селье Г. Профилактика некрозов сердца химическими средствами М.: Медгиз, 1961. - 208 с.
6. Торкунов П.А., Сапронов Н.С., Новоселова Н.Ю., Наливаева Н.Н. Фосфолипиды сердца в динамике экспериментального инфаркта миокарда у крыс // Патолог. физиология и эксперим. терапия. - 1997. - 2. - С. 21-23.
7. Шилов А.М., Святов И.С., Чубаров М.И., Санодзе И.Д. Результаты применения магнийсодержащих препаратов для лечения и профилактики гипер- и дислипидемии // Клиническая медицина. - 1998. - 4. - С. 35-37.
8. Шош Й., Гати Т., Чалаи Л., Деши И. Патогенез болезней цивилизации. - Будапешт: Академия наук Венгрии, 1976. - 154 с.
9. Bloom S/ Coronary arterial lesion in Mg-deficient hamsters // Magnesium. - 1985. - Vol. 4. - P. 82-95.
10. Britton J., Pavord I., Richards K., et al. Dietary magnesium, lung function, wheezing, and airway hyperreactivity in random adult population sampl // Lancet. - 1994. - Vol.344. - P. 357-362.
11. Lasserre B., Durlach J. Magnesium a Relevant ion. - 1994. - Vol.4. - P. 411 - 421.
12. Raissiguier Y. Magnesium, lipides and vascular disease: Experimental evidence in animal models // Magnesium. - 1986. - Vol. 5. - P. 182-190.
13. Seelig M. S. Magnesium deficiency in the pathogenesis of disease: erly roots of cardiovascular, skeletal anl renal abnormalities. - New York, 1980.
14. Seiye et al., 1960. Цитировано по: Торкунов П.А. и др. Фосфолипиды сердца в динамике экспериментального инфаркта миокарда у крыс // Патолог. физиология и эксперим. терапия. - 1997. - 2. - С. 21-23.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МОДЕЛИРОВАНИЯ ЭЛЕКТРОЛИТНОЙ НЕФРОПАТИИ У КРЫС | 2003 |
|
RU2256953C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ ПОЛИОРГАННОЙ ПАТОЛОГИИ У КРЫС | 2011 |
|
RU2453002C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ КАРДИОВАЗОРЕНАЛЬНОЙ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ У КРЫС | 2006 |
|
RU2327228C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ИНФАРКТА МИОКАРДА У КРЫС | 2007 |
|
RU2407062C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ СОЧЕТАННОГО МЕДИКАМЕНТОЗНОГО ПОРАЖЕНИЯ СЕРДЦА И ПОЧЕК У КРЫС | 2019 |
|
RU2726927C1 |
| СПОСОБ ПОСТАДИЙНОГО МОДЕЛИРОВАНИЯ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ У КРЫС | 2021 |
|
RU2770555C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ЛИПИДКОРРИГИРУЮЩИМИ И ИММУНОМОДУЛИРУЮЩИМИ СВОЙСТВАМИ | 2003 |
|
RU2259824C2 |
| СПОСОБ МОДЕЛИРОВАНИЯ НЕАЛКОГОЛЬНОГО СТЕАТОГЕПАТИТА У КРЫС | 2009 |
|
RU2394281C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ АТЕРОСКЛЕРОЗА | 2013 |
|
RU2545433C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАЗВИТИЯ СЕРДЕЧНО-СОСУДИСТОЙ ПАТОЛОГИИ У ПОТОМКОВ БОЛЬНЫХ ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА | 2001 |
|
RU2214597C2 |

Изобретение относится к медицине, а именно к экспериментальной кардиологии, и может быть использовано для изучения механизмов формирования, развития и ремиссии кардиальных заболеваний. Способ представляет собой сенсибилизацию миокарда у белых линейных крыс путем оперативного удаления одной почки с одновременной заменой питьевой воды на 1%-ный раствор хлорида натрия, ежедневным внутримышечным введением суспензии гидрокортизона ацетата из расчета 1,5 мг на 100 г массы животного, назначением животным кардиовазопатогенной полусинтетической диеты, нагруженной солями натрия и кальция при дефиците калия и магния, с последующим холодовым воздействием через 2 недели в условиях содержания крыс в течение 4 ч при 4oС. Предложенный способ прост в исполнении, отличается хорошей воспроизводимостью, низкой летальностью экспериментальных животных в процессе моделирования и после развития модели. 6 ил., 4 табл.
Способ моделирования инфарктоидной кардиовазопатии у крыс, отличающийся тем, что вызывают сенсибилизацию миокарда у белых линейных крыс путем оперативного удаления одной почки с одновременной заменой питьевой воды на 1%-ный раствор хлорида натрия, ежедневным внутримышечным введением суспензии гидрокортизона ацетата из расчета 1,5 мг на 100 г массы животного, назначением животным кардиовазопатогенной полусинтетической диеты, нагруженной солями натрия и кальция при дефиците калия и магния, с последующим холодовым воздействием через 2 недели в условиях содержания крыс в течение 4 ч при 4oС.
| СПОСОБ МОДЕЛИРОВАНИЯ ОЧАГОВЫХ НЕКРОЗОВ МИОКАРДА | 1994 |
|
RU2095854C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ СИНДРОМА ПОВЫШЕННОЙ ВЯЗКОСТИ КРОВИ | 1995 |
|
RU2110850C1 |
| Reznikov K.M., Modeling of myocardial lesions of varying degrees of manifestation, Biull Eksp Biol Med, 1985, May;99(5):532-534 | |||
| Avdeeva E.V., Risk factors of ischemic heart disease and lipid metabolism in cardiorespiratory disease, Klin Med (Mosk), 2000, 78(3):25-28. | |||
Авторы
Даты
2002-10-27—Публикация
2000-04-21—Подача