Изобретение относится к соединениям общей формулы I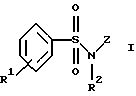
и к их применению в качестве терапевтически активных веществ,
где
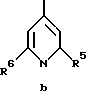
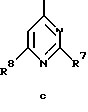
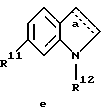
Z обозначает замещенную фенильную, замещенную пиридильную, замещенную пиримидильную или замещенную индолильную группу формул a-e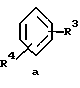
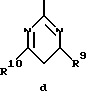
R1 обозначает водород, амин, низший алкиламин, низший диалкиламин, низший алкил, галоген или трифторметил;
R2 обозначает водород или низший алкил;
R3 обозначает водород, амин, низший алкиламин, низший диалкиламин, низший алкил, CF3, низшую алкоксигруппу или галоген;
R4 обозначает амин, низший алкиламин, низший диалкиламин, низший алкил, низшую алкоксигруппу или галоген;
R5 обозначает водород, низший алкиламин, ди-низший алкиламин, низшую алкоксигруппу или галоген;
R6 обозначает низший алкил, низший алкиламин, ди-низший алкиламин, низшую алкоксигруппу, галоген или CF3;
R7 обозначает амин, низший алкиламин, ди-низший алкиламин, низшую алкоксигруппу, низший алкилсульфанил, меркаптогруппу, пирролидин-1-ил или азетидин-1-ил;
R8 обозначает амин, низший алкиламин, ди-низший алкиламин, бензиламин, низшую алкоксигруппу, низший алкилсульфанил, галоген, пирролидин-1-ил или азетидин-1-ил;
R9 и R10 каждый независимо друг от друга обозначают низший алкокси- или низший алкиламиногруппу;
R11 обозначает водород или галоген;
R12 обозначает водород или низший алкил и
a обозначает необязательную двойную связь,
при условии, что R7 и R8 одновременно не обозначают метоксигруппы,
а также к их фармацевтически приемлемым солям.
Формула I включает известные и новые соединения.
Неожиданно было обнаружено, что не только эти уже известные соединения, но также и новые соединения обладают селективным сродством к рецепторам 5НТ-6. Следовательно, эти соединения пригодны для лечения или профилактики расстройств центральной нервной системы, например, таких как психозы, шизофрения, маниакальные депрессии [Bryan L. Roth и др., J. Pharmacol. Exp. Ther. , 268, с. 1403-1410 (1994)], депрессии [David R. Sibley и др., Mol. Pharmacol. , 43, с. 320-327 (1993)], неврологические нарушения [Anne Bourson и др. , J. Pharmacol. Exp. Ther., 274, с. 173-180 (1995); R.P. Ward и др., Neuroscience, 64, с. 1105-1110 (1995)], расстройства памяти, болезнь Паркинсона, боковой амиотрофический склероз, болезнь Альцгеймера и болезнь Хантингтона [Andrew J. Sleight и др., Neurotransmissions, 11, с. 1-5 (1995)].
Предметом настоящего изобретения является применение соединений общей формулы I и их фармацевтически приемлемых солей для лечения или профилактики вышеуказанных заболеваний и, следовательно, для приготовления соответствующих лекарственных средств, новые соединения формул Ia1, Ia2, Ib1, Ib2, Ic1, Ic2, Id1, Id2 и Ie и их фармацевтически приемлемые соли как таковые или для применения в качестве терапевтически активных веществ, получение этих новых соединений, лекарственные средства, содержащих новые или известные соединения формулы I или их фармацевтически приемлемые соли, а также приготовление таких лекарственных средств.
Соединения формулы I, в которых Z обозначает замещенный фенильный остаток, описаны, например, у R. Behnisch и др. в Chemische Berichte, 81, 4, с. 297-306 (1947), в частности соединения с галоидными заместителями в фенильном остатке, такие как 4-амино-N-(3,5-дихлофенил)бензолсульфонамид или 4-амино-(3,5-дибромфенил)бензолсульфонамид, соединения с метильными или метоксизаместителями в фенильном остатке, такие как 4-амино-N-(3,5-диметилфенил)бензолсульфонамид или 4-амино-N-(3,5-диметоксифенил)бензолсульфонамид. Представленные в данном описании сульфонамиды проявляют противомалярийное действие.
У J.L. Frederick и др. в Journal of Org. Chem., 26, с. 4715-4716 (1961) описаны фторсульфаниланилиды, например, такие как 4-амино-N-(3,5-дифторфенил)бензолсульфонамид, а также их получение и применение в качестве антибактериальных средств.
Далее, у J.K. Seydel в Mol. Pharmacol., 2, с. 259-265 (1966) описано действие против Е. coli., которое проявляет in vitro ряд сульфонамидов.
У Bergeim и др. в Journal of the American Chem. Soc., 69, с. 583-587 (1947) описано получение некоторых аминосульфаниланизидов, например, таких как 4-амино-N-(3-метоксифенил)бензолсульфонамид, в качестве возможных противомалярийных средств.
Ни в одной из указанных выше публикаций не упоминается о том, что фенилбензолсульфонамиды могли бы оказаться пригодными для применения в качестве действующих соединений при лечении неврологических нарушений.
Соединения формулы I, в которых Z обозначает замещенный пиридиновый остаток, описаны, например, у R. Urban и др. в Helvetia Chimica Acta, 47, с. 363-377 (1964), в частности такие соединения, как 4-амино-N-(4,6-диметоксипиридин-2-ил)бензолсульфонамид, 4-амино-N-(2-метокси-6-бромпиридин-3-ил)бензолсульфонамид, 4-амино-N-(2-метокси-6-метилпиридин-4-ил)-бензолсульфонамид или 4-амино-N-(2,6-диметоксипиридин-4-ил)бензолсульфонамид. Описаны также получение и антибактериальные свойства аминометоксипиридинов и сульфаниламидов. В этой публикации также отсутствует какое-либо указание относительно их возможного противодействия неврологическим нарушениям.
Соединения формулы I, в которых Z обозначает замещенный пиримидиновый остаток, описаны, например, у Bretschneider и др. в Monatshefte für Chemie, 92, с. 183-192 (1961). В этой публикации описано получение 2,6-дизамещенных 4-сульфаниламидопиримидинов, например такого соединения, как 4-амино-N-(2,6-диэтилсульфанилпиримидин-4-ил)бензолсульфонамид. У Bretschneider и др. в Monatshefte für Chemie, 95, с. 207-213 (1964), описаны дополнительные процессы синтеза 6-сульфаниламидо-2,4-диметоксипиримидина.
У W. Baker и др. в Journal of the American Chem. Soc., 69, с. 3072-3078 (1947), описано получение замещенных сульфаниламидопиримидинов, например таких соединений, как 4-амино-N-(4,6-диметоксипиримидин-2-ил)бензолсульфонамид, а также их возможное применение в качестве антибактериальных средств.
Сульфаниловые производные 2,6-дизамещенных пиримидинов, например таких соединений, как 4-амино-N-(2,6-бисдиметиламинопиримидин-4-ил)бензолсульфонамид, описаны в патенте Франции 1383287.
Ни в одной из этих публикаций не говорится о том, что сульфонамиды, которые содержат пиримидиновый остаток, также могли бы быть использованы в качестве действующих веществ при лечении неврологических нарушений.
Применение соединений, которые содержат первичную аминогруппу, для лечений неврологических нарушений в относительно общих чертах описано в международной заявке WO 92/14456. В этой заявке указано большое число различных групп соединений, например, таких как п-аминобензойные кислоты, п-аминофенилуксусные кислоты, аминоникотиновая кислота, 2,3-диаминопропионовая кислота и т.д. Среди этих соединений указаны также различные группы соединений и, в частности, сульфаниламиды и 1-аминозамещенные производные сульфаниламидов (п-H2N-C6H4-SO2NHR). Из конкретно указанных по названиям соединений 4-амино-N-(2,6-диметоксипиримидин-4-ил)бензолсульфонамид исключен вследствие отказа в защите права на применение соединений формулы I для лечения или профилактики расстройств вышеуказанного типа.
Соединения формулы I включают следующие группы:
а) анилиды формулы Iа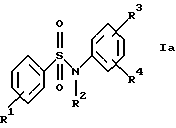
где R1, R2, R3 и R4 имеют указанные для формулы I значения;
б) соединения формулы Ib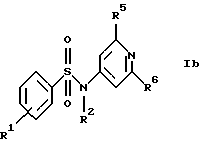
где R1, R2, R5 и R6 имеют указанные для формулы I значения;
в) соединения формул Ic и Id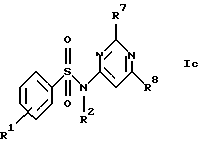
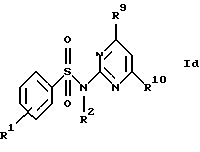
где R1, R2, R7, R8, R9 и R10 имеют указанные для формулы I значения;
г) соединения формулы Ie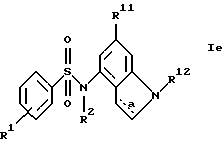
где R1, R2, R11, R12 и a имеют указанные для формулы I значения.
Особенно предпочтительны для применения с вышеуказанной целью следующие соединений формул Ia, Ib, Ic, Id и Ie:
4-амино-N-(2,6-бисметиламинопиримидин-4-ил)бензолсульфонамид;
4-амино-N-(6-этиламино-2-метиламинопиримидин-4-ил)бензолсульфонамид;
4-амино-N-(2-диметиламино-6-метиламинопиримидин-4-ил)бензолсульфонамид;
4-амино-N-(2-диметиламино-6-этиламинопиримидин-4-ил)бензолсульфонамид;
4-амино-N-(2,6-бисметиламинопиримидин-4-ил)-N-метилбензолсульфонамид;
4-амино-N-(2-азетидин-1-ил-6-метиламинопиримидин-4-ил)бензолсульфонамид;
4-амино-N-(2-азетидин-1-ил-6-этиламинопиримидин-4-ил)бензолсульфонамид;
4-амино-N-(6-метиламино-2-пирролидин-1-ил-пиримидин-4-ил)бензолсульфонамид;
4-амино-N-(2-бром-6-метиламинопиридин-4-ил)бензолсульфонамид;
4-амино-N-(2,6-бисметиламинопиридин-4-ил)бензолсульфонамид;
4-амино-N-(2-этиламино-6-метиламинопиридин-4-ил)бензолсульфонамид;
4-амино-N-(2-диметиламино-6-метиламинопиридин-4-ил)бензолсульфонамид;
4-амино-N-(2,6-бисэтиламинопиридин-4-ил)бензолсульфонамид;
N-(2,6-бисметиламинопиримидин-4-ил)-3-хлорбензолсульфонамид;
N-(2,6-бисметиламинопиримидин-4-ил)-3-трифторметилбензолсульфонамид;
4-амино-N-(2-метил-6-метиламинопиридин-4-ил)бензолсульфонамид;
4-амино-N-(3,5-диметоксифенил)бензолсульфонамид;
4-амино-N-(3,5-дихлорфенил)бензолсульфонамид;
4-амино-N-(3,5-дибромфенил)бензолсульфонамид и
4-амино-N-(1Н-индол-4-ил)бензолсульфонамид.
Используемый в данном описании термин "низший алкил" обозначает остатки, содержащие 1-7, предпочтительно 1-4 атомов углерода, например, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет-бутил.
Термин "низшая алкоксигруппа" обозначает связанный через атом кислорода низший алкильный остаток, который определен выше, например, такой как метокси-, этокси-, н-пропокси-, изопропокси-, н-бутокси-, изобутокси и трет-бутоксигруппа.
Термин "низший алкиламин" обозначает связанный через NH-группу низший алкильный остаток, который определен выше, например, такой как метиламин и этиламин.
Термин "ди-низший алкиламин" обозначает радикал из двух одинаковых или различных связанных через атом азота алкильных остатков, которые определены выше, например, такой как диметиламин, диэтиламин и метилэтиламин.
Термин "низший алкилсульфанил" обозначает связанный через атом серы низший алкильный остаток, который определен выше, например, такой как метилсульфанил (-S-СН3) и этилсульфанил (-S-СН2СН3).
Термин "галоген" включает фтор, хлор, бром и иод.
Касательно формулы Iа необходимо отметить, что в качестве терапевтически действующих веществ предпочтительны или особенно предпочтительны следующие известные соединения:
4-амино-N-(3,5-диметоксифенил)бензолсульфонамид,
4-амино-N-(3,5-дихлорфенил)бензолсульфонамид,
4-амино-N-(3,5-дибромфенил)бензолсульфонамид,
4-амино-N-(3,5-диметилфенил)бензолсульфонамид и
4-амино-N-(3-метоксифенил)бензолсульфонамид.
Новые соединения формулы Ia представляют собой соединения формул Ia1 и Ia2
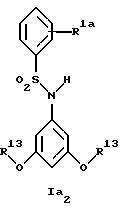
где R1a обозначает 3-трифторметил, 3-галоид или 4-галоид;
R3a обозначает водород, галоген, низшую алкоксигруппу, амин или низший алкиламин;
R4a обозначает амин или низший алкиламин, а
R13 обозначает низший алкил;
при условии, что R3a не обозначает водород, когда R4a обозначает амин,
а также их фармацевтически приемлемые соли.
Предпочтительны новые соединения формулы Ia1, в которых
R3a обозначает водород, амин или метиламин, а
R4a обозначает амин или метиламин.
Получение этих соединений описано в примерах 34-36.
В примере 37 описано получение нового соединения формулы Ia2, в котором R1a обозначает 3-трифторметил, а R13 обозначает метил.
Касательно формулы Ib необходимо отметить, то для использования в качестве терапевтически действующих веществ предпочтительны следующие известные соединения:
4-амино-N-(2,6-диметоксипиридин-4-ил)бензолсульфонамид и
4-амино-N-(2-метокси-6-метилпиридин-4-ил)бензолсульфонамид.
Новые соединения формулы Ib представляют собой соединения формул Ib2 и Ib2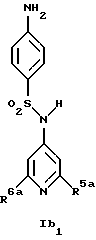
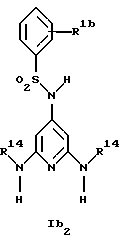
где R1b обозначает 4-галоид, 3-галоид или 3-трифторметил;
R5a обозначает водород, низший алкиламин, ди-низший алкиламин или галоген;
R6a обозначает низший алкил, CF3, низший алкиламин, ди-низший алкиламин или галоген и
R14 обозначает низший алкил;
при условии, что когда R6a обозначает галоген, R5a не обозначает водород,
а также их фармацевтически приемлемые соли.
Предпочтительны новые соединения формулы Ib1, в которых
R5a обозначает водород, метиламин, этиламин, диметиламин, хлор или бром и
R6a обозначает метил, метиламин, этиламин, диметиламин или бром, при условии, что когда R6a обозначает бром, R5a не обозначает водород.
Получение этих соединений описано в примерах 38-47, 51 и 53.
Предпочтительны новые соединения формулы Ib2, в которых
R1b обозначает 4-хлор-, 3-хлор- или 3-трифторметил и
R14 обозначает метил.
Получение этих соединений описано в примерах 48-50.
Новые соединения формулы Ic представляют собой соединения формул Ic1 и Ic2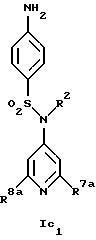
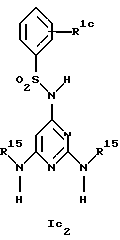
где R1c обозначает водород, 4-галоид, 4-низший алкил, 3-галоид или 3-трифторметил,
R2 обозначает водород или низший алкил,
R7a обозначает амин, низший алкиламин, ди-низший алкиламин, меркаптогруппу, пирролидин-1-ил или азетидин-1-ил,
R8a обозначает амин, низший алкиламин, ди-низший алкиламин, бензиламин, низшую алкоксигруппу, пирролидин-1-ил или азетидин-1-ил и
R15 обозначает низший алкил,
при условии, что когда R7a обозначает ди-низший алкиламин, R8a не обозначает низшую алкоксигруппу и ди-низший алкиламин,
а также их фармацевтически приемлемые соли.
Предпочтительны новые соединения формулы Ic1, в которых
R2 обозначает водород или метил,
R7a обозначает амин, метиламин, этиламин, пропиламин, изопропиламин, диметиламин, меркаптогруппу, пирролидин-1-ил или азетидин-1-ил и
R8a обозначает амин, метиламин, этиламин, пропиламин, изопропиламин, диметиламин, бензиламин, метоксигруппу, пирролидин-1-ил или азетидин-1-ил,
при условии, что когда R7a обозначает диметиламин, R8a не обозначает диметиламин и метоксигруппу. Получение этих соединений описано в примерах 1-25.
Предпочтительны новые соединения формулы Ic2, в которых
R1c обозначает водород, 4-фтор, 4-хлор, 4-метил, 4-трет-бутил, 3-хлор или 3-трифторметил и
R15 обозначает метил.
Получение этих соединений описано в примерах 27-33.
Новые соединения формулы Id представляют собой соединения формул Id1 и Id2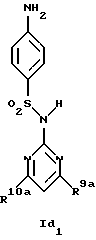
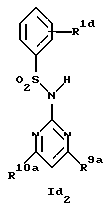
где R1d обозначает 3-трифторметил, 4-трифторметил, 3-галоид или 4-галоид и
R9a и R10a каждый обозначает низший алкиламин,
а также их фармацевтически приемлемые соли.
В примере 26 описано получение нового соединения формулы Id1, в котором R9a и R10a обозначают метиламино.
Также новыми являются соединения формулы Iе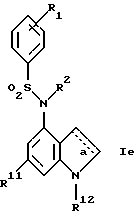
где R1, R2, R11, R12 и a имеют указанные в п.1 формулы изобретения значения.
Получение этих новых соединений описано в примере 52.
Соединения формулы I и их соли, если они не известны, а их получение еще не было описано, могут быть получены по известным методам исходя из соединений формулы II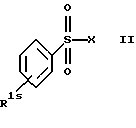
где R1s имеет значения, указанные для R1 или обозначает защищенную аминогруппу и
Х обозначает галоген или -NHY, где Y обозначает щелочной металл, например натрий или калий,
взаимодействием соединения формулы II, в котором Х обозначает галоген,
а) с соединением формулы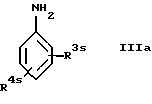
где R3s обозначает водород, низшую алкоксигруппу, галоген, защищенную аминогруппу или защищенный низший алкиламин и
R4s обозначает защищенную аминогруппу или защищенный низший алкиламин,
с последующим удалением аминозащитных групп, или
б) с соединением формулы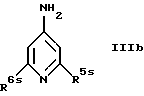
где R5s обозначает галоген и
R6s обозначает галоген, низший алкил или CF3,
а также при необходимости взаимодействием продукта реакции с низшим алкиламином или ди-низшим алкиламином с последующим удалением аминозащитной группы, или
в) с соединением формулы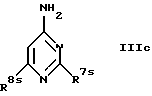
где R7s обозначает меркаптогруппу и
R8s обозначает амин, низший алкиламин, ди-низший алкиламин, бензиламин, низшую алкоксигруппу, пирролидин-1-ил или азетидин-1-ил
и при необходимости с последующим удалением аминозащитной группы, или
г) взаимодействием соединения формулы II, в котором Х обозначает -NHY, вначале с соединением формулы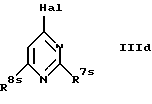
где R7s обозначает амин, низший алкиламин, меркаптогруппу, пирролидин-1-ил или азетидин-1-ил и
R8s обозначает галоген,
и при необходимости с последующей обработкой продукта реакции низшим алкиламином, ди-низшим алкиламином, азетидином, пирролидином или алкоголятом, или
д) взаимодействием соединения формулы II, в котором Х обозначает галоген, с соединением формулы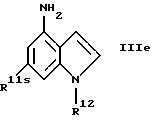
где R11s обозначает водород или галоген и
R12 обозначает водород или низший алкил,
и при необходимости с последующим восстановлением до соединения формулы Ie, в которой a не обозначает двойную связь, или
е) взаимодействием соединения формулы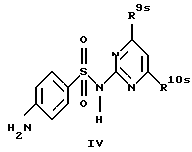
где
R9s и R10s обозначают низшую алкоксигруппу, с низшим алкиламином, или
ж) взаимодействием сульфадиметоксина формулы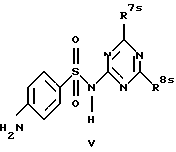
где R7s и R8s обозначают низшую алкоксигруппу, с низшим алкиламином, и
з) при необходимости превращением соединения общей формулы I в фармацевтически приемлемую соль.
Все варианты процесса, которые приведены выше, можно осуществлять по известным методам.
Для получения соединений формулы Ia взаимодействие с использованием исходных соединений формул II и IIIa целесообразно проводить при комнатной температуре в приемлемом растворителе, например в пиридине.
Для алкилирования аминогруппы можно, например, проводить взаимодействие защищенной аминогруппы с низшим алкилиодидом.
Приемлемой защитной группой для аминогруппы является ацетильная группа.
Удаление аминозащитной группы проводят добавлением основания (например, NaOH) и кипячением с обратным холодильником.
В случае соединений формулы Ia удаление защитной группы всегда является последней стадией реакции.
Для получения соединений формулы Ib взаимодействие исходных соединений формулы II (X обозначает галоген) с соединением IIIb целесообразно проводить при температурах от 20 до 80oС, предпочтительно при 60oС, в приемлемом растворителе, например в пиридине.
При получении соединений формулы Ic проводят взаимодействие исходных соединений формулы II (X обозначает галоген) с соединениями формулы IIIc.
Удаление аминозащитной группы проводят обработкой основанием по описанной выше методике.
Реакционный продукт взаимодействия соединения формулы II с соединением формулы IIIb, например 4-амино-N-(2,6-дибромпиридин-4-ил)бензолсульфонамид, можно использовать для получения соединений формулы Ib, в которых R5 обозначает галоген, низший алкиламин или ди-низший алкиламин, а R6 обозначает низший алкиламин или ди-низший алкиламин, взаимодействием с низшим алкиламином или ди-низшим алкиламином при температурах от 60 до 200oС.
Для получения соединений формулы I, в которых R2 обозначает низший алкил, можно проводить взаимодействие соответствующего сульфонамида с диазометаном по известному методу (пример 19).
Исходные продукты, необходимые для получения соединений формулы I, представляют собой известные соединения или могут быть получены аналогично известным методам. Специалистам в данной области техники эти реакции обычно известны.
Связывание соединений формулы I в соответствии с изобретением с 5-НТ6-рецепторами определяли следующим образом.
Использовали мембраны, полученные из клеток НЕК 293, которые подвергали трансфекции 5-НТ6-рецепторами крыс.
Эти клетки очищали двукратным центрифугированием (10 минут при 3000g) в забуференном фосфатом растворе хлорида натрия. Клеточную массу суспендировали в охлажденном льдом растворе, состоявшем из 50 мМ буфера трис-HCl, 10 мМ MgCl2, 0,5 мМ ЭДТК и 0,1 мМ фенилметилсульфонилфторида, и гомогенизировали (гомогенизатор Polytron, 15 с при максимальной скорости). Этот гомогенизат инкубировали при 37oС в течение 10 мин и затем центрифугировали (20 мин при 20000g). Клеточную массу вновь суспендировали в вышеупомянутом трис-буферном растворе. Конечная концентрация клеток составляла 4•107 клеток/мл. Аликвоты, каждая из которых включала по 1 мл гомогенизата, сушили вымораживанием при -80oС.
С целью определить сродство испытываемого соединения к 5-НТ6-рецептору проводили испытания с вытеснением. Для проведения такого испытания гомогенизат оттаивали и суспендировали в буферном растворе (при рН 7,4), включавшем 50 мМ буфера трис-HCl, 5 мМ MgCl2, 10-5 М паргилина и 0,1% аскорбиновой кислоты. 100 мкл суспензии мембран, 50 мкл [3H]-LSD (с удельной активностью 85 Ки/ммоль, конечная концентрация 1 нМ) и 50 мкл раствора испытываемого вещества инкубировали при 37oС в течение 1 ч. Соответствующее вещество исследовали при 7 различных концентрациях от 10-10 М до 10-4 М. Реакцию связывания испытываемого соединения прерывали быстрым фильтрованием через фильтр Watman [a] GF/B. Этот фильтр промывали 2 порциями по 2 мл буфера трис-HCl (50 мкМ, при рН 7,4) и сцинтилляционной спектроскопией в 2 мл сцинтилляционного раствора измеряли радиоактивность на фильтре. Все испытания были тройными и их повторяли по три раза.
Определяли значения pKi (pKi=-Log10Ki) испытываемых веществ. Значения Ki определяли по следующей формуле: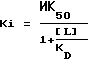
где значения ИК50 представляют собой такие концентрации испытываемых соединений в нМ, при которых вытесняется 50% лигандов, связанных с рецепторами. [L] представляет собой концентрацию лиганда, а KD является константой диссоциации лиганда.
Соединения в соответствии с изобретением обладают селективным сродством к 5-НТ6-рецепторам при значениях Ki менее 1,6 мкМ (см. таблицу).
Соединения формулы I и фармацевтически приемлемые соли соединений формулы I могут быть использованы в качестве медикаментов, например в форме фармацевтических препаратов. Такие фармацевтические препараты можно вводить перорально, например в форме таблеток, таблеток в оболочке, драже, твердых и мягких желатиновых капсул, растворов, эмульсий и суспензий. Однако их можно также вводить ректально, например в форме суппозиториев, парентерально, например в форме растворов для инъекций.
Для приготовления фармацевтических препаратов соединения формулы I можно смешивать с фармацевтически инертными неорганическими или органическими носителями. Так, например, в качестве таких носителей для изготовления таблеток, таблеток в оболочке, драже и твердых желатиновых капсул могут быть использованы лактоза, кукурузный крахмал и его производные, тальк, стеариновая кислота, ее соли и т.п. Приемлемыми носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры, полутвердые и жидкие полиолы и т.п. Однако в зависимости от природы действующего вещества в случае мягких желатиновых капсул обычно никаких носителей не требуется. Приемлемые носители для приготовления растворов и сиропов представляют собой, например, воду, полиолы, глицерин, растительное масло и т.п. Пригодными для суппозиториев носителями являются, например, природные или отвержденные масла, воски, жиры, полужидкие и жидкие полиолы и т.п.
Фармацевтические препараты дополнительно могут содержать консерванты, солюбилизаторы, стабилизаторы, смачивающие агенты, эмульгаторы, подслащивающие вещества, красители, ароматические и вкусовые добавки, соли для изменения осмотического давления, буферы, маскирующие добавки или антиоксиданты. Однако они могут также включать другие вещества терапевтического действия.
Лекарственные средства, содержащие соединение формулы I или его фармацевтически приемлемую соль и терапевтически инертный носитель, также составляют предмет настоящего изобретения, равно как и способ их приготовления, который включает объединение одного или нескольких соединений формулы I и/или фармацевтически приемлемых кислотно-аддитивных солей, при необходимости совместно с одним или несколькими другими терапевтически ценными веществами, в пригодную для галенового введения форму вместе с одним или несколькими терапевтически инертными носителями.
В соответствии с настоящим изобретением соединения общей формулы I, a также их фармацевтически приемлемые соли могут быть использованы для лечения или профилактики расстройств центральной нервной системы, таких как депрессии, психозы, шизофрения, неврологические нарушения, расстройства памяти, болезнь Паркинсона, боковой амиотрофический склероз, болезнь Альцгеймера и болезнь Хантингтона, и для приготовления соответствующих лекарственных средств. Дозировку можно варьировать в широких пределах, и очевидно, она должна соответствовать индивидуальным особенностям в каждом конкретном случае. При пероральном введении доза составляет от примерно 0,01 мг в день до примерно 1000 мг в день соединения общей формулы I или соответствующего количества его фармацевтически приемлемой соли, хотя этот верхний предел можно также превысить, если в этом существует необходимость.
Ниже изобретение более подробно проиллюстрировано на примерах, которые, однако, не ограничивают его объем.
Пример 1
4-амино-N-(2-амино-6-метиламинопиримидин-4-ил)бензолсульфонамид
0,98 г (0,006 моль) 2-амино-4,6-дихлорпиримидина и 3,03 г (0,012 моль) калиевой соли N-(4-сульфамоилфенил)ацетамида при 140oС в течение 8 ч перемешивали в 10 мл 1-метил-2-пирролидона. Затем в глубоком вакууме отгоняли растворитель, остаток распределяли в смеси этилацетата с водой, неорганическую фазу насыщали хлоридом натрия, а оставшийся этилацетат, растворенный в водной фазе, отгоняли в роторном испарителе. Водную фазу подкисляли 1н. HCl, выделившиеся кристаллы отфильтровывали вакуум-фильтрацией и промывали водой. После сушки получали 1,37 г (67%) N-[4-(2-амино-6-хлорпиримидин-4-илсульфамоил)фенил] ацетамида в виде бежевых кристаллов; tпл 272-273oС (с разложением).
0,885 г (0,0026 моль) N-[4-(2-амино-6-хлорпиримидин-4-ил-сульфамоил)фенил] ацетамида растворяли в 31 мл 0,5н. NaOH и кипятили с обратным холодильником в течение 3 ч. Смесь экстрагировали этилацетатом, водную фазу насыщали хлоридом натрия, а оставшийся этилацетат отгоняли в роторном испарителе. Затем водную фазу подкисляли 3н. HCl, а выделившийся осадок отфильтровывали вакуум-фильтрацией. После сушки получали 0,76 г (86%) 4-амино-N-(2-амино-6-хлорпиримидин-4-ил)бензолсульфонамида в виде бежевых кристаллов; tпл>265oC (с разложением).
0,527 г (0,00176 моль) 4-амино-N-(2-амино-6-хлорпиримидин-4-ил)бензолсульфонамида растворяли в 22 мл (0,176 моль) 8М раствора метиламина в этаноле и перемешивали в автоклаве при 130oС в течение 16 ч. Полученную суспензию фильтровали, осадок растворяли в этаноле, обрабатывали активированным углем, фильтровали и удаляли растворитель. Остаток суспендировали в этаноле и фильтровали. Таким путем получали 0,055 г (10%) 4-амино-N-(2-амино-6-метиламинопиримидин-4-ил)бензолсульфонамида в виде бежевых кристаллов; tпл> 285oС (с разложением).
Пример 2
4-амино-N-(2-амино-6-этиламинопиримидин-4-ил)бензолсульфонамид
0,50 г (0,00167 моль) 4-амино-N-(2-амино-6-хлорпиримидин-4-ил)бензолсульфонамида и 11 мл (0,167 моль) этиламина растворяли в 20 мл этанола и перемешивали в автоклаве при 130oС в течение 4 ч. Из реакционной смеси удаляли растворитель, остаток суспендировали в 5 мл этанола и обрабатывали в ультразвуковой бане в течение 15 мин. Осадок отфильтровывали, растворяли в 10 мл 0,1н. NaOH и фильтровали. Значение рН фильтрата доводили до 6 добавлением 0,1н. HCl. Осадок отфильтровывали вакуум-фильтрацией, промывали водой и сушили. Таким путем получали 0,271 г (53%) 4-амино-N-(2-амино-6-этиламинопиримидин-4-ил)бензолсульфонамида в виде бежевых кристаллов; tпл 272-274oС.
Пример 3
4-амино-N-(2-амино-6-бензиламинопиримидин-4-ил)бензолсульфонамид
0,30 г (0,001 моль) 4-амино-N-(2-амино-6-хлорпиримидин-4-ил)бензолсульфонамида и 11 мл (0,1 моль) бензиламина растворяли в 15 мл этанола и перемешивали в автоклаве при 130oС. Из реакционной смеси удаляли растворитель, остаток суспендировали в 5 мл этанола и обрабатывали в ультразвуковой бане в течение 15 мин. Осадок отфильтровывали, растворяли в 10 мл 0,1н. NaOH и фильтровали. Значение рН фильтрата доводили до 6 добавлением 0,1н. HCl. Осадок отфильтровывали вакуум-фильтрацией, промывали водой и сушили. Таким путем получали 0,15 г (41%) 4-амино-N-(2-амино-6-бензиламинопиримидин-4-ил)бензолсульфонамида в виде бежевых кристаллов; tпл >221oС (с разложением).
Пример 4
4-амино-N-(2,6-бисметиламинопиримидин-4-ил)бензолсульфонамид
5,0 г (0,016 моль) сульфадиметоксина растворяли в 60 мл 33%-ного этанольного раствора метиламина и перемешивали в автоклаве при 150oС в течение 30 ч. Смесь охлаждали, полностью удаляли растворитель, растирали в 70 мл метанола в течение 2 ч и фильтровали вакуум-фильтраций. Таким путем получали 4,2 г (84%) 4-амино-N-(2,6-бисметиламинопиримидин-4-ил)бензолсульфонамида в виде серых кристаллов; tпл 303-305oС.
11,5 г (0,0373 моль) 4-амино-N-(2,6-бисметиламинопиримидин-4-ил)бензолсульфонамида обрабатывали 11,5 мл 25%-ной водной соляной кислоты и перемешивали при 0oС в течение 1 ч. Воду полностью выпаривали, а остаток перекристаллизовывали из этанола/диэтилового эфира. Таким путем получали 11,8 г (89%) гидрохлорида 4-амино-N-(2,6-бисметиламинопиримидин-4-ил)бензолсульфонамида (1:1,8) в виде бледно-желтых кристаллов; tпл 175-250oС (с разложением).
Пример 5
4-амино-N-(6-этиламино-2-метиламинопиримидин-4-ил)бензолсульфонамид
2,0 г (0,011 моль) (4,6-дихлорпиримидин-2-ил)метиламина и 5,67 г (0,022 моль) калиевой соли N-(4-сульфамоилфенил)ацетамида при 140oС в течение 8 ч перемешивали в 10 мл 1-метил-2-пирролидона. Затем в глубоком вакууме отгоняли растворитель, остаток распределяли в смеси этилацетата с водой, неорганическую фазу насыщали хлоридом натрия, а оставшийся этилацетат, растворенный в водной фазе, отгоняли в роторном испарителе. Водную фазу подкисляли 1н. HCl, выделившиеся кристаллы отфильтровывали вакуум-фильтрацией и промывали водой. После сушки в виде бежевых кристаллов получали 2,72 г (68%) N-[4-(6-хлор-2-метиламинопиримидин-4-илсульфамоил)фенил] ацетамида; tпл>240oС (с разложением).
2,7 г (0,008 моль) N-[4-(6-хлор-2-метиламинопиримидин-4-илсульфамоил)фенил] ацетамида растворяли в 76 мл 1н. NaOH и кипятили с обратным холодильником в течение 3 ч. Смесь экстрагировали этилацетатом, водную фазу насыщали хлоридом натрия, а оставшийся этилацетат отгоняли в роторном испарителе. Затем водную фазу подкисляли 3н. HCl, а выделившийся осадок отфильтровывали вакуум-фильтрацией. После сушки в виде белых кристаллов получали 2,12 г (89%) гидрохлорида 4-амино-N-(6-хлор-2-метиламинопиримидин-4-ил)бензолсульфонамида (1: 1,9); масс-спектрограмма (ISN): me/e= 312 (C11H11ClN5O2S-).
0,314 г (0,001 моль) 4-амино-N-(6-хлор-2-метиламинопиримидин-4-ил)бензолсульфонамида и 6,6 мл (0,1 моль) этиламина перемешивали в 15 мл этанола в автоклаве при 130oС в течение 3 ч. Из реакционной смеси удаляли растворитель, остаток суспендировали в 8 мл этанола и в течение 15 мин обрабатывали в ультразвуковой бане. Осадок отфильтровывали, растворяли в 10 мл 0,1н. NaOH и фильтровали. Значение рН фильтрата доводили до 6 добавлением 0,1н. HCl. Осадок отфильтровывали вакуум-фильтрацией, промывали водой и сушили. В виде белых кристаллов получали 0,18 г (56%) 4-амино-N-(6-этиламино-2-метиламинопиримидин-4-ил)бензолсульфонамида; tпл> 252oС (с разложением).
Пример 6
4-амино-N-(6-изопропиламино-2-метиламинопиримидин-4-ил)бензолсульфонамид
0,314 г (0,001 моль) 4-амино-N-(6-хлор-2-метиламинопиримидин-4-ил)бензолсульфонамида и 8,6 мл (0,1 моль) изопропиламина перемешивали в 15 мл этанола в автоклаве при 130oС в течение 3 ч. Из реакционной смеси удаляли растворитель, остаток суспендировали в 8 мл этанола и в течение 15 мин обрабатывали в ультразвуковой бане. Осадок отфильтровывали, растворяли в 10 мл 0,1н. NaOH и фильтровали. Значение рН фильтрата доводили до 6 добавлением 0,1н. HCl. Осадок отфильтровывали вакуум-фильтрацией, промывали водой и сушили. В виде бежевых кристаллов получали 0,12 г (36%) 4-амино-N-(6-изопропиламино-2-метиламинопиримидин-4-ил)бензолсульфонамида; tпл> 240oС (с разложением).
Пример 7
4-амино-N-(6-диметиламино-2-метиламинопиримидин-4-ил)бензолсульфонамид
0,314 г (0,001 моль) 4-амино-N-(6-хлор-2-метиламинопиримидин-4-ил)бензолсульфонамида и 18 мл (0,1 моль) диметиламина в этаноле (5,6 М) перемешивали в автоклаве при 130oС в течение 4 ч. Из реакционной смеси удаляли растворитель, остаток суспендировали в 5 мл этанола и в течение 15 мин обрабатывали в ультразвуковой бане. Осадок отфильтровывали, растворяли в 10 мл 0,1н. NaOH и фильтровали. Значение рН фильтрата доводили до 6 добавлением 0,1н. HCl. Осадок отфильтровывали вакуум-фильтрацией, промывали водой и сушили. Таким путем получали 0,30 г (78%) 4-амино-N-(6-диметиламино-2-метиламинопиримидин-4-ил)бензолсульфонамида в виде бежевых кристаллов; tпл>300oC.
Пример 8
4-амино-N-(6-азетидин-1-ил-2-метиламинопиримидин-4-ил)бензолсульфонамид
0,314 г (0,001 моль) 4-амино-N-(6-хлор-2-метиламинопиримидин-4-ил)бензолсульфонамида и 1,0 мл (0,015 моль) триметиленимина перемешивали в 20 мл этанола в автоклаве при 130oС в течение 4 ч. Из реакционной смеси удаляли растворитель, остаток суспендировали в 5 мл этанола и в течение 15 мин обрабатывали в ультразвуковой бане. Осадок отфильтровывали, растворяли в 10 мл 0,1н. NaOH и фильтровали. Значение рН фильтрата доводили до 6 добавлением 0,1н. HCl. Осадок отфильтровывали вакуум-фильтрацией, промывали водой и сушили. Таким путем получали 0,24 г (72%) 4-амино-N-(6-азетидин-1-ил-2-метиламинопиримидин-4-ил)бензолсульфонамида в виде белых кристаллов; tпл 295-296oС.
Пример 9
4-амино-N-(2-метиламино-6-пирролидин-1-илпиримидин-4-ил)бензолсульфонамид
0,314 г (0,001 моль) 4-амино-N-(6-хлор-2-метиламинопиримидин-4-ил)бензолсульфонамида и 2,5 мл (0,15 моль) пирролидина перемешивали в 20 мл этанола в автоклаве при 130oС в течение 4 ч. Из реакционной смеси удаляли растворитель, остаток суспендировали в 5 мл этанола и в течение 15 мин обрабатывали в ультразвуковой бане. Осадок отфильтровывали, растворяли в 150 мл 0,1н. NaOH и фильтровали. Значение рН фильтрата доводили до 6 добавлением 0,1н. HCl. Осадок отфильтровывали вакуум-фильтрацией, промывали водой и сушили. Таким путем получали 0,22 г (63%) 4-амино-N-(2-метиламино-6-пирролидин-1-илпиримидин-4-ил)бензолсульфонамида в виде бежевых кристаллов; tпл>300oС.
Пример 10
4-амино-N-(2-этиламино-6-метиламинопиримидин-4-ил)бензолсульфонамид
2,0 г (0,011 моль) (4,6-дихлорпиримидин-2-ил)этиламина и 5,67 г (0,022 моль) калиевой соли N-(4-сульфамоилфенил)ацетамида при 140oС в течение 8 ч перемешивали в 10 мл 1-метил-2-пирролидона. Затем в глубоком вакууме отгоняли растворитель, остаток распределяли в смеси этилацетата с водой, неорганическую фазу насыщали хлоридом натрия, а оставшийся этилацетат, растворенный в водной фазе, отгоняли в роторном испарителе. Водную фазу подкисляли 1н. HCl, выделившиеся кристаллы отфильтровывали вакуум-фильтрацией и промывали водой. После сушки получали 2,88 г (75%) N-[4-(6-хлор-2-этиламинопиримидин-4-илсульфамоил)фенил] ацетамида в виде бежевых кристаллов, который использовали непосредственно на последующей стадии.
2,88 г (0,0075 моль) N-[4-(6-хлор-2-этиламинопиримидин-4-ил-сульфамоил)фенил] ацетамида растворяли в 76 мл 1н. NaOH и кипятили с обратным холодильником в течение 3 ч. Смесь экстрагировали этилацетатом, водную фазу насыщали хлоридом натрия, а оставшийся этилацетат отгоняли в роторном испарителе. Затем водную фазу подкисляли 3н. HCl, а выделившийся осадок отфильтровывали вакуум-фильтрацией. После сушки получали 2,2 г (90%) 4-амино-N-(6-хлор-2-этиламинопиримидин-4-ил)бензолсульфонамида в виде белых кристаллов; tпл 172-173oС.
0,1 г (0,00031 моль) 4-амино-N-(6-хлор-2-этиламинопиримидин-4-ил)бензолсульфонамида растворяли в 20 мл этанола и перемешивали с 0,6 мл (0,0043 моль) триметиламина и 0,1 г (0,0015 моль) метиламингидрохлорида в автоклаве при 130oС в течение 4 ч. Из реакционной смеси удаляли растворитель, остаток суспендировали в 5 мл этанола и в течение 15 мин обрабатывали в ультразвуковой бане. Осадок отфильтровывали, растворяли в 150 мл 0,1н. NaOH и фильтровали. Значение рН фильтрата доводили до 6 добавлением 0,1н. HCl. Осадок отфильтровывали вакуум-фильтрацией, промывали водой и сушили. Таким путем получали 0,053 г (54%) 4-амино-N-(2-этиламино-6-метиламинопиримидин-4-ил)бензолсульфонамида в виде бежевых кристаллов; tпл 261-263oС.
Пример 11
4-амино-N-(2,6-бисэтиламинопиридин-4-ил)бензолсульфонамид
1,50 г (0,00483 моль) сульфадиметоксина растворяли в 25 мл этанола, обрабатывали 12,5 мл (0,193 моль) охлажденного этиламина и перемешивали в автоклаве при 180oС в течение 24 ч. Смесь охлаждали и полностью удаляли растворитель. Остаток суспендировали в 150 мл горячего этанола и фильтровали вакуум-фильтрацией. Таким путем получали 0,79 г (40%) 4-амино-N-(2,6-бисэтиламинопиримидин-4-ил)бензолсульфонамида в виде бледно-бежевых кристаллов.
0,79 г (0,00234 моль) 4-амино-N-(2,6-бисэтиламинопиримидин-4-ил)бензолсульфонамида растворяли в 150 мл метанола, обрабатывали 2,0 мл (0,0070 моль) 3,5н. этанольного раствора соляной кислоты и перемешивали при 0oС в течение 2 ч. Из раствора полностью удаляли растворитель и остаток перекристаллизовывали из этанола/диэтилового эфира. Таким путем получали 0,61 г (70%) гидрохлорида 4-амино-N-(2,6-бисэтиламинопиримидин-4-ил)бензолсульфонамида в виде бледно-бежевых кристаллов; tпл 197-208oС.
Пример 12
4-амино-N-(2-этиламино-6-изопропиламинопиримидин-4-ил)бензолсульфонамида
0,5 г (0,0015 моль) 4-амино-N-(6-хлор-2-этиламинопиримидин-4-ил)бензолсульфонамида растворяли в 20 мл этанола и перемешивали с 13 мл (0,15 моль) изопропиламина в автоклаве при 130oС в течение 4 ч. Из реакционной смеси удаляли растворитель, остаток суспендировали в 5 мл этанола и в течение 15 мин обрабатывали в ультразвуковой бане. Осадок отфильтровывали, растворяли в 10 мл 0,1н. NaOH и фильтровали. Значение рН фильтрата доводили до 6 добавлением 0,1н. HCl. Осадок отфильтровывали вакуум-фильтрацией, промывали водой и сушили. Таким путем получали 0,20 г (37%) 4-амино-N-(2-этиламино-6-изопропиламинопиримидин-4-ил)бензолсульфонамида в виде белых кристаллов; tпл 258-259oС.
Пример 13
4-амино-N-(6-диметиламино-2-этиламинопиримидин-4-ил)бензолсульфонамид
0,5 г (0,0015 моль) 4-амино-N-(6-хлор-2-этиламинопиримидин-4-ил)бензолсульфонамида растворяли в 20 мл 33%-ного раствора диметиламина в этаноле и перемешивали в автоклаве при 130oС в течение 4 ч. Из реакционной смеси удаляли растворитель, остаток суспендировали в 5 мл этанола и в течение 15 мин обрабатывали в ультразвуковой бане. Осадок отфильтровывали, растворяли в 10 мл 0,1н. NaOH и фильтровали. Значение рН фильтрата доводили до 6 добавлением 0,1н. HCl. Осадок отфильтровывали вакуум-фильтрацией, промывали водой и сушили. Таким путем получали 0,426 г (83%) 4-амино-N-(6-диметиламино-2-этиламинопиримидин-4-ил)бензолсульфонамида в виде белых кристаллов; tпл 301-302oС.
Пример 14
4-амино-N-(6-азетидин-1-ил-2-этиламинопиримидин-4-ил)бензолсульфонамид
0,3 г (0,000915 моль) 4-амино-N-(6-хлор-2-этиламинопиримидин-4-ил)бензолсульфонамида растворяли в 20 мл этанола, обрабатывали 0,93 мл (0,0137 моль) триметиленимина и перемешивали в автоклаве при 130oС в течение 4 ч. Из реакционной смеси удаляли растворитель, остаток суспендировали в 5 мл этанола и в течение 15 мин обрабатывали в ультразвуковой бане. Осадок отфильтровывали, растворяли в 10 мл 0,1н. NaOH и фильтровали. Значение рН фильтрата доводили до 6 добавлением 0,1н. HCl. Осадок отфильтровывали вакуум-фильтрацией, промывали водой и сушили. Таким путем получали 0,248 г (78%) 4-амино-N-(6-азетидин-1-ил-2-этиламинопиримидин-4-ил)бензолсульфонамида в виде белых кристаллов; tпл 292-293oС.
Пример 15
4-амино-N-(2,6-биспропиламинопиримидин-4-ил)бензолсульфонамид
1,50 г (0,00483 моль) сульфадиметоксина суспендировали в 20 мл этанола, обрабатывали 16 мл (0,193 моль) пропиламина и перемешивали в автоклаве при 140oС в течение 65 ч. Смесь охлаждали и по истечении 24 ч выделившиеся кристаллы отфильтровывали вакуум-фильтрацией. Таким путем получали 0,75 г (50%) 4-амино-N-(2,6-биспропиламинопиримидин-4-ил)бензолсульфонамида в виде бледно-бежевых кристаллов; tпл 211-215oС.
0,75 г (0,00205 моль) 4-амино-N-(2,6-биспропиламинопиримидин-4-ил)бензолсульфонамида растворяли в 100 мл метанола, обрабатывали 1,5 мл (0,0062 моль) 3,5н. этанольного раствора соляной кислоты и перемешивали при 0oС в течение 2 ч. Из раствора полностью удаляли растворитель и остаток перекристаллизовывали из этанола/диэтилового эфира. Таким путем получали 0,86 г (82%) гидрохлорида 4-амино-N-(2,6-биспропиламинопиримидин-4-ил)бензолсульфонамида в виде бежевых кристаллов; tпл 189-195oС.
Пример 16
4-амино-N-(6-этиламино-2-изопропиламинопиримидин-4-ил)бензолсульфонамид
2,42 г (0,0117 моль) (4,6-дихлорпиримидин-2-ил)этиламина и 5,0 г (0,020 моль) калиевой соли N-(4-сульфамоилфенил)ацетамида перемешивали при 140oС в течение 8 ч в 10 мл 1-метил-2-пирролидона. Затем в глубоком вакууме отгоняли растворитель, остаток распределяли в смеси этилацетата с водой, неорганическую фазу насыщали хлоридом натрия, а оставшийся этилацетат, растворенный в водной фазе, отгоняли в роторном испарителе. Водную фазу подкисляли 1н. HCl, осадок, который при этом выделялся, отфильтровывали вакуум-фильтрацией и промывали водой. Этот продукт непосредственно использовали без сушки на последующей стадии.
Сырой продукт, полученный на стадии, описанной выше, растворяли в 100 мл 1н. NaOH и кипятили с обратным холодильником в течение 3 ч. Смесь экстрагировали этилацетатом, водную фазу насыщали хлоридом натрия, а оставшийся этилацетат отгоняли в роторном испарителе. Затем водную фазу подкисляли 3н. HCl, а осадок, который при этом выделялся, отфильтровывали вакуум-фильтрацией. После сушки получали 2,22 г [55% в пересчете на (4,6-дихлорпиримидин-2-ил)этиламин, использованный на предыдущей стадии] 4-амино-N-(6-хлор-2-изопропиламинопиримидин-4-ил)бензолсульфонамида в виде белых кристаллов; tпл 94-95oС.
0,1 г (0,000293 моль) 4-амино-N-(6-хлор-2-изопропиламинопиримидин-4-ил)бензолсульфонамида растворяли в 20 мл этанола, обрабатывали 1,93 мл (0,0293 моль) этиламина и перемешивали в автоклаве при 130oС в течение 4 ч. Из реакционной смеси удаляли растворитель, остаток суспендировали в 5 мл этанола и в течение 15 мин обрабатывали в ультразвуковой бане. Осадок отфильтровывали, растворяли в 10 мл 0,1н. NaOH и фильтровали. Значение рН фильтрата доводили до 6 добавлением 0,1н. HCl. Осадок отфильтровывали вакуум-фильтрацией, промывали водой и сушили. Таким путем получали 0,044 г (43%) 4-амино-N-(6-этиламино-2-изопропиламинопиримидин-4-ил)бензолсульфонамида в виде белых кристаллов; tпл 266-267oС.
Пример 17
4-амино-N-(2-диметиламино-6-метиламинопиримидин-4-ил)бензолсульфонамид
0,50 г (0,00153 моль) 4-амино-N-(2-диметиламино-6-хлорпиримидин-4-ил)бензолсульфонамида растворяли в 20 мл (0,176 моль) 8М раствора метиламина в этаноле и перемешивали в автоклаве при 130oС в течение 4 ч. Из реакционной смеси удаляли растворитель, остаток хроматографировали на силикагеле с использованием метанола/дихлорметана в соотношении 1:19. Таким путем получали 0,10 г (21%) 4-амино-N-(2-диметиламино-6-метиламинопиримидин-4-ил)бензолсульфонамида в виде бежевых кристаллов; tпл 253-254oС.
Пример 18
4-амино-N-(2-диметиламино-6-этиламинопиримидин-4-ил)бензолсульфонамид
0,2 г (0,00061 моль) 4-амино-N-(6-хлор-2-диметиламинопиримидин-4-ил)бензолсульфонамида растворяли в 20 мл этанола, обрабатывали 4,2 мл (0,061 моль) этиламина и перемешивали в автоклаве при 130oС в течение 4 ч. Из реакционной смеси удаляли растворитель, остаток суспендировали в 5 мл этанола и в течение 15 мин обрабатывали в ультразвуковой бане. Остаток отфильтровывали, растворяли в 10 мл 0,1н. NaOH и фильтровали. Значение рН фильтрата доводили до 6 добавлением 0,1н. HCl. Осадок отфильтровывали вакуум-фильтрацией, промывали водой и сушили. Таким путем получали 0,082 г (40%) 4-амино-N-(2-диметиламино-6-этиламинопиримидин-4-ил)бензолсульфонамида в виде бежевых кристаллов; tпл 237-238oС.
Пример 19
4-амино-N-(2,6-бисметиламинопиримидин-4-ил)-N-метилбензолсульфонамид
0,65 г (0,0021 моль) 4-амино-N-(2,6-бисметиламинопиримидин-4-ил)бензолсульфонамида растворяли в смеси 100 мл метанола с 400 мл диметилформамида и обрабатывали 60 мл раствора диазометана в диэтиловом эфире. Эту смесь перемешивали при комнатной температуре в течение 30 мин. Растворитель отгоняли и остаток хроматографировали на 50 г SiO2 5%-ным раствором метанола в хлористом метилене в качестве элюента. Таким путем получали 0,24 г (35%) 4-амино-N-(2,6-бисметиламинопиримидин-4-ил)-N-метилбензолсульфонамида в виде желтого твердого вещества; tпл 79-80oС.
Пример 20
4-амино-N-(6-азетидин-1-ил-2-диметиламинопиримидин-4-ил)бензолсульфонамид
0,20 г (0,00061 моль) 4-амино-N-(6-хлор-2-диметиламинопиримидин-4-ил)бензолсульфонамида растворяли в 20 мл этанола, обрабатывали 0,62 мл (0,0092 моль) триметиленимина и перемешивали в автоклаве при 130oС в течение 4 ч. Из реакционной смеси удаляли растворитель, остаток суспендировали в 5 мл этанола и в течение 15 мин обрабатывали в ультразвуковой бане. Осадок отфильтровывали, растворяли в 10 мл 0,1н. NaOH и фильтровали. Значение рН фильтрата доводили до 6 добавлением 0,1н. HCl. Осадок отфильтровывали вакуум-фильтрацией, промывали водой и сушили. Таким путем получали 0,13 г (61%) 4-амино-N-(6-азетидин-1-ил-2-диметиламинопиримидин-4-ил)бензолсульфонамида в виде бежевых кристаллов; tпл 239-240oC.
Пример 21
4-амино-N-(2-азетидин-1-ил-6-метиламинопиримидин-4-ил)бензолсульфонамид
2,0 мл (0,030 моль) триметиленимина и 2,30 мл (0,020 моль) 2,4,6-трихлорпиримидина при комнатной температуре в течение 3 ч перемешивали в 50 мл этанола. Растворитель отгоняли, остаток суспендировали в диэтиловом эфире и промывали насыщенным раствором NаНСО3. Органическую фазу сушили над MgSO4, концентрировали и остаток хроматографировали на силикагеле диэтиловым эфиром/гексаном в переменном соотношении от 1:5 до 2:1 (градиентное элюирование). Первая фракция (Rf=0,39, диэтиловый эфир/гексан в соотношении 1:3) содержала 0,67 г (16%) 2-азетидин-1-ил-4,6-дихлорпиримидина в виде белых кристаллов; tпл 109oС. Вторая фракция содержала 1,57 г (37%) 2,4-дихлор-6-азетидин-1-этилпиримидина в виде белых кристаллов; tпл 129-130oС.
0,65 г (0,0032 моль) 2-азетидин-1-ил-4,6-дихлорпиримидина и 1,6 г (0,0064 моль) калиевой соли N-(4-сульфамоилфенил)ацетамида при 140oС в течение 8 ч перемешивали в 10 мл 1-метил-2-пирролидона. Затем в глубоком вакууме отгоняли растворитель, остаток распределяли в смеси этилацетата с водой, неорганическую фазу насыщали хлоридом натрия, а оставшийся этилацетат, растворенный в водной фазе, отгоняли в роторном испарителе. Водную фазу подкисляли 1н. HCl, выделившийся осадок отфильтровывали вакуум-фильтрацией и промывали водой. Этот продукт без сушки использовали непосредственно на последующей стадии.
Сырой продукт, полученный на стадии, описанной выше, растворяли в 50 мл 1н. NaOH и кипятили с обратным холодильником в течение 2 ч. Смесь экстрагировали этилацетатом, водную фазу насыщали хлоридом натрия, а оставшийся этилацетат отгоняли в роторном испарителе. Затем водную фазу подкисляли 3н. HCl, а осадок, который при этом выделялся, отфильтровывали вакуум-фильтрацией. После сушки получали 0,66 г (60% в пересчете на 2-азетидин-1-ил-4,6-дихлорпиримидина, использованного на предыдущей стадии) 4-амино-N-(2-азетидин-1-ил-6-хлорпиримидин-4-ил)бензолсульфонамида в виде бежевых кристаллов; tпл>203oС (с разложением).
0,20 г (0,00059 моль) 4-амино-N-(2-азетидин-1-ил-6-хлорпиримидин-4-ил)бензолсульфонамида растворяли в 20 мл этанола, обрабатывали 0,4 г (0,00588 моль) гидрохлорида метиламина и 2,28 мл (0,0176 моль) триэтиламина и перемешивали в автоклаве при 130oС в течение 8 ч. Из реакционной смеси удаляли растворитель и остаток хроматографировали на силикагеле метанолом/дихлорметаном в соотношении 1: 19. Таким путем получали 0,053 г (27%) 4-амино-N-(2-азетидин-1-ил-6-метиламинопиримидин-4-ил)бензолсульфонамида в виде светло-бежевых кристаллов; tпл>260oC (с разложением).
Пример 22
4-амино-N-(2-азетидин-1-ил-6-этиламинопиримидин-4-ид)бензолсульфонамид
0,2 г (0,00061 моль) 4-амино-N-(2-азетидин-1-ил-6-хлорпиримидин-4-ил)бензолсульфонамида растворяли в 20 мл этанола, обрабатывали 3,9 г (0,061 моль) этиламина и перемешивали в автоклаве при 130oС в течение 12 ч. Из реакционной смеси удаляли растворитель, остаток суспендировали в 5 мл этанола и в течение 15 мин обрабатывали в ультразвуковой бане. Осадок отфильтровывали, растворяли в 10 мл 0,1н. NaOH и фильтровали. Значение рН фильтрата доводили до 6 добавлением 0,1н. HCl. Осадок отфильтровывали вакуум-фильтрацией, промывали водой и сушили. Таким путем получали 0,090 г (44%) 4-амино-N-(2-азетидин-1-ил-N-этиламинопиримидин-4-ил)бензолсульфонамида в виде бежевых кристаллов; tпл 260-262oС.
Пример 23
4-амино-N-(6-метиламино-2-пирролидин-1-илпиримидин-4-ил)бензолсульфонамид
0,58 г (0,00266 моль) 4,6-дихлор-2-пирролидин-1-илпиримидина и 1,36 г (0,00539 моль) калиевой соли N-(4-сульфамоилфенил)ацетамида при 140oС в течение 8 ч перемешивали в 10 мл 1-метил-2-пирролидона. Затем в глубоком вакууме отгоняли растворитель, остаток распределяли в смеси этилацетата с водой и экстрагировали. Водную фазу подкисляли 4н. HCl и экстрагировали этилацетатом. Обе органические фазы объединяли и концентрировали. Остаток перекристаллизовывали из небольшого количества этанола и маточный раствор хроматографировали на силикагеле с использованием циклогексана/этилацетата в соотношении 2: 1 в качестве элюента. В общей сложности получали 0,62 г (66%) N-[4-(6-хлор-2-пирролидин-1-илпиримидин-4-илсульфамоил)фенил] ацетамида в виде беловатых кристаллов; tпл 229-233oС.
0,62 г (0,00175 моль) N-[4-(6-хлор-2-пирролидин-1-илпиримидин-4-илсульфамоил)фенил] ацетамида растворяли в 20 мл этанола, обрабатывали 1,36 г (0,0201 моль) гидрохлорида метиламина и 5,3 мл (0,038 моль) триэтиламина и перемешивали в автоклаве при 140oС в течение 17 ч. Из смеси полностью удаляли растворитель, остаток распределяли в смеси этилацетата с водой и фильтровали вакуум-фильтрацией. Таким путем получали 0,30 г (44%) N-[4-(6-метиламино-2-пирролидин-1-илпиримидин-4-илсульфамоил)фенил] ацетамида в виде бежевых кристаллов; tпл 271-274oС.
0,30 г (0,00077 моль) N-[4-(6-метиламино-2-пирролидин-1-ил-пиримидин-4-илсульфамоил)фенил]ацетамида кипятили с обратным холодильником в 30 мл 1н. водного раствора гидроксида натрия в течение 3 ч. Смесь охлаждали и экстрагировали этилацетатом. После этого из водной фазы выделялись кристаллы, которые отфильтровывали вакуум-фильтрацией и хроматографировали на силикагеле с использованием этилацетата/этанола в соотношении 9:1 в качестве элюента. Таким путем получали 0,082 г (30%) 4-амино-N-(6-метиламино-2-пирролидин-1-илпиримидин-4-ил)бензолсульфонамида в виде бежевых кристаллов; tпл 299-301oС.
Пример 24
4-амино-N-(6-амино-2-меркаптопиримидин-4-ил)бензолсульфонамид
1 г (0,0043 моль) 4-ацетаминобензолсульфохлорида растворяли в 20 мл пиридина и обрабатывали 0,64 г (0,0045 моль) 4,6-диаминопиримидин-2-тиола. Смесь перемешивали при комнатной температуре в течение 2 ч, сливали в 30 мл воды, вакуум-фильтрацией отфильтровывали осадок и растворяли в 40 мл 1н. NaOH. Реакционную смесь кипятили с обратным холодильником в течение 2 ч, фильтровали, фильтрат обрабатывали 1н. HCl, доводя значение рН до 6, выделившийся осадок отфильтровывали. Этот осадок тщательно промывали водой и сушили. Таким путем получали 0,96 г (75%) 4-амино-N-(6-амино-2-меркаптопиримидин-4-ил)бензолсульфонамида в виде желтоватых кристаллов; tпл 232-234oC.
Пример 25
4-амино-N-(2-амино-6-метоксипиримидин-4-ил)бензолсульфонамид
0,27 г (0,0009 моль) 4-амино-N-(2-амино-6-хлорпиримидин-4-ил)бензолсульфонамида растворяли в растворе 0,23 г натрия в 20 мл метанола и перемешивали в автоклаве при 150oС в течение 9 ч. Растворитель отгоняли, остаток добавляли в воду и значение рН доводили до 4-5 добавлением 0,1н. HCl. Осадок, который при этом выделялся, отфильтровывали вакуум-фильтрацией, промывали водой и сушили. Полученные кристаллы растирали в 20 мл метанола, вновь отфильтровывали и сушили в глубоком вакууме. Таким путем получали 0,25 г (94%) 4-амино-N-(2-амино-6-метоксипиримидин-4-ил)бензолсульфонамида в виде бежевых кристаллов; tпл>250oС (с разложением).
Пример 26
4-амино-N-(4,6-бисметиламинопиримидин-2-ил)бензолсульфонамид
0,25 г (0,0008 моль) 4-амино-N-(4,6-диметоксипиримидин-2-ил)бензолсульфонамида растворяли в 20 мл 8М раствора метиламина в этаноле и перемешивали в автоклаве при 130oС в течение 21 ч. После этого реакционную смесь концентрировали, остаток суспендировали в 5 мл этанола, обрабатывали в ультразвуковой бане и осадок отфильтровывали. Этот осадок растворяли в 5 мл 0,1н. NaOH, раствор фильтровали и значение рН доводили до 5 добавлением 0,1н. HCl. Осадок, который при этом выделялся, отфильтровывали и сушили. Таким путем получали 0,1 г (42%) 4-амино-N-(4,6-бисметиламинопиримидин-2-ил)бензолсульфонамида в виде желтых кристаллов; tпл 262-263oC.
Пример 27
N-(2,6-бисметиламинопиримидин-4-ил)-4-хлорбензолсульфонамид
0,39 г (0,0022 моль) (4,6-дихлорпиримидин-2-ил)метиламина и 1,0 г (0,0044 моль) калиевой соли 4-хлорбензолсульфонамида перемешивали при 150oС в течение 8 ч в 10 мл 1-метил-2-пирролидона. Затем в глубоком вакууме отгоняли растворитель, остаток распределяли в смеси этилацетата с водой и экстрагировали. Водную фазу насыщали хлоридом натрия, в течение непродолжительного периода времени упаривали в вакууме, подкисляли 4н. HCl и экстрагировали дихлорметаном. Оба экстракта объединяли и хроматографировали на силикагеле с использованием циклогексана/этилацетата в соотношении 1:1 в качестве элюента. Таким путем получали 0,62 г (85%) 4-хлор-N-(6-хлор-2-метиламинопиримидин-4-ил)бензолсульфонамида в виде белых кристаллов; tпл 196-198oС.
0,62 г (0,0019 моль) 4-хлор-N-(6-хлор-2-метиламинопиримидин-4-ил)бензолсульфонамида растворяли в 10 мл этанола, обрабатывали 1,67 г (0,025 моль) гидрохлорида метиламина и 6,2 мл (0,044 моль) триэтиламина и перемешивали в автоклаве при 140oС в течение 18 ч. Из смеси полностью удаляли растворитель, остаток распределяли в смеси этилацетат/вода и вакуум-фильтрацией отфильтровывали нерастворимые компоненты. Отфильтрованную лепешку перекристаллизовывали из метанола/диэтилового эфира. Таким путем получали 0,28 г (45%) N-(2,6-бисметиламинопиримидин-4-ил)-4-хлорбензолсульфонамида в виде белых кристаллов; tпл 272-273oС.
Пример 28
N-(2,6-бисметиламинопиримидин-4-ил)-4-трет-бутилбензолсульфонамид
0,39 г (0,0022 моль) (4,6-дихлорпиримидин-2-ил)метиламина и 1,1 г (0,0044 моль) калиевой соли 4-трет-бутилбензолсульфонамида при 150oС в течение 8 ч перемешивали в 10 мл 1-метил-2-пирролидона. Затем в глубоком вакууме отгоняли растворитель, остаток распределяли в смеси этилацетата с водой и экстрагировали. Водную фазу насыщали хлоридом натрия, дегазировали в вакууме и подкисляли добавлением 4н. HCl, в результате чего выделялся осадок. Смесь фильтровали вакуум-фильтрацией, экстракт и твердый продукт объединяли и хроматографировали на силикагеле с использованием циклогексана/этилацетата в соотношении 2:1 в качестве элюента. Продукт перекристаллизовывали из этилацетата/н-гексана. Таким путем получали 0,57 г (73%) 4-трет-бутил-N-(6-хлор-2-метиламинопиримидин-4-ил)бензолсульфонамида в виде белых кристаллов; tпл 118-137oC (с разложением).
0,47 г (0,0013 моль) 4-трет-бутил-N-(6-хлор-2-метиламинопиримидин-4-ил)бензолсульфонамида растворяли в 10 мл этанола, обрабатывали 1,3 г (0,019 моль) метиламингидрохлорида и 4,7 мл (0,034 моль) триэтиламина и перемешивали в автоклаве при 140oС в течение 18 ч. Из смеси полностью удаляли растворитель, остаток распределяли в смеси этилацетат/вода и вакуум-фильтрацией отфильтровывали нерастворимые компоненты. Отфильтрованную лепешку перекристаллизовывали из метанола/диэтилового эфира. Таким путем получали 0,15 г (33%) N-(2,6-бисметиламинопиримидин-4-ил)-4-трет-бутилбензолсульфонамида в виде белых кристаллов; tпл 316-318oС.
Пример 29
N-(2,6-бисметиламинопиримидин-4-ил)-4-фторбензолсульфонамид
0,46 г (0,0026 моль) (4,6-дихлорпиримидин-2-ил)метиламина и 1,1 г (0,0051 моль) калиевой соли 4-фторбензолсульфонамида при 150oС в течение 8 ч перемешивали в 10 мл 1-метил-2-пирролидона. Затем в глубоком вакууме отгоняли растворитель, остаток распределяли в смеси этилацетата с водой и экстрагировали. Водную фазу насыщали хлоридом натрия, в течение непродолжительного периода времени упаривали в вакууме и подкисляли добавлением 4н. HCl, в результате чего выделялся осадок. Смесь фильтровали вакуум-фильтрацией, экстракт и твердый продукт объединяли и хроматографировали на силикагеле с использованием циклогексана/этилацетата в соотношении 2:1 в качестве элюента. Продукт перекристаллизовывали из этилацетата/н-гексана. Таким путем получали 0,46 г (56%) N-(6-хлор-2-метиламинопиримидин-4-ил)-4-фторбензолсульфонамида в виде белых кристаллов; tпл 121-123oС.
0,36 г (0,0011 моль) N-(6-хлор-2-метиламинопиримидин-4-ил)-4-фторбензолсульфонамида растворяли в 10 мл этанола, обрабатывали 1,2 г (0,018 моль) гидрохлорида метиламина и 4,0 мл (0,029 моль) триэтиламина и перемешивали в автоклаве при 140oС в течение 17 ч. Из смеси полностью удаляли растворитель, остаток распределяли в смеси этилацетат/вода, вакуум-фильтрацией отфильтровывали нерастворимые компоненты и экстрагировали. Экстракт и твердый продукт объединяли и перекристаллизовывали из метанола/диэтилового эфира. Таким путем получали 0,15 г (43%) N-(2,6-бисметиламинопиримидин-4-ил)-4-фторбензолсульфонамида в виде белых кристаллов; tпл 261-263oС.
Пример 30
N-(2,6-бисметиламинопиримидин-4-ил)бензолсульфонамид
5,38 г (0,0275 моль) калиевой соли бензолсульфонамида и 2,45 г (0,0138 моль) 2-метиламино-4,6-дихлорпиримидина суспендировали в 22 мл 1-метил-2-пирролидона и перемешивали при 150oС в течение 24 ч. Затем в глубоком вакууме удаляли растворитель, а остаток суспендировали в 250 мл воды. Смесь трижды экстрагировали, используя каждый раз по 100 мл этилацетата, и объединенные органические фазы промывали 200 мл насыщенного раствора NaHCO3. Объединенные водные фазы подкисляли 3н. HCl и осадок, который при этом выделялся, отфильтровывали вакуум-фильтрацией. Этот осадок далее хроматографировали на силикагеле с использованием дихлорметана/метанола в переменном соотношении 99:1-98:2. Желтоватые кристаллы, полученные после хроматографии, суспендировали в 70 мл 1н. NaOH, суспензию фильтровали и значение рН прозрачного фильтрата доводили до 3,5 добавлением 1н. HCl. Осадок, который при этом выделялся, отделяли и сушили. Таким путем получали 1,9 г (46%) N-(2-метиламино-6-хлорпиримидин-4-ил)бензолсульфонамида в виде бесцветных кристаллов; tпл 186-187oС.
0,25 г (0,00084 моль) N-(2-метиламино-6-хлорпиримидин-4-ил)бензолсульфонамида растворяли в 20 мл 2 М раствора метиламина в ТГФ и перемешивали в автоклаве при 130oС в течение 3 ч. Из смеси удаляли растворитель, остаток растворяли в 25 мл NaOH, фильтровали и значение рН фильтрата доводили до 6 добавлением 1н. HCl. Осадок отфильтровывали вакуум-фильтрацией, сушили и хроматографировали на силикагеле с использованием дихлорметана/метанола в соотношении 95: 5. Таким путем получали 0,09 г (36%) N-(2,6-бисметиламинопиримидин-4-ил)бензолсульфонамида в виде желтоватых кристаллов; tпл>263oС (с разложением).
Пример 31
N-(2,6-бисметиламинопиримидин-4-ил)-4-метилбензолсульфонамид
0,30 г (0,00097 моль) N-(2,6-диметоксипиримидин-4-ил)-4-метилбензолсульфонамида растворяли в 30 мл 33%-ного этанольного раствора метиламина и перемешивали в автоклаве при 140oС в течение 24 ч. Смесь охлаждали и фильтровали вакуум-фильтрацией. Таким путем получали 0,125 г (42%) N-(2,6-бисметиламинопиримидин-4-ил)-4-метилбензолсульфонамида в виде серых кристаллов; tпл 270-272oС.
Пример 32
N-(2,6-бисметиламинопиримидин-4-ил)-3-хлорбензолсульфонамид
0,24 г (0,00135 моль) (4,6-дихлорпиримидин-2-ил)метиламина и 0,62 г (0,0027 моль) калиевой соли 3-хлорбензолсульфонамида при 150oС в течение 8 ч перемешивали в 10 мл 1-метил-2-пирролидона. Затем в глубоком вакууме отгоняли растворитель и остаток распределяли в смеси этилацетат/вода и экстрагировали. Водную фазу подкисляли 4н. HCl и экстрагировали дихлорметаном. Остаток хроматографировали на силикагеле с использованием циклогексана/этилацетата в соотношении 2: 1. Таким путем получали 0,24 г (53%) 3-хлор-N-(6-хлор-2-метиламинопиримидин-4-ил)бензолсульфонамида в виде желтых кристаллов; tпл 120-130oС (с разложением).
0,10 г (0,00030 моль) 3-хлор-N-(6-хлор-2-метиламинопиримидин-4-ил)бензолсульфонамида растворяли в 5 мл EtOH, обрабатывали 0,27 г (0,004 моль) гидрохлорида метиламина и 1 мл (0,007 моль) триэтиламина и перемешивали в автоклаве при 145oС в течение 17 ч. Всю реакционную смесь распределяли в смеси этилацетат/вода и экстрагировали. Остаток перекристаллизовывали из МеОН. Таким путем получали 0,04 г (41%) N-(2,6-бисметиламинопиримидин-4-ил)-3-хлорбензолсульфонамида в виде белых кристаллов; tпл 167-168oС.
Пример 33
N-(2,6-бисметиламинопиримидин-4-ил)-3-трифторметилбензолсульфонамид
0,27 г (0,00155 моль) (4,6-дихлорпиримидин-2-ил)метиламина и 0,82 г (0,0031 моль) калиевой соли 3-трифторметилбензолсульфонамида перемешивали при 150oС в течение 8 ч в 10 мл 1-метил-2-пирролидона. Затем в глубоком вакууме удаляли растворитель и остаток распределяли в смеси этилацетат/вода и экстрагировали. Водную фазу подкисляли 4н. HCl и экстрагировали дихлорметаном. Остаток хроматографировали на силикагеле с использованием циклогексана/этилацетата в соотношении 2: 1. Таким путем получали 0,26 г (69%) N-(6-хлор-2-метиламинопиримидин-4-ил)-3-трифторметилбензолсульфонамида в виде белых/бежевых кристаллов; tпл 190-193oС.
0,10 г (0,00027 моль) N-(6-хлор-2-метиламинопиримидин-4-ил)-3-трифторметилбензолсульфонамида растворяли в 5 мл EtOH, обрабатывали 0,27 г (0,004 моль) метиламингидрохлорида и 1 мл (0,007 моль) триэтиламина и перемешивали в автоклаве при 145oС в течение 17 ч. Всю реакционную смесь распределяли в смеси этилацетат/вода и экстрагировали. Остаток перекристаллизовывали из МеОН. Таким путем получали 0,055 г (56%) N-(2,6-бисметиламинопиримидин-4-ил)-3-трифторметилбензолсульфонамида в виде белых кристаллов; tпл 234-235oС.
Пример 34
4-амино-N-(3,5-диаминофенил)бензолсульфонамид
0,105 г (0,00033 моль) N-[4-(3,5-диаминофенилсульфамоил)фенил]ацетамида растворяли в 6,5 мл 1н. NaOH и кипятили с обратным холодильником в течение 15 ч. Смесь обрабатывали 50 мл насыщенного раствора хлорида аммония и дважды экстрагировали, используя каждый раз по 100 мл этилацетата. Объединенные органические фазы промывали насыщенным раствором хлорида натрия и сушили над MgSO4. После удаления растворителя остаток хроматографировали на оксиде алюминия (нейтральный, активность I) вначале 5%-ным, а затем 10%-ным раствором метанола в дихлорметане. Таким путем получали 0,05 г (55%) 4-амино-N-(3,5-диаминофенил)бензолсульфонамида в виде бежевого твердого вещества; tпл 188-190oС.
Пример 35
Гидрохлорид 4-амино-N-(3,5-бисметиламинофенил)бензолсульфонамида
0,24 г (0,001 моль) N-(3-ацетиламино-5-нитрофенил)ацетамида суспендировали в 20 мл ТГФ, обрабатывали 0,092 г (0,0023 моль) NaOH и 10 мл ДМФ и перемешивали при комнатной температуре в течение 15 ч. Затем в смесь добавляли 0,29 мл (0,0046 моль) метилиодида и эту смесь перемешивали дополнительно в течение 48 ч. После этого растворитель отгоняли, остаток растворяли в 100 мл воды, четырежды экстрагировали, используя каждый раз по 80 мл этилацетата, объединенные органические фазы промывали насыщенным раствором хлорида натрия и сушили над сульфатом натрия. После удаления растворителя остаток хроматографировали на силикагеле 3%-ным раствором метанола в дихлорметане. Таким путем получали 0,2 г (75%) N-[3-(ацетилметиламино)-5-нитрофенил]-N-метилацетамида в виде коричневого масла. МС (EI): m/e=265 (Cl2H15N3O4 +).
0,19 г (0,00072 моль) N-[3-(ацетилметиламино)-5-нитрофенил]-N-метилацетамида растворяли в 15 мл этанола, обрабатывали 0,019 г Pd/C (10%) и гидрировали газообразным водородом при комнатной температуре в течение 2 ч. Катализатор отфильтровывали, растворитель отгоняли и остаток хроматографировали на силикагеле этилацетатом. Таким путем получали 0,16 г (94%) N-[3-(ацетилметиламино)-5-аминофенил] -N-метилацетамида в виде белых кристаллов; tпл 179-181oС.
0,15 г (0,00063 моль) N-[3-(ацетилметиламино)-5-аминофенил]-N-метилацетамида растворяли в 3 мл пиридина, обрабатывали 0,154 г (0,00064 моль) 4-ацетаминобензолсульфохлорида и перемешивали при комнатной температуре в течение 16 ч. После этого из смеси удаляли растворитель, остаток растворяли в 25 мл воды, четыре раза экстрагировали, используя каждый раз по 200 мл этилацетата, объединенные органические фазы промывали насыщенным раствором хлорида натрия и сушили над сульфатом натрия. После удаления растворителя остаток хроматографировали на силикагеле вначале 2%-ным, а затем 5%-ным раствором метанола в дихлорметане. Таким путем получали 0,15 г (55%) N-[3-(4-ацетиламинофенилсульфониламино)-5-(ацетилметиламино)фенил] -N-метилацетамида в виде окрашенного в оранжевый цвет аморфного твердого вещества. МС (ISN): me/e=431 (C20H23N4O5S-).
0,113 г (0,00026 моль) N-[3-(4-ацетиламинофенилсульфониламино)-5-(ацетилметиламино)фенил] -N-метилацетамида растворяли в 10 мл 1н. NaOH и кипятили с обратным холодильником в течение 2 ч. Смесь нейтрализовывали 1н. HCl, экстрагировали этилацетатом и органическую фазу сушили над сульфатом натрия. После удаления растворителя остаток растворяли в 4 мл метанола и обрабатывали 3 мл 2 М HCl. После добавления 7-8 мл этилацетата продукт медленно отделялся. Этот продукт отфильтровывали и сушили в вакууме. Таким путем получали 0,085 г (74%) гидрохлорида 4-амино-N-(3,5-бисметиламинофенил)бензолсульфонамида (1: 2,6) в виде окрашенного в розовый цвет аморфного твердого вещества. МС (ISN): me/e=305 (C14H17N4O2S-).
Пример 36
4-амино-N-(3-метиламинофенил)бензолсульфонамид
1,3 г (0,0079 моль) N-(3-аминофенил)бензолсульфонамида растворяли в 50 мл пиридина, обрабатывали 1,94 г (0,0083 моль) 4-ацетаминобензолсульфохлорида и перемешивали при комнатной температуре в течение 18 ч. Пиридин отгоняли, остаток суспендировали в воде и фильтровали вакуум-фильтрацией. Остаток на вакуум-фильтре тщательно промывали водой и сушили в глубоком вакууме. Таким путем получали 2,7 г (94%) N-{4-[3-(ацетилметиламино)фенилсульфамоил]фенил}ацетамида в виде окрашенного в светло-желтый цвет твердого вещества; tпл 258-260oС.
2,5 г (0,0069 моль) N-{4-[3-(ацетилметиламино)фенилсульфамоил]фенил}ацетамида растворяли в 150 мл 1н. NaOH и кипятили с обратным холодильником в течение 4 ч. После этого значение рН доводили до 4 добавлением 1н. HCl и выделившийся осадок отфильтровывали. После сушки полученного продукта на вакуум-фильтре его хроматографировали на силикагеле с использованием 3%-ного раствора метанола в дихлорметане. Таким путем получали 1,64 г (85%) 4-амино-N-(3-метиламинофенил)бензолсульфонамида в виде желтоватого твердого вещества; tпл 134-135oС.
Пример 37
N-(3,5-диметоксифенил)-3-трифторметилбензолсульфонамид
0,31 г (0,002 моль) 3,5-диметоксианилина растворяли в 10 мл пиридина, обрабатывали 0,54 г (0,0022 моль) 3-трифторметилбензолсульфохлорида и перемешивали в течение 2 ч при комнатной температуре. После удаления растворителя остаток растворяли в воде, экстрагировали этилацетатом, органическую фазу промывали насыщенным раствором хлорида натрия и сушили над сульфатом натрия. Растворитель выпаривали и остаток хроматографировали на силикагеле с использованием гексана/этилацетата в соотношении 2:1. Таким путем получали 0,68 г (94%) N-(3,5-диметоксифенил)-3-трифторметилбензолсульфонамида в виде белых кристаллов; tпл 78-81oС.
Пример 38
4-амино-N-(2,6-дибромпиридин-4-ил)бензолсульфонамид
5,1 г (0,02 моль) 4-амино-2,6-дибромпиридина растворяли в 100 мл пиридина, обрабатывали 7,1 г (0,03 моль) 4-ацетаминобензолсульфохлорида и перемешивали при 60oС в течение 16 ч. После удаления растворителя остаток растворяли в 100 мл 1н. HCl, дважды экстрагировали, используя каждый раз по 100 мл этилацетата, объединенные органические фазы промывали насыщенным раствором хлорида натрия и сушили над сульфатом натрия. Затем из смеси удаляли растворитель и остаток сушили в глубоком вакууме. Таким путем получали 7,2 г (79%) N-[4-(2,6-дибромпиридин-4-илсульфамоил)фенил]ацетамида в виде желтых кристаллов; tпл>260oC (с разложением).
6,2 г (0,0138 моль) N-[4-(2,6-дибромпиридин-4-илсульфамоил)фенил]ацетамида растворяли в 138 мл 1н. NaOH и кипятили с обратным холодильником в течение 2 ч. После охлаждения смеси ее значение рН доводили до 6 добавлением 2н. HCl и выделившийся осадок отфильтровывали. Осадок на вакуум-фильтре тщательно промывали водой и сушили. Затем этот осадок хроматографировали на силикагеле с использованием этилацетата/гексана в переменном соотношении 1: 2-1: 1. Таким путем получали 4,86 г (86%) 4-амино-N-(2,6-дибромпиридин-4-ил)бензолсульфонамида в виде бежевых кристаллов; tпл 220-222oС.
Пример 39
Дигидрохлорид 4-амино-N-(2-хлор-6-метиламинопиридин-4-ил)бензолсульфонамида
0,82 г (0,005 моль) 4-амино-2,6-дихлорпиридина растворяли в 25 мл пиридина, обрабатывали 1,3 г (0,0055 моль) 4-ацетаминобензолсульфохлорида и перемешивали при 60oС в течение 16 ч. После удаления растворителя остаток растворяли в 50 мл 1н. HCl, дважды экстрагировали, используя каждый раз по 50 мл этилацетата, объединенные органические фазы промывали насыщенным раствором хлорида натрия и сушили над сульфатом натрия. Затем из смеси удаляли растворитель и остаток хроматографировали на силикагеле с использованием этилацетата/гексана в соотношении 4: 1. Таким путем получали 1,45 г (80%) N-[4-(2,6-дихлорпиридин-4-илсульфамоил)фенил] ацетамида в виде желтых кристаллов; tпл>246oC (с разложением).
1,25 г (0,0035 моль) N-[4-(2,6-дихлорпиридин-4-илсульфамоил)фенил]ацетамида растворяли в 35 мл 1н. NaOH и кипятили с обратным холодильником в течение 2 ч. После охлаждения значение рН смеси доводили до 6 добавлением 2н. HCl и выделившийся осадок отфильтровывали. Осадок на вакуум-фильтре тщательно промывали водой и сушили. Затем этот осадок хроматографировали на силикагеле, используя этилацетат/гексан в переменном соотношении 1:2-1:1. Таким путем получали 1,04 г (93%) 4-амино-N-(2,6-дихлорпиридин-4-ил)бензолсульфонамида в виде белых кристаллов; tпл 209-211oС (с разложением).
0,11 г (0,00035 моль) 4-амино-N-(2,6-дихлорпиридин-4-ил)бензолсульфонамида перемешивали в 25 мл жидкого метиламина в автоклаве при 130oС в течение 72 ч. После удаления метиламина остаток растворяли в 5 мл дихлорметана/метанола в соотношении 1:1, фильтровали и после удаления растворителя хроматографировали на силикагеле, используя гексан/этилацетат в соотношениях 3:1, 2:1 и в завершение 1:1. Продукт, полученный в виде белого аморфного твердого вещества, растворяли в 2 мл метанола, обрабатывали 2 мл 2н. HCl в метаноле, разбавляли 20 мл диэтилового эфира и фильтровали вакуум-фильтрацией. Осадок на вакуум-фильтре тщательно промывали диэтиловым эфиром и сушили в глубоком вакууме. Таким путем получали 0,055 г (41%) дигидрохлорида 4-амино-N-(2-хлор-6-метиламинопиридин-4-ил)бензолсульфонамида (1: 2) в виде белых кристаллов; tпл>215oC (с разложением).
Пример 40
Гидрохлорид 4-амино-N-(2-бром-6-метиламинопиридин-4-ил)бензолсульфонамида
0,81 г (0,002 моль) 4-амино-N-(2,6-дибромпиридин-4-ил)бензолсульфонамида перемешивали в 35 мл жидкого метиламина в автоклаве при 130oС в течение 44 ч. Метиламину давали испариться, а остаток растворяли в этаноле, обрабатывали 2 г силикагеля, концентрировали и остаток хроматографировали на силикагеле с использованием вначале смеси этилацетат/гексан в соотношении 1:2, а затем чистого этилацетата. Таким путем получали 0,63 г (88%) 4-амино-N-(2-бром-6-метиламинопиридин-4-ил)бензолсульфонамида в виде бежевой пены. 0,33 г (0,00092 моль) этого продукта растворяли в 10 мл метанола, обрабатывали 5 мл 2М раствора HCl в метаноле, концентрировали и вновь обрабатывали 4 мл метанола. Полученный осадок отфильтровывали вакуум-фильтрацией, промывали небольшим количеством метанола и сушили в глубоком вакууме. Таким путем получали 0,27 г (69%) гидрохлорида 4-амино-N-(2-бром-6-метиламинопиридин-4-ил)бензолсульфонамида в виде белых кристаллов; tпл 226-228oС (с разложением).
Пример 41
4-амино-N-(2-бром-6-этиламинопиридин-4-ил)бензолсульфонамид
5,1 г (0,0125 моль) 4-амино-N-(2,6-дибромпиридин-4-ил)бензолсульфонамида перемешивали в 100 мл жидкого этиламина в автоклаве при 150oС в течение 24 ч. Этиламину давали испариться, а остаток растворяли в этаноле, обрабатывали 5 г силикагеля, концентрировали и остаток хроматографировали на силикагеле с использованием этилацетата/гексана в соотношении вначале 1:2, а затем 1:1. В результате получали 2,15 г продукта в виде коричневого масла, который суспендировали в 200 мл 25%-ной HCl. Смесь фильтровали вакуум-фильтрацией, значение рН фильтрата доводили до 8 добавлением 2н. NaOH и отделяли выпавший осадок. После сушки в глубоком вакууме получали 0,96 г (21%) 4-амино-N-(2-бром-6-этиламинопиридин-4-ил)бензолсульфонамида в виде бежевых кристаллов; tпл>85oС (с разложением).
Пример 42
Гидрохлорид 4-амино-N-(2,6-бисметиламинопиридин-4-ил)бензолсульфонамида
0,90 г (0,002 моль) 4-амино-N-(2,6-дибромпиридин-4-ил)бензолсульфонамида перемешивали в 35 мл жидкого метиламина в автоклаве при 160oС в течение 16 ч. Метиламину давали испариться, а остаток растворяли в этаноле, обрабатывали 1 г силикагеля, концентрировали и остаток хроматографировали на силикагеле с использованием вначале смеси этилацетат/гексан в соотношении 1:1, а затем чистого этилацетата. При этом получали 0,34 г коричневого масла, которое суспендировали в 100 мл 1н. NaOH. Смесь фильтровали вакуум-фильтрацией, значение рН фильтрата доводили до 8 добавлением 1н. HCl и отделяли выпавший осадок. После сушки в глубоком вакууме получали 0,22 г (35%) гидрохлорида 4-амино-N-(2,6-бисметиламинопиридин-4-ил)бензолсульфонамида (1:3) в виде бежевых кристаллов; tпл>280oC (с разложением). Этот продукт растворяли в 5 мл метанола и обрабатывали 3 мл 2н. раствора HCl в метаноле. Выделившийся осадок отфильтровывали и сушили. Таким путем получали 0,13 г гидрохлорида 4-амино-N-(2,6-бисметиламинопиридин-4-ил)бензолсульфонамида (1:3) в виде светло-бежевых кристаллов; tпл 197oС (с разложением).
Пример 43
4-амино-N-(2-этиламино-6-метиламинопиридин-4-ил)бензолсульфонамид
2,5 г (0,007 моль) 4-амино-N-(2-бром-6-метиламинопиридин-4-ил)бензолсульфонамида перемешивали 80 мл этиламина в автоклаве при 160oС в течение 40 ч. Остаточному этиламину давали испариться, а остаток хроматографировали на силикагеле с использованием этилацетата/гексана в соотношении 1:2, затем 2:3 и в завершение 1:1. 0,67 г полученного таким образом продукта в виде коричневого масла суспендировали в 200 мл 1н. NaOH, фильтровали вакуум-фильтрацией и фильтрат нейтрализовали 1н. HCl. Полученный продукт вновь фильтровали вакуум-фильтрацией, фильтрат насыщали NaCl и экстрагировали этилацетатом. Органическую фазу сушили. Таким путем получали 0,055 г (2,5%) 4-амино-N-(2-этиламино-6-метиламинопиридин-4-ил)бензолсульфонамида в виде бледно-коричневых кристаллов; МС (ISN): me/e=320 (C14H18N5O2S-).
Пример 44
4-амино-N-(2-диметиламино-6-метиламинопиридин-4-ил)бензолсульфонамид
2,5 г (0,007 моль) 4-амино-N-(2-бром-6-метиламинопиридин-4-ил)бензолсульфонамида перемешивали с 80 мл диметиламина в автоклаве при 160oС в течение 7 ч. Остаточному диметиламину давали испариться, а остаток хроматографировали на силикагеле с использованием этилацетата/гексана в соотношении 1: 1, затем 2:1 и в завершение 3:1. Полярные фракции дважды хроматографировали на силикагеле с использованием смеси этилацетат/гексан в соотношении 2: 3 и 1:1 в качестве элюента. Таким путем получали 0,175 г (8%) 4-амино-N-(2-диметиламино-6-метиламинопиридин-4-ил)бензолсульфонамида в виде бежевых кристаллов; МС (ISN): me/e = 322 (C14H20N5O2S+).
Пример 45
4-амино-N-(2,6-бисэтиламинопиридин-4-ил)-бензолсульфонамид
5,1 г (0,0125 моль) 4-амино-N-(2,6-дибромпиридин-4-ил)бензолсульфонамида перемешивали в 100 мл жидкого этиламина в автоклаве при 150oС в течение 24 ч. Этиламину давали испариться, а остаток растворяли в этаноле, обрабатывали 5 г силикагеля, концентрировали и остаток хроматографировали на силикагеле с использованием этилацетата/гексана в соотношении вначале 1:2, затем 1:1 и в завершение 2:1. При этом получали 1,16 г коричневого твердого вещества, которое суспендировали в 500 мл 1н. NaOH. Смесь фильтровали, значение рН фильтрата доводили до 8, вновь фильтровали и фильтрат экстрагировали этилацетатом. Продукт, полученный в результате этой последней фильтрации, объединяли с этилацетатной фазой, концентрировали и остаток хроматографировали на силикагеле с использованием этилацетата/гексана в соотношении 2:1. При этом получали 0,22 г окрашенного в коричневый цвет твердого вещества, которое суспендировали в 20 мл 1н. NaOH. Смесь вновь фильтровали, значение рН фильтрата доводили до 8 добавлением 1н. HCl и выделившийся продукт отфильтровывали вакуум-фильтрацией. Таким путем получали 0,14 г (3%) 4-амино-N-(2,6-бисэтиламинопиридин-4-ил)бензолсульфонамида в виде бежевых кристаллов; tпл 212-215oС (с разложением).
Пример 46
4-амино-N-(2-метиламинопиридин-4-ил)бензолсульфонамид
0,5 г (0,0014 моль) 4-амино-N-(2-бром-6-метиламинопиридин-4-ил)бензолсульфонамида растворяли в 25 мл этанола, обрабатывали 0,05 г Pd/C и гидрировали газообразным водородом при нормальном давлении в течение 1 ч. Катализатор отфильтровывали, фильтрат концентрировали, остаток растворяли в 10 мл 1н. NaOH, раствор фильтровали и затем значение рН фильтрата доводили до 8 добавлением 1н. HCl. Осадок, который медленно выделялся, отфильтровывали вакуум-фильтрацией, промывали и сушили в глубоком вакууме. Таким путем получали 0,22 г (57%) 4-амино-N-(2-метиламинопиридин-4-ил)бензолсульфонамида в виде белых кристаллов; tпл>261oC (с разложением).
Пример 47
4-амино-N-(2,6-бисдиметиламинопиридин-4-ил)бензолсульфонамид
0,81 г (0,002 моль) 4-амино-N-(2,6-дибромпиридин-4-ил)бензолсульфонамида перемешивали в 30 мл диметиламина в автоклаве при 160oС в течение 45 ч. Избытку диметиламина давали испаряться, а остаток растворяли в смеси метанола с этилацетатом, обрабатывали 1 г силикагеля, концентрировали и остаток хроматографировали на силикагеле с использованием этилацетата/гексана в соотношении вначале 1:3, а затем 1:2. После сушки в глубоком вакууме получали 0,67 г (100%) 4-амино-N-(2,6-бисдиметиламинопиридин-4-ил)бензолсульфонамида в виде бежевых кристаллов; tпл 157-160oС (с разложением).
Пример 48
Дигидрохлорид N-(2,6-бисметиламинопиридин-4-ил)-4-хлорбензолсульфонамида
3,0 г (0,012 моль) 4-амино-2,6-дибромпиридина растворяли в 60 мл пиридина, обрабатывали 2,76 г (0,013 моль) 4-хлорбензолсульфохлорида и перемешивали при 60oС в течение 5 ч. После удаления растворителя остаток растворяли в 100 мл 1н. HCl, дважды экстрагировали, используя каждый раз по 100 мл этилацетата, объединенные органические фазы промывали насыщенным раствором хлорида натрия и сушили над сульфатом натрия. Из смеси удаляли растворитель и остаток хроматографировали на силикагеле с использованием этилацетата/гексана в соотношении 1:4, а затем 1:1. Таким путем получали 4,4 г (87%) 4-хлор-N-(2,6-дибромпиридин-4-ил)бензолсульфонамида в виде желтых кристаллов. Для аналитических целей 0,2 г (0,0005 моль) вещества перекристаллизовывали из трет-бутилметилового эфира; tпл 203-205oС (с разложением).
0,50 г (0,0017 моль) 4-хлор-N-(2,6-дибромпиридин-4-ил)бензолсульфонамида перемешивали в 35 мл жидкого метиламина совместно с 0,025 г порошкообразной Cu в автоклаве при 80oС в течение 18 ч. Метиламину давали испариться, остаток растворяли в 50 мл воды, значение рН доводили до 8 и смесь трижды экстрагировали, используя каждый раз по 100 мл этилацетата. Объединенные органические фазы промывали насыщенным раствором хлорида натрия и сушили над сульфатом натрия. Затем эти фазы концентрировали и остаток суспендировали в 1н. NaOH. После фильтрования прозрачный фильтрат насыщали NaCl и подкисляли до значения рН 1 добавлением 1н. HCl. При этом выделяли выпадавший бежевый осадок. Таким путем получали 0,24 г (50%) дигидрохлорида N-(2,6-бисметиламинопиридин-4-ил)-4-хлорбензолсульфонамида в виде бежевых кристаллов; tпл>170oC (с разложением).
Пример 49
3-хлор-N-(2,6-бисметиламинопиридин-4-ил)бензолсульфонамид
2,0 г (0,0079 моль) 4-амино-2,6-дибромпиридина растворяли в 24 мл пиридина, обрабатывали 2,5 г (0,012 моль) 3-хлорбензолсульфохлорида и перемешивали при 60oС в течение 5 ч. После удаления растворителя остаток растворяли в 100 мл 1н. HCl, дважды экстрагировали, используя каждый раз по 100 мл этилацетата, объединенные органические фазы промывали насыщенным раствором хлорида натрия и сушили над сульфатом натрия. Из смеси удаляли растворитель и остаток хроматографировали на силикагеле с использованием этилацетата/гексана в соотношении 1:2, затем 1:1 и в завершение 2:1. Таким путем получали 2,12 г (63%) 3-хлор-N-(2,6-дибромпиридин-4-ил)бензолсульфонамида в виде желтых кристаллов; tпл 187-189oС.
1,0 г (0,0023 моль) 3-хлор-N-(2,6-дибромпиридин-4-ил)бензолсульфонамида перемешивали в 35 мл жидкого метиламина в автоклаве при 160oС в течение 18 ч. Метиламину давали испариться, остаток растворяли в воде, значение рН доводили до 8 и смесь трижды экстрагировали, используя каждый раз по 100 мл этилацетата. Объединенные органические фазы промывали насыщенным раствором хлорида натрия и сушили над сульфатом натрия. Растворитель выпаривали и остаток хроматографировали на силикагеле с использованием вначале этилацетата/гексана в соотношении 2:1, затем чистого этилацетата и в завершение смеси этилацетат/метанол в соотношении 1:1. После этого содержащую продукт фракцию вновь хроматографировали на силикагеле с использованием гексана/этилацетата в соотношении 1: 1. В результате получали 0,165 г (22%) 3-хлор-N-(2,6-бисметиламинопиридин-4-ил)бензолсульфонамида в виде окрашенных в светло-красноватый цвет кристаллов. 0,13 г (0,0004 моль) этих кристаллов суспендировали в 20 мл 1н. NaOH, фильтровали и значение рН прозрачного фильтрата доводили до 8 добавлением 1н. HCl. Осадок, который при этом выделялся, отфильтровывали вакуум-фильтрацией и сушили в глубоком вакууме. Таким путем получали 0,11 г (15%) 3-хлор-N-(2,6-бисметиламинопиридин-4-ил)бензолсульфонамида; tпл 133oС (с разложением).
Пример 50
Дигидрохлорид N-(2,6-бисметиламинопиридин-4-ил)-3-трифторметилбензолсульфонамида
3,0 г (0,0012 моль) 4-амино-2,6-дибромпиридина растворяли в 60 мл пиридина, обрабатывали 2,1 мл (0,013 моль) 3-трифторметилбензолсульфохлорида и перемешивали при 60oС в течение 5 ч. После удаления растворителя остаток растворяли в 100 мл воды, дважды экстрагировали, используя каждый раз по 100 мл диэтилового эфира, объединенные органические фазы промывали насыщенным раствором хлорида натрия и сушили над сульфатом натрия. Из смеси удаляли растворитель и остаток хроматографировали на силикагеле с использованием этилацетата/гексана в соотношении 1: 2, а затем 1:1. Таким путем получали 4,77 г (87%) N-(2,6-дибромпиридин-4-ил)-3-трифторметил-бензолсульфонамида в виде бледно-желтых кристаллов. Кристаллизацией из трет-бутилметилового эфира получали аналитически чистый образец; tпл 149-151oС.
0,50 г (0,0011 моль) N-(2,6-дибромпиридин-4-ил)-3-трифторметилбензолсульфонамида перемешивали в 35 мл жидкого метиламина совместно с 0,022 г порошкообразной Cu в автоклаве при 80oС в течение 18 ч. Метиламину давали испариться, остаток растворяли в 50 мл воды, значение рН доводили до 8 добавлением 1н. HCl и смесь трижды экстрагировали, используя каждый раз по 100 мл этилацетата. Объединенные органические фазы промывали насыщенным раствором хлорида натрия и сушили над сульфатом натрия. Смесь концентрировали и остаток хроматографировали на силикагеле с использованием этилацетата/гексана в соотношении 1:9, 1:4, 1:1 и 1:0. Фракцию, полученную с использованием чистого этилацетата, суспендировали в 1н. NaOH. После фильтрования прозрачный фильтрат насыщали NaCl и подкисляли 1н. HCl до значения рН 1. При этом выделяли выпадавший бежевый осадок. Таким путем получали 0,094 г (15%) дигидрохлорида N-(2,6-бисметиламинопиридин-4-ил)-3-трифторметилбензолсульфонамида в виде бежевых кристаллов; tпл>227oС (с разложением).
Пример 51
4-амино-N-(2-метил-6-метиламинопиридин-4-ил)бензолсульфонамид
1,54 г (0,0082 моль) 4-амино-2-бром-6-метилпиридина растворяли в 25 мл пиридина, обрабатывали 2,9 г (0,0124 моль) 4-ацетаминобензолсульфохлорида и перемешивали при 60oС в течение 16 ч. После удаления растворителя остаток хроматографировали на силикагеле с использованием этилацетата в качестве элюента. Из содержащих продукт фракций удаляли растворитель и сушили в глубоком вакууме. Таким путем получали 2,17 г (69%) N-[4-(2-(бром-6-метилпиридин-4-илсульфамоил)фенил] ацетамида в виде бесцветных кристаллов; tпл 262-264oС (с разложением).
1,15 г (0,003 моль) N-[4-(2-бром-6-метилпиридин-4-илсульфамоил)фенил] ацетамида растворяли в 15 мл 2н. NaOH и кипятили с обратным холодильником в течение 1 ч. После охлаждения смеси ее подкисляли добавлением 2н. HCl до значения рН 5, отфильтровывали бесцветный выделившийся осадок. Осадок на вакуум-фильтре промывали обильным количеством воды и сушили. Таким путем получали 0,95 г (93%) 4-амино-N-(2-бром-6-метилпиридин-4-ил)бензолсульфонамида в виде бесцветных кристаллов; tпл>110oC (с разложением).
0,94 г (0,00275 моль) 4-амино-N-(2-бром-6-метилпиридин-4-ил)бензолсульфонамида перемешивали в автоклаве при 135oС в течение 40 ч в 50 мл 8М раствора метиламина в этаноле. Метиламину давали испариться, остаток растворяли в этаноле, обрабатывали 2 г силикагеля, концентрировали и остаток хроматографировали на силикагеле с использованием этилацетата/гексана в соотношении вначале 1:1, а затем 9:1. Таким путем получали 0,39 г (48%) 4-амино-N-(2-метил-6-метиламинопиридин-4-ил)бензолсульфонамида в виде бесцветных кристаллов; tпл 173-175oС.
0,081 г (0,00028 моль) этого продукта перекристаллизовывали из метанола, диэтилового эфира и гексана, сушили в глубоком вакууме, растворяли в 3 мл метанола и обрабатывали 2,8 мл 0,1н. NaOH. Метанол отгоняли и остаток дважды сушили вымораживанием. Таким путем получали 0,084 г (97%) натриевой соли 4-амино-N-(2-метил-6-метиламинопиридин-4-ил)бензолсульфонамида (1:1) в виде белых кристаллов; МС (ISP): me/e=293 (C13H17N4O2S+).
0,31 г (0,0011 моль) 4-амино-N-(2-метил-6-метиламинопиридин-4-ил)бензолсульфонамида растворяли в 2 мл метанола, обрабатывали 1 мл 2,4н. раствора HCl в диэтиловом эфире и удаляли растворитель. Остаток растворяли в 1 мл метанола и медленно, по каплям добавляли при одновременном интенсивном перемешивании в диэтиловый эфир. При этом выпадал бесцветный осадок, который выделяли и сушили в глубоком вакууме. Таким путем получали 0,33 г (87%) гидрохлорида 4-амино-N-(2-метил-6-метиламинопиридин-4-ил)бензолсульфонамида (1: 1,86) в виде белых кристаллов; tпл>170oC (с разложением).
Пример 52
4-амино-N-(1Н-индол-4-ил)бензолсульфонамид
0,095 г (0,00072 моль) 4-амино-1Н-индола растворяли в 3 мл пиридина, обрабатывали 0,20 г (0,00086 моль) 4-ацетаминобензолсульфохлорида и перемешивали при 60oС в течение 16 ч. После удаления растворителя остаток растворяли в 10 мл 1н. HCl, дважды экстрагировали, используя каждый раз по 20 мл этилацетата, объединенные органические фазы промывали насыщенным раствором хлорида натрия и сушили над сульфатом натрия. Далее из смеси удаляли растворитель и остаток сушили в глубоком вакууме. Таким путем получали 0,155 г (65%) N-[4-(1Н-индол-4-илсульфамоил)фенил] ацетамида в виде бледно-серых кристаллов; tпл>260oС.
0,15 г (0,00045 моль) N-[4-(1Н-индол-4-илсульфамоил)фенил] ацетамида растворяли в 4 мл 1н. NaOH и кипятили с обратным холодильником в течение 1 ч. После охлаждения смеси ее значение рН доводили до 6 добавлением 0,1н. HCl и отфильтровывали выделившийся осадок. Осадок на вакуум-фильтре промывали обильным количеством воды и сушили. Затем этот осадок хроматографировали на силикагеле с использованием этилацетата/гексана в соотношении 1:1. Таким путем получали 0,085 г (66%) 4-амино-N-(1Н-индол-4-ил)бензолсульфонамида в виде белого аморфного твердого вещества; tпл 215oС.
Пример 53
4-амино-N-(2-метиламино-6-трифторметилпиридин-4-ил)бензолсульфонамид
0,15 г (0,00076 моль) 4-амино-2-хлор-6-трифторметилпиридина растворяли в 4 мл пиридина, обрабатывали 0,26 г (0,0015 моль) 4-ацетаминобензолсульфохлорида и перемешивали при 60oС в течение 20 ч. После удаления растворителя остаток растворяли в 10 мл 1н. HCl, дважды экстрагировали, используя каждый раз по 20 мл этилацетата, объединенные органические фазы промывали насыщенным раствором хлорида натрия и сушили над сульфатом натрия. Затем из смеси удаляли растворитель и остаток сушили в глубоком вакууме. Таким путем получали 0,20 г (67%) N-[4-(2-хлор-6-трифторметилпиридин-4-илсульфамоил)фенил] ацетамида в виде оранжево-желтых кристаллов;
МС (ISP): me/e=394 (C14H12ClF3N3O3S-).
0,20 г (0,0005 моль) N-[4-(2-хлор-6-трифгорметилпиридин-4-ил-сульфамоил)фенил] ацетамида растворяли в смеси 5 мл 1н. NaOH с 5 мл диоксана и кипятили с обратным холодильником в течение 5 ч. После охлаждения диоксан отгоняли, значение рН остатка доводили до 6 добавлением 0,1н. HCl, водную фазу экстрагировали этилацетатом, подвергали обратной промывке насыщенным раствором хлорида натрия и органическую фазу сушили над Na2SO4. Затем проводили хроматографию на силикагеле с использованием этилацетата/гексана в соотношении 1: 4. Таким путем получали 0,06 г (34%) 4-амино-N-(2-бром-6-трифторметилпиридин-4-ил)бензолсульфонамида в виде бледно-желтых кристаллов; tпл 179-181oC.
0,052 г (0,00015 моль) 4-амино-N-(2-хлор-6-трифторметилпиридин-4-ил)бензолсульфонамида перемешивали в 30 мл 8М раствора метиламина в этаноле в автоклаве при 135oС в течение 80 ч. Метиламину давали испариться, остаток растворяли в этаноле, обрабатывали 2 г силикагеля, концентрировали и остаток хроматографировали на силикагеле с использованием этилацетата/гексана в соотношении 1: 2. Таким путем получали 0,036 г (70%) 4-амино-N-(2-метиламино-6-трифторметилпиридин-4-ил)бензолсульфонамида в виде бесцветных кристаллов; tпл>68oС (с разложением).
Пример А
По обычному методу готовят таблетки следующего состава: - мг/таблетка
Действующее вещество - 100
Порошкообразная лактоза - 95
Белый кукурузный крахмал - 35
Поливинилпирролидон - 8
Na-карбоксиметилкрахмал - 10
Стеарат магния - 2
Вес таблетки - 250
| название | год | авторы | номер документа |
|---|---|---|---|
| БЕНЗОЛСУЛЬФОНОВЫЕ ПРОИЗВОДНЫЕ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1999 |
|
RU2201922C2 |
| ТРИЦИКЛИЧЕСКИЕ ДИКАРБОНИЛЬНЫЕ ПРОИЗВОДНЫЕ И ЛЕКАРСТВЕННЫЙ ПРЕПАРАТ НА ИХ ОСНОВЕ | 1995 |
|
RU2145606C1 |
| ИМИДАЗОДИАЗЕПИНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1995 |
|
RU2139873C1 |
| ПРОИЗВОДНЫЕ АРИЛ- И ГЕТЕРОАРИЛСУЛЬФОНАМИДОВ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 1995 |
|
RU2163598C2 |
| ПРОИЗВОДНЫЕ ИНДОЛА И ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ КИСЛОТНО-АДДИТИВНЫЕ СОЛИ, ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ НА ИХ ОСНОВЕ | 1994 |
|
RU2136662C1 |
| ПРОИЗВОДНЫЕ ОКСАЗОЛИДИН-2-ОНА И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 1994 |
|
RU2133743C1 |
| АРИЛПИРИМИДИНОВЫЕ ПРОИЗВОДНЫЕ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2189976C2 |
| ПРОИЗВОДНЫЕ 5H-ТИАЗОЛ[3,2-А]ПИРИМИДИНА, ПРОМЕЖУТОЧНЫЕ ПРОДУКТЫ И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 1998 |
|
RU2197493C2 |
| НОВЫЕ ПИРРОЛОКАРБАЗОЛЫ | 1995 |
|
RU2162089C2 |
| ЛИГАНДЫ Х-РЕЦЕПТОРА РЕТИНОЕВОЙ КИСЛОТЫ | 1995 |
|
RU2146241C1 |
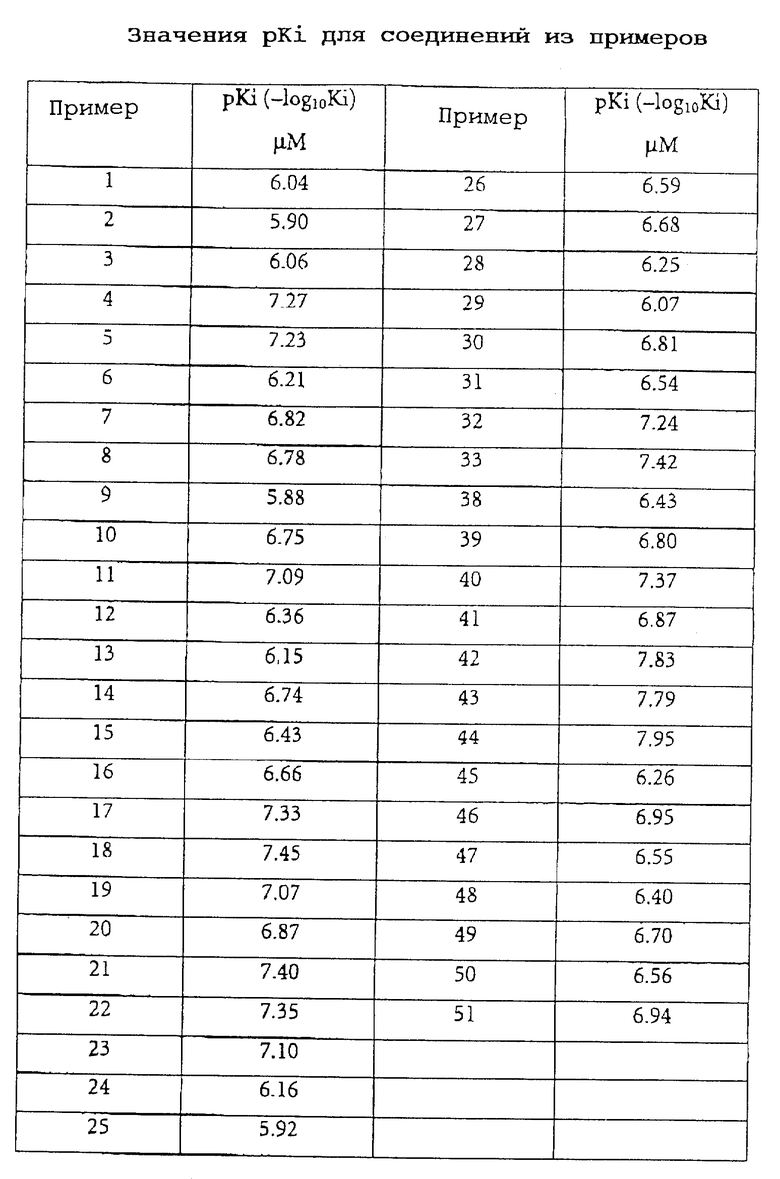
Изобретение относится к области медицины и медтехники и касается применения сульфаминов общей формулы (I) в качестве терапевтически активных веществ при расстройствах центральной нервной системы и для приготовления соответствующих лекарственных средств. Соединения формулы (I) обладают повышенной биологической активностью. 7 с. и 12 з.п.ф-лы, 1 табл.
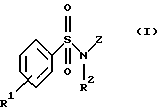
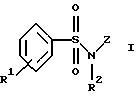
где Z обозначает замещенную фенильную, замещенную пиридильную, замещенную пиримидильную или замещенную индолильную группу формул а-е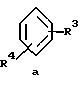
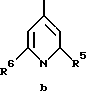
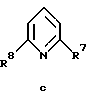
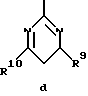
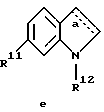
R1 обозначает водород, амин, низший алкиламин, низший диалкиламин, низший алкил, галоген или трифторметил;
R2 обозначает водород или низший алкил;
R3 обозначает водород, амин, низший алкиламин, низший диалкиламин, низший алкил, CF3, низшую алкоксигруппу или галоген;
R4 обозначает амин, низший алкиламин, низший диалкиламин, низший алкил, низшую алкоксигруппу или галоген;
R5 обозначает водород, низший алкиламин, ди-низший алкиламин, низшую алкоксигруппу или галоген;
R6 обозначает низший алкил, низший алкиламин, ди-низший алкиламин, низшую алкоксигруппу, галоген или СF3;
R7 обозначает амин, низший алкиламин, ди-низший алкиламин, низшую алкоксигруппу, низший алкилсульфанил, меркаптогруппу, пирролидин-1-ил или азетидин-1-ил;
R8 обозначает амин, низший алкиламин, ди-низший алкиламин, бензиламин, низшую алкоксигруппу, низший алкилсульфанил, галоген, пирролидин-1-ил или азетидин-1-ил;
R9 и R10 каждый независимо друг от друга обозначают низший алкокси- или низший алкиламиногруппу;
R11 обозначает водород или галоген;
R12 обозначает водород или низший алкил;
а обозначает необязательную двойную связь,
при условии, что R7 и R8 одновременно не обозначают метоксигруппу и что Z не включает
соединения формул Iа1 и Iа2 из группы соединений Iа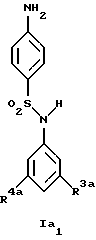
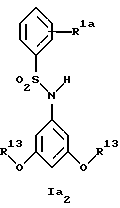
R1а обозначает 3-трифторметил, 3-галоид или 4-галоид;
R3а обозначает водород, галоген, низшую алкоксигруппу, амин или низший алкиламин;
R4а обозначает амин или низший алкиламин;
R13 обозначает низший алкил;
при условии, что когда R4а обозначает амин, R3а не обозначает водород,
соединения формул Ib1 и Ib2 из группы соединений Ib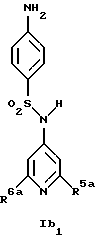
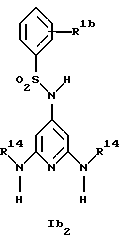
где R1b обозначает 4-галоид, 3-галоид или 3-трифторметил;
R5а обозначает водород, низший алкиламин, ди-низший алкиламин или галоген;
R6а обозначает низший алкил, СF3, низший алкиламин, ди-низший алкиламин или галоген и
R14 обозначает низший алкил;
при условии, что когда R6а обозначает галоген, R5а не обозначает водород,
соединения формул Ic1 и Iс2 из группы соединений Ic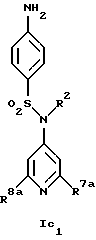
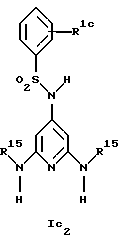
где R1с обозначает водород, 4-галоид, 4-низший алкил, 3-галоид или 3-трифторметил,
R2 обозначает водород или низший алкил,
R7а обозначает амин, низший алкиламин, ди-низший алкиламин, меркаптогруппу, пирролидин-1-ил или азетидин-1-ил,
R8а обозначает амин, низший алкиламин, ди-низший алкиламин, бензиламин, низшую алкоксигруппу, пирролидин-1-ил или азетидин-1-ил;
R15 обозначает низший алкил,
при условии, что когда R7а обозначает ди-низший алкиламин, R8а не обозначает низшую алкоксигруппу и ди-низший алкиламин,
соединения формул Id1 и Id2 из группы соединений Id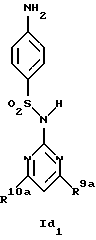
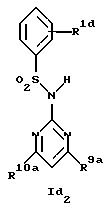
где R1d обозначает 3-трифторметил, 4-трифторметил, 3-галоид или 4-галоид;
R9а и R10а каждый обозначает низший алкиламин,
и соединения формулы Ie,
а также их фармацевтически приемлемых солей в качестве терапевтически активных веществ при расстройствах центральной нервной системы и соответственно для приготовления соответствующих лекарственных средств.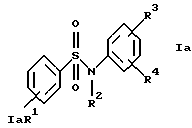
где R1, R2, R3 и R4 имеют указанные в п. 1 значения.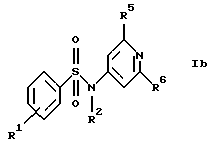
где R1, R2, R5 и R6 имеют указанные в п. 1 значения.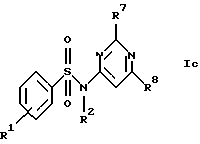
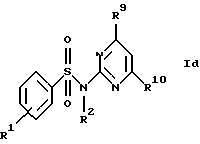
где R1, R2, R7, R8, R9 и R10 имеют указанные в п. 1 значения.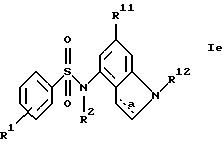
где R1, R2, R11, R12 и а имеют указанные в п. 1 значения.
4-амино-N-(2,6-бисметиламинопиримидин-4-ил)бензолсульфонамида;
4-амино-N-(6-этиламино-2-метиламинопиримидин-4-ил)бензолсульфонамида;
4-амино-N-(2-диметиламино-6-метиламинопиримидин-4-ил)бензолсульфонамида;
4-амино-N-(2-диметиламино-6-этиламинопиримидин-4-ил)бензолсульфонамида;
4-амино-N-(2,6-бисметиламинопиримидин-4-ил)-N-метилбензолсульфонамида;
4-амино-N-(2-азетидин-1-ил-6-метиламинопиримидин-4-ил)бензолсульфонамида;
4-амино-N-(2-азетидин-1-ил-6-этиламинопиримидин-4-ил)бензолсульфонамида;
4-амино-N-(6-метиламино-2-пирролидин-1-ил-пиримидин-4-ил)бензолсульфонамида;
4-амино-N-(2-бром-6-метиламинопиридин-4-ил)бензолсульфонамида;
4-амино-N-(2,6-бисметиламинопиридин-4-ил)бензолсульфонамида;
4-амино-N-(2-этиламино-6-метиламинопиридин-4-ил)бензолсульфонамида;
4-амино-N-(2-диметиламино-6-метиламинопиридин-4-ил)бензолсульфонамида;
4-амино-N-(2,6-бисэтиламинопиридин-4-ил)бензолсульфонамида;
N-(2,6-бисметиламинопиримидин-4-ил)-3-хлорбензолсульфонамида;
N-(2,6-бисметиламинопиримидин-4-ил)3-трифторметилбензолсульфонамида;
4-амино-N-(2-метил-6-метиламинопиридин-4-ил)бензолсульфонамида;
4-амино-N-(3,5-диметоксифенил)бензолсульфонамида;
4-амино-N-(3,5-дихлорфенил)бензолсульфонамида;
4-амино-N-(3,5-дибромфенил)бензолсульфонамида и
4-амино-N-(1Н-индол-4-ил)бензолсульфонамида
по любому из пп. 1-6.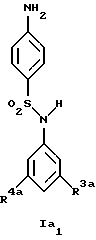
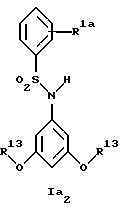
где R1а обозначает 3-трифторметил, 3-галоид или 4-галоид;
R3а обозначает водород, галоген, низшую алкоксигруппу, амин или низший алкиламин;
R4а обозначает амин или низший алкиламин и
R13 обозначает низший алкил;
при условии, что когда R4а обозначает амин, R3а не обозначает водород,
а также их фармацевтически приемлемые соли.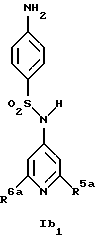
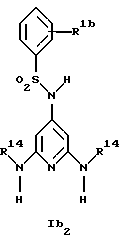
где R1b обозначает 4-галоид, 3-галоид или 3-трифторметил;
R5а обозначает водород, низший алкиламин, ди-низший алкиламин или галоген;
R6а обозначает низший алкил, СF3, низший алкиламин, ди-низший алкиламин или галоген и
R14 обозначает низший алкил;
при условии, что когда R6а обозначает галоген, R5а не обозначает водород,
а также их фармацевтически приемлемые соли.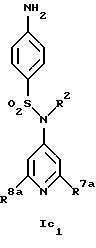
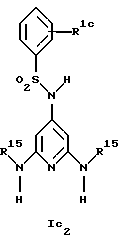
где R1с обозначает водород, 4-галоид, 4-низший алкил, 3-галоид или 3-трифторметил;
R2 обозначает водород или низший алкил;
R7а обозначает амин, низший алкиламин, ди-низший алкиламин, меркаптогруппу, пирролидин-1-ил или азетидин-1-ил;
R8а обозначает амин, низший алкиламин, ди-низший алкиламин, бензиламин, низшую алкоксигруппу, пирролидин-1-ил или азетидин-1-ил;
R15 обозначает низший алкил,
при условии, что когда R7а обозначает ди-низший алкиламин, R8а не обозначает низшую алкоксигруппу и ди-низший алкиламин,
а также их фармацевтически приемлемые соли.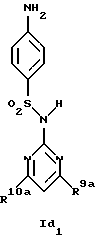
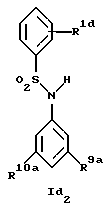
где R1d обозначает 3-трифторметил, 4-трифторметил, 3-галоид или 4-галоид;
R9а и R10а каждый обозначает низший алкиламин,
а также их фармацевтически приемлемые соли.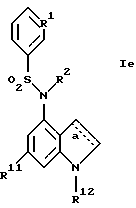
где R1, R2, R11, R12 и а имеют указанные в п. 1 значения.
Приоритет по пунктам:
28.06.1996 по пп. 1-5, 8-17, 19, 20;
01.04.1997 по пп. 6, 7, 18, 21-25.
| RU 94041207 А1, 20.06.1996 | |||
| Психотропное средство для лечения депрессивных состояний "инказан | 1972 |
|
SU788471A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПЕНОПОЛИУРЕТАНОВ | 0 |
|
SU323416A1 |
| US 3622625 А, 23.11.1971. | |||
Авторы
Даты
2002-11-10—Публикация
1997-06-27—Подача