Область техники
Изобретение относится к новым пероральным лекарственным формам, которые защищают эпителиальные и слизистые ткани ротовой полости и щечного кармана, глотки, гортани и пищевода от эрозий, язв или других подобных повреждений, возникающих в результате прямого контакта этих тканей с активным ингредиентом. Таблетка обладает модифицированной овальной формой и покрыта пленкой. Данное изобретение в дальнейшем относится к способу лечения или профилактики заболеваний, которые характеризуются нарушенным метаболизмом кальция и фосфата, с использованием описанных здесь новых покрытых пленкой лекарственных форм.
Предпосылки изобретения
Пероральное введение определенных активных ингредиентов иногда приводит к жалобам пациентов вскоре после приема средства; высказанные жалобы обычно характеризуются изжогой, жжением в пищеводе, болью и/или затруднением при глотании и/или болью позади и/или в области грудины. Считается, что причиной данных жалоб является эзофагит или раздражение пищевода, вызванные эрозией, язвой или другими подобными повреждениями эпителиальных и слизистых тканей верхних отделов желудочно-кишечного тракта, как правило, от ротовой полости до желудка включительно, а главным образом пищевода. Предполагается, что указанное раздражение является результатом прямого контакта активного ингредиента с эпителиальными и слизистыми тканями, что приводит к их местному раздражению. Если лекарственная форма задерживается в пищеводе, то активный ингредиент медленно растворяется и создает высокую концентрацию лекарства на слизистой поверхности пищевода. Особенно большие проблемы возникают в случае применения лекарств, которые после растворения имеют рН ниже 2-3, лекарства с цитотоксической активностью (едкое вещество) и/или местное образование гиперосмолярного раствора, который является причиной обезвоживания слизистой. Данные активные ингредиенты включают, но не ограничиваются, эмперонийбромид, доксициклин и другие тетрациклиновые антибиотики, препараты железа, хинидин, нестероидные противовоспалительные средства, алпренолол, аскорбиновая кислота, каптоприл, теофиллин, зидовудин (AZT) и бисфосфонаты.
Лекарственные формы разработали таким образом, чтобы задержать высвобождение активных ингредиентов на время прохождения через верхние отделы желудочно-кишечного тракта, а в некоторых случаях и через желудок, т.е. таблетки с энтеросолюбильным покрытием. Но в определенных случаях для лекарственного препарата нежелательно или необязательно находиться в лекарственной форме замедленного высвобождения. Следовательно, существует необходимость разработки новых пероральных лекарственных форм, которые способствовали бы быстрому прохождению через пищевод, минимизации или исключению высвобождения активного соединения в верхних отделах желудочно-кишечного тракта и доставке активного ингредиента в желудок. Указанные новые лекарственные формы представляют собой таблетки, обычно овальной формы, включая, но не ограничиваясь, овальные, модифицированные овальные, каплеобразные таблетки и покрытые пленкой для обеспечения быстрого прохождения через пищевод и высвобождения активного ингредиента в желудке, защищая таким образом ткани ротовой полости, глотки и пищевода. Наиболее предпочтительными являются новые модифицированной овальной формы, покрытые пленкой лекарственные формы, которые содержат бисфосфонаты, такие как ризедронат или алендронат.
Сущность изобретения
Настоящее изобретение относится к фармацевтическому составу в обычно овальной форме, включая, но не ограничиваясь, овальную, модифицированную овальную, каплеобразную формы. Лекарственная форма покрыта пленкой и включает безопасное и эффективное количество активного ингредиента и фармацевтически приемлемые наполнители. Указанные лекарственные формы способствуют быстрому по времени прохождению через пищевод, избегая, таким образом, высвобождения активного ингредиента в преддверии рта, глотке и пищеводе и защищая эпителиальные и слизистые ткани от эрозии, язвы или других подобных повреждений.
Соответственно, описанные здесь новые лекарственные формы эффективно доставляют в желудок указанного человека или другого млекопитающего безопасное и эффективное количество активного ингредиента и значительно смягчают эзофагит или раздражение пищевода, которые иногда сопутствуют пероральному применению определенных активных ингредиентов. Изобретение далее относится к способу лечения заболеваний, характеризующихся нарушенным обменом кальция и фосфата, включающему введение человеку или другому млекопитающему, страдающему таким заболеванием, новой пероральной лекарственной формы, содержащей бисфосфонат, как описано здесь.
Краткое описание фигур
На фиг.1 показан вид сверху модифицированной овальной таблетки;
фиг.2 представляет собой ее вид сбоку;
фиг.3 - вид спереди указанной модифицированной овальной таблетки.
Подробное описание настоящего изобретения
Настоящее изобретение относится к новой обычно овальной формы, покрытой пленкой пероральной лекарственной форме, включающей безопасное и эффективное количество активного ингредиента и фармацевтически приемлемые наполнители. Указанные лекарственные формы способствуют быстрому прохождению через пищевод, таким образом, избегая или минимизируя высвобождение активного ингредиента в ротовой полости, глотке и пищеводе и защищая эпителиальные и слизистые ткани от эрозии, язвы или других подобных повреждений. Особенно предпочтительными являются пероральные лекарственные формы модифицированной овальной формы, покрытые пленкой.
Соответственно, указанные лекарственные формы эффективно доставляют в желудок указанного человека или другого млекопитающего безопасные и эффективные количества активного ингредиента и значительно смягчают эзофагит или раздражение пищевода, которые иногда сопутствуют пероральному применению определенных активных ингредиентов.
Изобретение далее относится к способу лечения заболеваний, характеризующихся нарушенным обменом кальция и фосфата, включающему введение человеку или другому млекопитающему, страдающему таким заболеванием, новой пероральной лекарственной формы, как описано здесь.
А. Активный ингредиент
Активным ингредиентом, упомянутым здесь, может быть любой ингредиент, обладающий терапевтической пользой и который требуется доставить в желудок человека или другого млекопитающего. Преимущества данного изобретения особенно понятны, если активный ингредиент, высвобожденный до попадания в желудок, может явиться причиной жалоб пациентов, таких как изжога, жжение в пищеводе, боль и/или затруднение при глотании и/или боль позади и/или в области грудины. Такими активными ингредиентами могут быть таковые, которые в растворенном виде создают рН ниже 2-3, лекарства с цитотоксической активностью (едкое вещество) и/или вызывающие местное образование гиперосмолярного раствора, который является причиной обезвоживания слизистой. Данные активные ингредиенты включают, но не ограничиваются, эмперонийбромид, доксициклин и другие тетрациклиновые антибиотики, препараты железа, хинидин, нестероидные противовоспалительные средства, алпренолол, аскорбиновая кислота, каптоприл, теофиллин, зидовудин (AZT) и бисфосфонаты. Более предпочтительные активные ингредиенты представляют собой ризедронат, алендронат и памидронат, наиболее предпочтительный представляет собой ризедронат.
Бисфосфонаты по настоящему изобретению являются структурными вариантами геминальной группировки: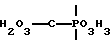
Термин "ризедронат", используемый здесь, обозначает бисфосфонатное соединение 3-пиридил-1-гидроксиэтилиден-1,1-бисфосфоновой кислоты и имеет следующую структуру: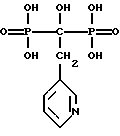
Структура ризедроната далее описана в патенте США 5583122, Benedict et al. , выданном Procter & Gamble Co., 10 декабря 1996 года, и в An American Conference, Bisphosphonates: Current Status and Future Prospects, The Royal College of Physicians, London, England, May 21-22, 1990, организованной IBC Technical Servises, обе ссылки включены сюда в качестве ссылки.
Термин "ризедронатный активный ингредиент" включает в себя ризедронат, соли ризедроната и эфиры ризедроната или любые их смеси. Любая фармацевтически приемлемая нетоксичная соль или эфир ризедроната может быть использована в качестве ризедронатного активного ингредиента в новой пероральной лекарственной форме по настоящему изобретению. Соли ризедроната могут являться солями добавления кислот, в частности гидрохлоридами, но может быть применена любая фармацевтически приемлемая нетоксичная органическая или неорганическая соль. Кроме того, могут быть использованы соли, образованные с группой фосфоновой кислоты, включающие, но не ограничивающиеся, соли щелочных металлов (К, Na) и соли щелочно-земельных металлов (Са, Мg), причем соли Са и Na являются предпочтительными.
В частности, другими эфирами ризедроната, которые подходят в качестве активного ингредиента, являются сложные эфиры C1-C18 алкилов с неразветвленной цепью или разветвленной цепью, включая, но не ограничиваясь, метил, этил, пропил, изопропил, бутил, изобутил, амил, гексил, гептил, октил, нонил, децил, лаурил, миристил, цетил и стеарил; сложные эфиры С2-C18 алкенилов с неразветвленной цепью или разветвленной цепью, включая, но не ограничиваясь, винил, алкил, ундеценил и линоленил; сложные эфиры С3-С8 циклоалкилов, включая, но не ограничиваясь, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил; сложные эфиры арилов, включая, но не ограничиваясь, фенил, толуил, ксилил и нафтил; алициклические эфиры, включая, но не ограничиваясь, ментил; и аралкиловые эфиры, включая, но не ограничиваясь, бензил и фенетил.
Термин "алендронат", используемый здесь, обозначает бисфосфатное соединение 4-амино-1-гидроксибутилиден-1,1-бисфосфоновая кислота и ее фармацевтически приемлемые соли, т.е. тригидрат натриевой соли. Структура ризедроната далее описана в патенте США 4922007 и 5019651, оба выданы Merck и оба включены сюда в качестве ссылки.
Вообще говоря, правильный выбор активного ингредиента зависит от типа выбранного состава, характера заболевания, особенно очага и типа заболевания, и желаемого режима высвобождения активного ингредиента. Кроме того, выбирая подходящие фармацевтически приемлемые наполнители для использования в новых лекарственных формах, содержащих активный ингредиент, должны учитываться физические и химические свойства активного ингредиента.
Эффективная пероральная доза активного ингредиента зависит от течения заболевания. Например, для взрослых количество ризедроната обычно составляет от приблизительно 1 мг до приблизительно 40 мг ежедневно, предпочтительно от приблизительно 1 мг до приблизительно 30 мг в сутки. Если доза будет вводиться в течение продолжительного промежутка времени, предпочтительной является доза 1-15 мг/сутки, особенно предпочтительно 1-10 мг/сутки. Если доза будет вводиться циклически, предпочтительной является доза 5-40 мг/сутки, особенно предпочтительно от 10-30 мг/сутки.
В. Участок доставки активного ингредиента
Человек или другое млекопитающее, страдающее различными заболеваниями или расстройствами, может быть успешно вылечен путем доставки новой лекарственной формы, содержащей активный ингредиент, в желудок указанного человека или другого млекопитающего. Описанные здесь новые пероральные, обычно овальной формы, покрытые пленкой лекарственные формы способствуют быстрому прохождению через пищевод, таким образом, избегая или минимизируя высвобождение активного ингредиента в ротовой полости, глотке и/или пищеводе и предохраняя эпителиальные и слизистые ткани от эрозии, язвы или других подобных повреждений. Термин "желудочно-кишечный тракт", используемый здесь, относится к пищеварительному тракту, т.е. это мышечно-мембранозная трубка, около тридцати футов (около 9 м) длиной, простирающаяся от рта до ануса. Термин "верхние отделы желудочно-кишечного тракта", используемый здесь, означает ротовую полость, глотку, пищевод и желудок. Термин "нижние отделы желудочно-кишечного тракта", используемый здесь, означает тонкий кишечник и толстый кишечник.
Термин "ротовая полость" означает ротовую или оральную полость и выстлана слизистой оболочкой, которая продолжается в наружные покровы губ и в слизистую оболочку глотки.
Термин "глотка" относится к части верхних отделов желудочно-кишечного тракта, которая расположена позади носа, рта и гортани. Это трубка, выстланная слизистой оболочкой, около 4 дюймов (около 10 см) длиной, продолжающаяся в пищевод и состоящая из слизистой оболочки, фиброзной оболочки и мышечной оболочки.
Термин "пищевод", используемый здесь, является мышечным каналом около 9 дюймов (около 25 см) длиной, простирающимся от глотки до желудка. Пищевод имеет три слоя: внутреннюю слизистую оболочку, окружающую просвет, среднюю авеолярную оболочку и наружную мышечную оболочку.
Термин "желудок", используемый здесь, означает часть желудочно-кишечного тракта между пищеводом и тонким кишечником.
С. Пленочная оболочка
Термин "покрытый пленкой", используемый здесь, относится к смеси фармацевтически приемлемых наполнителей, которые применяют к, объединяют с, смешивают с или иным образом добавляют к активному ингредиенту. Указанная оболочка может быть нанесена на спрессованную таблетку, шарики, гранулы или частицы активного ингредиента, которые спрессованы в таблетки. Выбранная оболочка должна быть совместима с конкретным выбранным активным ингредиентом.
Таким образом, указанная пленочная оболочка главным образом наносится на спрессованную таблетку, которая содержит частицы или гранулы активного ингредиента; в случаях, когда частицы или гранулы сами покрыты пленкой перед тем прессованием в таблетку, покрытие пленкой самой прессованной таблетки является необязательным. Поскольку данные новые лекарственные формы покрыты пленочной оболочкой, их применение позволит избежать нежелательной доставки активного ингредиента на слизистые и эпителиальные ткани верхних отделов пищеварительного тракта, особенно рта, глотки и пищевода. Указанная оболочка также позволяет доставлять активный ингредиент, что может варьироваться специалистом в данной области путем выбора наполнителей, из которых сделана оболочка, ее типом и/или ее толщиной.
Предпочтительными полимерами для образования пленочной оболочки являются полимеры, растворимые при рН от приблизительно 1,2 до приблизительно 5. Особо предпочтительные полимеры выбирают из группы, состоящей из одной гидроксипропилметилцеллюлозы (НРМС) и/или в сочетании с гидроксипропилцеллюлозой (НРС), карбоксиметилцеллюлозой, метилцеллюлозой, этилцеллюлозой, полиакрилатом и поливинилпирролидоном и желатином или другими, коммерчески доступными пленкообразующими препаратами, такими как Dri-Klear, произведенным Crompton & Knowles Corp., Mahwah, NJ, или Opadry, произведенным Colorcon, West Point Pennsylvania. Особенно предпочтительными являются НРМС, НРС, Dri-Klear и Opadry. НРМС пониженной вязкости, Е-5 и Е-15 являются предпочтительными, а наиболее предпочтительна Е-5. Предпочтительная концентрация полимера в суспензии для приготовления оболочки контролируется таким образом, чтобы достичь значений вязкости в пределах 50-250 сПз.
Количество оболочки, наносимое на таблетку, обычно находится в интервале от приблизительно 2% до приблизительно 5% прироста веса, с предпочтительным приростом в весе приблизительно 3%. Оболочка может и обычно содержит пластификатор. Предпочтительными пластификаторами являются полиэтиленгликоль и полипропиленгликоль, наиболее предпочтительным является полиэтиленгликоль. Предпочтительные количества пластификатора в пределах от 15 до 40% относительно пленкообразующего полимера, наиболее предпочтительно содержание приблизительно 20%. Для придания пленочному покрытию требуемой непрозрачности и цвета также могут быть добавлены красители и пигменты. Предпочтительное содержание пигмента находится в интервале от приблизительно 10% до приблизительно 40% относительно пленкообразующего полимера, причем наиболее предпочтительное содержание составляет от приблизительно 20% до приблизительно 30%. Другие добавки могут быть добавлены с целью минимизации пенообразования или для облегчения распыления раствора на таблетки.
D. Новые, обычно овальной формы, покрытые пленкой пероральные лекарственные формы для доставки лекарственной формы, содержащей активный ингредиент, в желудок
Как было установлено выше, настоящее изобретение относится к новым, обычно овальной формы, покрытым пленкой пероральным лекарственным формам активного ингредиента для осуществления доставки лекарственной формы в желудок человека или другого млекопитающего. Новая, обычно овальной формы, покрытая пленкой пероральная лекарственная форма способствует быстрому прохождению через верхние отделы желудочно-кишечного тракта и позволяет избежать доставки активного ингредиента до тех пор, пока он не достигнет желудка пациента. При достижении желудка лекарственная форма растворяется и достигается всасывание активного ингредиента через тонкий и/или толстый кишечник. Таким образом, ткани верхних отделов желудочно-кишечного тракта, особенно эпителиальные и слизистые слои ротовой полости, глотки и пищевода предохраняются от прямого контакта с активным ингредиентом, и активный ингредиент поглощается в соответствующем участке. Указанная пероральная лекарственная форма, таким образом, значительно облегчает эзофагит или раздражение пищевода, которые иногда являются следствием перорального введения фармацевтических препаратов, содержащих определенные активные ингредиенты.
Таким образом, пероральные лекарственные формы, приемлемые для использования, обычно представляют собой покрытые пленкой таблетки овальной формы, предпочтительно модифицированной овальной формы. Модифицированная овальная лекарственная форма представлена на фиг.1-3. В лекарственную форму включен активный ингредиент и фармацевтически приемлемые наполнители, которые хорошо известны специалистам в данной области, и ее формируют в подходящую форму с использованием оборудования и/или способов, которые хорошо известны специалистам в данной области. Обычно, овальные таблетки имеют следующие размеры: длина от 0,23 до 0,85 дюймов, предпочтительно от 0,25 до 0,75 дюймов, ширина от 0,11 до 0,4 дюймов, предпочтительно от 0,15 до 0,35 дюймов и толщина от 0,075 до 0,3, предпочтительно от 0,1 до 0,25 дюймов. Модифицированная овальная таблетка, представленная на фигурах 1-3, может иметь следующие размеры: длина около 0,455 дюймов, ширина 0,225 дюймов и толщина приблизительно 0,157 дюймов.
Термин "фармацевтический состав" означает пероральную лекарственную форму, включающую безопасное и эффективное количество активного ингредиента и фармацевтически приемлемые наполнители. Фармацевтические составы, описанные здесь, включают в себя от 0,1% до 99%, предпочтительно от 0,5% до 95% активного ингредиента и от 1% до 99,9%, предпочтительно от 5% до 99,9% фармацевтически приемлемых наполнителей. Для ризедроната состав включает 0,25-40%, предпочтительно от 0,5% до 30% ризедронатного активного ингредиента и от 60% до 97%, предпочтительно от 70% до 99,5% фармацевтически приемлемых наполнителей.
Используемый здесь термин "безопасное и эффективное количество" означает такие количества вещества или состава, которые достаточно высоки для оказания значительного положительного влияния на симптомы и/или чтобы оказать лечебный эффект, но достаточно низкие количества, чтобы исключить серьезные побочные эффекты (разумное соотношение польза/риск), в рамках адекватного медицинского подхода. Безопасное и эффективное количество активного ингредиента для использования в способе по настоящему изобретению может варьироваться в зависимости от индивидуальных режимов лечения, возраста и физического состояния пациентов, подлежащих лечению, тяжести состояния, продолжительности лечения, природы сочетанной терапии, конкретного применяемого активного ингредиента, конкретных применяемых фармацевтически приемлемых наполнителей и подобных факторов, которые определяются знаниями и опытом лечащего врача.
Используемый здесь термин "фармацевтически приемлемые наполнители" включает любой физиологически инертный, фармакологически неактивный материал, известный специалистам, который совместим с физическими и химическими характеристиками конкретного применяемого активного ингредиента. Фармацевтически приемлемые наполнители включают, но не ограничиваются, полимеры, смолы, пластификаторы, наполнители, смазывающие вещества, связывающие вещества, дезинтеграторы, растворители, сорастворители, буферные системы, сурфактанты, консерванты, подслащивающие агенты, корригенты, фармацевтические красители и пигменты. Все или часть фармацевтически приемлемых наполнителей, содержащихся в фармацевтических составах, используют для получения пленочной оболочки, которая подлежит применению в описанных здесь новых пероральных лекарственных формах.
Используемый здесь термин "пероральная лекарственная форма" означает фармацевтическую композицию, которая подлежит введению в желудок индивидуума через рот указанного индивидуума, а в соответствии с целью настоящего изобретения, доставляемая форма представлена в форме модифицированной овальной таблетки (предпочтительно покрытой пленкой), содержащей гранулы или частицы активного ингредиента.
Используемый здесь термин "покрытая пленкой пероральная лекарственная форма" относится к пероральной лекарственной форме, содержащей фармацевтическую композицию, как описано здесь, которая включает пленочное покрытие для эффективного высвобождения активного ингредиента в желудке. Покрытая пленкой пероральная лекарственная форма представляет собой спрессованную таблетку, содержащую гранулы или частицы активного ингредиента, которые могут быть покрытыми или непокрытыми.
Термин "быстрое прохождение через пищевод", используемый здесь, означает время, за которое таблетка перемещается из ротоглотки в желудок. Быстрое прохождение через пищевод будет означать прохождение менее чем за 90 с, предпочтительно приблизительно от 1 до 60 с. Наиболее предпочтительно время - менее 20 с, когда таблетка принимается с 50 мл воды.
Как установлено ниже, окончательное место доставки в желудок может быть удовлетворительно отрегулировано специалистом в данной области путем манипуляции одним или несколькими из следующих факторов:
а) собственно действующий ингредиент;
б) тип оболочки и сопутствующая жевательная толщина и ее проницаемость (свойство разбухать);
в) зависимые от времени характеристики оболочки самой по себе и/или в составе покрытой таблетки, частицы, шарика или гранулы;
г) размер частиц гранулированного активного ингредиента.
Как установлено ниже, фармацевтически приемлемые наполнители включают, но не ограничиваются ими, полимеры, смолы, пластификаторы, смазывающие вещества, связывающие вещества, дезинтеграторы, растворители, сорастворители, сурфактанты, консерванты, подслащивающие агенты, корригенты, буферные системы, фармацевтические красители и пигменты.
Предпочтительным растворителем является вода.
Корригенты, применимые по настоящему соединению, включают описанные в Remington's Pharmaceutical Sciences, 18, Edition, Mack Publishing Company, 1990, pp. 1288-1300, включенной в качестве ссылки. Красители или пигменты, применимые по настоящему изобретению, включают описанные в Handbook of Pharmaceutical Excipients, Second Edition, pp. 126-134, 1994 by the American Pharmaceutical Association & Pharmaceutical Press, включенной в качестве ссылки.
Предпочтительные сорастворители включают, но не ограничиваются ими, этанол, глицерин, пропиленгликоль, полиэтиленгликоль.
Предпочтительные буферные системы включают, но не ограничиваются, калийацетатный, карбонатный, боратный, фосфатный, сукцинатный, малатный, тартратный, цитратный, ацетатный, бензоатный, лактатный, глицератный, глюконатный, глютаратный и глютаматный буферы. Особенно предпочтительными являются фосфатный, тартратный, цитратный и калийацетатный буферы.
Предпочтительные сурфактанты включают, но не ограничиваются ими эфиры жирной кислоты и полиоксиэтиленсорбитана, полиоксиэтиленмоноалкильные эфиры, моноэфиры сахарозы и сложные и простые эфиры ланолина.
Предпочтительные консерванты включают, но не ограничиваются, фенол, алкильные эфиры пара-гидроксибензойной кислоты, бензойную кислоту и ее соли, борную кислоту и ее соли, сорбиновую кислоту и ее соли, хлорбутанол, бензиловый спирт, тимерозал, фенилмеркурацетат и фенилмеркурнитрат, нитромерзол, хлорид бензалкония, хлорид цетилпиридиния, метилпарабен и пропилпарабен. Особенно предпочтительны соли бензойной кислоты, хлорид цетилпиридиния, метилпарабен и пропилпарабен.
Предпочтительные подслащивающие вещества включают, но не ограничиваются, сахарозу, глюкозу, сахарин и аспартам. Особенно предпочтительны сахароза и сахарин.
Предпочтительные связывающие вещества включают, но не ограничиваются, метилцеллюлозу, карбоксиметилцеллюлозанатрий, гидроксипропилметилцеллюлозу, карбомер, повидон, аравийскую камедь, гуаровую смолу, ксантановую смолу и трагакант. Особенно предпочтительны метилцеллюлоза, карбомер, гуаровая смола, ксантановая смола, повидон и карбоксиметилцеллюлозанатрий.
Предпочтительные наполнители включают, но не ограничиваются, лактозу, сахарозу, мальтодекстрин, маннитол, крахмал и микрокристаллическую целлюлозу.
Предпочтительные пластификаторы включают, но не ограничиваются, полиэтиленгликоль, пропиленгликоль, дибутилфталат и касторовое масло, ацетилированные моноглицериды и триацетин.
Предпочтительные смазывающие вещества включают, но не ограничиваются, стеарат магния, стеариновую кислоту и тальк.
Предпочтительные дезинтеграторы включают, но не ограничиваются, поперечносшитый повидон, карбоксиметилкрахмалнатрий, глюканаткрахмалнатрий, карбоксиметилцеллюлозанатрий, альгиновую кислоту, глину и ионообменную смолу.
Предпочтительные полимеры включают, но не ограничиваются, гидроксипропилметилцеллюлозу (НРМС), одну и/или в комбинации с гидроксипропилцеллюлозой (НРС), карбоксиметилцеллюлозу, полиакрилаты, такие, как Eudragit® RL30D, производимый Rohm Pharma GmbH Weiderstadt, West Germany, метилцеллюлозу, этилцеллюлозу и поливинилпирролидон или другие коммерчески доступные препараты, образующие пленочную оболочку, такие, как Dri-Klear, произведенный Crompton & Knowles Corp., Mahwah, NJ, или Opadry, произведенный Colorcon, West Point, PA.
С применением новой пероральной формы по настоящему изобретению активный ингредиент может быть надежно доставлен в желудок, предупреждая, таким образом, нежелательное воздействие активного вещества на слизистые и эпителиальные ткани рта, глотки и/или пищевода. Указанные лекарственные формы предоставляют активному ингредиенту возможность легко всасываться в желудке и, по существу, без контакта активного ингредиента с эпителиальными и слизистыми тканями рта, глотки и пищевода. Таким образом, новая модифицированная овальная покрытая пленкой пероральная лекарственная форма по настоящему изобретению значительно облегчает состояния эзофагита или раздражения пищевода, которые иногда являются результатом перорального введения фармацевтической композиции, содержащей определенные активные ингредиенты.
В практике данного изобретения могут использоваться любые пленочные покрытия, которые растворимы в содержимом желудка при рН 1,2-5. Предпочтительный полимер для использования в качестве пленочного покрытия должен быть нанесен на спрессованную таблетку, желатиновую капсулу и/или шарики, частицы или гранулы активного ингредиента, с толщиной покрытия, обеспечивающей растворение в желудке. Растворение или дезинтеграция покрытия не проходит до тех пор, пока покрытая лекарственная форма не попадет в желудок.
Следующие неограничивающие примеры служат дальнейшей иллюстрации новой пероральной лекарственной формы по данному изобретению.
Пример 1
Модифицированная овальная, покрытая пленкой, ризедронатная таблетка
Пленочное покрытие наносят на 110 кг таблеток с ризедронатным ядром весом 240 мг каждая (см. табл. 1).
Dri-Klear представляет собой смесь НРМС, НРС, полиэтиленгликоля и диоксида кремния, произведенную Crompton & Knowles Corp., Marwah, NJ; Chroma-Tone White - это смесь НРС и диоксида, произведенная Crompton & Knowles Corp., Marwah, NJ.
Покрывающая суспензия готовится следующим образом:
1. Добавляют Dri-Klear к горячей очищенной воде, 60-80oС, при перемешивании.
2. Охлаждают раствор Dri-Klear до 40oС или ниже, с продолжением перемешивания до тех пор, пока не растворится Dri-Klear.
3. Добавляют Chroma-Tone White к очищенной воде при перемешивании. Диспергируют, используя высокоскоростной смеситель, в течение 10-25 минут.
4. Добавляют суспензию пигмента (шаг 3) к раствору полимера (шаг 2) и перемешивают. Продолжают перемешивание до готовности к применению.
5. Загружают сердцевины таблеток в колонку с боковыми отверстиями длиной 48 дюймов.
6. Предварительно нагревают таблетки до выходящей температуры приблизительно 35oС и начинают распыление. Наносят покрывающую суспензию при температуре входящего воздуха 40-60oС, со скоростью 300-400 г/мин.
7. Охлаждают и выгружают таблетки.
Пример 2
Каплевидная, покрытая пленкой алендронатная таблетка
Пленочное покрытие наносят на 100 кг таблеток с алендронатным ядром, весом 200 мг каждая (см. табл. 2).
Opadry представляет собой коммерческую смесь пленочного покрытия, произведенную Colorcon, West Point, PA,
Покрывающая суспензия готовится следующим образом;
1. Добавляют Opadry к очищенной воде при комнатной температуре при перемешивании.
2. Перемешивают до тех пор, пока все Opadry не растворится.
3. Добавляют суспензию оксида железа (III) к очищенной воде при перемешивании. Диспергируют с использованием высокоскоростного смесителя в течение 5 мин.
4. Добавляют суспензию оксида железа (III) (шаг 3) к раствору полимера (шаг 2) и перемешивают. Продолжают перемешивание до готовности к применению.
5. Загружают сердцевины таблеток в колонку с боковыми отверстиями длиной 48 дюймов.
6. Предварительно нагревают таблетки до выходящей температуры приблизительно 40oС и начинают распыление. Наносят покрывающую суспензию при температуре входящего воздуха 40-60oС, со скоростью 250-350 г/мин.
7. Охлаждают и выгружают таблетки.
Пример 3
Покрытые пленкой ризедронатные таблетки, произведенные путем приготовления гранул, содержащих активное вещество, нанесения на гранулы покрытия, прессовки в таблетку и последующего нанесения пленочного покрытия на таблетки.
А. Приготовление гранул ризедроната натрия, 212,5 кг (см. табл. 3).
Гранулы готовятся следующим образом:
1. Растворяют поливинилпирролидон в очищенной воде.
2. Смешивают ризедронат натрия, лактозу и микрокристаллическую целлюлозу с использованием рубящего миксера в течение 3 мин.
3. Гранулируют смесь с раствором поливинилпирролидона при перемешивании с 5-минутным интервалом.
4. Высушивают влажную массу в сушилке с псевдоожиженным слоем при температуре входящего воздуха 60oС.
5. Измельчают высушенный материал, используя молотковую мельницу, с целью достижения нужного размера гранул.
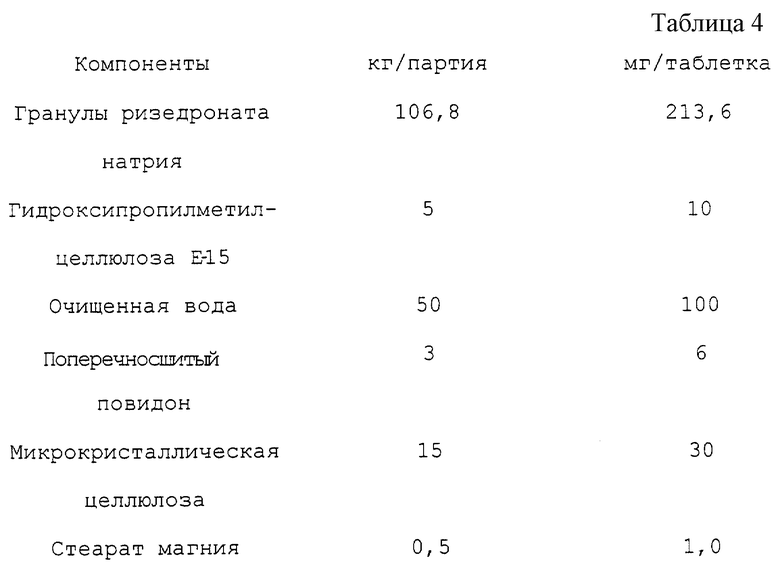
В. Покрытие гранул и приготовления таблеток ризедроната натрия, 130,3 кг (см. табл. 4).
Гранулы покрывают и прессуют в таблетки следующим образом:
1. Растворяют гидроксипропилметилцеллюлозу Е15 в очищенной воде, при 60oС при перемешивании. Охлаждают раствор до 30oС, с продолжением перемешивания до полного растворения.
2. Добавляют гранулы ризедроната натрия в подходящую покрывающую колонку.
3. Распыляют раствор гидроксипропилметилцеллюлозы Е-15 при температуре на входе 50oС. После покрытия высушивают гранулы при температуре на входе 60oС.
4. Переносят покрытые гранулы в двуоболочечный блендер и добавляют кросповидон и микрокристаллическую целлюлозу и перемешивают 5 минут.
5. Добавляют стеарат магния и перемешивают 3 минуты и прессуют в таблетки на ротационном прессе.
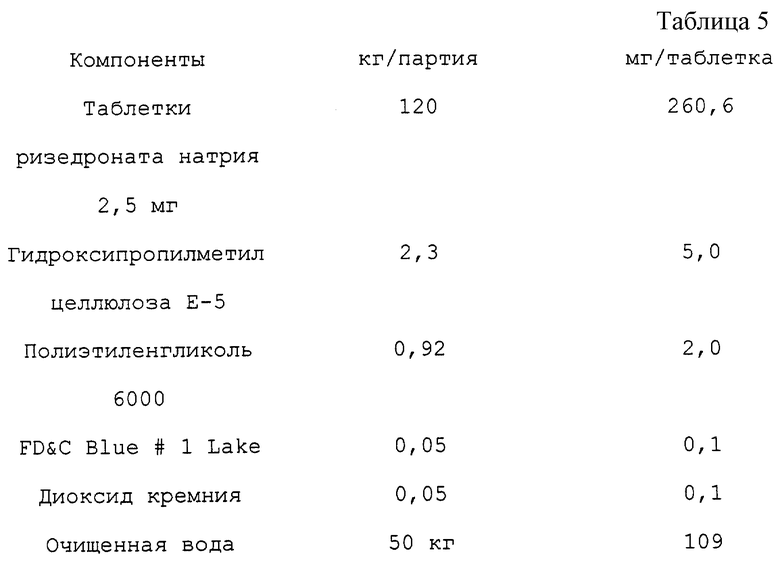
С. Пленочное покрытие
Пленочное покрытие наносится на 120 кг ризедронатных таблеток, весом 260,6 мг каждая (см. табл. 5).
Покрывающая суспензия готовится следующим образом:
1. Добавляют гидроксипропилметилцеллюлозу Е-5 к порции очищенной воды, при 80oС, при перемешивании. Добавляют остальную очищенную воду при 10oС до полного растворения.
2. Добавляют полиэтиленгликоль 6000 к очищенной воде при перемешивании.
3. Добавляют FD& C Blue # 1 Lake и диоксид кремния в раствор полиэтиленгликоля. Диспергируют с использованием рубящего миксера в течение 10-25 мин.
4. Добавляют суспензию пигмента (шаг 3) к раствору полимера (шаг 1) и смешивают.
5. Загружают сердцевины таблеток в колонку с боковыми отверстиями длиной 48 дюймов.
6. Предварительно нагревают таблетки до выходящей температуры приблизительно 40oС и начинают распыление. Наносят покрывающую суспензию при температуре входящего воздуха 40oС, со скоростью 250 г/мин.
7. Охлаждают и выгружают таблетки.



Изобретение относится к области медицины и касается пероральной лекарственной формы, подлежащей доставке в желудок, где указанная лекарственная форма включает безопасное и эффективное количество бисфосфоната и фармацевтически приемлемые наполнители, где указанная пероральная лекарственная форма характеризуется обычно овальной формой и пленочным покрытием для облегчения быстрого прохождения через пищевод и предупреждения раздражения в ротовой полости, преддверии рта, глотке и пищеводе. 5 з.п. ф-лы, 3 ил., 5 табл.
| RU 94026283 A1, 20.05.1996 | |||
| US 4302440 A, 24.11.1981 | |||
| Экономайзер | 0 |
|
SU94A1 |
| МАШКОВСКИИ М.Д | |||
| Лекарственные средства | |||
| - М.: Медицина, 1993, с | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2002-12-10—Публикация
1998-06-08—Подача