Предметом настоящего изобретения являются соединения формулы (I), а также их физиологически приемлемые соли и содержащие такие соединения фармацевтические композиции, их получение и применение в качестве лечебного средства, в частности в качестве ингибиторов резорбции костей за счет остеокластов (клеток, разрушающих кость) в качестве ингибиторов роста опухолей и метастазирования опухолей, в качестве средств, уменьшающих интенсивность воспаления, для лечения или профилактики сердечно-сосудистых заболеваний, как артериосклероз или повторный стеноз, для лечения и профилактики нефропатий и ретинопатий, как например диабетическая ретинопатия, а также в качестве антагонистов рецептора витронектина для лечения и профилактики заболеваний, которые основываются на взаимодействии между рецепторами витронектина и их лигандами при процессах внутреннего взаимодействия клетка - клетка или клетка - матрица. Изобретение относится, далее, к использованию соединений формулы (I), а также их физиологически приемлемых солей и содержащих такие соединения фармацевтических композиций в качестве лекарственных средств для облегчения или лечения заболеваний, которые по меньшей мере частично обусловлены нежелательной степенью рассасывания костей, ангиогенезом или пролиферацией гладкомышечных клеток.
Человеческие кости подвергаются непрерывному динамическому процессу превращения, включающему рассасывание и построение костей. Эти процессы регулируются специализированными для этой цели типами клеток. Построение костей основано на создании костной матрицы остеобластами, рассасывание костей основано на разрушении костной матрицы остеокластами. Множество костных заболеваний основано на нарушении равновесия между образованием и рассасыванием костей.
Остеопороз характеризуется потерей костной матрицы. Активированные остеокласты удаляют из костной матрицы многоядерные клетки диаметром вплоть до 400 мкм. Активированные остеокласты отлагаются на поверхности костной матрицы и выделяют протеолитические ферменты и кислоты в так называемой "закрытой зоне", области между их клеточной мембраной и костной матрицей. Кислая окружающая среда и протеазы вызывают разрушение кости.
Предлагаемые согласно изобретению соединения формулы (I) ингибируют рассасывание костей остеокластами. Костными заболеваниями, против которых можно использовать предлагаемые согласно изобретению соединения, являются прежде всего остеопороз, гиперкальциемия, остеопения, вызываемая, например, метастазами, заболевание зубов, гиперпаратиреоз, периартикулярные эрозии при ревматоидном артрите и болезнь Педжета. Далее, соединения формулы (I) можно использовать для облегчения, устранения или терапии костных заболеваний, которые возникают вследствие терапии с применением гликокортикоидов, стероидов или кортикостероидов или за счет недостатка половых гормонов. Все эти заболевания характеризуются утратой костей, которая основана на неравновесии между образованием и разрушением костей.
Исследования показывают, что появление остеокластов в костях регулируется интегрин-рецепторами на поверхности клеток остеокластов.
Интегрины представляют собой суперсемейство рецепторов, к которым, между прочим, относятся фибриногенный рецептор αIIbβ3 в тромбоцитах и рецептор витронектина αVβ3. Рецептор витронектина αVβ3 представляет собой постоянный мембранный гликопротеин, который экспримируется на поверхности ряда клеток, как эндотелиальные клетки, гладкомышечные клетки, остеокласты и опухолевые клетки. Рецептор αVβ3, который экспримируется в мембране остеокластов, направляет процесс наслоения в кости и рассасывания кости и таким образом приводит к остеопорозу.
При этом αVβ3 связывается с протеинами костной матрицы, как остеопонтин, костный сиалопротеин и тромбоспонтин, которые содержат трипептидный мотив Аrg-Gly-Asp (или RGD).
Horton и сотр. описывают RGD-пептиды и антитело против рецептора витронектина (23С6), которые ингибируют разрушение зубов за счет остеокластов и миграцию остеокластов (Horton и др., Exp. Cell. Res., 195, 368 (1991)). Sato и др. в J. Cell. Biol., 111, 1713 (1990) описывают эхистатин, RGD-пептид из змеиного яда, в качестве эффективного ингибитора рассасывания костей в тканевой культуре в качестве ингибитора прикрепления остеокластов к кости. Fischer и др. (Endocrinology, 132, 1411 (1993)) смогли показать на крысе, что эхистатин также ин виво ингибирует рассасывание костей.
Рецептор витронектина αVβ3 человеческих гдадкомышечных клеток аорты стимулирует миграцию этих клеток в новую внутреннюю оболочку, что в конце концов приводит к артериосклерозу и повторному стенозу после ангиопластики (Brown и др., Cardiovascular Res., 28, 1815 (1994)).
Соединения формулы (I), далее, могут служить в качестве носителей активных веществ, чтобы транспортировать целевое активное вещество в место воздействия (= мишень лекарственного средства; см., например, Targeted Druff Delivery, R. C. Juliano, Руководство по экспериментальной фармакологии, том 100, изд. Борн, G.V.R. и др., Springer Verlag). Под активно действующими веществами понимаются такие, которые можно применять для лечения вышеуказанных заболеваний.
Brooks и др. (Cell, 79, 1157 (1994)) показали, что антитела против αVβ3 или αVβ3-антагонистов могут вызывать "сморщивание" опухолей вследствие того, что они индуцируют апоптоз клеток кровеносных сосудов во время ангиогенеза. Chersh и др. (Science, 270, 1500 (1995)) описывает антитела против αVβ3 или αVβ3-антагонисты, которые ингибируют индуцированные bFGF процессы ангиогенеза в глазах крысы, что может быть полезным с терапевтической точки зрения при лечении ретинопатий.
В европейских патентах А 449079, А 530505, А 566919, международной заявке на патент WO 93/18057 описывают производные гидантоина, а в международной заявке на патент WO 95/1408 описывают 5-членные гетероциклические соединения, которые обладают ингибирующими агрегацию тромбоцитов активностями.
В международной заявке на патент WO 94/12181 описывают замещенные ароматические или неароматические циклические системы, а в международной заявке на патент WO 94/08577 описывают замещенные гетероциклы в качестве антагонистов фибриногеновых рецепторов и ингибиторов агрегации тромбоцитов. Из европейских патентов ЕР-А 518586 и ЕР-А 528587 известны аминоалкил- или гетероциклилзамещенные производные фенидаланина, из международной заявки на патент WO 95/31710 известны арильные производные в качестве ингибиторов рассасывания костей за счет остеокластов. В международной заявке на патент WO 95/28426 описываются RGD-пептиды в качестве ингибиторов рассасывания костей, ангиогенеза и повторного стеноза. В международной заявке на патент WO 96/00574 описываются бензодиазепины, а в международной заявке на патент WO 96/00730 описываются темплаты (матрицы) антагонистов фибриногеновых рецепторов, в частности бензодиазепины, которые связываются с несущим азот пятичленным кольцом, в качестве антагонистов рецептора витронектина.
Предметом настоящего изобретения являются пятичленные гетероциклы общей формулы (I)
где W означает R1-A-B-D-C(R16); R1-A-B-D-C(R16) =C;
или
причем циклические системы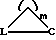
могут содержать один или два гетероатома из ряда О, N, S, могут быть насыщенными или одно- или многократно ненасыщенными и могут быть замещены 1-3 заместителями из R16 или однократно или двукратно могут быть замещены кислородом или серой через двойную связь;
Y означает С=O, C=S или -СН2-;
Z означает N(R0), О, S или -СН2-;
А означает прямую связь, (С1-С8)-алкандиил, -NR2-N-CR2-, -NR2-C(O)-NR2-, -NR2-C(O)O-, -NR2-C(O)S-, -NR2-C(O)S-NR2-, -NR2-C(S)-O-, NR2-C(S)-S-, -NR2-S(O)n-NR2-, -NR2-S(O)n-O-, -NR2-S(O)n-, (С3-С12)-циклоалкандиил,  -NR2-C(O)-, -C(O)-NR2-, -(С5-С14)-арилен-С(O)-NR2-, -О-, -S(O)n-, (С5-С14)-арилен-, -СО-, (С5-С14)-арилен-СО-, -NR2-, -SO2-NR2-, -О-С(О)-, -С(O)-O-, -N= CR2-, -R2C= N-, -CR2=CR3-, -(С5-С14)-арилен-S(O)n-, которые, каждый, могут быть замещены группой NR2 и/или одно- или двукратно -(С1-С8)-алкандиилом, как например -(С1-С8)-алкандиил-CO-NR2-(С1-С8)-аландиил, -(С1-С8)-алкандиил- СО-NR2- или -СО-NR2-(С1-С8)-алкандиил;
-NR2-C(O)-, -C(O)-NR2-, -(С5-С14)-арилен-С(O)-NR2-, -О-, -S(O)n-, (С5-С14)-арилен-, -СО-, (С5-С14)-арилен-СО-, -NR2-, -SO2-NR2-, -О-С(О)-, -С(O)-O-, -N= CR2-, -R2C= N-, -CR2=CR3-, -(С5-С14)-арилен-S(O)n-, которые, каждый, могут быть замещены группой NR2 и/или одно- или двукратно -(С1-С8)-алкандиилом, как например -(С1-С8)-алкандиил-CO-NR2-(С1-С8)-аландиил, -(С1-С8)-алкандиил- СО-NR2- или -СО-NR2-(С1-С8)-алкандиил;
В означает прямую связь, (С1-С8)-алкандиил, (С5-С10)-арилен, (С3-С8)-циклоалкандиил,  -NR2-, -С(O)-, NR2-C(O)-, -C(O)-NR2-, -NR2-C(O)-NR2-, -NR2-C(S)-NR2-, -ОС(O)-, -С(O)O-, -S(O)-, -S(O)2-, -S(O)-NR2-, -NR2-S(O)-, -NR2-S(O)2-, -O-, -S-, -CR2=CR3-, которые, каждый, могут быть одно- или двукратно замещены (С1-С6)-алкандиилом, как например
-NR2-, -С(O)-, NR2-C(O)-, -C(O)-NR2-, -NR2-C(O)-NR2-, -NR2-C(S)-NR2-, -ОС(O)-, -С(O)O-, -S(O)-, -S(O)2-, -S(O)-NR2-, -NR2-S(O)-, -NR2-S(O)2-, -O-, -S-, -CR2=CR3-, которые, каждый, могут быть одно- или двукратно замещены (С1-С6)-алкандиилом, как например
-(CH2)2-NR2-C(O)-; или двухвалентный остаток 5- или 6-членного насыщенного или ненасыщенного цикла, который может содержать один или два атома азота и может быть замещен одно- или двукратно (С1-С6)-алкилом или кислородом или серой через двойную связь;
D означает прямую связь, (С1-С8)-алкандиил, (С5-С10)-арилен, -О-, -NR2-, -CO-NR2-, -NR2-CO-, -NR2-C(O)-NR2-, -NR2-C(S)-NR2-,-OC(O)-, -С(O)O-, -СО-, -CS-, -S(O)-, -S(O)2-, -S(O)2-NR2-, -NR2-S(O)-, -NR2-S(O)2-, -S-, -CR2=CR3-,  -NR2-N= CR2-, -N=CR2-, -R2C=N-, -CH(OH)-, которые, каждый, одно- или двукратно могут быть замещены (С1-С8)-алкандиилом, -CR2=CR3- или (С5-С6)-ариленом, как например
-NR2-N= CR2-, -N=CR2-, -R2C=N-, -CH(OH)-, которые, каждый, одно- или двукратно могут быть замещены (С1-С8)-алкандиилом, -CR2=CR3- или (С5-С6)-ариленом, как например
-фенилен-NR2-C(O)- или -(CH2)2-S(O)2-CH2-;
Е означает прямую связь, (С1-С6)-алкандиил, (С2-С6)-алкендиил, (С2-С6)-алкиндиил,фенилен,фенилен-(С1-С3)-алкандиил,(С1-С3)-алкандиил-фенилен;
F имеет значение, указанное для D;
G означает
L означает C(R16) или N;
R0 означает водород, (С1-С8)-алкил, который в случае необходимости одно- или многократно замещен фтором; (С3-С12)-циклоалкил, (С3-С12)-циклоалкил-(С1-С8)-алкил; (С5-С14)-арил, (С5-С14)-арил-(С1-С8)-алкил, (С1-С8)-алкил-С(О)-, (С3-С12)-циклоалкил-С(O)-, (С3-C12)-циклоалкил-(С1-С6)-алкил-С(O)-, (С5-С14)-арил-С(O)- или (C5-С14)-арил-(С1-С6)-алкил-С(O)-, причем алкильные остатки могут быть одно- или многократно замещены фтором;
R1 означает R2-C(= NR2)NR2-, R2R3N-C(=NR2)-, R2R3N-C-(=NR2)-NR2- или 4-14-членную моно- или полициклическую, ароматическую или неароматическую циклическую систему, которая возможно может содержать 1-4 гетероатома из ряда N, О и S и возможно одно- или многократно замещена заместителями из ряда R12, R13, R14 и R15;
R2, R3, независимо друг от друга, означают водород, (С1-С10)-алкил, который в случае необходимости одно- или многократно замещен фтором, (С3-С12)-циклоалкил, (С3-С12)-циклоалкил-(С1-С8)-алкил, (C5-C14)-apил,
(C5-С14)-арил-(С1-С8)-алкил, Н2N, R8ONR9, R8OR9, R8OC(O)R9, R8-(C5-Cl4)-apил-R9, R8R8NR9, HO-(С1-С8)-aлкил-NR8R9, R8R8NC(O)R9, R8C(O)NR8R9,
R8C(O)R9, R8R8N-C(= NR8)-, R8R8N-C(= NR8)-NR8- или (С1-С18)-алкилкарбонилокси-(С1-С6)-алкоксикарбонил;
R4, R5, R6, R7, независимо друг от друга, означают водород, фтор, ОН, (С1-С8)-алкил, (С3-С12)-циклоалкил, (С3-С12)-циклоалкил-(С1-С8)-алкил, или R8OR9, R8SR9, R8CO2R9, R8OC(O)R9, R8-(C5-C14)-арил-R9, R8N(R2)R9, R8R8NR9, R8N(R2)C(O)OR9, R8S(O)nN(R2)R9, R8OC(O)N(R2)R9, R8C(O)N(R2)R9,
R8N(R2)C(O)N(R2)R9, R8N(R2)S(O)nN(R2)R9, R8S(O)nR9, R8SC(O)N(R2)R9,
R8C(O)R9, R8N(R2)C(O)R9, R8N(R2)S(O)nR9;
R8 означает водород, (С1-С8)-алкил, (С3-С12)-циклоалкил, (С3-С12)-циклоалкил-(С1-С8)-алкил, (С5-С14)-арил, (C5-С14)-арил-(С1-С8)-алкил, причем алкильные остатки могут быть одно- или многократно замещены фтором;
R9 означает прямую связь или (С1-С8)-алкандиил;
R10 означает C(O)R11, C(S)R11, S(O)nR11, P(O)nR11 или 4-8-членный, насыщенный или ненасыщенный гетероцикл, который содержит 1, 2, 3 или 4 гетероатома из ряда N, О, S, как например тетразолил, имидазолил, пиразолил, оксазолил, тиадиазолил;
R11 означает ОН, (С1-С8)-алкоксил, (C5-C14)-арил-(С1-С8)-алкоксил, (С5-С14)-арилоксигруппу, (С1-С8)-алкилкарбонилокси-(С1-С4)-алкоксил, (С5-С14)-арил-(С1-С8)-алкилкарбонилокси-(С1-С6)-алкоксил, NH2, моно- или ди-(С1-С8-алкил)-аминогруппу, (С5-С14)-арил- (С1-С8)-алкиламиногруппу, (С1-С8)-диалкиламинокарбонилметилоксигруппу, (C5-C14)-арил-(С1-С8)-диалкиламинокарбонилметилоксигруппу или (C5-C14)-ариламиногруппу или L- или D-аминокислоту;
R12, R13, R14, R15, независимо друг от друга, означают водород, (С1-С10)-алкил, который в случае необходимости замещен одно- или многократно фтором, (С3-С12)-циклоалкил (С3-С12)-циклоалкил-(С1-С8)-алкил, (С5-С14)-арил, (С5-С14)-арил-(С1-С8)-алкил, H2N, R8ONR9, R8ОR9, R8ОС-(О)R9,
R8R8NR9, R8-(C5-Cl4)-apил-R9, НО-(С1-С8)-алкил-N-(R2)R9, R8N(R2)C(O)R9, R8C(O)N(R2)R9, R8C(O)R9, R2R3N-C(=NR2)-NR2-, R2R3B-C(=NR2), =O, =S; причем два соседних заместителя из R12-R15 вместе могут означать, далее, -OCH2O-, OCH2СН2О-, -OC(CH3)2O-;
R16 означает водород, (С1-С10)-алкил, который в случае необходимости одно- или многократно замещен фтором; (С3-С12)-циклоалкил, (С3-С12)-циклоалкил-(С1-С8)-алкил, (С5-С14)-арил, (С5-С14)-арил-(С1-С8)-адкил, (С2-С20)-алкенил, (С2-С10)-алкинил;
m означает 1, 2, 3, 4, 5 или 6;
n означает 1 или 2;
p, q, независимо друг от друга, означают 0 или 1;
а также их физиологически приемлемые соли,
причем исключаются соединения, в которых R1-A-B-D-C(R16) или R1-A-B-D-C(R16)= C равны R1-K-C(R16), соответственно, R1-К-СН =С (R16= Н), причем здесь:
R1 означает X-NH-C(= NH)-(CH2)p, X1-NH-(CH2)p или 4-имидазолил- СН2-, причем р может означать целое число 0-3;
X означает водород, (С1-С6)-алкил, (С1-С6)-алкилкарбонил, (С1-С6)-алкоксикарбонил, (С1-С18)-алкилкарбонилокси-(С1-С6 )-алкоксикарбонил, (С6-С14)-алкилкарбонил, (C6-C14)-арилоксикарбонил,
(С6-С14)-арил-(С1-С6)-алкоксикарбонил, гидроксил, (С1-С6)-алкоксил, (С6-С14)арил-(С1-С6)-алкоксил или аминогруппу, причем арильные группы в Х представляют собой исключительно карбоциклы, в случае необходимости одно- или двукратно замещенные;
X1 означает (С4-С14)-арилкарбонил, (С4-С14)-арилоксикарбонил, (С4-С14)-арил-(С1-С6)-алкоксикарбонил, (C4-C14)-арил-(С1-С6)-алкоксил или R'-NH-C(= N-R"), причем R' и R", независимо друг от друга, имеют указанные для Х значения и причем арильные группы в X1 представляют собой исключительно карбоциклы, в случае необходимости одно- или многократно замещенные; и
К означает (С1-С6)-алкандиил, (С3-С7)-циклоалкандиил, фенилен, фенилен-(С1-С6)-алкандиил, (С1-С6)-алкандиил-фенилен, фенилен-(С2-С6)-алкендиил или двухвалентный остаток 5- или 6-членного, насыщенного или ненасыщенного цикла, который может содержать 1 или 2 атома азота и может быть одно- или двукратно замещен (С1-С6)-алкилом или кислородом или серой через двойную связь.
Встречающиеся в заместителях алкильные остатки могут быть линейными или разветвленными, насыщенными или одно- или многократно ненасыщенными. Соответственно, действует и для производимых от них остатков, как например алкоксил. Циклоалкильные остатки могут быть моно-, би- или трициклическими.
Моноциклическими циклоалкильными остатками являются, в частности, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил, которые, однако, также могут быть замещены, например, (С1-С4)-алкилом. В качестве примеров замещенных циклоалкильных остатков следует назвать 4-метилциклогексил и 2,3-диметилциклогептил.
Бициклические и трициклические циклоалкильные остатки могут быть незамещены или в любых пригодных положениях могут быть замещены одной или несколькими оксогруппами и/или одной или несколькими, одинаковыми или разными (С1-С4)-алкильными группами, например метильными или изопропильными группами, предпочтительно метильными группами. Свободная связь би- или трициклического остатка может находиться в любом положении молекулы, следовательно, остаток может быть связан через головной мостиковый атом или через атом в мостике. Свободная связь также может находиться в любом стереохимическом положении, например в экзо- или эндоположении.
Примерами для основной части корпуса бициклических систем являются норборнан (бицикло[2.2.1] гептан), бицикло[2.2.2]октан и бицикло[3.2.1]октан. Примером замещенной оксогруппой системы является камфара (=1,7,7-триметил-2-окcо-бицикло[2.2.1]гептан).
Примерами для основной части корпуса трициклических систем являются твистан (= тpициклo[4.4.0.03,8] дeкaн), адамантан (=трицикло[3.3.1.13,7]декан), норадамантан (=трицикло[3.3.1.03,7]нонан), трицикло[2.2.1.02,6]гептан, трицикло[5.3.2.04,9] додекан, трицикло[5.4.0.02,9] ундекан или трицикло[5.5.1.03,11]тридекан.
Арилом являются, например, фенил, нафтил, бифенилил, антрил или флуоренил, причем предпочтительны 1-нафтил, 2-нафтил или, в частности фенил. Арильные остатки, в частности фенильные остатки, могут быть одно- или многократно, предпочтительно одно-, двух- или трехкратно, замещены одинаковыми или разными остатками из ряда: (С1-С8)-алкил, в особенности (С1-С4)-алкил; (С1-С8)-алкоксил, в частности (С1-С4)-алкоксил; галоген, как фтор, хлор или бром; нитрогруппа, аминогруппа, трифторметил, гидроксил, метилендиоксигруппа, этилендиоксигруппа, -ОС(СН3)2O-, цианогруппа, гидроксикарбонил, аминокарбонил, (С1-С4)-алкоксикарбонил, фенил, феноксигруппа, бензилоксигруппа, (R17O)2R(O), (R17O)2R(O)-O-, где R17 означает водород, (С1-С18)-алкил, (С6-С14)-арил или (С6-С14)-арил-(С1-С8)-алкил или тетразолил.
В монозамещенных фенильных остатках заместитель может находиться в положении 2, 3 или 4, причем предпочтительны положения 3 и 4. Если фенил замещен двукратно, то заместители могут находиться в положении 1,2, 1,3 или 1,4 по отношению друг к другу. В двукратно замещенных фенильных остатках предпочтительно оба заместителя расположены в положении 3 или 4 по отношению к месту связывания.
Арильные группы, далее, могут представлять собой моно- или полициклические ароматические системы, где 1-5 С-атомов могут быть заменены на 1-5 гетероатомов, как например 2-пиридил, 3-пиридил, 4-пиридил, пирролил, фурил, тиенил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, тетразол или пиридил, пиразинил, пиримидинил, индолил, изоиндолил, индазолил, фталазинил, хинолил, изохинолил, хиноксалинил, хинахолинил, циннолинил, β-карболинил, или бензаннелированное, циклопента-, циклогекса- или циклогептааннелированное производное этих остатков.
Эти гетероциклы могут быть замещены такими же заместителями, как и вышеуказанные карбоциклические арильные системы.
В ряду этих арильных групп предпочтительны моно- или бициклические ароматические системы с 1-3 гетероатомами из ряда N, О, S, которые могут быть замещены 1-3 заместителями из ряда: (С1-С6)-алкил, (С1-С6)-алкоксил, фтор, хлор, нитрогруппа, аминогруппа, трифторметил, ОН, (С1-С4)-алкоксикарбонил, фенил, феноксигруппа, бензилоксигруппа или бензил.
При этом особенно предпочтительны моно- и бициклические ароматические 5-10-членные циклические системы с 1-3 гетероатомами из ряда N, О, S, которые могут быть замещены 1-2 заместителями из ряда: (С1-С4)-алкил, (С1-С4)-алкоксил, фенил, феноксигруппа, бензил или бензилоксигруппа.
Вышеуказанное действует также для производных от алкила, циклоалакила и арила двухвалентных остатков, как алкандиил, алкендиил, алкиндиил, циклоалкандиил и арилен.
Также предпочтительны соединения формулы (I), которые содержат липофильный остаток R4, R5, R6 или R7, как например бензилоксикарбониламиногруппа, циклогексилметилкарбониламиногруппа и т.д.
Далее, предпочтительны соединения формулы (I), в которых R1 означает 4-14-членную, моно- или полициклическую, ароматическую или неароматическую систему, которая может содержать в случае необходимости 1-4 гетероатома из ряда N, О, S и может быть в случае необходимости одно- или многократно замещена с помощью заместителей из ряда: R12, R13, R14 и R15, как например


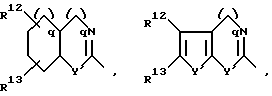

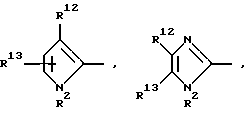

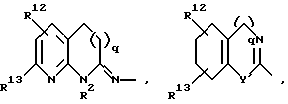






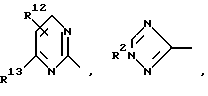




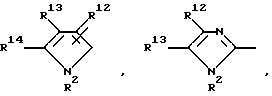

причем Y' означает NR2, кислород или серу.
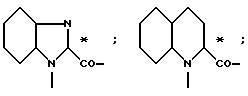
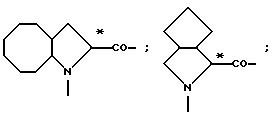
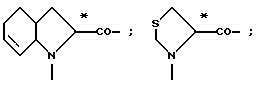
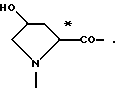
L- или D-Аминокислоты могут представлять собой природные или синтетические аминокислоты. Предпочтительны α-аминокислоты. Например, следует назвать (см. Губен-Вейль, Методы органической химии, том XV/1 и 2, издание Georg Thieme, Штутгарт, 1974):
Aad, Abu, γAbu, ABz, 2AВz, εAca, Ach, Acp, Adpd, Ahb, Aib, βAib, Ala, βAla, ΔAla, Alg, All, Ama, Amt, Ape, Apm, Apr, Arg, Asn, Asp, Asu, Aze, Azi, Bai, Bph, Can, Cit, Cys, (Cys)2, Cyta, Daad, Dab, Dadd, Dap, Dapm, Dasu, Djen, Dpa, Dtc, Fel, Gln, Glu, Gly, Guv, hAla, hArg, hCys, hGln, hGlu, His, hIle, hLeu, hLys, hMet, hPhe, hPro, hSer, hThr, hTrp, hTyr, Hyl, Hyp, 3Нур, Ilе, Ise, Iva, Kyn, Lant, Lcn, Leu, Lsg, Lys, βLys, ΔLys, Met, Mim, Min, nArg, Nle, Nva, Oly, Orn, Pan, Pec, Pen, Phe, Phg, Pic, Pro, ΔPro, Pse, Pya, Pyr, Pza, Qin, Ros, Sar, Sec, Sem, Ser, Thi, βThi, Thr, Thy, Thx, Tia, Tle, Tly, Trp, Trta, Tyr, Val, трет-бутилглицин (Tbg), неопентилглицин (Npg), циклогексилглицин (Chg), циклогексилаланин (Cha), 2-тиенилаланин (Thia), 2,2-дифениламиноуксусная кислота, 2-(п-толил)-2-фениламиноуксусная кислота, 2-(п-хлорфенил)аминоуксусная кислота;
далее пирролидин-2-карбоновая кислота; пиперидин-2-карбоновая кислота; 1,2,3,4-тетрагидроизохинолин-3-карбоновая кислота; декагидроизохинолин-3-карбоновая кислота; октагидроиндол-2-карбоновая кислота; декагидрохинолин-2-карбоновая кислота, октагидроциклопента[b] пиррол-2-карбоновая кислота; 2-азабицикло [2.2.2]октан-3-карбоновая кислота; 2-азабицикло[2.2.1]гептан-3-карбоновая кислота; 2-азабицикло[3.1.0]гексан-3-карбоновая кислота; 2-азаспиро[4.4]нонан3-карбоновая кислота;
2-азаспиро[4.5] декан-3-карбоновая кислота; спиро(бицикло[2.2.1]гептан) -2,3-пирролидин-5-карбоновая кислота; спиро(бицикло [2.2.2]октан)-2,3-пирролидин-5-карбоновая кислота;
2-aзaтpициклo[4.3.0.16,9] дeкaн-3-кapбoнoвaя кислота; декагидроциклопента[b] пиррол-2-карбоновая кислота; декагидроциклоокта[с] пиррол-2-карбоновая кислота; октагидроциклопента[c] пиррол-2-карбоновая кислота; октагидроизоиндол-1-карбоновая кислота; 2,3,3а,4,6а-гексагидроциклопента [b]пиррол-2-карбоновая кислота; 2,3,3а,4,5,7а-гексагидроиндол -2-карбоновая кислота; тетрагидротиазол -4-карбоновая кислота; изоксазолидин-3-карбоновая кислота; пиразолидин-3-карбоновая кислота; гидроксипирролидин-2-карбоновая кислота;
которые в случае необходимости могут быть замещены (см. следующие формулы):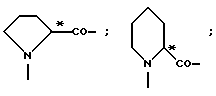








Положенные в основу вышеуказанным остаткам гетероциклы известны, например, из патентов США No A-4344949; А-4374847, А-4350704; и европейских патентов No А-29488, А-31741, А-46953, А-49605, А-49658, А-50800, А-51020, А-52870, А-79022, А-84164, А-89637, А-90341, А-90362, А-105102, А-109020, А-111873, А-271865 и А-344682.
Кроме того, аминокислоты также могут находиться в виде сложных эфиров, соответственно амидов, как например метиловый эфир, этиловый эфир, изопропиловый эфир, изобутиловый эфир, трет-бутиловый эфир, бензиловый эфир, этиламид, семикарбазид или ω-амино-(С2-С8)-алкиламид.
Функциональные группы аминокислот могут быть защищены. Пригодные защитные группы, как например уретановые защитные группы, карбоксильные защитные группы и защитные группы боковых цепей, описаны в Hubbuch, Kontakte (Merck), 1973, No 3, с. 14-23, и в Bullesbach, Kontakte (Merck), 1980, No 1, с. 23-35. В особенности следует указать: Aloc, Pyoc, Fmoc, Tcboc, Z, Воc, Ddz, Врос, Adoc, Msc, Моc, Z(NO2), Z(Haln), Bobz, Iboc, Adpoc, Mboc, Acm, трет-бутил, OBzl, ONbzl, OMbzl, Bzl, Mob, Pic, Trt.
Физиологически приемлемыми солями соединений общей формулы (I) являются, в частности, фармацевтически применимые и нетоксичные соли. Такие соли, например, соединений общей формулы (I), которые содержат кислые группы, например карбоксигруппу, образуются со щелочными или щелочно-земельными металлами, как например натрий, калий, магний и кальций, а также с физиологически приемлемыми органическими аминами, как например триэтиламин, этаноламин или трис-(2-гидрокси-этил)амин.
Соединения общей формулы (I), которые содержат основные группы, например аминогруппу, амидиногруппу или гуанидиногруппу, образуют соли с неорганическими кислотами, как например соляная кислота, серная кислота или фосфорная кислота, а также с органическими карбоновыми или сульфоновыми кислотами, как например уксусная кислота, лимонная кислота, бензойная кислота, малеиновая кислота, фумаровая кислота, винная кислота, метансульфокислота или п-толуолсульфокислота.
Предлагаемые согласно изобретению соединения общей формулы (I) могут содержать оптически активные атомы углерода, которые независимо друг от друга могут иметь R- или S-конфигурацию, и, таким образом, могут находиться в форме чистых энантиомеров или чистых диастереомеров или в виде смесей энантиомеров или диастереомеров. Как чистые энантиомеры и смеси энантиомеров, так и также диастереомеры и смеси диастереомеров составляют предмет настоящего изобретения.
Предлагаемые согласно изобретению соединения общей формулы (I), кроме того, могут содержать подвижные атомы водорода, следовательно, могут находиться в различных таутомерных формах. Также эти таутомеры составляют предмет настоящего изобретения.
Предлагаемые в изобретении соединения формулы (I), если A, D или F, независимо друг от друга, означают -CR2=CR3-, -NR2-N=CR2-, -N=CR2- или -R2C= N- и/или В означает -CR2=CR3-, и/или W означает R1-A-B-D-C(R16)=С, соответственно
могут находиться в виде смесей E/Z-изомеров. Предметом настоящего изобретения являются как чистые Е-, соответственно Z-изомеры, так и также смеси E/Z-изомеров. Диастереомеры, включая E/Z-изомеры, могут быть разделены путем хроматографии на индивидуальные изомеры. Рацематы могут быть разделены либо путем хроматографии на хиральных фазах, либо путем расщепления рацемата на оба энантиомера.
Предпочтительны соединения формулы (I), в которых:
W означает R1-A-B-D-C(R16); R1-A-B-D-C(R16)=С;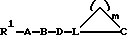
или
причем циклические системы
могут содержать 1 или 2 гетероатома из ряда N, O, могут быть насыщенными или однократно ненасыщенными и могут быть замещены 1 или 2 заместителями из R16;
Y означает С=O, C=S или -СН2-;
Z означает N(R0), O или -СН2-;
А означает прямую связь, (С1-С6)-алкандиил, -NR2-N=CR2-, -NR2-C(O)-NR2-, -NR2-C(O)O-, -NR2-C(O)S-, -NR2-C(S)-NR2-, -NR2-C(S)-O-, -NR2-C(S)-S-, -NR2-S(O)n-NR2-, -NR2-S(O)n-O-, -NR2-S(O)n-, (С3-С8)-циклоалкандиил,  -NR2-C(O)-, -C(O)-NR2-, -(С5-С12)-арилен-С(O)-NR2-, -О-, -S(O)n-, -(С5-С12)-арилен-, -СО-, -(С5-С12)-арилен-СО-, -NR2-, -SO2-NR2, -С(O)-O-, -О-С(О)-, -N= CR2-, - R2C=N-, -CR2=CR3-, -(С5-С12)-арилен-S(O)n-, которые, каждый, могут быть замещены с помощью NR2 и/или одно- или двукратно с помощью (С1-С8)-алкандиила;
-NR2-C(O)-, -C(O)-NR2-, -(С5-С12)-арилен-С(O)-NR2-, -О-, -S(O)n-, -(С5-С12)-арилен-, -СО-, -(С5-С12)-арилен-СО-, -NR2-, -SO2-NR2, -С(O)-O-, -О-С(О)-, -N= CR2-, - R2C=N-, -CR2=CR3-, -(С5-С12)-арилен-S(O)n-, которые, каждый, могут быть замещены с помощью NR2 и/или одно- или двукратно с помощью (С1-С8)-алкандиила;
В означает прямую связь, (С1-С6)-алкандиил, (С5-С8)-арилен, (С3-С8)-циклоалкандиил, 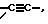 -NR2-, -C(O)-, -NR2-С(O)-, -C(O)-NR2-, -NR2-C(O)-NR2-, -S(O)-, -S(O)2-, -S(O)-NR2-, -S(O)2-NR2-, -NR2-S(O)-, -NR2-S(O)2-, -O-, -CR2=CR3-, которые, каждый, могут быть замещены одно- или двукратно с помощью (С1-С6)-алкандиила;
-NR2-, -C(O)-, -NR2-С(O)-, -C(O)-NR2-, -NR2-C(O)-NR2-, -S(O)-, -S(O)2-, -S(O)-NR2-, -S(O)2-NR2-, -NR2-S(O)-, -NR2-S(O)2-, -O-, -CR2=CR3-, которые, каждый, могут быть замещены одно- или двукратно с помощью (С1-С6)-алкандиила;
D означает прямую связь, (С1-С8)-алкандиил, (C5-C8)-apилен, -О-, -NR2-, -CO-NR2-, -NR2-CO-, -NR2-C(O)-NR2-, -NR2-C(S)-NR2-, -ОС(O)-, -С(O)O-, -СО-, -CS-, -S(O)-, -S(O)2-, -S(O)2-NR2-, -NR2-S(O)-, -NR2-S(O)2-, -S-, -CR2=CR3-,  -NR2-N=CR2-, -N=CR2-, -R2C=N-, которые, каждый, могут быть одно- или двукратно замещены с помощью (С1-С6)-алкандиила, -CR2=CR3- или (С5-С6)-арилена;
-NR2-N=CR2-, -N=CR2-, -R2C=N-, которые, каждый, могут быть одно- или двукратно замещены с помощью (С1-С6)-алкандиила, -CR2=CR3- или (С5-С6)-арилена;
Е означает прямую связь, (С1-С4)-алкандиил, (С2-С4)-алкендиил, (С2-С4)-алкиндиил,фенилен,фенилен-(С1-С2)-ал-кандиил,(С1-С2)-алкандиил-фенилен;
F имеет указанное для D значение;
G означает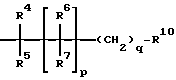
L означает C(R16) или N;
R0 означает водород, (С1-С6)-алкил, (С3-С8)-циклоалкил, (С3-С8)-циклоалкил-(С1-С6)-алкил; (С5-С12)-арил, (C5-С12)-арил-(С1-С6)-алкил, (С1-С8)-алкил-С(O), (С3-С8)-циклоалкил-С(О), (С3-С8)-циклоалкил-(С1-С4)-алкил-С(O), (С5-С12)-арил-С(O), (С5-С12)-арил-(С1-С4)-алкил-С(O), причем алкильные остатки могут быть одно- или многократно замещены фтором;
R1 означает R2-C(= NR2)NR3-, R2R3N-C(= NR2)-, R2R3N-C-(=NR2)-NR2 или 4-10-членную моно- или полициклическую, ароматическую или неароматическую циклическую систему, которая возможно может содержать 1-4 гетероатома из ряда N, О и S и в случае необходимости может быть одно- или многократно замещена заместителями из ряда R12, R13, R14 и R15;
R2, R3, независимо друг от друга, означают водород, (С1-С8)-алкил, который возможно замещен одно- или многократно фтором, (С3-С8)-циклоалкил, (С3-С8)-циклоалкил-(С1-С6)-алкил, (С5-С12)-арил, (С5-С12)-арил-(С1-С6)-алкил, H2N, R8ОNR9, R8ОR9, R8ОC(O)R9, R8-(C5-C12)-арил-R9, R8R8NR9, HO-(Cl-C8)-aлкил-NR8R9, R8R8NC(O)R9, R8C(O)NR8R9,
R8-C(O)R9, R8R8N-C(NR8)-, R8R8N-C(= NR8)-NR8- или (C1-С10)-алкилкарбонилокси-(С1-С4)-алкоксикарбонил;
R4, R5, R6, R7, независимо друг от друга, означают водород, фтор, ОН, (С1-С8)-алкил, (С5-С12)-циклоалкил, (C5-C12)-циклоалкил-(С1-С8)-алкил, или R8OR9, R8SR9, R8CO2R9, R8OC(O)R9, R8-(C5-Cl2)-apил-R9, R8N(R2)R9, R8R8NR9, R8N(R2)C(O)OR9, R8S(O)nN(R2)R9, R8OC(O)N(R2)R9, R8C(O)N(R2)R9,
R8N(R2)C(O)N(R2)R9, R8N(R2)S(O)nN(R2)R9, R8S(O)nR9, R8SC(O)N(R2)R9,
R8C(O)R9, R8N(R2)C(O)R9, R8N(R2)S(O)nR9;
R8 означает водород, (С1-С6)-алкил, (С5-С12)-циклоалкил, (С5-С12)-циклоалкил-(С1-С6)-алкил, (С5-С12)-арил, (C5-С12)-арил-(С1-С6)-алкил, причем алкильные остатки могут быть одно- или многократно замещены фтором;
R9 означает прямую связь или (С1-С6)-алкандиил;
R10 означает C(О)R11, C(S)R11, S(О)nR11, P(О)nR11 или 4-8-членный, насыщенный или ненасыщенный гетероцикл, который содержит 1, 2, 3 или 4 гетероатома из ряда N, О, S;
R11 означает ОН, (С1-С6)-алкоксил, (С5-С12)-арил-(С1-С6)-алкоксил, (С5-С12)-арилоксигруппу, (С1-С6)-алкилкарбонилокси-(С1-С4)-алкоксил, (С5-С12)-арил-(С1-С6)-алкилкарбонилокси-(С1-С6)-алкоксил, NH2, моно- или ди-(С1-С6-алкил)-аминогруппу, (С5-С12)-арил-(С1-С6)-алкиламиногруппу,
(С1-С6)-диалкиламинокарбонилметилоксигруппу;
R12, R13, R14, R15, независимо друг от друга, означают водород, (С1-С8)-алкил, который возможно одно- или многократно замещен фтором, (С3-С8)-циклоалкил, (С3-С8)-циклоалкил-(С1-С6)-алкил, (С5-С12)-арил, (С5-С12)-арил-(С1-С6 )-алкил, H2N, R8ОNR9, R8ОR9, R8ОC(О)R9, R8-(C5-C12)-арил-R9, R8R8NR9, HO-(Cl-C8)-aлкил-N-(R2)R9, R8N(R2)-C(O)R9, R8C(O)N(R2)R9,
R8C(O)R9, R2R3N-C(= NR2)-, R2R3N-C(=NR3)-NR2-, =O, =S; причем 2 соседних заместителя из R12-R15 вместе могут означать, далее, -ОСН2О-, -ОСН2-СН2О-, -ОС(СН3)2O-;
R16 означает Н, (С1-С8)-алкил, который может быть одно- или многократно замещен фтором, (С3-С8)-циклоалкил, (С3-С8)-циклоалкил-(С1-С6)-алкил, (С5-С12)-арил, (С5-С12)-арил-(С1-С6)-алкил, (С2-С8)-алкенил, (С2-С8)-алкинил;
m означает 3, 4, или 5;
n означает 1 или 2; и
р, q, независимо друг от друга, означают 0 или 1;
а также их физиологически приемлемые соли.
Особенно предпочтительны соединения формулы (I), в которой:
W означает R1-A-B-D-C(R16); R1-A-B-D-C(R16) = С или
Y означает С=O, C=S или -СН2-; предпочтительно С=O или C=S;
Z означает N(R0) или -СН2-; предпочтительно N(R0);
А означает прямую связь, (С1-С6)-алкандиил, -NR2-N=CR2-, -NR2-C(O)-NR2-, -NR2-C(O)O-, -NR2-C(O)S-, -NR2-S(O)n-NR2-, -NR2-S(O)n-, (С3-С6)-циклоалкандиил,  -NR2-C(O)-, -C(O)-NR2-, -(С5-С10)-арилен-С(O)-NR2-, -О-, (С5-С10)-арилен-, -СО-, (С5-С10)-арилен-СО-, -NR2-, -С(О)О-, -N= CR2-, -R2C=N-, -CR2=CR3-, которые могут быть, каждый, замещены с помощью NR2 и/или одно- или двукратно с помощью (С1-С6)-алкандиила;
-NR2-C(O)-, -C(O)-NR2-, -(С5-С10)-арилен-С(O)-NR2-, -О-, (С5-С10)-арилен-, -СО-, (С5-С10)-арилен-СО-, -NR2-, -С(О)О-, -N= CR2-, -R2C=N-, -CR2=CR3-, которые могут быть, каждый, замещены с помощью NR2 и/или одно- или двукратно с помощью (С1-С6)-алкандиила;
В означает прямую связь, (С1-С6)-алкандиил, (С5-С6)-арилен, (С5-С6)-циклоалкандиил, 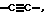 -NR2-C(O)-, -С(O)-NR2-, -NR2-S(O)2-, -O-, -CR2=CR3-, которые могут быть, каждый, одно- или двукратно замещены с помощью (С1-С6)-алкандиила;
-NR2-C(O)-, -С(O)-NR2-, -NR2-S(O)2-, -O-, -CR2=CR3-, которые могут быть, каждый, одно- или двукратно замещены с помощью (С1-С6)-алкандиила;
D означает прямую связь, (С1-С6)-алкандиил, (С5-С6)-арилен, -О-, -NR2-, -NR2-CO-, -NR2-C(O)-NR2-, -NR2-C(S)-NR2-, -OC(O)-, -C(O)-, -S(O)2-NR2-, -NR2-S(O)-, -NR2-S(O)2-, -N=CR2-, -R2C=N-, которые, каждый, могут быть одно- или двукратно замещены (С1-С6)-алкандиилом;
Е означает прямую связь, (С1-С4)-алкандиил, (С2-С4)-алкендиил;
F означает прямую связь, (С1-С6)-алкандиил, -О-, -CO-NR2-, -NR2-CO-, -NR2-C(O)-NR2-, -ОС(O)-, -СО-, -S(O)2-, -S(O)2-NR2-, -NR2-S(O)2-, -CR2=CR3-, 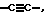 -N= CR2-, -R2C= N-, которые, каждый, могут быть одно- или двукратно замещены (С1-С6)-алкандиилом;
-N= CR2-, -R2C= N-, которые, каждый, могут быть одно- или двукратно замещены (С1-С6)-алкандиилом;
G означает
L означает C(R16) или N;
R0 означает водород, (С1-С6)-алкил, (С3-С6)-циклоалкил, (С3-С6)-циклоалкил-(С1-С4)-алкил, (С5-С10)-арилят, (C5-С10)-арил-(С1-С4)-алкил, (С1-С6)-алкил-С(O)-, (C5-C6)-циклоалкилметил-С(О)-, фенил-С(О)-, бензил-С(О)-, причем алкильные остатки могут быть замещены 1-6 атомами фтора;
R1 означает R2-C(=NR2)NR2-, R2R3N-C(=NR2)-,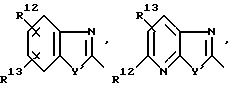
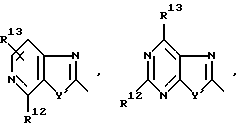

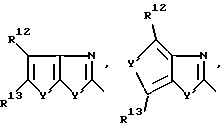






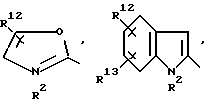

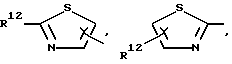



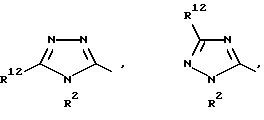


причем Y' означает NR2, O или S;
R2, R3, независимо друг от друга, означают водород, (С1-С6)-алкил, который возможно замещен одно- или многократно, предпочтительно одно-шестикратно, фтором, (С3-С6 )-циклоалкил, (С3-С6)-циклоалкил-(С1-С4)-алкил, (C5-C10)-арил, (С5-С10)-арил-(С1-С6)-алкил, H2N, R8ОR9, R8-(C5-С10)-арил-R9,
R8NHR9, R8R8NR9, R8NHC(O)R9, H2N-C(=NH)-, H2N-C(=NH)-NH-;
R4, R5, R6, R7, независимо друг от друга, означают водород, фтор, ОН, (С1-С6)-алкил, (С6-С12)-циклоалкил, (C6-C12)-циклоалкил-(С1-С6)-алкил, или R8ОR9, R8СО2R9, R8ОC(О)R9, R8-(C5-C10)-apил-R9, R8NHR9, R8R8NR9, R8NHC(O)OR9, R8S-(O)nNHR9, R8OC(O)NHR9, R8C(O)NHR9, R8C(O)R9, R8NHC(O)N-HR9,
R8NHS(O)n-NHR9, R8NHC(O)R9, R8NHS(O)nR9;
R8 означает водород, (С1-С6)-алкил, (С6-С12)-циклоалкил, (С6-С12)-циклоалкил-(С1-С4)-алкил, (С5-С10)-арил, (C5-С10)-арил-(С1-С4)-алкил, причем алкильные остатки могут быть замещены 1-6 атомами фтора;
R9 означает прямую связь или (С1-С6)-алкандиил;
R10 означает C(О)R11, S(О)nR11, P(О)nR11;
R11 означает ОН, (С1-С6)-алкокcил, (С5-С10)-арил -(С1-С6)-алкоксил, (С5-С10)-арилоксигруппу, (С1-С6)-алкилкарбонилокси-(С1-С4)-алкоксил, (С5-С10)-арил-(С1-С4)-алкилкарбонилокси-(С1-С4)-алкоксил, NН2, моно- или ди-(С1-С6-алкил)- аминогруппу;
R12, R13, R14, означают водород, (С1-С6)-алкил, который возможно замещен одно- или многократно фтором, (С3-С6)-циклоалкил, (С3-С6)-циклоалкил-(С1-С4)-алкил, (С5-С10)-арил, (С5-С10)-арил-(С1-С6)-алкил, H2N, R8ОR9, R8ОC(O)R9, R8-(C5-C10)-apил-R9, R8R8NR9, R8NHC(O)R9, R8C(O)NHR9, H2N-C(= NH)-, H2N-C(=NH)-NH-, =O; причем 2 соседних заместителя из R12-R14 вместе, далее, могут означать -ОСН2О-, -OCH2CH2O-;
R16 означает водород, (С1-С6)-алкил, который может быть 1-6-кратно замещен фтором, (С3-С6)-циклоалкил, (С3-С6)-циклоалкил-(С1-С4)-алкил, фенил,
фенил-(С1-С4)-алкил, (С2-С6)-алкенил;
m означает 3, 4, или 5;
n означает 1 или 2; и
р, q, независимо друг от друга, означают 0 или 1;
а также их физиологически приемлемые соли.
Совершенно особенно предпочтительны соединения формулы (I), в которой:
W означает R1-А-В-D-С(R16); R1-А-В-D-СН=С;
Y означает С=O, C=S;
Z означает N(R0);
А означает прямую связь, (С1-С4)-алкандиил, -NR2-N=CR2-, -NR2-C(O)-NR2-, -NR2-C(O)O-, -NR2-S(O)n-, -NR2-S(O)n-NR2-, -NR2-C(O)-, -NR2-, -N=CR2-, которые, каждый, могут быть замещены NH и/или однократно или двукратно (С1-С4)-алкандиила;
В означает прямую связь, (С1-С4) -алкандиил, фенилен, двухвалентный остаток пиридина, тиофена или фурана; циклогександиил, -C≡C- -C(O)-NR2-, -NR2-C(O)-, которые, каждый, могут быть одно- или двукратно замещены (С1-С4)-алкандиилом;
D означает прямую связь, (С1-С4)-адкандиил, фенилен, -О-, -NR2-, -NR2-CO-, -NR2-C(O)-NR2-, -R2N-S(O)2-NR2-, -NR2-S(O)2-, -NR2-S(O)-, -N= CR2-, -R2C= N-, которые, каждый, могут быть одно- или двукратно замещены (С1-С4)-алкандиилом;
E означает прямую связь или (С1-С4)-алкандиил;
F означает прямую связь, (С1-С6)-алкандиил, -О-, -CO-NR2-, -NR2-CO-, -NR2-C(O)-NR2-, -S(O)2-NR2-, -NR2-S(O)2-, -CR2=CR3-, -C≡C-, -N=CR2- или -R2C= N-, которые, каждый, могут быть одно- или двукратно замещены (С1-С4)-алкандиилом;
G означает 
R0 означает водород, (С1-С6)-алкил, трифторметил, пентафторэтил, (С5-С6)-циклоалкил, (С5-С6)-циклоалкил-(С1-С2)-алкил, возможно замещенный фенил или возможно замещенный в фенильном остатке бензил;
R1 означает R2R3N-C(=NR2),


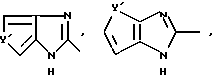
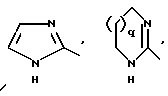

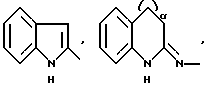
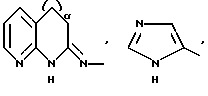


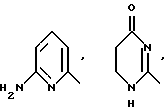

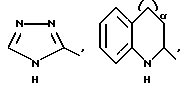
причем Y' означает NH, O или S;
R2, R3, независимо друг от друга, означают водород, (С1-С6)-алкил, трифторметил, пентафторэтил, (С5-С6)-циклоалкил, (С5-С6)-циклоалкил-(С1-С2)-алкил, фенил, бензил, H2N, R8ОR9, R8-(C5-C10)-арил R9, R8NHR9, R8R8NR9, R8NHC(O)R9, H2N-C(=NH), H2N-C(=NH)-NH-;
R4, R5, R6, R7, независимо друг от друга, означают водород, фтор, гидроксил, (С1-С6)-алкил, (С10-C12)-циклоалкил, (С10-С12)-циклоалкил-(С1-С6)-алкил, или R8ОR9, R8-(С5-С10)-арилR9, R8R8NR9, R8NHC(O)OR9,
R8S(O)nNHR9, R8OC(O)-NHR9, R8C(O)NHR9;
R8 означает водород, (С1-С6)-алкил, (С10-С12)-циклоалкил, (С10-С12)-циклоалкил-(С1-С2)-алкил, (С5-С10)-арил, (C5-С10)-арил-(С1-С2)-алкил;
R9 означает прямую связь или (С1-С6)-алкандиил;
R10 означает C(O)R11;
R11 означает гидроксил, (С1-С6)-алкоксил, феноксигруппу, бензилоксигруппу, (С1-С4)-алкилкарбонилокси-(С1-С4)-алкоксил, NH2, моно- или ди-(С1-С6-алкил)-аминогруппу;
R16 означает водород, (С1-С4)-алкил, трифторметил, пентафторэтил, (С5-С6)-циклоалкил, (С5-С6)-циклоалкил-(С1-С2)-алкил, фенил, бензил;
n означает 1 или 2; и
р, q, независимо друг от друга, означают 0 или 1;
а также их физиологически приемлемые соли.
Далее предпочтительны другие соединения формулы (I), где R0 означает водород, а также их физиологически приемлемые соли.
Используемые в тексте сокращения:
Воc = трет-бутоксикарбонил
DCCI = дициклогексилкарбодиимид
ДМФ = диметилформамид
HOOBt = 3-гидрокси-4-оксо-3,4-дигидро-1,2,3-бензотриазин
ТГФ = тетрагидрофуран
HOBt = 1-гидрокси-бензотриазол
TOTU = O-[циан(этоксикарбонил)метиленамино] -1,1,3,3-тетра- метил-уроний-тетрафторборат
DIPEA = диизопропилэтиламин
КТ = комнатная температура
Z = бензилоксикарбонил
Соединения формулы (I) можно получать, в общем, например, путем конвергентного синтеза, за счет связывания двух или более фрагментов, которые можно ретросинтетически вывести из общей формулы (I). При получении соединений формулы (I), в общем, для осуществления синтеза может оказаться необходимым временное блокирование функциональных групп, которые в соответствующей стадии синтеза могут приводить к нежелательным реакциям или побочным реакциям, за счет соответствующей проблеме синтеза стратегии в отношении защитных групп, что известно специалисту. Способ связывания фрагментов не ограничивается нижеприведенными примерами, а вообще применим для синтеза соединений формулы (I).
Например, соединения формулы (I) типа:
где F означает C(O)NR2, можно получать путем конденсации соединения формулы (II)
Причем М означает гидроксикарбонил, (С1-С6)-алкоксикарбонил, активированные производные карбоновых кислот, как хлорангидриды, активированные сложные эфиры или смешанные ангидриды, с HNR2 - G.
Для конденсации двух фрагментов при образовании амидной связи предпочтительно используют сами по себе известные в химии пептидов методы сочетания (см., например, Губен-Вейль, Методы органической химии, том 15/1 и 15/2 изд. Georg Thieme, Штутгарт, 1974). Для этой цели, как правило, необходимо, чтобы имеющиеся, не реагирующие аминогруппы во время конденсации были защищены защитными группами, которые затем снова удаляют. То же самое имеет значение для не участвующих в реакции карбоксильных групп, которые предпочтительно используют в виде (С1-С6)-алкиловых, бензиловых или трет-бутиловых сложных эфиров. Защита аминогрупп является излишней, когда генерируемые аминогруппы находятся еще в виде нитрогрупп или цианогрупп и образуются лишь после сочетания путем гидрирования. После сочетания имеющиеся защитные группы пригодным образом отщепляют. Например, нитрогруппы (защита гуанидиногрупп), бензилоксикарбонильные группы и сложноэфирные бензильные группы можно удалять путем гидрирования. Защитные группы трет-бутильного типа отщепляют в кислых условиях, в то время как 9-флуоренилметилоксикарбольный остаток удаляют с помощью вторичных аминов.
Соединения формулы (I), в которых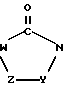
представляет собой диоксо- или тиоксо-оксо-замещенное имидазолидиновое кольцо, в котором W означает R1-A-B-D-C(R16), можно получать, например, путем введения во взаимодействие α-аминокислот или N-замещенных α-аминокислот или предпочтительно их эфиров, например метилового, этилового, трет-бутилового или бензилового эфира, например соединения общей формулы (III)
с изоцианатом или изотиоцианатом, например, общей формулы
U-E-F-G,
где U означает изоцианатную, изотиоцианатную группу или трихлорметилкарбониламиногруппу, причем получают производные мочевины или тиомочевины общей формулы (IV)
в которой V означает кислород или серу, которые путем нагревания с кислотой при омылении сложноэфирной функции циклизируют до соединений формулы (I) типа
Другим способом получения соединений общей формулы (I), в которой Y означает С= O или C= S и W означает R1-А-В-D-С(R16), является, например, взаимодействие соединений формулы (V)
с фосгеном, тиофосгеном или соответствующими эквивалентами (аналогично S. Goldshmidt и М. Wick, Liebigs Ann. Chem., 575, 217-231 (1952); и С. Тrорр, Chem. Ber., 61, 1431-1439 (1928)).
Соединения формулы (I), в которых
означает гетероцикл типа
в которой Y означает С=O или C=S и W означает R1-A-B-D-C(R16)=C, получают, например, согласно схеме 1 (см. в конце описания).
Превращение соединений формулы (VI) в соединения формулы (VII) и соединений формулы (VII) в соединения формулы (VIII) можно осуществлять, например, аналогично S. Chunggi и др., Tetrahedron Lett. 28 (33), 3827 (1987); или U. Schmidt и др., Angew. Chem., 53 (1984).
Другая возможность получения соединений формулы (VIII) состоит, например, в том, что сначала соединения формулы (VII) под воздействием кислоты циклизуют до соединений формулы (XII)
и затем соединения формулы (XII) по реакции Хорнера-Эммонса с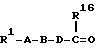
превращают в соединения формулы (VIII).
Соединения формулы (I), в которых
представляет собой гетероцикл типа
где W означает  можно получить, например, согласно схеме 2 (см. в конце описания).
можно получить, например, согласно схеме 2 (см. в конце описания).
Превращение соединений формулы (IX) в соединения формулы (X) можно осуществлять, например, аналогично Е. Marinez и др., Helv. Chim. Acta, 66 (1), 338 (1983); или E. W. Logusch и др., J. Org. Chem., 53 (17), 4069 (1988).
Соединения формулы (I), в которых
означает гетероцикл типа
где Y означает С= O или C=S и W означает  можно получать, например, согласно схеме 3 (см. в конце описания).
можно получать, например, согласно схеме 3 (см. в конце описания).
Следующая возможность получения соединений формулы (XIII) заключается, например, в том, что соединения формулы (VII) под влиянием кислоты циклизуют в соединения формулы (XII) и затем соединения формулы (XII) по реакции Хорнера-Эммонса с  превращают в соединения формулы (XIII).
превращают в соединения формулы (XIII).
В процессе конвергентного синтеза, однако, может оказаться предпочтительным, в зависимости от значения индивидуальных заместителей R1, А, В, D и т. д. , сначала получать гетероциклическую систему, которая содержит только часть заместителей, и затем вводить остальные заместители, например, путем связывания фрагментов. В качестве примера следует упомянуть синтез примера 1 (см. схему 4 в конце описания).
Этот общий принцип, однако, не ограничивается принципом осуществления примера, а является применимым вообще. Соединения формулы (I), в которых R1-А означает
или циклические гуанилгидразоны типа
получают, например, путем конденсации
соответственно
с кетонами или альдегидами типа O=C(R2) или соответствующими ацеталями или кеталями согласно известным из литературы способам, например аналогично N. Desideri и др. , Arch. Pharm. 325, 773-777 (1992); или A. Alves и др., Eur. J. Med. Chem. Chim. Ther., 21, 297-304 (1996).
Вышеуказанные гуанидгидразоны могут в случае необходимости образовываться в виде смесей изомеров E/Z, которые можно разделять согласно известным хроматографическим способам.
Соединения формулы (I), в которых R1-A означает R2-C(=NR2)NR2-N=C(R2)- или содержащую моно- или полицикл систему типа
можно получать аналогичным образом.
Соединения формулы (I), где R10 означает SO2R11, получают, например, тем, что соединение формулы (I), где R10 означает SH, согласно известным из литературы способам (см. Губен-Вейль, Методы органической химии, том 12/2, изд. Georg Thieme, Штутгарт, 1985, с. 1058 и последующие) окисляют до соединений формулы (I), где R10 означает SO3H, из которых затем, непосредственно или через соответствующие галоидангидриды сульфокислот, путем этерификации до сложных эфиров или связывания амидной связи получают соединения формулы (I), где R10 означает SO2R11 (R11 не означает гидроксил). Чувствительные к окислению группы в молекуле, как например амино-, амидино- или гуанидиногруппы, если необходимо, перед осуществлением окисления защищают пригодными защитными группами.
Соединения формулы (I), где R10 означает S(O)R11, получают, например, тем, что соединения формулы (I), где R10 означает SH, переводят в соответствующий сульфид (R10 означает S-) и затем окисляют мета-хлорнадбензойной кислотой до сульфиновых кислот (R10 означает SO2H) (см. Губен-Вейдь, Методы органической химии, том Е 11/1, изд. Georg Thieme, Штутгарт, 1985, с. 618 и последующие), из которых согласно известным из литературы способам получают соответствующие эфиры сульфиновых кислот или амиды сульфиновых кислот, где R10 означает S(O)R11 (причем R11 не означает гидроксил). Вообще можно также применять другие известные из литературы способы для получения соединений формулы (I), где R10 означает S(O)nR11 (где n = 1, 2) (см. Губен-Вейль, Методы органической химии, том Е 11/1, изд. Georg Thieme, Штутгарт, 1985, с. 618 и последующие, или том Е 11/2, Штутгарт, 1985, с. 1055 и последующие).
Соединения формулы (I), где R10 означает P(O)Rn 11 (n = 1, 2), получают известными из литературы способами (см. Губен-Вейль, Методы органической химии, том Е 1 и том Е 2, изд. Georg Thieme, Штутгарт, 1982) из пригодных предшественников, причем выбранный способ синтеза должен быть соответствующим для целевой молекулы.
Соединения формулы (I), где R10 означает C(S)R11, можно получать известными из литературы способами (см. Губен-Вейль, Методы органической химии, том Е 5/1 и том Е 5/2, изд. Georg Thieme, Штутгарт, 1985).
Соединения формулы (I), где R10 означает S(O)nR11 (n = 1, 2), P(O)Rn 11 (n = 1, 2) или C(S)R11, естественно, можно получать также путем связывания фрагментов, как описано выше, что, например, целесообразно, когда в группе E-F-G формулы (I) содержатся, например, аминосульфоновая кислота (продажная), аминосульфиновая кислота, аминофосфоновая кислота или аминофосфиновая кислота или получаемые из них производные, как эфиры или амиды.
Соединения формулы (I), в которых R1-A означает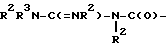
или циклические ацилгуанидины типа
можно получать, например, тем, что соединение формулы (I), в которой W означает Q(O)C-B-D-C(R16)- или Q(O)C-B-D-C(R16)=C или  или
или  и Q означает легко нуклеофильно замещаемую, удаляемую группу, вводят во взаимодействие с соответствующим гуанидином (производным гуанидина) типа
и Q означает легко нуклеофильно замещаемую, удаляемую группу, вводят во взаимодействие с соответствующим гуанидином (производным гуанидина) типа
или циклическим гуанидином (производным гуанидина):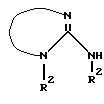
Вышеуказанные активированные производные кислот типа Q(O)C, где Q означает алкоксильную группу, предпочтительно метоксигруппу, феноксигруппу, фенилтиогруппу, метилтиогруппу, 2-пиридилтиогруппу, азотсодержащий гетероцикл, предпочтительно 1-имидазолил, получают предпочтительно само по себе известным образом из соответствующих хлорангидридов карбоновых кислот (Q означает С1), которые со своей стороны само по себе известным образом можно получать из соответствующих карбоновых кислот (Q означает ОН), например, с помощью тионилхлорида.
Наряду с хлорангидридами карбоновых кислот (Q означает С1) также само по себе известным образом непосредственно из соответствующих карбоновых кислот (Q означает ОН) можно получать другие активированные производные кислот типа Q(O)C, как например метиловые эфиры (Q означает ОСН3) - путем обработки газообразным хлороводородом в метаноле; имидазолиды (Q означает 1-имидазолил) - путем обработки карбонилдиимидазолом (см. Staab, Angew. Chem. Int. Ed. Engl. , 1, 351-367 (1962)); смешанные ангидриды (Q означает C2H5OC(O)O, соответственно, TosO) - с помощью Cl-COOC2H5, соответственно, тозилхлорида в присутствии триэтиламина в инертном растворителе. Активирование карбоновых кислот можно осуществлять также с помощью дициклогексилкарбодиимида (ДЦКИ) или с помощью O-[(циано(этоксикарбонил)метилен)амино]-1,1,3,3-тетра-метилуронийтетрафторбората ("TOTU") [Weis и Krommer, Chemiker Zeitung, 98, 817 (1974)] и других, обычных в химии пептидов активирующих реагентов. Ряд пригодных способов получения активированных производных карбоновых кислот формулы (II) указан в виде данных, приводимых в литературном источнике: J. March, Advanced Organic Chemistry, 3-е издание (John Wiley and Sons, 1985), с. 350.
Взаимодействие активированного производного карбоновой кислоты типа Q(O)C с соответствующим гуанидином (производным гуанидина) осуществляют само по себе известным образом в протонном или апротонном полярном, однако инертном органическом растворителе. При этом при взаимодействии сложных метиловых эфиров (Q означает ОСН3) с соответствующими гуанидинами оказываются пригодными метанол, изопропанол или тетрагидрофуран при температуре от 20oС до температуры кипения этих растворителей. В случае большинства взаимодействий соединений типа Q(O)C с гуанидинами в несолевой форме предпочтительно работают в апротонных инертных растворителях, как тетрагидрофуран, диметоксиэтан, диоксан. Однако также при использовании основания (как, например, гидроксид натрия) можно использовать воду в качестве растворителя при взаимодействии Q(O)C с гуанидинами.
Когда Q означает хлор, то предпочтительно работают при добавке улавливателя кислоты, например, в виде избыточного гуанидина (производного гуанидина), для связывания галоген-водородной кислоты.
Соединения формулы (I), в которой R1-A означает
или содержащую моно- или полицикл систему типа
можно получать аналогичным образом.
Соединения формулы (I), в которых R1-A означает сульфонил- или сульфоксилгуанидин типа R2R3-N-C(=NR2)-NR2-S(O)n (где n означает 1, 2), соответственно
(где n означает 1, 2),
получают известными из литературы способами путем взаимодействия R2R3N-C(=NR3)NR2H, соответственно
с производными сульфиновой или сульфоновой кислот формулы (I), в которой W означает Q-S(O)n-B-D-C(R16)- или Q-S(O)n-B-D-C(R16)=C или
или
и где Q означает, например, хлор или аминогруппу, аналогично S. Birtwell и др., J. Chem. Soo. 491 (1946), или Губен-Вейль, Методы органической химии, том Е 4 изд. Georg Thieme, Штутгарт, 1983, с. 620 и последующие.
Соединения формулы (I), в которых R1-A означает R2-C(=NR2)-NR2-S(O)n (n означает 1, 2) или содержащую моно- или полицикл систему типа
(где n = 1, 2), можно получать аналогичным образом.
Соединения формулы (I), в которых А означает -NR2-C(O)-NR2-, -NR2-C(O)O-, -NR2-C(O)S- и R1 означает R2RЗN-C(=NR2), R2-C(=NR2) или 4-14-членную моно- или полициклическую, ароматическую или неароматическую систему, которая определена как описано на с. 9 и может быть замещена как там описано, получают, например, тем, что соединение формулы (I), в которой W означает Q-B-D-C(R16)-, или Q-B-D-C(R16)=C, или ,
,
или
и Q означает HNR2-, НО- или HS-, вводят во взаимодействие с пригодным производным угольной кислоты, предпочтительно с фосгеном, дифосгеном (трихлорметиловый эфир хлормуравьиной кислоты), трифосгеном (бис(трихлорметиловый эфир) угольной кислоты) этиловым эфиром хлормуравьиной кислоты, изобутиловым эфиром хлормуравьиной кислоты, бис(1-гидрокси-1-Н-бензотриазолил)карбонатом или N,N'-карбонилдиимидазолом, в инертном по отношению к используемым реагентам растворителе, предпочтительно в диметилформамиде, тетрагидрофуране или толуоле, при температуре от -20oС до температуры кипения растворителя, предпочтительно в пределах от 0oС до 60oС, сначала с получением замещенного производного угольной кислоты формулы (I), в которой W означает
или
или
или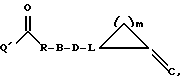
где R означает -NR2, -O- или -S- и Q', в зависимости от используемого производного угольной кислоты, означает хлор, этоксигруппу, изобутоксигруппу, бензатриазол-1-оксигруппу или 1-имидазолил.
Взаимодействие этих производных с R2R3N-C(=NR2)-NR2H или R2-C(=NR2)-NR2H или с содержащими моно- или полицикл системами типа
или
осуществляют как описано выше в случае получения ацилгуанидина (производных ацилгуанидина).
Соединения формулы (I), в которых F означает R2N-C(O)-NR2 или R2N-C(S)-NR2, получают, например, тем, что соединение типа
вводят во взаимодействие с изоцианатом OCN-G или изотиоционатом SCN-G согласно известным из литературы способам.
Соединения формулы (I), где F означает C(O)NR2, -SO2NR2- или -С(O)O-, можно получать, например, путем взаимодействия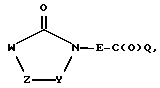
соответственно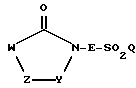
(где Q означает легко нуклеофильно замещенную, удаляемую группу, как например ОН, Сl, ОСН3 и т.д.), с HR2N-G, соответственно, HO-G, согласно известным из литературы способам. Соединения формулы (I), в которой R1-A означает моно- или полицикл типа
можно получать, например, тем, что соединение формулы (I), в которой W означает HR2N-B-D-C(R16)- или HR2N-B-D-C(R16)=C
или
или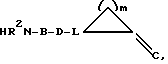
вводят во взаимодействие с моно- или полициклом типа
где X означает нуклеофильно замещенную, удаляемую группу, как например галоген или SH, SСН3, SO2CH3, SО2СН3, SО3Н или HN-NO2, согласно известным из литературы способам (см. Б например, A.F. Mokay и др., J. Med. Chem. 6, 587 (1963); M.N. Buchman и др., J. Am. Chem. Soc., 71, 766 (1949); F. Juny и др. , J. Med. Chem., 34, 1110 (1991); или G. Sorba и др., Eur. J. Med. Chem., 21, 391 (1986)).
Соединения формулы (I), в которых R1-А означает моно- или полицикл типа
можно получать, например, тем, что соединение формулы (I), в которой W означает HR2N-B-D-C(R16)- или HR2N-B-D-C(R16)=C
или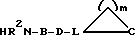
или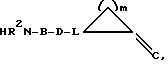
вводят во взаимодействие с соединением типа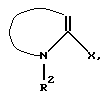
где X означает удаляемую группу, как например -SCH3, согласно известным из литературы способам (см. , например, Т. Hiroki и др., Sinthesis, 703 (1984); или М. Purkayastha и др., Indian J. Chem. Sect. В, 30, 646 (1991)).
Соединения формулы (I), в которых R1-A означает бис-аминотриазольный или бис-аминооксадиазольный остаток, можно получать, например, согласно P.J. Garrett и др. , Tetrahedron, 49, 165 (1993); или R. Lee Webb и др., J. Heterocyclic Chem. , 24, 275 (1987); согласно следующей последовательности реакций в соответствии со схемой 5 (см. в конце описания).
Известные из литературы способы получения приводятся, например, в J. March, Advanced Organic Chemistry, 3-е издание (John Willey and Sons, 1985).
Соединения общей формулы (I) и их физиологически приемлемые соли можно вводить животному, предпочтительно млекопитающему и в особенности человеку в качестве лекарственного средства индивидуально, в смесях друг с другом или в виде фармацевтических композиций, которые можно применять кишечно или парентерально и которые в качестве активной составной части содержат эффективную дозу по меньшей мере одного соединения общей формулы (I) или его соли, наряду с обычными фармацевтически применимыми носителями и добавками. Композиции обычно содержат примерно 0,5-90 мас.% терапевтически эффективного соединения.
Лекарственные средства можно вводить орально, например, в форме пилюль, таблеток, покрытых лаком таблеток, драже, гранулятов, твердых и мягких желатиновых капсул, растворов, сиропов, эмульсий, суспензий или аэрозольных смесей. Введение также можно осуществлять ректальным путем, например, в форме свечей или парентеральным путем, например, в виде растворов для инъекций или вливания, микрокапсул или палочек; чрезкожно, например, в виде мазей или настоек или через нос, например в виде спреев (аэрозолей) для носа.
Фармацевтические препараты получают само по себе известным образом, причем используют фармацевтически инертные неорганические или органические носители. Для получения пилюль, таблеток, драже и твердых желатиновых капсул можно применять, например, лактозу, кукурузный крахмал или его производные, тальк, стеариновую кислоту или ее соли и т.д. Носителями для мягких желатиновых капсул и свечей являются, например, жиры, воски, полутвердые и жидкие многоатомные спирты, природные или отвержденные масла и т.д. В качестве носителей для получения растворов и сиропов пригодны, например, вода, сахароза, инвертный сахар, глюкоза, многоатомные спирты и т.д. В качестве носителей для получения растворов для инъекций пригодны вода, спирты, глицерин, многоатомные спирты, растительные масла и т.д. В качестве носителей для микрокапсул, имплантантов или палочек пригодны сополимеры гликолевой кислоты с молочной кислотой.
Фармацевтические препараты, наряду с активными веществами и носителями, могут содержать еще добавки, как например наполнители, разбавители, профоры, связующие, придающие скользкость (таблеткам) вещества, смачиватели, стабилизаторы, эмульгаторы, консерванты, подслащивающие вещества, красители, вкусовые вещества или ароматизирующие вещества, сгустители, буферные вещества, далее, растворители или агенты растворения или средства для достижения пролонгирующего эффекта, а также соли для изменения осмотического давления, агенты для покрытия или атиоксиданты. Они могут также содержать два или более соединений общей формулы (I) или их физиологически приемлемых солей; далее, наряду по меньшей мере с одним соединением формулы (I) они могут содержать еще одно или несколько других, терапевтически эффективных веществ.
Доза может изменяться в широких пределах и в каждом отдельном случае ее нужно подбирать в соответствии с индивидуальными данными.
При оральном введении суточная доза может составлять 0,01-50 мг/кг, предпочтительно 0,1-5 мг/кг, предпочтительно 0,3-0,5 мг/кг массы тела для достижения эффективного результата; при внутривенном введении суточная доза составляет в общем примерно 0,01-100 мг/кг, предпочтительно 0,05-10 мг/кг массы тела. Суточная доза, в особенности при введении больших количеств, может быть разделена на несколько, например 2, 3 или 4, частичных доз на прием. В зависимости от индивидуального состояния может быть необходимо отклонение от указанной суточной дозы в сторону превышения ее или в сторону уменьшения ее.
ПРИМЕРЫ
Продукты характеризуют с помощью масс-спектров и/или ЯМР-спектров.
Пример 1
(2S)-Бензоилкарбониламино-3-[2-(4S)-(3-(4,5-дигидро-1Н-имидазол-2-ил-амино)-пропил)-2,5-диоксо-имидазолидин-1-ил)ацетиламино] пропионавая кислота (формула 1.8)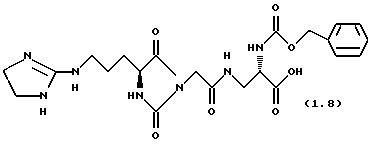
Синтез осуществляют согласно реакционной последовательности 1 (см. в конце описания).
1 а). Гидрохлорид метилового эфира (2S)-2-амино-5- бензилоксикарбониламинопентановой кислоты (формула 1.2)
При охлаждении льдом и в атмосфере аргона 240 мл тионилхлорида прикапывают к 300 мл абсолютного метанола и затем добавляют 40 г (150 ммоль) (2S)-2-амино-5- бензилоксикарбониламинопентановой кислоты (формула 1.1) и оставляют взаимодействовать в течение трех часов при комнатной температуре и в течение ночи при 4oС. Раствор выливают в метил-трет-бутиловый эфир, растворитель удаляют путем декантации и остаток растирают с диэтиловым эфиром. После отсасывания получают 29,14 г (61%) соединения формулы (1.2) в виде бесцветного твердого вещества.
1 б). Метиловый эфир 5-бензилоксикарбониламино-(2S)-(3-этоксикарбонилметилмочевино)-пентановой кислоты (формула 1.3)
При 0oС и при перемешивании к раствору 9,41 г (29,7 ммоль) соединения формулы (1.2) в 150 мл смеси дихлорметана с тетрагидрофураном в соотношении 2: 1 прикапывают 3,83 г (29,7 ммоль) этилизоцианатоацетата и затем 3 г (29,7 ммоль) триэтиламина. Спустя 30 минут выдерживания при 0oС баню со льдом удаляют и реакционную смесь продолжают перемешивать в течение полутора часов при комнатной температуре. После удаления растворителя в вакууме остаток хроматографируют на силикагеле при использовании этилацетата в качестве элюирующего средства. Содержащие продукт фракции концентрируют и остаток растирают с эфиром и отсасывают. Получают 11,02 г (83%) соединения формулы (1.3) в виде бесцветного твердого вещества.
1 в). Гидрохлорид [(4S)- (3-аминопропил) -2,5-диоксоимидазолин-1-ил]-уксусной кислоты (формула 1.4)
10,4 г (42,9 ммоль) соединения формулы (1.3) вместе со 100 мл 6 н. соляной кислоты в течение 45 минут кипятят с обратным холодильником. Раствор концентрируют, остаток смешивают с водой и подвергают сушке вымораживанием. Получают 7,1 г (66%) соединения формулы (1.4) в виде бесцветного твердого вещества.
1 г). Гидрохлорид [(4S)-(3-(4,5-дигидро-1Н-имидазол-2-ил-амино) -пропил) -2,5-диоксиимидазолидин-1-ил] -уксусной кислоты (формула 1.5)
400 мг (1,59 ммоль) соединения формулы (1.4) и 388 мг (1,59 ммоль) гидрохлорида 2-(метилмеркапто)-2-имидазолина растворяют в 5 мл воды. С помощью 1 н. раствора гидроксида натрия в смеси устанавливают рН-значение, равное 9, и в течение 2,5 часов нагревают при 60oС, причем рН-значение раствора поддерживают равным 9 путем добавления 1 н. раствора гидроксида натрия (общий расход 1 н. раствора гидроксида натрия составляет 3,4 мл). Реакционную смесь выдерживают в течение трех дней при комнатной температуре, устанавливают в ней рН 1 с помощью 1 н. соляной кислоты, растворитель удаляют в вакууме и остаток хроматографируют на силикагеле с помощью смеси метанола с водой в соотношении 9:1. Содержащие продукт фракции концентрируют и подвергают сушке вымораживанием. Получают 230 мг (45%) соединения формулы (1.5) в виде бесцветного порошка.
1 д). трет-Бутиловый эфир (2S)-3-амино-2-бензилоксикарбониламино-пропионовой кислоты (формула 1.6)
10 г (42 ммоль) (2S)-3-амино-2-бензилоксикарбонилами-нопропионовой кислоты в смеси из 100 мл диоксана, 100 мл изобутилена и 8 мл концентрированной серной кислоты в автоклаве встряхивают в течение трех дней при давлении N2, равном 20 атм. Избыточный изобутилен удаляют путем отдувки и к оставшемуся раствору добавляют 150 мл диэтилового эфира и 150 мл насыщенного раствора гидрокарбоната натрия. Фазы резделяют и водную фазу экстрагируют два раза по 100 мл диэтиловым эфиром. Объединенные органические фазы промывают два раза по 100 мл водой и сушат над сульфатом натрия. После удаления растворителя в вакууме получают 9,58 г (78%) соединения формулы (1.6) в виде бледно-желтого масла.
1 е). трет-Бутиловый эфир (2S)-бензоилоксикарбониламино-3-[2-((4S)-(3-(4,5-дигидро-1Н-имидазол-2-ил-амино)-пропил)-2,5-диоксо-имидазолидин-1-ил)-ацетиламино]-пропионовой кислоты (формула 1.7)
200 мг (0,7 ммоль) соединения формулы (1.5) и 114 мг (0,7 ммоль) HOOBt суспендируют в 5 мл диметилформамида и при 0oС смешивают со 154 г (0,7 ммоль) ДЦКИ. Перемешивают в течение 1 часа при 0oС и 1 час при комнатной температуре, после чего добавляют 206 мг (0,7 ммоль) соединения формулы (1.6), перемешивают в течение двух часов при комнатной температуре и выдерживают в течение ночи при комнатной температуре. Растворитель удаляют в вакууме и остаток хроматографируют на силикагеле с помощью смеси дихлорметана с метанолом, ледяной уксусной кислотой и водой в соотношении 8:2:0,2:0,2. После концентрирования и сушки вымораживанием получают 105 мг (27%) соединения формулы (1.7) в виде бесцветного твердого вещества.
1 ж). (2S)-Бензилоксикарбониламино- 3-[2-((4S)-(3-(4,5-дигидро-1Н-имидазол-2-ил-амино) -пропил)-2,5-диоксо-имидазолидин-1-ил)-ацетиламино] -пропионовая кислота (формула 1.8)
105 мг (0,188 ммоль) соединения формулы (1.7) растворяют в гомогенном растворе из 2 мл 90%-ной трифторуксусной кислоты и 0,2 мл 1,2-димеркаптоэтана и выдерживают в течение 1 часа при комнатной температуре. После концентрирования в вакууме остаток распределяют между диэтиловым эфиром и водой и водную фазу подвергают сушке вымораживанием. После хроматографии на СефадексеR LH 20 с помощью смеси воды с н-бутанолом и уксусной кислотой в соотношении 43:4,3:3,5 и последующей сушки вымораживанием получают 45 мг (48%) соединения формулы (1.8) в виде бесцветного твердого вещества.
Пример 2
3-[2-((4S)-(3-(5-Амино-2Н-[1,2,4] триазол-3-ил-амино-)-пропил)-2,5-диоксоимидазолидин-1-ил)-ацетиламино]-(2S)-бензилоксикарбониламино-пропионовая кислота (формула 2.5)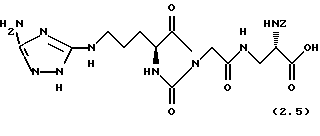
Синтез осуществляют согласно следующей реакционной последовательности 2 (см. в конце описания).
По поводу синтеза соединений формулы (1.4) и (1.6) см. пример 1.
2 а). [(4S)-(3-трет -Бутоксикарбониламинопропил)-2,5-диок-со-имидазолидин -1-ил]-уксусная кислота (формула 2.1)
6 г (23,84 ммоль) соединения формулы (1.4) растворяют в 350 мл смеси терагидрофурана с водой в соотношении 2:1. При 0oС с помощью 1 н. раствора гидроксида натрия устанавливают рН-значение, равное 10,5, добавляют 6,24 г (28,61 ммоль) ди-трет-бутилдикарбоната и поддерживают рН-значение раствора равным 9-10,5 путем добавления 1 н. раствора гидроксида натрия. Перемешивают в течение 1 часа при 0oС и выдерживают в течение ночи при 4oС. С помощью фосфатного буфера устанавливают рH 4 и растворитель удаляют в вакууме. Остаток растирают с метанолом, отфильтровывают и фильтрат концентрируют. После хроматографирования на силикагеле с помощью смеси дихлорметана с метанолом, ледяной уксусной кислотой и водой в соотношении 7:3:0,3:0,3 получают 5,65 г (75%) вязкого сиропа, представляющего собой соединение формулы (2.1).
2 б). трет-Бутиловый эфир (2S)-бензилоксикарбониламино-3-[2-((4S)-(3-трет -бутоксикарбониламинопропил)-2,5-диоксо-имидазолидин-1-ил)-ацетиламино] -пропионовой кислоты (формула 2.2)
2,8 г (8,9 ммоль) соединения формулы (2.1) и 1,45 г (8,9 ммоль) HOOBt растворяют в 50 мл диметилформамида и при 0oС смешивают с 1,95 г (8,9 ммоль) ДЦКИ. Спустя 1 час выдерживания при 0oС и 1 час при комнатной температуре добавляют 2,6 г (8,9 ммоль) соединения формулы (1.6), перемешивают два часа при комнатной температуре и реакционную смесь выдерживают в течение ночи при комнатной температуре. После отфильтровывания фильтрат концентрируют, остаток распределяют между водой и этилацетатом, органическую фазу сушат над сульфатом натрия, растворитель удаляют в вакууме и остаток хроматографируют на силикагеле с помощью смеси этилацетата с гептаном в соотношении от 9:1 до 6:4. Получают 2,98 г (57%) соединения формулы (2.2).
2 в). 3-[2-((4S)-(3-Аминопропил)-2,5-диоксо-имидазолидин-1-ил)-ацетиламино]-(2S)-бензилоксикарбониламино-пропионовая кислота (формула 2.3)
2,9 г (4,9 ммоль) соединения формулы (2.2) растворяют в смеси из 20 мл дихлорметана, 9,8 мл трифторуксусной кислоты и 2,35 мл триэтилсилана. После выдерживания в течение 3,5 часов при комнатной температуре смесь концентрируют и затем подвергают сушке вымораживанием. Остаток растирают в диэтиловом эфире, высушивают, кристаллизуют из небольшого количества метанола и растирают с эфиром. Получают 1,34 г (50%) соединения формулы (2.3) в виде бесцветного твердого вещества.
2 г). 3-[2-((4S)-4-(3-(Фенокси-N-циано-иминокарбониламино)-пропил)-2,5-диоксо-имидазолидин-1-ил)-ацетиламино] -(2S)-бензилоксикарбониламино-пропионовая кислота (формула 2.4)
400 мг (0,73 ммоль) соединения формулы (2.3) растворяют в 10 мл диметилформамида. Добавляют 0,14 мл триэтиламина и затем добавляют 190,7 мг (0,8 ммоль) дифенилового эфира цианкарбоминовой кислоты в 2 мл диметилформамида. После перемешивания в течение двух часов при комнатной температуре растворитель удаляют в вакууме, остаток растворяют в 50 мл 5%-ного раствора уксусной кислоты и подвергают сушке вымораживанием. После хроматографии на силикагеле с помощью метанола получают 260 мг (61%) соединения формулы (2.4).
2 д). 3-[2-((4S)-(3-(5-Амино-2Н-[1.2.4] триазол-3-ил-амино)-пропил)-2,5-диоксо- имидазолидин-1-ил)-ацетиламино]- (2S)-бензилоксикарбониламино-пропионовая кислота (формула 2.5)
260 мг (0,45 ммоль) соединения формулы (2.4) суспендируют в 10 мл изопропанола и смешивают с 62,4 мкл (0,45 ммоль) триэтиламина. Добавляют 28,5 мкл (0,585 ммоль) гидразина и в течение 10 часов кипятят с обратным холодильником. Выдерживают в течение ночи при комнатной температуре, осадок отсасывают и промывают бутанолом, тетрагидрофураном и эфиром. После хроматографировавия на СефадексеR LH 20 с помощью смеси воды с н-бутанолом и уксусной кислотой в соотношении 43: 4,3: 3,5 и последующей сушки вымораживанием получают 80 мг (34%) соединения формулы (2.5) в виде бесцветного твердого вещества.
Пример 3
(2S) -Бензилоксикарбониламино-3-[((4S)-(гуанидиноацил-амино-метил)-2,5-диоксо-имидазолидин-1-ил)-ацетиламино] -пропионовая кислота (формула 3.11)
Синтез осуществляют согласно реакционной последовательности 3 (см. в конце описания).
3 а). Дигидрохлорид метилового эфира (2S)-3-диамино-пропионовой кислоты (Формула (3.2)
При -15oС и в атмосфере аргона к 60 мл абсолютного метанола прикапывают 35 мл тионилхлорида и затем добавляют 25 г (240 ммоль) гидрохлорида (2S)-3-диаминопропионовой кислоты (формула 3.1) и дальнейшие 100 мл метанола. После перемешивания в течение 16 часов при комнатной температуре смесь кипятят с обратным холодильником в течение 4 часов. Раствор выливают в диизопропиловый эфир, растворитель удаляют декантацией и остаток хроматографируют на силикагеле с помощью метанола. Содержащие продукт фракции концентрируют и остаток растирают с диизопропиловым эфиром. После отсасывания осадка и высушивания над парафином получают 26,3 г (57%) соединения формулы (3.2) в виде бледно-желтого твердого вещества.
3 б). Гидрохлорид метилового эфира (2S)-амино-3-трет-бутоксикарбониламино-пропионовой кислоты (формула 3.3)
К суспензии 26 г (220 ммоль) соединения формулы (3.2) в 4,4 л дихлорметана при -78oС добавляют 75,8 мл триэтиламина и затем прикапывают раствор 26,78 г (123 ммоль) ди-трет-бутил-дикарбоната в 220 мл дихлорметана, оставляют нагреваться до 0oС и перемешивают в течение полутора часов при этой температуре. Реакционную смесь концентрируют и хроматографируют на силикагеле с помощью смеси этилацетата с метанолом в соотношении 20:1. Получают 15,67 г (58%) соединения формулы (3.3) в виде бледно-желтого сиропа.
3 в). Метиловый эфир (2S)-этилоксикарбонилметил-аминокарбониламино-3-трет -бутоксикарбониламино-пропионовой кислоты (формула 3.4)
К суспензии 10 г (45,8 ммоль) соединения формулы (3.3) в 100 мл тетрагидрофурана прикапывают 5,13 мл (45,8 ммоль) этилизоцианатоацетата, перемешивают в течение трех часов при комнатной температуре, растворитель удаляют в вакууме и остаток хроматографируют на силикагеле с помощью смеси этилацетата с метанолом в соотношении 20:1. Получают 13,44 г (85%) соединения формулы (3.4) в виде бледно-желтого масла.
3 г). Гидрохлорид 2-[(4S)-(аминометил)-2,5-диоксоимидазолидин]-уксусной кислоты (формула 3.5)
13,2 г (34 ммоль) соединения формулы (3.4) вместе со 150 мл 6 н. соляной кислоты кипятят с обратным холодильником в течение 45 минут. Раствор концентрируют и остаток подвергают сушке вымораживанием. После хроматографии на силикагеле с помощью смеси дихлорметана с метанолом в соотношении 7:3 и сушки вымораживанием содержащих продукт фракций получают 6,4 г (84%) соединения формулы (3,5) в виде бесцветного твердого вещества.
3 д). 2-[(4S)-(трет -Бутоксикарбониламинометил)-2,5-диоксоимидазолидин] -уксусная кислота (формула 3.6)
К раствору 4,4 г (19,7 ммоль) соединения формулы (3.5) в 300 мл смеси тетрагидрофурана с водой в соотношении 2:1 при температуре 0oС добавляют 1 н. раствор гидроксида натрия вплоть до достижения рН-значения, равного 10,5 (расход: 26 мл), затем добавляют 5,16 г (23,6 ммоль) ди-трет-бутилдикарбоната и поддерживают рН-значение, равное 9,5-10,5, путем добавления 1 н. раствора гидроксида натрия. После выдерживания в течение 1 часа при 0oС и 2 часов при комнатной температуре смесь оставляют стоять в течение ночи при 4oС, с помощью 1 н. соляной кислоты устанавливают рН-значение, равное 7, и затем с помощью фосфатного буфера устанавливают рН-значение, равное 4,1. Растворитель удаляют в вакууме, остаток растирают с метанолом, отфильтровывают, фильтрат концентрируют и остаток хроматографируют на силикагеле с помощью смеси дихлорметана с метанолом, уксусной кислотой и водой в соотношении 8: 2: 0,2: 0,2. Содержащие продукт фракции концентрируют и подвергают сушке вымораживанием. Выход соединения формулы (3.6) составляет 3,6 г (64%). Бесцветное твердое вещество.
3 е). Гидрохлорид метилового эфира 3-амино-(2S)-бензилокси-карбониламино-пропионовой кислоты (формула 3.7)
К 50 мл абсолютного метанола при температуре -15oС прикапывают 7,4 мл (100,8 ммоль) тионилхлорида. Добавляют 12 г (50,4 ммоль) гидрохлорида 3-aмино-(2S)-бeнзилоксикapбoниламино-пропионовой кислоты и затем 40 мл абсолютного метанола. После перемешивания в течение 45 минут при -15oС и 20 часов при комнатной температуре реакционную смесь выливают в диизопропиловый эфир, осадок отсасывают и высушивают в высоком вакууме. Получают 14,18 г (98%) соединения формулы (3.7) в виде бесцветного твердого вещества.
3 ж). Метиловый эфир (2S)-бензилоксикарбониламино-3-[(4S)-(трет -бутоксикарбониламино-метил)-2.5-диоксо-имидазолидин-1-ил)-ацетиламино]-пропионовой кислоты (формула 3.8)
К раствору 1,5 г (5,2 ммоль) соединения формулы (3.6) в 20 мл абсолютного диметилформамида при 0oС добавляют 848 мг (5,2 ммоль) HOOBt и затем 1,144 г (5,2 ммоль) ДЦКИ. После перемешивания в течение 1 часа при 0oС и 1 часа при комнатной температуре добавляют 1,5 г (5,2 ммоль) соединения формулы (3.7) и 0,67 мл N-этилморфолина и перемешивают 3 часа при комнатной температуре. Осадок отфильтровывают, фильтрат концентрируют, остаток обрабатывают этилацетатом и полученный раствор последовательно промывают насыщенным раствором гидрокарбоната натрия, раствором гидросульфата калия с сульфатом калия и водой и органическую фазу сушат над сульфатом натрия. После отфильтровывания и удаления растворителя в вакууме остаток хроматографируют на силикагеле с помощью смеси этилацетата с гептаном в соотношении 6: 4 с уменьшающейся долей гептана вплоть до чистого этилацетата и получают 1,75 г (65%) соединения формулы (3.8).
3 а). Соль трифторуксусной кислоты метилового эфира 3-[((4S)-(аминометил)-2,5 -диоксо-имидазолидин-1-ил)-ацетиламино] -(2S)-бензилоксикарбониламино-пропионовой кислоты (формула 3.9)
1,7 г (3,26 ммоль) соединения формулы (3.8) в 6,7 мл дихлорметана, 3,3 мл трифторуксусной кислоты и 0,78 мл триэтилсилана перемешивают 4 часа при комнатной температуре. Раствор выливают в диэтиловый эфир и осадок отфильтровывают. Получают 1,54 г (88%) соединения формулы (3.9) в виде бесцветного твердого вещества.
3 и). Метиловый эфир (2S)-бензилоксикарбониламино-3-[((4S)-(гуанидиноациламино-метил)-2,5-диоксо-имидазолидин-1-ил)-ацетиламино]-пропионовой кислоты (формула 3.10)
К раствору 500 мг (0,93 ммоль) соединения формулы (3.9) в 10 мл абсолютного диметилформамида добавляют 0,129 мл триэтиламина и затем при 0oС добавляют раствор 152 мг (0,93 ммоль) карбонилдиимидазола в 10 мл абсолютного диметилформамида. После перемешивания в течение 4 часов при комнатной температуре добавляют 89 мг (1,86 ммоль) гуанидина, перемешивают в течение 2 часов при комнатной температуре, растворитель удаляют в вакууме и остаток хроматографируют на силикагеле с помощью смеси дихлорметана с метанолом, уксусной кислотой и водой в соотношении 8,5:1,5:0,15:0,15. После концентрирования содержащих продукт фракций и сушки вымораживанием получают 300 мг (64%) соединения формулы (3.10) в виде бесцветного твердого вещества.
3 к). (2S)-Бензилоксикарбониламино-3-[((4S)-(гуанидиноацил- аминометил)-2,5-диоксо-имидазолидин-1 -ил)-ацетиламино] -пропионовая кислота (формула 3.11)
180 мг (0,32 ммоль) соединения формулы (3.10) растворяют в смеси из диоксана с водой и триэтиламином в соотношении 1:1:1. После выдерживания в течение 16 часов при комнатной температуре смесь концентрируют в ротационном испарителе, смешивают остаток с водой и подвергают сушке вымораживанием. Остаток хроматографируют на силикагеле с помощью смеси дихлорметана с метанолом, уксусной кислотой и водой в соотношении 8:2:0,2:0,2. Содержащие продукт фракции концентрируют в ротационном испарителе, смешивают с водой, подвергают сушке вымораживанием и затем остаток растирают с этилацетатом и диэтиловым эфиром. После отсасывания получают 62 мг (39%) соединения формулы (3.11) в виде бесцветного твердого вещества.
Масс-спектр (ионизация электронным распылением (+)): 493 (М+Н)+.
Пример 4
(2S)-Бензилоксикарбониламино-3-[((4S)- (3-(2-пиримидинил-амино)-пропил)-2,5-диоксо-имидазолидин-1-ил)-ацетиламино]-пропионовая кислота (формула 4.2)
Синтез осуществляют согласно реакционной последовательности 4 (см. в конце описания).
4 а). 2-[(4S)-(3-(2-Пиримидиламино) -пропил)-2,5-диоксоимидазолидин]-уксусная кислота (формула 4.1)
Cмесь из 1 г (4 ммоль) соединения формулы (1.4), 632 мг (4 ммоль) 2-бромпиридина и 2,04 мл (12 ммоль) диизопропилэтиламина (DIPEA) в 9 мл диметилформамида нагревают в течение 26 часов при 80oС. Растворитель удаляют в вакууме и остаток хроматографируют на силикагеле с помощью смеси дихлорметана с метанолом, уксусной кислотой и водой в соотношении 8:2:0,2:0,2. Содержащие продукт фракции концентрируют и получают 144 мг (12%) соединения формулы (4.1) в виде бесцветного твердого вещества.
4 б). трет-Бутиловый эфир (2S)-бензилоксикарбониламино-3-[((4S)-(3-(2-пиримидиламино)-пропил)-2,5-диоксо-имидазолидин-1-ил)-ацетиламино] -пропионовой кислоты (формула 4.2)
К раствору 128 мг (0,44 ммоль) соединения формулы (4.1), 128 мг (0,44 ммоль) соединения формулы (1.6), 60 мг (0,44 ммоль) HOBt и 0,035 мл N-этилформалина в 5 мл диметилформамида добавляют 97 мг (0,44 ммоль) ДЦКИ. После выдерживания в течение 1 часа при 0oС и 16 часов при комнатной температуре растворитель удаляют в вакууме и остаток хроматографируют на силикагеле с помощью смеси дихлорметана с метанолом, уксусной кислотой и водой в соотношении 9,5:0,5:0,05:0,05. Получают 180 мг (72%) соединения формулы (4.2).
4 в). (2S)-Бензилоксикарбониламино-3-[((4S)- (3-(2-пиримидиламино) -пропил)-2,5-диоксо-имидазолидин-1-ил)-ацетил-амино] -пропионовая кислота (формула 4.3)
170 мг (0,03 ммоль) соединения формулы (4.2) растворяют в смеси из 2 мл 90%-ной трифторуксусной кислоты и 0,2 мл 1,2-димеркаптоэтана. После выдерживания в течение 1 часа при комнатной температуре смесь вносят в диэтиловый эфир, осадок отделяют путем центрифугирования, еще раз суспендируют в диэтиловом эфире и снова центрифугируют. После растворения в воде и сушки вымораживанием, остаток хроматографируют на Сефадексе LH 20 с помощью смеси воды с бутанолом и уксусной кислотой в соотношении 43:4,3:3,5. После сушки вымораживанием получают 76 мг (49%) соединения формулы (4.3) в виде бесцветного твердого вещества.
Масс-спектр (ионизация электронным распылением (+)): 514 (М+Н)+.
Пример 5
(2S)-Бензилоксикарбониламино-3[((4S)- (3-(бензимидазолил-1-амино)-пропил)-2,5-диоксо-имидазолидин-1-ил)-ацетил-амино] -пропионовая кислота (формула 5.5)
Синтез осуществляют согласно реакционной последовательности 5 (см. в конце описания).
5 а). 2-[(4S)-(3-(3-(2-Нитрофенил)-тиомочевино)-пропил)-2.5-диоксо-имидазолидин-1-ил]-уксусная кислота (формула 5.1)
К раствору 4,5 г (17,88 ммоль) соединения формулы (1.4) в 100 мл диметилформамида при температуре 0oС добавляют 4,96 мл (35,76 ммоль) триэтиламина и затем 3,22 (17,88 ммоль) 2-нитрофенилизоцианата. После перемешивания в течение 4 часов при комнатной температуре растворитель удаляют в вакууме и остаток распределяют между дихлорметаном и 10%-ной уксусной кислотой. Водную фазу экстрагируют 2 раза дихлорметаном и органическую фазу сушат над сульфатом натрия. После отфильтровывания растворитель удаляют в вакууме и остаток хроматографируют на силикагеле. Содержащие продукт фракции концентрируют и получают 3,16 г (45%) соединения формулы (5.1).
5 б). 2-[(4S)-(3-(3-(2-Аминофенил) -тиомочевино)-пропил)-2,5-диоксо-имидазолидин-1-ил]-уксусная кислота (формула 5.2)
4,6 г (11,6 ммоль) соединения формулы (5.1) в 40 мл абсолютного этанола смешивают с 3,8 г 10%-ного палладия-на-угле. Добавляют 200 мл насыщенного аммиаком этанола и гидрируют в течение 6 часов при комнатной температуре. Катализатор отфильтровывают, фильтрат концентрируют и остаток (1,85 г) используют непосредственно для синтеза соединения формулы (5.4).
5 в). 2-[(4S)-(3-(Бензимидазолил- 2-амино)-пропил)-2,5-диоксо-имидазолидин-1-ил]-уксусная кислота (формула 5.3)
1,85 г соединения формулы (5.3) в 35 мл этанола вместе с 3 г оксида ртути и 730 мг серы кипятят с обратным холодильником в течение 16 часов. Отфильтровывают и остаток 5 раз выпаривают с водой. Объединенные водные фазы подвергают сушке вымораживанием. Получают 814 мг (21% в расчете на соединение формулы (5.1)) соединения формулы (5.3) в виде бесцветного твердого вещества.
5 г). трет-Бутиловый эфир (2S)-бензилоксикарбониламино-3-[(4S)-(3- (бензимидазолил-2-амино)-пропил) -2,5-диоксо-имидазолидин-1-ил)-ацетиламино] -пропионовой кислоты (формула 5.4)
Синтез соединения формулы (5.4) осуществляют путем введения во взаимодействие соединения формулы (5.3) с соединением формулы (1.6) как описано в примере 4 при получении соединения формулы (4.2) из соединений формул (4.1) и (1.6). Из 205 мг (0,56 ммоль) соединения формулы (5.3) получают, после хроматографии сырого продукта на силикагеле с помощью смеси дихлорметана с метанолом, уксусной кислотой и водой в соотношении 9:1:0,1:0,1 и 8:2:0,2:0,2 и последующей сушки вымораживанием содержащих продукт фракций, 255 мг (75%) соединения формулы (5.4) в виде бесцветного твердого вещества.
5 д). (2S)-Бензилоксикарбониламино-3-[((4S)- (3-(бензимидазолил-2-амино)-пропил) -2,5-диоксо-имидазолидин-1-ил)-ацетиламино]-пропионовая кислота (формула 5.5)
250 мг (0,41 ммоль) соединения формулы (5.4) в 3 мл 90%-ной трифторуксусной кислоты перемешивают в течение 1 часа при комнатной температуре. Трифторуксусную кислоту удаляют в вакууме, остаток смешивают с водой и подвергают сушке вымораживанием. Остаток хроматографируют на Сефадексе LH 20 с помощью смеси воды с бутанолом и уксусной кислотой в соотношении 43:4,3:3,5. После сушки вымораживанием получают 155 мг (66%) соединения формулы (5.5) в виде бесцветного твердого вещества.
Масс-спектр (ионизация электронным распылением (+): 552 (М+Н)+.
Пример 6
(2S) -Бензилоксикарбониламино-3-[((4S)- (3-(дис-3а,4,5,6, 7,7а-гексагидро-1Н-бензимидазол-2-ил-амино) -пропил)-2,5-диоксо-имидазолидин-1-ил) -ацетиламино]-пропионовая кислота (формула 6.4)
Синтез осуществляют согласно реакционной последовательности 6 (см. в конце описания).
6 а). Гидрохлорид [(4S)-(3-(цис-3а,4,5,6,7,7а- гексагидро-1Н-бензимидазол-2-ил-амино)-пропил) -2,5-диоксо-имидазолидин-1-ил] -уксусной кислоты (формула 6.2)
Раствор 298 мг (1 ммоль) соединения формулы (6.1) (получают согласно G. D. Hartmann и др., международная заявка на патент 95/32710, с. 115) и 251 мг (1 ммоль) соединения формулы (1.4) в 6 мл диметилформамида смешивают с 0,51 мл DIPEA
и 6 каплями воды и перемешивают 24 часа при 100oС. Растворитель удаляют в вакууме и остаток хроматографируют на силикагеле с помощью смеси дихлорметана с метанолом, уксусной кислотой и водой в соотношении 9:1:0,1:0,1 и затем объединенные, содержащие продукт фракции, хроматографируют на Сефадексе LH 20 с помощью смеси воды с бутанолом, уксусной кислотой в соотношении 43: 4,3: 3,5. Содержащие продукт фракции объединяют и подвергают сушке вымораживанием. После переведения в гидрохлорид получают 130 мг соединения формулы (6.2) в виде бесцветного твердого вещества.
6 б). Уксусная соль трет-бутилового эфира (2S)-бензил-оксикарбониламино-3 -[((45)-(3-(цис-3а, 4,5,6,7,7а -гексагидро-1Н-бензимидазол-2-ил-амино)-пропил)-2,5-диоксо-имидазолидин-1-ил)ацетиламино] -пропионовой кислоты (формула 6.3)
Синтез соединения формулы (6.3) осуществляют путем введения во взаимодействие соединения формулы (6.2) с соединением формулы (1.6), как описано в примере 4, при получении соединения формулы (4.2) из соединений формул (4.1) и (1.6). Из 130 мг (0,35 ммоль) соединения формулы (6.2) после хроматографии сырого продукта на силикагеле с помощью смеси дихлорметана с метанолом, уксусной кислотой и водой в соотношении 8:2:0,2:0,2 и затем в соотношении 9:1: 0,1: 0,1 и последующей сушки вымораживанием фракций, содержащих продукт, получают 45 мг (19%) соединения формулы (6.3) в виде бесцветного твердого вещества.
6 в). (2S)-Бензилоксикарбониламино-3-[((4S)-(3-цис-3а,4,5, 6,7,7а-гексагидро-1Н-бензимидазол-2-ил-амино)-пропил)-2,5-диоксо-имидазолидин-1-ил)-ацетиламино]-пропионовая кислота (формула 6.4)
40 мг (0,168 ммоль) соединения формулы (6.4) в 1 мл 90%-ной трифторуксусной кислоты перемешивают в течение 1 часа при комнатной температуре. После удаления трифторуксусной кислоты в вакууме и очистки сырого продукта с помощью препаративной высокоэффективной жидкостной хроматографии при использовании неподвижной фазы RP18 и последующей сушки вымораживанием содержащих продукт фракций получают 13 мг (14%) соединения формулы (6.4) в виде бесцветного твердого вещества.
Масс-спектр (ионизация электронным распылением (+)): 558 (М+Н)+.
Пример 7
(2S)-Бензилоксикарбониламино-3-[2- ((4S)-(N'-(4,5-дигидро-1Н-имидазол-2-ил) -гидразинокарбонилметил)-2,5-диоксо-имидазолидин-1-ил) -ацетиламино] -пропионовая кислота (формула 7.8)
Синтез осуществляют согласно реакционной последовательности 7 (см. в конце описания).
7 а). (4S)-Карбокси-метил-2,5-диоксо-имидазолидин (формула 7.1)
К суспензии 10 г (75 ммоль) L-аспарагиновой кислоты в воде при 80oС и при перемешивании добавляют 5,5 мл 11,7 н. раствора гидроксида натрия и 7,5 г (92,5 ммоль) цианата калия. В течение часа путем добавления порциями концентрированной соляной кислоты при температуре 85oС, смотря по обстоятельствам, устанавливают рН-значение, равное 7 (расход: 1,5 мл). Затем с помощью 5,5 мл концентрированной соляной кислоты в реакционной смеси устанавливают рН-значение, равное 3,5. Добавляют следующие 9,5 мл концентрированной соляной кислоты, перемешивают два часа при 85oС и реакционную смесь выдерживают при комнатной температуре в течение 18 часов. Осадок отсасывают, промывают небольшим количеством охлажденной льдом воды и сушат над P2O5. Получают 8,49 г (72%) соединения формулы (7.1) в виде бесцветного твердого вещества.
7 б). (4S)-Метоксикарбонил-метил- 2,5-диоксо-имидазолидин (формула 7.2)
При -15oС к 70 мл метанола добавляют 7,9 мл (107 ммоль) тионилхлорида, 8,47 г (53,5 ммоль) соединения формулы (7.1) и реакционную смесь перемешивают 24 часа при комнатной температуре. Затем раствор выливают в диэтиловый эфир, осадок отсасывают и промывают диэтиловым эфиром. После высушивания в высоком вакууме получают 5,12 г (56%) соединения формулы (7.2) в виде бесцветного твердого вещества. Концентрирование эфирной фазы и растирание остатка с диэтиловым эфиром дают после высушивания в высоком вакууме дальнейшие 2,79 г (30%) соединения формулы (7.2).
7 в). трет-Бутиловый эфир [(4S)-метоксикарбонил-метил) -2,5-диоксо-имидазолидин]-уксусной кислоты (формула 7.3)
В атмосфере аргона к суспензии 1,02 г (23,2 ммоль) гидрида натрия (55%-ный в масле) в 20 мл абсолютного диметилформамида, при охлаждении льдом, добавляют 4 г (23,2 ммоль) соединения формулы (7.2). По окончании выделения водорода добавляют 4,53 г (23,2 ммоль) трет-бутилового эфира бромуксусной кислоты. После перемешивания в течение 1 часа при 0oС, двух часов при комнатной температуре и выдерживания в течение ночи растворитель удаляют и остаток хроматографируют на силикагеле с помощью смеси дихлорметана с метанолом в соотношении 40:1. Содержащие продукт фракции концентрируют и остаток растирают с диэтиловым эфиром. Получают 4,21 г (63%) соединения формулы (7.3).
7 г). [(4S)-Метоксикарбонилметил)-2,5-диоксо-имидазолидин]-уксусная кислота (формула 7.4)
4,2 г (14,67 ммоль) соединения формулы (7.3) растворяют в 50 мл 90%-ной трифторуксусной кислоты. После перемешивания в течение 1 часа при комнатной температуре трифторуксусную кислоту удаляют в вакууме и остаток подвергают сушке вымораживанием. Получают 3,17 г (94%) соединения формулы (7.4).
7 д). трет-Бутиловый эфир (2S)-бензилоксикарбониламино -3-[((4S)-метоксикарбонилметил)-2,5-диоксо-имидазолидин-1-ил)-ацетиламино] -пропионовой кислоты (формула 7.5)
Синтез соединения формулы (7.5) осуществляют путем введения во взаимодействие соединения формулы (7.4) с соединением формулы (1.6), как описано в примере 4, при получении формулы (4.2) из соединений формул (4.1) и (1.6). Из 1 г (4,3 ммоль) соединения формулы (7.4) после хроматографии сырого продукта на силикагеле с помощью смеси дихлорметана с метанолом в соотношении 20: 1 и затем в соотношении 40:1, а также после концентрирования содержащих продукт фракций получают 1,72 г (79%) соединения формулы (7.5).
7 е). трет-Бутиловый эфир (2S)-бензилоксикарбониламино-3-[((4S)-карбоксиметил-2,5-диоксо-имидазолидин-1-ил)-ацетиламино] -пропионовой кислоты (формула 7.6)
Раствор 700 мг (1,38 ммоль) соединения формулы (7.5) в смеси воды с диоксаном и триэтиламином в соотношении 1:1:1 перемешивают в течение 6 часов при 50oС. После выдерживания в течение ночи при комнатной температуре реакционную смесь концентрируют и остаток хроматографируют на силикагеле с помощью смеси дихлорметана с метанолом, уксусной кислотой и водой в соотношении 9:1:0,1:0,1. После концентрирования содержащих продукт фракций получают 364 мг (54%) соединения формулы (7.6).
7 ж). трет-Бутиловый эфир (2S)-бензилоксикарбониламино-3-[2-((4S)-(N'-(4,5-дигидро -1Н-имидазол-2-ил)-гидразино-карбонилметил)-2,5-диоксо -имидазолидин-1-ил)-ацетиламино]-пропионовой кислоты (формула 7.7)
К раствору 100 мг (0,2 ммоль) соединения формулы (7.6) и 33,1 мг (0,2 ммоль) HOOBt в 5 мл диметилформамида при температуре 0oС добавляют 44,7 мг ДЦКИ. После выдерживания в течение 1 часа при 0oС и 1 часа при комнатной температуре добавляют 36,8 мг (0,2 ммоль) 2-гидразино-2-имидазол-гидробромида и перемешивают в течение трех дней при комнатной температуре. Растворитель удаляют в вакууме и остаток хроматографируют на силикагеле с помощью смеси дихлорметана с метанолом, уксусной кислотой и водой в соотношении 8:2:0,2: 0,2. Содержащие продукт фракции концентрируют и подвергают сушке вымораживанием. Получают 60 мг (52%) соединения формулы (7.7).
7 з). (2S)-Бензилоксикарбониламино-3-[2-((4S)-(N'-(4,5 -дигидро-1Н-имидазол-2-ил)-гидразинокарбонилметил) -2,5-диоксо-имидазолидин-1-ил)-ацетиламино]-пропионовая кислота (формула 7.8)
55 мг (0,096 ммоль) соединения формулы (7.7) в 1 мл 90%-ной трифторуксусной кислоты перемешивают в течение 1 часа при комнатной температуре. После удаления трифторуксусной кислоты в вакууме и очистки сырого продукта с помощью препаративной высокоэффективной жидкостной хроматографии при использовании неподвижной фазы RP18 и последующей сушки вымораживанием содержащих продукт фракций получают 10,6 мг (21%) соединения формулы (7.8) в виде бесцветного твердого вещества.
Масс-спектр (ионизация электронным распылением (+)): 519 (М+Н)+.
Пример 8
(2S)-Бензилоксикарбониламино-3-[2-(2,5- диоксо-(4S)-(N'-(1,4,5,6-терагидро-пиримидин-2-ил) -гидразинокарбонилметил)-имидазолидин-1-ил) -ацетиламино]-пропионовая кислота (формула 8.2)
Синтез осуществляют согласно реакционной последовательности 8 (см. в конце описания).
8 а). трет-Бутиловый эфир (2S)-бензилоксикарбониламино-3 -[2-(2,5-диоксо-(4S)-(N'-(1,4,5,6-тетрагидро-пиримидин -2-ил)-гидразинокарбонилметил)-имидазолидин -1-ил)-ацетиламино]-пропионовой кислоты (формула 8.1)
К раствору 130 мг (0,26 ммоль) соединения формулы (7.6) и 43 мг (0,26 ммоль) HOOBt в 5 мл диметилформамида при 0oС добавляют 58 мг ДЦКИ, перемешивают в течение 1 часа при 0oС и в течение 1 часа при комнатной температуре и затем добавляют 0,034 мл N-этилформалина (NEM) и 52 мг (0,26 ммоль) 2-гидразино-1,4,5,6- тетрагидропиримидин-гидробромида. После перемешивания в течение 28 часов при комнатной температуре растворитель удаляют в вакууме и остаток хроматографируют на силикагеле с помощью смеси дихлорметана с метанолом, уксусной кислотой и водой в соотношении 8,5:1,5:0,15:0,15. Содержащие продукт фракции концентрируют и подвергают сушке вымораживанием. Получают 80 мг (52%) соединения формулы (8.1).
8 б). (2S)-Бензилоксикарбониламино-3-[2 -(2,5-диоксо-(4S)-(N'-(1,4,5,6-тетрагидропиримидин-2-ил)- гидразинокарбонилметил)имидазолидин-1 -ил)-ацетиламино]-пропионовая кислота (формула 8.2)
Раствор 80 мг (0,136 ммоль) соединения формулы (8.1) в 4 мл 90%-ной трифторуксусной кислоты перемешивают в течение 1 часа при комнатной температуре, концентрируют в вакууме и остаток хроматографируют на Сефадексе LH 20 с помощью смеси воды с бутанолом и уксусной кислотой в соотношении 43: 4,3: 3,5. Содержащие продукт фракции концентрируют и очищают путем препаративной высокоэффективной жидкостной хроматографии при использовании неподвижной фазы RP18. После концентрирования содержащих продукт фракций и сушки вымораживанием получают 41,9 мг (59%) соединения формулы (8.2) в виде бесцветного твердого вещества.
Масс-спектр (ионизация электронным распылением (+)): 533 (М+Н)+.
Пример 9
2-Бензилоксикарбониламино-3-[2-(4S)-(2-(N' -(4,5-дигидро-1Н-имидазол-2-ил)-гидразинокарбонил)-этил-2,5 -диоксо-имидазолидин-1-ил)-ацетиламино] -пропионовая кислота (формула 9.1)
Синтез соединения формулы (9.1) осуществляют как описано в примере 7 исходя из L-глутаминовой кислоты.
Масс-спектр (ионизация электронным распылением (+)): 533 (М+Н)+.
Пример 10
3-[(2-((4S)-(8-(1Н-Бензимидазол-2-ил -метил)-карбамоил)-метил)-2,5-диоксо-имидазолидин -1-ил)-ацетиламино] -(2S)- бензилоксикарбониламино-пропионовая кислота (формула 10.2)
Синтез осуществляют согласно следующей реакционной последовательности 9 (см. в конце описания).
10 а). трет-Бутиловый эфир 3-[(2-((4S)-(8-(1Н-бензимидазол -2-ил-метил)-карбамоил) -метил)-2,5-диоксо-имидазолидин-1- ил)ацетиламино]-(2S)-бензилоксикарбониламино-пропионовой кислоты (формула 10.1)
К раствору 430 мг (0,87 ммоль) соединения формулы (7.6) и 142,5 мг (0,87 ммоль) HOOBt в 10 мл диметилформамида при температуре 0oС добавляют 192 мг ДЦКИ. После перемешивания в течение 1 часа при 0oС и в течение 1 часа при комнатной температуре добавляют 231 мг (1,04 ммоль) 2-(аминометил)бензимидазола и 0,5 мл диизопропилэтиламина и смесь продолжают перемешивать в течение двух часов при комнатной температуре. После выдерживания в течение ночи растворитель удаляют в вакууме и остаток хроматографируют на силикагеле с помощью смеси дихлорметана с метанолом, уксусной кислотой и водой в соотношении 9,5:0,5:0,05:0,05. После концентрирования содержащих продукт фракций получают 390 мг (72%) соединения формулы (10.1).
10 б). 3-[(2-((4S)-(8-(1Н-Бензимидазол-2 -ил-метил)-карбамоил)-метил) -2,5-диоксоимидазолидин-1-ил)-ацетиламино] -(2S)-бензилоксикарбониламино-пропионовая кислота (формула 10.2)
360 мг (0,579 ммоль) соединения формулы (10.1) растворяют в 10 мл 90%-ной трифторуксусной кислоты. После выдерживания в течение 30 минут при комнатной температуре раствор концентрируют в вакууме, остаток распределяют между этилацетатом и водой, водную фазу экстрагируют этилацетатом и подвергают сушке вымораживанием. Остаток хроматографируют на Сефадексе LH 20 с помощью смеси воды с бутанолом и уксусной кислотой в соотношении 43:4,3:3,5. Содержащие продукт фракции концентрируют и подвергают сушке вымораживанием. Получают 135 мг (40%) соединения формулы (10.2) в виде бесцветного твердого вещества.
Масс-спектр (ионизация электронным распылением (+)): 566 (М+Н)+.
Пример 11
(2S)-Бензилоксикарбониламино-3-[2-(4S)-(3-(3Н- имидазо-[4,5-b]пиридин-2-ил-амино)-пропил) -2,5-диоксо-имидазолидин-1- ил)-ацетиламино]-пропионовая кислота (формула 11.7)
Синтез осуществляют согласно реакционной последовательности 10 (см. в конце описания).
11 а). Гидрохлорид метилового эфира [4-(3-аминопропил)2,5-диоксо -имидазолидин-1-ил]-уксусной кислоты (формула 11.1)
При -15oС к 100 мл метанола добавляют 12,5 мл (107 ммоль) тионилхлорида, 21,5 г (85,4 ммоль) соединения формулы (1.4) и реакционную смесь перемешивают в течение 24 часов при комнатной температуре. Затем раствор выливают в диэтиловый эфир, осадок отсасывают и промывают диэтиловым эфиром. После высушивания в высоком вакууме получают 20,52 г (90%) соединения формулы (11.1) в виде бесцветного твердого вещества.
11 б). Метиловый эфир [4-(3-изотиоцианато-пропил)-2,5 -диоксо-имидазолидин-1-ил]-уксусной кислоты (формула 11.2)
К суспензии 2,65 г (10 ммоль) соединения формулы (11.1) в 30 мл дихлорметана добавляют 100 мл насыщенного раствора гидрокарбоната натрия. После перемешивания в течение 10 минут при охлаждении льдом к дихлорметановой фазе добавляют 1,53 мл (20 ммоль) тиофосгена. Перемешивают в течение 10 минут при охлаждении льдом, фазы разделяют и водную фазу экстрагируют 2 раза дихлорметаном. Объединенные органические фазы сушат над сульфатом натрия. После фильтрации и удаления растворителя в вакууме получают 2.04 г (75%) соединения формулы (11.2).
11 в). Метиловый эфир [(4S)-(3-(3-(3-амино-пиридин -2-ил)-тиомочевино) -пропил)-2,5-диоксо-имидазолидин-1-ил]-уксусной кислоты (формула 11.3)
Раствор 1,66 г (6,11 ммоль) соединения формулы (11.2) и 667 мг (6,11 ммоль) 2,3-диаминопиридина в 18 мл абсолютного этанола перемешивают в течение 16 часов при комнатной температуре и затем в течение двух часов кипятят с обратным холодильникам при перемешивании. Растворитель удаляют в вакууме и остаток хроматографируют на силикагеле с помощью смеси дихлорметана с метанолом, уксусной кислотой и водой в соотношении 9:1:0,1:0:1. После концентрирования содержащих продукт фракций и сушки вымораживанием получают 1,67 г (72%) соединения формулы (11.3).
11 г). Метиловый эфир [(4S)-3-(3Н-имидазо[4,5]пиридин -2-ил-амино-пропил)-2,5-диоксо- имидазолидин-1ил]-уксусной кислоты (формула 11.4)
К раствору 1,43 г (3,75 ммоль) соединения формулы (11.3) в 80 мл этанола добавляют 1,62 г (7,51 ммоль) оксида ртути и 24 мг серы и смесь кипятят с обратным холодильником в течение 1 часа. После фильтрации и концентирования фильтрата в вакууме получают 1,15 г (89%) соединения формулы (11.4).
11 д). Гидрохлорид [(4S)-3-(3Н-имидазо[4,5-b] пиридин-2-ил-амино)-пропил)-2,5-диоксо -имидазолидин-1-ил]-уксусной кислоты (формула 11.5)
286 мг (0,83 ммоль) соединения формулы (11.4) в 10 мл концентрированной соляной кислоты перемешивают в течение 5 часов при 50oС. После фильтрации полученный фильтрат разбавляют водой и подвергают сушке вымораживанием. Получают 277 мг (91%) соединения формулы (11.5) в виде бесцветного твердого вещества.
11 е). трет-Бутиловый эфир (2S)-бензилоксикарбониламино-3-[2-(4S)-(3-(3Н-имидазо[4,5-b] пиридин-2-ил-амино)-пропил)-2,5-диоксо-имидазолидин-1-ил)-ацетиламино]-пропионовой кислоты (формула 11.6)
К раствору 267 мг (0,72 ммоль) соединения формулы (11.5) и 213 мг (0,72 ммоль) соединения формулы (1.6) в 10 мл диметилформамида добавляют 237 мг (0,72 ммоль) O-[циан (этоксикарбонил)метиленамино]-1,1,3,3-тетраметилуронийтетрафторбората (TOTU) и 0,245 мл диизопропилэтиламина и перемешивают в течение 1 часа при комнатной температуре. Растворитель удаляют в вакууме, остаток растворяют в этилацетате и этилацетатную фазу экстрагируют 2 раза с помощью насыщенного раствора гидрокарбоната натрия и 2 раза с помощью воды. Органическую фазу сушат над сульфатом натрия. После фильтрации и концентрирования фильтрата в вакууме получают 425 мг (97%) соединения формулы (11.6).
11 ж). (2S)-Бензилоксикарбониламино-3-[2- (4S)-(3-(3Н-имидазо[4,5-b] пиридин-2-ил-амино) -пропил)2,5-диоксо-имидазолидин-1-ил)- ацетиламино] -пропионовая кислота (формула 11.7)
420 мг (0,69 ммоль) соединения формулы (11.6) растворяют в 10 мл 95%-ной трифторуксусной кислоты. После выдерживания в течение 15 минут при комнатной температуре раствор концентрируют в вакууме и остаток хроматографируют на Сефадексе LH 20 с помощью смеси воды с бутанолом и уксусной кислотой в соотношении 43:4,3:3,5. Содержащие продукт фракции концентрируют и подвергают сушке вымораживанием. Получают 234 мг (62%) соединения формулы (11.7) в виде бесцветного твердого вещества.
Масс-спектр (ионизация электронным распылением (+)): 553 (М+Н)+.
Пример 12
(2S)-Бензилоксикарбониламино-3-[2-(4S)-(3-(3Н-имидазо -[4,5-b]пиридин-2-ил-амино)-пропил-2,5 -диоксо-имидазолин-1-ил)-ацетиламино] -пропионовая кислота (формула 12.3)
Синтез осуществляют согласно реакционной последовательности 11 (см. в конце описания).
Исходным соединением для синтеза соединения формулы (12.3) является соединение формулы (11.2), которое аналогично получению соединения формулы (11.3) с помощью 3,4-ди-аминопиридина превращают в соединение формулы (12.1). Последнее затем аналогично получению соединения формулы (11.4) и формулы (11.5) циклизуют с помощью оксида ртути и вводят во взаимодействие с концентрированной соляной кислотой с получением соединения формулы (12.2). Соединение формулы (12.2) вводят во взаимодействие с соединением формулы (1.6), как описано в случае получения соединения формулы (11.6), и таким образом полученный продукт сочетания при ращеплении сложного трет-бутилового эфира, как описано в случае синтеза соединения формулы (11.7) из соединения формулы (11.6), переводят в соединение формулы (12.3).
Масс-спектр (ионизация электронным распылением (+)): 553 (М+Н)+.
Пример 13
(2S)-(Адамантан-1-ил-метоксикарбониламино)-3-[(4S) -(3-бензимидазолил-2-амино)-пропил)-5-оксо-2 -тиоксо-имидазолидин-1-ил)-ацетиламино]-пропионовая кислота (формула 13.7)
Синтез осуществляют согласно реакционной последовательности 12 (см. в конце описания).
13 а). Метиловый эфир 5-бензилоксикарбонил-амино- (2S)-метоксикарбонилметиламинотиокарбониламино -5-пентановой кислоты (формула 13.1)
К раствору 6,32 г (20 ммоль) H-Orn(Z)-OMe • HCl (Бахем) в 40 мл диметилформамида при температуре 0oС добавляют 2,62 г (20 ммоль) метилового эфира изотиоцианато-уксусной кислоты и 2,3 г (20 ммоль) N-этилморфолина. После перемешивания в течение 20 часов при комнатной температуре растворитель удаляют в вакууме, остаток растворяют в дихлорметане и дихлорметановый раствор экстрагируют 2 раза водой. После высушивания органической фазы над сульфатом натрия, фильтрации и удаления растворителя в вакууме получают соединение формулы (13.1), которое прямо используют для синтеза соединения формулы (13.2).
13 б). Гидрохлорид [(4S)-(3-аминопропил)-5-оксо-2-тиоксо -имидазолидин-1-ил]-уксусной кислоты (формула 13.2)
Суспензию соединения формулы (13.1) в 150 мл 6 н. соляной кислоты перемешивают в течение 5 часов при 50oС. Раствор концентрируют, остаток перемешивают два раза с диэтиловым эфиром, и после этого остаток высушивают в высоком вакууме и затем над гидроксидом калия. Получают соединение формулы (13.2), которое непосредственно используют для синтеза соединения формулы (13.3).
13 в). 2-[(4S)-(3-(3-(2-Нитрофенил)-тиомочевино) -пропил)-5-оксо-2-тиоксо-имидазолидин-1-ил]-уксусная кислота (формула 13.3)
К раствору соединения формулы (13.2) и 3,6 г (20 ммоль) 2-нитрофенилизотиоцианата в 50 мл диметилформамида при охлаждении льдом прикапывают 2,77 мл (20 ммоль) триэтиламина. Раствор перемешивают в течение ночи при комнатной температуре, добавляют еще раз 360 мг (2 ммоль) 2-нитрофенил-изотиоцианата и 0,8 мл триэтиламина и перемешивают следующие 5 часов при комнатной температуре. Растворитель удаляют в вакууме, остаток растворяют в этилацетате и этилацетатную фазу промывают 2 раза водным раствором гидросульфата калия с сульфатом калия и сушат над сульфатом натрия. После фильтрации этилацетат удаляют в вакууме и остаток хроматографируют на силикагеле с помощью смеси дихлорметана с метанолом, уксусной кислотой и водой в соотношении 9:1: 0,1: 0,1. После концентрирования содержащих продукт фракций получают 4,06 г (49% в расчете на соединение формулы (13.1)) соединения формулы (13.3).
13 г). 2-[(4S)-(3-(3-(2-Аминофенил- тиомочевино)-пропил)-5-оксо-2-тиоксо-имидазолидин -1-ил]-уксусная кислота (формула (13.4)
611 мг (1,48 ммоль) соединения формулы (13.4) в 50 мл насыщенного этанольного раствора аммиака гидрируют в присутствии 600 мг 10%-ного палладия-на-угле в течение трех часов при комнатной температуре. После фильтрации и концентрирования фильтрата в вакууме получают 488 мг (87%) соединения формулы (13.4).
13 д). [(4S)-3-(Бензимидазолил-2-амино) -пропил)-5-оксо-2-тиоксо-имидазолидин -1-ил]-уксусная кислота (формула 13.5)
К раствору 485 мг (1,27 ммоль) соединения формулы (13.4) в 50 мл этанола добавляют 550 г (2,54 ммоль) оксида ртути и 8,1 мг серы и смесь в течение трех часов кипятят с обратным холодильником. После фильтрации и удаления растворителя в вакууме остаток растворяют в 10%-ной уксусной кислоте и подвергают сушке вымораживанием. Получают 307 мг (79%) соединения формулы (13.5) в виде бесцветного твердого вещества.
13 е). трет-Бутиловый эфир (2S)-адамантан-1-ил-метоксикарбониламино)-3-[((4S) -(3-(-бензимидазолил-2-амино)-пропил)-5-оксо-2- тиоксо-имидазолидин-1-ил)-ацетиламино]-пропионовой кислоты (формула 13.6)
К раствору 290 мг (0,834 ммоль) соединения формулы (13.5) и 297 мг (0,834 ммоль) соединения (13.11) (синтез см. в п.п.13 з).-13 л). в абсолютном диметилформамиде добавляют 273 мг (0,834 ммоль) TOTU и 0,28 мл диизопропилэтиламина и смесь перемешивают в течение 2,5 часов при комнатной температуре. Растворитель удаляют в вакууме, остаток растворяют в этилацетате и этилацетатную фазу экстрагируют 2 раза насыщенным раствором гидрокарбоната натрия и водой. После высушивания над сульфатом натрия этилацетат удаляют в вакууме и остаток хроматографируют на силикагеле с помощью смеси дихлорметана с метанолом, уксусной кислотой и водой в соотношении 9,5:0,5:0,05,:0,05. После концентрирования содержащих продукт фракций получают 46,3 мг (8%) соединения формулы (13.6).
13 ж). (2S)-(Адамантан-1-ил-метоксикарбониламино)-3-[(4S)-(3-бензимидазолил-2 -амино)-пропил)-5-оксо-2-тиоксо-имидазолидин-1-ил) -ацетиламино] -пропионовая кислота (формула 13.7)
38,1 мг (0,056 ммоль) соединения формулы (13.6) растворяют в 2 мл 95%-ной трифторуксусной кислоты. После выдерживания в течение 10 минут при комнатной температуре раствор концентирируют в вакууме и остаток очищают путем препаративной высокоэффективной жидкостной хроматографии (неподвижная фаза RP18). После сушки вымораживанием содержащих продукт фракций получают 11 мг (32%) соединения формулы (13.7).
Масс-спектр (бомбардировка быстрыми атомами): 626 (М+Н)+.
Синтез трет-бутилового эфира 3-амино-(2S)-(адамантан-1-ил-метоксикарбониламино)-пропионовой кислоты (формула 13.11)
Синтез осуществляют согласно следующей реакционной последовательности 13 (см. в конце описания).
13 з). трет-Бутиловый эфир (2S)-бензилоксикарбониламино-3-трет-бутоксикарбониламино-пропионовой кислоты (формула 13.8)
К раствору 10 г (34 ммоль) соединения формулы (1.6) в 600 мл смеси тетрагидрофурана с водой в соотношении 2:1 при 0oС добавляют 8,9 г (40,8 ммоль) ди-трет-бутилдикарбоната и затем порциями 1 н. раствор гидроксида натрия, так чтобы рН-значение раствора составляло величину в пределах 9-10 (расход 1 н. раствора гидроксида натрия: 32 мл). После перемешивания в течение трех часов при комнатной температуре добавляют 1 л воды и экстрагируют 3 раза диэтиловым эфиром. После высушивания над сульфатом натрия, фильтрации и удаления растворителя в вакууме остаток хроматографируют на силикагеле с помощью смеси дихлорметана с метанолом в соотношении 20:1. Получают 13.19 г (98%) соединения формулы (13.8).
13 и). Гидрохлорид трет-бутилового эфира (2S)-амино-3-трет-бутоксикарбониламино-пропионовой кислоты (формула 13.9)
13,1 г (33,2 ммоль) соединения формулы (13.8) в растворе хлороводорода в метаноле гидрируют в присутствии 10%-ного палладия-на-угле. Спустя 1,5 часа отфильтровывают, фильтрат концентируют в вакууме и получают 9,77 г (99%) соединения формулы (13.9) в виде бесцветного твердого вещества.
13 к). трет-Бутиловый эфир (2S)-(адамантан-1-ил-метоксикарбониламино) -3-трет-бутоксикарбониламино-пропионовой кислоты (формула 13.10)
Раствор 10,9 г (65,4 ммоль) (1-гидроксиметил)-адамантана и 10,6 г (65,4 ммоль) карбонилдиимидазола в 60 мл тетрагидрофурана перемешивают в течение 1,5 часов при 50oС. Добавляют 9,7 г (32,7 ммоль) соединения формулы (13.9) в 25 мл тетрагидрофурана и 5,6 мл (32,7 ммоль) диизопропилэтиламина, перемешивают 4 часа при 60oС и выдерживают в течение ночи при комнатной температуре. Растворитель удаляют в вакууме и остаток хроматографируют на силикагеле с помощью смеси гептана с этилацетатом в соотношении 7:3. Получают 8,7 г (59%) соединения формулы (13.10) в виде бесцветного масла.
13 л). трет-Бутиловый эфир (2S)-(адамантан-1-ил-метоксикарбониламино)-3-амино-пропионовой кислоты (формула 13.11)
Раствор 8,7 г (19,22 ммоль) соединения формулы (13.10) в 180 мл смеси трифторуксусной кислоты с дихлорметаном в соотношении 1:1 после выдерживания в течение 1 минуты вносят в 1,5 мл охлажденного льдом раствора гидрокарбоната натрия. Раствор экстрагируют 3 раза дихлорметаном и дихлорметановую фазу затем сушат над сульфатом натрия. После фильтрации и удаления растворителя в вакууме получают 6,35 г (94%) соединения формулы (13.11) в виде бесцветного твердого вещества.
Пример 14
3-[2-((4R, S)-(3-(1Н-Бензимидазол-2-ил -амино)-пропил)-4-метил-2,5-диоксоимидазолидин-1-ил) -ацетиламино] -(2S)- бензилоксикарбониламино-пропионовая кислота (формула 14.8)
Синтез осуществляют согласно реакционной последовательности 14 (см. в конце описания).
14 а). 2-(4-Оксо-пентил)-изоиндол-1,3-дион (формула 14.1)
К раствору 14,3 мл (124,4 ммоль) 5-хлор-пентан-2-она в 100 мл диметилформамида добавляют 24,59 г (132,8 ммоль) фталимида калия, перемешивают 3 часа при комнатной температуре и 30 часов при 60oС. После фильтрации фильтрат распределяют между водой и дихлорметаном. Фазы разделяют и органическую фазу промывают последовательно водой, 2 раза 0,2 н. раствором гидроксида натрия и водой и сушат над сульфатом натрия. После фильтрации растворитель удаляют в вакууме и остаток хроматографируют на силикагеле с помощью смеси гептана с этилацетатом в соотношении 6:4. После концентрирования содержащих продукт фракций получают 9,8 г (34%) соединения формулы (14.1).
14 б). 5-Амино-2-оксо-пентан-гидрохлорид (формула 14.2)
13 г (56,2 ммоль) соединения формулы (14.1) растворяют в 335 мл 20%-ной соляной кислоты и кипятят с обратным холодильником в течение 6 часов. После выдерживания в течение ночи при комнатной температуре отфильтровывают и фильтрат концентрируют в вакууме. Получают в виде бледно-желтого цвета масла сырой продукт формулы (14.2), который непосредственно используют для синтеза соединения формулы (14.3).
14 в). 5-трет-Бутоксикарбонил-амино-2-оксо-пентан (формула 14.3)
Соединение формулы (14.2) (из стадии 14 б).) растворяют в 110 мл диоксана и 55 мл воды и в растворе устанавливают рН-значение, равное 8,5, путем добавления 65 мл 1 н. раствора гидроксида натрия. При 0oС добавляют 13,25 г (60,8 ммоль) ди-трет-бутил-дикарбоната и устанавливают рН-значение раствора равным 8,5 путем повторного добавления 1 н. раствора гидроксида натрия. После перемешивания в течение 4,5 часов при комнатной температуре диоксан удаляют в вакууме, остающийся раствор доводят до рН-значения, равного 2-3, путем добавления раствора гидросульфата калия и экстрагируют 3 раза этилацетатом. Объединенные органические фазы промывают насыщенным раствором гидрокарбоната натрия и сушат над сульфатом натрия. После отфильтровывания и удаления растворителя в вакууме получают 11,1 г (99%, в расчете на соединение формулы (14.1)) соединения формулы (14.3).
14 г). (4R,S)-(3-трет-Бутоксикарбонил-амино) -пропил-4-метил-2,5-диоксо-имидазолидин (формула 14.4)
К раствору 10,06 г (50 ммоль) соединения формулы (14.3) в 130 мл смеси этанола с водой в соотношении 1:1 добавляют 41,96 г (439,2 ммоль) карбоната аммония и 4,2 г (65,1 ммоль) цианида калия и смесь нагревают до 55-65oС. После выдерживания в течение 5,5 часов при этой температуре в реакционной смеси устанавливают рН-значение, равное 6,3, с помощью 6 н. соляной кислоты и дополнительно перемешивают в течение двух часов. Смесь выдерживают в течение ночи при комнатной температуре, растворитель удаляют в вакууме и остаток распределяют между водой и этилацетатом. Фазы разделяют и водную фазу экстрагируют 2 раза этилацетатом. Объединенные органические фазы сушат над сульфатом натрия, отфильтровывают осушитель и растворитель удаляют в вакууме. Получают 12,42 г (92%) соединения формулы (14.4) в виде бесцветных кристаллов.
14 д). Этиловый эфир [(4R,S)-(3-трет- бутоксикарбониламино-пропил)-4-метил -2,5-диоксо-имидазолидин-1-ил]-уксусной кислоты (формула 14.5)
В атмосфере аргона и при охлаждении льдом к раствору 4 г (14,7 ммоль) соединения формулы (14.3) в 100 мл диметилформамида добавляют 388 мг (16,1 ммоль) гидрида натрия и перемешивают в течение 45 минут при комнатной температуре. Добавляют 1,63 мл (14,7 ммоль) этилового эфира бромуксусной кислоты, перемешивают в течение трех часов при комнатной температуре и растворитель удаляют в вакууме. Остаток растворяют в этилацетате и этилацетатную фазу промывают 2 раза водой. После высушивания над сульфатом натрия и удаления растворителя в вакууме получают 4,98 г (95%) соединения формулы (14.5) в виде бледно-желтого масла.
14 е). Гидрохлорид [(4R,S)-(3-аминопропил)-4-метил-2,5 -диоксо-имидазолидин-1-ил]-уксусной кислоты (формула 14.6)
4,98 г (13,9 ммоль) соединения формулы (14,5) суспендируют в 50 мл 6 н. соляной кислоты и кипятят с обратным холодильником в течение 1 часа. Реакционную смесь концентрируют в вакууме, остаток растворяют в воде и подвергают сушке вымораживанием. Получают соединение формулы (14.7) в виде сырого продукта, который используют непосредственно для синтеза соединения формулы (14.7).
Синтез соединения формулы (14.7) исходя из соединения формулы (14.6) и соединения формулы (14.8) исходя из соединения формулы (14.7) осуществляют аналогично синтезу соединения формулы (5.5) исходя из соединения формулы (1.4) (см. пример 5).
Масс-спектр (ионизация электронным распылением (+)) соединения формулы (14.8): 566 (М+Н)+.
Пример 15
(2S)-Бензилоксикарбониламино-3-[(4S)-(3- (6-метокси-1H-бензимидазол-2-ил-амино)-пропил) -2,5-диоксо-имидазолидин-1-ил)-ацетиламино] -пропионовая кислота (формула 15.3)
Синтез осуществляют согласно реакционной последовательности 15 (см. в конце описания).
Исходным соединением для синтеза соединения формулы (15.3) является соединение формулы (11.2), которое аналогично получению соединения формулы (11.3) вводят во взаимодействие с 4-метокси-орто-фенилендиамином при комнатной температуре с получением соединения формулы (15.1). Последнее затем аналогично получению соединений формулы (11.4) и (11.5) циклизуют с помощью оксида ртути и вводят во взаимодействие с концентрированной соляной кислотой с получением соединения формулы (15.2). Соединение формулы (15.2) затем вводят во взаимодействие с соединением формулы (1.6), как описано при получении соединения формулы (11.6), и таким образом полученный продукт сочетания при расщеплении трет-бутилового сложного эфира, как описано в случае синтеза соединения формулы (11.7) из соединения формулы (11.6), переводят в соединение формулы (15.3).
Масс-спектр (ионизация электронным распылением (+)): 582 (М+Н)+.
Пример 16
(2S)-Бензилоксикарбониламино-3-[((4S)-(3- (5,6-диметокси-1Н-бензимидазол-2-ил-амино)-пропил) -2,5-диоксо-имидазолидин-1-ил)-ацетиламино]-пропионовая кислота (формула 16.1)
Синтез соединения формулы (16.1) осуществляют как описано в случае получения соединения формулы (15.3), тем, что вместо 1-метокси-3,4-диамино-бензола используют 1,2-диметокси-4,5-диаминобензол, который получают из 1,2-диметокси-4,5-динитро-бензола путем гидрирования в присутствии 10%-ного палладия-на-угле в метаноле.
Масс-спектр (ионизация электронным распылением (+)): 612 (М+Н)+.
Пример 17
(2S)-Бензилоксикарбониламино-3[((4S)-(3-(5,6- метилендиокси-бензимидазол-2-ил-амино) -пропил-2,5-диоксо-имидазолидин-1-ил) -ацетиламино]-пропионовая кислота (формула 17.1)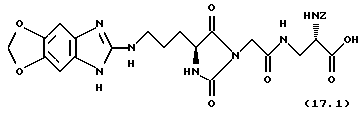
Синтез соединения формулы (17.1) осуществляют как описано в случае получения соединения формулы (15.3), тем, что вместо 1-метокси-3,4-диаминобензола используют 1,2-метилендиокси-4,5-диаминобензол, который получают из 1,2-метилендиокси-4,5-динитробензола путем гидрирования в присутствии 10%-ного палладия-на-угле в метаноле. Последнее соединение получают из 1,2-метилендиокси-4-нитробензола путем нитрования, как описано D.S. Wulfman и др., Synthesis, 924 (1978).
Масс-спектр (ионизация электронным распылением (+)): 624 (М+Н)+.
Пример 18
3-[2-((4S)-(2-(1Н-Бензимидазол-2-ил) -этил)-2,5-диоксо-имидазолидин-1-ил) -ацетиламино]-(2S)- бензилоксикарбониламино-пропионовая кислота (формула 18.5)
Синтез осуществляют согласно реакционной последовательности 16 (см. в конце описания).
18 а). Метиловый эфир (2S)-амино-4-(2-бензимидазолил)-бутановой кислоты (формула 18.1)
Соединение формулы (18.1) получают как описано Hans Lettre и др., Berichte, 84, 719 (1951).
18 б). Метиловый эфир (2S)-этилоксикарбонилметил-аминокар-бониламино-4-(2- (1H-бензимидазолил)-бутановой кислоты (формула 18.2)
При 0oС к раствору 4,6 г (20 ммоль) соединения формулы (18.1) в абсолютном диметилформамиде добавляют 3,4 мл (20 ммоль) диизопропилэтиламина и 2,58 г (20 ммоль) этилового эфира изоцианатоуксусной кислоты. После перемешивания в течение 16 часов при комнатной температуре растворитель удаляют в вакууме, остаток растворяют в этилацетате и этилацетатную фазу промывают 2 раза с помощью 10%-ного раствора лимонной кислоты. В водной фазе устанавливают рН-значение, равное 10, с помощью 2 н. раствора гидроксида калия и многократно экстрагируют эту фазу этилацетатом. Объединение органические фазы сушат над сульфатом натрия, осушитель отфильтровывают и фильтрат концентрируют в вакууме. Получают 4,4 г (61%) соединения формулы (18.2).
18 в). [(4S)-(2-(1Н-Бензимидазол-2-ил)-этил)-2,5-диоксо -имидазолидин-1-ил]-уксусная кислота (формула 18.3)
Раствор 200 мг (0,55 ммоль) соединения формулы (18.2) в 4 мл 4 н. соляной кислоты перемешивают в течение 16 часов при комнатной температуре. После удаления растворителя в вакууме остаток растворяют в воде и подвергают сушке вымораживанием. Получают 160 мг (53%) соединения формулы (18.3) в виде бесцветного твердого вещества.
18 г). трет-Бутиловый эфир 3-[2-((4S)-(2-(1Н-бензимидазол-2-ил)-этил) -2,5-диоксо-имидазолидин-1-ил)-ацетиламино] -(2S)-бензилоксикарбониламино-пропионовой кислоты (формула 18.4)
При 0oС к раствору 160 мг (0,53 ммоль) соединения формулы (18.3), 72 мг (0,53 ммоль) HOBt и 156 мг (0,53 ммоль) соединения формулы (1.6) в 5 мл диметилформамида добавляют 0,09 мл (0,53 ммоль) диизопропилэтиламина (DIPEA) и 120 мг (0,58 ммоль) ДЦКИ. Перемешивают в течение 20 минут при 0oС и в течение 16 часов при комнатной температуре. Осадок отфильтровывают, фильтрат концентрируют, остаток растворяют в этилацетате и этилацетатную фазу промывают 10%-ным раствором гидрокарбоната калия и насыщенным раствором хлорида натрия и сушат над сульфатом натрия. После фильтрации растворитель удаляют в вакууме и остаток (сырой продукт формулы 18.4) непосредственно превращают в соединение формулы (18.5).
18 д). 3-[2-((4S)-(2-(1Н-Бензимидазол-2-ил)-этил)-2,5-диоксо -имидазолидин-1-ил)-ацетиламино] -(2S)- бензилоксикарбониламино-пропионовая кислота (формула 18.5)
Раствор соединения формулы (18.4) в виде сырого продукта в 5 мл 95%-ной трифторуксусной кислоты перемешивают в течение 20 минут при комнатной температуре. Растворитель удаляют в вакууме и остаток растворяют в смеси трет-бутанола с водой в соотношении 1:1 и подвергают сушке вымораживанием. Получают 120 мг (44%, в расчете на соединение формулы (18.3)) соединения формулы (18.5) в виде бледно-желтого твердого вещества.
Масс-спектр (ионизация электронным распылением (+)): 492 (М+Н)+.
Пример 19
(2S)-Бензилоксикарбониламино-3-[2-((4S)-(3- гуанидино-3-оксо-пропил)-2,5-диоксо-имидазолидин -1-ил)-ацетиламино] -пропионовая кислота (формула 19.3)
Синтез осуществляют согласно реакционной последовательности 17 (см. в конце описания).
19 а). Трет-Бутиловый эфир (2S)-бензилоксикарбониламино-3- [((4S)-(2-карбоксиэтил)-2,5-диоксо-имидазолидин -1-ил)-ацетиламино]-пропионовой кислоты (формула 19.1)
Синтез соединения формулы (19.1) осуществляют исходя из L-глутаминовой кислоты аналогично синтезу соединения формулы (7.6) из L-аспарагиновой кислоты (см. пример 7).
19 б). трет-Бутиловый эфир (2S)-бензилоксикарбониламино-3-[2-((4S)- (3-гуанидино-3-оксо-пропил)-2,5-диоксо-имидазолидин- 1-ил)-ацетиламино] -пропионовой кислоты (формула 19.2)
К раствору 170 мг (2,88 ммоль) гуанидина и 6,5 мг (0,09 ммоль) имидазола в 2 мл диметилформамида добавляют 12,8 мг (0,09 ммоль) йодида лития и раствор 500 мг (0,96 ммоль) соединения формулы (19.1) в 5 мл диметилформамида и смесь перемешивают в течение ночи при комнатной температуре. Растворитель удаляют в вакууме, остаток обрабатывают этилацетатом, этилацетатную фазу промывают раствором гидрокарбоната калия и сушат над сульфатом натрия. После отфильтровывания растворитель удаляют в вакууме и получают 30 мг соединения формулы (19.2) в виде сырого продукта, который используют непосредственно для синтеза соединения формулы (19.3).
19 в). (2S)-Бензилоксикарбониламино-3-[2-((4S)-(3-гуадино -3-оксо-пропил)-2,5-диоксо-имидазолидин-1 -ил)-ацетил-амино] -пропионовая кислота (формула 19.3)
Раствор 30 мг соединения формулы (19.2) в виде сырого продукта в 1 мл 95%-ной трифторуксусной кислоты перемешивают в течение 10 минут при комнатной температуре. Растворитель удаляют в вакууме и остаток очищают с помощью препаративной высокоэффективной жидкостной хроматографии при использовании в качестве неподвижной фазы RP18. После концентрирования содержащих продукт фракций и сушки вымораживанием получают 9,5 мг (2% в расчете на соединение формулы (19.1)) соединения формулы (19.3) в виде бесцветного твердого вещества.
Масс-спектр (ионизация электронным распылением (+)): 492 (М+Н)+.
Пример 20
(2S)-Бензилоксикарбониламино-3-[2-(2,5-диоксо -(4S)-(2-(1,4,5,6-тетрагидро-пиримидин-2-ил-карбамoил) -этил)-имидазолидин-1-ил)-ацетиламино] -пропионовая кислота (формула 20.2)
Синтез осуществляют согласно реакционной последовательности 18 (см. в конце описания).
20 а). трет-Бутиловый эфир (2S)-бензилоксикарбониламино-3-[2-(2,5-диоксо-(4S)-(2-(1,4,5,6-тетрагидро-пиримидин-2-ил-карбамоил)-этил)-имидазолидин-1-ил)-ацетиламино]-пропионовой кислоты (формула 20.1)
К раствору 506 мг (1 ммоль) соединения формулы (19.1) в 4 мл абсолютного тетрагидрофурана при охлаждении льдом добавляют 135 мг (1 ммоль) HOBt, 206 мг (1,1 ммоль) ДЦКИ и перемешивают смесь в течение 30 минут. Затем этот раствор добавляют к раствору 136 мг (1 ммоль) 1,4,5,6-тетрагидро-пиримидин-2 -ил-амин-гидрохлорида и 112 мг трет-бутилата калия в диметилформамиде и смесь перемешивают в течение 1 часа при комнатной температуре. Растворитель удаляют в вакууме и остаток растирают с диэтиловым эфиром. После хроматографии на силикагеле с помощью смеси дихлорметана с метанолом, уксусной кислотой и водой в соотношении 9:1:0,1:0,1, концентрирования содержащих продукт фракций и сушки вымораживанием получают 90 мг (15%) соединения формулы (20.1).
20 б). (2S)-Бензилоксикарбониламино-3-[2-(2,5-диоксо -4-(2-(1,4,5,6-тетрагидро-пиримидин-2-ил-кабамоил)-этил)- имидазолидин-1-ил)-ацетиламино] -пропионовая кислота (формула 20.2)
Раствор 80 мг (0,136 ммоль) соединения формулы (20.1) в 10 мл 95%-ной трифторуксусной кислоты перемешивают в течение 20 минут при комнатной температуре. Растворитель удаляют в вакууме, остаток растворяют в воде и подвергают сушке вымораживанием. Получают 70 мг (97%) соединения формулы (20.2) в виде бесцветного твердого вещества.
Масс-спектр (ионизация электронным распылением (+)): 532 (М+Н)+.
Пример 21
4-[(4R, S)-(4-((1Н-Бензимидазол-2-ил-амино) -метил)-фенил)-4-метил-2,5-диоксо-имидазолидин-1-ил] -2-бензилоксикарбониламино-бутановая кислота (формула 21.7)
Синтез осуществляют согласно реакционной последовательности 19 (см. в конце описания).
21 а). 2-Бензилоксикарбониламино-4-[(4R, S)-(4-циано-фенил)4-метил -2,5-диоксо-имидазолидин-1-ил]-бутановая кислота (формула 21.2)
К раствору 1,07 г (5 ммоль) соединения формулы (21.1) (синтез см. международную заявку на патент 95/14008), 1,3 г (5 ммоль) трифенилфосфина и 1,7 г (5 ммоль) соединения формулы (21.10) в 20 мл абсолютного тетрагидрофурана добавляют раствор 870 мг (0,5 ммоль) диэтилазодикарбоксилата (DEAD) в абсолютном тетрагидрофуране. После выдерживания в течение 16 часов при комнатной температуре растворитель удаляют в вакууме, остаток обрабатывают этилацетатом, этилацетатную фазу промывают 10%-ным раствором лимонной кислоты и насыщенным раствором гидрокарбоната натрия и сушат над сульфатом натрия. После отфильтровывания растворитель удаляют в вакууме и остаток хроматографируют на силикагеле с помощью смеси дихлорметана с трет-бутилметиловым эфиром в соотношении 1:1. После концентрирования содержащих продукт фраций получают 1,2 г (44%) соединения формулы (21.2).
21 б). Уксусная соль бензинового эфира 4-[(4R,S)-(4-аминометил-фенил) -4-метил-2,5-диоксо-имидазолидин-1-ил] -2-бензилоксикарбониламино-бутановой кислоты (формула 21.3)
Раствор 1,2 г (2,22 ммоль) соединения формулы (21.2) в уксусной кислоте гидрируют в присутствии 150 мг оксида платины. Как только заканчивается поглощение водорода (спустя примерно 3 часа), катализатор отфильтровывают, фильтрат концентрируют и остаток очищают на силикагеле с помощью смеси дихлорметана с метанолом, уксусной кислотой и водой в соотношении 6:1:0,1:0,1. После концентрирования содержащих продукт фракций получают 450 мг (34%) соединения формулы (21.3).
21 в). Бензиловый эфир 2-бензилоксикарбониламино-4-[(4R, S)-метил-4- (4-(3-(2-нитрофенил)-тиомочевинометил) -фенил)-2,5-диоксо-имидазолидин-1-ил] -бутановой кислоты (формула 21.4)
К раствору 410 мг (0,75 ммоль) соединения формулы (21.3) в 5 мл диметилформамида добавляют 135 мг (0,75 ммоль) 2-нитрофенилизотиоцианата и 0,13 мл диизопропилэтиламина. После выдерживания в течение 16 часов при комнатной температуре растворитель удаляют в вакууме и остаток хроматографируют на силикагеле с помощью трет-бутилметилового эфира. Получают 380 мг (70%) соединения формулы (21.4).
21 г). Бензиловый эфир 4-[(4R,S)-(4-(3-(2-аминофенил) -тиомочевинометил)-фенил)-4-метил-2,5 -диоксо-имидазолидин-1-ил] -2-бензилоксикарбониламино-бутановой кислоты (формула 21.5)
К раствору 360 мг (0,49 ммоль) соединения формулы (21.4) в 5 мл метанола добавляют 650 мг дигидрата хлорида олова (2,9 ммоль) и 3 капли уксусной кислоты и смесь перемешивают в течение 16 часов при комнатной температуре.
После удаления растворителя в вакууме остаток хроматографируют на силикагеле с помощью смеси дихлорметана с метанолом в соотношении 20:1. Получают 280 мг (82%) соединения формулы (21.5).
21 д). Бензиловый эфир 4-[(4R,S)-(4-((1Н-бензимидазол-2 -ил-амино)-метил)-фенил)-4-метил -2,5-диоксо-имидазолидин-1-ил] - 2-бензилоксикарбониламино-бутановой кислоты (формула 21.6)
Смесь из 270 мг (0,38 ммоль) соединения формулы (21.5), 173 мг (0,8 ммоль) оксида ртути и 3 мг серы в 10 мл этанола кипятят с обратным холодильником в течение 12 часов. После отфильтровывания и удаления растворителя в вакууме получают 180 мг соединения формулы (21.6) в виде сырого продукта в форме красновато-коричневого сиропа, который непосредственно превращают в соединение формулы (21.7).
21 е). 4-[(4R,S)-(4-((1Н-Бензимидазол-2-ил-амино)-метил)фенил) -4-метил-2,5-диоксо-имидазолидин-1-ил] -2 -бензилоксикарбониламино-бутановая кислота (формула 21.7)
К раствору 180 мг (примерно 0,27 ммоль) соединения формулы (21.6), в виде сырого продукта, в 4 мл диоксана добавляют 0,27 мл 1 М раствора гидроксида лития и смесь перемешивают в течение ночи при комнатной температуре. Большую часть диоксана удаляют в вакууме, водный остаток доводят до рН 5 с помощью лимонной кислоты и водную фазу экстрагируют этилацетатом. После высушивания над сульфатом натрия, фильтрации и концентрирования фильтрата в вакууме остаток хроматографируют на силикагеле с помощью смеси дихлорметана с метанолом, уксусной кислотой и водой в соотношении 6:1:0,1:0,1. После концентрирования содержащих продукт фракций и сушки вымораживанием получают 107 мг (49%, в расчете на соединение формулы (21.5)) соединения формулы (21.7) в виде бесцветного твердого вещества.
Масс-спектр (ионизация электронным распылением (+)): 571 (М+Н)+.
21 ж). Синтез бензилового эфира 2-бензилоксикарбониламино-4-гидрокси-бутановой кислоты (формула 21.10)
Синтез осуществляют согласно реакционной последовательности 20 (см. в конце описания).
Суспензию 10 г (42 ммоль) соединения формулы (21.8) в 420 мл 0,1 М раствора гидроксида натрия в этаноле перемешивают в течение 16 часов при комнатной температуре. Реакционный раствор концентрируют, остаток смешивают с толуолом и растворитель удаляют в вакууме.
Добавляют 130 мл диметилформамида и 9,34 г (54,6 ммоль) бензилбромида и перемешивают в течение четырех дней при комнатной температуре. Добавляют 2,1 л 1 М раствора гидрокарбоната натрия и экстрагируют 3 раза этилацетатом. Объединенные этилацетатные фазы промывают с помощью 1 М раствора гидрокарбоната натрия и насыщенного раствора хлорида натрия и сушат над сульфатом магния. После отфильтровывания растворитель удаляют в вакууме и остаток хроматографируют на силикагеле с помощью смеси дихлорметана с ацетонитрилом в соотношении от 20:1 до 20:6. Содержащие продукт фракции концентрируют и остаток кристаллизуют из смеси диэтилового эфира с гексаном.
Получают 5,4 г (38%) соединения формулы (21.10) в виде бесцветных кристаллов.
Пример 22
3-[2-((4S)-(3-(1Н-Бензимидазол-2-ил- амино)-пропил)-2,5-диоксо-имидазолидин-1-ил) -ацетиламино)-(2S)-(2-хлор-бензилоксикарбониламино]-пропионовая кислота (формула 22.4)
Синтез осуществляют согласно реакционной последовательности 21 (см. в конце описания).
22а). 3-[2-(4S)-(3-(1-трет-Бутоксикарбонил -бензимидазол-2-ил-амино)-пропил)-2,5-диоксо -имидазолидин-1-ил)-ацетиламино] -(2S)-бензилоксикарбониламино-пропионовая кислота (формула 22.1)
К раствору 551 мг (1 ммоль) соединения формулы (5.5) в 4 мл смеси диоксана с водой в соотношении 1:1 добавляют 168 мг (2 ммоль) гидрокарбоната натрия и 437 мг (2 ммоль) ди-трет-бутилдикарбоната и смесь перемешивают в течение 16 часов при комнатной температуре. Растворитель удаляют в вакууме, остаток обрабатывают этилацетатом, этилацетатную фазу промывают 2%-ным раствором лимонной кислоты и насыщенным раствором хлорида натрия и сушат над сульфатом магния. После отфильтровывания растворитель удаляют в вакууме и получают 614 мг (94%) соединения формулы (22.1) в виде бесцветных кристаллов.
22 б). (2S)-Амино-3-[2-((4S)-(3-(1-трет-бутоксикарбонил- бензимидазол-2-ил-амино)-пропил) -2,5-диоксо-имидазолидин-1-ил)ацетиламино] -пропионовая кислота (формула 22.2)
Раствор 600 мг (0,92 ммоль) соединения формулы (22.1) в метаноле гидрируют в присутствии гидроксида палладия. Катализатор отфильтровывают, фильтрат концентрируют и остаток подвергают концентрированию 2 раза с толуолом в ротационном испарителе и после этого высушивают в высоком вакууме. Получают 385 мг (81%) соединения формулы (22.2).
22 в). 3-[2-((4S)-(3-(1-трет-Бутоксикарбонилбензимидазол -2-ил-амино)-пропил-2,5 -диоксо-имидазолидин-1-ил)-ацетиламино] -(2S)-(2-хлор -бензилоксикарбониламино)-пропионовая кислота (формула 22.3)
К раствору 61,7 мг (0,12 ммоль) соединения формулы (22.2) в 2,5 мл диметилформамида при 0oС добавляют 0,017 мл диизопропилэтиламина и затем раствор 28,4 мг (0,1 ммоль) N-(2-хлорбензилоксикарбонилокси)-сукцинимида и реакционную смесь перемешивают в течение 16 часов при комнатной температуре. Растворитель удаляют в вакууме и остаток распределяют между этилацетатом и 2%-ным раствором лимонной кислоты. Фазы разделяют и органическую фазу сушат над сульфатом магния.
После отфильтровывания, концентрирования фильтрата в вакууме и кристаллизации остатка из диэтилового эфира получают 36,5 мг (45%) соединения формулы (22.3) в виде бесцветных кристаллов.
22 г). 3-[2-(4S)-(3-(1Н-Бензимидазол-2-ил-амино) -пропил)-2,5-диоксо-имидазолидин-1-ил)-ацетиламино] -(2S) -(2-хлорбензилоксикарбониламино)-пропионовая кислота (формула 22.4)
Раствор 36,5 мг соединения формулы (22.3) в 3 мл 95%-ной трифторуксусной кислоты перемешивают в течение 1 часа при комнатной температуре. Трифторуксусную кислоту удаляют в вакууме и остаток подвергают концентрированию 2 раза с толуолом в ротационном испарителе. Остаток растворяют в метаноле и соединение формулы (22.4) осаждают диэтиловым эфиром. После центрифугирования остаток обрабатывают разбавленной уксусной кислотой и подвергают сушке вымораживанием. Получают 24 мг (77%) соединения формулы (22.4) в виде бесцветного твердого вещества.
Масс-спектр (ионизация электронным распылением (+)): 586 (М+Н)+.
Примеры 23-33
Получение соединений формул (23) - (33) осуществляют согласно реакционной последовательности 22 (см. в конце описания).
Пример 23
3-[2-((4S)-(3-(1Н-Бензимидазол-2-ил-амино)-пропил) -2,5-диоксо-имидазолидин-1-ил)-ацетиламино] -(2S)-(3,4 -диметокси-бензилоксикарбониламино)-пропионовая кислота (формула 23).
Маcc-спектр (ионизация электронным распылением (+)): 612 (M+1)+.
Пример 24
3-[2-((4S)-(3-(1H-Бензимидазол-2-ил-амино) -пропил)-2,5-диоксо-имидазолидин-1-ил)- ацетиламино] -(2S)-(3,4-метилендиокси- бензилоксикарбонил)-пропионовая кислота (формула 24).
Масс-спектр (ионизация электронным распылением (+)): 624 (М+1)+.
Пример 25
3-[2-((4S)-(3-(1Н-Бензимидазол-2-ил-амино)-пропил)-2,5-диоксо -имидазолидин-1-ил)-ацетиламино] -(2S)-(4-хлор- бензилоксикарбониламино)-пропионовая кислота (формула 25).
Масс-спектр (ионизация электронным распылением (+)): 586 (М+1)+.
Пример 26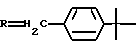
3-[2-((4S)-(3-(1Н-Бензимидазол-2-ил-амино) -пропил)-2,5-диоксо-имидазолидин-1-ил)-ацетиламино] -(2S)-(4-трет -бутил-бензилоксикарбониламино)-пропионовая кислота (формула 26).
Масс-спектр (ионизация электронным распылением (+)): 608 (М+1)+.
Пример 27
3-[2-((4S)-3-(1Н-Бензимидазол-2-ил-амино)-пропил) -2,5-диоксо-имидазолидин-1-ил) -ацетиламино]-(2S)-(3-хлор-бензилоксикарбониламино)-пропионовая кислота (формула 27).
Масс-спектр (ионизация электронным распылением (+)): 586 (М+1)+.
Пример 29
3-[2-((4S)-3-(1Н-Бензимидазол-2-ил-амино) -пропил)-2,5-диоксо-имидазолидин-1-ил)-ацетиламино] -(2S)-(4-трифторметил-бензилоксикарбониламино)-пропионовая кислота (формула 29).
Масс-спектр (ионизация электронным распылением (+)): 620 (М+1)+.
Пример 30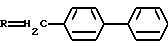
3-[2-((4S)-3-(1Н-Бензимидазол-2-ил-амино)-пропил) -2,5-диоксо-имидазолидин-1-ил)-ацетиламино]-(2S)-(4-фенил -бензилоксикарбониламино)-пропионовая кислота (формула 30).
Маcс-спектр (ионизация электронным распылением (+)): 628 (М+1)+.
Пример 31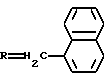
3-[2-((4S)-3-(1Н-Бензимидазол-2-ил-амино)-пропил) -2,5-диоксо-имидазолидин-1-ил)-ацетиламино] -(2S)-(нафталин-1 -ил-метоксикарбониламино)-пропионовая кислота (формула 31).
Масс-спектр (ионизация электронным распылением (+)): 602 (М+1)+.
Пример 32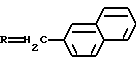
3-[2-((4S)-3-(1Н-Бензимидазол-2-ил-амино)-пропил) -2,5-диоксо-имидазолидин-1-ил)-ацетиламино] -(2S)-(нафталин -2-ил-метоксикарбониламино)-пропионовая кислота (формула 32).
Масс-спектр (ионизация электронным распылением (+)): 602 (M+1)+.
Пример 33
(2S)-(Бензофуран-3-ил-метоксикарбониламино) -3-[2-(4S)-(3-(1Н-бензимидазол-2-ил-амино)-пропил)-2,5-диоксо -имидазолидин-1-ил)-ацетиламино] -пропионовая кислота (формула 33).
Масс-спектр (ионизация электронным распылением (+)): 592 (М+1)+.
33 а). Получение сложных эфиров хлормуравьиной кислоты (формулы (23.2)-(33.2))
Синтез осуществляют согласно следующей общей методике получения:
К раствору 2,2 эквивалентов бис-трихлорметилкарбоната в абсолютном дихлорметане при 0oС прикапывают раствор 6 эквивалентов соответствующего спирта (HO-R) и 6 эквивалентов пиридина в абсолютном дихлорметане. Затем смесь перемешивают в течение двух часов при комнатной температуре, растворитель удаляют в вакууме, остаток обрабатывают этилацетатом или эфиром, смесь выдерживают в течение 30 минут при комнатной температуре и отфильтровывают возможно выпадающий осадок. После удаления растворителя в вакууме остаток высушивают в высоком вакууме и прямо используют для синтезов соединений формул (23.1)-(33.1).
33 б). Получение соединений формул (23.1)-(33.1)
Синтез осуществляют согласно следующей общей методике получения:
К раствору 1 эквивалента N-гидроксисукцинимида в тетрагидрофуране при 0oС добавляют 1 эквивалент соответствующего сложного эфира хлормуравьиной кислоты формулы (23.2)-(33.2) и 1 эквивалент диизопропилэтиламина (DIPEA). Перемешивают в течение 30 минут при 0oС и 45 минут при комнатной температуре и этот раствор добавляют к раствору 1 эквивалента соединения формулы (22.2) в диметилформамиде. Смесь перемешивают при комнатной температуре вплоть до окончания реакции и растворитель удаляют в вакууме. Остаток обрабатывают этилацетатом и этилацетатную фазу промывают 2 раза водным раствором лимонной кислоты (рН=3) и насыщенным раствором хлорида натрия. После высушивания над сульфатом натрия, фильтрации и удаления растворителя в вакууме остаток хроматографируют на силикагеле. После концентрирования содержащих продукт фракций получают соединения формул (23.1)-(33.1).
33 в). Получение соединений формул (23)-(33)
Соединения формул (23)-(33) получают из соединений формул (23.1)-(33.1) путем отщепления трет-бутоксикарбонильной группы с помощью 95%-ной трифторукоусной кислоты, как описано в случае получения соединения формулы (22.4) из соединения формулы (22.3).
Пример 34
3-[8-(3-(1Н-Бензимидазол-2-ил-амино)-пропионил)-2,4-ди-оксо-1,3,8-триаза-спиро[4,5] дец-3-ил] -(2S)-бензилокси-карбониламино-пропионовая кислота (формула 34.12)
Синтез осуществляют согласно реакционной последовательности 23 (см. в конце описания).
34 а). трет-Бутиловый эфир 2,4-диоксо-1,3,8-триаза-спиро-[4,5]-декан-8-карбоновой кислоты (формула 34.2)
К раствору 5 г (25,1 ммоль) N-трет-бутоксикарбонил-4-пиперидона (формула 34.1) и 24,01 г (250 ммоль) карбоната аммония в 80 мл смеси этанола с водой в соотношении 1: 1 добавляют 2,12 г (32,6 ммоль) цианида калия и смесь перемешивают 5 часов при 60oС. Затем путем добавления 6 н. соляной кислоты устанавливают рН 6,3 и перемешивают следующие 1,5 часа при 60oС. Осадок отсасывают и высушивают в высоком вакууме. Получают 3,43 г соединения формулы (34.2) в виде бесцветного твердого вещества. Путем экстракции фильтрата дихлорметаном, высушивания органической фазы над сульфатом натрия, фильтрации и удаления растворителя в вакууме получают дальнейший 1,0 г соединения формулы (34.2). Общий выход соединения формулы (34.2) составляет 4,43 г (66%); бесцветное твердое вещество.
34 б). Метиловый эфир N-тритил-L-серина (формула 34.3)
К раствору 6 г (38,56 ммоль) гидрохлорида метилового эфира L-серина и 7,8 г (77,12 ммоль) триэтиламина в абсолютном тетрагидрофуране при 0oС добавляют раствор 10,75 г (38,56 ммоль) тритилхлорида и раствор перемешивают 4 часа при 0oС и 2 дня при комнатной температуре. Растворитель удаляют в вакууме и остаток распределяют между дихлорметаном и 10%-ным водным раствором лимонной кислоты. Фазы разделяют, органическую фазу промывают водой и сушат над сульфатом натрия. После отфильтровывания растворитель удаляют в вакууме и остаток хроматографируют на силикагеле с помощью смеси гептана с этилацетатом в соотношении 6:4. После концентрирования содержащих продукт фракций получают 8 г (58%) соединения формулы (34.3).
34 в). трет-Бутиловый эфир 3-[2-метоксикарбонил-(2S)-(тритиламино)-этил] -2,4-диоксо -1,3,8-триаза-спиро[4,5] декан-8-карбоновой кислоты (формула 34.4)
К раствору 3,72 г (10,3 ммоль) соединения формулы (34.3) и 3,5 г (13,34 ммоль) трифенилфосфина в 20 мл абсолютного тетрагидрофурана добавляют раствор 3,6 г (13,37 ммоль) соединения формулы (34.2) в 15 мл абсолютного тетрагидрофурана. К этому раствору добавляют 2,11 мл (13,37 ммоль) диэтил-азо-дикарбоксилата и перемешивают реакционную смесь при комнатной температуре вплоть до окончания реакции. Растворитель удаляют в вакууме и остаток хроматографируют на силикагеле с помощью смеси гептана с этилацетатом. После концентрирования содержащих продукт фракций получают 6 г (95%) соединения формулы (34.4).
34 г). трет-Бутиловый эфир 3-((2S)-амино-2-метоксикарбонилэтил)-2,4-диоксо -1,3,8-триаза-спиро[4,5]декан-8-карбоновой кислоты (формула 34.5)
Раствор 4,6 г (7,5 ммоль) соединения формулы (34.4) в 180 мл смеси дихлорметана с метанолом и трифторуксусной кислотой в соотношении 95,5:3:1,5 перемешивают в течение 10 минут при комнатной температуре. Реакционную смесь концентрируют и остаток хроматографируют на силикагеле. После концентрирования содержащих продукт фракций получают 3,14 г (87%) соединения формулы (34.5).
34 д). трет-Бутиловый эфир 3-(2S)-бензилоксикарбонилами-но-2-метоксикарбонилэтил) -2,4-диоксо-1,3,8-триаза-спиро[4,5] декан-карбоновой кислоты (формула 34.6)
К раствору 3,14 г (8,48 ммоль) соединения формулы (34.5) и 2,11 г (8,48 ммоль) N-бензилоксикарбонилокси-сукцинимида в 80 мл абсолютного диметилформамида добавляют раствор 2,08 г (16,1 ммоль) диизопропилэтиламина в 25 мл абсолютного диметилформамида и смесь перемешивают в течение трех часов при комнатной температуре. Растворитель удаляют в вакууме и остаток хроматографируют на силикагеле с помощью смеси гептана с этилацетатом в соотношении 6: 4. После концентрирования содержащих продукт фракций получают соединение формулы (34.6).
34 е). Гидрохлорид метилового эфира (2S)-бензилоксикарбонил амино-3-(2,4-диоксо-1,3,8-триаза-спиро[4,5] дец-3-ил)-пропионовой кислоты (формула 34.7)
Раствор 4,7 г (9,3 ммоль) соединения формулы (34.6) в 100 мл 90%-ной трифторуксусной кислоты перемешивают в течение 45 минут при комнатной температуре. Трифторуксусную кислоту удаляют в вакууме и остаток хроматографируют на Сефадексе LH 20 с помощью смеси воды с бутанолом и уксусной кислотой в соотношении 43: 4,3:3,5. Содержащие продукт фракции концентрируют и подвергают сушке вымораживанием. После добавления 1 н. соляной кислоты и снова сушки вымораживанием получают 1,99 г (53%, в расчете на соединение формулы (34.5)) соединения формулы (34.7) в виде бесцветного твердого вещества.
34 ж). Метиловый эфир 3-[8-(3-(1Н-бензимидазол-2-ил-амино)-пропионил)-2,4-диоксо-1,3,8-триаза-спиро[4,5] дец-3-ил] -(2S)-бензилоксикарбониламино-пропионовой кислоты (формула 34.11)
Синтез соединения формулы (34.11) осуществляют путем реакции сочетания соединения формулы (34.7) с соединением формулы (34.10), как описано в примере 15 для синтеза соединения формулы (15.3) из соединения формулы (15.2).
34 з). 3-[8-(3-(1Н-Бензимидазол-2-ил-амино)-пропионил)-2,4 -диоксо-1,3,8-триаза-спиро[4,5] дец-3-ил] -(2S)-бензилоксикарбониламино-пропионовая кислота (формула 34.12)
Синтез соединения формулы (34.2) осуществляют путем расщепления сложного эфира формулы (34.11), как описано в примере 3 в случае синтеза соединения формулы (3.11) из соединения формулы (3.10).
Масс-спектр (ионизация электронным распылением (+)): 578 (М+Н)+.
34 и). Синтез 3-(1Н-бензоимидазол-2-ил-амино)-пропионовой кислоты (формула 34.10)
Соединение формулы (34.10) получают согласно реакционной последовательности 24 (см. в конце описания).
а). 3-[3-(2-Нитро-фенил-)тиомочевино]-пропионовая кислота (формула 34.8)
К раствору 5 г (27,75 ммоль) 2-нитрофенил-изотиоцианата и 2,5 г (27,75 ммоль) β-аланина в 80 мл диметилформамида добавляют 3,8 мл (27,75 ммоль) триэтиламина и перемешивают вплоть до окончания реакции. Растворитель удаляют в вакууме и остаток распределяют между этилацетатом и раствором гидросульфата калия с сульфатом калия. Фазы разделяют и органическую фазу сушат над сульфатом натрия. После отфильтровывания растворитель удаляют в вакууме и остаток хроматографируют на силикагеле. После концентрирования содержащих продукт фракций получают 5,3 г (71%) соединения формулы (34.8).
б). 3-[3-(2-Амино-фенил)-тиомочевино]-пропионовая кислота (формула 34.9)
5,3 г (19,7 ммоль) соединения формулы (34.8) в 410 мл насыщенного аммиаком этанола гидрируют при комнатной температуре в течение трех часов в присутствии 6,44 г 10%-ного палладия-на-угле. Катализатор отфильтровывают, фильтрат концентрируют в вакууме и остаток (1,9 г; соединение формулы (34.9) в виде сырого продукта) прямо используют для синтеза соединения формулы (34.10).
в). 3-(1Н-Бензимидазол-2-ил-амино)-пропионовая кислота (формула 34.10)
Смесь из соединения формулы (34.9), 3,44 г (14,79 ммоль) оксида ртути и 50 мг серы в 40 мл этанола в течение 5 часов кипятят с обратным холодильником. После отфильтровывания фильтрат концентрируют, остаток вместе с 6 н. соляной кислотой в течение 1 часа кипятят с обратным холодильником и после этого подвергают сушке вымораживанием. Получают фракцию 1 соединения формулы (34.9). Остаток на фильтре многократно вываривают с водой и объединенные водные фазы подвергают сушке вымораживанием. Получают фракцию 2 соединения формулы (34.9). Фракции 1 и 2 объединяют и хроматографируют на Сефадексе LH 20 с помощью смеси воды с бутанолом и уксусной кислотой в соотношении 43:4,3: 3,5. Содержащие продукт фракции концентрируют и подвергают сушке вымораживанием. Получают 340 мг (8% в расчете на соединение формулы (34.8)) соединения формулы (34.10) в виде бесцветного твердого вещества.
Пример 35
3-[2-(4(Е, соответственно, Z)-(3-(1Н-Бензимидазол-2-ил-амино)-пропилиден)-2,5-диоксо-имидазолидин-1-ил)-ацетиламино] -(2S)-бензилоксикарбониламино-пропионовая кислота (формула 35.8, форма Е, соответственно, Z)
Синтез осуществляют согласно реакционной последовательности 25 (см. в конце описания).
35 а). Метиловый эфир 3-амина-3-(диметоксифосфорил)-пропионовой кислоты (формула 35.2)
10 г (30,19 ммоль) триметилового эфира Z-фосфоноглицина (формула 35.1) в 300 мл метанола гидрируют в присутствии 10%-ного палладия-на-угле. Спустя 1 час катализатор отфильтровывают, и фильтрат концентрируют в вакууме. Получают 4,6 г соединения формулы (35.2) в виде сырого продукта, который используют непосредственно для синтеза соединения формулы (35.3).
35 б). Метиловый эфир 3-(диметоксифосфорил)-3-(3-этоксикарбонилметил-мочевино)-пропионовой кислоты (формула 35.3)
К раствору соединения формулы (35.2) в 20 мл диметилформамида добавляют 2,62 мл (23,4 ммоль) этилового эфира изоцианатоуксусной кислоты. После выдерживания в течение 16 часов при комнатной температуре добавляют следующие 0,262 мл (2,34 ммоль) этилового эфира изоцианатоуксусной кислоты и реакционную смесь перемешивают следующие 2 часа при комнатной температуре. Растворитель удаляют в вакууме и остаток распределяют между дихлорметаном и раствором гидросульфата калия с сульфатом калия. Фазы разделяют и органическую фазу промывают водой. После высушивания органической фазы над сульфатом натрия, отфильтровывания и концентрирования фильтрата в вакууме получают 6,2 г (63%, в расчете на соединение формулы (35.1) соединения формулы (35.3).
35 в). Этиловый эфир [4(Е, соответственно, Z)-(3-тpeт-бутоксикарбониламино-пропилиден)-2,5-диоксо-имидазолидин-1-ил] -уксусной кислоты (формула 35.4, форма Е, соответственно, Z)
К раствору 451 мг (18,8 ммоль) натрия в абсолютном этаноле добавляют раствор 5,8 г (17,84 ммоль) соединения формулы (35.3) в 30 мл абсолютного этанола. К этому раствору добавляют раствор соединения формулы (35.9), полученного из β-аланина согласно О.Р. Goel и др., Org. Synth. 67, 69 (1988). После перемешивания в течение трех часов при комнатной температуре растворитель удаляют в вакууме и остаток распределяют между водой и диэтиловым эфиром. Фазы разделяют и органическую фазу сушат над сульфатом натрия. После отфильтровывания остаток хроматографируют на силикагеле с помощью смеси дихлорметана с метанолом в соотношении 99:1. Получают 2,25 г соединения формулы (35.4, форма Е или Z) и 1,95 г соединения формулы (35.4, форма Z или Е). Общий выход составляет 4,2 г (69%) соединения формулы (35.4).
35 г). Соль трифторуксусной кислоты этилового эфира [4(Е, соответственно, Z)-(3-аминопропилиден)-2,5-диоксо-имидазолидин-1-ил]-уксусной кислоты (соединение формулы 35.5, форма Е, соответсвенно Z)
Раствор 2,25 г (6,6 ммоль) соединения формулы (35.4, форма Z или Е) в 25 мл 90%-ной трифторуксусной кислоты перемешивают в течение 1 часа при комнатной температуре. Трифторуксусную кислоту удаляют в вакууме, остаток разбавляют водой и подвергают сушке вымораживанием. Получают 2,2 г (94%) соединения формулы 35.5, форма Z или Е). Аналогичным образом получают из 1,95 г (5,71 ммоль) соединения формулы (35.4, форма Е или Z) 1,95 г (97%) соединения формулы (35.5, форма Е или Z).
35 д). Этиловый эфир [4(Е, соответсвенно, Z)-(3-изотиоцианатопропилиден)-2,5-диоксо-имидазолидин-1-ил] -уксусной кислоты (формула 35.6, форма Е, соответственно, Z)
Синтез соединения формулы (35.6, форма Е), соответственно соединения формулы (35.6, форма Z), из соединения формулы (35,5, форма Е), соответственно соединения формулы (35.5, форма Z), осуществляют как описано в примере 11 в случае синтеза соединения формулы (11.2) из соединения формулы (11.1).
35 е). Гидрохлорид [4(Е, соответственно, Z)-(3-(1Н-бензимидазол-2-ил-амино)-пропилиден)-2,5-диоксо-имидазолидин-1-ил] -уксусной кислоты (формула 35.7, форма Е, соответственно, Z)
Синтез соединения формулы (35.7, форма Е), соответственно соединения формулы (35.7, форма Z), из соединения формулы (35.6, форма Е), соответственно из соединения формулы (35.6, форма Z), осуществляют как описано в примере 15 в случае синтеза соединения формулы (15.2) из соединения формулы (11.2).
35 ж). 3-[2-(4(E, соответственно, Z)-(3-(1Н-бензимидазол-2-ил-амино)-пропилиден)-2,5-диоксо-имидазолидин-1-ил)-ацетиламино] -(2S)-бензилоксикарбониламино-пропионовая кислота (формула 35.8, форма Е, соответственно, Z)
Синтез соединения формулы (35.8, форма Е), соответственно (35.8, форма Z), из соединения формулы (35.7, форма Е), соответственно (35.7, форма Z), осуществляют как описано в примере 15 в случае синтеза соединения формулы (15.3) из соединения формулы (15.2).
Масс-спектр (ионизация электронным распылением (+) соединения формулы (35.8, форма Е), соответственно соединения формулы (35.8, форма Z): 550 (М+Н)+.
Пример 36
3-[2-(4(Z, соответственно, Е)-(3-(1Н-бензимидазол-2-ил-амино)-пропилиден)-5-оксо-2-тиоксо-имидазолидин-1-ил)-ацетиламино] -(2S)-бензилоксикарбониламино-пропионовая кислота (формула 36, форма Z, соответственно, Е)
Синтез соединения формулы (36, форма Z), соответственно формулы (36, форма Е), осуществляют как описано в примере 35, причем здесь соединение формулы (35.2) вводят во взаимодействие с метиловым эфиром изотиоцианатоуксусной кислоты вместо этилового эфира изотиоцианатоуксусной кислоты. Дальнейший синтез осуществляют как описано в примере 35.
Масс-спектр (ионизация электронным распылением (+) соединения формулы (36, форма Z), соответственно соединения формулы (36, форма Е): 566 (М+Н)+.
Пример 37
3-(4-E/Z-(4-Гуанидинокарбонилбензилиден)-2,5-диоксо-имидазолидин-1-ил)-(2S)-N-бензилоксикарбонил-аланин (соединение формулы 37.5, E/Z)
Синтез осуществляют согласно реакционной последовательности 26 (см. в конце описания).
37 а). трет-Бутиловый эфир 2-изоцианато-Z-аланина (формула 37.1)
Раствор 2,94 г (10 ммоль) Z-Dap-O-трет-бутил (формула (1.6) в 80 мл дихлорметана вместе с 80 мл насыщенного раствора гидрокарбоната натрия при интенсивном перемешивании охлаждают на бане со льдом примерно до 0oС. После прекращения процесса перемешивания и разделения фаз в органическую фазу вносят быстро 10,4 мл 1,93 М раствора фосгена в толуоле и оставляют снова реагировать при эффективном перемешивании и наружном охлаждении. Спустя следующие 10 минут фазы разделяют, водную фазу экстрагируют еще дважды по 40 мл дихлорметаном. Объединенные органические экстракты сушат над безводным сульфатом магния, отфильтровывают и освобождают от растворителя в вакууме. Получают примерно 3,0 г бесцветного масла, которое без дальнейшей очистки используют для синтеза соединения формулы (37.2).
37 б). трет-Бутиловый эфир N'-(диметокси-фосфорил)-(метоксикарбонил)-метил-уреидо -N-(2S)-бензилоксикарбонил-амино-3-пропионовой кислоты (формула 37.2)
В атмосфере защитного газа аргона полученное в стадии 37 а) количество соединения формулы (37.1) растворяют примерно в 30 мл дихлорметана и при перемешивании и при комнатной температуре добавляют в полученный раствор 1,97 г соединения формулы (35.2), растворенные примерно в 50 мл дихлорметана. Спустя примерно 2 часа реакция заканчивается. Раствор сначала промывают с помощью 100 мл 1 н. раствора гидросульфата калия, затем с помощью 100 мл воды, органическую фазу сушат над безводным сульфатом магния и отфильтровывают. После удаления растворителя в вакууме получают примерно 4,6 г чистого соединения формулы (37.2) (89%).
37 в). трет-Бутиловый эфир Е-, соответственно, Z-3-(4-(4-метоксикарбонил-бензилиден)-2,5-диоксо-имидазолидин-1-ил)-2-N-бензилоксикарбониламино-пропионовой кислоты (формула (37.3)
1,55 г (3 ммоль) соединения формулы (37.2) растворяют примерно в 8 мл метанола и смешивают с 0,6 мл (примерно 3,3 ммоль) 30%-ного раствора метанолята натрия в метаноле. Затем медленно (в атмосфере аргона и при перемешивании при комнатной температуре) к полученному раствору прикапывают 8 мл метанольного раствора, содержащего 0,59 г (3,6 ммоль) метилового эфира формилбензойной кислоты. Спустя примерно 1 час реакция заканчивается. Раствор концентрируют в вакууме, остаток обрабатывают этилацетатом, промывают водой, сушат, отфильтровывают и концентрируют. Получают 1,6 г смеси E/Z соединения формулы (37.3).
Путем хроматографии на силикагеле в качестве носителя и с помощью смеси этилацетата с н-гептаном в соотношении 2:1 в качестве элюирующего средства разделяют диаcтереомеры: получают 0,85 г Z-изомера соединения формулы (37.3) и 0,7 г Е-изомера соединения формулы (37.3).
37 г). трет-Бутиловый эфир Е-, соответственно, Z-3-(4-(4-гуанидинокарбонилбезилиден)-2,5-диоксо-имидазолидин-1-ил)-(2S)-N-бензилоксикарбониламино-пропионовой кислоты (формула 37.4, форма Е, соответственно, Z)
0,262 г (0,5 ммоль) соединения формулы (37.2, форма Z) растворяют в 5 мл абсолютного тетрагидрофурана, добавляют 0,148 г (2,5 ммоль) гуанидина и смесь в течение 20 часов кипятят с обратным холодильником. После удаления растворителя в вакууме остаток хроматографируют на силикагеле с помощью смеси метанола с дихлорметаном в соотношении 1:10. Получают 0,05 г соединения формулы (37.4, форма Z). Аналогичным образом превращают соединение формулы (37.3, форма Е), причем в качестве растворителя используют 1,2-диметоксиэтан. Получают 0,12 г соединения формулы (37.4, форма Е).
37 д). Соль трифторуксусной кислоты Е, соответственно, Z-3-(4-(4-гуанидинокарбонилбензилиден)-2,5-диоксо-имидазолидин-1-ил)- (2S)-N-бензилкарбониламино-пропионовой кислоты (формула 37.5, форма Е, соответственно, Z)
0,12 г соединения формулы (37.4, форма Е) растворяют примерно в 10 мл охлажденной льдом 90%-ной трифторуксусной кислоты и перемешивают примерно в течение полутора часов при комнатной температуре в атмосфере защитного газа аргона. После удаления растворителя в вакууме остаток хроматографируют на RP18 с помощью смеси метанола с водой. Содержащие продукт фракции концентрируют и получают 0,06 г соединения формулы (37.5, форма Е). Аналогичным образом из 0,05 г соединения формулы (37.4, форма Z) получают 0,02 г соединения формулы (37.5, форма Z).
Пример 38
3-(4-E/Z-(4-(3,4,5,6-Тетрагидропиримидин-2-ил)-аминокарбонилбензилиден) -2,5-диоксо-имидазолидин-1-ил)-(2S)-N-бензилоксикарбонил-аланин (формула 38.4, E/Z)
Синтез осуществляют согласно реакционной последовательности 27 (см. в конце описания).
38 а). трет-Бутиловый эфир Е-, соответственно, Z-3-(4-(2-фенилтио)-этоксикарбонилбензилиден) -2,5-диоксо-имидазолидин-1-ил)-(2S)-N-бензилоксикарбониламино-пропионовой кислоты (формула 38.1, форма Е, соответственно, Z)
Аналогично превращению в примере 37, стадия в), из 0,259 г (0,5 ммоль) соединения формулы (37.2) и 0,172 г (0,6 ммоль) (2-фенилтио) этилового эфира 4-формилбензойной кислоты получают 0,157 г соединения формулы (38.1), формы Z, и 0,153 г соединения формулы (38.1), формы Е (общий выход составляет примерно 91%), которые выделяют индивидуально с помощью хроматографии.
38 б). трет-Бутиловый эфир Е-, соответственно, Z-3-(4-(карбоксилбензилиден)-2,5-диоксо-имидазолидин-1-ил) -2-N-бензилоксикарбониламино-пропионовой кислоты (формула 38.2, форма Е, соответственно Z)
0,155 г (0,24 ммоль) соединения формулы (38.1, форма Z) растворяют в 5 мл безводного дихлорметана и смешивают с 0,098 г (0,4 ммоль) 65%-ной мета-хлорнадбензойной кислоты. Спустя 1,5 часа реакция заканчивается. Дихлорметановый раствор промывают примерно 10%-ным раствором бисульфата натрия и затем водой. После высушивания над сульфатом магния, отфильтровывания и удаления растворителя получают 0,15 г сложного фенилсульфонилэтилового эфира, который без дальнейшей обработки вносят в смесь из 8 мл диоксана, 1,4 мл метанола, а также 0,19 мл 1 н. раствора гидроксида натрия. Спустя 16 часов растворители удаляют в вакууме и остаток хроматографируют на силикагеле с помощью смеси дихлорметана с метанолом в соотношении 95:5. Выход соединения формулы (38.2, Z-форма) составляет 0,033 г. Аналогичным образом из 0,157 г соединения формулы (38.1, Е-форма) (0,24 ммоль) получают 0,051 г соединения формулы (38.2, Е-форма).
38 в). трет-Бутиловый эфир 3-(4-Е/Z-(4-(3,4,5,6-тетрагидро-пиримидин-2-ил)-аминокарбонилбензилиден)-2,5-диоксо-имидазолидин-1-ил)-(2S)-N-бензилоксикарбониламино-пропионовой кислоты (формула 38.3, форма E/Z)
Согласно методике синтеза соединения формулы (11.6) (методика 11 е).), 0,05 г соединения формулы (38.2, Е-форма) (0,1 ммоль) и 0,01 г (0,1 ммоль) 2-амино-3,4,5,6-тетрагидропиримидина вводят во взаимодействие с эквивалентным количеством TOTU (0,033 г) в диметилформамиде в присутствии диизопропилатиламина. Обычная обработка дает 0,06 г соединения формулы (38.3, Е-форма), которое вводят во взаимодействие без дальнейшей очистки. Таким же образом из 0,03 г соединения формулы (38.2, Z-форма) получают 0,025 г сырого продукта формулы (38.3, Z-форма).
38 г). 3-(4-E/Z-(4-(3,4,5,6-Тетрагидропиримидин-2-ил)-амино-карбонилбензилиден)-2,5-диоксо-имидазолидин-1-ил)-N-бензилоксикарбониламино-пропионовая кислота (формула (38.4, E/Z-форма)
0,055 г соединения формулы (38.3, Е-форма) в 2 мл 90%-ной трифторуксусной кислоты перемешивают в течение двух часов при охлаждении льдом. Удаление растворителя в вакууме и сушка вымораживанием остатка дают 0,02 г соединения формулы (38.4, Е-форма). Аналогичным образом, из 0,02 г соединения формулы (38.3, Z-форма) получают 0,012 г соединения формулы (38.4, Z-форма).
Подавление рассасывания костей с помощью предлагаемых согласно изобретению соединений можно определять, например, с помощью теста на рассасывание за счет остеокластов ("PIT"-анализ), например, согласно международной заявке на патент 95/32710.
Тест-методы, согласно которым можно определять антагонистическое действие предлагаемых согласно изобретению соединений на рецептор витронектина αVβ3, описываются ниже:
Тест-метод 1:
Ингибирование связи человеческого витронектина (Vn) на человеческом рецепторе витронектина (VnR) αVβ3 ELISA-тест: (твердофазный иммуноферментный анализ) (Тест-метод 1 при перечислении результатов испытания сокращенно обозначают Vn/Vnr).
1. Очистка человеческого витронектина
Человеческий витронектин выделяют из человеческой плазмы и очищают путем аффинной хроматографии по методу Yatohyo и др., Cell Structure and Function, 23, 281-292 (1988).
2. Очистка человеческого рецептора витронектина 
Человеческий рецептор витронектина получают из человеческой плаценты по методу Pytela и др. , Methods Enzymol., 144. 475 (1987). Человеческий рецептор витронектина αVβ3 также можно получать из некоторых линий клеток (например, из 293 клеток человеческой эмбриональной линии почечных клеток) которые контрансфицированы с ДНК-последовательностями обеих субъединиц αV и β3 рецептора витронектина. Субъединицы экстрагируют октилгликозидом и затем хроматографируют при использовании конканавалина А, гепарин-сефарозы и S-300.
3. Моноклональные анитела
Мышиные моноклональные анитела, специфические к субъединице β3 рецептора витронектика, получают по методу Newman и др., Blood, 227-232 (1985), или подобным способом.
Конъюгат кролика Fab 2 против мыши Fc на пероксидазе из хрена (HRP против мышиного Fc) отнесен к Pel Freeze (каталог No 715305-1).
4. Твердофазный иммуноферментный анализ
Микротитрационные пластинки Nunc Maxisorb с 96-ю лунками вместе с раствором человеческого витронектина (0,002 мг/мл, 0,05 мл/лунку) в ЗФР (забуференный фосфатом физиологический раствор) выдерживают в течение ночи при 4oС. Пластинки промывают два раза с помощью ЗФР с 0,05% Твина-20 и блокируют путем инкубирования (60 минут) с альбумином сыворотки крупного рогатого окота (BSA, 0,5%, класса качества "для радиоиммуноанализа" или выше) в ТРИС-НСl (50 ммоль), NaCl (100 ммоль), MgCl2 (1 ммоль), CaCl2 (1 ммоль), МnСl2 (1 ммоль), рН=7. Готовят растворы известных ингибиторов и тест-веществ в концентрации 2•10-12-2•10-6 моль/л в буфере для анализа [BSA (0,5%, класса качества "для радиоиммуноанализа" или выше) в ТРИС-НСl (50 ммоль/л), NaCl (100 ммоль), MgCl2 (1 ммоль), CaCl2 (1 ммоль), MnCl2 (1 ммоль), рН=7].
Блокированные пластинки разгружают и в каждую лунку вносят, смотря по обстоятельствам, по 0,025 мл вышеупомянутого раствора, который имеет определенную концентрацию (2•10-12-2•10-6) либо известного ингибитора, либо тест-вещества. 0,025 мл раствора рецептора витронектина в тест-буфере (0,03 мг/мл) вносят пипеткой в каждую лунку пластинки и пластинку инкубируют при комнатной температуре в течение 60-180 минут на аппарате для встряхивания. В этот промежуток времени готовят раствор (6 мл на пластинку) специфического к β3-субъединице рецептора витронектина мышиного моноклонального антитела в тест-буфере (0,0015 мг/мл). К этому раствору добавляют второе кроличье антитело (0,001 мл исходного раствора/6 мл раствора мышиного моноклонального против β3 антитела), которое представляет собой конъюгат HRP-антитела против мышиного Fc, и эту смесь из мышиного против β3 антитела и конъюгата кроличьего против мишиного Fс HRP-антитела инкубируют в течение времени инкубации ингибитора рецептора.
Тест-пластинки промывают 4 раза раствором ЗФР, который содержит 0,05% Твина-20, и в каждую лунку пластинки пипеткой вносят по 0,05 мл/лунку смеси антител и инкубируют в течение 60-180 минут.
Пластинку промывают 4 раза с помощью ЗФР с 0,05% Твина-20 и затем проявляют с помощью 0,05 мл/лунку раствора ЭФР, который содержит 0,67 мг/мл о-фенилендиамина и 0,012% перикиси водорода. Альтернативно этому можно использовать о-фенилендиамин в буфере (рН 5), который содержит 500 ммоль Nа3РO4 и 0,22 ммоль лимонной кислоты. Появление окраски фиксируют с помощью 1 н. серной кислоты (0,05 мл на лунку).
Для каждой лунки измеряют поглощение при 492-405 нм и данные оценивают согласно стандартным методам.
Тест-метод 2
Ингибирование связывания кистрина с человеческим рецептором витронектина (VnR) αVβ3: твердофазный иммуноферментный анализ. (Тест-метод 2 при перечислении результатов испытания (см. таблицу) сокращенно обозначают кистрин/VnR).
1. Очистка кистрина
Кистрин очищают по методу Dennis и др., как описано в Рrос. Natl. Acad. Sci. USA, 87, 2471-2475 (1989), и PROTEINS: Structure, Function and Genetics, 15, 312-321 (1993).
2. Очистка человеческого рецептора витронектина (αVβ3)
см. Тест-метод 1.
3. Моноклональные антитела - ELISA-тест
см. Тест-метод 1.
4. Твердофазный иммуноферментный анализ
Способность веществ ингибировать связывание кистрина с рецептором витронектина можно определять с помощью ELISA-теста (твердофазного иммуноферментного анализа). Для этой цели микротитрационные планшеты Nunc с 96 лунками выдерживают с раствором кистрина (0,002 мг/мл) по методу Dennis и др., как описано в PROTEINS: Structure, Function and Genetics, 15, 312-321 (1993). Дальнейшее экспериментальное осуществление твердофазного иммуноферментного анализа проводят как в случае тест-метода 1, пункт 4.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ЦИКЛОАЛКИЛЬНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ РЕЗОРБЦИИ КОСТИ И АНТАГОНИСТОВ РЕЦЕПТОРА ВИТРОНЕКТИНА | 1997 |
|
RU2180331C2 |
| НОВЫЕ ИМИНОПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ РЕЗОРБЦИИ КОСТИ И АНТАГОНИСТОВ РЕЦЕПТОРА ВИТРОНЕКТИНА | 1997 |
|
RU2197476C2 |
| АНТАГОНИСТЫ ВИТРОНЕКТИНОВОГО РЕЦЕПТОРА, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ | 1997 |
|
RU2198892C2 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ПУРИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 1997 |
|
RU2228335C2 |
| ЗАМЕЩЕННЫЕ АЗОЛЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1991 |
|
RU2047604C1 |
| ПЯТИЧЛЕННЫЕ ГЕТЕРОЦИКЛЫ В КАЧЕСТВЕ ИНГИБИТОРОВ АДГЕЗИИ ЛЕЙКОЦИТОВ И VLA-4-АНТАГОНИСТОВ | 1997 |
|
RU2229296C2 |
| ЗАМЕЩЕННЫЕ 6- И 7-АМИНОТЕТРАГИДРОИЗОХИНОЛИН-КАРБОНОВЫЕ КИСЛОТЫ | 1998 |
|
RU2212405C2 |
| АМИДЫ СУЛЬФАМИДО- И СУЛЬФАМИДОКАРБОНИЛПИРИДИН-2-КАРБОНОВЫХ КИСЛОТ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2129545C1 |
| НОВЫЕ КОНЪЮГАТЫ СВЯЗЫВАЮЩЕЕ СОЕДИНЕНИЕ - АКТИВНОЕ СОЕДИНЕНИЕ (ADC) И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2610336C2 |
| НОВЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ КАТЕПСИНА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ, ИХ ПРИМЕНЕНИЕ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2002 |
|
RU2316546C2 |
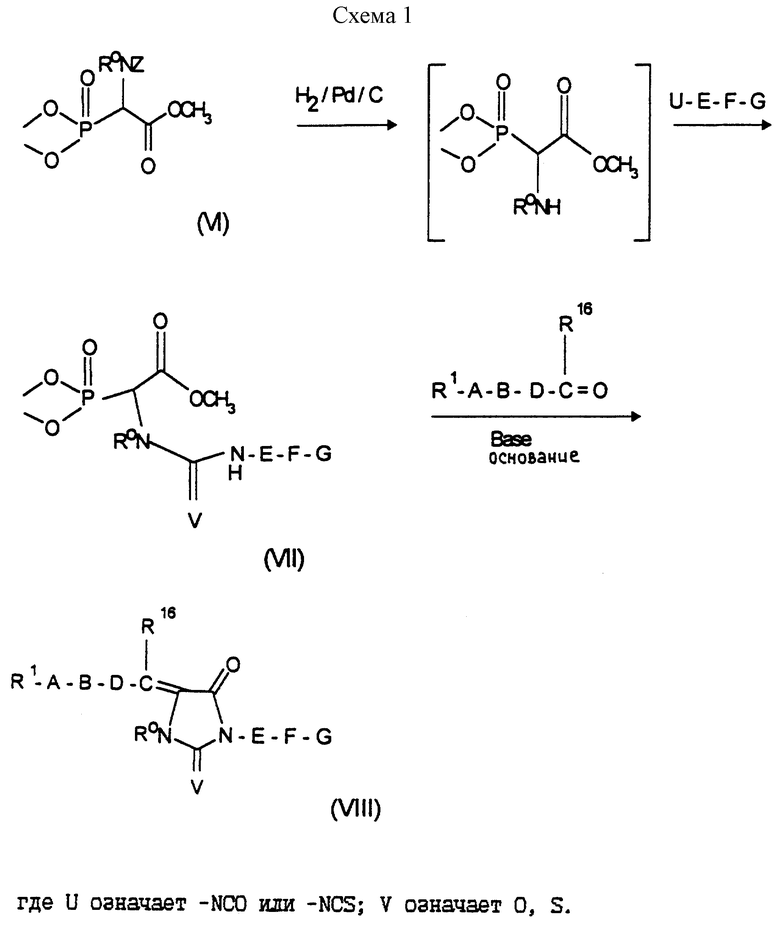
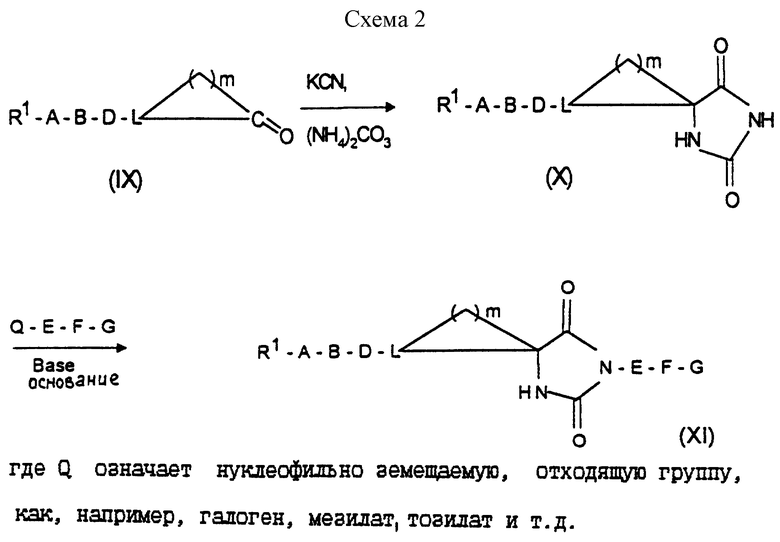








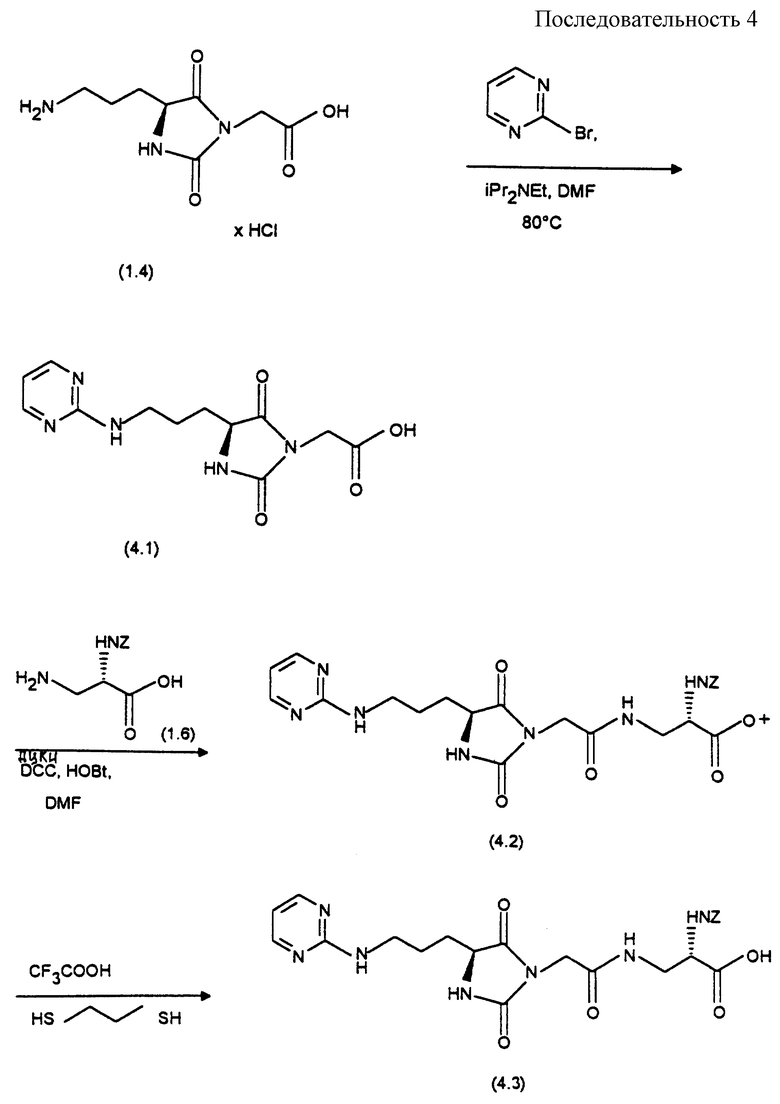
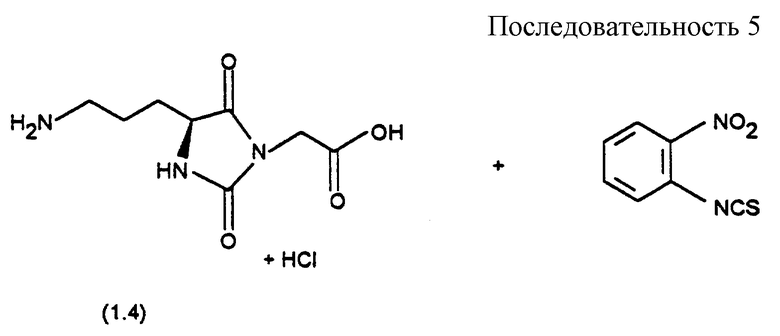


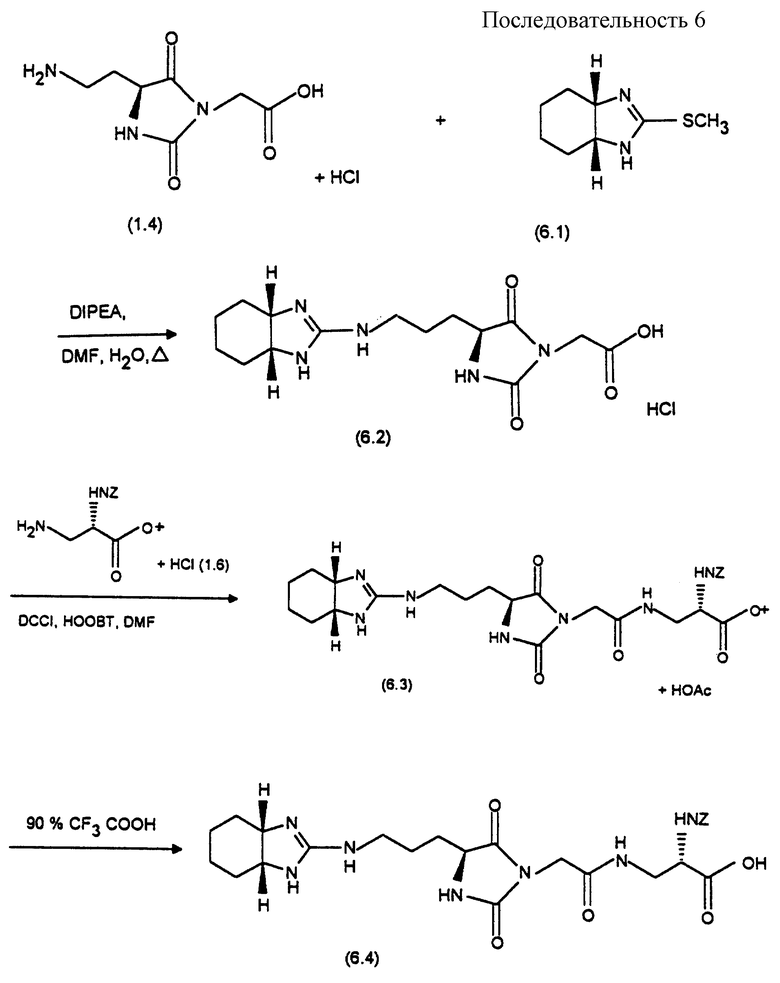












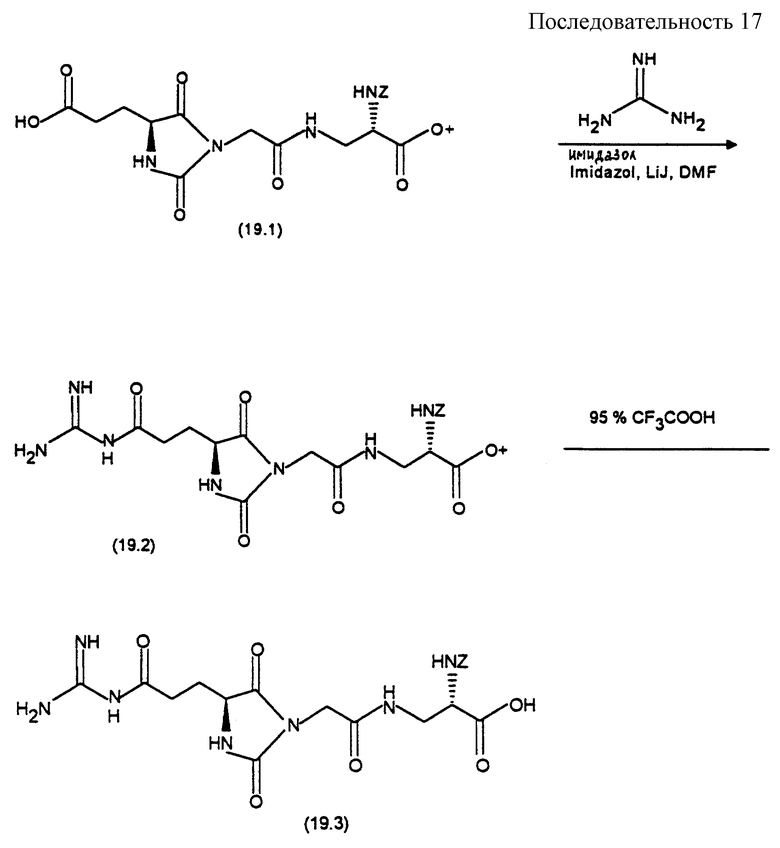














Предметом настоящего изобретения являются соединения формулы (I), где W означает R1-A-B-D-C(R16), R1-A-B-D-C(R16)=C или циклическую систему формулы (II), причем эта система может содержать только один гетероатом из ряда N; Y означает С=O, C=S; Z означает N(R0); А означает прямую связь, C1-C3-алкандиил, -NR2-, -СО-; В означает прямую связь, С1-C3-алкандиил, фенилен, -NR2-, -СО-, -С(O)-NR2-, -NR2-C(O)-; D означает прямую связь, С1-C3-алкандиил, фенилен, -NR2-, -CO-, -CO-NR2-; Е означает прямую связь, С1-C3-алкандиил; F означает D; G означает формулу (III); L означает N; R0 означает водород; R1 означает R2-C(= NR2)NR2-, R2R3N-C(=NR2)-, R2R3N-C-(NR2)-NR2 или гетероциклы. Соединения формулы (I) обладают ингибирующей активностью относительно адгезии остеокластов и благодаря этому свойству могут использоваться в качестве ингибиторов рассасывания костей, ингибиторов роста и метастазирования опухолей и т. д. и в качестве фармацевтической композиции. 2 с. и 3 з.п. ф-лы, 1 табл.

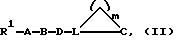
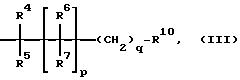
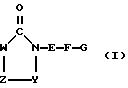
где W означает R1-A-B-D-C(R16); R1-A-B-D-C(R16)= C;
причем циклическая система
может содержать один гетероатом из ряда N и может быть насыщенной;
Y означает С= O, C= S;
Z означает N(R0);
А означает прямую связь, (С1-С3)-алкандиил, -NR2-, -С(О)-;
В означает прямую связь, (C1-С3)-алкандиил, фенилен-, -NR2-, -С(O)-, -NR2-C(O)-, -C(O)-NR2-;
D означает прямую связь, (C1-С3)-алкандиил, фенилен-, -NR2-, -CONR2-, -СО-;
Е означает прямую связь или (C1-С4)-алкандиил;
F имеет указанное для D значение;
G означает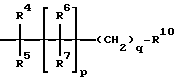
L означает N;
R0 означает водород;
R1 означает R2-C(= NR2)NR2-, R2R3N-C(= NR2)-, R2R3N-C(= NR2)-NR2;
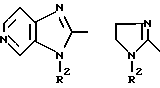
R2, R3 независимо друг от друга, означают водород, (C1-С4)-алкил, R8R8NR9, R8R8NC(O)R9, R8R8N-C(= NR8)-NR8-;
R4, R5, R6, R7 независимо друг от друга означают водород, R8OC(O)N(R2)R9;
R8 означает водород, (C1-С3)-алкил, (C3-С10)-циклоалкил-(C1-С3)-алкил, (C5-С12)-арил-(C1-С3)-алкил или
причем алкил может быть замещен галогеном, R8OR9;
R9 означает прямую связь или (C1-С4)-алкандиил;
R10 означает C(O)R11;
R11 означает ОН, (C1-С6)-алкоксил или бензилоксил;
R12, R13 независимо друг от друга, означают водород, H2N, R8OR9;
R16 означает водород или (C1-С4)-алкил;
m означает 1, 2, 3, 4;
р означает 1;
q= 0;
а также его физиологически приемлемые соли,
причем исключаются соединения, в которых R1-A-B-D-C(R16) или R1-A-B-D-C(R16)= C равны R1-K-C(R16) соответственно R1-K-CH= C(R16= H), причем здесь
R1 означает X-NH-C(= NH)-(CH2)p, X1-NH-(CH2)p или 4-имидазолил-CH2-, причем р может означать целое число 0-3;
X означает водород, (C1-С6)-алкил, (C1-С6)-алкилкарбонил, (C1-С6)-алкоксикарбонил, (C1-С18)-алкилкарбонилокси, -(C1-С6)-алкоксикарбонил, (C6-С14)-алкилкарбонил, (C6-С14)-арилоксикарбонил,
(C6-С14)-арил-(C1-С6)-алкоксикарбонил, гидроксил, (C1-С6)-алкоксил, (C6-С14)-арил-(C1-С6)-алкоксил или аминогруппу, причем арильные группы в Х представляют собой в случае необходимости одно- или многократно замещенные карбоциклы;
X1 означает (C4-С14)-арилкарбонил, (C4-С14)-арилоксикарбонил, (C4-С14)-арил-(C1-С6)-алкоксикарбонил, (C4-С14)-арил-(C1-С6)-алкоксил или R'-NH-C(= N-R"), причем R' и R", независимо друг от друга, имеют указанные для Х значения, причем арильные группы в X1 представляют собой в случае необходимости одно- или многократно замещенные исключительно карбоциклы;
К означает (C1-С6)-алкандиил, (C3-С7)-циклоалкандиил, фенилен, фенилен-(C1-С6)-алкандиил, (C1-С6)-алкандиил-фенилен, фенилен-(C2-С6)-алкендиил или двухвалентный остаток 5- или 6-членного, насыщенного или ненасыщенного цикла, который может содержать 1 или 2 атома азота и может быть одно- или двукратно замещен (C1-С6)-алкилом или связанным через двойную связь кислородом или серой.
Y означает С= O, C= S;
Z означает N(R0);
А означает прямую связь, (C1-С3)-алкандиил, -NR2-, -С(О)-;
В означает прямую связь, (C1-С3)-алкандиил, фенилен, -NR2-, -С(O)-, -NR2-C(O)-, -C(O)-NR2-;
D означает прямую связь, (C1-С3)-алкандиил, фенилен, -NR2-, -CONR2-, -СО-;
Е означает прямую связь или (C1-С4)-алкандиил;
F означает прямую связь, (C1-С3)-алкандиил, фенилен, -NR2-, -CO-NR2-, -СО-,
G означает
L означает N;
R0 означает водород;
R1 означает R2-C(= NR2) NR2-, R2R3N-C(= NR2)-NR2-,


R2, R3 независимо друг от друга означают водород, (C1-С4)-алкил, R8R8NR9, R8R8NC(O)R9, R8R8N-C(= NR8)-NR8-;
R4, R5, R6, R7 независимо друг от друга означают водород, R8OC(O)N(R2)R9;
R8 означает водород, (C1-С3)-алкил, (C3-С10)-циклоалкил-(C1-С3)-алкил, (C5-С12)-арил-(C1-С3)-алкил;
R9 означает прямую связь или (C1-С4)-алкандиил;
R10 означает C(O)R11;
R11 означает гидроксил, (C1-C6)-алкоксил или бензилоксил;
R12, R13 означают водород, H2N, R8OR9;
R16 означает водород или (C1-С4)-алкил;
m означает 1, 2, 3, 4;
р означает 1;
q означает 0,
а также его физиологически приемлемые соли.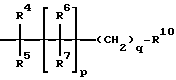
R0 означает водород; R1 означает R2R3N-C(= NR2),
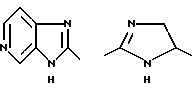


R2, R3 независимо друг от друга означают водород, (C1-С4)-алкил, R8R8NR9, R8R8NC(O)R9, R8R8N-C(= NR8)-NR8-; R4, R5, R6, R7 независимо друг от друга означают водород, R8OC(O)N(R2)R9; R8 означает водород, (C1-С3)-алкил, (C3-С10)-циклоалкил-(C1-С2)-алкил, (C5-С12)-арил-(C1-С2)-алкил; R9 означает прямую связь или (C1-С4)-алкандиил; R10 означает C(O)R11; R11 означает ОН, (C1-С6)-алкоксил, бензилоксил; R16 означает водород или (C1-С4)-алкил; m означает 1 или 2; р означает 1 и q= 0; а также его физиологически приемлемые соли.
| Способ получения 5-фенацил-1,3-имидазолил-2,4-дионов | 1975 |
|
SU534451A1 |
| АНАЛОГО-ЦИФРОВОЕ УСТРОЙСТВО ДЛЯ ЗАДЕРЖКИ ПРЯМОУГОЛЬНЫХ ИМПУЛЬСОВ | 0 |
|
SU300882A1 |
| Термоактивный щит опалубки | 1975 |
|
SU566919A1 |
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| Домовый номерной фонарь, служащий одновременно для указания названия улицы и номера дома и для освещения прилежащего участка улицы | 1917 |
|
SU93A1 |
Авторы
Даты
2002-12-27—Публикация
1997-03-19—Подача