Область изобретения
Настоящее изобретение относится к новому способу лечения с применением соединений, которые являются двойными неселективными антагонистами β-адренорецептора и α1-дренорецептора, в частности соединений карбазолил-(4)-оксипропаноламина формулы I, предпочтительно карведилола, для снижения смертности пациентов, страдающих застойной сердечной недостаточностью (ЗСН). Изобретение относится также к способу лечения с использованием соединений, которые являются двойными неселективными антагонистами β-адренорецептора и α1-адренорецептора, в частности соединений карбазолил-(4)-оксипропаноламина формулы I, предпочтительно карведилола, в сочетании с одним или несколькими другими терапевтическими средствами, причем такие средства выбирают из группы, состоящей из ингибиторов фермента, превращающего ангиотензин (ФПА), диуретиков и сердечных гликозидов, для снижения смертности пациентов, страдающих ЗСН. Изобретение далее относится к схеме применения с возрастанием дозы для введения соединений, которые являются антагонистами β-адренорецептора и α1-адренорецептора.
Предпосылки к созданию изобретения
Застойная сердечная недостаточность является результатом ослабленной нагнетающей способности сердца и связана с аномальной ретенцией воды и натрия. Традиционно лечение хронической слабой недостаточности включало ограничение физической деятельности, ограничение потребления соли и применение диуретика. Если эти меры недостаточны, к схеме лечения обычно добавляют сердечный гликозид, который является средством, которое повышает силу сокращения сердечной мышцы.
Для хронического лечения застойной сердечной недостаточности назначают ингибиторы фермента, превращающего ангиотензин, которые являются соединениями, предотвращающими превращение ангиотензина I в вазопрессорно-активный ангиотензин II, в сочетании с диуретиком, сердечным гликозидом или тем и другим.
Кроме того, застойная сердечная недостаточность является хорошо известным сердечным нарушением, которое приводит к избыточной смертности. Applefeld, М. М., (1986) Am. J. Med., 80, Suppl. 2В, 73-77. Следовательно, существует необходимость в создании терапевтических средств, которые могут снижать смертность, являющуюся результатом ЗСН, у пациентов, страдающих ею.
Краткое изложение существа изобретения
Настоящее изобретение представляет новое применение соединений, которые являются двойными неселективными антагонистами β-адренорецептора и α1-адренорецептора, для получения лекарственных препаратов для лечения застойной сердечной недостаточности. В частности, предпочтительны соединения карбазолил-(4)-оксипропаноламина формулы I, взятые отдельно или в сочетании с одним или несколькими другим терапевтическими средствами, причем такие средства выбирают из группы, состоящей из ингибиторов ФПА, диуретиков и сердечных гликозидов, в качестве терапевтических средств для снижения смертности, являющейся результатом застойной сердечной недостаточности у млекопитающих, в частности у людей. В частности, настоящее изобретение предпочтительно представляет способ лечения с применением взятого отдельно или в сочетании с одним или несколькими другими терапевтическими средствами, причем эти средства выбирают из группы, состоящей из ингибиторов ФПА, диуретиков и сердечных гликозидов, соединения формулы I, где R1 представляет -Н, R2 представляет -Н, R3 представляет -Н, R4 представляет -Н, Х представляет О, Аr представляет фенил, R5 представляет орто-ОСН3 и R6 представляет -Н, причем это соединение более известно как карведилол, который является (1-(карбазол-4-илокси-3[[2-(2-метоксифенокси)этил] амино](2-пропанолом) или его фармацевтически приемлемой солью.
Подробное описание изобретения
В патенте США No 4503067 описываются соединения карбазолил-(4)-оксипропаноламина формулы I: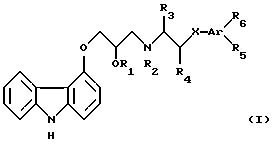
где R1 представляет водород, низший алканоил, содержащий вплоть до 6 атомов углерода, или ароил, выбранный из бензоила и нафтоила;
R2 представляет водород, низший алкил, содержащий вплоть до 6 атомов углерода, или арилалкил, выбранный из бензила, фенилэтила и фенилпропила;
R3 представляет водород или низший алкил, содержащий вплоть до 6 атомов углерода;
R4 представляет водород или низший алкил, содержащий вплоть до 6 атомов углерода, или, когда Х является кислородом, R4 вместе с R5 могут представлять -СН2-O;
Х представляет валентную связь, -CH2-, кислород или серу;
Аr выбирают из фенила, нафтила, инданила и тетрагидронафтила;
R5 и R6 каждый выбирают из водорода, фтора, хлора, брома, гидроксила, низшего алкила, содержащего вплоть до 6 атомов углерода, -СОNН2-группы, низшей алкоксигруппы, содержащей вплоть до 6 атомов углерода, бензилоксила, низшей алкилтиогруппы, содержащей вплоть до 6 атомов углерода, низшего алкилсульфонила, содержащего вплоть до 6 атомов углерода, или R5 и R6 вместе представляют метилендиоксигруппу;
и их фармацевтически приемлемые соли.
Этот патент далее представляет соединение формулы I, наиболее известное как карведилол, которое представляет собой (1-(карбазол-4-илокси-3-[[2-(2-метоксифенокси)этил]амино] (2-пропанол), со структурной формулой II: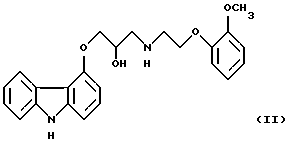
Соединения формулы I, среди которых карведилол является наиболее распространенным, являются новыми, обладающими множественными лекарственными действиями, которые используют при лечении гипертензии от слабой до умеренной. Известно, что карведилол является как конкурентным неселективным антагонистом β-адренорецептора, так и сосудорасширяющим фактором, а также антагонистом кальциевых каналов при высоких концентрациях. Сосудорасширяющее действие карведилола является в основном результатом блокады α1-адренорецептора, тогда как блокирующая β-адренорецептор активность этого лекарственного средства предотвращает рефлекторную тахикардию, когда его применяют при лечении гипертензии. Эти множественные действия карведилола отвечают за гипотензивную эффективность данного лекарственного средства у животных, в частности у людей. См. Willette, R.N., Sauermelch, C.F. and Ruffolo, R. R., Jr. (1990) Eur. J. Pharmacol., 176, 237-240; Nichols, A.J., Gellai, M. and Ruffolo, R.R., Ir. (1991) Fundam. Clin. Pharmacol. 5, 25-38; Ruffolo, R.R., Ir., Gellai, M., Hieble, J.P., Willette, R.N. and Nichols, A. J. (1990) Eur. Clin. Pharmacol., 38, S82-S88; Ruffolo, R.R., Ir., Boyle D.A. , Venuti, R.P. and Lukas, M.A. (1991) Drugs of Today, 27, 465-492 and Yue, T.-L., Cheng, H., Lysko, P.G., Mckenna, P.J., Feuerstein, R., Gu, I., Lysko, K. A. , Davis, L.L. and Feuerstein, G. (1992) J. Pharmacol. Exp. Ther., 263, 92-98.
Гипотензивное действие карведилола проявляется главным образом в снижении общего периферического сопротивления сосудов без вызывания сопутствующих рефлекторных изменений в частоте сердечных сокращений, обычно связанных с другими гипотензивными средствами. Willette, R.N. et al., см. выше; Nichols, A.J., et al., см. выше; Ruffolo, R.R., Ir., Gellai, M., Hieble, J. P., Villette, R.N. and Nicols A.I. (1990) Eur. Clin. Pharmacol. 38, S82-S88. Карведилол заметно снижает также величину инфаркта в моделях острого инфаркта миокарда на крысах, собаках и свиньях, Ruffolo, R.R., Jr., et al., Drugs of Today, см. выше, возможно как следствие его антиокислительного действия в ослаблении инициированного кислородными свободными радикалами липидного перокисления. Yue, T.-L., et al., см. выше.
Недавно в клинических исследованиях было обнаружено, что фармацевтические соединения, которые являются двойными неселективными антагонистами β-адренорецептора и α1-адренорецептора, в частности соединения формулы I, предпочтительно карведилол, взятые отдельно или в сочетании с обычными средствами, причем такие средства являются ингибиторами ФПА, диуретиками и сердечными гликозидами, представляют собой эффективные терапевтические средства для лечения ЗСН. Такое применение средств, например карведилола, при лечении ЗСН неожиданно, поскольку, в общем, β-блокаторы противопоказаны пациентам, страдающим сердечной недостаточностью, так как известно, что β-блокаторы имеют нежелательное кардиоподавляющее действие. Наиболее неожиданным наблюдением в исследованиях, в которых данные соединения применяли для лечения ЗСН, является то, что эти соединения, в частности карведилол, способны снижать смертность, являющуюся результатом ЗСН у пациентов, на 67 процентов. Кроме того, этот результат наблюдали в случаях всех классов ЗСН и обеих этиологий (ишемической и неишемической). Этот результат неожиданный, поскольку два последних исследования смертности с использованием в качестве β-блокаторов метопролола (Waagstein, et al., (1993) Lancet, 342, 1441-1446) и бисопролола (CIBIS investigators and committees, (1994) Circulation, 90, 1765-1773) при лечении ЗСН не показали различий в смертности между пациентами, получившими лекарственные средства, и пациентами, получившими плацебо.
В соответствии со способом лечения настоящего изобретения желательное терапевтическое действие соединений формулы I, в частности, карведилола, может быть повышено путем применения любого одного из этих соединений или любой фармацевтически приемлемой соли этих соединений в сочетании с ингибиторами ФПА, диуретиками и сердечными гликозидами, которые являются эффективными терапевтическими средствами для лечения ЗСН. В частности, предпочтительные ингибиторы ФПА настоящего изобретения выбирают из группы, состоящей из каптоприла, лизиноприла, фозиноприла и эналаприла или их фармацевтически приемлемых солей, и предпочтительными диуретиками настоящего изобретения являются гидрохлортиазид, фуросемид или торасемид или их фармацевтически приемлемые соли. Предпочтительными сердечными гликозидами настоящего изобретения являются дигоксин, β-метилдигоксин или дигитоксин. К желательным терапевтическим эффектам соединений формулы I, в частности карведилола, добавляются терапевтические свойства ингибиторов ФПА, или диуретиков, или сердечных гликозидов при введении в сочетании с ними. Каптоприл коммерчески доступен от E. R. Squibb and Sons, Inc. Lisinopril, эналаприл и гидрохлортиазид - от Merck and Co. Фуросемид поставляется Hoechst-Roussel Pharmaceuticals, Inc., дигоксин - Burroughs Wellcome Co и Boehringer Mannheim GmbH, дигитоксин, β-метилдигоксин, фозиноприл и торасемид - Boehringer Mannheim GmbH.
Соединения формулы I могут быть получены, как описывается в патенте США No 4503067. Карведилол поставляется SmithKline Beechman Corporation и Boehringer Mannheim GmbH (Германия).
Фармацевтические композиции соединений формулы I, включая карведилол, взятые отдельно или в сочетании с ингибиторами ФПА, или диуретиками, или сердечными гликозидами, можно вводить пациентам в соответствии с настоящим изобретением любым приемлемым для лечения способом, предпочтительно перорально. Для парентерального введения фармацевтическая композиция представляет собой стерильную приемлемую для инъекции жидкость, которую хранят в подходящем контейнере, например ампуле, или водную или неводную жидкую суспензию. Природа и состав фармацевтического носителя, разбавителя или наполнителя, конечно, будет зависеть от предполагаемого пути введения, например, от того, внутривенный или внутримышечный путь введения будет назначен.
Фармацевтические композиции соединений формулы I для применения в соответствии с настоящим изобретением можно готовить в виде растворов или лиофилизованных порошков для парентерального введения. Порошки можно разводить добавлением подходящего разбавителя или другого фармацевтически приемлемого носителя до использования. Жидкая готовая препаративная форма обычно представляет содержащий буфер изотонический водный раствор. Примерами подходящих разбавителей являются обычный изотонический солевой раствор, стандартная 5% декстроза в воде или забуференный ацетатом натрия или аммония раствор. Такая готовая препаративная форма особенно пригодна для парентерального введения, но ее можно также применять для перорального введения, или она может содержаться в ингаляторе или распылителе для инсуффляции измеренной дозы. Возможно добавление наполнителей, например этанола, поливинилпирролидона, желатина, гидроксицеллюлозы, аравийской камеди, полиэтиленгликоля, маннита, хлорида натрия или цитрата натрия.
Альтернативно, эти соединения можно капсулировать, таблетировать или изготовить в виде эмульсии или сиропа для перорального введения. Для усиления действия стабилизации композиции или для облегчения изготовления композиции можно добавить фармацевтически приемлемые твердые или жидкие носители. Жидкие носители включают сироп, арахисовое масло, оливковое масло, глицерин, солевой раствор, этанол и воду. Твердые носители включают крахмал, лактозу, дигидрат сульфата кальция, белую глину, стеарат магния или стеариновую кислоту, тальк, пектин, аравийскую камедь, агар или желатин. Носитель может также включать материал для длительного высвобождения активного ингредиента, например глицерилмоностеарат или глицерилдистеарат, взятый отдельно или с воском. Количество твердого носителя изменяется, но предпочтительно оно находится в диапазоне от около 20 мг до 1 г на унифицированную дозу. Фармацевтические композиции получают, следуя обычным способам фармации, включающим размалывание, смешивание, гранулирование и прессование, когда необходимо, для получения таблетированных форм или размалывание, смешивание и наполнение для получения твердых желатиновых капсулированных форм. Когда применяют жидкий носитель, препарат будет в форме сиропа, эликсиpa, эмульсии или водной или неводной суспензии. Такую жидкую готовую препаративную форму можно вводить непосредственно перорально или заполнять мягкие желатиновые капсулы.
Соединения, имеющие вышеупомянутые двойные свойства, предпочтительно вводят в три этапа. Эта схема характеризуется тем фактом, что пациентам в течение определенного периода времени вводят увеличиваемые дозы активного ингредиента до получения ими регулярной поддерживающей дозы. Если величину этой поддерживающей дозы принять за 100%, то было найдено, что первая фаза (этап) схемы применения должна продолжаться в течение 7-28 дней, во время которой вводят только 10-30% устанавливаемой дозы. Затем следует второй этап схемы применения, во время которого пациенту в течение периода 7-28 дней вводят 20-70% устанавливаемой дозы. После окончания этой фазы следует третий этап, где вводят полную устанавливаемую, суточную дозу (поддерживающую дозу). Суточная поддерживающая доза может изменяться в пределах от 10 до 100 мг этого активного ингредиента.
При лечении человека доза в соответствии с настоящим изобретением не должна превышать от около 3,125 до около 50 мг соединений формулы I, в частности карведилола, предпочтительно при введении два раза в день. Специалисту данной области является очевидным то, что лечение пациента по схеме должно начинаться с низких доз желаемого соединения формулы I, в частности карведилола, и должно проверяться на непереносимость к таким соединениям, например, приводящим к обмороку. Было обнаружено, что в том случае, если пациент переносит такое соединение, его нужно вводить медленно и постепенно повышая дозу до достижения поддерживающей дозы. Предпочтительный курс лечения пациента должен начинаться со стадии приема готовых препаративных форм, которые содержат 3,125 или 6,25 мг активного соединения на одну унифицированную дозу, предпочтительно при введении два раза в день в течение 7-28 дней. Выбор начальной дозы, наиболее подходящей для отдельного пациента, определяется практикующим врачом, использующим хорошо известные медицинские правила (принципы), включающие, но не ограничивающиеся им, массу тела. В случае если пациент проявляет терапевтически приемлемую переносимость соединения в течение двух недель, дозу удваивают в конце второй недели и пациенту вводят новую, более высокую дозу в течение дополнительного периода, предпочтительно до двух дополнительных недель, и следят за симптомами непереносимости. Этот курс продолжают до достижения пациентом поддерживающей дозы. Предпочтительная поддерживающая доза составляет 25,0 мг активного соединения на одну унифицированную дозу, предпочтительно при введении два раза в день, для пациентов, имеющих массу тела вплоть до 85 кг. Для пациентов, имеющих массу тела выше 85 кг, поддерживающая доза составляет от 25,0 мг до 50,0 мг, предпочтительно при введении два раза в день, предпочтительно около 50,0 мг активного соединения на одну унифицированную дозу, предпочтительно при введении два раза в день.
Настоящее изобретение относится к способу лечения для снижения смертности, являющейся результатом застойной сердечной недостаточности у млекопитающих, заключающемуся во введении этому млекопитающему, нуждающемуся в этом, эффективного количества карведилола в соответствии со следующей схемой применения:
(а) введение фармацевтической готовой препаративной формы, которая содержит 3,125 или 6,25 мг карведилола на одну унифицированную дозу, в течение периода 7-28 дней один или два раза в день;
(б) затем введение фармацевтической готовой препаративной формы, которая содержит 12,5 мг карведилола на одну унифицированную дозу, в течение периода дополнительных 7-28 дней один или два раза в день;
(в) и, наконец, введение фармацевтической готовой препаративной формы, которая содержит 25,0 или 50,0 мг карведилола на одну унифицированную дозу, один или два раза в день в качестве поддерживающей дозы.
Дозировка для человека при лечении болезни в соответствии с настоящим изобретением включает в себя сочетание соединений формулы I с обычными средствами. Например, обычная суточная доза гидрохлортиазида для взрослых составляет 25-100 мг в виде разовой дозы или разделенной дозы. Рекомендованная начальная доза для эналаприла составляет 2,5 мг, причем эту дозу вводят один или два раза в день. Обычный терапевтический диапазон доз для эналаприла составляет 5-20 мг в сутки, причем эту дозу вводят в виде разовой дозы или двух разделенных доз. Для большинства пациентов обычная начальная суточная доза каптоприла составляет 25 мг, причем эту дозу вводят три раза в день, большинство пациентов имеют удовлетворительную положительную динамику при введении 50 или 100 мг три раза в день.
Следует учитывать, что реальные предпочтительные дозы соединений, которые применяют в композициях этого изобретения, будут меняться в зависимости от готовой препаративной формы, способа введения, конкретного места введения и пациента.
В случае применения соединения формулы I, включая соединения формулы II, настоящего изобретения не ожидается никаких токсикологических эффектов. Пример, который следует ниже, не ограничивает объем настоящего изобретения, а представлен для его иллюстрации.
ПРИМЕРЫ
Исследование смертности пациентов с ЗСН
Краткое изложение. Для определения того, может ли β-адренергическая блокада ингибировать разрушительное действие симпатической нервной системы, следили за продолжительностью жизни пациентов с застойной сердечной недостаточностью (ЗСН), из которых 1052 входили в исследовательскую программу, при которой пациентам произвольно назначали (двойной слепой отбор) лечение в течение 6-12 месяцев плацебо (ПБО) или карведилол (КРВ). После обычного периода скрининга пациентов с ЗСН класса II-IV и фракции изгнания (систолическая) <0,35 назначали в один из четырех протоколов на основании проведения теста на 6-минутную ходьбу. ПБО и КРВ добавляли к существующей терапии дигоксином, диуретиками и ингибитором ФПА. Смертность (по intention-to-eat) регистрировалась заранее назначенным советом, проверяющим безопасность и данные (DSMB). Через 25 месяцев после регистрации DSMB рекомендовал окончание программы из-за благоприятного действия КРВ на выживание. Общая смертность была 8,2% в ПБО-группе и только 2,9% в КРВ-группе (Р=0,0001, анализ Cochran-Mantel-Haensel). Эти данные представляли снижение риска смерти при лечении КРВ на 67% (95% СН: от 42% до 81%). Эффект лечения был одинаковым у пациентов с симптомами класса II и класса III-IV. Смертность снижалась у пациентов класса II с 5,9% до 1,9%, 68% снижение (95% СН: от 20% до 97%) [Р=0,015] и у пациентов класса III-IV с 11,0% до 4,2%, 67% снижение (95% СН: от 30% до 84%) [Р=0,004, log-ранг]. Важно, что влияние КРВ было одинаковым при ишемической болезни сердца (риск снижался на 67%, Р=0,003) и при неишемической дилатированной кардиомиопатии (риск снижался на 67%, Р=0,014). В заключение, добавление КРВ к обычной терапии ассоциируется с существенным (67%) снижением смертности пациентов с хронической ЗСН. Влияние лечения проявляется во всем широком диапазоне тяжести и этиологии болезни.
Применяемый здесь термин "ЗСН класса II" обозначает пациентов с сердечным заболеванием, приводящим к незначительному или умеренному ограничению физической активности. Они чувствуют себя комфортно при отдыхе. Обычно физическая активность приводит к утомлению, учащенному сердцебиению, одышке или стенокардитической боли. Термином "ЗСН класса III" обозначают пациентов с сердечным заболеванием, приводящим к заметным ограничениям физической активности. Они чувствуют себя комфортно при отдыхе. Меньшая, чем обычная физическая активность приводит к утомлению, учащенному сердцебиению, одышке или стенокардитической боли. Термином "СН класса IV" обозначают пациентов с сердечным заболеванием, приводящим к неспособности к любой физической активности без дискомфорта, симптомов сердечной недостаточности или стенокардитического синдрома. Термином "менее чем обычная физическая активность" обозначают поднятие на один марш лестницы или ходьба на 180 м.
План изучения. На основе выполнения базового субмаксимального упражнения пациентов на фоне терапии диуретиками, ингибиторами ФПА и/или дигоксином отбирали для одного из четырех изучений:
изучение 220, изучение восприимчивости к дозе при умеренной (NYHA II-IV) ЗСН с испытанием на упражнение в качестве первой конечной точки
изучение 221, изучение для ступенчатого определения дозы при умеренной (NYHA II-IV) СН с испытанием на упражнение в качестве первой конечной точки
изучение 239, изучение для ступенчатого определения дозы при серьезной (NYHA II-IV) ЗСН с качеством жизни в качестве первой конечной точки
изучение 240, изучение для ступенчатого определения дозы при средней (NYHA II-III) ЗСН с прогрессированием ЗСН в качестве первичной конечной точки.
Шестьдесят четыре центра в США принимали участие в исследовательской программе. Все участки вели протоколы 239 и 240, тогда как 33 выполняли протокол 220 и 31 выполняли протокол 221.
Несмотря на то, что каждое исследование имело свои собственные цели, общей программной целью, определенной заранее, была оценка всей смертности. На основании проектированной регистрации 1100 пациентов программа имела 90% способность для обнаружения 50% снижения в смертности (двусторонней) между карведилолом и плацебо, что предполагает степень смертности в группе плацебо 12% по всей продолжительности исследований, (α=0,05).
Рандомизации предшествовали периоды скрининга и симптоматики, общие для четырех протоколов. Целью периода скрининга была квалификация пациентов для вступления в изучение, получения воспроизводимых базовых измерений и отбора пациентов в подходящее изучение на основании теста на субмаксимальное упражнение. Во время периода симптоматики пациенты получали низкую дозу open-label карведилола (6,25 мг, дважды в день) в течение двух недель. Пациенты, не способные переносить эту дозу, не участвовали в дальнейшей рандомизации. Пациентов, переносящих низкую дозу карведилола, затем рандомизировали для "слепой" лекарственной терапии (карведилолом или плацебо) дозой, ступенчато определенной, в течение нескольких недель, в пределах от 6,25 до 50 мг дважды в день (или эквивалентного количества плацебо). Фаза поддержания каждого изучения продолжалась от шести до 12 месяцев, после которой пациенты имели право получать open-label карведилол в обширном изучении.
Результаты. Анализ, представленный ниже, соответствует данным, на основании которых DSMB дал рекомендацию прекратить исследования. В этот анализ intent-to-eat включались все пациенты, зарегистрированные в исследованиях США 20 января 1995; причем 624 пациента получали карведилол и 356 - плацебо. Анализ базовых характеристик пациентов (табл. 1) показывает хороший баланс между рандомизированными группами.
Результаты общей смертности для программы приводятся в табл. 2. Включены все смертные случаи во время периода от намерения до лечения. Лечение карведилолом привело к 67% снижению риска всех смертных случаев. Анализ смертности по обычным базовым характеристикам показывает, что лечение имеет широкое действие вне зависимости от тяжести и этиологии СН. Это действие было постоянным у пациентов со слабой сердечной недостаточностью или от умеренной до тяжелой сердечной недостаточности. Подобным образом одинаковое снижение смертности наблюдали у пациентов с ишемической или неишемической сердечной недостаточностью.
Предшествующее описание показывает применение соединения этого изобретения. Это изобретение, однако, не ограничивается описанным здесь определенным примером воплощения, а включает в себя все модификации в пределах объема формулы изобретения.


Изобретение относится к области медицины и касается способа снижения смертности в результате застойной сердечной недостаточности, включающего введение карведилола отдельно или в сочетании с другими терапевтическими средствами. Способ обладает повышенной эффективностью. 8 з.п. ф-лы, 2 табл.
Приоритет по пунктам:
08.02.1995 по пп. 1-6;
07.06.1995 по пп. 7-9.
| US 4503067 А, 05.03.1985 | |||
| Справочник ВИДАЛЬ "Лекарственные средства в России" | |||
| - М.: Астра Фарм Сервис, 1995, с.675 | |||
| RU 2058144 C1, 20.04.1996 | |||
| ПРОИЗВОДНЫЕ ПИРИДО (3,2-А)КАРБАЗОЛА, ОБЛАДАЮЩИЕ КАРДИОТОНИЧЕСКОЙ АКТИВНОСТЬЮ | 1991 |
|
RU2032685C1 |
| СПОСОБ ЛЕЧЕНИЯ ИНДУЦИРОВАННОЙ ЗАСТОЙНОЙ (ГИПЕРЕМИЧЕСКОЙ) СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ | 1992 |
|
RU2080112C1 |
Авторы
Даты
2003-01-27—Публикация
1996-02-07—Подача