Данное изобретение относится к области медицины, а именно к иммунологии, и касается способа получения антиэмбриональной антиидиотипической сыворотки, используемой в качестве одного из агентов при тестировании пациента на предмет диагностики злокачественной опухоли.
По предварительной гипотезе в процессе опухолевого роста и при эмбриогенезе существует (функционирует) сходный механизм межклеточного (межмембранного) взаимодействия, в подтверждение этой гипотезы предлагается использование антиэмбриональной антиидиотипической сыворотки, действие которой может быть существенно для выявления опухолевого роста и/или опухолевой прогрессии. Аналогичная сыворотка использована при создании способа универсальной диагностики злокачественных опухолей (см. патент СССР 1836640, G 01 N 33/80, опубл. 23.08.93).
Известен способ диагностики злокачественной опухоли путем исследования скорости оседания эритроцитов под действием двух агентов - антиэмбриональной антиидиотипической сыворотки и контрольной сыворотки, при этом в качестве первого агента используют крысиную сыворотку, а второго - сыворотку крыс, которым предварительно вводят лимфоциты сингенных животных (см. патент РФ 2111495, G 01 N 33/80, опубл. 20.05.98). Причем диагностика заключается в нахождении минимального и максимального градиентов скорости оседания эритроцитов крови пациента в данных сыворотках и расчете по определенной формуле коэффициента злокачественного роста, величина которого указывает на наличие/отсутствие злокачественной опухоли.
В данном способе антиэмбриональная антиидиотипическая сыворотка используется в качестве агента, изменяющего скорость оседания эритроцитов крови пациента по сравнению с контрольной сывороткой в случае наличия злокачественного опухолевого роста клеток.
Настоящее изобретение направлено на решение задачи по созданию антиэмбриональной антиидиотипической сыворотки, свойства которой позволяли бы визуально контролировать наличие роста клеток злокачественных опухолей вне зависимости от гистогенеза, выявляемого при люминесцентной микроскопии. Достигаемый при этом технический результат заключается в повышении эффективности и достоверности диагностики злокачественных опухолевых заболеваний.
Указанный технический результат достигается тем, что при получении антиэмбриональной антиидиотипической сыворотки в сингенной системе на первом этапе производят введение в организм достоверно сингенного животного 7-12-дневных клеток эмбриональных тканей с хорионом, полученных от беременных самок, на втором этапе по истечении 5-14 дней после ввода эмбриональных клеток от имунного животного забирают лейкоциты и вводят их в организм другого, сингенного с предыдущим животного, а по истечении 4-12 дней после проведения последней иммунизации при образовании достаточного количества имунного компонента в крови животного получают сыворотку путем забора его крови, которую оставляют при комнатной температуре до образования плотного сгустка, а затем центрифугируют для полного оседания эритроцитов; полученную сыворотку отбирают, прогревают до 60oС, сорбируют на избытке гомогената клеток сингенных животных с последующим центрифугированием и фильтрацией.
На обоих этапах возможна обработка вводимых клеток антимитотическими агентами, или введение их с иммуностимуляторами, или замена цельных клеток их мембранной фракцией.
Под "достаточным" количеством иммунного компонента в крови животного подразумевается такая концентрация иммуноглобулинов (класса G и М), которая позволила бы провести описанные ниже диагностические методики. "Достаточность" (или концентрацию иммунных глобулинов класса G и/или М) можно оценивать по иным известным методикам, например:
a) реакция бласттрансформации лимфоцитов, или
b) реакция преципитации, или
c) иммуноферментный анализ, или
d) радиоиммунный анализ и т.д.
Предложенный способ предполагает, что конечный продукт, которым является иммунная сыворотка, забирается от иммунного животного на конечном этапе. Например, в случае 2-этапной иммунизации забор крови производится от иммунного животного 2, в случае 3-этапной иммунизации от животного 3 и т.д.
Иммунными компонентами, получаемыми на конечном этапе, могут быть:
a) иммунные лимфоциты, продуцирующие иммунные глобулины классов G и/или М, или
b) моноклональные антитела, созданные на основе указанных лимфоцитов, или
c) собственно иммуноглобулины G и/или М, или
d) Fab фрагменты иммуноглобулинов (С), или
e) цельная сыворотка как простейший вариант.
Указанные признаки являются существенными и взаимосвязаны между собой с образованием устойчивой совокупности существенных признаков, достаточной, чтобы получить сыворотку со следующими свойствами:
- в смеси с эритроцитами больных злокачественными опухолями происходит агглютинация эритроцитов в достоверно большом проценте случаев;
- в методе непрямой иммунофлюоресценции выявляется специфическое мембранное (перифирическое) свечение клеток злокачественных опухолей вне зависимости от гистогенеза при люминесцентной микроскопии, что свидетельствует об универсальной тропности (восприимчивости) получаемой сыворотки к опухолевым клеткам и может служить основанием для создания патологоанатомических тест-систем.
Сущность способа получения агента. В строго сингенной системе проводится многоэтапная иммунизация. В простейшем случае ее можно ограничить принципиально двумя этапами. На первом из них производится введение в организм достоверно сингенного животного клеток, полученных от беременных самок на определенном сроке беременности. Вводимые клетки содержат как клетки собственно эмбриона, так и клетки хориона. По истечении необходимого периода времени от имунного животного забираются любыми способами лейкоциты и вводятся в организм другого, сингенного с предыдущим животного. На обоих этапах допускается обработка вводимых клеток антимитотическими агентами, введение их с иммуностимуляторами (адьювантами) или без них или замена цельных клеток их мембранной фракцией. Сыворотка (или ее иммунный компонент) забирается от животных последней группы по истечении времени, необходимого для образования достаточного количества имунного компонента в крови животного после проведения второго этапа иммунизации.
Могут использоваться любые системы сингенных животных, предпочтительно использование мышей.
Антиидиотипическую сыворотку получают следующим образом.
1. Получение 12-дневных эмбриональных клеток мышей линии BALB (с) и проведение первой иммунизации.
На 12 день беременных самок забивают тракцией шейного отдела позвоночника или другим доступным способом. Переднюю стенку живота обрабатывают 95%-ным этанолом, вскрывают по всей передней поверхности. Два рога матки отделяют от подводящих сосудов (перерезается брыжейка), матку перерезают у ее влагалищного отдела и переносят в избыток холодного раствора Версена. Матку разрезают по длиннику, браншами отделяют в раствор эмбриональные ткани вместе с тканями хориона. Избыток раствора Версена удаляют пастеровской пипеткой, остатки маток удаляют. Эмбриональные ткани с хорионом тонко измельчают ножницами и в избытке свежего холодного раствора Версена переносят на магнитную мешалку в стерильном пенициллиновом флаконе на 25-30 мин. Спустя указанное время, взвесь фильтруют через двухслойный марлевый фильтр, клетки трижды отмывают избытком холодного раствора Хэнкса (при 1500 об/мин 3-4 мин). Концентрацию живых клеток в растворе подсчитывают в камере Горячева по известной методике. Предварительно осадив клетки центрифугированием при 1500 об/мин, удаляют избыток раствора Хэнкса, а к клеточному осадку вносят НАФ (НАФ - неполный Адьювант Фрейда) из расчета 10 млн. клеток - 0,1 мл НАФ. Смесь ресуспендируют до образования устойчивой эмульсии и вводят покапельно в область спины сингенным животным из расчета 0,1 мл эмульсии на одного.
2. Проведение второй иммунизации.
Спустя 14 дней после окончания первого этапа, имунных животных забивают, проводят предварительную обработку и разрез аналогично указанным выше. Удаляют селезенки и переносят их в гомогенизатор с 4 мл раствора Версена. Полученный гомогенат фильтруют через двухслойный марлевый фильтр, смесь отмывают однократно в растворе Хэнкса и наслаивают на смесь фиколл-верографин (плотность - 1077). Выделение спленоцитов (т.е. лейкоцитов, добытых из селезенки) в градиенте плотности производят при 2000 об/мин в течение 20-25 мин (в зависимости от объема исходной взвеси) и продолжают до получения ясно различимого "кольца", расположенного на границе растворов. Спленоциты ("кольцо") отбирают тонко оттянутой пастеркой, однократно отмывают в растворе Хэнкса, взвесь облучают. Доза облучения составляет 50 Гр (т.е. 5000 рад). Производят подсчет клеток и добавляют к трижды отмытым после облучения клеткам неполный Адьювант Фрейда из того же расчета, что и в п.1. Эмульсию вводят внутрибрюшинно сингенным животным из расчета 0,1 мл на одного.
3. Получение сыворотки
Спустя 12 дней после проведения последней иммунизации, производится забор крови из полостей сердца под эфирным наркозом. Полученную кровь оставляют при комнатной температуре до образования плотного сгустка, центрифугируют при 1500 об/мин 2-3 мин для полного оседания эритроцитов. Сыворотку отбирают тонко оттянутой пастеркой, прогревают при 56oС 15 мин, сорбируют на избытке гомогената клеток печени, почек, селезенки сингенных мышек BALB (с), центрифугируют при 8-9000 об/мин 20 мин, фильтруют миллипоровыми фильтрами (0,22 мкм).
4. Тестирование сыворотки. Полученную указанным способом сыворотку проверяют в методе непрямой иммунофлюоресценции на криостатных нефиксированных срезах (6-10 мкм) любого опухолевого штамма (В-16, РШМ-2 и пр.). Сыворотка считается активной, если обнаруживается специфическое мембранное свечение опухолевых клеток в конечном разведении 1:1.
В частном случае реализации способа возможна обработка вводимых клеток антимитотическими агентами следующим образом:
a) Эмбриональные клетки (в том числе и с клетками хориона) линейного лабораторного животного (например, мышь) берут на определенном гестационном возрасте, обусловленном сроком беременности и особенностями развития эмбриона конкретного вида лабораторного животного.
b) Клетки, указанные в п.(а), обрабатываются известными антимитотическими агентами (например, митомицин С, гамма-излучение или другими).
c) Параметры и время обработки клеток в п.(b) определяются достаточностью для достижения остановки их митотической активности и/или метаболизма.
d) Обработанные по п. (с) клетки вводят в организм сингенного с этими клетками лабораторного животного с известными иммуностимуляторами, использующимися в иммунологических методиках (например, Полный Адьювант Фрейнда, неполный Адьювант Фрейнда и др). Способ введения определяется параметрами приготовленного препарата.
e) Количество вводимого иммуностимулятора определяется количеством клеток и видом лабораторного животного и считается оптимальным в каждом конкретном случае, если его применение увеличивает концентрацию иммунных глобулинов в крови иммунного животного за более короткий промежуток времени, чем без его применения, или позволяет получить большую их концентрацию за тот же период времени, что и без его применения.
f) От животного, обработанного по пп.(d, e), забираются лейкоциты любыми известными способами по прошествии определенного периода времени.
g) Период времени по п. (f) считается достаточным, если концентрация иммунных глобулинов в крови иммунного животного достигает оптимальных значений. Оптимальной концентрацию иммунных глобулинов следует считать, если скорость ее увеличения в крови иммунного животного начинает снижаться.
h) Лейкоциты, полученные по пп.(f, g), обрабатываются антимитотическим агентом аналогично пп.(b, с).
i) После проведения обработки лейкоцитов по п.(h) производят их введение с иммуностимуляторами (как и в пп.d, е) в организм сингенного с лейкоцитами животного в количестве и объеме, оптимальном для получения оптимального титра антиидиотипических антител.
j) Титр антиидиотипических антител считается оптимальным, если позволяет выявлять идиотипы эмбриональных стадиоспецифических антигенов на опухолевых клетках в известных тестовых методиках.
k) По достижении концентрации антиидиотипических антител в крови лабораторного животного, обработанного по п.(i), достаточной по п.(j), производят выделение иммунного компонента, состав которого раскрыт выше.
Вариантом способа является способ, отличающийся по пп.(d, i), где цельные клетки заменяются их биологически активной фракцией (например, их мембранами или др). Замена считается адекватной, если приводит к результату по п. j).
Антиидиотипическая антиэмбриональная сыворотка испытывалась при реализации РО-теста (TURTEST) - биохимического метода иммунологического распознавания антигенов клеток злокачественных новообразований в крови больного, основанного на способности эритроцитов к агглютинации при взаимодействии с данной сывороткой. Выраженность этой реакции количественно определяют по изменению скорости оседания эритроцитов при взаимодействии с антиидиотипической антиэмбриональной сывороткой по сравнению с их оседанием в результате взаимодействия с контрольной сывороткой. Коэффициент злокачественного роста клеток (Кзр) определяют следующим образом: среднее значение, полученное между двумя контрольными пробами и рабочей пробой с антиидиотипической антиэмбриональной сывороткой, делят на величину 50 и умножают на большую величину из 3-х проб. Если результат будет превышать 1,5, то это свидетельствует о наличии злокачественного опухолевого процесса в организме больного.
Эффективность использования данной сыворотки при диагностике злокачественных опухолей поясняется следующими примерами.
Пример 1.
Пациентка А. с новообразованием в левом предсердии была подвергнута исследованию на РО-тест. Кзр составил 2,3. Это явилось причиной возникшего предположения о наличии злокачественной неоплазмы. После операции гистология подтвердила злокачественное новообразование - фибромиксосаркому левого предсердия.
Пример 2.
У больной С. злокачественная опухоль перикарда (злокачественная мезотелиома) была выявлена после биопсии. После РО-теста коэффициент злокачественного роста Кзр составил 2,8, что подтвердило первоначальный диагноз злокачественности новообразования.
Пример 3.
У четырех больных с миксомами правого предсердия РО-тест был проведен до операции; Кзр составил 0,8. После операции гистология подтвердила доброкачественный характер новообразований.
Пример 4.
У трех детей с рабдомиомами в правых отделах сердца РО-тест был проведен до операции. Кзр составил 0,9; 0,96 и 1,1 соответственно. После проведенных операций гистология подтвердила наличие немиксоматозных доброкачественных опухолей сердца - рабдомиом.
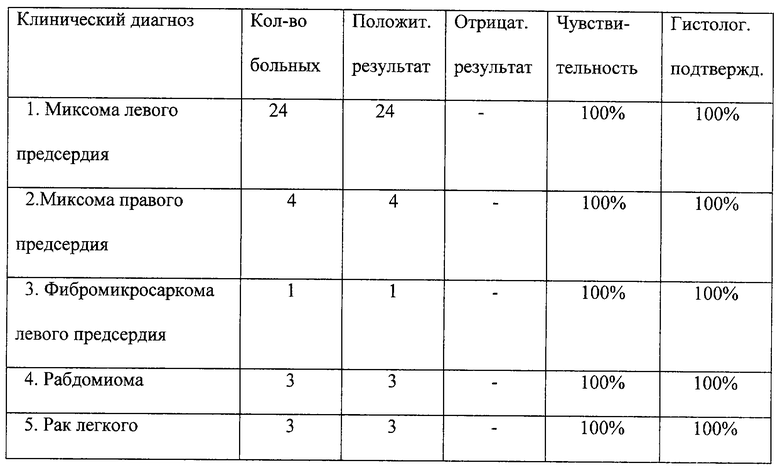
Исследование проведено на более чем 10 000 пациентах в различных клиниках Российской Федерации. В частности, исследования, проведенные в НЦ ССХ им. А. Н. Бакулева РАМН и в МСЧ 9 Министерства здравоохранения РФ, показали следующие результаты (см. таблицу). Из таблицы видно, что чувствительность метода очень высока и достигает практически 100%, подтверждая высокую диагностическую ценность сыворотки, полученной по способу согласно изобретению.
Антиидиотипическая сыворотка, получаемая по предлагаемому способу, эффективна при диагностике новообразований различной локализации и на любой стадии развития опухолевого процесса.
Изобретение относится к области медицины, а именно к иммунологии, и может быть использовано для диагностики злокачественных опухолевых заболеваний. Сущность способа заключается в том, что в сингенной системе на первом этапе производят введение в организм достоверно сингенного животного клеток эмбриональных тканей с хорионом, соответствующих 7-12-дневным эмбриональным тканям мышей, полученных от беременных самок животных этой же сингенной системы, на втором этапе по истечении 5-14 дней после ввода эмбриональных клеток от иммунизированного животного забирают лейкоциты и вводят их в организм сингенного с предыдущим животного, а по истечении 4-12 дней после проведения предыдущей иммунизации получают сыворотку путем забора крови животного, которую оставляют при комнатной температуре до образования плотного сгустка, а затем центрифугируют для полного оседания эритроцитов; полученную сыворотку отбирают, прогревают до 60oС, сорбируют на избытке гомогената клеток сингенных животных с последующим центрифугированием и фильтрацией. На обоих этапах возможна обработка вводимых клеток антимитотическим агентами, или введение их с иммуностимуляторами, или замена цельных клеток их мембранной фракцией. Техническим результатом является повышение эффективности и достоверности диагностики злокачественных опухолевых заболеваний. 1 з.п.ф-лы, 1 табл.
| Способ диагностики опухолей | 1992 |
|
SU1836640A3 |
| СПОСОБ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 1995 |
|
RU2111495C1 |
| СПОСОБ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ С ИСПОЛЬЗОВАНИЕМ СПЕЦИФИЧЕСКОЙ АНТИСЫВОРОТКИ К УНИВЕРСАЛЬНОМУ ОПУХОЛЕВОМУ АНТИГЕНУ | 1998 |
|
RU2137136C1 |
Авторы
Даты
2003-05-27—Публикация
2000-05-19—Подача