Изобретение относится к целевой везикулярной композиции для лечения инфекций Н. pylori и для защиты клетки.
Избыточная кислотность желудка и психический стресс ранее рассматривались как основные патофизиологические причины появления пептических язв. Marshall and Warren (Warren., Lancet, 1:1273-1275, 1893 and Marshall et al., Lancet, 2:1311-1315, 1984) впервые обнаружили неидентифицированные изогнутые палочковидные бактерии в желудке больных с язвой желудка или пептической язвой. Было показано, что эти бактерии, которые позже идентифицировали как грам-отрицательные спиралевидные бактерии и назвали Helicobacter pylori (Goodwin et al., Int. J. Syst. Bacteriol. 39: 397-405, 1989), ассоциированы с язвой желудка и пептической язвой (Buck et al., J. Infect. Dis. 153: 664-669, 1986 and Graham, Gasrtoenterology 96: 615-625, 1989).
Признание того, что пептическая язва является инфекционным заболеванием, вызванным бактериями Н. pylori, изменило подход к диагностике и терапии. Н. pylori участвует в этиологии хронических гастритов и пептического язвенного заболевания, а также карциномы желудка и лимфомы лимфоидной ткани, связанной со слизистой желудка, если инфекция существует в течение всей жизни (Forman et al., LanceL, 343, 243-244, 1994). Международным агентством раковых исследований (IARC, USA) недавно было заявлено, что Н. pylori является канцерогеном группы I, определяющим причину раковых заболеваний желудка человека.
Существует несколько патентов, в которых описаны различные способы лечения инфекций Н. pylori. В патенте США 5286492 описан способ лечения Н. pylori с помощью триклозана. В Европейском патенте 713392 описано применение клиохинола для лечения инфекций Н. pylori и родственных заболеваний. В Европейском патенте 676199 описано применение трифлоксацина или его производных для лечения инфекций Н. pylori. Европейский патент 750245 связан с использованием спирамицина для лечения желудочно-кишечных нарушений, вызванных Н. pylori. В патенте WIPO 9528929 описано применение амино-N-окисных антимикробных препаратов против инфекций Н. pylori.
В настоящее время лечение пептических язв лекарственными средствами, например блокаторами Н2-рецептора, ингибиторами секреции соляной кислоты в желудке и протекторами слизистой частично или полностью замещается антибиотиками, антимикробными препаратами. Было обнаружено, что режим тройной терапии (тетрациклин в комбинации с метронидазолом и дицитратовисмутатом трикалия, TDB) является более эффективным, чем монотерапия, но схема лечения больного и устойчивость к лекарствам ограничивает ее дальнейшее применение. Затруднения возникают с локализацией лекарственного средства с помощью подходящих систем доставки, поскольку они оседают у основания желудка и выводятся вместе с содержимым желудка. В результате лишь небольшое количество лекарственного средства доставляется к телу или дну желудка. Экологическая ниша Н. pylori благодаря тому, что бактерия располагается под слоями слизистой и развивает быструю устойчивость к антибиотикам (лекарственная устойчивость к вызывающему болезнь организму, происходящая либо вследствие непроницаемости бактериальной мембранной оболочки, либо вследствие продукции β-лактамаз) и может являться причиной неэффективности режимов монотерапии и (отчасти) тройной терапии. Системное введение с последующей локальной секрецией в желудочный сок рассматривают как способ, выбранный для доставки лекарственного средства к бактерии. К сожалению, только сильные основания проникают в желудок, а антибиотики, применяемые в лечении Н. pylori, являющиеся слабыми кислотами и основаниями, не поступают в кислую среду. На предыдущем уровне техники было описано всего лишь несколько систем доставки лекарственных средств, преодолевающих те трудности, которые возникают при использовании лекарственных средств для лечения инфекций Н. pylori. В патенте США 9624341 описан подход для создания лекарственных средств, таких как TDB, на основе жевательной резинки для доставки к зубной поверхности для удаления налета и пероральной локализованной доставки. Но эта доставка является неспецифической, и она неспецифически нацелена на клетки Н. pylori и имеет недостатки, обусловленные отсутствием специфичности. Кроме того, неприятные на вкус лекарственные средства не могут быть подходящими для лекарственных форм в виде жевательной резинки.
Поэтому следует учитывать, что существует необходимость новой системы доставки, преодолевающей биохимические и физико-химические препятствия в области инфицированного участка (т.е. слизистую оболочку желудка) и располагающей систему доставки непосредственно напротив линий клеток-мишеней с помощью специфических лигандов к системе цитопортера клеточной поверхности. Липосомы, образованные из липидов микроскопических везикул, были использованы для таргетирования лекарственных средств к различным участкам-мишеням, например, таким как грибковые клетки и раковые клетки. Множество исследований было выполнено на направляемых лигандом липосомных системах, действие которых основано, главным образом, на липосомных взаимодействиях, опосредованных антителом и углеводом. Это помогло выявить несколько концептуальных аспектов повышении стабильности in vitro и in vivo и таргетирующего потенциала по сравнению с нативными липосомами. Липосомы с присоединенным моноклональным антителом, специфическим для мишени, в качестве лиганда направляются к антигенам клеточной поверхности.
В данном изобретении заявители применили другую новейшую стратегию, основанную на специфических к углеводу лигандах - гликоконъюгатах, т.е. пектинах. Лектины представляют собой белки или гликопротеины, которые способны связывать моносахариды, олигосахариды и гликопротеины со специфичностью, подобной ферменту. Лектинизированные липосомы избирательно достигают соответствующих рецепторов, экспрессируемых на поверхности клеток-мишеней. Этими рецепторами являются цитопортеры, идентифицированные как гликосфинголипиды и гликопротеины.
Распознавание углеводных групп на поверхности клеток-мишеней предполагает применение углеводных эпитопов в качестве лигандов для целевой доставки лекарственных средств в цитоплазму. Концепция о поливалентности или мультивалентности, т. е. связывания с участком-мишенью посредством множественных взаимодействий, а именно через сродство к сахару и специфичность лектинов мембраны к гликоконъюгатам, рассматривается как сложный механизм. Среди гликоконъюгатных лигандов, гликолипиды, сфингогликолипиды, гликопротеины, лектины и полисахариды являются широко исследуемыми "пилотными" молекулами, которые селективно взаимодействуют с биопленками и доставляют содержимое внутрь клетки. Лектинизированные липосомы использовали для таргетирования клеток Hela (Liautard et al., Biol. Int. Rep., 2, 1123-1137, 1985), биопленок гликофорина A (IIutchinson et al., FEBS Lett. 234, 493-496, 1988), мышиных эмбрионов и трансформированных фибробластов (Bogdanor et al., Exp. Cel. Res., 181: 362-375, 1989), эритроцитов цыпленка (Carpenler et al., Anal. Biochem., 135: 151-155, 1983), и инфекции Streptococcus (Kaszuba et al., Biochem. Soc. Trans. , 19: 4165, 1991). Липосомы с присоединенными лектинами избирательно взаимодействуют с сахарами, экспрессированными на клеточной поверхности как гликоконъюгатами. Специфичность лектинов в отношении связывания с конкретным сахаром оценивали по сайт-направляющему компоненту или свойству. Таргетирование может быть реализовано путем взаимодействий, опосредованных углеводом.
Мультивалентные свойства лектинов придают им избирательность и сродство к бактериальным клеткам. Присоединенные лиганды [лектины, как, например, конканавалин A (Con А), агглютинин зародышей пшеницы (WGA) и агглютинин мозжечка крысы (RCA)] благодаря их специфичности и сродству к сахару специфически прилипают к гликокаликсу бактериальной биопленки. Таким образом, описанная в этом изобретении композиция может избирательно доставлять лекарственное средство не только к бактериальной клетке, но также и внутрь клетки через опосредованное рецептором поглощение.
Поэтому описанный в этом изобретении подход может быть применен для предупреждения язвы и канцерогенеза, связанных с инфекциями Н. pylori в верхнем отделе желудочно-кишечного тракта, одновременно для стерической защиты и обеспечения структурной целостности распадающихся клеточных линий слизистой оболочки. Описанная в настоящем изобретении новая композиция основана на липосомах, созданных с использованием WGA, ацилированного фосфатидилэтаноламином (РЕ) в качестве образующего пленку липидного компонента. РЕ сам по себе не в состоянии образовывать бислои (которые обычно принимают гексагональную инвертированную мицеллярную структуру вместо бислойного листа), однако при образовании производного с пальмитоилированным или ацилированным WGA/антителами он может образовывать стабильные везикулярные конструкции, вовлекающие водорастворимые вещества. При распределении ацилированного WGA-РЕ путем лиганд-рецепторной кластеризации система дестабилизируется и содержимое мгновенно высвобождается. Лектин служит в качестве лигандов и распознает аффинный к нему рецептор, экспрессированный на бактериальных оболочках. В результате липосома может разместиться на бактериальной оболочке, высвобождая свое антибактериальное содержимое. Кроме того, липидные компоненты могут служить в качестве предшественников простагландина или стимулирующих агентов, оказывающих защитное действие на клетку посредством биохимических манипуляций на участке воспаления.
Целью предлагаемой работы было сконструировать липидные везикулы, используя фосфатидилэтаноламин и его производные в качестве основных липидов. Впоследствии производное использовали для прикрепления белковых лигандов к поверхности. Ацилированные белковые якоря придают липосомам стабильность бислоя. Однако после последующего взаимодействия рецептора с лигандом они диссоциируют, оставляя бислои нестабилизированными. Результат может быть благотворно использован для высвобождения лекарственного средства как свидетеля в области предварительно выбранного участка. Таким образом, двойная функциональность ацилированных белков может придавать системе высокоспецифический терапевтический потенциал. Кроме того, белковые лиганды служат для того, чтобы обеспечить липосомам стабильность, особенно под действием стресса, имеющего место в биологической среде желудочно-кишечного тракта. Высвобождение свидетеля под действием стимулов, производимых мишенью, делает систему более чувствительной к мишени, увеличивая ее специфичность, и в результате эта система осуществляет монотерапию на эффективном уровне. Дальнейшей целью было обеспечить такие липидные составляющие предшественника простагландина, которые способствуют заживлению и восстановлению (защита и репарация клетки) дегенеративных и распадаюших клеток слизистой желудка на инфицированном участке.
Суммируя цели исследования, следует отметить, что изобретенные везикулярные конструкции, инкапсулирующие антибиотик амоксициллин в своих водных доменах, были получены с использованием РЕ вместе с фосфатидилхолином (PC) и холестерином (Chol), взятом в различном молярном отношении, и были стабилизированы ацилированной белковой оболочкой. Основной способ описан на фигуре 1.
Лектин придает системе биохимическую и физико-химическую стабильность. Эти везикулы, устойчивые к показателям желудочной секреции, таким как рН и пепсин, способны достигать целевого участка (участок изъязвления слизистой желудка, вызванного Н. pylori) посредством специфического к углеводу лиганда, ассоциированного с бактериальной биопленкой. Как только эти везикулы достигают бактериальной клеточной поверхности, структурная целостность основанных на РЕ/РС бислоев нарушается, высвобождая амоксициллин в область клеток-мишеней или внутрь клеток, уничтожая вызывающий болезнь организм. Липидный аналог PC может служить в качестве предшественника простагландина, обеспечивая существенными жирными кислотами воспаленную и деградированную слизистую желудка и защищая клетку.
В соответствии с настоящим изобретением в данном тексте описана композиция для лечения инфекций Н. pylori и для защиты клетки, которая содержит, % по весу:
Лектины - 1-20
Фосфолипиды - 20-80
Стерины - 0-50
Одно или более лекарственных средств - 0,1-80
Липосомы являются микроскопическими везикулами, в которых водная среда заключена в одном или во множестве фосфолипидных бислоев (i). Размер липосом может варьировать от 30 нм до 50 мкм в диаметре. В зависимости от количества слоев и размера липосомы могут быть разделены на категории
SUVs - малые монослойные липосомы
LUVs - большие монослойные липосомы
MLVs - многослойные липосомы
IUVs - монослойные липосомы промежуточного размера
MVVs - множественные везикулы
Бислои состоят в основном из фосфолипидов наряду со стеринами, добавленными для придания структурам жесткости и стабильности. Липосомы могут быть использованы для инкапсулирования как водорастворимых, так и растворимых в липидах лекарственных средств.
Липосомы имеют большой потенциал как системы доставки лекарственных средств. Их успешно используют для таргетирования противораковых и противогрибковых агентов.
Helicobacter pylori является бактерией, которую рассматривают как вызывающий болезнь организм в случаях хронического гастрита и пептической язвы, приводящих к карциноме желудка и лимфоме лимфоидных тканей, связанных со слизистой желудка. Этот организм располагается под слоем слизистой оболочки желудочно-кишечного тракта, и известно, что он развивает быструю устойчивость к антибиотикам. По этой причине обычно используемые режимы монотерапии или тройной терапии (тетрациклин, метронидазол и дицитратовисмутат трикалия) оказались неэффективными.
В данном изобретении заявители использовали способ таргетирования поверхности клеток-мишеней, объединенный с целевой доставкой лекарственного средства в цитоплазму, используя липосомы, в частности поверхностно-модифицированные, покрытые лигандом липосомы.
Эти липосомы, состоящие из фосфолипидов и холестерина и содержащие амоксициллин в своем водном компартменте, стабилизированы лектином. Лектин обеспечивает стабильность по отношению к желудочному секрету, а именно к рН и пепсину. Это позволяет интактным липосомам достичь клеток-мишеней, а именно изъязвленного участка слизистой, при помощи специфического к углеводу лиганда, ассоциированного с бактериальной оболочкой. При подходе к бактериальной клеточной поверхности мембрана липосом дестабилизируется и высвобождается амоксициллин вблизи от клеток-мишеней или внутрь клеток, уничтожая Н. pylori. Составные части разрушенной липосомной мембраны, т.е. фосфатидилхолин, в свою очередь служат в качестве цитопротекторов благодаря обеспечению существенными жирными кислотами воспаленной и деградированной слизистой оболочки желудка для ее репарации. Приготовление липосом проводили, как показано на блок-схеме, представленной на фигуре 1.
Вначале агглютинин зародышей пшеницы сочетали с пальмитиновой кислотой с получением пальмитоилированного WGA (PWGA) согласно процедуре, описанной Green and Huang (Green, S.C.; Huang, L., Anal. Biochem. 136: 151-155, 1983). Полученный ацилированный WGA добавляли к образованной пленке, полученной из фосфолипидов, т.е. из диолеоилфосфатидилэтаноламина (DOPE) и/или диолеоилфосфатидовой кислоты (DOA) наряду с холестерином (Chol), и подвергали действию ультразвука с получением липосом. Покрытие пленок WGA производили либо методом ковалентного покрытия, используя ацилированный WGA, либо путем индуцированного зарядом покрытия, используя немодифицированный WGA. Липосомы, свободные от белка, были получены для сравнения с использованием в основном такой же процедуры методом образования липидной пленки.
Отделения невключившегося материала достигали с помощью гель-фильтрационной колоночной хроматографии на сефадексе G-50-80 (грубый). Было показано, что элюируемые фракции около первого пика, фракции 10-30 (соответствующие пустому объему), содержат покрытые белком липосомы, и их собирали. Несвязавшееся лекарственное средство элюировалось позже во фракциях 35-45. Развитую систему липосом подвергали центрифугированию в линейном градиенте сахарозы, чтобы отделить немодифицированный WGA от липосом.
Характеристики формы липосом изучали с помощью трансмиссионной электронной микроскопии (JEM 1200 EX 11, JEOL, Japan), используя в качестве негативной краски фосфорновольфрамовую кислоту. Было найдено, что большинство липосом являются многослойными и сферическими по форме. Распределение частиц по размеру изучали с использованием техники лазерного светорассеяния (Autosizer IIC, Malvem Instrumenrs, France). Средний размер липосом составлял 5,5 микрон.
Дзета-потенциал липосом определяли с использованием спектрофотометра со светорассеянием для электрофореграмм (Zetasizer 4, Malvem Instrumants, UK) и было найдено, что он колебался между 25 и 40 мВ.
Эффективность инкапсулирования липосом определяли путем центрифугирования предварительно отдиализованной суспензии при 100000 g в течение 60 минут и промывания осадков 0,01 М PBS (рН 7,4) трижды. Везикулы лизировали тритоном Х-100 и содержание лекарственного средства измеряли спектрофотометрически. Эффективность инкапсулирования липосом заключалось в области между 31,8 и 40,5%. Липосомы, стабилизированные ацилированными белками и DOPE, обнаруживали более высокие значения по сравнению с липосомами с адсорбированным белком и ординарными липосомами.
Количество везикул в мм3 подсчитывали, используя гемоцитометр, с помощью микрофотографии (Leitz-Biomed, Germany)(Chatterjее, С.С., 1995, Human Physiology III ed. , National Book Centre, Calcutta, India, 328). Этот параметр вместе с выходом лекарственного средства изучали как показатель стабильности липосом суспензии. Выход лекарственного средства из липосом in vitro определяли против фосфатного буфера (рН 7,4) при 37 и 4oС, используя равновесный диализ. Было найдено, что покрытая белком система является более стабильной, на основании подсчета % везикул, а также из величины tD15 (время 15% выхода лекарственногo средства при диализе в среде), чем непокрытая композиции. Подобные исследования in vitro также были проведены в зависимости от рН, присутствия пепсина, трипсина и α-химотрипсина. Было найдено, что даже в SGF (имитируемой жидкости желудка) покрытые белком системы являются более стабильными, чем их ординарная модель.
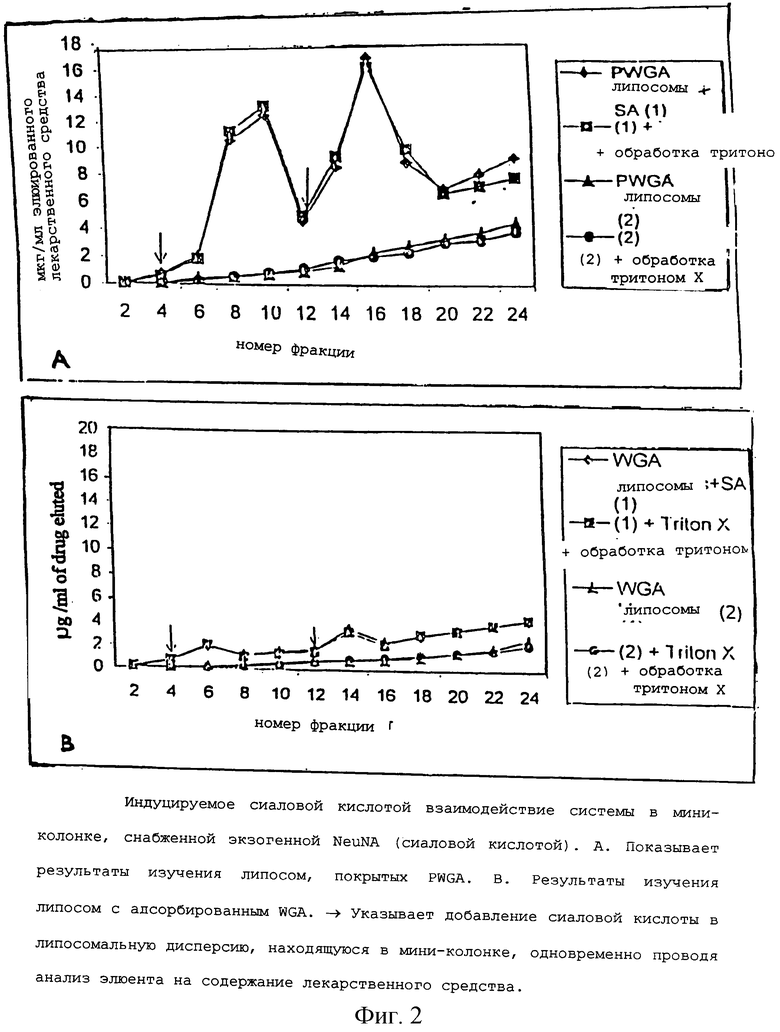
Лигандную специфичность липосом по отношению к сиаловой кислоте определяли путем изучения профиля элюции липосомной дисперсии до и после добавления сиаловой кислоты в мини-колонке с миллипоровой мембраной у основания. Результаты взаимодействия разработанной системы in vitro, индуцированного сиаловой кислотой, показаны на фигуре 2.
Результаты исследований показывают, что PWGA связывается с сиаловой кислотой, обеспечивая ее ковалентное связывание с липосомами. Дестабилизацию бислойной мембраны, происходящую как только ацилированный WGA связывается со свободной сиаловой кислотой, относят за счет импульса высвобожденного лекарственного средства и приписывают к чувствительной к мишени природе липосом.
В опытах in vitro клеточная специфичность липосом была исследована с использованием линии клеток Helicobacter pylori. Наблюдали значительное увеличение в связывании PWGA с липосомами по сравнению с ординарными липосомами и липосомами, полученными с WGA, с помощью адсорбционного метода. Результаты четко обнаруживают, что специфичность связывания липосом с клетками-мишенями различна и возрастает в случае, когда для покрытия используется ацилированный WGA.
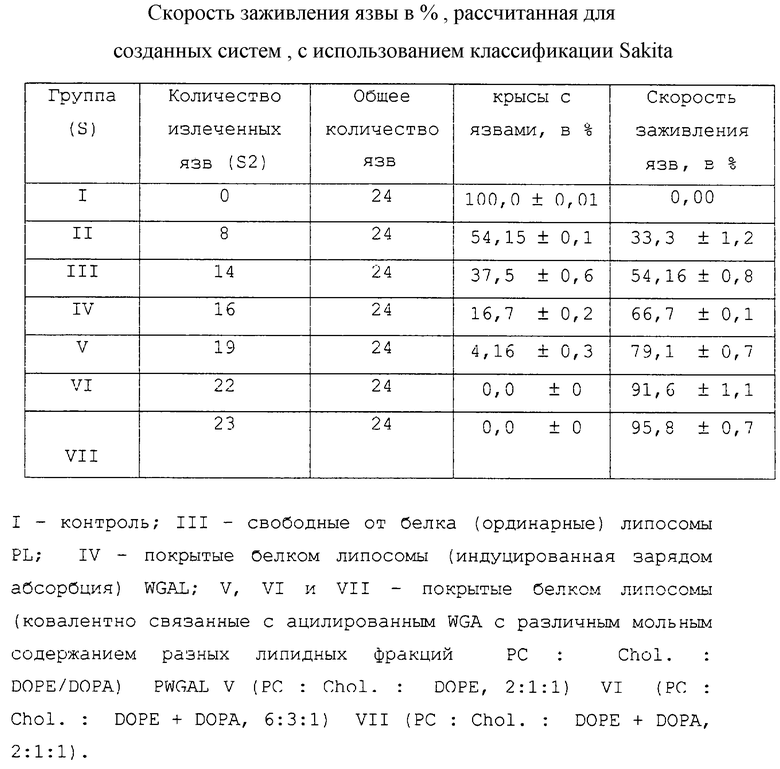
Репаративное и защитное действие на клетку полученных липосом оценивали у крысиных самцов-альбиносов линии Wistar. Изучали степень заживления явзы (%Ruh) после введения липосом против повреждений желудка, индуцированных NSAID, с последующим образованием колоний слизистой оболочки желудка с помощью перорально доставленной суспензионной культуры Н. felis. Степень изъязвления и скорость заживления язвы определяли по классификации Sakita (Sakita, Т., Oguro, Y., Miwa, Т., 1981, In: Handbook of Intestinal Endoscopy I ed., Tokyo: Chugi-Igakusha, 375-396) и Tamada (Tamada, F., 1992, In: Diagnostic and Therapeutic Gastrointestinal Endoscopy, KSH Hospital, 23-25). Гистопатологическое исследование слизистой желудка было выполнено с использованием фазово-контрастного микроскопа (Leitz-Biomed, Germany).
Результаты исследования по заживлению язвы даны в таблице 1.
Данные показывают, что среди различных тестируемых композиций система с покрытием из ацилированного агглютинина зародышей пшеницы дала самые хорошие результаты. Эти покрытые липосомы достигали почти 95,8% восстановления (заживление язвы) по сравнению с 33,3% восстановления с помощью амоксициллина при таком же уровне MIC90. Микрофотографией была подтверждена способность липосом, стабилизированных ацилированным WGA, к заживлению язвы, поскольку с ее помощью было обнаружено прикрепление везикул к клеточной поверхности с последующим иротективным действием везикул на клетку, которое предположительно опосредовано лиганд-рецепторным взаимодействием.
Выражение "везикулярные конструкции", которое применяют в данном описании, охватывает "липосомы", "ниосомы", "биосомы", "фармакосомы" и тому подобное.
В соответствии с настоящим изобретением описывают композицию для лечения инфекций Н. pylori и для защиты клетки, которая содержит, % по весу:
Лектины - 1-20
Фосфолипиды - 20-80
Стерины - 0-50
Одно или более лекарственных средств - 0,1-80
Лектины, используемые в настоящем изобретении, могут быть из растительного, животного или любого другого источника.
Лектины растительного происхождения могут быть выбраны из конканавалина А, агглютинина зародышей пшеницы, глицина А или могут быть получены из Telragonolobus purpuria, Viscum album, Vigna radiata. Lens culinaris, Lathyrus odoratus.
Лектины животного происхождения могут быть получены из макрофагов человека, перитонеальных лимфоцитов человека, перитонеальных макрофагов мыши, линии клеток В16 меланомы, мозжечка крысы, тимуса цыпленка.
Фосфолипиды, используемые в настоящем изобретении, могут быть фосфолипидами, принадлежащими к группе фосфатидилхолина, фосфатидилэтаноламина, фосфатидилсерина, фосфатидилглицерина, фосфатидовой кислоты и фосфатидилинозита, сфинголипидов.
Стерины, используемые в настоящем изобретении, могут быть холестерином, эргостерином, стигмастерином, ситостерином.
Лекарственными средствами, используемыми в настоящем изобретении, могут быть все лекарственные препараты, применяемые для антимикробного лечения Н. pylori, как, например, антибиотики, антагонисты Н2-рецепторов, протекторы, вяжущие средства и антациды.
Антибиотиками могут быть амиксициллин, кларитромицин, тетрациклин. Антипротозойными средствами могут быть метронидазол, омидазол. Антагонистами могут быть висмут и его соли. Блокаторами Н2-рецепторов могут быть омепразол, циметидин и ранитидин.
Подробное описание композиций
Количество составляющих в композициях приведены в % по весу.
Пример I. Дегидратированная по типу повторной гидратации
Пальмитоилированный агглютинин зародышей пшеницы - 0,7
Диолеоилфосфатидилэтаноламин - 0,7
Фосфатидилхолин - 48
Холестерин - 14
Амоксициллин или его соль - 22
Наполнители - 0,2
Всего - 100
1. Пальмитоилированный агглютинин зародышей пшеницы сочетали с диолеоилфосфатидилэтаноламином путем инкубации при комнатной температуре в течение 24 часов. Для очистки аддукта проводили гель-фильтрационную хроматографию на колонке с сефадексом в фосфатном буфере. Раствор сушили при температуре ниже 0oС.
2. Высушенный при температуре ниже 0oС аддукт вместе с фосфатидилхолином и холестерином растворяли в диэтиловом эфире и получали липидную пленку.
3. Образованную пленку подвергали гидратированию, используя раствор амоксициллина.
4. Смесь на стадии 3 инкубировали в течение 2 часов и подвергали действию ультразвука в течение 10 минут в 2 цикла.
5. Смесь на стадии 4 диализовали и/или центрифугировали для того, чтобы удалить свободное лекарственное средство, и лиофилизировали.
6. Постоянную атмосферу N2 поддерживали на протяжении всего процесса.
Пример II. Дегидратированная по типу восстановления
Диолеоилфосфатидилэтаноламин - 0,7
Фосфатидилхолин - 48
Холестерин - 14
Метронидазол - 22
Пальмитоилированный агглютинин зародышей пшеницы - 0,7
Наполнители - 0,2
Всего - 100
1. Диолеоилфосфатидилэтаноламин, фосфатидилхолин и холестерин растворяли в диэтиловом эфире. Растворитель упаривали с образованием тонкой пленки из липидов.
2. Образованную пленку подвергали гидратированию, используя метронидазол в буфере.
3. Смесь на стадии 2 инкубировали в течение 24 часов для гидратировапия. Гидратировапную суспензию подвергали действию ультразвука в течение 10 минут.
4. Добавляли пальмитоилированный агглютинин зародышей пшеницы и смесь инкубировали в течение еще 12 часов и затем диализовали и лиофилизировали.
5. Постоянную атмосферу N2 поддерживали на протяжении всего процесса.
Пример III.
Диолеоилфосфатидилэтаноламин - 0,4
Диолеоилфосфатидовая кислота - 0,4
Холестерин - 23
Фосфатидилхолин - 44
Пальмитоилированный агглютинин зародышей пшеницы - 0,8
Ранитидина гидрохлорид - 16
Наполнители - 0,1
Всего - 100
1. Диолеоилфосфатидилэтаноламин, диолеоилфосфатидовую кислоту, холестерин и фосфатидилхолин растворяли в диэтиловом эфире. Растворитель упаривали с образованием тонкой пленки из липидов.
2. Пальмитоилированный агглютинин зародышей пшеницы добавляли к образованной пленке и смесь инкубировали в течение 12 часов.
3. Смесь на стадии 2 подвергали гидратированию, используя раствор ранитидина гидрохлорида в буфере, и инубировали в течение 24 часов.
4. Гидратированную суспензию подвергали действию ультразвука в течение 10 минут и затем диализовали и лиофилизировали.
5. Постоянную атмосферу N2 поддерживали на протяжении всего процесса.
Пример IV.
Диолеоилфосфатидилэтаноламин - 0,7
Диолеоилфосфатидовая кислота - 0,7
Фосфатидилхолин - 28
Холестерин - 14
Пальмитоилированный агглютинин зародышей пшеницы - 14
Амоксициллин или его соль - 28
Наполнители - 0,2
Всего - 100
1. Диолеоилфосфатидилэтаноламин, диолеоилфосфатидную кислоту, холестерин и фосфатидилхолин растворяли в диэтиловом эфире. Растворитель упаривали с образованием тонкой пленки из липидов.
2. Образованную пленку подвергали гидратированию, используя раствор амоксициллина в буфере, и инкубировали в течение 24 часов.
3. К смеси на стадии 2 добавляли пальмитоилированный агглютинин зародышей пшеницы и инкубировали в течение 12 часов.
4. Гидратированную суспензию подвергали действию ультразвука в течение 10 минут и затем диализовали и лиофилизировали.
5. Постоянную атмосферу N2 поддерживали на протяжении всего процесса.
Пример V. Готовая к использованию
Дистеароилфосфатидилхолин (DSPC) - 20
Фосфатидилхолин - 20
Холестерин - 20
Фосфатидилэтаноламин - 10
Пальмитоилированный агглютинин зародышей пшеницы - 10
Ранитидина гидрохлорид - 18
Наполнители - 0,2
Всего - 100
1. Дистеароилфосфатидилхолин, холестерин, фосфатидилхолин, фосфатидилэтаноламин растворяли в диэтиловом эфире. Растворитель упаривали с образованием тонкой пленки из липидов.
2. Образованную пленку подвергали гидратированию, используя раствор ранитидина гидрохлорида и буфере, и инкубировали в течение 24 часов.
3. К смеси на стадии 2 добавляли пальмитоилированный агглютинин зародышей пшеницы и инкубировали в течение 12 часов.
4. Гидратированную суспензию подвергали действию ультразвука в течение 10 минут и затем диализовали и лиофилизировали.
5. Постоянную атмосферу N2 поддерживали на протяжении всего процесса.
Пример VI.
Дистеароилфосфатидилхолин (DSPC) - 23
Фосфатидилхолин - 23
Холестерин - 12
Фосфатидовая кислота - 0,5
Тетрациклина гидрохлорид - 23
Пальмитоилированный агглютинин зародышей пшеницы - 10
Наполнители - 0,4
Всего - 100
1. Дистеароилфосфатидилхолин, холестерин, фосфатидилхолин, фосфатидовую кислоту растворяли в диэтиловом эфире. Растворитель упаривали с образованием тонкой пленки из липидов.
2. Образованную пленку подвергали гидратированию, используя раствор тетрациклина гидрохлорида в буфере, и инкубировали в течение 2 часов при 45oС.
3. К смеси на стадии 2 добавляли пальмитоилированный агглютинин зародышей пшеницы и инкубировали в течение 12 часов.
4. Гидратированную суспензию подвергали действию ультразвука в течение 10 минут и затем диализовали и лиофилизировали.
5. Постоянную атмосферу N2 поддерживали на протяжении всего процесса.
Пример VII.
Димиристоилфосфатидилхолин (DMPC) - 15
Дистеароилфосфатидилхолин (DSPC) - 15
Фосфатидовая кислота - 0,8
Холестерин - 15
Пальмитоилированный агглютинин зародышей пшеницы - 15
Висмута фосфат - 30
Наполнители - 0,2
Всего - 100
1. Димирисоилфосфатидилхолин, дистеароилфосфатидилхолин, фосфатидовую кислоту, холестерин растворяли в диэтиловом эфире. Растворитель упаривали с образованием тонкой пленки из липидов.
2. Образованную пленку подвергали гидратированию, используя раствор фосфата висмута в буфере, и инкубировали в течение 2 часов при 45oС.
3. К смеси на стадии 2 добавляли пальмитоилированный агглютинин зародышей пшеницы и инкубировали в течение 12 часов.
4. Гидратированную суспензию подвергали действию ультразвука в течение 10 минут и затем диализовали и лиофилизировали.
5. Постоянную атмосферу Ns поддерживали на протяжении всего процесса.
Пример VIII.
Дистеароилфосфатидилхолин (DSPC) - 20
Фосфатидилхолин - 20
Холестерин - 10
Фосфатидовая кислота - 10
Диолеоилфосфатидилэтаноламин - 10
Пальмитоилированный агглютинин зародышей пшеницы - 10
Циметидина гидрохлорид - 19
Наполнители - 0,1
Всего - 100
1. Дистеароилфосфатидилхолин, фосфатидилхолин, фосфатидовую кислоту, холестерин растворяли в диэтиловом эфире. Растворитель упаривали с образованием тонкой пленки из липидов.
2. Образованную пленку подвергали гидратированию, используя раствор цимитидина гидрохлорида в буфере, и инкубировали в течение 2 часов при 45oС.
3. К смеси из стадии 2 добавляли пальмитоилированный агглютинин зародышей пшеницы и инкубировали в течение 12 часов.
4. Гидратированную суспензию подвергали действию ультразвука в течение 10 минут и затем диализовали и лиофилизировали.
5. Постоянную атмосферу N2 поддерживали на протяжении всего процесса.
Пример IX.
Диолеоилфосфатидилэтаноламин - 0,4
Диолеоилфосфатидовая кислота - 0,4
Холестерин - 20
Фосфатидилхолин - 41
Пальмитоилированный агглютинин зародышей пшеницы - 0,8
Кларитромицин - 32
Наполнители - 0,1
Всего - 100
1. Диолеоилфосфатидилэтаноламин, диолеоилфосфатидовую кислоту, холестерин и фосфатидилхолин растворяли в диэтиловом эфире. Растворитель упаривали с образованием тонкой пленки из липидов.
2. Пальмитиолированный агглютинин зародышей пшеницы добавляли к образованной пленке и смесь инкубировали в течение 12 часов.
3. Смесь на стадии 2 подвергали гидратированию, используя раствор кларитромицина в буфере, и инкубировали в течение 24 часов.
4. Гидратированную суспензию подвергали действию ультразвука в течение 10 минут и затем диализовали и лиофилизировали.
5. Постоянную атмосферу N2 поддерживали на протяжении всего процесса.
Пример X.
Диолеоилфосфатидилэтаноламин - 10
Диолеоилфосфатидовая кислота - 0,7
Фосфатидилхолин - 40
Холестерин - 26
Пальмитоилированный агглютинин зародышей пшеницы - 14
Омепразол натрия - 0,1
Наполнители - 0,2
Всего - 100
1. Диолеоилфосфатидилэтаноламин, диолеоилфосфатидовую кислоту, холестерин и фосфатидилхолин растворяли в диэтиловом эфире. Растворитель упаривали с образованием тонкой пленки из липидов.
2. Образованную пленку подвергали гидратированию, используя раствор омепразола в буфере, и инкубировали в течение 24 часов.
3. Пальмитоилированный агглютинин зародышей пшеницы добавляли к смеси на стадии 2 и инкубировали в течение 12 часов.
4. Гидратированную суспензию подвергали действию ультразвука в течение 10 минут и затем диализовали и лиофилизировали.
5. Постоянную атмосферу N2 поддерживали на протяжении всего процесса.
Изобретение относится к области фармакологии и касается композиции в виде липосом для лечения инфекций H. pylori и для защиты клетки. Изобретение заключается в том, что композиция содержит лектины, фосфолипиды, стерины, одно или более лекарственных средств. Эта композиция подходит не только для лечения инфекции H. pylori и других заболеваний, связанных с этой инфекцией, но и для защиты клеточных стенок. Изобретение обеспечивает повышение стабильности липосом, в результате может быть благотворно использовано для высвобождения средства, которое способствует заживлению и восстановлению дегенативных и распадающихся клеток слизистой желудка на инфицированном участке. 9 з.п.ф-лы, 2 ил., 1 табл.
| Основание секции шахтной механизированной крепи | 1972 |
|
SU481701A1 |
| US 5478819 А, 26.12.1998 | |||
| WO 9628141 А, 19.09.1996. | |||
Авторы
Даты
2003-06-27—Публикация
2000-01-24—Подача