Перекрестная ссылка на родственные заявки
В этой заявке испрашивается приоритет по патентной заявке Японии No. 2005-67469, поданной 10 марта 2005 г., содержание которой включено сюда путем ссылки во всей своей полноте.
Уровень техники
Эффективность лечения многих заболеваний, включая рак, существенно улучшилась в течение последних нескольких десятилетий, однако, многие схемы лечения требуют применения лекарственных веществ с опасными побочными эффектами, включая, например, алопецию, тошноту, рвоту, слабость и т.д. При некоторых схемах введения может также назначаться применение лекарственных веществ, которые не стабильны в физиологических условиях, например биологические терапевтические средства (например, гены или продукты генов) и/или другие лекарственные вещества, которые легко распадаются или другим образом изменяются при введении и таким образом теряют свою эффективность до достижения желаемого терапевтического результата. Такая нестабильность также делает более трудными и дорогими хранение лекарственных веществ и получение препаратов для введения.
Существует ряд классов противораковых агентов, охватывающих около 100 конкретных лекарственных веществ, а также многочисленные схемы комбинированной лекарственной терапии, способы доставки и схемы лечения. Противораковые агенты можно классифицировать в соответствии с несколькими критериями, такими как класс соединения и заболевание, подвергаемое лечению. Разработаны определенные агенты, имеющие преимущества при быстром делении раковых клеток и направленно действующие на конкретных фазах клеточного цикла, представляя другой способ классификации. Агенты могут быть также сгруппированы в соответствии с типом и тяжестью их побочных эффектов или способа доставки. Однако наиболее общепринятой классификацией противораковых агентов, основанных не на биотерапии, является классификация по классу химического соединения, что широко охватывает механизм действия этих соединений.
В зависимости от источника информации существуют небольшие различия в классификации противораковых агентов. Классы соединений описываются в Physician's Desk Reference следующим образом: алкалоиды; алкилирующие агенты; противоопухолевые антибиотики; антиметаболиты; гормоны и аналоги гормонов; иммуномодуляторы; фотосенсибилизирующие агенты; и другие разнородные агенты.
Соединения класса алкалоидов могут быть также обозначены как ингибиторы митоза, так как они являются специфическими для определенной фазы клеточного цикла и предназначены для ингибирования митоза или ингибирования ферментов, требуемых для митоза. Они происходят обычно из растительных алкалоидов и других природных продуктов и действуют в течение M-фазы клеточного цикла. Этот класс соединений часто используют для лечения неоплазий, таких как острый лимфобластный лейкоз, лимфома Ходжкина и неходжкинская лимфома; нейробластомы и рак легких, молочной железы и семенников.
Алкилирующие агенты представляют собой большой класс химиотерапевтических агентов, включающий следующие подклассы, каждый из которых представляет собой ряд индивидуальных лекарственных веществ: алкилсульфонаты; азиридины; этиленимины и метилмеламины; производные горчичного газа; производные нитрозомочевины; и другие, включая соединения платины. Алкилирующие агенты атакуют неопластические клетки путем прямого алкилирования ДНК клеток и, следовательно, вызывают неправильную репликацию ДНК. Этот класс соединений обычно используют для лечения разнообразных заболеваний, включая хронические лейкозы, лимфому неходжкинского типа, лимфому Ходжкина, множественную миелому и определенные типы рака легких, молочной железы и яичников.
Производные нитрозомочевины часто входят в категорию алкилирующих агентов, и они имеют сходный механизм действия, но вместо прямого алкилирования ДНК они ингибируют ферменты репарации ДНК, вызывая нарушение репарации. Эти соединения имеют преимущества, будучи способными пересекать гематоэнцефалический барьер и, следовательно, могут быть использованы для лечения опухолей мозга.
Противоопухолевые антибиотики обладают противомикробной и цитотоксической активностью и также воздействуют на ДНК путем химического ингибирования ферментов и митоза или путем изменения клеточных мембран. Они не являются специфичными для фаз клеточного цикла и широко используются для лечения рака.
Антиметаболитный класс противораковых агентов воздействует на рост ДНК и РНК и является специфичным для S-фазы клеточного цикла. Они могут быть разделены далее по типу соединения, что включает аналоги фолиевой кислоты, аналоги пуринов и аналоги пиримидинов. Они часто применяются при лечении хронических лейкозов, опухолей молочной железы, яичника, желудочно-кишечного тракта.
Существует два класса гормонов или аналогов гормонов, применяемых в качестве противораковых агентов, это кортикостероидные гормоны и половые гормоны. Тогда как некоторые кортикостероидные гормоны могут как убивать раковые клетки, так и замедлять рост опухоли, и они используются для лечения лимфомы, лейкозов и т.д., половые гормоны функционируют в первую очередь снижая рост раковых опухолей молочной железы, простаты и эндометрия. Существуют многочисленные подклассы гормонов и гормональных аналогов, включая андрогены, антагонисты гормонов коры надпочечников, антиандрогены, антиэстрогены, ингибиторы ароматазы, эстрогены, аналоги высвобождающего фактора лютеинизирующего гормона (LHRH) и прогестины.
Дополнительный небольшой класс противораковых агентов классифицируется как иммунотерапевтический. Существуют агенты, которые предназначены для стимуляции иммунной системы для более эффективной атаки на неопластические (раковые) клетки. Эту терапию часто используют в сочетании с другими видами терапии.
Существует также ряд соединений, таких как кампотектины, которые обычно перечисляют как «другие» противораковые агенты, и они могут быть применены для лечения разнообразных неоплазий.
Сочетания противораковых агентов также применяются для лечения ряда типов рака. Например, Sanofi Syntholabo продает ELOXATIN™ (оксалиплатин для инъекций) для лечения колоректального рака для применения в сочетании с 5-фторурацилом и леувокорином. Это сочетание лекарственных веществ часто применяют совместно с хирургическим вмешательством при лечении колоректального рака. Оксалиплатин представляет собой алкилирующий агент, который, как считается, действует путем ингибирования как репликации, так и транскрипции ДНК. В отличие от других агентов, содержащих платину, оксалиплатин продемонстрировал пониженную вероятность развития устойчивости. Оксалиплатин дополнительно описан в патентах США Nos. 4169846; 5338874; 5298642; 5959133; 5420319; 5716988; 5290961; и в Wilkes GM. "New therapeutic options in colon cancer: focus on oxaliplatin " Clin J Oncol Nurs. (2002) 6:131-137.
Несмотря на то что существует множество противораковых агентов, преимущества данных соединений часто перевешиваются тяжестью побочных эффектов, оказываемых агентом. Это соотношение часто обозначается как терапевтический индекс, который описывает баланс между требуемой дозой для достижения разрушения раковых клеток по сравнению с дозой, при которой вещество неприемлемо токсично для индивидуума. Препятствием для большинства противораковых агентов является относительно низкий диапазон терапевтического индекса (т.е. узкий диапазон доз, при которых раковые клетки разрушаются без неприемлемой токсичности для индивидуума). Эта характеристика лимитирует частоту и дозировку, когда агент полезен, и часто побочные эффекты становятся непереносимыми до того, как рак может быть полностью искоренен.
Тяжелые побочные эффекты, случающиеся при большинстве типов химиотерапии рака, являются результатом неспецифической природы этих лекарственных веществ, которые не делают различий между здоровыми и раковыми клетками, и взамен разрушают и те, и другие. С помощью определенных лекарственных веществ, специфичных для фаз клеточного цикла, пытаются уменьшить эти эффекты, направленно действуя на фазу клеточного цикла, вовлеченную в репликацию и деление клетки. Эти лекарственные вещества, однако, не делают различий между раковыми клетками и здоровыми клетками, которые находятся в состоянии нормального клеточного деления. Клетки, которые наиболее страдают от этих типов химиотерапии, представляют собой те, которые часто подвергаются клеточному делению, включая клетки крови, клетки волосяных фолликулов и клетки полового и пищеварительного трактов.
Наиболее общими побочными эффектами противораковых агентов являются тошнота и рвота. Большая часть индивидуумов страдает также от миелосуппрессии или подавления функций костного мозга, который продуцирует красные клетки крови, белые клетки крови и тромбоциты. Эти и другие побочные эффекты также усугубляются подавлением иммунной системы, сопровождающимся деструкцией и отсутствием продукции белых клеток крови и связанным с этим риском оппортунистической инфекции.
Другие побочные эффекты, обычные для широкого спектра противораковых агентов, включают: потерю волос (алопецию); потерю веса; изменения вкуса; стоматит и эзофагит (воспаление и язвы); запор; диарею; слабость; повреждение сердца; изменения нервной системы; повреждение легких; повреждение репродуктивных тканей; повреждение печени; повреждение почек и мочевой системы.
Широкий диапазон побочных эффектов, связанных с большинством противораковых агентов и их тяжесть у индивидуумов, которые уже ослаблены заболеванием и возможно иммунодефицитны, заставил исследователей искать механизмы, с помощью которых они могут облегчить некоторые из побочных эффектов, поддерживая в то же время эффективность лечения. Было предпринято несколько подходов к этой проблеме. Они включают сочетанную химиотерапию, когда множество противораковых агентов вводят совместно; адъювантную терапию, когда дополнительные агенты прописывают вместе с противораковым агентом для борьбы с побочными эффектами противоракового агента; сочетание лечения разной модальности, когда химиотерапию сочетают с облучением и/или хирургическим вмешательством; альтернативные носители для доставки для введения противораковых агентов, липосомы с инкапсулированными противораковыми агентами.
Липосомы образуются, когда фосфолипиды и их производные диспергируются в воде. При дисперсии в воде фосфолипиды образуют замкнутые пузырьки, называемые «липосомами», которые характеризуются липидными бислоями, инкапсулирующими водную основу. Различные липосомы применялись в качестве носителей для заключения в них терапевтических агентов, таких как лекарственные вещества, ферменты и генетические последовательности для применения в медицинской науке, в фармацевтической науке и в биохимии.
Примеры липосомных композиций включают патенты США Nos. 4983397; 6476068; 5834012; 5756069; 6387397; 5534241; 4789633; 4925661; 6153596; 6057299; 5648478; 6723338; 6627218; патентные заявки США Nos: 2003/0224037; 2004/0022842; 2001/0033860; 2003/0072794; 2003/0082228; 2003/0212031; 2003/0203865; 2004/0142025; 2004/0071768; международные патентные заявки WO 00/74646; WO 96/13250; WO 98/33481; Papahadjopolulos D, Allen TM, Gbizon A, et al., «Sterically stabilized liposomes: Improvements in pharmacokinetics and antitumor therapeutic efficacy» Proc Natl Acad Sci U.S.A. (1991) 88: 11460-11464; Allen TM, Martin FJ. «Advantages of liposomal delivery systems for anthracyclines» Semin Oncol (2004) 31: 5-15 (suppl 13). Weissig et al. Pharm. Res. (1998) 15: 1552-1556.
На более ранних стадиях разработки липосом применяли существующие в природе фосфолипиды клеточной мембраны, такие как фосфолипиды яичного желтка и фосфолипиды сои. В случае их внутривенного введения, однако, липосомы, использующие эти фосфолипиды, вероятно, включались в ретикулоэндотелиальную систему печени или селезенки, создавая проблему короткого периода пребывания в крови в результате чего снижая эффективность лекарственного вещества. После этого, в виде способа решения этой проблемы в качестве составляющей мембраны липосом применяли синтетические фосфолипиды, чья липидная часть содержит только насыщенные связи, для того, чтобы сделать более твердой мембрану липосом.
При попытке увеличить период полужизни в циркуляторном русле и избежать захвата ретикулоэндотелиальной системой исследователи разработали липосомы, которые были модифицированы включением полиэтиленгликоля или других гидрофильных полимеров (например, ПЭГ липосому, в которой один или более из составляющих липидов были модифицированы присоединением ПЭГ). Модифицированные ПЭГ липосомы часто также обозначались как «экранированные» липосомы. Doxil™ (липосомы с доксорубицином HCl для инъекций) представляет собой заключенный в липосомы доксорубицин с добавлением полиэтиленгликоля (ПЭГ), применяемого для избегания ретикулоэндотелиальной системы (RES) и пролонгирования времени циркуляции лекарственного вещества. Смотри Vail DM, Amantea MA, Colbern GT, et al, «Pegylated Liposomal Doxorubicin: Proof of Principle Using Preclinical Animal Models and Pharmacokinetic Studies.» Semin Oncol. (2004) 31 (Suppl 13): 16-35. Однако неблагоприятные эффекты вызывались также пролонгированным удерживанием в крови (например, синдром руки и стопы, неблагоприятный эффект Doxil™ на периферическую систему и т.д.), что становилось признанной проблемой.
Примеры липосом включают патенты США Nos. 4983397; 5013556; 6316024; 6056973; 5945122; 5891468; 6126966; 5593622, 5676971; 6586559; и 5846458, публикации патентных заявок США Nos. 2003/0224037; 2004/0022842; 2003/0113262; 2002/0136707; международные патентные заявки WO 99/30686; WO 02/41870 Aliminana et al., Prep. Biochem. Biotech. (2004) 34(1): 77-96. Липосомы описаны также в патентах США Nos. 6228391; 6197333; 6046225; 5292524; и в публикациях патентных заявок США Nos. 20050271588; 20040213833; 20040029210; 20030175205; 20030162748; 20030130190; 20030059461; и 20020034537.
В дополнение к липосомам, модифицированным ПЭГ, исследователи разработали множество других производных липидов. Эти производные липидов могут быть также включены в липосомы. Смотри, например: международную патентную заявку WO 93/01828; Park YS, Maruyama K, Huang L. «Some negatively charged phospholipids derivatives prolong the liposome circulation in vivo.» Biochimica et Biophysica Acta (1992) 1108: 257-260; Ahl et al., Biochimica Biophys. Acta (1997) 1329: 370-382.
Дополнительные липидные композиции описаны в патентах США Nos. 6936272; 6897196; 6077834; и в публикациях патентных заявок США Nos. 20050136064; 20040234588; 20030215490; 20030166601; и 20010038851.
В дополнение к модификации липосом ПЭГ и другими гидрофильными полимерами, исследователи также разработали липосомы, которые предназначены для специфической направленной доставки к конкретным типам клеток с помощью включения направляющих факторов (также обозначаемых как направляющие лиганды) для конкретных типов клеток. Примеры направляющих факторов/лигандов включают асиалогликопротеин, фолат, трансферрин, антитела и т.д. В некоторых случаях один или более составляющих липидов может быть модифицировано путем присоединения направляющего фактора.
Примеры липидных композиций, включающих направляющие факторы, включают патенты США Nos. 5049390; 5780052; 5786214; 6316024; 6056973; 6245427; 6524613; 6749863; 6177059; 6530944; патентные заявки США Nos. 2004/0022842; 2003/0224037; 2003/143742; 2003/0228285; 2002/0198164; 2003/0220284; 2003/0165934; 2003/0027779; международные патентные заявки Nos. WO 95/33841; WO 95/19434; WO 2001037807; WO 96/33698; WO 2001/49266; WO 9940789; WO 9925320; WO 9104014; WO 92/07959; EP 1369132; JP 2001002592; Iinuma H, Maruyama K, et al., «Intracellular targeting therapy of cisplatin-encapsulated transferrin-polyethylene glycol liposome on peritoneal dissemination of gastric cancer» Int J Cancer (2002) 99 130-137; Ishida O, Maruyama K, Tanahashi H, Iwatsuru M, Sasaki K, et al., «Liposomes bearing polyethylene glycol-coupled transferrin with intracellular targeting property to the solid tumors in vivo.» Pharmaceutical Research (2001) 18: 1042-1048; Holmberg et al., Biochem. Biophys. Res. Comm. (1989) 165(3): 1272-1278; Nam et al., J. Biochem. Mol Biol (1998) 31(1): 95-100; Nag et al., J. Drug Target. (1999) 6(6): 427-438.
В частности, Iinuma et al. разработали Tf-ПЭГ-липосому с трансферрином (Tf), присоединенным к поверхности липосомы. Iinuma et al. показали, что большее количество липосом связывалось с поверхностью опухолевых клеток и наблюдался более высокий захват липосом опухолевыми клетками в случае Tf-ПЭГ липосом по сравнению с ПЭГ-липосомами (Inuma et al., там же; Ishida et al., там же).
Однако, несмотря на последние достижения, сделанные в области доставки лекарственных веществ и меченых соединений, включая применение композиций липосом, все еще сохраняется потребность в усовершенствованных липидных композициях для доставки лекарственных веществ и меченых соединений к конкретным клеткам и/или тканям, за счет чего достигается терапевтический или диагностический эффект. В частности, в области онкологии лекарственные составы с улучшенной специфичностью и сниженной токсичностью необходимы для уверенного терапевтического успеха без неблагоприятного влияния на здоровые клетки и также без индукции опасных побочных эффектов у индивидуума, подвергаемого лечению. Сходно, меченые соединения, которые могут быть применены для диагностики состояний, особенно угрожающих жизни состояний, на ранней стадии (например, с высокой специфичностью и/или высокой чувствительностью) и также для точного мониторинга тяжести/степени состояния (например, прогрессии или регрессии с или без лечения), должны также существенно улучшить качество и успешность терапии.
Краткое изложение сущности изобретения
Настоящее изобретение относится к новым содержащим липиды композициям (включая липосомы (например, липосомы направленного действия, ненагруженные липосомы), липидные смеси и содержащие липосомы композиции), которые могут необязательно включать лекарственное вещество или меченое соединение или могут быть применены для получения составов, которые включают лекарственное вещество или меченое соединение, где содержащая липиды композиция создает преимущества в плане снижения побочных эффектов лекарственного вещества или меченого соединения, и/или также предотвращения разрушения, и/или потери эффективности лекарственного вещества или меченого соединения. Изобретение также включает способы получения и применения описанных здесь содержащих липиды композиций. В определенных аспектах изобретения содержащие липиды композиции могут быть применены для лечения или диагностики рака (например, рака молочной железы, рака желудка, колоректального рака, рака ободочной кишки, рака поджелудочной железы, не мелкоклеточного рака легких, мелкоклеточного рака легких, рака мозга, рака печени, рака почки, рака простаты, рака мочевого пузыря, рака яичника или гематологических злокачественных заболеваний (например, лейкоза, лимфомы, множественной миеломы и т.д.).
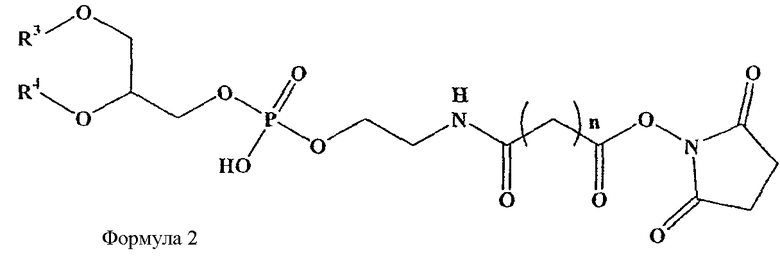
В определенных воплощениях предлагаются липосомы направленного действия, включающие один или более фосфолипидов, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, инкапсулированное лекарственное вещество или меченое соединение и необязательно, по меньшей мере, один дополнительный липид, где модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина включает направляющий лиганд, присоединенный к второму производному N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и где производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1,
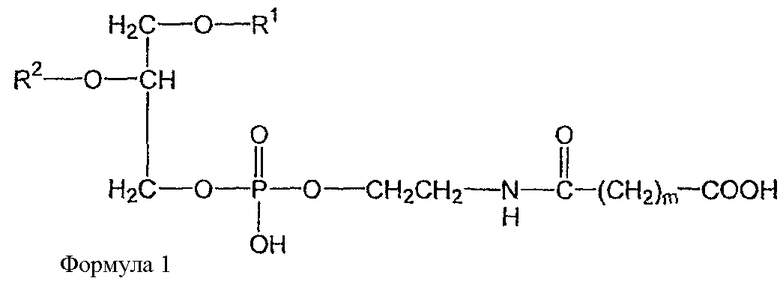
и второе производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 3,
где R1, R2, R5 и R6 каждый независимо представляет собой ацильную группу, и m и p независимо представляют собой целое число от 1 до 10; и где липосома не включает немодифицированный фосфатидилэтаноламин или полиэтиленгликоль и где направляющий лиганд не представляет собой интактное антитело.
В других воплощениях предлагаются ненагруженные липосомы, включающие один или более фосфолипидов, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и необязательно, по меньшей мере, один дополнительный липид, где модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина включает направляющий лиганд, присоединенный к второму производному N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина; и где производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1

и второе производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 3

где R1, R2, R5 и R6 каждый независимо представляет собой ацильную группу, и m и p независимо представляют собой целое число от 1 до 10; и где липосома не включает немодифицированный фосфатидилэтаноламин, полиэтиленгликоль, лекарственное вещество или меченое соединение и где направляющий лиганд не представляет собой интактное антитело.
В определенных воплощениях липосом направленного действия и ненагруженных липосом R1, R2, R5 и R6 представляют собой олеоил или стеароил, и m и p равно 3. В определенных воплощениях направляющим лигандом является трансферрин. В конкретных воплощениях один или более фосфолипидов представляют собой DMPC или DSPC, и присутствует, по меньшей мере, один дополнительный липид представляющий собой холестерин. В определенных воплощениях липосом направленного действия и ненагруженных липосом R1, R2, R5 и R6 представляют собой олеоил, m и p равно 3, один или более фосфолипидов представляют собой DMPC и, дополнительный липид представляет собой холестерин.
В определенных воплощениях липосом направленного действия и ненагруженных липосом m и p каждый независимо является целым числом от 2 до 4. В некоторых воплощениях m и p равны и являются целым числом от 2 до 4. В конкретных воплощениях m и p равны и составляют 3. В определенных воплощениях R1, R2, R5 и R6 каждый независимо представляет собой олеоил, стеароил, пальмитоил или миристоил. В некоторых воплощениях R1 и R2 являются одинаковыми и R5 и R6 являются одинаковыми. В других воплощениях R1, R2, R5 и R6 являются одинаковыми. В конкретных воплощениях R1, R2, R5 и R6 представляют собой олеоил или стеароил. В определенных воплощениях R1, R2, R5 и R6 представляют собой олеоил.
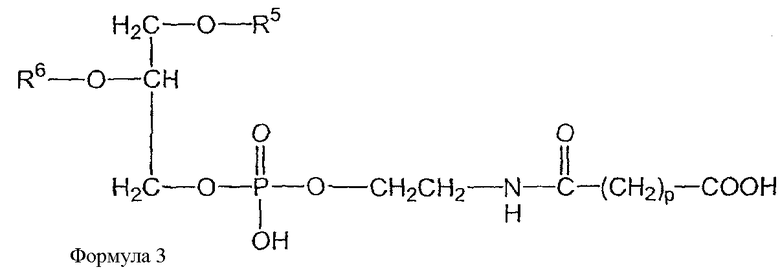
В дополнительных воплощениях предлагаются липидные смеси, включающие смесь одного или более фосфолипидов, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и необязательно, по меньшей мере, один дополнительный липид, где производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1

и сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлен формулой 2
и где R1, R2, R3 и R4, каждый независимо представляет собой ацильную группу, m и n независимо представляют собой целое число от 1 до 10; и где смесь не включает немодифицированный фосфатидилэтаноламин или полиэтиленгликоль.
В определенных воплощениях липидных смесей m и n каждый независимо является целым числом от 2 до 4. В некоторых воплощениях m и n равны и являются целым числом от 2 до 4. В конкретных воплощениях m и n равны и составляют 3.
В определенных воплощениях липидных смесей R1, R2, R3 и R4 каждый независимо представляет собой олеоил, стеароил, пальмитоил или миристоил. В некоторых воплощениях R1 и R2 являются одинаковыми и R3 и R4 являются одинаковыми. В конкретных воплощениях R1, R2, R3 и R4 являются одинаковыми. В некоторых воплощениях R1, R2, R3 и R4 представляют собой олеоил или стеароил. В определенных воплощениях m и n равны 3, где один или более фосфолипидов представляют собой DMPC или DSPC, и присутствует, по меньшей мере, один дополнительный липид, представляющий собой холестерин. В определенных воплощениях липидных смесей R1, R2, R3 и R4 представляют собой олеоил, m и n равны 3, один или более фосфолипидов представляют собой DMPC и дополнительный липид представляет собой холестерин.
В дополнительных воплощениях предлагаются липидные смеси, включающие смесь одного или более фосфолипидов, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и необязательно, по меньшей мере, один дополнительный липид, где производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1

и модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина включает направляющий лиганд, соединенный со вторым производным N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина; и где второе производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 3

где R1, R2, R5 и R6 каждый независимо представляет собой ацильную группу, m и p независимо представляют собой целое число от 1 до 10; и где смесь не включает немодифицированный фосфатидилэтаноламин или полиэтиленгликоль, и где направляющий лиганд не представляет собой интактное антитело.
В определенных воплощениях липидных смесей, где присутствует модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, m и p каждый независимо является целым числом от 2 до 4. В конкретных воплощениях m и p равны и являются целым числом от 2 до 4. В конкретных воплощениях m и p равны и составляют 3.
В определенных воплощениях липидных смесей, где присутствует модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, R1, R2, R5 и R6 каждый независимо представляет собой олеоил, стеароил, пальмитоил или миристоил. В некоторых воплощениях, где R1 и R2 являются одинаковыми, и R5, и R6 являются одинаковыми. В дополнительных воплощениях R1, R2, R5 и R6 являются одинаковыми. В некоторых воплощениях R1, R2, R5 и R6 представляют собой олеоил или стеароил. В некоторых воплощениях R1, R2, R5 и R6 представляют собой олеоил или стеароил, m и p равно 3, один или более фосфолипидов представляют собой DMPC или DSPC, по меньшей мере, один дополнительный липид представляет собой холестерин, и направляющим лигандом является трансферрин. В определенных воплощениях липидных смесей R1, R2, R5 и R6 представляют собой олеоил, m и p равно 3, один или более фосфолипидов представляют собой DMPC, дополнительный липид представляет собой холестерин, и направляющим лигандом является трансферрин.
В определенных воплощениях предлагаются содержащие липосомы композиции, включающие липосомы, включающие один или более фосфолипидов, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и необязательно, по меньшей мере, один дополнительный липид, где производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1

и сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлен формулой 2

где R1, R2, R3 и R4 каждый независимо представляет собой ацильную группу, m и n независимо представляют собой целое число от 1 до 10; и где композиция не включает немодифицированный фосфатидилэтаноламин или полиэтиленгликоль.
В некоторых воплощениях содержащих липосомы композиций m и n каждый независимо является целым числом от 2 до 4. В определенных воплощениях m и n равны и являются целым числом от 2 до 4. В конкретных воплощениях m и n равны и составляют 3.
В некоторых воплощениях содержащих липосомы композиций R1, R2, R3 и R4 каждый независимо представляет собой олеоил, стеароил, пальмитоил или миристоил. В конкретных воплощениях R1 и R2 являются одинаковыми, и R3 и R4 являются одинаковыми. В некоторых воплощениях R1, R2, R3 и R4 являются одинаковыми. В определенных воплощениях R1, R2, R3 и R4 представляют собой олеоил или стеароил. В некоторых воплощениях R1, R2, R3 и R4 представляют собой олеоил или стеароил, и m и n равны 3, и один или более фосфолипидов представляют собой DMPC, DSPC, POPC или DPPС. В определенных воплощениях R1, R2, R3 и R4 представляют собой олеоил, m и n равны 3, один или более фосфолипидов представляют собой DMPC, и дополнительный липид представляет собой холестерин.
В дополнительных воплощениях содержащих липосомы композиций предлагаются содержащие липосомы композиции, включающие липосомы, включающие один или более фосфолипидов, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и необязательно, по меньшей мере, один дополнительный липид, где производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1

и модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина включает направляющий лиганд, присоединенный ко второму производному N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина; и где второе производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 3

и где R1, R2, R5 и R6, каждый независимо представляет собой ацильную группу, m и p независимо представляют собой целое число от 1 до 10; и где композиция не включает немодифицированный фосфатидилэтаноламин или полиэтиленгликоль, и где направляющий лиганд не представляет собой интактное антитело.
В определенных воплощениях содержащих липосомы композиций, где присутствует модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, m и p каждый независимо является целым числом от 2 до 4. В конкретных воплощениях m и p равны и являются целым числом от 2 до 4. В некоторых воплощениях m и p равны и составляют 3.
В определенных воплощениях содержащих липосомы композиций, где присутствует модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, R1, R2, R5 и R6 каждый независимо представляет собой олеоил, стеароил, пальмитоил или миристоил. В конкретных воплощениях, R1 и R2 являются одинаковыми, и R5 и R6 являются одинаковыми. В определенных воплощениях R1, R2, R5 и R6 являются одинаковыми. В некоторых воплощениях R1, R2, R5 и R6 представляют собой олеоил или стеароил. В конкретных воплощениях R1, R2, R5 и R6 представляют собой олеоил или стеароил, один или более фосфолипидов представляют собой DMPC или DSPC, по меньшей мере, один дополнительный липид представляет собой холестерин, и направляющим лигандом является трансферрин. В определенных воплощениях R1, R2, R5 и R6 представляют собой олеоил, m и p равно 3, один или более фосфолипидов представляют собой DMPC, дополнительный липид представляет собой холестерин, и направляющим лигандом является трансферрин.
В дополнительных воплощениях содержащих липосомы композиций в них включено лекарственное вещество. В определенных воплощениях один или более фосфолипидов представляют собой DMPC или DSPC, R1, R2 и, когда присутствуют, R5 и R6 представляют собой олеоил или стеароил, m и, когда присутствует, p равно 3, по меньшей мере, один дополнительный липид, когда присутствует, представляет собой холестерин, лекарственное вещество представляет собой оксалиплатин, и направляющий лиганд, если присутствует, представляет собой трансферрин. В определенных воплощениях композиция дополнительно включает сахар в концентрации от приблизительно 1 до приблизительно 20% процентов сахара (об./об.). В определенных воплощениях один или более фосфолипидов представляют собой DMPC или DSPC, R1, R2 и, когда присутствуют, R5 и R6 представляют собой олеоил, m и, когда присутствует, p равно 3, по меньшей мере, один дополнительный липид, когда присутствует, представляет собой холестерин, лекарственное вещество представляет собой оксалиплатин, и направляющий лиганд, если присутствует, представляет собой трансферрин.
В дополнительных воплощениях содержащих липосомы композиций в них включено меченое соединение. В определенных воплощениях меченое соединение включает радиоизотопный остаток.
В определенных воплощениях липосом направленного действия, ненагруженных липосом, липидных смесей и содержащих липосомы композиций присутствует, по меньшей мере, один дополнительный липид. В конкретных воплощениях, по меньшей мере, один дополнительный липид представляет собой холестерин или производное холестерина.
В конкретных воплощениях липосом направленного действия, ненагруженных липосом, липидных смесей и содержащих липосомы композиций один или более фосфолипидов представляют собой фосфатидилхолин, фосфатидную кислоту, фосфатидилсерин или фосфатидилглицерин. В конкретных воплощениях один или более фосфолипидов представляют собой нейтральные фосфолипиды. В некоторых воплощениях один или более фосфолипидов представляют собой фосфатидилхолин. В конкретных воплощениях фосфатидилхолин включает остаток насыщенной жирной кислоты. В определенных воплощениях один или более фосфолипидов представляют собой DMPC, DSPC, POPC или DPPC. В некоторых из этих воплощений присутствует, по меньшей мере, один дополнительный липид. И в определенных из них, по меньшей мере, один дополнительный липид представляет собой холестерин или производное холестерина. В конкретных воплощениях включены DMPC и холестерин, DSPC и холестерин, POPC и холестерин или DPPC и холестерин. В определенных воплощениях включены DMPC и холестерин.
В конкретных воплощениях липосом направленного действия, ненагруженных липосом, липидных смесей и содержащих липосомы композиций направляющий лиганд, когда присутствует, направлен на клетку-мишень. В некоторых воплощениях направляющий лиганд направлен на рецептор клеточной поверхности клетки-мишени. В конкретных воплощениях направляющий лиганд представляет собой трансферрин, фолиевую кислоту, гиалуроновую кислоту, сахарную цепь или фрагмент моноклонального антитела. В других воплощениях направляющий лиганд представляет собой трансферрин, фолиевую кислоту, гиалуроновую кислоту или сахарную цепь. В конкретных воплощениях направляющий лиганд представляет собой трансферрин, фолиевую кислоту, гиалуроновую кислоту или сахарную цепь. В некоторых воплощениях направляющий лиганд представляет собой трансферрин. В конкретных воплощениях трансферрин находится в холо-форме, но не в апо-форме. В некоторых воплощениях трансферрин находится в холо-форме.
В определенных воплощениях липосом направленного действия и ненагруженных липосом средний диаметр липосомы составляет от приблизительно 50 нм до приблизительно 250 нм. В других, средний диаметр липосомы составляет от приблизительно 90 нм до приблизительно 200 нм.
В конкретных воплощениях липосом направленного действия и ненагруженных липосом дзета-потенциал липосомы является негативным. В определенных воплощениях дзета-потенциал составляет от приблизительно -75 мВ до приблизительно -90 мВ. В других, дзета-потенциал составляет от приблизительно -80 мВ до приблизительно -85 мВ.
В определенных воплощениях содержащих липосомы композиций, липосом направленного действия и ненагруженных липосом составы дополнительно включают раствор.
В конкретных воплощениях липосом направленного действия и содержащих липосомы композиций присутствует лекарственное вещество.
В конкретных воплощениях липосом направленного действия и содержащих липосомы композиций лекарственное вещество представляет собой оксалиплатин. В определенных воплощениях, когда лекарственное вещество представляет собой оксалиплатин, направляющий лиганд представляет собой трансферрин. В определенных воплощениях, по меньшей мере, один дополнительный липид присутствует и представляет собой холестерин.
В определенных воплощениях лекарственное вещество представляет собой противораковый агент. В конкретных воплощениях лекарственное вещество представляет собой цитотоксическое лекарственное вещество. В некоторых воплощениях лекарственное вещество представляет собой ингибитор топоизомеразы I. В конкретных воплощениях ингибитор топоизомеразы I представляет собой топотекан или иринотекан. В других воплощениях лекарственное вещество представляет собой алкалоид барвинка. В конкретных воплощениях алкалоид барвинка представляет собой винкристин, винбластин, винлеурозин, винродизин, винорелбин или виндезин. В некоторых воплощениях лекарственное вещество представляет собой нуклеиновую кислоту. В определенных воплощениях нуклеиновая кислота представляет собой антисмысловой олигонуклеотид или рибозим. В некоторых воплощениях лекарственное вещество представляет собой алкилирующий агент. В конкретных воплощениях лекарственное вещество представляет собой таксаны. В других воплощениях лекарственное вещество представляет собой антагонист метаболизма. В определенных воплощениях лекарственное вещество представляет собой противоопухолевый антибиотик. В некоторых воплощениях лекарственное вещество представляет собой лекарственное вещество для гормональной терапии. В некоторых воплощениях лекарственное вещество представляет собой лекарственное вещество с молекулярной мишенью.
В некоторых воплощениях липосом направленного действия и содержащих липосомы композиций лекарственное вещество представляет собой соединение платины. В конкретных воплощениях соединение платины представляет собой биплатин, цисплатин, карбоплатин, ормаплатин, оксалиплатин, зениплатин, энлоплатин, лобаплатин или спироплатин. В некоторых воплощениях соединение платины представляет собой оксалиплатин.
В некоторых воплощениях, где соединение платины представляет собой оксалиплатин, R1, R2, R5 и R6 представляют собой олеоил или стеароил, m и p равно 3, направляющим лигандом является трансферрин, один или более фосфолипидов представляют собой DMPC или DSPC и, по меньшей мере, один дополнительный липид присутствует и представляет собой холестерин. В определенных воплощениях, где лекарственное вещество представляет собой оксалиплатин, R1, R2, R5 и R6 представляют собой олеоил, m и p равно 3, направляющим лигандом является трансферрин, один или более фосфолипидов представляют собой DMPC и, по меньшей мере, один дополнительный липид присутствует и представляет собой холестерин. В конкретных воплощениях липосомы направленного действия и содержащие липосомы композиции свободны от других липидных компонентов.
В некоторых воплощениях, где лекарственное вещество представляет собой оксалиплатин, оксалиплатин растворен в водном растворе сахара, выбранного из группы, состоящей из трегалозы, мальтозы, сахарозы, маннозы, лактозы, маннита, глицерина и декстрозы. В определенных воплощениях сахар находится в концентрации от приблизительно 1 до приблизительно 20% процентов сахара (об./об.). В конкретных воплощениях концентрация оксалиплатина составляет от приблизительно 0,1 мг/мл до приблизительно 25 мг/мл внутри липосомы. В других воплощениях концентрация оксалиплатина составляет от приблизительно 0,5 мг/мл до приблизительно 10 мг/мл внутри липосомы. В еще одних воплощениях концентрация оксалиплатина составляет от приблизительно 0,5 мг/мл до приблизительно 3 мг/мл.
В конкретных воплощениях липосом направленного действия и содержащих липосомы композиций присутствует меченое соединение. В определенных воплощениях меченое соединение включает радиоизотопный остаток. В конкретных воплощениях радиоизотопный остаток включает 125I.
В конкретных воплощениях липосом направленного действия и содержащих липосомы композиций концентрация направляющего лиганда, включенного в липосому, составляет от приблизительно 1,0 мг/мл до приблизительно 3,0 мг/мл. В других концентрация направляющего лиганда, включенного в липосому, составляет от приблизительно 1,0 мг/мл до приблизительно 2,5 мг/мл.
В конкретных воплощениях липосом направленного действия и содержащих липосомы композиций, где лекарственное вещество присутствует и представляет собой оксалиплатин, направляющий лиганд представляет собой трансферрин. В конкретных воплощениях трансферрин находится в холо-форме. В некоторых воплощениях ион железа находится в концентрации от приблизительно 0,4 до приблизительно 3,0 мкг/мл. В других воплощениях ион железа находится в концентрации от приблизительно 0,4 до приблизительно 1,5 мкг/мл.
В конкретных воплощениях липосом направленного действия, ненагруженных липосом, липидных смесей и содержащих липосомы композиций, липосомы, липидные смеси или содержащая липосомы композиция не включают катионный липид. В конкретных воплощениях липосомы, липидные смеси или содержащая липосомы композиция не включают анионный липид. В некоторых воплощениях липосомы, липидная липосома, липидные смеси или содержащая липосомы композиция не включают ни анионный липид, ни катионный липид.
В конкретных воплощениях липосом направленного действия, ненагруженных липосом, липидных смесей и содержащих липосомы композиций составы дополнительно включают раствор. В определенных воплощениях липидные смеси свободны от раствора. В конкретных воплощениях раствор представляет собой водный раствор или смесь водного раствора и смешивающегося с водой растворителя.
В конкретных воплощениях липосом направленного действия, ненагруженных липосом, липидных смесей и содержащих липосомы композиций составы дополнительно включают сахарозу.
В дополнительном аспекте изобретения предлагаются фармацевтические составы описанных здесь содержащих липосомы композиций. Конкретные воплощения содержащих липосомы композиций, липосом направленного действия и ненагруженных липосом включают содержащие липосомы композиции, липосомы направленного действия или ненагруженные липосомы, как здесь описано, и один или более фармацевтически пригодных носителей, наполнителей, разбавителей, стабилизаторов или консервантов.
В еще одном аспекте изобретения предлагаются наборы, включающие описанные здесь содержащие липиды композиции. Определенные воплощения содержащих липосомы композиций, липосом направленного действия и ненагруженных липосом включают содержащие липосомы композиции, липосомы направленного действия или ненагруженные липосомы в упаковке и с инструкцией по применению.
В определенных воплощениях наборов содержащие липосомы композиции, липосомы направленного действия или ненагруженные липосомы, как здесь описано, содержатся в первом контейнере, а один или более фармацевтически приемлемые носители, наполнители, разбавители, стабилизаторы или консерванты содержатся во втором контейнере.
В конкретных воплощениях предлагаются наборы, включающие описанные здесь фармацевтические составы, упаковку и инструкции для применения.
В другом аспекте изобретения предлагаются способы получения описанных здесь содержащих липиды композиций.
В конкретных воплощениях предлагаются способы получения липосом направленного действия, как здесь описано, включающие стадии:
a) смешивания одного или более фосфолипидов, производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированного направляющим фактором производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и необязательно, по меньшей мере, одного дополнительного липида с образованием липидной смеси;
b) добавления лекарственного вещества или меченого соединения к липидной смеси, образованной на стадии (a);
c) образования липосомы.
В дополнительных воплощениях способа предлагается стадия (d) очистки липосомы со стадии (c). В конкретных воплощениях лекарственное вещество на стадии (b) перед смешиванием находится в водном растворе. В определенных воплощениях стадия (c) включает обработку ультразвуком или перемешивание. В некоторых воплощениях стадия (c) включает экструзию.
В других воплощениях предлагаются способы получения липосом направленного действия, как здесь описано, включающие стадии:
a) смешивания одного или более фосфолипидов, производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, сукцинимидного эфира производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и необязательно, по меньшей мере, одного дополнительного липида с образованием липидной смеси;
где сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлен формулой 2

где R3 и R4 каждый независимо представляет собой ацильную группу, n независимо представляет собой целое число от 1 до 10;
b) добавления лекарственного вещества или меченого соединения к липидной смеси, образованной на стадии (a);
c) образования липосомы; и
d) присоединения направляющего лиганда к сукцинимидному эфиру производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина.
В определенных воплощениях описанного выше способа, способ также включает стадию (e) очистки липосомы со стадии (d).
В конкретных воплощениях лекарственное вещество на стадии (b) перед смешиванием находится в водном растворе. В некоторых воплощениях стадия (c) включает экструзию. В конкретных воплощениях стадия (c) включает перемешивание.
В определенных воплощениях предлагаются способы получения ненагруженных липосом, как здесь описано, включающие стадии:
a) смешивания одного или более фосфолипидов, производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированного направляющим фактором производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и необязательно, по меньшей мере, одного дополнительного липида с образованием липидной смеси; и
b) образования липосомы.
В определенных воплощениях способов получения ненагруженных липосом способ дополнительно включает стадию (c) очистки липосомы со стадии (b).
В конкретных воплощениях стадия (b) включает обработку ульразвуком или перемешивание. В некоторых воплощениях стадия (b) включает экструзию.
В других воплощениях предлагаются способы получения ненагруженных липосом, как здесь описано, включающие стадии:
a) смешивания одного или более фосфолипидов, производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, сукцинимидного эфира производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и необязательно, по меньшей мере, одного дополнительного липида с образованием липидной смеси,
где сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлен формулой 2

где R3 и R4 каждый независимо представляет собой ацильную группу, n независимо представляет собой целое число от 1 до 10;
b) образования липосомы; и
c) присоединения направляющего лиганда к сукцинимидному эфиру производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина с образованием модифицированного направляющим фактором производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина.
В определенных воплощениях способов получения ненагруженных липосом, способы дополнительно включают стадию (d) очистки липосомы со стадии (c).
В конкретных воплощениях стадия (b) включает обработку ульразвуком или перемешивание. В некоторых воплощениях стадия (b) включает экструзию.
В других воплощениях предлагаются способы получения содержащих липиды композиций, как здесь описано, включающие стадию смешивания одного или более фосфолипидов, производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и сукцинимидного эфира производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина.
В дополнительных воплощениях предлагаются способы получения содержащих липиды композиций, где присутствует, по меньшей мере, один дополнительный липид, как здесь описано, включающие стадию смешивания одного или более фосфолипидов, по меньшей мере, одного дополнительного липида, производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и сукцинимидного эфира производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина.
В других воплощениях предлагаются способы получения содержащих липиды композиций, как здесь описано, включающие стадию смешивания одного или более фосфолипидов, производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и модифицированного направляющим фактором производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина.
В дополнительных воплощениях предлагаются способы получения содержащих липиды композиций, где присутствует, по меньшей мере, один дополнительный липид, как здесь описано, включающие стадию смешивания одного или более фосфолипидов, по меньшей мере, одного дополнительного липида, производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и модифицированного направляющим фактором производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина.
Предлагаются также способы получения описанных здесь содержащих липосомы композиций, включающие стадии:
a) смешивания одного или более фосфолипидов и производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и, когда присутствует, сукцинимидного эфира производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина или модифицированного направляющим фактором производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и необязательно, когда присутствует, по меньшей мере, одного дополнительного липида с образованием липидной смеси; и
b) добавления лекарственного вещества к липидной смеси, образованной на стадии (a); и
c) образования липосомы.
В определенных воплощениях способов получения различных содержащих липиды композиций (липосом направленного действия, ненагруженных липосом, содержащих липосомы композиций), где присутствует лекарственное вещество, лекарственное вещество находится в водном растворе. В определенных воплощениях стадию a) осуществляют в присутствии органического растворителя. В некоторых воплощениях водный раствор дополнительно включает сахар. В определенных воплощениях водный раствор может также включать смешиваемый с водой органический растворитель.
В других воплощениях предлагаются способы получения содержащих липосомы композиций, включающие стадии:
a) смешивания одного или более фосфолипидов и производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и,
когда присутствует, сукцинимидного эфира производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина или модифицированного направляющим фактором производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и необязательно, когда присутствует, по меньшей мере, одного дополнительного липида с образованием липидной смеси; и
b) добавления меченого соединения к липидной смеси, образованной на стадии (a);
c) образования липосомы.
В определенных воплощениях способов получения различных содержащих липиды композиций (липосом направленного действия, ненагруженных липосом, содержащих липосомы композиций), где присутствует меченое соединение, меченое соединение находится в водном растворе. В определенных воплощениях стадию a) осуществляют в присутствии органического растворителя. В определенных воплощениях водный раствор может также включать смешиваемый с водой органический растворитель.
В определенных воплощениях также предлагаются способы получения содержащих липосомы композиций, как здесь описано, где содержащие липосомы композиции включают модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, включающие стадии
a) смешивания одного или более фосфолипидов, производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и модифицированного направляющим фактором производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и необязательно, по меньшей мере, одного дополнительного липида с образованием липидной смеси; и
b) добавления растворителя к смеси, образованной на стадии (a) с образованием содержащей липосомы композиции.
В конкретных воплощениях стадию смешивания (a) осуществляют в присутствии органического растворителя. В конкретных воплощениях растворитель на стадии (b) представляет собой водный раствор или смесь водного раствора и смешиваемого с водой органического растворителя.
В определенных воплощениях стадия (b) включает обработку ульразвуком или перемешивание. В некоторых воплощениях стадия (b) включает экструзию.
В конкретных воплощениях способов получения содержащих липиды композиций на стадии (a) присутствует, по меньшей мере, один дополнительный липид.
В некоторых воплощениях способов получения содержащих липиды композиций на стадии (a) присутствует сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина.
В определенных воплощениях способов получения содержащих липиды композиций на стадии (a) присутствует модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина.
В дополнительном аспекте изобретения предлагаются способы лечения или диагностики с применением описанных здесь содержащих липиды композиций.
В конкретных воплощениях предлагаются способы лечения рака, включающие a) введение липосом направленного действия, как здесь описано, нуждающемуся в этом индивидууму в количестве, эффективном для лечения рака, где липосома направленного действия включает лекарственное вещество, и лекарственное вещество представляет собой противораковый агент.
В определенных воплощениях способа лечения или диагностики индивидуум представляет собой млекопитающее. В конкретных воплощениях индивидуумом является человек.
В определенных воплощениях способов лечения рак представляет собой рак молочной железы, желудка, ободочной кишки, колоректальный рак, рак поджелудочной железы, не мелкоклеточный рак легких, мелкоклеточный рак легких, рак мозга, рак печени, рак почки, рак простаты, рак мочевого пузыря, рак яичника или гематологические злокачественные заболевания.
В некоторых воплощениях способов лечения стадию (a) осуществляют перед, одновременно с или после сочетанной терапии рака разной модальности. В конкретных воплощениях сочетание лечения рака разной модальности включает химиотерапию, облучение или хирургическое вмешательство.
В конкретных воплощениях способов лечения стадию (a) осуществляют перед, одновременно с или после адъювантной терапии рака. В конкретных воплощениях адъювантная терапия рака включает введение одного или более агентов для снижения потери волос, рвоты, иммуносупрессии, тошноты, диареи, сыпи, сенсорных нарушений, анемии, слабости, стоматита или синдрома руки и стопы. В некоторых воплощениях стадию (a) выполняют перед, одновременно с или после введения одного или более дополнительных противораковых агентов. В определенных воплощениях один или более дополнительные противораковые агенты включают 5-фторурацил, лейковорин, капецитабин, UFT/LV (тегафур-урацил и лейковорин), иринотекан, антитело против EGFR, антитело против VEGF, ингибитор тирозинкиназы или их сочетания.
В некоторых воплощениях способов лечения липосомы направленного действия вводят путем парентерального введения. В конкретных воплощениях парентеральное введение является инъекцией или внутривенной инфузией.
Предлагаются также способы диагностики, включающие стадии:
a) введения липосом направленного действия, как здесь описано, нуждающемуся в этом индивидууму в количестве, эффективном для детекции, где липосома направленного действия включает меченое соединение; и
b) детекция меченого соединения.
В дополнительных воплощениях способов диагностики способы дополнительно включают стадию (c) сравнения уровня выявляемого меченого соединения с количеством меченого соединения, определяемого в предыдущий момент времени.
В дополнительных воплощениях способов диагностики стадия (b) включает определение с помощью гамма-счетчика.
В дополнительном аспекте изобретения предлагаются модифицированные трансферрином производные N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, где производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 3

где R5 и R6 каждый независимо представляет собой ацильную группу, и p представляет собой целое число от 1 до 10, и трансферрин присоединен к производному N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина.
В определенных воплощениях модифицированного трансферрином производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина p является целым числом от 2 до 4. В конкретных воплощениях p равно 3.
В некоторых воплощениях модифицированного трансферрином производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина R5 и R6 каждый независимо представляет собой олеоил, стеароил, пальмитоил или миристоил. В конкретных воплощениях R5 и R6 являются одинаковыми. В некоторых воплощениях R5 и R6 представляют собой олеоил или стеароил. В определенных воплощениях R5 и R6 представляют собой олеоил и p равно 3.
В дополнительном аспекте также предлагаются фармацевтические составы, включающие модифицированные трансферрином производные N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, как здесь описано, и один или более фармацевтически приемлемых носителей, наполнителей, разбавителей, стабилизаторов или консервантов.
В определенных воплощениях предлагаются липидные смеси, включающие смесь, по меньшей мере, двух различных нейтральных липидов, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, где производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1

и сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлен формулой 2

где R1, R2, R3 и R4 каждый независимо представляет собой ацильную группу, m и n независимо представляют собой целое число от 1 до 10; и где смесь не включает немодифицированный фосфатидилэтаноламин или полиэтиленгликоль.
В определенных воплощениях предлагаются содержащие липосомы композиции включающие, по меньшей мере, два различных нейтральных липида, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и инкапсулированное лекарственное вещество или меченое соединение, где производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1

и сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлен формулой 2

где R1, R2, R3 и R4 каждый независимо представляет собой ацильную группу; m и n независимо представляют собой целое число от 1 до 10; и где смесь не включает немодифицированный фосфатидилэтаноламин или полиэтиленгликоль.
В конкретных воплощениях содержащих липосомы композиций и липидных смесей m и n каждый независимо является целым числом от 2 до 4. В определенных воплощениях m и n равны и являются целым числом от 2 до 4. В других воплощениях m и n равны и составляют 3.
В некоторых воплощениях содержащих липосомы композиций и липидных смесей R1, R2, R3 и R4 каждый независимо представляет собой олеоил, стеароил, пальмитоил или миристоил. В некоторых воплощениях R1 и R2 являются одинаковыми, и R3 и R4 являются одинаковыми. В конкретных воплощениях R1, R2, R3 и R4 являются одинаковыми. В некоторых воплощениях R1, R2, R3 и R4 представляют собой олеоил.
В конкретных воплощениях содержащих липосомы композиций и липидных смесей молярное отношение нейтральные липиды:производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина:сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина составляет приблизительно 95:4:1.
В некоторых воплощениях содержащих липосомы композиций и липидных смесей, где нейтральные липиды представляют собой DMPC и холестерин, молярное отношение DMPC:холестерин:(производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина+сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина) составляет 50:45:5. В определенных из этих воплощений производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой NG-DOPE и сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой NHS-NG-DOPE.
В определенных воплощениях предлагаются липосомы направленного действия, включающие, по меньшей мере, два различных нейтральных липида, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и инкапсулированное лекарственное вещество или меченое соединение, где модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина включает направляющий лиганд, присоединенный ко второму производному N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина; и где производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1

и второе производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 3

где R1, R2, R5 и R6 каждый независимо представляет собой ацильную группу, и m и p независимо представляют собой целое число от 1 до 10; и где липосома не включает немодифицированный фосфатидилэтаноламин или полиэтиленгликоль, и где направляющий лиганд не является интактным антителом.
В конкретных воплощениях предлагаются липосомы направленного действия, включающие нейтральный фосфатидилхолин, холестерин или производное холестерина, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированное трансферрином производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и инкапсулированный оксалиплатин, где модифицированное трансферрином производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина включает трансферрин, присоединенный с помощью амидной связи карбоновой кислоты к второму производному N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина; и где производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1

и сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлен формулой 2, и второе производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 3

где R1, R2, R5 и R6 каждый независимо представляет собой ацильную группу, и m и p независимо представляют собой целое число от 1 до 10; и где липосома не включает немодифицированный фосфатидилэтаноламин или полиэтиленгликоль. В определенных воплощениях липосома направленного действия по существу свободна от EDC и/или DCC.
В определенных воплощениях липосом направленного действия m и p каждый независимо является целым числом от 2 до 4. В некоторых воплощениях m и p равны и являются целым числом от 2 до 4. В конкретных воплощениях m и p равны и составляют 3.
В некоторых воплощениях липосом направленного действия R1, R2, R5 и R6 каждый независимо представляет собой олеоил, стеароил, пальмитоил или миристоил. В определенных воплощениях R1 и R2 являются одинаковыми и R5 и R6 являются одинаковыми. В конкретных воплощениях R1, R2, R5 и R6 являются одинаковыми. В некоторых воплощениях R1, R2, R3 и R4 представляют собой олеоил или стеароил. В определенных воплощениях R1, R2, R3 и R4 представляют собой олеоил.
В определенном воплощении липосом направленного действия направляющий лиганд направлен на клетку-мишень. В конкретных воплощениях направляющий лиганд направлен на рецептор клеточной поверхности клетки-мишени. В некоторых воплощениях направляющий лиганд представляет собой трансферрин, фолиевую кислоту, гиалуроновую кислоту, сахарную цепь или фрагмент моноклонального антитела. В определенных воплощениях направляющий лиганд представляет собой трансферрин, фолиевую кислоту, гиалуроновую кислоту или сахарную цепь. В конкретных воплощениях направляющий лиганд представляет собой трансферрин. В некоторых из этих воплощений трансферрин находится в холо-форме, но не в апо-форме. В других воплощениях трансферрин находится в апо-форме.
В определенных воплощениях липидных смесей, содержащих липосомы композиций и липосомы направленного действия, составы не включают анионный липид. В некоторых воплощениях составы не включают катионный липид. В некоторых воплощениях составы не включают катионный липид или анионный липид. В конкретных воплощениях состав не включает фосфатидилглицерин или его производное. В конкретных воплощениях составы не включают фосфатидилхолин яйца.
В некоторых воплощениях липидных смесей, содержащих липосомы композиций и липосом направленного действия, по меньшей мере, два различных нейтральных липида представляют собой один или более фосфолипиды и холестерин или производные холестерина. В некоторых воплощениях, по меньшей мере, один из, по меньшей мере, двух различных нейтральных липидов представляет собой фосфолипид. В определенных воплощениях липидных смесей, содержащих липосомы композиций и липосом направленного действия, по меньшей мере, два различных нейтральных липида представляют собой фосфатидилхолин и холестерин. В конкретных воплощениях один из, по меньшей мере, двух различных нейтральных липидов представляет собой DMPC, DSPC или DPPC. В некоторых из воплощений один из, по меньшей мере, двух различных нейтральных липидов представляет собой холестерин или производное холестерина. В конкретных воплощениях, по меньшей мере, два различных нейтральных липида представляют собой DMPC и холестерин, DSPC и холестерин или DPPC и холестерин. В конкретных воплощениях, по меньшей мере, два различных нейтральных липида представляют собой DMPC и холестерин.
В определенных воплощениях липосом направленного действия средний диаметр липосомы составляет от приблизительно 50 нм до приблизительно 250 нм. В определенных воплощениях средний диаметр липосомы составляет от приблизительно 90 нм до приблизительно 200 нм. В конкретных воплощениях средний диаметр липосомы составляет от приблизительно 100 нм до приблизительно 140 нм.
В определенных воплощениях липосом направленного действия дзета-потенциал липосомы является негативным. В конкретных воплощениях дзета-потенциал составляет от приблизительно -75 мВ до приблизительно -90 мВ. В некоторых воплощениях дзета-потенциал составляет от приблизительно -80 мВ до приблизительно -85 мВ.
В некоторых воплощениях липидных смесей, содержащих липосомы композиций и липосом направленного действия, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой NG-DOPE (где NG-DOPE является эквивалентом того, что R1 и R2 являются олеоилами, а m равно 3) и, когда присутствует, сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой NHS-NG-DOPE (где NHS-NG-DOPE является эквивалентом того, что R3 и R4 являются олеоилами, а n равно 3) или, когда присутствует, модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой TF-NG-DOPE (где TF-NG-DOPE является эквивалентом того, что R5 и R6 являются олеоилами, а p равно 3).
В некоторых воплощениях содержащих липосомы композиций и липосом направленного действия составы дополнительно включают раствор.
В определенных воплощениях липосом направленного действия молярное отношение нейтральные липиды:производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина:модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина составляет приблизительно 95:4:1.
В определенных воплощениях липосом направленного действия молярное отношение DMPC:холестерин:(производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина + модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина) составляет приблизительно 50:45:5.
В конкретных воплощениях содержащих липосомы композиций и липосом направленного действия присутствует меченое соединение. В определенных воплощениях меченое соединение включает радиоизотопный остаток. В конкретных воплощениях меченое соединение включает 125I.
В некоторых воплощениях содержащих липосомы композиций и липосом направленного действия присутствует лекарственное вещество. В конкретных воплощениях лекарственное вещество представляет собой противораковый агент. В некоторых воплощениях лекарственное вещество представляет собой цитотоксический агент. В определенных воплощениях лекарственное вещество представляет собой ингибитор топоизомеразы I. В конкретных воплощениях ингибитор топоизомеразы I представляет собой топотекан или иринотекан. В других воплощениях лекарственное вещество представляет собой алкалоид барвинка. В некоторых воплощениях алкалоид барвинка представляет собой винкристин, винбластин, винлеурозин, винродизин, винорелбин или виндезин. В других воплощениях лекарственное вещество представляет собой нуклеиновую кислоту. В некоторых из этих воплощений нуклеиновая кислота представляет собой антисмысловой олигонуклеотид или рибозим. В конкретных воплощениях лекарственное вещество представляет собой соединение платины. В определенных воплощениях соединение платины представляет собой биплатин, цисплатин, карбоплатин, ормаплатин, оксалиплатин, зениплатин, энлоплатин, лобаплатин или спироплатин. В конкретных воплощениях соединение платины представляет собой оксалиплатин. В некоторых воплощениях лекарственное вещество представляет собой алкилирующий агент. В конкретных воплощениях лекарственное вещество представляет собой таксаны. В других воплощениях лекарственное вещество представляет собой антагонист метаболизма. В определенных воплощениях лекарственное вещество представляет собой противоопухолевый антибиотик. В некоторых воплощениях лекарственное вещество представляет собой лекарственное вещество для гормональной терапии. В конкретных воплощениях лекарственное вещество представляет собой лекарственное вещество с молекулярной мишенью.
В некоторых воплощениях, где присутствует оксалиплатин, оксалиплатин растворен в водном растворе сахара, выбранного из группы, состоящей из трегалозы, мальтозы, сахарозы, лактозы, маннозы, маннита, глицерина и декстрозы. В определенных воплощениях сахар находится в концентрации от приблизительно 1 до приблизительно 20% процентов сахара (об./об.). В некоторых воплощениях концентрация оксалиплатина составляет от приблизительно 0,1 мг/мл до приблизительно 25 мг/мл внутри липосомы. В других воплощениях концентрация оксалиплатина составляет от приблизительно 0,5 мг/мл до приблизительно 10 мг/мл внутри липосомы. В еще одних воплощениях концентрация оксалиплатина составляет от приблизительно 0,5 мг/мл до приблизительно 3 мг/мл.
В конкретных воплощениях, где присутствует модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, концентрация направляющего лиганда, включенного в липосому, составляет от приблизительно 1,0 мг/мл до приблизительно 3,0 мг/мл. В определенных воплощениях концентрация направляющего лиганда, включенного в липосому, составляет от приблизительно 1,0 мг/мл до приблизительно 2,5 мг/мл.
В определенных воплощениях, где присутствует модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, направляющий лиганд представляет собой трансферрин. В некоторых воплощениях трансферрин находится в холо-форме, но не в апо-форме. В определенных воплощениях трансферрин находится в холо-форме. В некоторых воплощениях ион железа находится в концентрации от приблизительно 0,4 до приблизительно 3,0 мкг/мл. В других воплощениях ион железа находится в концентрации от приблизительно 0,4 до приблизительно 1,5 мкг/мл.
В некоторых воплощениях липидных смесей, содержащих липосомы композиций и липосом направленного действия составы свободны от липидных компонентов, отличных от двух различных нейтральных липидов, производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и модифицированного направляющим фактором производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина. В других воплощениях составы свободны от липидных компонентов, отличных от фосфатидилхолина, холестерина или производного холестерина, производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и модифицированного трансферрином производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина.
В другом аспекте предлагаются фармацевтические составы, включающие липосомы направленного действия или содержащих липосомы композиций, как здесь описано, и один или более фармацевтически приемлемых носителей, наполнителей, разбавителей, стабилизаторов или консервантов.
В еще одном аспекте изобретения предлагаются наборы, содержащие одну или более описанных здесь липидных смесей, содержащих липиды композиций или липосом направленного действия, упаковку и инструкцию по применению.
В определенных воплощениях набор включает липосомы направленного действия. В конкретных воплощениях липосомы направленного действия содержатся в первом контейнере, а один или более фармацевтически приемлемые носители, наполнители, разбавители, стабилизаторы или консерванты содержатся во втором контейнере.
Если не отмечено иначе, содержащие липиды композиции, как здесь описано, предназначены для применения в способах лечения и диагностики, как здесь описано, и могут быть включены в описанные здесь фармацевтические составы и наборы. Описанные здесь содержащие липиды композиции (включая липидные смеси, содержащие липосомы композиции), липосомы (включая липосомы направленного действия, ненагруженные липосомы и т.д.) могут, если не указано иначе, быть получены с помощью описанных здесь способов получения.
В другом аспекте предлагаются способы получения описанных здесь содержащих липиды композиций, включающие стадию смешивания, по меньшей мере, двух различных нейтральных липидов, производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и сукцинимидного эфира производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина.
В определенных воплощениях предлагаются способы получения описанных здесь содержащих липосомы композиций, включающие стадии:
a) смешивания, по меньшей мере, двух различных нейтральных липидов, производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и сукцинимидного эфира производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина с образованием липидной смеси;
b) добавления лекарственного вещества к липидной смеси, образованной на стадии (a); и
c) образования липосомы.
В определенных воплощениях стадию смешивания (a) выполняют в присутствии органического растворителя.
В некоторых воплощениях лекарственное вещество на стадии (b) перед смешиванием находится в водном растворе.
В определенных воплощениях стадия (c) включает обработку ультразвуком или перемешивание. В конкретных воплощениях стадия (c) включает экструзию.
В дополнительных воплощениях предлагаются способы получения описанных здесь липосом направленного действия, включающие стадии:
a) смешивания, по меньшей мере, двух различных нейтральных липидов, производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и сукцинимидного эфира производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина с образованием липидной смеси;
b) добавления лекарственного вещества или меченого соединения к липидной смеси, образованной на стадии (a);
c) образования липосомы; и
d) присоединения направляющего лиганда к сукцинимидному эфиру производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина.
В определенных воплощениях описанного выше способа, способ дополнительно включает стадию (e) очистки липосомы со стадии (d). В конкретных воплощениях лекарственное вещество на стадии (b) перед смешиванием находится в водном растворе. В определенных воплощениях стадия (c) включает обработку ультразвуком или перемешивание. В некоторых воплощениях стадия (c) включает экструзию.
Предлагаются также дополнительные способы получения липосомы направленного действия, включающие стадии:
a) смешивания фосфатидилхолина, холестерина или производного холестерина, производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина с образованием липидной смеси;
b) добавления оксалиплатина к липидной смеси, образованной на стадии (a);
c) образования липосомы; и
d) функционализация части производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина с образованием сукцинимидного эфира производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина; и
e) присоединения трансферрина к сукцинимидному эфиру производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина.
В определенных воплощениях способ дополнительно включает стадию (f) очистки липосомы со стадии (e).
В конкретных воплощениях способа лекарственное вещество на стадии (b) перед смешиванием находится в водном растворе.
В некоторых воплощениях способа стадия (c) включает обработку ультразвуком или перемешивание.
В дополнительном аспекте изобретения предлагается применение содержащих липиды композиций (включая липосомы направленного действия) и их составы, как здесь описано, для получения лекарственного средства. В частности, для получения лекарственного средства для применения при лечении или диагностике состояний, как здесь описано. Далее, их фармацевтические составы, описанные здесь различным образом, также предназначены для применения при получении лекарственного средства для применения при лечении и диагностике состояний и в соответствии с описанными здесь способами, если не указано иначе.
В дополнительном аспекте изобретения предлагаются способы лечения рака, включающие стадию a) введения липосом направленного действия, как здесь описано, нуждающемуся в этом индивидууму в количестве, эффективном для лечения рака, где лекарственное вещество представляет собой противораковый агент.
В некоторых воплощениях индивидуум представляет собой млекопитающее. В конкретных воплощениях индивидуумом является человек.
В определенных воплощениях рак представляет собой рак молочной железы, желудка, ободочной кишки, колоректальный рак, рак поджелудочной железы, не мелкоклеточный рак легких, мелкоклеточный рак легких, рак мозга, рак печени, рак почки, рак простаты, рак мочевого пузыря, рак яичника или гематологические злокачественные заболевания.
В некоторых воплощениях способов лечения стадию (a) осуществляют перед, одновременно с или после сочетанной терапии рака разной модальности. В конкретных воплощениях сочетание лечения рака разной модальности включает химиотерапию, облучение или хирургическое вмешательство.
В некоторых воплощениях способов лечения стадию (a) осуществляют перед, одновременно с или после адъювантной терапии рака. В конкретных воплощениях адъювантная терапия рака включает введение одного или более агентов для снижения потери волос, рвоты, иммуносупрессии, тошноты, диареи, сыпи, сенсорных нарушений, анемии, слабости, стоматита или синдрома руки и стопы. В определенных воплощениях стадию (a) выполняют перед, одновременно с или после введения одного или более дополнительных противораковых агентов. В конкретных воплощениях один или более дополнительные противораковые агенты включают 5-фторурацил, лейковорин, капецитабин, UFT/LV (тегафур-урацил и лейковорин), иринотекан, антитело против EGFR, антитело против VEGF, ингибитор тирозинкиназы или их сочетания.
В определенных воплощениях способов лечения липосомы направленного действия вводят путем парентерального введения. В конкретных воплощениях парентеральное введение является инъекцией или внутривенной инфузией.
Краткое описание фигур
На фиг.1 дано схематическое изображение липосомы направленного действия.
На фиг.2 дано схематическое изображение активного нацеливания лекарственного вещества на опухолевые клетки с применением липосом направленного действия.
На фиг.3 дано схематическое изображение предполагаемого механизма действия липосом направленного действия, содержащих оксалиплатин.
На фиг.4 представлено схематическое изображение способа получения A липосом направленного действия.
На фиг.5 представлено схематическое изображение способа получения B липосом направленного действия.
На фиг.6 представлена цитотоксичность оксалиплатина на AsPC-1 клетках при различных концентрациях оксалиплатина.
На фиг.7 показано количество рецепторов трансферрина, присутствующих на клеточной поверхности нормальных лейкоцитов и клеточных линий опухолевого происхождения.
На фиг.8 представлены результаты распределения по размеру смесей, содержащих липосомы, полученных в примере 6 полученных с помощью QELS; A) Вход 1, B) Вход 2, C) Вход 3, D) Вход 4, E) Вход 5, F) Вход 6.
На фиг.9 представлены концентрации липосом в крови, где (♦) показывает липосомы Tf-PEG, полученные в примере 6, (■) показывает липосомы Tf-NG-DSPE:NG-DSPE:DSPC:CH, полученные в примере 5, и (▲) показывает липосомы Tf/PEG-NG-DSPE, полученные в примере 6.
На фиг.10 представлены концентрации липосом в тканях рака, где (♦) показывает липосомы Tf-PEG, полученные в примере 6, (■) показывает липосомы Tf-NG-DSPE:NG-DSPE:DSPC:CH, полученные в примере 5, и (▲) показывает липосомы Tf/PEG-NG-DSPE, полученные в примере 6.
На фиг.11 показана аккумуляция в опухолевой ткани липосом NG-PE, полученных в примере 13, после внутривенного введения, где липосомы NGPE, инкапсулированные тираминилинулином, меченным 125I, вводили мышам-носителям опухоли ободочной кишки 26. Данные представлены как среднее ± станд. откл. (n=5). (□) 0 моль% (-);(<) 1 моль% (+) Tf-NG-DOPE. * Достоверность различий от 0 моль% (-).
На фиг.12 представлены ингибиторные эффекты липосом на рост опухоли с помощью отложения данных об отношении роста опухоли к дням после первоначального воздействия, где (♦) показывает липосомы Tf-PEG, полученные в примере 9, (<) показывает PEG-липосомы, полученные в примере 6 без Tf; (▲) показывает липосомы Tf-NG-DSPE:NG-DSPE:DSPC:CH, полученные в примере 8; (○) показывает липосомы NG-DSPE:NG-DSPE:DSPC:CH, полученные в примере 8 без Tf; (*) показывает липосомы Tf/PEG-NG-DSPE, полученные в примере 9; (●) показывает липосомы PEG-NG-DSPE, полученные в примере 9 без Tf; (+) указывает на l-OHP раствор; и (-) указывает на отсутствие воздействия.
На фиг.13 представлен эффект различных концентраций NG-PT(NG-DSPE) на процент дозы лекарственного вещества, обнаруживаемой в крови, где концентрация (% от суммарного содержания липидов) NG-DSPE является следующим: (♦) 0%,(■)1%; (▲) 3%; (х) 6%; (○) 12%; и со следующими липидами (●) MPB 6%; (+) PDP 6%.
На фиг.14 представлена задержка в крови липосом с различными линкерами дикарбоновых кислот с и без Tf; где (♦) Tf-NGPE; (<) Tf-NSPE; (▲) Tf-MPB; (х) NGPE (без Tf); (*) MPB (без Tf).
На фиг.15 представлен экспериментальный анализ липосом с помощью электрофореза: показаны дорожка 6 (липосома трансферрин-N-глутарилдистеароилфосфатидилэтаноламин (липосома Tf-NG-DSPE-)); дорожка 5 (липосома трансферрин-полиэтиленгликоль-дистеароилфосфатидилэтаноламин (липосома Tf-PEG-DSPE-)). Дорожки 1-4 содержат h-апо-Tf (240 нг), h-апо-Tf (120 нг), h-апо-Tf (60 нг), и h-апо-Tf (30 нг), соответственно.
На фиг.16 представлено количество трансферрина, связанного с липосомами Tf-NG-DSPE с (дорожка 5) и без (дорожка 4) non-NG-DSPE, включенного в липосому. Дорожки 1-3 содержат h-апо-Tf (400 нг), h-апо-Tf (200 нг) и h-апо-Tf (50 нг), соответственно.
На фиг.17 представлена аккумуляция оксалиплатина в крови после введения (■)липосом NG-DOPe:tf-NG-DOPE:DMPC:CH при 5 мг/кг и (●) липосом Tf-PEG при 5 мг/кг.
На фиг.18 представлена аккумуляция оксалиплатина в опухолях ободочной кишки 26 после введения (■) липосом NG-DOPe:tf-NG-DOPE:DMPC:CH при 5 мг/кг и (●) липосом Tf-PEG при 5 мг/кг мыши с опухолями ободочной кишки 26.
На фиг.19 представлен противоопухолевый эффект липосом NG-DOPe:tf-NG-DOPE:DMPC:CH у мышей-носителей опухоли ободочной кишки 26, где (●) указывает на контроль с носителем (9% сахароза); (▲) указывает на l-OHP раствор, 5 мг/кг; (♦)указывает на липосомы NG-DOPe:tf-NG-DOPE:DMPC:CH, 5 мг/кг и (■) указывает на липосомы Tf-PEG , 5 мг/кг.
На фиг.20 представлен противоопухолевый эффект липосом NG-DOPe:Tf-NG-DOPE:DMPC:CH у мышей-носителей ксенографов опухоли HCT-116 ободочной кишки человека, где (●) указывает на контроль с носителем (300 мМ (10,27%) сахароза); (○) указывает на ненагруженную липосому (без лекарственного вещества), (▲) указывает на l-OHP раствор, 15 мг/кг; (♦) указывает на липосомы NG-DOPe:Tf-NG-DOPE:DMPC:CH, 10 мг/кг и (■) указывает на липосомы NG-DOPe:Tf-NG-DOPE:DMPC:CH, 15 мг/кг. Все липосомы вводили на точную массу тела с объемом инъекции 0,103 мл/10 г массы тела.
На фиг.21 представлен противоопухолевый эффект липосом NG-DOPe:Tf-NG-DOPE:DMPC:CH у мышей-носителей ксенографов опухоли HT-29 ободочной кишки человека, где (●) указывает на контроль с носителем (300 мМ (10,27%) сахароза); (▲) указывает на липосомы NG-DOPe:Tf-NG-DOPE:DMPC:CH, 15 мг/кг, (■) указывает на липосомы NG-DOPe:Tf-NG-DOPE:DMPC:CH, 10 мг/кг и (♦) указывает на липосомы NG-DOPe:Tf-NG-DOPE:DMPC:CH, 6,7 мг/кг.
На фиг.22 представлен противоопухолевый эффект липосом NG-DOPe:Tf-NG-DOPE:DMPC:CH у мышей-носителей ксенографов опухоли MKN45 желудка человека, где (●) указывает на контроль с носителем (300 мМ (10,27%) сахароза); (▲) указывает на липосомы NG-DOPe:Tf-NG-DOPE:DMPC:CH, 15 мг/кг; (■) указывает на липосомы NG-DOPe:Tf-NG-DOPE:DMPC:CH, 10 мг/кг и (♦) указывает на липосомы NG-DOPe:Tf-NG-DOPE:DMPC:CH, 6,7 мг/кг.
На фиг.23 представлен противоопухолевый эффект липосом NG-DOPe:Tf-NG-DOPE:DMPC:CH у мышей-носителей ксенографов опухоли COLO 205 человека, где (●) указывает на контроль с носителем (9% сахароза); (▲) указывает на l-OHP раствор, 5 мг/кг q4d × 3 (16 день), 10 мг/кг q2d × 2 (47 день), 2 мг/кг q2d × 6 (51 день); (♦)указывает на липосомы NG-DOPe:Tf-NG-DOPE:DMPC:CH, 5 мг/кг, q4d × 3 (16 день), 10 мг/кг q2d × 2 (47 день), 2 мг/кг q2d × 6 (51 день); и (■) указывает на липосомы NG-DOPe:Tf-NG-DOPE:DMPC:CH, 10 мг/кг q4d × 3 (16 день), 15 мг/кг q2d × 2 (47 день), 4 мг/кг q2d × 6 (51 день).
На фиг.24 представлен паттерн Na-ДДС-ПААГЭ после восстановления 2-меркаптоэтанолом, где дорожка 1 представляет собой маркеры молекулярной массы, дорожка 2 представляет собой холо-трансферрин, дорожки 3-5 представляют собой липосомы NG-DOPe:Tf-NG-DOPE:DMPC:CH, и дорожка 6 представляет собой Tf-NG-DOPE.
На фиг.25 представлен пример хроматограммы ВЭЖХ подходящей системы.
Подробное описание изобретения
Здесь предлагаются содержащие липиды композиции (включая липосомы направленного действия, ненагруженные липосомы, содержащие липосомы композиции, липидные смеси и т.д.), и способы их получения, и применение описанных здесь содержащих липиды композиций. Содержащие липиды композиции и липосомы, в частности, те, которые предлагаются здесь, пригодны для получения фармацевтических составов и для применения при лечении или диагностике различных состояний, включая рак. Композиции, включая фармацевтические составы, обеспечивают более эффективные схемы лечения и диагностики с пониженными побочными эффектами, связанными с лекарственным веществом или меченым соединением, подлежащими доставке индивидууму. Повышенная эффективность и пониженные неблагоприятные эффекты должны повышать терапевтический индекс лекарственного состава и обеспечивать возможность успешного лечения разнообразных состояний, включая рак, и должны также увеличить эффективность и снизить неблагоприятные эффекты, связанные с диагностикой. Повышенная специфичность лекарственных составов при сопровождающемся снижении побочных эффектов должны придать терапевтические преимущества большему количеству и диапазону подвергаемых лечению индивидуумов, таким образом, спасая или продлевая жизни и улучшая качество жизни индивидуумов, нуждающихся в лечении. Повышенная специфичность составов меченых соединений с параллельным снижением побочных эффектов должны увеличить количество индивидуумов, у которых может быть проведена успешная диагностика, например, способных быть устойчивыми к диагностическому составу, и также повысить точность (например, чувствительность и т.д.) диагноза, включая возможность более раннего диагноза состояний и более эффективного слежения за тяжестью заболевания (например, прогрессии или регрессии с или без терапии).
Включенными в описанные здесь композиции являются фармацевтические составы содержащих липиды композиций. Описанные здесь содержащие липиды композиции включают, но не ограничиваются этим, липосомы, которые инкапсулируют лекарственные вещества и меченые соединения, и могут быть применены для лечения или диагностики заболевания или других состояний, требующих лечения или диагностики, включая, например, рак (например, рак молочной железы, желудка, колоректальный рак и рак ободочной кишки).
Когда традиционные противораковые агенты (включая цитотоксические) вводят внутривенно, весь организм подвергается действию лекарственного вещества не избирательно. В результате этого может возникать ряд побочных реакций, рак не является мишенью, и/или эффект лекарственного вещества может быть потерян в процессе его циркуляции. Инкапсулирование лекарственного вещества в композицию липосомы перед введением может вести к одному или более преимуществам, включая снижение побочного(ых) эффекта(ов) лекарственного вещества на нормальную клетку, защиту лекарственного вещества до того, как оно достигнет патологической клетки-мишени в случае, когда лекарственное вещество может быть нестабильным, пролонгирование присутствия лекарственного вещества в системе циркуляции для возможности доставки к патологическим клеткам, и/или ускорение доставки лекарственного вещества к патологической клетке-мишени. Более специфичная мишень лекарственного вещества и снижение потери лекарственного вещества из-за захвата РЭС также составляет преимущество в снижении количества лекарственного вещества, которое необходимо вводить и тем самым снижает стоимость терапии, а также имеет другие описанные здесь преимущества.
Сходно, многие меченые соединения имеют побочные эффекты и/или разрушаются в промежутке времени между введением и диагностикой (например, временем, в течение которого диагностика осуществляется технически, например, детекция радиоизотопов, магнитно-резонансная визуализация, ультразвук и т.д.). Включение меченых соединений в описанные здесь содержащие липиды композиции должно увеличить эффективность меченого соединения, такую как, например, порог детекции, который может быть достигнут при меньших дозах меченого соединения, снижение побочных эффектов агента, и/или расширение окна времени, при котором может быть осуществлена диагностика.
Содержащие липиды композиции включают также липиды, модифицированные направляющими лигандами (например, липосомы направленного действия, ненагруженные липосомы, содержащие липосомы композиции, липидные смеси) или другие производные. Например, липосомные композиции, включающие направляющий фактор (например, трансферрин и т.д.) и модифицированные липиды (например, производные N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина), разработаны для улучшения безопасности эффективности противораковых агентов (например, оксалиплатина) за счет пролонгирования времени циркуляции лекарственного вещества в плазме (по сравнению с лекарственным веществом, вводимым только в растворе) и за счет наличия на опухолевых клетках рецепторов, специфичных для направляющего фактора. Эта улучшенная биодоступность и направленность на опухоль должна приводить к усиленной безопасности и повышенной противоопухолевой активности и, следовательно, более высокой вероятности эффективного лечения нуждающихся в этом индивидуумов при снижении также побочных эффектов, связанных с многими лекарственными веществами, особенно с тяжелыми побочными эффектами, связанными с большинством противораковых агентов. Сходно, такая модификация и направляющие факторы могут также применяться для эффективной направленности на конкретные места (например, типы опухоли, органы, ткани и т.д.) для доставки меченых соединений.
В изобретении предлагаются также модифицированные трансферрином производные N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, которые могут быть применены в описанных здесь содержащих липиды композициях и их составах.
Содержащие липиды композиции, включая описанные здесь липосомы, могут быть получены с помощью описанных здесь способов, а также способов получения липосом, известных специалисту в данной области техники и подходящих с точки зрения указаний, предлагаемых в настоящем описании. Если не указано иначе, описанные здесь липосомы и содержащие липосомы композиции могут быть включены без ограничения в фармацевтические составы и/или наборы, включая фармацевтические составы и/или наборы, как здесь описано, и дополнительно, те, которые должны быть очевидны специалисту в данной области техники и подходящих с точки зрения указаний, предлагаемых в настоящем описании. Сходно липосомы и содержащие липосомы композиции и фармацевтические составы, включающие липосомы и содержащие липосомы композиции, могут быть применены без ограничения, если не указано иначе, в способах лечения или диагностики, совместимых с описанием, предлагаемым в настоящей спецификации, и в соответствии с практикой специалистов в данной области техники и подходящих с точки зрения предлагаемых здесь указаний.
Примером липосомы направленного действия, включающей лекарственное вещество (оксалиплатин), является представленная схематически на фиг. 1. Предполагаемые механизмы захвата и способа действия липосом направленного действия предлагаются на фиг. 2 и 3. Применяемый здесь термин «липосома направленного действия» относится обычно к липосоме с компонентами, включающими, по меньшей мере, один или более фосфолипид(ов), NωPE, TF-NωPE, и которая также включает лекарственное вещество или меченое соединение, как здесь описано. Каждый из этих компонентов, как описано в описании, без ограничения может быть включен в липосомы направленного действия настоящего изобретения не выходя за рамки представленных здесь указаний. Отмечается, что ненагруженные липосомы, описанные здесь очень подробно, также могут быть «направленными», так что они могут включать модифицированные Tf NωPEs, но обычно они не включают лекарственное вещество или меченое соединение.
Производные N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина
Описанные здесь содержащие липиды композиции включают, по меньшей мере, одно производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина в соответствии с формулой 1, ниже:

где R1 и R2 независимо представляют собой ацильную группу, и m представляет собой целое число от 1 до 10.
Применяемый здесь термин «производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина» и родственные ему соединения относятся к производным N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов, охватываемым формулой 1, как здесь представлено. Сходно аббревиатура NωPE применяется здесь для обозначения производных N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов, охватываемых формулой 1 (например, Nω-DOPE, NωDSPE, NG-DOPE и т.д.) и, например, NG-DOPE относится к N-глутарилфосфатидилэтаноламину(ам) формулы 1, если не указано иначе.
Подразумевается, что только описанные здесь фосфатидилэтаноламин(ы), включенные в содержащие липиды композиции (включая липосомы направленного действия), являются производными N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов формулы 1 или сукцинимидными эфирами производных N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов формулы 2 или модифицированными направляющим фактором производными N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов формулы 3, как здесь описано более подробно ниже. Применяемый здесь термин «немодифицированный фосфатидилэтаноламин» и родственные ему соединения относятся к фосфатидилэтаноламину, полусинтетическому(ким) фосфатидилэтаноламину(нам), синтетическому(ким) фосфатидилэтаноламину(нам) и/или их производным, которые не охватываются формулой 1, формулой 2 или формулой 3.
Самые разнообразные ацильные группы, представленные R1 и R2, могут быть использованы в формуле 1, как хорошо известно специалисту в данной области техники.
В некоторых воплощениях ацильная группа происходит из насыщенных или ненасыщенных алифатических карбоновых кислот, имеющих 12-22 атома углерода. Примеры ацильных групп включают, но не ограничиваются этим, ацильные группы, происходящие от лауриновой кислоты, тридекановой кислоты, миристиновой кислоты, пентадекановой кислоты, пальмитиновой кислоты, маргариновой кислоты, стеариновой кислоты, нонадекановой кислоты, арахиновой кислоты, генэйкозановой кислоты, бегеновой кислоты, 2-лауролеиновой кислоты, 5-лауролеиновой кислоты, 11-лауролеиновой кислоты, 5-миристоленовой кислоты, миристоленовой кислоты, 2-пальмитолеиновой кислоты, 7-пальмитолеиновой кислоты, цис-9-пальмитолеиновой кислоты, транс-9-пальмитолеиновой кислоты, петроселиновой кислоты, петроселидиновой кислоты, олеиновой кислоты, элаидиновой кислоты, вакценовой кислоты, гондоевой кислоты, транс-гондоевой кислоты, эруковой кислоты, линолевой кислоты, линоэлаидиновой кислоты, α-элеостеариновой кислоты, β-элеостеариновой кислоты, линоленовой кислоты, псевдоэлеостеариновой кислоты, арахидоновой кислоты, эйкозапентаеновой кислоты или докозагексаеновой кислоты.
В определенных воплощениях ацильная группа происходит из насыщенных или ненасыщенных алифатических карбоновых кислот, имеющих 14-18 атомов углерода. Примеры ацильных групп этого типа включают, но не ограничиваются этим, те, которые происходят из олеиновой кислоты (18 углеродов), пальмитиновой кислоты (16 углеродов), стеариновой кислоты (18 углеродов) или миристиновой кислоты (14 углеродов). Как это известно специалистам в данной области техники, соответствующие ацильные группы представляют собой олеоил, пальмитоил, стеароил и миристоил соответственно.
В других воплощениях ацильные группы происходят из насыщенных или ненасыщенных алифатических карбоновых кислот, имеющих 14-18, 14-20, 14-22, 16-18, 16-20, 16-22, 18-20, 18-22, 12, 14, 16, 18, 20 или 22 углерода. В определенных воплощениях ацильные группы происходят из насыщенных или ненасыщенных алифатических карбоновых кислот, имеющих даже больше число углеродов.
В некоторых воплощениях ацильные группы происходят из олеиновой кислоты (олеоил), стеариновой кислоты (стеароил), пальмитиновой кислоты (пальмитоил), линолевой кислоты (линолеоил, 18 углеродов) или миристиловой кислоты (миристоил). В других воплощениях ацильные группы происходят из олеиновой кислоты (олеоил). В определенных воплощениях ацильные группы происходят из стеариновой кислоты (стеароил). В еще одних воплощениях ацильные группы происходят из пальмитиновой кислоты (пальмитоил). В других воплощениях ацильные группы происходят из миристиловой кислоты (миристоил).
В некоторых воплощениях ацильные группы происходят из насыщенной алифатической карбоновой кислоты, такой как, но не ограничиваясь этим, пальмитиновая кислота (16 углеродов), стеариновая кислота (18 углеродов) или миристиловая кислота (14 углеродов).
В других воплощениях ацильные группы происходят из ненасыщенной алифатической карбоновой кислоты, такой как, но не ограничиваясь этим, олеиновая кислота (олеоил, 18 углеродов), линолевая кислота (линолеоил, 18 углеродов) или линоленовая кислота (линоленоил, 18 углеродов). В некоторых воплощениях ацильная группа происходит из линолевой кислоты.
В определенных воплощениях m равно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10. В других воплощениях m является целым числом от 1-8, 1-6, 1-5, 1-7, 1-3, 1-2, 2-8, 2-6, 2-5, 2-4, 2-3, 3-4, 3-5 или 3-6. В некоторых воплощениях m является целым числом от 2-4. В других воплощениях m равно 1, 2 или 3.
В определенных воплощениях m является целым числом от 1 до 4. Как известно специалисту в данной области техники, m=1 соответствует производному малоновой кислоты фосфатидилэтаноламина (PE), тогда как m=2, 3 или 4 соответствует производным янтарной кислоты, глутаровой кислоты и адипиновой кислоты PE соответственно. В некоторых воплощениях m=3 (глутаровая кислота).
В определенных воплощениях R1 и R2 представляют собой одну и ту же ацильную группу. В других воплощениях R1 и R2 представляют собой разные ацильные группы. В определенных воплощениях R1 и R2 представляют собой олеоил, стеароил, пальмитоил или миристоил. В некоторых воплощениях R1 и R2 представляют собой олеоил. В других воплощениях R1 и R2 представляют собой стеароил. В конкретных воплощениях R1 и R2 представляют собой пальмитоил. В других воплощениях R1 и R2 представляют собой миристоил.
В некоторых воплощениях производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина формулы 1 представляет собой N-глутарилдиолеоилфосфатидилэтаноламин (NG-DOPE (т.е., где R1 и R2 представляют собой олеоил и m равно 3)). В других воплощениях это N-глутарилдистеароилфосфатидилэтаноламин (NG-DSPE (т.е., где R1 и R2 представляют собой стеароил и m равно 3)). В других воплощениях это N-глутарилдимиристоилфосфатидилэтаноламин (NG-DMPE (т.е., где R1 и R2 представляют собой миристоил и m равно 3)). В других воплощениях это N-глутарилдипальмитоилфосфатидилэтаноламин (NG-DPPE (т.е., где R1 и R2 представляют собой пальмитоил и m равно 3)). В других воплощениях это N-сукцинилдистеароилфосфатидилэтаноламин (NS-DSPE (т.е., где R1 и R2 представляют собой стеароил и m равно 2)). В других воплощениях это N-адипинилдистеароилфосфатидилэтаноламин (NA-DSPE (т.е., где R1 и R2 представляют собой стеароил и m равно 4)). В определенных воплощениях производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина формулы 1 представляет собой NG-DOPE или NG-DSPE.
Получение производных N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов
Описанные здесь производные N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина могут быть получены с помощью связывания дикарбоновой кислоты с аминогруппой фосфатидилэтаноламина.
Фосфолипиды, включая фосфатидилэтаноламины и их производные, применяемые для описанных здесь целей, должны быть высокой чистоты и должны быть идеально гомогенными. Известные способы получения фосфолипидов высокой чистоты включают экстракцию липида из буферного раствора и очистку с применением колоночной хроматографии. Например, способы получения N-сукцинилдипальмитоилфосфатидилэтаноламина описаны в международной патентной заявке, публикация WO93/01828 (JPAH7-501316) и патентах США Nos. 5804552 и 5554728, содержание которых включено здесь во всей своей полноте. Эти способы получения включают очистку производного фосфолипида из реакционной смеси с помощью хроматографии реакционной смеси на колонке силикагеля 60. Дипальмитоилфосфатидилэтаноламин (DPPE) вступает в реакцию с ангидридом янтарной кислоты с триэтиламином в качестве катализатора при комнатной температуре под газообразным азотом в течение 16 часов.
Другие способы получения производных N-(ω-карбокси)ациламидофосфатидилэтаноламина описаны в опубликованной патентной заявке Японии JPA2001-261688, которые включают очистку путем отделения жидкого слоя после добавления буферного раствора рН 3,5-7,5 к реакционной смеси, и включены сюда полностью путем ссылки. В этом случае PE вводили в реакцию с ангидридом дикарбоновой кислоты с щелочным триэтиламином в качестве катализатора при 4°С в течение 1 час. Этот способ может не работать хорошо для всех производных фосфатидилэтаноламина.
DOPE (диолеоилфосфатидилэтаноламин) может также быть получен коммерчески или получен с помощью способов, известных специалисту в данной области техники. Например, кратко, лецитин (исходное вещество API) может быть химически гидролизован с получением глицеринфосфохолина, который выделяют осаждением. Липид затем ацилируют с применением активированной олеиновой кислоты и DOPC (диолеоилфосфатидилхолин) выделяют с помощью колоночной хроматографии с нормальной фазой и пропускают через ионно-обменную колонку для очистки. DOPE может быть получен из DOPC с помощью взаимодействия с этаноламином с применением фосфолипазы D.
Фосфолипидные производные N-(ω-карбокси)ациламидофосфатидилэтаноламина могут быть также получены таким же способом, что и описанный, например, в патенте США No. 4534899, который включен здесь во всей своей полноте. Кратко, дикарбоновый ангидрид вводят в реакцию с фосфолипидом, таким как фосфатидилэтаноламин с получением производного дикарбоновой кислоты и фосфатидилэтаноламина.
Сукцинимидные эфиры производных N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов
Сукцинимидные эфиры производных N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов, как здесь описано, представлены следующей формулой 2:

где R3 и R4 независимо представляют собой ацильную группу, и n представляет собой целое число от 1 до 10.
Применяемый здесь термин «сукцинимидные эфиры производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина» и родственные им соединения относится к сукцинимидным эфирам производных N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов, охватываемых формулой 2, как здесь представлено. Сходно аббревиатура SuccNωPE может быть использована для обозначения сукцинимидных эфиров производных N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов, охватываемых формулой 2 (например, SuccNω-DOPE, SuccNω-DSPE, SuccNG-DOPE и т.д.) и, например, NHS-NG-PE относится к сукцинимидному эфиру N-глутарилфосфатидилэтаноламина(ов), формулы 2, образованному с помощью реакции с NHS, если не указано иначе.
Широкое разнообразие ацильных групп, которые представлены R3 и R4, может быть применено, как хорошо понятно специалистам в данной области техники и как описано выше для R1 и R2. Если здесь не указано иначе, точно подразумевается, что предлагаемое здесь описание ацильных групп в отношении формулы 1 (например, R1 и R2) равно применимо к ацильным группам в отношении формулы 2 (например, R3 и R4). Включая, в частности, представленное выше описание в разделе, озаглавленном «Производные N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина».
В определенных воплощениях R3 и R4 представляют собой одну и ту же ацильную группу. В других воплощениях R3 и R4 представляют собой разные ацильные группы. В определенных воплощениях R3 и R4 представляют собой олеоил, стеароил, пальмитоил или миристоил. В некоторых воплощениях R3 и R4 представляют собой олеоил. В других воплощениях R3 и R4 представляют собой стеароил. В определенных воплощениях R3 и R4 представляют собой пальмитоил. В других воплощениях R3 и R4 представляют собой миристоил.
В определенных воплощениях n равно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10. В других воплощениях n является целым числом от 1-8, 1-6, 1-5, 1-7, 1-3, 1-2, 2-8, 2-6, 2-5, 2-4, 2-3, 3-4, 3-5 или 3-6. В некоторых воплощениях n является целым числом от 2-4. В других воплощениях n равно 1, 2 или 3.
В определенных воплощениях n является целым числом от 1 до 4. Как известно специалисту в данной области техники, n=1 соответствует производному малоновой кислоты фосфатидилэтаноламина (PE), тогда как n=2, 3 или 4 соответствует производным янтарной кислоты, глутаровой кислоты и адипиновой кислоты PE соответственно. В некоторых воплощениях n=3 (глутаровая кислота).
В некоторых воплощениях сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина формулы 2 представляет собой сукцинимидный эфир N-глутарилдиолеоилфосфатидилэтаноламина (NG-DOPE). В других воплощениях это сукцинимидный эфир N-глутарилдистеароилфосфатидилэтаноламина (NG-DSPE). В определенных воплощениях сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина формулы 2 представляет собой сукцинимидный эфир NG-DOPE или NG-DSPE.
В некоторых воплощениях сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина формулы 2 представляет собой сукцинимидный эфир N-глутарилдиолеоилфосфатидилэтаноламина (SuccNG-DOPE (т.е., где R3 и R4 представляют собой олеоил и n равно 3)). В других воплощениях это сукцинимидный эфир N-глутарилдистеароилфосфатидилэтаноламина (SuccNG-DSPE (т.е., где R3 и R4 представляют собой стеароил и n равно 3)). В других воплощениях это сукцинимидный эфир N-глутарилдимиристоилфосфатидилэтаноламина (SuccNG-DMPE (т.е., где R3 и R4 представляют собой миристоил и n равно 3)). В других воплощениях это сукцинимидный эфир N-глутарилдипальмитоилфосфатидилэтаноламина (SuccNG-DPPE (т.е., где R3 и R4 представляют собой пальмитоил и n равно 3)). В других воплощениях это сукцинимидный эфир N-сукцинилдистеароилфосфатидилэтаноламина (SuccNS-DSPE (т.е., где R3 и R4 представляют собой стеароил и n равно 2)). В других воплощениях это сукцинимидный эфир N-адипинилдистеароилфосфатидилэтаноламина (SuccNA-DSPE (т.е., где R3 и R4 представляют собой стеароил и n равно 4)). В определенных воплощениях сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина формулы 2 представляет собой SuccNG-DOPE или SuccNG-DSPE.
В некоторых воплощениях производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой Nω-DOPE и сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой SuccNω-DOPE. В других воплощениях производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой Nω-DSPE и сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой SuccNω-DSPE. В еще одних воплощениях производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой Nω-DOPE и сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой SuccNω-DSPE. В определенных других воплощениях производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой Nω-DSPE и сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой SuccNω-DOPE. В определенных воплощениях сукцинимидный эфир может представлять собой NHS (например, NHS-Nω-DOPE, NHS-Nω-DSPE и т.д.).
В некоторых воплощениях производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой NG-DOPE и сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой SuccNG-DOPE. В других воплощениях производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой NG-DSPE и сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой SuccNG-DSPE. В еще одних воплощениях производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой NG-DOPE и сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой SuccNG-DSPE. В определенных других воплощениях производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой NG-DSPE и сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой SuccNG-DOPE. В определенных из этих воплощений сукцинимидный эфир может представлять собой NHS (например, NHS-NG-DOPE, NHS-NG-DSPE и т.д.).
Получение сукцинимидных эфиров производных N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов
Описанные здесь сукцинимидные эфиры производных N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов могут быть получены путем модификации описанных здесь производных N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов, полученных как известно в данной области техники и описано здесь. Получение сукцинимидных эфиров производных N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов описывается также более подробно ниже, включая примеры. С точки зрения указаний, предлагаемых в настоящем описании, специалист в данной области техники также должен быть способен модифицировать описанные здесь методы.
Способ получения сукцинимидных эфиров производных N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов настоящего изобретения является следующим.
К 1 эквиваленту производных N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов, представленных формулой 2, как здесь описано, добавляют приблизительно 0,7-1,3 эквивалента NHS, который растворен в органическом растворителе, который не имеет активного водорода. Смесь затем вводят в реакцию с приблизительно 0,7-1,3 эквивалента соединения карбодиимида при 0-50°С в течение приблизительно 1-7 дней.
Примеры органических растворителей, которые не имеют активного водорода включают, но не ограничиваются этим, сложные эфиры (например, этилацетат, бутилацетат и т.д.), алифатические углеводороды (например, гексан, гептаны и т.д.), ароматические углеводороды (например, толуол, ксилол и т.д.), галогенизированные углеводороды (например, хлороформ, дихлорметан, дихлорэтан и т.д.), простые эфиры (например, ТГФ, диоксан, диэтиловый эфир и т.д.), циклические углеводороды (например, циклогексан и т.д.), ДМФ и ДМСО. Органический растворитель может быть также обезвожен.
Самые разнообразные карбодиимидные соединения могут быть применены до тех пор, пока соединения обладают карбодиимидной группой (-N=C=N-). Например, карбодиимидные соединения, которые могут быть применены, включают, но не ограничиваются этим, карбодиимидные группы, такие как N,N'-дициклогексилкарбодиимид (DCC), N,N'-диизопропилкарбодиимид, N-этил-N'-(3-диметиламинопропил)карбодиимид гидрохлорид (EDC) и т.д. В определенных воплощениях применяют DCC. В других применяют EDC.
Описанную выше реакцию можно также выполнять в условиях, которые сводят к минимуму или исключают получение побочных продуктов. Нежелательные побочные продукты включают соединения мочевины (например, N,N'-дициклогексилмочевину, N-этил-N'-(3-диметиламинопропил)мочевину и т.д.), N-ацилированные соединения мочевины, карбоксиангидридные соединения и соединения 5-оксазолона. Условия и материалы, которые не способствуют или сводят к минимуму образование побочных продуктов включают 1) медленное растворение соединений карбодиимида в органическом растворителе, 2) осуществление реакции при температуре ниже 0°С для предотвращения выработки тепла в результате реакции и т.д. Другие способы оптимизации реакции и сведения к минимуму получения побочных продуктов должны быть понятны специалистам в данной области техники, особенно с точки зрения представленных здесь указаний.
Органический растворитель, который способен растворить соединения карбодиимида, является таким же, что и органический растворитель, который не имеет активного водорода, как описано выше. Растворитель, применяемый для растворения карбодиимида, и органический растворитель без активных водородов могут быть одинаковыми или различаться.
За ходом реакции можно следить с помощью систем тонкослойной хроматографии (ТСХ), высокоэффективной жидкостной хроматографии (ВЭЖХ) и/или детекторов рассеяния света. Другие методы прослеживания хода реакции должны быть также известны специалистам в данной области техники.
Очистка может быть выполнена с помощью колоночной хроматографии на силикагеле с применением смеси хлороформа и метанола. Методы дополнительной очистки должны быть известны специалистам в данной области техники.
В полностью обезвоженных органических растворителях и в отсутствие сильного закисления или сильного защелачивания сукцинимидные эфиры производных N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов, как здесь описано, обычно стабильны.
Модифицированные направляющим фактором производные N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина
Модифицированные направляющим фактором производные N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина включают направляющий лиганд, присоединенный ко второму производному N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, где второе производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 3

где R5 и R6 независимо представляют собой ацильную группу, и p представляет собой целое число от 1 до 10.
Применяемый здесь термин «модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина» и родственные ему соединения относится к производным N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов, охватываемым формулой 3 и модифицированных направляющим фактором, как здесь предлагается. Сходно аббревиатура Tf-NωPE может быть использована для обозначения модифицированных направляющим фактором производных N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов (например, Tf-Nω-DOPE, Tf-Nω-DSPE, Tf-NG-DOPE и т.д.) и, например, Tf-NG-PE относится к направляющему лиганду, соединенному с N-глутарилфосфатидилэтаноламином(ами), формулы 3.
Широкое разнообразие ацильных групп, которые представлены R5 и R6, может быть применено, как хорошо понятно специалистам в данной области техники и как описано выше для R1 и R2. Если здесь не указано иначе, точно подразумевается, что предлагаемое здесь описание ацильных групп в отношении формулы 1 (например, R1 и R2) равно применимо к ацильным группам в отношении формулы 3 (например, R5 и R6). Включая, в частности, представленное выше описание в разделе, озаглавленном «Производные N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина».
В определенных воплощениях R5 и R6 представляют собой одну и ту же ацильную группу. В других воплощениях R5 и R6 представляют собой разные ацильные группы. В определенных воплощениях R5 и R6 представляют собой олеоил, стеароил, пальмитоил или миристоил. В некоторых воплощениях R5 и R6 представляют собой олеоил. В других воплощениях R5 и R6 представляют собой стеароил. В определенных воплощениях R5 и R6 представляют собой пальмитоил. В других воплощениях R5 и R6 представляют собой миристоил.
В определенных воплощениях p равно 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10. В других воплощениях p является целым числом от 1-8, 1-6, 1-5, 1-7, 1-3, 1-2, 2-8, 2-6, 2-5, 2-4, 2-3, 3-4, 3-5 или 3-6. В некоторых воплощениях p является целым числом от 2-4. В других воплощениях p равно 1, 2 или 3.
В определенных воплощениях p является целым числом от 1 до 4. Как известно специалистам в данной области техники, p=1 соответствует производному малоновой кислоты фосфатидилэтаноламина (РЕ), тогда как p=2, 3 или 4 соответствует производным янтарной кислоты, глутаровой кислоты и адипиновой кислоты РЕ соответственно. В некоторых воплощениях p=3 (глутаровая кислота).
В некоторых воплощениях модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина формулы 3 представляет собой модифицированный направляющим фактором N-глутарилдиолеоилфосфатидилэтаноламин (TF-NG-DOPE). В других воплощениях модифицированный направляющим фактором N-глутарилдистеароилфосфатидилэтаноламин - это (TF-NG-DSPE). В определенных воплощениях модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина формулы 3 представляет собой TF-NG-DOPE или TF-NG-DSPE.
В некоторых воплощениях производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина формулы 3 представляет собой N-глутарилдиолеоилфосфатидилэтаноламин (NG-DOPE (т.е., где R5 и R6 представляют собой олеоил и p равно 3)). В других воплощениях - это N-глутарилдистеароилфосфатидилэтаноламин (NG-DSPE (т.е., где R5 и R6 представляют собой стеароил и p равно 3)). В других воплощениях - это N-глутарилдимиристоилфосфатидилэтаноламин (NG-DMPE (т.е., где R5 и R6 представляют собой миристоил и p равно 3)). В других воплощениях - это N-глутарилдипальмитоилфосфатидилэтаноламин (NG-DPPE (т.е., где R5 и R6 представляют собой пальмитоил и p равно 3)). В других воплощениях - это N-сукцинилдистеароилфосфатидилэтаноламин (NS-DSPE (т.е., где R5 и R6 представляют собой стеароил и p равно 2)). В других воплощениях - это N-адипинилдистеароилфосфатидилэтаноламин (NA-DSPE (т.е., где R5 и R6 представляют собой стеароил и p равно 4)). В определенных воплощениях производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина формулы 3 представляет собой NG-DOPE или NG-DSPE.
В определенных воплощениях направляющий лиганд представляет собой трансферрин (Tf), который описывается более подробно ниже, и производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина включен в модифицированное трансферрином производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина формулы 3, как здесь описано.
В некоторых воплощениях производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой Nω-DOPE и направляющий лиганд представляет собой трансферрин (Tf), и модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой Tf-Nω-DOPE. В других воплощениях производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой Nω-DSPE и направляющий лиганд представляет собой трансферрин (Tf), и модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой Tf-Nω-DSPE. В еще одних воплощениях производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой Nω-DOPE и направляющий лиганд представляет собой трансферрин (Tf), и модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой Tf-Nω-DSPE. В определенных других воплощениях производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой Nω-DSPE и направляющий лиганд представляет собой трансферрин (Tf), и модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой Tf-Nω-DOPE. В определенных из этих воплощений m может быть равно 3, и производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой NG-PE в соответствии с формулой 1.
В некоторых воплощениях производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой NG-DOPE и модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой TF-NG-DOPE. В других воплощениях производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой NG-DSPE и модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой TF-NG-DSPE. В еще одних воплощениях производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой NG-DOPE и модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой TF-NG-DSPE. В определенных других воплощениях производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой NG-DSPE и модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляет собой TF-NG-DOPE.
Модифицированные направляющим фактором производные N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина могут быть получены из SuccNωPE с помощью реакции с направляющим лигандом и другими реагентами, как здесь описано более подробно. TF-NωPE может либо быть получен перед смешиванием с другими липидными компонентами описанных здесь содержащих липиды композиций (и необязательно очищенных) или оно может быть получен in situ в результате взаимодействия с предварительно полученным SuccNωPE, который включен в содержащую липиды композицию.
Дополнительные липидные компоненты
Содержащие липиды композиции, как здесь описано, также содержат один или более дополнительных липидных компонентов в дополнение к описанным здесь NωPE, SuccNωPE и/или TF-NωPE. Могут быть применены разнообразные дополнительные липидные компоненты, однако, термин «дополнительный(е) липидный(е) компонент(ы)» не предназначен для включения немодифицированных фосфатидилэтаноламинов (PE) или производных РЕ в формулы 1, 2 или 3. В некоторых воплощениях один или более дополнительный(ые) липидный(е) компонент(ы) может представлять собой фосфолипид или один или более фосфолипидов. В определенных воплощениях один или более дополнительные липидные компоненты могут включать, по меньшей мере, два нейтральных липида. В других воплощениях могут присутствовать один или более фосфолипидов и, необязательно, «дополнительный липид» (который не представляет собой фосфолипид). Могут быть применены различные нейтральные липиды, однако, по меньшей мере, два нейтральных липида не предназначены для включения немодифицированых фосфатидилэтаноламинов (PE) или модифицированных PE формул 1, 2 или 3. Не подразумевается, что применяемый здесь термин «фосфолипид» должен включать PE или их производные формул 1, 2 или 3. Сходно, термин «дополнительный липид» не включает ни PE или их производные формул 1, 2 или 3, ни другие фосфолипиды.
В конкретных воплощениях фосфолипид(ы) могут быть применены в описанных здесь содержащих липиды композициях и составах. Например, один или более, по меньшей мере два, по меньшей мере три, по меньшей мере четыре фосфолипида; или два, три или четыре фосфолипида. В конкретных воплощениях присутствует один фосфолипид. В определенных воплощениях липидные компоненты композиций ограничены одним фосфолипидом, NωPE и SuccNωPE (или модифицированным TF NωPE, когда проводилась реакция с направляющим фактором).
В конкретных воплощениях два или более нейтральных липидов могут быть применены в описанных здесь содержащих липиды композициях и составах. Например, по меньшей мере два, по меньшей мере три, по меньшей мере четыре нейтральных липидов; или два, три или четыре нейтральных липида. В конкретных воплощениях присутствует два нейтральных липида. В определенных воплощениях липидные компоненты композиций ограничены двумя нейтральными липидами, NωPE и SuccNωPE (или модифицированным TF NωPE, когда проводилась реакция с направляющим фактором).
В некоторых воплощениях, когда дополнительный липидный компонент(ы) включает фосфолипид, фосфолипид может представлять собой фосфатидилхолин, включая существующий в природе, полусинтетический или синтетический фосфатидилхолины (например, DSPC, DMPC и т.д.). В некоторых воплощениях фосфатидилхолин представляет сбой не природный фосфатидилхолин (например, не фосфатидилхолин яйца). В конкретных воплощениях фосфатидилхолин представляет сбой ацилфосфатидилхолин (например, DMPC, DPPC, POPC, DSPC и т.д.). В некоторых воплощениях фосфолипид является катионным. В других воплощениях фосфолипид является анионным. В еще одних воплощениях фосфолипид является нейтральным. В конкретных воплощениях один или более фосфолипида(ов) не являются анионными. В других воплощениях один или более фосфолипида(ов) не являются катионными. В определенных воплощениях, где присутствует более одного фосфолипида, может быть включен анионный или нейтральный липид. Примеры фосфолипидов включают, но не ограничиваются этим, фосфатидилхолины (PC), фосфатидную кислоту, фосфатидилсерин, фосфатидилглицерин и т.д. В некоторых воплощениях содержащие липиды композиции не включают фосфатидилсерин или фосфатидилглицерин.
В определенных воплощениях, по меньшей мере, один из, по меньшей мере, двух нейтральных липидов может представлять собой фосфолипид. В некоторых воплощениях фосфолипид может представлять собой фосфатидилхолин, включая существующие в природе, полусинтетический или синтетический фосфатидилхолины (например, DSPC, DMPC и т.д.). В некоторых воплощениях фосфатидилхолин представляет сбой не природный фосфатидилхолин (например, не фосфатидилхолин яйца). В конкретных воплощениях фосфатидилхолин представляет собой ацилфосфатидилхолин (например, DMPC, DPPC, POPC, DSPC и т.д.).
В некоторых воплощениях, по меньшей мере, один из, по меньшей мере, двух нейтральных липидов может представлять собой холестерин или производное холестерина (например, родственное холестерину соединение, положительно заряженный холестерин (например, DC-Chol), включающий радиоизотопный остаток (например, 3H, 14C, 125I, 131I и т.д.), имеющий функциональный остаток (например, флуоресцентный остаток и т.д.)).
В определенных воплощениях, когда содержащие липиды композиции включают один или более фосфолипидов, композиции могут дополнительно включать дополнительный нейтральный нефосфолипид в качестве дополнительного липида. Например, холестерин или производное холестерина, как описано выше.
Фосфолипиды (не-PC) для применения в описанных здесь содержащих липиды композициях включают синтетические, полусинтетические или существующие в природе фосфолипиды. Примеры фосфолипидов включают, но не ограничиваются этим, фосфатидилхолин (PC), фосфатидную кислоту, фосфатидилсерин, фосфатидилглицерин и т.д. В других воплощениях один или более фосфолипидов включают фосфатидилхолин (PC) или фосфатидную кислоту и не включают фосфатидилсерин или фосфатидилглицерин.
В некоторых воплощениях фосфолипид представляет собой фосфатидилхолин. В определенных воплощениях фосфатидилхолин может представлять собой, например, дистеароилфосфатидилхолин (DSPC), димиристоилфосфатидилхолин (DMPC), дипальмитоилфосфатидилхолин (DPPC), пальмитоилолеоилфосфатидилхолин (POPC), фосфатидилхолин яйца (EPC), гидрогенизированный фосфатидилхолин сои (HSPC) и т.д. В конкретных воплощениях, по меньше мере, один фосфолипид представляет собой фосфатидилхолин. В определенных воплощениях фосфатидилхолин представляет собой DMPC. В других воплощениях фосфатидилхолин представляет собой DSPC. В других воплощениях фосфатидилхолин представляет собой DPPC. В других воплощениях фосфатидилхолин представляет собой POPC. В других воплощениях фосфатидилхолин представляет собой EPC. В других воплощениях фосфатидилхолин представляет собой HSPC. В некоторых воплощениях включен один фосфолипид и он представляет собой DMPC, DSPC, DPPC, POPC, EPC или HSPC. В конкретных воплощениях, где содержащая липиды композиция включает единственный фосфолипид (не-PE фосфолипид), фосфолипид представляет собой DMPC. В других воплощениях, где содержащая липиды композиция включает единственный фосфолипид (не-PE фосфолипид), фосфолипид представляет собой DSPC. В других воплощениях, где содержащая липиды композиция включает единственный фосфолипид (не-PE фосфолипид), фосфолипид представляет собой DPPC. В других воплощениях, где содержащая липиды композиция включает единственный фосфолипид (не-PE фосфолипид), фосфолипид представляет собой POPC. В других воплощениях, где содержащая липиды композиция включает единственный фосфолипид (не-PE фосфолипид), фосфолипид представляет собой EPC. В других воплощениях, где содержащая липиды композиция включает единственный фосфолипид (не-PE фосфолипид), фосфолипид представляет собой HSPC.
В определенных воплощениях дополнительный(е) липидный(е) компонент(ы) могут включать, по меньшей мере, один фосфолипид, такой как холестерин или производное холестерина. В конкретных воплощениях дополнительный(е) липидный(е) компонент(ы) представляют собой единственный фосфолипид и холестерин. В определенных воплощениях дополнительный(е) липидный(е) компонент(ы) включают, по меньшей мере, один фосфатидилхолин и холестерин. В конкретных воплощениях дополнительный(е) липидный(е) компонент(ы) включают единственный фосфатидилхолин и холестерин. В определенных воплощениях, где включен холестерин, фосфолипид представляет собой DSPC, DMPC, DPPC, POPC, EPC или HSPC. В некоторых воплощениях дополнительный(е) липидный(е) компонент(ы) включают холестерин и DMPC. В других воплощениях дополнительный(е) липидный(е) компонент(ы) включают холестерин и DSPC. В определенных воплощениях дополнительный(е) липидный(е) компонент(ы) представляют собой холестерин и один из DMPC или DSPC. В определенных воплощениях дополнительный(е) липидный(е) компонент(ы) представляют собой холестерин и DMPC. В других воплощениях дополнительный(е) липидный(е) компонент(ы) представляют собой холестерин и DSPC. В других воплощениях дополнительный(е) липидный(е) компонент(ы) включают холестерин и DPPC. В других воплощениях дополнительный(е) липидный(е) компонент(ы) включают холестерин и POPC. В других воплощениях дополнительный(е) липидный(е) компонент(ы) включают холестерин и EPC. В других воплощениях дополнительный(е) липидный(е) компонент(ы) включают холестерин и HSPC. В определенных воплощениях дополнительный(е) липидный(е) компонент(ы) представляют собой холестерин и один из DMPC, DSPC, DPPC, POPC, EPC или HSPC. В определенных воплощениях дополнительный(е) липидный(е) компонент(ы) представляют собой холестерин и DMPC. В других воплощениях дополнительный(е) липидный(е) компонент(ы) представляют собой холестерин и DSPC. В других воплощениях дополнительный(е) липидный(е) компонент(ы) представляют собой холестерин и DPPC. В других воплощениях дополнительный(е) липидный(е) компонент(ы) представляют собой холестерин и POPC. В других воплощениях дополнительный(е) липидный(е) компонент(ы) представляют собой холестерин и EPC. В других воплощениях дополнительный(е) липидный(е) компонент(ы) представляют собой холестерин и HSPC.
В конкретных воплощениях присутствует один фосфолипид и фосфолипид не представляет собой HSPC или EPC.
В конкретных воплощениях присутствует один или более фосфолипидов. В определенных воплощениях один или более фосфолипидов включает фосфатидилхолин. В определенные воплощения включены один или более фосфолипидов и холестерин (или производное холестерина). В определенных воплощениях фосфолипид представляет собой фосфатидилхолин и композиция дополнительно включает холестерин (или производное холестерина). В конкретных воплощениях фосфатидилхолин представляет собой фосфатидилхолин, который включает остаток насыщенной жирной кислоты (например, DMPC, DSPC или DPPC). В определенных воплощениях фосфатидилхолин не представляет собой фосфатидилхолин яйца. В конкретных воплощениях фосфатидилхолин не представляет собой HSPC.
В конкретных воплощениях присутствуют два нейтральных липида. В некоторых воплощениях два нейтральных липидов представляют собой холестерин (или производное холестерина) и фосфатидилхолин. В определенных воплощениях фосфатидилхолин представляет собой фосфатидилхолин, который включает остаток насыщенной жирной кислоты (например, DMPC, DSPC или DPPC). В определенных воплощениях фосфатидилхолин не представляет собой фосфатидилхолин яйца.
Дополнительный(е) липидный(е) компонент(ы), как здесь описано и известно специалистам в данной области техники, коммерчески доступен от ряда поставщиков, включая, например, Avanti Polar Lipids, Inc. (Alabaster, AK), Northern Lipid Inc. (Canada), Lipoid GmbH (Germany), NOF Corporation (Japan), Nippon Fine Chemical Co., Ltd (Japan).
Лекарственные вещества
Различные лекарственные вещества могут быть включены в содержащие липиды композиции настоящего изобретения, например соединение или ген. В определенных воплощениях лекарственное вещество может представлять собой противораковый агент, например противораковый агент, подходящий для инкапсулирования в липосому. Количество лекарственного вещества, предназначенного для включения в содержащие липиды композиции и их составы, как здесь описано, может быть быстро определено специалистом в данной области техники с точки зрения предлагаемых здесь указаний и в зависимости от выбранного лекарственного вещества и планируемого использования композиции или состава, принимая во внимание факторы, специфичные как для лекарственного вещества, так и для индивидуума, подвергаемого лечению, как описано здесь далее.
В определенных воплощениях лекарственное вещество может представлять собой нуклеиновую кислоту, например, нуклеиновую кислоту, кодирующую последовательности с противораковыми свойствами. Например, но не ограничиваясь этим, антисмысловые олигонуклеотиды, рибозимы и т.д.
В некоторых воплощениях противораковый агент может представлять собой цитотоксическое лекарственное вещество, включая те, которые известны специалистам в данной области техники и практикующим врачам. Примеры противораковых агентов включают ингибиторы топоизомеразы I, алкалоиды барвинка, алкилирующие агенты (включая соединения платины), таксаны и другие, известные специалистам в данной области техники.
В некоторых воплощениях противораковое лекарственное вещество может представлять собой ингибитор топоизомеразы I, например, но не ограничиваясь этим, топотекан, иринотекан и т.д.
Противораковое лекарственное вещество может также представлять собой алкалоид барвинка, например, винкристин, винбластин, винлеурозин, винродизин, винорелбин, виндезин и т.д.
Далее, противораковое лекарственное вещество может также представлять собой соединение платины. Не ограничивающие примеры соединений платины включают биплатин, цисплатин, карбоплатин, ормаплатин, оксалиплатин, зениплатин, энлоплатин, лобаплатин, спироплатин и т.д.
Оксалиплатин (платина (II) цис-оксалато комплекс транс-1-1,2-диаминоциклогексана) представляет собой платину, более конкретно, органоплатину, комплекс, имеющий структуру, представленную следующей формулой, показанной ниже. Оксалиплатин также известен как следующее: диаминоциклогексан платина, DACH-платина и цис-[(1R, 2R)-1,2-циклогександиамин-N,N'][оксалато(2)-O,O']платина (C8H14N2O4Pt; Мол. М. 397,4 г/моль). Как указывалось ранее, оксалиплатин является активным фармацевтическим ингредиентом в Eloxatin™.
Оксалиплатин пригоден в качестве противоракового агента, так как он имеет терапевтическую активность, сходную с таковой цисплатина, и относительно низкие нефротоксичность и рвотное действие (стимуляцию рвоты). Способы производства оксалиплатина хорошо известны в данной области техники (например, JP-A-9- 40685; патенты США Nos. 4169846, 5338874; 5959133; 5298642; и 5290961 (содержание которых включены здесь во всей своей полноте). Оксалиплатин дополнительно описан в Chaney SG et al. «Recognition and processing of cisplatin- and oxaliplatin-DNA adducts.» Crit Rev Oncol Hematol. (2005) 53: 3-11 (включено сюда в качестве ссылки во всей своей полноте).
В определенных воплощениях концентрация оксалиплатина, инкапсулированного в липосому, составляет приблизительно 1 мг/мл, например, приблизительно 0,8 мг/мл.
Обычно липосомная композиция настоящего изобретения содержит от приблизительно 1 до приблизительно 50 мкг оксалиплатина/мг липида и от приблизительно 1 до приблизительно 150 мкг TF/мг липида. Например, от приблизительно 10 до приблизительно 50 мкг оксалиплатина/мг липида и от приблизительно 10 до приблизительно 150 мкг TF/мг липида.
В определенных воплощениях композиции содержат от приблизительно 1 до приблизительно 45 мкг оксалиплатина/мг липида, от приблизительно 1 до приблизительно 40 мкг оксалиплатина/мг липида, от приблизительно 1 до приблизительно 35 мкг оксалиплатина/мг липида, от приблизительно 1 до приблизительно 30 мкг оксалиплатина/мг липида, от приблизительно 1 до приблизительно 25 мкг оксалиплатина/мг липида, от приблизительно 1 до приблизительно 20 мкг оксалиплатина/мг липида, от приблизительно 1 до приблизительно 15 мкг оксалиплатина/мг липида, от приблизительно 1 до приблизительно 10 мкг оксалиплатина/мг липида, от приблизительно 1 до приблизительно 5 мкг оксалиплатина/мг липида, от приблизительно 5 до приблизительно 50 мкг оксалиплатина/мг липида, от приблизительно 5 до приблизительно 45 мкг оксалиплатина/мг липида, от приблизительно 5 до приблизительно 35 мкг оксалиплатина/мг липида, от приблизительно 5 до приблизительно 25 мкг оксалиплатина/мг липида, от приблизительно 5 до приблизительно 20 мкг оксалиплатина/мг липида, от приблизительно 5 до приблизительно 15 мкг оксалиплатина/мг липида, от приблизительно 5 до приблизительно 10 мкг оксалиплатина/мг липида, приблизительно 1 мкг оксалиплатина/мг липида, приблизительно 2 мкг оксалиплатина/мг липида, приблизительно 4 мкг оксалиплатина/мг липида, приблизительно 5 мкг оксалиплатина/мг липида, приблизительно 10 мкг оксалиплатина/мг липида, приблизительно 15 мкг оксалиплатина/мг липида, приблизительно 20 мкг оксалиплатина/мг липида, приблизительно 30 мкг оксалиплатина/мг липида, приблизительно 40 мкг оксалиплатина/мг липида или приблизительно 50 мкг оксалиплатина/мг липида.
В определенных воплощениях композиции содержат от приблизительно 1 до приблизительно 145 мкг TF/мг липида, от приблизительно 1 до приблизительно 120 мкг TF/мг липида, от приблизительно 1 до приблизительно 115 мкг TF/мг липида, от приблизительно 1 до приблизительно 100 мкг TF/мг липида, от приблизительно 1 до приблизительно 90 мкг TF/мг липида, от приблизительно 1 до приблизительно 70 мкг TF/мг липида, от приблизительно 1 до приблизительно 60 мкг TF/мг липида, от приблизительно 1 до приблизительно 50 мкг TF/мг липида, от приблизительно 1 до приблизительно 25 мкг TF/мг липида, от приблизительно 10 до приблизительно 150 мкг TF/мг липида, от приблизительно 10 до приблизительно 140 мкг TF/мг липида, от приблизительно 10 до приблизительно 125 мкг TF/мг липида, от приблизительно 10 до приблизительно 100 мкг TF/мг липида, от приблизительно 10 до приблизительно 80 мкг TF/мг липида, от приблизительно 10 до приблизительно 50 мкг TF/мг липида, от приблизительно 10 до приблизительно 25 мкг TF/мг липида, приблизительно 1 мкг TF/мг липида, приблизительно 5 мкг TF/мг липида, приблизительно 10 мкг TF/мг липида, приблизительно 25 мкг TF/мг липида, приблизительно 40 мкг TF/мг липида, приблизительно 50 мкг TF/мг липида, приблизительно 70 мкг TF/мг липида, приблизительно 100 мкг TF/мг липида, приблизительно 120 мкг TF/мг липида, приблизительно 140 мкг TF/мг липида или приблизительно 150 мкг TF/мг липида.
В некоторых воплощениях от приблизительно 0,5 до приблизительно 50 мкг оксалиплатина/мг липида и от приблизительно 1 до приблизительно 150 мкг TF/мг липида. В некоторых воплощениях от приблизительно 5 до приблизительно 50 мкг оксалиплатина/мг липида и от приблизительно 10 до приблизительно 100 мкг/мг. В определенных воплощениях от приблизительно 2 до приблизительно 50 мкг оксалиплатина/мг липида и от приблизительно 5 до приблизительно 150 мкг TF/мг липида; от приблизительно 3 до приблизительно 50 мкг оксалиплатина/мг липида и от приблизительно 5 до приблизительно 150 мкг TF/мг липида; от приблизительно 4 до приблизительно 50 мкг оксалиплатина/мг липида и от приблизительно 5 до приблизительно 150 мкг TF/мг липида; от приблизительно 2 до приблизительно 40 мкг оксалиплатина/мг липида и от приблизительно 5 до приблизительно 150 мкг TF/мг липида; от приблизительно 3 до приблизительно 40 мкг оксалиплатина/мг липида и от приблизительно 5 до приблизительно 150 мкг TF/мг липида; от приблизительно 4 до приблизительно 40 мкг оксалиплатина/мг липида и от приблизительно 5 до приблизительно 150 мкг TF/мг липида; от приблизительно 2 до приблизительно 50 мкг оксалиплатина/мг липида и от приблизительно 10 до приблизительно 150 мкг TF/мг липида; от приблизительно 3 до приблизительно 50 мкг оксалиплатина/мг липида и от приблизительно 10 до приблизительно 150 мкг TF/мг липида; от приблизительно 4 до приблизительно 50 мкг оксалиплатина/мг липида и от приблизительно 10 до приблизительно 150 мкг TF/мг липида; от приблизительно 5 до приблизительно 50 мкг оксалиплатина/мг липида и от приблизительно 5 до приблизительно 100 мкг TF/мг липида; от приблизительно 5 до приблизительно 50 мкг оксалиплатина/мг липида и от приблизительно 5 до приблизительно 100 мкг TF/мг липида; или от приблизительно 0,5 до приблизительно 50 мкг оксалиплатина/мг липида и от приблизительно 5 до приблизительно 100 мкг TF/мг липида.
В определенных воплощениях концентрация оксалиплатина в липосомном составе равна 0,8 ± 10% мг/мл.
В определенных воплощениях, когда лекарственное вещество представляет собой оксалиплатин, оксалиплатин может быть растворен в растворе (например, в водном растворе). В некоторых воплощениях раствор включает сахар (например, трегалозу, мальтозу, сахарозу, лактозу, маннозу, маннит, глицерин, декстрозу, фруктозу и т.д.). Концентрация сахара может составлять несколько процентов. Например, концентрации сахара (об./об.) приблизительно 0,1-12%; 0,5-12%, 1%-12%, 2%-8%, 2%-6%, 2%-5%, 2%-4%, 2%-5%, 2%-6%, 2%-8%, 2%-9%, 2%-10%, 4%-10%, 4%-9%, 4%-8%, 4%-6%, 3%-4%, приблизительно 2%, приблизительно 3%, приблизительно 4%, приблизительно 5%, приблизительно 6%, приблизительно 7%, приблизительно 8%, приблизительно 9% или приблизительно 10%. В определенных воплощениях раствор включает сахар и является водным. Подразумевается, что раствор, в котором растворен оксалиплатин, может также содержать дополнительные компоненты, включая известные специалистам в данной области техники.
В определенных воплощениях концентрация сахара составляет приблизительно 5%, приблизительно 7%, приблизительно 8%, приблизительно 9% или приблизительно 10%. В других воплощениях концентрация сахара составляет от приблизительно 5% до приблизительно 10%. В некоторых воплощениях сахар представляет собой декстрозу и концентрация декстрозы в растворе оксалиплатина составляет приблизительно 5%. В некоторых воплощениях сахар представляет собой декстрозу, и концентрация декстрозы в растворе оксалиплатина составляет приблизительно 9%. В определенных воплощениях сахар представляет собой сахарозу и концентрация сахарозы в растворе оксалиплатина составляет приблизительно 9%. В определенных воплощениях сахар представляет собой сахарозу и концентрация сахарозы в растворе оксалиплатина составляет приблизительно 10%.
В некоторых воплощениях концентрация сахара в растворе может составлять, например, от приблизительно 50 мг/мл до приблизительно 150 мг/мл, от приблизительно 50 мг/мл до приблизительно 130 мг/мл, от приблизительно 50 мг/мл до приблизительно 120 мг/мл, от приблизительно 50 мг/мл до приблизительно 100 мг/мл, от приблизительно 80 мг/мл до приблизительно 100 мг/мл, от приблизительно 90 мг/мл до приблизительно 150 мг/мл, от приблизительно 90 мг/мл до приблизительно 130 мг/мл, приблизительно 60 мг/мл, приблизительно 80 мг/мл, приблизительно 90 мг/мл, приблизительно 100 мг/мл, приблизительно 110 мг/мл, приблизительно 105 мг/мл, приблизительно 120 мг/мл или приблизительно 140 мг/мл.
Раствор может также содержать другие ингредиенты, известные специалистам в данной области техники, такие как, но не ограничиваясь этим, соли, буферы, сахароспирты и т.д. В определенных воплощениях раствор, в котором растворен оксалиплатин, содержит фосфат натрия (например, одноосновный и/или двухосновный фосфат натрия).
В определенных воплощениях концентрация фосфата натрия может быть от приблизительно 5 до приблизительно 15 мМ. Например, от приблизительно 5 до приблизительно 12 мМ, от приблизительно 5 до приблизительно 10 мМ, от приблизительно 5 до приблизительно 7 мМ, от приблизительно 7 до приблизительно 12 мМ, от приблизительно 7 до приблизительно 15 мМ, от приблизительно 9 до приблизительно 12 мМ, приблизительно 5 мМ, приблизительно 7 мМ, приблизительно 10 мМ, приблизительно 12 мМ или приблизительно 15 мМ.
В определенных воплощениях раствор сахара может дополнительно включать от приблизительно 1,0 до приблизительно 1,5 мг/мл фосфата натрия. Например, от приблизительно 1,2 до приблизительно 1,5 мг/мл, от приблизительно 1,0 до приблизительно 1,7 мг/мл, от приблизительно 1,0 до приблизительно 2 мг/мл, от приблизительно 1,0 до приблизительно 2,5 мг/мл, от приблизительно 1,0 до приблизительно 3 мг/мл, от приблизительно 0,5 до приблизительно 3,5 мг/мл фосфата натрия.
В некоторых воплощениях рН раствора должен быть от приблизительно 6,5 до приблизительно 7,5, от приблизительно 6,7 до приблизительно 7,5, от приблизительно 7 до приблизительно 7,5, приблизительно 7, приблизительно 7,5, приблизительно 6,8 или приблизительно 6,5.
В некоторых воплощениях лекарственное вещество представляет собой оксалиплатин и содержится в растворе приблизительно 9% сахарозы. В некоторых воплощениях лекарственное вещество представляет собой оксалиплатин и содержится в растворе приблизительно 9% сахарозы с концентрацией оксалиплатина приблизительно 1 мг/мл. В некоторых воплощениях лекарственное вещество представляет собой оксалиплатин и содержится в растворе сахарозы приблизительно 105 мг/мл. В некоторых воплощениях лекарственное вещество представляет собой оксалиплатин и содержится в растворе сахарозы приблизительно 105 мг/мл с концентрацией оксалиплатина в растворе липосомы приблизительно 1 мг/мл. В определенных воплощениях раствор дополнительно включает фосфат натрия. В определенных воплощениях оксалиплатин находится в концентрации приблизительно 0,8 ± 10% мг/мл раствора липосомы.
Меченые соединения
Разнообразные меченые соединения могут быть также включены в содержащие липиды композиции настоящего изобретения. Обычно меченое соединение может представлять собой агент пригодный для осуществления диагностических процедур in vivo.
Как и в случае включения и применения лекарственных веществ, как здесь описано, количество меченого соединения, предназначенного для включения в содержащие липиды композиции и их составы, как здесь описано, может быть легко определено специалистом в данной области техники с точки зрения представленных здесь указаний и в зависимости от выбранного меченого соединения и планируемого применения композиции или состава, принимая во внимание факторы, специфичные как для меченого соединения, так и для индивидуума, подвергаемого диагностике, как здесь описано далее.
Примеры меченых соединений включают, например, материалы, включающие радиоизотопы (например, 3H, 14C, 67Ga, 111In, 125I, 131I, 133Xe и т.д.), материал, включающий флуоресцентные части (например, флуоресцеин, флуоресцеинизотиоцианат и т.д.), материал, включающий фермент (например, пероксидазу, щелочную фосфатазу и т.д.), а также дополнительные меченые соединения, известные специалистам в данной области техники.
Как должно быть понятно специалисту в данной области техники, выбор меченого соединения и применяемых способов диагностики должен зависеть от подвергаемых исследованию органа (например, печень, поджелудочная железа, простата и т.д.), ткани (например, опухолевой или неопухолевой или типа ткани (например, молочной железы и т.д.)). Например, содержащие липиды композиции (например, липосомы направленного действия, содержащие липосомы композиции и т.д.), включающие 125I, особенно пригодны для идентификации присутствия и определения тяжести (например, первоначальной, в процессе курса лечения, после лечения) различных типов рака (например, рака молочной железы, рака желудка, колоректального рака, рака ободочной кишки и т.д.) с помощью гамма-счетчика.
Направляющие факторы
Если не указано иначе, термины «направляющий фактор» и «направляющий лиганд» могут здесь применяться взаимозаменяемо.
Описанные здесь содержащие липиды композиции характеризуются включением производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированного направляющим фактором (т.е. TF-NωPE), направленного на конкретные клетки-мишени. Термин «направляющий фактор» относится к части, которая может связываться с рецептором или поверхностным антигеном, присутствующими на поверхности клетки-мишени. В определенных воплощениях направляющие факторы направлены на рецепторы клеточной поверхности на конкретной клетке-мишени. Направляющий фактор часто представляет собой белок или пептид, который может быть присоединен к липидному компоненту содержащей липиды композиции.
Наиболее эффективно направляющие факторы выбирают так, чтобы рецептор или антиген, на которые направлен фактор, присутствовали только на тех клетках, которые являются мишенью для доставки лекарственного вещества или меченого соединения (например, патологические клетки) и не присутствовал на здоровых клетках. Альтернативно, более высокое количество рецепторов или антигенов экспрессируется на клетках-мишенях (например, патологических или больных клетках) по сравнению с клетками-немишенями (например, здоровыми). Предпочтительно, чтобы рецептор или антиген, который связывает направляющий фактор, или не присутствовал, или присутствовал в низком количестве на здоровых клетках так, чтобы связывание с направляющим фактором возникало не часто. Другими словами направляющие факторы необходимы для избирательной доставки липосом, как здесь описано (включая инкапсулированное лекарственное вещество), к клеткам-мишеням (например, патологическим, нездоровым и т.д.). Избирательная доставка инкапсулированного лекарственного вещества к клеткам-мишеням, таким образом, снижает возможность возникновения побочных эффектов из-за действия инкапсулированного лекарственного вещества или меченого соединения на клетки-немишени (например, здоровые), тем самым также снижая побочные эффекты, известные индивидууму, которому вводят композицию или ее состав.
Примеры направляющих факторов включают, но не ограничиваются этим, трансферрин, фолиевую кислоту, фолат, гиалуроновую кислоту, цепи сахаров (например, галактозу, маннозу и т.д.), фрагменты моноклональных антител, асиалоглюкопротеин и т.д., а также другие направляющие факторы, известные специалистам в данной области техники.
В конкретных воплощениях направляющий фактор представляет собой белок или пептид, направленный на рецептор клеточной поверхности (например, трансферрин, фолат, фолиевая кислота, асиалоглюкопротеин и т.д.).
В других воплощениях направляющий фактор направлен на антиген (например, фрагменты моноклональных антител (например, Fab, Fab', F(ab')2, Fc и т.д.)). Не подразумевается, что направляющие факторы включают интактное или целое моноклональное антитело. Применяемый здесь термин «целое антитело» или «интактное антитело» и родственные им соединения обычно относится к антителу IgG или иммунному глобулину. Фрагмент моноклонального антитела обычно относится к продукту расщепления моноклонального антитела, например фрагменту, полученному с помощью ращепления протеазой, такой как пепсин и т.д.
В определенных воплощениях направляющий фактор не направлен на антиген (например, не является фрагментом моноклонального антитела, например, Fab, Fab', F(ab')2, Fc и т.д.)).
В определенных воплощениях направляющий фактор представляет собой трансферрин.
Трансферрин (Tf) представляет собой связывающий железо белок с молекулярной массой 80000, который синтезируется в гепатоцитах и находится в крови. Трансферрин снабжает клетки железом (Fe) через рецепторы Tf на поверхности каждой клетки. Рецептор трансферрина обычно экспрессируется в опухолевых тканях в более высоком количестве по сравнению с нормальными тканями, независимо от типов опухолей. Мембраны опухолевых клеток, как известно, гиперэкспрессируют рецепторы трансферрина для поддержания клеточной пролиферации. Смотри, Shindelman JE, Ortmeyer AE, Sussman HH. «Demonstration of the transferrin receptor in human breast cancer tissue. Potential marker for identifying dividing cells.» Int J Cancer. (1981) 27(3):329-34; Lloyd JM, O'Dowd T, Driver M, Tee DE. «Demonstration of an epitope of the transferrin receptor in human cervical epithelium- a potentially useful cell marker.» J Clin Pathol. (1984) 37(2):131-5; и Habeshaw JA, Lister TA, Stansfeld AG, Greaves MF. «Correlation of transferrin receptor expression with histological class and outcome in non-Hodgkin lymphoma.» Lancet. (1983) 1(8323): 498-501. Связывание терапевтических агентов с трансферрином должно, следовательно, увеличить захват лекарственного вещества в опухолевые клетки через рецептор трансферрина. Не будучи связанными механизмом действия, вероятный путь захвата липосом с трансферрином, как здесь описано, представлен схематически на фиг. 2 и 3. Трансферрин коммерчески доступен или может быть получен рекомбинантным способом, как описано, например, в патенте США 5026651, включенном здесь полностью в качестве ссылки.
Не будучи связанными с теорией, считается, что конъюгация трансферрина (Tf) с NωPE осуществляется с помощью реакции первичного амина с NωPE, что введет к образованию амидной связи карбоновой кислоты между заякоренным липидом и белком.
В определенных воплощениях молярное отношение Tf к суммарному липиду, присутствующему в липосомном продукте направленного действия, составляет приблизительно 0,00014:1 моль/моль (Tf:суммарный липид) (0,015 масс./масс.). В других воплощениях молярное отношение Tf:суммарный липид, присутствующий в липосомном продукте направленного действия, составляет от приблизительно 0,016 до приблизительно 0,029:от приблизительно 126 до приблизительно 158 мМ/мМ.
Содержащие липиды композиции
Описанные здесь содержащие липиды композиции включают липосомы направленного действия, включающие производные липиды, дополнительные липиды и инкапсулированное лекарственное вещество или меченое соединение, а также промежуточные соединения, применяемые для получения липосом направленного действия, включая липосомные смеси и содержащие липосомы композиции, как здесь описано, где содержащие липиды композиции (включая липосомы направленного действия) свободны от немодифицированного фосфатидилэтаноламина и гидрофильных полимеров, таких как, но не ограничиваясь этим, полиэтиленгликоль. Содержащие липиды композиции также включают липосомы, которые включают Tf, но не включают лекарственное вещество или меченое соединение (например, ненагруженные липосомы).
Применяемый здесь термин «гидрофильный полимер» и родственные ему соединения относится к полимерам, таким как полиэтиленгликоль (ПЭГ) и другие полиэтоксилированные полимеры, которые применяются в области липосом для защиты липосом в попытке увеличить период полужизни липосомы в циркуляторном русле. Подразумевается, что этот термин охватывает свободные гидрофильные полимеры, нековалентно связанные с липосомами, а также гидрофильные полимеры, которые каким-то способом конъюгированы или ковалентно связаны с конкретным компонентом липосомы (например, модифицированными ПЭГ липидами и т.д.). Такие гидрофильные полимеры альтернативно обозначаются в этой области как «водорастворимые» полимеры. Дополнительные примеры гидрофильных полимеров включают, но не ограничиваются этим, поливиниловый спирт, полимолочную кислоту, полигликолевую кислоту, поливинилпирролидон, полиакриламид, полиглицерин, полиаксозолины и т.д.
Применяемый здесь термин «липидная смесь» и родственные ему относится к смесям липидных компонентов, как здесь описано, где липидная смесь не включает раствор, например, водный раствор (например, воду, буфер или смесь воды и смешиваемого с водой растворителя (например, сахара (например, трегалозы, сахарозы, лактозы, маннозы, декстрозы, фруктозы и т.д.), сахароспирта (например, сорбита, мальтита, лактита, глицерина, маннита и т.д.), спирта (например, этанола, трет-бутанола и т.д.) и т.д.) или органического растворителя.
Термин «содержащая липосомы композиция» и родственные ему относится к смесям липидов и, необязательно, лекарственному(ам) веществу(ам) или меченому(ным) соединению(ям), в которых водный раствор (например, вода, буфер (например, ацетатный буфер, фосфатный буфер, цитратный буфер, боратный буфер, тартратный буфер и т.д.) или смесь воды и смешиваемого с водой растворителя) включены с помощью смешивания (например, одного или более перемешивания, встряхивания и т.д.). Водный раствор может также включать дополнительные компоненты, такие как один или более сахаров (например, трегалозу, мальтозу, сахарозу, лактозу, маннозу, декстрозу, фруктозу и т.д.), сахароспирт (например, сорбит, мальтит, лактит, манит, глицерин и т.д.), спирт (например, этанол, трет-бутанол и т.д.) и т.д. И водный раствор может также включать органический растворитель ((например, сложные эфиры (например, этилацетат, бутилацетат и т.д.), алифатические углеводороды (например, гексан, гептан и т.д.), ароматические углеводороды (например, толуол, ксилол и т.д.), галогенизированные углеводороды (например, хлороформ, дихлорметан, дихлорэтан и т.д.), простые эфиры (например, ТГФ, диоксан, диэтиловый эфир, изопропиловый эфир и т.д.), циклические углеводороды (например, циклогексан и т.д.), ДМФ, ДМСО и т.д.) или их смеси. Содержащая липосомы композиция должна обычно включать не гомогенную смесь липидов, водного раствора и липосом, имеющих широкое распределение вокруг 100-10000 нм и средний диаметр 500-2000 нм. Характеристика примеров содержащих липосомы композиций дополнительно представлена в примерах.
В определенных воплощениях содержащие липиды композиции не включают гидрофильные полимеры. В конкретных воплощениях содержащие липиды композиции не включают ПЭГ.
В некоторых воплощениях промежуточные липидные смеси включают, по меньшей мере, два различных нейтральных липида или один или более фосфолипидов и производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, где липидные компоненты описаны здесь более подробно и где смесь свободна от немодифицированного фосфатидилэтаноламина и гидрофильных полимеров, таких как полиэтиленгликоль. Необязательно водный раствор, как здесь описано, может быть смешан с липидными компонентами с образованием содержащей липосомы композиции. В определенных воплощениях липидная смесь не включает лекарственное вещество или меченое соединение. В конкретных воплощениях липидная смесь может быть обработана с образованием содержащей липосомы композиции или липосомного состава.
В некоторых воплощениях промежуточные липидные смеси включают, по меньшей мере, два различных нейтральных липида или один или более фосфолипидов, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и лекарственное вещество или меченое соединение, где липидные компоненты и лекарственное вещество/меченое соединение описаны здесь более подробно и где смесь свободна от немодифицированного фосфатидилэтаноламина и гидрофильных полимеров, таких как полиэтиленгликоль. Необязательно, водный раствор, как здесь описано, может быть смешан с липидными компонентами с образованием содержащей липосомы композиции, например, когда добавляют лекарственное вещество или меченое соединение в виде водного раствора лекарственного вещества/меченого соединения. В определенных воплощениях содержащая липосомы композиция может быть обработана (например, с помощью одного или более методов - экструзии, исключающей по размеру хроматографии и т.д. или методов, известных в данной области техники) с образованием липосомы.
В некоторых воплощениях липидные смеси включают один или более фосфолипидов или, по меньшей мере, два различных нейтральных липида, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, где липидные компоненты описаны здесь более подробно и где смесь свободна от немодифицированного фосфатидилэтаноламина и гидрофильных полимеров, таких как полиэтиленгликоль. Смеси могут быть также по существу свободны от не-NHS исходного вещества, побочного продукта и/или продукта расщепления, связанного с синтезом сукцинимидного эфира производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина (например, карбодиимидов (например, DCC, EDC и т.д.), ацилированных соединений мочевины и т.д.). Необязательно, водный раствор, как здесь описано, может быть смешан с липидными компонентами с образованием содержащей липосомы композиции.
В некоторых воплощениях промежуточные липидные смеси включают один или более фосфолипидов или, по меньшей мере, два различных нейтральных липида, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, где липидные компоненты описаны здесь более подробно и где смесь свободна от немодифицированного фосфатидилэтаноламина и гидрофильных полимеров, таких как полиэтиленгликоль. Смеси могут быть также по существу свободны от не-NHS исходного вещества, побочного продукта и/или продукта расщепления, связанного с синтезом сукцинимидного эфира производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина (например, карбодиимидов (например, DCC, EDC и т.д.), ацилированных соединений мочевины и т.д.). Необязательно, водный раствор, как здесь описано, может быть смешан с липидными компонентами с образованием содержащей липосомы композиции. В некоторых воплощениях липидная смесь не включает лекарственное вещество или меченое соединение. Липидная смесь может быть обработана с образованием содержащей липиды композиции или липосомного состава.
В некоторых воплощениях промежуточные липидные смеси включают один или более фосфолипидов или, по меньшей мере, два различных нейтральных липида, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и лекарственное вещество или меченое соединение, где липидные компоненты и лекарственное вещество/меченое соединение описаны здесь более подробно и где композиция свободна от немодифицированного фосфатидилэтаноламина и гидрофильных полимеров, таких как полиэтиленгликоль. Смеси могут быть также по существу свободны от не-NHS исходного вещества, побочного продукта и/или продукта расщепления, связанного с синтезом сукцинимидного эфира производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина (например, карбодиимидов (например, DCC, EDC и т.д.), ацилированных соединений мочевины и т.д.). Необязательно, водный раствор, как здесь описано, может быть смешан с липидными компонентами с образованием содержащей липосомы композиции.
В определенных воплощениях промежуточные содержащие липиды композиции включают липосому, содержащую один или более фосфолипидов или, по меньшей мере, два различных нейтральных липида, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и инкапсулированное лекарственное вещество, где липидные и лекарственные компоненты описаны здесь более подробно и где липосома свободна от немодифицированного фосфатидилэтаноламина и гидрофильных полимеров, таких как полиэтиленгликоль. Липосомы могут быть также по существу свободны от не-NHS исходного вещества, побочного продукта и/или продукта расщепления, связанного с синтезом сукцинимидного эфира производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина (например, карбодиимидов (например, DCC, EDC и т.д.), ацилированных соединений мочевины и т.д.). В некоторых воплощениях липидная смесь не включает лекарственное вещество или меченое соединение. Липидная смесь может быть обработана с образованием содержащей липиды композиции или липосомного состава.
В определенных воплощениях липидные смеси включают один или более фосфолипидов или, по меньшей мере, два различных нейтральных липида, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и инкапсулированное лекарственное вещество или меченое соединение, где липидные компоненты, направляющий фактор и лекарственное вещество или меченое соединение описаны здесь более подробно и где липосома свободна от немодифицированного фосфатидилэтаноламина и гидрофильных полимеров, таких как полиэтиленгликоль. В некоторых воплощениях липидных смесей, липосомы по существу свободны от не-NHS исходного вещества, побочного продукта и/или продуктов расщепления, связанных с синтезом сукцинимидного эфира производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина (например, карбодиимидов (например, DCC, EDC и т.д.), ацилированных соединений мочевины и т.д.). В конкретных воплощениях липидная смесь представляет собой содержащую липосомы композицию (например, где лекарственное вещество или меченое соединение добавляют в виде водного раствора). Необязательно, водный раствор, как здесь описано, может быть смешан с липидными компонентами с образованием содержащей липосомы композиции.
В определенных воплощениях липосомы направленного действия включают липосомы, содержащие один или более фосфолипидов или, по меньшей мере, два различных нейтральных липида, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и инкапсулированное лекарственное вещество или меченое соединение, где липидные компоненты, направляющий фактор и лекарственное вещество/меченое соединение описаны здесь более подробно и где липосома свободна от немодифицированного фосфатидилэтаноламина и гидрофильных полимеров, таких как полиэтиленгликоль. В некоторых воплощениях липосом направленного действия, липосомы по существу свободны от не-NHS исходного вещества, побочного продукта или продуктов расщепления, связанных с синтезом сукцинимидного эфира производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина (например, карбодиимидов (например, DCC, EDC и т.д.), ацилированных соединений мочевины и т.д.). Однако в некоторых воплощениях сукцинимидный эфир производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина может присутствовать на первоначальных этапах получения липосом направленного действия (например, NHS-NG-PEs (например, NHS-NG-DOPE, NHS-NG-DSPE т.д.), например, перед гидролизом сукцинимидного эфира, который может давать, например, NHS и NG-DOPE в конечном составе. В определенных воплощениях, когда SuccNωPE не включен внутрь липосомы, липосома или содержащая липосомы композиция может также быть свободна или по существу свободна от NHS, как в случае предварительного образования TF-NωPE и использования в качестве исходного вещества. В конкретных воплощениях липосомы направленного действия по существу свободны от DCC и EDC. В определенных воплощениях липосомы направленного действия по существу свободны от DCC.
Дополнительно каждая из содержащих липосомы композиций, как здесь описано, может быть обработана для получения липосом. Получение липосом хорошо известно в данной области техники, кроме того, может быть осуществлено в соответствии с описанными здесь способами, например, как описано для способов получения A и B, описанных более подробно ниже. Способы получения липосом из содержащих липосомы композиций включают, но не ограничиваются этим, экструзию, обработку ультразвуком, пузырьки с обратной фазой, процедуру замораживания-оттаивания, исключающую по размеру хроматографию, ультрафильтрацию и т.д. и их сочетания. Липосомы, образованные из описанных здесь содержащих липосомы композиций, могут включать лекарственное вещество или меченое соединение или могут быть свободны от лекарственного вещества или меченого соединения (например, для липосом, также обозначаемых здесь как «ненагруженные липосомы»). В конкретных воплощениях содержащие липосомы композиции, липосомы (включая ненагруженные липосомы) и липосомы направленного действия могут быть составлены в виде фармацевтических составов и дополнительно могут быть использованы в описанных здесь способах лечения и диагностики и/или наборах.
Термин «по существу свободные» относится к уровням и продуктам, которые не определимы или определимы в минимальной степени традиционными аналитическими методами, применяемыми в данной области техники. Например, ВЭЖХ (смотри, например, European Pharmacopoeia 5th Ed.), ТСХ, газовой хроматографией и т.д., а также другими аналитическими методами, известными специалисту в данной области техники.
Например, содержащие липиды композиции могут содержать менее приблизительно 0,1%, менее приблизительно 0,5%, менее приблизительно 1%, менее приблизительно 2%, менее приблизительно 3%, менее приблизительно 4%, менее приблизительно 5% или менее приблизительно 6% по массе конкретного исходного вещества, побочного продукта или продукта расщепления, связанного с синтезом сукцинимидного эфира производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, к суммарному липидному компоненту. В конкретных воплощениях композиции должны содержать менее приблизительно 10%, менее приблизительно 7%, менее приблизительно 5%, менее приблизительно 3%, менее приблизительно 2% или менее приблизительно 1% суммарных загрязнений (например, % суммы исходного вещества, побочного продукта и продукта расщепления, связанного с синтезом сукцинимидного эфира производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина).
В некоторых воплощениях липосомы направленного действия включают липосомы, содержащие фосфатидилхолин (например, нейтральный, анионный или катионный), холестерин или производное холестерина, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и инкапсулированное лекарственное вещество или меченое соединение, где липидные компоненты, направляющий фактор и лекарственное вещество описаны здесь более подробно и где липосома свободна от немодифицированного фосфатидилэтаноламина и гидрофильных полимеров, таких как полиэтиленгликоль. В конкретных воплощениях фосфатидилхолин представляет собой нейтральный фосфатидилхолин.
В конкретных воплощениях липосомы направленного действия включают липосомы, содержащие фосфатидилхолин (например, нейтральный, анионный или катионный), холестерин или производное холестерина, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированное трансферрином производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и инкапсулированное лекарственное вещество или меченое соединение, где липидные компоненты и лекарственное вещество или меченое соединение описаны здесь более подробно и где липосома свободна от немодифицированного фосфатидилэтаноламина и гидрофильных полимеров, таких как полиэтиленгликоль. В конкретных воплощениях фосфатидилхолин представляет собой нейтральный фосфатидилхолин.
В конкретных воплощениях липосомы направленного действия включают липосомы, содержащие фосфатидилхолин (например, нейтральный, анионный или катионный), холестерин или производное холестерина, производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированное трансферрином производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и инкапсулированный оксалиплатин, где липидные компоненты описаны здесь более подробно и где липосома свободна от немодифицированного фосфатидилэтаноламина и гидрофильных полимеров, таких как полиэтиленгликоль. В конкретных воплощениях фосфатидилхолин представляет собой нейтральный фосфатидилхолин.
В определенных воплощениях описанные здесь содержащие липиды композиции (включая липосомы направленного действия и ненагруженные липосомы) и их составы могут дополнительно содержать липиды, полученные с помощью модификации дикарбоновой кислоты, фосфатидилглицерина, сфингозина, церамида, производного холестерина или тому подобного. Эти производные дикарбоновой кислоты могут быть получены, как здесь описано для производных N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов и в соответствии со способами получения, известными специалисту в данной области техники.
В некоторых воплощениях описанные здесь содержащие липиды композиции (включая липосомы направленного действия и ненагруженные липосомы) и их составы не включают анионные липиды (например, фосфатидилсерины, фосфатидилинситосолы, фосфатидилглицерины и т.д.) или катионные липиды (например, сфингозин, DOTAP, DOTMA, DC-CHOL и т.д.). В конкретных воплощениях композиции свободны от анионных липидов. В других воплощениях композиции свободны от катионных липидов. В определенных воплощениях композиции свободны от катионных и анионных липидов.
В некоторых воплощениях содержащих липиды композиций композиция содержит лекарственное вещество. В других воплощениях содержащие липиды композиции включают меченое соединение.
В определенных воплощениях содержащих липиды композиций лекарственное вещество представляет собой оксалиплатин, направляющий фактор (TF) представляет собой трансферрин (Tf) и липидные компоненты включают: DMPC или DSPC и холестерин или производное холестерина, и производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и модифицированное трансферрином производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, где модифицированное трансферрином производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина включает трансферрин, присоединенный к производному N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина с помощью амидной связи карбоновой кислоты.
В некоторых воплощениях производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представляют собой NG-DOPE или NG-DSPE.
В конкретных воплощениях липидные компоненты содержащих липиды композиций представляют собой DMPC, холестерин, NG-DOPE и модифицированный TF NG-DOPE. В других воплощениях липидные компоненты представляют собой DSPC, холестерин, NG-DOPE и модифицированный TF NG-DOPE. В еще одних воплощениях липидные компоненты представляют собой DMPC, холестерин, NG-DSPE и модифицированный TF NG-DSPE. В определенных других воплощениях липидные компоненты представляют собой DSPC, холестерин, NG-DSPE и модифицированный TF NG-DSPE. В определенных из этих воплощений направляющий фактор (TF) представляет собой трансферрин и лекарственное вещество представляет собой оксалиплатин.
В конкретных воплощениях липидные компоненты представляют собой DPPC, холестерин, NG-DOPE и модифицированный TF NG-DOPE. В других воплощениях липидные компоненты представляют собой POPC, холестерин, NG-DOPE и модифицированный TF NG-DOPE. В еще одних воплощениях липидные компоненты представляют собой DPPC, холестерин, NG-DSPE и модифицированный TF NG-DSPE. В определенных других воплощениях липидные компоненты представляют собой POPC, холестерин, NG-DSPE и модифицированный TF NG-DSPE. В определенных из этих воплощений направляющий фактор (TF) представляет собой трансферрин и лекарственное вещество представляет собой оксалиплатин.
В конкретных воплощениях липидные компоненты представляют собой HSPC, холестерин, NG-DOPE и модифицированный TF NG-DOPE. В других воплощениях липидные компоненты представляют собой EPC, холестерин, NG-DOPE и модифицированный TF NG-DOPE. В еще одних воплощениях липидные компоненты представляют собой HSPC, холестерин, NG-DSPE и модифицированный TF NG-DSPE. В определенных других воплощениях липидные компоненты представляют собой EPC, холестерин, NG-DSPE и модифицированный TF NG-DSPE. В определенных из этих воплощений направляющий фактор (TF) представляет собой трансферрин и лекарственное вещество представляет собой оксалиплатин.
Соотношения липидных компонентов
Обычно, молярный процент исходных веществ NG-DOPE должен составлять от приблизительно 2,5 моль% до приблизительно 4,5 моль% по сравнению с суммарным содержанием липидов. Дополнительно, молярный процент исходных веществ NHS-NG-DOPE должен составлять от приблизительно 0,5 моль% до приблизительно 2,5 моль% по сравнению с суммарным содержанием липидов. В некоторых воплощениях относительное молярное отношение NG-DOPE к NHS-NG-DOPE должно составлять приблизительно 3,4:1. В определенных воплощениях относительное отношение моль% NG-DOPE к NHS-NG-DOPE может составлять приблизительно 4:1. В конкретных воплощениях, когда присутствуют нейтральный фосфолипид и нейтральный липид, молярное отношение (например, DMPC:Chol:NG-DOPE:NHS-NG-DOPE) может составлять 43,0:38,5:3,42:1, что также может быть выражено как 50:45:4:1 в моль%.
В определенных воплощениях отношение дополнительного(ных) липида(ов) в моль% к NωPE, к SuccNωPE (например, по меньшей мере, два нейтральных липида:NωPE:SuccNωPE или один или более фосфолипидов:NωPE:SuccNωPE, или (один или более фосфолипидов + нейтральный(ные) липид(ы):NωPE:SuccNωPE) может составлять от приблизительно 98 моль% до приблизительно 87 моль% дополнительных липидов:от приблизительно 1 моль% до приблизительно 12 моль% NωPE:от приблизительно 0,5 моль% до приблизительно 1% SuccNωPE; где суммарный моль% всех компонентов составляет 100 моль%. Например, дополнительные липиды:NωPE:SuccNωPE могут составлять приблизительно 95:4:1, 90:9:1, 92:7:1, 93:6:1 и т.д.
В конкретных воплощениях, когда дополнительные липиды включают фосфолипид и другой липид, такой как холестерин, производные холестерина и т.д., диапазон моль% для каждого липидного компонента составляет от приблизительно 30 моль% до приблизительно 64%, где сумма дополнительных липидов составляет от приблизительно 98 моль% до приблизительно 87 моль%.
В определенных воплощениях, когда дополнительные липиды представляют собой два различных нейтральных липида, диапазон моль% для каждого нейтрального липида составляет от приблизительно 30 моль% до приблизительно 64%, где сумма нейтральных липидов составляет от приблизительно 98 моль% до приблизительно 87 моль%.
В примере воплощения, где один дополнительный липид представляет собой фосфатидилхолин, а второй дополнительный липид представляет собой холестерин или производное холестерина, моль% фосфатидилхолина составляет от приблизительно 30 до приблизительно 70 моль% (например, от приблизительно 50 до приблизительно 64 моль%, от приблизительно 40 до приблизительно 65 моль%, от приблизительно 40 до приблизительно 60 моль%, от приблизительно 50 до приблизительно 62 моль%, от приблизительно 55 до приблизительно 60 моль%, от приблизительно 35 до приблизительно 55 моль%, приблизительно 30 моль%, приблизительно 40 моль%, приблизительно 45 моль%, приблизительно 50 моль%, приблизительно 55 моль%, приблизительно 60 моль%, приблизительно 65 моль%, приблизительно 70 моль%) и моль% холестерина или производного холестерина составляет от приблизительно 30 до приблизительно 60 моль% (например, от приблизительно 32 до приблизительно 45 моль%, от приблизительно 32 до приблизительно 40 моль%, от приблизительно 40 до приблизительно 60 моль%, от приблизительно 35 до приблизительно 55 моль%, от приблизительно 35 до приблизительно 60 моль%, от приблизительно 45 до приблизительно 60 моль%, от приблизительно 35 до приблизительно 45 моль%, приблизительно 30 моль%, приблизительно 35 моль%, приблизительно 40 моль%, приблизительно 45 моль%, приблизительно 50 моль%, приблизительно 55 моль% или приблизительно 60 моль%). В некоторых воплощениях фосфатидилхолин составляет приблизительно 50 моль%, приблизительно 52 моль%, приблизительно 55 моль%, приблизительно 58 моль%, приблизительно 60 моль%, приблизительно 62 моль%, и холестерин или производные холестерина составляют от приблизительно 30 моль%, приблизительно 32 моль%, приблизительно 34 моль%, приблизительно 35 моль%, приблизительно 37 моль%, приблизительно 38 моль%, приблизительно 40 моль%, приблизительно 42 моль%, приблизительно 43 моль%, приблизительно 45 моль%.
В конкретных воплощениях моль% NωPE составляет от приблизительно 1 до приблизительно 11 моль%, от приблизительно 1 до приблизительно 10 моль%, от приблизительно 1 до приблизительно 8 моль%, от приблизительно 1 до приблизительно 6 моль%, от приблизительно 1 до приблизительно 5 моль%, от приблизительно 1 до приблизительно 4 моль%, от приблизительно 1 до приблизительно 3 моль%, от приблизительно 1 до приблизительно 2 моль%, от приблизительно 2 до приблизительно 10 моль%, от приблизительно 2 до приблизительно 5 моль%, приблизительно 1 моль%, приблизительно 2 моль%, приблизительно 3 моль%, приблизительно 4 моль%, приблизительно 5 моль%, приблизительно 7 моль%, приблизительно 8 моль%, приблизительно 9 моль%, приблизительно 10 моль%, приблизительно 11 моль% или приблизительно 12 моль%.
В определенных воплощениях отношение первый дополнительный липид:второй дополнительный липид:NωPE:SuccNωPE составляет, например, 50:45:4:1. В некоторых воплощениях первый дополнительный липид представляет собой фосфатидилхолин (например, DMPC, DOPC, DPPC, DSPC и т.д.) и второй дополнительный липид представляет собой холестерин. В некоторых воплощениях PE в NωPE представляет собой DOPE или DSPE. В конкретных воплощениях NωPE представляет собой NG-DOPE или NG-DSPE. В некоторых воплощениях липиды представляют собой DMPC:Chol:NG-DOPE:NHS-NG-DOPE и отношение их моль% составляет 50:45:4:1. В других воплощениях липиды представляют собой DSPC:Chol:NG-DSPE:NHS-NG-DSPE и отношение их моль% составляет 50:45:4:1. В других воплощениях липиды представляют собой DSPC:Chol:NG-DSPE:NHS-NG-DSPE и отношение их моль% составляет 62:33:4:1.
В некоторых воплощениях суммарный моль% NωPE и TF-NωPE (NωPE+TF-NωPE) составляет от приблизительно 2 до приблизительно 13 моль% от суммарного содержания липидов. Например, от приблизительно 2 до приблизительно 12 моль%, от приблизительно 2 до приблизительно 10 моль%, от приблизительно 2 до приблизительно 8 моль%, от приблизительно 2 до приблизительно 6 моль%, от приблизительно 2 до приблизительно 4 моль%, приблизительно 2 моль%, приблизительно 3 моль%, приблизительно 4 моль%, приблизительно 5 моль%, приблизительно 6 моль%, приблизительно 7 моль%, приблизительно 8 моль%, приблизительно 9 моль%, приблизительно 10 моль%, приблизительно 11 моль% или приблизительно 12 моль%.
Обычно суммарный моль% TF-NωPE составляет от приблизительно 0,002 до приблизительно 0,2 моль% относительно суммы содержания липидов. Например, в некоторых воплощениях суммарный моль% TF-NωPE составляет от приблизительно 0,002 до приблизительно 0,15 моль%, суммарный моль% TF-NωPE составляет от приблизительно 0,002 до приблизительно 0,1 моль%, от приблизительно 0,002 до приблизительно 0,05 моль%, от приблизительно 0,01 до приблизительно 0,03 моль%, от приблизительно 0,005 до приблизительно 0,2 моль%, от приблизительно 0,007 до приблизительно 0,2 моль%, от приблизительно 0,007 до приблизительно 0,05 моль%, от приблизительно 0,01 до приблизительно 0,025 моль%, от приблизительно 0,015 до приблизительно 0,025 моль%, от приблизительно 0,01 до приблизительно 0,2 моль%, от приблизительно 0,02 до приблизительно 0,2 моль%, от приблизительно 0,04 до приблизительно 0,2 моль%, от приблизительно 0,06 до приблизительно 0,2 моль%, от приблизительно 0,08 до приблизительно 0,2 моль%, приблизительно 0,002 моль%, приблизительно 0,008 моль%, приблизительно 0,01 моль%, приблизительно 0,02 моль%, приблизительно 0,03 моль%, приблизительно 0,025 моль%, приблизительно 0,015 моль%, приблизительно 0,06 моль%, приблизительно 0,08 моль%, приблизительно 0,1 моль%, приблизительно 0,15 моль%, или приблизительно 0,2 моль%.
Характеристика липосом и содержащих липосомы композиций
Помимо описания содержащих липиды композиций по соотношению компонентов (например, соотношению липидов, отношению лекарственного вещества/меченого соединения к липидам и т.д.) описываемые здесь содержащие липосомы композиции могут быть также охарактеризованы (например, по их физико-химическим свойствам и т.д.) с помощью стандартных аналитических способов, что должно быть ясно опытному специалисту. Такие апробированные аналитические способы включают, но не ограничиваются этим, определение среднего диаметра, заключаемого объема, результирующего заряда (зета-потенциала), количества захваченного (т.е. заключенного) лекарственного вещества, размера частиц, стабильности при различных условиях (например, при хранении, в форме, подготовленной для введения in vitro), осмотических свойств, количества конъюгированного направляющего фактора и т.д. Иллюстративные аналитические способы для такой характеристики представлены ниже, а также в разделе «Примеры», и для описания композиций могут быть также применены дополнительные способы, известные опытному специалисту.
Как должно быть ясно опытному специалисту, содержание лекарственного вещества в липосомах может быть определено с помощью принятых способов анализа с применением ВЭЖХ, с использованием соответствующих контролей, как это обычно производится в данной области техники и дополнительно описано в разделе «Примеры». При применении подходящих контролей также может быть осуществлена идентификация инкапсулированного лекарственного вещества с помощью ВЭЖХ или, в случае определенных лекарственных веществ (например, лекарственных веществ, содержащих платину), с помощью аналитических способов, таких как ИСП-МС (индуктивно связанная плазменная масс-спектрометрия), применяемых специалистами в данной области техники.
В некоторых воплощениях количество лекарственного вещества (например, оксалиплатина и т.д.) или меченого соединения, заключенного в липосому или содержащую липосомы композицию, может составлять от приблизительно 0,1 мг/мл до приблизительно 15 мг/мл внутри липосомы. Например, концентрация лекарственного вещества может составлять от приблизительно 0,5 мг/мл до приблизительно 15 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 10 мг/мл, от приблизительно 0,1 мг/мл до приблизительно 10 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 5 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 3 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 2 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 1,5 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 3 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 2 мг/мл, от приблизительно 0,8 мг/мл до приблизительно 1,5 мг/мл, от приблизительно 0,7 мг/мл до приблизительно 3 мг/мл, от приблизительно 0,7 мг/мл до приблизительно 2 мг/мл, от приблизительно 0,7 мг/мл до приблизительно 1,7 мг/мл, приблизительно 0,7 мг/мл, приблизительно 1,5 мг/мл, приблизительно 0,7 мг/мл, приблизительно 1,4 мг/мл, приблизительно 0,7 мг/мл, приблизительно 1,3 мг/мл, приблизительно 0,5 мг/мл, приблизительно 0,7 мг/мл, приблизительно 0,8 мг/мл, приблизительно 0,9 мг/мл, приблизительно 1 мг/мл, приблизительно 1,1 мг/мл, приблизительно 1,2 мг/мл, приблизительно 1,3 мг/мл, приблизительно 1,4 мг/мл, приблизительно 1,5 мг/мл, приблизительно 1,6 мг/мл, приблизительно 2 мг/мл, приблизительно 3 мг/мл, приблизительно 4 мг/мл, приблизительно 5 мг/мл, приблизительно 6 мг/мл, приблизительно 7 мг/мл, приблизительно 8 мг/мл, приблизительно 9 мг/мл, приблизительно 10 мг/мл или приблизительно 15 мг/мл внутри липосомы.
Электрический потенциал в плоскости сдвига называют зета-потенциалом липосомы. Как известно опытному специалисту, зета-потенциал липосом может быть экспериментально определен с помощью соответствующей аппаратуры, например, измерением с помощью ELS-600 (Otsuka Electronics, Япония) с применением способа лазерно-доплеровского микроэлектрофореза или других аппаратуры и протоколов, доступных для опытного специалиста. Например, J.Colloid and Interface Sci., 39, 670-675 (1972), nition.com/en/products/zeecom_s.htm и т.д.
В некоторых воплощениях описанные здесь липосомы (включая липосомы направленного действия и липосомы содержащей липосомы композиции) должны обладать суммарным отрицательным зета-потенциалом. В некоторых воплощениях зета-потенциал составляет от приблизительно -10 мВ до приблизительно -200 мВ. Например, от приблизительно -50 мВ до приблизительно -150 мВ, от приблизительно -50 мВ до приблизительно -130 мВ, от приблизительно -60 мВ до приблизительно -120 мВ, от приблизительно -50 мВ до приблизительно -100 мВ, от приблизительно -75 мВ до приблизительно -90 мВ, от приблизительно -80 мВ до приблизительно -90 мВ, от приблизительно -80 мВ до приблизительно -85 мВ, от приблизительно -85 мВ до приблизительно -90 мВ, от приблизительно -75 мВ до приблизительно -85 мВ, от приблизительно -70 мВ до приблизительно -90 мВ, приблизительно - 75 мВ, приблизительно -80 мВ, приблизительно -85 мВ, приблизительно -83 мВ, приблизительно -90 мВ, приблизительно -100 мВ, приблизительно -120 мВ.
Полагают, что после внутривенного введения небольших липосом они проходят через окна синусоидов печени и обычно быстро вступают в контакт с гепатоцитами. Липосомы промежуточного размера, как полагают, задерживаются в компартменте крови и могут циркулировать на протяжении значительного периода времени. Однако крупные липосомы проходят медленнее через синусоиды печени и быстро захватываются купферовскими клетками. Таким образом, размер липосомы очень важен для определения поведения in vivo. См., например, Liu et al., Biochim. Biophys. Acta (1992) 1104(1):95-101; Harashima et al., J. Drug Target. (1995) 3(4):253-261 (которые включены здесь в качестве ссылки во всей своей полноте) и т.д.
Размер липосомной частицы может быть получен на основании корреляционной функции путем использования различных алгоритмов при применении корреляционной фотонной спектроскопии (PCS; динамического рассеивания света или квазиэластичного рассеивания света (QELS)). Полученный этими способами размер частиц сопоставим со средним диаметром, определенным с помощью PCS. При PCS для описания распределения размеров используются стандартное отклонение и χ2. В системах PCS χ2 определяет то, является ли система унимодальной (гауссово распределение) или мультимодальной (распределение Nicomp). Средний размер частиц может быть определен по интенсивности взвешенных измерений и описывается на основании гауссова распределения при χ2≤5. Если χ2>5, то используют среднее основного пика распределения Nicopm. Подобный анализ должен быть знаком опытному специалисту, так же как и аппаратное обеспечение, например, Nicomp QELS Particle Sizer, PSS Model 380ZLS, S/N 0103301; pssnicomp.com/zetaspec.htm.
В некоторых воплощениях липосом, в особенности липосом направленного действия, средний диаметр описанных здесь липосом должен составлять от приблизительно 50 до приблизительно 275 нм. Например, средний диаметр липосом может составлять от приблизительно 50 до приблизительно 200 нм, от приблизительно 50 до приблизительно 265 нм, от приблизительно 50 до приблизительно 250 нм, от приблизительно 50 до приблизительно 225 нм, от приблизительно 50 до приблизительно 175 нм, от приблизительно 50 до приблизительно 150 нм, от приблизительно 50 до приблизительно 120 нм, от приблизительно 50 до приблизительно 100 нм, от приблизительно 75 до приблизительно 250 нм, от приблизительно 75 до приблизительно 200 нм, от приблизительно 75 до приблизительно 175 нм, от приблизительно 75 до приблизительно 150 нм, от приблизительно 75 до приблизительно 120 нм, от приблизительно 75 до приблизительно 100 нм, от приблизительно 90 до приблизительно 100 нм, от приблизительно 90 до приблизительно 120 нм, от приблизительно 90 до приблизительно 150 нм, от приблизительно 90 до приблизительно 200 нм, от приблизительно 95 до приблизительно 100 нм, от приблизительно 95 до приблизительно 120 нм, от приблизительно 95 до приблизительно 125 нм, от приблизительно 95 до приблизительно 130 нм, от приблизительно 95 до приблизительно 150 нм, от приблизительно 95 до приблизительно 175 нм, приблизительно 90 нм, приблизительно 95 нм, приблизительно 100 нм, приблизительно 120 нм, приблизительно 130 нм или приблизительно 150 нм. Для конкретной липосомной композиции липосома направленного действия должна иметь диаметр, превышающий на от приблизительно 15 до приблизительно 25 нм диаметр липосомы, образованной из тех же компонентов, но без включения направляющего фактора.
Описанные здесь липосомы (например, липосомы направленного действия, ненагруженные липосомы, липосомы в содержащих липосомы композициях) могут быть также охарактеризованы по концентрации направляющего лиганда, который включен в липосому. В зависимости от выбранного направляющего лиганда опытному специалисту должны быть очевидны различные средства определения количества направляющего лиганда. Например, как описано в примерах, содержание трансферрина (Tf) в липосомах может быть определено по электрофоретической подвижности (например, при измерении с помощью Na-ДДС-ПАГЭ) липосомы по отношению к соответствующим контролям.
Вкратце, подтверждение содержания трансферрина в липосомах может быть оценено с помощью двух анализов содержания и/или идентичности трансферрина, конъюгированного с липсомами. Сначала электрофоретическую подвижность трансферрина липосомы, анализируемую с помощью Na-ДДС-ПАГЭ, можно сравнить с характером подвижности очищенного конъюгированного трансферрина, например, TF-NωPE. Кроме того, электрофоретическую подвижность конъюгированного трансферрина можно также сравнивать со свободным трансферрином в качестве контрольного стандарта. Дополнительное подтверждение идентичности трансферрина в липосомах может быть получено с помощью ИФА, состава квалификации для исследования, который показывает специфическое связывание антитела против трансферрина с липосомами для направленной доставки. Концентрация направляемых трансферрином липосом может быть измерена с помощью колориметрических анализов количества белка, таких как BCA, анализа, хорошо известного опытному специалисту. Опытный специалист в свете представленных здесь указаний должен также иметь в виду сходные способы и другие известные способы в данной области техники для определения количества разнообразных направляющих факторов.
Вкратце, количество трансферрина в липосоме может быть проанализировано с помощью аналитического реагента бицинхониновой кислоты (BCA). Медь (II) восстанавливается до меди (I) белком в щелочных условиях. Образовавшийся ион меди (I) образует растворимый, интенсивно окрашиваемый комплекс с BCA. Суммарный связанный с микрочастицей белок измеряют с помощью взаимодействия известного количества суспензии микрочастиц с реагентами BCA. После образования окраски микрочастицы удаляют фильтрацией, и окраску измеряют спектрофотометрически.
В некоторых воплощениях концентрация направляющего лиганда, включенного в липосому, должна составлять от приблизительно 0,5 мг/мл до приблизительно 5,0 мг/мл, от приблизительно 0,5 мг/мл до приблизительно 2,0 мг/мл, от приблизительно 1,0 мг/мл до приблизительно 2,0 мг/мл, от приблизительно 1,0 мг/мл до приблизительно 3,0 мг/мл, от приблизительно 1,0 мг/мл до приблизительно 2,5 мг/мл, от приблизительно 1,0 мг/мл до приблизительно 2,0 мг/мл, или от приблизительно 1,3 мг/мл до приблизительно 2,5 мг/мл.
Роль иона железа является очень важной для связывания трансферрина с поверхностью опухолевых клеток. Поэтому содержание иона железа в липосомах направленного действия, включающих Tf, является другим важным способом характеристики липосом. Специалистам в данной области техники должен быть известен ряд способов определения содержания ионов железа, одним из способов является ICP-MS.
Когда липосома содержит трансферрин, содержание иона железа в липосоме может составлять, например, от приблизительно 0,25 мкг/мл до приблизительно 3 мкг/мл, от 0,4 мкг/мл до приблизительно 3 мкг/мл, от 0,25 мкг/мл до приблизительно 2 мкг/мл, от 0,25 мкг/мл до приблизительно 1,5 мкг/мл, от 0,25 мкг/мл до приблизительно 1 мкг/мл, от 0,4 мкг/мл до приблизительно 2 мкг/мл, от 0,4 мкг/мл до приблизительно 1,5 мкг/мл, от 0,5 мкг/мл до приблизительно 2 мкг/мл, от приблизительно 0,5 мкг/мл до приблизительно 1,4 мкг/мл, или от приблизительно 0,5 мкг/мл до приблизительно 1,5 мкг/мл.
Липосомы, включая липосомы направленного действия и ненагруженные липосомы, можно также характеризовать по их осмотическому давлению при заданной температуре. Осмотическое давление при заданной температуре зависит от молярной концентрации раствора сахара (сахарозы). И оно также зависит от общей плотности ионов и размера молекул в растворе. Обычно осмотическое давление может быть измерено с помощью аппарата, известного как осмометр, который измеряет осмотическое давление в подходящих единицах давления, как это должно быть известно опытному специалисту.
В некоторых воплощениях осмотическое давление липосом, в частности, липосом направленного действия и ненагруженных липосом, при комнатной температуре должно составлять от приблизительно 310 до приблизительно 410 мОсм/кг. Например, осмотическое давление может составлять от приблизительно 310 до приблизительно 400 мОсм/кг, от приблизительно 310 до приблизительно 380 мОсм/кг, от приблизительно 320 до приблизительно 360 мОсм/кг, от приблизительно 315 до приблизительно 375 мОсм/кг, от приблизительно 320 до приблизительно 375 мОсм/кг, от приблизительно 315 до приблизительно 370 мОсм/кг, от приблизительно 320 до приблизительно 370 мОсм/кг, приблизительно 360 мОсм/кг, приблизительно 350 мОсм/кг, приблизительно 340 мОсм/кг, приблизительно 370 мОсм/кг, или приблизительно 380 мОсм/кг при комнатной температуре.
При различных описанных здесь условиях (например, условиях хранения, подготовки для введения и/или условиях in vitro) осмотическое давление может меняться менее, чем приблизительно на 25%, менее, чем приблизительно на 20%, менее, чем приблизительно на 15%, при отслеживании на протяжении конкретного периода времени, связанного с различными описанными здесь условиями. Например, 360±50 мОсм/кг.
Получение содержащих липиды композиций
Существует три главных требования для лекарственных веществ и меченых соединений, предназначенных для введения индивидуумам в курсе терапии, а именно эффективность, безопасность и гарантия качества. Несмотря на доказанную эффективность и безопасность, возможность применения лекарственных веществ при терапии неопределенна, если его качество (например, чистота, однородность, воспроизводимость дозировки, стабильность с течением времени и т.д.) не может быть соответственно гарантировано при производстве и распространении. Способы получения лекарственных веществ или меченого соединения, которые не гарантируют соответствующего высокого качества лекарственного средства, также повышают вероятность побочных реакций у индивидуумов, которым вводят лекарственное вещество. В течение продолжительности жизни лекарственного вещества или меченого соединения важно, чтобы продукт, который производится и распределяется, имел те же самые стандарты, что и продукт, который первоначально получил разрешительные санкции. Таким образом, способность соответствующим образом получать лекарственные вещества или меченые соединения высокого качества необходима для получения безопасных продуктов, таких как лекарственные вещества или меченые соединения, и лекарственное вещество или меченое соединение, которые могут быть получены и очищены рутинно и легко, выгодно отличаются как по коммерческим перспективам, так и по безопасности. Когда, например, эффективность меченого соединения относится к его способности быть пригодным для диагностики конкретного заболевания или состояний в сочетании с конкретными способами диагностики (например, активности меченого соединения (например, способности быть визуализированным в гамма-счетчике и т.д.), не ухудшается от неприемлемого уровня от партии к партии или в процессе хранения.
Ниже описываются общие способы получения описанных здесь композиций, которые могут быть применены для получения соответствующего высокого качества (например, высокой чистоты, однородности и т.д.) липосом направленного действия (и их промежуточных соединений) и ненагруженных липосом. Эти способы также представлены схематически на фиг. 4 (способ получения A) и 5 (способ получения B).
Сукцинимидные эфиры производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламины и производные N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, как здесь описано, пригодны в качестве компонентов фосфолипидных комплексов, таких как липосомы, полимерные мицеллы, микро- и наносферы, эмульсии и водорастворимые полимеры. Здесь описывается получение этих PE производных и способы их получения также известны в данной области техники, как отмечалось выше.
В частности, сукцинимидные эфиры производных N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов и производные N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов также пригодны в качестве компонентов описанных здесь содержащих липиды композиций. Содержащие липиды композиции могут быть получены в соответствии с описанными здесь способами, хотя модификации этих способов также должны быть очевидны специалисту в данной области техники. Например, различные способы, известные специалисту в данной области техники, могут быть использованы для составления липосом из липидных компонентов (например, обработка ультразвуком, взбалтывание, экструзия, дегидратация и т.д.). Например, как описано в патентн. заявке США, публ. No. 2004/0142025, содержание которой включено здесь в качестве ссылки во всей своей полноте.
Применение описанных здесь общих способов, включенных в примеры, для получения липосом направленного действия охватывает также способы получения других содержащих липиды композиций (например, липидных смесей, содержащих липосомы композиций, ненагруженных липосом и промежуточных липосом), как здесь описано.
Способ получения A
Способ получения А изображен схематически на фиг.4.
A: получение смеси NωPE:SuccNωPE:дополнительный липид (промежуточного продукта 1)
Сукцинимидные эфиры производных N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов (SuccNωPE) и производные N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов (NωPE), как здесь описано, смешивают с дополнительным(ми) липидом(дами) ((например, по меньшей мере, с одним фосфолипидом(амии) (например, PC (например, DMPC, DSPC и т.д.), PI, сфингомиелином, фосфатидной кислотой и т.д.)) и, по меньшей мере, с одним дополнительным липидом (например, холестерином), затем растворяют в подходящем растворителе (например, этаноле, T-BuOH, хлороформе, изопропиловом эфире и т.д.). Количество растворителя обычно составляет от 1 до 100 об./масс. (по отношению к суммарной массе липидов). В определенных воплощениях оно составляет от 2 до 20 об./масс.
Применяемые здесь, как описано в предшествующем параграфе, SuccNωPE и NωPE могут быть получены и очищены описанными здесь способами или способами, известными опытному специалисту. SuccNωPE и NωPE, а также другие описанные здесь компоненты для получения липосом направленного действия должны иметь чистоту и однородность, достаточные для получения в конечном итоге липосом направленного действия с чистотой и однородностью, необходимыми для соответствия инструктивным указаниям по введению индивидуумам липосом направленного действия и соответствия указаниям по приемлемой лабораторной практике (GLP) и приемлемой практике производства (GMP).
Когда (в дополнение к одному или более фосфолипидов) используют дополнительный(е) липид(ы) в сочетании с фосфолипидом, отношение фосфолипида(ов) к другому(им) дополнительному(ым) липиду(ам) составляет приблизительно 2:1. Соотношение в смеси производных SuccNωPE к фосфолипидам составляет от приблизительно 1 до приблизительно 12% (от 1:99 до 12:88) или приблизительно 3-6% (от 3:97 до 6:94) от общей концентрации/отношения (NHS-NGPE + NGPE) к (CHOL + фосфолипид). Например, иллюстративное отношение включает 50:45:4:1 (например, PC:Chol:NG-PE:NHS-NG-PE), где, например, в смеси находятся 17,5 мг NHS-NG-DOPE, 63,1 мг NG-DOPE, 312 мг Chol и 607 мг фосфолипидов.
B: Получение смеси лекарственное вещество:NωPE:SuccNωPE:дополнительный липид (промежуточного продукта 2)
Смесь NωPE:SuccNωPE:дополнительный липид, полученную на предшествующей стадии A, затем смешивают с водным раствором (например, буфером и т.д.), содержащим лекарственное вещество или меченое соединение, подлежащее инкапсулированию, например, противораковый агент (например, оксалиплатин, ингибитор топоизомеразы I, алкалоид барвинка и т.д.), с получением смеси лекарственное вещество:NωPE:SuccNωPE:нейтральный липид (промежуточный продукт 2).
Когда лекарственным веществом является оксалиплатин (l-OHP), концентрация раствора оксалиплатина составляет приблизительно 8 мг/мл в приблизительно 9% растворе сахарозы. Например, концентрация оксалиплатина в липосомах направленного действия составляет приблизительно 0,8 мг/мл ± 10%.
C: Получение липосомы лекарственное вещество:NωPE:SuccNωPE:дополнительный липид (промежуточного продукта 3)
Смесь лекарственное вещество:NωPE:SuccNωPE:дополнительный липид (промежуточный продукт 2), полученную на стадии B, затем озвучивают или перемешивают с последующим выпариванием растворителя с образованием липосомы лекарственное вещество:NωPE:SuccNωPE:дополнительный липид (промежуточного продукта 3). Способы и условия проведения озвучивания, перемешивания и выпаривания и средства осуществления данных стадий хорошо понятны опытному специалисту, а также дополнительно описаны в разделе Примеры. См., например, способы получения с помощью способов пузырьков с обращенной фазой (REV), патент США No. 4235871 (включенный здесь во всей своей полноте в качестве ссылки). Могут быть также применены общие способы получения липосом, такие как способы простого гидрирования и способы введения этанола, известные опытному специалисту.
Образованную, как описано выше, липосому лекарственное вещество:NωPE:SuccNωPE:дополнительный липид далее экструдируют по размеру и выделяют липосому лекарственное вещество:NωPE:SuccNωPE:дополнительный липид. Для концентрирования раствора липосомы затем может быть необязательно применена ультрафильтрация.
Когда липосома содержит l-OHP (лекарственное вещество), DMPS (дополнительный липид/фосфолипид (нейтральный)), холестерин (CHOL, дополнительный липид/нейтральный липид), N-глутарил-DOPE (NG-DOPE) и NHS-NG-DOPE, можно выделить липосому со средним диаметром приблизительно 0,2 микрометра (200 нм). Сходного размера липосомы могут быть также получены в случае липосом, содержащих l-OHP (лекарственное вещество), DSPC (дополнительный липид/фосфолипид (нейтральный)), холестерин, N-глутарил-DSPE (NG-DSPE) и NHS-NG-DSPE. Иллюстративные направляющие количества липидных компонентов составляют, например, приблизительно 40 мг/мл DMPC (дополнительный липид/фосфатидилхолин/фосфолипид/нейтральный липид), приблизительно 20 мг/мл CHOL (дополнительный липид/нейтральный липид) и приблизительно 5 мг/мл NG-DOPE (суммарное количество NG-PE и NHS-NG-PE). Иллюстративное соотношение для липидных компонентов составляет 50:45:5 (дополнительный липид 1 (например, фосфатидилхолин): дополнительный липид 2 (например, CHOL): NG-PE (например, NG-DOPE + NHS-NG-DOPE).
D: Получение липосомы лекарственное вещество:NωPE:TF-NωPE:дополнительный липид (липосомы направленного действия)
Липосому лекарственное вещество:NωPE:SuccNωPE:дополнительный липид, образованную как описано на стадии C, можно затем функционализировать с помощью направляющего фактора по выбору для получения липосомы лекарственное вещество:NωPE:TF-NωPE:дополнительный липид (обозначаемой также «липосома направленного действия»).
Присоединение направляющего фактора (TF) (например, функционализация промежуточной липосомы (промежуточного продукта 3) направляющим фактором) осуществляют ковалентным присоединением направляющего фактора к SuccNωPE посредством взаимодействия сукцинимидного остатка с направляющим фактором. Посредством подходящих условий реакции сукцинимидные группы на экспонируемой поверхности липосомы (на наружной поверхности липидного бислоя, где лекарственное вещество или меченое соединение инкапсулировано во внутрь липосомы) могут быть ковалентно модифицированы с образованием модифицированных направляющим фактором производных N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламинов (TF-NωPE). Присоединение направляющего фактора к липосоме ведет к образованию липосомы лекарственное вещество:NωPE:TF-NωPE:дополнительный липид (липосомы направленного действия).
Конкретнее, сукцинильный карбоксильный остаток SuccNωPE, как описано здесь, функционализируют при подходящих условиях. Если направляющий фактор содержит аминогруппу(ы), аминогруппу(ы) направляющего фактора вводят во взаимодействие с сукцинильным карбоксильным остатком с образованием амидной связи карбоновой кислоты. Условия, подходящие для данной реакции, дополнительно описываются здесь, в том числе в разделе Примеры, а также должны быть хорошо понятны опытному специалисту. Опытный специалист также должен быть способен модифицировать условия реакции для их оптимизации для конкретных сочетаний направляющего фактора и липосом, не прибегая к излишнему экспериментированию, с учетом данных здесь указаний.
Различные направляющие факторы, как описано здесь и известные опытному специалисту, могут быть получены из коммерческих источников или получены способами, известными специалисту.
Когда, например, в качестве направляющего фактора выбирают трансферрин, трансферрин может быть получен из коммерческих источников в виде очищенного белка, например, от Celliance Corp., GA, США. Трансферрин можно также получить с помощью рекомбинантных способов, хорошо известных в данной области техники (например, путем применения прокариотной клетки (E.coli и т.д.), применения эукариотной клетки (CHO, BHK и т.д.) и т.д.). Как хорошо известно, трансферрин может быть получен и использован в липосомах направленного действия либо в апо-, либо в холо-форме. Альтернативно, липосомы направленного действия, включающие апо-трансферрин, могут быть обработаны соединениями железа, такими как цитрат железа, хлорид железа (III) и т.д., с получением липосом направленного действия, включающих липосому, модифицированную холо-трансферрином.
Иллюстративное количество трансферрина в качестве направляющего фактора составляет, например, приблизительно 2 мг/мл трансферрина. Такое количество должно быть достаточным для иллюстративной липосомы направленного действия, включающей приблизительно 40 мг/мл DMPC, приблизительно 20 мг/мл CHOL и приблизительно 5 мг/мл NG-DOPE (суммарное количество NG-PE и NHS-NG-PE).
После функционализации липосомы (промежуточного продукта 3) направляющим фактором, как описано здесь, с получением липосом направленного действия, полученные липосомы могут быть необязательно дополнительно очищены способами, известными специалистам в данной области техники, включая описанные здесь способы очистки, в особенности описанные выше в связи со стадией C.
Когда липосома содержит l-OHP (лекарственное вещество), DMPS, холестерин (CHOL), N-глутарил-DOPE (NG-DOPE) и Tf-NG-DOPE, можно выделить липосому со средним диаметром от приблизительно 0,05 микрометра до приблизительно 0,2 микрометра (от приблизительно 50 нм до приблизительно 200 нм). Сходного размера липосомы могут быть также получены в случае липосом, содержащих l-OHP (лекарственное вещество), DSPC, холестерин, N-глутарил-DSPE (NG-DSPE) и NHS-NG-DSPE.
Получение липосом направленного действия описанным выше способом (обозначаемым для удобства как способ получения A) воспроизводимо дает липосомы направленного действия высокой чистоты и однородности. В частности, липосомы направленного действия в значительной мере свободны от отличных от NHS исходных веществ (описанных здесь) и побочных продуктов (например, ацилированных соединений мочевины и т.д.), связанных с образованием SuccNωPEs. В частности, получение и очистка SuccNωPEs до образования липосомы дает липосомы (промежуточный продукт 3) и липосомы направленного действия, в значительной мере свободные от карбодиимидных исходных веществ (например, DCC, EDC и т.д.), применяемых для функционализации NωPEs для образования SuccNωPEs. Как упоминалось ранее, лекарственные вещества и меченые соединения, в том числе липосомы направленного действия, заключающие в себе лекарственные вещества и меченые соединения, которые предназначены для введения индивидуумам в ходе лечения или диагностики, обязательно должны быть высококачественными.
Необязательно липидные смеси, описанные в A (промежуточный продукт 1), могут быть обработаны направляющим фактором с образованием липидной смеси, содержащей TF-NωPE. Кроме того, данную липидную смесь можно смешать с водным раствором с образованием содержащей липосому композиции. Наконец, содержащая липосому композиция может быть обработана с получением липосомного состава. Необязательно водный раствор может включать лекарственное вещество или меченое соединение.
Альтернативный способ получения (способ B)
Способ получения B схематически изображен на Фиг. 5.
A. Получение липосомы лекарственное вещество:NωPE:дополнительные липиды
Липосомы направленного действия, как описано здесь, могут быть также получены путем растворения дополнительных липидов и NωPE в подходящем растворителе (например, этаноле, трет-BuOH, хлороформе, изопропиловом эфире и т.д.), диспергирования полученного раствора в водном растворе, необязательно содержащем лекарственное вещество или меченое соединение, и последующих обработки полученной дисперсии ультразвуком или образования везикул с обращенной фазой с получением липосомы (лекарственное вещество:NωPE:нейтральные липиды). Раствор липосомы может быть сконцентрирован ультрафильтрацией.
В качестве неограничивающего примера может служить способ получения липосом образованием везикул с обращенной фазой (REV) (Патент США No. 4235871, включенный с качестве ссылки). Разумеется, могут быть также применены обычные способы получения липосомной композиции, такие как способы простой гидратации и введения этанола.
Для стабильного удерживания NωPE(s) в липидном бислое NωPE(s) можно получить и очистить, и затем NωPE(s) вместе с дополнительными липидами (например, фосфолипидом(ами), холестерином и т.д.) используют для получения липосомы в соответствии со способами, известными опытному специалисту.
В качестве неограничивающего примера служит смешивание и растворение в подходящем растворителе дополнительных липидов, например, одного или более фосфолипидов (например, DSPC, DMPC и т.д.), необязательно другого дополнительного липида (например, холестерина) и, по меньшей мере, одного NωPE.
Когда дополнительными липидами являются фосфолипид и холестерин, соотношение смешиваемых фосфолипида и холестерина может составлять, например, приблизительно 1:1, например, приблизительно 1,1:1, приблизительно 1,2:1, приблизительно 0,9:1 (например, DMPC и холестерина 50:45 (моль%). Содержание NωPE(s) как доли от суммарного содержания липидов составляет, например, 6% относительно фосфолипида. После этого полученный раствор смешивают с раствором оксалиплатина в водном буфере. Содержание NωPE может составлять от приблизительно 0,8 моль% до приблизительно 12 моль% от общего содержания липидов. Например, от приблизительно 1 моль% до приблизительно 10 моль%, от приблизительно 1 моль% до приблизительно 8 моль%, от приблизительно 1 моль% до приблизительно 6 моль%, от приблизительно 1 моль% до приблизительно 5 моль%, от приблизительно 1 моль% до приблизительно 4 моль%, от приблизительно 1 моль% до приблизительно 3 моль%, от приблизительно 1 моль% до приблизительно 2 моль%, от приблизительно 2 моль% до приблизительно 12 моль%, от приблизительно 2 моль% до приблизительно 10 моль%, от приблизительно 3 моль% до приблизительно 8 моль%, приблизительно 1 моль%, приблизительно 2 моль%, приблизительно 3 моль%, приблизительно 4 моль%, приблизительно 5 моль%, приблизительно 6 моль%, приблизительно 8 моль%, приблизительно 10 моль% или приблизительно 12 моль%.
Концентрация лекарственного вещества или меченого соединения в растворе может быть такой, как описано выше, и, в частности, как описано выше в способе получения A. Сходным образом, раствор, содержащий лекарственное вещество или меченое соединение, включает описанные здесь компоненты раствора.
Липосомы, заключающие в себе l-OHP (лекарственное вещество), DSPC, холестерин и N-глутарил-DSPE (NG-DOPE), полученные данным способом, могут быть выделены с получением содержащей оксалиплатин липосомы (например, с помощью гель-фильтрации, хроматографии с исключением по размеру, ультрафильтрации, ультрацентрифугирования и т.д.), имеющей средний диаметр приблизительно 0,2 мкм.
B. Получение липосомы лекарственное вещество:SuccNωPE:NωPE:дополнительные липиды
После стадии A часть NωPE, находящегося в липосоме, полученной на стадии A (липосоме лекарственное вещество:NωPE:дополнительные липиды), функционализируют с получением липосомы, включающей SuccNωPE (т.е. липосомы лекарственное вещество:SuccNωPE:NωPE:дополнительные липиды), которую затем можно модифицировать с образованием TF-NωPE.
Для образования SuccNωPE карбоксильную группу на конце NωPE модифицируют с получением сукцинимидной группы. Такая функционализация может быть осуществлена способами, описанными для получения SuccNωPE(s).
Например, в присутствии липосомы вводят во взаимодействие карбодиимид (например, EDC, DCC и т.д.) и N-гидроксисульфосукцинимид (NHS) с получением липосомы лекарственное вещество:SuccNωPE:NωPE:дополнительные липиды.
C. Получение липосомы лекарственное вещество:TF-NωPE:NωPE:дополнительные липиды
После стадии B полученную на стадии B липосому лекарственное вещество:SuccNωPE:NωPE:дополнительные липиды вводят во взаимодействие с направляющим фактором с образованием липосомы лекарственное вещество:TF-NωPE:NωPE:дополнительные липиды. Способы и условия проведения реакции являются такими же, как и описанные для способа получения A, стадия D.
Полученные согласно способу получения B липосомы лекарственное вещество:TF-NωPE:NωPE:дополнительные липиды могут быть очищены и концентрированы описанными здесь и известными опытному специалисту способами.
Сравнение способов получения
Способ получения A обладает рядом преимуществ по сравнению со способом получения B, хотя для получения липосом лекарственное вещество:TF-NωPE:NωPE:дополнительные липиды (липосом направленного действия, необязательно содержащих либо лекарственное вещество, либо меченое соединение) могут быть использованы оба способа. Самое главное заключается в том, что липосомы, полученные способом A, должны быть свободны или в значительной мере свободны от загрязнений (например, отличных от NHS исходных веществ и/или побочных продуктов), связанных с получением SuccNωPEs. В частности, как отмечалось ранее, липосомы направленного действия, полученные способом получения A, должны быть свободны или в значительной мере свободны от, например, карбодиимидов (например, EDC, DCC и т.д.) и ацилированных производных мочевины. В некоторых воплощениях, когда SuccNωPE не включают во внутреннюю часть липосомы, липосома или содержащая липосому композиция может быть также свободна или в значительной мере свободна от NHS. Кроме того, чем больше масштаб реакции, тем продолжительнее время получения. Время для способа получения A значительно меньше времени для способа получения B.
Хотя очистка липосом лекарственное вещество:TF-NωPE:NωPE:дополнительные липиды, полученных с помощью способа получения B, должна снижать количество таких загрязнений, липосомы (например, липосомы лекарственное вещество:SuccNωPE:NωPE:дополнительные липиды, полученные на стадии B способа получения B) очистить труднее, чем липиды (например, SuccNωPEs, полученные и очищенные до стадии A способа получения A). Поскольку часть SuccNωPE, по-видимому, ориентирована внутрь липосом (например, функциональная группа сукцинимидного сложного эфира находится на внутренней стороне липидного бислоя и недоступна для взаимодействия с направляющим фактором), представляется вероятным, что липосомы направленного действия, полученные способом получения A, могут содержать некоторое остаточное количество заключенного в них SuccNωPE.
Дополнительным преимуществом способа получения A является то, что содержание TF-NωPE относительно NωPE в конечных липосомах лекарственное вещество:TF-NωPE:NωPE:дополнительные липиды можно контролировать точнее при применении способа получения A. Относительные количества этих липидов прямо соотносятся с относительными количествами SuccNωPE и NωPE, используемыми в качестве исходных веществ на стадии A способа получения A. Таким образом, количество модифицированного TF SuccNωPE также можно контролировать более точно.
При применении способа получения B количество NωPE относительно количества SuccNωPE зависит от эффективности реакции стадии B способа B. Эта реакция, как полагают, заканчивается при содержании NωPE в липосоме, составляющем приблизительно 10%, но можно ожидать экспериментальные вариации между партиями. Низкая эффективность реакции, вероятно, обусловлена отчасти стерическим препятствием предварительно образованной липосомы. Когда SuccNωPE образуется из выделенного NωPE (только липид), стерическое препятствие является значительно меньшим, и реакция идет дальше до завершения. Кроме того, после образования SuccNωPE (только в липидной форме) полученный продукт может быть очищен из реакционной смеси, что тем самым обеспечивает удаление непрореагировавших NωPE, карбодиимида и NHS, а также других побочных продуктов, которые могут образовываться во время реакции.
Липосомы, образованные с помощью любого способа, по-видимому, являются более однородными (и, следовательно, могут быть использованы для получения более воспроизводимого лекарственного/диагностического продукта) по сравнению с липосомами, которые включают ПЭГ или другие гидрофильные полимеры, такие как описанные в разделе Известный уровень техники настоящего описания. Обычно, когда ПЭГ или другие гидрофильные полимеры применяют для увеличения времени циркуляции липосом (например, для защиты липосом от захвата RES), их применение приводит к образованию липосом с расширенным диапазоном молекулярной массы из-за широкого распределения самих ПЭГ или гидрофильных полимеров. Это распределение увеличивает сложности, связанные с производством (например, воспроизводимость и/или очистку), и может также увеличивать вариабельность клинической эффективности. Липосомы направленного действия, полученные способами A или B, должны иметь преимущества в данных отношениях.
Дополнительные способы получения
Липидные смеси и содержащие липосому композиции (которые могут быть использованы для получения липосом) могут быть также получены путем модификации способов получения A и B. Например, в некоторых воплощениях липидные смеси и содержащие липосому композиции, включающие дополнительный(е) липидный(е) компонент(ы):NωPE:TF-NωPE или дополнительный(е) липидный(е) компонент(ы):NωPE:TF-NωPE:лекарственное вещество/меченое соединение (где «дополнительный(е) липидный(е) компонент(ы)» относится к одному или более фосфолипидам (например, одному или более нейтральному, одному или более анионному, одному или более катионному фосфолипидам или сочетаниям двух или более из упомянутых выше), необязательно дополнительно включающему один или более дополнительных липидов, как описано здесь (например, холестерин или его производное); или, по меньшей мере, два разных нейтральных липида, как описано здесь (например, по меньшей мере, один фосфолипид (например, PC (например, DMPC, DSPC и т.д.), PI, сфингомиелин, фосфатидную кислоту и т.д.) и, по меньшей мере, один другой нейтральный липид (например, холестерин)), могут быть получены с помощью способов получения, описанных ниже, а также других модификаций способов, предполагаемых опытным специалистом в свете указаний настоящего описания. Компоненты дополнительных липидов, NωPE, TF-NωPE и, если присутствуют, лекарственные вещества или меченые соединения могут быть такими, как описано в настоящем описании. Сходным образом, относительные количества компонентов также являются такими, как описано в настоящем описании.
В некоторых воплощениях липидная смесь, полученная на первой стадии способа получения B (липидная смесь, полученная растворением дополнительных липидов и NωPE в подходящем органическом растворителе), может быть модифицирована включением NHS и затем модифицирована TF с получением липидной смеси дополнительный(ые) липидный(ые) компонент(ы):NωPE:TF-NωPE. Эта липидная смесь может быть затем смешана с водным раствором (необязательно содержащим лекарственное вещество или меченое соединение) с образованием содержащей липосому композиции. Альтернативно, лекарственное вещество или меченое соединение может быть включено после получения содержащей липосому композиции. В некоторых воплощениях лекарственное вещество или меченое соединение, свободное от водного раствора, может быть включено в липидную смесь, образованную после модификации с помощью NHS и TF, с образованием липидной смеси дополнительный(ые) липидный(ые) компонент(ы):NωPE:TF-NωPE:лекарственное вещество или меченое соединение. Данная липидная смесь может быть затем смешана с водным раствором с образованием содержащей липосому композиции.
В некоторых воплощениях липидная смесь, полученная на первой стадии способа получения B (липидная смесь, полученная растворением дополнительного(ых) липидного(ых) компонента(ов) и NωPE в подходящем растворителе), может быть смешана с водным раствором с образованием содержащей липосому композиции (дополнительный(ые) липидный(ые) компонент(ы):NωPE). Эту содержащую липосому композицию можно затем обработать NHS и TF и затем смешать с лекарственным веществом или меченым соединением с образованием содержащей липосому композиции дополнительный(ые) липидный(ые) компонент(ы):NωPE:TF-NωPE:лекарственное вещество/меченое соединение. Альтернативно, содержащую липосому композицию дополнительный(ые) липидный(ые) компонент(ы):NωPE можно обработать лекарственным веществом или меченым соединением и затем модифицировать NHS и затем TF.
В некоторых воплощениях липидная смесь, полученная на первой стадии способа получения B (липидная смесь, полученная растворением дополнительного(ых) липидного(ых) компонента(ов) и NωPE в подходящем растворителе), может быть смешана с лекарственным веществом или меченым соединением (необязательно включающим водный раствор) с образованием липидной смеси (где лекарственное вещество или меченое соединение не включает водный раствор) или содержащей липосому композиции. Когда образуется липидная смесь, липидную смесь затем можно обработать NHS и TF с образованием липидной смеси дополнительный(ые) липидный(ые) компонент(ы):NωPE:TF-NωPE:лекарственное вещество/меченое соединение, которую затем можно смешать с водным раствором с образованием содержащей липосому композиции. Альтернативно, когда образуется содержащая липосому композиция (например, когда лекарственное вещество или меченое соединение включено в водный раствор), данную содержащую липосому композицию можно затем обработать NHS и TF тоже с получением содержащей липосому композиции дополнительный(ые) липидный(ые) компонент(ы):NωPE:TF-NωPE:лекарственное вещество/меченое соединение.
В дополнительном альтернативном способе получения, способе C, отдельные компоненты одновременно смешивают в органическом растворителе с образованием липидной смеси (C-1)(например, компоненты: дополнительный(ые) липидный(ые) компонент(ы); NωPE; TF-NωPE или компоненты: дополнительный(ые) липидный(ые) компонент(ы):NωPE:TF-NωPE:лекарственное вещество/меченое соединение), где TF-NωPE получают и необязательно очищают перед смешиванием. Липидную смесь C-1 затем можно смешать с водным раствором с образованием содержащей липосому композиции C-2 (дополнительный(ые) липидный(ые) компонент(ы):NωPE:TF-NωPE, необязательно содержащей лекарственное вещество или меченое соединение). Когда образованная таким образом содержащая липосому композиция не содержит лекарственное вещество или меченое соединение, лекарственное вещество или меченое соединение может быть добавлено после образования содержащей липосому композиции (C2-A). Альтернативно, когда в качестве исходного компонента используют включающее водный раствор лекарственное вещество или меченое соединение, содержащая липосому композиция может быть образована одновременно со смешиванием всех исходных компонентов.
C-2 (необязательно содержащая лекарственное вещество или меченое соединение) или C2-A может быть обработана с образованием липосомы (C-3). Когда C-3 не включает лекарственное вещество или меченое соединение, липосома станет ненагруженной липосомой, как описано ранее (например, липосомой дополнительный(ые) липидный(ые) компонент(ы):NωPE:TF-NωPE). Когда C-3 включает лекарственное вещество или меченое соединение, липосома станет липосомой направленного действия, как описано здесь. Когда C-3 является ненагруженной липосомой, лекарственное вещество или меченое соединение может быть, как описано ранее, добавлено к ненагруженной липосоме на следующей стадии с образованием липосомы направленного действия, что может быть осуществлено сразу после получения C-3 или спустя некоторое время, которое может включать период хранения ненагруженной липосомы C-3.
В дополнительном альтернативном способе получения, способе D, отдельные компоненты одновременно смешивают в органическом растворителе с образованием липидной смеси (D-1) (например, компоненты: дополнительный(ые) липидный(ые) компонент(ы); NωPE; или компоненты: дополнительный(ые) липидный(ые) компонент(ы):NωPE:лекарственное вещество или меченое соединение). Липидную смесь D-1 затем можно смешать с водным раствором с образованием содержащей липосому композиции D-2 (дополнительный(ые) липидный(ые) компонент(ы):NωPE:(необязательно содержащей лекарственное вещество или меченое соединение). Содержащая липосому композиция D-2 затем может быть смешана с TF-NωPE с образованием содержащей липосому композиции D-3 (дополнительный(ые) липидный(ые) компонент(ы):NωPE:TF-NωPE(необязательно содержащей лекарственное вещество или меченое соединение)), где TF-NωPE получают и необязательно очищают до смешивания. Когда образованная таким образом содержащая липосому композиция не содержит лекарственное вещество или меченое соединение, лекарственное вещество или меченое соединение может быть добавлено после образования содержащей липосому композиции (D3-A). Альтернативно, когда в качестве исходного компонента используют лекарственное вещество или меченое соединение, включающее водный раствор, содержащая липосому композиция может быть образована одновременно со смешиванием всех компонентов.
D-3 (необязательно содержащую лекарственное вещество или меченое соединение) или D3-A можно затем обработать с получением липосомы (D-4). Когда D-4 не включает лекарственное вещество или меченое соединение, липосома станет ненагруженной липосомой, как описано ранее (например, липосомой дополнительный(ые) липидный(ые) компонент(ы):NωPE:TF-NωPE). Когда D-4 включает лекарственное вещество или меченое соединение, липосома станет липосомой направленного действия, как описано здесь. Когда D-4 является ненагруженной липосомой, лекарственное вещество или меченое соединение может быть, как описано ранее, добавлено к ненагруженной липосоме на следующей стадии с образованием липосомы направленного действия, что может быть осуществлено сразу после получения D-4 или спустя некоторое время, которое может включать период хранения ненагруженной липосомы D-4.
Как и в случае липидных смесей, содержащих липосому композиций и липосом (включая липосомы направленного действия, ненагруженные липосомы и т.д.), образованных способом получения A, содержащие липиды композиции, полученные способом получения C или способом D, должны быть в значительной мере свободны от отличного от NHS исходного вещества, побочного продукта и/или продукта распада, связанных с синтезом сукцинимидного сложного эфира производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина (например, карбодиимидов (например, DCC, EDC и т.д.), ацилированных соединений мочевины и т.д.), насколько исходное вещество (например, TF-NG-PE) в значительной мере свободно от этих веществ до исходной стадии способа получения C или способа D. Когда SuccNωPE не включают в качестве исходного вещества (и, следовательно, не включают внутрь липосомы), липосома или содержащая липосому композиция также может быть свободна или в значительной мере свободна от NHS, как в случае предварительного образования и использования в качестве исходного вещества TF-NωPE. В отдельных воплощениях содержащие липиды композиции, полученные способом получения C или способом D, в значительной мере свободны от DCC и EDC. В некоторых воплощениях содержащие липиды композиции, полученные способом получения C или способом D, в значительной мере свободны от DCC.
В некоторых воплощениях дополнительный(ые) липидный(ые) компонент(ы) включает(ют) один или более фосфолипидов (например, фосфатидилхолин и т.д.) и холестерин или производное холестерина. В отдельных воплощениях фосфатидилхолин представляет собой DMPC, POPC, DSPC и т.д., как описано здесь. В некоторых воплощениях фосфатидилхолин представляет собой DMPC или DSPC. В некоторых воплощениях дополнительным(и) липидом(ами) являются фосфолипид и холестерин. В некоторых воплощениях фосфолипид представляет собой нейтральный фосфолипид.
В некоторых воплощениях дополнительный(ые) липидный(ые) компонент(ы) включает(ют), по меньшей мере, два разных нейтральных липида, которые включают фосфолипид (например, фосфатидилхолин и т.д.) и холестерин или производное холестерина. В отдельных воплощениях фосфатидилхолин представляет собой DMPC, POPC, DSPC и т.д., как описано здесь. В некоторых воплощениях фосфатидилхолин представляет собой DMPC или DSPC. В отдельных воплощениях, по меньшей мере, два разных нейтральных липида представляют собой фосфолипид и холестерин.
В некоторых воплощениях NωPE представляет собой NG-PE. В отдельных воплощениях NωPE представляет собой Nω-DOPE или Nω-DSPE. В некоторых воплощениях NωPE представляет собой NG-DOPE или NG-DSPE.
В отдельных воплощениях TF представляет собой, например, асиалогликопротеин, фолат, трансферрин и т.д. В некоторых воплощениях TF представляет собой трансферрин (Tf). В некоторых воплощениях TF-NωPE представляет собой Tf-NωPE (например, Tf-NG-DOPE или Tf-NG-DSPE).
В отдельных воплощениях лекарственное вещество представляет собой, например, противораковый агент (например, оксалиплатин, ингибитор топоизомеразы I, алкалоид барвинка и т.д.). В других воплощениях липидная смесь или содержащая липосому композиция включает меченое соединение. В некоторых воплощениях липидная смесь или содержащая липосому композиция не включает меченое соединение или лекарственное вещество.
Как упоминалось ранее, каждая из липидных смесей может быть смешана с водным раствором с образованием содержащих липосому композиций и каждая из содержащих липосому композиций может быть обработана с образованием соответствующих липосом (например, липосом направленного действия (например, включающих лекарственное вещество или меченое соединение), промежуточных липосом, ненагруженных липосом и т.д.), как подробно описано здесь.
Что касается вариаций описанных здесь способов получения, подразумевается, что модификация NωPE с помощью NHS, модификация NHS-NωPE с помощью TF, получение содержащих липосому композиций из липидных смесей и получение липосом из содержащих липосому композиций может быть осуществлено опытным специалистом, как описано здесь, без излишнего экспериментирования с учетом указаний, предлагаемых в настоящем описании, включая, в частности, подробное описание способов получения A и B и как представлено в примерах.
Фармацевтические составы
В другом аспекте настоящего изобретения предлагаются фармацевтические составы для лечения или диагностики нуждающихся в этом индивидуумов, включающие содержащие липиды композиции, как описано здесь, и один или более фармацевтически приемлемые носители, наполнители, разбавители, стабилизаторы, консерванты или другие неактивные ингредиенты, включая сочетания упомянутого выше, известных опытным специалистам и дополнительно описываемых здесь.
В некоторых воплощениях фармацевтических составов содержащая липиды композиция представляет собой липосому направленного действия, как описано здесь. В других воплощениях содержащая липиды композиция представляет собой содержащую липосому композицию. В некоторых воплощениях содержащая липиды композиция представляет собой ненагруженную липосому. В некоторых воплощениях композиция включает лекарственное вещество. В других воплощениях композиция включает меченое соединение.
В некоторых воплощениях носитель может включать одно или более из стерильной воды, буферного раствора или физиологического раствора, разбавителя или их сочетаний.
Фармацевтические составы могут дополнительно включать одно или более из различных солей, сахаров, белков, крахмала, желатина, растительных масел, полиэтиленгликоля и тому подобного, включая сочетания двух или более из вышеупомянутых.
Дополнительный аспект изобретения включает применение композиций и их составов, как описано здесь, для производства лекарственного средства. В частности, производства лекарственного средства для применения для лечения или диагностики состояний, как описано здесь. Кроме того, активные композиции и их составы, описанные здесь с разных сторон, также предназначены для применения в производстве лекарственного средства для применения для лечения или диагностики состояний и в соответствии с описанными здесь способами, если это не указано иначе.
Применение композиций
Введение
Как отмечалось ранее, в одном аспекте предлагаются способы лечения или диагностики состояний, как описано здесь, с применением содержащих лекарственное вещество или меченое соединение содержащих липид композиций (например, липосом направленного действия, содержащих лекарственное вещество или меченое соединение содержащих липосому композиций) и фармацевтических составов, как описано здесь.
В одном воплощении способы могут быть реализованы в виде терапевтического подхода к лечению описанных здесь состояний. Так, в конкретном воплощении содержащие лекарственное вещество содержащие липид композиции или фармацевтические составы могут быть использованы для лечения описанных здесь состояний у нуждающихся в этом индивидуумов, включая человека. Способы обычно включают введение индивидууму композиции или состава, описанных здесь, в количестве, эффективном для лечения состояния.
В другом воплощении способы могут быть реализованы в виде диагностического подхода к диагностике описанных здесь состояний. Так, в конкретном воплощении содержащие меченое соединение содержащие липид композиции или фармацевтические составы могут быть использованы для диагностики описанных здесь состояний у нуждающихся в этом индивидуумов, включая человека. Способы обычно включают введение индивидууму композиции или состава, описанных здесь, в количестве, эффективном для диагностики состояния. Такое введение обычно производят в сочетании со способами выявления состояния.
В некоторых воплощениях индивидуумом является млекопитающее, включая, но не ограничиваясь этим, человека, корову, лошадь, кошачьих, собачьих, грызунов или приматов. В других воплощениях индивидуумом является человек.
Термины «фармацевтически эффективное количество» или «терапевтически эффективное количество» относится к количеству композиции, достаточному для лечения определенного нарушения, состояния или заболевания или одного или более симптомов и/или для профилактики возникновения заболевания или нарушения. В отношении рака фармацевтически или терапевтически эффективное количество включает количество, достаточное, помимо прочего, для индукции уменьшения роста или для снижения скорости роста опухоли.
Термины «количество, эффективное для диагностики», или «диагностически эффективное количество», или «количество, эффективное для установления диагноза» близки друг другу и относятся к количеству композиции, достаточному для установления диагноза определенного нарушения, состояния или заболевания и/или одного или более из его их проявлений, где диагноз включает установление заболевания и/или определение степени или тяжести заболевания. Например, в отношении рака «диагностически эффективное количество» включает количество, достаточное для обнаружения, например, наличия и/или концентрации одной или более злокачественных клеток, опухоли(ей) или другого проявления рака. Часто диагностика должна проводиться по отношению к базальному уровню или фоновому уровню определения, наблюдаемому у индивидуумов без состояния. Уровни определения, превышающие фоновый или базальный уровни (повышенные уровни определения), служат указанием на наличие и в некоторых случаях тяжесть состояния.
Когда это используется в отношении способов лечения и применения содержащих лекарственное вещество содержащих липид композиций, «нуждающимся в этом» индивидуумом может быть индивидуум, у которого уже было диагностировано состояние или который ранее лечился в отношении состояния, подлежащего лечению. В отношении способов диагностики и применения содержащих меченое соединение композиций «нуждающимся в этом» индивидуумом может быть индивидуум, у которого подозревают наличие состояния, имеет риск состояния (например, семейную историю состояния, факторы образа жизни, указывающие на риск состояния (например, курение в качестве фактора риска рака легкого и т.д.)) или у которого ранее было диагностировано состояние (например, диагноз может включать мониторинг тяжести (например, прогрессию/регрессию) заболевания во времени и/или в связи с терапией).
В некоторых воплощениях состоянием, подлежащим лечению или диагностике, является рак. В некоторых воплощениях рак может быть раком желудка, ободочной кишки, ободочной и прямой кишки или молочной железы. В некоторых воплощениях рак представляет собой рак молочной железы. В иных воплощениях рак представляет собой рак желудка. В некоторых воплощениях рак представляет собой рак поджелудочной железы, немелкоклеточный рак легкого, мелкоклеточный рак легкого, рак мозга, рак печени, рак почки, рак простаты, рак мочевого пузыря, рак яичника или гематологические злокачественные образования (например, лейкоз, лимфому, множественную миелому и т.д.).
Содержащие лекарственное вещество композиции, включая описанные здесь составы, могут быть использованы отдельно или в сочетании (например, до, одновременно или после) с другими способами лечения (например, дополнительной терапией рака, лечением сочетанными способами). Например, в сочетании с другими терапевтическими агентами (например, противораковыми химиотерапевтическими агентами, как описано здесь и известными специалистам в данной области техники (например, алкилирующими агентами, таксанами, метаболическим антагонистом, противораковым антибиотиком, растительными алкалоидами, лекарственным веществом для гормональной терапии, лекарственным веществом с мишенью-молекулой и т.д.)), хирургической операцией и/или рентгенотерапией. Когда подлежащим лечению состоянием является рак, описанные здесь композиции можно вводить в сочетании с одним или более противораковыми агентами или цитотоксическими соединениями, как описано здесь и как известно в данной области техники, одним или более дополнительными агентами для снижения возникновения и/или тяжести неблагоприятных реакций и/или их проявлений, хирургической операцией (например, для удаления опухоли или лимфатических узлов и т.д.) или облучением. Когда одна или более хирургических операций или облучение составляют часть схемы лечения, композиции можно вводить до, одновременно или после рентгенотерапии или хирургической операции. Сходным образом, композиции и их составы, как описано здесь, можно вводить до, одновременно или после введения одного или более противораковых агентов. Липосомы направленного действия и их составы, описанные здесь, также можно вводить в сочетании (например, до, одновременно или после) с лекарственными веществами для облегчения симптомов, связанных с состоянием или схемой лечения (например, лекарственными веществами для подавления рвоты, выпадения волос, иммуносупрессии, диареи, сыпи, нарушения чувствительности, анемии, усталости, стоматита, синдрома рука-нога и т.д.). Липосомы направленного действия можно также вводить более чем на одной стадии (включая на протяжении) схемы лечения (например, после хирургической операции вместе или после рентгенотерапии и т.д.).
Содержащие меченое соединение композиции, включая описанные здесь составы, могут быть использованы отдельно или в сочетании (например, до, одновременно или после) со способами лечения (например, дополнительной терапией рака, лечением сочетанными способами). Например, композиции можно использовать для отслеживания успешности лечения. Например, для определения того, выявляется ли подлежащее лечению состояние до, после или одновременно со схемой лечения (как описано выше в отношении способов лечения).
В некоторых воплощениях композиции вводят до или после хирургической операции (например, удаления опухоли или лимфатических узлов и т.д.). В других воплощениях композиции вводят после хирургической операции и до, одновременно или после рентгенотерапии. Оптимальное сочетание одного или более из хирургической операции и/или рентгенотерапии в сочетании с введением описанных здесь композиций и необязательно одним или более химиотерапевтическими агентами может быть определено лечащим врачом, исходя из конкретного случая и принимая во внимания различные факторы, оказывающие влияние на конкретного индивидуума, включая те, которые описаны здесь.
В некоторых воплощениях содержащие лекарственное вещество композиции или фармацевтические составы можно вводить в сочетании с одним или обоими из 5-фтоурацила и/или лейковорина. В других воплощениях содержащую лекарственное вещество композицию или фармацевтические составы можно вводить в сочетании с одним или более другими противораковыми лекарственными веществами, такими как капецитабин, UFT/LV тегафур-урацил и лейковорин, иринотекан, антитело против EGFR (например, цетуксимаб и т.д.), антитело против VEGF (например, авастин и т.д.), ингибитор тирозинкиназы (например, эрлотиниб) и т.д. Такое введение может также сочетаться со схемой лечения, включающей рентгенотерапию и/или хирургическую операцию. В некоторых воплощениях заключенным в липосому направленного действия лекарственным веществом является оксалиплатин.
В связи с описанными здесь способами применения содержащие липид композиции или фармацевтические составы настоящего изобретения можно вводить парентерально. Парентеральное введение можно производить путем болюсной инъекции (в/в), инфузии (в/в), внутрибрюшинной инъекции или посредством местной инъекции (такой как внутричерепная инъекция). В некоторых воплощениях введение производится посредством болюсной инъекции или продолжительной инфузии.
Продолжительная внутривенная инфузия может продолжаться на протяжении минут или часов. Например, но не ограничиваясь этим, от приблизительно 10 минут до приблизительно 5 часов, от приблизительно 15 минут до приблизительно 4 часов, от приблизительно 30 минут до приблизительно 4 часов, от приблизительно 45 минут до приблизительно 4 часов, от приблизительно 60 минут до приблизительно 4 часов, от приблизительно 45 минут до приблизительно 3 часов, от приблизительно 60 минут до приблизительно 2 часов, от приблизительно 90 минут до приблизительно 3 часов, от приблизительно 90 минут до приблизительно 2 часов, приблизительно 10 минут, приблизительно 15 минут, приблизительно 20 минут, приблизительно 30 минут, приблизительно 45 минут, приблизительно 50 минут, приблизительно 60 минут, 80 минут, приблизительно 1,5 часа, приблизительно 2 часа, приблизительно 2,5 часа, приблизительно 3 часа, приблизительно 3,5 часа, приблизительно 4 часа, приблизительно 5 часов, приблизительно 12 часов, приблизительно 24 часа, приблизительно 36 часов или приблизительно 48 часов.
Состав и дозировка
Как упоминалось выше, содержащие липид композиции и фармацевтические составы, как описано здесь, можно вводить нуждающимся в этом индивидуумам для лечения или диагностики описанных здесь состояний в связи с описанными здесь способами применения.
Описанные здесь содержащие липид композиции и, в частности, описанные здесь липосомы направленного действия обычно должны применяться в количестве, эффективном для достижения желаемого результата, например, в количестве, эффективном для лечения или профилактики подлежащего лечению конкретного состояния. Композицию(и) можно вводить терапевтически для достижения лечебного действия. Лечебное действие означает подавление или облегчение подвергаемого лечению основного нарушения и/или подавление или облегчение одного или более симптомов, связанных с основным заболеванием, в результате чего больной сообщает об улучшении самочувствия или состояния, несмотря на то, что больной может страдать от основного заболевания. Терапевтическое действие также включает остановку или замедление прогрессии заболевания, независимо от того, имеет ли место улучшение.
В некоторых воплощениях, когда подлежащим лечению состоянием является рак, эффективным количеством является количество, достаточное для снижения опухолевого роста (например, измеряемого по скорости увеличения среднего объема опухоли до и/или после лечения). В некоторых воплощениях эффективным количеством является количество, достаточное для снижения среднего объема опухоли (например, когда средний объем опухоли после лечения снижается по сравнению со средним объемом опухоли до лечения).
Количество композиций, вводимых для введения эффективного количества инкапсулированного лекарственного вещества (например, оксалиплатина), должно зависеть от множества факторов, включая, например, подлежащее лечению конкретное состояние, способ введения, тяжесть подлежащего лечению состояния, возраста и массы больного, биологической доступности композиции, ожидаемых неблагоприятных эффектов у подлежащего лечению индивидуума и т.д. Определение эффективной дозы также находится в компетенции специалистов в данной области техники в свете предлагаемых здесь указаний.
В некоторых воплощениях доза инкапсулированного оксалиплатина в конкретный момент времени должна находиться в диапазоне от приблизительно 1 до приблизительно 400 мг/м2/день. Например, в диапазоне от приблизительно 1 до приблизительно 350 мг/м2/день, от 1 до приблизительно 300 мг/м2/день, от 1 до приблизительно 250 мг/м2/день, от 1 до приблизительно 200 мг/м2/день, от 1 до приблизительно 150 мг/м2/день, от 1 до приблизительно 100 мг/м2/день, от приблизительно 5 до приблизительно 80 мг/м2/день, от приблизительно 5 до приблизительно 70 мг/м2/день, от приблизительно 5 до приблизительно 60 мг/м2/день, от приблизительно 5 до приблизительно 50 мг/м2/день, от приблизительно 5 до приблизительно 40 мг/м2/день, от приблизительно 5 до приблизительно 20 мг/м2/день, от приблизительно 10 до приблизительно 80 мг/м2/день, от приблизительно 10 до приблизительно 70 мг/м2/день, от приблизительно 10 до приблизительно 60 мг/м2/день, от приблизительно 10 до приблизительно 50 мг/м2/день, от приблизительно 10 до приблизительно 40 мг/м2/день, от приблизительно 10 до приблизительно 20 мг/м2/день, от приблизительно 20 до приблизительно 40 мг/м2/день, от приблизительно 20 до приблизительно 50 мг/м2/день, от приблизительно 20 до приблизительно 90 мг/м2/день, от приблизительно 30 до приблизительно 80 мг/м2/день, от приблизительно 40 до приблизительно 90 мг/м2/день, от приблизительно 40 до приблизительно 100 мг/м2/день, от приблизительно 80 до приблизительно 150 мг/м2/день, от приблизительно 80 до приблизительно 140 мг/м2/день, от приблизительно 80 до приблизительно 135 мг/м2/день, от приблизительно 80 до приблизительно 130 мг/м2/день, от приблизительно 80 до приблизительно 120 мг/м2/день, от приблизительно 85 до приблизительно 140 мг/м2/день, от приблизительно 85 до приблизительно 135 мг/м2/день, от приблизительно 85 до приблизительно 135 мг/м2/день, от приблизительно 85 до приблизительно 130 мг/м2/день, от приблизительно 85 до приблизительно 120 мг/м2/день. Дозы, вводимые в конкретный момент времени, могут также составлять приблизительно 130 мг/м2/день, приблизительно 120 мг/м2/день, приблизительно 100 мг/м2/день, приблизительно 90 мг/м2/день, приблизительно 85 мг/м2/день, приблизительно 80 мг/м2/день, приблизительно 70 мг/м2/день, приблизительно 60 мг/м2/день, приблизительно 50 мг/м2/день, приблизительно 40 мг/м2/день, приблизительно 30 мг/м2/день, приблизительно 20 мг/м2/день, приблизительно 15 мг/м2/день или приблизительно 10 мг/м2/день.
Вводимая доза может быть выше или ниже описанных здесь диапазонов доз, в зависимости, помимо прочих факторов, от биологической доступности композиции, устойчивости индивидуума к неблагоприятным побочным эффектам, способа введения и различных факторов, обсуждавшихся выше. Величина дозы и интервал могут быть подобраны индивидуально для обеспечения уровня композиции в плазме, достаточного для поддержания лечебного действия, в соответствии с решением лечащего врача. Опытные специалисты должны быть способны оптимизировать эффективные местные дозы без излишнего экспериментирования в свете предлагаемых здесь указаний.
Дозы могут быть также установлены при использовании животных моделей in vivo, что должно быть понятным специалистам в данной области техники.
Множественные дозы (например, непрерывные или болюсные) композиций, как описано здесь, можно также вводить нуждающимся в этом индивидуумам на протяжении часов, дней, недель или месяцев. Например, но не ограничиваясь этим, ежедневно, через день, каждые 10 дней, еженедельно, ежемесячно, два раза в неделю, три раза в неделю, два раза в месяц, три раза в месяц, четыре раза в месяц, пять раз в месяц, через месяц, каждый третий месяц, каждый четвертый месяц и т.д.
Наборы
Предлагаются также наборы для введения описанных здесь композиций, включая фармацевтические составы, включающие композиции.
В некоторых воплощениях наборы могут включать единицу дозы (например, применяемой для терапии или диагностики), по меньше мере, одной содержащей липид композиции или ее фармацевтического состава, как раскрыто здесь. Наборы могут дополнительно включать подходящую упаковку и/или инструкции по применению композиции. Наборы могут также включать средства доставки композиции или ее фармацевтического состава, такие как шприц для инъекции или другое устройство, как описано здесь и известно специалистам в данной области техники.
В некоторых воплощениях наборы могут включать единицу дозы (например, применяемой для терапии или диагностики) ненагруженной липосомы или ее фармацевтического состава, как раскрыто здесь. Наборы могут дополнительно включать подходящую упаковку и/или инструкции по применению композиции. Наборы могут также включать средства доставки композиции или ее фармацевтического состава, такие как шприц для инъекции или другое устройство, как описано здесь и известно специалистам в данной области техники. Кроме того, в некоторых воплощениях набор может содержать отдельную единицу дозы лекарственного вещества или меченого соединения, подлежащего включению в ненагруженную липосому.
Кроме того, содержащая липид композиция или ее фармацевтический состав могут быть собраны в форме наборов. В наборе предлагается содержащая липид композиция или ее фармацевтический состав и реагенты для получения композиции для введения. Композиция может находиться в сухой лиофилизированной форме или в растворе, в частности стерильном растворе. Когда композиция находится в сухой форме, реагент может включать фармацевтически приемлемый разбавитель для получения жидкого состава. Такие разбавители включают те, которые известны специалистам в данной области техники, например, растворы сахара, например, декстрозы, сахарозы и т.д. В некоторых воплощениях растворы могут включать растворы сахара с концентрацией сахара от приблизительно 1% до приблизительно 20%, от приблизительно 1% до приблизительно 18%, от приблизительно 1% до приблизительно 15%, от приблизительно 1% до приблизительно 10%, от приблизительно 3% до приблизительно 10%, от приблизительно 3% до приблизительно 6%, приблизительно 1%, приблизительно 2%, приблизительно 3%, приблизительно 4%, приблизительно 5%, приблизительно 6%, приблизительно 7%, приблизительно 8%, приблизительно 9%, приблизительно 10%, приблизительно 12%, приблизительно 15%, приблизительно 18% или приблизительно 20%. В некоторых воплощениях раствор может представлять собой раствор декстрозы (с концентрацией декстрозы, например, приблизительно 1%, приблизительно 2%, приблизительно 5% и т.д.). В некоторых воплощениях содержащая липид композиция может представлять собой, например, липосому направленного действия, ненагруженную липосому, липидную смесь или содержащую липосому композицию (необязательно содержащую лекарственное вещество или меченое соединение).
Набор может также содержать устройство для введения или для разделения композиций, включая, но не ограничиваясь этим, шприц, пипетку или другое устройство, известное специалистам. Находящуюся в жидкой форме композицию можно хранить в ампуле или другом стерильном закрытом контейнере, включая те, которые известны специалистам в данной области техники.
Наборы могут включать другие терапевтические соединения для применения в сочетании с описанными здесь соединениями. В одном воплощении терапевтические агенты представляют собой другие противораковые агенты. Эти агенты могут предлагаться в отдельной форме или в смеси с соединениями настоящего изобретения, предлагаемые так, что такое смешивание не снижает эффективность любого из дополнительных терапевтических агентов описанных здесь композиций и составов. Сходным образом наборы могут включать дополнительные агенты для дополнительной терапии. Например, агенты для снижения неблагоприятных эффектов лекарственного вещества (например, противотошнотные агенты, агенты против облысения, иммуностимулирующие агенты и т.д.).
Наборы могут включать соответствующие инструкции по приготовлению и введению композиции, информацию о побочных эффектах композиций и другую относящуюся к делу информацию. Инструкции могут находиться в любом подходящем формате, включая, но не ограничиваясь этим, печатные материалы, видеопленку, считываемый компьютером диск или оптический диск.
В другом аспекте изобретения предлагаются наборы для лечения индивидуума, страдающего от описанных здесь состояний или восприимчивому к ним, включающие первый контейнер, включающий дозированное количество содержащей липид композиции или ее составов, как описано здесь, и инструкции по применению. Контейнер может быть любым известным в данной области техники и подходящим для хранения и доставки внутривенных составов. В некоторых воплощениях набор дополнительно включает второй контейнер, включающий фармацевтически приемлемый носитель, разбавитель, адъювант и т.д. для получения композиции, подлежащей введению индивидууму.
Могут также предлагаться наборы, которые содержат дозы раскрытых здесь композиций или составов, достаточные для обеспечения эффективного лечения индивидуума на протяжении длительного периода времени, такого как неделя, 2 недели, 3 недели, 4 недели, 6 недель, 8 недель, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев или более.
Наборы также могут включать множественные дозы содержащей липид композиции или ее составов и инструкции по применению, упакованные в количествах, достаточных для хранения и использования в аптеках, например аптеках при клиниках и рецептурных аптеках.
Все цитируемые здесь патенты, патентные заявки и публикации включены в настоящее описание в качестве ссылки во всей своей полноте.
Примеры
Настоящее изобретение дополнительно описывается со ссылкой на следующие примеры; эти примеры, однако, не ограничивают объем настоящего изобретения.
Пример 1: Тест цитотоксичности для оксалиплатина
Раствор оксалиплатина (l-OHP) получали растворением оксалиплатина в 9% растворе сахарозы (сахароза/дистиллированная вода) в концентрации 8 мг/мл. Жизнеспособность клеток определяли с помощью имеющегося в продаже набора для анализа цитотоксичности (WST-I kit, Wako Pure Chemical Industries, Ltd., Япония).
Клетки AsPC-1 (предоставленные Dr. Hironobu Yanagie из Research Center for Advanced Science and Technology, the University of Tokyo, Япония), культивированные в среде RPMI 1640 с добавлением 10% FCS (сыворотки плодов телят; SIGMA, США), обрабатывали растворами l-OHP с концентрациями [200 × (l/2)(0-10) нМ] при 37˚C в 5% CO2 в течение 48 часов. После этого среду удаляли, и добавляли субстрат (WST-I, Cell Counting Kit, Dojindo Laboratories, Япония) к клеткам, которые инкубировали при 37˚C в 5% CO2 в течение 2 часов для появления окрашенного продукта. Развившуюся окраску измеряли по поглощению при 450 нм (контрольная длина волны: 620 нм) на Immuno Mini NJ-2300 (Cosmo Bio Co., Ltd., Япония).
Результаты показаны на фиг. 6. Было обнаружено, что цитотоксичность l-OHP составляет LD50 > 8 мкг/мл.
Пример 2: Определение количества рецепторов трансферрина на клеточной поверхности
В эксперименте использовали нормальные лейкоциты человека и берущие начало от злокачественной опухоли человека клеточные линии (K562, MKN45P и HL60), полученные из следующих источников: K562:TKG0210 (Cell Resource Center for Biomedical Research, Institute of Department, Aging and Cancer, Tohoku University, Япония); MKN45P: Dr. Hisae Iinuma, Teikyo University School of Medicine, Япония; HL60:TKG0345 (Cell Resource Center for Biomedical Research, Institute of Department, Aging and Cancer, Tohoku University, Япония).
Количество рецепторов Tf (трансферрина) на поверхности каждого типа клеток определяли с помощью скэтчардовского анализа (Comp. Biochem. Physiol., 116B, 137-160 (1949), с применением Microsoft Excel). Раствор 125I-меченого Tf (Na-125I (PerkinElmer Japan Co., Ltd., Япония) и h-Tf (T-4132, SIGMA, США) соединяли йодогенным способом (Biochem. Biophys. Res. Commun., 122, 319-325 (1984)), добавляли к каждой клеточной культуре в различных концентрациях в диапазоне [300 × (1/2)(0-9) нМ] при 4˚С и инкубировали в течение 1 часа.
Концентрацию 125I-меченого Tf определяли количественным измерением белка по способу Лоури (J. Biol. Chem., 193, 265-270 (1951)), а радиоактивность измеряли с помощью гамма-счетчика (Auto Well Gamma System ARC-300, Aloka Co., Ltd., Япония). Вкратце, раствор центрифугировали для осаждения клеток, и фракцию клеток промывали охлажденным на льду ЗФР (180 × g (сила тяжести) в течение 3 мин, что повторяли 3 раза, с последующим измерением радиоактивности с помощью гамма-счетчика для определения концентрации Tf, связанного с клеточной поверхностью). Количество клеток определяли с помощью количественного измерения белка с использованием способа Лоури (J. Biol. Chem., 193, 265-270 (1951)).
Для каждой экспериментальной точки концентрацию несвязанного Tf определяли вычитанием концентрации связанного Tf из известной концентрации добавленного Tf. Скэтчардовский график получали нанесением концентрации связанного Tf по горизонтальной оси и отношения концентрации связанного Tf к концентрации несвязанного Tf по вертикальной оси. Количество связанного Tf (т.е. количества рецепторов) определяли по пересечению с осью x графика, как описано в Proc. Natl. Acad. Sci USA, 80 2263-2266 (1983); J. Cell Physiol, 132, 492-500 (1987); Proc. Natl. Acad. Sci USA, 92 3318-3322 (1995); J. Pharm. Sci, 84, 216-220 (1995); Eur. J. Biochem., 186, 367-373 (1989); J. Biol, Chem., 258, 4715-4724 (1983), которые здесь в качестве ссылки во всей своей полноте.
Количество 125I-Tf, связанного с клеточной поверхностью клеток разного типа, показано на фиг. 7. Было выявлено, что количество рецепторов трансферрина (Tf) на клеточной поверхности линий клеток, берущих начало от злокачественных опухолей человека, значительно выше, чем на нормальных лейкоцитах.
Пример 3: Получение NHS-NG-DOPE
200 мг NG-DOPE (Avanti Polar Lipids, Inc., США) (Кат. №. 870242, м.м. 880,13) отвешивали в конический сосуд с 2 выводами. В сосуд добавляли 39,2 мг NHS (Sigma, США, м.м. = 115,09). Затем добавляли 5 мл смеси хлороформ/этилацетат (1:1(об./об.), Wako Pure Chemical Industries, Ltd., Япония) и перемешивали вращением для начала растворения NG-DOPE и NHS. Наблюдалось легкое помутнение.
После первоначального перемешивания добавляли палочковую мешалку, сосуд слегка продували газообразным азотом (из заполненного газообразным азотом баллона) через один из выводов сосуда и закрывали резиновой пробкой. Перемешивание в атмосфере азота производили с применением палочковой мешалки и магнитной мешалки. Второй вывод был закрыт пробиркой. Реакцию проводили при комнатной температуре (20-23ºС). Смесь перемешивали в течение 5-10 минут. Отбирали 20 мкл образец реакционной смеси липид + NHS для использования в качестве контроля при ТСХ.
В отдельном сосуде получали раствор DCC (99%, Aldrich, США, м.м.: 206,33 г/моль) путем растворения 70 мг DCC в 5 мл этилацетата. DCC растворялся в растворителе быстро с образованием прозрачного раствора. Полученный таким образом раствор DCC (приблизительно 5 мл) затем по каплям добавляли к реакционной смеси липид/NHS в течение 10-15-минут. После добавления DCC реакционная смесь становилась более мутной.
ТСХ проводили с контролем (липид/NHS) и аликвотой липид/NHS/DCC в момент времени 0 в качестве реперов следующим образом. Образец 50 мкг (2,5 мкл раствора 20 мг/мл) наносили на пластину для ТСХ (алюминиевая пластина - силикагель 60F254 от EM Science (Gibbstown, NJ, США) кат. №. SP05554M), сушили и затем помещали в проявочную камеру, в которой растворитель (смесь 70% хлороформа, 28% метанола, 2% воды) мог двигаться. Отмечали фронт растворителя, и затем пластину ТСХ погружали в молибдат аммония (5% молибдат аммония в 10% H2SO4) и дегидратировали с помощью сушильного аппарата.
Реакционную смесь липид/NHS/DCC перемешивали под струей азота, и образование продукта (Rf 0,3-0,4) отслеживали во времени.
Через 18 часов превращение в NHS-NG-DOPE не было полным, и добавляли дополнительное количество NHS (26 мг в 2 мл этилацетата) и DCC (47 мг в 1 мл этилацетата). Ход реакции вновь тестировали с помощью ТСХ в момент времени 20 час.
Реакции давали пройти на протяжении выходных дней при температуре окружающей среды при продувании азотом и перемешивании (при защите от света). Перед очисткой оставалось некоторое количество исходного вещества.
Очистка: Реакционную смесь охлаждали на льду на протяжении ~30 минут. Охлажденную реакционную смесь затем фильтровали через бюхнеровскую воронку и затем промывали 3 раза 2×5 мл хлороформа. Всю полученную жидкость собирали и сушили на роторном испарителе. После выпаривания была получена полутвердая паста. Пасту затем ресуспендировали в 2-3 мл хлороформа.
Очистку суспендированной пасты на силикагеле проводили с помощью 4 г диоксида кремния (400 меш), увлажненного хлороформом. Силикагель упаковывали в колонку 1 см × 28 см с запорным краном. Приблизительный размер слоя составлял 1 см × 14 см. Колонку уравновешивали хлороформом (упаковка под действием силы тяжести).
Образец наносили на уравновешенную (но не высушенную) колонку силикагеля. В колонку добавляли 10 мл хлороформа (5×2 мл). Собирали фракции 5×2 мл. Скорость тока определялась силой тяжести, но фракции 5×10 мл были собраны в течение 10-20 мин и обозначены как фракции 1-5.
Затем на колонку наносили 50 мл (5×10 мл) смеси хлороформ/метанол (90/10, об./об.). Собирали фракции 5×10 мл, которые были обозначены как фракции 6-10.
После сбора фракций 6-10 на колонку наносили смесь хлороформ/метанол (5/1, (об./об.)) объемом 100 мл (10×10 мл). Собирали дополнительные фракции 10×10 мл, которые были обозначены как фракции 11-15.
Фракции 6-15 (5 мкл аликвоты) анализировали с помощью ТСХ, как описано выше.
После ТСХ фракций 6-15 фракции 7-11 объединяли и сушили до тонкой пленки с помощью роторного испарителя. Конечный продукт, полученный после упаривания, имел массу 130 мг (выход 65%), как это было определено с помощью ТСХ при сравнении с неочищенным продуктом реакции и сравнения со стандартным продуктом (NHS-NG-DOPE), полученным от NOF (Япония).
Пример 4: Получение NHS-NG-DOPE
Предварительно полученные и очищенные NG-DOPE (200 мг) (NOF Corporation Japan) и NHS (N-гидроксисульфосукцинимид; 34 мг) отвешивали и помещали в 5 мл конический сосуд с 2 отверстиями. Одно отверстие закрывали резиновой пробкой, и через оставшееся отверстие добавляли палочковую мешалку.
Сосуд затем помещали в вакуум и осторожно заполняли струей газообразного азота (повторяли три раза). Сосуд затем оставляли в атмосфере азота при применении баллона с азотом.
После помещения в атмосферу азота в сосуд добавляли 2,5 мл безводного хлороформа и перемешивали с помощью палочковой мешалки и магнитной мешалки. Реакцию проводили при температуре окружающей среды в течение приблизительно 30 минут, и для растворения исходных веществ использовали вращение. Отбирали 20 мкл образец смеси липид + NHS для использования в контроле/мониторинге реакции с помощью ТСХ.
Затем получали раствор растворением 61 мг DCC (1,3-дициклогексилкарбодиимида) в 2,5 мл безводного хлороформа (быстро образуется прозрачный раствор). Раствор DCC по каплям добавляли к смеси липид/NHS на протяжении 15 минут. После добавления DCC раствор мутнел.
В момент 0 проводили ТСХ (70% хлороформ, 30% метанол, 5% вода) смеси липид/NHS и липид/NHS/DCC для отслеживания реакции путем нанесения 50 мг хлороформа на пластину для ТСХ, просушивания и помещения в реакционную камеру (70% хлороформ, 30% метанол, 5% вода) для перемещения.
Реакционную смесь продолжали перемешивать под струей азота, и образование продукта (Rf 0,3-0,4) отслеживали во времени.
Реакции давали проходить на протяжении 2-3 дней при температуре окружающей среды при продувании азотом и перемешивании.
Реакционную смесь затем фильтровали через бюхнеровскую воронку и промывали дважды 2×5 мл хлороформа. Весь раствор собирали и сушили на роторном испарителе. Была получена полутвердая паста.
Полутвердую пасту ресуспендировали в 2×3 мл хлороформа и затем фильтровали и высушивали. Данную процедуру повторяли три раза. Наконец после трех раз продукт ресуспендировали в 2×3 мл хлороформа.
Колонку силикагеля получали смешиванием диоксида кремния с хлороформом с последующей упаковкой в колонку 1 см × 28 см с запорным краном. Приблизительный размер слоя колонки составлял 1 см × 14 см. Колонку уравновешивали хлороформом (упаковка под действием силы тяжести).
Образцы наносили на уравновешенную (но не высушенную) колонку силикагеля. Затем на колонку наносили 100 мл хлороформа, и собирали аликвоты в 100 мл фракциях. Скорость потока определялась силой тяжести (фракция 1).
Фракция 1. На колонку наносили 100 мл смеси хлороформ/метанол (90/10, об./об.). Собирали 100 мл фракции (фракция 2).
На колонку наносили 200 мл (20×10 мл) смеси хлороформ/метанол (50/10, об./об.). Собирали 20×10 мл фракции (фракции 3-23).
Фракции с 1 по 23 анализировали с использованием аликвот 5 мл посредством ТСХ.
Фракции с 9 по 22 объединяли и высушивали до тонкой пленки с помощью роторного испарителя и лиофилизирования. Конечная масса NHS-NG-DOPE из этих фракций составила 61,9 мг (выход 27,9%).
Пример 5: Получение липидной смеси (NG-DOPE:Tf-NG-DOPE:DMPC:CH)
583 мг DMPC (NOF corporation, Япония), 299 мг холестерина (Wako Pure Chemical Industries, Ltd., Япония) и 75,7 мг NG-DOPE (NOF corporation, Япония) смешивали и растворяли в t-BuOH (10 масс./об. по отношению к липидам (10 мл)) при 45-50°С.
Полученный раствор выливали в сосуд и замораживали приблизительно на 8 часов на полке при -40°С. Давление снижали до приблизительно 0,1 мм рт. ст. и сосуд оставляли при пониженном давлении в течение 2 дней при ступенчатом повышении температуры от -40°С до 25°С, и в результате этого процесса была получена лиофилизованная липидная смесь.
Полученный, как описано выше, порошок лиофилизованной липидной смеси смешивали с 20 мг порошкообразного Tf-NG-DOPE (полученного как в примере 29) и перемалывали. Таким образом был получен однородный порошок липидной смеси с соотношением липидов 50:45:5 (DMPC:Chol:NG-DOPE+Tf-NG-DOPE).
Пример 6: Получение содержащих липосому композиций
Липидные смеси получали согласно предшествующим примерам с компонентами, представленными ниже:
Партия 1: DMPC/Chol/NG-DOPE (155 мг/79,4 мг/16,1 мг)
Партия 2: DMPC/Chol/NG-DOPE (155 мг/79,4 мг/l6,l мг)
Партия 3: DMPC/Chol/NG-DOPE/NHS-NG-DOPE (l52 мг/77,9 мг/15,8 мг/4,38 мг)
Партия 4: DMPC/Chol/NG-DOPE/NHS-NG-DOPE (152 мг/77,9 мг/15,8 мг/4,38 мг)
Партия 5: DMPC/Chol/NG-DOPE/Tf-NG-DOPE (148 мг/76,0 мг/15,4 мг/4,8 мг)
Партия 6: DMPC/Chol/NG-DOPE/Tf-NG-DOPE (148 мг/76,0 мг/15,4 мг/4,8 мг)
Каждую из партий 1, 3 и 5 гидратировали и перемешивали с 300 мМ водным раствором сахарозы (20 об./масс. по отношению к липидам (5 мл)(5 мл раствора сахарозы (20 об./масс.) добавляли к сухой липидной смеси и перемешивали) в течение 30 мин при 40-45°С. Каждую из партий 2, 4 и 6 гидратировали и перемешивали с водным раствором l-OHP (8 мг l-OHP/мл, (20 об./масс. по отношению к липидам (5 мл) в 300 мМ растворе сахарозы в течение 30 мин при 40-45°С. Таким образом была получена содержащая липосому смесь.
Диаметр липосомы определяли с помощью QELS, и результаты представлены на фиг.8. Липосомы, находящиеся в содержащей липосому смеси, имеют средний диаметр 500-2000 нм и имеют широкое распределение размеров в области 100-10000 нм.
Пример 7: Получение содержащей оксалиплатин липосомы (NG-DOPE:Tf-NG-DOPE:DMPC:CH)
Композиция липосомы была следующей:
Димиристоилфосфатидилхолин (1,2-димиристоил-sn-глицеро-3-фосфохолин: DMPC) (NOF Corporation, Япония)
Холестерин (CH) (Solvay Pharmaceuticals B.V., Нидерланды)
N-глутарилдиолеилфосфатидилэтаноламин (N-глутарил-1,2-диолеил-sn-глицеро-3-фосфоэтаноламин, натриевая соль: DOPE-CO- (CH2)3-COOH, обозначаемая здесь далее как NG-DOPE) (NOF Corporation, Япония)
Succ-N-глутарилдиолеилфосфатидилэтаноламин (N-(сукцинимидилглутарил)-1,2-диолеил-sn-глицеро-3-фосфоэтаноламин, натриевая соль: DOPE-CO-(CH2)3-CO-OSu; обозначаемая здесь далее как NHS-NG-DOPE) (NOF Corporation, Япония)
DMPC:CH:NG-DOPE:NHS-NG-DOPE = 50:45:4:1 (m/m).
В качестве водной фазы использовали водный раствор l-OHP (8 мг/мл в 300 мМ растворе сахарозы).
Смесь DMPC, CH, NG-DOPE и NHS-NG-DOPE (при молярном соотношении 50:45:4:1) растворяли в 4 об./масс. (по отношению к общей массе липидов) горячего растворителя, представляющего собой смесь этанол/трет-бутанол/вода. Липидный раствор вводили в 300 мМ раствор сахарозы, содержащий приблизительно 8 мг/мл l-OHP при приблизительно 45˚С, так что концентрация растворителя становилась равной приблизительно 14% об./об.
Суспензию пропускали через экструдер, закрытый пятью кусочками фильтра 100 нм (Кат. № 112105, Whatman plc, Великобритания) при давлении приблизительно 200-800 фунт на кв. дюйм при приблизительно 45°С. Таким образом была получена липосома, имеющая средний диаметр около 100 нм. Диаметр липосомы определяли с помощью QELS.
6 л забуференного фосфатом физиологического раствора (pH 7,9), 6 л раствора трансферрина (Кат. №. 4455, Selorogicals, GA, США) и 18 л суспензии липосомы смешивали и перемешивали при 30˚С в течение 15-60 мин. Это дало реакционную смесь, содержавшую 4 мг/мл трансферрина и 20 мг/мл липидов.
Количественный анализ трансферрина проводили с помощью тестов с бицинхоновой кислотой (ВСА) в соответствии с инструкциями, предоставленными продавцом.
Увеличение молекулярной массы после включения трансферрина исследовали с помощью ДДС-Na-ПАГЭ (электрофореза в полиакриламидном геле с додецилсульфатом натрия). Анализ NG-DOPE проводили с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) с испарительным детектором рассеяния света (ELSD2000, Alltech, MD, США) с использованием колонки силикагеля (YMC PVA Silica Column, 4,6×250 мм, 5 мкм).
Пример 8: Получение содержащей оксалиплатин липосомы (NG-DSPE:Tf-NG-DSPE:DSPC:СН)
Композиция липосомы была следующей:
Дистеароилфосфатидилхолин (1,2-дистеароил-sn-глицеро-3-фосфохолин: DSPC)
Холестерин (СН)
N-глутарилдистеароилфосфатидилэтаноламин (N-глутарил-1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин, натриевая соль: DSPE-(СН2)3-СООН, обозначаемая здесь далее как NG-DSPE)
DSPC:СН:NG-DSPE=2:1:0,2 (моль/моль).
В качестве водной фазы использовали водный раствор l-ОНР (8 мг/мл в 9% растворе сахарозы), как описано в примере 1.
Смесь DSPC (МС8080, NOF, Япония), холестерина (038-03005, Wako Pure Chemical Industries, Ltd., Япония) и NG-DSPE (Dr. Kazuo Maruyama, Teikyo University, Faculty of Pharmaceutical Sciences, Япония) в соотношении 2:1:0,2 (м/м) растворяли в хлороформе и изопропиловом спирте.
К полученному раствору добавляли раствор l-OHP (в 9% растворе сахарозы), и затем полученную смесь обрабатывали ультразвуком в течение приблизительно 15-30 минут. Раствор затем упаривали с помощью роторного испарителя при 60°С для удаления растворителя и замораживали/размораживали пять раз. Суспензию замораживали (погружением в баню с сухим льдом/ацетоном) и оттаивали (погружением в теплую воду). Это повторяли пять раз.
Затем полученный продукт сортировали по размеру при 60°С с помощью фильтров для экструдера (дважды при 400 нм и затем пять раз при 100 нм) (LipexTM Extruder, Model No. T-001, Northern Lipids Inc., Канада) и ультрацентрифугировали (200000×g, 60 мин, приблизительно 4°С). Осадок ресуспендировали в 9% растворе сахарозы или буфере MES (pH 5,5) (MES buffer. Кат. № 345-01625, Dojindo Laboratories, Япония) с получением заключающей в себе l-OHP липосомы NG-DSPE:DSPC:CH.
Затем заключающую в себе l-OHP липосому NG-DSPE:DSPC:CH модифицировали трансферрином (Tf). К полученной таким образом заключающей в себе l-OHP липосоме NG-DSPE добавляли l-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид (EDC; Кат. № #22980, Pierce Biotechnology, Inc., США) (в количестве, составляющем 2,7% от массы липида) и N-гидроксисульфосукцинимид (S-NHS; 038-0432, Wako Pure Chemical Industries, Ltd., Япония) (в количестве, составляющем 7,3% от массы липида), и смесь оставляли при комнатной температуре на 10 минут.
Затем к полученному раствору добавляли трансферрин (Tf) в количестве, составляющем приблизительно 20% от массы липида (Кат. № T4132, SIGMA, США), и перемешивали при комнатной температуре в течение 3 часов. Добавляли раствор трансферрина (Tf) (в количестве, составляющем приблизительно 20% от суммарного объема реакционной смеси) в 1 мМ ЗФР (забуференном фосфатом физиологическом растворе) и 1 мМ ЗФР (в количестве, составляющем приблизительно 20% от суммарного объема реакционной смеси), и полученный раствор перемешивали при комнатной температуре в течение 1 часа.
К полученной таким образом суспензии апо-формы липосомы Tf-NG-DSPE добавляли 10-40 экв. (по отношению к трансферрину) цитрата железа-цитрата натрия (Wako Pure Chemical Industries, Ltd., Япония) и перемешивали при комнатной температуре в течение 15 минут. Полученный раствор подвергали ультрафильтрации, как описано выше. Осадок затем ресуспендировали в 9% растворе сахарозы с получением тем самым холо-формы липосомы Tf-NG-DSPE. Раствор подвергали ультрафильтрации (200000 × g, 60 мин, приблизительно 4°С), и затем осадок ресуспендировали в 9% растворе сахарозы.
Количественный анализ трансферрина проводили с помощью тестов с бицинхоновой кислотой (BCA), выполненных в соответствии с инструкцией продавца (Кат. № 23227, BCATM Protein Assay Kit, Pierce Biotechnology, Inc., США).
Увеличение молекулярной массы после модификации исследовали с помощью ДДС-Na-ПАГЭ (электрофореза в полиакриламидном геле с додецилсульфатом натрия). Анализ NG-DSPE проводили с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) с испарительным детектором рассеяния света (ELSD2000, Alltech, MD, США) с использованием колонки силикагеля (YMC PVA Silica Column, 4,6 × 250 мм, 5 мкм).
Пример 9: Получение PEGилированных содержащих оксалиплатин липосом
В соответствии с протоколом эксперимента в примере 8 были получены липосомы DSPC:холестерин:DSPE-PEG(2K)-OMe:DSPE-PEG(3.4K)-COOH (Tf-PEG-липосомы). В этих липосомах соотношение компонентов было следующим: DSPC:холестерин:DSPE-PEG(2K)-OMe:DSPE-PEG(3.4K)-COOH=2:1:0,16:0,03.
Данная липосома содержала 6 моль% ПЭГ-липида и 1 моль% ПЭГ-COOH-липида, и Tf присоединен к липосоме через ПЭГ-COOH.
Способом примера 8 были также получены липосомы Tf/PEG-DSPE (Tf/PEG-NG-DSPE липосомы).
В этих липосомах соотношение компонентов было следующим: DSPC:холестерин:DSPE-PEG(2K)-OMe:NG-DSPE=2:1:0,16:0,03.
Данная липосома модифицирована ПЭГ, и Tf присоединен к липосоме через NG-DSPE. Производные ПЭГ липосомы можно также получить способами, описанными в патентных заявках США, публикации Nos. 2003/0224037 и 2004/0022842, раскрытие которых включено сюда во всей их полноте.
Пример 10: Получение ненагруженной липосомы
Смесь DMPC, Chol (Wako Pure Chemical Industries, Ltd., Япония), NG-DOPE (NOF Corporation, Япония) и NHS-NG-DOPE (NOF Corporation, Япония) (в молярном соотношении 50:45:4:1; 410 г DMPC, 211 г Chol, 43 г NG-DOPE и 12 г of NHS-NG-DOPE, соответственно) растворяли в 4 об./масс. (по отношению к общей массе липида) теплого растворителя этанол/трет-бутанол/вода. Полученную суспензию объемом 20 л инкубировали при 45°С при перемешивании и пропускали через экструдер (Stevested Machinery & Engineering Ltd., Канада), который был накрыт пятью слоями поликарбонатных 100 нм фильтров (Кат. № 112105, Whatman plc, Великобритания) при давлении приблизительно 200-800 фунт на кв. дюйм при приблизительно 45°С. Таким образом были получены липосомы, имеющие средний диаметр около 100 нм. Диаметр липосомы определяли с помощью QELS.
Суспензию липосомы, ЗФР буфер (pH 7,9) и раствор в ЗФР трансферрина (Кат. № 4455, Selorogicals, GA, США) (pH 7,0) смешивали в соотношении 3:1:1 (об./об.), затем перемешивали в течение 15-60 мин при 30°С. Таким образом было получено приблизительно 6 л ненагруженной липосомы.
20 г (приблизительно 19 мл) раствора липосомы вносили в сосуд и замораживали приблизительно на 8 часов на полке при -40°С. Давление снижали до приблизительно 0,1 мм рт. ст. и сосуд оставляли при пониженном давлении в течение 2 дней при ступенчатом повышении температуры от -40°С до 25°С на протяжении 2-дневного периода. По окончании этого процесса было получено приблизительно 3,5 г лиофилизованной ненагруженной липосомы. Липосомы затем хранили при 4°С.
Пример 11: Включение оксалиплатина в заранее полученную ненагруженную липосому
Водный раствор l-OHP (8 мг/мл в 300 мМ растворе сахарозы) добавляли к приблизительно 3,5 г лиофилизованной ненагруженной липосоме и повторно гидратировали перемешиванием в течение 2 часов при 40°С. После перемешивания липосомный l-OHP отделяли от свободного l-OHP фракционированием с помощью Сефадекса G-25 (Ø1×45 см). Липосомный l-OHP и свободный l-OHP отслеживали по VIS 600 нм и УФ 210 нм соответственно.
Измеряли количество l-OHP и холестерина. Концентрацию l-OHP рассчитывали для случая конденсирования липосомной фракции по отношению к исходной концентрации холестерина, и, наконец, выход l-OHP определяли путем сравнения концентрации l-OHP липосомы и исходной концентрации l-OHP.
Общая концентрация l-OHP для случая конденсирования липосомной фракции по отношению к исходной концентрации холестерина составляла 210 мкг/мл. И выход l-OHP равнялся 2,6%.
Это означает, что 210 мкг/мл l-OHP было инкапсулировано в лиофилизованную ненагруженную липосому.
Пример 12: Сравнение уровней липосомы в крови и органах
Было проведено сравнительное исследование для оценки задержки в крови и аккумуляции в органах, заключающих в себе l-OHP Tf-модифицированных липосомных композиций у мышей-носителей опухоли. В качестве животных моделей использовали самцов мышей линии BALB/c в возрасте 5 недель, а в качестве опухолевых клеток использовали клетки Colon 26 (берущие начало от рака ободочной кишки мыши). Клетки были получены от Laboratory of Biopharmaceutics, Teikyo University School of Pharmaceutical Sciences, Япония.
Клетки Colon 26 (2×106 клеток), дополнительно культивированные in vitro, имплантировали подкожно в область спины мыши. В качестве мыши-носителя опухоли ободочной кишки использовали мышь с опухолью диаметром приблизительно от 8 до 10 мм (в среднем после роста в течение от 8 до 10 дней). В хвостовую вену вводили раствор каждой из липосом, полученных в примерах 5 и 6, или l-OHP (8 мг/мл в 9% растворе сахарозы). В каждом случае концентрацию оксалиплатина доводили до 5 мг l-OHP/кг массы тела. В качестве липосом использовали липосому Tf-NG-DSPE ((<); пример 5), липосому Tf/PEG-NG-DSPE ((▲); пример 6) и липосому Tf-PEG-DSPE ((♦); пример 6).
Кровь, плазму, печень, селезенку, почку, сердце, легкое и опухолевые ткани изымали у 3 мышей каждой группы для каждой временной точки через 1, 3, 6, 24, 48 и 72 часа после введения. Концентрацию Pt в крови, каждом органе и опухолевых тканях определяли с помощью атомной абсорбции (AA), а концентрацию l-OHP рассчитывали и представляли в виде отношения (%) к дозе. Концентрации в крови показаны на фиг. 9.
Липосома Tf-NG-DSPE показала по существу такую же задержку в крови до 3 часов после введения, что и липосома Tf-PEG-DSPE, и липосома Tf/PEG-NG-DSPE. Однако после 6 часов липосома Tf-NG-DSPE показала некоторую задержку в крови, но исчезала из крови быстрее, чем липосомы PEG. Концентрации в опухолевых тканях показаны на фиг. 10. Липосома Tf-NG-DSPE показала по существу такую же аккумуляцию в опухолевых тканях, как и липосома Tf-PEG-DSPE, и липосома Tf/PEG-DSPE, несмотря на задержку в крови в меньшей концентрации на протяжении времени.
На основании представленных выше результатов было обнаружено, что для доставки достаточной концентрации лекарственного вещества в опухолевую ткань у мыши на значительном или более высоком уровне необходима и достаточна задержка в крови в течение приблизительно 6 часов после введения. Полагают, что время задержки в крови в течение более продолжительного времени может увеличивать вероятность оказания неблагоприятного действия на нормальную ткань.
Пример 13: Получение диагностической липосомы и аккумуляция 125 I в опухолевой ткани
Липосомы получали тем же способом, что и в примере 7, за исключением того, что l-OHP был заменен [125I]-тираминилинулином (в растворе ЗФР), и были получены липосомы DMPC/CH/NG-DOPE/Tf-NG-DOPE/[125I]-тираминилинулин. Липидные компоненты получали так же, как описано в примере 7. Было получено два липосомных состава с компонентами, указанными ниже. Липосома, не содержащая Tf-NG-DOPE, служила в качестве контроля для ненаправленного распределения липосомы.
Липосома направленного действия: DMPC/CH/NG-DOPE/Tf-NG-DOPE (63,3/31,7/4/1 (м/м))
Ненаправленная липосома (контроль): DMPC/CH/NG-DOPE (63,3/31,7/5 (м/м))
125I присоединяли к тираминилинулину соединением Na-125I (PerkinElmer Japan Co., Ltd., Япония) и тираминилинулина (Dr. Kazuo Maruyama, Teikyo University, Faculty of Pharmaceutical Sciences, Япония) с помощью йодогенного способа (Biochem. Biophys. Res. Commun., 122, 319-325 (1984), включенного в качестве ссылки во всей своей полноте). Таким образом был получен 125I-тираминилинулин. Раствор 125I-тираминилинулин/ЗФР (') с концентрацией приблизительно 1 мг/мл затем инкапсулировали в липосому, как описано в примере 7.
100 мкл каждого из растворов липосомы инъецировали в хвостовую вену мыши-носителя мышиного рака ободочной кишки, описанного в примере 12. Опухолевую ткань и хвост изымали у 5 мышей каждой группы для каждой временной точки через 1, 6, 24, и 48 часов после введения. Измеряли массу опухолевой ткани, и радиоактивность (единица: имп./мин) в опухолевой ткани и хвосте измеряли с помощью гамма-счетчика (Aloka Auto Gamma System ARC-300, Япония). Результаты выражали в виде распределенного количества в опухолевой ткани (% от дозы/г опухоли) = [(величина счета в опухолевой ткани) - (величина фона)] × 100 / [(величина счета Std.) - (величина счета в хвосте)] / (масса опухолевой ткани (г)). Период полураспада радиоактивности 125I составляет приблизительно 60 дней.
Радиоактивность 100 мкл введенного раствора (стандарт: Std.) принимали за 100%, а величину счета пустой пробирки для тестирования принимали за величину фона (b.g.). Результаты показаны на фиг.11. Как видно из фиг.11, модифицированная Tf липосома показала высокую аккумуляцию в опухолевой ткани, тогда как ненаправленная липосома не показала высокой аккумуляции. Эти результаты показывают, что липосома, заключающая в себе радиоактивное соединение, пригодна для выявления опухолевой ткани.
Пример 14: Сравнение противоопухолевых эффектов липосом
Было проведено сравнительное исследование для оценки противоопухолевых эффектов у мышей-носителей рака ободочной кишки Colon 26, заключающих в себе l-OHP модифицированных Tf липосомных композиций (липосом Tf-PEG, полученных в примере 9, липосом Tf-NG-DSPE:NG-DSPE:DSPC:CH, полученных в примере 8, липосом Tf/PEG-NG-DSPE, полученных в примере 9; по 9 мышей в каждой группе) и каждой из липосомных композиций, к которым трансферрин не был присоединен ((-)TF; по 6 мышей в каждой группе).
Мышей-носителей опухоли получали тем же способом, что и в примере 12. В качестве контроля использовали раствор l-OHP (8 мг/мл в 9% растворе сахарозы). Дату, когда l-OHP вводили в дозе 5 мг/кг, определяли как дату начала, и на 4 день l-OHP вновь вводили в дозе 5 мг/кг. Размер опухоли в день 0 принимали за 1, и размер выражали в виде отношения, основанного на этом исходном размере. Размер опухоли измеряли на 0, 2, 5, 7, 10, 13, 15, 18 и 21 день, и фиксировали дни выживания.
Результаты показаны на фиг.12.
Как можно видеть на фиг.12, композиции липосом, к которым был присоединен трансферрин, проявляли ингибирующее действие на опухолевый рост. С другой стороны, композиции липосом, к которым трансферрин не был присоединен, обладали более слабым ингибирующим действием на опухолевый рост по сравнению с таковым композиций липосом, к которым трансферрин был присоединен. На основании результатов, представленных на фиг.9 и 10, было обнаружено, что для оказания ингибирующего действия на опухолевый рост и обеспечения достаточной концентрации аккумулируемого лекарственного вещества в опухолевой ткани на значительном и по существу таком же уровне необходима и достаточна задержка в крови в течение приблизительно 6 часов после введения липосомы, к которой присоединен трансферрин. Полагают, что время задержки в крови в течение более продолжительного времени может увеличивать вероятность оказания неблагоприятного действия на нормальную ткань.
Пример 15: Оптимизация содержания NG-DSPE
Для определения оптимального отношения NG-DSPE в липосоме при смешивании исследовали задержку в крови нормальных мышей NG-DSPE, в которую противораковый агент не заключали. Липосомные композиции, в которые противораковый агент не заключали, получали тем же способом, что и в примере 8, но с использованием воды вместо раствора l-OHP в качестве водной фазы, при различных количествах NG-DSPE.
Общее молярное количество всех липидных компонентов, составляющих липосому, принимали за 100%, и содержание NG-DSPE выражали в виде отношения (моль%) NG-DSPE к общей сумме липидных компонентов. Кроме того, получали липосому, содержащую 6 моль% липида MPB (MPB-DSPE) или липида PDP (PDP-DSPE) в качестве составляющего липида. Липосому MBP получают образованием липосомы путем присоединения малеимидфенилбутирата (MPB) к аминогруппе этаноламина липида и присоединения Tf к липосоме через MPB (870013(16:0), Avanti Polar Lipids, Inc, США). Липосому PDP (870205(16:0, Avanti Polar Lipids, Inc, США) получают образованием липосомы путем присоединения 2-пиридилтиопропионата (PDP) к аминогруппе этаноламина липида и присоединения Tf к липосоме через PDP.
В эксперименте использовали 105 мышей (самцы линии ICR в возрасте 6 недель) (Tokyo Laboratory Animal Science Co., Ltd., Япония). В качестве метки к тираминилинулину (полученному, как описано в примере 13) присоединяли 125I, и этот раствор инулина с концентрацией приблизительно 1 мг/мл заключали в липосому. Измеряли массу собранных крови и органов для каждого случая, и радиоактивность (единица: имп./мин) липосомного маркера измеряли с помощью гамма-счетчика (Aloka Auto Gamma System ARC-300, Япония). Кроме того, измеряли радиоактивность каждого вводимого в хвостовую вену раствора (100 мкл). Радиоактивность 100 мкл вводимого раствора (стандарт: Std) принимали за 100%, и величину (% дозы) для каждого органа выражали в виде процента. Общее количество крови принимали равным 7,3% от массы тела, и количество липосомы в крови выражали в форме количества во всей крови. Величину счета пустой пробирки для тестирования принимали за величину фона (b.g.), которую вычитали из величины счета каждого образца.
Распределенное количество в крови (%) = [(величина счета крови) - (величина b.g.)] × (масса тела мыши (г)) × 0,073 x 100/[(величина счета Std.) - (величина счета хвоста) × (масса крови (г))].
Результаты показаны на фиг.13. Что касается концентрации в крови через 6 часов, липосома NG-DSPE показала высокую задержку в крови, когда содержание липида составляет 3 моль% или более. В случае малеимид-липосомы (MPB 6%) задержка в крови была низкой.
Пример 16: Действие Tf и дикарбоновой кислоты на задержку в крови
Для исследования влияния наличия или отсутствия присоединенного к липосоме трансферрина и типа дикарбоновой кислоты (например, глутарила, сукцинила и т.д.) определяли задержку в крови липосомы с присоединенным трансферрином, в которую не заключали противораковый агент. Экспериментальный способ был таким же, как и описанный в примере 15.
Была получена липосома, содержащая фосфолипид, к которому вместо глутаровой кислоты была присоединена янтарная кислота.
NG-DSPE (глутаровая кислота) получали следующим образом. В темноте под струей газообразного азота DSPE (ME-8080, NOF Corporation, Япония) суспендировали в 10-кратном объеме безводного хлороформа по отношению к объему DSPE. Затем по каплям при комнатной температуре добавляли триэтиламин (208-02643, Wako Pure Chemical Industries, Ltd., Япония) и раствор безводной глутаровой кислоты (G0071, Tokyo Chemical Industry, Япония) в безводном хлороформе (растворенной в безводном хлороформе того же объема, что и DSPE) в количествах, равных 1,3 эквивалентам. По окончании раствору давали взаимодействовать при 30°С в течение 2 часов при перемешивании.
После этого реакционный раствор промывали 3 раза ацетатным буфером (pH 4,5), и органический слой дегидратировали сульфатом магния и фильтровали фильтрацией с отсосом с помощью водоструйного насоса. После этого фильтрат концентрировали при пониженном давлении при 30°С. Когда он становился маслянистым (при объеме, равном приблизительно 2 объемам DSPE), добавляли метанол для образования кристаллов и затем фильтровали. Это вновь растворяли в хлороформе, и данную процедуру повторяли дважды. Затем кристаллы сушили при пониженном давлении при комнатной температуре, в результате чего был получен целевой продукт в виде белых кристаллов. Липосому NG-DSPE получали тем же способом, что и в примере 8.
Результаты показаны на фиг.14. Липосома, к которой трансферрин присоединен через дикарбоновую кислоту (NG-DSPE:N-глутарилдистеароилфосфатидилэтаноламин, NG-DSPE:N-сукцинилдистеароилфосфатидилэтаноламин), проявляет высокую задержку в крови. Однако в случае липосомы, к которой трансферрин присоединен посредством S-S связи с помощью малеимида (MPB), задержка в крови была низкой, даже несмотря на то, что к ней был присоединен тот же лиганд, трансферрин.
Пример 17: Электрофоретический анализ липосом
В качестве примера аналитических способов характеристики липосом представлен пример электрофореза. Липосому растворяли и денатурировали при 95°С в течение 5 мин в буфере для образца, содержащем 2,5% ДДС-Na и 5% 2-меркаптоэтанола. Используя полиакриламидный гель приблизительно от 7,5% до 10% (Funakoshi, Easy gel (II), precast gel, Япония), 5 мкл каждого образца наносили на гель, и электрофорез проводили при постоянном токе 20 мА в течение от 1 до 2 часов.
После электрофореза гель окрашивали серебром с помощью набора для окрашивания серебром (Wako Pure Chemical Industries, Silver Staining II Kit Wako, Япония). На фиг. 15 показаны результаты для следующих липосом: дорожка 6 (липосома трансферрин-N-глутарилдистеароилфосфатидилэтаноламин (липосома Tf-NG-DSPE)); дорожка 5 (липосома трансферрин-полиэтиленгликоль-дистеароилфосфатидилэтаноламин (липосома Tf-PEG-DSPE)). Дорожки 1-4 содержат h-apo-Tf (240 нг), h-apo-Tf (120 нг), h-apo-Tf (60 нг) и h-apo-Tf (30 нг) соответственно.
В случае примера сравнения, липосомы Tf-PEG-DSPE, из-за некоторой неоднородности молекулярной массы полиэтиленгликоля возникала усложненная картина электрофореза с несколькими полосами. В случае липосомы Tf-NG-DSPE возникала одна полоса, которую значительно проще анализировать и которая повышает возможности очистки липосомы. Данные результаты показывают, что для липосомной композиции по настоящему изобретению аналитический способ тестирования является более простым, чем для производной PEG липосомной композиции.
Пример 18: Влияние свободного PE на липосомные композиции
Для исследования влияния наличия свободного фосфатидилэтаноламина (non-NG-PE) в липосоме определяли связывающую способность Tf для липосомы Tf-NG-DSPE и липосомы, полученной добавлением дистеароилфосфатидилэтаноламина (DSPE) (в отсутствие NG). Липосому Tf-NG-DSPE получали из DSPC (64 части), CH (32 части) и NG-DSPE (4 части), а липосому Tf-NG-DSPE + DSPE получали из DSPC (64 части), CH (32 части) и NG-DSPE (4 части) и DSPE (10 частей) тем же способом, что и в примере 8.
Затем к NG-DSPE присоединяли Tf с применением NHC и ECD в количестве, равном 10 эквивалентам, и Tf в количестве, равном 0,05 эквивалента. Затем образцы липосомы в количестве, соответствующем 1 мг липида, разделяли с помощью ДДС-Na-ПАГЭ, и полосы визуализировали окраской серебром, как описано в примере 17.
Результаты показаны на фиг.16. Было обнаружено, что в случае липосомы NG-DSPE + DSPE, к которой добавляли 10 моль% DSPE, количество связанного Tf было значительно ниже такового в липосоме NG-DSPE, которая не содержала non-NG-DSPE. По-видимому, это обусловлено тем, что аминогруппа Tf и аминогруппа DSPE конкурируют между собой в реакции, при которой Tf присоединяется к карбоксильной группе NG-DSPE.
Пример 19: Сравнение уровней липосом в крови и органах
Используя протоколы, описанные в примере 12, сравнивали уровни липосом NG-DOPE:Tf-NG-DOPE:DMPC:CH (Tf-NG-DOPE:NG-DOPE) (полученных как в примере 7) и липосом Tf-PEG-DSPE (полученных как в примере 9) в крови и опухоли. Результаты по количеству липосомы, задержанной в крови, представлены на фиг. 17, а количество липосомы, выявленной в опухолях, показано на фиг. 18.
Результаты на фиг. 17 и 18 показывают, что хотя липосомы Tf-NG-DOPE:NG-DOPE проявляют меньшую аккумуляцию в крови (фиг. 17), чем липосомы Tf-PEG-DSPE, они обладали способностью доставлять большее количество оксалиплатина в опухоль (фиг. 18). Меньшая аккумуляция липосом в крови, вероятно, снижает неблагоприятные системные эффекты оксалиплатина.
Пример 20: Сравнение противоопухолевых эффектов липосом у мышей-носителей опухоли Colon 26
Используя протоколы, описанные в примере 14, сравнивали действие липосом NG-DOPE:Tf-NG-DOPE:DMPC:CH (полученных как в примере 7) и липосом Tf-PEG-DSPE (полученных как в примере 9) на опухоли толстой кишки 26 у мышей. Результаты показаны на фиг.19.
Как можно видеть на фиг.19, обе липосомы проявляют ингибирование опухолевого роста по сравнению с раствором оксалиплатина, однако, как отмечено на фиг. 19, аккумуляция меньшего количества NG-DOPE:Tf-NG-DOPE:DMPC:CH в крови (плазме) должна, видимо, означать, что эти липосомы лучше переносятся индивидуумами, которым их вводят.
Пример 21: Противоопухолевое действие липосомы на модели ксенотрансплантата HCT-116 опухоли ободочной кишки
Определяли противоопухолевую эффективность вводимых липосом NG-DOPE:Tf-NG-DOPE:DMPC:CH (полученных как в примере 7) в отношении подкожно имплантированных ксенотрансплантатов HCT-116 опухоли ободочной кишки человека. Тестирование проводили в Southern Research Institute, AL, США на самцах бестимусных мышей NCr-nu (02/A/08F17T9, Frederick Cancer Research and Development Center, MD, контрольного соединения). Противоопухолевая активность липосом NG-DOPE:Tf-NG-DOPE:DMPC:CH суммирована на фиг.20.
Липосомы NG-DOPE:Tf-NG-DOPE:DMPC:CH вводили внутривенно (в/в) на каждый четвертый день, всего четыре инъекции (q4d×4) в дозах 15 и 10 мг/кг/инъекция. Оксалиплатин вводили по той же схеме в дозе 15 мг/кг/инъекция. Контрольным группам инъецировали по той же схеме носитель (приблизительно 10,3% сахарозу) и ненагруженную липосому.
Средний объем опухоли для модели опухоли ободочной кишки HCT-116 после лечения липосомами NG-DOPE:Tf-NG-DOPE:DMPC:CH каждые 4 дня составлял 28,9% от объема контрольной опухоли для группы 15 мг/кг и 35,9% от объема контрольной опухоли для группы 10 мг/кг. Противоопухолевую активность липосом NG-DOPE:Tf-NG-DOPE:DMPC:CH также сравнивали с оксалиплатином вне липосом на модели HCT-116, где липосомы NG-DOPE:Tf-NG-DOPE:DMPC:CH показали большую эффективность в единицах относительного объема опухоли при введении 15 мг/кг (28,9% от объема контрольной опухоли) каждые 4 дня (4×). Оксалипланин вне липосомы, вводимый в дозе 15 мг/кг каждые 4 дня (4×) дал 39,3% от объема контрольной опухоли.
Пример 22: Противоопухолевое действие липосомы на модели ксенотрансплантата HT-29 опухоли ободочной кишки
Определяли противоопухолевую эффективность вводимых липосом NG-DOPE:Tf-NG-DOPE:DMPC:CH (полученных как в примере 7) в отношении подкожно имплантированных ксенотрансплантатов HT-29 опухоли ободочной кишки человека. Тестирование проводили в Panapharm Laboratories Co., Ltd., Япония на самках бестимусных мышей BALB/cA Jcl-nu (CLEA Japan, Inc., Япония; 50 мышей), и результаты суммированы на фиг. 21. Группам из 4 мышей вводили липосомы NG-DOPE:Tf-NG-DOPE:DMPC:CH в дозах 6,7, 10 или 15 мг/кг или контрольный носитель. Группы, получавшие носитель и 6,7 и 10 мг/кг, получали инъекции на 10, 14 и 19 дни, а группа, получавшая 15 мг/кг, получали инъекции на 10 и 14 дни.
Средний объем опухоли для модели опухоли ободочной кишки HT-29 после лечения липосомами NG-DOPE:Tf-NG-DOPE:DMPC:CH составлял 66,3% от объема контрольной опухоли для группы 6,7 мг/кг и 39,5% от объема контрольной опухоли для группы 10 мг/кг (величина p≤0,01).
Пример 23: Противоопухолевое действие липосомы на модели ксенотрансплантата MKN45 опухоли желудка
Определяли противоопухолевую эффективность вводимых липосом NG-DOPE:Tf-NG-DOPE:DMPC:CH (полученных как в примере 7) в отношении подкожно имплантированных ксенотрансплантатов MKN45 опухоли желудка человека. Тестирование проводили в Panapharm Laboratories Co., Ltd., Япония на самцах бестимусных мышей BALB/cA Jcl-nu (CLEA Japan, Inc., Япония; 50 мышей), и результаты суммированы на фиг.22.
Группам из 4 мышей вводили липосомы NG-DOPE:Tf-NG-DOPE:DMPC:CH в дозах 6,7, 10 или 15 мг/кг или контрольный носитель. Группы, получавшие носитель и 6,7 и 10 мг/кг, получали инъекции на 7, 12 и 24 дни, а группа, получавшая 15 мг/кг, получали инъекции на 7 и 24 дни. Средний объем опухоли для модели опухоли желудка MKN45 после лечения липосомами NG-DOPE:Tf-NG-DOPE:DMPC:CH составлял 65,4% от объема контрольной опухоли для группы 6,7 мг/кг (величина p ≤ 0,05), 49,6% от объема контрольной опухоли для группы 10 мг/кг (величина p≤0,01) и 48,5% от объема контрольной опухоли для группы 15 мг/кг (величина p≤0,01; введение каждые 17 дней).
Пример 24: Противоопухолевое действие липосомы на модели ксенотрансплантата COLO 205 опухоли ободочной кишки
Определяли противоопухолевую эффективность вводимых липосом NG-DOPE:Tf-NG-DOPE:DMPC:CH (полученных как в примере 7) в отношении подкожно имплантированных ксенотрансплантатов COLO 205 опухоли ободочной кишки человека. Тестирование проводили в Southern Research Institute, AL, США на самцах бестимусных мышей NCr-nu (01/A/09F3T8, Federic Cancer Research and Development Center, MD, США), и результаты суммированы на фиг.23.
40 мышам вводили липосомы NG-DOPE:Tf-NG-DOPE:DMPC:CH путем в/в инъекции каждые 4 дня, всего 3 инъекции (q4d×4) в дозах 10 и 5 мг/кг/инъекция. Оксалиплатин вводили в дозе 5 мг/кг/инъекция по той же схеме. Контрольная группа получала инъекции по той же схеме. Опухоли поздней стадии повторно лечили, начиная с 47 дня для всех групп.
Липосомы NG-DOPE:Tf-NG-DOPE:DMPC:CH вводили на каждый второй день, всего две инъекции в дозах 15 и 10 мг/кг/инъекция и затем лечение продолжали введением на каждый второй день, всего шесть инъекций в дозах 4 и 2 мг/кг/инъекция соответственно. Контрольную группу обрабатывали по той же схеме.
Средний объем опухоли для модели опухоли ободочной кишки COLO 205 после лечения липосомами NG-DOPE:Tf-NG-DOPE:DMPC:CH, вводимыми сначала в дозах 10 и 5 мг/кг, с последующим лечением поздней стадии опухоли, ранее подвергавшейся лечению липосомами NG-DOPE:Tf-NG-DOPE:DMPC:CH в дозах 15 и 10 мг/кг, с последующим лечением липосомами NG-DOPE:Tf-NG-DOPE:DMPC:CH в дозах 4 и 2 мг/кг при применении разных схем лечения составлял от 53,2% до 69,5% от объема контрольной опухоли (величина p≤0,05 или 0,01).
Пример 25: Инкапсулирование оксалиплатина в липосомы направленного действия
Для измерения доли оксалиплатина, инкапсулированного в липосомы NG-DOPE:Tf-NG-DOPE:DMPC:CH (Tf-NG-DOPE:NG-DOPE), полученные как в примере 7, использовали следующую процедуру.
Степень инкапсулирования определяли пропусканием аликвоты образца через вращаемую колонку 3,000 MWCO (исключаемая молекулярная масса) (3OK MWCO cellulose ultrafilter membrane column, Cat. No. 42410, Millipore Corp., США) и измерением концентрации оксалиплатина в элюате с помощью ВЭЖХ с изократическим элюированием 1% ацетонитрилом в разбавленном водном растворе фосфорной кислоты (pH 3,0).
Уровень оксалиплатина определяли после мембранной фильтрации с помощью анализа ВЭЖХ для количественного определения неинкапсулированного (свободного) лекарственного вещества. Эффективность захвата в 3 партиях, полученных как в примере 7, составляла более 98% (см. таблицу 1).
Пример 26: pH липосом направленного действия
pH липосом направленного действия можно определить помещением липосом изобретения в дистиллированную воду и измерением стандартным pH-метром, как описано ниже.
pH липосом NG-DOPE:Tf-NG-DOPE:DMPC:CH (полученных как в примере 7) определяли с помощью pH-метра (VWR Model 8000) с электродом, заполненным гелем Ag/AgCl. Величины pH для 4 партий липосом варьировали от 7,17 до 7,23, как показано в таблице 2 ниже.
Вид липосом с разными pH суммирован в таблице 3. Эти результаты показывают, что низкий pH ведет к агрегации, осаждению и выпадению в осадок, что может быть обусловлено протонированием NG-DOPE и Tf с последующей агрегацией бислоя и денатурацией трансферрина.
Пример 27: Идентификация конъюгированного трансферрина и поведение трансферрина в липосомах направленного действия при ДДС-Na-ПАГЭ
Данное исследование проводили для подтверждения конъюгации трансферрина с NG-DOPE в липосомах NG-DOPE:Tf-NG-DOPE:DMPC:CH, полученных как в примере 7. В данном способе, когда трансферрин конъюгирован с NG-DOPE, комплекс проявляет большую молекулярную массу по сравнению с неконъюгированным трансферрином.
Липосому растворяли и денатурировали при 95°C в течение 5 мин в буфере для образца, содержащем 2,5% ДДС-Na и 5% 2-меркаптоэтанола. Образцы затем наносили на 5-10% градиентный полиакриламидный гель и подвергали электрофорезу в присутствии ДДС-Na. Мигрировавшие полосы белка визуализировали с помощью G-коллоидного бриллиантового синего (B2025, SIGMA, США).
Трансферрин в липосоме выявлялся как трансферрин, конъюгированный с NG-DOPE, который проявлял большую молекулярную массу по сравнению с интактным трансферрином (см. фиг.24). Минорная полоса с меньшей молекулярной массой выявлялась как свободный трансферрин.
Отношение свободного трансферрина к трансферрину, конъюгированному с NG-DOPE, при ДДС-Na-ПАГЭ (фиг.24) рассчитывали как площадь пика с помощью программы Scion Image (имеющейся в свободном доступе по адресу ). Отношение свободного Tf к суммарному Tf липосомы NG-DOPE:Tf-NG-DOPE:DMPC:CH равнялось приблизительно 4,7%.
Пример 28: Анализ осмотического давления
Осмотическое давление при заданной температуре зависит от сахарозы и солей, таких как хлорид натрия и фосфатный буфер. Оно не зависит от растворенного вещества, но зависит от суммарной плотности ионов и размера молекул в растворе. Обычно осмотическое давление можно измерить с помощью прибора, известного как осмометр, который определяет осмотическое давление в подходящих единицах давления.
Осмотическое давление липосом NG-DOPE:Tf-NG-DOPE:DMPC:CH, полученных как в примере 7, измеряли при комнатной температуре с помощью осмометра (Vapro Vapor Pressure Osmometer Model5520, Wescor, Inc., США). Величины осмолярности для 3 препаратов липосом варьировали от 360 до 370 мОсм/кг, как показано в таблице 4.
Пример 29: Выделение Tf-NG-DOPE
900 мл EtOH добавляли к 100 мл ненагруженной липосомы (DMPC/Chol/NG-DOPE/Tf-NG-DOPE) (как получали в примере 10 до лиофилизирования) и полностью перемешивали. Смесь затем центрифугировали (9000 об/мин, 10 мин, 20°С; CFl 6RX, Hitachi Koki Co., Ltd., Япония) вновь, и был получен осадок. 100 мл EtOH добавляли к этому остатку и полностью перемешивали. Смесь вновь центрифугировали (9000 об/мин, 10 мин, 20°С; CFl 6RX, Hitachi Koki Co., Ltd., Япония), и был получен беловатый (светло-оранжевый) осадок. Этот процесс промывки повторяли еще раз.
Полученный выше осадок сушили газообразным N2 в течение 30 мин. Высушенное вещество затем растворяли в 10 мл дистиллированной воды и пропускали через стерильный фильтр (0,22 мкм) (Millipore Corp., США).
Фильтрат выливали в сосуд и замораживали в течение приблизительно 8 часов на полке при -40°С. Давление в образце снижали до приблизительно 0,1 мм рт. ст. и оставляли при пониженном давлении в течение 2 дней при ступенчатом росте температуры от -40°С до 25°С. Таким образом было получено приблизительно 444 мг Tf-NG-DOPE (содержание трансферрина составляло приблизительно 45% от ненагруженной липосомы).
Пример 30: Получение Tf-NG-DSPE
200 мкл водного раствора NHS (Wako Pure Chemical Industries, Ltd., Япония) (0,1 моль/л), 200 мкл водного раствора EDC (N-этил-N'-(3-диметиламинопропил)-карбодиимид гидрохлорид) (Tokyo Chemical Industry Co., Ltd., Япония) (0,25 моль/л) и 1 мл раствора NG-DSPE (2 ммоль/л), содержащего 2% (масс./об.) OG (н-октил-D-глюкопиранозид) (Wako Pure Chemical Industries, Ltd., Япония) в 50 ммоль/л MES буфера (рН 5,5) перемешивали и взбалтывали в течение 10 минут.
Избыток реагентов удаляли с помощью колонки сефадекса G-15 (1,5 см × 20 см, 0,1% (масс./об) OG в 50 ммоль/л HEPES буфера (рН 8,0), GE Healthcare Bio-Sciences Corp., США) и фракционировали по приблизительно 1 мл/пробирка.
5 мл 1% водного раствора трансферрина (Sigma, USA) добавляли по каплям к фракциям, содержащим NG-DSPE, и осторожно перемешивали в течение 20 часов при 4°С. Идентификацию каждой фракции проводили с помощью МС определения.
Продукт реакции затем фракционировали по приблизительно 1,7 мл/пробирка на колонке TOYOPEARL HW-55S (1,5 см × 45 см, 0,9% NaCl, Tosoh Bioscience LLC, США). Tf-NG-DSPE определяли с помощью масс-спектрометрии (MALDI-TOF/MS) и Na-ДДС-ПАГЭ с окрашиванием CBB (Coomasie Brilliant Blue, Wako Pure Chemical Industries, Ltd., Япония).
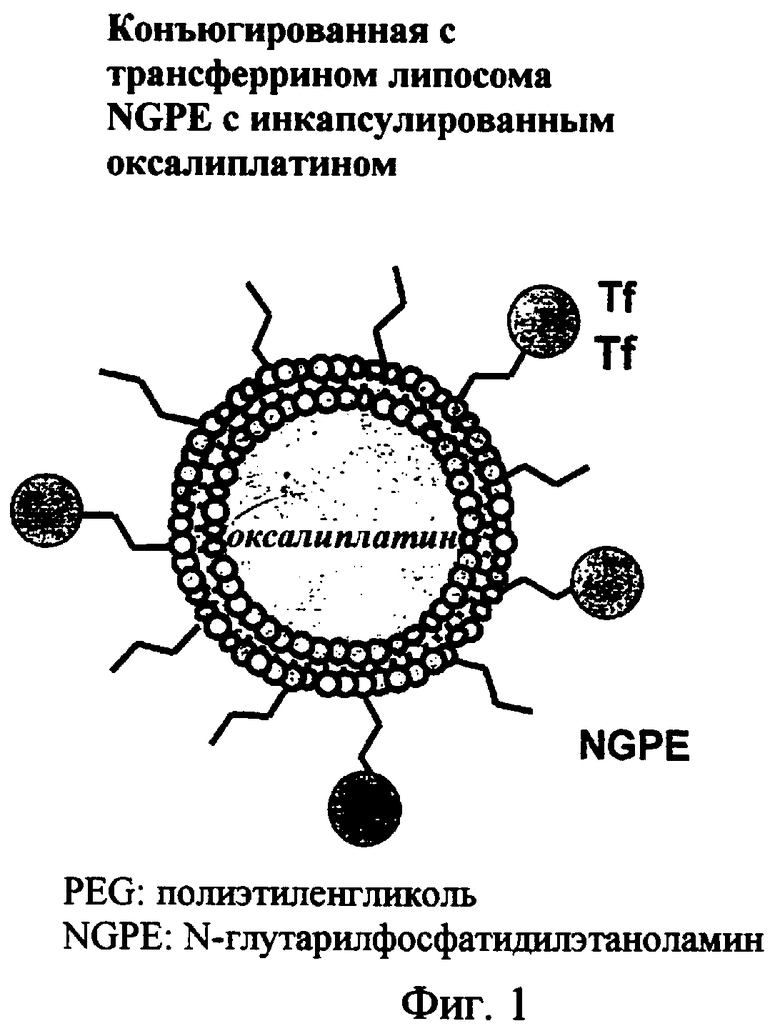
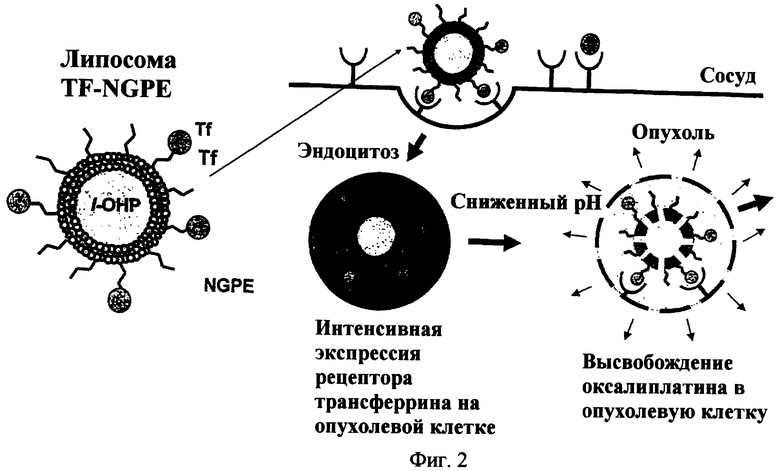
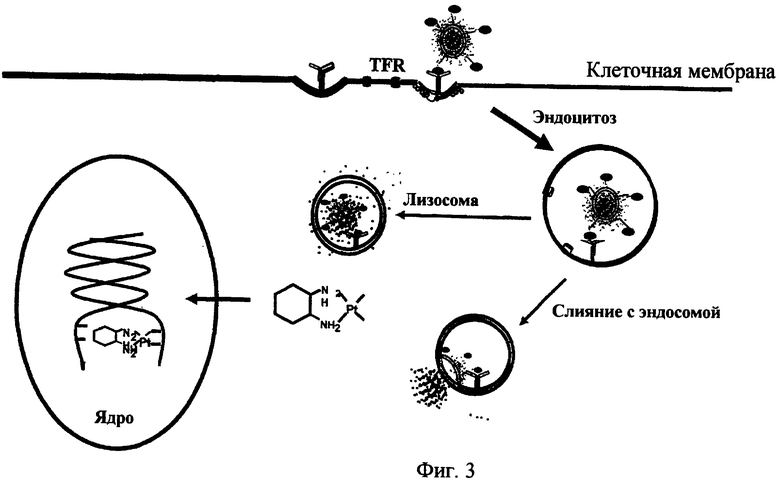
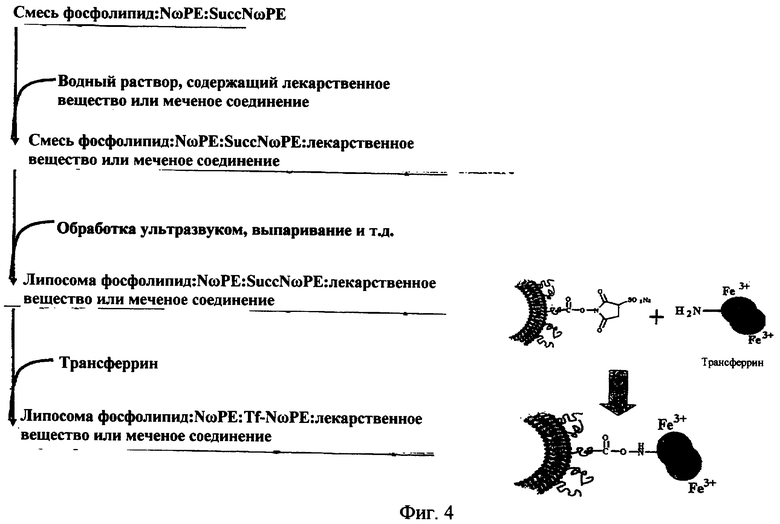

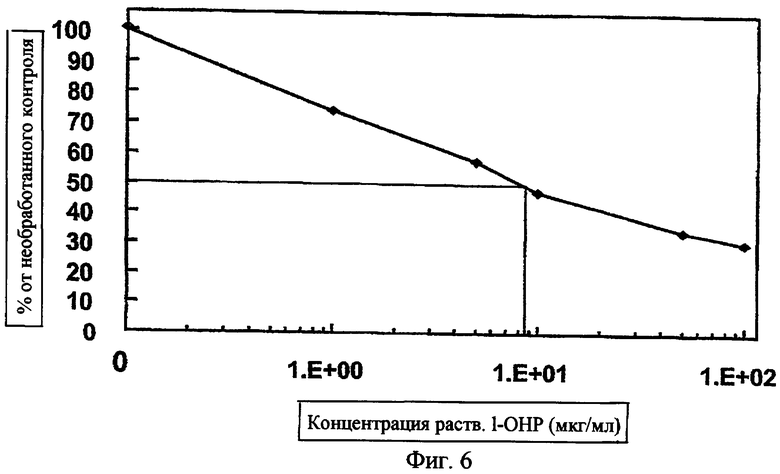
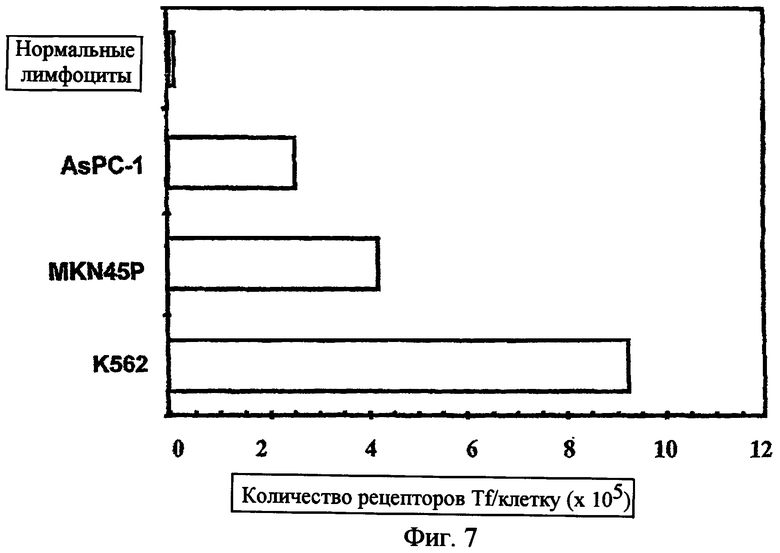
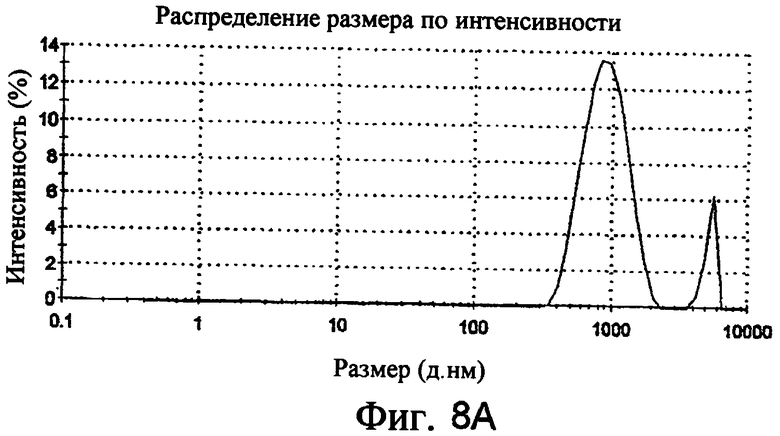

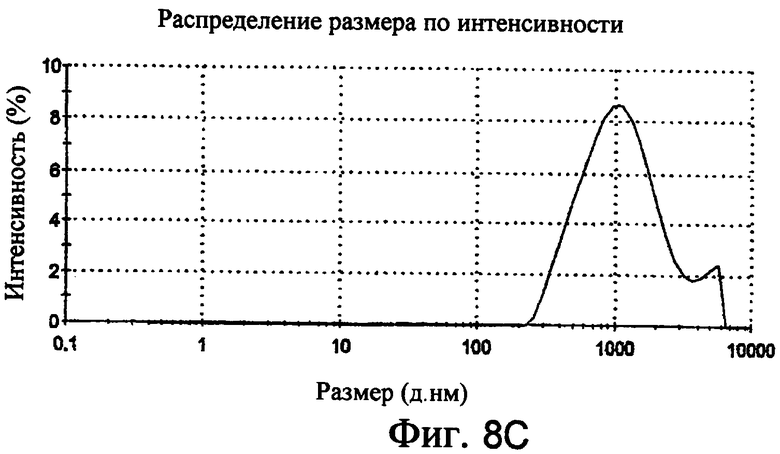
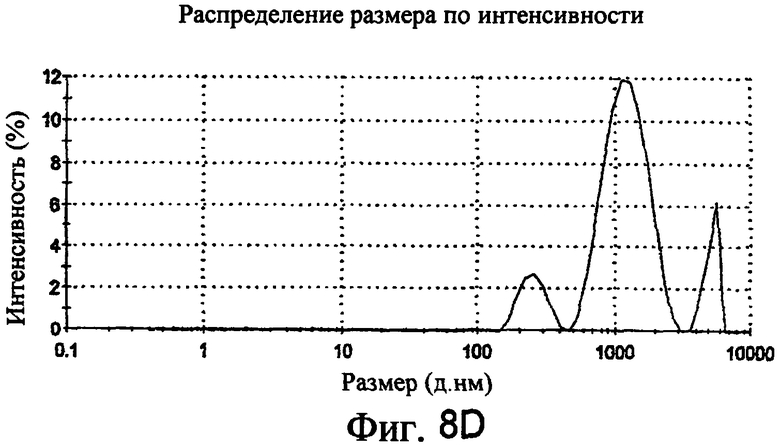
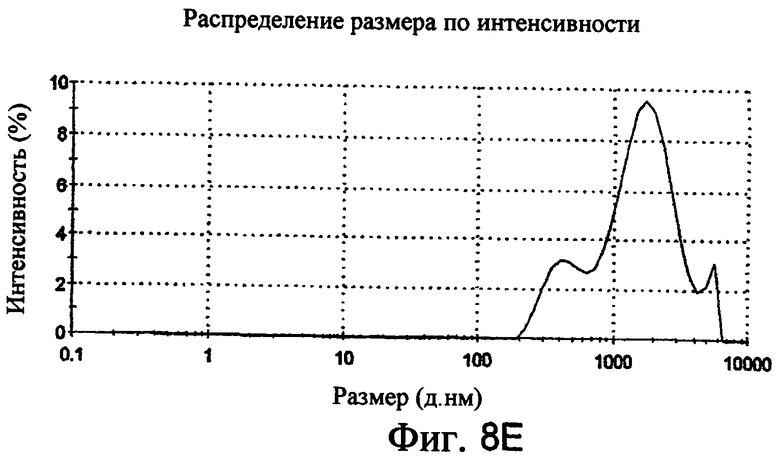
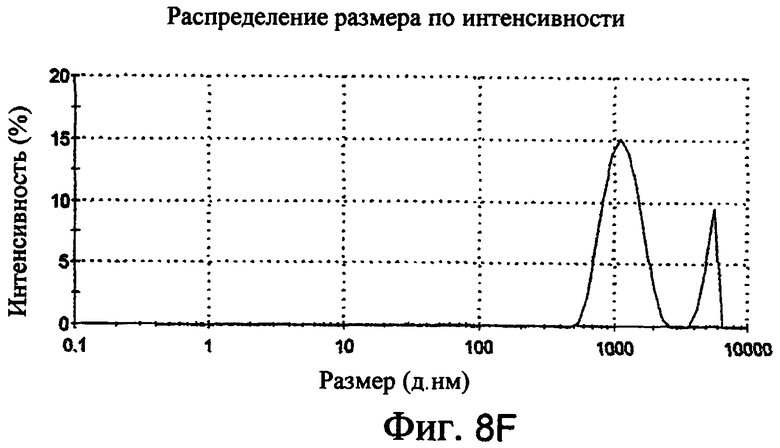
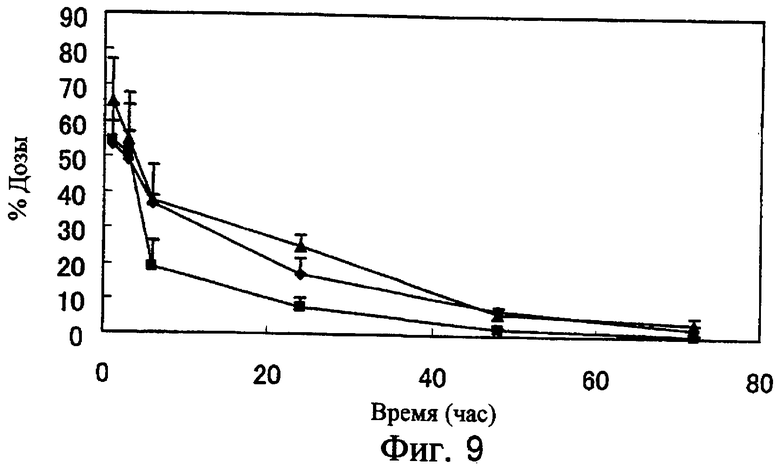
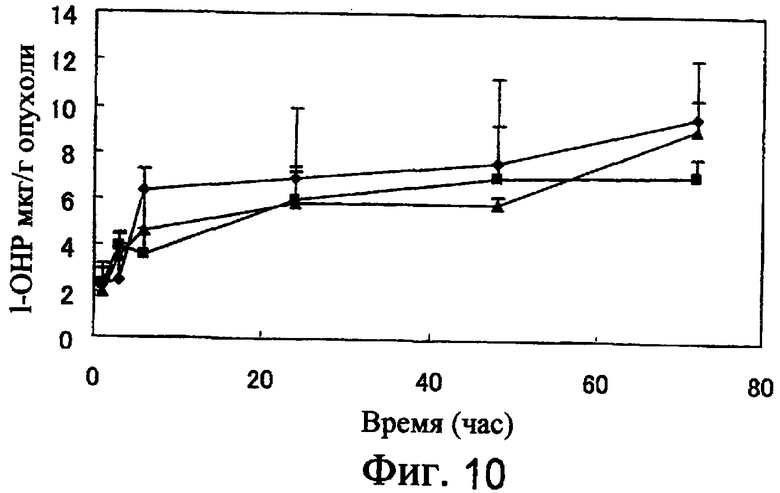
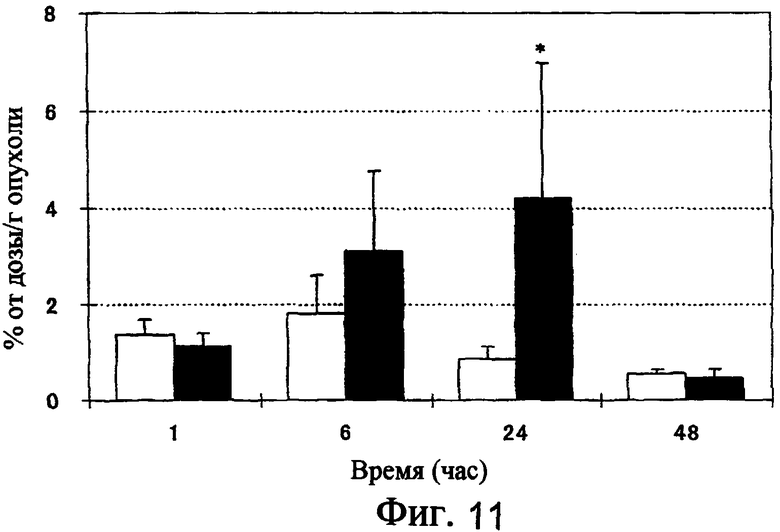
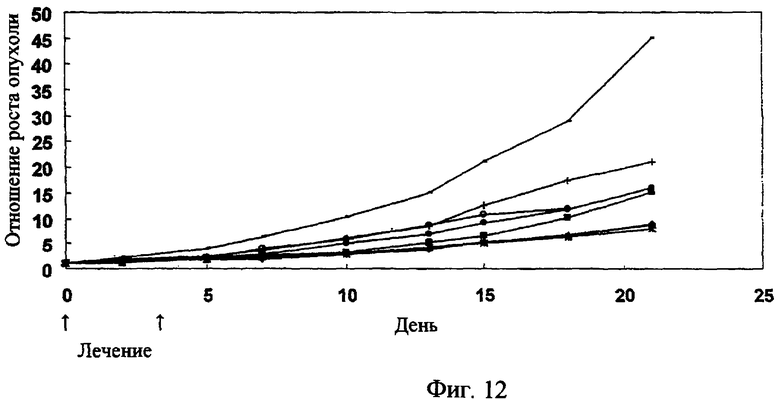

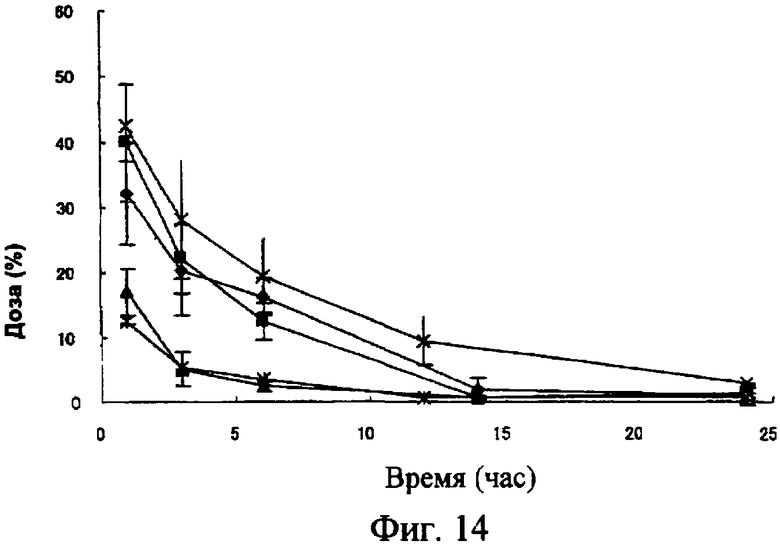


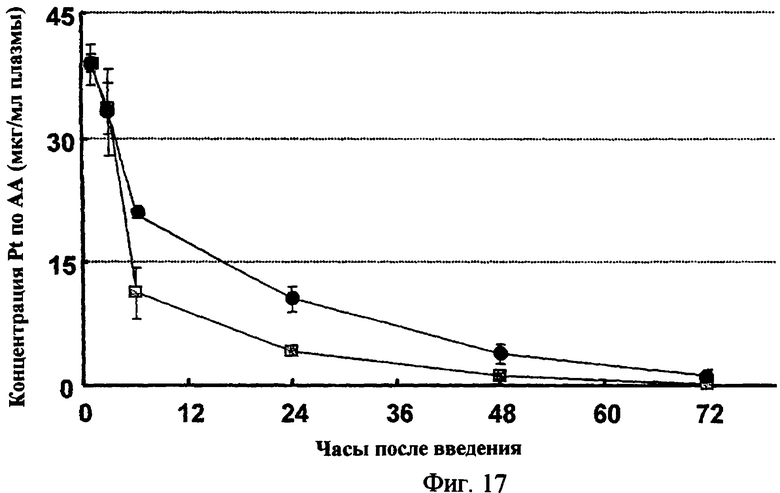
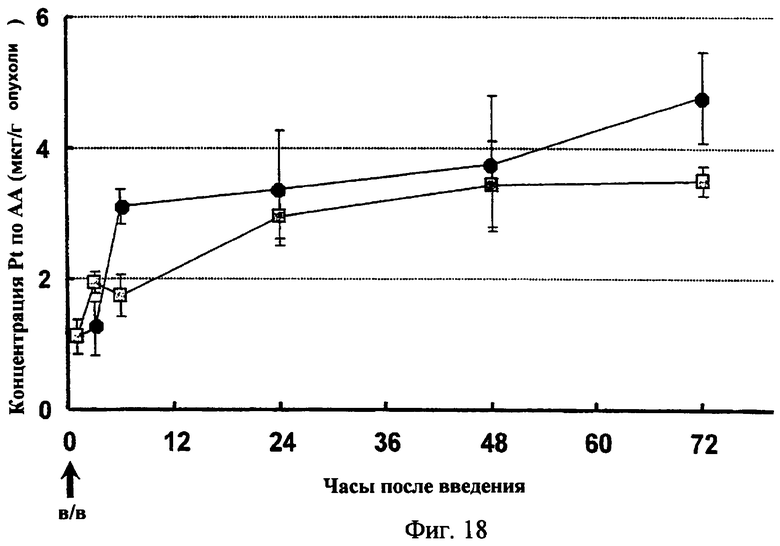
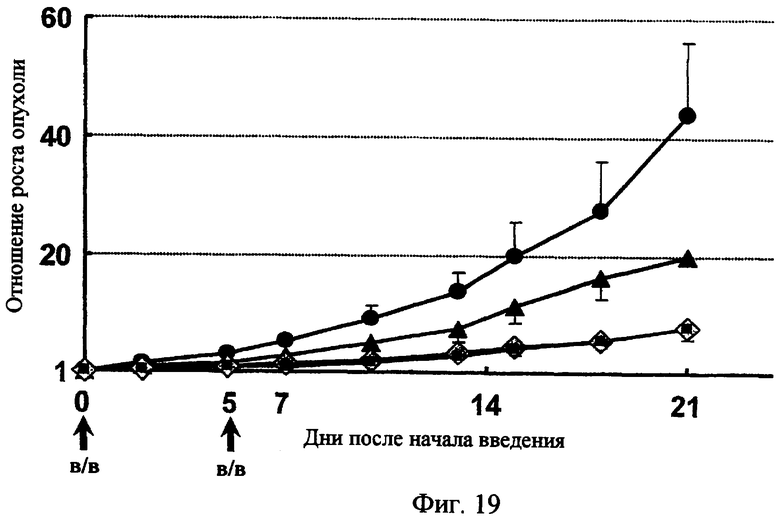
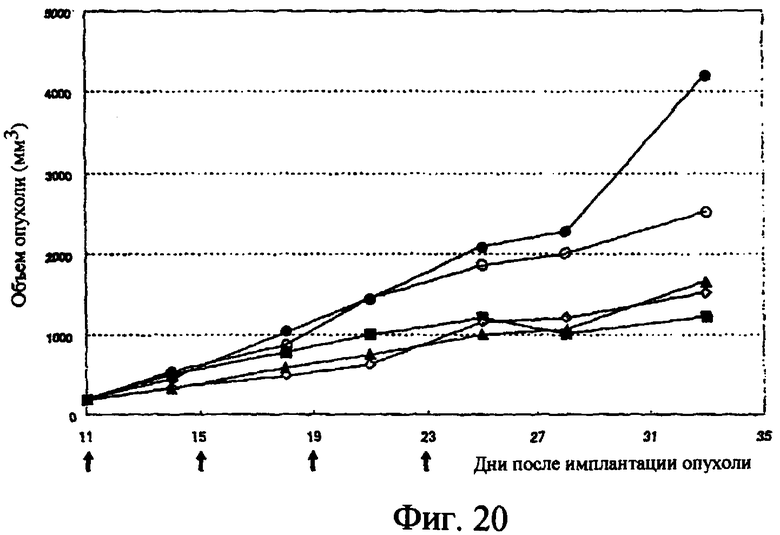
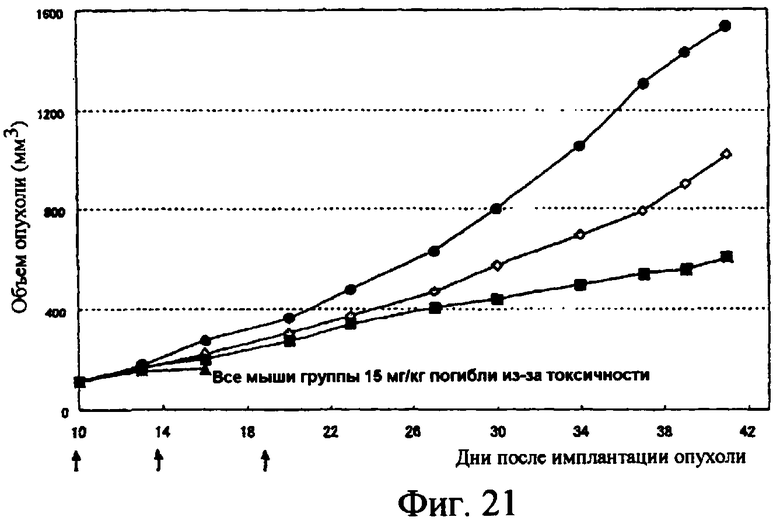
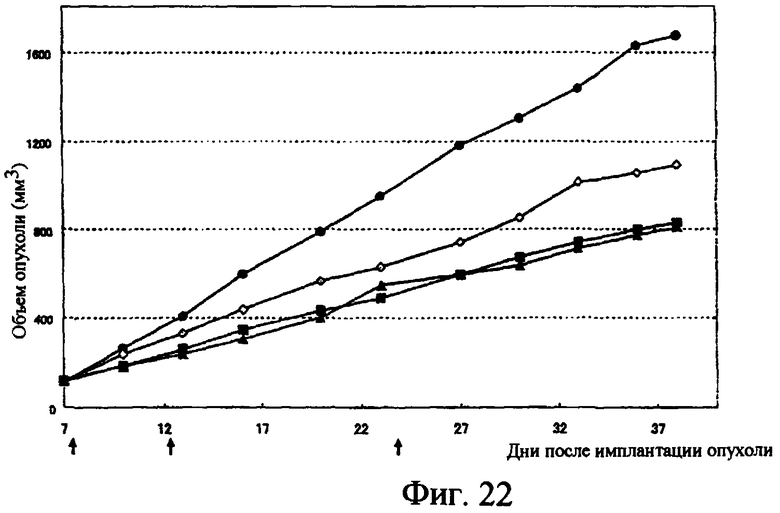
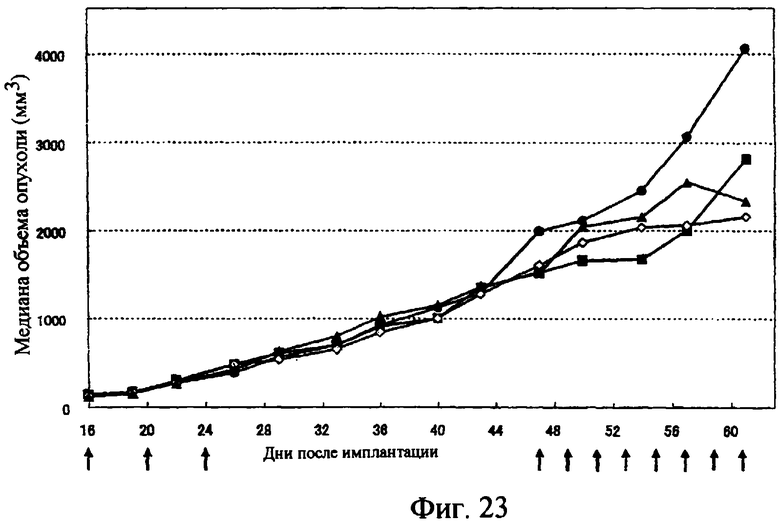
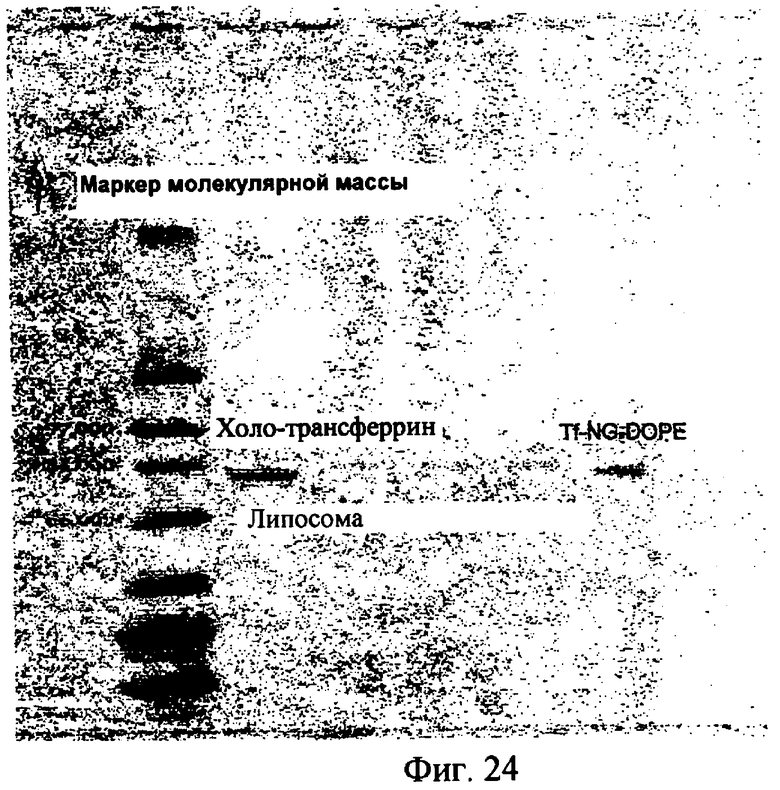
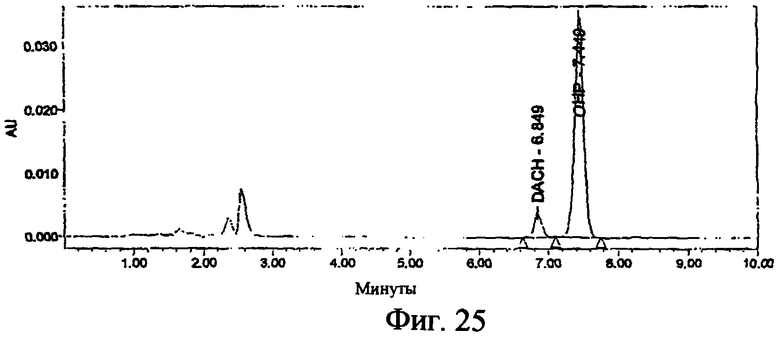
Группа изобретений относится к области медицины и может быть использована в форме содержащих липосомы составов для лечения рака. Липосома включает один или более фосфатидилхолинов, первое производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, инкапсулированное лекарственное вещество и, по меньшей мере, один дополнительный липид, который представляет собой холестерин или производное холестерина. Модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина включает направляющий лиганд, присоединенный ко второму производному N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина. Первое производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1
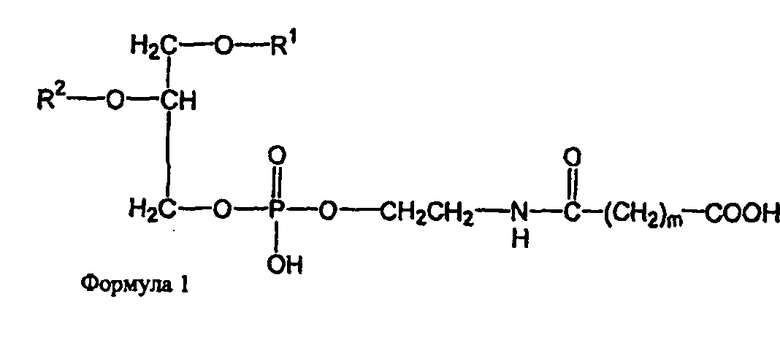
и второе производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 3
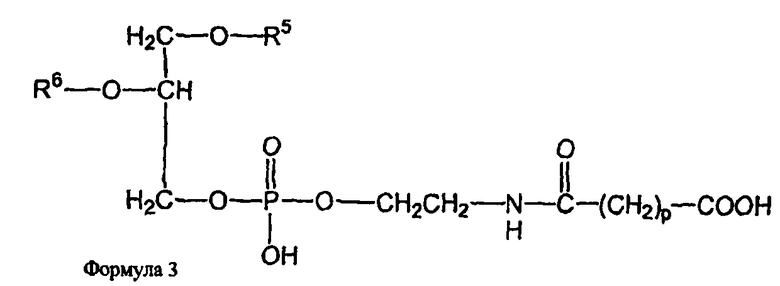
Направляющий лиганд предпочтительно представляет собой трансферрин, а инкапсулированное лекарственное вещество - оксалиплатин. При этом липосома не включает немодифицированный фосфатидилэтаноламин, фосфатидилхолин из яйца или гидрофильный полимер, используемый для увеличения периода полужизни липосомы в циркуляторном русле, а направляющий лиганд не представляет собой интактное антитело. Описывается также способ получения липосомы и способ лечения рака с ее помощью. Группа изобретений обеспечивает улучшенную адресную доставку лекарственного вещества в опухолевые клетки. 21 н. и 92 з.п. ф-лы, 30 ил., 4 табл., 30 пр.
1. Липосома, предназначенная для лечения рака, включающая один или более фосфатидилхолинов, первое производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, инкапсулированное лекарственное вещество и, по меньшей мере, один дополнительный липид, который представляет собой холестерин или производное холестерина,
где модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина включает направляющий лиганд, присоединенный ко второму производному N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина; и
где первое производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1
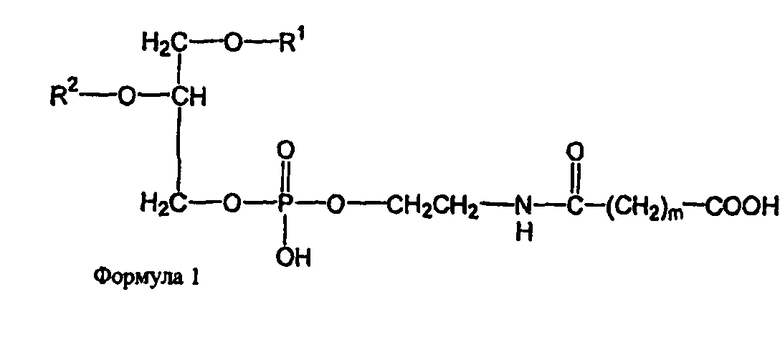
и второе производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 3
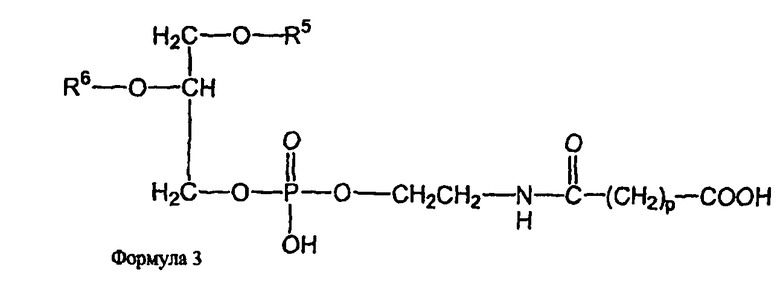
где R1, R2, R5 и R6 независимо представляют собой ацильную группу,
где ацильные группы, независимо, происходят из насыщенных или ненасыщенных алифатических карбоновых кислот, имеющих 18-22 атома углерода, и
где R1 и R2 являются одинаковыми и R5 и R6 являются одинаковыми; и
m и p независимо представляют собой целое число от 1 до 10;
и где указанный направляющий лиганд присутствует в количестве от приблизительно 1 мкг направляющего лиганда на 1 мг липида до приблизительно 50 мкг направляющего лиганда на 1 мг липида, и где липосома не включает немодифицированный фосфатидилэтаноламин, фосфатидилхолин из яйца или гидрофильный полимер, используемый для увеличения периода полужизни липосомы в циркуляторном русле, и где направляющий лиганд не представляет собой интактное антитело.
2. Липосома по п.1, где, по меньшей мере, один дополнительный липид представляет собой холестерин.
3. Липосома по п.1, где один или более фосфатидилхолинов представляет собой DMPC, DSPC, РОРС или DPPC.
4. Липосома по любому из пп.1-3, где липосома включает DMPC и холестерин, DSPC и холестерин, РОРС и холестерин или DPPC и холестерин.
5. Липосома по любому из пп.1-3, где липосома включает DMPC и холестерин.
6. Липосома по п.1, где направляющий лиганд выбран из группы, состоящей из трансферрина, фолиевой кислоты, гиалуроновой кислоты, сахарной цепи и фрагмента моноклонального антитела.
7. Липосома по п.6, где направляющий лиганд выбран из группы, состоящей из трансферрина, фолиевой кислоты, гиалуроновой кислоты и сахарной цепи.
8. Липосома по п.7, где направляющий лиганд представляет собой трансферрин.
9. Липосома по п.8, где трансферрин находится в холоформе, но не в апоформе.
10. Липосома по любому из пп.1-3 или 6-9, где средний диаметр липосомы составляет от приблизительно 50 до приблизительно 250 нм.
11. Липосома по любому из пп.1, 2, 6-9, где R1, R2, R5 и R6 представляют собой олеоил или стеароил и m и p равны 3.
12. Липосома по п.1, где m и p каждый независимо является целым числом от 2 до 4.
13. Липосома по п.1, где m и p равны между собой и являются целым числом от 2 до 4.
14. Липосома по п.13, где m и p равны между собой и составляют 3.
15. Липосома по п.1, где R1, R2, R5 и R6 независимо представляют собой олеоил или стеароил.
16. Липосома по п.1, где R1, R2, R5 и R6 являются одинаковыми.
17. Липосома по п.1, где, по меньшей мере, один дополнительный липид представляет собой холестерин, фосфатидилхолин представляет собой DMPC, m и p равны между собой и составляют 3, R1, R2, R5 и R6 представляют собой олеоил, лекарственное вещество представляет собой оксалиплатин и направляющий лиганд представляет собой трансферрин.
18. Липосома по п.1, где лекарственное вещество представляет собой противораковый агент.
19. Липосома по п.1, где лекарственное вещество представляет собой соединение платины.
20. Липосома по п.19, где соединение платины представляет собой биплатин, цисплатин, карбоплатин, ормаплатин, оксалиплатин, зениплатин, энлоплатин, лобаплатин или спироплатин.
21. Липосома по п.20, где соединение платины представляет собой оксалиплатин.
22. Липосома по п.17 или 21, где оксалиплатин растворен в водном растворе сахара, выбранного из группы, состоящей из трегалозы, мальтозы, сахарозы, маннозы, лактозы, маннита, глицерина и декстрозы.
23. Липосома по п.17 или 21, где оксалиплатин растворен в водном растворе сахара, выбранного из группы, состоящей из трегалозы, мальтозы, сахарозы, маннозы, лактозы, маннита, глицерина и декстрозы, где сахар находится в концентрации от приблизительно 1 до приблизительно 20% сахара (об./об.).
24. Липосома по п.17 или 21, где концентрация оксалиплатина составляет от приблизительно 0,1 до приблизительно 25 мг/мл внутри липосомы.
25. Способ получения липосомы по п.1, включающий стадии
a) смешивания одного или более фосфатидилхолинов, первого производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированного направляющим фактором производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и, по меньшей мере, одного дополнительного липида, представляющего собой холестерин или производное холестерина, с образованием липидной смеси;
b) добавления лекарственного вещества к липидной смеси, образованной на стадии (a);
c) образования липосомы.
26. Способ по п.25, дополнительно включающий стадию (a) очистки липосомы со стадии (c).
27. Способ по п.25 или 26, где лекарственное вещество на стадии (b) перед смешиванием находится в водном растворе.
28. Способ по п.25 или 26, где стадия (c) включает обработку ультразвуком, перемешивание или экструзию.
29. Способ получения липосомы по п.1, включающий стадии a) смешивания одного или более фосфатидилхолинов, первого производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, сукцинимидного эфира второго производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и, по меньшей мере, одного дополнительного липида, представляющего собой холестерин или производное холестерина, с образованием липидной смеси,
где сукцинимидный эфир второго производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлен формулой 2
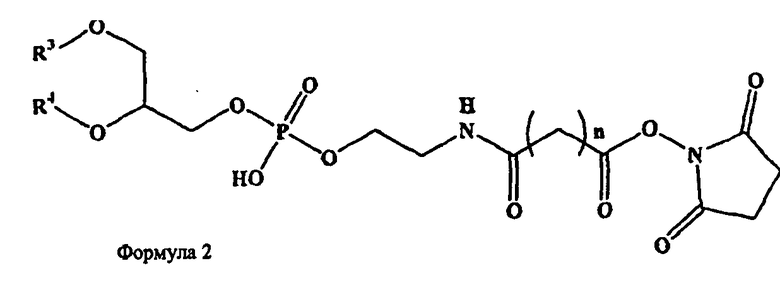
где R3 и R4 представляют собой ацильную группу,
где ацильные группы происходят из насыщенных или ненасыщенных алифатических карбоновых кислот, имеющих 18-22 атома углерода, и
где R3 и R4 являются одинаковыми;
n независимо представляет собой целое число от 1 до 10;
b) добавления лекарственного вещества к липидной смеси, образованной на стадии (а);
c) образования липосомы; и
d) присоединения направляющего лиганда к сукцинимидному эфиру второго производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина с образованием модифицированного направляющим фактором производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина.
30. Способ по п.29, дополнительно включающий стадию (e) очистки липосомы со стадии (d).
31. Способ по п.29 или 30, где лекарственное вещество на стадии (b) перед смешиванием находится в водном растворе.
32. Способ по п.29 или 30, где стадия (с) включает обработку ультразвуком, перемешивание или экструзию.
33. Способ лечения рака, включающий а) введение липосомы по п.1 нуждающемуся в этом индивидууму в количестве, эффективном для лечения рака, где липосома направленного действия включает лекарственное вещество, и лекарственное вещество представляет собой противораковый агент.
34. Фармацевтический состав, включающий липосому по любому из пп.1-24 и один или более фармацевтически приемлемых носителей, наполнителей, разбавителей, стабилизаторов или консервантов.
35. Модифицированное трансферрином производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, где производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 3
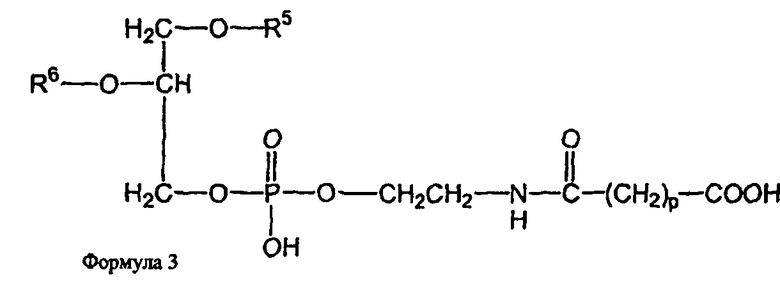
где R5 и R6 представляет собой ацильную группу и где R5 и R6 являются одинаковыми и p представляет собой целое число от 1 до 10,
и трансферрин присоединен к производному N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина.
36. Модифицированное трансферрином производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина по п.35, где R5 и R6 представляют собой олеоил или стеароил и p равно 3.
37. Ненагруженная липосома, включающая один или более фосфатидилхолинов, первое производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и, по меньшей мере, один дополнительный липид, представляющий собой холестерин или производное холестерина,
где модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина включает направляющий лиганд, присоединенный ко второму производному N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина; и
где первое производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1
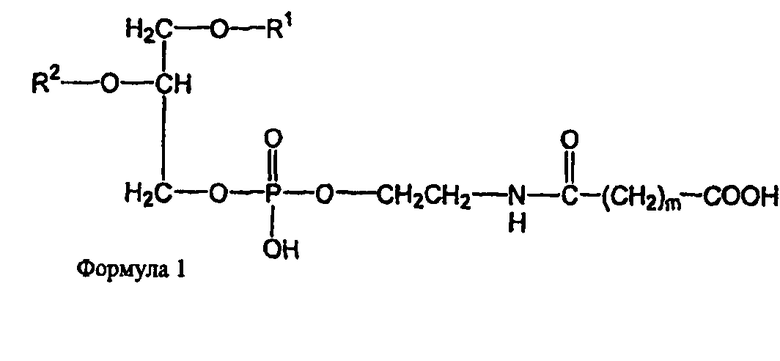
и второе производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 3
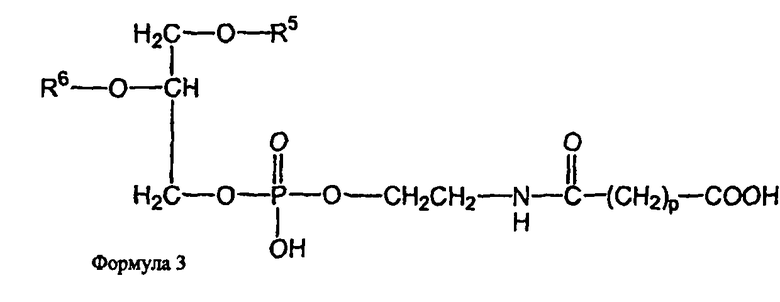
где R1, R2, R5 и R6 каждый независимо представляет собой ацильную группу,
где ацильные группы, независимо, происходят из насыщенных или ненасыщенных алифатических карбоновых кислот, имеющих 18-22 атома углерода, и
где R1 и R2 являются одинаковыми, R5 и R6 являются одинаковыми и
m и p независимо представляют собой целое число от 1 до 10; и
и где указанный направляющий лиганд присутствует в количестве от приблизительно 1 мкг направляющего лиганда на 1 мг липида до приблизительно 50 мкг направляющего лиганда на 1 мг липида, и
где липосома не включает немодифицированный фосфатидилэтаноламин, фосфатидилхолин из яйца или гидрофильный полимер, используемый для увеличения периода полужизни липосомы в циркуляторном русле, и где направляющий лиганд не представляет собой интактное антитело.
38. Ненагруженная липосома по п.37, где один или более фосфатидилхолинов представляет собой DMPC, DSPC, РОРС или DPPC.
39. Ненагруженная липосома по п.37 или 38, где смесь включает DMPC и холестерин, DSPC и холестерин, РОРС и холестерин или DPPC и холестерин.
40. Ненагруженная липосома по п.39, где смесь включает DMPC и холестерин.
41. Ненагруженная липосома по п.37, где направляющий лиганд выбран из группы, состоящей из трансферрина, фолиевой кислоты, гиалуроновой кислоты, сахарной цепи и фрагмента моноклонального антитела.
42. Ненагруженная липосома по п.41, где направляющий лиганд выбран из группы, состоящей из трансферрина, фолиевой кислоты, гиалуроновой кислоты и сахарной цепи.
43. Ненагруженная липосома по п.42, где направляющий лиганд представляет собой трансферрин.
44. Ненагруженная липосома по п.43, где трансферрин находится в холоформе, но не в апоформе.
45. Ненагруженная липосома по любому из пп.37, 38 или 41-44, где средний диаметр липосомы составляет от приблизительно 50 до приблизительно 250 нм.
46. Ненагруженная липосома по любому из пп.37 или 41-44, где R1, R2, R5 и R6 представляют собой олеоил или стеароил и m и p равны 3.
47. Ненагруженная липосома по п.37, где m и p каждый независимо является целым числом от 2 до 4.
48. Ненагруженная липосома по п.37, где m и p равны между собой и являются целым числом от 2 до 4.
49. Ненагруженная липосома по п.48, где m и p равны между собой и составляют 3.
50. Ненагруженная липосома по п.37, где R1, R2, R5 и R6 независимо представляют собой олеоил или стеароил.
51. Ненагруженная липосома по п.37, где R1, R2, R5 и R6 являются одинаковыми.
52. Ненагруженная липосома по п.37, где R1, R2, R5 и R6 представляют собой олеоил, m и p равны между собой и составляют 3, один или более фосфатидилхолинов представляют собой DMPC, присутствует, по меньшей мере, один дополнительный липид, представляющий собой холестерин, и направляющий лиганд представляет собой трансферрин.
53. Способ получения ненагруженной липосомы по п.37, включающий стадии
a) смешивания одного или более фосфатидилхолинов, первого производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированного направляющим фактором производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, и, по меньшей мере, одного дополнительного липида, представляющего собой холестерин или производное холестерина для образования липидной смеси; и
b) образования липосомы.
54. Способ по п.53, дополнительно включающий стадию (c) очистки липосомы со стадии (b).
55. Способ по п.53 или 54, где стадия (b) включает обработку ультразвуком, перемешивание или экструзию.
56. Способ получения ненагруженной липосомы по п.37, включающий стадии
a) смешивания одного или более фосфатидилхолинов, первого производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и сукцинимидного эфира второго производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и, по меньшей мере, одного дополнительного липида, представляющего собой холестерин или производное холестерина, для образования липидной смеси,
где сукцинимидный эфир второго производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлен формулой 2
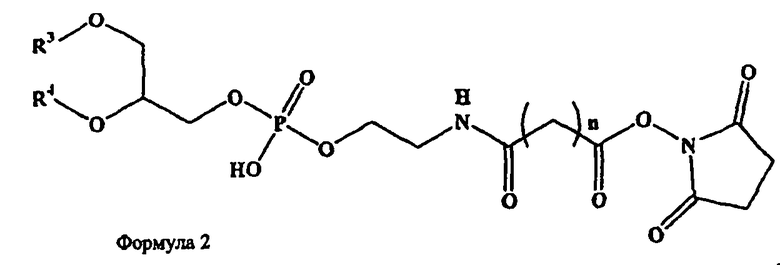
где R3 и R4 представляют собой ацильную группу,
где ацильные группы происходят из насыщенных или ненасыщенных алифатических карбоновых кислот, имеющих 18-22 атома углерода, и
где R3 и R4 являются одинаковыми,
n независимо представляет собой целое число от 1 до 10;
b) образования липосомы и
c) присоединения направляющего лиганда к сукцинимидному эфиру второго производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина с образованием модифицированного направляющим фактором производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина.
57. Способ по п.56, дополнительно включающий стадию (d) очистки липосомы со стадии (c).
58. Способ по п.56 или 57, где стадия (b) включает обработку ультразвуком, перемешивание или экструзию.
59. Способ получения терапевтической липосомы, включающий стадию
a) инкапсулирования лекарственного вещества в ненагруженную липосому по любому из пп.37-52.
60. Липидная смесь для получения липосомы по п.1 или 37, включающая смесь одного или более фосфатидилхолинов, первого производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, сукцинимидного эфира второго производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и, по меньшей мере, одного дополнительного липида, представляющего собой холестерин или производное холестерина, где
первое производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1

и сукцинимидный эфир второго производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлен формулой 2

где R1, R2, R3 и R4 независимо представляют собой ацильную группу,
где ацильные группы, независимо, происходят из насыщенных или ненасыщенных алифатических карбоновых кислот, имеющих 18-22 атома углерода, и
где R1 и R2 являются одинаковыми, R3 и R4 являются одинаковыми и
m и n независимо представляют собой целое число от 1 до 10; и
где смесь не включает немодифицированный фосфатидилэтаноламин, фосфатидилхолин из яйца или гидрофильный полимер, используемый для увеличения периода полужизни липосомы в циркуляторном русле, и где направляющий лиганд не представляет собой интактное антитело.
61. Липидная смесь по п.60, где один или более фосфатидилхолинов представляет собой DMPC, DSPC, РОРС или DPPC, где m и n равны между собой и составляют 3 и где R1, R2, R3 и R4 представляют собой олеоил или стеароил.
62. Липидная смесь для получения липосомы по п.1 или 37, включающая смесь одного или более фосфатидилхолинов, первого производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированного направляющим фактором производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и, по меньшей мере, одного дополнительного липида, представляющего собой холестерин или производное холестерина, где
первое производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1
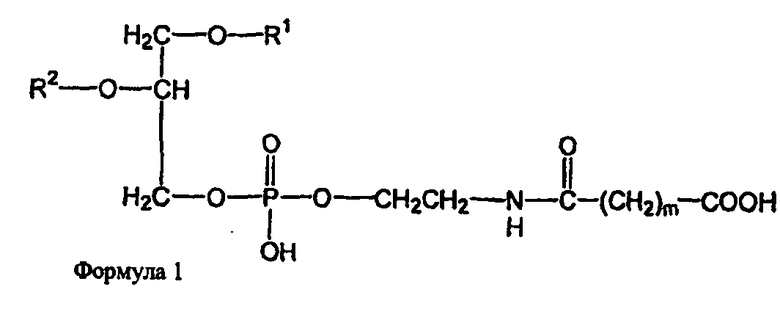
и модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина включает направляющий лиганд, присоединенный ко второму производному N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина; и
где второе производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 3
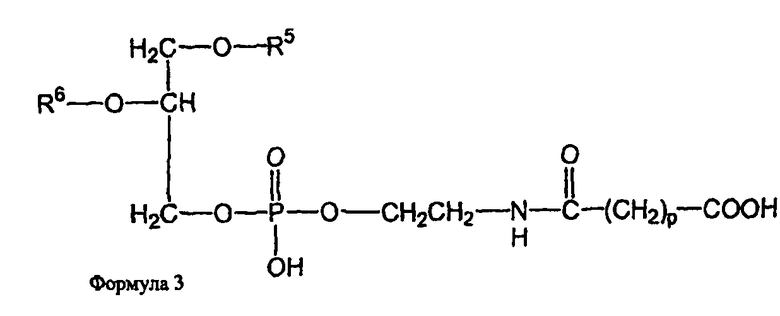
где R1, R2, R5 и R6 независимо представляет собой ацильную группу,
где ацильные группы, независимо, происходят из насыщенных или ненасыщенных алифатических карбоновых кислот, имеющих 18-22 атома углерода, и
где R1 и R2 являются одинаковыми, R5 и R6 являются одинаковыми;
m и p независимо представляют собой целое число от 1 до 10; и
где указанный направляющий лиганд присутствует в количестве от приблизительно 1 мкг направляющего лиганда на 1 мг липида до приблизительно 50 мкг направляющего лиганда на 1 мг липида и
где смесь не включает немодифицированный фосфатидилэтаноламин, фосфатидилхолин из яйца или гидрофильный полимер, используемый для увеличения периода полужизни липосомы в циркуляторном русле, и где направляющий лиганд не представляет собой интактное антитело.
63. Липидная смесь по п.62, где один или более фосфатидилхолинов представляет собой DMPC, DSPC, РОРС или DPPC, где m и p равны между собой и составляют 3, где R1, R2, R5 и R6 являются одинаковыми и представляют собой олеоил или стеароил и где направляющий лиганд представляет собой трансферрин.
64. Способ получения липидной смеси по п.60, включающий стадию смешивания одного или более фосфатидилхолинов, первого производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и сукцинимидного эфира второго производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и, по меньшей мере, одного дополнительного липида, представляющего собой холестерин или производное холестерина.
65. Способ получения липидной смеси по п.62, включающий стадию смешивания одного или более фосфатидилхолинов, первого производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и модифицированного направляющим фактором производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и, по меньшей мере, одного дополнительного липида, представляющего собой холестерин или производное холестерина.
66. Содержащая липосомы композиция для получения липосом по п.1, включающая негомогенную смесь липидов, водного раствора и липосом, включающих один или более фосфатидилхолинов, первое производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, сукцинимидный эфир второго производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и, по меньшей мере, один дополнительный липид, представляющий собой холестерин или производное холестерина, где
первое производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1
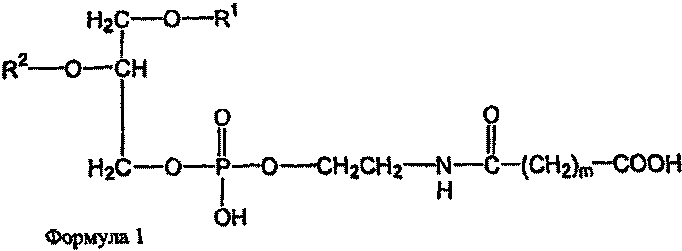
и сукцинимидный эфир второго производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлен формулой 2
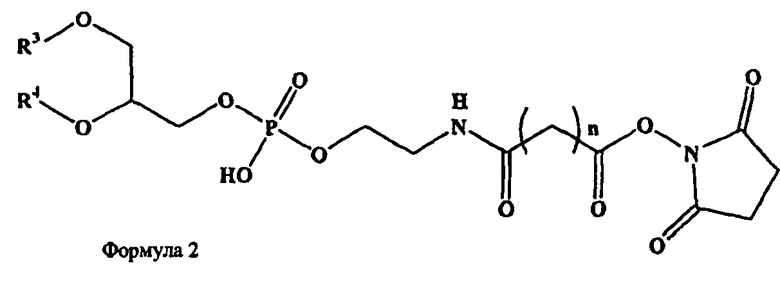
где R1, R2, R3 и R4 независимо представляют собой ацильную группу,
где ацильные группы, независимо, происходят из насыщенных или ненасыщенных алифатических карбоновых кислот, имеющих 18-22 атома углерода, и
где R1 и R2 являются одинаковыми, R3 и R4 являются одинаковыми;
m и n независимо представляют собой целое число от 1 до 10; и
где композиция не включает немодифицированный фосфатидилэтаноламин, фосфатидилхолин из яйца или гидрофильный полимер, используемый для увеличения периода полужизни липосомы в циркуляторном русле, и где направляющий лиганд не представляет собой интактное антитело;
и где композиция необязательно включает инкапсулированное лекарственное вещество.
67. Содержащая липосомы композиция по п.66, где один или более фосфатидилхолинов представляет собой DMPC, DSPC, РОРС или DPPC, где m и n равны между собой и составляют 3, где R1, R2, R3 и R4 являются одинаковыми и представляют собой олеоил или стеароил.
68. Содержащая липосомы композиция для получения липосом по п.1, включающая негомогенную смесь липидов, водного раствора и липосом, включающих один или более фосфатидилхолинов, первое производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и, по меньшей мере, один дополнительный липид, представляющий собой холестерин или производное холестерина, где
первое производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1
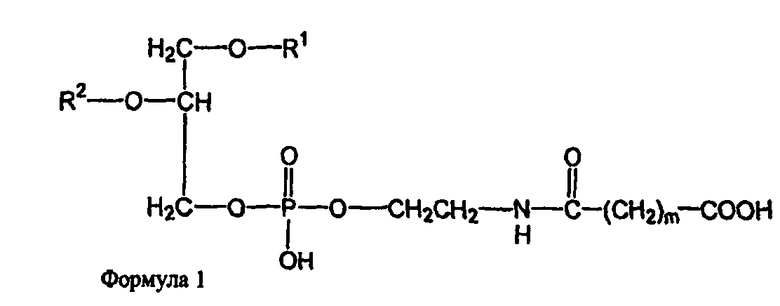
модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина включает направляющий лиганд, присоединенный ко второму производному N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина; и где второе производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 3
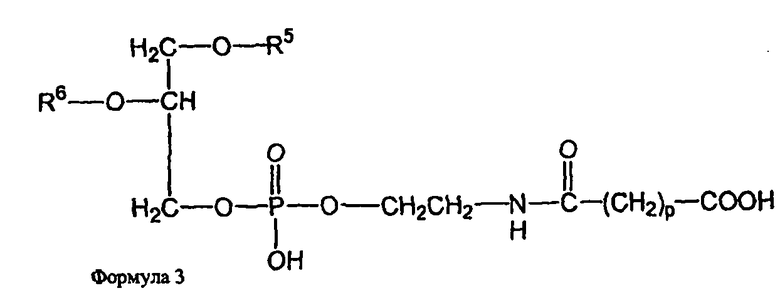
где R1, R2, R5 и R6 независимо представляет собой ацильную группу,
где ацильные группы, независимо, происходят из насыщенных или ненасыщенных алифатических карбоновых кислот, имеющих 18-22 атома углерода, и
где R1 и R2 являются одинаковыми, R5 и R6 являются одинаковыми и
m и p независимо представляют собой целое число от 1 до 10; и
и где указанный направляющий лиганд присутствует в количестве от приблизительно 1 мкг направляющего лиганда на 1 мг липида до приблизительно 50 мкг направляющего лиганда на 1 мг липида и
где композиция не включает немодифицированный фосфатидилэтаноламин, фосфатидилхолин из яйца или гидрофильный полимер, используемый для увеличения периода полужизни липосомы в циркуляторном русле, и где направляющий лиганд не представляет собой интактное антитело;
и где композиция необязательно включает инкапсулированное лекарственное вещество.
69. Содержащая липосомы композиция по п.68, где один или более фосфатидилхолинов представляет собой DMPC, DSPC, РОРС или DPPC,
где m и p равны между собой и составляют 3, где R1, R2, R5 и R6 являются одинаковыми и представляют собой олеоил или стеароил и где направляющий лиганд представляет собой трансферрин.
70. Содержащая липосомы композиция по п.66, включающая лекарственное вещество.
71. Содержащая липосомы композиция по п.68, включающая лекарственное вещество.
72. Способ получения содержащей липосомы композиции по п.66 или 68, включающий стадии
a) смешивания одного или более фосфатидилхолинов и первого производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и, когда присутствует, сукцинимидного эфира второго производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина или модифицированного направляющим фактором производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и, по меньшей мере, одного дополнительного липида, представляющего собой холестерин или производное холестерина, с образованием липидной смеси; и
b) добавления лекарственного вещества к липидной смеси, образованной на стадии (a); и
c) образования содержащей липосомы композиции.
73. Способ получения содержащей липосомы композиции по п.68, включающий стадии
a) смешивания одного или более фосфатидилхолинов, первого производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и модифицированного направляющим фактором производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и, по меньшей мере, одного дополнительного липида, представляющего собой холестерин или производное холестерина, с образованием липидной смеси; и
b) добавления растворителя к смеси, образованной на стадии (a), с образованием содержащей липосомы композиции.
74. Липосома по п.1, которая содержит от приблизительно 10 мкг направляющего лиганда/мг липида до приблизительно 50 мкг направляющего лиганда/мг липида.
75. Липосома по п.1, где лекарственное вещество представляет собой оксалиплатин, R1, R2, R5 и R6 представляют собой олеоил, m и p равны 3, и направляющий лиганд представляет собой трансферрин, один или более фосфатидилхолинов представляет собой DMPC и липосома направленного действия содержит от приблизительно 10 мкг направляющего лиганда/мг липида до приблизительно 50 мкг направляющего лиганда/мг липида.
76. Липосома по п.1, которая содержит от приблизительно 10 мкг направляющего лиганда/мг липида до приблизительно 25 мкг направляющего лиганда/мг липида.
77. Липосома по п.1, где лекарственное вещество представляет собой оксалиплатин, R1, R2, R5 и R6 представляют собой олеоил, m и p равны 3, и направляющий лиганд представляет собой трансферрин, один или более фосфатидилхолинов представляет собой DMPC и липосома направленного действия содержит от приблизительно 10 мкг направляющего лиганда/мг липида до приблизительно 25 мкг направляющего лиганда/мг липида.
78. Липосома по п.1, где общее содержание первого производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и модифицированного направляющим фактором производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина составляет от приблизительно 2 до приблизительно 6 моль % от общего содержания липидов.
79. Липосома по п.1, где лекарственное вещество представляет собой оксалиплатин, R1, R2, R5 и R6 представляют собой олеоил, m и p равны 3, направляющий лиганд представляет собой трансферрин, один или более фосфатидилхолинов представляет собой DMPC и общее содержание первого производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и модифицированного направляющим фактором производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина составляет от приблизительно 2 до приблизительно 6 моль % от общего содержания липидов.
80. Липосома по п.74, где общее содержание первого производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и модифицированного направляющим фактором производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина составляет от приблизительно 2 до приблизительно 6 моль % от общего содержания липидов.
81. Липосома по п.76, где общее содержание первого производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и модифицированного направляющим фактором производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина составляет от приблизительно 2 до приблизительно 6 моль % от общего содержания липидов.
82. Липосома по п.77, где общее содержание первого производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и модифицированного направляющим фактором производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина составляет от приблизительно 2 до приблизительно 6 моль % от общего содержания липидов.
83. Липосома, предназначенная для лечения рака, включающая один или более фосфатидилхолинов, первое производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина, инкапсулированное лекарственное вещество и, по меньшей мере, один дополнительный липид, который представляет собой холестерин или производное холестерина,
где модифицированное направляющим фактором производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина включает направляющий лиганд, присоединенный ко второму производному N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина; и
где первое производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 1
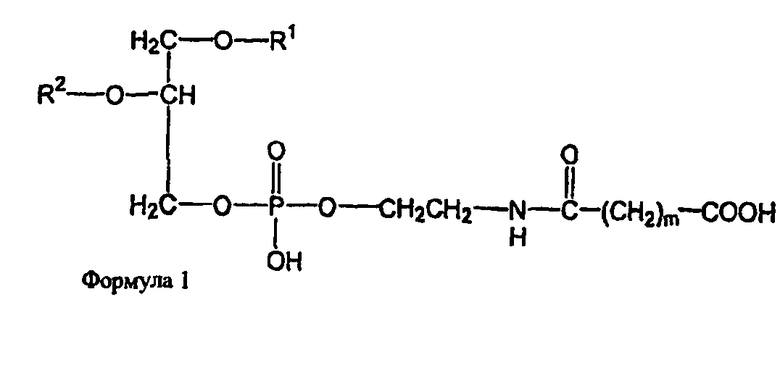
и второе производное N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина представлено формулой 3
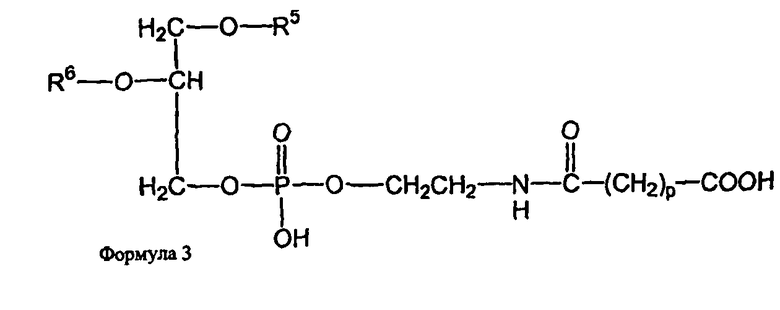
где R1, R2, R5 и R6 независимо представляют собой ацильную группу,
где ацильные группы, независимо, происходят из насыщенных или ненасыщенных алифатических карбоновых кислот, имеющих 12-22 атома углерода,
где липосомы направленного действия содержат от приблизительно 10 мкг направляющего лиганда на 1 мг липида до приблизительно 50 мкг направляющего лиганда на 1 мг липида и
m и p независимо представляют собой целое число от 1 до 10; и
где липосома не включает немодифицированный фосфатидилэтаноламин, фосфатидилхолин из яйца или гидрофильный полимер, используемый для увеличения периода полужизни липосомы в циркуляторном русле, и где направляющий лиганд не представляет собой интактное антитело.
84. Липосома по п.83, где, по меньшей мере, один дополнительный липид представляет собой холестерин.
85. Липосома по п.83 или 84, где один или более фосфатидилхолинов представляет собой DMPC, DSPC, РОРС или DPPC.
86. Липосома по п.85, где липосома включает DMPC и холестерин.
87. Липосома по любому из пп.83, 84 и 86, где направляющий лиганд выбран из группы, состоящей из трансферрина, фолиевой кислоты, гиалуроновой кислоты, сахарной цепи и фрагмента моноклонального антитела.
88. Липосома по п.87, где направляющий лиганд выбран из группы, состоящей из трансферрина, фолиевой кислоты, гиалуроновой кислоты и сахарной цепи.
89. Липосома по п.88, где направляющий лиганд представляет собой трансферрин.
90. Липосома по п.89, где трансферрин находится в холоформе, но не в апоформе.
91. Липосома по любому из пп.83, 84, 86 или 88-90, где средний диаметр липосомы составляет от приблизительно 50 до приблизительно 250 нм.
92. Липосома по любому из пп.83, 84, 86 или 88-90, где R1, R2, R5 и R6 представляют собой олеоил или стеароил и m и p равны 3.
93. Липосома по п.92, где R1, R2, R5 и R6 представляют собой олеоил.
94. Липосома по любому из пп.83, 84, 86, 88-90 или 93 где лекарственное вещество представляет собой противораковый агент.
95. Липосома по п.94, где лекарственное вещество представляет собой соединение платины.
96. Липосома по п.95, где соединение платины представляет собой биплатин, цисплатин, карбоплатин, ормаплатин, оксалиплатин, зениплатин, энлоплатин, лобаплатин или спироплатин.
97. Липосома по п.96, где соединение платины представляет собой оксалиплатин.
98. Липосома по п.97, где лекарственное вещество представляет собой оксалиплатин, R1, R2, R5 и R6 представляют собой олеоил, каждый из m и p равен 3, направляющий лиганд представляет собой трансферрин, один или более фосфатидилхолинов представляют собой DMPC, по меньшей мере, один дополнительный липид представляет собой холестерин.
99. Липосома по п.98, где трансферрин находится в холоформе.
100. Липосома по любому из пп.97-99, где оксалиплатин растворен в водном растворе сахара, выбранного из группы, состоящей из трегалозы, мальтозы, сахарозы, маннозы, лактозы, маннита, глицерина и декстрозы.
101. Липосома по п.100, где сахар присутствует в концентрации приблизительно 300 мМ.
102. Липосома по любому из пп.97-99 и 101, где концентрация оксалиплатина составляет от приблизительно 0,1 мг/мл до приблизительно 25 мг/мл внутри липосомы.
103. Способ лечения рака, включающий
а) введение липосомы по п.83 нуждающемуся в этом индивидууму в количестве, эффективном для лечения рака, где липосома включает лекарственное вещество и лекарственное вещество представляет собой противораковый агент.
104. Фармацевтический состав, включающий липосому по п.83 и один или более фармацевтически приемлемых носителей, наполнителей, разбавителей, стабилизаторов или консервантов.
105. Липосома по п.83, где направляющий лиганд представляет собой трансферрин, по меньшей мере, один дополнительный липид представляет собой холестерин, где указанная липосома направленного действия содержит трансферрин в количестве от приблизительно 10 мкг трансферрина на 1 мг липида до приблизительно 50 мкг трансферрина на 1 мг липида, каждый R1, R2, R5 и R6 представляет собой ацильную группу из насыщенных или ненасыщенных алифатических карбоновых кислот, имеющих 18-22 атома углерода, R1 и R2 являются одинаковыми, R5 и R6 являются одинаковыми.
106. Липосома по п.105, где R1, R2, R5 и R6 представляют собой олеоил, стеароил, пальмитоил или миристоил и m и p равны 3.
107. Липосома по п.106, где лекарственное вещество представляет собой противораковый агент.
108. Липосома по п.106, где один или более фосфатидилхолинов представляют собой DMPC или DSPC.
109. Липосома по п.83, где направляющий лиганд представляет собой трансферрин и, по меньшей мере, один дополнительный липид представляет собой холестерин, где указанная липосома направленного действия содержит трансферрин в количестве от приблизительно 10 мкг трансферрина на 1 мг липида до приблизительно 50 мкг трансферрина на 1 мг липида, R1 и R2 являются одинаковыми, R5 и R6 являются одинаковыми и R1, R2, R5 и R6 не являются пальмитоилом или миристоилом.
110. Липосома по п.83, где направляющий лиганд представляет собой трансферрин и, по меньшей мере, один дополнительный липид представляет собой холестерин, где указанная липосома направленного действия содержит трансферрин в количестве от приблизительно 10 мкг трансферрина на 1 мг липида до приблизительно 50 мкг трансферрина на 1 мг липида, содержание фосфатидилхолинов составляет 40-60 моль %; содержание холестерина составляет 35-55 моль %; общее содержание первого производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина и модифицированного направляющим фактором производного N-(ω)-дикарбоновой кислоты и фосфатидилэтаноламина составляет 2-8 моль % и общее содержание фосфатидилхолинов, холестерина и производных фосфатидилэтаноламина составляет 100 моль %; каждый R1, R2, R5 и R6 представляет собой ацильную группу из насыщенных или ненасыщенных алифатических карбоновых кислот, имеющих 18-22 атома углерода, R1 и R2 являются одинаковыми, R5 и R6 являются одинаковыми.
111. Липосома по п.110, где R1, R2, R5 и R6 представляют собой олеоил или стеароил и m и p равны 3.
112. Липосома по п.111, где лекарственное вещество представляет собой противораковый агент.
113. Липосома по п.111, где один или более фосфатидилхолинов представляют собой DMPC или DSPC.
| US 5834012 A, 10.11.1998 | |||
| US 6120797 A, 19.09.2000 | |||
| Singh M | |||
| Transferrin as a targeting ligand for liposomes and anticancer drugs | |||
| Curr Pharm Des | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| Iinuma H | |||
| et al | |||
| Intracellular targeting therapy of cisplatin-encapsulated transferrin-polyethylene glycol liposome on peritoneal dissemination of gastric cancer | |||
| Int J | |||
Авторы
Даты
2012-06-27—Публикация
2006-03-08—Подача