Изобретение относится к экспериментальной медицине, конкретно к экспериментальной хирургии и гистологии, цитологии и клеточной биологии, и касается способов моделирования патологического кожного рубца.
В литературе не найдено способов моделирования патологических кожных рубцов в эксперименте.
Задачей, решаемой данным изобретением, является создание модели послеоперационного кожного рубца по своим морфологическим и патофизиологическим характеристикам близкой к патологическим рубцам человека (гипертрофическим и келоидным рубцам), позволяющей изучать характер влияния различных факторов, в том числе используемых с лечебной целью, на процессы формирования и ремоделирования рубцовой ткани.
Поставленная задача достигается способом моделирования патологического кожного рубца путем иссечения полнослойного лоскута кожи в центре спины у белых беспородных крыс-самцов массой 180-200 г в продольном направлении площадью 5х4 см2 с последующей шовной фиксацией краев полнослойного кожного дефекта к подлежащим мышцам непрерывным обвивным швом нитью полированного нехромированного кетгута 4 с сохранением площади первоначально нанесенного дефекта при сроке формирования рубца в течение 50-55 суток.
Данные отличительные признаки не найдены в проанализированной авторами научно-медицинской литературе, являются новыми и не вытекают явным образом для специалиста из уровня техники.
Предлагаемая модель прошла экспериментальные исследования на кафедре гистологии, цитологии и эмбриологии СГМУ. Таким образом, данное техническое решение соответствует критериям изобретения: "новизна", "изобретательский уровень", "промышленно применима".
Способ осуществляют следующим образом.
В качестве экспериментальных животных используют белых беспородных крыс-самцов массой 180-200 г.
Предварительно волосы на спине животных коротко выстригают ножницами без излишней травматизации кожи и выщипывания волос. Крыс фиксируют в станке в положении на животе. Под ингаляционным масочным наркозом парами эфира производят иссечение полнослойного лоскута кожи 5х4 см2 в центре спины в продольном направлении. Края сформированного полнослойного кожного дефекта подшивают непрерывным обвивным швом к подлежащим мышцам без стягивания краев нитью полированного нехромированного кетгута 4 с сохранением площади первоначально нанесенного дефекта. Раневую поверхность промывают 0,5%-ным раствором хлорамина. Длительность операции составляет 5 минут. При выполнении данной методики летальные исходы у экспериментальных животных отсутствовали.
Послеоперационные раны заживают в естественных условиях с формированием массивного струпа темно-коричневого цвета до 5-6 мм толщиной. На 50-55 сутки эксперимента формируются обширные грубые послеоперационные рубцы.
Животных содержат в стационарных условиях вивария на обычном брикетном питании с добавлением овощей, творога; при дозированном освещении (12:12, свет с 8 часов). В одной клетке содержат по 3 крысы. Ежедневно всех животных осматривают, оценивают их общее состояние, внешний вид, пищевую возбудимость, двигательную активность, характер и фазу течения раневого процесса. Массу тела измеряют на медицинских весах, размеры раневого дефекта и сформированного рубца линейкой.
Пример выполнения способа. 2.02.2002. Белую беспородную крысу-самца массой 190 г фиксировали в станке в положении на животе. Коротко выстригли волосы на спине. Под эфирным масочным наркозом иссекли полнослойный кожный лоскут 5х4 см2 в центре спины в продольном направлении. Края сформированного полнослойного кожного дефекта подшили непрерывным обвивным швом к подлежащим мышцам без стягивания краев нитью полированного нехромированного кетгута 4 с сохранением площади первоначально нанесенного дефекта. Раневую поверхность промыли 0,5%-ным раствором хлорамина. Длительность операции составила 5 минут. Послеоперационная рана заживала в естественных условиях. За счет фиксации краев полнослойного кожного дефекта к подлежащим мышцам ранняя фаза контракции раны ограничивалась, и площадь полнослойного кожного дефекта оставалась фактически неизменной на протяжении первых 7 суток в послеоперационном периоде и незначительно сокращалась в сроки до 14-15 суток послеоперационного периода. Заживление раны протекало с формированием грубого темно-коричневого струпа до 5-6 мм толщиной, который со временем уплотнялся и был интимно сращен с дном раны. Формирование рубца завершилось к 28.03.2002. Таким образом, длительность процесса заживления раны вплоть до периода рубцевания с отторжением струпа и полной эпителизацией гранулирующей поверхности составила 55 суток от момента операции. На 55-е сутки произвели забор полученного рубца и окружающей кожи для гистологического исследования. При заборе материала на момент формирования рубца, а также через 10, 25, 40 суток с момента его формирования обращают на себя внимание технические трудности, вызванные плотной, грубой текстурой как самого рубца, так и фиброзных сращений рубцового регенерата и окружающей его кожи с подлежащими мягкими тканями.
После взятия материала рубцы с окружающей их кожей фиксировали в жидкости Карнуа и 12%-ном растворе нейтрального формалина. Депарафинированные срезы толщиной 5-7 мкм окрашивали гематоксилином и эозином, а также по Ван-Гизону. Тучные клетки выявляли толуидиновым синим. Гистохимически определяли гликоген и нейтральные гликопротеиды - ШИК-реакцией по Мак-Манусу, гликозаминогликаны - окраской альциановым синим по Стидмену (рН 1,0; 2,5), эластические волокна - орсеином по Унна-Тенцеру, нуклеиновые кислоты - окраской метиленовым зеленым и пиронином по Браше.
Для выявления нервных элементов использовали материал, зафиксированный в 12%-ном растворе нейтрального формалина. Приготовленные на криостате срезы толщиной 15-20 мкм импрегнировали азотнокислым серебром по Бильшовскому-Грос в модификации А.И. Рыжова (1960), а также окрашивали суданом черным на миелин.
Для электронной микроскопии материал фиксировали в 2,5% глутаральдегиде, забуференном на 0,2 М какодилатном буфере (рН 7,2) по D.D. Sabatini, К. Bensch, R. J. Barrnett (1963) при температуре 4oС. Затем постфиксировали в 1%-ном растворе четырехокиси осмия в течение 4 часов, дегидратировали и заливали в аралдит. Срезы получали на ультратоме LKB-III (Швеция). Полутонкие срезы окрашивали толуидиновым синим, ультратонкие контрастировали уранилацетатом и цитратом свинца. Изучали в электронном микроскопе JEM - 100 СХ-II (Япония).
Проведен морфоколичественный анализ структурной перестройки рубцовой ткани по методу Г.Г. Автандилова [1]. Подсчет количества тучных клеток, сосудов, фибробластов проводили на сериальных срезах через каждые 150-200 мкм рубцовой ткани при увеличении х400, используя рамку площадью 0,0484 мм2. По результатам подсчета определялась удельная плотность структур. Исследовали динамику удельного количества основных структурно-тканевых элементов. Измеряли толщину рубца, эпидермиса и собственно кожи. Материалы морфоколичественных исследований обрабатывали по правилам параметрической статистики с определением критерия Стъюдента.
Анализ результатов гистологического исследования проводился в сравнении с группами: интактных животных (группа контроля) и группой животных, у которых иссекался полнослойный кожный лоскут тех же локализаций и размеров, но без подшивания краев к подлежащим мышцам (группа сравнения).
Исследования показали, что созданная модель кожного послеоперационного рубца существенно отличается от группы сравнения и имеет следующие признаки, характерные для патологического рубца:
1) обширный, избыточный объем рубцовой ткани; так при формировании модели патологического рубца - длина рубца на момент его формирования составляла (49±3) мм, ширина (15±2) мм, площадь рубца - 32-35% площади удаленного лоскута и не уменьшалась в сроки до 95 суток эксперимента, а у группы сравнения длина рубца составляла (48±3) мм, ширина (9±1) мм, площадь рубца занимала 21-25% площади удаленного лоскута, которая имела тенденцию к уменьшению (р≤0,05);
2) длительное нарушение процесса эпителизации раны с неполным восстановлением архитектоники эпидермиса и явлениями кариопикноза (фиг.1);
3) наличие в толще рубца толстых, грубых пучков коллагеновых фуксинофильных волокон с явлениями мукоидного набухания;
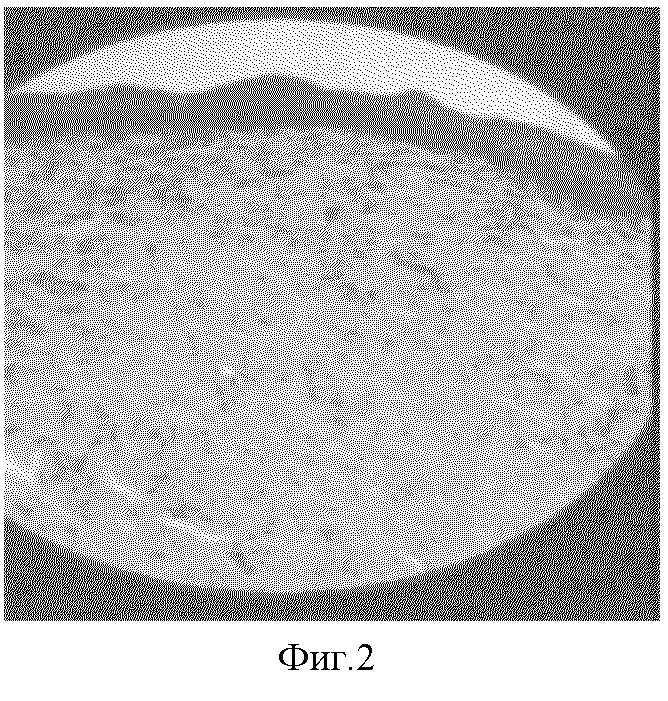
4) отсутствие эластических волокон и вновь сформированных придатков кожи в сроки до 95 суток эксперимента (фиг.2);
5) снижение удельной плотности сосудов и длительно сохраняющаяся лейкоцитарная инфильтрация рубцовой ткани;
6) многообразие клеток фибробластического ряда различной степени зрелости, что обеспечивает длительное поддержание популяции клеток в активном состоянии и препятствует процессам ремоделирования рубцовой ткани;
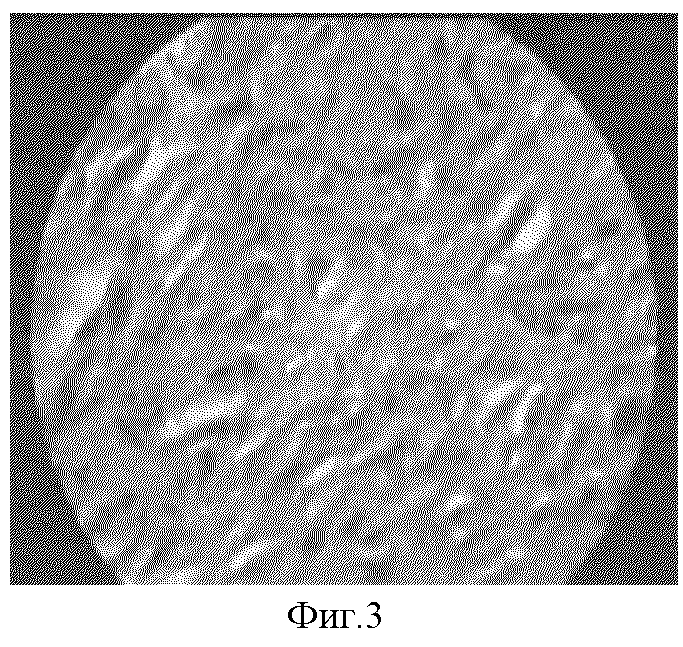
7) преобладание гиалуроновой кислоты, слабокислых сульфатированных мукоидных веществ и сиаломуцинов в межклеточном веществе (фиг.3);
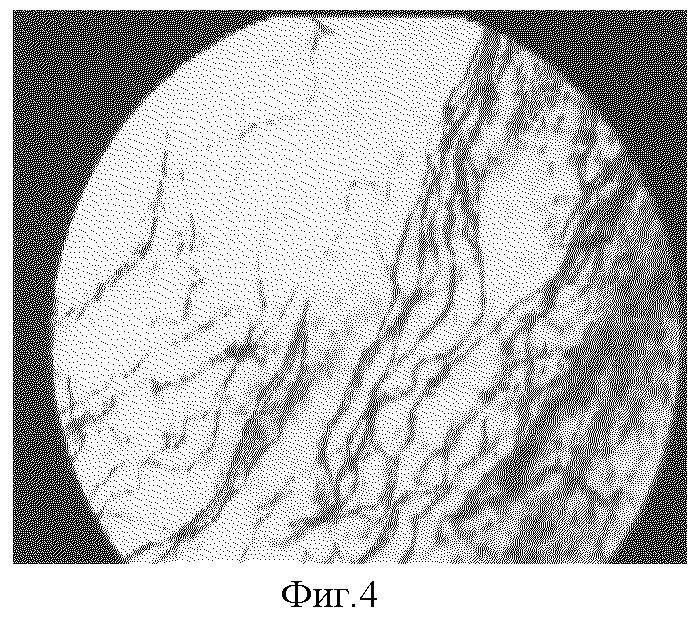
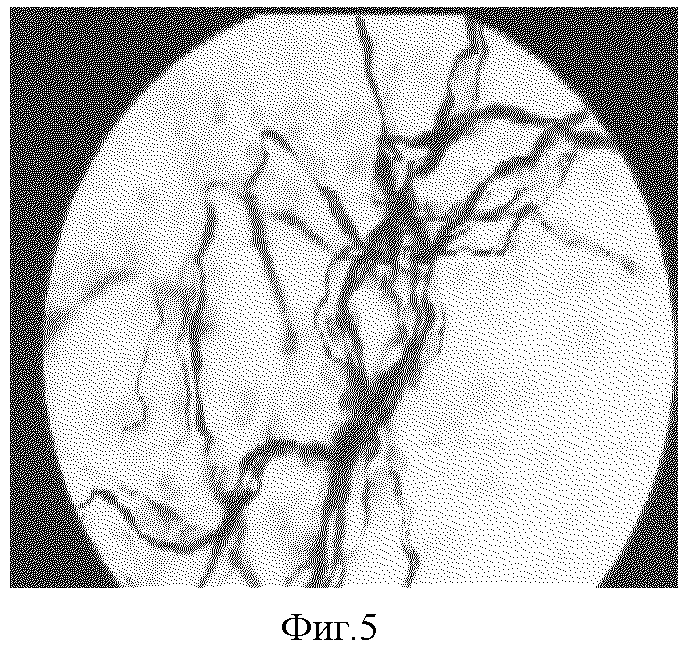
8) наличие выраженных морфологических изменений нервного аппарата (варикозных утолщений и натеков нейроплазмы, тотальной гиперимпрегнации нервных волокон, чередования участков аргирофобии и аргирофилии, наличие участков рубцовой ткани с явлениями гипериннервации (фиг.4), а также причудливые деформации нервных волокон (фиг.5));
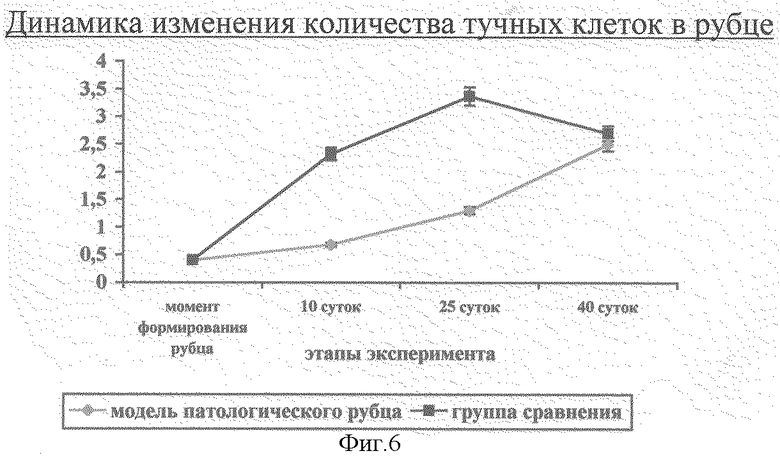
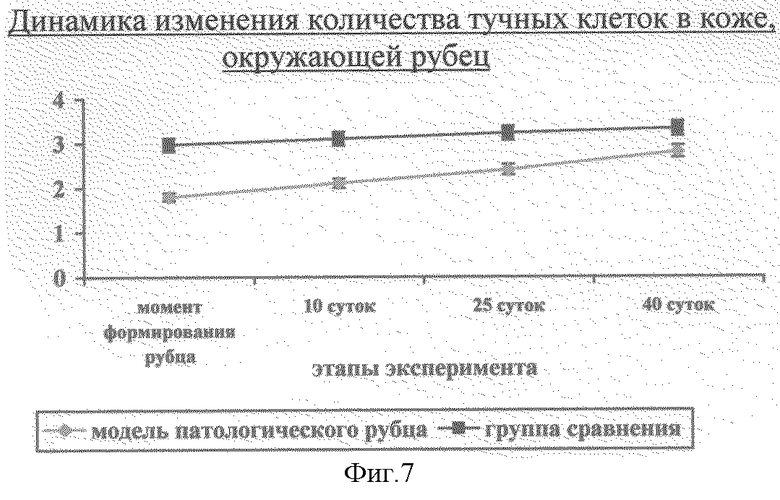
9) замедленная и неадекватная реакция тучных клеток в рубце (фиг.6) и окружающей его коже (фиг.7) на поздних этапах заживления ран в фазе рубцевания.
Экспериментальные исследования были проведены на 87 животных, у которых был получен грубый кожный рубец, имеющий описанные выше морфологические признаки патологического рубца.
Совокупность существенных признаков, а именно выбор экспериментального животного - крысы, иссечение полнослойного кожного лоскута определенного размера 5х4 см2, подшивание краев сформированного полнослойного кожного дефекта к подлежащим мышцам, а также использование в качестве шовного материала кетгута, позволяет создать послеоперационный кожный рубец, близкий по патофизиологическим и морфологическим критериям к патологическим (гипертрофическим и келоидным) рубцам кожи человека.
В качестве материала были выбраны беспородные белые крысы-самцы, так как процесс рубцевания кожи у крыс имеет общие закономерности с человеком [2, 3] .
Иссечение полнослойных кожных лоскутов площадью 5х4 см2 позволяет сформировать грубый рубец обширных размеров, в то время как иссечение лоскутов кожи меньшей площади приводит к образованию более нежных рубцов.
Подшивание краев сформированного полнослойного кожного дефекта к подлежащим мышцам осуществлялось с целью ограничения ранней фазы контракции, что приближает экспериментальный раневой процесс к человеческому, так как контракционная способность кожи человека меньше, чем у большинства животных.
Для моделирования рубца среди разнообразия шовного материала мы использовали кетгут, который, являясь биологическим рассасывающимся шовным материалом, обладает высокой фитильностью и сенсибилизирующим действием [4, 5]. Данные побочные эффекты кетгута способствуют поддержанию воспалительного процесса в ране и формированию более грубого рубца.
На 50-55 сутки эксперимента заканчиваются процессы формирования рубцовой ткани и эпителизации поверхности и начинается фаза ремоделирования рубцовой ткани.
Таким образом, как показали экспериментальные исследования, впервые создана модель патологического кожного рубца, максимально приближенная к морфологической структуре патологического послеоперационного кожного рубца человека.
СПИСОК ЛИТЕРАТУРЫ
1. Автандилов Г.Г. Медицинская морфометрия. - М.: Медицина, 1990, 384 с.
2. Бирюков М.Л. Послеожоговые келоидные рубцы и их связь с фиброматозом. // Вопросы ожоговой патологии. Горький, 1980, с.65-69.
3. Бирюков М.Л. О прямом склерозе при заживлении ожоговых ран // Вопросы ожоговой патологии. Горький, 1980, с.59-64.
4. Скрипников Н.С., Костенко В.А., Пронина Е.Н., Черно В.С., Конопля Н. М. , Романцев А.Ю. Экспериментальное обоснование применения новых биологических рассасывающихся шовных материалов. // Современные подходы к разработке эффективных перевязочных средств, шовных материалов и полимерных имплантатов: Матер. III Междунар. конф. "Современные подходы к разработке эффективных перевязочных средств, шовных материалов и полимерных имплантатов". - М., 1998, с.170-173.
5. Тепликов А. В. , Сандаков П.Я., Маслов Ю.Н., Одинцова О.В. Сравнительная оценка фитильности хирургических нитей. // Современные подходы к разработке эффективных перевязочных средств, шовных материалов и полимерных имплантатов: Матер. III Междунар. конф. "Современные подходы к разработке эффективных перевязочных средств, шовных материалов и полимерных имплантатов". - М., 1998, с.162-164.
ПЕРЕЧЕНЬ ПРИЛАГАЕМЫХ ЧЕРТЕЖЕЙ
Фиг. 1. Участок наползания регенерирующего эпителия при моделировании патологического рубца на 55 сутки эксперимента. Окраска гематоксилином и эозином, х 150.
Фиг.2. Многочисленные фуксинофильные коллагеновые волокна в зрелом патологическом рубце на 90 сутки эксперимента. Окраска по Ван Гизону, х150.
Фиг.3. Несульфатированные гликозаминогликаны в собственно коже патологического рубца на 80 сутки эксперимента. Окраска альциановым синим по Стидмену рН 2,5 с докраской ядер гематоксилином, х600.
Фиг.4. Участок гипериннервации рубца на 90 сутки эксперимента по моделированию патологического кожного рубца. Импрегнация азотнокислым серебром по Бильшовскому-Грос в модификации А.И. Рыжова, х150.
Фиг. 5. Клубочковидная деформация нервных волокон в модели патологического кожного рубца на 90 сутки эксперимента с подшиванием краев раны. Импрегнация азотнокислым серебром по Бильшовскому-Грос в модификации А.И. Рыжова, х150.
Фиг.6. Динамика изменения количества тучных клеток в модели патологического рубца.
Фиг. 7. Динамика изменения количества тучных клеток в коже, окружающей патологический рубец.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЛЕЧЕНИЯ ГИПЕРТРОФИЧЕСКИХ И КЕЛОИДНЫХ КОЖНЫХ РУБЦОВ | 2002 |
|
RU2234963C2 |
| Способ блефаропластики обширных полнослойных дефектов век с помощью сложносоставного аутотрансплантата | 2015 |
|
RU2611940C1 |
| СПОСОБ УСТРАНЕНИЯ РАНЕВОГО ДЕФЕКТА КОЖИ ПЕРИАНАЛЬНОЙ ОБЛАСТИ У МУЖЧИН | 2010 |
|
RU2432127C1 |
| СПОСОБ УСТРАНЕНИЯ ОРОСТОМЫ В ОБЛАСТИ ДНА ПОЛОСТИ РТА | 2022 |
|
RU2802394C1 |
| СПОСОБ ЗАКРЫТИЯ ОБШИРНЫХ КОЖНЫХ ДЕФЕКТОВ | 2006 |
|
RU2301632C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО УСТРАНЕНИЯ РУБЦОВЫХ ДЕФОРМАЦИЙ КОЖИ | 2000 |
|
RU2201146C2 |
| Способ моделирования трофических гнойных ран в эксперименте | 2021 |
|
RU2753955C1 |
| СПОСОБ АУТОПЛАСТИКИ БРЮШНОЙ СТЕНКИ ПРИ БОЛЬШИХ ЭПИГАСТРАЛЬНЫХ ГРЫЖАХ ПОСЛЕ ЛАПАРОТОМИЙ ПРИ ПАНКРЕОНЕКРОЗЕ | 2015 |
|
RU2587646C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ГЛУБОКОГО КОЖНОГО ДЕФЕКТА В ОБЛАСТИ ПРОМЕЖНОСТИ | 2013 |
|
RU2597276C2 |
| Способ подготовки мягких тканей протезного ложа к протезированию | 2019 |
|
RU2725550C1 |
Изобретение относится к моделированию в медицине и может быть применимо для моделирования патологических кожных рубцов. Иссекают полнослойный лоскут кожи в центре спины у белых беспородных крыс-самцов массой 180-200 г в продольном направлении площадью 5х4 см2. Фиксируют края полнослойного кожного дефекта к подлежащим мышцам непрерывным обвивным швом нитью кетгута с сохранением площади первоначально нанесенного дефекта. В частном случае используют полированный нехромированный кетгут 4. Способ позволяет создать модель, максимально приближенную к морфологической структуре послеоперационного кожного рубца человека. 1 з.п.ф-лы, 7 ил.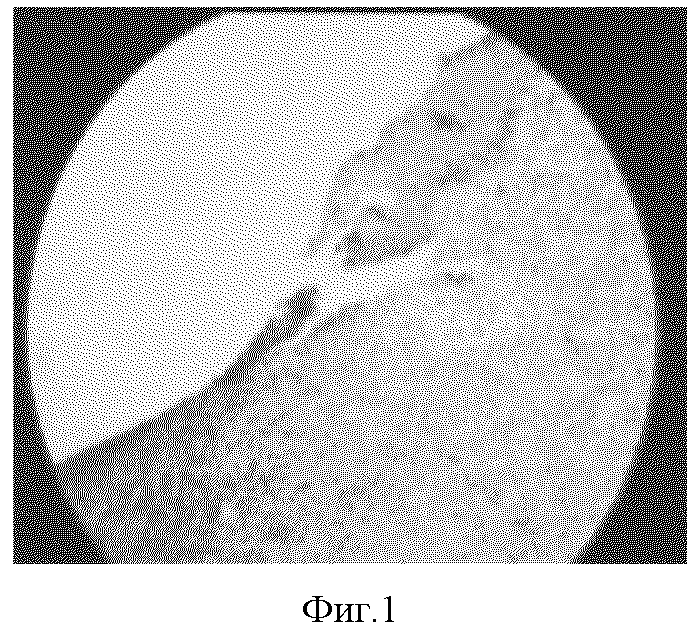
| Реферат из автоматизированной базы данных MEDLINE: ROBB B.S | |||
| А new model for studying the development of human hypertrophic burn scar formation | |||
| J Burn Care Rehabil | |||
| Кузнечная нефтяная печь с форсункой | 1917 |
|
SU1987A1 |
| Способ моделирования процесса резорбции рубца мягких тканей | 1991 |
|
SU1815672A1 |
| Реферат из автоматизированной базы данных MEDLINE: POLO M | |||
| An in vivo model of human proliferative scar | |||
| J Surg Res | |||
| Способ и аппарат для получения гидразобензола или его гомологов | 1922 |
|
SU1998A1 |
Авторы
Даты
2004-02-27—Публикация
2002-09-16—Подача