Предпосылки создания изобретения
Область применения изобретения
Настоящее изобретение относится к биотехнологии, а именно к 3-дезокси-D-арабиногептулозонат-7-фосфатсинтазе, префенатдегидратазе и генам, кодирующим указанные ферменты. Указанные гены являются полезными для улучшения продуктивности ароматических аминокислот.
Описание предшествующих методов
В промышленном масштабе L-аминокислоты традиционно производились методом ферментации с использованием микроорганизмов, принадлежащих к родам Brevibacterium, Corynebacterium, Bacillus, Escherichia, Streptomyces, Pseudomonas, Arthrobactor, Serratia, Penicillium и Candida. Как сами эти микроорганизмы, так и штаммы, полученные из природных или мутантных микроорганизмов, использовались для улучшения продуктивности. Кроме того, были описаны различные методики получения рекомбинантных ДНК, использовавшихся для улучшения продуктивности L-аминокислот за счет усиления активности ферментов, вовлеченных в пути биосинтеза L-аминокислот.
И хотя продуктивность получения L-аминокислот была улучшена путем выведения вышеуказанных микроорганизмов или улучшения процесса получения, существует потребность в разработке более дешевых и эффективных процессов получения L-аминокислот для того, чтобы удовлетворить предполагаемую в будущем явно возрастающую потребность в L-аминокислотах.
Общеизвестны методы получения аминокислот методом ферментации с использованием метанола в качестве исходного материала, который является недорогим и может быть получен в большом количестве, применяя бактерии, принадлежащие к родам Achromobactor и Pseudomonas (см. выложенную патентную заявку Японии №45-25273). Protaminobactor (см. выложенную патентную заявку Японии №49-125590). Protaminohactor и Metanomonas (см. выложенную патентную заявку Японии №50-25790), Microcyclus (см. выложенную патентную заявку Японии №52-18886), Melhylobacillus (см. выложенную патентную заявку Японии №4-91793) и Bacillus (см. выложенную патентную заявку Японии №3-505284).
Кроме того, есть несколько ферментов, играющих центральную роль в биосинтезе ароматических соединений, таких как L-фениаланин, L-тирозин и L-триптофан. Ключевым ферментом является 3-дезокси-D-арабиногептулозонат-7-фосфатсинтаза (далее использовано сокращение "DS"). В биосинтезе L-фенилаланина префенатдегидратаза (далее использовано сокращение "PD") также является ключевым ферментом.
Однако ни один из генов, кодирующих DS и PD, из бактерии, принадлежащей к роду Methylophilus, известен не был.
Краткое описание изобретения
Объектом настоящего изобретения являются гены, кодирующие DS и PD, из бактерии, принадлежащей к роду Methylophilus.
Для того чтобы выявить вышеуказанные объекты, авторы настоящего изобретения провели тщательное исследование. В результате им удалось выделить из Methylophilus methylotrophus гены, кодирующие DS и PD, используя штамм Escherichia coli, дефицитный по гену хоризматмутаза-префенатдегиратазы (pheA), и тем самым совершить настоящее изобретение.
Таким образом, настоящее изобретение предоставляет:
1. Белок, характеризующийся одним из следующих свойств (А) и (В):
(A) белок, состоящий из аминокислот в последовательности, указанной в SEQ ID NO:2; или
(B) белок, состоящий из аминокислот в последовательности, включающей делеции, замены, вставки или добавления одной или нескольких аминокислот в аминокислотной последовательности, указанной в SEQ ID NO:2, и который обладает активностью 3-дезокси-D-арабиногептулозонат-7-фосфатсинтазы.
2. ДНК, кодирующую белок, характеризующийся одним из следующих свойств (А) и (В):
(A) белок, состоящий из аминокислот в последовательности, указанной в SEQ ID NO:2; или
(B) белок, состоящий из аминокислот в последовательности, включающей делеции, замены, вставки или добавления одной или нескольких аминокислот в аминокислотной последовательности, указанной в SEQ ID NO:2, и который обладает активностью 3-дезокси-D-арабиногептулозонат-7-фосфатсинтазы.
3. ДНК по п.2, которая является ДНК, характеризующейся одним из следующих свойств(а)и (b):
(a) ДНК, состоящая из нуклеотидов в последовательности, указанной в SEQ ID NO:1; или
(b) ДНК, которая гибридизуется с нуклеотидной последовательностью. указанной в SEQ ID NO:1, или с зондом, приготовленным из указанной последовательности, в жестких условиях и кодирует белок, обладающий активностью 3-дезокси-D-арабиногептулозонат-7-фосфатсинтазы.
4. ДНК по п.3, где жесткие условия являются такими условиями, в которых отмывка происходит при 60°С, а концентрация соли соответствует 1×SSC и 0.1% SDS.
5. Белок, характеризующийся одним из следующих свойств (С) и (D):
(C) белок, состоящий из аминокислот в последовательности, указанной в SEQ ID NO:4; или
(D) белок, состоящий из аминокислот в последовательности, включающей делеции, замены, вставки или добавления одной или нескольких аминокислот в аминокислотной последовательности, указанной в SEQ ID NO:4, и который обладает по крайней мере одной из активностей префенатдегидратазы или хоризматмутазы.
6. ДНК, кодирующую белок, характеризующийся одним из следующих свойств (С) и (D):
(C) белок, состоящий из аминокислот в последовательности, указанной в SEQ ID NO:4; или
(D) белок, состоящий из аминокислот в последовательности, включающей делеции, замены, вставки или добавлнения одной или нескольких аминокислот в аминокислотной последовательности, указанной в SEQ ID NO:2, и который обладает по крайней мере одной из активностей префенатдегидратазы или хоризматмутазы.
7. ДНК по п.6, которая является ДНК, характеризующейся одним из следующих свойств (с) и (d):
(c) ДНК, состоящая из нуклеотидов в последовательности, указанной в SEQ ID NO:3; или
(d) ДНК, которая гибридизуется с нуклеотидной последовательностью, указанной в SEQ ID NO:3, или с зондом, приготовленным из указанной последовательности, в жестких условиях и кодирует белок, обладающий по крайней мере одной из активностей префенатдегидратазы или хоризматмутазы.
8. ДНК по п.7, где жесткие условия являются такими условиями, в которых отмывка происходит при 60°С, а концентрация соли соответствует 1×SSC и 0.1% SDS.
В настоящем изобретении термин “активность 3-дезокси-D-арабиногептулозонат-7-фосфатсинтазы” означает активность, которая катализирует реакцию синтеза 3-дезокси-D-арабиногептулозонат-7-фосфата из фосфоенолпирувата и D-эритроза-4-фосфата. Термин “активность префенатдегидратазы” означает активность, которая катализирует реакцию синтеза фенилпировиноградной кислоты из префеновой кислоты, термин “активность хоризматмутазы” означает активность, которая катализирует реакцию синтеза префеновой кислоты из хоризмовой кислоты. Предполагается, что PD, описанная в настоящем изобретении, обладает как активностью хоризматмутазы, так и активностью префенатдегидратазы, подобной другим микроорганизмам, таким как Escherichia coli. В настоящем изобретении термин “по крайней мере одна из активностей префенатдегидратазы или хоризматмутазы” означает одно или оба свойства, которыми обладает PD. Далее в настоящем изобретении термин “по крайней мере одна из активностей префенатдегидратазы или хоризматмутазы” может упоминаться как термин “активность PD”.
Далее настоящее изобретение будет объяснено подробнее.
ДНК согласно настоящему изобретению может быть получена из хромосомной ДНК М. Methylotrophus, как описано ниже.
Сначала приготавливается хромосомная ДНК из M. methylotrophus, например из штамма М. methylotrophus AS-1. Хромосомная ДНК может быть получена из клеточного осадка посредством, например, метода Saito и Miura (Biochem. Biophys. Acta, 72, 619 (1963)) или метода K.S.Kirby (Biochem. J., 64, 405 (1956)).
Затем для выделения генов DS и PD из хромосомной ДНК, полученной таким образом, приготавливается библиотека ДНК. Сначала хромосомная ДНК частично расщепляется с помощью подходящих ферментов рестрикции для получения смеси разнообразных фрагментов. Широкий круг ферментов рестрикции может быть использован, если степень расщепления регулируется временем реакции расщепления или подобным образом. Например, ферментам Suu3AI или BamHI предоставляется возможность проведения реакции с хромосомной ДНК для ее расщепления при температуре не ниже 30°С, предпочтительно при 37°С при концентрации ферментов 1-10 единиц/мл в течение различных промежутков времени (от 1 минуты до 2 часов).
Впоследствии для приготовления рекомбинантной ДНК полученные фрагменты ДНК лигируются в ДНК вектор, автономно реплицирующийся в клетках бактерий, принадлежащих к роду Escherichia. Конкретнее, ферменту рестрикции, который создает концевые нуклеотидные последовательности, комплементарные последовательностям, созданным ферментом рестрикции Sau3AI, использованным для расщепления хромосомной ДНК, например BumHI, предоставляется возможность прореагировать с ДНК вектора для его разрезания в условиях, когда температура поддерживается не ниже 30°С и концентрация фермента 1-100 единиц/мл, предпочтительно в течение 1-3 часов для его полного расщепления. Затем смесь фрагментов хромосомной ДНК, полученная, как описано выше, смешивается с разрезанной ДНК вектора и подвергается действию ДНК лигазы, предпочтительно Т4 ДНК лигазы, в условиях, когда температура поддерживается в интервале 4-16°С при концентрации фермента 1-100 единиц/мл в течение не менее чем 1 час, предпочтительно в течение 4-24 часов для получения рекомбинантной ДНК.
Полученная рекомбинантная ДНК используется для трансформации микроорганизма, принадлежащего к роду Escherichia, например, Escherichia coli В-7078 (pheA::Tn10(KmR)). Затем трансформанты помещаются на чашки с агаром, не содержащим фенилаланин, и полученные колонии переносятся в жидкую питательную среду и выращиваются. Для получения фрагмента ДНК, содержащего ген PD, из клеток выделяются плазмиды.
Содержит ли фрагмент ДНК, полученный описанным выше способом, ген PD или нет, подтверждается определением последовательности фрагмента и подтверждением, что полученная последовательность содержит последовательность, указанную в SEQ ID NO:3.
Было доказано, что клонированный фрагмент, содержащий ген PD, также содержит ген DS потому, что указанный фрагмент комплементирует ароматическую ауксотрофность штамма Е. coli AB3257 (aroG365-, aroH367-, aroF363-, thi-1, ilvC7, argE3, his-4, proA2, xyl-5 galK-2, lacYI, mtl-1, strA712, tfr3, tsx-358, supE44, hsdR2, zjj-202::Тn10), являющегося дефицитным по DS штаммом, и путем определения последовательности фрагмента.
В случае, когда для расщепления хромосомной ДНК штамма Methylophilus methylotropus AS-1 используется BamHI, гены DS и PD клонируются как BamHI-фрагмент размером около 10 kb.
Гены DS и PD из другой бактерии, принадлежащей к роду Melhylotropus, могут быть выделены методом, подобным описанному выше. Далее, поскольку нуклеотидная последовательность ДНК согласно настоящему изобретению выяснена, указанная ДНК может быть получена из хромосомной ДНК или геномной библиотеки бактерии, принадлежащей к роду Methylophilus, применяя ПЦР (полимеразную цепную реакцию) с использованием в качестве затравок олигонуклеотидов, синтезированных на основе установленной последовательности, или гибридизацией с использованием описанных выше олигонуклеотидов в качестве зонда.
Могут быть использованы обычные методы, хорошо известные лицу, имеющему опыт в приготовлении геномной ДНК, получении библиотеки геномной ДНК, гибридизации, ПЦР, получении ДНК плазмид, расщеплении и лигировании ДНК, трансформации. Указанные методики описаны в Sambrook, J., Fritsch, E.F., Maniatis Т. “Molecular Cloning: A Laboratory Manual. Second Edition”, Cold Spring Harbor Laboratory Press (1989).
Нуклеотидная последовательность гена DS, полученного, как описано выше, приведена в SEQ ID NO:1 в Списке последовательностей. Кроме того, аминокислотная последовательность белка, который может кодироваться этой нуклеотидной последовательностью, приведена в SEQ ID NO:2.
Нуклеотидная последовательность гена PD, полученного, как описано выше, приведена в SEQ ID NO:3 в Списке последовательностей. Кроме того, аминокислотная последовательность белка, который может кодироваться этой нуклеотидной последовательностью, приведена в SEQ ID NO:4.
ДНК согласно настоящему изобретению может кодировать DS или PD, включающие замены, делеции, вставки, добавления или инверсии одной или нескольких аминокислот в одном или нескольких положениях при условии, что активность DS или PD, кодированных таким образом, не повреждается. Количество “несколько” в случае аминокислот различается в зависимости от положения или типа аминокислотного остатка в трехмерной структуре белка. Это объясняется следующими причинами. А именно, некоторые аминокислоты, такие как изолейцин и валин, являются аминокислотами, обладающими высокой гомологией с другими аминокислотами. Различия в таких аминокислотах незначительно влияют на трехмерную структуру белка. Вследствие этого белком, кодируемым ДНК согласно настоящему изобретению, может быть белок, обладающий гомологией, не меньшей чем 35-50%, предпочтительно 50-70%, по отношению к исходным аминокислотным остаткам, составляющим DS или PD, и который обладает активностью DS или PD. Наиболее подходящим числом для “нескольких” аминокислот является от 2 до 30, предпочтительно от 2 до 20, наиболее предпочтительно от 2 до 10.
ДНК, кодирующая по существу такой же белок, как DS или PD, как описано выше, получается, например, такой модификацией нуклеотидной последовательности, к примеру, посредством метода сайт-направленного мутагенеза, что замена, делеция, вставка, добавление или инверсия затрагивают один или несколько аминокислотных остатков в определенном положении. Описанным выше модифицированная ДНК может быть получена известными, традиционными методами обработки с целью получения мутаций. Методы получения мутаций включают в себя метод обработки ДНК, кодирующей DS и PD, in vitro, например, гидроксиламином, и метод обработки микроорганизма, например бактерии, принадлежащей к роду Escherichia и содержащей ДНК, кодирующую DS и PD, УФ-облучением или мутагенным реагентом, таким как N-метил-N’-нитро-N-нитрозогуанидин (NTG) и азотистой кислотой, обычно используемым для обработки с целью получения мутаций.
Замена, делеция, вставка, добавление или инверсия нуклеотида, описанные выше, также включают мутации (мутанты или варианты), которые встречаются в природе, например, в виду индивидуальных различий или родовых и видовых различий микроорганизмов, содержащих DS и PD.
ДНК, кодирующая по существу такой же белок, как и DS и PD, выявляется при экспрессии ДНК, содержащей описанные выше мутации, в подходящей клетке и изучении активности DS и PD в экпрессированном продукте. ДНК, кодирующая по существу такой же белок, как и DS и PD, получается при выделении ДНК, которая гибридизуется с ДНК, имеющей, например, нуклеотидную последовательность, указанную в SEQ ID NO:1 в списке последовательностей, в жестких условиях, и кодирует белок, обладающий активностью DS и PD, среди содержащей мутации ДНК, кодирующей DS и PD, или клеток, содержащих такую ДНК. “Жесткими условиями”, упомянутыми здесь, являются условия, при которых образуется так называемый специфический гибрид, а неспецифический не образуется. Трудно четко указать эти условия с использованием численных значений. Однако, например, жесткими условиями являются условия, при которых ДНК с высокой гомологией, например ДНК с гомологией не менее 50%, гибридизуются друг с другом, а ДНК с гомологией ниже, чем указанная, не гибридизуются. С другой стороны, примером жестких условий являются условия, при которых ДНК гибридизуются друг с другом при концентрации солей, соответствующей обычным условиям отмывки при гибридизации по Саузерну, т.е. 60°С. 1×SSC, 0.1% SDS, предпочтительно 0.1×SSC, 0.1% SDS.
В число генов, которые гибридизуются в условиях, описанных выше, входят гены, содержащие стоп-кодон, расположенный в кодирующем участке гена, а также гены, кодирующие неактивный белок из-за мутаций в активном центре. Однако такие мутации могут быть легко исключены путем лигирования таких генов в коммерчески доступные экспрессирующие векторы и измерения активности DS и PD в соответствии с методами, описанными выше.
Примерами реципиентов для экспрессии генов DS и PD являются, например, бактерия, принадлежащая к роду Escherichia, такая как Escherichia coli, коринеформная бактерия, такая как Brevibacterium lactofermentum, бактерия, принадлежащая к роду Methylophilus, такая как Methylophilus methylotropus, другие разнообразные эукариоты, такие как Saccharomyces cerevisiae, клетки животных и растений, предпочтительно прокариоты, в частности Е.coli, коринеформные бактерии и М. methylotropus.
В число векторов, которые используются для введения гена DS или PD в Е. coli, входят, например, pUC19, pUC18, pBR322, pHSG299, pHSG399, pHSG398, RSF1010, pMW119, pMW118, pMW219 и pMW218. Фаговые ДНК векторы также могут быть использованы.
В число векторов, которые могут быть использованы для введения гена DS или PD в коринеформные бактерии, входят, например, рМА330 (см. выложенную патентную заявку Японии №58-67699), рНМ1519 (см. выложенную патентную заявку Японии №58-77895), pAJ655, pAJ611 и рАJ1844 (см. выложенную патентную заявку Японии №58-192900), pCG1 (см. выложенную патентную заявку Японии №57-134500), pCG2 (см. выложенную патентную заявку Японии №58-35197), pCG4 и pCG11 (см. выложенную патентную заявку Японии №57-183799), рНК4 (см. выложенную патентную заявку Японии №5-7491).
Введение гена DS и PD может быть осуществлено трансформацией реципиента, описанного выше, рекомбинантным вектором, полученным введением гена DS или PD в описанный выше вектор. Ген DS или PD может быть встроен в геном реципиента в соответствии с методом, основанным на использовании трансдукции, транспозонов (Berg, D.E. and Berg, C.M. Bio/Technol., 1, 417 (1983)), фага Мu (выложенная патентная заявка Японии №2-109985) или путем гомологичной рекомбинации (Experiments in Molecular Genetics, Cold Spring Harbor Lab. (1972)).
Белки DS и PD могут быть получены при выращивании клетки, в которую ген DS или PD введен в соответствии с описанным выше методом, продукции и накоплении DS или PD в питательной среде, сборе из среды. Питательная среда для выращивания может быть подобрана в соответствии с использованным здесь реципиентом.
Белки DS и PD, полученные описанным выше методом, если необходимо, могут быть выделены из клеточного экстракта или среды с помощью стандартных методов выделения ферментов, таких как ионообменная хроматография, гель-фильтрация, абсорбционная хроматография, осаждение из раствора и им подобные.
Микроорганизм, обладающий более высокой активностью DS или PD, чем исходный, может быть получен при использовании ДНК согласно настоящему изобретению. Это может быть осуществлено при трансформации микроорганизма вектором, содержащим ген DS или PD в экспрессирующей форме.
В число бактерий, которые могут быть использованы в настоящем изобретении, входят, например, Methylophilus methylotropus AS1 (NCIMB10515) или подобные. Methylophilus methylotropus AS1 (NCIMB10515) может быть предоставлена из Национальной коллекции промышленных и морских бактерий, NCIMB Lts., Torry Research Station 135, Abbey Road, Aberdeen AB9 8DG, United Kingdom.
Для улучшения продуктивности ароматических аминокислот, особенно L-фенилаланина, предпочтительна амплификация генов, кодирующих ферменты DS и PD.
Краткое описание рисунков.
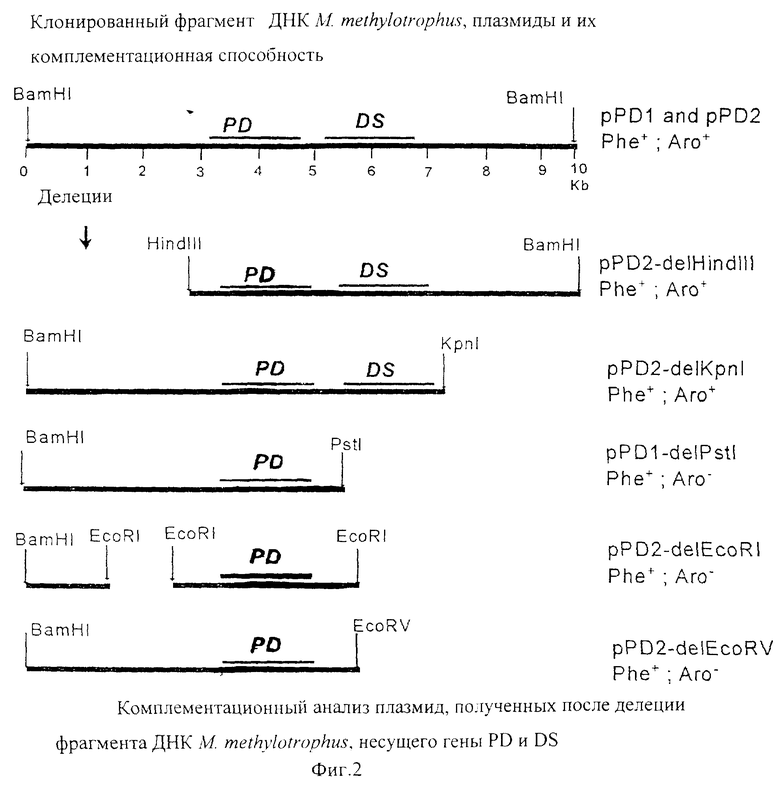
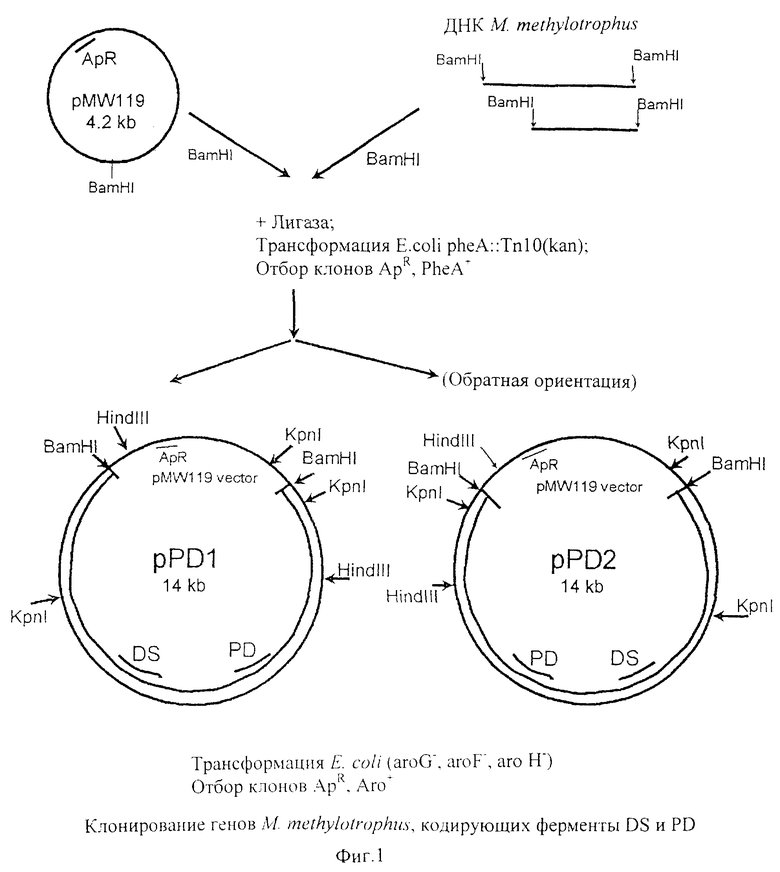
На фиг.1 приведена схема конструкции плазмид pPD1 и pPD2, содержащих гены DS и PD.
На фиг.2 показан комплементационный анализ плазмид, полученных после удаления фрагмента ДНК из М. methylotropus, содержащего гены DS и PD.
Лучший способ осуществления изобретения
BamHI фрагмент ДНК размером 10 kb, содержащий префенатдегидратазу и DAHP-синтазу из М. methylotropus, был клонирован в малокопийный вектор pMW119 (АрR) в ходе экспериментов по клонированию (shot-gun) по комплементации мутации в реципиенте (фиг.1). В ходе этих экспериментов хромосомная ДНК из М. methylotropus AS-1 была расщеплена с помощью BamHI и полученные фрагменты ДНК были лигированы с использованием Т4 ДНК лигазы с продуктом расщепления рестриктазой BamHI плазмиды pMW119. Продукт лигирования был использован для трансформации штамма Е.coli B-7078 (pheA::Tn10(KmR)). Среди клонов, устойчивых к ампициллину, были отобраны штаммы, в которых исчезла ауксотрофность по фенилаланину, и из этих штаммов были выделены рекомбинантные плазмиды. Одна из полученных плазмид была названа pPD1. Плазмида с обратной ориентацией клонированного в pPD1 фрагмента была названа pPD2.
Плазмиды pPD1 и pPD2 комплементировали к прототрофности не только мутации pheA- в штамме Е.coli В-7078, но и также DS-минус в штамме Е.coli AB3257 (aroG-, аrоH-, aroF-). Таким образом предполагалось, что обе плазмиды pPD1 и pPD2 несли гены, кодирующие PD и DS, в одном и том же клонированном фрагменте ДНК.
Были сконструированы производные плазмид pPD1 и pPD2, содержащие делеции (фиг.2), Делеции производились in vitro расщеплением ДНК плазмиды с помощью различных ферментов рестрикции с последующим лигированием полученных ДНК фрагментов. Смеси после лигирования использовались для трансформации PD-минус штамма Е. coli В-7078 (pheA::Tn10(kan)), чтобы получить Phe+ прототрофность. Выделенные плазмиды были картированы и проверены на способность комплементировать DS-минус в штамме Е. coli AB3257 (aroG-, аrоH-, aroF-), чтобы получить Аrо+ прототрофность. Производные, содержащие делецию, различались по структуре и комплементационной способности. Были найдены производные, несущие только один ген, кодирующий фермент PD. Такие производные, содержащие делецию, теряли способность комплементировать DS-минус в штамме Е.coli AB3257 (aroG-, аrоH-, aroF-), чтобы получить прототрофность.
Таким образом предполагалось, что клонированный в pPD1 и pPD2 ДНК фрагмент из М. methylotropus содержал два различных гена, кодирующих ферменты DS и PD соответственно.
Последовательности нуклеотидов двух генов из M. methylotropus, кодирующих ферменты DS и PD, были определены. Нуклеотидная последовательность гена DS и последовательность аминокислот, кодируемая этой нуклеотидной последовательностью, показаны в SEQ ID NO:1. Нуклеотидная последовательность гена PD и последовательность аминокислот, кодируемая этой нуклеотидной последовательностью, показаны в SEQ ID NO:3.
Нуклеотидные последовательности генов из M. methylotropus, кодирующих DS и PD, были проанализированы и охарактеризованы с помощью компьютерных программ. Последовательности генов DS и PD после трансляции были в значительной степени подобны аминокислотным последовательностям белков с теми же функциями из многих других микроорганизмов (таблицы 1, 2).
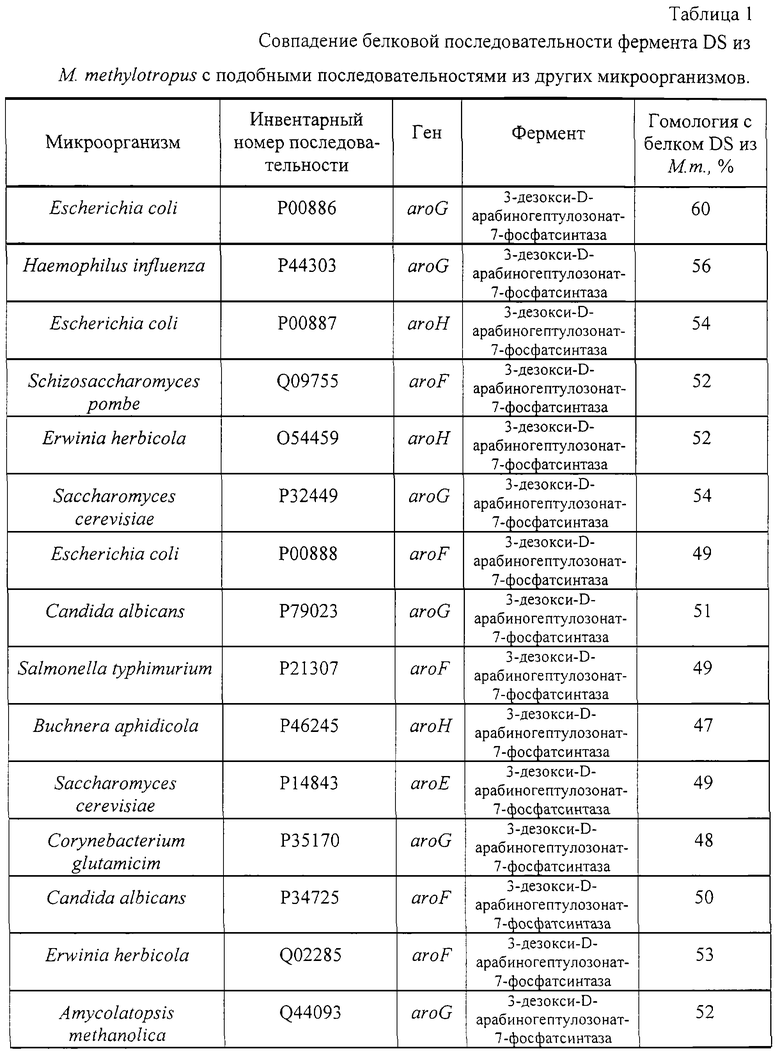
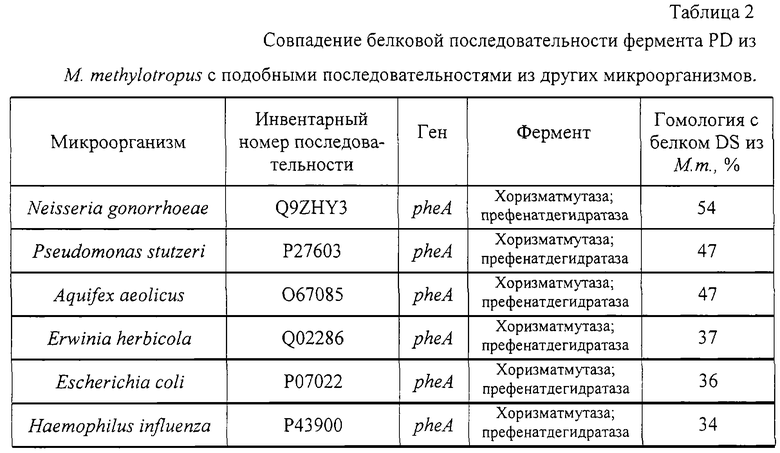





| название | год | авторы | номер документа |
|---|---|---|---|
| ПРЕФЕНАТДЕГИДРАТАЗА-ХОРИЗМАТМУТАЗА И ФРАГМЕНТ ДНК, КОДИРУЮЩИЙ ПРЕФЕНАТДЕГИДРАТАЗУ-ХОРИЗМАТМУТАЗУ, ИЗ БАКТЕРИИ Methylophilus methylotrophus | 2003 |
|
RU2250261C1 |
| СПОСОБ ПОЛУЧЕНИЯ L-ЛИЗИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИЙ Methylophilus И СПОСОБ ПОЛУЧЕНИЯ БАКТЕРИАЛЬНЫХ КЛЕТОК Methylophilus | 2000 |
|
RU2334794C2 |
| БАКТЕРИЯ, ПРОДУЦИРУЮЩАЯ L-АМИНОКИСЛОТУ, И СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ | 2000 |
|
RU2351653C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ | 2000 |
|
RU2250266C2 |
| БАКТЕРИЯ, ПРОДУЦИРУЮЩАЯ L-АМИНОКИСЛОТУ, И СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ | 2000 |
|
RU2368659C2 |
| СПОСОБ ПРОДУКЦИИ АРОМАТИЧЕСКИХ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Methylophilus | 2005 |
|
RU2333950C2 |
| МИКРООРГАНИЗМ ИЗ РОДА Escherichia, ОБЛАДАЮЩИЙ УСИЛЕННОЙ СПОСОБНОСТЬЮ К ПРОДУКЦИИ L-ТРИПТОФАНА, И СПОСОБ ПОЛУЧЕНИЯ L-ТРИПТОФАНА С ЕГО ИСПОЛЬЗОВАНИЕМ | 2013 |
|
RU2593957C2 |
| ДНК, КОДИРУЮЩАЯ БЕЛОК, КОТОРЫЙ УЧАСТВУЕТ В СИНТЕЗЕ ТРЕГАЛОЗЫ (ВАРИАНТЫ), И СПОСОБ ПОЛУЧЕНИЯ L-ГЛУТАМИНОВОЙ КИСЛОТЫ (ВАРИАНТЫ) | 2001 |
|
RU2276189C2 |
| СПОСОБ ПРОДУКЦИИ БЕЛКА | 2006 |
|
RU2435863C2 |
| НОВЫЙ ВАРИАНТ DAHP СИНТАЗЫ И СПОСОБ ПОЛУЧЕНИЯ L-ЛИЗИНА С ЕГО ПРИМЕНЕНИЕМ | 2021 |
|
RU2794484C1 |
Изобретение относится к биотехнологии, а именно к 3-дезокси-D-арабиногептулозонат-7-фосфатсинтазе и фрагменту ДНК, кодирующему этот фермент. 3-дезокси-D-арабиногептулозонат-7-фосфатсинтаза выделена из Methylophilus methylotrophus и может содержать замены, делеции, вставки или добавления одной или нескольких аминокислот в аминокислотной последовательности и при этом сохранять свою активность. Данный фермент играет ключевую роль в биосинтезе ароматических соединений, таких как L-фениламанил, L-тирозин и L-триптофан. Данное изобретение позволяет улучшить продуктивность L-аминокислот за счет усиления активности ферментов, вовлеченных в пути биосинтеза L-аминокислот. 2 с.п.ф-лы, 2 табл., 2 ил.
| Кипятильник для воды | 1921 |
|
SU5A1 |
| US 5985617, 16.11.1999 | |||
| Глубокий насос | 1940 |
|
SU77196A1 |
| Роторное транспортирующее устройство | 1974 |
|
SU608722A1 |
| ЩЕЛКУНОВ С.Н | |||
| Конструирование гибридных молекул ДНК, Новосибирск, “Наука”, 1987, стр.164. | |||
Авторы
Даты
2004-05-27—Публикация
2000-11-13—Подача