Изобретение относится к области медицины и медицинского приборостроения, а именно к способу оптической диагностики физиологического и патофизиологического состояния биологических тканей, а также к реализующей этот способ медицинской диагностической аппаратуре, предназначенной для неинвазивного (неразрушающего, прижизненного) контроля и мониторинга физиологического состояния тканей человека. Изобретение основано на методах получения информации путем облучения исследуемого участка ткани источниками лазерного или узкополосного светодиодного излучения с различной длиной волны, мощностью, поляризацией и другими физическими параметрами луча, освещающего ткань, и последующим частотно-спектральным и/или амплитудно-спектральным анализом параметров вышедшего из ткани вторичного излучения (отраженного, рассеянного, наведенного, возбужденного, фонового и т.п.).
Известны общие физические и медико-биологические принципы и устройства для такой диагностики.
Известен способ и устройства для флюоресцентной неинвазивной медицинской диагностики злокачественных новообразований в тканях (RU 2012243 С1 15.01.1994, US 5647368 15.07.1997 и др.).
Известен способ и устройства для неинвазивного определения процентного содержания оксигемоглобина крови (методы неинвазивной оксиметрии), протекающей по сосудам тканей и органов человека (US 4714341 1987, WO 94/03102 и др.).
Известен способ и устройства для фотоплетизмографической диагностики параметров сердечных ритмов (систолических и диастолических волн) кровообращения в тканях и органах (SU 1655463 A1, RU 5912 U1, 16.02.98 и др.).
Известен способ и устройство для определения скорости капиллярного кровотока с использованием эффекта Доплера, а также методики оценки состояния биотканей на их основе (US 4596254 от 24.06.1986, RU 2140199 С1 от 27.10.1999 и др.).
Известен способ и устройство для биофотометрического контроля состояния пораженных биологических тканей (SU 1545346 A1 от 18.06.1984; SU 1481938 A1 от 19.11.1985).
Однако перечисленные известные методы и устройства имеют ряд существенных недостатков. Так, описываемые устройства для флюоресцентной диагностики не учитывают возможность внесения существенной ошибки в измерения за счет того, что исходное освещающее излучение и сигнал флюоресценции, возникающий при облучении биоткани и регистрируемый приемной аппаратурой, могут существенно и независимо друг от друга ослабляться из-за наличия в ткани поглощающих свет сторонних веществ (меланина, биллирубина и т.д.). Это приводит к неконтролируемому данными методами изменению соотношений сигналов, что сказывается на достоверности и объективности диагностики. Описываемые методы неинвазивной оксиметрии, привязанные к технологии вычисления содержания оксигемоглобина в крови во время пульсовых волн периферического кровообращения, позволяют определять лишь процентное, а не абсолютное содержание оксигемоглобина и только в артериальном русле сосудистой системы. Такая информация является неполной, т.к. физиологически клиническое состояние ткани сильно зависит не только от количества подводимого к ней кислорода, но и от возможности его “утилизовать” в процессе обмена веществ. Т.е. для более полной клинической картины наблюдаемых в тканях процессов желательно иметь возможность определения содержания оксигемоглобина и в венозном русле сосудистой системы. Методы фотоплетизмографической диагностики являются методами качественной оценки динамических пульсаций кровотока, т.к. так же как и методы флюоресцентной диагностики не учитывают изменения в уровнях сигналов за счет присутствия в тканях поглощающих свет веществ и за счет неконтролируемого уровня внутреннего пространственного рассеяния света на неоднородностях структур (поверхности эритроцитов, например), общее количество которых переменно при динамической пульсации крови. Все это для методов фотоплетизмографии приводит к невозможности вычисления точных количественных параметров кровенаполнения биоткани по измеренным сигналам и соответственно слабой информативности этих методов. И так далее.
Наиболее близким по сути принятых технических решений прототипом для данного заявляемого устройства является диагностический аппарат, описанный в международной заявке WO 97/15226. Аппарат содержит:
- источник(и) первичного (пробного) электромагнитного излучения широкого спектрального диапазона длин волн;
- средства доставки излучения от источника к диагностируемой биологической ткани;
- средства регистрации отраженного от биоткани излучения и излучения вынужденной (наведенной) флюоресценции (аутофлюоресценции);
- средства обработки полученных ответных сигналов от биоткани для получения медицинской диагностической информации;
- средства регулировки интенсивности исходного (пробного) излучения, включающие цепи обратной связи для управления выходной мощностью по сигналам с приемников излучения от ткани.
В качестве дополнительных устройств в аппарате-прототипе заявлены эталон отражения (калибратор), позволяющий имитировать сигналы от здоровых и больных тканей и осуществлять относительную методику диагностики по соотношению сигналов биоткань/эталон, дополнительный фотоплетизмограф для определения микроциркуляции ткани, видеокамера регистрации изображения зоны обследования и ряд других дополнительных узлов и блоков, расширяющих возможности аппаратуры и позволяющих модифицировать варианты исполнения источника излучения, тракта доставки излучения к биоткани и т.д.
Базовая методика диагностики, описанная для указанного выше устройства, заключается в подведении пробного электромагнитного (например, оптического диапазона длин волн) излучения к обследуемому участку биоткани и регистрации отраженного первичного и/или стимулированного (вторичного) флюоресцентного излучения от биоткани с последующим анализом амплитуды и оптического спектрального состава зарегистрированного излучения. Сравнение полученных данных с данными от эталонного отражателя или от заведомо здоровых тканей позволяет делать прогноз относительно состояния ткани в терминах “норма-патология”.
К основным недостаткам устройства, взятого за прототип, относятся:
1) Построение конструкции устройства и методик измерения по принципу регистрации и обработки только отраженного от ткани или наведенного в области отражения вторичного излучения. Этот недостаток сильно ограничивает диагностические возможности аппаратуры для реальной медицинской практики, т.к. известно (Тучин В.В. Лазеры и волоконная оптика в биомедицинских исследованиях, - Саратов, СГУ, 1998), что подавляющее большинство биологических тканей являются, например для оптического диапазона длин волн, полупрозрачными и мутными (неоднородными) средами, при взаимодействии с которыми излучение не только отражается от них, но и проникает в их толщу, рассеивается внутри среды по разным направлениям, частично поглощается средой или преобразуется в излучение других длин волн и выходит из ткани наружу, составляя, так называемый, поток обратно-рассеянного излучения, который во много раз может превосходить по величине отраженный поток и который за счет глубинных, многократных взаимодействий излучения с толщей среды несет в себе намного больше информации о свойствах среды.
2) Отсутствие в устройстве возможности анализа динамических параметров амплитуд регистрируемых сигналов (частотного спектра получаемого электрического сигнала) на малых отрезках времени (10-6 с - 1 с) в каждом спектральном диапазоне длин волн, которые несут богатую информацию о параметрах микроциркуляции крови и других жидкостей в обследуемом участке ткани, что делает диагностику на данном аппарате малоинформативной в смысле медицины для реальных живых биотканей.
Кроме того, общим существенным недостатком всех перечисленных известных способов и устройств является то, что каждый из этих способов и устройств предназначен для диагностики оптическими методами отдельно выбранных медико-биологических параметров ткани в отрыве от совокупности других ее медико-биологических параметров, которые также могут влиять на регистрируемые прибором оптические свойства тканей и соответственно сказываться на точности, достоверности и общей медицинской информативности (значимости), получаемой в результате проведения диагностики информации. В подавляющем большинстве случаев в известных методах и устройствах критериями обнаружения областей патологий в тканях являются критерии сравнения показателей с обследуемых подозрительных тканей и тканей, считающихся здоровыми (например, RU 2012243), причем эти критерии разрабатываются для каждого прибора отдельно на этапе его создания в идеализированных условиях лабораторий и на ограниченной выборке больных с конкретным типом (типами) заболевания. Однако при проведении реальных обследований пациентов в клинике врач заранее, как правило, не имеет никакой априорной информации о том, какие участки ткани могут являться здоровыми, а какие поражены заболеванием. Кроме того, реальные пациенты клиник могут иметь множественные и сопутствующие основному заболеванию нарушения, скажем общую сердечную недостаточность и вызванные ей нарушения периферического кровообращения, которые сказываются на оптических свойствах всех тканей всего организма и не позволяют иметь опорную информацию типа “нормальная ткань”. Соответственно, указанные известные способы и приборы не могут охватить всего многообразия встречающихся на практике типов, нозологических форм и разновидностей заболеваний тканей и органов человека. Точность, достоверность и медицинская значимость такой раздельной диагностики частных медико-биологических параметров по отдельно взятым оптическим показателям весьма низка, а применение указанных приборов ограничено рядом отдельных клинических ситуаций.
Предложенное изобретение основано на том, что все оптико-физические свойства биотканей очень сильно зависят от общего физиологического и патофизиологического состояния ткани (Физиология человека: В 3-х томах. Пер. с англ. / Под ред. Р.Шмидта и Г.Тевса. - М.: Мир, 1996). Они могут сильно меняться в зависимости от параметров кровообращения в тканях, от способности дыхательных органов и форменных элементов крови насыщать ткани кислородом, от параметров клеточного дыхания и метаболизма и т.д. Общие интегральные оптические свойства биотканей зависят от оптических свойств отдельных слоев и типов тканей, составляющих общее понятие “биологическая ткань”. А оптические свойства отдельных слоев и типов тканей сильно зависят от процентного содержания в них основных хромофоров, флюорохромов и других оптически “активных” веществ, имеющих характерные полосы спектрального поглощения, рассеяния и/или люминесценции (например, меланина, гемоглобина, биллирубина, природных порфиринов, флавинов, воды и т.п.) (Wai-Fung Cheong et. al. A review of the optical properties of biological tissues. / IEEE J. of Quant. Electronics, Vol. 26(12), 1990. - pp. 2166-2185). Общее накопление этих оптически “активных” биохимических компонентов в тканях, а также параметры периферического тканевого кровообращения и лимфатического дренажа (параметры микроциркуляции крови и других жидкостей в тканях) и определяют общее функциональное, физиологическое и патофизиологическое состояние ткани, в том числе ее “нормальное” состояние или состояние болезни. Поэтому только интегральная оценка в совокупности всех или большинства указанных компонент позволяет более или менее достоверно оценивать наличие и степень тяжести существующих в тканях нарушений (патологий). Такая интегральная оценка может быть проведена при условии, что по регистрируемым оптическим сигналам, выходящим из биоткани, в процессе диагностики определяются физико-математическими вычислительными методами как все основные оптико-физические параметры среды распространения излучения, включая динамические характеристики изменчивости свойств среды во времени (параметры изменчивости регистрируемых оптических сигналов во времени), так и основные статические биохимические параметры - уровни накопления в тканях тех или иных биохимических компонент ткани. При этом под физиологическим состоянием ткани понимаются следующие (для примера) известные в медицине состояния ткани:
- Нормальное состояние
- Злокачественные новообразования
- Стадии язвенно-некротического процесса (некроз, рубцевания)
- Дистрофические изменения
- Регенераторные процессы в раневой поверхности
- Некроз и другие состояния.
Таким образом, задачами, решаемыми предлагаемым способом и реализующим его устройством, является:
- устранение указанных недостатков известных способов и устройств, а также недостатков прямого прототипа заявленного способа и устройства;
- обеспечение возможности диагностики общего физиологического и патофизиологического состояния обследуемых тканей через регистрацию совокупности оптически активных компонент и динамических процессов в тканях;
- повышение точности, достоверности и медицинской информативности диагностических процедур, которые будут обеспечиваться применением на практике данного способа и реализующего его устройства;
- расширение функциональных возможностей диагностических процедур и обеспечение возможности использования заявляемых способа и устройства в различных областях медицины, таких, например, как, онкология, ангиология, дерматология, гастроэнтерология, травматология, трансплантология и др.
Технический и медико-биологический результаты от использования предлагаемого способа и устройства достигаются следующим образом.
Способ определения состояния биологической ткани заключается в том, что воздействуют на исследуемый участок биологической ткани электромагнитным излучением оптического диапазона длин волн с использованием одновременно или поочередно не менее чем двух длин волн. Это излучение проникает внутрь ткани, частично поглощается внутри ткани биохимическими хромофорами, рассеивается на неоднородностях структуры ткани, преобразуется за счет взаимодействия с некоторыми органическими молекулами (например, молекулами порфирина) в излучение флюоресценции, фосфоресценции, комбинационного (рамановского) рассеяния и т.п., т.е. в общем случае, меняет свои спектральные и пространственно-энергетические характеристики в зависимости от особенностей исследуемой биоткани и за счет актов многократного рассеяния, в конечном итоге, частично выходит наружу по всей обследуемой поверхности, составляя так называемое вторичное оптическое излучение с поверхности биоткани. Вышедшее из ткани вторичное оптическое излучение, несущее за счет измененных своих спектральных и пространственно-энергетических характеристик информацию о медико-биологическом состоянии исследуемой ткани, одновременно регистрируют не менее чем в двух пространственных точках на поверхности исследуемого участка биологической ткани на разном расстоянии от участка воздействия, так, чтобы зарегистрировать тенденцию в изменении параметров вторичного излучения на каждой воздействующей длине волны за счет разницы в длине пути вторичного излучения внутри биоткани от участка воздействия до точек регистрации. Анализируют спектральные статические и динамические характеристики вторичного излучения для каждой точки регистрации и при каждой из используемых длин волн. А собственно физиологическое состояние биологической ткани определяют далее на основе анализа совокупности спектральных статических и динамических характеристик регистрируемого вторичного оптического излучения для каждой из точек регистрации и каждой из воздействующих длин волн путем вычисления по этим данным количественного накопления в исследуемом участке биологической ткани оптически активных природных биохимических компонент ткани и параметров состояния ее микроциркуляторного русла. При этом динамические параметры регистрируемого вторичного излучения для каждой из точек регистрации определяют на основе частотного по времени, например, Фурье-анализа спектров флуктуации вторичного излучения, которые регистрируют быстродействующими фотоприемниками на длинах волн воздействующего излучения, а статические спектральные данные для каждой из точек регистрации определяют путем анализа спектральной оптической плотности вторичного излучения как на воздействующих длинах волн, так и на длинах волн флюоресценции, фосфоресценции и/или комбинационного рассеяния за счет разложения вторичного излучения в оптический спектр и одновременной регистрации всего полученного спектра набором чувствительных фотоприемников. Под статическими спектральными данными в данном случае подразумеваются средние по времени спектральные плотности мощности регистрируемого вторичного излучения для каждой пространственной точки сбора информации по поверхности биоткани как на длинах волн возбуждающего электромагнитного излучения, так и на длинах волн бокового спектра - длинах волн флюоресценции, фосфоресценции и/или комбинационного рассеяния (рамановского рассеяния), по которым можно вычислить средние по времени уровни накопления в зоне обследования таких оптически активных биохимических составляющих ткани, как порфирины, флавиновые и пиридиннуклеотидовые ферменты, коллаген, гемоглобин, оксигемоглобин и т.п. вещества. А под динамическими параметрами регистрируемого вторичного излучения для каждой из точек регистрации по поверхности биоткани подразумеваются колебания в амплитудах сигналов на каждой из длин волн воздействующего излучения в диапазоне частот 0,01 Гц-50 кГц, которые несут в себе информацию о динамических параметрах микроциркуляции крови в обследуемой биоткани - ритмах кровотока, связанных с сердечными ритмами, средней скорости капиллярного кровотока (за счет эффекта Доплера) и т.п. При окончательном определении состояния биологической ткани по результатам диагностики по описываемому способу и построении заключительного вычислительного процесса на первом этапе обработки данных путем решения обратной задачи оптики светорассеивающих сред с использованием средних статических спектральных данных на воздействующих длинах волн определяют значения погонных оптических коэффициентов поглощения и рассеяния излучения биотканью и/или ее отдельными слоями, на втором этапе обработки данных по полученным статическим спектральным данным на длинах волн флюоресценции, фосфоресценции и/или комбинационного рассеяния с использованием результатов предыдущего этапа вычислений определяют уровни накопления в биоткани и/или ее отдельных слоях оптически активных биохимических компонент ткани (гемоглобина, оксигемоглобина, флавиновых ферментов, коллагена и т.п.), а по зарегистрированным динамическим данным с использованием методов обработки данных, применяемых в лазерной доплерографии и фотоплетизмографии, определяют динамические параметры микроциркуляции крови в исследуемой ткани. На последнем, третьем этапе обработки данных по полученным совокупным данным второго этапа вычислений с использованием статистико-вероятностных алгоритмов классификации многопараметрической ситуации определяют наиболее вероятное фактическое физиологическое состояние обследуемой биоткани из общепринятой в медицине классификации состояний - норма, воспаление, ишемия, эрозивно-язвенный процесс и т.п.
При проведении диагностики длины волн воздействующего электромагнитного излучения выбирают в соответствии с характерными полосами оптического поглощения, рассеяния и/или полосами возбуждения флюоресценции (фосфоресценции) тех биохимических компонент биоткани, которые необходимы для определения того или иного типа физиологического состояния. При распространении внутри биоткани излучение именно этих длин волн будет наиболее сильно менять свои спектральные и пространственно-энергетические характеристики. Например, будет сильно ослабляться внутри кровенаполненной ткани излучение с длинами волн 405-410 нм за счет сильного поглощения его гемоглобином и оксигемоглобином крови, которые в этом спектральном диапазоне имеют особо интенсивные полосы поглощения - так называемые “полосы Соре”. Это поглощение, в общем случае, описывается известным уравнением переноса излучения в мутных средах (Тучин В.В. Лазеры и волоконная оптика в биомедицинских исследованиях, - Саратов, СГУ, 1998), зависит от концентрации гемоглобина и оксигемоглобина в тканях и может быть описано, как некая функция расстояния от точки входа излучения в биоткань (точки освещения поверхности биоткани). Таким образом, получение информации об исследуемой ткани от двух, трех, четырех и более пространственных точек по поверхности исследуемой биоткани, расположенных на разном расстоянии от области первичного воздействия (освещения), путем замера выходящего из ткани вторичного излучения при ее освещении различными длинами волн позволяет определить совокупность процентного содержания в тканях основных биохимических компонентов ткани, взаимодействующих с освещающим ткань оптическим излучением.
Диагностическая система для определения состояния биологической ткани, реализующая предлагаемый способ диагностики, включает в себя блок источников электромагнитного излучения, которые генерируют излучение в оптическом диапазоне длин волн, систему транспортировки излучения от источников излучения к исследуемой биологической ткани и систему транспортировки вторичного излучения от биологической ткани в систему обработки сигналов от оптических приемников.
Блок источников излучения включает смеситель излучения источников излучения, соединенный далее с системой транспортировки излучения от источников излучения к исследуемой биологической ткани. Смеситель может быть выполнен в виде оптического моноволокна, сопряженного с отдельными оптическими волокнами, идущими от каждого источника излучения и собранными в единый оптический жгут, что позволяет доставлять излучение разных источников в одну и ту же точку исследуемой поверхности биологической ткани.
Система транспортировки вторичного излучения от биологической ткани в систему обработки сигналов содержит не менее двух независимых оптических приемников излучения, установленных на разном расстоянии от выхода системы транспортировки излучения от блока источников излучения к биологической ткани. Это позволяет каждому приемнику воспринимать вторичное излучение с поверхности биологической ткани на разном расстоянии от участка воздействия на ткань электромагнитным излучением источников. Как вариант, системы транспортировки вторичного излучения и транспортировки излучения от блока источников к исследуемой биологической ткани могут быть выполнены в виде оптических волокон, заключенных в единую гибкую оболочку (единый жгут).
Система обработки сигналов получает данные от системы транспортировки вторичного излучения и содержит соответственно в системе транспортировки вторичного излучения не менее двух одинаковых блоков, соединенных с выходом системы транспортировки вторичного излучения от биологической ткани и входом блока обработки результатов диагностики. При этом каждый из этих одинаковых блоков включает в себя по два спектральных оптических блока, первый из которых регистрирует сигналы основного спектра на длинах волн источников излучения быстродействующими фотоприемниками, а второй разлагает излучение в оптический спектр с помощью полихроматора с дифракционной решеткой и регистрирует наряду с сигналами на длинах волн источников излучения слабые сигналы боковых спектров неупругого взаимодействия - сигналы флюоресценции, фосфоресценции и/или комбинационного рассеяния - набором чувствительных фотоприемников, например линейкой фотоприемников на основе ПЗС-структур (Полупроводниковые фотоприемники: ультрафиолетовый, видимый и ближний инфракрасный диапазоны спектра / Под ред. В.И.Стафеева - М.: Радио и Связь, 1984, -с. 185-190). В каждый из этих двух спектральных оптических блоков одновременно доставляется определенная доля, например, по 50% оптического излучения из системы транспортировки вторичного излучения за счет разделения пучка света примерно на два равных пучка перед этими блоками делителем излучения.
Первый спектральный оптический блок в каждом блоке системы обработки сигналов может быть выполнен из “n” быстродействующих фотоприемников, например фотодиодов ФД-7К, и селективных по спектру зеркал, установленных перед фотоприемниками для выделения необходимых для регистрации спектральных диапазонов длин волн. Как вариант, первый спектральный оптический блок может быть выполнен и иначе - из “n” быстродействующих фотоприемников и неселективных по спектру делителей вторичного излучения. В этом случае перед фотоприемниками установлены селективные по спектру оптические фильтры, выделяющие необходимые для регистрации спектральные диапазоны длин волн.
Выходы фотоприемников первого спектрального оптического блока соединены с входом блока предварительного усиления, выполненного в виде набора из “n” широкополосных усилителей электрических сигналов, выход блока предварительного усиления связан со входом блока выделения и усиления сигнала, выход которого соединен с входом блока оцифровки сигналов, выход блока оцифровки через блоки коммутации и передачи соединен с входом блока обработки результатов диагностики.
Второй спектральный оптический блок в каждом блоке системы обработки сигналов может быть выполнен по схеме полихроматора с использованием, например, дифракционной решетки в качестве диспергирующего элемента. Он также содержит оптическую систему формирования луча и в нем в качестве фотоприемников установлены чувствительные фотоприемники, например, на основе ПЗС-структур, регистрирующие весь полученный в этом блоке оптический спектр.
Выходы фотоприемников второго спектрального оптического блока связаны через блоки усиления, оцифровки сигналов, коммутации и передачи с входом блока обработки результатов диагностики.
Изобретение поясняется чертежами, на которых изображено:
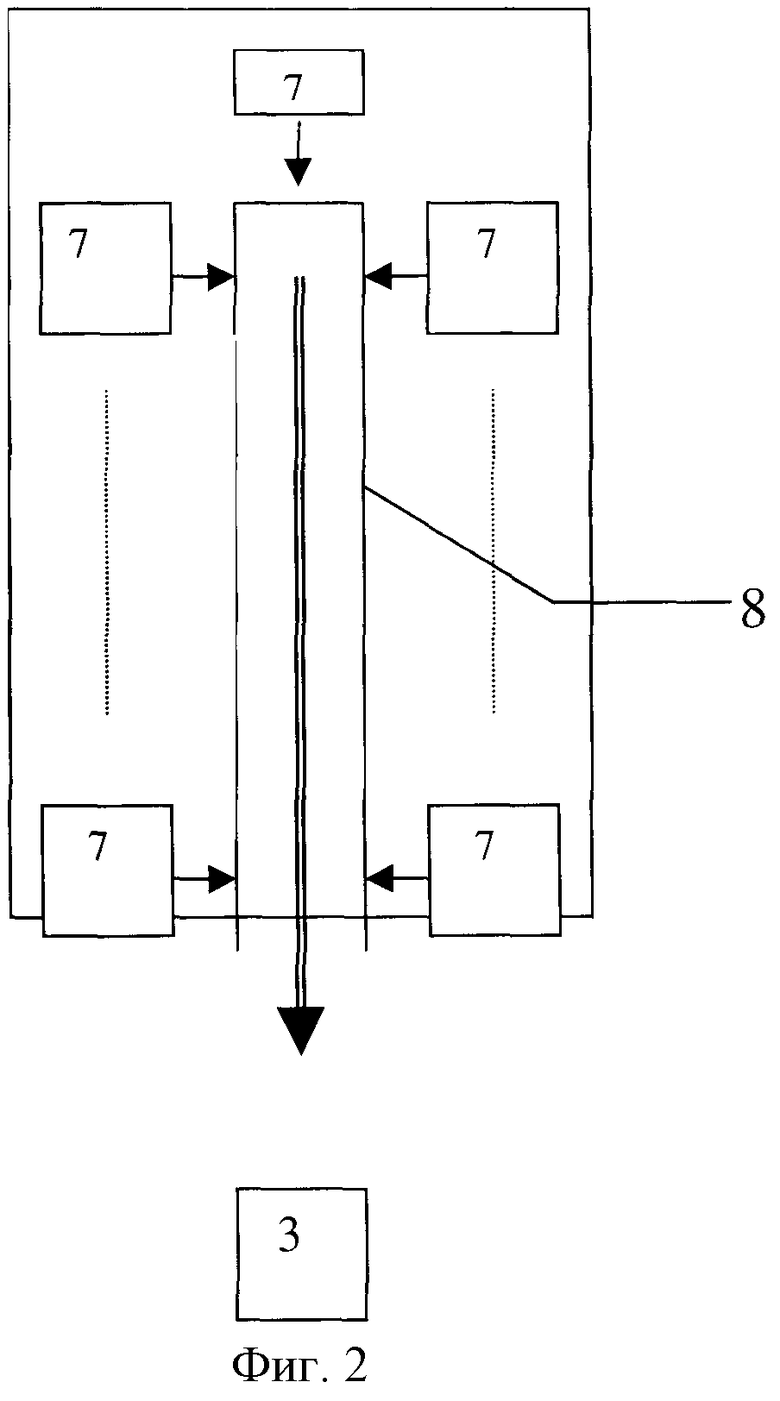
на фиг.1 - общая блок-схема предлагаемой диагностической системы; на фиг.2 - блок-схема блока источников излучения; на фиг.3 - устройство спектральных оптических блоков; на фиг.4 - блок-схема алгоритма обработки данных; на фиг.5 - схематическое пояснение уравнения переноса.
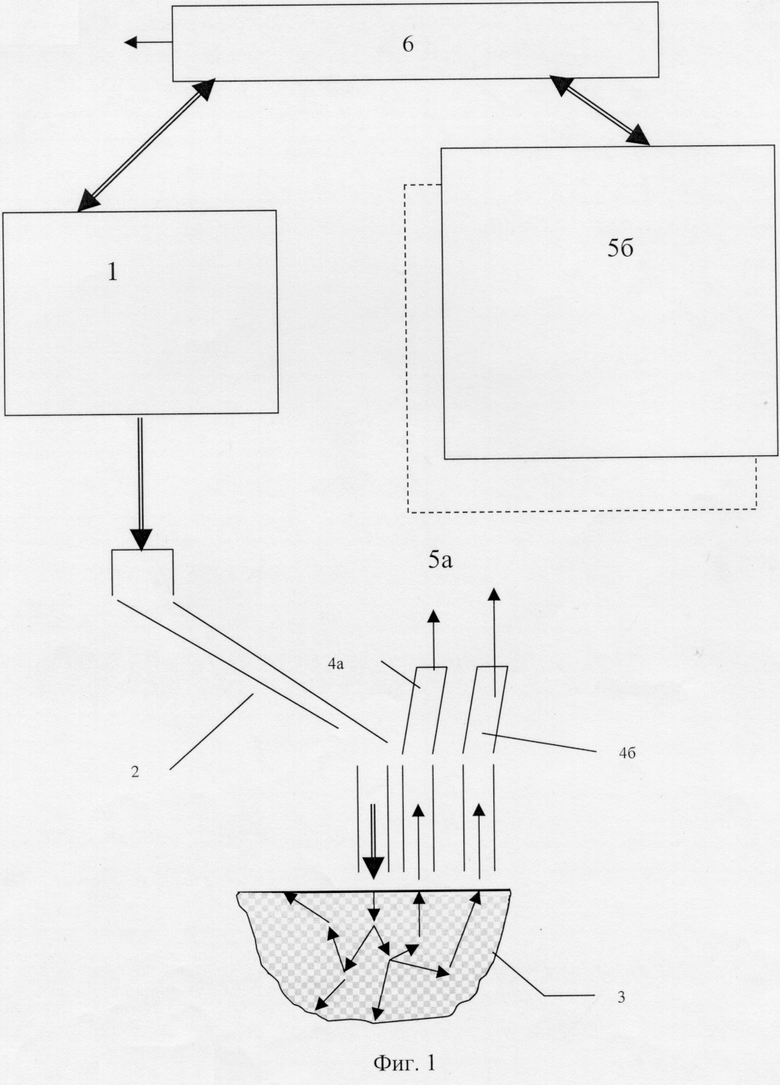
Предлагаемая диагностическая система (фиг.1), как описано выше, содержит в своем составе четыре основных блока: блок источников первичного узкополосного оптического излучения 1, систему транспортировки излучения 2 от блока источников к исследуемой биологической ткани 3, систему транспортировки вторичного излучения 4 от биологической ткани в систему обработки сигналов 5 и собственно систему обработки сигналов 5. При этом система обработки сигналов 5 выполнена в виде двух или более одинаковых оптоэлектронных блоков (6а, 6б и т.д.) и блока обработки результатов диагностики 7. Регистрируемые оптические сигналы от биологической ткани поступают в систему обработки сигналов 5 в каждый из блоков 6а, 6б и т.д. через соответствующие системы транспортировки вторичного оптического излучения 4а, 4б и т.д.
Блок источников первичного излучения (фиг.2) состоит из набора (не менее 2 шт.) лазерных и/или светодиодных источников излучения 8, каждый из которых работает в своем отдельном узком спектральном диапазоне длин волн из общего спектрального интервала 0,2 -100 мкм. Выходы источников излучения 8 соединены со смесителем излучения 9, обеспечивающим одновременный или поочередный ввод излучения всех источников в единую систему транспортировки излучения 2 (например, световод) к биоткани 3. Соединение может быть выполнено посредством сбора в единый жгут всех отдельных оптических волокон, идущих от каждого излучателя, и присоединением этого жгута далее на вход к смесителю, который может представлять собой единое оптическое моноволокно большего или равного жгуту диаметра. Соединение и сам смеситель может быть также, как вариант, выполнены на основе оптических элементов - посредством системы линзовых объективов, коллиматоров и/или селективных полупрозрачных зеркал, фокусирующих и направляющих излучение в общее оптическое волокно или на общий выходной объектив, освещающий биоткань.
Как вариант, блок источников излучения может быть выполнен на основе набора перестраиваемых по длине волны лазеров и/или светодиодов, а также на основе набора широкополосных, например ламповых, источников света в комплекте со сменным набором светофильтров, каждый из которых вырезает из общего спектра лампы нужный диапазон длин волн. Дополнительно для обеспечения контроля работоспособности источников оптического излучения и системы транспортировки излучения от блока источников излучения к исследуемой биологической ткани диагностическая система может быть оснащена встроенной системой контроля мощности оптического излучения источников.
Выбор количества излучателей и их рабочих длин волн осуществляется на основе необходимости определения в тканях того, или иного набора биохимических компонент (биомолекул, клеток) и их динамических параметров. Конкретные рабочие длины волн выбираются из условия их соответствия характерным спектральным полосам поглощения, рассеяния, люминесценции и т.п. регистрируемых биохимических компонент. Данные длины волн в общем случае хорошо известны из литературных источников (Юденфренд С. Флуоресцентный анализ в биологии и медицине, - М.: Мир, 1965; MJ.Gemert, S.L.Jacgues et.al Skin Optics / Biomed. Engineering, v.36, # 12, 1989, - p. 1146-1154).
Транспортировка исходного воздействующего оптического излучения (см. фиг.1) от блока источников излучения к биоткани и регистрируемого вторичного излучения от биоткани обратно в устройство осуществляется системами транспортировки 2 и 4, выполненными, например, на основе оптических световодов или оптических объективов, наведенных на освещение и обзор определенных пространственных областей на биоткани. При этом система транспортировки 2 позволяет освещать определенный и ограниченный ее выходной апертурой локальный участок тестируемой биоткани одновременно или поочередно на всех выбранных длинах волн, а система транспортировки 4 располагается (для световодов) или выполняется (для объективов) так, что воспринимает лишь вышедшее из ткани рассеянное внутри нее излучение в совокупности с наведенным излучением флюоресценции, фосфоресценции и т.п. как в непосредственной близости от освещенного участка биологической ткани (узел 4а), так и на некотором другом (0,01-10 см) расстоянии от него (узел 4б и т.д.). Системы транспортировки излучения 2 и 4 могут быть выполнены в виде оптических волокон, собранных в жгут с диаметром не более 2 мм.
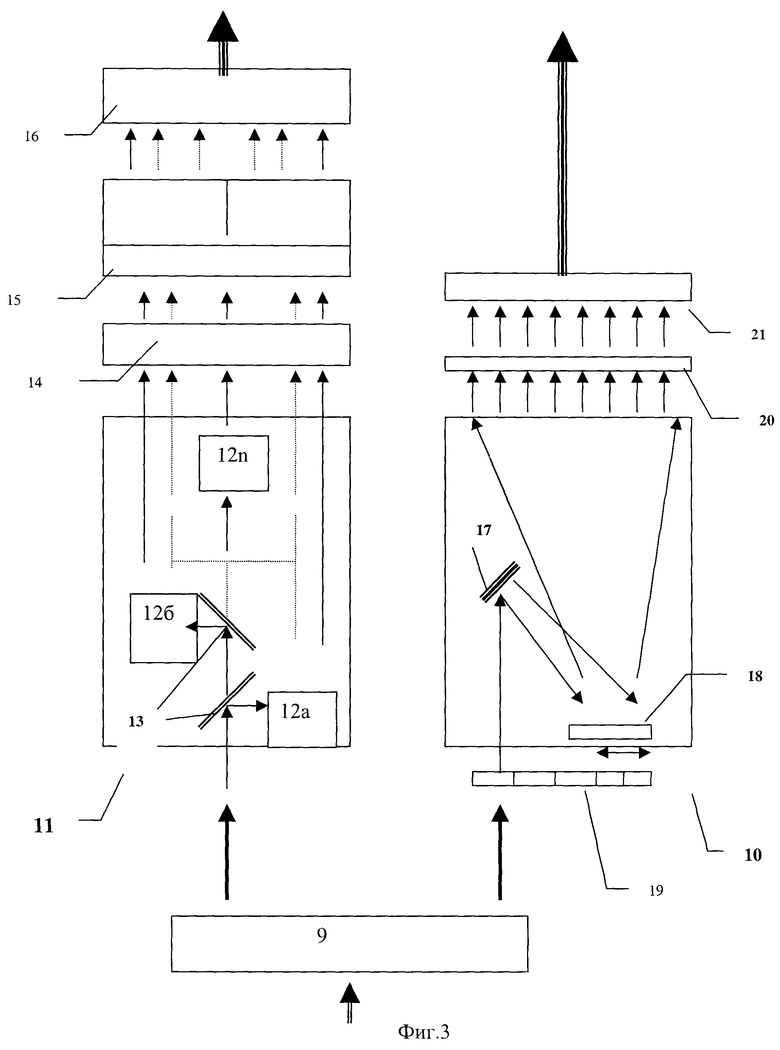
Система обработки сигналов 5 (см. фиг.1) представляет собой оптико-электронное устройство, производящее оптическую фильтрацию и селекцию регистрируемых сигналов, преобразование оптических сигналов в электрические посредством набора фотоприемников, усиление и фильтрацию электрических сигналов, их оцифровку, коммутацию и окончательную обработку результатов диагностики. Она выполнена в виде двух или более одинаковых оптоэлектронных блоков (6а, 6б и т.д.) и блока обработки результатов диагностики 7. Каждый из блоков 6а, 6б и т.д. содержит по два спектральных оптических блока 11 и 12 (см. фиг.3). Первоначально в каждом из блоков 6а, 6б и т.д. пришедшее от биологической ткани вторичное излучение с выхода системы транспортировки вторичного излучения (поз. 4а, 4б и т.д. фиг.1) в распределительном оптическом узле 10 посредством оптических делителей и/или для варианта световодов посредством отвода от общего жгута части волокон распределяется по спектральным оптическим блокам 11 и 12.
Спектральный оптический блок 11 реализует динамическую, с разрешением по времени до 10-6с, регистрацию пришедших сигналов основного спектра (на длинах волн источников излучения). Для этого блок 11 содержит “n” быстродействующих фотоприемников (например, фотодиодов) 13а, 13б...13n, излучение на которые из основного потока отводится селективными по спектру зеркалами 14, выделяющими необходимые для регистрации спектральные диапазоны длин волн. Как альтернативный вариант, в оптической схеме могут быть использованы неселективные по спектру делители (расщепители) потока и установленные перед каждым фотоприемником соответствующие селективные оптические фильтры. Электрические сигналы с фотоприемников поступают на блок предварительного усиления 15, представляющий собой набор из “n” широкополосных усилителей электрических сигналов. После усиления сигналы поступают в блок 16, предназначенный для выделения и усиления для каждого сигнала отдельно его высокочастотной переменной, а также постоянной и низкочастотной переменной составляющих для последующего анализа динамических параметров сигналов и реализации методик доплерографической и фотоплетизмографической обработки данных. После разделения все сигналы поступают на блок 17 для оцифровки, коммутации и передачи дальше в блок обработки результатов диагностики 7 по фиг.1.
Оптический спектральный блок 12 реализует выделение и статическую регистрацию слабых сигналов боковых спектров неупругого рассеяния от биоткани (сигналов флюоресценции и т.п.). Он выполняется по одной из известных схем полихроматоров, например, с использованием дифракционной решетки 18 в качестве диспергирующего элемента и оптической системы формирования луча 19, например, на основе зеркальной оптики. На входе полихроматора при необходимости может устанавливаться дополнительный набор сменных фильтров 20, гасящих до необходимого уровня входящую мощность излучения на основных длинах волн излучателей источника освещения биоткани. Разложенное таким образом в спектр излучение попадает на систему высокочувствительных (до 10-16 Вт) фотоприемников 21, например, на основе ПЗС (CCD) матриц, где преобразуется в электрический сигнал. Далее электрический сигнал с фотоприемников подается в блок усиления, оцифровки и коммутации сигналов 22 и после этого передается в блок окончательной обработки результатов диагностики 7 по фиг.1. Этот блок обработки результатов диагностики может представлять собой, например, компьютерную систему обработки данных или систему узкоспециализированных микроконтроллеров на основе сигнальных и других аналоговых и/или цифровых процессоров сигналов.
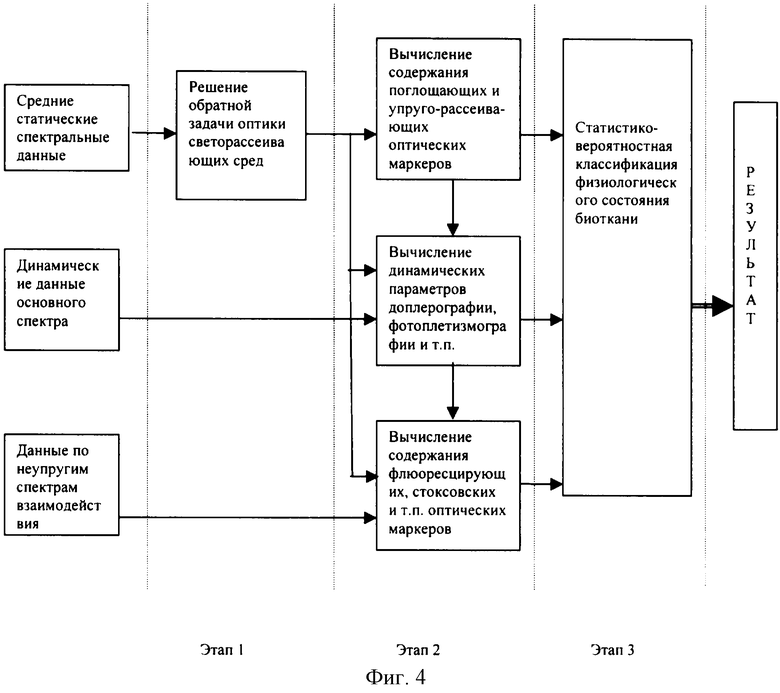
Обработка полученных сигналов для получения окончательного диагностического результата производится в несколько стадий (фиг.4).
Первой из них является решение прямой и обратной задачи оптики светорассеивающих сред (см., например, Рамм А.Г. Многомерные обратные задачи рассеяния. Перевод с английского, - М.: Мир, 1994 г.) для определения всех или наиболее значимых послойных оптико-физических параметров биоткани и их динамических характеристик. Входными данными для этих расчетов служат амплитудно-частотные параметры сигналов с пространственно разнесенных точек, полученных на выходе блоков 6а, 6б и т.д. по фиг.1. Результатом расчетов является определение средних послойных спектральных погонных коэффициентов рассеяния и поглощения для исследуемого участка биологической ткани.
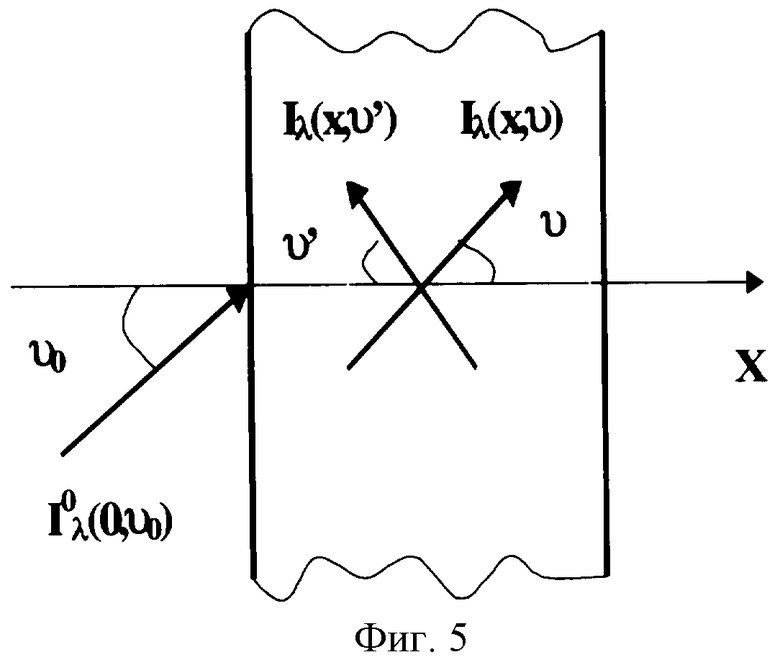
Определение средних статических оптико-физических свойств биотканей может быть выполнено с привлечением методов теории переноса (ТП) и рассеяния излучения в оптически неоднородных средах. Основное уравнение ТП является интегро-дифференциальным, куда параметры среды входят как погонные, детерминированные коэффициенты уравнения. Обычно при составлении уравнения переноса рассматривают распространение некоторой монохроматической (на длине волны λ) интенсивности излучения Iλ вдоль какого-либо выбранного направления при падении излучения на плоскую границу раздела под некоторым углом ν0 (фиг.5). Среда предполагается поглощающей и рассеивающей с погонными коэффициентами поглощения и рассеяния μa и μs (см-1) соответственно. В этом случае при азимутальной симметрии основное уравнение переноса излучения (УПИ) обычно записывается в виде изменения интенсивности вдоль одной координаты распространения:
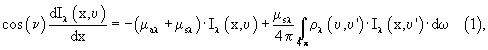
где dω - элемент телесного угла, p(υ,υ') - фазовая функция рассеяния (индикатриса рассеяния), характеризующая угловое перераспределение интенсивности излучения при рассеянии.
Такая постановка задачи является весьма общей и способна описывать очень многие физические явления, от оптических до переноса нейтронов. В общем случае для определения двух основных неизвестных (μа и μs) в предположении известности индикатрисы рассеяния среды необходимо иметь два уравнения типа (1) для двух разных пространственных координат. В предлагаемом изобретении это достигается вводом в состав устройства двух и более идентичных каналов приема информации, выполненных в виде двух и более каналов 4а, 4б и т.д., системы транспортировки вторичного излучения от биологической ткани в систему обработки сигналов и двух и более одинаковых оптоэлектронных блоков 6а, 6б и т.д. в системе обработки сигналов.
Дальнейшая оценка уровня содержания различных биохимических компонент в тканях производится на основе известной зависимости погонного коэффициента поглощения от содержания в тканях различных оптически активных веществ. Для приближения равномерного распределения веществ внутри однородного по своему макросоставу слоя справедливо следующее, хорошо известное соотношение:
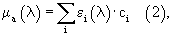
где εi(λ) - табличный (заранее известный) коэффициент погонной (молярной) экстинции для i-го компонента ткани, сi - погонная (молярная) концентрация i-го компонента.
Проводя измерения на разных длинах волн λj(j=1,2...i) из (2), можно получить искомые концентрации сi.
Второй стадией является вычисление по полученным статическим оптико-физическим параметрам биотканей уровней накопления (концентрации) в тканях и/или ее отдельных слоях тех или иных ее биохимических и клеточных компонентов, которые могут быть вычислены методами спектроскопии поглощения (по спектрам поглощения). На этом же этапе обрабатываются переменные составляющие сигналов с блоков динамической регистрации основного спектра и сигналы с блока статической регистрации боковых спектров неупругого рассеяния (флюоресценции, фосфоресценции и т.д.). Последние необходимы для вычисления уровней накопления в тканях веществ, обладающих особыми свойствами неупругого рассеяния - порфиринов, флавинов и т.д. Все эти вычисления для повышения точности и достоверности диагностики ведутся с учетом уже полученных ранее данных по средним рассеивающим и поглощающим оптико-физическим свойствам биоткани, т.е. при вычислениях учитывается среднее стороннее рассеяние и поглощение (экранировка) сигналов в биоткани, которые в общем случае сильно влияют на регистрируемые сигналы (например, занижают их). Динамические параметры сигналов оценивают известными методами обработки сигналов, принятыми в лазерной доплерографии и/или фотоплетизмографии, например, методами Фурье-анализа. В результате получают количественные биофизические характеристики по скорости движения, параметрам пульсации, вариабельности и т.п. наполняющих ткань жидкостей (кровь, лимфа и т.д.) в области диагностики, которые в совокупности характеризуют параметры состояния микроциркуляторного русла биоткани. По сигналам с блока статической регистрации боковых спектров (сигналам флюоресценции и т.п.) оценивают далее количественное накопление в тканях различных природных флюоресцирующих веществ (решение обратной задачи оптики для сигналов флюоресценции с учетом полученных ранее средних и динамически меняющихся оптико-физических свойств среды).
Третьей и заключительной стадией обработки является общий анализ физиологического и патофизиологического состояния ткани на основе использования совокупности биохимических и биофизических данных о биоткани, полученных на предыдущих этапах вычислений и статистико-вероятностных алгоритмов классификации многопараметрической ситуации, с помощью которых определяют наиболее вероятное фактическое физиологическое состояние обследуемой биоткани из общепринятой в медицине классификации состояний (норма, воспаление, ишемия, эрозивно-язвенный процесс, рубцевание раневой поверхности, доброкачественный опухолевый рост, злокачественный опухолевый рост, некроз ткани и т.п.).
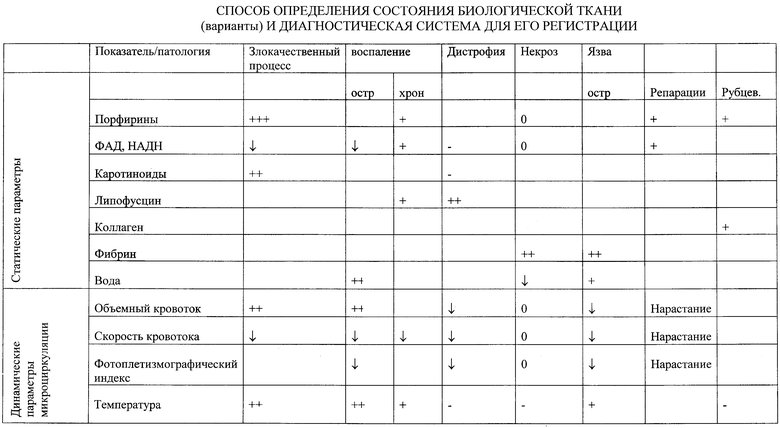
На таблице представлен условный алгоритм решения подобных вопросов классификации физиологического и патофизиологического состояния тканей. В вертикальной графе указаны названия биологически активных веществ и ряд функциональных параметров микроциркуляции (кровотока), подлежащих определению диагностической системой. Значения этих параметров изменяются в определенных пределах в здоровых тканях и выходят за эти пределы при патологии. В верхней строке указаны виды патологических состояний тканей, для которых характерны специфичные отклонения тех или иных параметров в той или иной степени.
Например, при злокачественных процессах специфичным является значительное (как ни при какой другой патологии) увеличение активности и присутствия в тканях порфиринов (+++), увеличение объемной микроциркуляции (кровотока). Вследствие гипоксии опухоли снижается уровень накопления и активность флавиновых ферментов (↓) и наблюдаются значительные колебания других параметров.
При остром воспалении специфичным является повышение содержания воды (++) в тканях вследствие отека.
При хроническом воспалении преобладают пролиферативные изменения, следовательно, будет несколько увеличиваться активность порфиринов (+), но в меньшей степени, чем при злокачественном процессе.
При некрозе ткани практически отсутствует кровоток (0), активность ферментов резко подавлена или отсутствует.
Способ определения состояния биологической ткани с использованием предлагаемых диагностического способа и диагностической системы может быть проиллюстрирован на следующих клинических примерах.
Пример 1 - рак мягкого неба.
Пациент П., 56 лет. Д-з. Рак мягкого неба 3 ст. Диагноз подтвержден данными морфологического исследования.
Результаты исследования лазерной диагностической системой
Показатели микроциркуляции по результатам лазерной допплерографии и фотоплетизмографии значительно отличаются от здоровой ткани выраженной вариабельностью: имеются участки с повышенным объемным кровотоком и области со сниженным кровотоком (преимущественно в центральной части опухоли). Спектральный анализ допплерографического сигнала выявил увеличение доли медленных частот, что связано с возрастанием автономной миогенной активности сосудов микроциркуляторного русла. Процентное соотношение оксигемоглобина к восстановленному снижено.
Исследование флюоресцентной активности тканей показало увеличение уровня порфиринов в ткани от 1,5 до 4,5 раз по сравнению с интактными участками и значительный разброс показателей активности флавопротеинов (ФАД) и пиридиннуклеотидов (НАДН) в связи с неоднородностью кровоснабжения опухоли.
Таким образом, специфичным признаком опухолевого процесса является значительная вариабельность практически всех показателей. Исследование одного из параметров, как это делается до сих пор в известных методах и устройствах оптической диагностики, явно недостаточно для диагностики опухолевого процесса, так как кровоснабжение опухоли неоднородное и, следовательно, активность ферментов и биохимический состав тканей также будет значительно колебаться.
После лучевой терапии исследования показали 3 фазы изменения параметров по результатам исследований лазерной диагностической системой.
1 фаза следовала сразу после облучения и характеризовалась образованием некротического струпа в виде фибриновой пленки. Показатели кровотока в области некроза опухоли были значительно снижены. Спектральный анализ ритмов кровотока показал преобладание быстрых частот, связанных с актом дыхания и кардиоритмом, за счет венозного застоя. Отмечалось подавление медленных ритмов, связанных с миогенной активностью. Активность порфиринов колебалась - была в 2 раза выше нормы или не определялась. Активность НАДН и ФАД - не определялась. Отмечалась выраженная флюоресценция на синей длине волны за счет фибрина.
2 фаза - воспалительная реакция на лучевое воздействие. Визуально характеризовалась выраженной гиперемией и отеком места расположения опухоли. Объемный кровоток значительно превышал исходный уровень (в 2 раза) и был однородным. При спектральном анализе преобладали быстрые частоты, связанные с актом дыхания, что объясняется венозным застоем. Активность ферментов резко подавлена.
3 фаза - репарации. Опухоль не визуализируется. В месте расположения опухоли имеется нежная грануляционная ткань.
Объемный кровоток несколько выше в области грануляций по сравнению с интактной, возрастает амлитуда низких частот, связанных с миогенной активностью сосудов. Активность порфиринов, НАДН, ФАД не превышает показатели нормы.
Таким образом, использование комплекса вышеуказанных параметров позволило не только диагностировать злокачественный процесс, но и оценить динамику и эффективность лучевой терапии.
Пример 2 - язва двенадцатиперстной кишки.
Пациент Д., 42 года. Страдает язвенной болезнью около 5 лет. При эзофагогастроскопии обнаружена язва луковицы двенадцатиперстной кишки размером 1 см в диаметре с фибриновой пленкой, которая не заживала в течение 1 месяца с момента обнаружения. Больной получал лекарственный препарат - Н2-блокаторы (ранитидин). Морфологическое исследование биптатов язвы 12 п.к. подтвердило диагноз.
При оптической диагностике обнаружено значительное снижение кровотока в области фибриновой пленки и менее - по краям язвы. Обнаружено подавление низких частот допплеровского сигнала. Активность порфиринов несколько возрастала, но не более чем в 1,5 раза по сравнению с нормой. Активность НАДН и ФАД была снижена. Отмечалась выраженная флюоресценция на синей длине волны за счет фибрина.
После назначения адекватной терапии (омепрозол, денол, кларитромицин) наблюдалось заживление язвы по данным гастроскопии с образованием рубцовой ткани. Это сопровождалось усилением объемного кровотока в месте бывшей локализации язвы, снижением активности порфиринов и повышением активности НАДН и ФАД. Таким образом, использование данного оптического метода диагностики позволило, во-первых, дифференцировать язвенный процесс от перерождения язвы в рак (однородность изменений параметров, незначительное повышение уровня порфиринов, положительный эффект от лечения). Во-вторых, оценить эффективность лечения - нормализация оптических параметров сопровождалось рубцеванием язвы.
Пример 3 - Ишемия тканей, связанная с локальным нарушением кровотока.
Больной О., страдает синдромом Рейно от воздействия вибрации, проявляющийся периферическими нарушениями кровотока в пальцах кистей в виде ангиоспазмов - “белые пальцы”. Работает обрубщиком в контакте с вибрацией в течение 20 лет. Болезнь проявляется в виде приступов побеления пальцев, болей в руках и нарушениях трофики тканей пальцев - утолщение дистальных фаланг, расслоение ногтевой пластинки, шелушение кожи.
Проведение оптической диагностики показало значительное снижение объемного кровотока с подавлением низких частот допплеровского сигнала, а также изменение активности ферментов: повышение уровня порфиринов в 1,5 раза. Повышение порфиринов очевидно связано с адаптацией ткани на хроническую гипоксию. Отмечалось увеличение уровня коллагена (флюоресценция на синей длине волны), что объясняется грубой перестройкой структуры ткани при нарушении кровотока. У больных с начальными проявлениями синдрома Рейно (редкие ангиоспазмы конечностей), пальцы рук визуально не были изменены. Вне приступа болезни отсутствовали изменения параметров кровотока, активность порфиринов, ФАД, НАДН не отличалась от нормы.
Таким образом, оптические методы диагностики в представленном комплексе позволяют определять дистрофические процессы в тканях, уточнить стадию процесса, что значительно расширяет область применения этого способа.
Пример 4 - ишемия тканей, связанная с хроническими заболеваниями легких.
Больной Е., 56 лет, страдает хроническим обструктивным бронхитом с выраженной дыхательной недостаточностью - 3 степени в течение 10 лет. Поступил в клинику в стадии обострения заболевания. Диагноз подтвержден клиническими данными - больного беспокоят выраженная одышка, кашель. При осмотре, одышка - число дыханий 30 в мин, цианоз периферических тканей, множество хрипов в легких. При проведении эхокардиографии признаки “легочного сердца”, повышенное давление в легочной артерии. Газы крови - снижение парциального давления кислорода - 58,6 мм рт. ст., сатурация крови 89,8%.
Проведена комплексная лазерная оптическая диагностика тканей в области предплечья. Лазерная допплерометрия показала повышение объемного кровотока с выраженными застойными явлениями, повышение амплитуды частот, характеризующих активность гладкомышечных клеток, что косвенно указывает на гипоксию. Оксигемоглобин в тканях - 90,1%. Активность порфиринов без особенности; НАДН, ФАД снижена.
Таким образом, использование комплексной лазерной диагностики позволило ex temporo - в течение 10 минут оценить степень гипоксии тканей, а исследование микроциркуляторного русла указывает на недостаточность правых отделов сердца, что подтверждено данными ЭХО КГ.
На фоне лечения специфическими антибиотиками, бронхолитиками, гипербарической оксигенации, антагонистами кальция, пролонгированными нитратами состояние больного улучшилось, что сопровождалось динамикой показателей на лазерном оптическом комплексе: уменьшились застойные явления в микроциркуляторном русле, возросло количество оксигемоглобина до 93%, повысился уровень НАДН и ФАД.
Пример 5 - интоксикация свинцом.
Больная М., 42 лет работает аппаратчицей смешивания сыпучих материалов в производстве белил. Имеет контакт с солями свинца, превышающими предельно допустимые концетрации в 10-15 раз (ПДК - 0,01 мг/м3). Поступила в клинику с диагнозом хронической свинцовой интоксикацией, проявляющейся в виде анемии (гемоглобин 110 г/л, Эритроциты 3,8×10(12)/л с базофильной зернистостью 5 на 10,000), нарушения порфиринового обмена - повышение альфа-аминолевулиновой кислоты в 3 раза, полинейропатии конечностей. Свинец в моче 0,1 мг/л (норма 0,04 мг/л).
Исследование на лазерном оптическом диагностическом комплексе обнаружило выраженное повышение уровня порфиринов - в 10 раз выше нормы, подавление активности НАДН и ФАД.
Таким образом, метод эффективен в диагностике порфириновых нарушений, вызванных интоксикацией свинцом.
На основании вышеизложенного можно сделать вывод, что предложенный способ определения состояния биологической ткани и конструкция диагностической системы позволяют следующее.
A) Распознавать различные физиологические и патофизиологические состояния биотканей, т.е. состояния тканей при развитии в них различных заболеваний и патологий.
Б) Перейти на качественно иной уровень интерпретации, анализа и обработки диагностических данных, когда в результате комплексной собранной информации оценивается не только вероятность наличия заболевания при сравнении сигналов с некими эталонными значениями или степень его отклонения от “нормы”, а общее физиологическое и патофизиологическое состояние биоткани в терминах медицины и клинической практики на основе определения основного биохимического состава ткани, параметров функционирования микроциркуляторного русла, питания тканей кислородом и т.п.
Одновременно измеряются как статические, так и динамические параметры регистрируемых сигналов, т.е. одновременно реализовываются методики флюоресцентной диагностики, биофотометрии, доплерометрии, фотоплетизмографии и т.п.
B) Учитывается, соответственно, идентичным образом влияние свойств среды на все регистрируемые сигналы для всех методов диагностики и всех используемых длин волн излучения, т.е. - существенно повышена достоверность диагностики.
Указанные особенности предложенного способа по А), Б) и В) являются основополагающими и принципиально его отличают от всех ранее известных методов и устройств лазерной диагностики, что и обеспечивает его высокую эффективность и достоверность диагностики и тем самым предопределяет его перспективность внедрения в клиническую практику.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДИАГНОСТИЧЕСКИЙ КОМПЛЕКС ДЛЯ ИЗМЕРЕНИЯ МЕДИКО-БИОЛОГИЧЕСКИХ ПАРАМЕТРОВ КОЖИ И СЛИЗИСТЫХ ОБОЛОЧЕК IN VIVO | 2007 |
|
RU2337608C1 |
| Устройство для количественной оценки флюоресценции и оптических свойств тканей in vivo | 2016 |
|
RU2657294C1 |
| УСТРОЙСТВО ДЛЯ ОПТИЧЕСКОЙ ДИАГНОСТИКИ КРОВОСНАБЖЕНИЯ И ЖИЗНЕОБЕСПЕЧЕНИЯ БИОЛОГИЧЕСКИХ ТКАНЕЙ | 2017 |
|
RU2663938C1 |
| ДИАГНОСТИЧЕСКОЕ УСТРОЙСТВО ДЛЯ ИЗМЕРЕНИЯ ФИЗИКО-БИОЛОГИЧЕСКИХ ХАРАКТЕРИСТИК КОЖИ И СЛИЗИСТЫХ ОБОЛОЧЕК IN VIVO | 2002 |
|
RU2234853C1 |
| УСТРОЙСТВО ДЛЯ НЕИНВАЗИВНОГО ИЗМЕРЕНИЯ ПОТОКА МИКРОЦИРКУЛЯЦИИ КРОВИ | 2016 |
|
RU2636880C1 |
| СПОСОБ РЕГИСТРАЦИИ И ОБРАБОТКИ ДАННЫХ ОПТИЧЕСКОЙ БИОПСИИ В ДИНАМИЧЕСКОМ РЕЖИМЕ | 2022 |
|
RU2804287C2 |
| Портативное мультимодальное устройство оптической спектроскопии для диагностики состояния микроциркуляторно-тканевых систем организма человека | 2023 |
|
RU2836326C1 |
| УСТРОЙСТВО ДЛЯ КАЛИБРОВКИ МЕДИЦИНСКИХ ДИАГНОСТИЧЕСКИХ СПЕКТРОФОТОМЕТРИЧЕСКИХ ПРИБОРОВ | 2008 |
|
RU2398232C2 |
| СПОСОБ СОЗДАНИЯ МОДЕЛЕЙ, ИМИТИРУЮЩИХ ОПТИЧЕСКИЕ СВОЙСТВА ЖИВЫХ БИОЛОГИЧЕСКИХ ТКАНЕЙ | 2008 |
|
RU2389083C1 |
| Способ определения типа биологической ткани | 2017 |
|
RU2676647C1 |
Изобретение относится к области медицины и медицинского приборостроения, а именно к способу и устройству оптической диагностики физиологического и патофизиологического состояния биологических тканей, предназначенным для неинвазивного контроля и мониторинга физиологического состояния тканей человека. Изобретение основано на методах получения информации путем облучения исследуемого участка ткани источниками лазерного или узкополосного светодиодного излучения с различной длиной волны, мощностью, поляризацией и другими физическими параметрами луча, освещающего ткань, и последующим частотно-спектральным и/или амплитудно-спектральным анализом параметров вышедшего из ткани вторичного излучения (отраженного, рассеянного, наведенного, возбужденного, фонового и т.п.). Изобретение позволяет повысить точность, достоверность и медицинскую информативность диагностических процедур. 2 н. и 12 з.п. ф-лы, 1 табл., 5 ил.
| RU 97100373 А1, 20.02.1999 | |||
| СПОСОБ ДИАГНОСТИКИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 1996 |
|
RU2132635C1 |
| ГОРДИЕНКО А.Г | |||
| и др | |||
| Верификация опухолей с помощью лазерной флюоресцентной спектроскопии | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| - Донецк, 1990, с | |||
| Переносная мусоросжигательная печь-снеготаялка | 1920 |
|
SU183A1 |
| US 5647368 А, 15.07.1997. | |||
Авторы
Даты
2004-08-20—Публикация
2002-03-19—Подача