Изобретение относится к ветеринарной вирусологии и биотехнологии и может быть использовано при разработке и изготовлении средств специфической профилактики репродуктивно - респираторного синдрома свиней (РРСС).
РРСС - это новая болезнь вирусной этиологии, характеризующаяся нарушением функций воспроизводства у свиноматок и ремонтных подсвинков, пневмонией у поросят на доращивании и увеличением их смертности в предотъемный период. Впервые болезнь была зарегистрирована и описана в 1987 году в США и Канаде, а с 1990 года болезнь регистрируется в странах Западной Европы и Юго-Восточной Азии. По официальным данным МЭБ в 1996-1998 гг. заболевание регистрировали в 30 странах мира. В России РРСС был установлен в 1993 году и на сегодняшний день это заболевание диагностировано во многих областях и краях России. Впервые вирус РРСС был выделен и исследован учеными Центрального ветеринарного института в Нидерландах в 1991 году. Вирус был классифицирован как представитель семейства Arteriviridae и отнесен к роду Arterivirus. В организме животных вирус размножается в альвеолярных макрофагах легких и в дальнейшем в результате виремии он аккумулируется в матке и других органах. При циркуляции вируса в крови он легко преодолевает трансплацентарный барьер и поражает плод. В зависимости от срока супоросности свиноматки или иммунного ответа организма матери происходит гибель плода или рождение больных поросят, которые погибают в первые дни жизни. В некоторых хозяйствах гибель новорожденных поросят достигает 80-90%. Важным средством против РРСС является его вакцинопрофилактика. Специфическая профилактика РРСС проводится с помощью живых и инактивированных вакцин.
Хотя преимущество живых вакцин из-за технологичности в производстве и простоты при применении не вызывает сомнений, но иммунная реакция у свиней при их введении не всегда стабильна и в ряде случаев вызывает осложнения после вакцинации.
В настоящее время в мировом промышленном свиноводстве для специфической профилактики РРСС широко используют эмульсионные инактивированные вакцины, приготовленные из различных штаммов вируса, репродуцированного в чувствительных биологических системах. Вакцинация создает у свиноматок выраженный иммунитет и предупреждает передачу вируса эмбрионам и плодам (1, 2).
Однако технология изготовления эмульсионных инактивированных вакцин против РРСС обладает недостатками, устранение которых остается актуальной задачей и служит основной предпосылкой для проведения исследований по ее усовершенствованию и решения вопроса защиты свиноводства от этой инфекции.
Известен способ изготовления эмульсионной инактивированной вакцины против РРСС, включающий получение антигенного материала из штамма CNCM №1-1102 гомологичного вируса, репродуцированного в чувствительной биологической системе, очистку антигенного материала от балластных примесей, инактивацию вируса, соединение антигенного материала с масляным адъювантом и последующий контроль целевого продукта (3).
Известен способ изготовления эмульсионной инактивированной вакцины против РРСС, включающий получение антигенного материала из штамма CNCM №1-1140 гомологичного вируса, репродуцированного в чувствительной биологической системе, очистку антигенного материала от балластных примесей, инактивацию вируса, соединение антигенного материала с масляным адъювантом и последующий контроль целевого продукта (4).
Известен способ изготовления эмульсионной инактивированной вакцины против РРСС, включающий получение антигенного материала из штамма CNCM №1-1153 гомологичного вируса, репродуцированного в чувствительной биологической системе, очистку антигенного материала от балластных примесей, инактивацию вируса, соединение антигенного материала с масляным адъювантом и последующий контроль целевого продукта (5).
Известен способ изготовления эмульсионной инактивированной вакцины против РРСС, включающий получение антигенного материала из штамма CNCM №1-1387 или CNCM №1-1388 гомологичного вируса, репродуцированного в чувствительной биологической системе, очистку антигенного материала от балластных примесей, инактивацию вируса, соединение антигенного материала с масляным адъювантом и последующий контроль целевого продукта (6).
Известен способ изготовления эмульсионной инактивированной вакцины против РРСС, включающий получение антигенного материала из штамма АТСС VR-2402 гомологичного вируса, репродуцированного в чувствительной биологической системе, очистку антигенного материала от балластных примесей, инактивацию вируса, соединение антигенного материала с масляным адъювантом и последующий контроль целевого продукта (7).
Известен способ изготовления эмульсионной инактивированной вакцины против РРСС, включающий получение антигенного материала из штамма АТСС VR-2509 гомологичного вируса, репродуцированного в чувствительной биологической системе, очистку антигенного материала от балластных примесей, инактивацию вируса, соединение антигенного материала с масляным адъювантом и последующий контроль целевого продукта (8).
Известен способ изготовления эмульсионной инактивированной вакцины против РРСС, включающий получение антигенного материала из штамма АТСС VR-2525 гомологичного вируса, репродуцированного в чувствительной биологической системе, очистку антигенного материала от балластных примесей, инактивацию вируса, соединение антигенного материала с масляным адъювантом и последующий контроль целевого продукта (9).
Известен способ изготовления эмульсионной инактивированной вакцины против РРСС, включающий получение антигенного материала из штамма ЕСАСС V-93070108 гомологичного вируса, репродуцированного в чувствительной биологической системе, очистку антигенного материала от балластных примесей, инактивацию вируса, соединение антигенного материала с масляным адъювантом и последующий контроль целевого продукта (10).
Известен также масляный адъювант ВНИИЗЖ, содержащий масляную основу и алкилмодифицированный полиоксиалкиленсилоксановый сополимер (АПС) в качестве эмульгатора при соотношении указанных компонентов (мас.%) 5:10-90:95 (11).
Наиболее близким предлагаемому изобретению по совокупности существенных признаков является способ изготовления эмульсионной инактивированной вакцины против РРСС, включающий получение антигенного материала из штамма CNCM №1-1102 гомологичного вируса, репродуцированного в чувствительной биологической системе, очистку антигенного материала от балластных примесей, инактивацию вируса, соединение антигенного материала с масляным адъювантом и последующий контроль целевого продукта (3).
Существенные недостатки известных способов, как и способа - прототипа, состоят в том, что при их осуществлении используют вирулентные штаммы, которые всегда создают проблемы при выполнении требований ветеринарно-санитарной безопасности.
Кроме того, эмульсионные инактивированные вакцины, полученные известными способами, никогда не применялись на территории Российской Федерации, поэтому их эффективность в отношении российских изолятов вируса РРСС не изучалась.
В задачу создания настоящего изобретения входила разработка способа изготовления высокоиммуногенной и безвредной эмульсионной инактивированной вакцины против РРСС на основе нового производственного штамма гомологичного вируса, выделенного на территории России, обладающего высокой биологической, антигенной и иммуногенной активностью в нативном виде и после инактивации и пригодного для изготовления эмульсионного инактивированного вакцинного препарата, создающего напряженный и длительный иммунитет у привитых животных против циркулирующих на территории России изолятов вируса РРСС.
Технический результат от использования предлагаемого изобретения заключается в расширении арсенала эмульсионных инактивированных вакцин против РРСС, обладающих высокой иммуногенной активностью и безвредностью и создающих напряженный и длительный иммунитет у привитых животных против циркулирующих на территории России эпизоотических изолятов вируса РРСС.
Указанный технический результат достигнут созданием способа изготовления эмульсионной инактивированной вакцины против РРСС, охарактеризованного следующей совокупностью признаков:
1. Способ изготовления эмульсионной инактивированной вакцины против РРСС.
2. Приготовление антигенного материала из штамма вируса РРСС, репродуцированного в чувствительной биологической системе.
3. Из штаммов используют штамм “БД” вируса РРСС в эффективном количестве.
4. Из чувствительных биологических систем используют перевиваемую культуру клеток Маrс-145.
5. Штамм “БД” используют с биологической активностью, по меньшей мере, 6,0 lg ТЦД50/см3.
6. Очистка антигенного материала от балластных примесей.
7. Очищенный антигенный материал подвергают инактивации.
8. Из инактивантов используют аминоэтилэтиленимин (АЭЭИ).
9. АЭЭИ используют в виде 1% водного раствора.
10. АЭЭИ вносят в антигенный материал в концентрации 0,001-0,05%.
11. Инактивацию вируса РРСС ведут в течение 20-22 часов при 37±2°С и рН 7,6-7,8.
12. Соединение очищенного и авирулентного антигенного материала с масляным адъювантом.
13. Из масляных адъювантов используют масляный адъювант “Монтанид ИЗА-70”.
14. Антигенный материал из штамма “БД” вируса РРСС соединяют с масляным адъювантом “Монтанид ИЗА-70” в соотношении, по меньшей мере, 1:2.
15. Из масляных адъювантов используют масляный адъювант ВНИИЗЖ.
16. Антигенный материал из штамма “БД” вируса РРСС соединяют с масляным адъювантом ВНИИЗЖ в соотношении, по меньшей мере, 1:1.
17. Контроль целевого продукта.
Предлагаемое изобретение включает следующую совокупность существенных признаков, обеспечивающих получение технического результата во всех случаях, на которые испрашивается правовая охрана:
1. Способ изготовления эмульсионной инактивированной вакцины против РРСС.
2. Приготовление антигенного материала из штамма “БД” вируса РРСС, репродуцированного в чувствительной биологической системе.
3. Штамм “БД” вируса РРСС используют в эффективном количестве.
4. Очистка антигенного материала от балластных примесей.
5. Инактивация вируса.
6. Соединение очищенного и авирулентного антигенного материала из штамма “БД” вируса РРСС с масляным адъювантом.
7. Контроль целевого продукта.
Предлагаемое изобретение характеризуется также другими признаками, выражающими конкретные формы выполнения или особые условия его использования:
1. Из чувствительных биологических систем используют перевиваемую культуру клеток Маrс-145.
2. Штамм “БД” вируса РРСС используют с биологической активностью, по меньшей мере, 6,0 lg ТЦД 50/см3.
3. Из инактивантов используют АЭЭИ.
4. АЭЭИ используют в виде 1% водного раствора.
5. АЭЭИ вносят в антигенный материал в концентрации 0,001-0,05%.
6. Инактивацию вируса РРСС ведут в течение 20-22 часов при 37±2°С и рН 7,6-7,8.
7. Из масляных адъювантов используют масляный адъювант “Монтанид ИЗА-70”.
8. Антигенный материал из штамма “БД” вируса РРСС соединяют с масляным адъювантом “Монтанид ИЗА-70” в соотношении, по меньшей мере, 1:2.
9. Из масляных адъювантов используют масляный адъювант ВНИИЗЖ.
10. Антигенный материал из штамма “БД” вируса РРСС соединяют с масляным адъювантом ВНИИЗЖ в соотношении, по меньшей мере, 1:1.
Признаками изобретения, характеризующими предлагаемый способ и совпадающими с признаками прототипа, в том числе родовое понятие, отражающее назначение, являются:
1. Способ изготовления эмульсионной инактивированной вакцины против РРСС.
2. Получение антигенного материала из штамма гомологичного вируса, репродуцированного в чувствительной биологической системе.
3. Очистка антигенного материала от балластных примесей.
4. Инактивация вируса.
5. Соединение антигенного материала с масляным адъювантом.
6. Контроль целевого продукта.
По сравнению со способом-прототипом существенными отличительными признаками изобретения являются:
1. Из штаммов возбудителя инфекции используют штамм “БД” вируса РРСС.
2. Штамм “БД” вируса РРСС используют в эффективном количестве.
Предлагаемое изобретение характеризуется также другими отличительными признаками, выражающими конкретные формы выполнения или особые условия его использования:
1. Из чувствительных биологических систем используют перевиваемую культуру клеток Маrс-145.
2. Штамм “БД” вируса РРСС используют с биологической активностью, по меньшей мере, 6,0 lg ТЦД 50/см3.
3. Из инактивантов используют АЭЭИ.
4. АЭЭИ используют в виде 1% водного раствора.
5. АЭЭИ вносят в антигенный материал в концентрации 0,001-0,05%.
6. Инактивацию вируса РРСС ведут в течение 20-22 часов при 37±2°C и рН 7,6-7,8.
7. Из масляных адъювантов используют масляный адъювант “Монтанид ИЗА-70”.
8. Антигенный материал из штамма “БД” вируса РРСС соединяют с масляным адъювантом “Монтанид ИЗА-70” в соотношении, по меньшей мере, 1:2.
9. Из масляных адъювантов используют масляный адъювант ВНИИЗЖ.
10. Антигенный материал из штамма “БД” вируса РРСС соединяют с масляным адъювантом ВНИИЗЖ в соотношении, по меньшей мере, 1:1.
Вакцина, полученная предлагаемым способом, позволяет расширить арсенал средств специфической профилактики РРСС.
Достижение технического результата от использования предлагаемого способа объясняется тем, что при изготовлении эмульсионной инактивированной вакцины против РРСС используют антигенный материал из нового штамма “БД” вируса РРСС, обладающего высокой биологической, антигенной и иммуногенной активностью в нативном виде и после инактивации и обеспечивающего получение высокоиммуногенной и безвредной вакцины, создающей напряженный и длительный иммунитет у привитых свиней.
Дополнительный технический результат от использования предлагаемого способа достигается за счет того, что инактивацию антигенного материала осуществляют АЭЭИ, что позволяет значительно снизить трудо- и энергозатраты на изготовление вакцины и повысить качество антигенного материала.
Дополнительный технический результат от использования предлагаемого изобретения в части повышения антигенной и иммуногенной активности целевого продукта достигается за счет использования в его составе масляного адъюванта “Монтанид ИЗА-70” или масляного адъюванта ВНИИЗЖ.
Штамм “БД” является новым, ранее неизвестным штаммом вируса РРСС, в нативном виде непатогенным.
Исходный вирус для получения штамма “БД” выделен из сыворотки крови свиней с клиническими признаками РРСС, полученной из СХП “Рассвет” Кировского района Ставропольского края в 1996 году. Производственный штамм “БД” получен путем многократных последовательных пассажей на 3-суточной культуре клеток Маrс-145.
Штамм “БД” депонирован во Всероссийской государственной коллекции штаммов микроорганизмов, используемых в ветеринарии и животноводстве, Всероссийского государственного научно-исследовательского института контроля, стандартизации и сертификации ветеринарных препаратов (ВГНКИ) 25 мая 1998 года под регистрационным шифром “БД-ДЕП”.
Штамм “БД” является безвредным и обладает высокой биологической антигенной и иммуногенной активностью в нативном виде и после инактивации. Экспериментально подтверждена возможность его использования для изготовления вакцинных препаратов.
Штамм “БД” вируса РРСС характеризуется следующими признаками и свойствами.
Морфологические свойства
Штамм “БД” вируса РРСС относится к семейству Arteriviridae, роду Arterivirus, RNA-геномный, обладает морфологическими признаками, характерными для вируса РРСС: форма вириона шарообразная, размер вириона 45-75 нм с ядром, заполняющим 3/4 вириона диаметром 25-35 нм, окружен липидной оболочкой.
Антигенные свойства
Вирус РРСС штамма “БД” стабильно нейтрализуется гомологичной антисывороткой. Вирус не обладает гемагглютинирующими свойствами. При вакцинации вирус индуцирует образование специфических антител, выявляемых в иммуноферментном анализе (ИФА). Методом полимеразной цепной реакции (ПЦР) выявлена геномная РНК вируса РРСС. Нуклеотидное секвенирование штамма “БД” вируса РРСС показало его значительное (около 40%) отличие от штамма CNCM №1-1102 и штамма АТСС VR-2332, признанных эталонными в Европе и Северной Америке соответственно. Идентификацию и специфичность вируса РРСС определяли в ИФА (IDEXX, США) с контролем специфичности. Результат проведенной дифференциальной диагностики был отрицательным на вирус болезни Ауески, парвовирус свиней, вирус диареи КРС и вирус трансмиссивного гастроэнтерита.
Биотехнологические характеристики
Штамм “БД” проявляет высокую биологическую, антигенную и иммуногенную активность. Штамм “БД” предназначен для приготовления диагностических и вакцинных препаратов. Штамм “БД” вируса РРСС репродуцируется в цитоплазме клеток 3-суточной культуры клеток Маrс-145 при температуре 37°С. Исходной суспензией из сыворотки крови, содержащей вирус, заражали культуру клеток Маrс-145. После проведения 7-10 пассажей в течение 48-72 часов инкубирования вирус накапливается до титра 4,0-4,5 lg ТЦД50/см3. Инфекционность вируса повышали путем серийных быстро чередующихся пассажей, которая к 41 пассажу достигла 7,0-7,5 lg ТЦД50/см3. Штамм “БД” является стабильным и безвредным.
Хемо- и генотаксономическая характеристика
Штамм “БД” является РНК-содержащим вирусом. Нуклеиновая кислота содержит одну нить, поверхность вируса покрыта слоем гликопротеинов. Белковая оболочка обнаруживает следующие фрагменты:
М - трансмембранный протеин,
Е - мембранный протеин,
GL - поверхностный гликопротеин,
GS - поверхностный гликопротеин,
N - нуклеокапсидный протеин.
Физические свойства
Масса вириона от 49·103 Да до 55·103 Да. Плавучая плотность в градиенте хлористого цезия 1,18-1,2 г/см3.
Устойчивость к внешним факторам
Штамм “БД” не устойчив к растворителям (эфиру, хлороформу) и детергентам, чувствителен к формальдегиду, ультрафиолетовому облучению, гамма-облучению и высыханию.
Дополнительные признаки и свойства
Иммуногенная активность - через 14 дней после иммунизации свиней вызывает у них образование специфических антител.
Реактогенность отсутствует.
Патогенность отсутствует.
Вирулентность отсутствует.
Онкогенность отсутствует.
Контагиозность отсутствует.
Стабильность аттенуации установлена при проведении 5 пассажей на чувствительных подсвинках.
Исходя из полученных данных, можно утверждать, что штамм “БД” вируса РРСС по антигенному и иммунологическому спектрам является оригинальным, в таксономическом отношении новым, ранее неизвестным штаммом вируса РРСС.
Проведенный заявителем анализ уровня техники, включающий поиск по патентным и научно-техническим источникам информации и выявление источников, содержащих сведения об аналогах предлагаемого изобретения, позволил установить, что заявитель не обнаружил источники, характеризующиеся признаками, тождественными (идентичными) всем существенным признакам предлагаемого изобретения. Определение из перечня выявленных аналогов прототипа как наиболее близкого по совокупности признаков аналога, позволило установить совокупность существенных по отношению к усматриваемому заявителем техническому результату отличительных признаков предлагаемого способа, изложенных в независимом пункте формулы изобретения.
Следовательно, заявляемое решение соответствует условию патентоспособности “новизна”.
Для проверки соответствия предлагаемого решения условию патентоспособности “изобретательский уровень” проведен дополнительный поиск известных решений для выявления признаков, включенных в отличительную часть независимого пункта формулы изобретения. Результаты поиска показали, что предлагаемое решение не вытекает для специалиста явным образом из известного уровня техники, изложенного в соответствующем разделе описания (не выявлены решения, имеющие признаки, совпадающие с отличительными признаками предлагаемого изобретения), а также не выявлено влияние предусматриваемых существенными признаками предлагаемого изобретения преобразований для достижения технического результата.
Следовательно, предлагаемый способ соответствует условию патентоспособности “изобретательский уровень”.
Сущность предлагаемого изобретения пояснена примерами его исполнения, которые не ограничивают объем изобретения.
Пример 1.
Эмульсионную инактивированную вакцину против РРСС готовят из матрового вируса штамма “БД”, выращенного в перевиваемой культуре клеток Маrс-145 3-суточного возраста с концентрацией клеток более 100 тыс. кл./см3. Матровый вирус считается пригодным для наработки вирусного сырья, если он соответствует следующим требованиям: титр инфекционности после репродукции в монослое клеток Маrс-145 6,5 lg ТЦД50/см3, рН 7,2-7,4 и при отсутствии контаминации. Для изготовления вакцины берут матрасы емкостью 1,5 дм3 с культурой клеток. После слива ростовой среды и однократного отмывания ФБР или питательной средой в матрасы вносят по 5 см3 вируссодержащего материала матровой серии. Адсорбцию вируса проводят при 37°С в течение часа. После этого в матрасы вносят среду Игла в объеме 200 см3 с добавлением 5% фетальной сыворотки крупного рогатого скота с антибиотиками (гентамицин в концентрации 50 мкг/см3 или его аналоги).
Культивирование ведут при 37°С в течение 48-72 часов. Для контроля незараженными оставляют 3 матраса, в которых заменяют среду. Размножение вируса в культуре клеток Маrс-145 определяют по характеру ЦПД с образованием скопления шарообразных клеток, поднимающихся над монослоем. В контрольных матрасах не должно быть каких-либо деструктивных изменений клеток. Матрасы, в которых наблюдаются цитопатические изменения с поражением до 60% клеточного монослоя (обычно через 48-72 часа), отбирают и замораживают при -20°С. Вирус для изготовления вакцины получают 2-кратным замораживанием и оттаиванием инфицированных клеток с последующим сливом содержимого матрасов в одну емкость, соблюдая стерильные условия. Полученный вирус очищают от балластных примесей (клеточного детрита) центрифугированием при 1000 об/мин в течение 10 минут. Очищенная от детрита суспензия должна иметь вид прозрачной жидкости розовато-вишневого цвета. Затем из емкости отбирают пробу для лабораторно-производственного контроля на инфекционную активность и стерильность. Производственная серия вируса РРСС считается пригодной, если она соответствует следующим требованиям: титр инфекционности после репродукции в монослое клеток Маrс-145, по меньшей мере, 6,0 lg ТЦД50/см3, рН 7,2-7,4 и при отсутствии контаминации. Очищенную вируссодержащую суспензию подвергают инактивации. Инактивацию наработанного вирусного сырья ведут с помощью 1% водного раствора АЭЭИ, вносимого до конечной концентрации 0,001-0,05%. Для этого в суспензию, нагретую до 26-28°С, вносят при постоянном перемешивании раствор АЭЭИ и устанавливают значение рН 7,6-7,8 добавлением в нее 5% раствора янтарной кислоты. Инактивацию ведут в термостате при температуре (37±2)°С в течение 20-22 часов с периодическим перемешиванием. По окончании инактивации суспензию охлаждают до 4-6°С, устанавливают значение ее рН в пределах 7,6-7,8 и отбирают пробы антигена для проверки на стерильность, авирулентность и иммуногенную активность, используя для этого известные специалисту методы. Эмульсионную вакцину готовят путем диспергирования смеси антигенсодержащего материала и масляного адъюванта, содержащего минеральное масло с эмульгатором. Из масляных адъювантов используют препарат “Монтанид ИЗА-70” фирмы “Сеппик” (Франция) или масляный адъювант ВНИИЗЖ. Масляный адъювант и инактивированный антиген соединяют следующим образом:
1) при использовании “Монтанида ИЗА-70” - гомогенизация в течение 4-5 минут при скорости вращения винта 3000 об/мин и температуре 10°С, при этом получают однородную эмульсию бело-розового цвета типа “вода-масло”;
2) при использовании масляного адъюванта ВНИИЗЖ - гомогенизация в размельчителе тканей РТ-2 в течение 5 минут при 5000 об/мин.
Тип получаемой эмульсии “вода-масло”.
При изготовлении вакцины антиген соединяют с масляным адъювантом в следующем соотношении: с адъювантом “Монтанид ИЗА-70”, по меньшей мере, 1:2, а с масляным адъювантом ВНИИЗЖ, по меньшей мере, 1:1. Готовую эмульсионную вакцину собирают в стерильную емкость и фасуют в стерильные стеклянные флаконы и контролируют в соответствии с техническими условиями. Вакцину считают иммуногенной, если у трех подсвинков, привитых в дозе 2 см3, через 30 суток после вакцинации в сыворотке крови выявляют специфические антитела и у всех животных при контрольном заражении не отмечают клинических признаков заболевания. Вакцину считают безвредной, если при подкожном введении цельной вакцины пяти белым мышам массой 18-21 г в объеме 0,5 см3 и при внутримышечном введении двум подсвинкам массой 20-25 кг в объеме 5 см3, она не вызывает заболевания или гибели лабораторных животных в течение 10, а подсвинков - в течение 15 суток наблюдения. На месте введения не должно быть никаких изменений подкожной клетчатки.
Вакцина представляет собой эмульсию белого или белого с розовым оттенком цвета слегка вязкой консистенции. При хранении допускается незначительное отслоение минерального масла на поверхности эмульсии. При встряхивании вакцина приобретает однородную гомогенную структуру.
Полученная вакцина имеет оптимальный компонентный состав, маc.%:
Антигенный материал
из штамма “БД” вируса
РРСС, репродуцированного
в перевиваемой культуре
клеток Маrс-145 с биологической
активностью, по меньшей
мере, 6,0 lg ТЦД50/см3 33,3-50,0
АЭЭИ (1% водный раствор) 0,001-0,05
Масляный адъювант до 100,0
Содержание антигена в вакцине в указанных выше пределах является его эффективным количеством в препарате, обеспечивающим достижение технического результата.
Полученную вакцину применяют с профилактической целью в неблагополучных и угрожаемых по РРСС хозяйствах. Свиноматок, свинок и хряков-производителей прививают двукратно с интервалом 15-20 дней за 3 недели до случки (осеменения). В последующем ранее иммунизированных свиноматок прививают однократно за 3 недели до случки (осеменения), а хряков-производителей ревакцинируют через каждые 6 месяцев. Вакцину вводят внутримышечно за ухом в дозе 2 см3 независимо от возраста животного. Иммунитет у привитых животных наступает на 21-30 сутки после вакцинации и сохраняется до 12 месяцев. Вакцина индуцирует высокий уровень антител против РРСС, обеспечивает надежный пассивный материнский иммунитет у молодняка до 20-25-дневного возраста, что позволяет защитить его от полевого вирулентного вируса РРСС в ранний период жизни.
Пример 2.
Описанным в примере 1 способом изготовлена эмульсионная инактивированная вакцина против РРСС на основе штамма “БД” и масляного адъюванта “Монтанид ИЗА-70”. Проведены исследования по изучению ее иммуногенной активности
Иммуногенную активность полученной вакцины определяли на подсвинках живой массой 20-25 кг 6-8 недельного возраста, свободных от антител к вирусу РРСС. Вакцину вводили по 2,0 см3 внутримышечно в области шеи. У животных до вакцинации и через 34 дня после вакцинации были отобраны пробы крови и исследованы в ИФА (набор IDEXX, США) на наличие специфических антител. Их оценка проводилась по значению величины s/p против вируса РРСС. Результаты исследований приведены в таблице 1.
Примечание: “+” - клинические признаки болезни;
“-” - отсутствие клинических признаков болезни;
s/p<0,3 - отрицательный результат;
s/p=0,3-0,4 - сомнительный результат;
s/p>0,4 - положительный результат.
Из таблицы 1 видно, что в сыворотках крови вакцинированных животных появлялись специфические антитела в высоких титрах. Вакцинированные животные не заболели после контрольного их заражения вирулентным эталонным вирусом РРСС, штамм “Лелистад”.
Пример 3.
Проведены испытания иммуногенной активности эмульсионной инактивированной вакцины против РРСС на основе штамма “БД” и масляного адъюванта “Монтанид ИЗА-70”, изготовленной так, как описано в примере 1.
Исследования по определению иммуногенной активности вакцины проводили так, как описано в примере 2. Результаты исследований приведены в таблице 2. Данные таблицы 2 свидетельствуют о том, что препарат индуцирует у привитых животных поствакцинальные антитела в высоком титре.
Пример 4.
Проведены испытания иммуногенной активности эмульсионной инактивированной вакцины против РРСС на основе штамма “БД” и масляного адъюванта, изготовленной так, как описано в примере 1.
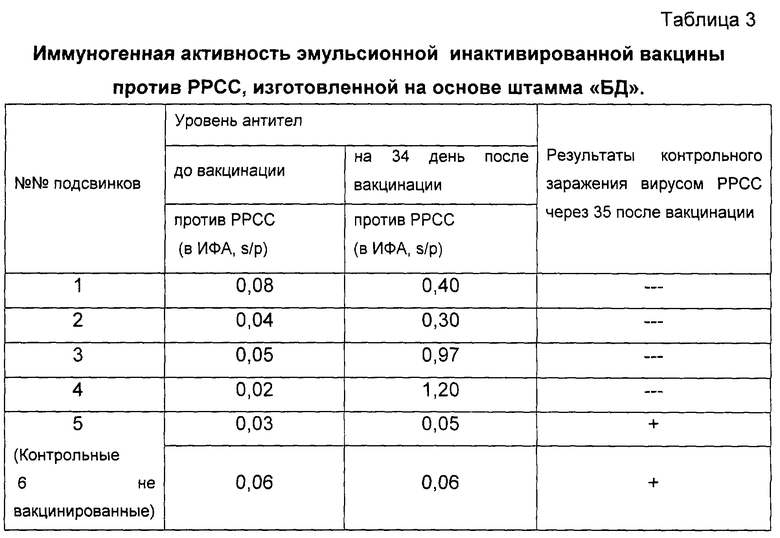
Исследования по определению иммуногенной активности вакцины проводили так, как описано в примере 2. Результаты исследований приведены в таблице 3 и свидетельствуют о высокой иммуногенной активности полученной вакцины.
Пример 5.
Проведены испытания эмульсионной инактивированной вакцины против РРСС на основе штамма “БД” и масляного адъюванта ВНИИЗЖ, изготовленной так, как описано в примере 1.
Образцы вакцины были проверены на безвредность. Для этой цели пяти белым мышам массой 18-21 г подкожно и двум подсвинкам внутримышечно было введено по 0,5 см3 и 5 см3 вакцины соответственно. За мышами вели наблюдение в течение 10 суток, подсвинками - 15 суток. За период наблюдения все мыши оставались живыми и здоровыми. У подсвинков температура тела оставалась в пределах нормы, на месте введения вакцины наблюдали незначительную припухлость и на вскрытии при осмотре места введения отмечали множество мелких инкапсулированных очажков диаметром 1-3 мм, при разрезе которых выделялось вакцинное содержимое.
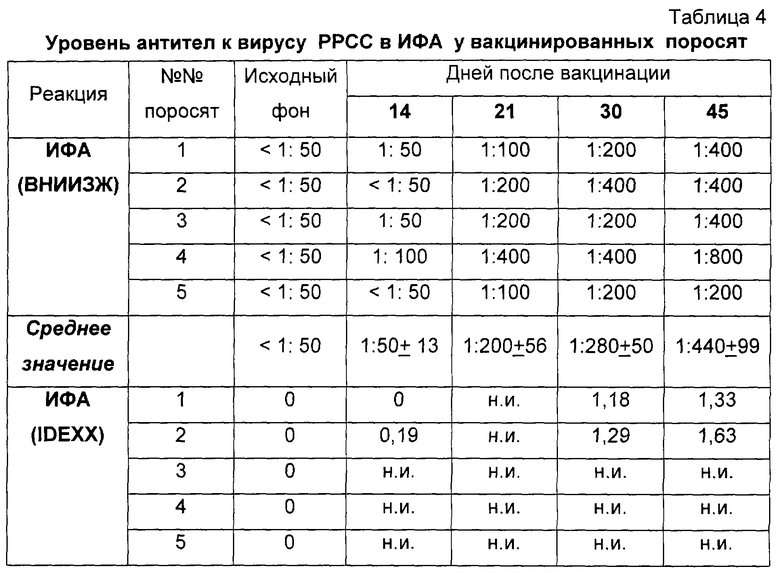
Затем полученную вакцину проверили на иммуногенность на пяти серонегативных поросятах 2,5-3-месячного возраста. Вакцину вводили однократно в дозе 2,0 см3 внутримышечно в среднюю треть шеи (за ухом). За животными в течение 45 суток вели клиническое наблюдение и периодически отбирали пробы крови. Сыворотки крови были исследованы в ИФА на наличие специфических антител к вирусу РРСС. Результаты исследований представлены в таблице 4.
Примечание: н.и. - проба не исследовалась; в ИФА (ВНИИЗЖ) значение 1:100 и выше - результат положительный; для ИФА (IDEXX) значение s/p 0,4 и выше - результат положительный.
Как видно из таблицы 4, специфические антитела к вирусу РРСС в сыворотках крови на диагностическом уровне появились к 21 дню после вакцинации и в среднем по группе составил 1:200±56. В последующие сроки отбора (30, 45 дней) уровень специфических антител возрастал и составил 1:280±50 и 1:440±99 соответственно. Наличие высокого уровня антител в сыворотках крови поросят после вакцинации было также подтверждено в коммерческом ИФА-наборе фирмы IDEXX (США).
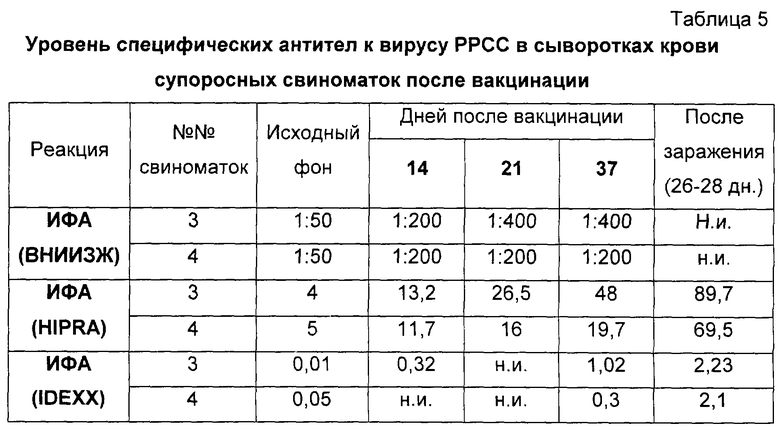
Вторым этапом проверки было определение безвредности и иммуногенности вакцины на двух супоросных свиноматках (47-50 дней супоросности). Вакцину вводили однократно в дозе 2,0 см3 внутримышечно (за ухом). Через 42 дня после введения вакцины (на 90-93 день супоросности) свиноматки были интраназально заражены вирулентным европейским вирусом РРСС, штамм Leiystad, в объеме 10 см3 вирусосодержащей жидкости с титром 104.0 lg ТЦД50/см3. За животными вели клиническое наблюдение в течение 4-х месяцев. Через 14, 21, 37, 66-69 дней после вакцинации были отобраны пробы крови и сыворотки были исследованы в ИФА (ВНИИЗЖ, HIPRA, IDEXX) на наличие антител против вируса РРСС. После вакцинации и контрольного заражения у супоросных свиноматок не отмечали каких-либо отклонений от физиологической нормы. Температура тела животных оставалась в пределах нормативных показателей, аппетит сохранялся, животные активно реагировали на окружающую обстановку. Местная реакция на введение вакцины отсутствовала.
Результаты исследований сывороток крови свиноматок представлены в таблице 5.
Примечание: н.и. - проба не исследовалась; в ИФА (ВНИИЗЖ) значение 1:100 и выше - результат положительный; для ИФА (HIPRA) значение больше 20 - результат положительный; для ИФА (IDEXX) значение s/p>0,3 - результат отрицательный; 0,3-0,39 - сомнительный; 0,4 и выше - результат положительный.
Как видно из таблицы 5, на 14, 21 и 37 день после вакцинации в сыворотке крови животных выявляли специфические антитела к вирусу РРСС и к 26-28 дню после заражения (4-5 дней после опороса) их уровень значительно повысился (до s/p 2,23 и 2,1 в ИФА - IDEXX и 89,7, 69,5 в ИФА - HIPRA). Эти свиноматки принесли 16 поросят, из них 14 живых и здоровых и 2 мертворожденных. Сохранность среди живых и здоровых поросят за время подсосного периода составила 100%.
У подсосных поросят были отобраны пробы крови и сыворотки исследованы на наличие антител к вирусу РРСС. Через 4-7 дней после опороса сыворотки крови новорожденных поросят имели высокие титры антител к вирусу РРСС (s/p 1,7-1,96 в ИФА - IDEXX), которые сохранялись до 36-дневного возраста.
Эмульсионная инактивированная вакцина против РРСС, полученная предлагаемым способом, является безвредным иммуногенным препаратом и защищает свиноматок от контрольного заражения вирулентным вирусом РРСС, штамм Leiystad.
Таким образом, приведенная выше информация свидетельствует о выполнении при использовании предлагаемого изобретения следующей совокупности условий:
- способ изготовления эмульсионной инактивированной вакцины против РРСС, воплощающий предлагаемое изобретение, предназначен для использования в сельском хозяйстве, а именно, в ветеринарной вирусологии и биотехнологии;
- для предлагаемого изобретения в том виде, как оно охарактеризовано в независимом пункте формулы изобретения, подтверждена возможность его осуществления с помощью описанных в заявке или известных до даты приоритета средств и методов;
- при использовании предлагаемого способа изготовления эмульсионной инактивированной вакцины против РРСС достигается технический результат, предусмотренный задачей создания изобретения.
Следовательно, предлагаемое изобретение соответствует условию патентоспособности “промышленная применимость”.
Источники информации
1. Wensvoort G. et al. Mystery Swine Disease in the Netherlands: The isolation of Leiystad virus. Vet. Quarterly, 1991, 13, 3, 121-130.
2. Сюрин В.Н. и др. Вирусные болезни животных. - Москва, ВНИТИБП, 1998, 552-558.
3. РСТ №92/21375, А 61 К 39/12, G 01 N 33/569, С 12 N 7/00, 10.12.92 г. (прототип).
4. РСТ №93/07898, А 61 К 39/12, G 01 N 33/569, С 12 N 7/00, 29.04.93 г.
5. Пат. Франции №2682966, С 12 N 7/02, 04, 30.04.93 г.
6. ЕР 0676467, С 12 N 7/00, А 61 К 39/12, С 12 Р 21/08, С 07 К 16/10, 11.10.95 г.
7. Пат. США №5587164, А 61 К 39/00, 39/12, 39/38, 39/193, 24.12.96 г.
8. Пат США №5690940, C 12 N 15/38, 7/01, 25.11.97 г.
9. Пат. США №5866401, С 12 N 7/08, 7/01, 7/00, 7/02, 02.02.99 г.
10. Пат. Великобритании №2282811, С 12 N 15/40, А 61 К 39/12, С 07 К 14/18, C 12 N 7/02, 7/04, 19.04.95 г.
11. Пат. России №2108111, А 61 К 39/39, А 61 К 39/00, 39/102, 39/12, 39/135, 10.04.98 г.


| название | год | авторы | номер документа |
|---|---|---|---|
| ВАКЦИНА ЭМУЛЬСИОННАЯ ИНАКТИВИРОВАННАЯ ПРОТИВ РЕПРОДУКТИВНО-РЕСПИРАТОРНОГО СИНДРОМА СВИНЕЙ | 2002 |
|
RU2236253C2 |
| ВАКЦИНА АССОЦИИРОВАННАЯ ЭМУЛЬСИОННАЯ ИНАКТИВИРОВАННАЯ ПРОТИВ РЕПРОДУКТИВНО-РЕСПИРАТОРНОГО СИНДРОМА И ПАРВОВИРУСНОЙ ИНФЕКЦИИ СВИНЕЙ | 2004 |
|
RU2269361C2 |
| ВАКЦИНА ПРОТИВ РЕПРОДУКТИВНО-РЕСПИРАТОРНОГО СИНДРОМА СВИНЕЙ ЭМУЛЬСИОННАЯ ИНАКТИВИРОВАННАЯ | 2006 |
|
RU2316346C2 |
| ШТАММ "КПР-96" ВИРУСА РЕПРОДУКТИВНО-РЕСПИРАТОРНОГО СИНДРОМА СВИНЕЙ ДЛЯ ИЗГОТОВЛЕНИЯ ДИАГНОСТИЧЕСКИХ И/ИЛИ ВАКЦИННЫХ ПРЕПАРАТОВ | 2005 |
|
RU2295567C1 |
| ВАКЦИНА АССОЦИИРОВАННАЯ ПРОТИВ ВИРУСНОЙ ДИАРЕИ, РОТАВИРУСНОЙ И КОРОНАВИРУСНОЙ ИНФЕКЦИЙ КРУПНОГО РОГАТОГО СКОТА ЭМУЛЬСИОННАЯ ИНАКТИВИРОВАННАЯ | 2012 |
|
RU2515058C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ИНАКТИВИРОВАННОЙ ЭМУЛЬСИОННОЙ ВАКЦИНЫ ПРОТИВ ПАРВОВИРУСНОЙ ИНФЕКЦИИ СВИНЕЙ | 2002 |
|
RU2214275C1 |
| ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОГО РИНОТРАХЕИТА КРУПНОГО РОГАТОГО СКОТА ЭМУЛЬСИОННАЯ ИНАКТИВИРОВАННАЯ | 2004 |
|
RU2271220C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ВИРУС-ВАКЦИНЫ ПРОТИВ РЕПРОДУКТИВНО-РЕСПИРАТОРНОГО СИНДРОМА СВИНЕЙ | 2002 |
|
RU2232596C1 |
| Вакцина инактивированная эмульсионная против ящура типа А | 2017 |
|
RU2665850C1 |
| ИНАКТИВИРОВАННАЯ ЭМУЛЬСИОННАЯ ВАКЦИНА ПРОТИВ ПАРВОВИРУСНОЙ ИНФЕКЦИИ СВИНЕЙ | 2002 |
|
RU2214276C1 |
Изобретение относится к ветеринарной вирусологии и биотехнологии. Способ включает приготовление антигенного материала из штамма “БД-ДЕП” (коллекция ВГНКИ) вируса репродуктивно-респираторного синдрома свиней (РРСС), репродуцированного в перевиваемой культуре клеток Marc-145 с биологической активностью, по меньшей мере, 6,0 lg ТЦД50/см3. Вирус культивируют в течение 48-72 часов при 37±2°С и рН 7,2-7,4. После очистки вирусосодержащей суспензии от балластных примесей известным образом в нее вносят аминоэтилэтиленимин в концентрации 0,001-0,05% для инактивации вируса. Очищенный и авирулентный антигенный материал соединяют с масляным адъювантом в эффективном соотношении. Готовый препарат подвергают контролю в соответствии с требованиями ТУ. Способ позволяет расширить арсенал эмульсионных инактивированных вакцин против РРСС, обладающих высокой иммуногенной активностью и безвредностью и создающих напряженный и длительный иммунитет у привитых животных против циркулирующих на территории России эпизоотических изолятов вируса РРСС. 10 з.п. ф-лы, 5 табл.
| Автоматический огнетушитель | 0 |
|
SU92A1 |
| СЮРИН В.Н | |||
| и др | |||
| Вирусные болезни животных | |||
| - М.: ВНИТИБП, 1998, с.552-558. | |||
Авторы
Даты
2004-09-20—Публикация
2002-10-17—Подача