Настоящее изобретение относится к новым производным простого пропаргилового эфира приведенной ниже формулы I. Оно относится к получению этих соединений и к агрохимическим композициям, содержащим в качестве действующего вещества по крайней мере одно из этих соединений. Изобретение относится также к получению указанных композиций и к применению соединений или композиций для борьбы или предупреждения заражения растений фитопатогенными микроорганизмами, прежде всего грибами.
Изобретение относится к производным простого пропаргилового эфира общей формулы I
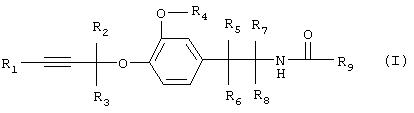
включая их оптические изомеры и смеси таких изомеров,
где R1 обозначает водород, алкил, циклоалкил или необязательно замещенный арил,
R2 и R3 каждый независимо друг от друга обозначает водород или алкил,
R4 обозначает алкил, алкенил или алкинил,
R5, R6, R7, и R8 каждый независимо друг от друга обозначает водород или алкил и
R9 обозначает группу  ,
, ,
,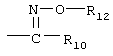 или
или 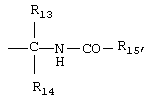
R10 обозначает необязательно замещенный арил или необязательно замещенный гетероарил,
R11 обозначает водород или необязательно замещенный алкил, алкенил или алкинил,
Z обозначает водород, -CO-R16, -COOR16, -CO-COOR16 или –CONR16R17,
R12 обозначает водород или необязательно замещенный алкил, алкенил или алкинил,
R13 обозначает водород или алкил,
R14 обозначает водород, алкил, циклоалкил или циклоалкилалкил,
R15 обозначает алкил, алкенил, алкинил, необязательно замещенный арил или необязательно замещенный арилалкил и
R16 и R17 независимо друг от друга обозначают водород, необязательно замещенный алкил, необязательно замещенный циклоалкил, необязательно замещенный арил или необязательно замещенный гетероарил.
Указанное выше понятие “арил” включает ароматические углеводородные кольца, такие как фенил, нафтил, антраценил, фенантренил и бифенил, например 1,3-бифенил и 1,4-бифенил, при этом предпочтительным является фенил.
Гетероарил обозначает ароматические кольцевые системы, включая моно-, би- или трициклические системы, в которых в качестве кольцевого члена присутствует по крайней мере один атом кислорода, азота или серы. Примерами являются фурил, тиенил, пирролил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, оксадиазолил, тиадиазолил, триазолил, тетразолил, пиридил, пиридазинил, пиримидинил, пиразинил, триазинил, тетразинил, индолил, бензотиофенил, бензофуранил, бензимидазолил, индазолил, бензотриазолил, бензотиазолил, бензоксазолил, хинолинил, изохинолинил, фталазинил, хиноксалинил, хиназолинил, циннолинил и нафтиридинил.
Указанные выше арильные и гетероарильные группы необязательно могут быть замещены. Это означает, что они могут иметь один или несколько одинаковых или различных заместителей. Как правило, одновременно присутствуют не более трех заместителей. Примерами заместителей арильных или гетероарильных групп являются алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил, фенил и фенилалкил, в свою очередь все указанные выше группы могут нести один или несколько одинаковых или различных атомов галогена; алкокси; алкенилокси; алкинилокси; алкоксиалкил; галоалкокси, алкилтио; галоалкилтио; алкилсульфонил; формил; алканоил; гидрокси; галоген; циано; нитро; амино; алкиламино; диалкиламино; карбокси; алкоксикарбонил; алкенилоксикарбонил или алкинилоксикарбонил.
Необязательно замещенные алкильные, алкенильные, алкинильные или циклоалкильные группы могут нести один или несколько заместителей, выбранных из ряда, включающего галоген, алкил, алкокси, алкилтио, нитро, циано, гидрокси, меркапто, алкилкарбонил или алкоксикарбонил. Предпочтительно количество заместителей не превышает трех за исключением галогена, когда алкильные группы могут быть пергалогенированы.
В указанных выше определениях понятие "галоген" включает фтор, хлор, бром и йод.
Алкильный, алкенильный и алкинильный радикалы могут быть с прямой или разветвленной цепью. Это также относится к алкильным, алкенильным или алкинильным фрагментам других алкил-, алкенил- или алкинилсодержащих групп.
В зависимости от количества указанных атомов углерода алкил индивидуально или как часть другого заместителя представляет собой, например, метил, этил, пропил, бутил, пентил, гексил, гептил, октил, нонил, децил, ундецил, додецил и их изомеры, например изопропил, изобутил, трет-бутил или втор-бутил, изопентил или трет-пентил.
Циклоалкил в зависимости от количества указанных атомов углерода представляет собой циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил.
В зависимости от количества указанных атомов углерода алкенил как отдельная группа или как структурный элемент других групп представляет собой, например, этенил, аллил, 1-пропенил, бутен-2-ил, бутен-3-ил, пентен-1-ил, пентен-3-ил, гексен-1-ил, 4-метил-3-пентенил или 4-метил-3-гексенил.
Алкинил как отдельная группа или как структурный элемент других групп представляет собой, например, этинил, пропин-1-ил, пропин-2-ил, бутин-1-ил, бутин-2-ил, 1-метил-2-бутинил, гексин-1-ил, 1-этил-2-бутинил или октин-1-ил.
Галоалкильная группа может содержать один или несколько (одинаковых или различных) атомов галогена и может представлять собой, например, СНСl2, СН2F, ССl3, СН2Сl, CHF2, СF3, СН2СН2Вr, С2Сl5, CH2Br, CHClBr, СF3CH2, и т.д.
Наличие по крайней мере одного асимметрического атома углерода в соединениях формулы I означает, что соединения могут находиться в формах оптических изомеров и энантиомеров. Вследствие наличия возможной алифатической С=С двойной связи может иметь место также геометрическая изомерия. Следует понимать, что под объем соединений формулы I подпадают все такие возможные изомерные формы и их смеси.
Предпочтительные подгруппы соединений формулы I включают соединения, в которых R1 обозначает водород, алкил, циклоалкил, фенил или нафтил; при этом фенил и нафтил необязательно имеют заместители, выбранные из ряда, включающего алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил, фенил и фенилалкил, где все эти группы в свою очередь могут быть замещены одним или несколькими атомами галогена; алкокси, алкенилокси, алкинилокси; алкоксиалкил; галоалкокси; алкилтио; галоалкилтио; алкилсульфонил; формил; алканоил; гидрокси; галоген; пиано; нитро; амино; алкиламино; диалкиламино; карбокси; алкоксикарбонил; алкенилоксикарбонил или алкинилоксикарбонил, или
R1 обозначает водород, С1-С8алкил, С3-С8циклоалкил, фенил или нафтил; при этом фенил и нафтил необязательно имеют 1-3 заместителя, выбранных из ряда, включающего С1-С8алкил, С2-С8алкенил, С2-С8алкинил, С2-С8галоалкил, С1-С8алкокси, С1-С8галоалкокси, С1-С8алкилтио, С1-С8галоалкилтио, С1-С8алкилсульфонил, галоген, циано, нитро и С1-С8алкоксикарбонил, или
R1 обозначает водород, С1-С8алкил, фенил, необязательно замещенный 1-3 заместителями, выбранными из ряда, включающего С1-С8алкил, С1-С8галоалкил, С1-С8алкокси, С1-С8галоалкокси, С1-С8алкилтио, С1-С8галоалкилтио, галоген, циано, нитро и С1-С8алкоксикарбонил, или
R2 и R3 обозначают водород, или
R4 обозначает алкил, или
R5, R6, и R7 обозначают водород, или
R8 обозначает C1-С6алкил,
R4 обозначает C1-С6алкил, или
R8 обозначает метил или этил, или
R4 обозначает метил или этил, или
R10 обозначает арил или гетероарил, каждый из которых необязательно замещен заместителями, выбранными из ряда, включающего алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил, фенил и фенилалкил, где все эти группы могут быть замещены одним или несколькими атомами галогена; алкокси, алкенилокси, алкинилокси; алкоксиалкил; галоалкокси; алкилтио; галоалкилтио; алкилсульфонил; формил; алканоил; гидрокси; галоген; циано; нитро; амино; алкиламино; диалкиламино; карбокси; алкоксикарбонил; алкенилоксикарбонил и алкинилоксикарбонил, или
R10 обозначает фенил, нафтил, 1,3-бифенил или 1,4-бифенил, каждый из которых необязательно замещен 1-3 заместителями, выбранными из ряда, включающего С1-С8алкил, С2-С8алкенил, С2-С8алкинил, С1-С8галоалкил, С1-С8алкокси, С1-С8галоалкокси, С1-С8алкилтио, С1-С8галоалкилтио, С1-С8алкилсульфонил, галоген, циано, нитро и С1-С8алкоксикарбонил, или
R10 обозначает фенил, нафтил, 1,3-бифенил или 1,4-бифенил, каждый из которых необязательно замещен 1-3 заместителями, выбранными из ряда, включающего С1-С8алкил, С1-С8галоалкил, С1-С8алкокси, С1-С8галоалкокси, C1-С8алкилтио, С1-С8галоалкилтио, галоген, циано, нитро и С1-С8алкоксикарбонил, или
R11 обозначает водород, С1-С4алкил, С1-С4галоалкил, С3-С4алкенил или С3-С4алкинил или
R11 обозначает водород или С1-С4алкил или
R11 обозначает водород или
Z обозначает водород или -CO-R16, где R16 обозначает С1-С4алкил или С3-С6циклоалкил, или
Z обозначает водород или -CO-R16, где R16 обозначает С1-С4алкил, или
Z обозначает водород или ацетил или
Z обозначает водород или
R12 обозначает водород, C1-С6алкил, C1-С6галоалкил, С3-С6алкенил или С3-С6алкинил или
R12 обозначает водород, C1-С6алкил, С3-С6алкенил или С3-С6алкинил или
R12 обозначает водород или C1-С3алкил или
R13 обозначает водород или С1-С4алкил или
R13 обозначает водород или
R14 обозначает C1-С6алкил или С3-С7циклоалкил или
R14 обозначает С2-С5алкил или С3-С7циклоалкил или
R15 обозначает алкил, алкенил, алкинил; арил или арилалкил, при этом арил и арилалкил каждый необязательно замещены заместителями, выбранными из ряда, включающего алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил, фенил и фенилалкил, где все эти группы могут быть замещены одним или несколькими атомами галогена; алкокси, алкенилокси, алкинилокси; алкоксиалкил; галоалкокси; алкилтио; галоалкилтио; алкилсульфонил; формил; алканоил; гидрокси; галоген; циано; нитро; амино; алкиламино; диалкиламино; карбокси; алкоксикарбонил; алкенилоксикарбонил и алкинилоксикарбонил, или
R15 обозначает С1-С8алкил, С3-С8алкенил, С3-С8алкинил; фенил или бензил, при этом фенил и бензил необязательно замещены 1-3 заместителями, выбранными из ряда, включающего С1-С8алкил, С2-С8алкенил, С2-С8алкинил, С1-С8галоалкил, С1-С8алкокси, С1-С8галоалкокси, С1-С8алкилтио, С1-С8галоалкилтио, С1-С8алкилсульфонил, галоген, циано, нитро и С1-С8алкоксикарбонил, или
R15 обозначает С3-С6алкил, С3-С6алкенил или фенил, необязательно замещенный 1-3 заместителями, выбранными из ряда, включающего С1-С8алкил, С1-С8галоалкил, С1-С8алкокси, С1-С8галоалкокси, С1-С8алкилтио, С1-С8галоалкилтио, галоген и циано.
Одна из предпочтительных подгрупп соединений формулы I состоит из соединений, в которых R11 обозначает водород или алкил, Z обозначает водород или -CO-R16, R12 обозначает водород, алкил, алкенил или алкинил и R16 обозначает водород или алкил.
Другие предпочтительные подгруппы соединений формулы I включают соединения, в которых
R1 обозначает водород, алкил, циклоалкил, фенил или нафтил; при этом фенил и нафтил необязательно замещены заместителями, выбранными из ряда, включающего алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил, фенил и фенилалкил, где все эти группы в свою очередь могут быть замещены одним или несколькими атомами галогена; алкокси, алкенилокси, алкинилокси; алкоксиалкил; галоалкокси; алкилтио; галоалкилтио; алкилсульфонил; формил; алканоил; гидрокси; галоген; циано; нитро; амино; алкиламино; диалкиламино; карбокси; алкоксикарбонил; алкенилоксикарбонил или алкинилоксикарбонил, и R4 обозначает алкил, и R10 обозначает арил или гетероарил, каждый из которых необязательно замещен заместителями, выбранными из ряда, включающего алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил, фенил и фенилалкил, где все эти группы могут быть замещены одним или несколькими атомами галогена; алкокси, алкенилокси, алкинилокси; алкоксиалкил; галоалкокси; алкилтио; галоалкилтио; алкилсульфонил; формил; алканоил; гидрокси; галоген; циано; нитро; амино; алкиламино; диалкиламино; карбокси; алкоксикарбонил; алкенилоксикарбонил и алкинилоксикарбонил, и Z обозначает водород или -CO-R16, где R16 обозначает C1-С4алкил, и R15 обозначает алкил, алкенил, алкинил; арил или арилалкил, при этом арил и арилалкил каждый необязательно замещены заместителями, выбранными из ряда, включающего алкил, алкенил, алкинил, циклоалкил, циклоалкилалкил, фенил и фенилалкил, где все эти группы могут быть замещены одним или несколькими атомами галогена; алкокси, алкенилокси, алкинилокси; алкоксиалкил; галоалкокси; алкилтио; галоалкилтио; алкилсульфонил; формил; алканоил; гидрокси; галоген; циано; нитро; амино; алкиламино; диалкиламино; карбокси; алкоксикарбонил; алкенилоксикарбонил и алкинилоксикарбонил, или
R1 обозначает водород, С1-С8алкил, С3-С8циклоалкил, фенил или нафтил; при этом фенил и нафтил необязательно замещены 1-3 заместителями, выбранными из ряда, включающего С1-С8алкил, С2-С8алкенил, С2-С8алкинил, С1-С8галоалкил, С1-С8алкокси, С1-С8галоалкокси, С1-С8алкилтио, С1-С8галоалкилтио, С1-С8алкилсульфонил, галоген, циано, нитро и С1-С8алкоксикарбонил, и R2, R3, R5, R6, и R7 обозначают водород, и R4 и R8 независимо друг от друга обозначают C1-С6алкил, и R10 обозначает фенил, нафтил, 1,3-бифенил или 1,4-бифенил, каждый из которых необязательно замещен 1-3 заместителями, выбранными из ряда, включающего С1-С8алкил, С2-С8алкенил, С2-С8алкинил, С1-С8галоалкил, С1-С8алкокси, С1-С8галоалкокси, С1-С8алкилтио, С1-С8галоалкилтио, С1-С8алкилсульфонил, галоген, циано, нитро и С1-С8алкоксикарбонил; и R11 обозначает водород или С1-С4алкил, и Z обозначает водород или ацетил, и R12 обозначает водород, C1-С6алкил, С3-С6алкенил или С3-С6алкинил, и R13 обозначает водород или С1-С4алкил, и R14 обозначает C1-С6алкил или С3-С7циклоалкил, и R15 обозначает С1-С8алкил, С3-С8алкенил, С3-С8алкинил; фенил или бензил, при этом фенил и бензил необязательно замещены 1-3 заместителями, выбранными из ряда, включающего С1-С8алкил, С2-С8алкенил, С2-С8алкинил, С1-С8галоалкил, С1-С8алкокси, С1-С8галоалкокси, С1-С8алкилтио, С1-С8галоалкилтио, С1-С8алкилсульфонил, галоген, циано, нитро и С1-С8алкоксикарбонил, или
R1 обозначает водород, С1-С8алкил, фенил, необязательно замещенный 1-3 заместителями, выбранными из ряда, включающего С1-С8алкил, С1-С8галоалкил, С1-С8алкокси, С1-С8галоалкокси, С1-С8алкилтио, С1-С8галоалкилтио, галоген, циано, нитро и С1-С8алкоксикарбонил, и R2, R3, R5, R6, и R7 обозначают водород и R4 и R8 каждый независимо друг от друга обозначают метил или этил, и R10 обозначает фенил, нафтил, 1,3-бифенил или 1,4-бифенил, каждый независимо друг от друга необязательно замещен 1-3 заместителями, выбранными из ряда, включающего С1-С8алкил, С1-С8галоалкил, С1-С8алкокси, С1-С8галоалкокси, С1-С8алкилтио, С1-С8галоалкилтио, галоген, циано, нитро и С1-С8алкоксикарбонил, и R11, Z и R13 каждый обозначает водород, и R12 обозначает водород или C1-С3алкил, и R14 обозначает С2-С5алкил или С3-С7циклоалкил, и R15 обозначает С3-С6алкил, С3-С6алкенил или фенил, необязательно замещенный 1-3 заместителями, выбранными из ряда, включающего С1-С8алкил, С1-С8галоалкил, С1-С8алкокси, С1-С8галоалкокси, С1-С8алкилтио, С1-С8галоалкилтио, галоген и циано.
Предпочтительными отдельными соединениями являются
2-(3,4-дихлорфенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-
инилоксифенил)этил]ацетамид,
2-(3,4-дихлорфенил)-2-гидрокси-N-[2-(3-метокси-4-пент-2-
инилоксифенил)этил]ацетамид,
2-(4-фторфенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(4-хлорфенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(4-бромфенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(4-метоксифенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(4-метилфенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(2-нафтил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(3,4-дихлорфенил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-оксоацетамид,
2-(3,4-дихлорфенил)-N-[2-(3-метокси-4-пент-2-инилоксифенил)этил]-2-оксоацетамид,
2-(4-хлорфенил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-оксоацетамид,
2-(4-бромфенил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-оксоацетамид,
2-(4-метилфенил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-оксоацетамид,
2-(3,4-диметоксифенил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-оксоацетамид,
2-(1-метилэтоксикарбониламино)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-3-метилбутирамид,
2-(1,1-диметилэтоксикарбониламино)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-3-метилбутирамид,
2-(1,1-диметилэтоксикарбониламино)-N-{2-[3-метокси-4-(пент-2-инилокси)фенил]этил}-3-метилбутирамид,
2-(1,1-диметилэтоксикарбониламино)-N-{2-[3-метокси-4-(4-фторфенилпроп-2-инилокси)фенил]этил}-3-метилбутирамид,
2-(1,1-диметилэтоксикарбониламино)-N-{2-[3-метокси-4-(4-хлорфенилпроп-2-инилокси)фенил]этил}-3-метилбутирамид,
2-(3,4-дихлорфенил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-метоксиминоацетамид,
2-(4-хлорфенил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-
метоксиминоацетамид,
2-(4-метилфенил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-метоксиминоацетамид,
2-(4-бромфенил)-2-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-
метоксиминоацетамид,
2-(4-хлорфенил)-2-гидрокси-N-[(R)2-(3-метокси-4-проп-2-инилоксифенил)пропил]ацетамид,
2-(4-хлорфенил)-2-гидрокси-N-[(S)2-(3-метокси-4-проп-2-инилоксифенил)пропил]ацетамид,
2-(4-хлор-2-нитрофенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-
инилоксифенил)этил]ацетамид,
2-(4-этилфенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(4-трифторметилфенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-
инилоксифенил)этил]ацетамид,
2-(4-метилфенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(4-хлорфенил)-2-гидрокси-N-[2-(3-метокси-4-пент-2-инилоксифенил)этил]ацетамид,
2-(4-бромфенил)-2-гидрокси-N-[2-(3-метокси-4-пент-2-инилоксифенил)этил]ацетамид,
2-(4-метилфенил)-2-гидрокси-N-[2-(3-метокси-4-пент-2-инилоксифенил)этил]ацетамид,
2-(4-трифторметилфенил)-2-гидрокси-N-[2-(3-метокси-4-пент-2-инилоксифенил)этил]ацетамид,
2-(4-хлорфенил)-2-гидрокси-N-[2-(3-метокси-4-гекс-2-инилоксифенил)этил]ацетамид,
2-(4-бромфенил)-2-гидрокси-N-[2-(3-метокси-4-гекс-2-инилоксифенил)этил]ацетамид,
2-(4-метилфенил)-2-гидрокси-N-[2-(3-метокси-4-гекс-2-инилоксифенил)этил]ацетамид,
2-(3,4-дихлорфенил)-2-гидрокси-N-[2-(3-метокси-4-гекс-2-инилоксифенил)этил]ацетамид,
2-нафтил-2-гидрокси-N-[2-(3-метокси-4-гекс-2-инилоксифенил)этил]ацетамид,
2-(4-трифторметилфенил)-2-гидрокси-N-[2-(3-метокси-4-гекс-2-инилоксифенил)этил]ацетамид,
2-(4-бифенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(4-бромфенил)-2-метилалилокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(4-хлорфенил)-2-гидрокси-2-(проп-2-инил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(3,4-дихлорфенил)-N-[2-(3-метокси-4-пент-2-инилоксифенил)этил]-2-оксоацетамид,
2-(4-хлорфенил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-метоксиминоацетамид,
2-(4-метилфенил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-метоксиминоацетамид и
2-(3,4-дихлорфенил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-метоксиминоацетамид.
Для борьбы с повреждающими растения (фитопатогенными) грибами были предложены некоторые карбаматы аминокислот, производные миндальной кислоты и производные алкоксиминоуксусной кислоты (например, в ЕР-А-398072, WO 94/29267 и WO 96/23763). Однако действия этих соединений не являются удовлетворительными во всех отношениях с точки зрения сельскохозяйственных потребностей. При создании изобретения неожиданно было установлено, что соединения, имеющие структуру, описываемую формулой I, представляют собой новые виды бактерицидов, обладающих высоким уровнем активности.
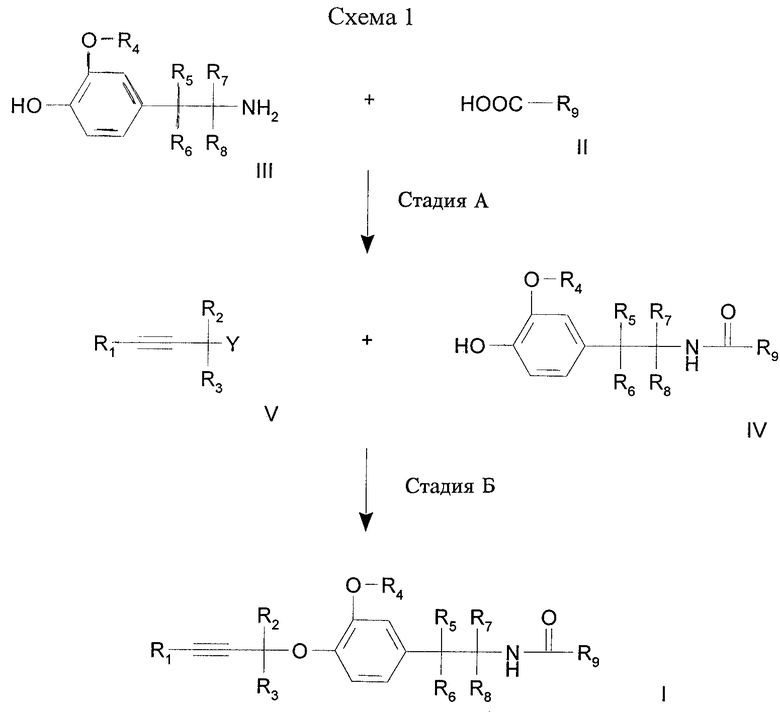
Производные простого пропаргилового эфира формулы I могут быть получены согласно одному из процессов, представленных на схемах 1-5 (см. в конце описания).
Стадия Б
Кислоту формулы II или производное кислоты формулы II с активированной карбоксильной функцией, где R9 имеет значения, указанные для формулы I, подвергают взаимодействию с амином формулы III, где R4, R5, R6, R7 и R8 имеют значения, указанные для формулы I, необязательно в присутствии основания и необязательно в присутствии разбавителя (стадия А).
Производные кислоты формулы II с активированной карбоксильной функцией представляют собой все соединения, имеющие активированную карбоксильную группу, такие как галогенангидрид, например хлорангидрид, такие как симметричные или смешанные ангидриды, например смешанные ангидриды с O-алкилкарбонатами, такие как активированные сложные эфиры, например сложные пара-нитрофениловые эфиры или сложные N-гидроксисукцинимидные эфиры, а также образованные in situ активированные формы аминокислоты формулы II с конденсирующими агентами, такими как дициклогексилкарбодиимид, карбонилдиимидазол, гексафторфосфат бензотриазол-1-илокси-трис(диметиламино)фосфония, гексафторфосфат O-бензотриазол-1-ил-N,N,N',N'-бис(пентаметилен)урония, гексафторфосфат О-бензотриазол-1-ил-N,N,N',N'-бис(тетраметилен)урония, гексафторфосфат О-бензотриазол-1-ил-N,N,N’,N’-тетраметилурония или гексафторфосфат бензотриазол-1-илокситрипирролидинофосфония. Смешанные ангидриды кислот формулы II могут быть получены путем взаимодействия аминокислоты формулы II с эфирами хлормуравьиной кислоты, такими как алкиловые эфиры хлормуравьиной кислоты, например этилхлорформиат или изобутилхлорформиат, необязательно в присутствии органического или неорганического основания, такого как третичный амин, например триэтиламин, N,N-диизопропилэтиламин, пиридин, N-метилпиперидин или N-метилморфолин.
Указанную реакцию предпочтительно проводят в растворителе, таком как ароматические, неароматические или галогенированные углеводороды, такие как хлорированные углеводороды, например дихлорметан или толуол; кетоны, например ацетон; сложные эфиры, например этилацетат; амиды, например N,N-диметилформамид; нитрилы, например ацетонитрил, или простые эфиры, например диэтиловый эфир, метил-трет-бутиловый эфир, диоксан или тетрагидрофуран, или вода. Также можно использовать смеси этих растворителей. Реакцию проводят необязательно в присутствии органического или неорганического основания, такого как третичный амин, например триэтиламин, N,N-диизопропилэтиламин, пиридин, N-метилпиперидин или N-метилморфолин, такого как гидроксид металла или карбонат металла, предпочтительно гидроксид щелочного металла или карбонат щелочного металла, например гидроксид лития, гидроксид натрия или гидроксид калия, при температурах в диапазоне от -80 до 150°С, предпочтительно при температурах в диапазоне от -40 до 40°С.
И, наконец, после этого соединения формулы I могут быть получены путем взаимодействия фенола формулы IV, где R4, R5, R6, R7, R8 и R9 имеют значения, указанные для формулы I, с соединением формулы V, где R1, R2 и R3 имеют значения, указанные для формулы I, и где Y обозначает уходящую группу, такую как галогенид, например хлорид или бромид, или эфир сульфоновой кислоты, например тозилат, мезилат или трифлат (стадия Б).
Реакцию предпочтительно проводят в растворителе, таком как ароматические, неароматические или галогенированные углеводороды, такие как хлорированные углеводороды, например дихлорметан или толуол; кетоны, например ацетон или 2-бутанон; сложные эфиры, например этилацетат; простые эфиры, например диэтиловый эфир, метил-трет-бутиловый эфир, диоксан или тетрагидрофуран, амиды, например диметилформамид; нитрилы, например ацетонитрил; спирты, например метанол, этанол, изопропанол, н-бутанол или трет-бутанол, сульфоксиды, например диметилсульфоксид, или вода. Также можно использовать смеси этих растворителей. Реакцию проводят необязательно в присутствии органического или неорганического основания, такого как третичный амин, например триэтиламин, N,N-диизопропилэтиламин, пиридин, N-метилпиперидин или N-метилморфолин, такого как гидроксид металла, карбонат металла или алкоксид металла, предпочтительно гидроксид щелочного металла, карбонат щелочного металла или алкоксид щелочного металла, например гидроксид лития, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, метоксид натрия, метоксид калия, этоксид натрия, этоксид калия, трет-бутоксид натрия или трет-бутоксид калия, при температурах в диапазоне от -80 до 200°С, предпочтительно при температурах в диапазоне от 0 до 120°С.
Стадия В: Соединение формулы VI, где R4, R5, R6, R7 и R8 имеют значения, указанные для формулы I, алкилируют с помощью соединения формулы V (см. схему 1), где R1, R2, R3 и Y имеют значения, указанные для схемы 1, в тех же условиях, которые указаны для стадии Б на схеме 1.
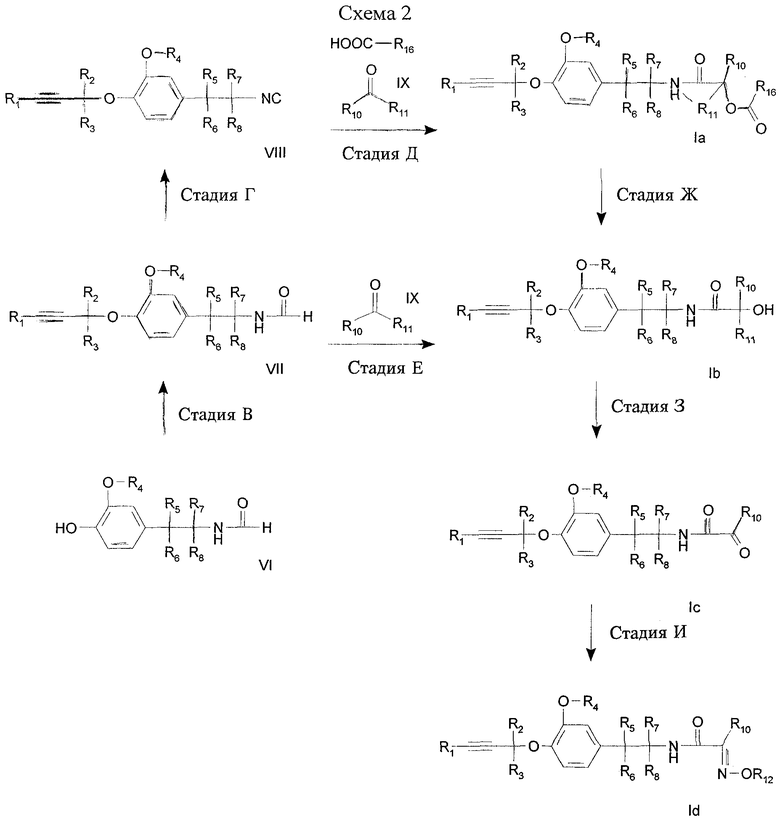
Стадия Г: Соединение формулы VII, где R1, R2, R3, R4, R5, R6, R7 и R8 имеют значения, указанные для формулы I, подвергают дегидратации, получая изоцианид формулы VIII, где R1, R2, R3, R4, R5, R6, R7 и R8 имеют значения, указанные для формулы I, в хорошо известных условиях (D. Seebach, G. Adam, Т. Gees, M. Schiess, W. Weigang, Chem. Ber. 1988, 121, 507).
Стадия Д: Изоцианид формулы VIII, где R1, R2, R3, R4, R5, R6, R7 и R8 имеют значения, указанные для формулы I, подвергают взаимодействию с альдегидом или кетоном формулы IX, где R10 и R11 имеют значения, указанные для формулы I, в присутствии карбоновой кислоты R16-COOH, где R16 обозначает водород или низший алкил, как правило уксусной кислоты, получая О-ацил-α-гидроксиамид формулы Iа, где R1, R2, R3, R4, R5, R6, R7, R8, R10 и R11 имеют значения, указанные для формулы I, (трехкомпонентная реакция Пассерини, J. March, Advanced Organic Chemistry, 4-е изд., Wiley, 1992, стр. 980).
В альтернативном варианте изоцианид формулы VIII, где R1, R2, R3, R4, R5, R6, R7 и R8 имеют значения, указанные для формулы I, подвергают взаимодействию с альдегидом или кетоном формулы IX в присутствии тетрахлорида титана, получая α-гидроксиамид формулы Ib (где R1, R2, R3, R4, R5, R6, R7, R8, R10 и R11 имеют указанные выше значения) в хорошо известных условиях (Chem. Ber. 1988, 121, 507; О. Ort. и др. Pesticide Sci. 1997, 50, 331).
Стадия Е: Соединение формулы VII, где R1, R2, R3, R4, R5, R6, R7 и R8 имеют значения, указанные для формулы I, обрабатывают одним эквивалентом фосгена (например, трифосгена) и основанием (например, триэтиламином) и на второй стадии, без выделения промежуточного продукта в виде изоцианата, обрабатывают тетрахлоридом титана и альдегидом или кетоном формулы IX, где R10 и R11 имеют значения, указанные для формулы I, в хорошо известных условиях (WO 96/17840), получая α-гидроксиамид формулы Ib, где R1, R2, R3, R4, R5, R6, R7, R8, R10 и R11 имеют значения, указанные для формулы I.
Стадия Ж: O-ацил-α-гидроксиамид формулы Iа, где R1, R2, R3, R4, R5, R6, R7, R8, R10, R11 и R16 имеют указанные выше значения, подвергают гидролизу с получением α-гидроксиамида формулы Ib, где R1, R2, R3, R4, R5, R6, R7, R8, R10 и R11 имеют значения, указанные для формулы I, в классических условиях (J. March, Advanced Organic Chemistry, 4-е изд., изд-во Wiley, 1992).
Стадия З: Соединение формулы Ib, где R1, R2, R3, R4, R5, R6, R7, R8, R10 и R11 имеют значения, указанные для формулы I, окисляют с помощью органического окислителя, например алкилгидропероксида, реагента на основе ДМСО (Т. Т. Tidwell, Org. React., 1990, 29, 297-572), гипервалентного йодсодержащего реагента, диоксирана, нитроксильного радикала, или неорганического окислителя, например пероксидов.
Взаимодействие соединения формулы Ib с окислителем предпочтительно проводят в инертном растворителе, таком как ТГФ, дихлорметан, вода или кетон, например ацетон, или в их смеси в присутствии кислоты или без нее, или в присутствии основания или без него при температуре от -80 до 150°С.
Стадия И: Соединение формулы Iс, где R1, R2, R3, R4, R5, R6, R7, R8 и R10 имеют значения, указанные для формулы I, подвергают взаимодействи с R12-O-NH2, где R12 имеет указанные выше значения, в классических условиях оксимирования (см., например, J. March, Advanced Organic Chemistry, 4-е изд., изд-во Wiley, 1992), получая соединение формулы Id где R1, R2, R3, R4, R5, R6, R7, R8, R10 и R12 имеют указанные выше значения. Кроме того, если R12 обозначает Н, соединения формулы Id могут быть алкилированы с помощью R12-LG, где R12 имеет указанные выше значения (за исключением Н), LG обозначает уходящую группу, как правило Сl, Вr, O-тозил, O-мезил, в присутствии основания в инертном растворителе при темепературе от -20 до 160°С.
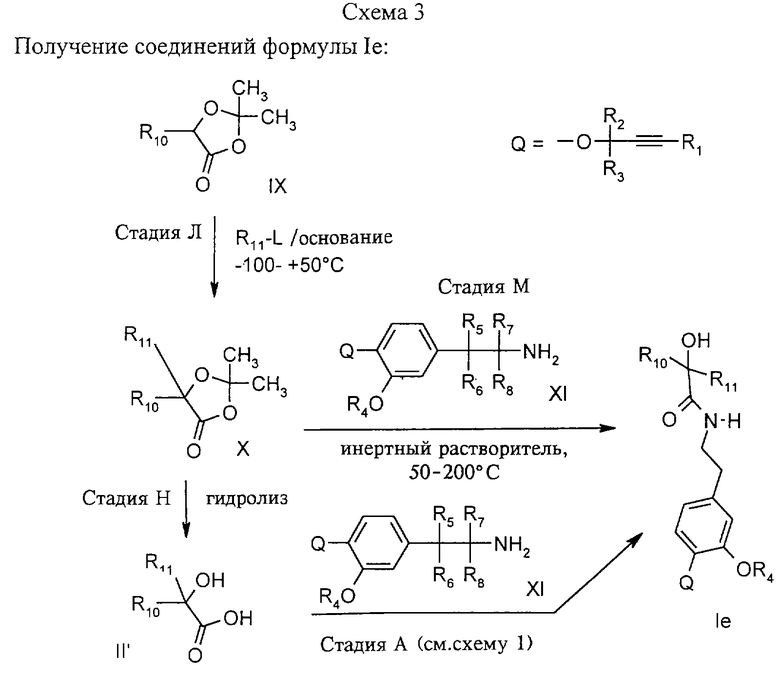
Стадия Л: Диоксоланон IX (полученный путем конденсации миндальной кислоты с ацетоном в присутствии кислотного катализатора (см. ЕР-А-071568)) обрабатывают последовательно основанием, таким как диизопропиламид лития (ЛДА) и алкилирующим агентом R11-L согласно известным методам (THL 1994, 2891, Rec. Trav. Chim. Pays-Bas, DE 4319887).
Стадии М и Н: Образовавшийся диоксоланон Х либо выдерживают с соответствующим амином XI при температуре 50-200°С (стадия М), либо диоксалонон сначала гидролизуют разбавленной водной минеральной кислотой (например, НСl) или в щелочных условиях (водный раствор гидроксида натрия (0-120°С; стадия Н)) с получением замещенной гидроксикислоты II', которая затем может быть подвергнута амидированию (согласно стадии А схемы 1). Гидроксикислоты II' также могут быть получены путем взаимодействия реагента Гриньяра R10-MgHal (используя в качестве исходных продуктов арилгалогенид и Mg) с соответствующим эфиром α-кетокислоты (Synthesis 1993,606).
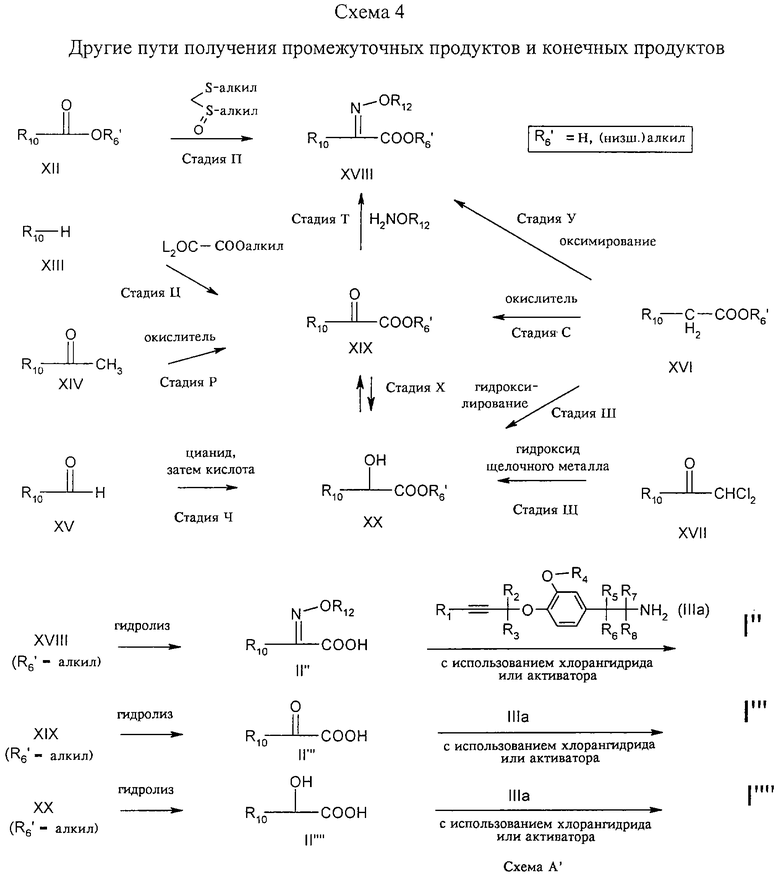
Стадия П: Соответствующее производное эфира карбоновой кислоты XII подвергают взаимодействию с алкилметилсульфинилалкилсульфидом (MMTS) в присутствии основания с получением промежуточного продукта, который может быть окислен (NaIO4) до кетотиометилового эфира, который в свою очередь может быть оксимирован до оксиминокарбоновой кислоты XVIII, как описано в J.Med. Chem. 28, 1896.
Стадия Р, стадия С: Ацетофеноновое производное XIV или производное фенилуксусной кислоты XVI окисляют до производного кетокарбоновой кислоты XIX с помощью окислителя, например SeO2, в инертном растворителе, таком как диоксан, пиридин, при температуре в диапазоне 20-150°С (J. Gen. Org. Chem. USSR, 21, 694, 1951).
Стадия Т: Производное кетокарбоновой кислоты XIX трансформируют в соответствующий оксим XVIII с помощью производного гидроксиламина H2NOR12 в инертном растворителе согласно методу, описанному для стадии I (см. схему 2).
Стадия У: Производное эфира арилуксусной кислоты XVI оксимируют с помощью алкилнитрита в щелочных или кислых условиях согласно методу, описанному в Org. reactions, том 7, 327 (1953); Houben Weyl X/1, 911 и далее; там же Х/4, 44 и далее.
Стадия X: Производное кетокарбоновой кислоты XIX восстанавливают с помощью водорода в присутствии катализатора, такого как PtO2, в инертном растворителе, таком как тетрогидрофуран, или с помощью борогидрида натрия при пониженной температуре (от -20 до 60°С) в растворителе, таком как спирт (этанол) или простой циклический эфир, с получением производного миндальной кислоты XX. В литературе описан ряд хиральных катализаторов, позволяющих получить энантиомерно чистые спирты (Org. Synth. 63, 18 (1984; JACS 109, 5856; C.R. Stephenson, Advanced Asymm. Synthesis, London, 1996; M.Hudlicky. Reductions in Org. Chemistry, ACS Monogr. 188, Washington, 1996).
При необходимости спирт XX может быть окислен с помощью окислителя (например, ДМСО/СlСОСОСl/трет-амин; J. Am. Chem. Soc. 108, 1035) с получением кетона XIX согласно методу, описанному для стадии 3 (см. схему 2) (M.Hudlicky, Oxidations in Org. Chemistry, монография 186 ACS, Washington, 1990).
Стадия Ц: Арильное производное XIII трансформируют в эфир кетокарбоновой кислоты XIX путем обработки производным эфира щавелевой кислоты L2OC-СООалкил, где L2 обозначает уходящую группу, такую как атом хлора или алкоксигруппа, в присутствии кислоты Льюиса, например, АlСl3, в инертном растворителе, таком как дихлорбензол или CS2 (J. Med. Chem. 28, 1896).
Стадия Ч: Альдегид XV трансформируют в соответствующий циангидрин путем взаимодействия с цианидом щелочного металла (например, KCN) в присутствии бисульфита натрия (NaHSO3) в инертном растворителе, таком как вода, или путем взаимодействия с триалкилсилилцианидом в присутствии кислоты Льюиса (ZnI2). Затем циангидрин или его триалкилсилиловый эфир гидролизуют с помощью минеральных кислот, таких как водная соляная кислота, согласно методу, описанному в Org. Synth. Coll. том V, 437 (1973).
Стадия Ш: Ариловый эфир уксусной кислоты XVI подвергают гидроксилированию с производным перекиси водорода, например с бистриметилсилильным производным перекиси водорода, в инертном растворителе и в присутствии основания, такого как диизопропиламид лития (ЛДА) при температурах от -90 до 50°С согласно методу, описанному в Synth. Comm. 18, 2141 (1988).
Стадия Щ: Дихлорацетофенон XVII обрабатывают гидроксидом щелочного металла (NaOH) в воде согласно методу, описанному в ЕР-А-071568.
Стадия А': Промежуточные продукты XVIII, XIX и XX, где R6' обозначает алкил, могут быть гидролизованы с помощью 1,0-1,5 экв. водного раствора гидроксида щелочного металла в воде или в смесях со спиртом или тетрагидрофураном, в результате чего получают соответствующие кислоты (II", II'", II""). Кислоты II", II'", II"" могут быть подвергнуты взаимодействию с соответствующим амином IIIa с получением амидов II", II'", II"". Реакция может быть проведена либо с помощью хлорангидрида в присутствии основания (пиридина или триэтиламина) в инертном растворителе или предпочтительно непосредственно с помощью активатора (например, дициклогексилкарбодиимида, карбонилдиимидазола или гексафторфосфата бензотриазол-1-илокситрис(диметиламино)фосфония (ВОР) в инертном растворителе и необязательно в присутствии основания (третичного амина) согласно методу, описанному у М. Bodansky, Principles of Peptide Synthesis; M. Bodansky, The Practice of Peptide Synthesis, Springer-Verlag Berlin, 1994), как это указано для стадии А (см. схему 1).
Промежуточные продукты XVIII, XIX и XX, где R6' обозначает алкил, могут быть также непосредственно подвергнуты взаимодействию с амином IIIa в растворителе с высокой температурой кипения или без него при температурах 70-240°С согласно методу, описанному в WO 94/29267.
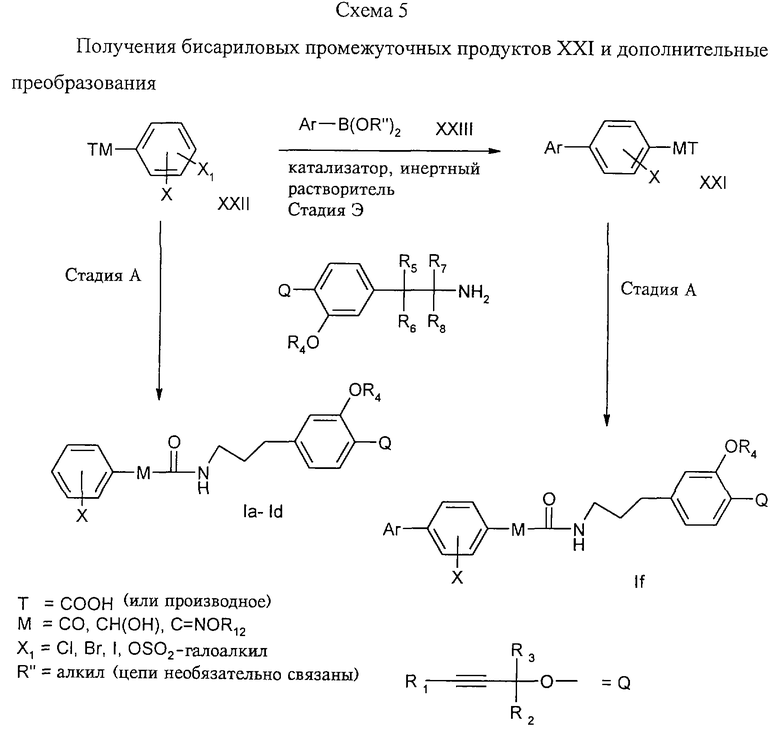
Стадия Э: Производное карбоновой кислоты ХХП, имеющее уходящую группу X1, подвергают реакции сочетания согласно методу Сузуки с арилбороновой кислотой или ее эфиром XXIII с получением бифенильного производного XXI (Synth. Comm. 11, 513 (1981); Acta Chem. Scand. 47, 221; Chem. Rev. 95, 2457; Heterocycles 34, 1395) в присутствии основания (карбонат щелочного металла, фторид щелочного металла (например, CsF), третичного амина (этилдиизопропиламин или лиганд Бухвальда (2'-дициклогексилфосфанилбифенил-2-ил)диметиламин) и палладиевого катализатора (например, PdP(Ph)4, Pd(OAc)2, (PPh)3PdCl2) в инертном растворителе (бензол, толуол, ацетонитрил, диоксан, вода, алифатические спирты) при 0-150°С.
Стадия А: После этого полученное производное карбоновой кислоты XXI подвергают амидированию согласно методу, описанному для стадии А (см. схему 1). Путем непосредственного амидирования соединения XXII получают конечные продукты Ia-изоf.
Соединения формулы I при комнатной температуре находятся в форме масла или твердого вещества и они обладают ценными бактерицидными свойствами. Они могут применяться в сельскохозяйственном секторе или близких областях в качестве превентивных средств или для лечения при борьбе с фитопатогенными микроорганизмами. Соединения формулы I по изобретению отличаются тем, что они при низких нормах расхода обладают не только высокой бактерицидной, прежде всего фунгицидной активностью, но также и тем, что они очень хорошо переносятся растениями.
При создании изобретения неожиданно было установлено, что соединения формулы I обладают очень ценным с практической точки зрения спектром биоцидной активности в отношении фитопатогенных микроорганизмов, прежде всего грибов. Они обладают очень ценными лечебными и профилактическими свойствами и могут применяться для защиты многих видов селькохозяйственных растений. С помощью соединений формулы I можно ингибировать или уничтожать фитопатогенные микроорганизмы, которые встречаются на различных видах культурных растений или на частях таких растений (плодах, цветках, листьях, стеблях, клубнях, корнях), при этом защита от этих микроорганизмов, например от фитопатогенных грибов, также распространяется на те части растения, которые формируются в более поздний период.
Новые соединения формулы I обладают эффективностью в отношении фитопатогенных грибов, принадлежащих к определенным родам из класса несовершенных грибов (Fungi imperfecti) (например, Cercospora), Basidiomycetes (например, Puccinia) и Ascomycetes (например, Erysiphe и Venturia) и прежде всего в отношении Oomycetes (например, Plasmopara, Peronospora, Pythium и Phytophthora). Таким образом, настоящее изобретение представляет собой ценный вклад в области разработки композиций, предназначенных для борьбы с фитопатогенными грибами. Соединения формулы I могут также применяться в качестве протравливателей для защиты семенного материала (плоды, клубни, зерна) и черенков растений от грибных инфекций и от фитопатогенных грибов, которые встречаются в почве.
Изобретение относится также к композициям, содержащим в качестве действующего вещества соединения формулы I, прежде всего к композициям для защиты растений, и к их применению в сельскохозяйственном секторе или близких областях.
Кроме того, изобретение включает способ приготовления таких композиций, согласно которому действующее вещество смешивают до гомогенного состояния с одним или несколькими соединениями или группами соединений, представленных в настоящем описании. Изобретение также включает способ обработки растений, отличающийся тем, что в нем применяют новые соединения формулы I или новые композиции.
Подлежащие защите согласно настоящему изобретению культурные растения включают, например, следующие виды растений: зерновые (пшеница, ячмень, рожь, овес, рис, кукуруза, сорго и родственные культуры); свекольные (сахарная свекла и кормовая свекла); семечковые, косточковые и ягодные культуры (яблони, груши, сливы, персики, миндаль, вишня, земляника, малина и ежевика); бобовые растения (бобы, чечевица, горох, соя); масличные культуры (рапс, горчица, мак, маслины, подсолнечниковые, кокос, клещевина, какао-бобы, арахис); огуречные растения (тыквы, огурцы, дыни); волокнистые растения (хлопчатник, лен, конопля, джут); цитрусовые культуры (апельсины, лимоны, грейпфруты, мандарины); овощные культуры (шпинат, салат, спаржа, капустные, моркови, луки, томаты, картофель, сладкий перец); лавровые культуры (авокадо, коричное дерево, камфорное дерево) и такие растения, как табак, орехи, кофе, сахарный тростник, чай, перец, виноград, хмель, бананы и природные каучуконосы, а также декоративные растения.
Соединения формулы I, как правило, применяют в виде композиций, и они могут применяться для обработки посевной площади или растений, подлежащих обработке, одновременно или последовательно с другими действующими веществами. Эти другие действующие вещества могут представлять собой удобрения, доноры микроэлементов или другие препараты, оказывающие влияние на рост растения. Можно также применять гербициды избирательного действия или инсектициды, фунгициды, бактерициды, нематоциды, моллюскициды или смеси, состоящие из нескольких этих препаратов, при необходимости вместе с другими носителями, поверхностно-активными веществами или другими способствующими нанесению адъювантами, которые обычно применяются для изготовления препаративных форм.
Соединения формулы I могут быть смешаны с другими фунгицидами, в результате чего неожиданно может быть получено синергетическое действие.
Особенно предпочтительными компонентами таких смесей являются азолы, такие как азаконазол, битертанол, пропиконазол, дифеноконазол, диниконазол, ципроконазол, эпоксиконазол, флухинконазол, флусилазол, флутриафол, гексаконазол, имазалил, имибенконазол, ипконазол, тебуконазол, тетраконазол, фенбуконазол, метконазол, миклобутанил, перфуразоат, пенконазол, бромуконазол, пирифенокс, прохлораз, триадимефон, триадименол, трифлумизол или тритиконазол; пиримидинилкарбинолы, такие как анцимидол, фенаримол или нуаримол; 2-аминопиримидины, такие как бупримат, диметиримол или этиримол; морфолины, такие как додеморф, фенпропиридин, фенпропиморф, спироксамин или тридеморф; анилинопиримидины, такие как ципродинил, пириметанил или мепанипирим; пирролы, такие как фенпиклонил или флудиоксонил; фениламиды, такие как беналаксил, фуралаксил, металаксил, R-металаксил, офурас или оксадиксил; бензимидазолы, такие как беномил, карбендазим, дебакарб, фуберидазол или тиабендазол; дикарбоксимиды, такие как хлозолинат, дихлозолин, ипродин, миклозолин, процимидон или винклозолин; карбоксамиды, такие как карбоксин, фенфурам, флутоланил, мепронил, оксикарбоксин или тифлузамид; гуанидины, такие как гуазатин, додин или иминоктадин; стробилурины, такие как азоксистробин, крезоксим-метил, метоминостробин, SSF-129, метил-2-[(2-трифторметил)пирид-6-илоксиметил]-3-метоксиакрилат или O-метилоксим 2-[α-{[(α-метил-3-трифторметилбензил)имино]окси}-орто-толил]глиоксиловой кислоты (трифлоксистробин); дитиокарбаматы, такие как фербам, манкоцеб, манеб, метирам, пропинеб, тирам, цинеб или цирам; N-галометилтиодикарбоксамиды, такие как каптафол, калтан, дихлофлуанид, флуромид, фолпет или толифлуанид; медьсодержащие соединения, такие как бордосская жидкость, гидроксид меди, оксихлорид меди, сульфат меди, оксид меди, манкоппер или оксин меди; нитрофенольные производные, такие как динокал или нитротал-изопропил; фосфорорганические производные, такие как эдифенфос, ипробенфос, изопротиолан, фосдифен, пиразофос или токлофос-метил, и и другие соединения из различных классов, такие как ацибензолар-S-метил, анилазин, бластицидин-S, хинометионат, хлоронеб, хлороталонил, цимоксанил, дихлон, дихломезин, дихлоран, диэтофенкарб, диметоморф, дитианон, этридиазол, фамоксадон, фенамидон, фентин, феримзон, флуазинам, флусульфамид, фенгексамид, фосэтилалюминий, гимексазол, касугамицин, метасульфокарб, пенцикурон, фталид, полиоксины, пробеназол, пропамокарб, пирохилон, хиноксифен, хинтозен, сера, триазоксид, трициклазол, трифорин, валидамицин, (S)-5-метил-2-метилтио-5-фенил-3-фениламино-3,5-дигидроимидазол-4-он (RPA 407213), 3,5-дихлор-N-(3-хлор-1-этил-1-метил-2-оксопропил)-4-метилбензамид (RH-7281), N-аллил-4,5-диметил-2-триметилсилилтиофен-3-карбоксамид (MON 65500), 4-хлор-4-циано-N,N-диметил-5-пара-толилимидазол-1-сульфонамид (IKF-916), N-(1-циано-1,2-диметилпропил)-2-(2,4-дихлорфенокси)пропионамид (АС 382042), ипроваликарб (SZX 722).
Пригодные носители и поверхностно-активные вещества могут быть твердыми или жидкими и они представляют собой вещества, обычно применяемые для изготовления препаративных форм, например натуральные или регенерированные минеральные вещества, растворители, диспергирующие агенты, смачивающие агенты, прилипатели, загустители, связующие вещества или удобрения. Такие носители и добавки описаны, например, в WO 95/30651.
Предпочтительным методом применения соединения формулы I или агрохимической композиции, содержащей по крайней мере одно из таких соединений, является обработка листовой системы (листовая обработка), причем частота обработок и норма расхода зависят от степени риска заражения рассматриваемым патогеном. Соединения формулы I также могут быть нанесены на семена (нанесение покрытия) либо путем пропитки зерен жидкой композицией, содержащей действующее вещество, либо путем нанесения на них покрытия из сухой композиции.
Соединения формулы I применяют в немодифицированной форме или предпочтительно совместно с адъювантами, обычно используемыми для изготовления препаративных форм, которые готовят известным методом для получения, например, эмульгирующихся концентратов, покрывающих паст, готовых к применению растворов для опрыскивания или разбавляемых растворов, разбавленных эмульсий, смачивающихся порошков, растворимых порошков, дустов, гранул или также путем капсулирования, например, в полимерные вещества. Методы обработки, такие как опрыскивание, обработка в виде тумана, опыливание, разбрасывание, покрытие или полив, выбирают в зависимости от типа композиции, а также в соответствии с поставленными целями и конкретными условиями.
Предпочтительные нормы расхода обычно составляют от 1 г до 2 кг действующего вещества (д.в). на гектар (га), предпочтительно от 10 г до 1 кг д.в./га, наиболее предпочтительно от 25 до 750 г д.в./га. При использовании для протравливания семян нормы расхода составляют от 0,001 г до 1,0 г действующего вещества на 1 кг семян.
Препаративные формы, т.е. композиции, препараты или смеси, содержащие соединение(я) (действующее(ие) вещество(а)) формулы I и при необходимости твердый или жидкий адъювант, получают известным методом, например путем смешения до однородного состояния и/или размалывания действующего вещества с наполнителями, например с растворителями, с твердыми носителями и при необходимости с поверхностно-активными веществами (детергентами).
Поверхностно-активные вещества, обычно применяемые в области приготовления препаративных форм, являются известными специалисту в данной области или могут быть найдены в соответствующей технической литературе.
Сельскохозяйственные композиции обычно содержат от 0,1 до 99 мас.%, предпочтительно от 0,1 до 95 мас.%, соединения формулы I, от 99,9 до 1 мас.%, предпочтительно от 99,9 до 5 мас.% твердого или жидкого адъюванта и от 0 до 25 мас.%, предпочтительно от 0,1 до 25 мас.%, поверхностно-активного вещества.
В то время как концентрированные композиции являются более предпочтительными в качестве поступающих в продажу продуктов, непосредственный потребитель, как правило, применяет разбавленные композиции.
Композиции могут содержать также другие ингредиенты, такие как стабилизаторы, противовспенивающие вещества, регуляторы вязкости, связующие вещества и прилипатели, а также удобрения или другие действующие вещества для достижения определенных действий.
Приведенные ниже примеры служат для иллюстрации изобретения, но они никоим образом не ограничивают его объем. Температуры даны в градусах Цельсия. Ph обозначает фенил.
Примеры процессов получения
Пример Е1: 2-(3,4-Дихлорфенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид
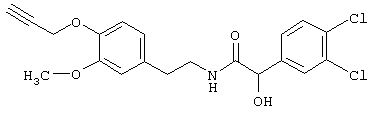
К смеси, содержащей (3,4-дихлорфенил)гидроксиуксусную кислоту (3 г), гидрохлорид 4-(2-аминоэтил)-2-метоксифенола (2,7 г) и этилдиизопропиламин (7 мл) в диметилформамиде (60 мл) добавляют в виде одной порции гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония (6 г). Смесь перемешивают при комнатной температуре в течение 3 ч. Затем добавляют воду (400 мл). Смесь экстрагируют этилацетатом (2×400 мл) и промывают соляным раствором (2×200 мл). Органические слои собирают, сушат над MgSO4 и упаривают. В результате получают 2-(3,4-дихлорфенил)-2-гидрокси-N-[2-(4-гидрокси-3-метоксифенил)этил]ацетамид, который очищают с помощью экспресс-хроматографии на колонках на силикагеле (этилацетат/гексан, 2:1), получая продукт в виде масла.
Смесь, содержащую 2-(3,4-дихлорфенил)-2-гидрокси-N-[2-(4-гидрокси-3-метоксифенил)этил]ацетамид, пропаргилбромид (0,5 мл) и карбонат калия (1,5 г) в диметилсульфоксиде, перемешивают при 80°С в течение 3 ч. Смесь охлаждают до комнатной температуры и добавляют воду (150 мл). Смесь экстрагируют этилацетатом (2 х 200 мл) и промывают соляным раствором (100 мл). Органические слои собирают, сушат над MgSO4 и упаривают. В результате получают 2-(3,4-дихлорфенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид, который очищают с помощью экспресс-хроматографии на колонках на силикагеле (этилацетат/гексан, 2:1), получая продукт в виде масла.
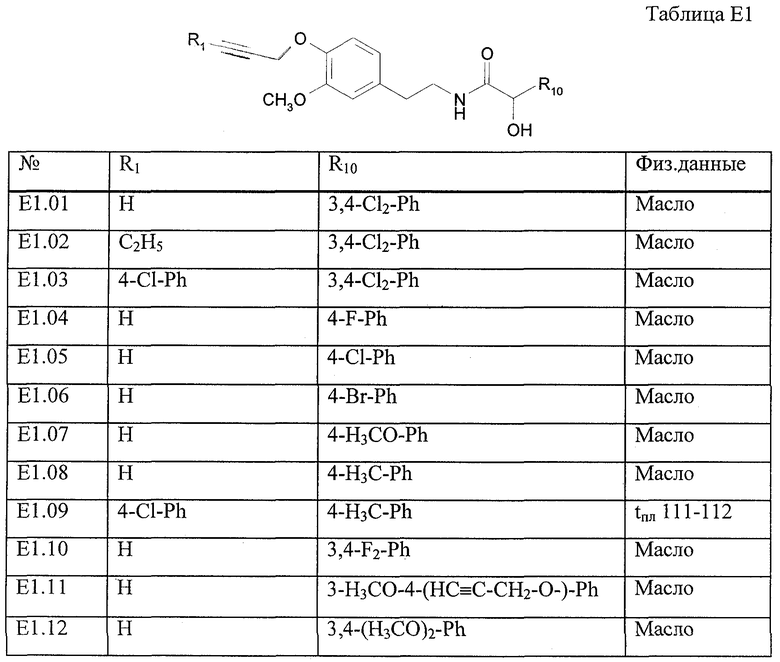
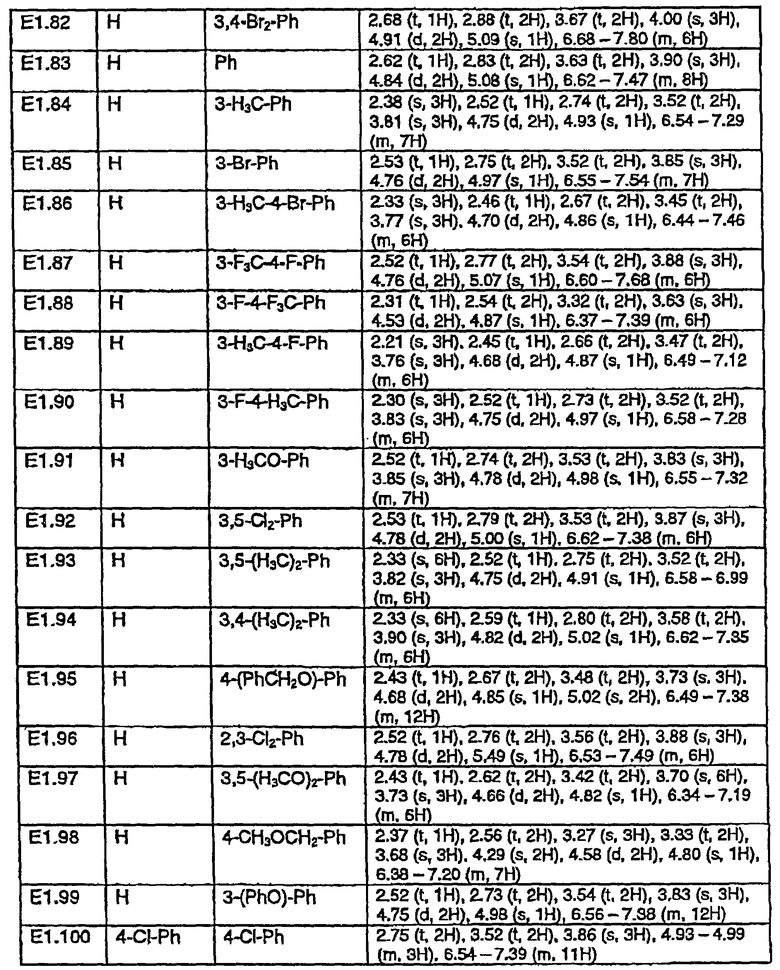
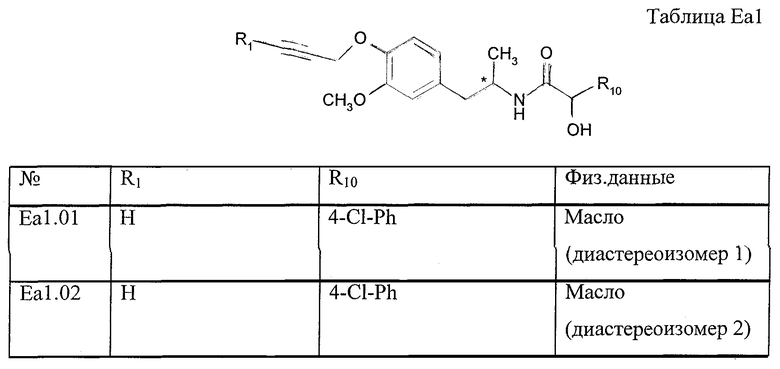
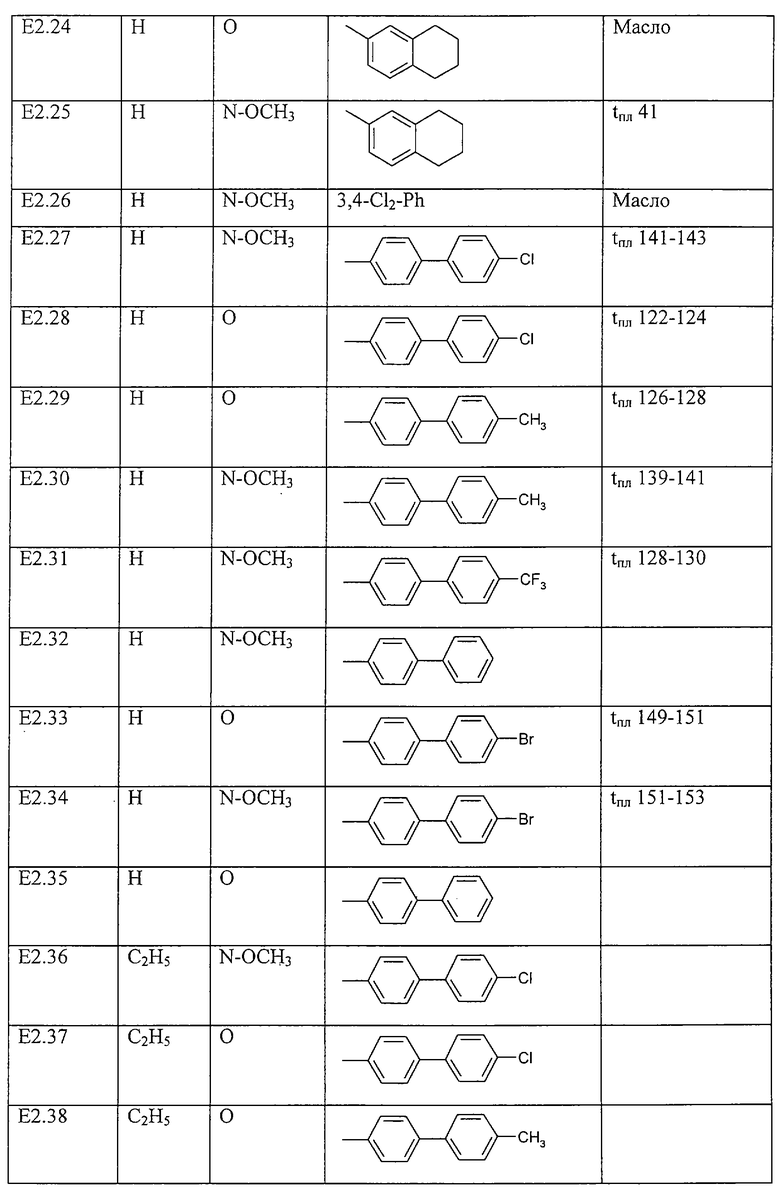
Работая согласно процессу, описанному в примере Е1, получают соединения, перечисленные в таблице E1, E1*.
Пример Е2: 2-(3,4-Дихлорфенил)-2-метоксииминон-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид
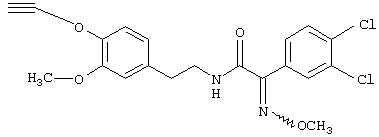
К раствору, содержащему 1,30 г (3,20 ммоля) 2-(3,4-дихлорфенил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-оксоацетамида в 7,0 мл этанола, добавляют 0,52 мл пиридина (0,64 ммоля) и 0,33 г (3,98 ммоля) гидрохлорида O-метилгидроксиламина. Раствор выдерживают при 80°С в течение 4 ч. После выпаривания растворителя остаток подвергают экспресс-хроматографии, получая 2-(3,4-дихлорфенил)-2-метоксиимино-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид в виде твердого вещества белого цвета (tпл 107-108°С)
Пример Е3: 2-(3,4-Дихлорфенил)-N-[2-(3-метокси-4-пент-2-инилоксифенил)этил]-2-оксоацетамид
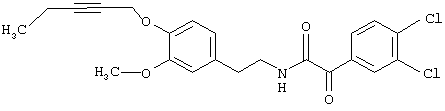
К раствору, содержащему 0,8 мл оксалилхлорида (9,0 ммолей) в 8 мл метиленхлорида, добавляют при -63°С в течение 15 мин раствор, содержащий 0,84 мл ДМСО (12,0 ммолей) в 4 мл CH2Cl2. В течение 10 мин добавляют раствор, содержащий 2,6 г (6,0 ммолей) 2-(3,4-дихлорфенил)-2-гидрокси-N-[2-(3-метокси-4-пент-2-инилоксифенил)этил]ацетамида в 30 мл CH2Cl2. После выдерживания в течение 10 мин при -65°С добавляют в течение 15 мин раствор, содержащий 3,2 мл (24,0 ммоля) триэтиламина в 8 мл CH2Cl2. После выдерживания еще в течение 15 мин при этой же температуре смесь подвергают гидролизу с помощью 6,0 мл воды и дают ей нагреться до комнатной температуры. Раствор промывают растворами KHSO4 (20%), NаНСО3 (насыщенный) и NaCl (насыщенный). После упаривания остаток подвергают экспресс-хроматографии (этилацетат/гексан, 25/75), получая 2-(3,4-дихлорфенил)-N-[2-(3-метокси-4-пент-2-инилоксифенил)этил]-2-оксоацетамид.
1H-ЯМР (300 МГц. СDСl3): 1,15 (t, 3 Н, CH2СН3), 2,22 (m, 2 Н, СH2СН3), 2,87 (t, 2 Н, СН2СН2), 3,64 (t, 2 Н, СН2СН2), 3,88 (s, 3 Н, ОСН3), 4,72 (m, 2 Н, ОСН2), 6,77 (m, 2 Н, СН аром.), 6,99 (d, 1 Н, СН аром.), 7,16 (t, 1 Н, NH), 7,57 (d, 8.22, m) и 8,49 (m. 3 Н, СН аром.).
Пример Е4: 2-(4'-Хлорбифенил-4-ил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-оксоацетамид
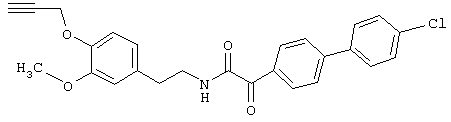
Смесь, содержащую 652 мг 2-(4'-хлорбифенил-4-ил)-2-оксоуксусной кислоты, 1,5 г этилдиизопропиламина и 1,25 г гексафторфосфата бензотриазол-1-илокситрис(диметиламино)фосфония (ВОР) в15 мл диметилформамида, перемешивают в течение ночи при охлаждении до 0°С. Затем реакционную смесь разбавляют этилацетатом, промывают водой и соляным раствором, сушат над сульфатом натрия, упаривают и очищают с помощью ЖХВР (Lichrosphere Si-60/этилацетатгексан), получая требуемый 2-(4'-хлорбифенил-4-ил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-оксоацетамид, tпл 122-124°C.
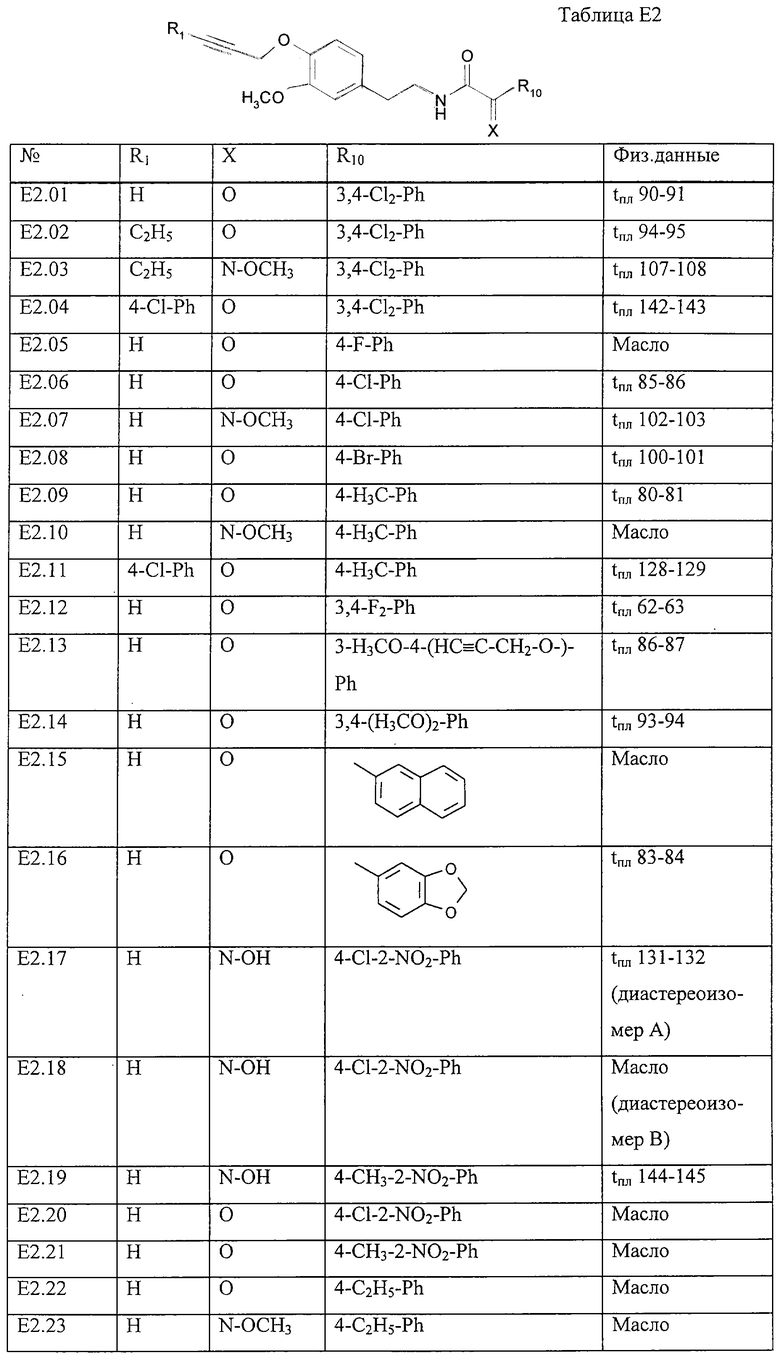
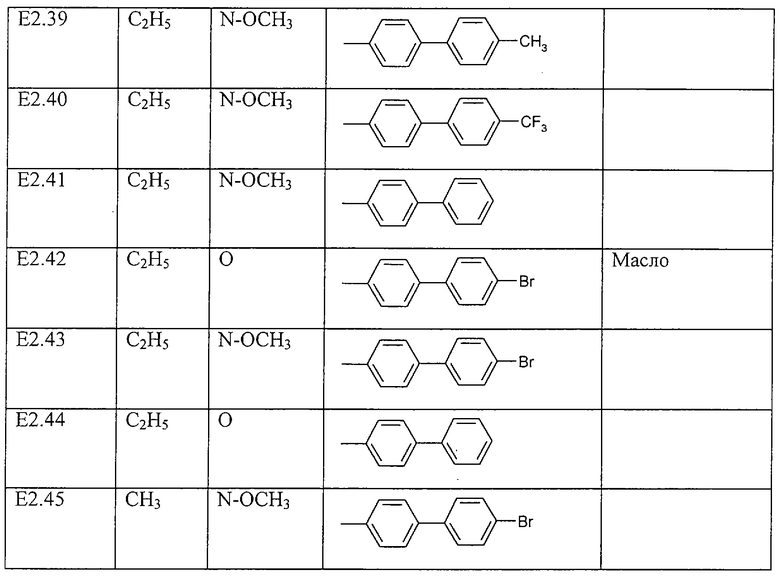
Работая согласно процессам, описанным в примерах Е2, Е3 и Е4, получают соединения, пречисленные в таблице Е2.
Пример Е5: 2-(3,4-Дихлорфенил)-2-гидрокси-N-[2-(3-метокси-4-пент-2-инилоксифенил)этил]ацетамид
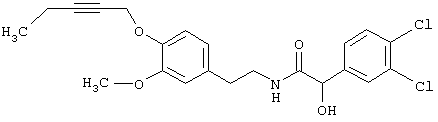
3,4 г (13,0 ммолей) N-[2-(3-метокси-4-пент-2-инилоксифенил)этил]формамида и 4,3 мл (32 ммоля) триэтиламина растворяют в 13 мл СН2Сl2. Добавляют при 5°C 1,4 г (4,7 ммоля) бис(трихлорметил)карбоната (трифосген) в 9 мл СН2Сl2. Смесь перемешивают в течение 4 ч при 5°С и затем охлаждают до -78°С. Добавляют раствор, содержащий 1,43 мл (13,0 ммоля) TiCl4 в 20 мл СН2Сl2 и смесь перемешивают в течение 2 ч при -40°С. По каплям добавляют 2,5 г (12,9 ммоля) 3,4-дихлорбензальдегида в 7 мл СН2Сl2 и смесь перемешивают в течение 17 ч при комнатной температуре. Смесь подвергают гидролизу с помощью 7 мл 5 н. HCl, премешивают в течение 30 мин при комнатной температуре и промывают водой. После упаривания остаток подвергают экспресс-хроматографии (этилацетат/гексан, 6:4), получая 2-(3,4-дихлорфенил)-2-гидрокси-N-[2-(3-метокси-4-пент-2-инилоксифенил)этил]ацетамид.
1Н-ЯМР (300 МГц, CDCl3): 1,15 (t, 3 Н, СН2СН3), 2,22 (m, 2 Н, СН2СН3), 2,75 (t, 2 H, CH2CH2), 3,51 (m, 2 H, CH2CH2), 3,69 (d. 2 Н, ОН), 3,83 (s, 3 Н, ОСН3), 4,74 (m, 2 Н, ОСН2), 4,96 (d, 1 Н, СНОН), 6,27 (t, 1 H, NH), 6,58 (m, 1 H), 6,68 (m, 1 H), 6.92 (d. 1 H), 7,19 (d, 1 H), 7,42 (d, 1 Н) и 7,49 (m, 1 Н, СН аром.).
Пример Е6: 2-(4'-Трифторбифенил-4-ил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид
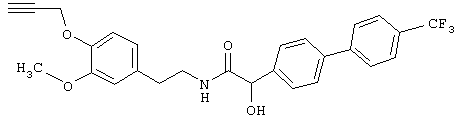
а) 4-(4-Трифторметил)ацетофенон
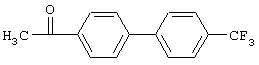
Суспензию, содержащую 3,44 г 4-бромацетофенона, 4,94 г 4-трифторбороновой кислоты, 7,88 г фторида цезия, 80 мг ацетата палладия и (2'-дициклогексилфосфанилбифенил-2-ил)диметиламина (лиганд Бухвальда)), в 100 мл диоксана нагревают в атмосфере азота. После завершения реакции суспензию фильтруют через фильтр типа Hyflo, фильтрат упаривают и очищают фильтрацией через силикагель (гексан/этилацетат, 7:3), получая 4-(4'-трифторметилфенил)ацетофенон в виде твердого вещества желтоватого цвета, tпл 114-116°С.
б) 2-(4'-Трифторметилбифенил-4-ил)-2-оксоуксусная кислота
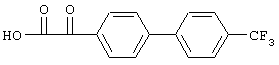
Смесь, содержащую 3,96 г 4-(4'-трифторметилфенил)ацетофенона и 3,9 г диоксида селена в 21 мл пиридина, выдерживают при 105°С. После завершения реакции реакционную смесь упаривают, растворяют в диэтиловом эфире, подщелачивают с помощью разбавленного 1 н. гидроксида натрия и промывают диэтиловым эфиром. Водный слой подкисляют 1 н. НСl и экстрагируют дихлорметаном. Экстракты промывают соляным раствором и сушат над сульфатом натрия. После упаривания получают 2-(4'-трифторметилбифенил-4-ил)-2-оксоуксусную кислоту, tпл 155°С (разл.).
в) 2-(4'-Трифторбифенил-4-ил)-2-гидроксиуксусная кислота
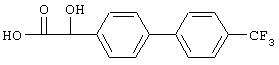
Раствор, содержащий 1,47 г 2-(4'-трифторбифенил-4-ил)-2-оксоуксусной кислоты в 20 мл тетрагидрофурана, подвергают гидрированию при комнатной температуре в присутствии 160 мг оксида платины(IV) при пониженном давлении до тех пор, пока не закончится поглощение водорода. Реакционную смесь фильтруют и упаривают, получая 2-(4'-трифторбифенил-4-ил)-2-гидроксиуксусную кислоту, tпл 185-187°С.
г) К раствору, содержащему 662 мг гидрохлорида N-(2-(3-метокси-4-проп-2-инилоксифенил)этиламина в 35 мл N,N-диметилформамида и 1,5 мл N-этилдиизопропиламина, последовательно добавляют 740 мг 2-(4'-трифторбифенил-4-ил)-2-гидроксиуксусной кислоты и 1,25 г гексафторфосфата бензотриазол-1-илокситрис(диметиламино)фосфония. Раствор желтоватого цвета перемешивают в течение ночи при 20°С, разбавляют этилацетатом, промывают водой и соляным раствором и сушат над сульфатом натрия. Фильтрат упаривают и образовавшийся остаток очищают с помощью хроматографии (силикагель; гексан/этилацетат), получая требуемый 2-(4'-трифторбифенил-4-ил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид, tпл 107-109°С.
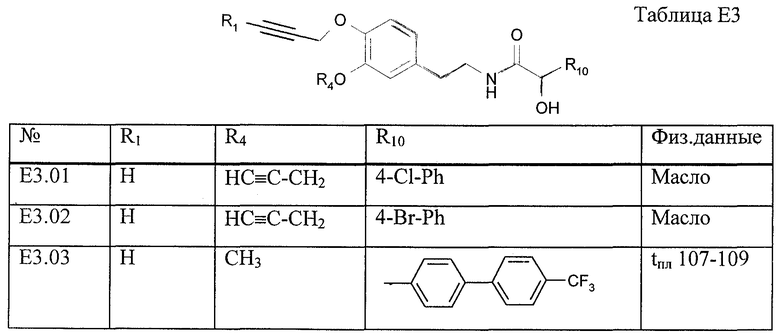
Работая аналогично процессам, описанным в примерах Е5 и Е6, получают соединения, перечисленные в таблице Е3.
Пример Е7: N-[2-(3-Метокси-4-пент-2-инилоксифенил)этил]формамид
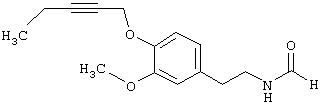
41 мл 30%-ного раствора метилата натрия в метаноле добавляют к раствору, содержащему 31,5 г (180 ммолей) N-[2-(4-гидрокси-3-метоксифенил)этил]формамида в 880 мл метанола. Добавляют 48,1 г (184 ммоля) пент-2-инилового эфира толуол-4-сульфоновой кислоты и смесь выдерживают при температуре дефлегмации в течение 4 ч. После упаривания остаток растворяют в этилацетате и промывают водой. После упаривания остаток подвергают экспресс-хроматографии и после кристаллизации в простом эфире получают N-[2-(3-метокси-4-пент-2-инилоксифенил)этил]формамид.
1Н-ЯМР (300 МГц, CDCl3): 1.14 (t, 3 Н, CH2СН3), 2,22 (m, 2 Н, СН2СН3), 2,81 (t, 2 Н, СН2СН2), 3,48 и 3,57 (2 q (17:83), 2 Н, СН2СН2), 3,88 (s, 3 Н, ОСН3), 4,70 (m, 2 Н, ОСН2), 5,58 (b, 1 H, NH), 6,73 (m, 2 Н, аром.), 6,98 (m, 1 Н, аром.), 8,14 (s, 1 Н, СНО).
Пример Е8: 2-(4-Бромфенил)-2-метилоксалилокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид
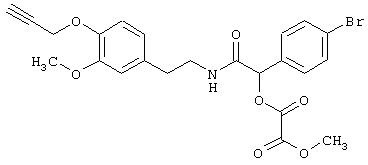
К раствору, содержащему 2-(4-бромфенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид (0,7 г, 1,6 ммоля) в 30 мл метиленхлорида, добавляют пиридин (0,3 г, 3,8 ммоля). Эту смесь охлаждают до 0°С и добавляют метилхлороксоацетат (0,2 г, 1,6 ммоля). После выдерживания в течение 3 ч при комнатной температуре растворитель удаляют под вакуумом и остаток трижды упаривают с толуолом. Образовавшийся остаток подвергают хроматографии на силикагеле (простой эфир/гексан, 60:40), получая 2-(4-бромфенил)-2-метилоксалилокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид.
1Н-ЯМР (300 МГц, СDСl3): 2,31 (t, 1H, 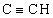 ), 2,59 (m, 2H, СН2СН2), 3,35 (m, 2H, CH2CH2), 3,62 (s, 3Н, ОСН3), 3,70 (s, 3H, ОСН3), 4,54 (s, 2H,
), 2,59 (m, 2H, СН2СН2), 3,35 (m, 2H, CH2CH2), 3,62 (s, 3Н, ОСН3), 3,70 (s, 3H, ОСН3), 4,54 (s, 2H, 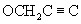 ), 5,85 (s, 1Н, СНС=O), 6,13 (t, 1Н, NH), 6,47 (m, 2H, СН аром.), 6,73 (d, 1H, CH аром.), 7,03 (d, 2H, СН аром.), 7,28 (d, 2H, СН аром.).
), 5,85 (s, 1Н, СНС=O), 6,13 (t, 1Н, NH), 6,47 (m, 2H, СН аром.), 6,73 (d, 1H, CH аром.), 7,03 (d, 2H, СН аром.), 7,28 (d, 2H, СН аром.).
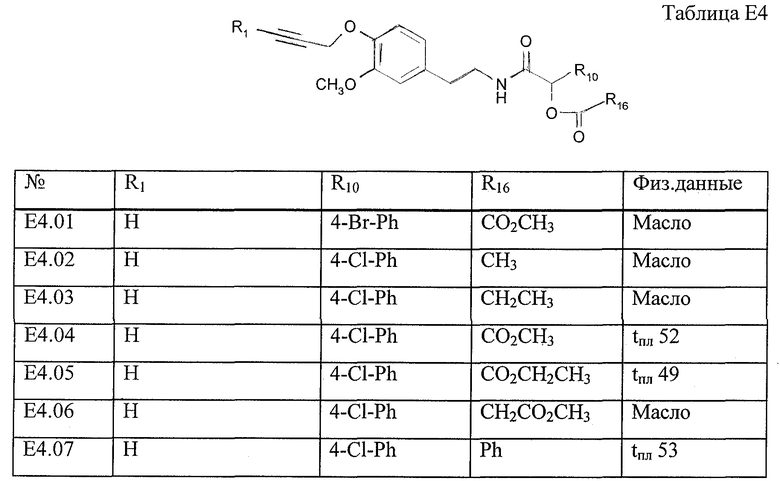
Работая аналогично процессу, описанному в примере Е8, получают соединения, перечисленные в таблице Е4.
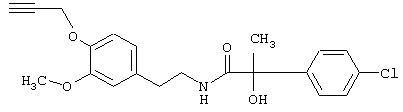
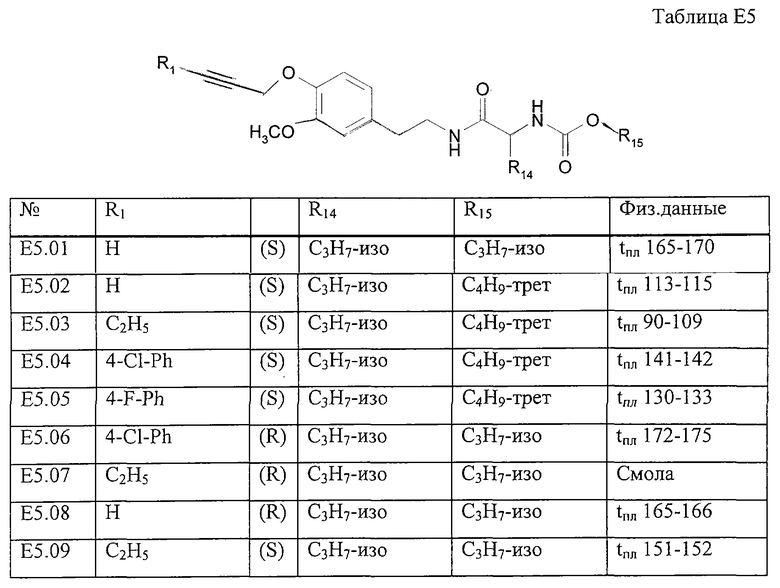
Пример Е9: 2-(1,1-Диметилэтоксикарбониламино)-N-{2-[3-метокси-4-(4-хлорфенилпроп-2-инилокси)фенил]этил}-3-метилбутирамид
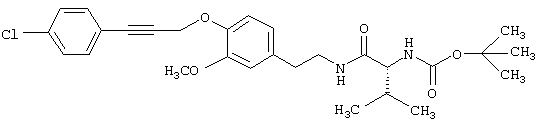
К смеси, содержащей BOC-L-валин (4,7 г), гидрохлорид 4-(2-аминоэтил)-2-метоксифенола (4,5 г) и этилдиизопропиламин (6,5 г) в диметилформамиде (90 мл), добавляют в виде одной порции гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония (9,8 г). Смесь перемешивают при комнатной температуре в течение 4 ч. Затем добавляют воду (400 мл). Смесь экстрагируют этилацетатом (2×400 мл) и промывают соляным раствором (2×200 мл). Органические слои собирают, сушат (MgSО4) и упаривают.
В результате получают 2-(1,1-диметилэтоксикарбониламино)-N-[2-(4-гидрокси-3-метоксифенил)этил]-3-метилбутирамид, который очищают с помощью экспресс-хроматографии на колонках на силикагеле (этилацетат/гексан, 2:3), получая продукт в виде масла.
К смеси, содержащей 3-(4-хлорфенил)проп-2-ин-1-ол (3,3 г) и толуол-4-сульфонилхлорид (3,7 г) в диэтиловом эфире (100 мл), предварительно охлажденной до -15°С, добавляют небольшими порциями в течение 10 мин порошкообразный гидроксид калия (2,8 г). Реакционную смесь перемешивают при 0°С в течение 90 мин. После этого добавляют воду (200 мл), смесь экстрагируют диэтиловым эфиром (2×100 мл) и промывают соляным раствором (50 мл). Органические слои собирают, сушат (Na2SО4) и упаривают. В результате получают 3-(4-хлорфенил)проп-2-иниловый эфир толуол-4-сульфоновой кислоты.
Смесь, содержащую 2-(1,1-диметилэтоксикарбониламино)-N-[2-(4-гидрокси-3-метоксифенил)этил]-3-метилбутирамид (4,0 г), 3-(4-хлорфенил)проп-2-иниловый эфир толуол-4-сульфоновой кислоты (5,3 г) и 1 М раствор метоксида натрия в метаноле (18 мл) в метаноле (100 мл), нагревают до температуры дефлегмации в течение 3 ч. Затем растворитель удаляют путем дистилляции. Добавляют воду (300 мл). Смесь экстрагируют этилацетатом (2×200 мл) и промывают соляным раствором (100 мл). Органические слои собирают, сушат (MgSO4) и упаривают. В результате получают 2-(1,1-диметилэтоксикарбониламино)-N-{2-[3-метокси-4-(4-хлорфенилпроп-2-инилокси)фенил]этил}-3-метилбутирамид, который очищают с помощью экспресс-хроматографии на колонках на силикагеле (этилацетат/гексан, 1:1) и перекристаллизации (этилацетат/гексан), tпл 141-142°С.
Работая аналогично процессу, описанному в примере Е9, получают соединения, перечисленные в таблице Е5.
Пример Е10: N-[2-(3,4-Дигидроксифенил)этил]формамид
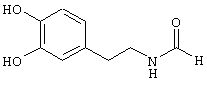
Муравьиную кислоту (198 мл, 5,26 моля) добавляют по каплям к 372 мл (3,95 моля) уксусного ангидрида при 0°С. Смесь перемешивают в течение 2 ч при 55°С и затем снова охлаждают до 0°С. При этой температуре добавляют 500 мл тетрагидрофурана, а затем 50 г (0,26 моля) гидрохлорида 3-гидрокситирамина. Образовавшуюся суспензию белого цвета перемешивают в течение 18 ч при 75°С, в результате чего она превращается в раствор желтого цвета. Реакционную смесь упаривают и остаток подвергают экспресс-хроматографии, получая N-[2-(3,4-дигидроксифенил)этил]формамид.
1Н-ЯМР (300 МГц, CDCl3): 2,72 (t, 2H, СН2СH2), 3,49 (t, 2H, СН2СH2), 6,67-7,20 (m, 3Н, СН аром.), 8,04 (s, 1H, CHO).
Пример Е11: N-[2-(3,4-Биспроп-2-инилоксифенил)этил]формамид
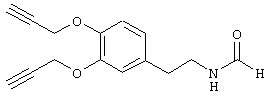
120 мл 30%-ного раствора метилата натрия в метаноле добавляют к раствору, содержащему 52 г (0,29 моля) N-[2-(3,4-дигидроксифенил)этил]формамида в 670 мл метанола. Добавляют 73 г (0,62 моля) пропаргилбромида и смесь выдерживают при температуре дефлегмации в течение 4 ч. После упаривания остаток растворяют в этилацетате, промывают водой и сушат над сульфатом магния. Растворитель удаляют в вакууме и остаток очищают с помощью экспресс-хроматографии, получая N-[2-(3,4-биспроп-2-инилоксифенил)этил]формамид.
1Н-ЯМР (300 МГц, CDCl3): 2,54 (m, 2H, С≡СН), 2,82 (t, 2H, CH2CH2), 3,57 (t, 2Н, СН2СН2), 4,78 (m, 4Н, СН2С≡С), 6,81 (d, 1H, CH аром.), 6,90 (s, 1H, CH аром.), 7,04 (d, 1H, CH, аром.), 8,19 (s, 1H, CHO).
Пример E12: 2-(4-Хлорфенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-проп-2-инилоксиацетамид
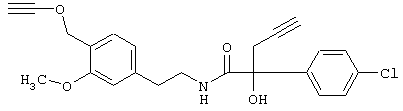
а) 5-(4-Хлорфенил)-2,2-диметил-5-проп-2-инил-(1,3)-диоксолан-4-он
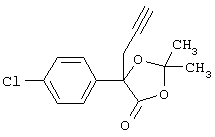
3,3 мл бутиллития (1,6 молярный раствор в гексане) добавляют при перемешивании в атмосфере азота при -78°С к раствору, содержащему 0,8 мл диизопропиламина в 20 мл тетрагидрофурана. После перемешивания в течение 30 мин при этой температуре добавляют 1,13 г 5-(4-хлорфенил)-2,2-диметил-(1,3)-диоксолан-4-она в 5 мл тетрагидрофурана и продолжают перемешивание в течение 1,5 ч. После этого реакционную смесь обрабатывают раствором, содержащим 0,57 мл пропаргилбромида в 3 мл тетрагидрофурана. Перемешивание при приблизительно -60°С продолжают в течение ночи. После этого реакцию прекращают, добавляя 1 н. НСl (рН 6) и смесь лед/вода, смесь экстрагируют диэтиловым эфиром. Экстракты сушат над сульфатом натрия и упаривают. В результате получают 5-(4-хлорфенил)-2,2-диметил-5-проп-2-инил-(1,3)-диоксолан-4-он в виде масла, который непосредственно используют для следующей стадии.
б) 2-(4-Хлорфенил)-2-гидроксипент-4-иноевая кислота
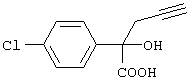
Раствор, содержащий 530 мг 5-(4-хлорфенил)-2,2-диметил-5-проп-2-инил-1-(1,3)-диоксолан-4-она в 10 мл тетрагидрофурана и 5 мл метанола, обрабатывают 2 мл 1 н. NaOH и выдерживают при 60°С в течение 1 ч. После этого раствор охлаждают, разбавляют водой и промывают простым эфиром. Затем водный раствор подкисляют 1 н. НСl и экстрагируют этилацетатом. Экстракты сушат над сульфатом натрия и упаривают, получая 2-(4-хлорфенил)-2-гидроксипент-4-иноевую кислоту в виде густого масла коричневатого цвета, которую используют на следующей стадии.
в) Суспензию, содержащую 1,2 г гидрохлорида 2-(3-метокси-4-проп-2-инилоксифенил)этиламина в 50 мл дихлорметана, обрабатывают 1,53 мл N-этилдиизопропиламина. К образовавшемуся раствору по каплям добавляют 50 мг 4-диметиламинопиридина и 1,2 г 2-(4-хлорфенил-2-гидроксипент-4-иноилхлорида (свежеприготовленного из полученной выше кислоты и оксалилхлорида в дихлорметане) в 15 мл дихлорметана. Реакционную смесь перемешивают в течение ночи при 20°С и затем реакцию прекращают, сливая на смесь лед/вода. Реакционную смесь экстрагируют дихлорметаном, экстракты сушат над сульфатом натрия, фильтруют и упаривают. После ЖХВР-хроматографии остатка (Lichrophere Si-60; гексан/этилацетат) получают требуемый 2-(4-хлорфенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-проп-2-инилоксиацетамид в виде вязкого масла.
1Н-ЯМР (CDCl3; част./млн.): 7,48 (d, 2H); 7,30 (d, 2H); 6,99-6,75 (m, 1H + NH); 6,75-6,56 (m, 2H); 4,72 (m, 2H); 3,83 (s, 1H); 3,80 (s, 3H); 3,48 (m, 2H); 3,05 (AB-q, 2H); 2,75 (t, 2H); 2,52 (m, 1H); 2,05 (m, 2H).
Этот же продукт - 2-(4-хлорфенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-проп-2-инилоксиацетамид - получают путем выдерживания 5-(4-хлорфенил)-2,2-диметил-5-проп-2-инил-(1,3)-диоксолан-4-она с 1,2 экв. гидрохлорида 2-(3-метокси-4-бут-2-инилоксифенил)этиламина и 1,2 экв. ДБУ (1,8-диазабицикло(5.4.0)ундец-7-ен) при 150°С.
Пример Е13: 2-(4-Хлорфенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]пропионамид
а) Этиловый эфир 2-(4-хлорфенил)-2-гидроксипропионовой кислоты
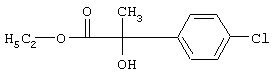
К раствору, содержащему 11,5 г этилпирувата в 20 мл диэтилового эфира, при перемешивании медленно добавляют при охлаждении (0°С) свежеприготовленный раствор Гриньяра (полученный из 23,9 г 4-хлорйодбензола и 3 г магниевой стружки). Для предотвращения образования вязкой суспензии добавляют небольшое количество тетрагидрофурана. После перемешивания в течение 2 ч при комнатной температуре реакцию прекращают, сливая раствор на смесь льда и 2 н. серной кислоты. После экстракции диэтиловым эфиром, последующей промывки соляным раствором, сушки над сульфатом натрия и упаривания получают остаток, который очищают на силикагеле (гексан/этилацетат), получая этиловый эфир 2-(4-хлорфенил)-2-гидроксипропионовой кислоты в виде масла желтоватого цвета.
1Н-ЯМР (CDCl3; част./млн.): 7,52 (2, 2Н); 7,31 (d, 2Н); 4,22 (q); 3,82 (s, 1H); 1,77 (s, 3H);1,29 (t,3H).
б) 2-(4-Хлорфенил)-2-гидроксипропионовая кислота
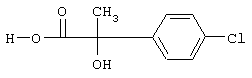
Раствор, содержащий 5,72 г этилового эфира 2-(4-хлорфенил)-2-гидроксипропионовой кислоты в 170 мл тетрагидрофурана, подвергают гидролизу при 0°С с помощью раствора, содержащего 30,5 мл 1 н. гидроксида лития в 19 мл воды. После завершения реакции реакционную смесь разбавляют водой, промывают диэтиловым эфиром, подкисляют 1 н. НСl и экстрагируют этилацетатом. Экстракты промывают соляным раствором, сушат над сульфатом натрия и упаривают, получая 2-(4-хлорфенил)-2-гидроксипропионовую кислоту.
1Н-ЯМР (CDCl3; част./млн.): 7,61 (2Н, d); 7,32 (2H. d); 4,0-6,5 (широкий ОН); 10,7 (широкий, СООН).
в) К раствору, содержащему 906 мг гидрохлорида 2-(3-метокси-4-бут-2-инилоксифенил)этиламина и 2,75 мл N-этилдиизопропиламина, при перемешивании последовательно добавляют 752 мг 2-(4-хлорфенил)-2-гидроксипропионовой кислоты и 1,875 г гексафторфосфата бензотриазол-1-илокситрис(диметиламино)фосфония. Образовавшийся прозрачный раствор перемешивают в течение ночи и экстрагируют этилацетатом. Экстракты промывают несколько раз водой, сушат над сульфатом натрия, фильтруют и упаривают. Образовавшийся маслянистый остаток очищают на силикагеле (гексан/этилацетат), получая 2-(4-хлорфенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]пропионамид.
1Н-ЯМР (CDCl3; част./млн.): 7,42 (d, 2H); 7,28 (d, 2H); 6,90 (d, 1H); 6,66 (s, 1H); 6,55 (dd, 1H), 6,47 (m, широкий, 1H); 4,71 (d, 2H); 3,81 (s, 3Н); 3,48 (q, 2H); 3,24 (s, 1H); 2,72 (t, 2H); 2,52 (m, 1H).
Пример E14: 2-(3',4'-Хлорбифенил-4-ил)-2-оксоуксусная кислота
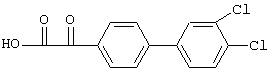
Смесь, содержащую 2,2 г 4-бромфенилоксоуксусной кислоты, 3,4-дихлорфенилбороновую кислоту и 440 мг 5%-ного палладия на угле в 2,5 мл 2-пропанола и 30 мл воды, перемешивают в течение ночи при 65°С. Затем реакционной смеси дают охладиться до 40°С и ее обрабатывают 30 мл смеси, содержащей 2-пропанол, воду и 2 н. NaOH (70:15:1), фильтруют через Hyflo и промывают 4 раза 70 мл указанной выше смеси. Фильтрат подкисляют 2 н. серной кислотой, отгоняют 2-пропанол и оставшейся смеси дают осадиться при 0°С. После фильтрации получают 2-(3',4'-хлорбифенил-4-ил)-2-оксоуксусную кислоту в виде твердого вещества, tпл 168-169,5°С.
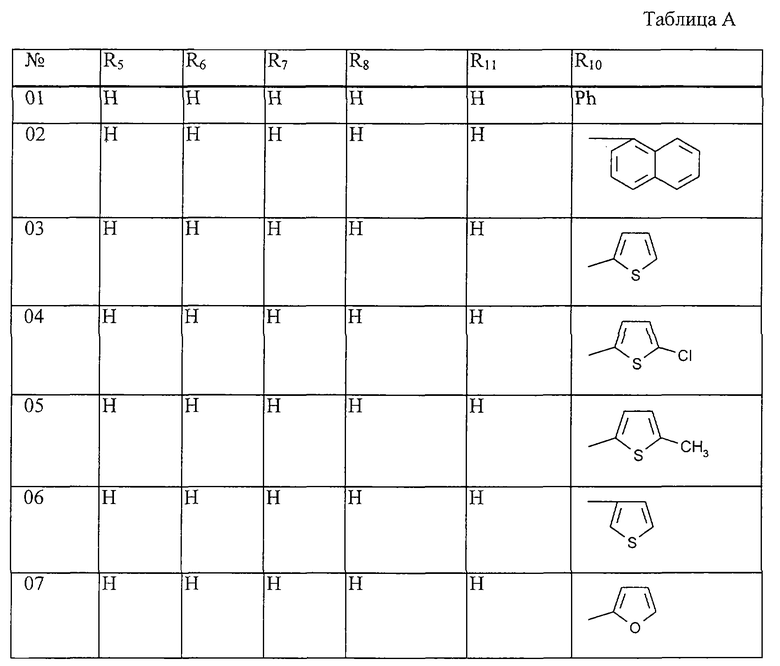
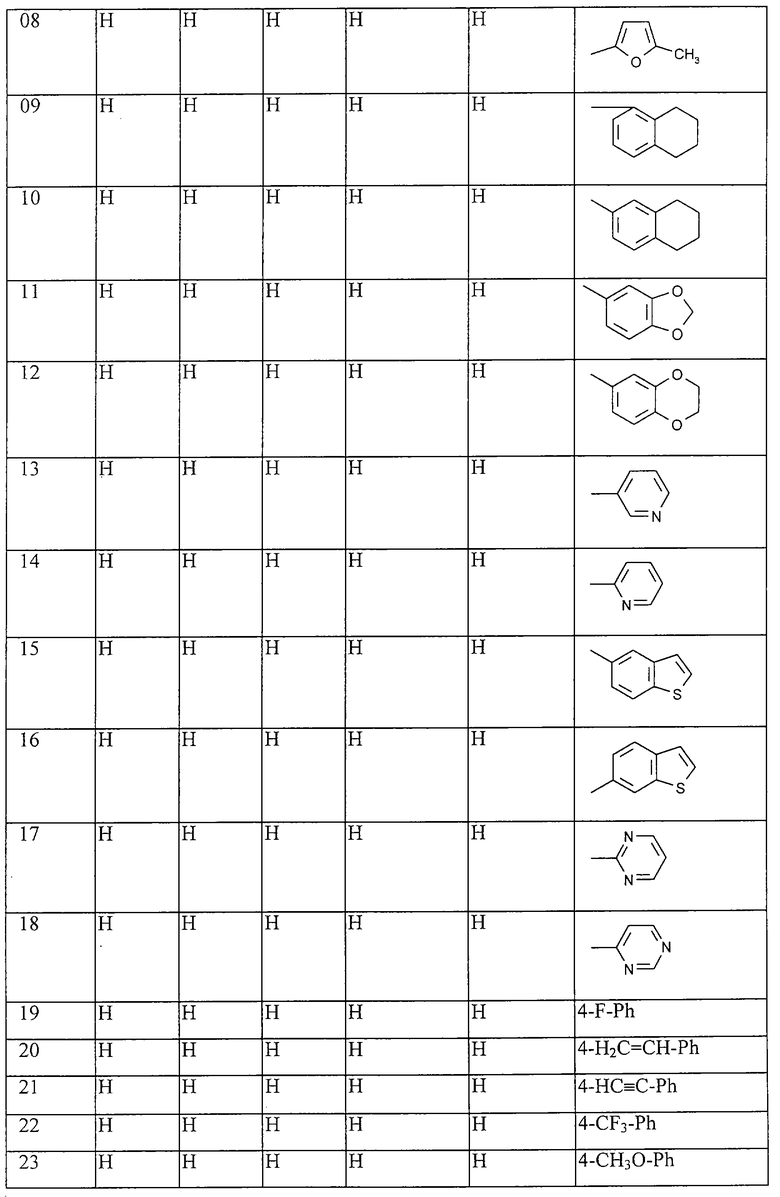
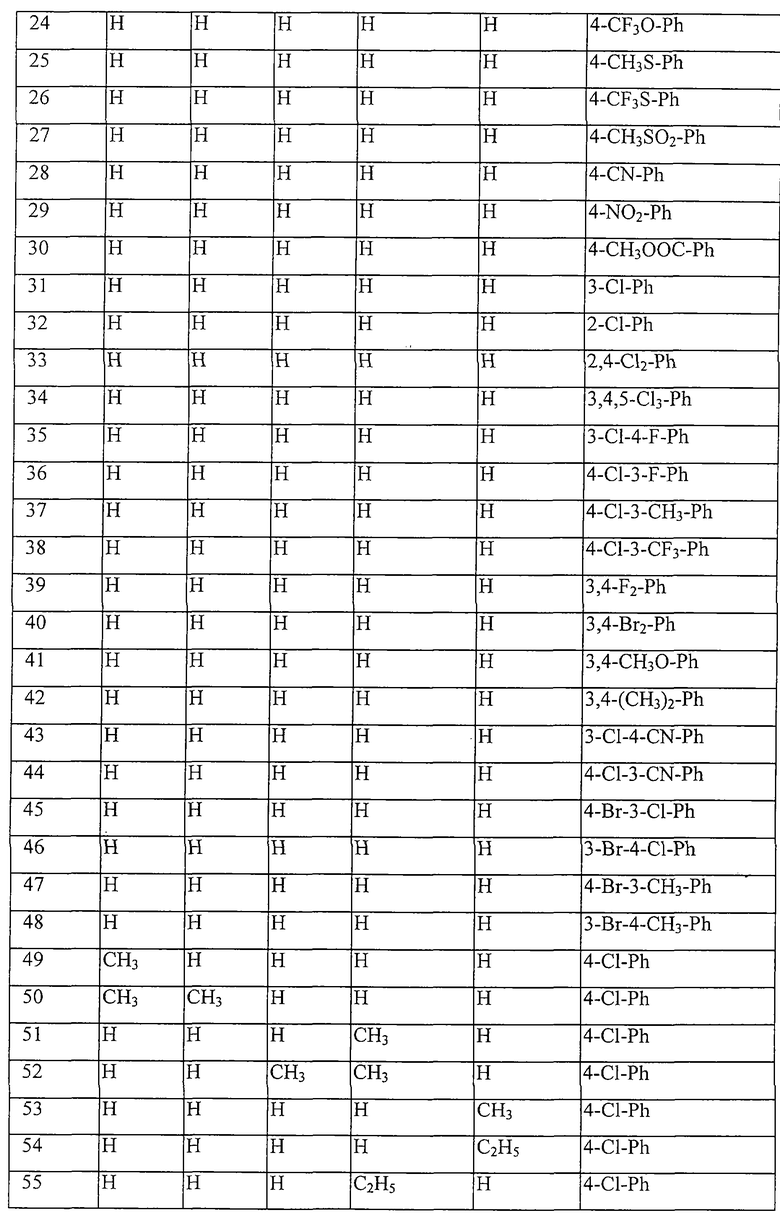
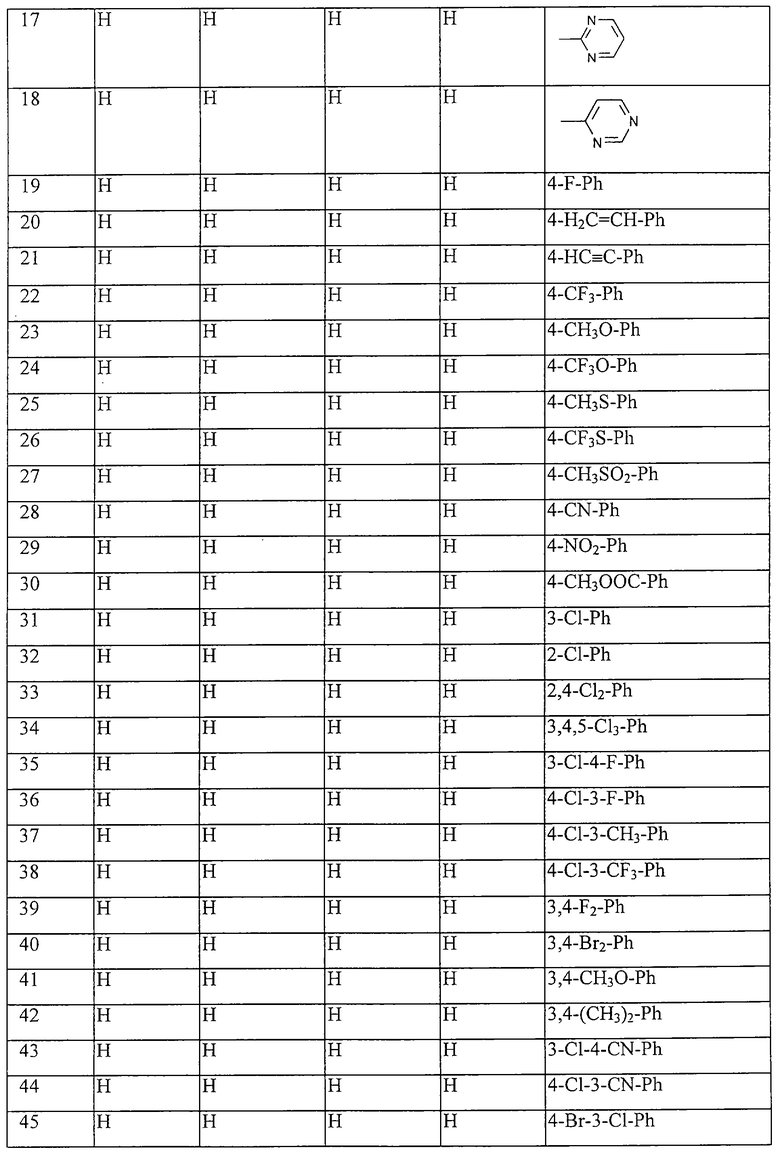
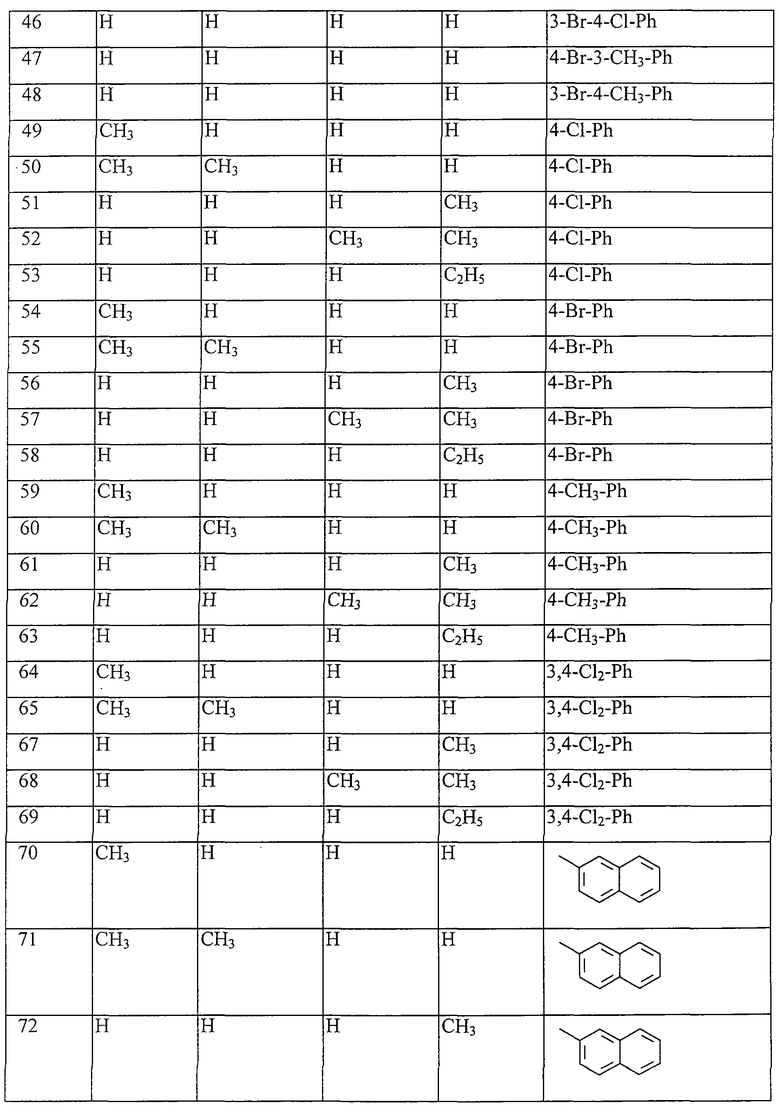
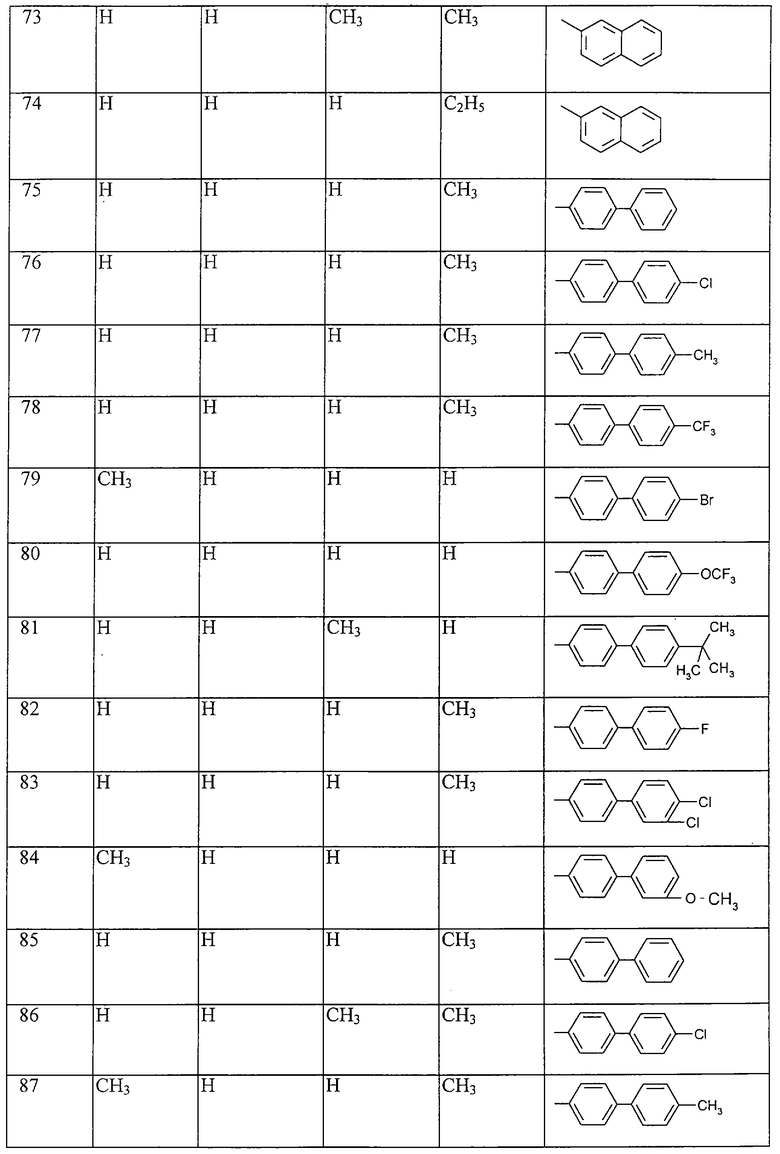
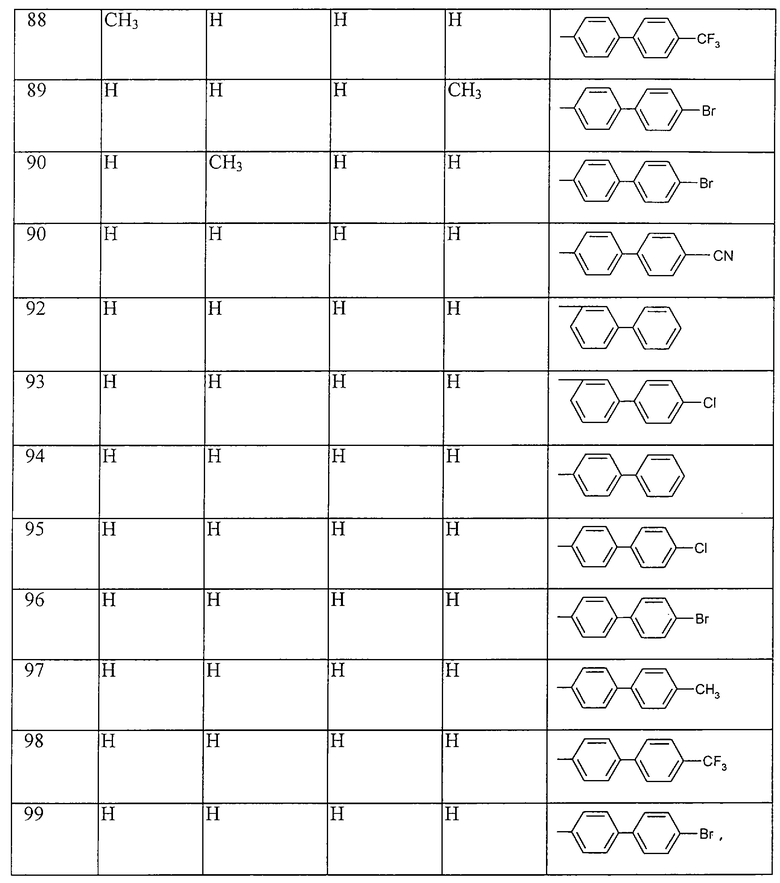
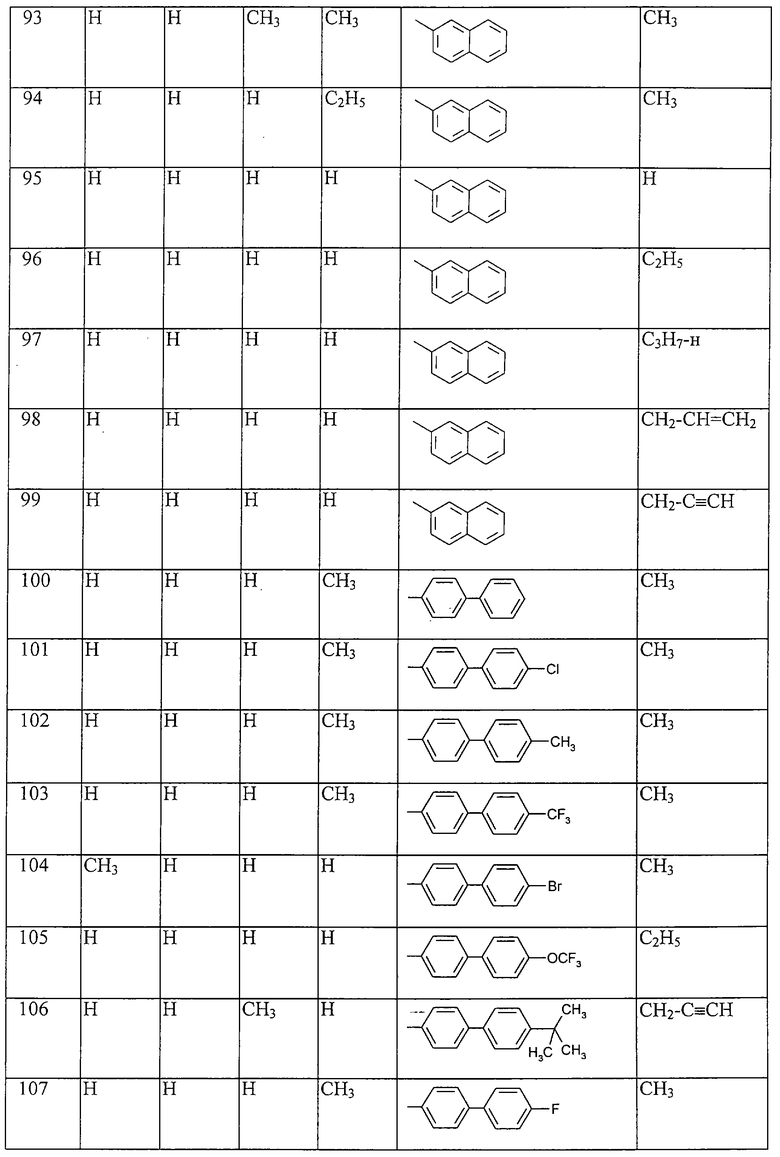
Работая аналогично процессам, описанным выше в примерах, получают соединения, перечисленные в таблицах 1-48. Ph обозначает фенил.
Таблица 1: Соединения, представленные формулой I.1
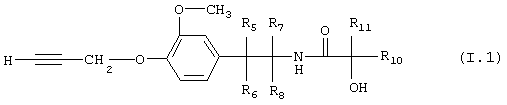
где комбинация групп R5, R6, R7, R8 и R10 в каждом варианте соответствует комбинации, приведенной в одном из рядов таблицы А.
Таблица 2: Соединения, представленные формулой I.2
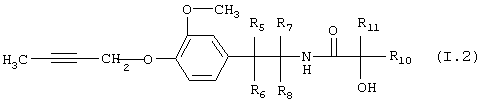
где комбинация групп R5, R6, R7, R8 и R10 в каждом варианте соответствует одному из рядов таблицы А.
Таблица 3: Соединения, представленные формулой I.3
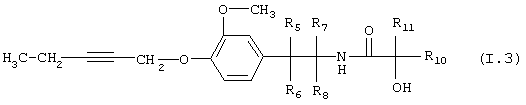
где комбинация групп R5, R6, R7, R8 и R10 в каждом варианте соответствует одному из рядов таблицы А.
Таблица 4: Соединения, представленные формулой I.4
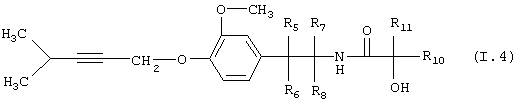
где комбинация групп R5, R6, R7, R8 и R10 в каждом варианте соответствует одному из рядов таблицы А.
Таблица 5: Соединения, представленные формулой I.5
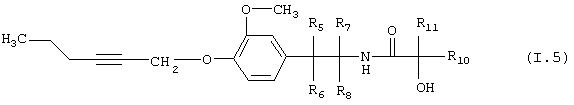
где комбинация групп R5, R6, R7, R8 и R10 в каждом варианте соответствует одному из рядов таблицы А.
Таблица 6: Соединения, представленные формулой I.6
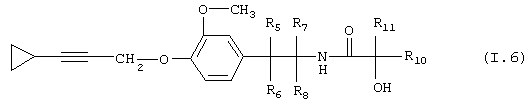
где комбинация групп R5, R6, R7, R8 и R10 в каждом варианте соответствует одному из рядов таблицы А.
Таблица 7: Соединения, представленные формулой I.7
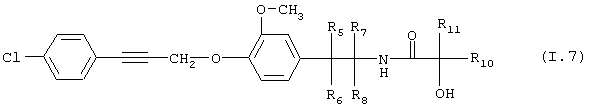
где комбинация групп R5, R6, R7, R8 и R10 в каждом варианте соответствует одному из рядов таблицы А.
Таблица 8: Соединения, представленные формулой 1.8
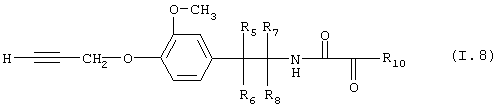
где комбинация групп R5 R6, R7, r8 и R10 в каждом варианте соответствует одному из рядов таблицы Б.
Таблица 9: Соединения, представленные формулой I.9
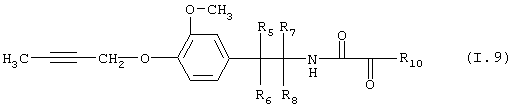
где комбинация групп R5 R6, R7, R8 и R10 в каждом варианте соответствует одному из рядов таблицы Б.
Таблица 10: Соединения, представленные формулой I.10
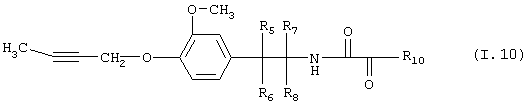
где комбинация групп R5 R6, R7, R8 и R10 в каждом варианте соответствует одному из рядов таблицы Б.
Таблица 11: Соединения, представленные формулой I.11
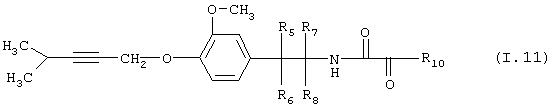
где комбинация групп R5 R6, R7, R8 и R10 в каждом варианте соответствует одному из рядов таблицы Б.
Таблица 12: Соединения, представленные формулой I.12
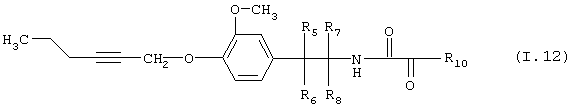
где комбинация групп R5 R6, R7, R8 и R10 в каждом варианте соответствует одному из рядов таблицы Б.
Таблица 13: Соединения, представленные формулой I.13
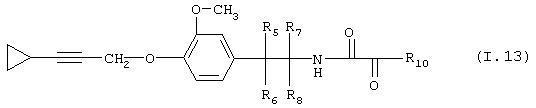
где комбинация групп R5 R6, R7, R8 и R10 в каждом варианте соответствует одному из рядов таблицы Б.
Таблица 14: Соединения, представленные формулой I.14
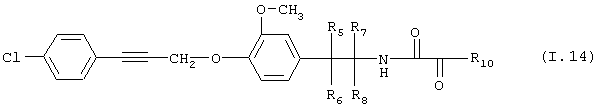
где комбинация групп R5 R6, R7, R8 и R10 в каждом варианте соответствует одному из рядов таблицы Б.
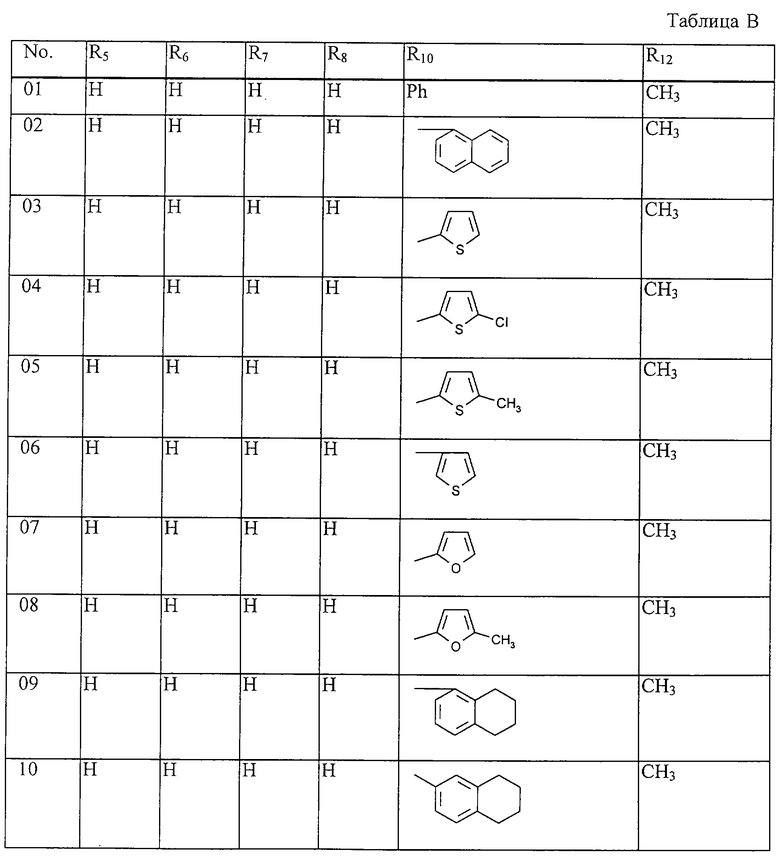
Таблица 15: Соединения, представленные формулой I.15
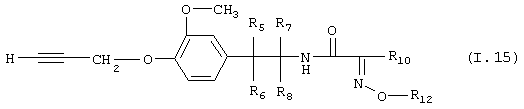
где комбинация групп R5 R6, R7, R8, R10 и R12 в каждом варианте соответствует одному из рядов таблицы В.
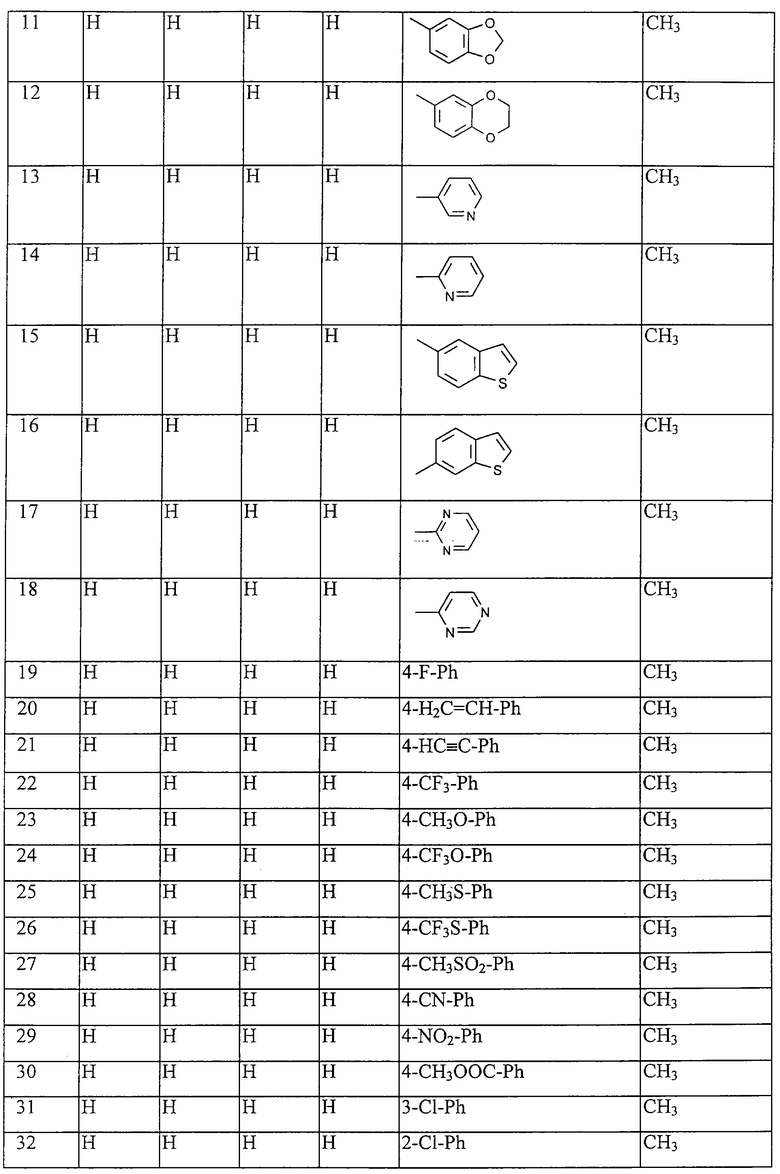
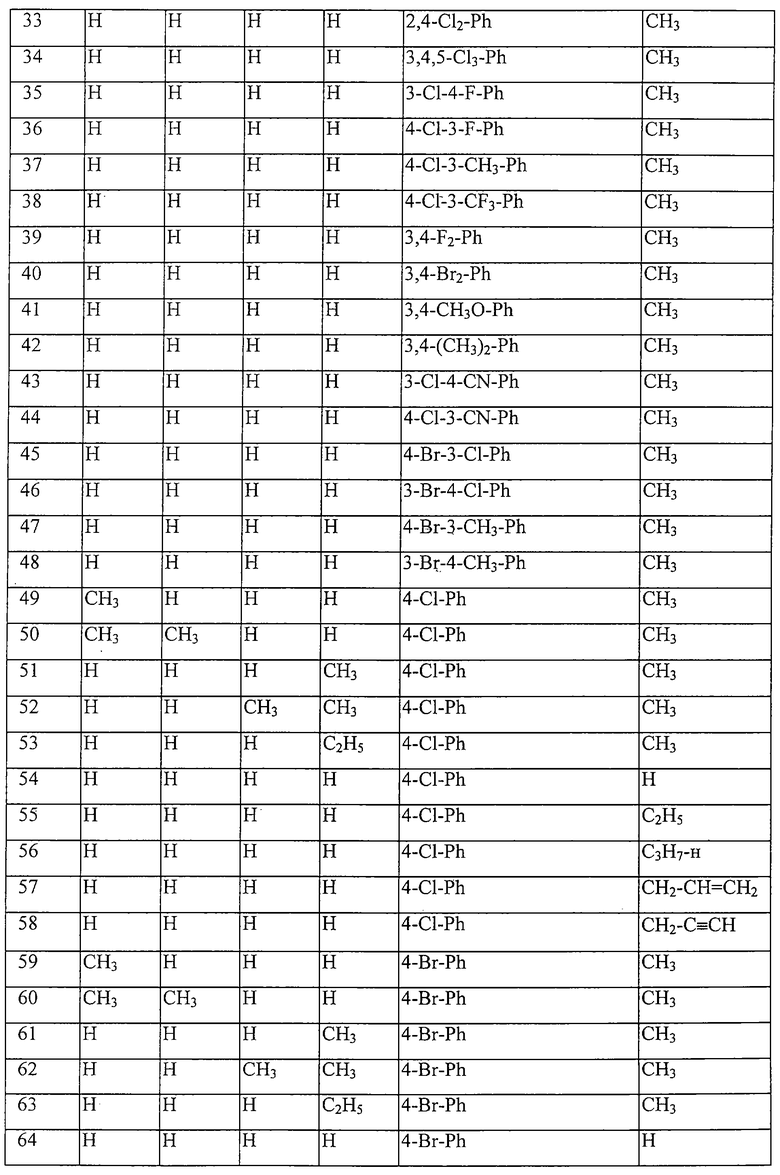
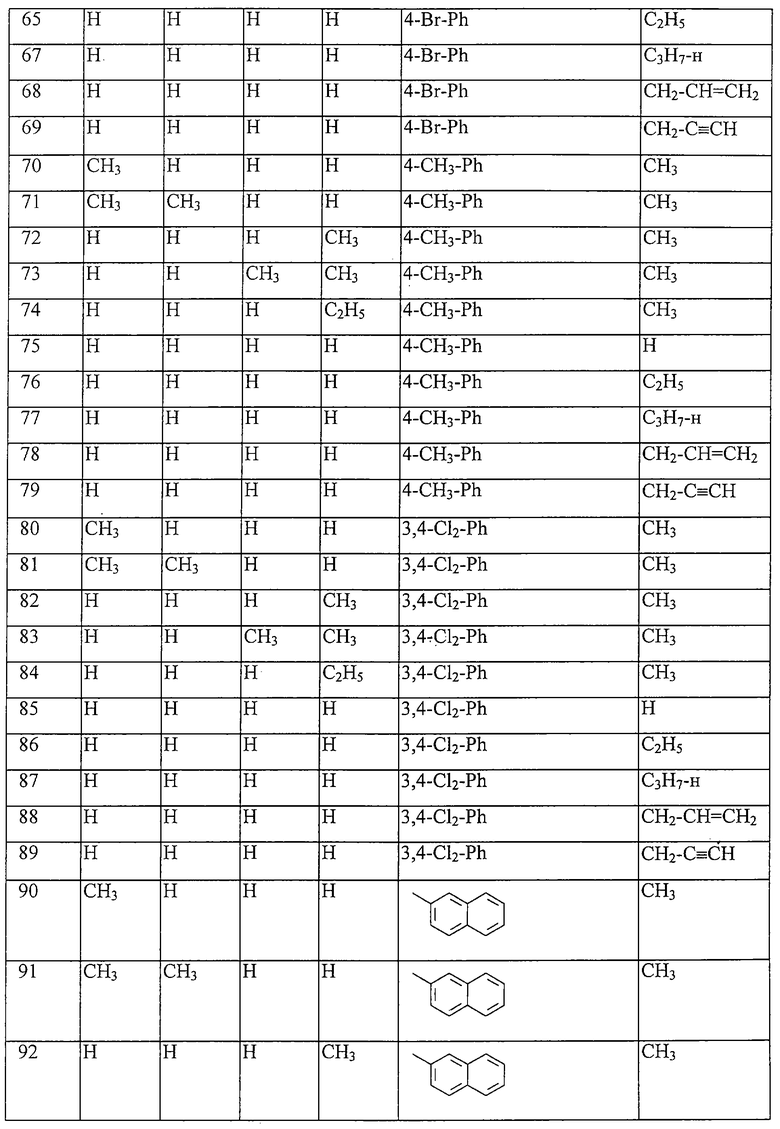
Таблица 16: Соединения, представленные формулой I.16
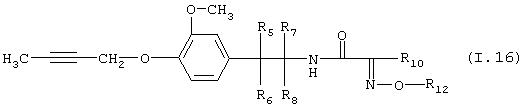
где комбинация групп R5 R6, R7, R8, R10 и R12 в каждом варианте соответствует одному из рядов таблицы В.
Таблица 17: Соединения, представленные формулой I.17
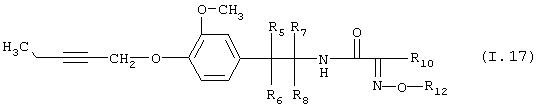
где комбинация групп R5 R6, R7, R8, R10 и R12 соответствует в каждом варианте одному из рядов таблицы В.
Таблица 18: Соединения, представленные формулой I.18
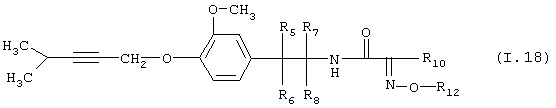
где комбинация групп R5 R6, R7, R8, R10 и R12 соответствует в каждом варианте одному из рядов таблицы В.
Таблица 19: Соединения, представленные формулой I.19
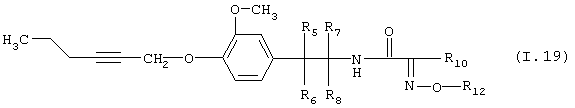
где комбинация групп R5 R6, R7, R8, R10 и R12 соответствует в каждом варианте одному из рядов таблицы В.
Таблица 20: Соединения, представленные формулой I.20
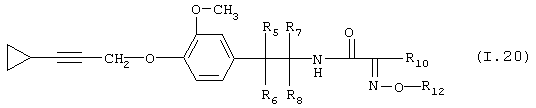
где комбинация групп R5 R6, R7, R8, R10 и R12 соответствует в каждом варианте одному из рядов таблицы В.
Таблица 21: Соединения, представленные формулой I.21
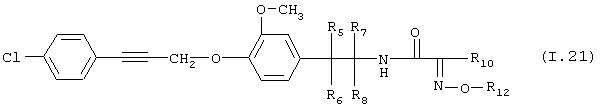
где комбинация групп R5 R6, R7, R8, R10 и R12 соответствует в каждом варианте одному из рядов таблицы В.
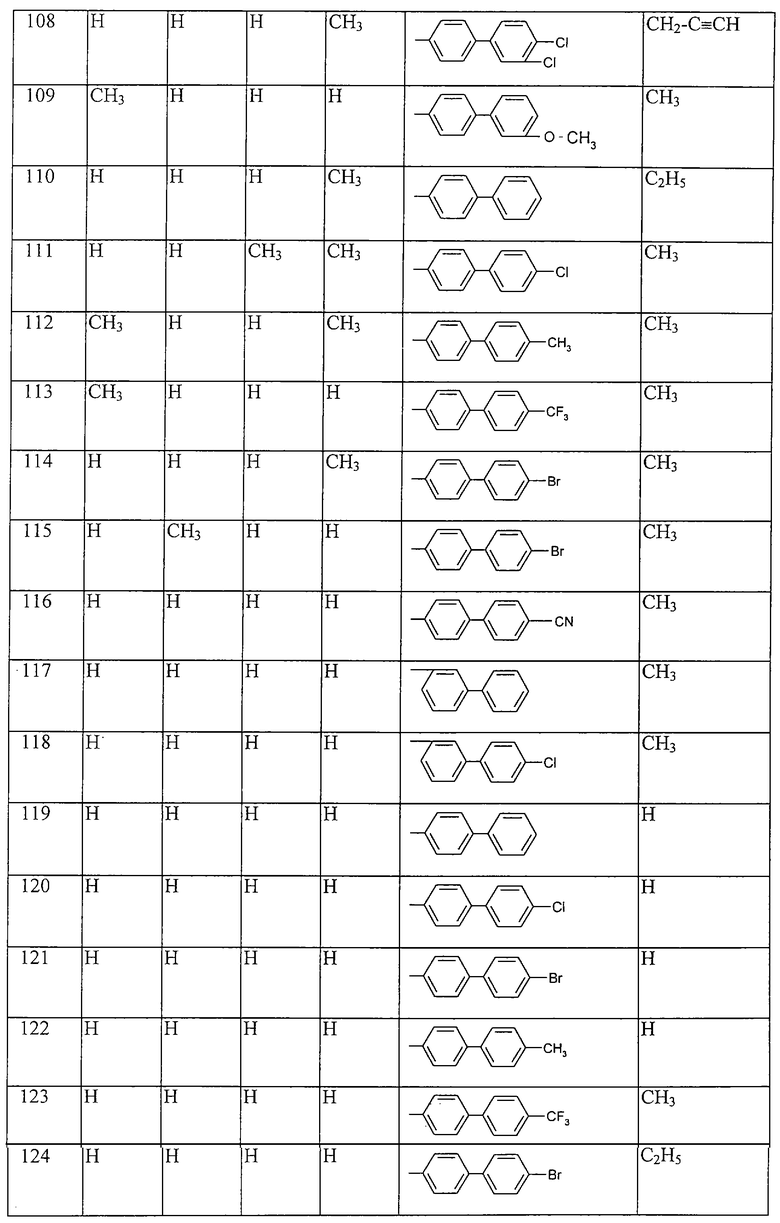
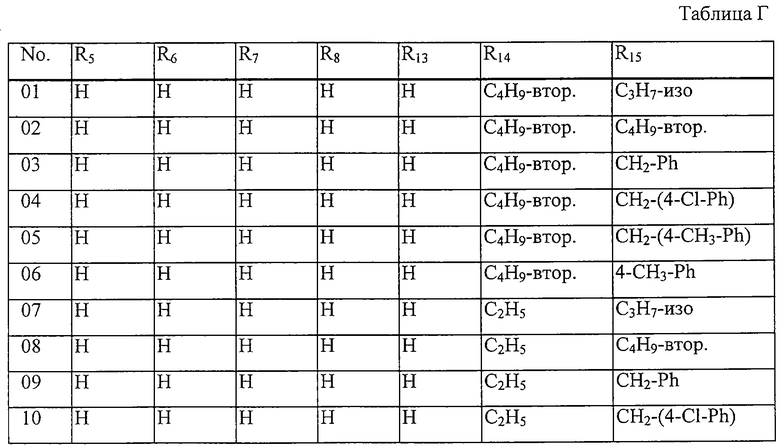
Таблица 22: Соединения, представленные формулой I.22
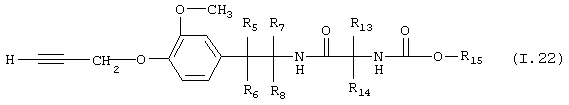
где комбинация групп R5 R6, R7, R8, R13, R14 и R15 соответствует в каждом варианте одному из рядов таблицы Г.
Таблица 23: Соединения, представленные формулой I.23
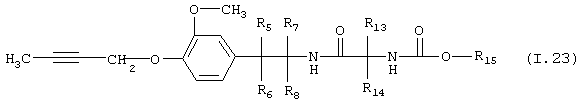
где комбинация групп R5 R6, R7, R8, R13, R14 и R15 соответствует в каждом варианте одному из рядов таблицы Г.
Таблица 24: Соединения, представленные формулой I.24
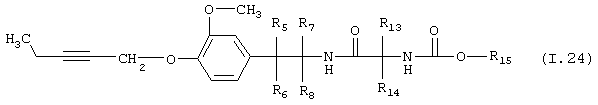
где комбинация групп R5 R6, R7, R8, R13, R14 и R15 соответствует в каждом варианте одному из рядов таблицы Г.
Таблица 25: Соединения, представленные формулой I.25
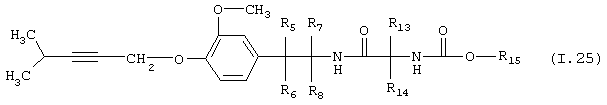
где комбинация групп R5 R6, R7, R8, R13, R14 и R15 соответствует в каждом варианте одному из рядов таблицы Г.
Таблица 26: Соединения, представленные формулой I.26
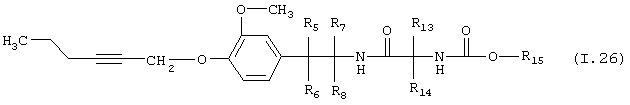
где комбинация групп R5 R6, R7, R8, R13, R14 и R15 соответствует в каждом варианте одному из рядов таблицы Г.
Таблица 27: Соединения, представленные формулой I.27
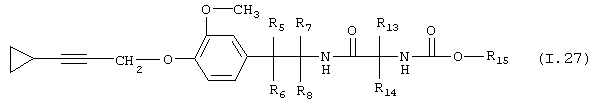
где комбинация групп R5 R6, R7, R8, R13, R14 и R15 соответствует в каждом варианте одному из рядов таблицы Г.
Таблица 28: Соединения, представленные формулой I.28
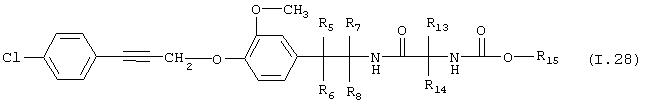 где комбинация групп R5 R6, R7, R8, R13, R14 и R15 соответствует в каждом варианте одному из рядов таблицы Г.
где комбинация групп R5 R6, R7, R8, R13, R14 и R15 соответствует в каждом варианте одному из рядов таблицы Г.
Таблица 29: Соединения, представленные формулой I.29
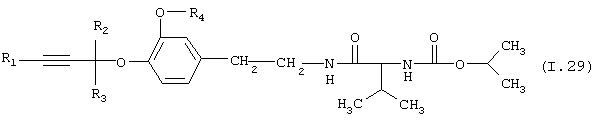
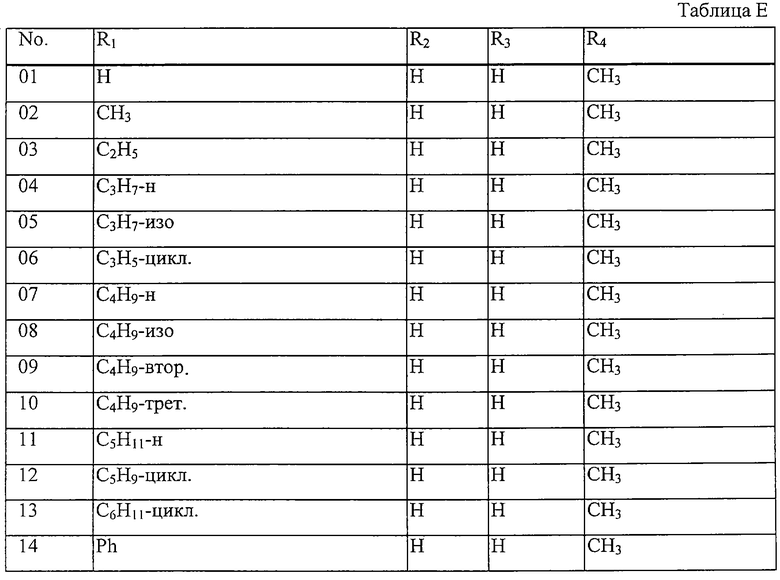
где комбинация групп R1, R2, R3 и R4 соответствует в каждом варианте одному из рядов таблицы Е.
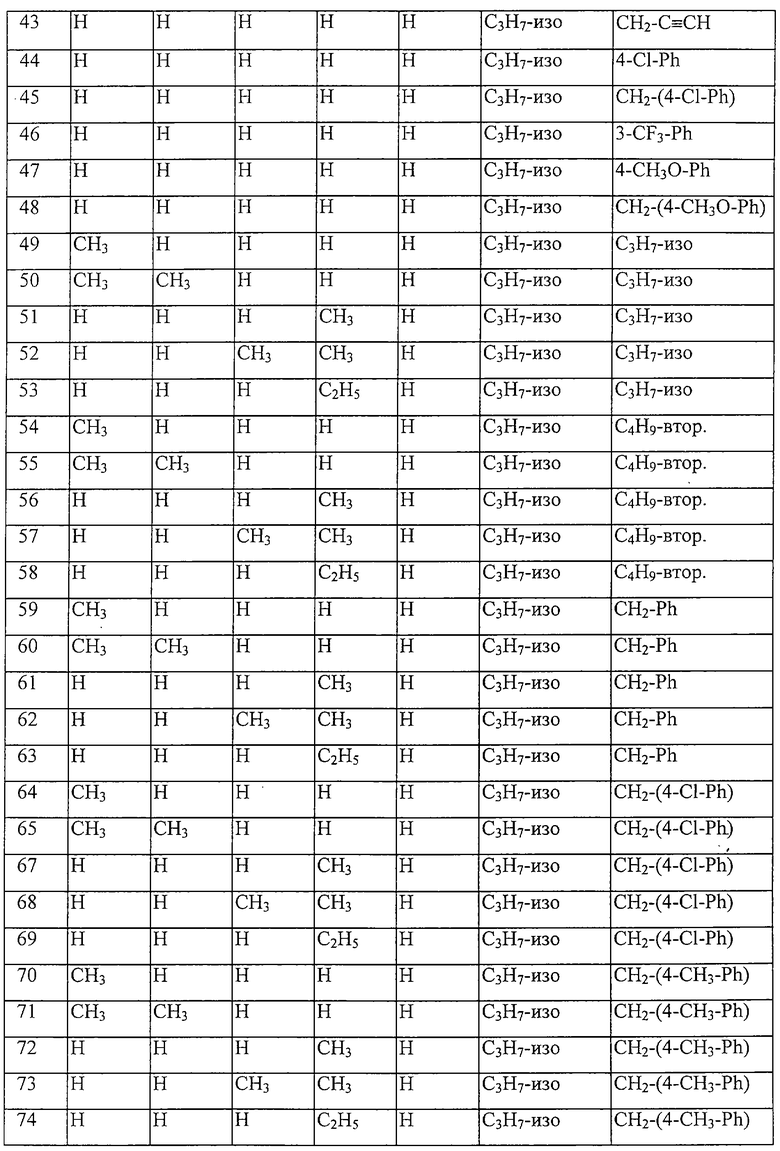
Таблица 30: Соединения, представленные формулой I.30
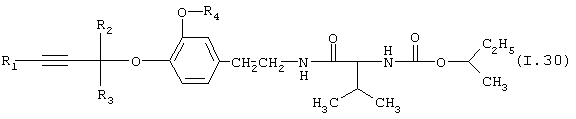
где комбинация групп R1, R2, R3 и R4 соответствует в каждом варианте одному из рядов таблицы Е.
Таблица 31: Соединения, представленные формулой I.31
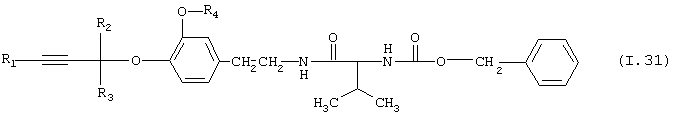
где комбинация групп R1, R2, R3 и R4 соответствует в каждом варианте одному из рядов таблицы Е.
Таблица 32: Соединения, представленные формулой I.32
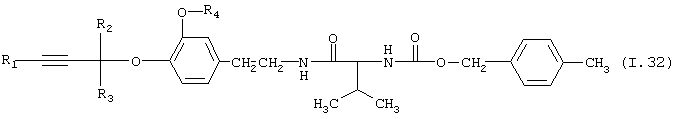
где комбинация групп R1, R2, R3 и R4 соответствует в каждом варианте одному из рядов таблицы Е.
Таблица 33: Соединения, представленные формулой I.33
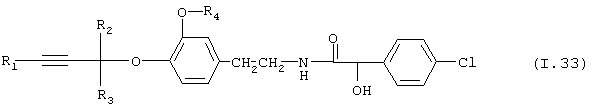
где комбинация групп R1, R2, R3 и R4 соответствует в каждом варианте одному из рядов таблицы Е.
Таблица 34: Соединения, представленные формулой I.34
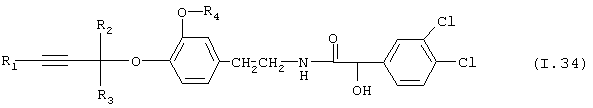
где комбинация групп R1, R2, R3 и R4 соответствует в каждом варианте одному из рядов таблицы Е.
Таблица 35: Соединения, представленные формулой I.35
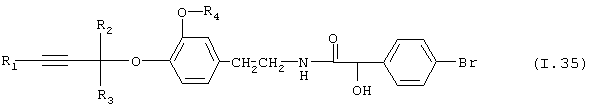
где комбинация групп R1, R2, R3 и R4 соответствует в каждом варианте одному из рядов таблицы Е.
Таблица 36: Соединения, представленные формулой I.36
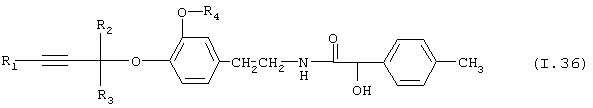
где комбинация групп R1, R2, R3 и R4 соответствует в каждом варианте одному из рядов таблицы Е.
Таблица 37: Соединения, представленные формулой I.37
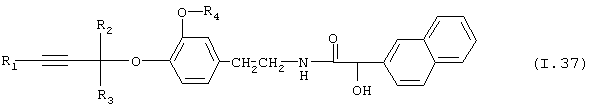
где комбинация групп R1, R2, R3 и R4 соответствует в каждом варианте одному из рядов таблицы Е.
Таблица 38: Соединения, представленные формулой I.38
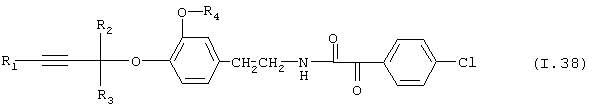
где комбинация групп R1, R2, R3 и R4 соответствует в каждом варианте одному из рядов таблицы Е.
Таблица 39: Соединения, представленные формулой I.39
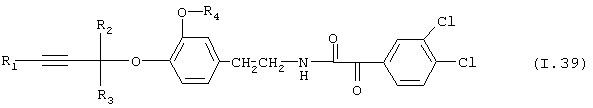
где комбинация групп R1, R2, R3 и R4 соответствует в каждом варианте одному из рядов таблицы Е.
Таблица 40: Соединения, представленные формулой I.40
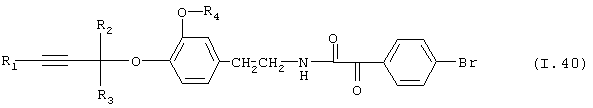
где комбинация групп R1, R2, R3 и R4 соответствует в каждом варианте одному из рядов таблицы Е.
Таблица 41: Соединения, представленные формулой I.41
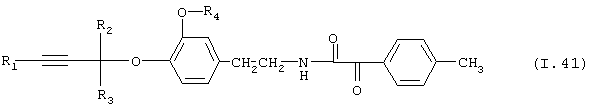
где комбинация групп R1, R2, R3 и R4 соответствует в каждом варианте одному из рядов таблицы Е.
Таблица 42: Соединения, представленные формулой I.42
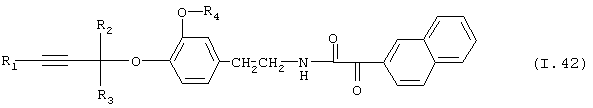
где комбинация групп R1, R2, R3 и R4 соответствует в каждом варианте одному из рядов таблицы Е.
Таблица 43: Соединения, представленные формулой I.43
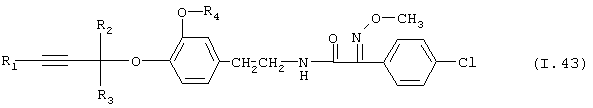
где комбинация групп R1, R2, R3 и R4 соответствует в каждом варианте одному из рядов таблицы Е.
Таблица 44: Соединения, представленные формулой I.44
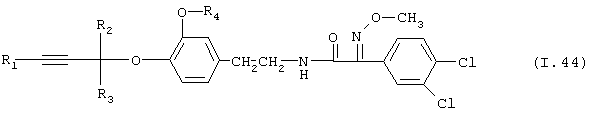
где комбинация групп R1, R2, R3 и R4 соответствует в каждом варианте одному из рядов таблицы Е.
Таблица 45: Соединения, представленные формулой I.45
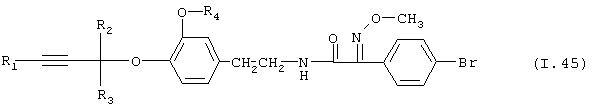
где комбинация групп R1, R2, R3 и R4 соответствует в каждом варианте одному из рядов таблицы Е.
Таблица 46: Соединения, представленные формулой I.46
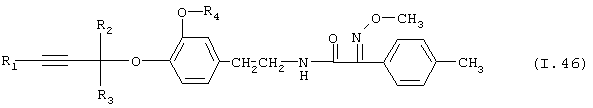
где комбинация групп R1, R2, R3 и R4 соответствует в каждом варианте одному из рядов таблицы Е.
Таблица 47: Соединения, представленные формулой I.47
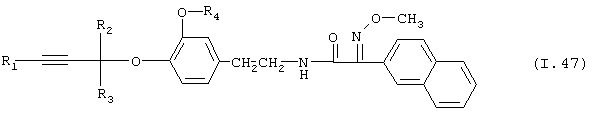
где комбинация групп R1, R2, R3 и R4 соответствует в каждом варианте одному из рядов таблицы Е.
Таблица 48: Соединения, представленные формулой I.48
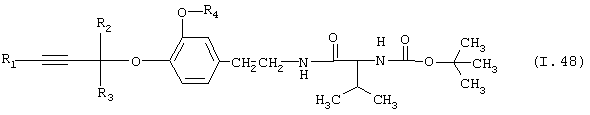
где комбинация групп R1, R2, R3 и R4 соответствует в каждом варианте одному из рядов таблицы Е.
Композиции могут быть приготовлены аналогично методу, описанному, например, в WO 95/30651.
Биологические примеры
D-1: Активность в отношении Plasmopara viticola на культурном винограде
а) Остаточное защитное действие
Чубуки культурного винограда на стадии 4-5-листьев опрыскивают смесью для опрыскивания (0,02% действующего вещества), приготовленной из композиции тестируемого соединения в виде смачивающегося порошка. Через 24 ч обработанные растения заражают суспензией спорангиев гриба. Поражение грибом оценивают после инкубации в течение 6 дней при 95-100%-ной относительной влажности и при 20°С.
б) Остаточное лечебное действие
Чубуки культурного винограда на стадии 4-5-листьев заражают суспензией спорангиев гриба. После инкубации в течение 24 ч в увлажняющей камере при относительной влажности 95-100% и при 20°С зараженные растения сушат и опрыскивают смесью для опрыскивания (0,02% действующего вещества), приготовленной из композиции тестируемого соединения в виде смачивающего порошка. После высыхания полученного при опрыскивании покрытия обработанные растения помещают опять в увлажняющую камеру. Поражение грибом оценивают через 6 дней после заражения.
Соединения, приведенные в таблице 1, обладают очень хорошей фунгицидной активностью в отношении Plasmopara viticola на культурном винограде. В этом опыте соединения Е1.01, Е1.02, Е1.05, Е1.06, Е1.08, Е1.13, Е1.21, Е1.30, Е1.40, Е1.42, Е1.46, Е1.48, Е1.49, Е1.50, Е1.53, Е1.55, Е1.56, Е1.57, Ea1.01, Ea1.02, Е2.01, Е2.02, Е2.06, Е2.07, Е2.08, Е2.14, Е2.19, Е2.26, Е3.01, Е3.02, Е3.03, Е4.01 и 1.86 полностью ингабируют поражение грибом.
D-2: Активность в отношении Phytophthora на растениях томатов
а) Остаточное защитное действие
После культивирования в течение 3 недель растения томатов опрыскивают смесью для опрыскивания (0,02% действующего вещества), приготовленной из композиции тестируемого соединения в виде смачивающегося порошка. Через 48 ч обработанные растения заражают суспензией спорангиев гриба. Поражение грибом оценивают после инкубации зараженных растений в течение 5 дней при 90-100%-ной относительной влажности и при 20°С.
б) Системное действие
После культивирования в течение 3 недель растения томатов поливают смесью для опрыскивания (0,02% действующего вещества по отношению к объему почвы), приготовленной из композиции тестируемого соединения в виде смачивающегося порошка. Принимают меры предосторожности для того, чтобы смесь для опрыскивания не попадала на надземные части растений. Через 96 ч обработанные растения заражают суспензией спорангиев гриба. Поражение грибом оценивают после инкубации зараженных растений в течение 4 дней при 90-100%-ной относительной влажности и при 20°С.
Соединения, приведенные в таблицах 1-47, обладают продолжительным действием в отношении поражения грибом. В этом опыте соединения Е1.01, Е1.02, Е1.05, Е1.06, Е1.08, Е1.13, Е1.21, Е1.30, Е1.40, Е1.42, Е1.46, Е1.48, Е1.49, Е1.50, Е1.53, Е1.55, Е1.56, Е1.57, Ea1.01, Ea1.02, Е2.01, Е2.02, Е2.06, Е2.07, Е2.08, Е2.14, Е2.19, Е2.26, Е3.01, Е3.02, Е3.03, Е4.01 и 1.86 полностью ингибируют поражение грибом.
D-3: Активность в отношении Phytophthora на растениях картофеля
а) Остаточное защитное действие
2-3-недельные растения картофеля (сорта Bintje) опрыскивают смесью для опрыскивания (0,02% действующего вещества), приготовленной из композиции тестируемого соединения в виде смачивающегося порошка. Через 48 ч обработанные растения заражают суспензией спорангиев гриба. Поражение грибом оценивают после инкубации зараженных растений в течение 4 дней при 90-100%-ной относительной влажности и при 20°С.
б) Системное действие
2-3-недельные растения картофеля (сорта Bintje) поливают смесью для опрыскивания (0,02% действующего вещества по отношению к объему почвы), приготовленной из композиции тестируемого соединения в виде смачивающегося порошка. Принимают меры предосторожности для того, чтобы смесь для опрыскивания не попадала на надземные части растений. Через 48 ч обработанные растения заражают суспензией спорангиев гриба. Поражение грибом оценивают после инкубации зараженных растений в течение 4 дней при 90-100%-ной относительной влажности и при температуре 20°С. Соединения, приведенные в таблицах 1-47, обладают эффективностью в отношении поражения грибом.
В этом опыте соединения Е1.01, Е1.02, Е1.06, Е1.08, Е1.13, Е1.30, Е1.40, Е1.41, Е1.42, Е1.49, Е1.53, Е1.55, Е1.56, Е2.06, Е2.07, Е2.19, Е3.01 и Е3.02 полностью ингибируют поражение грибом.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ПРОИЗВОДНЫЕ ФЕНИЛПРОПАРГИЛОВОГО ЭФИРА | 2001 |
|
RU2259353C2 |
| ПРОИЗВОДНЫЕ ПИРИДАЗИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКИХ АГЕНТОВ | 2004 |
|
RU2326118C2 |
| НОВЫЕ СОЕДИНЕНИЯ | 2001 |
|
RU2419608C2 |
| ПРОИЗВОДНЫЕ ПИПЕРИДИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2001 |
|
RU2298550C2 |
| ПРОИЗВОДНЫЕ ГЕТЕРОАРИЛАЛКИЛПИПЕРАЗИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2001 |
|
RU2243970C1 |
| ЗАМЕЩЕННЫЕ АМИДЫ БЕНЗОЙНОЙ КИСЛОТЫ И ИХ СОДЕРЖАЩИЙ ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 2001 |
|
RU2353618C2 |
| ТИАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ, ОБЛАДАЮЩИЕ МИКРОБИОЦИДНОЙ АКТИВНОСТЬЮ | 2017 |
|
RU2779183C2 |
| НОВЫЕ СОЕДИНЕНИЯ | 2001 |
|
RU2261245C2 |
| ПРОИЗВОДНЫЕ ПИРАЗОЛИНДИОНА КАК ИНГИБИТОРЫ НАДФН-ОКСИДАЗЫ | 2010 |
|
RU2569855C2 |
| ПРОИЗВОДНОЕ БЕНЗОЛАЦЕТАМИДА, СПОСОБЫ ЕГО ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1991 |
|
RU2087465C1 |
Изобретение относится к соединениям общей формулы I
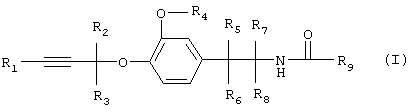
включая их оптические изомеры и смеси таких изомеров, где r1 обозначает водород, С1-С6алкил, С3-С6циклоалкил или арил, необязательно замещенный 1-3 атомами галогена, R2 и R3 каждый независимо друг от друга обозначают водород или С1-С6алкил, R4 обозначает С1-С6алкил или С3-С6алкинил, R5, R6, R7 и r8 каждый обозначает водород и
 ,
,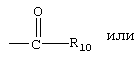
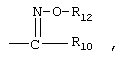
r10 обозначает арил, необязательно замещенный 1-3 заместителями, выбранными из группы, включающей галоген, С1-С6алкил, С1-С6алкокси, С1-С6галоалкил, С1-С4галоалкокси, С1-С4алкокси, С1-С4алкил, С1-С6алкилтио, С3-С6алкинилокси, нитро и С1-С6алкоксикарбонил или необязательно замещенный гетероарил, представляющий собой ароматическую кольцевую систему, содержащую в качестве гетероатома по крайней мере один атом кислорода или серы, r11 обозначает водород, С1-С6алкил или С3-С6алкинил, R12 обозначает водород или С1-С6алкил, Z обозначает водород -CO-R16 или -CO-COOR16 и R16 обозначает С1-С6алкил, -СН2-СО- С1-С6алкил или фенил. Технический результат – производные простого пропаргилового эфира, представляющие собой бактерициды, используемые для борьбы или предупреждения заражения растений фитопатогенными микроорганизмами. 5 з.п. ф-лы, 12 табл.
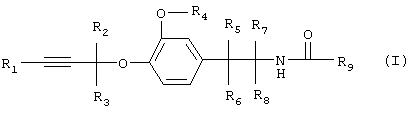
включая их оптические изомеры и смеси таких изомеров,
где r1 обозначает водород, С1-С6алкил С3-С6циклоалкил или арил, необязательно замещенный 1-3 атомами галогена,
R2 и R3 каждый независимо друг от друга обозначают водород или С1-С6алкил,
R4 обозначает С1-С6алкил или С3-С6алкинил,
R5, R6, R7 и r8 каждый обозначает водород, и
R9 обозначает группу
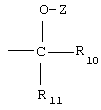
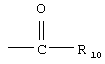
или

r10 обозначает арил, необязательно замещенный 1-3 заместителями, выбранными из группы, включающей галоген, С1-С6алкил, С1-С6алкокси, С1-С6галоалкил,С1-С4галоалкокси, С1-С4алкоксиС1-С4алкил, С1-С6алкилтио, С3-С6алкинилокси, нитро и С1-С6алкоксикарбонил, или необязательно замещенный гетероарил, представляющий собой ароматическую кольцевую систему, содержащую в качестве гетероатома по крайней мере один атом кислорода или серы,
r11 обозначает водород С1-С6алкил или С3-С6алкинил,
R12 обозначает водород или С1-С6алкил,
Z обозначает водород ,-CO-R16 или -CO-COOR16, и
R16 обозначает С1-С6алкил, -СН2-СО- С1-С6алкил или фенил.
2-(3,4-дихлорфенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(3,4-дихлорфенил)-2-гидрокси-N-[2-(3-метокси-4-пент-2-инилоксифенил)этил]ацетамид,
2-(4-фторфенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(4-хлорфенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(4-бромфенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(4-метоксифенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(4-метилфенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(2-нафтил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(3,4-дихлорфенил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-оксоацетамид,
2-(3,4-дихлорфенил)-N-[2-(3-метокси-4-пент-2-инилоксифенил)этил]-2-оксоацетамид,
2-(4-хлорфенил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-оксоацетамид,
2-(4-бромфенил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-оксоацетамид,
2-(4-метилфенил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-оксоацетамид,
2-(3,4-диметоксифенил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-оксоацетамид,
2-(1-метилэтоксикарбониламино)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-3-метилбутирамид,
2-(1,1-диметилэтоксикарбониламино)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-3-метилбутирамид,
2-(1,1-диметилэтоксикарбониламино)-N-{2-[3-метокси-4-(пент-2-инилокси)фенил]этил}-3-метилбутирамид,
2-(1,1-диметилэтоксикарбониламино)-N-{2-[3-метокси-4-(4-фторфенилпроп-2-инилокси)фенил]этил}-3-метилбутирамид,
2-(1,1-диметилэтоксикарбониламино)-N-{2-[3-метокси-4-(4-хлорфенилпроп-2-инилокси)фенил]этил}-3-метилбутирамид,
2-(3,4-дихлорфенил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-метоксиминоацетамид,
2-(4-хлорфенил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-метоксиминоацетамид,
2-(4-метилфенил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-метоксиминоацетамид,
2-(4-бромфенил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-метоксиминоацетамид.
2-(4-хлорфенил)-2-гидрокси-N-[(R)2-(3-метокси-4-проп-2-инилоксифенил)пропил]ацетамид,
2-(4-хлорфенил)-2-гидрокси-N-[(S)2-(3-метокси-4-проп-2-инилоксифенил)пропил]ацетамид,
2-(4-хлор-2-нитрофенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(4-этилфенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(4-трифторметилфенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(4-метилфенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(4-хлорфенил)-2-гидрокси-N-[2-(3-метокси-4-пент-2-инилоксифенил)этил]ацетамид,
2-(4-бромфенил)-2-гидрокси-N-[2-(3-метокси-4-пент-2-инилоксифенил)этил]ацетамид,
2-(4-метилфенил)-2-гидрокси-N-[2-(3-метокси-4-пент-2-инилоксифенил)этил]ацетамид,
2-(4-трифторметилфенил)-2-гидрокси-N-[2-(3-метокси-4-пент-2-инилоксифенил)этил]ацетамид,
2-(4-хлорфенил)-2-гидрокси-N-[2-(3-метокси-4-гекс-2-инилоксифенил)этил]ацетамид,
2-(4-бромфенил)-2-гидрокси-N-[2-(3-метокси-4-гекс-2-инилоксифенил)этил]ацетамид,
2-(4-метилфенил)-2-гидрокси-N-[2-(3-метокси-4-гекс-2-инилоксифенил)этил]ацетамид,
2-(3,4-дихлорфенил)-2-гидрокси-N-[2-(3-метокси-4-гекс-2-инилоксифенил)этил]ацетамид,
2-нафтил-2-гидрокси-N-[2-(3-метокси-4-гекс-2-инилоксифенил)этил]ацетамид,
2-(4-трифторметилфенил)-2-гидрокси-N-[2-(3-метокси-4-гекс-2-инилоксифенил)этил]ацетамид,
2-(4-бифенил)-2-гидрокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(4-бромфенил)-2-метилоксалилокси-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(4-хлорфенил)-2-гидрокси-2-(проп-2-инил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]ацетамид,
2-(3,4-дихлорфенил)-N-[2-(3-метокси-4-пент-2-инилоксифенил)этил]-2-оксоацетамид,
2-(4-хлорфенил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)этил]-2-метоксиминоацетамид,
2-(4-метилфенил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)-этил]-2-метоксиминоацетамид,
2-(3,4-дихлорфенил)-N-[2-(3-метокси-4-проп-2-инилоксифенил)-этил]-2-метоксиминоацетамид.
| Экономайзер | 0 |
|
SU94A1 |
| Прибор для очистки паром от сажи дымогарных трубок в паровозных котлах | 1913 |
|
SU95A1 |
| Приспособление в пере для письма с целью увеличения на нем запаса чернил и уменьшения скорости их высыхания | 1917 |
|
SU96A1 |
| RU 94045970 A1, 27.05.1996. | |||
Авторы
Даты
2004-09-27—Публикация
2000-01-10—Подача