Изобретение относится к области синтеза гетероциклических соединений, конкретно к способу получения 6-замещенных производных 2-(алкилсульфанил)-4(3H)-пиримидинона формулы
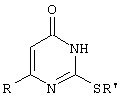
где
R=С6Н5СН2, R’=СН3, СН(СН3)С2Н5, цикло-С5H9, цикло-С6H11,
R=2,6-F2С6Н3СН2, R’=СН3, СН(СН3)С2Н5, цикло-С5H9, цикло-С6H11,
R=2,6-С12С6Н3СН2, R’=СН3, СH(СН3)C2Н5, цикло-С5H9, цикло-С6H11,
R=1-С10Н7СН2, R’=СН(СН3)С2Н5, цикло-С5Н9, цикло-С6Н11,
R=Ph2CH, R’=СН3, С2Н5, СН(СН3)С2Н5, цикло-С5Н9, цикло-С6H11, которые находят применение как противовирусные пролекарственные препараты.
Известны способы получения 6-замещенных 2-(алкилсульфанил)-4(3H)-пиримидинонов путем алкилирования соответствующих 6-замещенных 2-тиоурацилов галоидными алкилами в присутствии карбоната калия в безводном ДМФА [Structure-based design, synthesis, and biological evaluation of conformationally restricted novel 2-alkylthio-6-[l-(2,6-difluorophenyl)alkyl]-3,4-dihydro-5-alkylpyrimidin-4(3H)-ones as non-nucleoside inhibitors of HIV-1 reverse transcriptase / Mai A., Sbardella G., Artico M. et al // J. Med. Chem. - 2001 - Vol.44, N16 - P.2544-2554; Chiral resolution and molecular modeling inverstigation of rac-2-cyclopentylthio-6-[1-(2,6-difluorophenyl)ethyl]-3,4-dihydro-5-methylpyrimidin-4(3H)-one (MC-1047), a potent anti-HIV-1 reverse transcriptase agent of the DABO class / Quaglia M.G., Mai A., Sbardella G. et al. // Chirality - 2001. - Vol.13 - P.75-80] или алкоксида натрия в абсолютном спирте [Пат. 2740785 США МКИ C 07 D - 239/28 4-Hydroxy-5-alkyl-6-arylpyrimidine derivatives / Nicholson R.T., Rorig K.J. (США) - №436992 US; Заявл. 15.06.54; Опубл. 17.09.56 - Р.4; Synthesis of 5-alkyl-6-arylmethyl-2-(7-bromo-3,5-dioxaheptylthio)-pyrimidin-4(1H)-ones and 7-oxopyrimidino-l,5,3-oxathiazepines as new S-DABO analogues with anti-HIV activity / Pedersen O.S., Petersen L., Brandt M. et al. // Monatsh. Chem. - 1999. - Vol.130, N12 - P.1499-1512].
Недостатком данных методов является необходимость использования пожаро- и взрывоопасных дорогостоящих реагентов, а также абсолютных растворителей.
Также описаны способы получения 6-замещенных 2-(алкилсульфанил)-4(3H)-пиримидинонов путем алкилирования 6-замещенных-2-тиоурацилов галоидными алкилами в присутствии гидроксида калия в водной [Симон И.Б. Синтез веществ с антитиреоидным действием. III. S-Метил-6-производные тиоурацила / Симон И.Б., Ковтуновская И.И. // Журн. Общ. Химии - 1951. - Т.21, N4 - С.760-764] или водно-спиртовой среде [Навроцкий М.Б. Синтез и изучение фармакологической активности новых производных 6-(арилметил)-4(3H)-пиримидинона // Канд. Дисс. - Пятигорск, 2002].
Недостатком данных методов является низкий выход продуктов алкилирования и узкий спектр производных 6-замещенного 2-(алкилсульфанил)-4(3H)-пиримидинона, которые могут быть получены этими методами.
Общим недостатком методов получения 6-замещенных 2-(алкилсульфанил)-4(3H)-пиримидинонов является необходимость предварительного получения соответствующих 6-замещенных производных 2-тиоурацила, которые, в свою очередь, получаются из β-кетоэфиров, путем конденсации последних с тиомочевиной в среде абсолютного спирта в присутствии алкоксида натрия. Таким образом, процесс усложняется путем включения еще одной стадии синтеза, что снижает выход целевых 6-замещенных производных 2-(алкилсульфанил)-4(3H)-пиримидинона в расчете на исходный β-кетоэфир, а также усложняет процедуры очистки и выделения целевых веществ.
Известен способ получения 6-замещенных 2-(алкилсульфанил)-4(3H)-пиримидинонов путем конденсации гидробромида S-этилизотиомочевины и β-кетоэфира в присутствии водной суспензии карбоната натрия в воде при мольном соотношении S-этилизомочевины гидробромид : карбонат натрия : β-кетоэфир, равных 2:1:2. Реакция проводится в течение 18 часов при комнатной температуре [Renault J. Synthesis and antiviral study of dihydrothieno and thianopyrimidine diones acyclic nucleosides as potential anti-HIV agents / Renault J., Laduree D., Robba M. // Nucleosides Nucleotides - 1994.- Vol.13, N5 - P.1135-1145].
Данный способ, несмотря на свою относительную простоту и экономичность не дает удовлетворительного выхода конечных продуктов в случае β-кетоэфиров, содержащих стерически экранированный карбонил. Кроме того, он описан лишь для получения производных 2-(этилсульфанил)-4(3H)-пиримидинона, а также требует предварительного получения и выделения в чистом виде S-алкилизотиомочевины гидрогалогенидов.
Наиболее близким является способ получения 6-замещенных 2-(алкилсульфанил)-4(3H)-пиримидинонов прямой конденсацией S-метилизотиомочевины гидроиодида и β-кетоэфиров в среде водного гидроксида калия при мольном соотношении S-метилизотиомочевины гидроиодид : гидроксид калия : β-кетоэфир, равных 1:1:1. Реакция проводится в течение 6 часов при комнатной температуре [Симон И.Б. Синтез веществ с антитиреоидным действием. III. S-Метил-6-производные тиоурацила / Симон И.Б., Ковтуновская И.И. // Журн. Общ. Химии - 1951. - Т.21, N4 - С.760-764].
Этот способ не дает удовлетворительного выхода и уровня чистоты конечных продуктов и применим лишь для получения узкого спектра 6-замещенных 2-(метилсульфанил)-4(3H)-пиримидинонов. Так, по данному способу 6-бензил-2-(метилсульфанил)-4(3H)-пиримидинон был получен с выходом 32% и температурой плавления 178-180°С [Симон И.Б. Синтез веществ с антитиреоидным действием. III. S-Метил-6-производные тиоурацила / Симон И.Б., Ковтуновская И.И. // Журн. Общ. Химии - 1951. Т.21, N4 - С.760-764], в то время как чистый продукт имеет температуру плавления 183-184°С [Synthesis and anti-HIV-1 activity of thio analogues of dihydroalkoxybenzyloxopyrimidines / Mai A., Artico M., Sbardella G., et al. // J. Med. Chem. - 1995. Vol.38, N 17 - P.3258-3263].
Недостатком данного способа является необходимость предварительного получения и выделения в чистом виде S-алкилизотиомочевины гидрогалогенидов.
Задачей предлагаемого технического решения является разработка нового технологичного способа получения практически любых 6-замещенных 2-(алкилсульфанил)-4(3H)-пиримидинонов, позволяющего проводить синтез в одну стадию в мягких условиях с использованием дешевых исходных соединений, позволяющего получать 6-замещенные 2-(алкилсульфанил)-4(3H)-пиримидиноны с высоким выходом и высокой степенью чистоты.
Техническим результатом является повышение выхода заявляемых соединений, упрощение процесса получения и выделения конечных продуктов.
Предлагаемый технический результат достигается в способе получения 6-замещенных 2-(алкилсульфанил)-4(3H)-пиримидинонов общей формулы
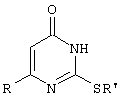
где
R=С6Н5СН2, R’=СН3, СН(СН3)С2Н5, цикло-С5H9, цикло-С6H11,
R=2,6-F2С6Н3СН2, R’=СН3, СH(СН3)C2H5, цикло-С5H9, цикло-С6H11,
R=2,6-Сl2С6Н3СН2, R’=СН3, СH(СН3)C2H5, цикло-С5Н9, цикло-С6H11,
R=1-С10Н7СН2, R’=СН3, СН(СН3)С2Н5, цикло-С5H9, цикло-С6H11,R=Рh2СН, R’=СН3, С2Н5, СH(СН3)С2H5, цикло-С5Н9, цикло-С6H11,
с использованием реакции S-алкилизотиомочевппы гидрогалогенида, в основной среде, c последующим выделением целевого продукта, причем используют S-алкилизотиомочевины гидрогалогенид, выбранный из S-метилизотиомочевины гидроиодида, S-этилизотиомочевины гидробромида, S-втор-бутилизотиомочевины гидробромида, S-циклопентилизотиомочевины гидробромида или S-циклогексилизотиомочевины гидробромида, полученный in situ из тиомочевины и соответствующего галогеналкана или втор-бутанола или циклоалканола в присутствии бромистоводородной кислоты, подвергают взаимодействию в присутствии водного pacтвopa калия карбоната с раствором в этаноле метилового эфира 4-арил-3-оксобутановой кислоты или метилового эфира 4,4-диарил-3-оксобутановой кислоты, выбранных из ряда: метиловый эфир 4-фенил-3-оксобутановой, метиловый эфир 4-(2,6-дифторфенил)-3-оксобутановой, метиловый эфир 4-(2,6-дихлорфенил)-3-оксобутановый, метиловый эфир 4-(1-нафтил)-3-оксобутановой и метиловый эфир 4,4-дифенил-3-оксобутановой кислот, при мольном соотношении метиловый эфир 4-арил-3-оксобутановой кислоты или метиловый эфир 4,4-диарил-3-оксобутановой кислоты : S-алкилизотиомочевины гидрогалогенид : калия карбонат, равном 1:1-3:1-3.
Сущностью предлагаемого способа является конденсация метиловых эфиров 4-арил-3-оксобутановой кислоты или 4,4-диарил-3-оксобутановой кислоты с генерированной in situ S-алкилизотиомочевиной с образованием целевого 6-замещенного производного 2-(aлкилсульфaнил)-4(3H)-пиpидинона:
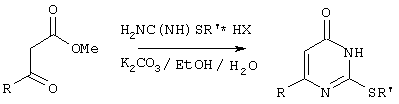
где
R=С6Н5СН2, R’=СН3, СН(СН3)С2Н5, цикло-C5H9 цикло-C6H11,
R=2,6-F2С6Н3СН2, R’=СН3, СH(СН3)C2Н5, цикло-С5Н9, цикло-С6Н11,
R=2,6-Сl2С6Н3СН2, R’=СН3, СН(СН3)С2Н5, цикло-С5H9, цикло-C6H11,
R=1-С10Н7СН2, R’=СН(СН3)С2Н5, цикло-С5H9, цикло-С6H11,
R=Ph2CH, R’=СН3, С2Н5, СН(СН3)С2Н5, цикло-С5H9, цикло-С6H11,
Х=Br, I
Производные S-алкилизотиомочевины, содержащие первичный алкильный фрагмент при атоме серы получаются по реакции соответствующего галогеналкана (иодметана или бромэтана) с тиомочевиной в 95%-ном этаноле [Беккер X. Органикум / Беккер X., Домшке Г., Фангхенель Э. и др.: Пер. с нем. - В 2 т. - М.: Мир, 1992 - Т.2 - 474 с., ил.], которые в заявляемом способе получают непосредственно внутри реактора и используются без дополнительного выделения и очистки:
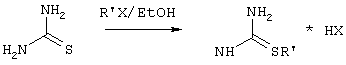
где R’=СН3, С2Н5; Х=Br, I
Производные S-алкилизотиомочеивины, содержащие вторичный алкильный фрагмент при атоме серы получаются по реакции соответствующего втор-алканола (втор-бутанола) или циклоалканола (циклопентанола или циклогексанола) с тиомочевиной в присутствии 48%-ной бромистоводородной кислоты [Frank R.L., Smith P.V. The Preparation of Mercaptans from Alcohols // J. Am. Chem. Soc. - 1946. - Vol.46 - P.2103], которые в заявляемом способе получают непосредственно внутри реактора и используются без дополнительного выделения и очистки:
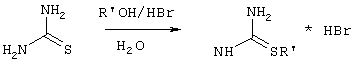
где
R’=СН(СН3)С2Н5, цикло-С5H9, цикло-С6H11
Метиловые эфиры 4-арил-3-оксобутановой кислоты и 4,4-диарил-3-оксобутановой кислоты получаются известным способом [Навроцкий М.Б. Синтез и изучение фармакологической активности новых производных 6-(арилметил)-4(3H)-пиримидинона // Канд. Дисс. - Пятигорск, 2002].
В предлагаемом способе повышение выхода целевых продуктов достигается за счет проведения реакции в гомофазной среде (водно-спиртовой раствор), а также применения в качестве основания калия карбоната, а не калия гидроксида. Известно, что последний в большей степени, чем калия карбонат, способствует разложению производных S-алкилизотиомочевины до соответствующих алкилмеркаптанов и дициандиамида [Вейганд-Хильгетаг. Методы эксперимента в органической химии: Пер. с нем. - М.: Химия, 1968 - 944 с., ил.], снижая тем самым выход целевого 6-замещенного 2-(алкилсульфанил)-4(3H)-пиримидина.
Необходимость применения избытка S-алкилизотиомочевины гидрогалогенида обусловлена невысокой стабильностью свободных S-алкилизотиомочевин и их склонностью к разложению. Таким образом, для достижения наиболее полной конверсии исходного метилового эфира 4-арил-3-оксобутановой кислоты или метилового эфира 4,4-диарил-3-оксобутановой кислоты в целевой 6-замещенный 2-(алкилсульфанил)-4(3H)-пиримидинон необходимо применение неэквимолярного количества S-алкилизотиомочевины гидрогалогенида.
Преимуществом данного способа является возможность получения практически любых 6-замещенных производных 2-(алкилсульфанил)-4(3H)-пиримидинона, многие из которых находят применение как противовирусные лекарственные вещества, в одну стадию с хорошим выходом с использованием доступных реагентов, а также препаративная простота синтеза и легкость выделения чистых продуктов реакции.
Предлагаемый способ осуществляется следующим образом.
Получение 6-замещенных 2-(н-алкилсульфанил)-4(3H)-пиримидинонов.
В реактор, снабженный обратным холодильником и механической мешалкой, помещают 3.81 г (50 ммоль) тиомочевины, 25 мл 95%-ного этанола и 50 ммоль н-галогеналкана. Полученная смесь кипятится при перемешивании 0.5-3 часа и оставляется на 18 часов при комнатной температуре. К реакционной смеси прибавляется раствор калия карбоната (6.91 г, 50 ммоль) в воде (25 мл) и раствор 25 ммоль метилового эфира 4-арил-3-оксобутановой кислоты или 4,4-диарил-3-оксобутановой кислоты в 15 мл 95%-ного этанола. Полученная смесь перемешивается 72-144 часа при комнатной температуре, нейтрализуется 1N раствором соляной кислоты (50 мл) и фильтруется. Осадок на фильтре промывается водой (100 мл) и сушится на воздухе до постоянной массы. После кристаллизации из бензола, 95%-ного этанола или ацетонитрила получается чистый продукт.
Получение 6-замещенных 2-(втор-алкилсульфанил)-4(3H)-пиримидинонов и 6-замещенных 2-(циклоалкилсульфанил)-4(3H)-пиримидинонов.
В реактор, снабженный механической мешалкой, внутренним термометром и обратным холодильником помещают 3.81 грамма (50 ммоль) тиомочевины, 50 ммоль втор-алканола или циклоалканола и 17.15 мл (25.50 грамм, 150 ммоль) 48%-ной бромистоводородной кислоты. Полученная смесь кипятится при перемешивании в течение 9 часов, а затем охлаждается до 0-5°С. К реакционной смеси медленно прибавляется раствор калия карбоната (20.73 грамма, 150 ммоль) в воде (15 мл) и раствор 25 ммоль метил 4-арил-3-оксобутаноата или 4,4-диарил-3-оксобутаноата в 95%-ном этаноле (40 мл). Прибавление проводится таким образом, чтобы внутренняя температура не превышала 20°С.
Полученная смесь интенсивно перемешивается при комнатной температуре в течение 96-144 часа, нейтрализуется IN бромистоводородной кислотой (150 мл) и фильтруется. Осадок на фильтре промывается водой (100 мл), сушится на воздухе до постоянной массы и кристаллизуется из подходящего растворителя.
При выделении продукта в виде масла реакционная масса извлекается этилацетатом (3·50 мл). Органические вытяжки объединяются, промываются насыщенным водным раствором хлорида натрия (50 мл) и осушаются сульфатом магния. После удаления растворителя при пониженном давлении остаток кристаллизуется из подходящего растворителя или очищается колоночной хроматографией (элюент - этанол - хлороформ (1:99-1:95)), а затем кристаллизуется.
Изобретение иллюстрируется следующими примерами
Пример 1
Синтез 6-бензил-2-(метилсульфанил)-4(3H)-пиримидинона
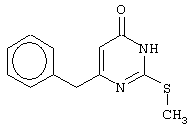
В реактор, снабженный обратным холодильником и механической мешалкой, помещают 3.81 грамма (50 ммоль) тиомочевины, 25 мл 95%-ного этанола и 3.12 мл (7.10 г, 50 ммоль) иодметана. Полученная смесь кипятится при перемешивании 0.5 часа и оставляется на 18 часов при комнатной температуре. К реакционной смеси прибавляется раствор калия карбоната (6.91 г, 50 ммоль) в воде (25 мл) и раствор 4.81 г (25 ммоль) метилового эфира 4-фенил-3-оксобутановой кислоты в 15 мл 95%-ного этанола. Соотношение метиловый эфир 4-фенил-3-оксобутановой кислоты : S-метилизотиомочевины гидроиодид : калия карбонат=1:2:2. Полученная смесь перемешивается 72 часа при комнатной температуре, нейтрализуется 1N раствором соляной кислоты (50 мл) и фильтруется. Осадок на фильтре промывается водой (100 мл) и сушится на воздухе до постоянной массы. После кристаллизации из бензола получается чистый продукт с выходом 4.53 г (78% от теоретического значения). Т. пл.=183-184°С, что соответствует литературным данным [Synthesis and anti-HIV-1 activity of thio analogues of dihydroalkoxybenzyloxopyrimidines / Mai A., Artico M., Sbardella G. et al. // J. Med. Chem. - 1995. - Vol.38, N17 - P.3258-3263].
Пример 2
Синтез 6-бензил-2-(метилсульфанил)-4(3H)-пиримидинона
Проводится аналогично синтезу 1, за исключением мольного соотношения метиловый эфир 4-фенил-3-оксобутановой кислоты : S-метилизотиомочевины гидроиодид : калия карбонат=1:1:1.
Выход 6-бензил-2-(метилсульфанил)-4(3H)-пиримидинона - 40% от теоретического значения.
Пример 3
Синтез 6-бензил-2-(метилсульфанил)-4(3H)-пиримидинона
Проводится аналогично синтезу 1, за исключением мольного соотношения метиловый эфир 4-фенил-3-оксобутановой кислоты : S-метилизотиомочевины гидроиодид : калия карбонат=1:3:3.
Выход 6-бензил-2-(метилсульфанил)-4(3H)-пиримидинона - 78% от теоретического значения.
Пример 4
Синтез 6-(2,6-дифторбензил)-2-(метилсульфанил)-4(3H)-пиримидинона
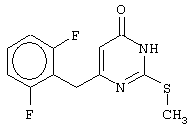
Проводится аналогично синтезу 1, за исключением использования в качестве метилового эфира 4-арил-3-оксобутановой кислоты метилового эфира 4-(2,6-дифторфенил)-3-оксобутановой кислоты. Мольное соотношение метиловый эфир 4-(2,6-дифторфенил)-3-оксобутановой кислоты : S-метилизотиомочевины гидроиодид : калия карбонат=1:2:2.
После кристаллизации из ацетонитрила получается чистый продукт с выходом 82% от теоретического значения. Т. пл.=197-198°С, что соответствует литературным данным [5-Alkyl-2-(alkylthio)-6-(2,6-dihalophenylmethyl)-3,4-dihydropyrimidine-4(3H)-ones: novel potent and selective dihydro-alkoxy-benzyl-oxopyrimidine derivatives / Mai A., Artico M., Sbardella G. et al. // J. Med. Chem. - 1999. - Vol.42, N.4, P.619-627].
Пример 5
Синтез 6-(2,6-дихлорбензил)-2-(метилсульфанил)-4(3H)-пиримидинона
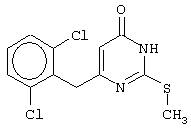
Проводится аналогично синтезу 1, за исключением использования в качестве метилового эфира 4-арил-3-оксобутановой кислоты метилового эфира 4-(2,6-дихлорфенил)-3-оксобутановой кислоты. Мольное соотношение метиловый эфир 4-(2,6-дихлорфенил)-3-оксобутановой кислоты : S-метил-изотиомочевины гидроиодид : калия карбонат=1:2:2.
После кристаллизации из ацетонитрила получается чистый продукт с выходом 74% от теоретического значения. Т.пл.=237-238.5°С, что соответствует литературным данным [5-Alkyl-2-(alkylthio)-6-(2,6-dihalophenylmethyl)-3,4-dihydropyrimidine-4(3H)-ones: novel potent and selective dihydro-alkoxy-benzyl-oxopyrimidine derivatives / Mai A., Artico M., Sbardella G. et al. // J. Med. Chem. - 1999. - Vol.42, N.4, P.619-627].
Пример 6
Синтез 6-бензгидрил-2-(метилсульфанил)-4(3H)-пиримидинона
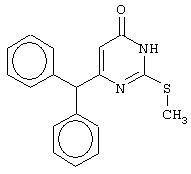
Проводится аналогично синтезу 1, за исключением использования в качестве метилового эфира 4,4-диарил-3-оксобутановой кислоты метилового эфира 4,4-дифенил-3-оксобутановой кислоты и времени конденсации, равного 96 часов. Мольное соотношение метиловый эфир 4,4-дифенил-3-оксобутановой кислоты : S-метилизотиомочевины гидроиодид : калия карбонат=1:2:2.
После кристаллизации из смеси этанола и диметилформамида получается чистый продукт с выходом 79% от теоретического значения. Т.пл.=234.5-236°С, что соответствует литературным данным [Навроцкий М.Б. Синтез и изучение фармакологической активности новых производных 6-(арилметил)-4(3H)-пиримидинона // Канд. Дисс. - Пятигорск, 2002].
Пример 7
Синтез 6-бензгидрил-2-(этилсульфанил)-4(3H)-пиримидинона
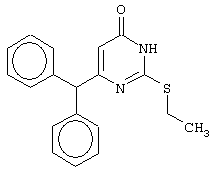
В реактор, снабженный обратным холодильником и механической мешалкой, помещают 3.81 грамма (50 ммоль) тиомочевины, 25 мл 95%-ного этанола и 3.73 мл (5.45 г, 50 ммоль) бромэтана. Полученная смесь кипятится при перемешивании 3 часа и оставляется на 18 часов при комнатной температуре. К реакционной смеси прибавляется раствор калия карбоната (6.91 г, 50 ммоль) в воде (25 мл) и раствор 6.71 г (25 ммоль) метилового эфира 4,4-дифенил-3-оксобутановой кислоты в 15 мл 95%-ного этанола. Мольное соотношение метиловый эфир 4,4-дифенил-3-оксобутановой кислоты : S-этил-изотиомочевины гидробромид : калия карбонат=1:2:2. Полученная смесь перемешивается 144 часа при комнатной температуре, нейтрализуется 1N раствором соляной кислоты (50 мл) и фильтруется. Осадок на фильтре промывается водой (100 мл) и сушится на воздухе до постоянной массы. После кристаллизации из 95%-ного этанола получается чистый продукт с выходом 72% от теоретического значения. Т.пл.=192-194°С, что соответствует литературным данным [Навроцкий М.Б. Синтез и изучение фармакологической активности новых производных 6-(арилметил)-4(3H)-пиримидинона // Канд. Дисс. - Пятигорск, 2002].
Пример 8
Синтез 6-(2,6-дифторбензил)-2-(втор-бутилсульфанил)-4(3H)-пиримидинона
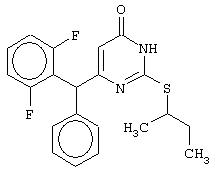
В реактор, снабженный механической мешалкой, внутренним термометром и обратным холодильником помещают 3.81 грамма (50 ммоль) тиомочевины, 4.59 мл (3.71 г, 50 ммоль) втор-бутанола и 17.15 мл (25.50 грамм, 150 ммоль) 48%-ной бромистоводородной кислоты. Полученная смесь кипятится при перемешивании в течение 9 часов, а затем охлаждается до 0-5°С. К реакционной смеси медленно прибавляется раствор калия карбоната (20.73 грамма, 150 ммоль) в воде (15 мл) и раствор 5.70 г (25 ммоль) метил 4-(2,6-дифторфенил)-3-оксобутаноата в 95%-ном этаноле (40 мл). Прибавление проводится таким образом, чтобы внутренняя температура не превышала 20°С. Мольное соотношение метиловый эфир 4-(2,6-дифторфенил)-3-оксобутановой кислоты : S-втор-бутилизотиомочевины гидробромид : калия карбонат=1:2:2.
Полученная смесь интенсивно перемешивается при комнатной температуре в течение 96 часов, нейтрализуется 1N бромистоводородной кислотой (150 мл) и извлекается этилацетатом (3·50 мл). Органические вытяжки объединяются, промываются насыщенным водным раствором хлорида натрия (50 мл) и осушаются сульфатом магния. После удаления растворителя при пониженном давлении остаток кристаллизуется из подходящего растворителя или очищается колоночной хроматографией (элюент - этанол - хлороформ (1:99-1:95)), а затем кристаллизуется из ацетонитрила. В результате получается чистый продукт с выходом 5.55 г (64% от теоретического значения). Т.пл. 149-150°С, что соответствует данным литературы [5-Alkyl-2-(alkylthio)-6-(2,6-dihalophenylmethyl)-3,4-dihydropyrimidine-4(3H)-ones: novel potent and selective dihydro-alkoxy-benzyl-oxopyrimidine derivatives / Mai A., Artico M., Sbardella G. et al. // J. Med. Chem. - 1999. - Vol.42, N.4, P.619-627].
Пример 9
Синтез 6-бензил-2-(втор-бутилсульфанил)-4(3H)-пиримидинона
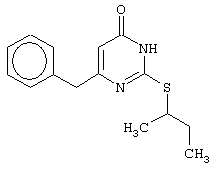
Проводится аналогично синтезу 8, за исключением использования в качестве метилового эфира 4-арил-3-оксобутановой кислоты метилового эфира 4-фенил-3-оксобутановой кислоты. Мольное соотношение метиловый эфир 4-фенил-3-оксобутановой кислоты : S-втор-бутилизотиомочевины гидробромид : калия карбонат=1:2:2.
Получен продукт с выходом 63% от теоретического значения. Т. пл.=100-102°С, что соответствует литературным данным [Synthesis and anti-HIV-1 activity of thio analogues of dihydroalkoxybenzyloxopyrimidines / Mai A., Artico M., Sbardella G. et al. // J. Med. Chem. - 1995. - Vol.38, N17 - P.3258-3263].
Пример 10
Синтез 6-(2,6-дихлорбензил)-2-(втор-бутилсульфанил)-4(3H)-пиримидинона
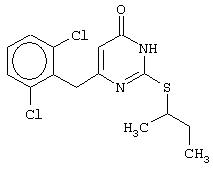
Проводится аналогично синтезу 8, за исключением использования в качестве метилового эфира 4-арил-3-оксобутановой кислоты метилового эфира 4-(2,6-дихлорфенил)-3-оксобутановой кислоты. Мольное соотношение метиловый эфир 4-(2,6-дихлорфенил)-3-оксобутановой кислоты : S-втор-бутилизотиомочевины гидробромид : калия карбонат=1:2:2.
Получен продукт с выходом 55% от теоретического значения. Т.пл.=183-184°С, что соответствует литературным данным [5-Alkyl-2-(alkylthio)-6-(2,6-dihalophenylmethyl)-3,4-dihydropyrimidine-4(3H)-ones: novel potent and selective dihydro-alkoxy-benzyl-oxopyrimidine derivatives / Mai A., Artico M., Sbardella G. et al. // J. Med. Chem. - 1999. - Vol.42, N.4, P.619-627].
Пример 11
Синтез 6-(1-нафтилметил)-2-(втор-бутилсульфанил)-4(3H)-пиримидинона
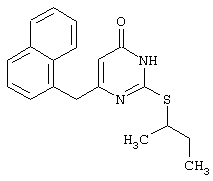
Проводится аналогично синтезу 8, за исключением использования в качестве метилового эфира 4-арил-3-оксобутановой кислоты - метилового эфира 4-(1-нафтил)-3-оксобутановой кислоты. Мольное соотношение метиловый эфир 4-(1-нафтил)-3-оксобутановой кислоты : S-втор-бутилизотиомочевины гидробромид : калия карбонат=1:2:2.
Получен продукт с выходом 49% от теоретического значения. Т.пл.=161-162°С, что соответствует литературным данным [Dihydro(alkylthio)(naphthylmethyl)oxopyrimidines: novel non-nucleoside reverse transcriptase inhibitors of S-DABO series / Mai A., Artico M., Sbardella G. et al. // J. Med. Chem. - 1997. - Vol.40, N10 - P.1447-1454].
Пример 12
Синтез 6-бензгидрил-2-(втор-бутилсульфанил)-4(3H)-пиримидинона
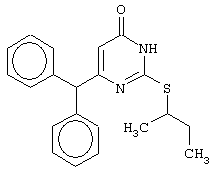
Проводится аналогично синтезу 8, за исключением использования в качестве метилового эфира 4,4-диарил-3-оксобутановой кислоты метилового эфира 4,4-дифенил-3-оксобутановой кислоты и времени конденсации, равного 144 часа. Мольное соотношение метиловый эфир 4,4-дифенил-3-оксобутановой кислоты : S-втор-бутилизотиомочевины гидроиодид : калия карбонат=1:2:2.
Получен продукт с выходом 42% от теоретического значения. Т.пл.=154.5-156.5°С, что соответствует литературным данным [Навроцкий М.Б. Синтез и изучение фармакологической активности новых производных 6-(арилметил)-4(3H)-пиримидинона // Канд. Дисс. - Пятигорск, 2002].
Пример 13
Синтез 6-(2,6-дихлорбензил)-2-(циклопентилсульфанил)-4(3H)-пиримидинона
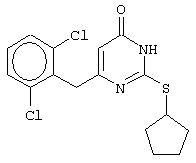
В реактор, снабженный механической мешалкой, внутренним термометром и обратным холодильником помещают 3.81 грамма (50 ммоль) тиомочевины, 4.54 мл (4.31 г, 50 ммоль) циклопентанола и 17.15 мл (25.50 грамм, 150 ммоль) 48%-ной бромистоводородной кислоты. Полученная смесь кипятится при перемешивании в течение 9 часов, а затем охлаждается до 0-5°С. К реакционной смеси медленно прибавляется раствор калия карбоната (20.73 грамма, 150 ммоль) в воде (15 мл) и раствор 6.53 г (25 ммоль) метил 4-(2,6-дихлорфенил)-3-оксобутаноата в 95%-ном этаноле (40 мл). Прибавление проводится таким образом, чтобы внутренняя температура не превышала 20°С. Мольное соотношение метиловый эфир 4-(2,6-дихлорфенил)-3-оксобутановой кислоты : S-циклопентилизотиомочевины гидробромид : калия карбонат=1:2:2.
Полученная смесь интенсивно перемешивается при комнатной температуре в течение 96 часов, нейтрализуется 1N бромистоводородной кислотой (150 мл) и извлекается этилацетатом (3·50 мл). Органические вытяжки объединяются, промываются насыщенным водным раствором хлорида натрия (50 мл) и осушаются сульфатом магния. После удаления растворителя при пониженном давлении остаток кристаллизуется из подходящего растворителя или очищается колоночной хроматографией (элюент - этанол - хлороформ (1:99-1:95)), а затем кристаллизуется из ацетонитрила. В результате получается чистый продукт с выходом 5.06 г (57% от теоретического значения). Т.пл. 185-186°С, что соответствует литературным данным [5-Alkyl-2-(alkylthio)-6-(2,6-dihalophenylmethyl)-3,4-dihydropyrimidine-4(3H)-ones: novel potent and selective dihydro-alkoxy-benzyl-oxopyrimidine derivatives / Mai A., Artico M., Sbardella G. et al. // J. Med. Chem. - 1999. - Vol.42, N.4, P.619-627].
Пример 14
Синтез 6-бензил-2-(циклопентилсульфанил)-4(3H)-пиримидинона
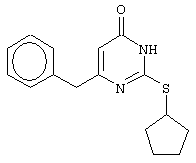
Проводится аналогично синтезу 12, за исключением использования в качестве метилового эфира 4-арил-3-оксобутановой кислоты метилового эфира 4-фенил-3-оксобутановой кислоты. Мольное соотношение метиловый эфир 4-фенил-3-оксобутановой кислоты : S-циклопентилизотиомочевины гидробромид : калия карбонат=1:2:2.
Получен продукт с выходом 66% от теоретического значения. Т.пл.=147-148°С, что соответствует литературным данным [Synthesis and anti-HIV-1 activity of thio analogues of dihydroalkoxybenzyloxopyrimidines / Mai A., Artico M., Sbardella G. et al. // J. Med. Chem. - 1995. - Vol.38, N17 - P.3258-3263].
Пример 15
Синтез 6-(2,6-дифторбензил)-2-(циклопентилсульфанил)-4(3H)-пиримидинона
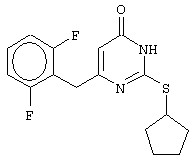
Проводится аналогично синтезу 12, за исключением использования в качестве метилового эфира 4-арил-3-оксобутановой кислоты - метилового эфира 4-(2,6-дифторфенил)-3-оксобутановой кислоты.
Мольное соотношение метиловый эфир 4-(2,6-дифторфенил)-3-оксобутановой кислоты : S-циклопентилизотиомочевины гидроиодид : калия карбонат=1:2:2.
Получен чистый продукт с выходом 66% от теоретического значения. Т.пл.=168-169°С, что соответствует литературным данным [5-Alkyl-2-(alkylthio)-6-(2,6-dihalophenylmethyl)-3,4-dihydropyrimidine-4(3H)-ones: novel potent and selective dihydro-alkoxy-benzyl-oxopyrimidine derivatives / Mai A., Artico M., Sbardella G. et al. // J. Med. Chem. - 1999. - Vol.42, N.4, P.619-627].
Пример 16
Синтез 6-(1-нафтилметил)-2-(циклопентилсульфанил)-4(3H)-пиримидинона
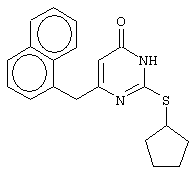
Проводится аналогично синтезу 12, за исключением использования в качестве метилового эфира 4-арил-3-оксобутановой кислоты - метилового эфира 4-(1-нафтил)-3-оксобутановой кислоты. Мольное соотношение метиловый эфир 4-(1-нафтил)-3-оксобутановой кислоты : S-циклопентилизотиомочевины гидробромид : калия карбонат=1:2:2.
Получен продукт с выходом 43%. Т.пл.=172-173°С, что соответствует литературным данным [Dihydro(alkylthio)(naphthylmethyl)oxopyrimidines: novel non-nucleoside reverse transcriptase inhibitors of S-DABO series / Mai A., Artico M., Sbardella G. et al. // J. Med. Chem. - 1997. - Vol.40, N10 - P.1447-1454].
Пример 17
Синтез 6-бензгидрил-2-(циклопентилсульфанил)-4(3H)-пиримидинона
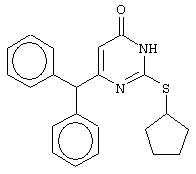
Проводится аналогично синтезу 12, за исключением использования в качестве метилового эфира 4,4-диарил-3-оксобутановой кислоты - метилового эфира 4,4-дифенил-3-оксобутановой кислоты и времени проведения конденсации - 144 часа. Мольное соотношение метиловый эфир 4,4-дифенил-3-оксобутановой кислоты : S-циклопентилизотиомочевины гидробромид : калия карбонат=1:2:2.
Получен чистый продукт с выходом 40%. Т.пл.=195-196.5°С, что соответствует литературным данным [Навроцкий М.Б. Синтез и изучение фармакологической активности новых производных 6-(арилметил)-4(3H)-пиримидинона // Канд. Дисс. - Пятигорск, 2002].
Пример 18
Синтез 6-(1-нафтилметил)-2-(циклогексилсульфанил)-4(3H)-пиримидинона
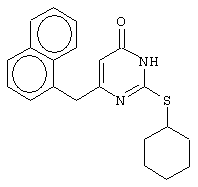
В реактор, снабженный механической мешалкой, внутренним термометром и обратным холодильником помещают 3.81 грамма (50 ммоль) тиомочевины, 5.27 мл (5.01 г, 50 ммоль) циклогексанола и 17.15 мл (25.50 грамм, 150 ммоль) 48%-ной бромистоводородной кислоты. Полученная смесь кипятится при перемешивании в течение 9 часов, а затем охлаждается до 0-5°С. К реакционной смеси медленно прибавляется раствор калия карбоната (20.73 грамма, 150 ммоль) в воде (15 мл) и раствор 6.06 г (25 ммоль) метил 4-(1-нафтил)-3-оксобутаноата в 95%-ном этаноле (40 мл). Прибавление проводится таким образом, чтобы внутренняя температура не превышала 20°С. Мольное соотношение метил 4-(1-нафтил)-3-оксобутановой кислоты : S-циклогексилизотиомочевины гидробромид : калия карбонат=1:2:2.
Полученная смесь интенсивно перемешивается при комнатной температуре в течение 120 часов, нейтрализуется 1N бромистоводородной кислотой (150 мл) и извлекается этилацетатом (3·50 мл). Органические вытяжки объединяются, промываются насыщенным водным раствором хлорида натрия (50 мл) и осушаются сульфатом магния. После удаления растворителя при пониженном давлении остаток кристаллизуется из подходящего растворителя или очищается колоночной хроматографией (элюент - этанол - хлороформ (1:99-1:95)), а затем кристаллизуется из этилацетата. В результате получается чистый продукт с выходом 2.10 г (24% от теоретического значения). Т.пл. 175-176°С, что соответствует литературным данным [Dihydro(alkylthio)(naphthylmethyl)oxopyrimidines: novel non-nucleoside reverse transcriptase inhibitors of S-DABO series / Mat A., Artico M., Sbardella G. et al. // J. Med. Chem. - 1997. - Vol.40, N10 - P.1447-1454].
Пример 19
Синтез 6-бензил-2-(циклогексилсульфанил)-4(3H)-пиримидинона
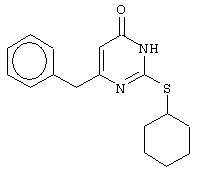
Проводится аналогично синтезу 18, за исключением применения в качестве метилового эфира 4-арил-3-оксобутановой кислоты метилового эфира 4-фенил-3-оксобутановой кислоты. Мольное соотношение метиловый эфир 4-фенил-3-оксобутановой кислоты : S-циклогексилизотиомочевины гидробромид : калия карбонат=1:2:2.
После кристаллизации из ацетонитрила получен чистый продукт с выходом 31% от теоретического значения. Т.пл.=172-173°С, что соответствует литературным данным [Synthesis and anti-HIV-1 activity of thio analogues of dihydroalkoxybenzyloxopyrimidines / Mai A., Artico M., Sbardella G. et al. // J. Med. Chem. - 1995. - Vol.38, N17 - P.3258-3263].
Пример 20
Синтез 6-(2,6-дифторбензил)-2-(циклогексилсульфанил)-4(3H)-пиримидинона
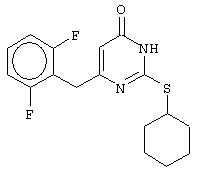
Проводится аналогично синтезу 18, за исключением применения в качестве метилового эфира 4-арил-3-оксобутановой кислоты - метилового эфира 4-(2,6-дифторфенил)-3-оксобутановой кислоты. Мольное соотношение метиловый эфир 4-(2,6-дифторфенил)-3-оксобутановой кислоты: S-циклогексилизотиомочевины гидробромид: калия карбонат=1:2:2.
Получен чистый продукт с выходом 27% от теоретического значения. Т.пл.=164-165°С, что соответствует литературным данным [5-Alkyl-2-(alkylthio)-6-(2,6-dihalophenylmethyl)-3,4-dihydropyrimidine-4(3H)-ones: novel potent and selective dihydro-alkoxy-benzyl-oxopyrimidine derivatives / Mai A., Artico M., Sbardella G. et al. // J. Med. Chem. - 1999. - Vol.42, N.4, P.619-627].
Пример 21
Синтез 6-(2,6-дихлорбензил)-2-(циклогексилсульфанил)-4(3H)-пиримидинона
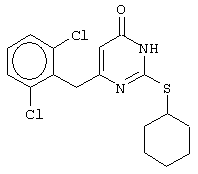
Проводится аналогично синтезу 18, за исключением использования в качестве метилового эфира 4-арил-3-оксобутановой кислоты метилового эфира 4-(2,6-дихлорфенил)-3-оксобутановой кислоты. Мольное соотношение метиловый эфир 4-(2,6-дихлорфенил)-3-оксобутановой кислоты : S-цикло-гексилизотиомочевины гидробромид : калия карбонат=1:2:2.
Получен чистый продукт с выходом 25% от теоретического значения. Т.пл.=200-201°С, что соответствует литературным данным [5-Alkyl-2-(alkylthio)-6-(2,6-dihalophenylmethyl)-3,4-dihydropyrimidine-4(3H)-ones: novel potent and selective dihydro-alkoxy-benzyl-oxopyrimidine derivatives / Mai A., Artico M., Sbardella G. et al. // J. Med. Chem. - 1999. - Vol.42, N.4, P.619-627].
Пример 22
Синтез 6-бензгидрил-2-(циклогексилсульфанил)-4(3H)-пиримидинона
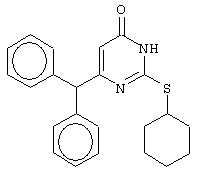
Проводится аналогично синтезу 18, за исключением использования в качестве метилового эфира 4,4-диарил-3-оксобутановой кислоты метилового эфира 4,4-дифенил-3-оксобутановой кислоты и времени конденсации, равного 144 часа. Мольное соотношение метиловый эфир 4,4-дифенил-3-оксобутановой кислоты : S-циклогексилизотиомочевины гидробромид : калия карбонат=1:2:2.
Получен чистый продукт с выходом 20% от теоретического значения. Т.пл.=186.5-188.5°С, что соответствует литературным данным [Навроцкий М.Б. Синтез и изучение фармакологической активности новых производных 6-(арилметил)-4(ЗH)-пиримидинона // Канд. Дисс. - Пятигорск, 2002].
Как следует из представленных примеров, предложенный нами способ получения 6-замещенных производных 2-(алкилсульфанил)-4(3H)-пиримидинона является технологичным, позволяет получать широкий спектр указанных соединений с хорошим выходом и высокой чистотой.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЭТИЛОВЫХ ЭФИРОВ 2-АЛКИЛ-4-АРИЛ-3-ОКСОБУТАНОВЫХ КИСЛОТ | 2009 |
|
RU2412154C1 |
| Способ получения 2-алкокси-6-[1-(2,6-дифторфенил)циклопропил]-5-метилпиримидин-4(3Н)-она | 2017 |
|
RU2654067C1 |
| Способ получения производных N-алкил- и N,N-диалкилизоцитозина | 2017 |
|
RU2664121C1 |
| Способ получения α-диазокарбонильных соединений в водной среде | 2018 |
|
RU2686489C1 |
| ПРОИЗВОДНЫЕ 1,2,3,4-ТЕТРАГИДРОНАФТАЛИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ И СПОСОБ ЛЕЧЕНИЯ | 1998 |
|
RU2194696C2 |
| СПОСОБ ПОЛУЧЕНИЯ СЛОЖНЫХ ЭФИРОВ L-КАРНОЗИНА И ИХ СОЛЕЙ | 2001 |
|
RU2188204C1 |
| ПРОИЗВОДНЫЕ 8-ХИНОЛИНКСАНТИНА И 8-ИЗОХИНОЛИНКСАНТИНА В КАЧЕСТВЕ ИНГИБИТОРОВ ФОСФОЭСТЕРАЗЫ PDE 5 | 2001 |
|
RU2269529C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЭТИЛОВОГО ЭФИРА 2-МЕТИЛ-3-ОКСО-4-(2,6-ДИФТОРФЕНИЛ)ПЕНТАНОВОЙ КИСЛОТЫ | 2012 |
|
RU2490252C1 |
| СОЕДИНЕНИЯ И СПОСОБ СНИЖЕНИЯ МОЧЕВОЙ КИСЛОТЫ | 2009 |
|
RU2501554C2 |
| ПРОИЗВОДНЫЕ БОРОНОВОЙ КИСЛОТЫ | 2015 |
|
RU2717558C2 |
Изобретение относится к способу получения 6-замещенных производных 2-(алкилсульфанил)-4(3H)-пиримидинона общей формулы (I), которые находят применение как полупродукты для синтеза лекарственных препаратов и как самостоятельные лекарственные препараты. В соединениях формулы (I)
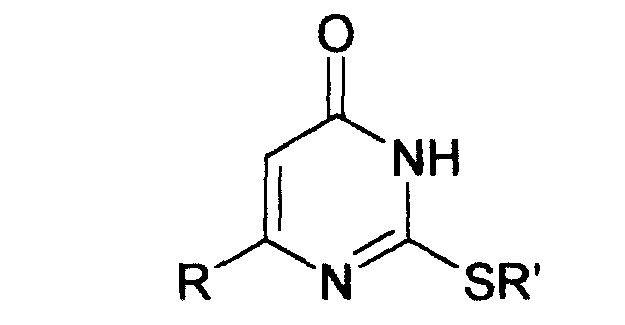
R=С6Н5СН2, R’=СН3, СН(СН3)С2Н5, цикло-С5H9, цикло-C6H11,
R=2,6-F2С6Н3СН2, R’=СН3, СН(СН3)С2Н5, цикло-С5H9, цикло-C6H11,
R=2,6-Cl2С6Н3СН2, R’=СН3, СН(СН3)С2Н5, цикло-С5H9, цикло-C6H11,
R=1-С10Н7СН2, R’=СН3, СН(СН3)С2Н5, цикло-С5H9, цикло-C6H11,
R=Ph2CH, R’=СН3, С2Н5, СН(СН3)С2Н5, цикло-С5H9, цикло-C6H11.
Способ заключается в том, что S-алкилизотиомочевины гидрогалогенид, выбранный из группы: S-метилизотиомочевины гидроиодид, S-этилизотиомочевины гидробромид, S-втор-бутилизотиомочевины гидробромид, S-цикло-пентилизотиомочевины гидробромид или S-циклогексилизотиомочевины гидробромид, полученный непосредственно внутри реактора (in situ) из тиомочевины и соответствующего галогеналкана или втор-бутанола или циклоалканола в присутствии бромистоводородной кислоты, подвергают взаимодействию в присутствии водного раствора калия карбоната с раствором в этаноле метилового эфира 4-арил-3-оксобутановой кислоты или метилового эфира 4,4-диарил-3-оксобутановой кислоты, выбранных из ряда: метиловый эфир 4-фенил-3-оксобутановой, метиловый эфир 4-(2,6-дифторфенил)-3-оксобутановой, метиловый эфир 4-(2,6-дихлорфенил)-3-оксобутановой, метиловый эфир 4-(1-нафтил)-3-оксобутановой и метиловый эфир 4,4-дифенил-3-оксобутановой кислот, при мольном соотношении метиловый эфир 4-арил-3-оксобутановой кислоты или метиловый эфир 4,4-диарил-3-оксобутановой кислоты : S-алкилизотиомочевины гидрогалогенид : калия карбонат, равном 1:1-3:1-3, с последующим выделением целевого продукта. Техническим результатом является повышение выхода заявляемых соединений, упрощение процесса получения и выделения конечных продуктов.
Способ получения 6-замещенных 2-(алкилсульфанил)-4(3H)-пиримидинонов общей формулы
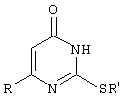
где R - С6Н5СН2, R’ - СН3,СН(СН3)С2Н5, цикло-С5H9, цикло-С6H11;
R - 2,6-F2С6Н3СН2, R’ - СН3,СH(СН3)C2Н5, цикло-С5H9, цикло-С6H11;
R - 2,6-Сl2С6Н3СН2, R’ - СН3,СН(СН3)С2Н5, цикло-С5H9, цикло-С6H11;
R - 1-С10Н7СН2, R’ - СН3,СН(СН3)С2Н5, цикло-С5H9, цикло-C6H11,
R - Ph2CH,R’ - СН3,С2Н5,СН(СН3)С2Н5, цикло-С5H9, цикло-C6H11,
с использованием реакции S-алкилизотиомочевины гидрогалогенида в основной среде с последующим выделением целевого продукта, отличающийся тем, что используют S-алкилизотиомочевины гидрогалогенид, выбранный из S-метилизотиомочевины гидроиодида, S-этилизотиомочевины гидробромида, S-втор-бутилизотиомочевины гидробромида, S-циклопентилизотиомочевины гидробромида или S-циклогексилизотиомочевины гидробромида, полученный in situ из тиомочевины и соответствующего галогеналкана, или втор-бутанола, или циклоалканола в присутствии бромистоводородной кислоты, который подвергают взаимодействию в присутствии водного раствора калия карбоната с раствором в этаноле метилового эфира 4-арил-3-оксобутановой кислоты или метилового эфира 4,4-диарил-3-оксобутановой кислоты, выбранных из ряда метиловый эфир 4-фенил-3-оксобутановой, метиловый эфир 4-(2,6-дифторфенил)-3-оксобутановой, метиловый эфир 4-(2,6-дихлорфенил)-3-оксобутановой, метиловый эфир 4-(1-нафтил)-3-оксобутановой и метиловый эфир 4,4-дифенил-3-оксобутановой кислот, при мольном соотношении метиловый эфир 4-арил-3-оксобутановой кислоты или метиловый эфир 4,4-диарил-3-оксобутановой кислоты: S-алкилизотиомочевины гидрогалогенид: калия карбонат равном 1:1-3:1-3.
| СИМОН и др | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Журнал общей химии | |||
| Приспособление к пишущей машине для назначения и указания последней строки страницы | 1925 |
|
SU1951A1 |
| 0 |
|
SU167204A1 | |
| Synthesis and antiviral study of dihydrothieno and thianopyrimidine diones acyclic nucleosides as potential anti-HIV agents | |||
| Nucleosides Nucleotides | |||
| Прибор для охлаждения жидкостей в зимнее время | 1921 |
|
SU1994A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| J.of Medicinal Chemistry (Rome, IT) - 1999, 42(4), 619-627 (English).CA ACS on STN, 123:285888: MAI ANTONELLO et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| J.of Medicinal Chemistry (Rome, IT) | |||
| Топка с качающимися колосниковыми элементами | 1921 |
|
SU1995A1 |
Авторы
Даты
2004-10-20—Публикация
2003-04-21—Подача