Изобретение относится к новым производным пиперидил- или пиперазинил-замещенного 1,2,3,4-тетрагидронафталина, в виде их (R)-энантиомеров, (S)-энантиомеров или рацематов, в форме их свободного основания или фармацевтически приемлемой соли, к способу их получения, к фармацевтическим композициям, содержащим названные терапевтически активные соединения, и к применению названных активных соединений в терапии.
Целью изобретения является создание соединений для лечебных целей, в особенности соединений, обладающих избирательным воздействием на подгруппу 5-гидрокси-триптаминовых рецепторов, обозначаемых как h5-HT1βрецептор (ранее называвшихся 5-HT1Dβрецептор), у млекопитающих, включая человека.
Также целью изобретения является создание соединений, обладающих терапевтическим эффектом после перорального применения.
Уровень техники
Различные классы пиперазинилзамещенных производных бензанилида, таких как антагонисты 5-HT1D, раскрыты, inter alia в Европейском патенте 533266, ЕП 533267, ЕР 533268, GB 227930 и WO 95/11243.
WO 94/13659 раскрывает очень широкий класс конденсированных бензосоединений, имеющих пара-замещенный пиперидильный или пиперазинильный радикал в ароматическом кольце, причем утверждается, что названный класс соединений связывается с 5-НТ1А-рецептором.
WO 94/21619 раскрывает полностью ароматическую кольцевую систему нафталина, которая может быть замещена пиперидильной или пиперазинильной группой, причем утверждается, что названные соединения также являются возможными агонистами и антагонистами серогонина (5HT1)
ЕР 402923 раскрывает 2-аминоалкильные или алкиленароматические производные 1,2,3,4-гефагидронафталина, имеющие дополнительный азотный заместитель по 5 положению в тетралиновом кольце, причем названные соединения действуют как антагонисты допамина.
Обоснование изобретения
Оказалось, что различные заболевания центральной нервной системы, такие как депрессия, тревога и другие, включают нарушение нейротрансмиттеров норадреналина (NA) и 5-гидрокситриптамина (5-НТ), причем последний также известен как серотонин. Полагают, что лекарственные средства, наиболее часто применявшиеся в лечении депрессии, действуют путем улучшения нейротрансмиссии каждого или обоих из этих физиологических агонистов. Оказалось, что повышение 5-НТ нейротрансмиссии прежде всего влияет на депрессивное настроение и тревогу, тогда как повышение норадреналиновой нейротрансмиссии влияет на симптомы олигофрении (аменцию), возникающие у пациентов в состоянии депрессии. Изобретение касается соединений, которые воздействуют на 5-НТ нейротрансмиссию.
Считается что активность серотонина, или 5-НТ, вовлечена в различные виды психиатрических нарушений. Например, считается, что повышение активности 5-НТ связано с тревогой, в то время как снижение высвобождения 5-НТ связано с депрессией. Кроме того, серотонин вовлечен в такие болезненные состояния, как нарушения питания, желудочно-кишечные заболевания, сердечно-сосудистая регуляция и нарушения сексуального поведения.
5-НТ рецепторы
Различные эффекты 5-НТ могут быть связаны с тем фактом, что серотонергические нейроны стимулируют секрецию нескольких гормонов, например кортизола, пролактина, β-эндорфина, вазопрессина и других. Оказывается, секреция каждого из этих гормонов регулируется специфически несколькими различными 5-НТ (серотониновыми) подтипами рецепторов. Благодаря методикам молекулярной биологии к настоящему времени эти рецепторы классифицированы, как 5-HT1, 5-НТ2, 5-НТ3, 5-НТ4, 5-HT5, 5-НТ6 и 5-НТ7, причем рецептор 5-HT1 в свою очередь подразделяется на 5-HT1A, 5-HT1B, 5-НТ1D, 5-НТ1E и 5-HT1F подтипы. Каждый подтип рецептора включается в различные серотониновые функции и обладает различными свойствами.
Регуляция 5-НТ трансмиссии
Высвобождение 5-НТ в нервных окончаниях регулируется по принципу обратной связи двумя различными подтипами 5-НТ рецепторов. Ингибиторные 5-HT1A ауторецепторы расположены на клеточных телах в ядрах шва (головного мозга), которые при стимуляции 5-НТ снижают импульс распространения в 5-НТ нейронах, снижая таким образом высвобождение 5-НТ в нервных окончаниях. Другим подтипом ингибиторного 5-НТ рецептора, расположенного в 5-НТ нервных окончаниях, являются h5-HP1B рецепторы (у грызунов r5-HT1B рецепторы), которые регулируют синаптическую концентрацию 5-НТ, путем контролирования количества высвобождающегося 5-НТ. Антагонист этого терминального ауторецептора, таким образом, увеличивает количество 5-НТ, высвобожденного при нервном импульсе, что показано как в экспериментах in vitro, так и in vivo.
Использование антагониста терминального h5-HT1B рецептора будет соответственно повышать синаптическую концентрацию 5-НТ и повышать трансмиссию в 5-НТ системе. Таким образом осуществляется антидепрессивный эффект, что делает его пригодным для лечения депрессии.
Также существует другая локализация рецепторов подтипа h5-HT1B Оказалось, что большая часть этих постсинаптических рецепторов расположена в нервных окончаниях другой системы нейронов (так называемых гетерорецепторов). Так как h5-HT1B рецептор опосредует ингибиторные ответы, антагонист этого рецепторного подтипа, может также повышать высвобождение других нейротрансмиттеров, отличных от 5-НТ.
Соединения, имеющие h5-HT1B активность могут в соответствии с хорошо известными и признанными фармакологическими тестами быть разделены на полные агонисты, частичные агонисты и антагонисты.
Раскрытие изобретения
Целью настоящего изобретения является создание соединений, обладающих выборочным воздействием на h5-HT1B рецепторы, предпочтительно обладающих антагонистическими свойствами, а также имеющими хорошую биодоступность. Исследовано воздействие и на другие рецепторы, выбранные из 5-HT1A, 5-HT2A, D1, D2A, D3, α1 и α2 рецептора.
Соответственно, настоящим изобретением предлагаются соединения формулы I,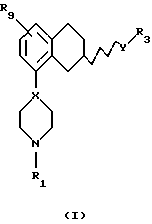
где Х представляет собой N или СН;
Y представляет собой NR2CH2, CH2-NR2, NR2-CO, CO-NR2, или NR2SO2,
где R2 представляет собой Н, C1-C6-алкил;
R1 представляет собой Н, C1-C6-алкил, С3-C6-циклоалкил;
R3 представляет собой C1-C6-алкил, С3-C6-циклоалкил или (СН2)n-арил,
где арил представляет собой фенил или гетероциклическое кольцо, содержащее один или два гетероатома, выбранных из N или О и S, и которые могут быть одно- или двузамещенными R4 и/или R5;
где R4 представляет собой Н, C1-C6-алкил, С3-C6-циклоалкил, галоген, CN, СF3, ОН, C1-C6-алкокси, NR6R7, ОСF3, SО3СН3, SО3СF3, SO2NR6R7, фенил, фенил-C1-C6-алкил, фенокси, C1-C6-алкилфенил, необязательно замещенное гетероциклическое кольцо, содержащее один или два гетероатома, выбранных из N, О, S, SO и SО2, где заместитель(и) выбран(ы) из C1-C6-алкила, С3-C6-циклоалкила и фенил-С1-C6-алкила, необязательно замещенного гетероциклического кольца, содержащего один или два гетероатома, выбранных из N или О и S, где заместитель(ли) выбран(ы) из C1-C6-алкила, С3-C6-циклоалкила и фенил-С1-C6-алкила или COR8;
где R6 представляет собой C1-C6-алкил или С3-C6-циклоалкил;
R7 представляет собой Н, C1-C6-алкил или С3-C6-циклоалкил; и
R8 представляет собой C1-C6-алкил, С3-C6-циклоалкил, СF3, NR6R7, фенил, гетероароматическое кольцо, содержащее один или большее количество гетероатомов, выбранных из N, О и S, или гетероциклическое кольцо, содержащее один или большее количество гетероатомов, выбранных из N, О, S, SO и SO2;
где R5 представляет собой Н, ОН, СF3, ОСF3, галоген, C1-C6-алкил или C1-C6-алкокси;
n представляет собой 0-4;
R9 представляет собой C1-C6-алкил, С3-C6-циклоалкил, ОСF3, OCHF3, OCH2F, галоген, CN, СF3, ОН, С1-C6-алкокси, C1-C6-алкокси-С1-C6-алкил, NR6R7, SО3СН3, SО3СF3, SО2NR6R7, незамещенное или замещенное гетероциклическое или гетероароматическое кольцо, содержащее один или два гетероатома, выбранных из N, О и S, где заместитель(ли) представляет(ют) собой C1-C6-алкил; или COR8; где R6, R7 и R8 такие, как определено выше,
в виде (R)-энантиомеров, (S)-энантиомеров или рацематов в форме свободного основания или их фармацевтически приемлемой соли или сольвата, которые обладают высоким избирательным воздействием на h5-НТ1В рецепторы, и также проявляют достаточную биодоступность при пероральном применении.
В контексте настоящего изобретения C1-C6-алкил может быть с прямой или разветвленной цепью. C1-C6-алкил может представлять собой метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, втор-бутил, трет-бутил, н-пентил, изо-пентил, трет-пентил, нео-пентил, н-гексил или изо-гексил.
В контексте настоящего изобретения C1-C6-алкокси может быть с прямой или разветвленной цепью. C1-C6-алкил может представлять собой метокси, этокси, н-пропокси, изо-пропокси, н-бутокси, изо-бутокси, втор-бутокси, трет-бутокси, н-пентилокси, изо-пентилокси, трет-пентилокси, нео-пентилокси, н-гексилокси или изо-гексилокси.
В контексте настоящего изобретения С3-C6-циклоалкил может представлять собой циклопропил, циклобутил, циклопентил или циклогексил.
В контексте настоящего изобретения галоген может представлять собой фтор, хлор, бром или йод.
В контексте настоящего изобретения гетероароматическое кольцо; содержащее один или два гетероатома, выбранных из N, О и S, предпочтительно представляет собой 5-или 6-членное гетероароматическое кольцо, и может представлять собой фурил, имидазол, изоксазол, изотиазол, оксазолил, пиразинил, пиразолил, пиридазинил, пиридил, пиримидил, пирролил, тиазолил или тиенил. Гетероароматическое кольцо может быть как замещенным, так и незамещенным.
В контексте настоящего изобретения гетероциклическое кольцо, содержащее один или два гетероатома, выбранных из N, О, S, SO и SО2, необязательно содержит карбонильную функциональную группу и предпочтительно представляет собой 5- 6- или 7-членное гетероциклическое кольцо, и может представлять-, имидазолидинил, имидазолинил, морфолинил, пиперазинил, пиперидил, пиперидонил, пиразолидинил, пиразолинил, пирролидинил, пирролинил, тетрагидропиранил, тиоморфолинил, предпочтительно пиперидино, 1-пиперазинил, морфолино, тио-морфолино и 4-пиперидон-1-ил.
Предпочтительное воплощение изобретения относится к соединениям формулы I, где Y представляет собой NHCO или CONH, то есть амиды. Из этих соединений предпочтительными являются такие соединения, в которых R9 представляет собой C1-C6-алкил, C1-C6-алкокси, OCHF2 или OCH2F, и R3 представляет собой незамещенный фенил или моно- или ди-замещенный фенил, и в частности орто-, мета- или пара-замещенный фенил, и в частности те, в которых R4 представляет собой фенил, фенил-C1-C6-алкил, циклогексил, пиперидино, 1-пиперазино, морфолино, СF3, 4-пиперидон-1-ил, н-бутокси или COR8, где R8 представляет собой фенил, циклогексил, 4-пиперидон-1-ил, 1-пиперазинил, морфолино, СF3, пиперидино или NR6R7.
Примеры сочетаний заместителей следующие:
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R9 представляет собой СН3, C2H5 или С3Н7;
Х представляет собой СН, Y представляет собой CONR2, R представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой фенил, фенилметил или фенилэтил, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой СН, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет собой пиперидино, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН3, C2H5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R4 представляет собой пиперидино, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, C2H5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)-фенил, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R4 представляет собой морфолино, R5 представляет собой Н, R9 представляет собой СН3, C2H5 или С3Н7;
Х представляет собой СН, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой морфолино, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой СН, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R4 представляет собой пиперидино, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет собой фенил, фенилметил или фенилэтил, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (CH2)2-фенил, R4 представляет собой пиперидино, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой СН, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой пиперидино, R5 представляет собой Н, R8 представляет собой ОСН3;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, C2H5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой COR8, R8 представляет собой циклогексил, R9 представляет собой, СН3, C2H5 или С3Н7;
Х представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН3, C2H5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет собой морфолино, R5 представляет собой Н, R9 представляет собой ОСН3;
X представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН2, C2H5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R9 представляет собой СН2, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R4 представляет собой пиперидино, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой пиперидино, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, C2H5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой фенил, фенилметил или фенилэтил, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, C2H5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет собой морфолино, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН3, C2H5 или С3Н7, R2 представляет собой Н, R2 представляет собой (СН2)2-фенил, R4 представляет собой фенил, фенилметил или фенилэтил, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, C2H5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой морфолино, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2 -фенил, R4 представляет собой пиперидино, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, C2H5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой фенил, фенилметил или фенилэтил, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой СН, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой морфолино, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой пиперидино, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет собой морфолино, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R9 представляет собой (СН2)2-фенил, R4 представляет собой морфолино, R5 представляет собой Н, R3 представляет собой ОСН3;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R4 представляет собой пиперидино, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R4 представляет собой фенил, фенилметил или фенилэтил, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R4 представляет собой фенил, фенилметил или фенилэтил, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой фенил, фенилметил или фенилэтил, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет собой пиперидино, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет собой пиперидино, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой COR8, R8 представляет собой морфолино, R9 представляет собой ОСН3;
Х представляет собой СН, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (CH2)2-фенил, R4 представляет собой морфолино, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R4 представляет собой морфолино, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой СН, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет собой фенил, фенилметил или фенилэтил, R5 представляет собой H, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой COR8, R8 представляет собой морфолино, R9 представляет собой ОСН3;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R9 представляет собой ОСН3;
Х представляет собой СН, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R4 представляет собой фенил, фенилметил или фенилэтил, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет собой фенил, фенилметил или фенилэтил, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой пиперидино, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой СН, представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой COR8, R8 представляет собой циклогексил, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R9 представляет собой ОСН3;
Х представляет собой СН, представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет собой COR8, R8 представляет собой NR6R7, R6R7СН3, С2Н5 или С3Н7, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R9 представляет собой ОСН3;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет собой морфолино, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой пиперидино, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой пиперидино, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (CH2)2-фенил, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 иди С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R4 представляет собой пиперидино, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет собой морфолино, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой СН, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет собой фенил, фенилметил или фенилэтил, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет собой COR8, R8 представляет собой NR6R7, R6R7СН3, С2Н5 или С3Н7, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет собой фенил, фенилметил или фенилэтил, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет собой морфолино, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет собой пиперидине, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой СН, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой морфолино, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой морфолино, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой морфолино, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет собой пиперидино, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R4 представляет собой фенил, фенилметил или фенилэтил, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой СН, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой NR2CO, R1, представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет пиперидино, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (CH2)-фенил, R" представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет пиперидино, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет фенил, фенилметил или фенилэтил, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R4 представляет пиперидино, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (CH2)2-фенил, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой фенил, фенилметил или фенилэтил, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой фенил, фенилметил или фенилэтил, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой пиперидино, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет собой морфолино, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R4 представляет собой морфолино, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет собой фенил, фенилметил, фенилэтил, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой COR8, R8 представляет собой морфолино, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R4 представляет собой морфолино, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой морфолино, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R4 представляет собой фенил, фенилметил или фенилэтил, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой морфолино, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой СН, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой фенил, фенилметил или фенилэтил, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R4 представляет собой COR8, R8 представляет собой морфолино, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R4 представляет собой морфолино, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R4 представляет собой фенил, фенилметил или фенилэтил, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой фенил, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет собой фенил, фенилметил или фенилэтил, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет собой морфолино, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R4 представляет собой пиперидино, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой N, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R4 представляет собой морфолино, R5 представляет собой Н, R9 представляет собой ОСН3;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R4 представляет собой фенил, фенилметил, фенилэтил, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой N, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет собой пиперидино, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой CONR2, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой (СН2)2-фенил, R9 представляет собой СН3, С2Н5 или С3Н7;
Х представляет собой СН, Y представляет собой NR2CO, R1 представляет собой Н, СН3, С2Н5 или С3Н7, R2 представляет собой Н, R3 представляет собой СН2-фенил, R4 представляет собой фенил, фенилметил или фенилэтил, R5 представляет собой Н, R9 представляет собой СН3, С2Н5 или С3Н7;
Предпочтительные соединения
(R)-N-[5-метоксиметил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил]-4-морфолинобензамид;
(R)-N-[5-бром-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-трифторметилбензамид;
(R)-N-[5-бром-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид;
(R)-N-[5-бром-8-(пиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид;
(R)-N-[5-гидрокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-бутоксибензамид;
(R)-N-[5-метокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид;
(R)-N-[5-метоксиметил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил]-4-морфолинокарбонилбензамид;
(R)-N-[5-метил-8-(пиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил]-4-морфолинобензамид;
(R)-N-[5-бром-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинокарбонилбензамид;
N-(4-морфолинофенил)-8-(4-метилпиперазинил)-5-метокси-1,2,3,4-тетрагидронафталин-2-карбоксамид;
N-(морфолинокарбонилфенил)-8-(4-метилпиперазин-1-ил)-5-метокси-1,2,3,4-тетрагидронафталин-2-карбоксамид;
(R)-N-[5-этил-8-(4-метилапиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид;
(R)-N-[5-этил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -(4-морфолинокарбонил)бензамид;
(R)-N-[5-дифторметокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил]-4-морфолинобензамид и
(R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид.
Соединения настоящего изобретения существуют в форме рацематов или (R)- или (S)-энантиомеров, в виде свободного основания или их фармацевтически приемлемой соли или сольвата. Соединения в форме (R)-энантиомера являются предпочтительными.
Для образования нетоксичных фармацевтически приемлемых солей присоединения кислот соединений настоящего изобретения применяются как органические, так и неорганические кислоты. Примерами кислот являются серная, азотная, фосфорная, щавелевая, хлористоводородная, муравьиная, бромистоводородная, лимонная, уксусная, молочная, винная, дибензоилвинная, диацетилвинная, памоевая, этандисульфоновая, сульфамовая, янтарная, пропионовая, гликолевая, яблочная, глюконовая, пирувиновая, фенилуксусная, 4-аминобензойная, антраниловая, салициловая, 4-аминосалициловая, 4-гидроксибензойная, 3,5-дигидроксибензойная, 3,5-дигидроксибензойная, 3-гидрокси-2-нафтойная, никотиновая, метансульфоновая, этансульфоновая, гидроксиэтансульфоновая, бензолсульфоновая, пара-толуолсульфоновая, сульфаниловая, нафталинсульфоновая, аскорбиновая, циклогексилсульфамовая, фумаровая, малеиновая и бензойная кислоты. Эти соли могут быть легко получены способами, известными из уровня техники.
Предпочтительными сольватами соединений являются гидраты.
Фармацевтические составы
Во втором аспекте настоящее изобретение предлагает фармацевтическую композицию (препаративную форму), содержащую в качестве активного ингредиента терапевтически-эффективное количество соединения формулы I в виде энантиомера или рацемата в форме их свободного основания или фармацевтически-приемлемой соли или сольвата, необязательно в сочетании с разбавителями, эксципиентами или инертными носителями.
В соответствии с настоящим изобретением соединения
настоящего изобретения обычно применяются перорально, ректально или путем инъекций в виде фармацевтических готовых препаративных форм, содержащих активный ингредиент в форме или свободного основания, или фармацевтически приемлемой нетоксичной соли присоединения кислоты, например гидрохлорида, гидробромида, лактата, ацетата, фосфата, сульфата, сульфамата, цитрата, тартрата, оксалата, и им подобные в фармацевтически приемлемой дозированной форме. Дозированная форма может представлять собой твердый, полутвердый или жидкий препарат. Обычно активное вещество составляет от 0,1 до 99% от веса препарата, более конкретно от 0,5 до 20% по весу для препаратов, предназначенных для инъекций, и от 0,2 до 50% по весу для препаратов, пригодных для перорального применения.
Для получения фармацевтической готовой препаративной формы соединения настоящего изобретения в виде единичной дозированной формы для перорального применения, выбранное соединение может быть смешано с твердым эксципиентом, например лактозой, сахарозой, сорбитом, маннитом, крахмалами, такими как картофельный крахмал, кукурузный крахмал или амилопектин, производными целлюлозы, связывающими веществами, такими как желатин или поливинилпирролидон, и смазочными материалами, такими как стеарат магния, стеарат кальция, полиэтиленгликоль, воски, парафин и им подобные, и затем спрессовывается в таблетки. Если требуются таблетки с покрытием, содержимое, приготовленные как описано выше, может быть покрыто концентрированным раствором сахара, который может содержать, например, гуммиарабик, желатин, тальк, диоксид титана, и им подобные. С другой стороны, таблетки также могут быть покрыты полимерами, известными специалистам в данной области техники, растворенными в легко испаряющимся органическом растворителе или смеси органических растворителей. Красители могут быть добавлены в это покрытие для простоты отличия таблеток, содержащих различные активные вещества или различные количества активного соединения.
Для получения мягких желатиновых капсул, активное вещество может быть смешано с, например, растительным маслом или полиэтиленгликолем. Твердые желатиновые капсулы могут содержать гранулы активного вещества, причем используют или эксципиенты, приведенные выше для таблеток, например лактозу, сахарозу, сорбит, маннит, крахмалы (например, картофельный крахмал, кукурузный крахмал или амилопектин), производные целлюлозы, или желатин. Твердые желатиновые капсулы также могут наполняться жидкими иди полутвердыми лекарственными препаратами.
Дозированные единичные формы-стандартные дозы, для ректального применения могут представлять собой растворы или суспензии, или могут быть приготовлены в форме суппозиториев, содержащих активное вещество в смеси с нейтральной жировой основой, или желатиновых ректальных капсул, содержащих активное вещество в смеси с растительным маслом или парафиновым маслом. Жидкие препараты для перорального применения могут быть приготовлены в виде сиропов или суспензий, например растворы, содержащие от около 0,1% до около 20% по весу активного вещества, описанного здесь, остальное составляет сахар и смесь этанола, воды, глицерина и пропиленгликоля. Необязательно такой жидкий препарат может содержать красящие агенты, ароматизаторы, сахарин или карбоксиметилцеллюлозу как сгущающие агенты или эксципиенты, известные специалистам в этой области.
Растворы для парентерального применения путем инъекций могут быть получены в виде водного раствора водорастворимой фармацевтически приемлемой соли активного вещества, предпочтительно в концентрации от около 0,1% до около 10% по весу. Эти растворы также могут содержать стабилизирующие агенты или буферирующие агенты и могут быть удобно представлены в виде ампул с определенной стандартной дозой.
Подходящая дневная доза соединения по изобретению при терапевтическом лечении людей составляет около 0,01-100 мг/кг веса тела при пероральном применении и 0,001-100 мг/кг веса тела при парентеральном применении.
Соединение изобретения также может быть использовано в сочетании с ингибитором повторного поглощения 5-НТ, таким как флуоксетин, пароксетин, циталопрам, кломипрамин, сертралин, алапроклат или флувоксамин, предпочтительно пароксетин или циталопрам. Другая возможная комбинация состоит в использовании соединения настоящего изобретения вместе с ингибитором моноаминоксидазы, таким как моклобемид, транилципрамин, брофаромид или фенелзин, предпочтительно моклобемид или фенелзин. Еще одной возможной комбинацией является соединение по изобретению вместе с 5-HT1A антагонистом, таким как соединения, раскрытые в WO 96/33710, предпочтительно (R)-5-карбамоил-3-(N,N-дициклобутиламино)-8-фтор-3,4-дигидро-2Н-1-бензопиран.
Медицинское и фармацевтическое использование
Еще один аспект настоящего изобретения состоит в использовании соединений формулы I в терапии в качестве антагонистов h5-HT1В, частичных агонистов или полных агонистов, предпочтительно как антагонистов, и использование в лечении заболеваний, опосредованных 5-гидрокситриптамином. Примерами таких заболеваний являются заболевания ЦНС, такие как нарушения настроения (депрессии, большие депрессивные эпизоды, дистимия, сезонные аффективные расстройства, депрессивная фаза биполярного расстройства), состояние тревоги (обсессивно-компульсивное расстройство, панические состояния с или без агорафобий, страх общества, специфические страхи, генерализованные тревожные состояния, посттравматические стрессовые состояния), личностные расстройства (расстройства импульсного управления, трихотелломания), ожирение, анорексия, булимия, предменструальный синдром, половые расстройства, алкоголизм, злоупотребление табаком, аутизм, недостаток внимания, гиперактивные состояния, мигрень, расстройства памяти (возрастное ухудшение памяти, пресенильная и сенильная деменция), патологическая агрессия, шизофрения, эндокринные нарушения (например, гиперпролактинемия), инсульт, дискинезия, болезнь Паркинсона, нарушение терморегуляции, боль, гипертензия. Другими примерами заболеваний, опосредованных гидрокситриптамином, являются недержание мочи, вазоспазм и контроль роста опухоли (например, карцинома легкого).
Способы получения
Настоящее изобретение также относится к способам получения соединений формулы I. Из последующего описания этого процесса становится понятно, что там, где необходимо, подходящие защитные группы добавляются (и, соответственно, удаляются) к различным реагентам и промежуточным продуктам, причем способами, понятными специалистам в области органического синтеза. Общепринятые методики для использования таких защитных групп, а также примеры подходящих защитных групп описаны, например, в "Protective Groups in Organic Sinthesis" T.W, Greene, Wiley-Interscience/New York, 1991.
Способы получения промежуточных веществ
1. В случае, когда Y представляет собой NR2CO и Х представляет собой N
(i) Бензилирование соединения формулы II, или в виде рацемата или в виде энантиомера,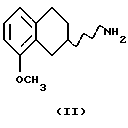
С получением соединения формулы III может быть осуществлено реакцией с подходящим бензилирующим агентом, например бензилгалогенидом, таким как бензилбромид или бензилхлорид, или активированным спиртом, например бензилмезилатом или бензилтозилатом. Реакция может проводиться с использованием соли или основания соединения II в подходящем растворителе, например N,N-диметилформамиде, ацетоне или ацетонитриле, с соответствующим основанием, например NaOH, NаНСО3, К2СО3 или триалкиламином, таким как триэтиламин, при температуре от +20 до +150oС. Присутствие подходящего катализатора, например иодида калия или йодида натрия, может повысить скорость реакции. Азот в соединении II также может быть защищен восстановительным алкилированием с арилальдегидом в присутствии восстанавливающего агента, такого как цианоборгидрид натрия, боргидрид натрия или каталитически с Н2 и подходящим катализатором, содержащим палладий, платину, родий или никель в соответствующем растворителе, например тетрагидрофуране, диоксане, метаноле или этаноле. Донор протона, такой как пара-толуолсульфоновая кислота, может быть использован для катализа образования имин/енамина, и доведение рН до слегка кислой, соответствующей кислотой, такой как уксусная кислота, может ускорить реакцию, в результате которой получают соединение III.
(ii) Деметилирование соединения формулы III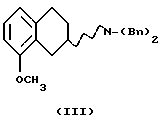
С получением соединения формулы IV, может быть проведено путем обработки соединения кислотными реагентами, такими как HBr, HI, НВr/СН3СООН, ВВr3, АlСl3, пиридин-НСl или основными нуклеофильными реагентами, такими как СН3С6H4S- или С2Н5S- в подходящем растворителе. Подходящими растворителями могут быть метиленхлорид или хлороформ, и реакция может проходить при -78oС и +60oС.
(iii) Превращение соединения формулы IV в соединение формулы V
может быть выполнено реакцией с соединением формулы VI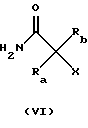
где Х представляет собой удаляемую группу, например, галоген, такой как хлор, бром или йод, или группу алкан- или аренсульфонилокси, такую как пара-толуолсульфонилокси группа, и Ra и Rb представляют собой водород или низшую алкильную группу, например метил. Процесс может проводиться с солью соединения формулы IV, полученной путем реакции с основанием, таким как К2СО3, Nа2СО3, КОН, NaOH, BuLi или NaH. Реакция может проводиться в соответствующем растворителе, например в апротонном растворителе, таком как диоксан, N,N-диметилформамид, тетрагидрофуран, толуол, бензол или петролейный эфир, и реакция может протекать при температуре от +20oС до +150oС.
(iv) Превращение соединения формулы V в соединение формулы VII
может быть осуществлено в подходящем растворителе (например, апротонном растворителе, таком как N,N-диметилформамид, диоксан, 1,1,3,3-тетраметилмочевина, тетрагидрофуран или триамид гексаметилфосфорной кислоты, с соответствующим основанием, например, К2СО3, КОН, трет-бутоксид калия или NaH, при температуре в пределах от +20oС до +150oС.
Присутствие сорастворителя, такого как 1,3-диметил-3,4, 5,6-тетрагидро-2(1Н)-пиримидона или триамида гексаметилфосфорной кислоты в соответствующей концентрации в растворителе может повысить скорость реакции.
(v) Гидролиз соединения формулы VII в соединение VIII может быть проведен в условиях кислой среды с использованием таких кислот, как Н2SО4, НСl или НВr в подходящем растворителе, например в Н2O, этаноле, метаноле или их смеси, и реакция может протекать в пределах от +20oС до +100oС, или в щелочных условиях, с использованием таких оснований, как NaOH, КОН в соответствующем растворителе, таком как Н2O, этанол, метанол или их смеси, и реакция может протекать в пределах от +20oС до +100oС.
(vi) Превращение соединения формулы VIII в соединение формулы IX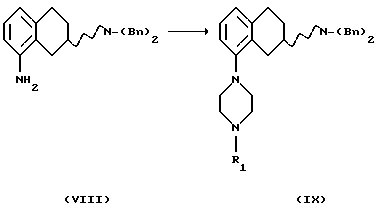
может быть выполнено путем
а) реакции с соединением формулы Х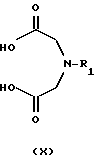
где R1 представляет собой C1-C6 алкил или С3-C6-циклоалкил. Процесс может быть проведен в подходящем растворителе, например апротонном/безводном растворителе, таком как тетрагидрофуран или N,N-диметилформамид, в присутствии связывающего реагента, такого как N,N-карбонилдиимидазол, и реакция может протекать в пределах от +20oС до +130oС. За реакцией следует восстановление имида с помощью соответствующего восстанавливающего агента, например LiAlH4 в подходящем растворителе, таком как диэтиловый эфир или тетрагидрофуран при температуре между +20oС и кипячения с обратным холодильником, или
b) реакцией соединением формулы XI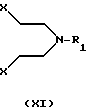
где Х представляет собой удаляемую группу, например галоген, такой как хлор или бром, или группу алкал- или аренсульфонилокси, такую как пара-толуолсульфонилокси группа, и R1 представляет собой Н, C1-С6-алкил или С3-C6-циклоалкил. Процесс может протекать в соответствующем растворителе, таком как этанол, бутанол, N,N-диметилформамид, ацетонитрил или смесь воды и ацетонитрила с подходящим основанием, таким как К2СО3, NаНСО3 или КОН, и реакция может протекать в пределах от +20oС до +150oС.
(vii) Соединение формулы IX также может быть получено бензилированием соединения формулы LVIII, где Rc представляет собой галоген, такой как хлор, бром или йод, в виде его рацемата или энантиомера.
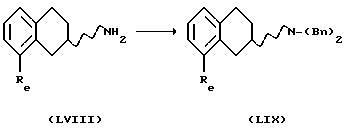
с получением соединения формулы LIX, реакцией с соответствующим бензилирующим агентом, например бензилгалогенидом, таким как бензилбромид или бензилхлорид, или активированным спиртом, таким как, бензилмезилат или бензилтозилат. Реакция может проводиться с использованием соли или основания соединения LVIII в соответствующем растворителе, например N,N-диметилформамиде, ацетоне или ацетонитриле, с соответствующим основанием, например NaOH, NаНСО3, К2СО3 или триалкил-амин, таким как триэтиламин, при температуре в пределах от +20oС до 150oС. Присутствие подходящего катализатора, например йодида калия или йодида натрия, может увеличить скорость реакции.
(viii) Превращение соединения формулы LIX в соединение формулы IX, где R1 представляет собой водород, C1-C6-алкил или С3-C6-циклоалкил, может быть осуществлено путем реакции с соединением формулы XXII.
Процесс может быть выполнен в подходящем растворителе, например в апротонном растворителе, таком как бензол, толуол, диоксан, тетрагидрофуран или N,N-диметилформамид, с соответствующим основанием, таким как трет-бутоксид натрия или бис (триметилсилил)амид лития, в присутствии подходящего палладиевого катализатора, такого как PdX2, L2Pd(0) или L2PdX2, где Х представляет собой галоген, такой как хлор или бром, и L представляет собой подходящий лиганд, такой как трифенилфосфин, три-о-толилфосфин, трифурилфосфин, трифениларсин или дибензилиденацетон, и с или без добавления лиганда L', такого как трифенилфосфин, три-о-толилфосфин, трифурилфосфин, 2,2'-бис(дифенилфосфино)-1,1'-бинафталин (или в виде рацемата или энантиомера), или трифениларсин, и реакция может протекать при температуре в пределах от +20oС до +150oС, приводя в результате к получению соединения формулы IX.
Превращение LIX в IX также происходит через превращение XXII в аминостаннан или аминоборан, используя такие агенты, как (N,N-диэтиламино)трибутилолово или трис(диметиламино)боран в подходящем растворителе, например в апротонном растворителе, таком как бензол, толуол, диоксан, тетрагидрофуран или N, N-диметилформамид, и затем используя условия, сходные с описанными выше, получая в результате соединение формулы IX.
(ix) Галогенирование соединения формулы IX, где R1 представляет собой водород, C1-C6-алкил или С3-C6-циклоалкил,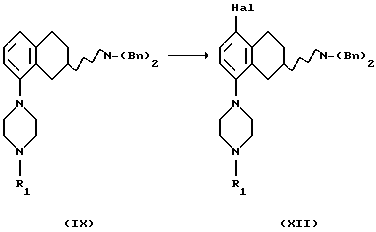
для получения соединения формулы XII может быть проведено ароматическим электрофильным замещением с использованием подходящего галогенирующего агента, такого как Вr2, Cl2, I2, IСl2 или SO2Cl2. Реакция может проводиться с использованием соли или основания соединения IX в соответствующем растворителе, например уксусной кислоте, HCl/этаноле или воде, с или без подходящего основания, например ацетата щелочного металла, такого как ацетат натрия, и реакция может протекать при температуре в пределах от -20oС до комнатной температуры.
Соединение формулы XII также может быть получено путем бензилирования соединения формулы IX для получения соединения формулы XII путем реакции с подходящим бензилирующим агентом, например бензилгалогенидом, таким как бензилбромид или бензилхлорид, или активированным спиртом, например бензилмезилатом или бензилтозилатом в подходящем растворителе, например N,N-диметилформамиде, ацетоне или ацетонитриле с подходящим основанием, например NaOH, NаНСО3, К2СО3 или триалкиламином, таким как триэтиламин, при температуре в пределах от +20oС до +150oС. Присутствие подходящего катализатора, например йодида калия или йодида натрия, может повысить скорость реакции.
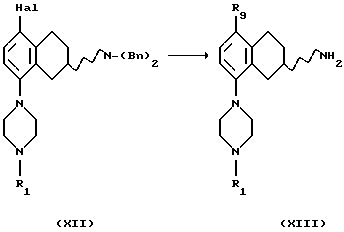
(х) Превращение соединения формулы XII в соединение формулы XIII, где R1 представляет собой водород, C1-C6-алкил или С3-C6-циклоалкил, и R9 представляет собой C1-C6 алкил, может быть осуществлено путем реакции обмена металл-галоген в соответствующем безводном растворителе, таком как тетра-гидрофуран или диэтиловый эфир, с использованием подходящего алкил-лития или металла, например бутиллития, лития или магниевой стружки, с последующей обработкой соответствующим алкилгалогенидом, таким как метилйодид, этилбромид или пропилйодид, и реакция может протекать при температуре в пределах от -78oС до комнатной температуры, с последующим отщеплением бензильной группы путем гидрогенации в присутствии подходящего катализатора, содержащего палладий, родий, платину или никель, в подходящем растворителе, например уксусной кислоте или этаноле и при температуре реакционной от +20oС до +120oС или путем обработки другими электрофилами, такими как ацетальдегид или метилхлорформиат, после чего проводится соответствующая окончательная обработка. Реакция может протекать при реакционной температуре в пределах от -78oС до комнатной температуры.
В случае, когда в качестве электрофила используется ацетальдегид, за вышеприведенной реакцией следует восстановление бензилового спирта и отщепление бензильных групп путем гидрогенизации с участием подходящего катализатора, содержащего палладий, родий, платину или никель, в подходящем растворителе, например уксусной кислоте или этаноле, и реакция может протекать при температуре от +20oС до +120oС.
В том случае, когда в качестве электрофила используется метилхлорформиат, за вышеприведенной реакцией следует восстановление метилового эфира в подходящем растворителе, таком как диэтиловый эфир или тетрагидрофуран, с помощью соответствующего восстанавливающего агента, такого как алюмогидрид лития, и реакция может протекать при температуре от +20oС до температуры кипячения с обратным холодильником, с последующим отщеплением бензильных групп и восстановлением бензилового спирта путем гидрогенации с участием подходящего катализатора, содержащего палладий, родий, платину или никель в подходящем растворителе, например в уксусной кислоте или этаноле, и реакция может протекать при температуре от +20oС до +120oС.
Когда R1 представляет собой водород, перед этапом обработки соединением лития азот пиперазина защищают подходящей защитной группой, такой как бензильная группа или другой защитной группой, известной специалистам в этой области, и затем удаленной известными способами, получая в результате соединение формулы XIII.
(xi) Соединение формулы XIII, где R1 представляет собой водород, может быть также получено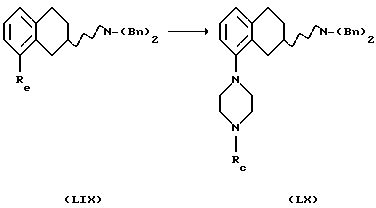
превращением соединения формулы LIX в соединение формулы LX, реакцией с соединением формулы LXI, где Rc представляет собой подходящую защитную группу, такую как бензильная группа
Процесс может проводиться в подходящем растворителе, например апротонном растворителе, таком как бензол, толуол, диоксан, тетрагидрофуран или N,N-диметилформамид, с подходящим основанием, таким как трет-бутоксид натрия или бис-(триметилсилил)амид лития, в присутствии подходящего палладиевого катализатора, такого как PdX2, L2Рd(О) или L2PdX2, где Х представляет собой галоген, такой как хлор или бром, и L представляет собой подходящий лиганд, такой как трифенилфосфин, тио-о-толилфосфин, трифурилфосфин, трифениларсин или дибензилиденацетон, и с или без добавления лиганда L', такого как трифенилфосфин, три-о-толилфосфин, трифурилфосфин, 2,2'-бис(дифенилфосфино)-1,1'-бинафталин (или его рацемат или энантиомер) или трифениларсин, и реакция может протекать при температуре от +20oС до +150oC, в результате чего получают соединение формулы LX.
Превращение LIX в LX также может протекать через превращение LXI в аминостаннан или аминоборан, используя такие агенты, как (N,N-диэтиламино)трибутилово или трис(диметил-амино)боран в подходящем растворителе, например апротонном растворителе, таком как бензол, толуол, диоксан, тетрагидрофуран или N, N-диметилформамид, и затем используя те же условия, которые описаны в вышеприведенном описании, получают в результате соединение формулы LX.
(xii) Галогенирование соединения формулы LX,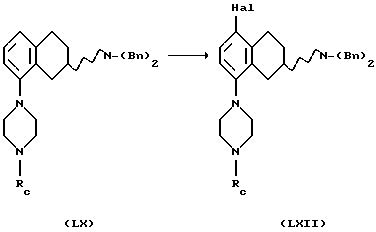
с получением соединения формулы LXII может быть выполнено путем ароматического электрофильного замещения с использованием подходящего галогенирующего агента, такого как Вr2, Cl2, I2, ICl или SО2Сl. Реакция может быть проведена с использованием соли или основания соединения LX в соответствующем растворителе, например, уксусной кислоте, HCl/этаноле или воде, с или без подходящего основания, например ацетата щелочного металла, такого как ацетат натрия, и реакция может протекать при температуре от -20oС до комнатной температуры.
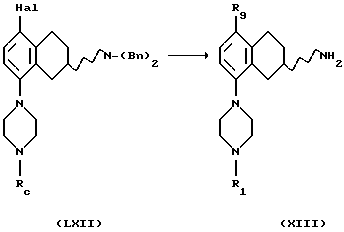
(xiii) Превращение соединения формулы LXII в соединение формулы XIII, где R1 представляет собой водород, и R9 представляет собой C1-C6 алкил, может быть проведено путем реакции обмена метал-галоген в соответствующем безводном растворителе, таком как тетрагидрофуран или диэтиловый эфир, с использованием подходящего алкиллития или металла, например бутиллития, лития или магниевой стружки, с последующей обработкой соответствующим алкилгалогенидом, таким как метилйодид, этилбромид или пропилйодид, и реакция может осуществляться при реакционной температуре в пределах от -78oС до комнатной температуры, за чем следует отщепление бензильных групп путем гидрогенации в присутствии подходящего катализатора, содержащего палладий, родий, платину или никель, в подходящем растворителе, например в уксусной кислоте или этаноле, и при температуре реакционной смеси от +20oС до 120oС, или путем обработки другими электрофилами, такими как ацетальдегид или метилхлорформиат, и с последующей соответствующей обработкой. Реакция может проводиться при температуре в пределах от -78oС до комнатной температуры.
В случае, когда в качестве электрофила используется ацетальдегид, за вышеприведенными реакциями следует восстановление бензилового спирта и отщепление бензильных групп путем гидрогенизации при использовании подходящего катализатора, содержащего палладий, родий, платину или никель, в подходящем растворителе, например в уксусной кислоте или этаноле, и реакция может происходить при температуре от +20oС до +120oС.
В случае, когда в качестве электрофила используется метилхлорформиат, за вышеприведенными реакциями следует восстановление метилового эфира в подходящем растворителе, таком как диэтиловый эфир или тетрагидрофуран, с помощью соответствующего восстанавливающего агента, такого как алюмогидрид лития, и реакция может происходить при температуре от +20oС до кипячения с обратным холодильником, с последующим отщеплением бензильных групп и восстановлением бензилового спирта путем гидрогенизации с использованием подходящего катализатора, содержащего палладий, родий, платину или никель, в подходящем растворителе, например в уксусной кислоте или этаноле, и реакция может протекать при температуре от +20oС до +120oС.
(xiv) Превращение соединения формулы XIII, где R1 представляет собой водород, в соединение формулы XIV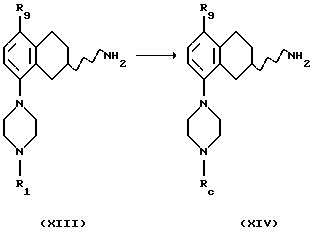
где Rc представляет собой защитную группу, может быть осуществлено путем защиты пиперазинового кольца в подходящем растворителе, например метиленхлориде или хлороформе, соответствующим защищающим агентом, например, ди-трет-бутил-бикарбонатом, с соответствующим основанием, например, триэтиламином или К2СО3 и при температуре от -20oС до +60oС.
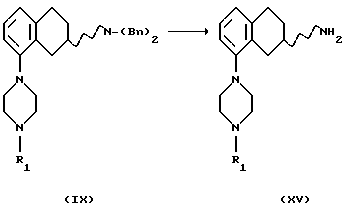
(xv) Превращение соединения формулы IX, где R1 представляет собой водород, C1-C6 алкил или С3-C6-циклоалкил в соединение формулы XV, где R1 представляет собой водород, C1-C6-алкил или С3-C6-циклоалкил, может быть проведено путем отщепления бензильных групп путем гидрогенизации в присутствии подходящего катализатора, содержащего палладий, родий, платину или никель, в подходящем растворителе, например в уксусной кислоте или этаноле, и при температуре реакционной смеси от +20oС до +120oС.
(xvi) Галогенирование соединения формулы XV, где R1 представляет собой водород, C1-C6-алкил или С3-C6-циклоалкил,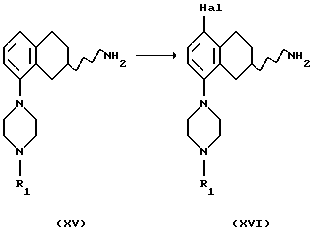
С получением соединения формулы XVI может быть выполнено путем ароматического электрофильного замещения с использованием подходящего галогенирующего агента, такого как Вr2, Cl2, I2, ICl или SО2Сl2. Реакция может быть проведена с использованием соли или основания соединения XV в соответствующем растворителе, например, уксусной кислоте, HCl/этаноле или воде, с или без подходящего основания, например ацетата щелочного металла, такого как ацетат натрия, и реакция может протекать при температуре от -20oС до комнатной температуры.
(xvii) Превращение соединения формулы XVI, где R1 представляет собой водород, в соединение формулы XVII,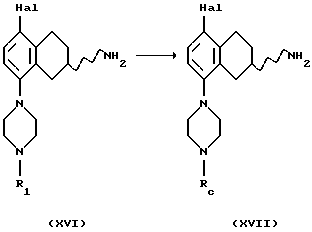
где Rc представляет собой подходящую защитную группу, может быть проведено путем зашиты пиперазинового кольца в подходящем растворителе, например метиленхлориде или хлороформе, подходящим защитным агентом, например, ди-трет-бутилдикарбонатом, с подходящим основанием, например, триэтиламином или К2СО3, и температуре от -20oС до +60oС.
(xviii) Галогенирование соединения формулы XVIII, где R9 представляет собой C1-C6-алкокси, имеющего вид или рацемата или энантиомера,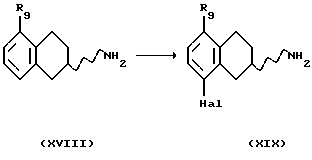
С получением соединения формулы XIX может быть выполнено путем ароматического электрофильного замещения с использованием подходящего галогенирующего агента, такого как Вr2, Cl2, I2, ICl или SO2Cl2. Реакция может быть проведена с использованием соли или основания соединения XVIII в соответствующем растворителе, например уксусной кислоте, HCl/этаноле или воде, с или без подходящего основания, например ацетата щелочного металла, такого как ацетат натрия, и реакция может протекать при температуре от -20oС до комнатной температуры.
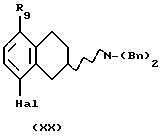
(xix) Бензилирование соединения формулы XIX или его рацемата или энантиомера, с получением соединения формулы XX путем реакции с подходящим бензилирующим агентом, например бензилгалогенидом, таким как бензилбромид или бензилхлорид, или активированным спиртом, например бензилмезилатом или тозилатом. Реакция может проводиться с использованием соли или основания соединения XIX в подходящем растворителе, например N,N-диметилформамиде, ацетоне или ацетонитриле, с подходящим основанием, таким как триэтиламин, NaOH, NаНСО3 или К2СО3 при температуре в пределах от +20 до +150oС. Присутствие подходящего катализатора, например галогенида щелочного металла, такого как йодид калия или йодид натрия, может увеличить скорость реакции.
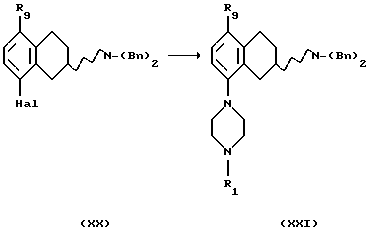
(хх) Превращение соединения формулы XX в соединение формулы XXI, где R1 представляет собой водород, C1-C6-алкил или С3-C6-циклоалкил, и R9 представляет собой C1-C9-алкокси, может быть осуществлено путем реакции с соединением формулы XXII, где R1 представляет собой водород, C1-C6-алкил или С3-С6 -циклоалкил.
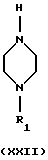
Процесс может быть выполнен в подходящем растворителе, например в апротонном растворителе, таком как бензол, толуол, диоксан, тетрагидрофуран или N, N-диметилформамид, с соответствующим основанием, таким как трет-бутоксид натрия или бис(триметилсилил)амид лития, в присутствии подходящего палладиевого катализатора, такого как PdX2, L2Pd(O) или L2PdX2, где Х представляет собой галогем, такой как хлор или бром, и L представляет собой подходящий лиганд, такой как трифенилфосфин, три-о-толилфосфин, трифурилфосфин, трифениларсин или дибензилиденацетон, и с или без добавления лиганда L', такого как трифенилфосфин, три-о-толилфосфин, трифурилфосфин, 2,2'-бис(дифенилфосфино)-1,1'-бинафталин (или в виде рацемата или энантиомера), или трифениларсин, и реакция может протекать при температуре в пределах от +20oС до +150oС.
(xxi) Превращение соединения формулы XXI в соединение формулы XXIII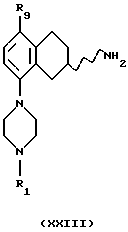
где R1 представляет собой водород, C1-C6-алкил или С3-C6-циклоалкил, R9 представляет собой C1-C6-алкокси, может проводиться путем гидрогенизации с использованием катализатора, содержащего палладий, платину, родий или никель в подходящем растворителе, например в уксусной кислоте или этаноле, и при температуре реакции от +20oС до 120oС.
(xxii) Превращение соединения формулы XXIII, где R1 представляет собой водород, в соединение формулы XXIV,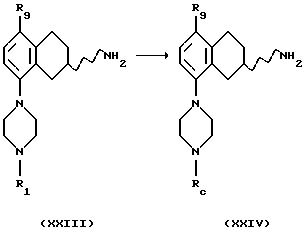
где Rc представляет собой защитную группу, может быть осуществлено путем защиты пиперазинового кольца в подходящем растворителе, например метиленхлориде или хлороформе, с соответствующим защитным реагентом, например ди-трет-бутил-дикарбонатом, с подходящим основанием, например триметил-амином или К2СО3 и при температуре от -20oС до +60oС.
(xxiii) Деалкилирование соединения формулы XXI,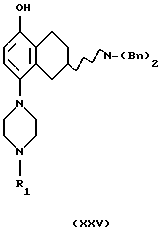
с получением соединения формулы XXV, где R1 представляет собой водород, C1-C6-алкил или С3-C6-циклоалкил, может быть проведено путем обработки соединения кислотным агентом, таким как HBr, HI, НВr/СН3СООН, ВВr3, AlCl3, пиридин-HCl, или с основным нуклеофильным реагентом, таким как СН3С6Н4S- или С2Н5S- в подходящем растворителе. Подходящими растворителями могут быть метиленхлорид или хлороформ, и реакция может протекать при температуре от -78oС до +60oС.
(xxiv) Превращение соединения формулы XXV в соединение формулы XXVI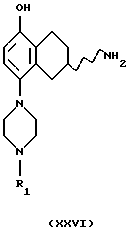
где R1 представляет собой водород, C1-C6-алкил или С3-C6-циклоалкил, может быть осуществлено путем гидрогенизации с использованием катализатора, содержащего палладий, платину, родий или никель, в подходящем растворителе, например в уксусной кислоте или этаноле, и при температуре реакции от +20oС до 120oС,
(xxv) Превращение соединения формулы XII, где R1 представляет собой C1-C6-алкил или С3-C6-циклоалкил, в соединение формулы XXVII, где R1 представляет собой C1-C6- алкил или С3-C6-циклоалкил, может быть осуществлено путем реакции обмена металл-галоген в соответствующем безводном растворителе, таком как тетрагидрофуран или диэтиловый эфир, с использованием подходящего алкиллития или металла, например бутиллития, лития или магниевой стружки, с последующей обработкой соответствующим электрофилом, таким как бромметил-метиловый эфир, и с последующей соответствующей обработкой. Реакция может быть проведена при температуре реакции в пределах от -78oС до комнатной температуры.

(xxvi) Превращение соединения формулы XXVII, где R1 представляет собой C1-C6-алкил или С3-C6-циклоалкил, в соединение формулы XXVIII, где и R1 представляет собой C1-C6 алкил или С3-C6-циклоалкил, может проводиться путем отщепления бензильных групп путем гидрогенизации на подходящем катализаторе, содержащем палладий, родий, платину или никель, и в подходящем растворителе, например в уксусной кислоте и этаноле, и реакция может протекать при температуре от +20oС до +120oС,
(xxvii) Алкилирование соединения формулы XXV, где R1
представляет собой C1-C6-алкил или С3-С6-циклоалкил, для получения соединения формулы XXIX, где R1 представляет собой C1-C6-алкил или С3-C6-циклоалкил, может быть осуществлено в подходящем растворителе, таком как изопропанол или диоксан, подходящим алкилирующим агентом, таким как хлордифторметан, в присутствии подходящего основания, такого как NaOH или КОН и при температуре от +20oС до +80oС.

(xxviii) Превращение соединения XXIX, где R1 представляет собой C1-C6-алкил или С3-C6-циклоалкил, в соединение формулы XXX, где и R1 представляет собой C1-C6-алкил или С3-C6-циклоалкил, может проводиться путем отщепления бензильных групп путем гидрогенизации на подходящем катализаторе, содержащем палладий, родий, платину или никель, и в подходящем растворителе, например в уксусной кислоте и этаноле, и реакция может протекать при температуре от +20oС до +120oС,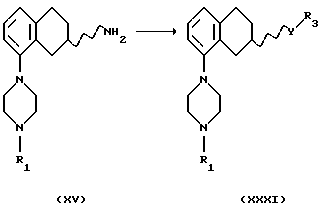
(xxix) Превращение соединения XV, где R1 представляет собой C1-C6-алкил или С3-C6-циклоалкил, в соединение формулы XXXI, где Y представляет собой NR2CO, R2 представляет собой водород, R3 представляет собой C1-C6-алкил или С3-C6-циклоалкил или (СН2)n-арил, где арил представляет собой фенил или гетероароматическое кольцо, содержащее один или два гетероатома, выбранных из N, О и S, и которое может быть одно- или двузамещенным R4 и/или R5; может быть осуществлено путем алкилирования соответствующей активированной карбоновой кислотой, такой как хлорангидрид кислоты, в подходящем растворителе, таком как метиленхлорид или хлороформ, с подходящим основанием, например триалкиламином, таким как триэтиламин, или при использовании карбоновой кислоты (R3СООН) с активирующим агентом, например N,N'-карбонилдиимидазолом, N, N'-дициклогексилкарбодиимидом или хлоридом дифенилфосфина, с подходящим основанием, таким как N-метилморфолин, в подходящем растворителе, таком как N, N-диметилформамид или тетрагидрофуран, и реакция может протекать при температуре от +20oС до +150oС.
2. В случае, когда Y представляет собой CONR2 и Х представляет собой N
(i) Нитрование соединения формулы XXXII, описанного у Johnson D.W.; Mander L. N. Aust J. Chem. 1974, 27, 1277-1286, или его рацемата или энантиомера, для получения соединения формулы XXXIII
где R4 представляет собой C1-C6-алкил, может быть проведено путем ароматического электрофильного замещения с использованием подходящего нитрирующего агента, такого как азотная кислота или азотная кислота и серная кислота, в подходящем растворителе, например в уксусной кислоте, уксусном ангидриде или воде, при температуре реакционной смеси от -20oС до комнатной температуры.
(ii) Гидролиз соединения формулы XXXIII может быть проведен в кислых условиях при использовании таких кислот, как H2SO4, HCl, HBr, в подходящем растворителе, таком как Н2О, этанол, метанол, уксусная кислота или их смесь, и реакция может протекать при температуре от +20oС до кипячения с обратным холодильником, или в щелочных условиях, используя такие основания, как NaOH или КОН, в подходящем растворителе, таком как H2O, этанол, метанол или их смеси, и реакция может протекать при температуре от +20oС до кипячения с обратным холодильником, давая в результате соединения формулы XXXIV.

(iii) Превращение соединения формулы XXXIV в соединение формулы XXXV, где Y представляет собой CONR2, можно выполнить путем активации кислотной функции соединения формулы XXXIV в виде галогенида кислоты, такого как хлорангидрид кислоты, с подходящим основанием, таким как триалкиламин, например триэтиламином, или путем использования активирующего агента, такого как N, N'-карбонилдиимидазол, N,N-дициклогексилкарбодиимид или хлорид дифенилфосфина, с подходящим основанием, таким как N-метилморфолин, в подходящем растворителе, например метиленхлориде, хлороформе, толуоле, N,N-диметилформамиде, диоксане или тетрагидрофуране, с последующим добавлением соответствующего амина или анилина HNR2R3, где R2 представляет собой Н или C1-C6-алкил, R3 представляет собой C1-C6-алкил, С3-C6-циклоалкил или (СН2)n-арил, где арил представляет собой фенил или гетероарома-тическое кольцо, содержащее один или два гетероатома, выбранных из N, О и S, и который может быть одно- или двузамещенным R4 и/или R5; и реакция может протекать при температуре от 0oС до +120oС.
(iv) Превращение соединения формулы XXXV в соединение формулы XXXVI, где Y представляет собой CONR2, R2 представляет собой Н или C1-C6-алкил, R3 представляет собой C1-C6-алкил, С3-C6-циклоалкил или (СН2)n-арил, где арил представляет собой фенил или гетероароматическое кольцо, содержащее один или два гетероатома, выбранных из N, О и S, и который может быть одно- или двузамещенным R4 и/или R5; можно выполнить путем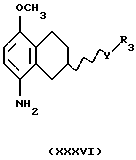
гидрогенизации, используя катализатор, содержащий палладий, платину или никель, в подходящем растворителе, таком как этанол, метанол или уксусная кислота, при температуре реакции от +20oС до +120oС; или восстановлением дитионитом натрия в подходящем растворителе.
3. В случае, когда Х представляет собой СН и Y представляет собой NR2CO,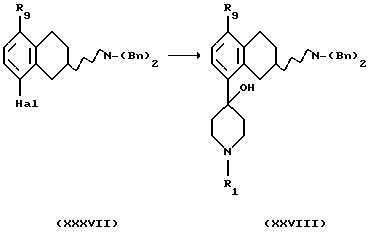
(i) Превращение соединения формулы XXXVII, где R9 представляет собой C1-C6-алкокси, в соединение формулы XXXVIII, где R1 представляет собой C1-C6-алкил или С3-C6-циклоалкил, R9 представляет собой C1-C6-алкокси, может быть проведено путем реакции обмена металл-галоген в соответствующем безводном растворителе, таком как тетрагидрофуран или диэтиловый эфир, используя подходящий алкил-литий или металл, например бутиллитий, литий или магниевая стружка, с последующей обработкой соответствующим N-алкилпиперидоном, где алкил(R1) представляет собой C1-C6-алкил или С3-C6-циклоалкил, такой как N-метил-4-пиперидон, с последующей соответствующей обработкой. Реакция может проводиться при температуре реакционной смеси в пределах от -78oС до комнатной температуры.
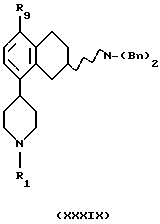
(ii) Соединение формулы XXXVIII может быть переведено в соединение формулы XXXIX путем обработки подходящим восстанавливающим агентом, таким как боргидрид натрия, и протонирующим агентом, таким как СF3СООН, СF3SO3Н или НСООН в соответствующем растворителе, таком как тетрагидрофуран или диэтиловый эфир. Реакция может проводиться при температуре реакционной смеси от 0oС до кипячения с обратным холодильником.
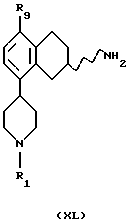
(iii) Превращение соединения формулы XXXIX в соединение формулы XL может быть проведено путем гидрогенизации с использованием такого катализатора, как палладий, платина, родий или никель, в подходящем растворителе, таком как уксусная кислота или этанол, и при температуре реакционной смеси от +20oС до +120oС.
4. В случае, когда Y представляет NR2CO и R9 находится в 6 положении
(i) Бензилирование соединения формулы XLI в виде его рацемата или энантиомера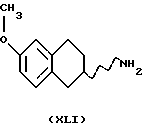
с получением соединения формулы XLII может быть проведено путем реакции с подходящим бензилирующим агентом, например бензилгалогенидом, таким как бензилбромид или бензилхлорид, или с активированным спиртом, например бензилмезилатом или бензилтозилатом. Реакция может проводиться с использованием соли или основания соединения XLI в подходящем растворителе, например N,N-диметилформамиде, ацетоне или ацетонитриле, с подходящим основанием, например NaOH, NаНСО3, К2СО3, или триалкиламином, таким как триэтиланин, при температуре в пределах от + 20oС до +150oС. Присутствие подходящего катализатора, такого как йодид калия или йодид натрия, может увеличить скорость реакции.
(ii) Деметилирование соединения формулы XLII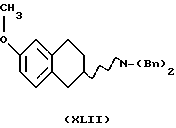
для получения соединения формулы XLIII может быть проведено путем обработки соединения кислотным агентом, таким как HBr, HI, НВr/СН3СООН, ВВr3, А1С13, пиридин-НСl, или с основным нуклеофильным агентом, таким как СН3С6Н4S- или C2H5S- в подходящем растворителе. Подходящими растворителями могут быть метиленхлорид или хлороформ, и реакция может протекать при температуре от -78oС до +60oС.
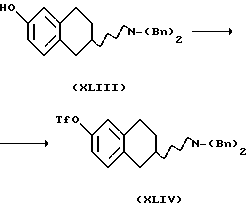
(iii) Превращение соединения формулы XLIII в соединение формулы XLIV может быть проведено с таким соединением, как трифторметансульфоновый ангидрид, в подходящем растворителе, таком как метиленхлорид или тетрахлорид углерода в присутствии основания, такого как 2,4,6-коллидин, триэтиламин или пиридин, при температуре реакционной смеси в пределах от -78oС до комнатной температуры.
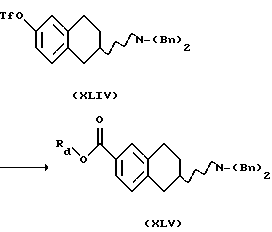
(vi) Превращение соединения формулы XLIV в соединение формулы XLV, где Rd представляет собой C1-C6-алкильную группу, может быть проведено в соответствующем растворителе, таком как диметилсульфоксид или N,N-диметилформамид, с подходящим основанием, таким как триалкиламин, например триэтиламином, в присутствии подходящего катализатора, такого как Pd(OAc)2 и подходящего лиганда, такого как трифенилфосфин, 1,1'-бис (дифенилфосфино)ферроцен или 1,3-бис(дифенилфосфино)пропан, и подходящего спирта, такого как метанол, этанол или пропанол, в атмосфере оксида углерода при температуре реакционной смеси от 40oС до 120oС.
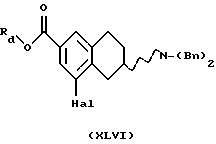
(v) Галогенирование соединения формулы XLV, где Rd представляет собой C1-C6-алкильную группу, для получения соединения формулы XLVI может проводиться с использованием подходящего галогенирующего агента, такого как 1,3-дибром-5,5-диметилгидантоин. Реакция может быть проведена с использованием соли или основания соединения XLV в соответствующем растворителе, например СF3SО3Н или Н2SО4, и при температуре реакционной смеси от 30oС до 150oС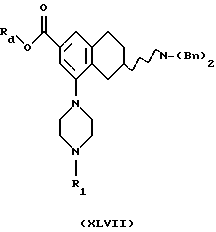
(vi) Превращение соединения формулы XLVI в соединение формулы XLVII, где R1 представляет собой C1-C6-алкил или С3-C6-циклоалкил, может быть выполнено реакцией с соединением формулы XXII, где R1 представляет собой C1-C6-алкил или С3-C6-циклоалкил.
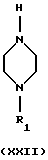
Процесс может быть проведен в подходящем растворителе, например апротонном растворителе, таком как бензол, толуол, диоксан, тетрагидрофуран или N,N-диметилформамид, с подходящим основанием, таким как трет-бутоксид натрия или бис-(триметилсилил)амид лития, в присутствии подходящего палладиевого катализатора, такого как РdХ2, L2Pd(O) или L2PdX2, где Х представляет собой галоген, такой как хлор или бром, и L представляет собой подходящий лиганд, такой как трифенилфосфин, три-о-толилфосфин, трифурилфосфин, трифениларсин или дибензилиденацетон, и с или без добавления лиганда L', такого как трифенилфосфин, три-о-толилфосфин, трифурилфосфин, 2,2'-бис(дифенилфосфино)-1,1'-бинафталин (или в виде рацемата или энантиомера) или трифениларсин, и реакция может проходить при температуре от +20oС до +150oС.

(vii) Превращение соединения формулы XLVII в соединение формулы XLVIII может быть проведено путем восстановления алкилового сложного эфира в подходящем растворителе, таком как диэтиловый эфир или тетрагидрофуран, соответствующим восстанавливающим агентом, таким как алюмогидрид лития, и реакция может протекать при температуре от +20oС до кипячения с обратным холодильником, с последующим отщеплением бензильных групп и восстановлением бензилового спирта путем гидрогенизации на подходящем катализаторе, содержащем палладий, родий, платину или никель, в подходящем растворителе, например в уксусной кислоте или этаноле, и реакция может протекать при температуре от +20oС до +120oС.
(viii) Соединение формулы XLVIII также может быть получено путем защиты аминогрупп соединения формулы XVIII или его рацемата или энантиомера,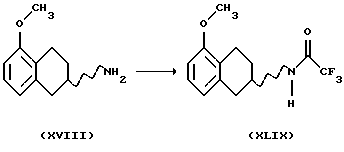
для получения соединения формулы XLIX путем реакции с подходящим ацилирующим агентом, например трифторуксусным хлоридом или трифторуксусным ангидридрм. Реакция может быть проведена с использованием соли или основания соединения XVIII в подходящем растворителе, например метиленхлориде или хлороформе, с подходящим основанием, например NaOH, NаНСО3, К2СО3 или триалкиламином, таким как триэтиламин, при температуре в пределах от -20oС до +80oС.
(ix) Нитрование соединения формулы XLIX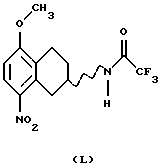
для получения соединения формулы L может быть выполнено путем обработки соединения подходящим нитрирующим агентом, таким как азотная кислота, в подходящем растворителе, таком как уксусная кислота, и реакция может протекать при температуре от 0oС до +30oС.
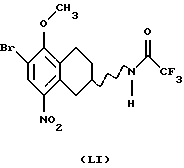
(х) Галогенирование соединения формулы L для получения соединения формулы LI может быть проведено с подходящим галогенирующим агентом, таким как N-бромсукцинимид или 1,3-дибром-5,5-диметилгидантоин. Реакция может проводиться в соответствующем растворителе, таком как хлороформ или метилен-хлорид, с или без подходящей кислоты, например СF3SО3Н или Н2SO4, и при температуре реакционной смеси от 0oС до +80oС.
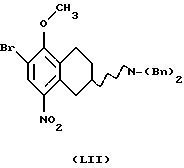
(xi) Превращение соединения. формулы LI в соединение формулы LII может быть проведено путем
а) гидролиза амида в соединении формулы LI в условиях кислой среды с использованием таких кислот, как Н2SO4, HCl или НВr, в подходящем растворителе, например в Н2О, этаноле, метаноле или их смеси, и реакция может протекать при температуре от +20oС до +100oС, или в условиях щелочной среды, используя такие основания как NaOH или КОН, в подходящем растворителе, таком как Н2О, этанол, метанол или их смеси, и реакция может протекать при температуре от +20oС до +100oС.
За гидролизом следует
b) бензилирование первичного амина реакцией с подходящим бензилирующим агентом, например бензилгалогенидом, таким как бензилбромид или бензилхлорид, или с активированным спиртом, например бензилмезилатом или бензилтозилатом. Реакция может быть проведена в подходящем растворителе, например N, N-диметилформамиде, ацетоне или ацетонитриле, с подходящим основанием, например NaOH, NаНСО3, К2СО3 или три-алкиламином, таким как триэтиламин, при температуре в пределах от +20oС до +150oС, получая в результате соединение формулы LII. Присутствие подходящего катализатора, например йодида калия или йодида натрия, может увеличить скорость реакции.
(xii) Восстановление соединения формулы LII для получения соединения формулы LIII может быть проведено в подходящем растворителе, таком как смесь метанол/вода или этанол/вода, в присутствии подходящего восстанавливающего агента, например гидросульфита натрия, при температуре реакционной смеси от +20oС до +100oС.

(xiii) Превращение соединения формулы LIII в соединение формулы LIV
может быть выполнено путем реакции с соединением формулы XI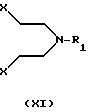
где Х представляет собой удаляемую группу, например галоген, такой как хлор или бром, или алкан- или аренсульфонилокси группу, такую как пара-толуолсульфонилокси группа, и R1 представляет собой C1-C6-алкил или С3-C6-циклоалкил. Процесс может быть проведен в подходящем растворителе, таком как этанол, бутанол, N,N-диметилформамид, ацетонитрил или в смеси воды и ацетонитрила с подходящим основанием, таким как К2СО3, NаНСО3 или КОН, и реакция может протекать при температуре от +20oС до +150oС.
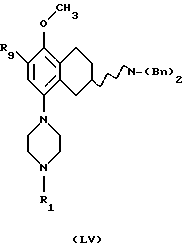
(xiv) Превращение соединения формулы LIV в соединение формулы LV, где R1 представляет собой C1-C6-алкил или С3-C6-циклоалкил, R9 представляет собой С1-C6-алкил, может быть проведено реакцией обмена металл-галоген в соответствующем безводном растворителе, таком как тетрагидрофуран или диэтиловый эфир, с использованием подходящего алкил-лития или металла, например бутиллития, лития или магниевой стружки, с последующей обработкой соответствующим алкилгалогенидом, таким как метилйодид, этилбромид или пропилйодид, и реакция может проводиться при температуре в пределах от -78oС до комнатной температуры, или путем обработки другими электрофилами, такими как ацетальдегид или метилхлорформиат, и с последующей соответствующей обработкой. Реакция может быть проведена при температуре реакционной смеси в пределах от -78oС до комнатной температуры.
В случае, когда в качестве электрофила используется ацетальдегид, за вышеприведенными реакциями следует восстановление бензинового спирта путем гидрогенизации на подходящем катализаторе, содержащем палладий, родий, платину или никель, в подходящем растворителе, например в уксусной кислоте или этаноле, и реакция может протекать при температуре от +20oС до +120oС.
В случае, когда в качестве электрофила используется метилхлорформиат, за вышеприведенными реакциями следует восстановление метилового эфира в подходящем растворителе, таком как диэтиловый эфир или тетрагидрофуран, с помощью соответствующего восстанавливающего агента, такого как алюмогидрид лития, и реакция может происходить при температуре от +20oС до кипячения с обратным холодильником, с последующим восстановлением бензинового спирта путем гидрогенизации на подходящем катализаторе, содержащим палладий, родий, платину или никель, в подходящем растворителе, например в уксусной кислоте или этаноле, и реакция может протекает при температуре от +20oС до +120oС.
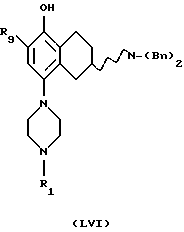
(xv) Деметилирование соединения формулы LV для получения соединения формулы LVI может проводиться обработкой соединения кислотным агентом, таким как водный раствор HBr, HI, НВr/СН3СООН, ВВr3, А1С13, пиридин-HCl, или с основным нуклеофильным агентом, таким как СН3С6H4S- или С2Н5S- в подходящем растворителе. Подходящими растворителями могут быть метилен-хлорид или хлороформ, и реакция может протекать при температуре от -78oС до +60oС.
(xvi) Превращение соединения формулы LVI в соединение формулы LVII может быть проведено путем обработки таким соединением, как трифторметансульфоновый ангидрид, в подходящем растворителе, таком как метиленхлорид или четыреххлористый углерод, в присутствии основания, такого как 2,4,6-коллидин, триэтиламин или пиридин, при температуре реакционной смеси в пределах от -78oС до комнатной температуры.
(xvii) Превращение соединения формулы LVII в соединение формулы XLVIII может быть проведено
a) путем обработки соединения формулы LVII соответствующим палладиевым катализатором, таким как палладий(II)-ацетат, и соответствующим лигандом, таким как трифенил-фосфин, в присутствии подходящей кислоты, например муравьиной кислоты, в соответствующем растворителе, таком как N,N-диметилформамид, при температуре реакционной смеси от +20oС до +120oС, с последующей
b) реакцией в подходящем растворителе, таком как метанол, в присутствии формиата аммония и Pd/C, при температуре реакционной смеси в пределах от +20oС до кипячения с обратным холодильником с получением в результате соединения формулы XLVIII.
Способы получения конечных продуктов
Другой целью настоящего изобретения является способ A(i), A(ii), В или С для получения соединения общей формулы I путем
A(i)
ацилирования, в случае, когда R1 представляет собой C1-C6-алкил или С3-C6-циклоалкил, Y представляет собой NR2CO, R2 представляет собой водород, и X, R3 и R9 такие, как определено выше для общей формулы I, за исключением тех случаев, когда R9 представляет собой заместитель, чувствительный по отношению к определенным ацилирующим агентам, соединения формулы А,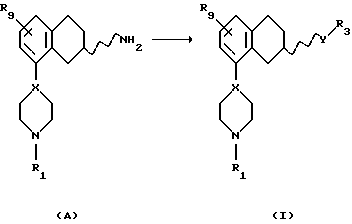
активированной карбоновой кислотой R3СОL, когда L представляет собой удаляемую группу, или карбоновой кислотой R3СООН с активирующим агентом.
Таким образом ацилирование в соответствии со способом A(i) может проводиться с соответствующей активированной карбоновой кислотой, R3СОL, где R3 такой, как определено выше, и L представляет собой удаляемую группу, такую как галоген, например хлор, в подходящем растворителе, таком как метиленхлорид или хлороформ, с подходящим основанием, например триалкиламином, таким как триэтиламин, при температуре от -20oС до кипячения с обратным холодильником, или карбоновой кислотой R3СООН, где R3 такой, как определено выше, с активирующим агентом, например N/N'-карбонилдиимидазолом, N,N'-дициклогексилкарбодиимидом или хлоридом дифенилфосфина, с подходящим основанием, таким как N-метилморфолин, в подходящем растворителе, таком как N,N-диметилформамид или тетра-гидрофуран, и реакция может бцтъ проведена при температуре от +20oС до +150oС.
A(ii)
ацилирования в случае, когда R1 представляет собой водород, Y представляет собой NR2CO, R2 представляет собой водород, Rc представляет собой защитную группу и X, R3 и R9 такие, как определено выше для общей формулы I, за исключением того, что R9 является заместителем, который чувствителен к определенным ацилирующим агентам, соединения формулы В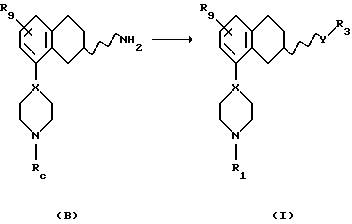
активированной карбоновой кислотой R3COL, где L представляет собой удаляемую группу, или карбоновой кислотой R3СООН с активирующим агентом, с последующим удалением защитной группы Rc.
Таким образом, ацилирование в соответствии с процессом A(ii) может быть выполнено с соответствующей активированной карбоновой кислотой, R3СОL, где R3 такой, как определено выше, и L представляет собой удаляемую группу, такую как галоген, например хлор, в подходящем растворителе, таком как метиленхлорид или хлороформ, с подходящим основанием, например триалкиламином, таким как триэтиламин, при температуре от -20oС до кипячения с обратным холодильником, или карбоновой кислотой R3СООН, где R3 такой, как определено выше, с активирующим агентом, например N,N'-карбонилдиимидазолом, N,N'-дициклогексилкарбодиимидом или хлоридом дифенилфосфина, с подходящим основанием, таким как N-метилморфолин, в подходящем растворителе, таком как N,N-диметилформамид или тетрагидрофуран, и реакция может быть проведена при температуре от +20oС до +150oС, с последующим удалением защитной группы Rc путем гидролиза в подходящем растворителе, таком как метиленхлорид или хлороформ, с подходящей кислотой, такой как трифторуксусная кислота, при температуре от +20oС до +60oС.
В.
реакции, в случае, когда Y представляет собой CONR2, R2, R3 и R9 такие, как определено выше для общей формулы I, за исключением того, что R9 представляет собой заместитель, который чувствителен к определенному алкилирующему агенту XI, соединения формулы С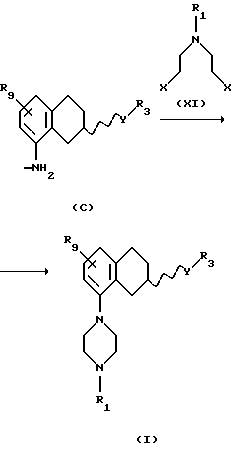
с соединением формулы XI, где Х представляет собой удаляемую группу.
Таким образом, реакция в соответствии со способом В может быть выполнена с соединением формулы XI, где R1 такой, как определено выше для общей формулы I, и Х представляет собой удаляемую группу, например галоген, такой как хлор или бром, или алкан- или аренсульфонилокси группу, такую как пара-толуолсульфонилокси группа. Процесс может проводиться в подходящем растворителе, таком как этанол, бутанол, N,N-диметилформамид, ацетонитрил или смесь воды и ацетонитрила с или без подходящего основания, например К2СО3, NaHCO3 или КОН, и реакция может протекать при температуре от +20oС до +150oС.
С.
реакции, в случае, когда Y представляет собой NR2CO, R9 представляет собой галоген, и R1, R2 и R3 такие, как определено выше для общей формулы I, соединения формулы D
с подходящим галогенирующим агентом, таким как Br2, Cl2, I2, ICl или SO2Cl2.
Таким образом, реакция в соответствии с способом С может быть проведена путем ароматического электрофильного замещения, с использованием подходящего галогенирующего агента, такого как Br2, Сl2, I2, ICl или SО2Сl2. Реакция может быть проведена с использованием соли или основания соединения D в соответствующем растворителе, например уксусной кислоте, HCl/этаноле или воде, с или без подходящего основания, например ацетата щелочного металла, такого как ацетат натрия, и при температуре реакционной смеси от -20oС до комнатной температуры.
Промежуточные вещества
Еще один аспект изобретения представляет собой соединение, имеющее формулу
где Х представляет собой N или СН;
Z представляет собой NH2 или СООН;
R1 представляет собой Н, C1-C6-алкил или С3-C6-циклоалкил;
R9 представляет собой C1-C6-алкил, С3-C6-циклоалкил, ОСF3, ОСНF2, OCH2F, галоген, CN, СF3, ОН, C1-C6-алкокси, C1-C6-алкокси -C1-C6-алкил, NR6R7, SО3СН3, SО3СF3, SО2NR6R7, незамещенное или замещенное гетероциклическое или гетероароматическое кольцо, содержащее один иди два гетероатома, выбранных из N или О, где заместитель(и) представляет(ют) собой C1-C6-алкил; иди COR8; где
R6 представляет собой Н, C1-C6-алкил или С3-C6-циклоалкил;
R7 представляет собой C1-C6-алкил или С3-C6-циклоалкил; и
R8 представляет собой C1-C6-алкил, С3-C6-циклоалкил, СF3, NR6R7, фенил, гетероароматическое кольцо, содержащее один или два гетероатома, выбранных из N, О или S, или гетероциклическое кольцо, содержащее один или два гетероатома, выбранных из N, О, S, SO и SO2, где R6 и R7 такие, как определено выше,
и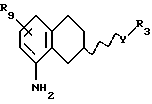
где Y представляет собой CONR2, где R2 представляет собой C1-C6-алкил,
R3 представляет собой C1-C6-алкил, С3-C6-циклоалкил или (СН2)n-арил,
где арил представляет собой фенил или гетероароматическое кольцо, содержащее один или два гетероатома, выбранных из N или О и S, и которое может быть одно- или двузамещенным R4 и/или R5; где R4, R5 и n такие, как определено выше;
R9 представляет собой C1-C6-алкил, С3-C6-циклоалкил, ОСF3, OCHF2, OCH2F, галоген, CN, СF3, ОН, C1-C6-алкокси, C1-C6-алкокси -C1-C6-алкил, NR6R7, SО3СН3, SО3СF3, SO2NR6R7, незамещенное или замещенное гетероциклическое или гетероароматическое кольцо, содержащее один или два гетероатома, выбранных из N или О, где заместитель(и) представляет(ют) собой C1-C6-алкил; или COR8; где R6, R7 и R8 такие, как определено выше.
Рабочие примеры
Следующие примеры раскрывают, но не ограничивают изобретение.
Пример 1
(R)-2-N,N-дибензиламино-8-метокси-1,2,3,4-тетрагидронафталин
К раствору (R)-8-метокси-2-амино-1,2,3,4-тетрагидронафталина гидрохлорида (24 г, 0,11 моль) в ацетонитриле (600 мл) добавляют карбонат калия (53 г, 0,39 моль), йодид калия (каталитическое количество) и бензилбромид (34 мл, 0,28 моль). Реакционную смесь перемешивают при кипячении с обратным холодильником в течение 35 часов.
После отфильтровывания осадка и удаления ацетонитрила в вакууме остаток распределяют между диэтиловым эфиром и водой. Органическую фазу отделяют, сушат (Na2SO4) и упаривают в вакууме, получая сырой продукт, который очищают на колонке из силикагеля, используя гексан/этилацетат (3:1) в качестве элюента. Выход: 36 г (91%) названного в заголовке соединения в виде твердого белого вещества: т. п. 105-107oС; [α]
Пример 2
(R)-7-N,N-дибензиламино-5,6,1,8-тетрагидро-1-нафтол
(R)-2-N,N-дибензиламино-8-метокси-1,2,3,4-тетрагидронафталин (43 г, 0,12 моль) растворяют в диэтиловом эфире (800 мл) и по каплям добавляют избыток эфирного раствора НСl. Осадок отфильтровывают и сушат в вакууме, получая белое твердое вещество. Этот сырой продукт (42 г, 0,11 моль) растворяют в безводном метиленхлориде (1 л) и охлаждают до -60oС. К этому раствору добавляют по каплям трибромид бора (16 мл, 0,15 моль), растворенного в безводном метиленхлориде (100 мл). Температуру реакционного раствора доводят до -5oС и поддерживают в течение ночи. К этому раствору, охлажденному льдом, по каплям добавляют 2 М водный раствор гидроксида аммония и смесь экстрагируют дважды ментиленхлоридом. Объединенные органические фазы сушат (Na2SO4), фильтруют и растворитель удаляют в вакууме, получая неочищенный остаток. Хроматография на силикагеле (элюент: метиленхлорид) дает 34 г (выход 93%) названного в заголовке соединения в виде густого прозрачного масла: [α]
Пример 3
(R)-2-(7-N, N-дибензиламино-5,6,7,8-тетрагидро-1-нафтилокси)-2-метилпропанамид
(R)-2-N,N-дибензиламино-5,6,7,8-тетрагидро-1-нафтол (10 г, 29 ммоль) перемешивают в безводном диоксане (150 мл) с гидридом натрия (80% в масле, 0,96 г, 32 ммоль) в течение 1 часа. Добавляют 2-бром-2-метилпропанамад (4,8 г, 29 ммоль; описанный в: Coutts, I.G. С.; Southcott, M.R. J. Chem. Soc. Perkin Trans. I, 1990, 767-770) и реакционную смесь нагревают при 100oС в течение 2,5 часов. После охлаждения осажденный бромид натрия отфильтровывают, фильтрат упаривают в вакууме и остаток распределяют между водой и метиленхлоридом. Органическую фазу отделяют, сушат (Na2SO4), фильтруют и упаривают, получая сырой продукт, который очищают на колонке силикагеля, используя метиленхлорид в качестве элюента. Выход: 9,6 г (76%) названного в заголовке соединения в виде белых кристаллов: т.п. 125-126oС; [α]
Пример 4
(R)-N-(7-N, N-дибензиламино-5,6,7,8-тетрагидро-1-нафтил)-2-гидрокси-2-метилпропанамид
К раствору (R)-2-(7-N, N-дибензиламино-5,6,7,8-тетрагидро-1-нафтилокси)-2-метилпропанамида (9,1 г, 21 ммоль) в безводном 1,3-диметил-3,4,5,6-тетрагидро-2(Н)-пиримидоне (10 мл) и сухом N,N-диметилформамиде (100 мл) добавляют гидрид натрия (80% в масле, 1,4 г, 47 ммоль) и реакционный раствор нагревают при 130oС в течение 8 часов. Раствор выливают в смесь льда и воды и трижды экстрагируют этилацетатом. Объединенную органическую фазу сушат (Na2SO4), фильтруют и выпаривают в вакууме. После хроматографии на силикагеле (элюент: хлороформ/этанол насыщенный NН3; 100:0,5) получают 7,6 г (выход 84%) названного в заголовке соединения в виде белых кристаллов: т.п. 134-135oС; [α]
Пример 5
(R)-2-N,N-дибензиламино-8-амино-1,2,3,4-тетрагидронафталин
(R)-N-(7-N, N-дибензиламино-5,6,7,8-тетрагидро-1-нафтил)-2-гидрокси-2-метилпропионамида (7,4 г, 17 ммоль) растворяют в смеси этанола (200 мл) и 20%-ного водного раствора НСl (300 мл) и нагревают при кипячении с обратным холодильником в течение 8 часов. Этанол выпаривают в вакууме, оставшийся раствор промывают дважды диэтиловым эфиром и охлаждают на ледяной бане. После подщелачивания 45%-ного водным раствором гидроксида натрия смесь экстрагируют метиленхлоридом. Объединенную органическую фазу сушат (Na2SO4), фильтруют и упаривают в вакууме. Очистка на колонке силикагеля с использованием хлороформа в качестве элюента дает 3,8 г (выход 76%) названного в заголовке соединения в виде светло-коричневого масла:
[α]
Пример 6
(R)-1-(7-N, N-дибензиламино-5,6,7,8-тетрагиаро-1-нафтил)-4-N-метилпиперазин-2,6-дион
1,1'-карбонилдиимидазол (6,0 г, 37 ммоль) добавляют к перемешиваемой суспензии метилиминодиуксусной кислоты (2,7 г, 18 ммоль) в безводном тетрагидрофуране (250 мл). Реакционную смесь нагревают до кипячения с обратным холодильником в течение 1,5 часов. Добавляют (R)-2-N,N-дибензиламино-8-амино-1,2,3,4-тетрагидронафталин (5,7 г, 17 ммоль) и перемешивание при кипячении с обратным холодильником продолжают в течение 17 часов. Вносят дополнительное количество 1,1'-карбонилдиимидазола (2,9 г, 18 ммоль) и нагревают при кипячении с обратным холодильником в течение еще 17 часов. Растворитель выпаривают в вакууме и сырой продукт очищают на колонке силикагеля с использованием хлороформа/этанола, насыщенных NН3 (100:0,5) в качестве элюента. Выход: 6,6 г (87%) названного в заголовке соединения в виде масла: [α]
Пример 7
(R)-2-N, N-дибензиламино-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин
(R)-1-(7-N, N-дибензиламино-5,6,1,8-тетрагидро-1-нафтил)-4-метилпиперазин-2,6-дион(1,4 г, 31 ммоль) добавляют к суспензии алюмогидрида лития (0,57 г, 15 ммоль) в безводном диэтиловом эфире (70 мл). Реакционную смесь нагревают при кипячении с обратным холодильником в течение 7 часов. Реакцию гасят добавлением воды (0,60 мл), 15%-ного водного раствора гидроксида натрия (0,60 мл) и снова водой (1,8 мл). Смесь фильтруют, сушат (Na2SO4) и упаривают в вакууме. Очистка на колонке силикагеля с использованием хлороформа/этанола, насыщенных NH3, (100:2) в качестве элюента дает 1,0 г (выход 79%) названного в заголовке соединения в виде густого масла: [α]
Пример 8
(R)-5-бром-2-N, N-дибензиламино-8-(4-метилпиперазин-1-ил)-1, 2,3,4-тетрагидронафталин
К раствору (R)-2-N,N-дибензиламино-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталина (2,8 г, 6,5 ммоль) и ацетата натрия (6,8 г, 83 ммоль) в уксусной кислоте (100 мл) добавляют бром (370 мл, 7,2 ммоль) одной порцией и реакционную смесь перемешивают в течение 5 минут. Растворитель выпаривают в вакууме, оставшееся твердое вещество распределяют между водой и метиленхлоридом и охлаждают на ледяной бане. Водную фазу подщелачивают 2М водным раствором гидроксида натрия и фазы разделяют. Органическую фазу сушат (Na2SO4), фильтруют и выпаривают в вакууме, получая сырой продукт, который очищают на колонке силикагеля с использованием хлороформа/этанола, насыщенных NН3 (100: 2) в качестве элюета. Выход: 2 г (61%) густого коричневого масла: ЭИМС (70 электровольт) m/z (относительная интенсивность) 503 и 505 (0,6 М+).
Пример 9
(R)-2-N, N-дибензиламино-5-гидрокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин
К раствору (R)-2-N, N-дибензиламино-5-метокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталина (2,1 г, 4,7 ммоль) в уксусной кислоте (40 мл) добавляют 47%-ный водный раствор бромистоводородной кислоты (20 мл) и реакционный раствор нагревают при кипячении с обратным холодильником в течение 7 часов. Растворитель выпаривают в вакууме и остаток растворяют в воде (75 мл) и охлаждают на ледяной бане. Раствор подщелачивают 2М водным раствором гидроксида натрия и экстрагируют метиленхлоридом. Фазы разделяют и органическую фазу сушат (Na2SO4), фильтруют и упаривают в вакууме. Очистка на колонке силикагеля с использованием хлороформа/метанола/концентрированого гидроксида аммония (95: 5: 0,5) в качестве элюента дает 1,8 г (выход 89%) названного в заголовке соединения в виде густого масла: ЭИМС (70 электровольт) m/z (относительная интенсивность) 441 (7 М+).
Пример 10
(R)-2-амино-5-гидрокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин
К раствору (R)-2-N, N-дибензиламино-5-гидрокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталина (0,70 г, 1,6 ммоль) и формиата аммония (2,4 г, 38 ммоль) в метаноле (50 мл) добавляют палладий (10%) на активированном угле. Смесь нагревают при кипячении с обратным холодильником в течение 4 часов и затем палладий отфильтровывают. Растворитель выпаривают в вакууме, остаток распределяют между диэтиловым эфиром и 2М гидроксидом аммония. Органическую фазу отделяют, сушат (Na2SO4), фильтруют и упаривают в вакууме. Остаток промывают водой и диэтиловым эфиром и затем сушат в вакууме. Выход: 200 мг (44%) серых кристаллов: т.п. 238-239oС; [α]
Пример 11
(R)-N-[5-гидрокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетра-гидро-2-нафтил]-4-бутоксибензамид
К охлажденному льдом раствору (R)-2-амино-5-гидрокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталина (100 мг, 0,38 ммоль) и триэтиламина (79 мкл, 0,57 ммоль) в N,N-диметилформамиде (30 мл) добавляют по каплям 4-бутоксибензоилхлорид в N,N-диметилформамиде (5 мл). После добавления реакционную смесь перемешивают при температуре окружающей среды в течение 15 минут. Растворитель выпаривают в вакууме и остаток очищают на колонке силикагеля, используя в качестве элюента хлороформ/метанол/концентрированный гидроксид аммония (95:5:0,5). Выход: 73 мг (44%) аморфного твердого вещества: т. п. 125oС (с разложением); [α]
Пример 12
(R)-2-N,N-дибензиламино-8-(пиперазин-1-ил)-1,2,3,4-тетрагидронафталин
(R)-2-N, N-дибензиламино-8-амино-1,2,3,4-тетрагидронафталин (9,8 г, 39 ммоль) и бис-(2-хлорэтил)амина гидрохлорид (5,5 г, 32 ммоль) растворяют в н-бутаноле (80 мл). Реакционную смесь перемешивают при 100oС и через 65 часов фильтруют, растворитель выпаривают в вакууме. Очистка на колонке силикагеля, с использованием в качестве элюента хлороформа/метанола/концентрированного гидроксида аммония (95: 5: 0,5) дает 6,0 г (выход: 51%) названного в заголовке соединения в виде густого масла: [α]
Пример 13
(R)-2-амино-8-(пиперазин-1-ил)-1,2,3,4-тетрагидронафталин
К раствору (R)-2-N, N-дибензиламино-8-(пиперазин-1-ид)-1,2,3,4-тетрагидронафталина (5,5 г, 13 ммоль) в метаноле (400 мл) добавляют формиат аммония (20 г, 0,32 моль) и палладий (10%) на активированном угле. Смесь кипятят с обратным холодильником в течение 1 часа и затем палладий отфильтровывают. Растворитель выпаривают в вакууме и остаток распределяют между метиленхлоридом и 2М раствором гидроксида аммония. Органическую фазу отделяют, сушат (Na2SO4), фильтруют и выпаривают в вакууме, получая сырой продукт, который очищают на колонке силикагеля, с использованием в качестве элюента хлороформа/метанола/концентрированного гидроксида аммония (80:20:2,5). Выход: 2,4 г (76%) названного в заголовке соединения в виде масла: [α]
Пример 14
(R)-2-амино-5-бром-8-(пиперазин-1-ил)-1,2,3,4- тетрагидронафталин
Названное в заголовке соединение получают из (R)-2-амино-8-(пиперазин-1-ил)-1,2,3,4-тетрагидронафталина, следуя общему способу из примера 8. Очистка на колонке силикагеля, с использованием в качестве элюента метиленхлорида/этанола/концентрированного гидроксида аммония (80:20:2) дает 0,8 г (67%) густого светло-коричневого масла: [α]
Пример 15
Трет-бутил (R)-4-(7-амино-4-бром-5,6,7,8-тетрагидро-1-нафтил) пиперазин-1-карбоксилат
К охлажденному на льду раствору (R)-2-амино-5-бром-8-(пиперазин-1-ил)-1,2,3,4-тетрагидронафталина (0,8 г, 2,6 ммоль) и триэтиламина (0,53 мл, 3,9 ммоль) в метиленхлориде (50 мл) добавляют ди-трет-бутилдикарбонат (0,56 г, 2,6 ммоль), растворенный в метиленхлориде (10 мл). После добавления реакционную смесь оставляют перемешиваться при комнатной температуре в течение 1 часа. Добавляют воду (10 мл) и смесь охлаждают на бане со льдом. Водную фазу подщелачивают 2М водным раствором гидроксида натрия и фазы разделяют. Органическую фазу сушат (Na2SO4), фильтруют и выпаривают в вакууме, получая сырой продукт, который очищают на колонке силикагеля, с использованием в качестве элюента хлороформа/метанола/концентрированного гидроксида аммония (95: 5: 0,5). Выход: 0,41г (38%) густого бесцветного масла: [α]
Пример 16
(R)-N-[5-бром-8-(4-трет-бутоксикарбонилпиперазин-1-ил)-1,2, 3,4-тетрагидро-2-нафтил]-4-морфолинобензамид
4-морфолинобензойную кислоту (0,50 г, 2,4 ммол; описанную у Degutis, J.; Rasteikiene, L.; Degutiene, A. Zh. Org. Khim. 1978, 14(10), 2060-2064) растворяют в тионилхлориде (10 мл). Через 2 минуты тионидхлорид выпаривают в вакууме, остаток обрабатывают толуолом и растворитель снова выпаривают в вакууме. Неочищенный хлорангидрид кислоты (81 мг, 0,36 ммоль) растворяют в метиленхлориде (10 мл) и добавляют по каплям к раствору трет-бутил (R)-4-(7-амино-4-бром-5,6,7,8-тетрагидро-1-нафтил)пиперазин-1-карбоксилата (140 мг, 0,34 ммоль) и триэтиламина (71 мкл, 0,51 ммоль) в метиленхлориде (10 мл). После добавления реакционную смесь перемешивают при температуре окружающей среды в течение 15 минут, затем промывают разбавленным водным раствором гидрокарбоната натрия и фазы разделяют. Органическую фазу сушат (Na2SO4), фильтруют и выпаривают в вакууме, остаток очищают на колонке силикагеля, с использованием в качестве элюента хлороформа/этанола, насыщенных NН3 (100:2). Выход: 160 мг (79%) густого бесцветного масла: [α]
Пример 17
(R)-N-[5-бром-8-(пиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид
К охлажденному льдом раствору (R)-N-[5-бром-8-(4-трет-бутилоксикарбонилпиперазин-1-ил)-1,2,3,4-тетрагидро-2- нафтил] -4-морфолинобензамида (150 мг, 0,26 ммоль) в метиленхлориде (20 мл) добавляют трифторуксусную кислоту (0,7 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение 20 часов. Растворитель выпаривают в вакууме, остаток растворяют в воде (20 мл), подщелачивают 2М водным раствором гидроксида натрия и экстрагируют метиленхлоридом. Фазы разделяют, органическую фазу сушат (Na2SO4), фильтруют и выпаривают в вакууме. Остаток очищают на колонке силикагеля, с использованием в качестве элюента хлороформа/метанола/концентрированного гидроксида аммония (90: 10: 1). Выход: 94 мг (72%) белых кристаллов: т.п. 228-229oС; [α]
Пример 18
(R)-2-амино-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин
К раствору (R)-2-N,N-дибензиламино-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталина (4,0 г, 9,4 ммоль) в метаноле (250 мл) добавляют формиат аммония (14 г, 56 ммоль) и палладий (10%) на активированном угле (1,4 г). Смесь кипятят с обратным холодильником в течение 3 часов, затем палладий отфильтровывают. Растворитель выпаривают в вакууме, остаток распределяют между метиленхлоридом и 2М раствором гидроксида аммония. Органическую фазу отделяют, сушат (Na2SO4), фильтруют и выпаривают в вакууме, получая неочищенный продукт, который очищают на колонке силикагеля с использованием в качестве элюента хлороформа/метанола/концентрированного гидроксида аммония (90:9: 0,5). Выход: 1,9 мг (83%) масла: [α]
Пример 19
(R)-2-амино-5-бром-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин
Названное в заголовке соединение получают из (R)-2-амино-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталина, используя общий способ из примера 8. Очистка на колонке силикагеля с использованием в качестве элюента хлороформа/этанола/концентрированного гидроксида аммония (80:20:2) дает 630 мг (выход 89%) густого бесцветного масла: ЭИМС (70 электровольт) m/z (относительная интенсивность) 323 и 325 (20, М+).
Пример 20
(R)-N-[5-бром-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид
Названное в заголовке соединение получают из (R)-2-амино-5-бром-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталина, используя общий способ из примера 16. Очистка на колонке силикагеля с использованием в качестве элюента хлороформа/метанола/концентрированного гидроксида аммония (95:5:1) дает 100 мг (выход 62%) белых кристаллов: т.п. 245-246o C C[α]
Пример 21
(R)-2-амино-8-бром-5-метокси-1,2,3,4-тетрагидронафталина гидрохлорид
(R)-2-амино-5-метокси-1,2,3,4-тетрагидронафталина гидрохлорид (5,0 г, 23 ммоль) растворяют в уксусной кислоте (300 мл) в атмосфере азота. Добавляют ацетат натрия (5,5 г, 70 ммоль), затем одной порцией добавляют бром (3,5 г, 23 ммоль). Смесь перемешивают в течение 5 минут при комнатной температуре. Растворитель удаляют в вакууме, остаток распределяют между этилацетатом и NaOH (2M). Слои разделяют, водную фазу дважды экстрагируют этилацетатом. Органические слои объединяют и сушат (Na2SO4). Растворитель удаляют в вакууме, получая остаток в виде коричневого масла. Соль НСl осаждают из диэтилового эфира/метиленхлорида добавлением НСl в диэтиловый эфир (3М): Выход: 7,7 г (94%). Перекристаллизация из метанола дает названое в заголовке соединение в виде игольчатых кристаллов: т.п. 264-265oС; [α]
Пример 22
(R)-8-бром-2-N,N-дибензиламино-5-метокси-1,2,3,4-тетрагидронафталин
(R)-2-амино-8-бром-5-метокси-1,2,3,4-тетрагидронафталина гидрохлорид (4,5 г, 17,5 ммоль), бензилбромид (6,6 г, 38 ммоль), карбонат калия (9,7 г, 70 ммоль) и йодид калия (100 мг, каталитическое количество) перемешивают с ацетонитрилом (250 мл) в атмосфере азота и кипятят с обратным холодильником в течение 18 часов. Растворитель удаляют в вакууме и остаток распределяют между этилацетатом и аммиаком (2М). Слои разделяют, органический слой сушат (MgSO4). Растворитель удаляют в вакууме, получая остаток, который очищают с помощью флэш-хроматографии на силикагеле, используя в качестве элюента гексан/метиленхлорид 8:2. Названое в заголовке соединение получают в виде масла. Выход 7,5 г (98%): [α]
Пример 23
(R)-2-N, N-дибензиламино-5-метокси-8-(4-метилпиперназин-1-ил)-1,2,3,4-тетрагидронафталин
К раствору (R)-8-бром-2-N, N-дибензиламино-5-метокси-1,2,3,4-тетрагидронафталина (19 г, 44 ммоль) в сухом толуоле (500 мл) в атмосфере аргона добавляют N-метилпиперазин (5,9 мл, 53 ммоль), трис(дибензилиденацетон)дипалладий(0) (0,41 г, 0,44 ммоль), (R)-BINAP (0,82 г, 1,3 ммоль) и трет-бутоксид натрия (0,40 мг, 4,2 ммоль). Темный раствор перемешивают при 85oС в течение 23 часов и затем охлаждают, фильтруют и выпаривают в вакууме. Очистка на колонке силикагеля с использованием в качестве элюента хлороформа/этанола, насыщенных NН3 (100:2) дает 19 г (97%) густого бесцветного масла: [α]
Пример 24
(R)-2-амино-5-метокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тет-рагидронафталин
Названное в заголовке соединение получают из (R)-2-N,N-дибензиламино-5-метокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталина, следуя общему способу из примера 10. Выход: 5,3 г (82%) густого бесцветного масла: [α]
Пример 25
(R)-N-[5-метокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид
К раствору 4-морфолинобензойной кислоты (0,92 г, 4,5 ммоль; описанную в: Degutis, J. ; Rasteikiene, L.; Deguitiene, A. Zh. Org. Khim. 1978, 14(10), 2060-2064) в безводном N,N-диметилформамиде (75 мл) добавляют 1,1'-карбонил-диимидазол (0,76 г, 4,8 ммоль) и реакционную смесь нагревают при 75oС. Когда выделение диоксида углерода заканчивается (через 45 минут), реакционную смесь охлаждают до комнатной температуры, добавляют раствор (R)-2-амино-5-метокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталина (1,2 г, 4,2 ммоль) растворенный в безводном N,N-диметилформамиде (20 мл). Реакционную смесь оставляют перемешиваться при температуре окружающей среды в течение 48 часов, растворитель выпаривают в вакууме. Очистка на колонке силикагеля с использованием в качестве элюента хлороформа/метанола/концетрированного гидроксида аммония (180:5:0,5) с последующей перекристаллизацией из этилацетата и нескольких капель метанола дает 1,0 г (53%) белых кристаллов: т.п. 237-238oС [α]
Пример 26
(R)-N-[5-гидрокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-цианобензамид
Названное в заголовке соединение получают из (R)-2-амино-5-гидрокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталина, следуя общему способу получения из примера 11. Очистка на колонке силикагеля с использованием в качестве элюента хлороформа/метанола/концетрированного гидроксида аммония (95: 5: 0,5) дает 71 мг (выход 45%) светло-коричневых кристаллов: т.п. 144oС (агломерат); [α]
Пример 27
(R)-N-[5-метокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинокарбонилбензамид
Названное в заголовке соединение получают из (R)-2-амино-5-гидрокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталина, следуя общему способу получения из примера 16. Очистка на колонке силикагеля с использованием в качестве элюента хлороформа/метанола/концетрированного гидроксида аммония (96:4:0,3) после перекристаллизации из этилацетата/диэтилового эфира дает 93 мг (выход 52%) белых кристаллов: т.п. 209-210oС [α]
Пример 28
(R)-N-[5-бром-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинокарбонилбензамид
Названное в заголовке соединение получают из (R)-2-амино-5-бром-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталина, следуя общему способу получения из примера 16. Очистка на колонке силикагеля с использованием в качестве элюента хлороформа/метанола/концентрированного гидроксида аммония (96: 4: 0,3) после перекристаллизации из этилацетата/диэтилового эфира дает 110 мг (выход 64%) белых кристаллов: т.п. 228-230oС [α]
Пример 29
Метил 5-метокси-8-нитро-1,2,3,4-тeтpaгидpoнaфтaлин-2-кapбoксилат
Метил 5-метокси-1,2,3,4-тетрагидронафталин-2-карбоксилат (1,1 г, 5 ммоль; описанный в: Johnson, D. W.; Manger, L,N, Aust. J. Chem. 1974, 8, 1277-1286) растворяют в уксусной кислоте (20 мл), обрабатывают 70%-ной азотной кислотой (0,4 мл) при 0oС в течение 1 часа и смесь выливают в ледяную воду и диэтиловый эфир. Органическую фазу отделяют, выпаривают в вакууме и остаток растирают с диизопропиловым эфиром, получая 0,27 г (20%) названного в заголовке соединения в виде кристаллов: т.п. 100-104oС; ЭИМС (70 электровольт) m/z (относительная интенсивность) 265 (35, М+).
Пример 30
5-метокси-8-нитро-1,2,3,4-тетрагидронафталин-2-карбоновая кислота
Смесь метил 5-метокси-8-нитро-1,2,3,4-тетрагидронафталин-2-карбоксилата (1,9 г, 7,1 ммоль) в метаноле (20 мл) и 2М NaOH (10 мл) кипятят с обратным холодильником в течение 1,5 часов и растворитель выпаривают в вакууме. Остаток помещают в этилацетат и подкисляют. Органическую фазу отделяют, сушат и выпаривают в вакууме, получая 1,7 г (выход 95%) кристаллов: т.п. (после перекристаллизации в диизоприловом эфире/этаноле) 189-190oС; ЭИМС (70 электровольт) m/z (относительная интенсивность) 251 (30, М+).
Пример 31
М-(4-морфолинофенил)-5-метокси-8-нитро-1,2,3,4-тетрагидро-нафталин-2-карбоксамид
Смесь 5-метокси-8-нитро-1,2,3,4-тетрагидронафталин-2-карбоновой кислоты (1,3 г, 5 ммоль), толуола (20 мл) и тионилхлорида (1,8 мл, 25 ммоль) нагревают при 80oС в течение 1 часа. Растворитель удаляют в вакууме и остаток, растворенный в метиленхлориде (10 мл), добавляют к раствору 4-морфолиноанилина (890 мг, 5 ммоль) и триэтиламина (1,0 г, 10 ммоль) в метиленхлориде (20 мл) при 0oС. Смесь перемешивают при 20oС в течение 2 часов, добавляют воду и осадок фильтруют, получая 1,9 г (90%) названного в заголовке продукта в виде кристаллов; т.п. 251-253oС; ЭИМС (70 электровольт) m/z (относительная интенсивность) 411 (100, М+).
Пример 32
N-(4-морфолинофенил)-8-амино-5-метокси-1,2,3,4-тетрагидронафталин-2-карбоксамид
Раствор N-(4-морфолинофенил)-5-метокси-8-нитро-1,2,3,4-тетрагидронафталин-2-карбоксамида (2,05 г, 5 ммоль) и дитионита натрия (3,5 г, 20 ммоль) в N, N-диметилформамиде (20 мл) и воде (2 мл) нагревают при 90o в течение 7 часов. После охлаждения реакционную смесь распределяют между водой и этилацетатом, фазы разделяют, органическую фазу промывают дважды водой и выпаривают в вакууме. Остаток растирают с диизопропиловым эфиром/этилацетатом, получая 1,4 г (выход 72%) названного в заголовке продукта в виде кристаллов: т.п. 219-222oС; ЭИМС (70 электровольт) m/z (относительная интенсивность) 381 (70, М+).
Пример 33
N-(4-морфолинофенил)-8-(4-метилпиперазинил)-5-метокси-1,2,3,4-тетрагидронафталин-2-карбоксамид
Раствор N-(4-морфолинофенил)-8-амино-5-метокси-1,2,3,4-тетрагидронафталин-2-карбоксамида (1,4 г, 3,5 ммоль), бис-(2-хлорэтил)-метиламина гидрохлорида (960 мг, 5 ммоль) и гидрокарбоната натрия (420 мг, 5 ммоль) в н-бутаноле (30 мл) нагревают при 90o в течение 5 часов. После охлаждения добавляют 2М гидроксид аммония (30 мл) и смесь нагревают при 50oС в течение 1 часа. Фазы разделяют, выпаривают в вакууме и очищают с помощью флэш-хроматографии на силикагеле с хлороформом/этанолом/конц. гидроксидом аммония 90/10/0,3 в качестве элюента. Выход: 320 мг (20%) названного в заголовке соединения: т. п. 230-232oС; ЭИМС (70 электровольт) m/z (относительная интенсивность) 464 (75, М+).
Пример 34
N-(4-морфолинокарбонилфенил)-5-метокси-8-нитро-1,2,3,4-тетрагидронафталин-2-карбоксамид
Смесь 5-метокси-8-нитро-1,2,3,4-тетрагидронафталин-2-карбоновой кислоты (1,0 г, 4 ммоль), толуола (20 мл), N,N-диметилформамида (10 капель) и тионилхлорида {1,5 мл, 20 ммоль) нагревают при 60oС в течение 1 часа. Растворитель удаляют в вакууме и остаток, растворенный в метиленхлориде (20 мл), добавляют к раствору 4-аминобензоилморфолина (820 мг, 4 ммоль, описанный в: Devlin J.P. J. Chem. Soc. Perkin Trans. I, 1975, 830-841) и триэтиламина (800 мг, 8 ммоль) в метиленхлориде (30 мл) при 5oС. После перемешивания при 20oС в течение 2 часов добавляют воду, органическую фазу отделяют, сушат, растворитель удаляют в вакууме. Маслянистый остаток кристаллизуют из диизоприлового эфира/этилацетата, получая 1,2 г (выход 73%) названного в заголовке соединения в виде кристаллов: т. п. 186-189oС; ЭИМС (70 электровольт) m/z (относительная интенсивность) 439 (20, М+).
Пример 35
N-(морфолинокарбонилфенил)-8-амино-5-метокси-1,2,3,4-тетрагидронафталин-2-карбоксамид
Раствор N-(4-морфолинокарбонилфенил)-5-метокси-8-нитро-1,2,3,4-тетрагидронафталин-2-карбоксамида (1,3 г, 2,8 ммоль) и дитионита натрия (2,0 г, 11 ммоль) в N,N-диметилформамиде (20 мл) и воде (2,5 мл) нагревают при 85o в течение 3 часов. После охлаждения реакционную смесь распределяют между водой и этилацетатом, фазы разделяют и органическую фазу промывают дважды водой и выпаривают в вакууме. Органическую фазу сушат и упаривают. Остаток обрабатывают диизоприловым эфиром, получая 310 мг (выход 30%) названного в заголовке соединения в виде кристаллов: ЭИМС (70 электровольт) m/z (относительная интенсивность) 409 (100, М+).
Пример 36
N-(морфолинокарбонилфенил)-8-(4-метилпиперазин-1-ил)-5-метокси-1,2,3,4-тетрагидронафталин-2-карбоксамид
Раствор N-(морфолинокарбонилфенил)-8-амино-5-метокси-1,2,3,4-тетрагидронафталин-2-карбоксамида (280 мг, 0,69 ммоль), бис(2-хлорэтил)метиламин гидрохлорида (190 мг, 1,0 ммоль) и гидрокарбоната натрия (84 мг, 1,0 ммоль) в н-бутаноле (20 мл) нагревают при 90o в течение 5 часов. После охлаждения добавляют 2М гидроксид аммония (10 мл) и смесь нагревают при 50oС в течение 1 часа. Органическую фазу выпаривают в вакууме, остаток очищают с помощью флэш-хроматографии на колонке силикагеля, используя в качестве элюента хлороформ/этанол/гидроксид аммония (90;10:0,5), получая 60 мГ (18%) названного в заголовке соединения: ЭИМС (70 электровольт) m/z (относительная интенсивность) 492 (50, М+).
Пример 37
(R)-2-амино-5-метокси-8-(1-метилпиперидин-4-ил)-1,2,3,4-тетрагидронафталин
(R)-8-бром-2-N,N-дибензиламино-5-метокси-1,2,3,4-тетрагидронафталин (6,8 г, 16 ммоль) растворяют в безводном тетрагидрофуране (100 мл) в атмосфере азота. Раствор охлаждают до -78oС и по каплям добавляют н-бутиллитий (11,7 мл, 1,6 М, 19 ммоль) в течение 3 минут. Смесь перемешивают в течение 5 минут и N-метил-4-пиперидон (5,4 г, 48 ммоль) добавляют в течение 3 минут. Убирают охлаждающую баню, дают температуре подняться до 0oС, а затем реакцию гасят добавлением воды. Слои разделяют, органический слой сушат (MgSO4). Растворитель удаляют в вакууме, получая остаток, который очищают кристаллизацией (этилацетат/гексан). Выход 5,8 г (77%): ЭИМС (70 электровольт) m/z (относительная интенсивность) 470 (2, М+). Кристаллы (4,6 г, 9,8 ммоль) растворяют в толуоле, добавляют пара-толуолсульфоновую кислоту (2,8 г, 15 ммоль) и реакционную смесь перемешивают при кипячении с обратным холодильником в течение 8 часов под азотом с азеотропной отгонкой воды в насадку Дина-Старка. Охлажденную реакционную смесь промывают 2М водным раствором гидроксида натрия, фазы разделяют, сушат (MgSO4), фильтруют и упаривают в вакууме, получая густое масло: ЭИМС (70 электровольт) m/z (относительная интенсивность) 452 (1, М+). Масло (0,6 г, 1,3 ммоль) растворяют в растворе метанола (30 мл) и воды (15 мл) и добавляют формиат аммония (1,7 г, 26 ммоль) и палладий (0,3 г: 10% на активированном угле). Смесь кипятят с обратным холодильником в течение 45 минут, палладий отфильтровывает.
Растворитель выпаривают в вакууме, остаток распределяют между этилацетатом и 2М раствором гидроксида аммония. Органическую фазу отделяют, сушат (MgSO4), фильтруют и упаривают в вакууме, получая 300 мг (выход 95%) названного в заголовке соединения.
Пример 38
(R)-N-[5-метокси-8-(1-метилпиперидин-4-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид
Названное в заголовке соединение получают из (R)-2-амино-5-метокси-8-(1-метилпиперидин-4-ил)-1,2, 3,4- тетрагидронафталина, следуя общему способу получения из примера 16. Очистка на колонке силикагеля, используя в качестве элюента метиленхлорид/этанол/концентрированный гидроксид аммония (10:1:0,5) дает 135 мг (выход 53%) кристаллов: т.п. 237-242oС (с разложением); [α]
Пример 39
Хроматографическое получение энантиомеров N-(4-морфолинофенил)-8-(4-метилпиперазинил)-5-метокси-1,2,3,4-тетрагидронафталин-2-карбоксамида
N-(4-морфолинофенил)-8-(4-метилпиперазинил)-5-метокси-1,2,3,4-тетрагидронафталин-2-карбоксамид (5 мг) растворяют в 4 мл элюента, состоящего из ацетонитрила и фосфатного буфера с рН 3,0, μ=0,1 (62,5:37,5 объем/объем). Этот раствор очищают на колонке Nucleosil 7 C18 (25•250 мм) с вышеприведенной подвижной фазой для удаления последних элюирующихся загрязнений. Собранные фракции основного компонента концентрируют при пониженном давлении при 35-39oС. Остаток растворяют в 30 мл элюента, состоящего из 10 мМ ацетата аммония, диэтиламина и уксусной кислоты (4000+2+2, объем/объем/объем, рН 5,26), и хиральное полупрепаративное получение энантиомеров N-(4-морфолинофенил)-8-(4-метилпиперазинил)-5-метокси-1,2,3,4-тетрагидронафталин-2-карбоксамида выделяют на полупрепаративной колонке Chiral AGP (10•150 мм), используя предколонку, заполненную той же стационарной фазой. Используется скорость протекания 2,0 мл/мин и данные регистрируются при 260 нм. Фракции обоих энантиомеров собирают раздельно и концентрируют до объема около 5 мл при пониженном давлении при 35-39oС. рН концентрированных фракций доводят до 10-11 с помощью 5М NaOH и экстрагируют хлороформом. Две органические фазы промывают водой и сушат безводным сульфатом магния. После фильтрации через стекловату органические фильтраты упаривают в вакууме, получая два энантиомера в виде двух желтоватых твердых веществ.
Пример 40
(R)-2-N, N-дибензиламино-5-(1-гидроксиэтил)-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин
(R)-5-бром-2-N, N-дибензиламино-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин (1,4 г, 2,8 ммоль) растворяют в свежеперегнанном тетрагидрофуране (100 мл), промывают током аргона и охлаждают до -78oС. К раствору добавляют трет-бутиллитий (2,6 мл, 1,4 М в пентане, 3,7 ммоль) и красноватый раствор перемешивают при температуре окружающей среды в течение 10 минут. Добавляют ацетальдегид (320 мкл, 5,7 ммоль) и реакционную смесь перемешивают при -78oС в течение 10 минут, при 0oС в течение 2 часов и при комнатной температуре в течение 10 минут. Реакцию гасят водой и растворитель выпаривают в вакууме. Остаток распределяют между диэтиловым эфиром (100 мл) и 2М NH3 (20 мл) и водную фазу экстрагируют диэтиловым эфиром (20 мл). Объединенные органические слои промывают насыщенным солевым раствором (20 мл) и сушат (MgSO4). Растворитель выпаривают, получая 2,0 г сырого продукта. Очищение на колонке силикагеля, с использованием в качестве элюента хлороформ/метанол/конц. NН3 (95:5:0,5), дает 910 мг (выход 68%) названного в заголовке соединения в виде желтоватой пены; ESI m/z (относительная интенсивность) 470 (100, М+1).
Пример 41
(R)-2-амино-5-этил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин
(R)-2-N, N-дибензиламино-5-(1-гидоксиэтил)-1,2,3,4-тетрагидронафталин (1,6 г, 3,4 ммоль) растворяют в уксусной кислоте (80 мл) и перемешивают при 100oС в течение 2 часов. Растворитель выпаривают в вакууме и остаток растворяют в метаноле (150 мл). Добавляют палладий (10%) на активированном угле (600 мг) и раствор промывают потоком азота. К раствору добавляют формиат аммония (1,7 г, 28 ммоль) и реакционную смесь перемешивают при 65oС в течение 2 часов. Катализатор отфильтровывают, растворитель выпаривают в вакууме, получая 1,3 г сырого продукта. Остаток распределяют между метиленхлоридом (120 мл) и 2М NН3 (30 мл). Органическую фазу промывают насыщенным солевым раствором (20 мл) и сушат (MgSO4). Растворитель выпаривают в вакууме, получая 740 мг (выход 79%) названного в заголовке соединения в виде белого полукристаллического твердого вещества: ЭИМС (70 электровольт) m/z (относительная интенсивность) 273 (24, М+).
Пример 42
(R)-N-[5-этил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид
4-морфолинобензойную кислоту (64 мг, 0,31 ммоль) растворяют в сухом N, N-диметилформамиде (1 мл), добавляют 1,1'-карбонилдиимидазол (52 мг, 0,32 ммоль). Реакционную смесь перемешивают при 75oС в течение 1 часа и охлаждают до комнатной температуры. Добавляют раствор (R)-2-амино-5-этил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин (80 мг, 0,29 ммоль) в сухом N, N-диметилформамиде (3 мл), реакционную смесь перемешивают при комнатной температуре в течение 14 часов. Растворитель выпаривают, остаток сушат в вакууме. Сырой продукт очищают с помощью препаративной ТСХ на силикагеле, используя в качестве элюента хлороформ/метанол/конц. NН3 (95:5;0,5), получая 85 мг (выход 59%) названного в заголовке соединения в виде белого твердого вещества: т. п. 234oС (разлож); ЭИМС (70 электровольт) m/z (относительная интенсивность) 462 (27, М+); [α]
Пример 43
(R)-N-[5-этил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинокарбонил)бензамид
4-морфолинокарбонилбензойную кислоту (180 мг, 0,77 ммоль; описанную в: J. Med. Chem. 1994, 37(26), 4538-4554) и 1,1'- карбонилдиимидазол (130 мг, 0,80 ммоль) растворяют в сухом N,N-диметилформамиде и перемешивают при 75oС в течение 2 часов. После охлаждения до комнатной температуры добавляют раствор (R)-2-амино-5-этил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталина (200 мг, 0,73 ммоль) в сухом N,N-диметилформамиде, реакционную смесь перемешивают в течение 60 часов. Растворитель выпаривают в вакууме и остаток распределяют между метиленхлоридом (60 мл) и 2М NН3 (5 мл). Органическую фазу промывают насыщенным солевым раствором (10 мл) и сушат (Na2SO4). Выпаривание растворителя в вакууме дает 360 мг сырого продукта. Очистка с помощью колоночной хроматографии на силикагеле с использованием в качестве элюента хлороформ/метанол/конц. NН3 (95:5:0,5) дает 240 мг (выход 65%) названного в заголовке соединения в виде белого твердого вещества: т.п. 213-214oС; ЭИМС (70 электровольт) m/z (относительная интенсивность) 490 (27, М+); [α]
Пример 44
(R)-2-N, N-дибензиламино-5-дифторметокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин
К раствору (R)-2-N,N-дибензиламино-5-гидрокси-8-(4-метил-пиперазин-1-ил)-1,2,3,4-тетрагидронафталина (1 г, 2,3 ммоль) в 2-пропаноле (75 мл) добавляют гидроксид натрия (2,8 г, 69 ммоль) при перемешивании пока большая часть не растворится (1,5 часа), реакционную смесь нагревают до 65oС. Хлордифторметан пропускают через реакционный раствор при энергичном перемешивании в течение 6 минут, реакционной смеси дают остыть до комнатной температуры. Реакционную смесь фильтруют, растворитель выпаривают в вакууме и остаток распределяют между диэтиловым эфиром и водой. Фазы разделяют, органическую фазу сушат (Na2SO4), фильтруют и упаривают в вакууме. Очистка на колонке силикагеля с использованием в качестве элюента хлороформ/этанол, насыщенные NН3 (100: 1) дает 230 мг (выход 21%) густого бесцветного масла: [α]
Пример 45
(R)-2-амино-5-дифторметокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин
Названное в заголовке соединение получают из (R)-2-N,N-дибензиламино-5-дифторметокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталина, следуя общему способу получения из примера 10. Выход 67 мг (42%) густого бесцветного масла: ЭИМС (70 электровольт) m/z (относительная интенсивность) 311 (28, М+).
Пример 46
(R)-N-[5-дифторметокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил]-4-морфолинобензамид
Названное в заголовке соединение получают из (R)-2-амино-5-дифторметокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталина, следуя общему способу получения из примера 25. Очистка на колонке силикагеля с использованием в качестве элюента хлороформ/этанол с NH3 (100:3) дает 26 мг (выход 24%) белых кристаллов: т.п. 222-223oС; [α]
Пример 47
(R)-2-N-[8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил]-4-трифторметилбензамид
К охлажденному льдом раствору (R)-2-амино-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталина (110 мг, 0,44 ммоль) и триэтиламина (91 мкл, 0,66 ммоль) в метиленхлориде (20 мл) добавляют по каплям 4-(трифторметил)бензоилхлорид (96 мг, 0,46 ммоль) в метиленхлориде (5 мл). После добавления реакционный раствор оставляют перемешиваться при температуре окружающей среды в течение 15 минут и затем промывают разбавленным водным раствором гидрокарбоната натрия. Фазы разделяют, органическую фазу сушат (Na2SO4), фильтруют и упаривают в вакууме, получая сырой продукт, который очищают на колонке силикагеля с использованием в качестве элюента хлороформа/этанола, насыщенных NНз (100:2). Выход: 150 мг (81%) названного в заголовке соединения в виде белых кристаллов: т.п. 203-204oС; [α]
Пример 48
(R)-N-[5-бром-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-трифторметилбензамид
(R)-N-[8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил]-4-трифторметилбензамид (80 мг, 0,19 ммоль) и ацетат натрия (200 мг) растворяют в уксусной кислоте (3 мл) и смесь перемешивают при комнатной температуре. К реакционной смеси добавляют по каплям бром (34 мг, 0,21 ммоль), смесь перемешивают при температуре окружающей среды в течение 2 часов. Добавляют 2М раствор гидроксида натрия (100 мл), смесь экстрагируют диэтиловым эфиром (2•50 мл). Объединенный органический слой сушат над безводным сульфатом натрия, фильтруют и концентрируют в вакууме. Очистка на колонке силикагеля с использованием в качестве элюента метиленхлорида/этанола, насыщенных NН3 (94: 6), дает 80 мг (выход 85%) названного в заголовке соединения в виде белого твердого вещества: т.п. 229-230oС; [α]
Пример 49
(R)-2-N, N-дибензиламино-5-метоксиметил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин
(R)-5-бром-2-N, N-дибензиламино-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин (400 мг, 0,79 ммоль) растворяют в свежеперегнанном тетрагидрофуране (40 мл), промывают струей аргона и охлаждают до -78oС. К раствору добавляют трет-бутиллитий (740 мкл, 1,4 М в пентане, 1,0 ммоль). Красноватый раствор перемешивают при температуре окружающей среды в течение 10 минут. Добавляют бромметилметиловый эфир (65 мкл, 0,79 ммоль), реакционную смесь перемешивают при -78oС в течение 1 часа, при 0oС в течение 1 часа и при комнатной температуре в течение 10 минут. Реакцию гасят водой, растворитель выпаривают. Остаток распределяют между диэтиловым эфиром (70 мл) и 2М NН3 (15 мл), водный слой экстрагируют диэтиловым эфиром (20 мл). Объединенные органические слои промывают солевым раствором (15 мл) и сушат (MgSO4). Растворитель выпаривают, получая 330 мг сырого продукта. Очистка на колонке силикагеля с использованием в качестве элюента хлороформа/метанола/конц. NН3 (250: 5: 0,5) и (180:5:0,5) дает 160 мг (выход 43%) названного в заголовке соединения в виде желтоватого масла: ЭИМС (70 электровольт) m/z (относительная интенсивность) 469 (4, M+); [α]
Пример 50
(R)-2-амино-5-метоксиметил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин
(R)-2-N, N-дибензиламино-5-метоксиметил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин (160 мг, 0,34 ммоль) растворяют в метаноле и раствор промывают потоком азота. Добавляют палладий (10%) на активированном угле (80 мг) и формиат амония (170 мг, 2,7 ммоль). Реакционный раствор перемешивают при 65oС в течение 2 часов. Катализатор отфильтровывают, растворитель выпаривают в вакууме, получая 97 мг сырого продукта. Очистка с помощью препаративной ТСХ с использованием в качестве элюента хлороформа/этанола, насыщенных аммиаком (8: 1), дает 72 мг (выход 73%) названного в заголовке соединения в виде полутвердого вещества: ЭИМС (70 электровольт) m/z (относительная интенсивность) 289 (40, М+); [α]
Пример 51
(R)-N-[5-метоксиметил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил]-4-морфолинобензамид
4-морфолинобензойную кислоту (54 мг, 0,26 ммоль) растворяют в сухом N, N-диметилформамиде (1 мл) и добавляют 1,1'-карбонилдиимидазол. Реакционную смесь перемешивают при 75oС в течение 1,5 часов и охлаждают до комнатной температуры. Добавляют раствор (R)-2-амино-5-метоксиметил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталина (72 мг, 0,25 ммоль) в сухом N,N-диметилформамиде (3 мл). Реакционную смесь перемешивают при комнатной температуре в течение 15 часов. Растворитель выпаривают, получая 160 мг сырого продукта. Очистка с помощью препаративной ТСХ с использованием в качестве элюента хлороформа/этанола/конц. NH3 (95:5:0,5) дает 95 мг (выход 80%) названного в заголовке соединения в виде твердого вещества: т.п. 200oС (разлож); (ЭИМС (70 электровольт) m/z (относительная интенсивность) 478 (7, М+); [α]
Пример 52
(R)-2-N, N-дибензиламино-5-гидроксиметил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин
(R)-5-бром-2-N,N-дибензиламино-8-(4-метилпиперазин-1-ил)-1, 2,3,4-тетрагидронафталин (800 мг, 1,6 ммоль) растворяют в свежеперегнанном тетрагидрофуране (80 мл), промывают потоком аргона и охлаждают до -78oС. К раствору добавляют трет
бутиллитий (1,5 мл, 1,4 М в пентане, 2,1 ммоль), реакционную смесь перемешивают при комнатной температуре в течение 10 минут. Добавляют метилхлорформиат (250 мкл, 3,2 ммоль), реакционную смесь перемешивают при -78oС в течение 50 минут и при 0oС в течение 1 часа. Реакцию гасят водой, растворитель выпаривают в вакууме. Остаток распределяют между диэтиловым эфиром (90 мл) и 2 М NН3 (15 мл). Органический слой промывают насыщенным солевым раствором (10 мл) и сушат (MgSO4). Растворитель выпаривают в вакууме, получая 770 мг сырого продукта. Очистка с помощью колоночной хроматографии на силикагеле с использованием в качестве элюента хлороформа/этанола/конц. NН3 (250: 5: 0,5) дает 610 мг (R)-5-карбоксиметил-2-N,N-дибензиламино-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталина (содержащего 13% соответствующего 5-водородного аналога) в виде желтоватого масла: ЭИМС (70 электровольт) m/z (относительная интенсивность) 483 (1, М+). Метиловый сложный эфир (610 мг, 1,1 ммоль) растворяют в свежеперегнанном тетрагидрофуране (35 мл), добавляют алюмогидрид лития (120 мг, 3,1 ммоль). Реакционную смесь перемешивают при 45oС в течение 2 часов с последующим охлаждением до комнатной температуры. Реакцию гасят водой (120 мкл), 15% NaOH (120 мкл) и водой (240 мкл) с последующим перемешиванием взвеси при комнатной температуре в течение 2,5 часов. Осадок отфильтровывают, растворитель выпаривают в вакууме, получая 730 мг сырого продукта. Очистка с помощью колоночной хроматографии на силикагеле с использованием в качестве элюента хлороформа/метанола/конц. NН3 (95; 5:0,5) дает 360 мг (выход 50%) названного в заголовке соединения в виде белой пены: ЭИМС (70 электровольт) m/z (относительная интенсивность) 455 (1, М+); [α]
Пример 53
(R)-2-амино-5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин
(R)-2-N, N-дибензиламино-5-гидроксиметил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин (360 мг, 0,78 ммоль) растворяют в метаноле (35 мл), добавляют палладий (10%) на активированном угле (170 мг) и раствор промывают потоком азота. К раствору добавляют формиат аммония (390 мг, 6,2 ммоль), реакционную смесь перемешивают при 65oС в течение 13 часов. Катализатор отфильтровывают, растворитель упаривают в вакууме, получая 220 мг остатка. Сырое гидроксиметильное соединение растворяют в уксусной кислоте (25 мл), добавляют палладий (10%) на активированном угле (60 мг), раствор промывают потоком водорода. Реакционную смесь гидрогенизируют при комнатной температуре и при атмосферном давлении в течение 4 часов. Катализатор отфильтровывают и добавляют новую порцию палладия (10%) на активированном угле (160 мг) с последующей гидрогенизацией при комнатной температуре и при атмосферном давлении в течение 24 часов. Катализатор отфильтровывают и растворитель выпаривают в вакууме. Остаток распределяют между диэтиловым эфиром (70 мл) и конц. NH3 и органическую фазу промывают насыщенным солевым раствором (5 мл). Органический слой сушат (МgSО4) и растворитель выпаривают в вакууме, получая 120 мг (выход 61%) названного в заголовке соединения в виде полукристаллического белого твердого вещества: ЭИМС (70 электровольт) m/z (относительная интенсивность) 259 (20, М+); [α]
Пример 54
(R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид
4-морфолинобензойную кислоту (92 мг, 0,44 ммоль) растворяют в сухом N, N-диметилформамиде (2 мл) и промывают потоком азота. К раствору добавляют 1,1'-карбонилдиимидазол (76 мг, 0,47 ммоль) и реакционную смесь перемешивают при 75oС в течение 1,5 часов. Раствор охлаждают до комнатной температуры, добавляют (R)-2-амино-5-метил-8-(4-метилпиперазин-1-ил)-1,2, 3,4-тетрагидронафталин (110 мг, 0,42 ммоль), растворенного в сухом N,N-диметилформамиде (2 мл). Раствор перемешивают при комнатной температуре в течение 30 часов. Растворитель выпаривают в вакууме, получая 290 мг сырого продукта. Очистка с помощью препаративной ТСХ на силикагеле с использованием в качестве элюента хлороформа/метанола/конц. NH3 (95:5:0,5), дает 145 мг (выход 73%) названного в заголовке соединения в виде белого твердого вещества: т.п. >231oС (разлож. ); ЭИМС (70 электровольт) m/z (относительная интенсивность) 448 (3, М+); [α]
Пример 55
(S)-2-амино-8-бром-5-метокси-1,2,3,4-тетрагидронафталин
Названное в заголовке соединение синтезируют в соответствии со способом из примера 21, используя (S)-форму; ЭИМС (70 электровольт) m/z (относительная интенсивность) 257 (17, М+, 81Вr), 255 (20: М+, 79Br).
Пример 56
(S)-8-бром-2-N,N-дибензиламино-5-метокси-1,2,3,4-тетрагидронафталин
Названное в заголовке соединение синтезируют в соответствии со способом из примера 22, используя (S)-форму; ЭИМС (70 электровольт) m/z (относительная интенсивность) 437 (38, М+, 81Вr), 435 (20: М+, 79Br).
Пример 57
(S)-2-N, N-дибензиламино-5-метокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин
Названное в заголовке соединение синтезируют в соответствии со способом из примера 23, используя (S)-форму; ЭИМС (70 электровольт) m/z (относительная интенсивность) 455 (10, М+).
Пример 58
(S)-2-амино-5-метокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин
Названное в заголовке соединение синтезируют в соответствии со способом из примера 24, используя (S)-форму; ЭИМС (70 электровольт) m/z (относительная интенсивность) 275 (55, М+).
Пример 59
(S)-N-[5-метокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид
Названное в заголовке соединение синтезируют в соответствии со способом из примера 25, используя (S)-форму: т.п. 229-232oС; [α]
Пример 60
(R)-N-[5-гидрокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид
Названное в заголовке соединение синтезируют в соответствии со способом из примера 25, используя продукт из примера 10: т.п. 84-88oС; [α]
Пример 61
(R)-2-N, N-дибензиламино-8-(4-бензилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин
Раствор (R)-2-N, N-дибензиламино-8-бром-1,2,3,4-тетрагидронафталина (58 г, 0,14 моль), N-бензилпиперазин (31 г, 0,18 моль), R-BINAP (6,7 г, 11 ммоль), трис(дибензилиденацетон) дипалладий(0) (4,4 г, 4,8 ммоль) и трет-бутоксид натрия (19 г, 0,2 моль) нагревают в аргоне при 100oС в течение 17 часов. Смесь охлаждают до температуры окружающей среды и фильтруют через слой целита. Растворитель удаляют и сырой остаток очищают на колонке силикагеля, используя в качестве элюента гексан/этилацетат (4:1), получая 62 г (выход 86%) названного в заголовке соединения в виде светло-коричневого масла. [α]
Пример 62
(R)-2-N, N-дибензиламино-5-бром-8-(4-бензилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин
К раствору (R)-2-N,N-дибензиламино-8-(4-бензилпиперазин-1-ил)-1,2,3,4-тетрагидронафталина (61 г, 0,12 моль) и ацетата натрия (148 г, 1,8 моль) в уксусной кислоте (2 л) при перемешивании добавляют бром (24 г, 0,15 моль). Смесь перемешивают в течение 5 минут при комнатной температуре, раствор упаривают в вакууме. Остаток распределяют между диэтиловым эфиром (1,5 л) и водой (1 л). Органическую фазу собирают и экстрагируют водным раствором гидроксида натрия (5 М), промывают солевым раствором, сушат (NaSO4), фильтруют и выпаривают в вакууме, получая 70 г коричневого масла. Масло очищают на колонке силикагеля, используя в качестве элюента гептан/этилацетат (5:1), получая 41 г (выход 58%) названного в заголовке соединения в виде масла. [α]
Пример 63
(R)-2-N, N-дибензиламино-5-метил-8-(4-бензилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин
Раствор (R)-2-N, N-дибензиламино-5-бром-8-(4-бензилпиперазин-1-ил)-1,2,3,4-тетрагидронафталина (35 г, 59 ммоль) в безводном тетрагидрофуране (650 мл) в атмосфере аргона охлаждают до -70oС с последующим добавлением по каплям н-бутиллития (36 мл, 89 ммоль; 2,5 М в гексане) в течение 1 часа. Раствор перемешивают при -70oС в течение 2 часов и медленно добавляют йодметан (9,3 г, 65 ммоль), растворенный в безводном тетрагидрофуране (25 мл). Раствор выдерживают при -70oС в течение 1 часа и затем при 0oС еще один, час, а затем гасят добавлением 2-пропанола (8 мл). Растворители выпаривают и остаток распределяют между метиленхлоридом (700 мл) и водой (350 мл). Органический слой собирают и водную фазу экстрагируют метиленхлоридом (200 мл). Объединенную органическую фазу сушат (Na2SO4), фильтруют и упаривают, получая 31 г коричневого масла. Масло очищают на колонке силикагеля, используя в качестве элюента гептан/диэтиловый эфир (5:1), получая 20 г (выход 64%) названного в заголовке соединения в виде масла. ЭИМС (70 электровольт) m/z (относительная интенсивность) 515 (2, М+).
Пример 64
(R)-2-амино-5-метил-8-(пиперазин-1-ил)-1,2,3,4-тетрагидронафталин
Смесь (R)-2-N, N-дабензиламино-5-метил-8-(4-бензилпиперазин-1-ил)-1,2,3,4-тетрагидронафталина (20 г, 38 ммоль), формиата аммония (57 г, 0,98 моль) и 10% палладия на активированном угле (5,6 г) кипятят с обратным холодильником в метаноле (2 л) в течение 3 часов. Смесь охлаждают до комнатной температуры и фильтруют через слой целита. Раствор выпаривают в вакууме, остаток распределяют между метиленхлоридом (750 мл) и водным раствором аммиака (2М, 250 мл). Органическую фазу собирают, водную фазу повторно экстрагируют метиленхлоридом (250 мл). Объединенные органические фазы сушат (Na2SO4), фильтруют и выпаривают в вакууме, получая 8,8 г (выход 95%) названного в заголовке соединения в виде масла. Масло растирают с диэтиловым эфиром, получая светло-коричневые кристаллы: т.п. 204-205oС; ЭИМС (70 электровольт) m/z (относительная интенсивность) 245 (31, М+).
Пример 65
Трет-бутил-(R)-4-(4-метил-7-амино-5,6,7,8-тетрагидро-1-нафтил) пиперазин-1-карбоксилат
Раствор (R)-2-амино-5-метил-8-(пиперазин-1-ил)-1,2,3,4-тетрагидронафталина (8,3 г, 34 ммоль) и триэтиламин (4,0 г, 40 ммоль) в метиленхлориде (2 л) охлаждают до 2oС и по каплям добавляют ди-трет-бутилдикарбонат (7,4 г, 34 ммоль) в метиленхлориде (250 мл) в течение 30 минут. Смесь перемешивают при комнатной температуре в течение 1 часа, с последующим добавлением водного раствора гидрокарбоната натрия (500 мл). Фазы разделяют, органическую фазу сушат (Na2SO4), фильтруют и упаривают в вакууме. Сырой продукт очищают на колонке силикагеля, используя в качестве элюента метилен-хлорид/метанол/NН3 (вод. ) (10:0,6:0,06), получая 3,7 г (выход 32%) названного в заголовке соединения в виде масла, которое отвердевает после растирания с диэтиловым эфиром. ЭИМС (70 электровольт) m/z (относительная интенсивность) 345 (37, М+).
Пример 66
(R)-N-[5-метил-8-(4-трет-бутилоксикарбонилпиперазин-1-ил)-1, 2,3,4-тетрагидро-2-нафтил]-4-морфолинобензамид
К раствору 4-морфолинобензойной кислоты (2,5 г, 12 ммоль; описанной в: Degutis, J. ; Rasteikiene, L.; Degutinene, A. Zh. Org. Khim. 1978, 14(10), 2060-2064) в безводном N,N-диметилформамиде (120 мл) добавляют 1,1'-карбонилдиимидазол (2,1 г, 13 ммоль) частями в атмосфере аргона. Раствор нагревают до 75oС в течение 30 минут и затем охлаждают до комнатной температуры. К раствору добавляют по каплям трет-бутил-(R)-4-(4-метил-7-амино-5,6,7,8-тетрагидро-1-нафтил)пиперазин-1-карбоксилат (3,7 г, 11 ммоль) в безводном N, N-диметилформамиде (60 мл) и смесь перемешивают в течение 24 часов. Растворитель упаривают в вакууме, сырой продукт очищают на колонке силикагеля, используя в качестве элюента гептан/этилацетат (3:2), получая 4,2 г (выход 74%) названного в заголовке соединения в виде масла.
13С-ЯМР (75 МГц, СDС13) δ 166; 155; 153; 135; 132; 130; 128; 128; 125; 117; 114; 79; 66; 52; 48; 45; 32; 28,5; 29,5; 26; 19.
Пример 67
(R)-N-[5-метил-8-(пиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид
К раствору (R)-N-[5-метил-8-(4-трет-бутилоксикарбонил-пиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамида (4,2 г, 7,9 ммоль) в метиленхлориде (390 мл) при 5oС добавляют трифторуксусную кислоту (12 мл). Раствор перемешивают при комнатной температуре в течение 24 часов и растворитель упаривают в вакууме. Остаток распределяют между метиленхлоридом (250 мл) и 5 М водным раствором гидроксида натрия (100 мл, рН 10-11). Органическую фазу собирают, водную фазу повторно экстрагируют метиленхлоридом (100 мл). Объединенную органическую фазу сушат (Na2SO4), фильтруют и упаривают в вакууме. Сырой продукт очищают на колонке силикагеля, используя в качестве элюента метиленхлорид/метанол/ NН3 (водн.) (10:0,8:0,08), получая 3,2 г (выход 92%) названного в заголовке соединения в виде масла, которое кристаллизуют (светло-коричневые кристаллы), растирая в диэтиловом эфире: т.п. 207-210oС [α]
Пример 68
(R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-хлорбензамид
К раствору (R)-2-амино-5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталина (52 мг, 0,20 ммоль) и триэтиламина (1 мл, 7,7 ммоль) в метиленхлориде (10 мл) добавляют раствор 4-хлорбензоилхлорида (50 мг, 0,29 ммоль) в метиленхлориде (10 мл) и реакционную смесь перемешивают при 0oС в течение 30 минут. Перемешивание продолжают при температуре окружающей среды еще в течение 2 часов, затем растворитель упаривают в вакууме. Остаток очищают на колонке силикагеля, используя в качестве элюента этилацетат, содержащий триэтиламин (7,5%), получая 50 мг (выход 63%) названного в заголовке соединения в виде белых кристаллов: т.п. 210-212oС; ЭИМС (70 электровольт) m/z (относительная интенсивность) 397 (28, М+).
Пример 69
(R)-2-N,N-дибензиламино-8-бром-1,2,3,4-тетрагидронафталин
(R)-8-бром-2-амино-1,2,3,4-тетрагидронафталина гидрохлорид (50 г, 0,19 моль) распределяют между диэтиловым эфиром (700 мл) и 2М водным раствором NaOH (100 мл). Водный слой экстрагируют диэтиловым эфиром (50 мл), объединенную органическую фазу промывают насыщенным солевым раствором (75 мл). Эфирный слой сушат (Na2SO4), растворитель упаривают в вакууме, получая 43,3 г свободного основания. Основание перемешивают в ацетонитриле (600 мл) и добавляют бензилбромид (54 мл, 0,46 моль), карбонат калия (66 г, 48 моль), йодид калия (200 мг, 1 ммоль) и еще 100 мл ацетонитрила, реакционную смесь нагревают для кипячения с обратным холодильником. После перемешивания в течение 9 часов неорганические соли отфильтровывают, с последующим упариванием растворителя в вакууме, получая 91 г остатка. Сырой продукт растворяют в диэтиловом эфире (100 мл), охлаждают на льду, медленно добавляют НСl в диэтиловом эфире (200 мл, 200 ммоль, 1М). Гексан (1.2 л) добавляют к взвеси, осадок фильтруют и промывают гексаном (1 л). Добавляют диэтиловый эфир (1,5 л) и 1 М водный раствор NaOH (150 мл), смесь перемешивают в течение 2 часов. Фазы разделяют, водную фазу повторно экстрагируют диэтиловым эфиром (100 мл), объединенные органические слои промывают насыщенным солевым раствором (100 мл). Органическую фазу сушат (Na2SO4) и растворитель упаривают в вакууме, получая 73 г (выход 94%) названного в заголовке соединения в виде желтого масла. Аналитический образец очищают с помощью препаративной ТСХ на силикагеле, используя в качестве элюента хлороформ/гексан (1:5); [α]
Пример 70
(R)-2-N, N-дибензиламино-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин
(R)-2-N, N-дибензиламино-8-бром-1,2,3,4-тетрагидронафталин (48 г, 118 ммоль) и 4-метилпиперазин (16 мл, 0,14 моль) растворяют в толуоле (450 мл) и промывают потоком аргона. К раствору добавляют (R)-(+)-2,2'-бис(дифенил)фосфино-1,1'-бинафтил (5,5 г, 8,9 ммоль), трис(дибензилиденацетон)дипалладий(0) (3,4 г, 3,7 ммоль) и трет-бутоксид натрия (16 г, 0,17 ммоль), реакционную смесь перемешивают при 85oС в течение 3 часов. Фильтрация через Целит с использованием хлороформа/метанола/конц. амиака (95:5:0,5) в качестве элюента с последующим выпариванием растворителя в вакууме дает 68 г сырого продукта. Очистка с помощью колоночной хроматографии на силикагеле, используя в качестве элюента этилацетат/триэтиламин (100:1), дает 44 г (выход 88%) названного в заголовке соединения в виде желтоватого масла, которое кристаллизуется спустя некоторое время: т.п. 82-84oС; ЭИМС (70 электровольт) m/z (относительная интенсивность) 425 (26, М+) [α]
Пример 71
(R)-2-амино-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин
(R)-2-N, N-дибензиламино-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин (47 г/ 0/11 ммоль) растворяют в уксусной кислоте (480 мл) и загружают в стеклянный автоклав Buchi (1 л). К раствору добавляют 10% Pd/C (9,4 г, содержащий 50% воды). Реакционную смесь перемешивают при 70oС и при давлении водорода 5 бар в течение 10 часов. Катализатор удаляют фильтрацией и растворитель упаривают в вакууме, получая 65 г сырого материала в виде масла. Сырой материал используют на следующем этапе без выделения из свободного амина. Аналитический образец получают путем распределения сырого продукта между метиленхлоридом и водным NН3. Фазы разделяют, органическую фазу промывают насыщенным солевым раствором, сушат (Na2SO4) и очищают с помощью колоночной хроматографии на силикагеле, используя в качестве элюента хлороформ/метанол/конц. NН3 (90: 9:0,5), получая названное в заголовке соединение в виде коричневатого масла: ЭИМС (70 электровольт) m/z (относительная интенсивность) 245 (10, М+); [α]
Пример 72
(R)-2-амино-5-бром-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин
(R)-2-амино-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин (27 г, 0,11 ммоль) и ацетат натрия (9,6 г, 0,12 моль) растворяют в уксусной кислоте (145 мл). К раствору добавляют бром (6,0 мл, 0,12 ммоль), растворенный в уксусной кислоте (145 мл) в течение 13 минут при максимальной температуре 23oС. После завершения добавления реакционную смесь перемешивают при комнатной температуре в течение 1,25 часа. Растворитель упаривают в вакууме, дополнительное количество уксусной кислоты (60 мл) добавляют и упаривают. Остаток распределяют между этилацетатом (300 мл) и водой (100 мл) и охлаждают на льду. рН доводят до 11-12 добавлением водного NaOH (45%) и фазы разделяют. Водный слой экстрагируют этилацетатом (2•200), объединенные органические фазы промывают насыщенным солевым раствором (80 мл) и сушат (Na2S04). Растворитель упаривают в вакууме, получая 27 г названного в заголовке соединения в виде коричневатого масла: ЭИМС (70 электровольт) m/z (относительная интенсивность) 324 и 325 (22 и 17, М+); [α]
Пример 73
(R)-2-N, N-дибензиламино-5-бром-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин
(R)-2-амино-5-бром-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин (35 г, 0,10 моль) растворяют в метаноле (250 мл) и промывают потоком азота. Добавляют бензальдегид (11 мл, 0,10 моль) и уксусную кислоту (18 мл, 0,31 ммоль) и раствор перемешивают при комнатной температуре в течение 1 часа. Цианоборгидрид натрия (6,9 г, 0,10 моль), растворенный в метаноле (100 мл), добавляют в течение 8 минут. Реакционную смесь перемешивают при 40oС в течение 1,5 часов. Дополнительное количество бензальдегида (21 мл, 208 ммоль) и NаСNВН3 (3,5 г, 52 ммоль) добавляют по частям в течение 48 часов. Реакционную смесь перемешивают еще в течение 7 часов, гасят уксусной кислотой (27 мл, 0,49 моль) и перемешивают при комнатной температуре в течение 15 часов. К раствору добавляют водный NaOH (30 мл, 45%), через 3,5 часа растворитель упаривают в вакууме. Остаток распределяют между этилацетатом (400 мл) и водой (100 мл), рН доводят до 11 водным NaOH (14 мл, 45%). Фазы разделяют, водную фазу повторно экстрагируют этилацетатом (150 мл), объединенный органический слой промывают насыщенным солевым раствором (100 мл). Органическую фазу сушат (Na2SO4), растворитель упаривают в вакууме, получая 68 г сырого продукта. Очистка с помощью колоночной хроматографии на силикагеле с использованием в качестве элюента этилацетата/триэтиламина (100:1) дает 45 г (выход 85%) названного в заголовке соединения в виде желтоватого масла: ЭИМС (70 электровольт) m/z (относительная интенсивность) 504 и 505 (0,8 и 0,6, М+); [α]
Пример 74
(R)-2-N, N-дибензиламино-5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин
(R)-2-N, N-дибензиламино-5-бром-8-(4-метилпиперазин-1-или)-1,2,3,4-тетрагидронафталин (16 г, 0,31 моль) растворяют в свежеперегнанном тетрагидрофуране (300 мл) и охлаждают до -78oС в атмосфере аргона. К раствору добавляют н-бутиллитий (19 мл, 1,6 М в гексане, 0,31 моль) по каплям в течение 45 минут при максимальной температуре -76oС. Темно-зеленый раствор перемешивают еще 20 минут. В течение 25 минут по каплям добавляют раствор метилйодида (1,9 мл, 0,31 моль) в свежеперегнанном тетрагидрофуране (10 мл) при максимальной температуре -74oС, причем исчезает зеленое окрашивание. Реакционную смесь перемешивают при -78oС в течение 50 минут и при 0oС в течение 50 мин. Реакцию гасят изопропиловым спиртом (3 мл) и растворитель упаривают в вакууме. Остаток распределяют между этилацетатом (300 мл) и водой (30 мл), фазы разделяют и органический слой промывают насыщенным солевым раствором (30 мл). После сушки (Na2SO4) и упаривания растворителя в вакууме получают 15 г сырого продукта. Очистка с помощью колоночной хроматографии на силикагеле с использованием в качестве элюента этилацетата/триэтиламина (100:1) дает 11 г (выход 82%) названного в заголовке соединения в виде коричневого масла: ЭИМС (70 электровольт) m/z (относительная интенсивность) 439 (5, М+); [α]
Пример 75
(R)-2-амино-5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин
(R)-2-N, N-дибензиламино-5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидронафталин (28 г, 64 ммоль) растворяют в уксусной кислоте (280 мл) и загружают в стеклянный автоклав Buchi (1 л). Добавляют 10% палладий на активированном угле (2,8 г, содержащий 50% воды). Реакционную смесь перемешивают при 70oС при давления водорода 5 бар в течение 3,5 часов. Катализатор отфильтровывают, растворитель упаривают в вакууме. Остаток распределяют между этилацетатом (400 мл) и водой (100 мл) и охлаждают на ледяной бане, рН доводят до 12 добавлением водного NaOH (45%), фазы разделяют. Водную фазу повторно экстрагируют этилацетатом (2•100 мл) и объединенный органический слой промывают насыщенным солевым раствором (50 мл) и сушат (Nа2SO4). Выпаривание растворителя в вакууме дает 18 г (выход 99%) названного в заголовке соединения в виде коричневого масла: ЭИМС (70 электровольт) m/z (относительная интенсивность) 259 (34, М+); [α]
Пример 76
Соли (R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил]-4-морфолинобензамида
Точки плавления определяются с использованием дифференциального сканирующего калориметра (DSC). Скорость изменения температуры составляла 10oС в минуту, начиная с комнатной температуры. Образцы исследовались в алюминиевых кюветах с неплотными крышками в токе азота. Кислый (2S,3S)-тартрат (R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил]-4-морфолинобензамида
(R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид (150 мг, 0,33 ммоль) растворяют в тетрагидрофуране (3 мл) при нагревании и по каплям добавляют D-(-)-винную кислоту (110 мг, 0,69 ммоль), растворенную в тетрагидрофуране (3 мл). Белый осадок фильтруют и промывают тетрагидрофураном, получая 180 мг (выход 86%). Сырую соль (170 мг) перекристаллизовывают из 3%-ного водного раствора ацетона (30 мл), после отстаивания в течение 3 часов при комнатной температуре колбу помещают в морозильную камеру на 65 часов. Твердое вещество фильтруют и промывают холодным ацетоном, получая 120 мг (выход 61%) белых кристаллов: т.п. 142-148oС. Аналит. рассчитано для С27Н36N4O2•С4Н6O6•2Н2O: С, 58,7; Н 7,0; N 8,8 Найдено: С 58,6; Н 7,1; N 8,8
Пример 77
Кислый (2R, 3R)-тартарат (R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил]-4-морфолинобензамида
(R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид (150 мг, 0,33 ммоль) растворяют в тетрагидрофуране (3 мл) при нагревании и по каплям добавляют L-(+)-винную кислоту (110 мг, 0,69 ммоль), растворенную в тетрагидрофуране (3 мл). Белый осадок фильтруют и промывают тетрагидрофураном, получая 180 мг (выход 86%). Сырую соль (180 мг) перекристаллизовывают из 3% водного раствора ацетона (48 мл) (нерастворимый материал фильтруют) и после отстаивания в течение ночи при комнатной температуре твердое вещество фильтруют, получая 8 мг (выход 61%). Растворитель удаляют из маточного раствора, осторожно пропуская азот, так, чтобы удалить 4 мл. Колбе дают постоять при комнатной температуре в течение 65 часов и затем помещают в морозильную камеру на 5 часов. Твердое вещество фильтруют и промывают холодным ацетоном, получая 61 мг (выход 29%) белых кристаллов: т. п. 120-130oС. Аналит. рассчитано для С27Н36N4O2•С4Н6O6•2Н2О: С, 58,7; Н 7,0; N 8,8 Найдено: С 58,9; Н 7,1; N 8,6.
Пример 78
Бензолсульфонат (R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил]-4-морфолинобензамида
(R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид (100 мг, 0,22 ммоль) растворяют в тетрагидрофуране (2 мл) при нагревании и по каплям добавляют бензолсульфоновую кислоту (40 мг, 0,24 ммоль), растворенную в тетрагидрофуране (4 мл). Добавляют диэтиловый эфир и полученное в результате масло растирают. Твердое вещество фильтруют и промывают диэтиловым эфиром, получая белое твердое вещество, которое хранят в эксикаторе над голубым гелем: т. п. >250oС. Аналит. рассчитано для С27Н36N4O2•С6Н6O3S•Н2О: С, 63,4; Н 6,8; N 9,0 Найдено: С 63,1; Н 7,0; N 8,7
Пример 79
Кислый 1,2-этандисульфонат (R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетратидро-2-нафтил]-4-морфолинобензамида
(R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид (100 мг, 0,22 ммоль) растворяют в тетрагидрофуране (3 мл) при нагревании и по каплям добавляют дигидрат 1,2-этандисульфоновой кислоты (55 мг, 0,24 ммоль), растворенный в тетрагидрофуране (2 мл). Добавляют диэтиловый эфир (2 мл) и полученное в результате твердое вещество фильтруют и промывают тетрагидрофураном/диэтиловым эфиром, получая белое твердое вещество, которое хранят в эксикаторе над голубым гелем: т.п. 220oС. Аналит. расcчитано для C27H36N4O2•C2H6O6•4H2O: С, 48,9; Н 7,1; N 7,9 Найдено: С 49,1; Н 6,8; N 7,6
Пример 80
Кислый малеат (R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил]-4-морфолинобензамида
(R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид (100 мг, 0,22 ммоль) растворяют в тетрагидрофуране (2 мл) при нагревании и по каплям добавляют малеиновую кислоту (29 мг, 0,24 ммоль), растворенную в тетрагидрофуране (1 мл). К прозрачному раствору добавляют диэтиловый эфир (5 мл), получая масло. Растворитель декантируют и полученное в результате масло растирают с диэтиловым эфиром. Твердое вещество фильтруют и промывают диэтиловым эфиром, получая белое твердое вещество, которое хранят в эксикаторе над голубым гелем: т.п. 160oС (разлож). Аналит. рассчитано для C27H36N4O2•C4H4O4•H2O: С, 63,8; Н 6,9; N 9,6 Найдено: С 63,7; Н 7,2; N 9,3
Пример 81
Кислый сульфат (R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил]-4-морфолинобензамида
(R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид (100 мг, 0,22 ммоль) растворяют в тетрагидрофуране (2 мл) при нагревании и по каплям добавляют серную кислоту (25 мг, 0,24 ммоль), растворенную в тетрагидрофуране (1 мл). Белый осадок фильтруют и промывают тетрагидрофураном, получая 110 мг (выход 89%). Сырую соль перекристаллизовывают из H2O (12 мл) и оставляют в морозильной камере на ночь. Твердое вещество фильтруют и промывают холодной водой, получая 28 мг (выход 31%) белого твердого вещества: т.п. 230oС (разлож). Аналит. рассчитано для С27Н36N4O2•H2O4S•Н2O: С, 57,4; Н 7,1; N 9,9 Найдено: С 57,7; Н 7,4; N 9,9
Пример 82
Глюконат (R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил]-4-морфолинобензамида
(R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид (100 мг, 0,22 ммоль) растворяют в этаноле (3 мл) и по каплям добавляют 50%-ный водный раствор D-глюконовой кислоты (80 мкл, 0,24 ммоль). Растворитель удаляют в вакууме, получая густое масло. Неочищенное масло перекристаллизовывают из 5% Н2О в растворе ацетона (3 мл) и 10% H2O в растворе ацетона (3 мл), декантируют и оставляют при комнатной температуре на 65 часов. Твердое вещество фильтруют и промывают холодной 3% водой в растворе ацетона, получая 95 мг (выход 65%) белого твердого вещества: т.п. 130-140oС. Аналит. рассчитано для C27H36N4O2•C6H12O7•H2O: С, 59,8; Н 7,6; N 8,5 Найдено: С 60,0; Н 7,4; N 8,3
Пример 83
Кислый сукцинат (R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил]-4-морфолинобензамида
(R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид (100 мг, 0,22 ммоль) растворяют в тетрагидрофуране (2 мл) при нагревании и по каплям добавляют янтарную кислоту (56 мг, 0,46 ммоль), растворенную в тетрагидрофуране (2 мл). Добавляют диэтиловый эфир (4 мл) до помутнения раствора. Раствор нагревают для кипячения с обратным холодильником и отставляют для охлаждения. Твердое вещество фильтруют, получая 42 мг (выход 34%) белого твердого вещества, которое хранят в эксикаторе над голубым гелем: т.п. 150oС (разлож).
Пример 84
Метансульфонат (R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил]-4-морфолинобензамида
(R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид (100 мг, 0,22 ммоль) растворяют в тетрагидрофуране (15 мл) и по каплям добавляют метансульфоновую кислоту (42 мГ, 0,44 ммоль), растворенную в тетрагидрофуране (5 мл). Растворитель удаляют в вакууме, получая белое твердое вещество, которое перекристаллизовывают из ацетона (5 мл) и затем из 15% Н2О в растворе ацетона (7 мл). Кристаллы фильтруют, получая 37 мг (выход 31%) светло-желтых кристаллов, которые хранят в эксикаторе над голубым гелем: т.п. 250oС. Аналит. рассчитано для С27Н36N4O2•СН4O3S•2Н2О: С, 57,9; Н 7,6; N 9,7 Найдено: С 58,1; Н 7,4; N 9,6
Пример 85
Кислый (S)-малат (R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил]-4-морфолинобензамида
(R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид (100 мг, 0,22 ммоль) растворяют в тетрагидрофуране (20 мл) и по каплям добавляют L-(-)-яблочную кислоту (59 мг, 0,44 ммоль), растворенную в тетрагидрофуране (3 мл). Осадок фильтруют и твердое вещество перекристаллизовывают из 15% Н2О в растворе ацетона (7 мл). Кристаллы фильтруют, получая 100 мг (выход 77%) белых кристаллов: т.п. 200oС. Аналит. рассчитано для C27H36N4O2•С4Н6O5•2Н2O: С, 57,9; Н 7,6; N 9,7 Найдено: С 58,1; Н 7,4; N 9,6
Пример 86
Дикислый цитрат (R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил]-4-морфолинобензамида
(R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид (100 мг, 0,22 ммоль) растворяют в тетрагидрофуране (15 мл) и по каплям добавляют лимонную кислоту (51 мг, 0,27 ммоль), растворенную в 10% Н20 в тетрагидрофуране (5 мл). Твердый материал фильтруют и перекристаллизовывают из 20% Н2О в этаноле (5 мл). Твердое вещество фильтруют, получая 88 мг (выход 62%) белых кристаллов: т.п. 160oС (разл.). Аналит. рассчитано для C27H36N4O2•C6H8O7•2H2O: С, 57, 9; Н 7,6; N 9,7 Найдено: С 58,1; Н 7,4; N 9,6
Пример 87
Гидрохлорид (R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил]-4-морфолинобензамида
(R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид (100 мг, 0,22 ммоль) растворяют в безводном тетрагидрофуране (15 мл) и по каплям добавляют НСl в безводном диэтиловом эфире (4М), пока раствор не станет кислым. Белый осадок фильтруют и промывают диэтиловым эфиром, получая названное в заголовке соединение в виде белых кристаллов.
Фармакология
Стимуляция электрическим полем высвобождения [3H]-5-HT из затылочной области коры мозга морской свинки
[3H]-5-HT высвобождается под действием стимуляции электрического поля из среза затылочной области коры мозга морских свинок, которые проинкубировали с [3H]-5-HT. Характер высвобождения сходен с высвобождением, вызванным нервной стимуляцией, то есть экзоцитотикальным высвобождением из серотонэргических нервных окончаний, проявляя зависимость от присутствия Са2+ в инкубационной среде. Высвобождение [3H]-5-НТ регулируется на уровне нервных окончаний ауторецепторов у морских свинок (как и у человека), завися от подтипа h5-HT1B рецептора. Таким образом, агонист h5-HT1B рецепторов снижает количество высвобожденного [3H]-5-HT при стимуляции области, тогда как высвобождение повышается антагонистами этого вида рецепторов. Тестирование соединений подобным способом является удобной скрининговой методикой для определения силы и функционального эффекта новых агонистов и антагонистов h5-НТ1B рецепторов.
Способы и материалы
Состав буфера (мМ): NаНСО3 (25), NaH2PO4.H2O (1,2), NaCl (117), КС1 (6), MgSО4•7H2O (1.2), CaCl2 (1,3), EDTA Na2 (0,03). Буфер насыщают газом по крайней мере в течение 30 минут перед использованием. рН буфера составляет около 7,2 при комнатной температуре, но повышается до 7,4 при 37oС.
Получение срезов затылочной части коры мозга
Морских свинок (200-250 г) обезглавливают (декапитируют) и удаляют цельный мозг. Иссекают затылочную часть коры и делают срезы с помощью инструмента для получения срезов McIlwain. Белую часть ткани следует предварительно осторожно удалить пинцетом. Срезы инкубируют в 5 мл буфера в присутствии 5 мМ паргилинхлорида. После инкубирования с 0,1 мМ [3H]-5-HT еще в течение 30 минут срезы переносят в пробирку для тестирования и трижды промывают таким же раствором буфера. Срезы пластмассовой пипеткой переносят в камеры для суперфузии и промывают в течение 40 минут буфером в присутствии ингибитора поглощения циталопрама 2,5 мкм со скоростью потока 0,5 мл/мин.
Электрическая стимуляция высвобождения [3H]-5-НТ
Буфер, подвергнутый суперфузии, собирают в 2 мл фракции. Срезы стимулируют электричеством импульсами с частотой 3 Гц, длительностью 2 мс и силой 30 мА в течение 30 минут при 4 и 13 фракциях. Тестируемые лекарственные средства добавляли, начиная с 8 фракции до конца эксперимента.
Результаты
Первая электрическая (или К+) стимуляция привела к высвобождению стандартного количества [3H]-5-HT. Перед первой и второй стимуляцией в среду добавляли антагонист h5-HT1B, что приводило к дозазависимому повышению высвобождения (S2) после второй стимуляции (см. фиг.1).
Соотношение S2/S1, которое представляет процент высвобожденного [3H]-5-HT при второй стимуляции (S2), деленный на соответствующее количество при первой стимуляции (S1), используется для оценки эффекта лекарственного средства на высвобождение трансмиттера.
Результаты представлены в таблицах 1 и 2.
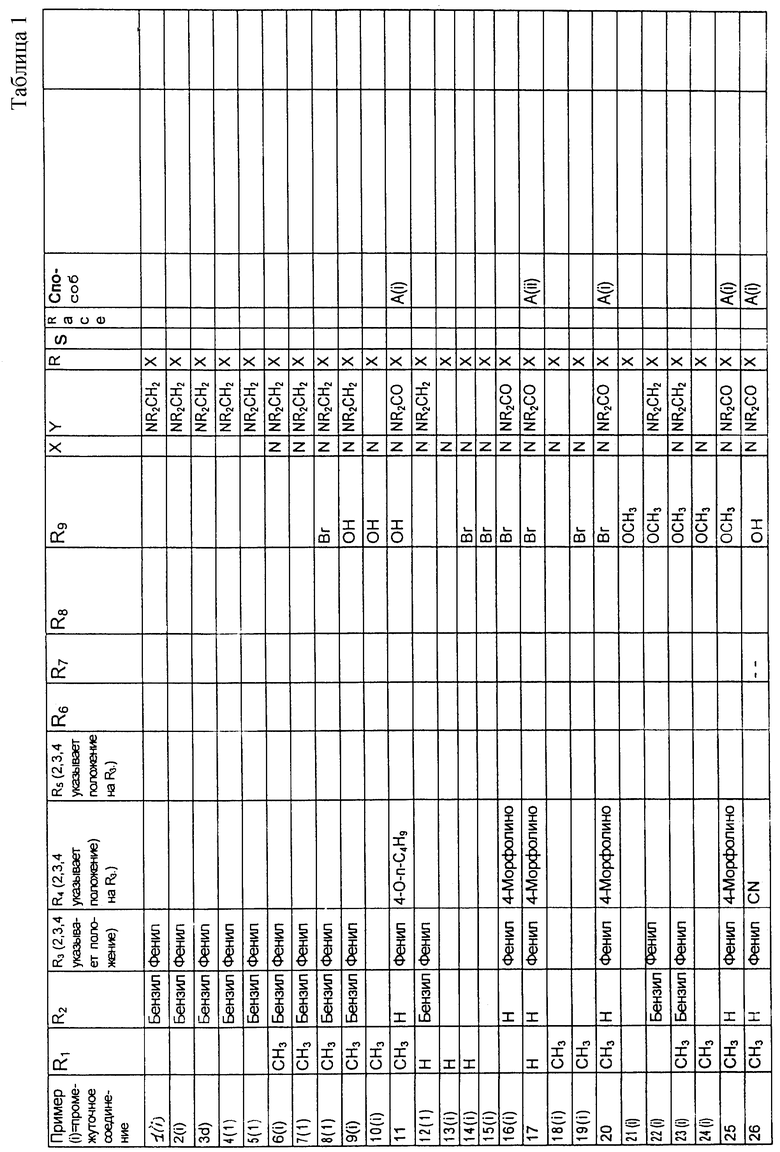

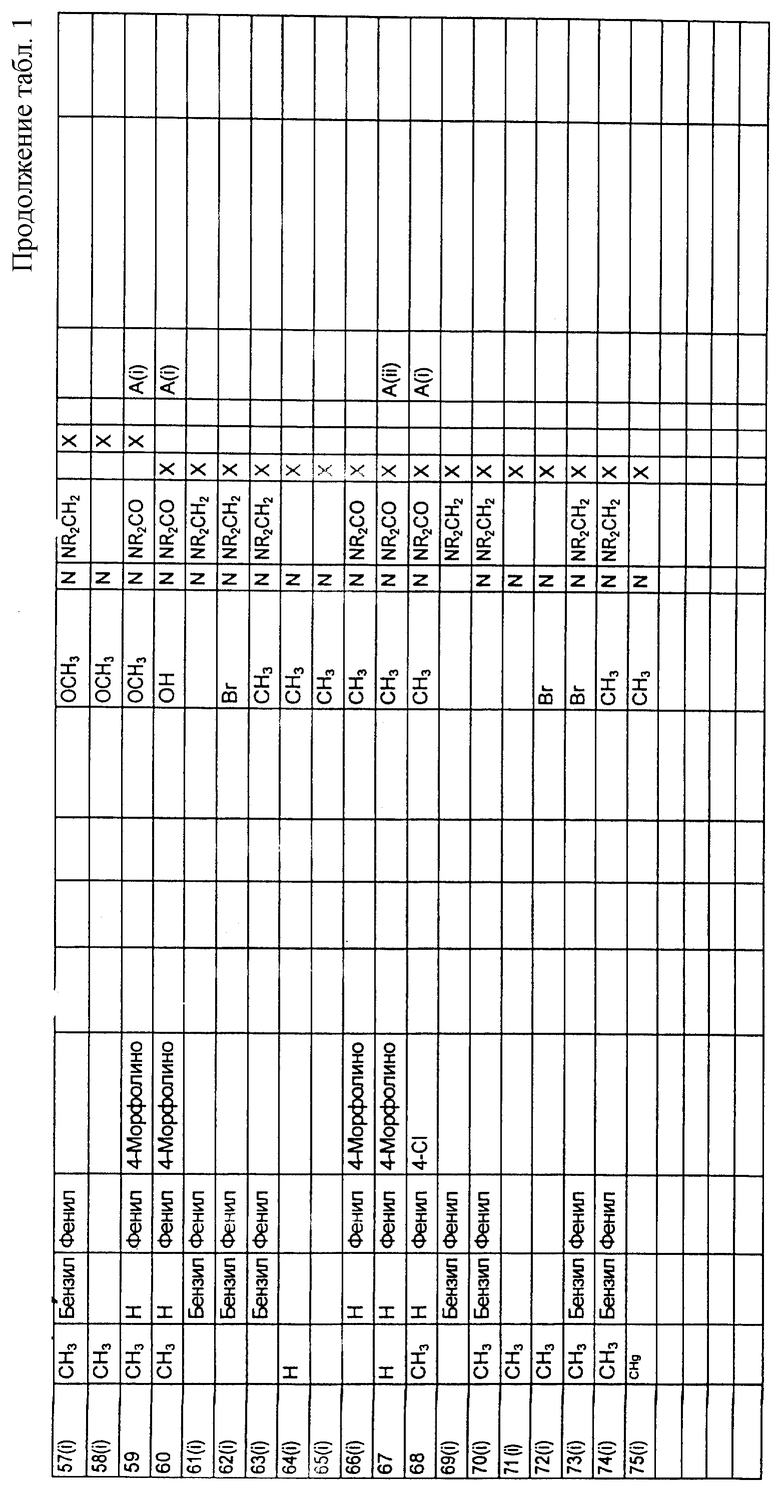
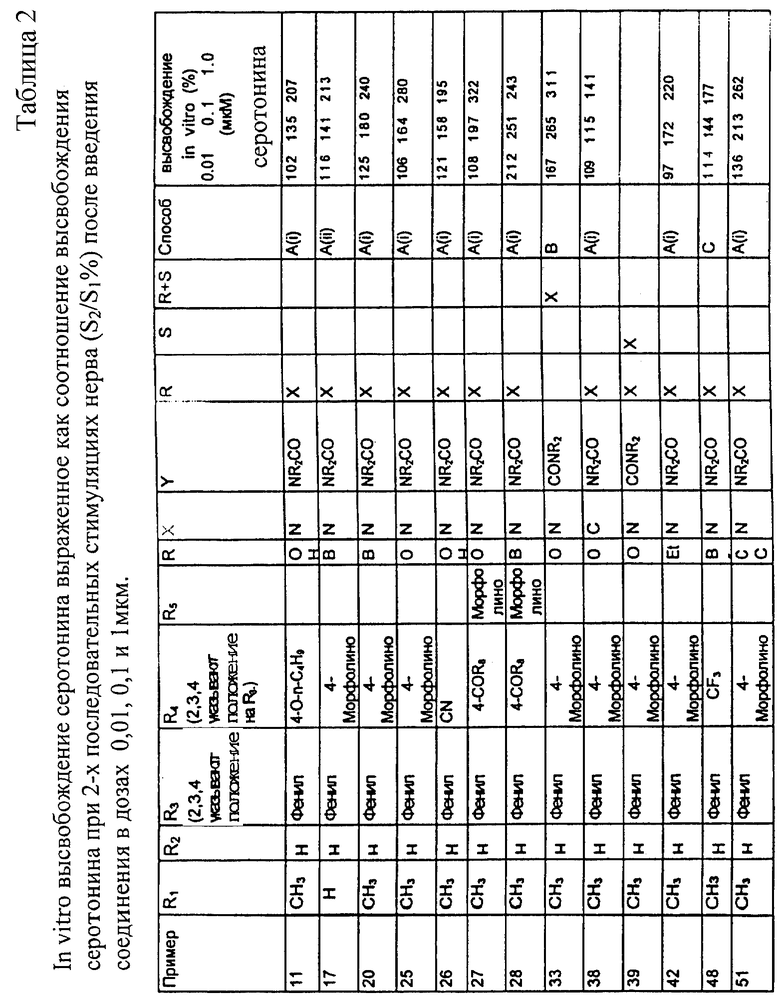
Изобретение относится к новым производным 1,2,3,4-тетрагидронафталина формулы (I) в виде (R)-энантиомеров, (S)-энантиомеров или рацематов в форме свободного основания или их фармацевтически приемлемых солей или сольватов, где Х представляет N или CH; У представляет NR2-CH2, NR2-CO или CO-NR2; R2 представляет Н или С1-С6-алкил; R1 представляет Н или С1-С6-алкил; R3 представляет фенил, который может быть моно- или дизамещен R4; R4 представляет Н, галоген, CN, CF3, С1-С6-алкокси, необязательно замещенное гетероциклическое кольцо, содержащее один или два гетероатома, выбранных из N, O, либо COR8; R8 представляет гетероциклическое кольцо, содержащее один или два гетероатома, выбранных из N, O; R9 представляет С1-С6-алкил, ОСНF2, ОН, галоген, С1-С6-алкокси, С1-С6-алкокси- С1-С6-алкил. Соединения формулы (I) обладают антагонистической активностью в отношении рецептора 5-НТ1В и могут найти применение в медицине. 10 с. и 22 з.п.ф-лы, 2 табл., 1 ил.
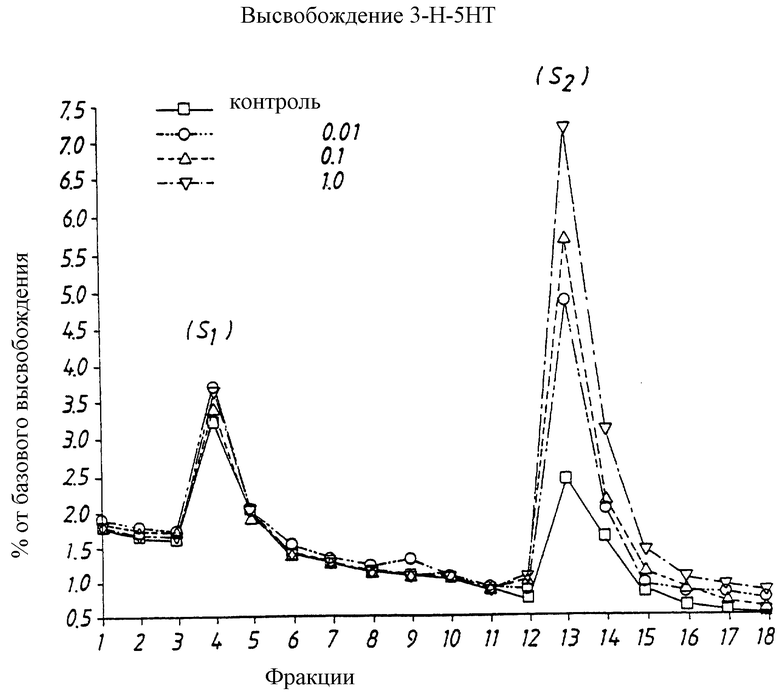
где X представляет собой N или СН;
Y представляет собой NR2CH2, NR2-CO или CO-NR2,
где R2 представляет собой Н или C1-C6-алкил;
R1 представляет собой Н или C1-C6-алкил;
R3 представляет собой фенил, который может быть моно- или дизамещен R4,
где R4 представляет собой Н, галоген, CN, СF3, C1-С6-алкокси, необязательно замещенное гетероциклическое кольцо, содержащее один или два гетероатома, выбранных из N и О, либо COR8,
где R8 представляет собой гетероциклическое кольцо, содержащее один или два гетероатома, выбранных из N, О;
R9 представляет собой C1-C6-алкил, OCHF2, галоген, ОН, C1-С6-алкокси, С1-С6-алкокси-С1-С6-алкил, в виде (R)-энантиомеров, (S)-энантиомеров или рацематов в форме свободного основания или их фармацевтически приемлемой соли или сольвата.
(R)-N-[5-метоксиметил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид;
(R)-N-[5-бром-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-трифторметилбензамид;
(R)-N-[5-бром-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид;
(R)-N-[5-бром-8-(пиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид;
(R)-N-[5-гидрокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-бутоксибензамид;
(R)-N-[5-метокси-6-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид;
(R)-N-[5-метокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинокарбонилбензамид;
(R)-N-[5-метил-8-(пиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид;
(R)-N-[5-бром-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинокарбонилбензамид;
N-(4-морфолинофенил)-8-(4-метилпиперазинил)-5-метокси-1,2,3,4-тетрагидронафталин-2-карбоксамид;
N-(морфолинокарбонилфенил)-8-(4-метилпиперазин-1-ил)-5-метокси-1,2,3,4-тетрагидронафталин-2-карбоксамид;
(R)-N-[5-этил-8-(4-метилпипераэин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид;
(R)-N-[5-этил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -(4-морфолинокарбонил)бензамид;
(R)-N-[5-дифторметокси-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид; или (R)-N-[5-метил-8-(4-метилпиперазин-1-ил)-1,2,3,4-тетрагидро-2-нафтил] -4-морфолинобензамид,
в форме свободного основания или фармацевтически приемлемой соли или сольвата.
A(i) ацилирование соединения формулы А
где R1 представляет собой C1-С6-алкил, активированной карбоновой кислотой R3-COL, где L - удаляемая группа или, карбоновой кислотой R3-СООН с активирующим реагентом, либо
A(ii) ацилирование соединения формулы В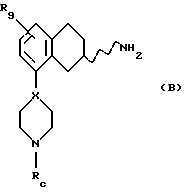
где Rс представляет собой защитную группу,
активированной карбоновой кислотой R3-СОL, где L - удаляемая группа, или карбоновой кислотой R3-COOH с активирующим реагентом, с последующим удалением защитной группы Rc, за исключением того случая, когда R9 является заместителем, который чувствителен по отношению к определенному ацилирующему агенту.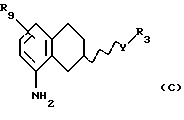
с соединением формулы Xl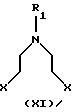
где Х представляет собой удаляемую группу за исключением случая, когда R9 представляет собой заместитель, который чувствителен к определенному алкилирующему реагенту.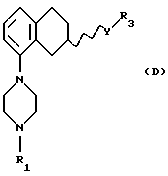
с подходящим галогенирующим агентом, таким, как Вr2, Сl2, I2, ICl или SO2С12.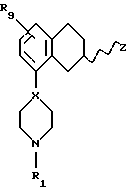
где Х представляет собой N или СН;
Z представляет собой NH2 или СООН;
R1 представляет собой Н или C1-С6-алкил;
R9 представляет собой C1-C6-алкил, OCHF2, галоген, ОН, C1-С6-алкокси, C1-C6-алкокси-С1-С6-алкил.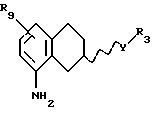
где Y представляет собой CONR2,
где R2 представляет собой Н или C1-С6-алкил;
R3 представляет собой C1-С6-алкил, фенил, который может быть моно- или дизамещен R4,
где R4 представляет собой Н, галоген, CN, СF3, C1-C6-алкокси, необязательно замещенное гетероциклическое кольцо, содержащее один или два гетероатома, выбранных из N и О, либо COR8,
где R8 представляет собой гетероциклическое кольцо, содержащее один или два гетероатома, выбранных из N и О;
R9 представляет собой C1-С6-алкил, OCHF2, галоген, ОН, C1-С6-алкокси, С1-С6-алкокси-С1-С6-алкил.
| Экономайзер | 0 |
|
SU94A1 |
| Тепломассообменная колонна | 1973 |
|
SU639568A1 |
| RU 94039542 A1, 10.08.1996. | |||
Авторы
Даты
2002-12-20—Публикация
1998-07-15—Подача