Предпосылки к созданию изобретения
Область техники
Настоящее изобретение относится к микробиологической промышленности, в частности к способу продукции аминокислот. Более конкретно настоящее изобретение относится к способу получения L-лейцина с использованием бактерии, принадлежащей к роду Escherichia, в которой количество произведенного L-валина, L-изолейцина и L-гомосерина менее 1% от количества произведенного L-лейцина.
Предшествующий уровень техники
Традиционно L-аминокислоты получают в промышленности методом ферментации с использованием штаммов микроорганизмов, полученных из природных источников, или их мутантов, специально модифицированных для увеличения продуктивности L-аминокислот.
Известны различные штаммы бактерий, принадлежащих к роду Escherichia, которые используются для продукции L-лейцина методом ферментации. Это штаммы, устойчивые к L-лейцину и его аналогам, таким как 4-азалейцин или 5,5,5-трифторлейцин (патент США 567446331), β-2-тиенилаланин и β-гидроксилейцин (патент США 5763231), L-валин, 4-азалейцин, 3-гидроксилейцин и L-лейцин (патент РФ 2140450); штаммы, требующие липоевую кислоту для роста (патент США 6214591); штаммы с увеличенной активностью ферментов, вовлеченных в биосинтез L-лейцина, таких как ген ilvE (патент США 5120654); штаммы, в которых у целевого фермента отсутствует чувствительность к ингибированию произведенным L-лейцином по типу обратной связи, такого как изопропилмалат синтаза (Европейский патент ЕР 1067191).
Практически все известные штаммы - продуценты L-лейцина одновременно производят L-валин и в небольших количествах L-изолейцин. Например, штамм Е.coli АJ 11478 (патент США 5763231) производит одновременно 1.9 г/л L-лейцина и 0.09 г/л L-валина (количество L-валина составляет 4.7% от количества L-лейцина). L-валин и L-изолейцин, произведенные одновременно с L-лейцином, затрудняют извлечение L-лейцина из культуральной жидкости. Кроме того, побочная продукция L-валина и L-изолейцина снижает выход L-лейцина, поскольку обе аминокислоты получаются из общего предшественника - 2-кетоизовалерата.
Ранее было показано, что некоторые неприродные аминокислоты, такие как норвалин, гомоизолейцин и норлейцин, могут образовываться в Serratia marcescens с помощью ферментов биосинтеза L-лейцина из α-кетобутирата, α-кето-β-метилвалерата и α-кетовалерата, соответственно (Kisumi M., Sugiura M. and Chibata I., J. Biochem. 1976, 80(2) 333-9).
Описание изобретения
Целью настоящего изобретения является получение бактерии - продуцента L-лейцина, который производит L-валин, L-изолейцин и L-гомолейцин в количестве, меньшем 1% от количества произведенного L -лейцина.
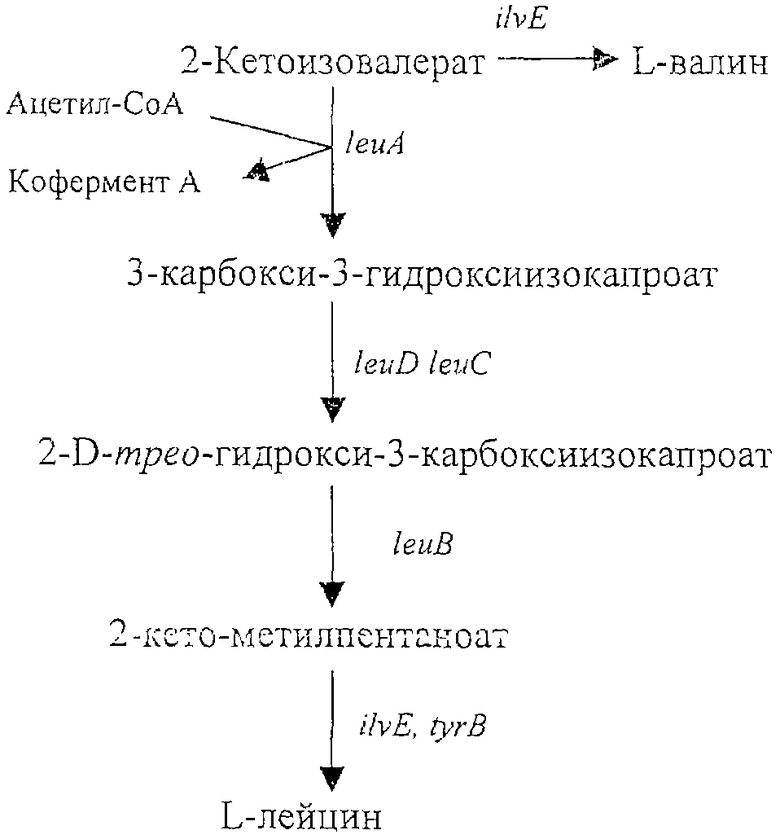
Указанная цель достигается путем инактивации гена ilvE, кодирующего аминотрансферазу разветвленных аминокислот.
Инактивация гена ilvE снижает продукцию L-лейцина, так как эта аминотрансфераза принимает участие в образовании L-лейцина из его кето-предшественника - 2-кето-метилпентаноата. Другой аминотрансферазой, которая может участвовать в продукции L-лейцина, является трансаминаза ароматических аминокислот, кодируемая геном tyrB. Поэтому для восстановления и даже увеличения продукции L-лейцина в случае инактивации гена ilvE осуществлялось увеличение активности фермента, кодируемого геном tyrB, например, путем трансформации бактерии многокопийной плазмидой, содержащей ген tyrB.
Таким образом было совершено настоящее изобретение.
Таким образом, настоящее изобретение предоставляет бактерию, принадлежащую к роду Escherichia, - продуцент L-лейцина, которая производит L-валин, L-изолейцин и L-гомолейцин в количестве, меньшем 1% от количества произведенного L-лейцина. Далее настоящее изобретение предоставляет бактерию, принадлежащую к роду Escherichia, - продуцент L-лейцина, которая производит L-валин, L-изолейцин и L-гомолейцин в количестве, меньшем 1% от количества произведенного L -лейцина, и в которой продукция L-лейцина повышена за счет повышения активности фермента, кодируемого геном tyrB.
Далее настоящее изобретение предоставляет способ получения L-лейцина методом ферментации, включающий стадии выращивания указанной бактерии в питательной среде с целью продукции и накопления L-лейцина в питательной среде и выделения L-лейцина из культуральной жидкости.
Таким образом, настоящее изобретение предоставляет следующее:
(1). Бактерия, принадлежащая к роду Escherichia, - продуцент L-лейцина, которая производит L-валин, L-изолейцин и L-гомолейцин в количестве, меньшем 1% от количества произведенного L -лейцина.
(2). Бактерия в соответствии с (1), которая производит L-валин, L-изолейцин и L-гомолейцин в количестве, меньшем 1% от количества произведенного L-лейцина вследствие инактивации гена HvE или снижения активности белка, кодируемого геном ilvE.
(3). Бактерия в соответствии с (2), в которой активность белка, кодируемого геном tyrB, повышена.
(4). Бактерия в соответствии с (3), в которой активность белка, кодируемого геном tyrB, повышена за счет трансформации указанной бактерии ДНК, содержащей ген tyrB.
(5). Бактерия в соответствии с (4), в которой трансформация осуществляется с помощью многокопийного вектора.
(6). Способ получения L-лейцина, включающий стадии:
- выращивания бактерии в соответствии с (1) - (5) в питательной среде с целью продукции и накопления L-лейцина в питательной среде, и
- выделения L-лейцина из культуральной жидкости.
(7). Способ в соответствии с (7), в котором бактерия модифицирована с целью повышения экспрессии генов биосинтеза L-лейцина.
1. Бактерия согласно настоящему изобретению
Бактерией согласно настоящему изобретению является бактерия, принадлежащая к роду Escherichia, - продуцент L-лейцина, которая производит L-валин, L-изолейцин и L-гомолейцин в количестве, меньшем 1% от количества произведенного L -лейцина.
Термин “бактерия - продуцент L-лейцина”, использованный здесь, означает бактерию, способную к продукции и накоплению L-лейцина в питательной среде в количестве большем, чем штамм дикого типа или родительский штамм Е.coli, такой как штамм Е.coli К-12, и предпочтительно означает, что микроорганизм способен к продукции и накоплению в питательной среде не менее 0.5 г/л, более предпочтительно, не менее 1.0 г/л L-лейцина.
Термин “бактерия, принадлежащая к роду Escherichia” означает, что бактерия относится к роду Escherichia в соответствии с классификацией, известной специалисту в области микробиологии. В качестве примера микроорганизма, принадлежащего к роду Escherichia, использованного в настоящем изобретении, может быть упомянута бактерия Escherichia coli (E.coli).
Термин “производит L-валин, L-изолейцин и L-гомолейцин в количестве, меньшем 1% от количества произведенного L-лейцина”, означает, что количество L-валина, L-изолейцина и L-гомолейцина, которое присутствует в питательной среде после завершения выращивания бактерии - продуцента L-лейцина, значительно ниже в сравнении с количеством основного продукта, L-лейцина. Количество L-валина, L-изолейцина и L-гомолейцина значительно ниже в сравнении с L-лейцина в случае, когда, например, количество каждого из таких соединений как L-валин, L-изолейцин и L-гомолейцин, меньше 1% от количества произведенного L-лейцина. Предпочтительно, это означает, что количество L-валина, L-изолейцина и L-гомолейцина не может быть даже определено традиционными методами, например, тонкослойной хроматографией (ТСХ) или ВЭЖХ.
Термин “инактивация гена ilvE” означает, что целевой ген модифицирован таким образом, что модифицированный ген кодирует мутантный (неактивный) фермент с не детектируемым известными методами уровнем активности или этот модифицированный ген не способен кодировать какой-либо фермент. Ген ilvE кодирует трансаминазу разветвленных аминокислот (309 аминокислотных остатков), катализирующую реакции аминирования α-кетокарбоксикислот и их солей. Указанная трансаминаза разветвленных аминокислот превращает, например, α-кетокапроат в L-лейцин, α-кетоизовалерат в L-валин, α-кето-β-метилвалерат в L-изолейцин. Ген ilvE (нуклеотиды с 3950107 по 3951036 в последовательности с номером NC 000913.1 в GenBank, gi:16131628) расположен между генами ilvM и ilvD. Инактивация гена может быть произведена традиционными методами, такими как мутагенная обработка с помощью УФ-излучения или обработка нитрозогуанидином (N-метил-N’-нитро-N-нитрозогуанидин), сайт-специфический мутагенез, дезинтеграция гена с использованием гомологичной рекомбинации или/и инсерционно-делеционный мутагенез (Datsenko K.A. and Wanner B.L., Proc. Natl. Acad. Sci. USA, 2000, 97(12), 6640-6645).
Термин “снижение активности белка, кодируемого геном ilvE” означает, что последовательность гена ilvE, кодирующая белок, или последовательность, регулирующая экспрессию гена ilvE, были модифицированы таким образом, что удельная активность фермента уменьшилась. Снижение активности указанного белка может быть осуществлено традиционными методами, такими как мутагенная обработка с помощью УФ-излучения или обработка нитрозогуанидином (N-метил-N’-нитро-N-нитрозогуанидин) или сайт-специфический мутагенез с последующей селекцией бактерий с требуемым фенотипом. Бактерия, содержащая в указанном белке мутацию типа “leaky”, также может быть использована в настоящем изобретении. Белком, содержащим мутацию типа “leaky”, является мутантный белок, в котором изменения последовательности не приводят к полному исчезновению его активности (Lewin В., Genes VII, Oxford Press, 2000, р.16).
Также, бактерией согласно настоящему изобретению является бактерия, принадлежащая к роду Escherichia, - продуцент L-лейцина, которая производит L-валин, L-изолейцин и L-гомолейцин в количестве, меньшем 1% от количества произведенного L-лейцина, и в которой активность белка, кодируемого геном tyrB, повышена.
Термин “активность белка, кодируемого геном tyrB, повышена” означает, что количество молекул указанного белка в клетке повышено или удельная активность белка повышена. Ген tyrB кодирует трансаминазу ароматических аминокислот (397 аминокислотных остатков), которая, используя глутамат в качестве донора аминогруппы, катализирует трансаминирование α-кетокислот, таких как фенилпируват и 4-гидроксифенилпируват, с образованием фенилаланина и тирозина, соответственно. Но термин “активность”, использованный здесь, означает активность по превращению α-кетокапроата в L-лейцина с использованием глутамата в качестве донора аминогруппы (Escherichia coli and Salmonella, Second Edition, Editor in Chief: F.C.Neidhardt, ASM Press, Washington D.C., 1996). Ген tyrB (нуклеотиды с 4264693 по 4265886 в последовательности NC_000913.1 в базе данных GenBank, gi:16131880) расположен между генами air и aphA.
Методы увеличения активности белка согласно настоящему изобретению, в особенности методы увеличения количества молекул указанного белка в клетке, включают методы увеличения числа копий гена и методы изменения последовательности, регулирующей экспрессию ДНК, кодирующей указанный белок, или последовательности “энхасера”, но не ограничиваются ими.
Термин “трансформация бактерии ДНК, содержащей ген tyrB” означает введение указанной ДНК в клетку бактерии, например, с помощью традиционных методов с целью увеличения числа копий гена. Число копий гена может быть увеличено путем введения этого гена в многокопийный вектор с образованием рекомбинантной ДНК с последующим введением полученной рекомбинантной ДНК в микроорганизм. Примерами векторов, использующихся для введения рекомбинантной ДНК, являются плазмидные векторы, такие как pMW118, pBR322, pUC19, pET22b, pACYC184 и подобные им, фаговые векторы, такие как 11059, 1BF101, M13mp9, фаг Mu (выложенная патентная заявка Японии №2-109985) и подобные им, и транспозоны (Berg, D.E. and Berg, C.M., Bio/Technol, 1,417 (1983)), такие как Mu, Tn10, Tn5 и подобные им. Кроме того, усиление экспрессии гена может быть достигнуто путем интеграции гена в бактериальную хромосому методом гомологичной рекомбинации или подобным.
Методы изменения последовательности, регулирующей экспрессию, или последовательности “энхасера” могут быть использованы совместно с методами увеличения числа копий гена.
Для выведения микроорганизма, принадлежащего к роду Escherichia и обладающего повышенной экспрессией указанного гена, необходимый участок гена может быть получен с помощью ПЦР (полимеразной цепной реакции) основываясь, главным образом, на уже доступной информации о генах Е.coli. Например, ген tyrB может быть клонирован с хромосомной ДНК штаммов Е.coli K12 или Е.coli MG 1655 с использованием метода ПЦР. Хромосомная ДНК, необходимая для этого, также может быть получена из любого другого штамма Е.coli.
Изменение последовательности, регулирующей экспрессию ДНК, кодирующей указанный белок, может быть достигнуто путем помещения ДНК, кодирующей белок согласно настоящему изобретению, под контроль сильного промотора. В качестве сильных промоторов известны, например, lac промотор, trp промотор, trc промотор, PL промотор фага лямбда. С другой стороны, промотор может быть усилен, например, путем введения мутации в указанный промотор с целью увеличения уровня транскрипции гена, расположенного после промотора. Далее, известно, что замена нескольких нуклеотидов в участке между местом связывания рибосомы (RBS) и старт кодоном, а в особенности, в последовательности непосредственно перед старт-кодоном, в значительной степени влияет на транслируемость мРНК (Gold et al., Annu. Rev. Microbiol, 35, 365-403, 1981; Hui et al., EMBO J., 3, 623-629, 1984).
Более того, некий “энхансер” может быть дополнительно введен с целью увеличения уровня транскрипции указанного гена. Введение ДНК, содержащей либо ген, либо промотор в хромосомную ДНК, описано, например, в выложенной патентной заявке Японии №1215280(1989).
Бактерия согласно настоящему изобретению может быть в дальнейшем улучшена за счет увеличения экспрессии одного или нескольких генов, вовлеченных в биосинтез L-лейцина. Примерами таких генов являются гены лейцинового оперона, leu оперона, предпочтительно гена, кодирующего изопропилмалатсинтазу (ген leuA, нуклеотиды с 81958 по 83529 в последовательности NC_000913.1 в базе данных GenBank, gi:16128068), у которой утрачена чувствительность к ингибированию L-лейцином по типу обратной связи (Европейский патент ЕР 1067191). Лейциновый оперон также включает в себя гены leuB (gi:16128067), leuC (gi:16128066) и leuD (gi:16128065) (нуклеотиды с 80867 по 81961, с 79464 по 80864 и с 78848 по 79453 в последовательности NC_000913.1 в базе данных GenBank, соответственно).
В качестве исходного штамма, в котором будет инактивирована активность трансаминазы разветвленных аминокислот, кодируемой геном ilvE, и увеличена активность трансаминазы ароматических аминокислот, кодируемой геном tyrB, могут быть использованы бактерии, принадлежащие к роду Escherichia, такие как Е.coli K12, Е.coli W1660 и подобные им. Также могут быть использованы в качестве родительского штамма бактерии, принадлежащие к роду Escherichia, - продуценты L-лейцина, такие как Н-9068 (АТСС 21530), Н-9070 (FERM ВР-4704) и Н-9072 (FERM ВР-4706), устойчивые к 4-азалейцину или 5,5,5-трифторлейцину (патент США 5744331), штаммы Е.coli, содержащие изопропилмалатсинтазу, у которой чувствительность к лейцину по типу обратной связи утрачена (Европейский патент ЕР1067191), штамм Е.coli AJ11478, устойчивый к β-2-тиенилаланину и β-гидроксилейцину (патент США 5763231) и подобные им.
Методы получения плазмидной ДНК, расщепления и лигирования ДНК, трансформации, выбора олигонуклеотидов в качестве затравок и подобные им являются традиционными методами, хорошо известными для специалиста в данной области. Эти методы описаны, например, в книге Sambrook, J., Fritsch, E.F., and Maniatis, Т., "Molecular Cloning A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press (1989).
2. Способ согласно настоящему изобретению
Способом согласно настоящему изобретению является способ получения L-лейцина, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде с целью продукции и накопления L-лейцина в питательной среде, и выделения L-лейцина из культуральной жидкости.
Согласно настоящему изобретению выращивание, выделение и очистка L-лейцина из культуральной или подобной ей жидкости может быть осуществлена способом, подобным традиционным способам ферментации, в которых аминокислота продуцируется с использованием микроорганизма.
Питательная среда, используемая для выращивания, может быть как синтетической, так и натуральной, при условии, что указанная среда содержит источники углерода, азота, минеральные добавки и, если необходимо, соответствующее количество питательных добавок, необходимых для роста микроорганизмов. К источникам углерода относятся различные углеводы, такие как глюкоза и сахароза, а также различные органические кислоты. В зависимости от характера ассимиляции используемого микроорганизма, могут использоваться спирты, такие как этанол и глицерин. В качестве источника азота могут использоваться различные неорганические соли аммония, такие как аммиак и сульфат аммония, другие соединения азота, такие как амины, природные источники азота, такие как пептон, гидролизат соевых бобов, ферментолизат микроорганизмов. В качестве минеральных добавок могут использоваться фосфат калия, сульфат магния, хлорид натрия, сульфат железа, сульфат марганца, хлорид кальция и подобные им соединения. В качестве витаминов могут использоваться тиамин и дрожжевой экстракт.
Выращивание осуществляется предпочтительно в аэробных условиях, таких как перемешивание культуральной жидкости на качалке, взбалтывание с аэрацией, при температуре в пределах от 20 до 40°С, предпочтительно в пределах от 30 до 38°С. рН среды поддерживают в пределах от 5 до 9, предпочтительно от 6.5 до 7.2. рН среды может регулироваться аммиаком, карбонатом кальция, различными кислотами, основаниями и буферными растворами. Обычно выращивание в течение от 1 до 5 дней приводит к накоплению целевой L-аминокислоты в культуральной жидкости.
После выращивания твердые остатки, такие как клетки, могут быть удалены из культуральной жидкости методом центрифугирования или фильтрацией через мембрану, а затем L-лейцин может быть выделен и очищен методами ионообменной хроматографии, концентрирования и кристаллизации.
Чертеж показывает метаболические пути синтеза L-лейцина и L-валина
Наилучший способ осуществления изобретения
Более детально настоящее изобретение будет разъяснено ниже со ссылкой на примеры.
Пример 1. Получение бактерии, принадлежащей к роду Escherichia, - продуцента L-лейцина.
Для осуществления данного подхода клетки природного штамма Е.coli К-12 (ВКПМ В-7) были обработаны мутагеном, N-метил-N’-нитро-N-нитрозогуанидин (0.05 мг/мл), в течение 20 мин при 37°С, 4 раза отмыты физиологическим раствором и засеяны на минимальную среду М9 с агаром, содержащую 4.0 мг/мл DL-4-азалейцина. Чашки инкубировались в течение 5 дней при 37°С. Колонии, появившиеся на чашках, были отобраны и очищены на чашках в L-агаром путем нанесения полосок. Лучший из полученных мутантов, устойчивых к DL-4-азалейцину, мутант 55 продуцировал 2.1 г/л L-лейцина и 0.8 г/л L-валина (таблица, смотри ниже). Этот штамм Е.coli 55 был отобран и использован для получения двойной ауксотрофии по L-изолейцину и L-валину. Было получено большое количество двойных ауксотрофов, требующих L-изолейцин и L-валин для роста. Среди полученных двойных ауксотрофов был выбран лучший продуцент L-лейцина - штамм 505, продуцирующий 1.3 г/л L-лейцина. Указанный штамм не производил L-валин и L-изолейцин, но двойная ауксотрофия привела к уменьшению продукции L-лейцина.
Двойная ауксотрофия по L-изолейцину и L-валину была обусловлена мутацией в гене ilvE. Это было подтверждено тем фактом, что введение плазмиды, содержащей ген ilvE, в штамм 505 полностью комплементировало двойную ауксотрофию по L-изолейцину и L-валину. Более того, измерение ферментативной активности аминотрансферазы разветвленных аминокислот, кодируемой геном ilvE из штамма 505, с использованием 2-кетоизовалерата в качестве субстрата показало отсутствие у нее какой-либо активности. Условия измерения ферментативной активности описаны Coller R.H. and Kohlhaw G. (Nonidentity of the aspartate and the aromatic aminotransferase components oftransaminase A in E.coli. J. Bacteriology, 1972, 112(1), p.365-371).
Штамм 505 был депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) (РФ, 113545 Москва, 1-й Дорожный проезд, 1) 14 мая 2001 г. под инвентарным номером ВКПМ В-8124.
Пример 2. Клонирование гена tyrB из Е.coli в плазмиду pACYC185.
Фрагмент хромосомы из штамма Е.coli К-12 (ВКПМ В-7), содержащий ген tyrB, был амплифицирован методом ПЦР с использованием затравок 1 (SEQ ID NO:1) и 2 (SEQ ID NO:2), приведенных в Списке последовательностей. Затравки 1 и 2 (24-звенные) содержат последовательности сайтов ВаmHI и HindIII, соответственно, присоединенные к их 5’-концам. Затем ВаmHI - НindIII фрагмент ДНК длиной 1.7 т.п.о. был лигирован по соответствующим сайтам плазмиды pACYC184 (Chang, A.C.Y. and Cohen, S.N., Construction and characterization of amplifiable multicopy DNA cloning vehicles derived from the P15A cryptic miniplasmid, J. Bacteriol, 134, 1141-1156, 1978. Rose, R.E., The nucleotide sequence of pACYC184, Nucleic Acids Res., 16, 355, 1988) с получением плазмиды pACYC-tyrB. Плазмида pACYC-tyrB была введена в клетки штамма Е.coli методом трансформации, таким образом был получен штамм 505/pACYC-tyrB.
Пример 3. Влияние амплификации гена tyrB на продукцию L-лейцина
Одна петля каждого из штаммов 55, 505, 505/pACYC-tyrB была перенесена в 20 мл пробирки с L-бульоном и полученная культура инкубировалась в течение ночи с аэрацией при 32°С. 0.1 мл каждой ночной культуры был перенесен в 20 мл пробирки (внутренний диаметр - 22 мм), разбавлен в 2 мл питательной среды для ферментации и выращивался при 32°С в течение 48 часов на роторной качалке. Питательная среда для ферментации содержала 60 г/л глюкозы, 25 г/л сульфата аммония, 2 г/л КН2РО4, 1 г/л MgSO4, 0.1 мг/л тиамина, 5 г/л дрожжевого экстракта Difco и 25 г/л мела (рН 7.2). Глюкозу и мел стерилизовали раздельно.
После выращивания традиционным методом была определена стабильность плазмиды. Количество L-лейцина, накопленного в культуральной жидкости, определяли методом ТСХ. Подвижная фаза для ТСХ имела следующий состав: изопропанол - 80 мл, этилацетат - 80 мл, NH4OH (30%) - 25 мл, H2O - 50 мл.
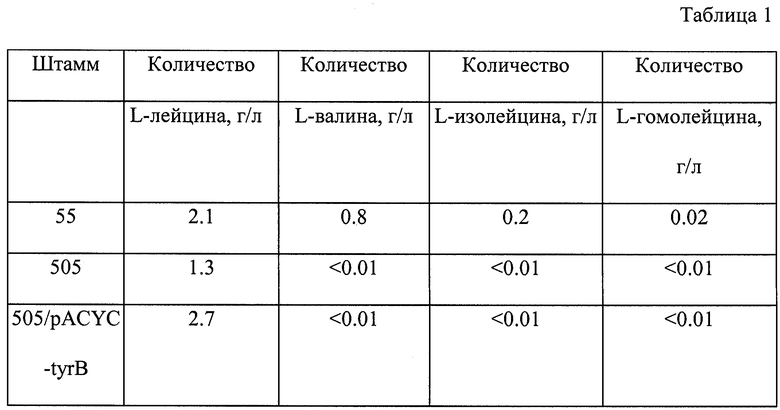

Как видно из таблицы, штаммы 505 и 505/pACYC-tyrB не производили L-валин, L-изолейцин и L-гомосерин. Инактивация гена ilvE приводила к снижению продукции L-лейцина. Амплификация гена tyrB усиливала накопление L-лейцина штаммом 505 - продуцентом L-лейцина.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИЙ С ОПТИМИЗИРОВАННЫМ УРОВНЕМ ГЕННОЙ ЭКСПРЕССИИ | 2003 |
|
RU2268305C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ, ШТАММ Escherichia coli - ПРОДУЦЕНТ L-АМИНОКИСЛОТЫ (ВАРИАНТЫ) | 2001 |
|
RU2215784C2 |
| СПОСОБ ПОЛУЧЕНИЯ НОРЛЕЙЦИНА И НОРВАЛИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ РОДА Escherichia, В КОТОРОЙ ВСЕ СИНТАЗЫ АЦЕТОГИДРОКСИКИСЛОТ ИНАКТИВИРОВАНЫ | 2004 |
|
RU2315807C2 |
| ШТАММ БАКТЕРИЙ ESCHERICHIA COLI ПРОДУЦЕНТ L-ЛЕЙЦИНА (ВАРИАНТЫ) | 1997 |
|
RU2140450C1 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ СЕМЕЙСТВА ГЛУТАМАТА ИЛИ L-ВАЛИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia | 2009 |
|
RU2418064C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА ИЛИ L-АРГИНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН aldH | 2006 |
|
RU2330882C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА ИЛИ L-АРГИНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН fdrA | 2006 |
|
RU2337957C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА ИЛИ L-АРГИНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН bisC | 2006 |
|
RU2337958C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АРГИНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ОПЕРОН relBE | 2005 |
|
RU2313574C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ ESCHERICHIA, В КОТОРОЙ ИНАКТИВИРОВАН ОПЕРОН mazEF | 2005 |
|
RU2313573C2 |
Изобретение относится к микробиологической промышленности. Осуществляют получение L-лейцина с использованием бактерии, принадлежащей к роду Escherichia, которая производит L-валин, L-изолейцин и L-гомолейцин в количестве, меньшем 1% от количества произведенного L-лейцина, вследствие инактивации гена ilvE, кодирующего аминотрансферазу разветвленных аминокислот, и которая продуцирует повышенное количество L-лейцина вследствие повышения активности трансаминазы ароматических аминокислот, кодируемой геном tyrB. Изобретение позволяет повысить продукцию L-лейцина при снижении продукции L-валина, L-изолейцина и L-гомолейцина. 3 н.з.п. ф-лы, 5 з.п. ф-лы, 1 ил., 1 табл.,
| ШТАММ БАКТЕРИЙ ESCHERICHIA COLI ПРОДУЦЕНТ L-ЛЕЙЦИНА (ВАРИАНТЫ) | 1997 |
|
RU2140450C1 |
| ФРАГМЕНТ ДНК RHTC, КОДИРУЮЩИЙ СИНТЕЗ БЕЛКА RHTC, ПРИДАЮЩЕГО ПОВЫШЕННУЮ УСТОЙЧИВОСТЬ К L-ТРЕОНИНУ БАКТЕРИЯМ ESCHERICHIA COLI, И СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ | 1998 |
|
RU2148642C1 |
| US 5120654 A, 09.06.1992 | |||
| US 6124121 A, 26.09.2000. | |||
Авторы
Даты
2004-12-27—Публикация
2002-06-25—Подача