Область изобретения
Настоящее изобретение относится к применению фармакологически активных аналогов витамина D в новом способе медицинской профилактики и лечения остеопороза и связанных заболеваний костей, а также фармацевтических препаратов, содержащих указанные соединения, и лекарственных форм таких препаратов. Настоящее изобретение относится также к новым фармакологически активным аналогам витамина D, а также к фармацевтическим препаратам, содержащим указанные соединения, и к лекарственным формам таких препаратов.
Предпосылки создания изобретения
Недавно было показано, что 1α,25-дигидроксивитамин D3 (1,25(ОН)2D3) эффективен в отношении ассимиляции костей, что указывает на потенциальную возможность применения данного соединения в лечении остеопороза и состояний, характеризующихся аномальной минерализацией костей. Erben и другие (Endocrinology, 139, 4319-4328 (1998)) представили доказательство прямого анаболического действия 1,25(OH)2D3 на кости.
Однако терапевтические возможности 1,25(OH)2D3 при таких симптомах сильно ограничены хорошо известным влиянием указанного гормона на кальциевый метаболизм; повышенные концентрации в крови быстро приводят к усилению гиперкальциемии. Таким образом, указанное соединение не совсем подходит для применения в качестве лекарственного средства при лечении остеопороза, которое может требовать длительного введения лекарства в сравнительно высоких дозах.
Известен ряд окса- и тиа-аналогов витамина D3.
1α,25-дигидрокси-20-окса-21-норвитамин D3 и 1α-гидрокси-20-окса-21-норвитамин D3 описаны в публикации N. Kubodera et al., Chem. Pharm. Bull., 34, 2286 (1986), 1α,25-дигидрокси-22-оксавитамин D3 и 25-гидрокси-22-оксавитамин D3 описаны в Е. Мurауаmа et аl., Chem. Pharm. Bull., 34, 4410 (1986), J. Abe et al., FEBS LETTERS, 226, 58 (1987) и европейской патентной заявке, номер публикации 184 112, а 1α,25-дигидрокси-23-оксавитамин D3 и 1α,25-дигидрокси-23-тиавитамин D3 описаны в европейской патентной заявке, номер публикации 78704. 24- и 25-сульфонил-аналоги 1α,25-дигидроксивитамина D3 описаны в G.H. Posner et al., J. Med. Chem., 42, 3425 (1999).
Некоторые из указанных соединений могут обладать преимуществами по сравнению с 1,25(ОН)2D3, оказывая пониженные воздействия на кальциевый метаболизм по сравнению с 1,25(ОН)2D3. Однако сообщения о возможном влиянии указанных соединений на ассимиляцию костей отсутствуют.
Краткое описание изобретения
По причине серьезных медицинских осложнений у больного и сравнительно ограниченного числа лекарств, пригодных для лечения остеопороэа, а также из-за тяжести известных побочных действий 1,25(ОН)2D3 целью настоящего изобретения является представление активных аналогов витамина D, включая новые аналоги, с целью получения лекарственных препаратов для соответствующей терапии остеопороза, включая применение указанных соединений для получения лекарственных средств для активации остеогенеза и лечения или профилактики остеопороза, такого как индуцированный стероидом старческий и постменопаузальный остеопороз, остеомиляция и связанные заболевания костей. Кроме того, целью изобретения является создание активных аналогов витамина D, включая новые аналоги, с целью получения лекарственных препаратов для повышения мышечной силы, включая лечение слабости скелетных мышц.
Изобретателями неожиданно было обнаружено, что описанные ранее аналоги витамина D, известные как обладающие противовоспалительным и иммуномодулирующим действиями, а также ингибирующие пролиферацию некоторых клеток, где указанные аналоги описываются представленной общей формулой I, и новые соединения общей формулы I, обладают анаболическим действием на кости in vivo в моделях остеопороза и связанных заболеваний костей. Кроме того, костная анаболическая активность аналогов согласно настоящему изобретению, включая новые соединения, сопровождается действием по укреплению скелетных мышц. Таким образом, рассматриваемые соединения даже более полезны при лечении различных заболеваний, в особенности при лечении остеопороза.
Таким образом, цель настоящего изобретения состоит в получении выбранных аналогов витамина D, имеющих общие формулы I и Iа, приведенные ниже. Общая формула I рассматриваемых активных соединений описана ранее в международной патентной заявке № WO 91/15475, которая включена в описание во всей полноте в качестве ссылки.
Следовательно, настоящее изобретение касается применения соединений, представленных общей формулой I

где
Х означает водород или гидрокси;
Y означает кислород или серу либо окисленную серу, выбранную из групп S(O) и S(O2);
R1 и R2, которые могут быть одинаковыми или различными, означают водород или остаток после удаления 1 атома водорода из линейного, разветвленного или циклического, насыщенного или ненасыщенного C1-С6-углеводорода; или R1 и R2, вместе с атомом углерода, к которому они присоединены (обозначено звездочкой в формуле I), несущим группу X, образуют С3-С8-углеродный цикл;
Q означает бирадикальный остаток после удаления 2 атомов водорода из линейного, разветвленного или циклического, насыщенного или ненасыщенного C1-C8-углеводорода;
R3 означает водород или остаток после удаления 1 атома водорода из линейного, разветвленного или циклического, насыщенного или ненасыщенного C1-С6-углеводорода;
R1, R2 и/или Q необязательно замещены одним или более атомами дейтерия или фтора и
n равен 0 или 1;
и производных соединений формулы I, в которых одна или более гидроксильных групп превращены в группы -O-ацил или -O-гликозил, или фосфатный эфир, такие маскированные группы гидролизуются in vivo; для получения лекарственного средства для лечения и/или профилактики остеопороза и связанных заболеваний костей.
Подробное описание изобретения
При использовании по настоящему изобретению предпочтительными соединениями формулы I являются соединения, в которых Y означает серу или окисленную серу, такую как S(O) или S(O2); и/или соединения формулы I, где R1 и R2, вместе с атомом углерода, к которому они присоединены, несущим группу X, образуют С3-С5-олефиновую группу, такую как С3-С5-алкенильную группу или С3-С5-углеродный цикл, указанный цикл предпочтительно является насыщенным, таким как С3-С5-алкилен; и/или соединения формулы I, где Х означает гидрокси; и/или соединения формулы I, где Q означает фениленовую группу, необязательно замещенную одним или более атомами фтора; и/или соединения формулы I, где R3 означает водород; и/или соединения формулы I, где n равно 1.
Примерами конкретных соединений, используемых по изобретению, являются:
1(S), 3(R)-дигидрокси-20(R)-(2-гидрокси-2-метил-1-пропоксиметил)-9,10-секопрегна-5(Z), 7 (Е), 10 (19)-триен (соединение 101),
1(S), 3(R)-дигидрокси-20(R)-(4-гидрокси-1-бутоксиметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 104), 1(S), 3(R)-дигидрокси-20(R)-(4-гидрокси-4-метил-1-пентилоксиметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 105), 1(S), 3(R)-дигидрокси-20(R)-[3-(1-гидроксициклогекс-1-ил)-проп-2-ин-1-илоксиметил]-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 110), 1(S), 3(R)-дигидрокси-20(R)-22(S)-метил-(4-гидроксипент-2Е-ен-1-илоксиметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 112), 1(S), 3(R)-дигидрокси-20(R)-22(R)-метил-(4-гидроксипент-2Е-ен-1-илоксиметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 113), 1(S), 3(R)-дигидрокси-20(R)-(2-циклопропил-2(S)-гидроксиэтил) тиометил]-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 114), 1(S), 3(R)-дигидрокси-20(R)-(2-циклопропил-2(R)-гидроксиэтил) тиометил]-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 115), 1(S), 3(R)-дигидрокси-20(R)-(3-гидрокси-3-метил-1-бутилсульфинилметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединения 118 и 119), 1(S), 3(R)-дигидрокси-20(R)-(3-гидрокси-3-метил-1-бутилсульфонилметил)-9,10-секопрегна-5(Z), 7(E), 10(19)-триен (соединение 120), 1(S), 3(R)-дигидрокси-20(R)-22(S)-метил-(3-гидрокси-3-метил-1-бутилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 122), 1(S), 3(R)-дигидрокси-20(R)-22(R)-метил-(3-гидрокси-3-метил-1-бутилтиометил)-9,10-секопрегна-5(Z), 1(Е), 10(19)-триен (соединение 123), 1(S), 3(R)-дигидрокси-20(R)-22(S)-метил-(3-гидрокси-3-этил-1-пентилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 124), 1(S), 3(R)-дигидрокси-20(R)-22(R)-метил-(3-гидрокси-3-этил-1-пентилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 125), 1(S), 3(R)-дигидрокси-20(R)-(2-((1-гидрокси-1-этил)пропил) фенилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 143), 1(S), 3(R)-дигидрокси-20(R)-(4-((1-гидрокси-1-этил)пропил) фенилтиометил)-9,10-секопрегна-5(Z), 7(E), 10(19)-триен (соединение 146), 1(S), 3(R)-дигидрокси-20(R)-(3-гидрокси-фенилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 148), 1(S), 3(R)-дигидрокси-20(R)-(2-гидрокси-2-этил-1-Оутилтиометил)-9,10-секопрегна-5(Z), 7(E), 10(19)-триен (соединение 150), 1(S), 3(R)-дигидрокси-20(R)-(4-гидрокси-4-этил-1-гексилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 151), 1(S), 3(R)-дигидрокси-20(R)-(3-гидроксифеноксиметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 152) и 1(S), 3(R)-дигидрокси-20(R)-(4-гидрокси-4-метил-1-пент-2(Z)-енилоксиметил-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 154).
Предпочтительными соединениями являются:
1(S), 3(R)-дигидрокси-20(R)-(3-гидрокси-3-метил-1-бутоксиметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 102), 1(S), 3(R)-дигидрокси-20(R)-(3-гидрокси-3-этил-1-пентилоксиметил-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 103), 1(S), 3(R)-дигидрокси-20(R)-(4-гидрокси-4-метил-1-пентилоксиметил)-9,10-секопрегна-(Z), 7(Е), 10(19)-триен (соединение 106), 1(S), 3(R)-дигидрокси-20(R)-(4-гидрокси-4-метил-1-пент-2(Е)-енилоксиметил-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 107), 1(S), 3(R)-дигидрокси-20(R)-(4-гидрокси-4-метил-1-пент-2-инилоксиметил)-9,10-секопрегна-5(Z), 7(E), 10(19)-триен (соединение 108), 1(S), 3(R)-дигидрокси-20(R)-(4-гидрокси-4-трифторметил-5,5,5-трифтор-1-пент-2-инилоксиметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 109), 1(S), 3(R)-дигидрокси-20(R)-[3-(2-гидрокси-2-пропил) феноксиметил]-9,10-секопрегна-5(Z), 7(E), 10(19)-триен (соединение 111), 1(S), 3(R)-дигидрокси-20(R)-(2-гидрокси-2-метил-1-пропилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 116), 1(S), 3(R)-дигидрокси-20(R)-(3-гидрокси-3-метил-1-бутилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 117), 1(S), 3(R)-дигидрокси-20(R)-(3-гидрокси-3-этил-1-пентилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 121), 1(S), 3(R)-дигидрокси-20(R)-(5-гидрокси-5-метил-1-гексилоксиметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 126), 1(S), 3(R)-дигидрокси-20(R)-[2-(2-гидрокси-2-пропил) феноксиметил]-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 127), 1(S), 3(R)-дигидрокси-20(R)-[2-(3-гидрокси-3-пентил) феноксиметил]-9,10-секопрегна-5(Z), 7(E), 10(19)-триен (соединение 128), 1(S), 3(R)-дигидрокси-20(R)-[3-(3-гидрокси-3-пентил) феноксиметил]-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 129), 1(S), 3(R)-дигидрокси-20(R)-[4-(2-гидрокси-2-пропил) феноксиметил]-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 130), 1(S), 3(R)-дигидрокси-20(R)-[4-(3-гидрокси-3-пентил) феноксиметил]-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 131), 1(S), 3(R)-дигидрокси-20(R)-[3-(гидроксиметил)феноксиметил]-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 132), 1(S),3(R)-дигидрокси-20(R)-(3-гидрокси-3-этил-1-пентилсульфинилметил-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 133), 1(S), 3(R)-дигидрокси-20(R)-(3-гидрокси-3-этил-1-пентилсульфинилметил)-9,10-секопрегна-5(Z), 7(E), 10(19)-триен (соединение 134), 1(S), 3(R)-дигидрокси-20(R)-(3-гидрокси-3-этил-1-пентилсульфонилметил)-9,10-секопрегна-5(Z), 7(Е), -10(19)-триен (соединение 135), 1(S), 3(R)-дигидрокси-20(R)-(4-гидрокси-4-метил-1-пентилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 136), 1(S), 3(R)-дигидрокси-20(R)-(3-(гидроксиметил)фенилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 137), 1(S), 3(R)-дигидрокси-20(R)-(3-((1-гидрокси-1-метил)этил) фенилтиометил)-9,10-секопрегна-5(Z), 7(Е), -10(19)-триен (соединение 138), 1(S), 3(R)-дигидрокси-20(R)-(4-гидрокси-4-этил-1-гекс-2-инилоксиметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 139), 1(S), 3(R)-дигидрокси-20(R)-(2-гидроксифеноксиметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 140), 1(S), 3(R)-дигидрокси-20(R)-(3-гидроксифеноксиметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 141), 1(S), 3(R)-дигидрокси-20(R)-(2-((1-гидрокси-1-метил)этил) фенилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 142), 1(S), 3(R)-дигидрокси-20(R)-(3-((1-гидрокси-1-этил)пропил) фенилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 144), 1(S), 3(R)-дигидрокси-20(R)-(4-((1-гидрокси-1-метил)этил) фенилтиометил)-9,10-секопрегна-5(Z), 7(E), 10(19)-триен (соединение 145), 1(S), 3(R)-дигидрокси-20(R)-(2-гидрокси)фенилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 147), 1(S), 3(R)-дигидрокси-20(R)-(4-гидрокси-фенилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 149), 1(S), 3(R)-дигидрокси-20(R)-(3,3-дифтор-4-гидрокси-4-метил-1-пентилоксиметил)-9,10-секопрегна-5(Z), -7(Е), 10(19)-триен (соединение 153), 1(S), 3(R)-дигидрокси-20(R)-(4-(гидроксиметил)фенилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 163), 1(S), 3(R)-дигидрокси-20(R)-(4-((1-гидрокси-1-этил)пропил)) фенилтиометил)-9,10-секопрегна-5(Z), 7(E), 10(19)-триен (соединение 164), 1(S), 3(R)-дигидрокси-20(R)-(4-((1-гидрокси-1-метил)этил)) фенилтиометил)-22(R)-метил-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 165), 1(S), 3(R)-дигидрокси-20(R)-(4-((1-гидрокси-1-метил)этил)) фенилтиометил)-22(S)-метил-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 166) производные указанных соединений, где одна или более гидроксильных групп превращены в -O-ацильные или -O-гликозильные группы, или фосфатные эфиры, такие защищенные группы гидролизуются in vivo; для получения лекарственного средства для лечения и/или профилактики остеопороза и связанных заболеваний костей.
Примеры R1 и R2, взятых отдельно, включают (помимо водорода) метил, трифторметил, этил, винил, нормальный, изо- и циклопропил и 1-метилвинил. Когда R1 и R2 различны, предпочтительно R1 означает водород, а R2 означает циклопропил. Предпочтительны соединения, где R1=R2 означает метил, этил, водород или СF3.
Предпочтительно использовать соединения общей формулы I, где каждый из R1 и R2 независимо означает С1-С2-алкильную группу, такую как метил и этил, и где Q означает 1,4-замещенный фенилен.
Примеры взятых вместе R1 и R2 включают ди-, три-, тетра- и пентаметилен. Предпочтителен пентаметилен.
Примеры Q включают метилен, ди-, три-, тетраметилен, -СН2-СН=СН-, -CH2-C=C-, (CH2)2CF2, фенилен (С6Н4; орто, мета, пара), -СН2-(С6Н4)- (орто, мета, пара) и -(С6Н4)-СН2 (орто, мета, пара). Предпочтительны мета- и пара-С6Н4. Наиболее предпочтителен пара-С6Н4.
Примеры R3 включают (помимо водорода) метил, нормальный бутил и фенил. Предпочтительны водород и метил.
Производные формулы I, где одна или более гидроксильных групп защищены группами, которые могут вновь превращаться в гидроксильные группы in vivo, также входят в объем изобретения ("биореверсируемые производные или пролекарства I"). Термин "биореверсируемые производные или пролекарства I" включает, но не в порядке ограничения, производные соединений указанной формулы I, где одна или более гидроксильных групп превращены в -O-ацильные или -O-гликозильные группы, или фосфатный эфир, такие защищенные группы гидролизуются in vivo. Соединения I, в которых Х означает водород, представляют другой тип пролекарства. Указанные соединения сравнительно неактивны in vitro, но могут быть превращены в активные соединения формулы I ферментативным гидроксилированием после введения пациенту.
Кроме того, настоящее изобретение касается соединений формулы Iа
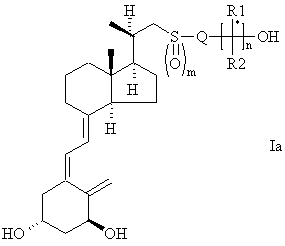
где R1, R2 и Q принимают вышеуказанные значения, m=0, 1 или 2; и n=1. Предпочтительны соединения формулы 1а, где R1 и R2, взятые раздельно, включают (помимо водорода) метил, трифторметил, этил, винил, нормальный, изо- и циклопропил и 1-метилвинил. Более предпочтительны также соединения формулы Iа, где R1=R2 или где каждый из R1 и R2 независимо означает С1-С2-алкильную группу, такую как метил и этил, и метил предпочтителен.
Предпочтительны соединения формулы Iа, где Q включает метилен, ди-, три- и тетраметилен, -СН2-СН=СН-, -СН2-С=С-, фенилен (С6Н4; орто, мета, пара), -СН2-(С6Н4)-(орто, мета, пара) и -(С6Н4)-СН2 (орто, мета, пара). Более предпочтительны соединения формулы Iа, где Q означает линейный пропилен, предпочтительно замещенный одним или более атомами фтора, или где Q означает незамещенную фениленовую группу. Предпочтительно Q означает CH2CH2CF2, мета-С6Н4 или пара-С6Н4.
Соединения формулы Iа также предпочтительно выбирают из группы, включающей:
1(S), 3(R)-дигидрокси-20(R)-(3,3-дифтор-4-гидрокси-4-метил-1-пентилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 155), 1(S), 3(R)-дигидрокси-20(R)-(3,3-дифтор-4-гидрокси-4-метил-1-пентилсульфинилметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 156), 1(S), 3(R)-дигидрокси-20(R)-(3-((1-гидрокси-1-метил)этил) фенил сульфинилметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (изомер соединения 159) (соединение 157),
1(S), 3(R)-дигидрокси-20(R)-(3-((1-гидрокси-1-метил)этил) фенилсульфонилметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 158),
1(S), 3(R)-дигидрокси-20(R)-(3-((1-гидрокси-1-метил)этил) фенил сульфинилметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (изомер соединения 157) (соединение 159),
1(S), 3(R)-дигидрокси-20(R)-(4-((1-гидрокси-1-метил)этил) фенилсульфонилметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 160),
1(S), 3(R)-дигидрокси-20(R)-(4-((1-гидрокси-1-метил)этил) фенилсульфинилметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (изомер соединения 162) (соединение 161) и
1(S), 3(R)-дигидрокси-20(R)-(4-((1-гидрокси-1-метил)этил) фенилсульфинилметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (изомер соединения 161) (соединение 162).
Определения
"С3-С8-углеродный цикл" включает насыщенные циклоалканы и ненасыщенные циклические олефины, такие как циклоалкены с одной эндоциклической двойной связью и 3-8 углеродными атомами.
Когда термины "включают", "включает", "включенный" или "включающий" используются в данном описании, их следует истолковывать как уточняющие наличие указанных признаков, целых чисел, стадий или компонентов, но это не исключает наличия или дополнения еще одного или более характерных признаков, числа, стадии, компонента или группы.
Как видно из формул I и Iа, в зависимости от значений R1, R2, R3 и X соединения по изобретению могут включать несколько диастереоизомерных форм (например, R- или S-конфигурации относительно атома углерода, отмеченного звездочкой). Изобретение охватывает все эти диастереоизомеры в чистой форме, а также смеси диастереоизомеров. Соединения по настоящему изобретению отличаются структурно от всех вышеупомянутых окса- и тиасоединений тем, что они имеют R-конфигурацию в положении 20.
Соединения формул I или Iа, в которых Y=О или S, могут быть получены из производных витамина D 1 (Tetrahedron, 43, 4609 (1987)), например, способами, схематично изображенными на схемах 1 и 2. O-Алкилирование Ib или S-алкилирование III, приводящие к IV, осуществляют обработкой в щелочных условиях создающим боковую цепь блоком общей формулы Z-R, где Z означает уходящую группу, такую как (Сl, Вr или I) или п-толуолсульфонилокси или трифторметансульфонилокси, и R означает -(Q)-[С(R1)(R2)]nХ или, необязательно, радикал, который может быть превращен в указанный радикал на любой подходящей последующей стадии (или нескольких стадиях). Так, R в соединениях IV, V, VI и VII необязательно имеет одно и то же значение на протяжении конкретной последовательности синтезов. Превращение R в -(Q)-[С(R1)(R2)]nХ может включать несколько стадий или может включать временную защиту чувствительной триеновой системы молекулы. Альтернативный способ включает обработку промежуточного соединения II (Z означает вышеуказанную уходящую группу) в щелочных условиях создающим боковую цепь блоком HY-R, где Y означает кислород или серу и R принимает вышеуказанные значения, с получением промежуточного соединения IV. Помимо любой необходимой модификации в боковой цепи (R), конверсия IV до I включает стадию фотоизомеризации и стадию десилилирования, по аналогии со ступенями, используемыми на последних стадиях синтеза других аналогов витамина D (смотри, European patent №0227826).
Может быть удобно поменять последовательность реакции алкилирования (d или е) и реакции фотоизомеризации (g), в этом случае (5Z)-изомер I, Ia, II или III является ключевым промежуточным соединением.
Создающие боковую цепь блоки, RZ, являются либо известными соединениями (некоторые описаны в международной патентной заявке PCT/DK89/00079), либо могут быть получены способами, аналогичными описанным в PCT/DK89/00079. R означает обычно -(Q)-[C(R1)(R2)]nХ1, где X1 означает защищенную ОН группу, например, тетрагидропиранилокси или триалкилсилилокси. (Любые подобные ТНР-эфиры RZ, не описанные в PCT/DK89/00079, легко получить из соответствующего спирта).
Создающие боковую цепь блоки HY-R также являются известными соединениями либо могут быть получены способами, аналогичными тем, что используются для получения подобных известных соединений.
Как схематически показано выше, по меньшей мере, для 23-тиасоединений способ не исключает переноса алкилирования 23-тиола даже на последнюю стадию (например, IХ→Iа (схема 3)).
Соединения формулы I, где Y=S(О) или S(O2), удобно получать путем окисления соответствующего соединения IV, V, VI, VII или I, где Y=S, например, с помощью перекиси водорода и вольфрамата натрия в водном метаноле. (Диастереоизомерные сульфоксиды (Y=S(О)) могут быть разделены хроматографически).
В данном описании использованы следующие стандартные обозначения:
Me = метил
Et = этил
Рrn = н-пропил
Pri = изопропил
But = трет-бутил
ТНР = тетрагидро-4Н-пиран-2-ил
THF = тетрагидрофуран (ТГФ)
Ts = п-толуолсульфонил
ТВА = тетра(н-бутил)аммоний
DMF = диметилформамид

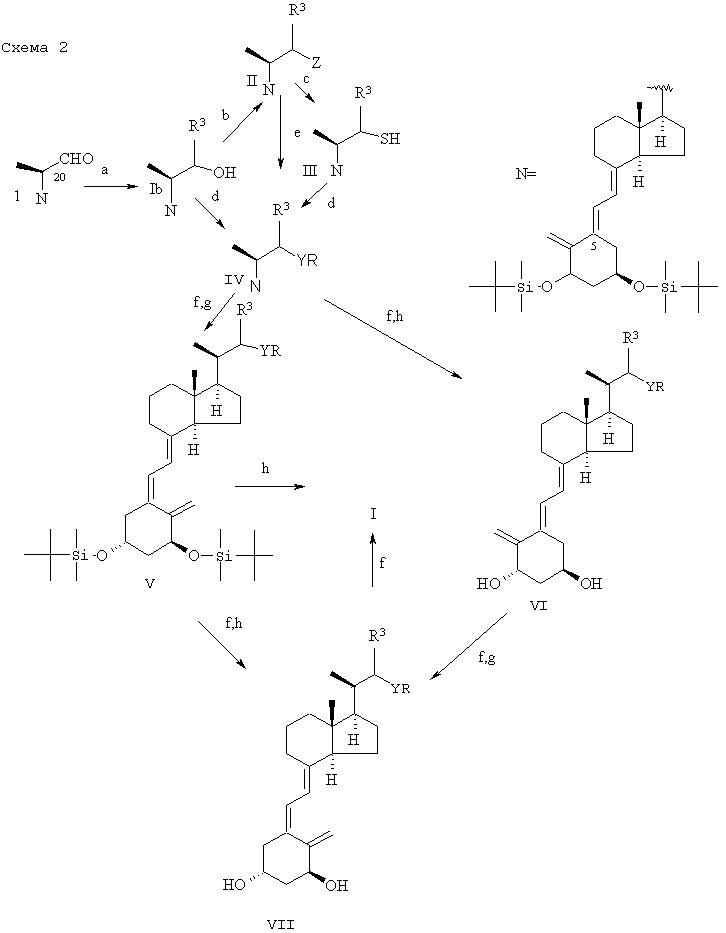

Примечания к схемам 1, 2 и 3
a) Взаимодействие с формальным источником R3 (например, восстановление NaBH4 для R3=H или взаимодействие с R3Li для R3=алкил); необязательное разделение диастереоизомеров для R3=алкил (например, путем хроматографии).
b) Конверсия ОН до уходящей группы (например, путем тозилирования для Z=OTs).
c) (i) Нуклеофильное замещение тиоацетатом, (ii) основный гидролиз.
d) Алкилирование создающим боковую цепь блоком R-Z в присутствии основания (например, КОН, KOBut или КН), в присутствии или отсутствие катализатора (например, 18-Crown-6) в растворителе (например, ТГФ).
e) Взаимодействие с создающим боковую цепь блоком R-YH в присутствии основания (например, NaH) в растворителе, например, ДМФ.
f) Необязательная модификация функциональной группы в боковой цепи.
g) Изомеризация с hυ-триплетным сенсибилизатором, например антраценом.
h) Снятие защиты с помощью ТВА+F- или HF.
Следует отметить, что хотя указанные промежуточные соединения могут иметь защищенные гидроксильные группы в виде трет-бутилдиметилсилиловых эфиров, объем настоящего изобретения не исключает использование альтернативных защитных групп для гидроксила, хорошо известных из уровня техники (таких, как описаны в T.W.Greene and P.G.M.Wuts, "Protective groups in organic synthesis", 3rd ed., Wiley, New York, 1999), вместе с альтернативными реакциями по снятию защиты.
Описание чертежей
Фиг.1 является графической иллюстрацией влияния на массу поясничного отдела позвоночника, L4, крыс в соответствии с описанной моделью на OVX крысах, где группы животных проходят обработку по приведенной ниже схеме. Под графической иллюстрацией приведен статистический анализ. Различия между группами исследованы с помощью теста Kruskal-Wallis'а, включающего методику множественного сравнения: ns-нз означает незначительный, nt - ни означает не исследовано и * означает р<0,05. Различия считаются значительными при р<0,05. Результаты представлены столбчатой диаграммой в виде средних значений + SD.
Животных делят на 6 групп:
Группа 1: интактный контроль, введен пропиленгликоль, 0,1 мл/кг (растворитель)
Группа 2: контроль-OVX крысы, введен пропиленгликоль, 0,1 мл/кг (растворитель)
Группа 3: OVX крысы, введен 1α, 25 (ОН)2D3, 0,25 мкг/кг
Группа 4: OVX крысы, введено соединение 145, 10 мкг/кг
Группа 5: OVX крысы, введено соединение 145, 50 мкг/кг
Группа 6: OVX крысы, введено соединение 145, 100 мкг/кг
Фиг.2 является графической иллюстрацией биомеханического исследования поясничного отдела позвоночника, L3.
Цилиндр тела позвонка исследуют по проксимальной-дистальной осям на аппарате для тестирования материала (Alwetron TCT 5, Lorentzen and Wettre, Stockholm, Sweden) при постоянной скорости деформации 2 мм/мин. Во время сжатия кривые зависимости нагрузка-деформация записываются и накапливаются на PC (ProLinea 4/33, Compaq, USA). Fmax является максимальной точкой на кривой зависимости деформаций от нагрузок.
Крыс обрабатывают согласно описанной ниже модели OVX крыс, где группы животных проходят обработку по той же схеме, что для Фиг.1. Статистический анализ приведен в графической иллюстрации, сравните описание для Фиг.1.
Фармакологические способы - модель остеопороза на OVX крысах
Для изучения костных анаболических характеристик и действий аналогов витамина D по настоящему изобретению при профилактике или лечении деминерализации скелета in vivo, используют модель на 4-недельных OVX крысах.
Модель на крысах, подвергнутых овариэктомии (OVX модель), которым перорально в течение 28 дней вводят лекарственное средство, используют для проверки аналогов витамина D. В этих моделях овариэктомия вызывает изменения в сетчатой структуре, идентичные наблюдаемым в скелете человека возрастным изменениям и в период менопаузы. Кроме того, модель и последующие анализы выполняют в простых стандартных условиях. 1α,25(ОН)2D3 используют в качестве стандартного соединения.
Животные и пищевой режим:
Самок Sprague Dawley крыс, весящих приблизительно 130 г (возраст 40-45 дней), приобретают у MB, Ejby, Denmark. Животных кормят промышленно выпускаемым кормом и обеспечивают свободный доступ к пище и питьевой воде. Животных делят на группы, подвергающиеся различной обработке.
Способ овариэктомии:
Животных анастезируют и осуществляют овариэктомию путем дорсального разреза.
Обработку OVX животных начинают через 2 недели после овариэктомии.
Животным вводят лекарство перорально в течение 28 дней. Оральная доза принудительно вводимого лекарства составляет 0,1 мл/100 г массы тела. Массу тела каждого животного регистрируют ежедневно перед пероральным введением лекарственного средства. На 1, 14, 21 и 28 день животных помещают раздельно на 24 часа в клетки для определения обмена веществ для сбора мочи. Мочу замораживают при -20°С для последующего измерения содержания кальция.
На 28 день животных анастезируют и отбирают 2 мл крови либо сердечной пункцией, либо из глазничной вены, после этого животных умерщвляют с помощью СО2. Затем отбирают фракцию сыворотки и замораживают при -20°С для последующего измерения содержания кальция, фосфора и креатинина.
Матку удаляют и взвешивают для подтверждения овариэктомии. Селезенку и вилочковую железу удаляют и взвешивают для оценки общего иммунологического статуса.
Левую и правую бедренную кость, левую и правую большеберцовую кость, поясничные позвонки 3 и 4 (L3 и L4) удаляют и очищают от всей мягкой и соединительной ткани. Левую бедренную кость, левую и правую большеберцовую кость и L4 сушат в печи при 50-60°С в течение, по меньшей мере, 24 часов и сразу же после этого взвешивают. Кости обжигают в печи при 800°С в течение 4 часов, растворяют в 1 н. НСl и анализируют на содержание кальция в Hitachi 911 автоанализаторе. Правую бедренную кость и L3 оставляют в 0,9% NaCl и замораживают при -20°С для последующего биомеханического анализа, проводимого Jesper Skovhus Thomson and Lis Mosekilde at Aarhus University, определяющего различные биомеханические параметры.
Действие соединения 145 в сравнении со стандартной дозой 1,25(OH)2D3 (1,25D3) (0,25 мкг/кг) и в сравнении с OVX контрольной группой (приведено в %) показано в таблицах 1-4.
Из таблиц 1-4 и Фиг.1 и Фиг.2 следует, что анаболические действия на кости соединения 145 сопоставимы или даже больше, чем 1,25D3, это наглядно показано повышенной массой костей (Фиг.1) и повышением биомеханической прочности костей (Фиг.2), тогда как отрицательное действие, эффект известкования, снижено, что демонстрирует действительное анаболическое действие соединения. Таким образом, рассматриваемые соединения особенно полезны при получении фармацевтических композиций для лечения указанных здесь определенных заболеваний у человека и животных.
Фармацевтические составы
Хотя возможно введение только активного ингредиента (т.е. в виде чистого химического соединения), предпочтительно его присутствие в виде фармацевтического состава. Обычно активный ингредиент составляет от 0,1 ч/млн до 1 мас. % от массы состава.
Составы, как для применения в ветеринарии, так и для лечения человека, по настоящему изобретению включают, таким образом, активный ингредиент в сочетании с фармацевтически приемлемым носителем и, необязательно, другим терапевтическим ингредиентом (ингредиентами). Носитель (носители) должен быть "приемлемым", в том смысле, что быть совместимым с другими ингредиентами или составами и не являются вредными для пациента.
Составы включают, например, составы в форме, пригодной для перорального, глазного, ректального, парентерального (включая подкожное, внутримышечное и внутривенное), трансдермального, внутрисуставного и местного, назального или буккального введения.
Под термином "стандартная дозированная единица" подразумевается единичная, т.е. разовая доза, которая может быть введена пациенту и которая удобна в обращении и ее легко упаковать, сохраняющая физическую и химическую стабильность стандартная доза включает либо активный материал как таковой, либо в смеси с твердыми или жидкими фармацевтическими разбавителями или носителями.
Составы могут обычно быть представлены в стандартной лекарственной форме и могут быть получены любым из способов, хорошо известных в области фармации, ср. Remington: The Science and Practice of Pharmacy, 19th Ed. 1995. Все способы включают стадию объединения активного ингредиента с носителем, представляющим собой один или более дополнительных ингредиентов. Обычно составы получают путем равномерного и однородного объединения, активного ингредиента с жидким носителем или тонко измельченным твердым носителем, либо с обоими, и затем, при необходимости, превращения продукта в требуемый состав.
Составы по настоящему изобретению, подходящие для перорального введения, могут быть в форме дискретных единиц, таких как капсулы, саше, таблетки или лепешки, каждая из которых содержит заданное количество активного ингредиента; в форме раствора или суспензии в водной жидкости или неводной жидкости; или в форме эмульсии масло-в-воде или эмульсии вода-в-масле. Предпочтительно растворять или суспендировать активное соединение в неводной жидкости, такой как растительное масло, чтобы инкапсулировать в желатиновую капсулу. Активный ингредиент может также быть введен в форме болюса, электуария или пасты.
Составы для ректального введения могут быть в форме суппозитория, включающего активный ингредиент и носитель, или в форме клизмы.
Составы, подходящие для парентерального введения, обычно включают стерильный масляный или водный препарат активного ингредиента, который предпочтительно является изотоническим в отношении крови реципиента. Трансдермальные составы могут быть в форме пластыря.
Составы, подходящие для внутрисуставного или глазного введения, могут быть в форме стерильного водного препарата активного ингредиента, который может быть в микрокристаллической форме, например, в форме водной микрокристаллической суспензии. Липосомные составы или биоразлагаемые полимерные системы также могут быть использованы для представления активного ингредиента в форме, подходящей как для внутрисуставного, так и глазного применения.
Составы, подходящие для местного или глазного введения, включают жидкие или полужидкие препараты, такие как линименты, лосьоны, гели, аппликаторы, эмульсии типа масло-в-воде или вода-в-масле, такие как кремы, мази или пасты; или растворы, либо суспензии, такие как капли.
Составы в виде таблеток или капсул обычно предпочтительны для системного введения активного ингредиента. Состав в форме таблеток может быть получен прессованием или формованием активного ингредиента, необязательно, с одним или более дополнительными ингредиентами. Прессованные таблетки могут быть получены прессованием, в подходящей машине, активного ингредиента в сыпучей форме, такой как порошок или гранулы, необязательно, смешанного со связующим веществом, смазкой, инертным разбавителем, поверхностно-активным веществом или диспергирующим агентом. Формованные таблетки получают формованием, в подходящей машине, смеси порошкообразного активного ингредиента и подходящего носителя, смоченного инертным жидким разбавителем.
Для назального введения или применения путем ингаляции порошкообразных, самодвижущихся или распыляемых составов, приготовляемых и отпускаемых в виде спрея, можно использовать распылитель или пульверизатор. Приготовленные составы обычно имеют размер частиц в пределах от 10 мк до 100 мк. Указанные составы наиболее желательны в форме тонко измельченного порошка для легочного введения из порошкового ингалятора или подаваемых в виде самодвижущегося порошка составов. В случае самотекущего раствора и распыляемых составов эффект может быть достигнут либо за счет подбора клапана, имеющего требуемые характеристики разбрызгивания (т.е. способного давать спрей с требуемым размером частиц), либо за счет включения активного ингредиента, такого как суспендированный порошок, с регулируемым размером частиц. Указанные самодвижущиеся составы могут быть подающими порошок составами либо составами, подающими активный ингредиент в виде капель раствора или суспензии.
Подаваемые в виде самодвижущегося порошка составы предпочтительно включают диспергированные частицы твердых активных ингредиентов и жидкий пропеллент с температурой кипения ниже 18°С при атмосферном давлении. Жидким пропеллентом может быть любой пропеллент, известный как подходящий для медицинского применения, и может включать один или более приемлемых для применения в медицине инертных газов или их смесей. Обычно на пропеллент приходится 45-99,9% мас./мас. от состава, тогда как на ингредиент приходится 1 ч/млн - 1% мас./мас. от состава.
В дополнение к вышеуказанным ингредиентам составы по изобретению могут включать один или более вспомогательных ингредиентов, таких как разбавители, буферные растворы, корригенты, связующие вещества, поверхностно-активные вещества, загустители, смазывающие вещества, консерванты, например, метилгидроксибензоат (включая антиоксиданты), эмульгирующие агенты и тому подобные.
Как указано выше, соединения формулы I или Iа могут быть использованы для лечения или профилактики остеопороза или связанных заболеваний костей. Следовательно, изобретение также касается способа лечения остеопороза и связанных состояний, включающего введение нуждающемуся в этом пациенту эффективного количества соединения формулы I или Iа.
Кроме того, изобретение касается использования соединений формулы Iа в фармацевтических композициях для местного или системного лечения или профилактики заболеваний человека или животного, поддающихся лечению витамином D или аналогами витамина D, таких как, например, псориаз и другие нарушения кератинизации, HIV-обусловленный дерматоз, заживление ран, различные формы раковых опухолей, такие как лейкоз, рак молочной железы, глиальные опухоли головного мозга, остеогенная саркома, миелофиброз, меланома, другие карциномы кожи, и заболеваний или нарушений иммунной системы, таких как реакция "хозяин против трансплантата" и "трансплантат против хозяина", и отторжение трансплантата, и аутоиммунные заболевания, такие как дискоидная красная волчанка и системная красная волчанка, сахарный диабет и хронический дерматоз аутоиммунного типа, например, склеродермия и обыкновенная пузырчатка, и воспалительных заболеваний, таких как астма и ревматоидный артрит, также как ряда других болезненных состояний, включающих гиперпаратиреоз, в особенности вторичный гиперпаратиреоз, связанный с почечной недостаточностью, снижение умственной деятельности или старческое слабоумие (болезнь Альцгеймера) и другие нейродегенеративные заболевания, гипертензию, акне, алопецию, атрофию кожи, например, стероидиндуцируемую атрофию кожи, старение кожи, включая фотостарение, и их использования для активирования остеогенеза и лечения/профилактики остеопороза и связанных заболеваний костей и остеомаляции. Кроме того, костная анаболическая активность новых соединений по изобретению сопровождается также действием по укреплению скелетных мышц.
Требуемое количество соединения формулы I или Iа для терапевтического действия изменяется, конечно, в зависимости от конкретного соединения, способа введения и нуждающегося в лечении млекопитающего. Соединения по изобретению могут быть введены парентеральным, внутрисуставным, кишечным или местным способами. Они хорошо поглощаются при введении через кишечник, и это предпочтительный способ введения при лечении системных нарушений. При лечении дерматологических нарушений, таких как псориаз или глазные болезни, предпочтительны местная или кишечная формы.
Данные соединения могут быть использованы в комбинации с другими фармацевтическими средствами или терапевтическими воздействиями. При лечении остеопороза указанные соединения удобно объединять с другими терапевтическими средствами для лечения или профилактики остеопороза, включающими эстрогены, SERMs (селективные эстрогенрецепторные модуляторы) или бисфосфонаты. При лечении псориаза настоящие соединения могут быть использованы в сочетании с другими антипсориатическими лекарственными средствами, например, стероидами или другими методами лечения, например, фототерапия или УФ-фототерапия, или комбинированная PUVA-терапия. При лечении рака настоящие соединения могут быть использованы в комбинации с другими противораковыми средствами или противораковыми терапевтическими способами, такими как лучевая терапия. Для предупреждения прививочной реакции и реакции "трансплантат против хозяина", или при лечении аутоиммунных заболеваний, настоящие соединения удобно использовать в сочетании с другими иммуносупрессивными/иммунорегулирующими лекарственными средствами или способами лечения, например, с циклоспорином А.
Настоящее изобретение также касается способа лечения пациентов, страдающих одним или более патологическими нарушениями, указанный способ состоит во введении нуждающемуся в лечении пациенту эффективного количества одного или более соединений формулы I или Iа, отдельно или в сочетании с одним или более другими терапевтически активными соединениями, обычно применяемыми для лечения указанных патологических состояний. Лечение настоящими соединениями и/или дополнительными терапевтически активными соединениями можно проводить одновременно или с перерывами. Предпочтительными патологическими состояниями, излечиваемыми настоящими соединениями, являются индуцируемый стероидами, возрастной и постклимактерический остеопорозы.
Для системного лечения вводят суточные дозы 0,001-100 мкг на кг массы тела, предпочтительно 0,01-50 мкг/кг массы тела млекопитающего, например, 0,05-30 мкг/кг соединения формулы I или Iа, обычно соответствующая суточная доза для взрослого человека приблизительно от 0,5 мкг до 6 мг. При местном лечении дерматологических нарушений назначают мази, кремы или лосьоны, содержащие 0,1-500 мкг/г и, предпочтительно 0,1-100 мкг/г соединения формулы I или Iа. Для местного применения в офтальмологии назначают глазные мази, капли или гели, содержащие 0,1-500 мкг/г и, предпочтительно 0,1-100 мкг/г соединения формулы I или Iа. Пероральные композиции составляют обычно в виде таблеток, капсул или капель, содержащих 0,05-50 мкг, предпочтительно 0,1-25 мкг соединения формулы I или Iа на стандартную дозу.
Изобретение также раскрыто в следующих способах получения и примерах, которые не рассматриваются как ограничивающие рамки объема изобретения и приложенных пунктов.
СПОСОБЫ ПОЛУЧЕНИЯ И ПРИМЕРЫ
Общая часть
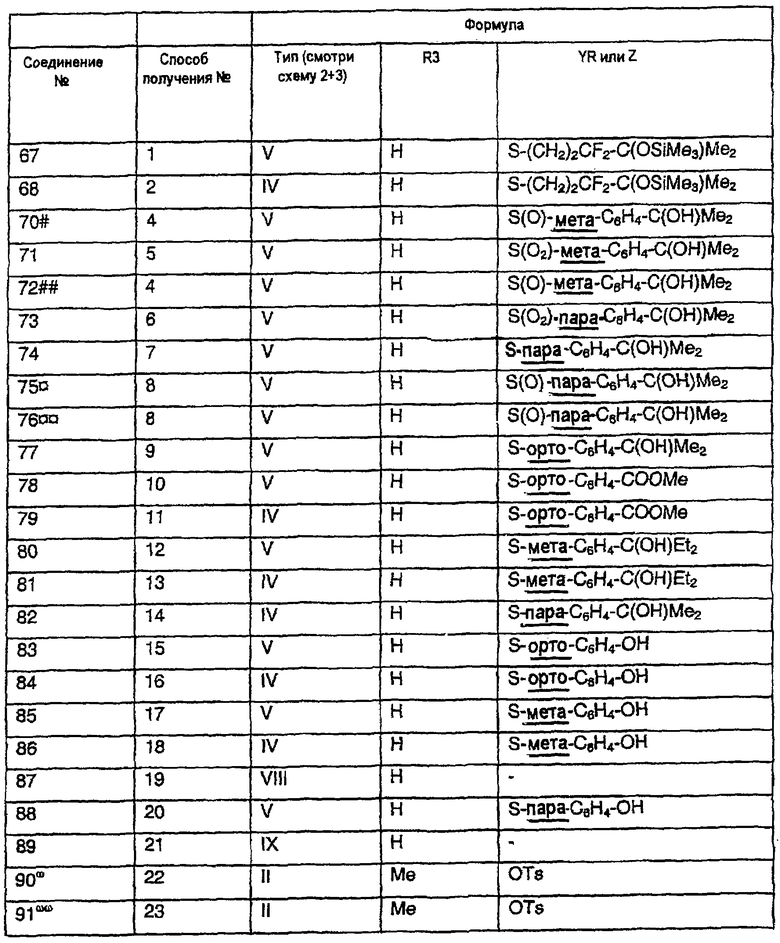
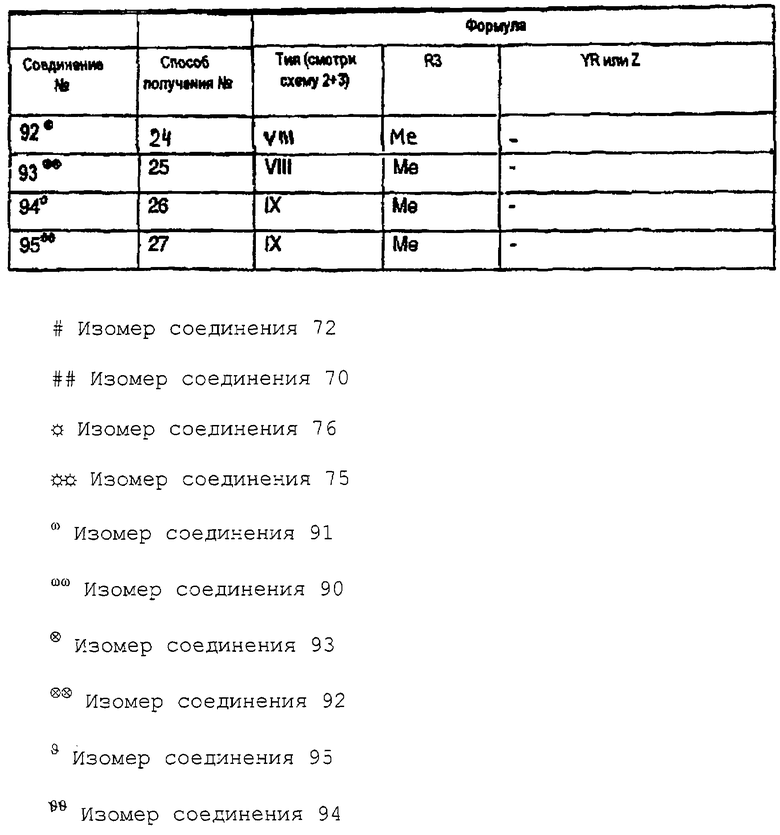
Характерные примеры соединений Iа перечислены в таблице 5. Промежуточные соединения для схем 1, 2 и 3, упоминаемые в способах получения, обозначены номерами в соответствии с формулами таблицы 6. Они используются для иллюстрации типичных синтезов характерных примеров соединений Ia.
Для спектра 1H-ядерного магнитного резонанса (300 МГц) значения химических сдвигов (δ) приведены в м.д. для растворов в дейтерированном хлороформе (за исключением особо оговоренных случаев) относительно внутреннего стандарта - тетраметилсилана (δ=0) или хлороформа (δ=7,25). Значение для мультиплета, или точно установленного (дублет (д), триплет (т), квартет (кв)) или нет (м), даны приблизительно в средней точке, за исключением, когда указан интервал (с = синглет, уш = уширенный). Константы взаимодействия (J) приведены в Герцах и иногда округлены до ближайшей единицы. Для спектра 13С-ядерного магнитного резонанса (75,5 МГц) значения химических сдвигов (δ) приведены в м.д. для растворов в дейтерированном хлороформе (за исключением особо оговоренных случаев) относительно внутреннего стандартата - тетраметилсилана (δ=0) или хлороформа (δ=76,81).
Эфир означает диэтиловый эфир и высушенный над натрием. ТГФ сушат над натрийбензофеноном. Петролейный эфир относится к фракции пентана. Если не оговорено, % означает об/об%. Взаимодействия проводят при комнатной температуре, если не оговорено особо. Процедура обработки включает разбавление указанным растворителем (иным, чем органический реакционный растворитель), экстракцию водой и затем насыщенным раствором соли, сушку над безводным МgSO4 и концентрацию в вакууме до получения остатка. Хроматографию выполняют на силикагеле.
Таблица 5: Примеры соединений формулы Ia, где n=0 (соединение 147, 148, 149) или n=1. (Соединения 101-154 формулы I, перечисленные в соответствующей таблице 1, описаны в №091/15475, включенном в описание в качестве ссылки). Подробности приведены для соединений, где указан пример №; другие соединения могут быть получены из известных исходных материалов с применением аналогичных реакционных последовательностей.

Таблица 6: Промежуточные соединения, используемые в синтезе соединений формулы I или Iа (Соединения 2-66 перечислены в соответствующей таблице 2, приведенной в WO91/15475 и получены по способам получения 1-64 и общим методикам 1-7, описанным в WO 91/15475, приведенном в качестве ссылки).
Способы получения
Способ получения 1: соединение 67
Способ: общая методика 3.
Соединение IV: соединение 68.
Элюент для хроматографии: 0-4% этилацетат в петролейном эфире.
13С-ЯМР: δ 148,1, 140,4, 135,0, 123,9, 122,9, 117,9, 111,0, 75,6, 71,9, 67,3, 55,9, 55,6, 45,8, 45,5, 44,6, 40,4, 39,2, 35,6, 31,8, 28,6, 26,9, 25,8, 25,7, 25,7, 25,6, 24,1.
Способ получения 2: соединение 68
Способ: общая методика 2, при замене ДМФ на ТГФ/гексаметилфосфорный триамид 20:1 (об/об).
Соединение II: соединение 5.
R-YH: соединение 69.
13С-ЯМР: δ 153,4, 142,7, 135,4, 123,9, 121,5, 116,4, 106,5, 75,6, 70,0, 67,0, 56,1, 55,6, 45,6, 43,8, 40,3, 39,2, 36,4, 35,6, 31,8, 28,7, 26,9, 25,6, 24,8, 24,1, 23,3, 21,9, 18,6, 18,1, 17,9, 12,3, 2,1, -4,9, -5,1, -5,1.
Способ получения 3: соединение 69 3,3-дифтор-4-метил-4-(триметилсилилокси)пентантиол
Способ: Метилмагнийбромид (3 М, 2 эквив.) в эфире добавляют к 4-бром-2,2-дифторбутаноату (D. Morel and F. Dawans, Tetrahedron, 33, 1445-7, (1977)) в эфире. Обработка дает 5-бром-3,3-дифтор-2-метилпропан-2-ол. 13С-ЯМР: δ 123,9, 72,8, 35,2, 23,4, 23,1. Обработка указанного соединения (2,0 г), триэтиламина (1,70 мл) и 4-(диметиламино)пиридина (59 мг) в дихлорметане (25 мл) триметилсилилхлоридом (1,52 мл) при комнатной температуре в течение ночи, дает, после обработки дихлорметаном и хроматографии (1-3% этилацетата в петролейном эфире, в качестве элюента), 1-бром-3,3-дифтор-4-метил-4-(триметилсилилокси)пентан. 13С-ЯМР: δ 123,6, 75,5, 35,2, 24,2, 23,9, 2,1. Полученное соединение (1,62 г) подвергают взаимодействию с О-этилксантогенатом калия (1,80 г) в ацетоне (15 мл) при комнатной температуре в течение ночи и обрабатывают хлороформом/насыщенным водным хлоридом аммония, получая S-(3,3-дифтор-4-метил-4-(триметилсилилокси)пентил)-O-этилксантогенат.
13С-ЯМР: δ 214,0, 123,7, 75,6, 69,7, 30,5, 28,2, 24,0, 13,5, 2,1. Образовавшееся соединение (0,6 г) подвергают взаимодействию с этаноламином (0,22 мл) в ДМФ (5 мл) в течение 30 мин при комнатной температуре и обрабатывают водой/эфиром. Хроматография (эфир/петролейный эфир 1:100, в качестве элюента) дает соединение 69. 13С-ЯМР: δ 123,9, 75,5, 35,8, 24,0, 17,0, 2,1.
Способ получения 4: соединения 70 и 72
Соединения получают, применяя способ получения 41 по WО 91/15475, за тем исключением, что используют в качестве исходного материала соединение 57 вместо соединения 15. Соединение 70, наименьший Rf, 13С-ЯМР: δ 150,8, 148,1, 144,1, 139,8, 135,3, 128,8, 127,4, 122,9, 122,7, 120,1, 118,0, 110,9, 72,3, 71,8, 67,3, 65,3, 55,7, 45,8, 45,3, 44,6, 40,3, 31,7, 31,6, 31,3, 28,5, 26,1, 25,6, 25,6, 23,1, 21,5, 19,5, 18,0, 17,9, 12,0, -4,9, -5,0, -5,3.
Соединение 72, наибольший Rf, 13С-ЯМР: δ 150,6, 148,1, 144,7, 139,8, 135,3, 129,0, 126,9, 122,7, 122,0, 119,8, 118,1, 111,0, 72,3, 71,9, 67,3, 65,6, 56,2, 55,9, 45,9, 45,5, 44,6, 40,6, 31,7, 31,6, 31,0, 28,5, 26,9, 25,7, 25,6, 23,1, 21,6, 18,7, 18,0, 17,9, 12,3, -4,9, -5,0, -5,3.
Способ получения 5: соединение 71
Соединение получают, применяя способ получения 42 по WO91/15475, за тем исключением, что используют в качестве исходного материала соединение 57 вместо соединения 43 и/или 44.
13С-ЯМР: δ 150,8, 148,1, 139,9, 139,6, 135,4, 129,6, 129,0, 126,1, 123,7, 122,7, 118,1, 111,0, 72,2, 71,8, 67,3, 61,6, 55,8, 55,6, 45,8, 45,3, 44,6, 40,4, 31,7, 30,5, 29,5, 28,4, 26,3, 25,6, 25,6, 23,1, 21,3, 19,4, 18,0, 17,9, 12,1, -4,9, -5,0, -5,3.
Способ получения 6: соединение 73
Соединение получают, применяя способ получения 42 по WO 91/15475, за тем исключением, что используют в качестве исходного материала соединение 74 вместо соединения 43 и/или 44. 13С-ЯМР: δ 155,0, 148,1, 139,6, 138,3, 135,4, 127,7, 125,2, 122,7, 118,1, 111,0, 72,3, 71,8, 67,3, 61,7, 55,9, 55,7, 45,8, 45,3, 44,6, 40,4, 31,6, 30,4, 28,5, 26,3, 25,6, 25,6, 23,1, 21,3, 19,4, 18,0, 17,9, 12,0, -4,9, -5,0, -5,3.
Способ получения 7: соединение 74
Способ: общая методика 3.
Исходный материал: соединение 82.
Элюент для хроматографии: 0-50% эфир в петролейном эфире.
13С-ЯМР: δ 148,1, 146,5, 140,3, 135,7, 135,1, 128,8, 124,8, 122,9, 117,9, 111,0, 72,1, 71,8, 67,3, 55,9, 55,6, 45,8, 45,5, 44,6, 40,8, 40,3, 35,2, 31,5, 28,6, 26,8, 25,7,25,6, 23,3, 21,7, 18,7, 18,0, 17,9, 12,2, -4,9, -5,0, -5,3.
Способ получения 8: соединение 75 и 76
Соединения получают, применяя способ получения 41 по WO91/15475, за тем исключением, что используют в качестве исходного материала соединение 74 вместо соединения 15.
Соединение 75, наибольший Rf, 13С-ЯМР: δ 152,1, 148,1, 142,7, 139,8, 135,3, 125,3, 123,7, 122,7, 118,1, 111,0, 72,1, 71,9, 67,3, 65,6, 56,2, 55,9, 45,9, 45,5, 44,6, 40,6, 31,6, 31,0, 28,5, 27,0, 25,6, 25,6, 23,1, 21,6, 18,7, 18,0, 17,9, 12,3, -4,9, -5,0, -5,3. Соединение 76, наибольший Rf, 13С-ЯМР: δ 152,8, 148,1, 142,2, 139,8, 135,2, 125,2, 124,3, 122,7, 118,0, 110,9, 72,2, 71,8, 67,3, 65,3, 55,7, 55,7, 45,8, 45,3, 44,6, 40,3, 31,6, 31,2, 28,5, 26,0, 25,6, 25,6, 23,1, 21,5, 19,5, 18,0, 17,9, 12,0, -4,9, -5,0, -5,3.
Способ получения 9: соединение 77
Способ: общая методика 7.
Исходный материал: соединение 78.
13С-ЯМР: δ 7,42 (м, 2Н), 7,17 (м, 2Н), 6,22 (д, 1Н), 6,00 (д, 1Н), 5,17 (д, 1Н), 4,89 (с, 1Н), 4,85 (д, 1Н), 4,36 (м, 1Н), 4,18 (м, 1Н), 3,25 (дд, 1Н), 2,88 (дд, 1Н), 2,83 (дд, 1Н), 2,43 (дд, 1Н), 2,20 (дд, 1Н), 1,99 (т, 1Н), 1,68 (с, 6Н), 1,90-1,20 (м, 13Н), 1,08 (д, ЗН), 0,86 (с, 18Н), 0,51 (с, 3Н), 0,05 (с, 12Н).
Способ получения 10: соединение 78
Способ: общая методика 3.
Исходный материал: соединение 79.
Элюент для хроматографии: 0-20% эфир в петролейном эфире.
1H-ЯМР: δ 7,92 (д, 1Н), 7,41 (т, 1Н), 7,28(д, 1Н), 7,10 (т, 1Н), 6,22 (д, 1Н), 6,02 (д, 1Н), 5,17 (д, 1Н), 4,85 (д, 1Н), 4,35 (м, 1Н), 4,17 (м, 1Н), 3,81 (с, 3Н), 3,19 (дд, 1Н), 2,82 (дд, 1Н), 2,72 (дд, 1Н), 2,43 (дд, 1Н), 2,20 (дд, 1Н), 1,98 (т, 1Н), 1,95-1,30 (м, 13Н), 1,08 (д, 1Н), 0,90 (с, 18Н), 0,56 (с, 3Н), 0,05 (с, 12Н).
Способ получения 11: соединение 79
Способ: общая методика 2.
Соединение II: соединение 5.
R-YH: Метил-2-меркаптобензоат.
1H-ЯМР: δ 7,93 (д, 1H), 7,41 (т, 1Н), 7,28 (д, 1Н), 7,13 (т, 1H), 6,44 (д, 1H), 5,82 (д, 1H), 4,97 (д,1Н), 4,93 (д, 1H), 4,51 (дд, 1H), 4,21 (м, 1H), 3,91 (с, 1H), 3,19 (дд, 1H), 2,87 (д, 1H), 2,73 (дд, 1H), 2,55 (дд, 1H), 2,31 (д, 1H), 2,07 (т, 1H), 1,95-1,35 (м, 15Н), 1,09 (д, 1H), 0,89 (с, 9Н), 0,85 (с, 9Н), 0,57 (с, 3Н), 0,05 (с, 12Н).
Способ получения 12: соединение 80
Способ: общая методика 3.
Исходный материал: соединение 81.
Элюент для хроматографии: 0-20% эфир в петролейном эфире.
13С-ЯМР: δ 148,1, 146,3, 140,3, 137,0, 135,0, 128,2, 127,1, 126,5, 123,0, 122,9, 117,9, 111,0, 71,9, 67,3, 55,9, 55,6, 45,8, 45,5, 44,6, 40,9, 40,3, 35,3, 34,8, 28,6, 26,8, 25,7, 25,6, 23,2, 21,7, 18,6, 18,0, 18,0, 12,3, 7,6, -4,9, -5,0, -5,3.
Способ получения 13: соединение 81
Способ: общая методика 2.
Соединение II: соединение 5.
R-YH: 3-(3-меркаптофенил)пентан-3-ол (ср. G.Grue-Sorensen, E.Binderup and L.Binderup, в "Vitamin D, a pluripotent steroid hormone: Structural studies, molecular endocrinology and clinical applications", Eds. A.W.Norman, R.Bouillon and M.Thomaset, Walter de Gruyter, New York, 1994, p.75-76).
13С-ЯМР: δ 153,4, 146,3, 142,7, 137,0, 135,4, 128,2, 127,1, 126,5, 123,0, 121,5, 116,4, 106,5, 70,0, 67,0, 56,0, 55,6, 45,6, 43,8, 40,9, 40,2, 36,4, 35,3, 34,8, 28,7, 26,7, 25,7, 25,6, 23,3, 22,1, 21,8, 18,6, 18,1, 17,9, 12,3, 7,6, -5,0, -5,1, -5,1.
Способ получения 14: соединение 82
Способ: общая методика 2.
Соединение II: соединение 5.
R-YH: 2-(4-меркаптофенил)пропан-2-ол (ср. G.Grue-Sorensen, E.Binderup and L. Binderup, в "Vitamin D, a pluripotent steroid hormone: Structural studies, molecular endocrinology and clinical applications", Eds. A.W.Norman, R.Bouillon and M.Thomaset, Walter de Gruyter, New York, 1994, p.75-76).
13С-ЯМР: δ 153,4, 146,5, 142,6, 135,7, 135,4, 128,8, 124,8, 121,4, 116,4, 106,5, 72,1, 70,1, 67,0, 56,0, 55,6, 45,6, 43,7, 40,8, 40,2, 36,4, 35,2, 31,5, 28,7, 26,8, 25,7, 25,6, 23,3, 21,8, 18,7, 18,0, 17,9, 12,3, -5,0, -5,1, -5,1.
Способ получения 15: соединение 83
Способ: общая методика 3.
Исходный материал: соединение 84.
Элюент для хроматографии: 0-20% эфир в петролейном эфире.
1H-ЯМР: δ 7,44 (д, 1Н), 7,22 (т, 1Н), 6,96 (д, 1Н), 6,87 (т, 1Н), 6,72 (с, 1Н), 6,19 (д, 1Н), 5,98 (д, 1Н), 5,15 (д, 1Н), 4,83 (Д, 1Н), 4,35 (т, 1Н), 4,15 (м, 1Н), 2,98 (дд, 1Н), 2,79 (дд, 1Н), 2,56 (дд, 1Н), 2,41 (дд, 1Н), 2,18 (дд, 1Н), 2,03 (т, 1Н), 1,95-1,3 (м, 13Н), 1,05 (д, 3Н), 0,88 (с, 18), 0,34 (с, ЗН), 0,03 (м, 12Н).
Способ получения 16: соединение 84
Способ: общая методика 2. Реакционные условия изменены от 30 мин при комнатной температуре до 10 мин и 60°С.
Соединение II: соединение 5.
R-YH: 2-меркаптофенол (используют 10-кратный молярный избыток относительно соединения 5).
1H-ЯМР: δ 7,45 (д, 1Н), 7,22 (т, 1Н), 6,96 (д, 1Н), 6,65 (т, 1Н), 6,73 (с, 1Н), 6,42 (д, 1Н), 5,79 (д, 1Н), 4,97 (т, 1Н), 4,92 (т, 1Н), 4,51 (дд, 1Н), 4,20 (м, 1Н), 2,98 (дд, 1Н), 2,84 (дд, 1Н), 2,56 (дд, 1Н), 2,50 (д, 1Н), 2,29 (д, 1Н), 2,00 (т, 1Н), 1,95-1,3 (м, 13Н), 1,06 (д, 3Н), 0,89 (с, 9Н), 0,84 (с, 9Н), 0,35 (с, ЗН), 0,05 (м, 12Н).
Способ получения 17: соединение 85
Способ: общая методика 2.
Соединение II заменено соединением 87. Реакционные условия изменены от 30 мин при комнатной температуре до 10 мин и 60°С.
R-YH: 3-меркаптофенол (используют 10-кратный молярный избыток относительно соединения 87).
Элюент для хроматографии: 0-20% эфир в петролейном эфире.
13С-ЯМР: δ 155,6, 148,1, 140,3, 139,3, 135,0, 129,6, 122,9, 120,8, 117,9, 115,2, 112,4, 111,0, 71,8, 67,4, 55,9, 55,6, 45,8, 45,5, 44,6, 40,3, 35,2, 28,6, 26,8, 25,7, 25,6, 23,3, 21,8, 18,7, 18,0, 18,0, 12,3, -4,9, -5,0, -5,3.
Способ получения 18: соединение 86
Способ: общая методика 2. Реакционные условия изменены от 30 мин при комнатной температуре до 10 мин и 60°С.
Соединение II: соединение 5.
R-YH: 3-меркаптофенол (используют 10-кратный молярный избыток относительно соединения 5).
Способ получения 19: соединение 87
Способ: общая методика 3.
Исходный материал: соединение 5.
Элюент для хроматографии: 10% эфир в петролейном эфире.
13С-ЯМР: δ 148,1, 144,4, 139,9, 135,2, 133,1, 129,5, 127,7, 122,8, 118,0, 111,0, 74,1, 71,8, 67,3, 55,7, 52,2, 45,8, 45,1, 44,6, 39,6, 35,2, 28,5, 26,6, 25,6, 25,6, 23,1, 21,7, 21,4, 18,0, 17,9, 16,5, 12,1, -4,9, -5,0, -5,3.
Способ получения 20: соединение 88
Способ: общая методика 2. Реакционные условия изменены от 30 мин при комнатной температуре до 10 мин и 60°С.
Соединение формулы II заменено соединением 87.
R-YH: 4-меркаптофенол (используют 10-кратный молярный избыток относительно соединения 5).
13С-ЯМР: δ 154,4, 148,1, 140,4, 135,0, 132,9, 127,7, 122,9, 117,9, 115,8, 111,0, 71,8, 67,4, 55,9, 55,5, 45,8, 45,5, 44,6, 42,9, 40,3, 35,4, 28,6, 26,8, 25,7, 25,6, 23,3, 21,7, 18,6, 18,0, 18,0, 12,2, -4,9, -5,0, -5,3.
Способ получения 21: соединение 89
Способ: общая методика 4.
Исходный материал V заменяют соединением общей формулы VIII: соединение 87. Соединение 89 очищают перекристаллизацией из этилацетата.
Способ получения 22: соединение 90
Способ: применяют способ, используемый в способе получения 3 по WO 91/15475, но заменяя соединение 2 соединением 3.
Способ получения 23: соединение 91
Способ: применяют способ, используемый в способе получения 3 по WO 91/15475, но заменяя соединение 2 соединением 4.
Способ получения 24: соединение 92
Способ: общая методика 3.
Исходный материал: соединение 90.
Элюент для хроматографии: 10% эфир в петролейном эфире.
Способ получения 25: соединение 93
Способ: общая методика 3.
Исходный материал: соединение 91.
Элюент для хроматографии: 10% эфир в петролейном эфире.
Способ получения 26: соединение 94
Способ: общая методика 4.
Исходный материал V: соединение 92.
Способ получения 27: соединение 95
Способ: общая методика 4.
Исходный материал V: соединение 93.
ПРИМЕРЫ
Пример 1
1(S), 3(R)-дигидрокси-20(R)-(2-((1-гидрокси-1-метил) этил)фенилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен, соединение 142
Способ: общая методика 4.
Исходный материал V: соединение 77.
1H-ЯМР: δ 7,44 (м, 2Н), 7,19 (м, 2Н), 6,36 (д, 1Н), 6,02 (д, 1Н), 5,32 (д, 1Н), 4,99 (с, 1Н), 4,89 (с, 1Н), 4,42 (м, 1Н), 4,13 (м, 1Н), 3,25 (дд, 1Н), 2,88 (дд, 1Н), 2,82 (дд, 1H), 2,58 (дд, 1Н), 2,30 (дд, 1H), 2,05-1,25 (м, 16Н), 1,68 (с, 6Н), 1,08 (д, 3Н), 0,53 (с, 3Н).
Пример 2
1(S), 3(R)-дигидрокси-20(R)-(3-((1-гидрокси-1-этил) пропил)фенилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен, соединение 144
Способ: общая методика 4.
Исходный материал V: соединение 80.
1H-ЯМР: δ 147,7, 146,5, 142,7, 137,2, 133,1, 128,4, 127,3, 126,7, 124,9, 123,2,117,2, 111,8, 70,8, 66,9, 56,1, 55,8, 45,8, 45,3, 42,9, 41,2, 40,3, 35,5, 35,0, 29,0, 26,8, 23,5, 22,1, 18,8, 12,5, 7,8.
Пример 3
1(S), 3(R)-дигидрокси-20(R)-(4-((1-гидрокси-1-метил) этил)фенилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен, соединение 145
Способ: общая методика 4.
Исходный материал V: соединение 74.
13С-ЯМР: δ 147,7, 146,7, 142,6, 135,8, 133,2, 129,0, 125,0, 124,8, 117,3, 111,8, 72,3, 70,8, 66,8, 56,1, 55,8, 45,8, 45,2, 42,9, 41,0, 40,3, 35,4, 31,7, 29,0, 26,9, 23,5, 22,1, 18,9, 12,5.
Пример 4
1(S), 3(R)-Дигидрокси-20(R)-(2-гидрокси)фенилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен, соединение 147 Способ: общая методика 4. Исходный материал V: соединение 83.
1H-ЯМР: δ 7,45 (д, 1Н), 7,23 (т, 1Н), 6,97 (д, 1Н), 6,85 (т, 1Н), 6,74 (с, 1Н), 6,34 (д, 1Н), 5,98 (д, 1Н), 5,31 (д, 1Н), 4,97 (д, 1Н), 4,42 (м, 1Н), 4,21 (м, 1Н), 2,98 (дд, 1Н), 2,80 (дд, 1Н), 2,52 (м, 2Н), 2,29 (дд, 1Н), 2,0-1,20 (м, 16Н), 1,06 (д, 3Н), 0,35 (с, 3Н).
Пример 5
1(S), 3(R)-дигидрокси-20(R)-(3-гидрокси)фенилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен, соединение 148
Способ: общая методика 4.
Исходный материал V: соединение 85
13С-ЯМР: δ 155,8, 147,6, 142,7, 139,4, 133,1, 129,8, 125,0, 121,1, 117,2, 115,5, 112,7, 111,9, 70,9, 66,9, 56,1, 55,7, 45,8, 45,3, 42,9, 40,5, 40,3, 35,3, 29,0, 26,9, 23,6, 22,1, 18,9, 12,5.
Пример 6
1(S), 3(R)-дигидрокси-20(R)-(4-гидрокси)фенилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен, соединение 149
Способ: общая методика 4.
Исходный материал V: соединение 88.
13С-ЯМР: δ 154,8, 147,6, 142,8, 133,2, 133,0, 127,7, 125,0, 117,2, 116,0, 111,9, 70,9, 66,9, 56,2, 55,7, 45,8, 45,3, 43,1, 42,8, 40,4, 35,5, 29,0, 26,9, 23,6, 22,1, 18,7, 12,4.
Пример 7
1(S), 3(R)-дигидрокси-20(R)-(3,3-дифтор-4-гидрокси-4-метил-1-пентилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен, соединение 155
Способ: общая методика 5.
Исходный материал V: соединение 67.
13С-ЯМР: δ 147,6, 142,7, 133,2, 124,9, 124,4, 117,3, 111,8, 73,1, 70,8, 66,8, 56,1, 55,7, 45,8, 45,3, 42,9, 40,4, 39,4, 35,7, 32,2, 29,0, 26,9, 24,8, 23,5, 23,5, 22,1, 18,8, 12,5.
Пример 8
1(S), 3(R)-дигидрокси-20(R)-(3,3-дифтор-4-гидрокси-4-метил-1-пентилсульфинилметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен, соединение 156
Способ: По способу получения 41 в WO 91/15475
Исходный материал I: соединение 155.
13С-ЯМР: δ 147,7, 142,1, 133,5, 126,1, 124,7, 117,5, 111,8, 73,1, 70,8, 66,8, 60,5, 58,5, 56,3, 56,0, 45,8, 45,3, 42,9, 40,4, 31,9, 28,9, 26,2, 23,5, 23,4, 22,0, 19,4, 18,4, 12,8.
Пример 9
1(S), 3(R)-дигидрокси-20(R)-(3-((1-гидрокси-1-метил)этил)фенилсульфинилметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен, соединение 157 (изомер соединения 159)
Способ: общая методика 4.
Исходный материал V: соединение 70.
13С-ЯМР: δ 151,3, 147,7, 143,8, 141,9, 133,7, 129,0, 127,8, 124,5, 123,1, 120,4, 117,5, 111,7, 72,3, 70,7, 66,7, 65,3, 55,9, 55,8, 45,6, 45,2, 42,9, 40,4, 31,8, 31,8, 31,4, 28,9, 26,2, 23,4, 21,8, 19,7, 12,2.
Пример 10
1(S), 3(R)-дигидрокси-20(R)-(3-((1-гидрокси-1-метил) этил)фенилсульфонилметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен, соединение 158
Способ: общая методика 4.
Исходный материал V: соединение 71.
13С-ЯМР: δ 151,1, 147,6, 141,9, 140,1, 133,5, 129,8, 129,2, 126,3, 124,7, 123,9, 117,5, 111,8, 72,4, 70,8, 66,8, 61,8, 56,0, 55,9, 45,6, 45,2, 42,9, 40,5, 31,9, 30,6, 28,9, 26,4, 23,4, 21,7, 19,6, 12,4.
Пример 11
1(S), 3(R)-дигидрокси-20(R)-(3-((1-гидрокси-1-метил)этил)фенилсульфинилметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен, соединение 159 (изомер соединения 157)
Способ: общая методика 4.
Исходный материал V: соединение 72.
13С-ЯМР: δ 150,8, 147,7, 144,9, 142,1, 133,4, 129,2, 127,2, 124,7, 122,2, 120,0, 117,5, 111,8, 72,5, 70,8, 66,8, 65,8, 56,4, 56,1, 45,8, 45,3, 42,9, 40,6, 31,9, 31,8, 31,1, 28,9, 27,0, 23,4, 22,0, 18,9, 12,5.
Пример 12
1(S), 3(R)-дигидрокси-20(R)-(4-((1-гидрокси-1-метил) этил)фенилсульфонилметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен, соединение 160
Способ: общая методика 4.
Исходный материал V: соединение 73.
13С-ЯМР: δ 155,4, 147,6, 141,8, 138,3, 133,6, 127,9, 125,5, 124,6, 117,6, 111,8, 72,4, 70,7, 66,8, 61,9, 56,1, 55,9, 45,6,.45,2, 42,8, 40,4, 31,8, 31,7, 30,5, 28,9, 26,4, 23,4, 21,7, 19,6, 12,3.
Пример 13
1(S), 3(R)-дигидрокси-20(R)-(4-((1-гидрокси-1-метил)этил)фенилсульфинилметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен, соединение 161 (изомер соединения 162)
Способ: общая методика 4.
Исходный материал V: соединение 75.
13С-ЯМР: δ 152,4, 147,7, 142,9, 142,1, 133,5, 125,6, 124,7, 123,9, 117,5, 111,8, 72,4, 70,8, 66,8, 65,8, 56,4, 56,1, 45,8, 45,2, 42,9, 40,6, 31,8, 31,1, 28,9, 27,0, 23,4, 22,0, 18,9, 12,5.
Пример 14
1(S), 3(R)-дигидрокси-20(R)-(4-((1-гидрокси-1-метил)этил)фенилсульфинилметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен, соединение 162 (изомер соединения 161)
Способ: общая методика 4.
Исходный материал V: соединение 76.
13С-ЯМР: δ 153,3, 147,7, 141,8, 133,7, 125,5, 124,5, 117,5, 111,7, 72,2, 70,6, 66,7, 65,3, 55,9, 45,6, 45,2, 42,9, 40,3, 31,8, 31,4, 28,9, 26,1, 23,4, 21,8, 19,7, 12,2.
Пример 15
1(S), 3(R)-дигидрокси-20(R)-(4-(гидроксиметил) фенилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен, соединение 163
Способ: общая методика 2.
Соединение II заменяют соединением 89.
R-SH: 4-Меркаптобензиловый спирт.
Остаток после обработки очищают хроматографией (силикагель; этилацетат в качестве элюента), получая соединение 163.
Пример 16
1(S), 3(R)-дигидрокси-20(R)-(4-((1-гидрокси-1-этил)пропил))фенилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен, соединение 164
Способ: общая методика 2.
Соединение II заменяют соединением 89.
R-SH: 3-(4-Меркаптофенил)пентан-3-ол.
Остаток после обработки очищают хроматографией (силикагель; этилацетат в качестве элюента), получая соединение 164.
Пример 17
1(S), 3(R)-дигидрокси-20(R)-(4-((1-гидрокси-1-метил)этил))фенилтиометил)-22-метил-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен, соединение 165 (изомер соединения 166)
Способ: общая методика 2.
Соединение II заменяют соединением 94.
R-SH: 2-(4-Меркаптофенил)пропан-2-ол.
Остаток после обработки очищают хроматографией (силикагель; этилацетат в качестве элюента), получая соединение 165.
Пример 18
1(S), 3(R)-дигидрокси-20(R)-(4-((1-гидрокси-1-метил)этил))фенилтиометил)-22-метил-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен, соединение 166 (изомер соединения 165)
Способ: общая методика 2.
Соединение II заменяют соединением 95.
R-SH: 2-(4-Меркаптофенил)пропан-2-ол.
Остаток после обработки очищают хроматографией (силикагель; этилацетат в качестве элюента), получая соединение 166.
Пример 19
Капсулы, содержащие соединение 145
Соединение 145 растворяют в арахисовом масле до конечной концентрации 10 мкг/мл (масла).
10 массовых частей желатина, 5 массовых частей глицерина, 0,08 массовых частей сорбата калия и 14 массовых частей дистиллированной воды смешивают при нагревании и формируют мягкие желатиновые капсулы. Затем вносят по 100 мкл соединения 145 в масляном растворе, так что каждая капсула содержит 1 мкг соединения 145.
Пример 20
1) Капли, содержащие соединение 145 в форме масляного раствора
0,1 г соединения 145 и 0,5 г D,α-альфа-токоферола (в качестве антиоксиданта) растворяют в триглицеридах со средней длиной цепи (Medium Chain Triglycerides) (Ph.Eur) до получения 100 л (=94,5 кг). Препарат фильтруют и раствор переносят в коричневые флаконы, имеющие подходящую пробку с пипеткой или прокладку-капельницу, чтобы иметь возможность накапать 1 мл раствора, подразделяемый на 25 капель.
1 мл раствора содержит 1 микрограмм соединения 145 и 0,04 микрограмма соединения 145 на каплю. Флакон закрывают подходящей навинчивающейся крышкой, изготовленной из полипропилена.
2) Капли, содержащие соединение 145 в форме солюбилизированного водного раствора
A) 0,2 г соединения 145 и 2 г D,L-альфа-токоферола растворяют в контейнере из нержавеющей стали в 10,2 кг (14 л) этанола 99,9% и 2 кг Cremophor RH40(R) (полиоксил 40 гидрогенизированное касторовое масло).
B) 54 кг очищенной воды, 0,015 кг моногидрата лимонной кислоты, 0,950 кг цитрата натрия, 45 кг сорбитола и 0,150 кг метилпарабена растворяют при нагревании в отдельном контейнере.
После охлаждения ниже 25°С раствор В медленно выливают в раствор А, перемешивая смесь. Cremophor RH40 образует при этом мицеллярный раствор, в котором нерастворимые в воде соединение 145 и D,L-альфа-токоферол остаются в препарате в растворе. Наконец, к препарату добавляют очищенную воду, получая 113 кг (=100 л) препарата с рН в интервале (6,5-7,5). Препарат фильтруют и разливают в коричневые флаконы, снабженные подходящей пробкой с пипеткой или прокладкой-капельницей и навинчивающейся крышкой.
1 мл препарата содержит 2 микрограмма соединения 145, подразделенных, например, на 20 капель, каждая из которых соответствует 0,1 микрограмму соединения 145.
Пример 21
Жидкость для инъекции, содержащая соединение 145
Соединение 145 (активное вещество) 10 мкг
Дигидрат динатрийфосфата (буфер) 15,4 мг
Дигидрат первичного кислого фосфата натрия
(буфер) 2 мг
Хлорид натрия 0,8 мг
Аскорбат натрия (антиоксидант) 5 мг
Solutol® HS 15 от BASF (солюбилизатор) 5 мг
Вода для инъекции до 1 мл
Solutol® HS 15 растворяют в воде для инъекции, нагревая максимум до температуры 80°С. Создают защитный азотный слой.
Добавляют буферные вещества и хлорид натрия и затем раствор охлаждают максимум до 30°С. Затем добавляют аскорбат натрия и, наконец, в полученном растворе растворяют соединение 145.
Затем раствор стерильно фильтруют и автоклавируют в подходящем температурно-временном режиме.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНАЛОГИ ВИТАМИНА D, КОМПОЗИЦИИ, СОДЕРЖАЩИЕ УКАЗАННЫЕ АНАЛОГИ, И ИХ ПРИМЕНЕНИЕ | 2003 |
|
RU2320644C2 |
| Аналоги витамина D, фармацевтическая композиция, соединения | 2000 |
|
RU2223953C2 |
| НОВЫЕ АНАЛОГИ ВИТАМИНА D | 2001 |
|
RU2261244C2 |
| СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2000 |
|
RU2228928C2 |
| ПРОИЗВОДНЫЕ ВИТАМИНА D, СПОСОБЫ ЕГО ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1997 |
|
RU2175318C2 |
| СТЕРЕОСЕЛЕКТИВНЫЙ СИНТЕЗ АНАЛОГОВ ВИТАМИНА Д | 2005 |
|
RU2380359C2 |
| ПРОИЗВОДНЫЕ ВИТАМИНА-D, СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ТЕРАПЕВТИЧЕСКИЙ АГЕНТ, СПОСОБ ЛЕЧЕНИЯ | 2001 |
|
RU2230738C9 |
| АНАЛОГИ ВИТАМИНА D, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМОПЗИЦИЯ | 1997 |
|
RU2183622C2 |
| АНАЛОГ ВИТАМИНА Д | 1991 |
|
RU2037484C1 |
| АНАЛОГИ ВИТАМИНА D, СПОСОБЫ ЕГО ПОЛУЧЕНИЯ, ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1998 |
|
RU2196132C2 |

Изобретение относится к области медицины и касается применения соединения формулы 1 для лечения и/или профилактики остеопороза и родственных заболеваний костей. 7 з.п. ф-лы, 6 табл., 2 ил.


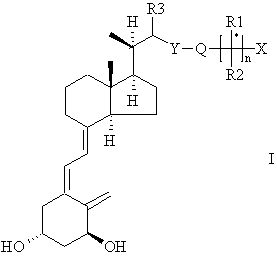
где Х означает водород или гидрокси;
Y означает кислород или серу, либо окисленную серу, выбранную из групп S(O) и S(O2);
R1 и R2, которые могут быть одинаковыми или различными, означают водород или остаток после удаления 1 атома водорода из линейного, разветвленного или циклического, насыщенного или ненасыщенного C1-С6-углеводорода; или R1 и R2 вместе с атомом углерода, к которому они присоединены (обозначен звездочкой в формуле I), несущим группу X, образуют C3-С8-углеродный цикл;
Q означает бирадикальный остаток после удаления 2 атомов водорода из линейного, разветвленного или циклического, насыщенного или ненасыщенного C1-С8-углеводорода;
R3 означает водород или остаток после удаления 1 атома водорода из линейного, разветвленного или циклического, насыщенного или ненасыщенного C1-С6-углеводорода;
R1, R2 и/или Q необязательно замещены одним или более атомами дейтерия или фтора;
n равен 0 или 1;
и производных соединений формулы I, в которых одна или более гидроксильных групп превращены в группы -O-ацил или -O-гликозил, или фосфатные эфиры, такие защитные группы гидролизуются in vivo; для получения лекарственного средства для лечения и/или профилактики остеопороза и связанных заболеваний костей.
1(S), 3(R)-дигидрокси-20(R)-(3-гидрокси-3-этил-1-пентилоксиметил-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 103),
1(S), 3(R)-дигидрокси-20(R)-(4-гидрокси-4-метил-1-пентилоксиметил)-9,10-секопрегна-(Z), 7(Е), 10(19)-триен (соединение 106),
1(S), 3(R)-дигидрокси-20(R)-(4-гидрокси-4-метил-1-пент-2(Е)-енилоксиметил-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 107),
1(S), 3(R)-дигидрокси-20(R)-(4-гидрокси-4-метил-1-пент-2-инилоксиметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 108),
1(S), 3(R)-дигидрокси-20(R)-(4-гидрокси-4-трифторметил-5,5,5-трифтор-1-пент-2-инилоксиметил)-9,10-секопрегна-5(Z), 7(E), 10(19)-триен (соединение 109),
1(S), 3(R)-дигидрокси-20(R)-[3-(2-гидрокси-2-пропил)феноксиметил]-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 111),
1(S), 3(R)-дигидрокси-20(R)-(2-гидрокси-2-метил-1-пропилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 116),
1(S), 3(R)-дигидрокси-20(R)-(3-гидрокси-3-метил-1-бутилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19) -триен (соединение 117),
1(S), 3(R)-дигидрокси-20(R)-(3-гидрокси-3-этил-1-пентилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 121),
1(S), 3(R)-дигидрокси-20(R)-(5-гидрокси-5-метил-1-гексилоксиметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 126),
1(S), 3(R)-дигидрокси-20(R)-[2-(2-гидрокси-2-пропил) феноксиметил]-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 127),
1(S), 3(R)-дигидрокси-20(R)-[2-(3-гидрокси-3-пентил)феноксиметил]-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 128),
1(S), 3(R)-дигидрокси-20(R)-[3-(3-гидрокси-3-пентил)феноксиметил]-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 129),
1(S), 3(R)-дигидрокси-20(R)-[4-(2-гидрокси-2-пропил)феноксиметил]-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 130),
1(S), 3(R)-дигидрокси-20(R)-[4-(3-гидрокси-3-пентил)феноксиметил]-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 131),
1(S), 3(R)-дигидрокси-20(R)-[3-(гидроксиметил)феноксиметил]-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 132),
1(S), 3(R)-дигидрокси-20(R)-(3-гидрокси-3-этил-1-пентилсульфинилметил-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 133),
1(S), 3(R)-дигидрокси-20(R)-(3-гипрокси-3-этил-1-пентилсульфинилметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 134),
1(S), 3(R)-дигидрокси-20(R)-(3-гидрокси-3-этил-1-пентилсульфонилметил)-9,10-секопрегна-5(Z), 7(Е), -10(19)-триен (соединение 135),
1(S), 3(R)-дигидрокси-20(R)-(4-гидрокси-4-метил-1-пентилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 136),
1(S), 3(R)-дигидрокси-20(R)-(3-(гидроксиметил)фенилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 137),
1(S), 3(R)-дигидрокси-20(R)-(3-((1-гидрокси-1-метил)этил)фенилтиометил)-9,10-секопрегна-5(Z), 7(Е), -10(19)-триен (соединение 138),
1(S), 3(R)-дигидрокси-20(R)-(4-гидрокси-4-этил-1-гекс-2-инилоксиметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 139),
1(S), 3(R)-дигидрокси-20(R)-(2-гидроксифеноксиметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 140),
1(S), 3(R)-дигидрокси-20(R)-(3-гидроксифеноксиметил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 141),
1(S), 3(R)-дигидрокси-20(R)-(2-((1-гидрокси-1-метил)этил)фенилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 142),
1(S), 3(R)-дигидрокси-20(R)-(3-((1-гидрокси-1-этил)пропил)фенилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 144),
1(S), 3(R)-дигидрокси-20(R)-(4-((1-гидрокси-1-метил)этил)фенилтиометил)-9,10-секопрегна-5(Z), 7(Е), 10(19)-триен (соединение 145),
1(S), 3(R)-дигидрокси-20(R)-(2-гидрокси)фенилтиометил)-9,10-секопрегна-5(Z),
7(E), 10(19)-триен (соединение 147),
1(S), 3(R)-дигидрокси-20(R)-(3,3-дифтор-4-гидрокси-4-метил-1-пентилоксиметил)-9,10-секопрегна-5(Z), -7(E), 10(19)-триен (соединение 153),
1(S), 3(R)-дигидрокси-20(R)-(4-(гидроксиметил)фенилтиометил)-9,10-секопрегна-5(Z), 7(E), 10(19)-триен (соединение 163),
1(S), 3(R)-дигидрокси-20(R)-(4-((1-гидрокси-1-этил)пропил))фенилтиометил)-9,10-секопрегна-5(Z), 7(E), 10(19)-триен (соединение 164),
1(S), 3(R)-дигидрокси-20(R)-(4-((1-гидрокси-1-метил)этил))фенилтиометил)-22(R)-метил-9,10-секопрегна-5(Z), 7(E), 10(19)-триен (соединение 165) и
1(S), 3(R)-дигидрокси-20(R)-(4-((1-гидрокси-1-метил)этил))фенилтиометил)-22(S)-метил-9,10-секопрегна-5(Z), 7(E), 10(19)-триен (соединение 166),
для получения лекарственного средства для лечения и/или профилактики остеопороза и родственных заболеваний костей.
| ЕР 0567353 А1, 27.10.1993 | |||
| WO 9115475 А1, 17.10.1991 | |||
| RU 95113157 А1, 20.11.1996 | |||
| RU 95113480 А1, 20.03.1997. |
Авторы
Даты
2005-06-10—Публикация
2001-01-31—Подача