Данное изобретение относится к новым аналогам витамина D, которые проявляют сильную активность в индуцировании дифференциации и ингибирования нежелательной пролиферации некоторых клеток, включая клетки кожи и раковые клетки, а также иммуномодулирующие эффекты, к фармацевтическим препаратам, содержащим указанные соединения, к дозированным формам таких препаратов и к их применению для лечения и профилактики болезней, характеризующихся аномальной дифференциацией клеток и/или пролиферацией клеток.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Было показано, что 1α,25-дигидрокси-витамин D3(1,25-(ОН)2D3) влияет на эффекты и/или продуцирование интерлейкинов (Muller,K. et al., Immunol. Lett., 17, 361-366 (1988)), что указывает на потенциальное применение этого соединения в лечении болезней, характеризующихся дисфункцией иммунной системы, например аутоиммунных заболеваний, СПИД, гомологичной болезни и реакций отторжения трансплантатов, или других состояний, характеризующихся аномальным продуцированием интерлейкина-1, например воспалительных заболеваний, таких как ревматоидный артрит и астма.
Было также показано, что 1,25-(ОН)2D3 способен стимулировать дифференциацию клеток и ингибировать избыточную пролиферацию клеток (Abe, E. et al., Proc. Natl. Acad. Sci., USA, 78, 4990-4994 (1981)), и было сделано предположение, что указанное соединение может быть полезным в лечении болезней, характеризующихся аномальной пролиферацией клеток и/или дифференциацией клеток, таких как лейкоз, миелофиброз и псориаз.
Кроме того, было предложено применение 1,25-(OH)2D3 или его пролекарства 1α-OH-D3 для лечения гипертензии (Lind, L. et al., Acta Med.Scand., 222, 423-427 (1987)) и сахарного диабета (Inomata, S. et al., Bone Mineral., 1, 187-192 (1986)). Другое показание для 1,25-(ОН)2D3 подсказано последним наблюдением связи между наследственной резистентностью к витамину D и алопецией: лечение 1,25-(ОН)2D3 может промотировать рост волос (Editorial, Lancet, 4 марта, стр.478 (1989)). Кроме того, тот факт, что местное применение 1,25-(ОН)2D3 уменьшает размер сальных желез в ушах самца сирийского хомячка, наводит на мысль, что это соединение могло бы быть полезным для лечения акне (Malloy V.L. et al., The Tricontinental Meeting for Ivestigative Dermatology, Washington, (1989)).
Однако терапевтические возможности при таких показаниях сильно ограничены хорошо известным потенциальным воздействием 1,25-(ОН)2D3 на метаболизм кальция, повышенные концентрации в крови будут способствовать быстрому развитию гиперкальциемии. Поэтому указанное соединение и некоторые из его сильных синтетических аналогов являются неудовлетворительными для применения в качестве лекарств для лечения, например, псориаза, лейкоза или иммунных заболеваний, которые могут требовать непрерывного введения лекарства в относительно высоких дозах.
В последнее время описаны некоторые аналоги витамина D, которые обнаруживают некоторую степень селективности в отношении активности индуцирования дифференциации клеток/ингибирования пролиферации клеток in vitro по сравнению с воздействием на метаболизм кальция in vivo (что определяют по повышенной концентрации кальция в сыворотке и/или увеличенному выведению кальция с мочой), что нежелательно ограничивает дозу, которая может быть безопасно введена. Один из первых появившихся аналогов, кальципотриол (INN) или кальципотриен (USAN), был разработан на основе указанной селективности и в настоящее время широко известен в мире как эффективное и безопасное лекарство для местного лечения псориаза.
Исследование, проведенное с другим аналогом витамина D, сеокальцитолом [1(S),3(R)-дигидрокси-20(R)-(5'-этил-5'-гидрокси-гепта-1'(Е),3'(Е)-диен-1'-ил)-9,10-секопрегна-5(Z),7(Е),10(19)-триеном], выбранным на указанной основе, подтверждает концепцию, что систематически вводимые аналоги витамина D могут ингибировать пролиферацию раковых клеток молочных желез in vivo при субтоксических дозах (Colston, K.W. et al., Biochem. Pharmacol. 44, 2273-2280 (1992) и Mathiasen, I.S. et al., J. Steroid Biochem. Molec.Biol., 46, 365-371 (1993)).
Родственные соединения, имеющие следующую формулу, раскрыты в WO 98/47866:
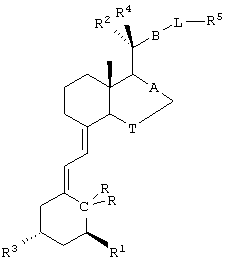
где А означает одинарную или двойную связь, Т означает CH2 или CH2CH2; В означает CH2CH2, СН=СН или 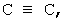 R1 и R3 означают Н или ОН, C(R,R) означает СН2 или C=CH2, R2 означает СН3 и R4 означает Н или R2 означает Н и R4 означает СН3, L означает фенил и R5 означает ОН или C(C1-4алкил)2OH или L-R5 означает 2-фурил, который является 5-замещенным C(C1-4 алкил)2ОН при условии, что когда L означает фенил, А означает одинарную связь, В означает
R1 и R3 означают Н или ОН, C(R,R) означает СН2 или C=CH2, R2 означает СН3 и R4 означает Н или R2 означает Н и R4 означает СН3, L означает фенил и R5 означает ОН или C(C1-4алкил)2OH или L-R5 означает 2-фурил, который является 5-замещенным C(C1-4 алкил)2ОН при условии, что когда L означает фенил, А означает одинарную связь, В означает 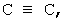 Т означает СН2, R1 и R3, каждый, означают ОН, C(R,R) означает С=СН2, R2 означает СН3, R4 означает Н и R5 означает С(СН3)2OH, тогда R5 должен быть в орто- или пара-положении. Указанные соединения описаны в WO 98/47866 как применимые для лечения или профилактики зависимых от витамина D расстройств, в частности псориаза, базалиом, нарушений кератинизации и кератоза, лейкоза, остеопороза, почечной недостаточности, сопровождающейся гиперпаратиреозом, отторжения трансплантата и гомологичной болезни.
Т означает СН2, R1 и R3, каждый, означают ОН, C(R,R) означает С=СН2, R2 означает СН3, R4 означает Н и R5 означает С(СН3)2OH, тогда R5 должен быть в орто- или пара-положении. Указанные соединения описаны в WO 98/47866 как применимые для лечения или профилактики зависимых от витамина D расстройств, в частности псориаза, базалиом, нарушений кератинизации и кератоза, лейкоза, остеопороза, почечной недостаточности, сопровождающейся гиперпаратиреозом, отторжения трансплантата и гомологичной болезни.
Стереохимия соединений, описанных в WO 98/47866, не дана при двойной связи (положение 22), когда В означает СН=СН. Однако из приведенных примеров и синтезов очевидно, что рассматриваются только 22-транс-соединения. Несмотря на обширные усилия предшествующего уровня техники обеспечить терапевтически эффективные продукты, сохраняется потребность в новых аналогах витамина D с приемлемым сочетанием желательной терапевтической активности и минимальных токсических эффектов. Соединения по данному изобретению представляют собой не раскрытые до сих пор аналоги витамина D с активностями ингибирования пролиферации клеток и промотирования дифференциации клеток без нежелательных побочных эффектов повышенных уровней кальция в сыворотке и раздражения кожи.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение относится к соединениям общей формулы I
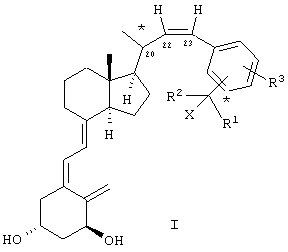
где Х означает водород или гидрокси; R1 и R2, которые могут быть одинаковыми или разными, означают водород, (C1-C4) алкил, необязательно замещенный одной гидроксильной группой или одним или несколькими атомами фтора, или вместе с атомом углерода, к которому они присоединены, R1 и R2 образуют (C3-C5)карбоциклическое кольцо, R3 означает водород, (C1-C4) алкил, (C1-C4) алкокси или атом галогена, такого как фтор, хлор, бром или иод.
Конфигурация атомов углерода, отмеченных звездочкой, может быть или S, или R.
Как должно быть очевидно, соединения формулы I имеют цис-конфигурацию при двойной связи в положении 22. Согласно изобретению, обнаружено, что 22-цис-соединения значительно более активны в стимуляции дифференциации клеток и ингибировании нежелательной пролиферации клеток.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Предпочтительные воплощения
В соединениях по изобретению предпочтительно, когда Х означает гидрокси; R1 и R2 являются одинаковыми и предпочтительно означают (C1-C2)алкил, необязательно замещенный одной гидроксильной группой или одним или несколькими атомами фтора; и R3 означает водород, (C1-C2) алкил, фтор или хлор. Предпочтительными положениями группы C(R1) (R2) (X) являются мета и пара. Еще более предпочтительными являются соединения формулы I, где R1 и R2, оба, означают метил, трифторметил или этил и R3 означает водород.
Изобретение также включает в себя диастереоизомеры соединений формулы I в чистом виде или как смесь диастереоизомеров соединений формулы I.
Предпочтительные соединения по изобретению выбраны из группы, состоящей из таких соединений, как: 1(S),3(R)-дигидрокси-20(R)-[2(Z)-(3-(2-гидрокси-2-пропил)фенил)винил]-9,10-секопрегна-5(Z),7(Е),10(19)-триен, 1(S),3(R)-дигидрокси-20(S)-[2(Z)-(4-(2-гидрокси-2-пропил)фенил)винил]-9,10-секопрегна-5(Z),7(Е),10(19)-триен, 1(S),3(R)-дигидрокси-20(R)-[2(Z)-(4-(2-гидрокси-2-пропил)фенил)винил]-9,10-секопрегна-5(Z),7(Е),10(19)-триен, и их гидролизуемые in vivo сложные эфиры с фармацевтически приемлемыми кислотами.
Используемый здесь термин "алкил" относится к любой одновалентной группе, полученной из алкана удалением атома водорода от любого атома углерода, и включает в себя подклассы нормального алкила (н-алкил) и первичного, вторичного и третичного алкила, соответственно, и имеющего указанное в описании число атомов углерода, включая, например, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил и изобутил. Алкан относится к ациклическому разветвленному или неразветвленному углеводороду, имеющему общую формулу CnH2n+2, и, следовательно, состоящему из атомов водорода и насыщенных атомов углерода.
"Галоген" обозначает фтор, хлор, бром или иод, предпочтительны фтор, хлор и бром.
СИНТЕЗ, РЕАКЦИИ
Соединения по изобретению могут быть получены, как показано на схеме Ia. Присоединение алкина формулы 1а (Calverley, M.J. and Bretting C.Aa.S.; Bioorg. Med. Chem. Lett. 9, 1841-1844, 1993) к фрагменту арильной боковой цепи формулы II в присутствии каталитических количеств комплекса палладия, такого как Pd(PPh3)4 или Pd(PPh3)2Cl2, каталитических количеств иодида меди (I) и основания органического амина в качестве растворителя дает промежуточное соединение формулы IIIa. Тройную связь в положении 22 соединения IIIa восстанавливают до 22-цис-двойной связи водородом в присутствии каталитических количеств катализатора Линдлара.
Для превращения промежуточного соединения IVa в Ia проводят стадию фотоизомеризации и стадию удаления защиты, аналогичные стадиям, используемым на последних стадиях синтеза других аналогов витамина D, см. европейский патент №0227826.
Соединения формулы Ib (20-эпимеры Ia) получают аналогично с 20-эпимером Ib (Bretting С., Mark Hansen С., Rastrup Andersen N., 1994, Chemistry and Biologi of 22,23-yne analogs of calcitriol. Norman A.W., Bouillon R, Thomasset M. (eds.) Vitamin D - A Pluropotent Steroid Hormone: Structural Stadies, Molecular Endocrinology and Clinical Applications. Walter de Gruyter, Берлин - Нью-Йорк, стр.73-74) в качестве исходного материала, как показано на схеме Ib.
Образующие боковую цепь блоки формулы II являются либо известными соединениями, либо могут быть получены, как показано на схеме II.
В качестве варианта, соединения по изобретению могут быть получены, как показано на схеме III.
Аналог витамина D формулы 2b (Calverley M., Tetrahedron, 43, 4609, (1987)) с альдегидкарбонилом в положении 22 реагирует с алкилиденфосфораном формулы Х с образованием смеси 22 (Z) и 22(Е) изомеров, из которой путем хроматографии выделяют 22(Z) изомер IV.
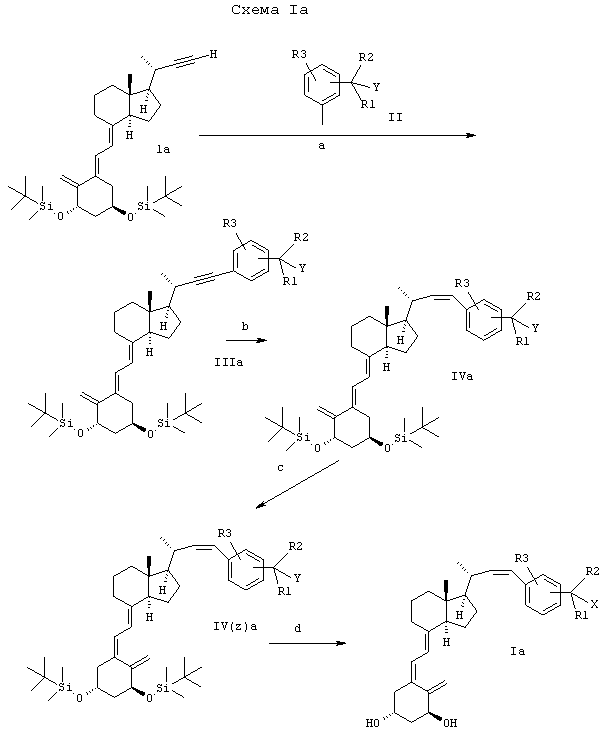
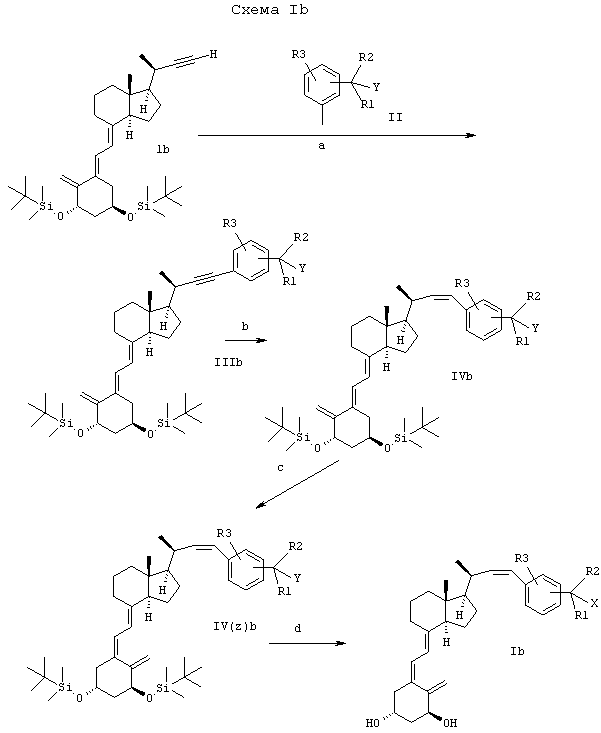
Примечания к схемам Ia и Ib:
X1 означает бром или иод, Y означает водород, гидрокси или защищенную гидроксигруппу,
X, R1, R2 и R3 такие, как указано выше.
a) Сочетание по Хеку в присутствии в качестве катализатора Pd(PPh3)2Cl2/иодида меди (I).
b) Гидрирование в присутствии катализатора Линдлара.
c) Изомеризация с hν в присутствии триплетного сенсибилизатора, например антрацена.
а) Удаление защиты с помощью TBAF или HF.
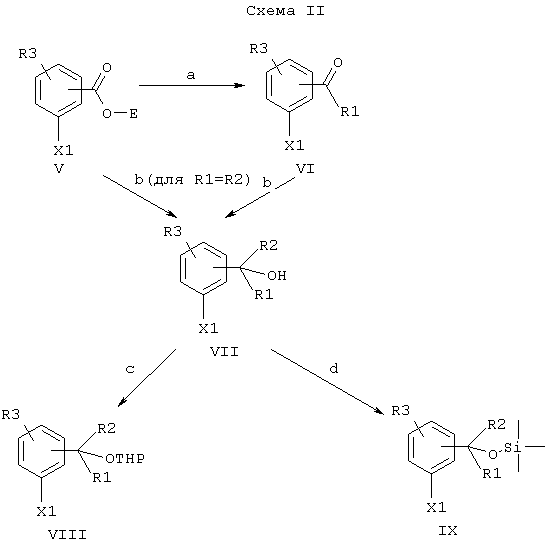
Примечания к схеме II:
Е означает низший алкил, такой как метил, этил или изопропил,
X1, R1, R2 и R3 такие, как указано выше.
a) Реакция Гриньяра с R1MgBr или R1MgI.
b) Реакция Гриньяра с R2MgBr или R2MgI.
c) Реакция с дигидропираном.
d) Силилирование с Me3SiCl +основание.
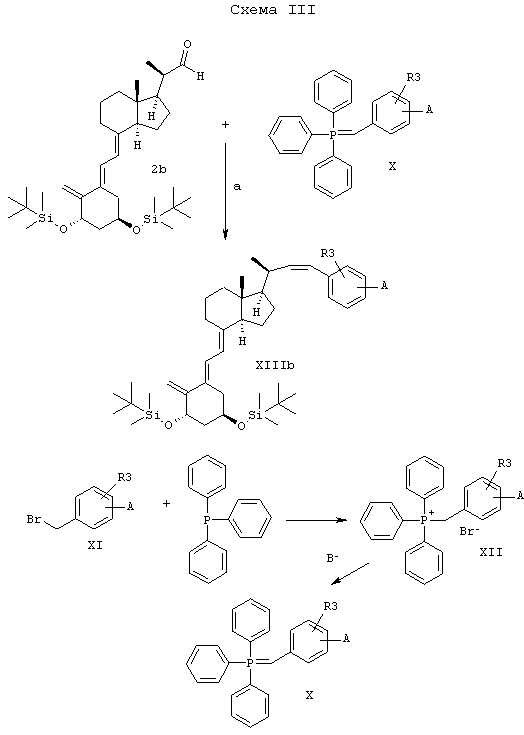
Примечания к схеме III:
R3 как указано выше.
А означает группу "C(R1) (R2) (Y)", где R1, R2 и Y такие, как указано выше, или группа, которая легко может быть превращена в "C(R1) (R2) (Y)", например сложноэфирная группа.
а) Реакция Виттига (алкилиденфосфоран Х получают на месте воздействием основанием на легкодоступный галогенид трифенилалкилфосфония XII).
В данном описании использованы следующие стандартные аббревиатуры: But=трет-бутил, DMF=N,N-диметилформамид, DMAP=4-диметиламинопиридин, Et=этил, Ether=простой диэтиловый эфир, pet. erher=петролейный эфир, Ме=метил, PPTS=п-толуол-сульфонат пиридиния, Py=пиридин, TBAF=фторид тетра-н-бутиламмония, TBS=трет-бутилметилсилил, THF=тетрагидрофуран, ТНР=тетрагидро-4Н-пиран-2-ил, Ts=тозил.
ФАРМАКОЛОГИЧЕСКИЕ МЕТОДЫ
Чтобы продемонстрировать эффективность соединений формулы I, может быть использован анализ для оценки испытуемых соединений на антипролиферативную активность в клетках кожи, например, эффект против псориаза, такой как анализ in vitro с использованием НаСаТ, клеточной линии спонтанно иммортализованных неонкогенных кератиноцитов кожи человека (Mark Hansen С. et al., J. Invest. Dermatol., 1, 44-48 (1996)), измеряющий усвоение 3H-тимидина.
Как правило, классические эффекты 1,25-(ОН)2D3 на кальциевый баланс в организме, включая кальциемические и кальциурические активности, нежелательны для аналогов витамина D по данному изобретению, для которых желательна селективность в отношении, например, ингибирования пролиферации некоторых клеток, отсутствие кальциемических эффектов и раздражения кожи.
Так, кальциемическая активность соединений может быть определена на крысах in vivo, как описано ранее (Binderup, L., Bramm, E., Biochem. Pharmacol. 37, 889-895 (1988)).
Кроме того, связывание с рецептором витамина D данных соединений относительно связывания кальцитриола в сравнении с соединениями предшествующего уровня техники может быть определено in vitro, как описано ранее (Binderup, L., Bramm, E., Biochem. Pharmacol. 37, 889-895 (1988)).
Данные соединения предназначены для применения в фармацевтических препаратах, которые могут назначаться при местном или системном лечении расстройств у человека или животных, таких как рак, лейкоз, миелофиброз и псориаз, некоторых болезненных состояний, включая гиперпаратиреоидизм, особенно вторичный гиперпаратиреоидизм, связанный с почечной недостаточностью, сахарный диабет, гипертензию, акне, алопецию, старение кожи, СПИД, нейродегенеративные расстройства, такие как болезнь Альцгеймера, гомологичные реакции, отторжение трансплантатов, для профилактики и/или лечения вызываемой стероидом атрофии кожи и для промотирования остеогенеза и лечения остеопороза.
Данные соединения могут применяться в сочетании с другими фармацевтическими веществами или возможными лечебными средствами. При лечении псориаза данные соединения могут быть использованы в сочетании с другими лекарствами против псориаза, например со стероидами, или с другими средствами, например с фототерапией или с УФ-облучением или комбинированной PUVA-обработкой. При лечении рака данные соединения могут быть использованы в сочетании с другими противораковыми лекарствами или противораковыми методами лечения, такими как лучевая терапия. Для предотвращения отторжения трансплантата и гомологичной болезни или для лечения аутоиммунных болезней данные соединения полезно использовать в сочетании с другими иммуносупрессивными/иммунорегулирующими лекарствами или обработками, например с циклоспорином А.
Необходимое для терапевтического эффекта количество соединения формулы I (называемого здесь далее как активный ингредиент) конечно будет изменяться в зависимости как от конкретного соединения и пути введения, так и от млекопитающего, подвергаемого лечению. Соединения по изобретению могут быть введены парентеральным, интраартикулярным, энтеральным или местным путями. Они хорошо абсорбируются при энтеральном введении, и это является предпочтительным путем введения при лечении системных расстройств. При лечении дерматологических расстройств типа псориаза или глазных болезней предпочтительны местные или энтеральные формы.
Хотя и возможно вводить только активный ингредиент в виде сырого химиката, предпочтительно предоставлять его в виде фармацевтического препарата. Обычно активный ингредиент составляет от 0,1 м.д. до 0,1% по массе препарата.
Препараты по данному изобретению как для ветеринарного, так и для медицинского применения для человека, таким образом, содержат активный ингредиент в сочетании с фармацевтически приемлемым носителем для него и необязательно с другим терапевтическим ингредиентом (ингредиентами). Носитель (носители) должен быть "приемлемым" в смысле совместимости с другими ингредиентами препаратов и не вредным для его реципиента.
Препараты включают, например, препараты в форме, подходящей для орального, офтальмического, парентерального (включая подкожное, внутримышечное и внутривенное), чрескожного, интраартикулярного и местного введения.
Под термином "унифицированная доза" подразумевается цельная, т.е. единственная доза, которая может быть введена пациенту и которая удобна в обращении и для упаковки, оставаясь физически и химически стабильной стандартной дозой, содержащей либо активное соединение как таковое, либо его смесь с твердыми или жидкими фармацевтическими разбавителями или носителями.
Препараты могут быть удобно представлены в унифицированной дозированной форме и могут быть получены любыми методами, хорошо известными в фармации. Все методы содержат стадию объединения активного ингредиента с носителем, который содержит один или несколько вспомогательных ингредиентов. В основном, препараты готовят однородным и тщательным смешиванием активного ингредиента с жидким носителем или тонкоизмельченным твердым носителем или с обоими и затем, если необходимо, формованием продукта в желательный препарат.
Препараты по данному изобретению, подходящие для орального введения, могут быть в виде дискретных единиц, таких как капсулы, саше, таблетки или пастилки, каждая из которых содержит заранее определенное количество активного ингредиента, в виде порошка или гранул, в виде эмульсии типа масло в воде или эмульсии типа вода в масле. Активный ингредиент может быть также введен в виде болюса, электуария или пасты.
Препараты для ректального введения могут быть в виде суппозитория, содержащего активный ингредиент и носитель, или в виде клизмы.
Препараты, подходящие для парентерального введения, обычно содержат стерильный масляный или водный препарат активного ингредиента, который предпочтительно является изотоничным с кровью реципиента. Чрескожные препараты могут быть в форме пластыря или тампона.
Препараты, подходящие для интраартикулярного или офтальмического введения, могут быть в виде стерильного водного препарата активного ингредиента, который может быть в микрокристаллической форме, например в форме водной микрокристаллической суспензии. Липосомные препараты или биоразлагаемые полимерные системы также могут быть использованы для доставки активного ингредиента как при интраартикулярном, так и при офтальмическом введении.
Препараты, подходящие для местного или офтальмического введения, содержат жидкие или полужидкие препараты, такие как линименты, лосьоны, гели, аппликанты, эмульсии типа масло в воде или вода в масле, такие как кремы, мази или пасты, или растворы или суспензии, такие как капли.
В дополнение к упомянутым выше ингредиентам препараты по данному изобретению могут содержать один или несколько дополнительных ингредиентов, таких как разбавители, связующие, консерванты и т.п.
Препараты могут также содержать другие терапевтически активные соединения, обычно применяемые в лечении указанных выше патологических состояний, такие как другие иммуносупрессанты в лечении иммунологических болезней или стероиды в лечении дерматологических болезней.
Данное изобретение относится также к способу лечения пациентов, страдающих одним из перечисленных выше патологических состояний, указанный способ содержит введение пациенту при необходимости лечения эффективного количества одного или нескольких соединений формулы I отдельно или в сочетании с одним" или несколькими разбавителями или другими терапевтически активными соединениями, обычно применяемыми в лечении указанных патологических состояний. Лечение данными соединениями и/или дополнительными терапевтически активными соединениями может быть одновременным или с интервалами.
При системном лечении вводят суточные дозы от 0,001-2 мкг на килограмм массы тела, предпочтительно от 0,002-0,3 мкг/кг массы тела млекопитающего, например 0,003-0,3 мкг/кг соединения формулы I, обычно соответствующие суточной дозе для взрослых людей от 0,2 до 25 мкг. При местном лечении дерматологических нарушений назначают мази, кремы или лосьоны, содержащие от 0,1-1000 мкг/г и предпочтительно от 1-500 мкг/г и более предпочтительно от 10-250 мкг/г соединения формулы I. Для местного применения в офтальмологии назначают мази, капли или гели, содержащие от 0,1-1000 мкг/г и предпочтительно от 1-500 мкг/г, более предпочтительно от 10-250 мкг/г соединения формулы I. Оральные препараты готовят предпочтительно в виде таблеток, капсул или капель, содержащих от 0,05-100 мкг, предпочтительно от 0,1-50 мкг соединения формулы I на унифицированную дозу.
Далее изобретение будет описано в следующих общих процедурах, препаратах и примерах.
ПРИМЕРЫ
Общее
Примеры соединений формулы I перечислены в таблице 1, тогда как промежуточные соединения формул VII, VIII и IX перечислены в таблице 2 и промежуточные соединения формул III и IV перечислены в таблице 3.
Для спектров ядерного магнитного резонанса (300 МГц) величины химических сдвигов (δ) даны для растворов в дейтериохлороформе по отношению к внутреннему тетраметилсилану (δ=0) или хлороформу (δ=7,25). Величина мультиплета, либо определенная (дублет (d), триплет (t), квартет (q)), либо нет (m), дается при аппроксимированной средней точке, если не назван диапазон (s=синглет, b=широкий).
Константы спин-спинового взаимодействия (J) даны в герцах (Гц) и иногда аппроксимированы к ближайшей единице.
Эфир означает диэтиловый эфир, осушенный над натрием. THF сушат над натрийбензофеноном. Петролейный эфир относится к пентановой фракции. Реакции обычно проводят в атмосфере аргона при комнатной температуре, если не указано иначе. Используемая процедура обработки включает в себя разбавление указанным в описании растворителем (иначе органическим растворителем для проведения реакции), экстракцию водой и затем насыщенным раствором соли, сушку над безводным MgSO4 и концентрирование в вакууме, чтобы получить остаток. Хроматографию проводят на силикагеле.
Примеры соединений формулы I
Неограничивающие примеры промежуточных соединений формул VII, VIII и IX
Неограничивающие примеры промежуточных соединений формул III и IV
ОБЩИЕ МЕТОДИКИ
Общая методика 1
Реакция метилмагнийиодида со сложным эфиром формулы V
К перемешиваемому охлаждаемому льдом раствору сложного метилового эфира V (27 моль) в сухом эфире (20 мл) добавляют по каплям в течение 20 минут фильтрованный раствор реактива Гриньяра, приготовленный из магния (1,47 г, 60 ммоль) и метилиодида (4,0 мл, 64 ммоль) в сухом эфире (40 мл). После перемешивания в течение двух часов при комнатной температуре в реакционную смесь медленно вливают воду (40 мл). Фазы разделяют и водную фазу экстрагируют эфиром (3×50 мл). Объединенные эфирные фазы последовательно экстрагируют 1 н. водным раствором HCl (50 мл), водой (3×50 мл) и насыщенным водным раствором хлорида натрия (50 мл), сушат над MgSO4 и концентрируют в вакууме до образования темного масла. Неочищенное масло очищают хроматографией на силикагеле, чтобы получить кетон формулы VI в качестве побочного продукта и спирт формулы VII в качестве главного продукта.
Соединение формулы VII при желании может быть кристаллизовано из гексана или из смеси гексана и простого эфира.
Вариант: общая методика 1а
Следуют общей методике 1 за исключением того, что вместо метилиодида используют этилбромид.
Общая методика 2
Получение тетрагидро-4Н-пиран-2-ил-эфира формулы VIII
Спирт формулы VII (16 ммоль) растворяют в метиленхлориде (50 мл), добавляют 3,4-дигидро-2Н-пиран (2,4 мл, 26 ммоль) и п-толуолсульфонат пиридиния (0,43 г, 1,7 ммоль) и смесь перемешивают при комнатной температуре в течение 4 часов. Реакционную смесь разбавляют эфиром (150 мл) и экстрагируют водой (3×50 мл) и насыщенным водным раствором хлорида натрия (50 мл), сушат и концентрируют в вакууме. Неочищенный продукт очищают хроматографией на силикагеле.
Общая методика 3
Получение простого триметилсилилового эфира формулы IX
К раствору соединения формулы VII (14 ммоль) в безводном дихлорметане (50 мл) в атмосфере аргона при перемешивании и охлаждении на ледяной бане добавляют триэтиламин (42 ммоль) и DMAP (25 мг). При перемешивании в течение 20 минут при 0°С добавляют по каплям триметилсилилхлорид (40 ммоль) и перемешивание продолжают 2-6 часов при комнатной температуре. Добавляют эфир (500 мл) и воду (100 мл). Органическую фазу отделяют, экстрагируют водой (3×50 мл) и насыщенным водным раствором хлорида натрия (50 мл), сушат и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле, чтобы получить желаемый продукт в виде желтоватого масла.
Общая методика 4
Сочетание по Хеку соединения 1 и фрагмента боковой цепи формулы II
Соединение 1 (100 мг, 0,17 ммоль), соединение формулы II (0,2 ммоль), дихлорид бис(трифенилфосфин)палладия (II) (24 мг) и иодид меди (II) растворяют в смеси безводного триэтиламина (5 мл) и безводного THF (4 мл) и перемешивают в атмосфере аргона в течение ночи. Реакционную смесь гасят водой (15 мл) и разбавляют эфиром (85 мл). Органическую фазу отделяют, экстрагируют водой (3×15 мл) и насыщенным водным раствором хлорида натрия (15 мл), сушат и концентрируют в вакууме. Остаток очищают хроматографией на силикагеле (элюент: 1-5% эфира в пентане), чтобы получить желаемый продукт в виде аморфной смолы.
Общая методика 5
Гидрирование в присутствии катализатора Линдлара
Соединение формулы III (0,57 ммоль) растворяют в смеси дихлорметана (5 мл) и этанола (20 мл), добавляют катализатор Линдлара (100 мг) и смесь перемешивают в атмосфере водорода до тех пор, пока не прекратится поглощение водорода. Катализатор отфильтровывают и фильтрат разбавляют этилацетатом (80 мл). Органическую фазу экстрагируют водой (3×15 мл) и насыщенным водным раствором хлорида натрия (15 мл), сушат и концентрируют. Остаток очищают хроматографией на силикагеле (элюент: 1-5% эфира в пентане), чтобы получить желаемый продукт в виде аморфной смолы.
Общая методика 6
Изомеризация соединения формулы IV в соответствующий 5 (Z) изомер
Раствор подходящего соединения формулы IV (0,3 ммоль), антрацена (100 мг) и триэтиламина (0,05 мл) в дихлорметане (20 мл) в атмосфере аргона в колбе из стекла пирекс облучают УФ-светом от ультрафиолетовой лампы высокого давления типа TQ760 Z2 (Hanau) при температуре около 10°С в течение 20 минут при перемешивании. Реакционную смесь концентрируют в вакууме и обрабатывают петролейным эфиром (2×5 мл). После фильтрования фильтрат концентрируют в вакууме и очищают хроматографией (смесь эфира и петролейного эфира в качестве элюента), чтобы получить указанное в заголовке соединение указанного приготовления.
Общая методика 7
Реакция Виттига с карбонильным соединением формулы 2b
Галогенид трифенилалкилфосфония (XII) (1,2 ммоль) растворяют в дихлорметане (10 мл). В атмосфере аргона добавляют 2н метилат натрия (1,2 мл) и 1(S),3(R)-бис(трет-бутилдиметилсилилокси)-20(R)формил-9,10-секопрегна-5(Е),7(Е),10(19)-триен (2b) (1 ммоль). Реакционную смесь перемешивают в атмосфере аргона в течение ночи, и глубокий оранжевый цвет постепенно бледнеет до желтого.
Реакционную смесь разбавляют эфиром (25 мл) и экстрагируют водой (2×10 мл), сушат и концентрируют, чтобы получить смесь 22-цис- и 22-транс-изомеров в виде желтого масла. 22-Цис-изомер выделяют хроматографией на силикагеле (смесь эфира и петролейного эфира в качестве элюента).
Общая методика 8
Получение галогенида трифенилалкилфосфония формулы XII
Трифенилфосфин (2,62 г, 20 ммоль) и бромид формулы XI (20 ммоль) растворяют в бензоле (12 мл) и перемешивают в течение ночи при комнатной температуре. Осадок отфильтровывают, промывают бензолом (5×2 мл) и петролейным эфиром (5 мл) и сушат в вакууме, чтобы получить галогенид трифенилалкилфосфония формулы XII.
Общая методика 9
Удаление защиты с помощью HF
К перемешиваемому раствору подходящего силил-защищенного соединения формулы IV(z) (0,25 ммоль) в этилацетате (1,5 мл) добавляют ацетонитрил (6 мл) с последующим добавлением 5% раствора фтористоводородной кислоты в смеси ацетонитрил-Н2О 7:1 (2,0 мл). После перемешивания еще в течение 45-60 минут добавляют 1 М гидрокарбонат калия (10 мл) и реакционную смесь обрабатывают (этилацетат). Остаток очищают хроматографией (элюент: 30% пентан в этилацетате), чтобы получить желаемое соединение формулы I.
Общая методика 10
Удаление защиты с помощью TBAF
К раствору подходящего силил-защищенного соединения формулы IV(z) (0,18 ммоль) в THF (4,5 мл) добавляют тригидрат TBAF (0,29 г, 0,9 ммоль) и смесь кипятят с обратным холодильником в течение одного часа при перемешивании. После добавления 0,2 М гидрокарбоната натрия (5 мл) смесь обрабатывают (этилацетат). Остаток очищают хроматографией (элюент: 30% пентан в этилацетате), чтобы получить желаемое соединение формулы I.
Общая методика 11
Взаимодействие метиллития со сложным эфиром формулы XIII
К раствору подходящего соединения формулы XIII (0,33 ммоль) в безводном эфире (10 мл), охлажденному до -30°С, в атмосфере аргона добавляют метиллитий (0,45 мл, 1,6 М в эфире). Реакционную смесь медленно нагревают до комнатной температуры в течение 2 часов и затем разбавляют эфиром (15 мл). Эфирную фазу экстрагируют водой (3×5 мл) и насыщенным водным раствором хлорида натрия (5 мл), сушат и выпаривают в вакууме, чтобы получить неочищенный продукт. Его очищают хроматографией (смесь эфира и петролейного эфира в качестве элюента), чтобы получить соединение, указанное в заголовке данной методики.
Общая методика 12
Удаление защиты соединения формулы III с помощью PPTS
К раствору подходящего соединения III (0,16 ммоль) в 99% этаноле (2 мл) добавляют PPTS (2 мг) и смесь перемешивают при 50°С в атмосфере аргона в течение одного часа. Добавляют этилацетат (15 мл) и смесь экстрагируют насыщенным водным раствором NaHCO3 (3×5 мл) и водой (5 мл). Органическую фазу сушат и выпаривают в вакууме, чтобы получить неочищенный продукт, который очищают хроматографией, чтобы получить желаемое соединение.
Синтезы
Синтез 1 Соединение 3
Способ: Общая методика 1
Исходное вещество: метил-4-иодбензоат
1H-ЯМР: δ=7,66 (м, 2Н), 7,24 (м, 2Н), 1,72 (с, 1Н), 1,55 (с, 6Н) м.д.
Синтез 2 Соединение 4
Способ: Общая методика 1
Исходное вещество: метил-3-иодбензоат
1H-ЯМР: δ=7,85 (т, 1Н), 7,57 (дд, 1Н), 7,41(дд, 1Н), 7,07 (т, 1Н), 1,56 (с, 6Н) м.д.
Синтез 3 Соединение 5
Способ: Общая методика 2
Исходное вещество: соединение 3
1H-ЯМР: δ=7,65 (м, 2Н), 7,20 (м, 2Н), 4,42 (м, 1Н), 3,95 (м, 1H), 3,39 (м, 1H), 1,83 (м, 1Н), 1,70-1,35 (м, 5Н), 1,63 (с, 3Н), 1,49 (с, 3Н) м.д.
Синтез 4 Соединение 6
Способ: Общая методика 2
Исходное вещество: соединение 4
1H-ЯМР: δ=7,79 (т, 1Н), 7,58 (дд, 1Н), 7,42 (дд, 1Н), 7,07 (т, 1Н), 4,44 (м, 1Н), 3,95 (м, 1Н), 3,40 (м, 1Н), 1,84 (м, 1Н), 1,72-1,35 (м, 5Н), 1,63 (с, 3Н), 1,49 (с, 3Н) м.д.
Синтез 5 Соединение 7
Способ: Общая методика 3
Исходное вещество: соединение 3
1H-ЯМР: δ=7,62 (м, 2Н), 7,18 (м, 2Н), 1,54 (с, 6Н), 0,09 (с, 9Н) м.д.
Синтез 6 Соединение 42
Способ: Общая методика 7
Исходное вещество: бромид 4-(2-гидрокси-2-пропил)фенилметилтрифенилфосфония.
1H-ЯМР: δ=7,42 (м, 2Н), 7,23 (м, 2Н), 6,41 (д, 1Н), 6,24 (д, J=11,8 Гц, 1Н), 5,76 (д, 1Н), 5,53 (м, 1Н), 4,96 (м, 1Н), 4,91 (м, 1Н), 4,50 (м, 1Н), 4,19 (м, 1Н), 2,83 (м, 1Н), 2,67 (м, 1Н), 2,49 (дд, 1Н), 2,30 (д, 1Н), 2,09-1,01 (м, 14Н), 1,57 (с, 6Н), 1,07 (в, 3Н), 0,88 (с, 9Н), 0,82 (с, 9Н), 0,19 (с, 3Н), 0,05 (с, 3Н), 0,04 (с, 3Н), 0,03 (с, 3Н), 0,01 (с, 3Н) м.д.
Синтез 7 Соединение 43
Способ: Общая методика 6
Исходное вещество: соединение 42
1H-ЯМР: δ=7,42 (м, 2Н), 7,23 (м, 2Н), 6,21 (м, 2Н), 5,95 (д, 1Н), 5,53 (м, 1Н), 5,15 (м, 1Н), 4,81 (м, 1Н), 4,35 (м, 1Н), 4,16 (м, 1Н), 2,78 (м, 1H), 2,66 (м, 1Н), 2,41 (дд, 1Н), 2,19 (дд, 1H), 2,07-1,00 (м, 14Н), 1,57 (с, 6Н), 1,07 (д, 3Н), 0,86 (с, 9Н), 0,84 (с, 9Н), 0,19 (с, 3Н), 0,04 (м, 12Н) м.д.
Синтез 8 Соединение 44
Способ: Общая методика 4
Исходное вещество: соединение 5
1H-ЯМР: δ=7,33 (м, 4Н), 6,45 (д, 1H), 5,84 (д, 1H), 4,99 (м, 1H), 4,94 (м, 1H), 4,53 (м, 1H), 4,38 (дд, 1H), 4,22 (м, 1H), 3,94 (м, 1H), 3,36 (м, 1H), 2,89 (м, 1H), 2,72 (м, 1H), 2,55 (дд, 1H), 2,32 (м, 1H), 2,15-1,22 (м, 19Н), 1,64 (с, 3H), 1,48 (с, 3H), 1,29 (д, 3H), 0,90 (с, 9Н), 0,86 (с, 9Н), 0,64 (с, 3H), 0,06 (м, 12Н) м.д.
Синтез 9 Соединение 45
Способ: Общая методика 12
Исходное вещество: соединение 44
1H-ЯМР: δ=7,35 (м, 4Н), 6,23 (д, 1H), 6,02 (д, 1H), 5,18 (м, 1H), 4,86 (м, 1H), 4,36 (м, 1H), 4,18 (м, 1H), 2,84 (м, 1H), 2,70 (м, 1H), 2,44 (дд, 1H), 2,21 (дд, 1H), 2,12-1,14 (м, 14Н), 1,55 (с, 6Н), 1,28 (д, 3H), 0,87 (с, 9Н), 0,86 (с, 9Н), 0,61 (с, 3H), 0,05 (м, 12Н) м.д.
Синтез 10 Соединение 46
Способ: Общая методика 5
Исходное вещество: соединение 45
1H-ЯМР: δ=7,44 (м, 2Н), 7,26 (м, 2Н), 6,44 (д, 1H), 6,25 (д, J=11,8 Гц, 1H), 5,78 (д, 1H), 5,45 (м, 1H), 4,98 (м, 1H), 4,92 (м, 1H), 4,52 (м, 1H), 4,19 (м, 1H), 2,81 (м, 2Н), 2,50 (дд, 1H), 2,30 (м, 1H), 2,10-1,02 (м, 14Н), 1,59 (с, 6Н), 1,13 (д, 3H), 0,89 (с, 9Н), 0,84 (с, 9Н), 0,50 (с, 3H), 0,06 (с, 3H), 0,05 (с, 3H), 0,04 (с, 3H), 0,03 (с, 3H) м.д.
Синтез 11 Соединение 47
Способ: Общая методика 6
Исходное вещество: соединение 46
1H-ЯМР: δ=7,44 (м, 2Н), 7,25 (м, 2Н), 6,23 (д, J=11,7 Гц, 1Н), 6,21 (д, 1Н), 5,98 (д, 1Н), 5,45 (м, 1Н), 5,16 (м, 1Н), 4,83 (м, 1Н), 4,36 (м, 1Н), 4,18 (м, 1Н) 2,81 (м, 2Н), 2,42 (дд, 1Н), 2,20 (дд, 1Н), 2,07-1,02 (м, 14Н), 1,59 (с, 6Н), 1,13 (д, 3H), 0,87 (с, 9Н), 0,86 (с, 9Н), 0,50 (с, 3H), 0,05 (м, 12Н) м.д.
Синтез 12 Соединение 48
Способ: Общая методика 7
Исходное вещество: бромид 3-этоксикарбонилфенилметилтрифенилфосфония
13С-ЯМР: δ=166,9, 153,3, 142,8, 140,2, 138,1, 135,2, 132,7, 129,9, 129,6, 128,0, 127,2, 124,9, 121,5, 116,3, 106,6, 70,1, 67,0, 56,8, 56,2, 51,9, 45,6, 43,7, 40,3, 36,4, 34,6, 28,7, 27,0, 25,6, 25,6, 23,3, 22,0, 20,3, 18,0, 17,9, 12,1, -4,9, -5,0, -5,1 м.д.
Синтез 13 Соединение 49
Способ: Общая методика 6
Исходное вещество: соединение 48
1H-ЯМР: δ=7,93 (т, 1Н), 7,88 (м, 1Н), 7,44 (м, 1Н), 7,38 (т, 1Н), 6,28 (д, 1Н, J=11,4 Гц), 6,19 (д, 1Н), 5,97 (д, 1Н), 5,52 (т, 1Н, J=11,4 Гц), 5,16 (м, 1Н), 4,82 (м, 1Н), 4,35 (м, 1Н), 4,17 (м, 1Н), 3,90 (с, 3H), 2,76 (м, 2Н), 2,41 (дд, 1Н), 2,2 (дд, 1Н), 2,03-0,71 (м, 13Н), 1,13 (д, 3H), 0,87 (с, 9Н), 0,85 (с, 9Н), 0,47 (с, 3H), 0,03 (м, 12Н) м.д.
Синтез 14 Соединение 50
Способ: Общая методика 11
Исходное вещество: соединение 49
1H-ЯМР: δ=7,38 (т, 1Н), 7,31 (м, 2Н), 7,15 (м, 1Н), 6,28 (д, 1Н, J=11,5 Гц), 6,20 (д, 1Н), 5,97 (д, 1Н), 5,47 (т, 1Н, J=11,5 Гц), 5,15 (м, 1Н), 4,82 (м, 1Н), 4,35 (м, 1Н), 4,17 (м, 1Н), 2,80 (м, 2Н), 2,42 (дд, 1Н), 2,20 (дд, 1Н), 2,08-0,70 (м, 14Н), 1,58 (с, 3H), 1,57 (с, 3H), 1,12 (д, 3H), 0,86 (с, 9Н), 0,85 (с, 9Н), 0,47 (с, 3H), 0,04 (м, 12Н) м.д.
Синтез 15 Бромид 3-этоксикарбонилфенилметилтрифенилфосфония
Способ: Общая методика 8
Исходное вещество: этил-3-бромметилбензоат
1H-ЯМР: δ=7,90 (м, 17Н), 7,60 (т, 1Н), 7,25 (т, 1Н), 5,55 (д, 2Н), 4,24 (к, 2Н), 1,29 (т, 3H) м.д.
Синтез 16 Бромид 4-(2-гидрокси-2-пропил)фенилметилтрифенилфосфония
Способ: Общая методика 8
Исходное вещество: 2-(4-бромметилфенил)-2-пропанол
1H-ЯМР: δ=7,88 (м, 3H), 7,72-7,60 (м, 12Н), 7,32 (д, 2Н), 6,95 (дд, 2Н), 4,90 (д, 2Н), 1,48 (с, 6Н) м.д.
Пример 1
1(S),3(R)-дигидрокси-20(R)-[2(Z)-(3-(2-гидрокси-2-пропил)фенил)винил]-9,10-секопрегна-5(Z),7(E),10(19)-триен
Способ: Общая методика 10
Исходное вещество: соединение 50
13С-ЯМР: δ=148,9, 147,6, 142,8, 139,3, 137,9, 133,1, 128,1, 126,8, 126,2, 124,9, 124,8, 122,4, 117,1, 111,7, 72,5, 70,7, 66,8, 56,9, 56,3, 45,9, 45,2, 42,8, 40,4, 34,9, 31,8, 31,7, 29,0, 27,3, 23,6, 22,3, 20,5, 12,4 м.д.
Пример 2
1(S),3(R)-дигидрокси-20(S)-[2(Z)-(4-(2-гидрокси-2-пропил)фенил)винил]-9,10-секопрегна-5(Z),7(Е),10(19)-триен
Способ: Общая методика 10
Исходное вещество: соединение 43
1H-ЯМР: δ=7,42 (м, 2Н), 7,23 (м, 2Н), 6,33 (д, 1Н), 6,24 (д, J=11,4 Гц, 1Н), 5,95 (д, 1Н), 5,53 (м, 1Н), 5,28 (м, 1Н), 4,94 (м, 1Н), 4,40 (м, 1Н), 4,19 (м, 1Н), 2,88-2,50 (м, 3H), 2,28 (дд, 1Н), 2,08-1,04 (м, 16Н), 1,58 (с, 6Н), 1,07 (д, 3H), 0,21 (с, 3H) м.д.
Пример 3
1(S),3(R)-дигидрокси-20(R)-[2(Z)-(4-(2-гидрокси-2-пропил)фенил)винил]-9,10-секопрегна-5(Z),7(Е),10(19)-триен
Способ: Общая методика 9
Исходное вещество: соединение 47
1H-ЯМР: δ=7,43 (м, 2Н), 7,23 (м, 2Н), 6,36 (д, 1Н), 6,24 (д, J=11,4 Гц, 1Н), 5,98 (д, 1Н), 5,53 (м, 1Н), 5,28 (м, 1Н), 4,96 (м, 1Н), 4,40 (м, 1Н), 4,19 (м, 1Н), 2,88-2,50 (м, 3H), 2,28 (дд, 1Н), 2,08-1,04 (м, 16Н), 1,59 (с, 6Н), 1,12 (д, 3H), 0,51 (с, 3H) м.д.
Пример 4
Капсулы, содержащие соединение 101
Соединение 101 растворяют в арахисовом масле до конечной концентрации 1 мкг соединения 101/мл масла. 10 частей по массе желатина, 5 частей по массе глицерина, 0,08 части по массе сорбата калия и 14 частей по массе дистиллированной воды смешивают вместе при нагревании и формуют в мягкие желатиновые капсулы. Затем каждую из них заполняют 100 мкл соединения 101 в масляном растворе так, что капсула содержит 0,1 мкг соединения 101.
Пример 5
Дерматологический крем, содержащий соединение 101
В 1 г миндального масла растворяют 0,05 мг соединения 101. К этому раствору добавляют 40 г минерального масла и 20 г самоэмульгирующегося пчелиного воска. Смесь нагревают до сжижения. После добавления 40 мл горячей воды смесь хорошо перемешивают. Полученный крем содержит приблизительно 0,5 мкг соединения 101 на 1 грамм крема.
Пример 6
Раствор для инъекций, содержащий соединение 101
Раствор, применимый для инъекций, содержит 10 мкг соединения №101 здесь, 15,4 мг дигидрата фосфата динатрия, 2 мг дигидрата дигидрофосфата натрия, 0,8 мг хлорида натрия, 5 мг аскорбата натрия, 5 мг Solutol® HS 15, до 1 мл воды для инъекций.
Изобретение относится к новому соединению формулы I
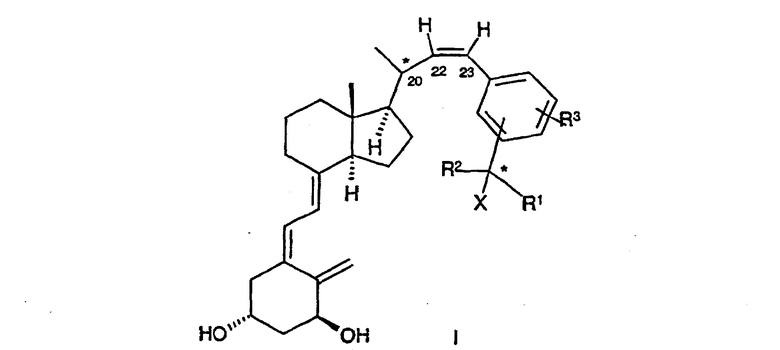
где X означает водород или гидрокси; R1 и R2, которые могут быть одинаковыми или разными, означают водород, (C1-C4)алкил; R3 означает водород, метил, фтор или хлор, и к его способным гидролизоваться in vivo сложным эфирам с фармацевтически приемлемыми кислотами. Изобретение также относится к фармацевтической композиции, обладающей активностью ингибирования пролиферации и промотирования дифференциации клеток, содержащей эффективное количество соединения формулы (I) вместе с фармацевтически приемлемыми носителями и/или разбавителями; и к применению соединения формулы (I) для приготовления медикамента для лечения или профилактики болезни, характеризующейся аномальной дифференциацией клеток и/или пролиферацией клеток. 2 н. и 11 з.п. ф-лы, 3 табл.
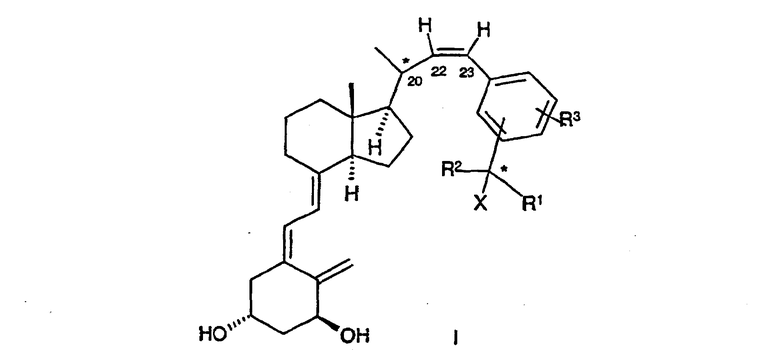
где X означает водород или гидрокси;
R1 и R2, которые могут быть одинаковыми или разными, означают водород, (C1-C4)алкил;
R3 означает водород, метил, фтор или хлор,
и его способные гидролизоваться in vivo сложные эфиры с фармацевтически приемлемыми кислотами.
1(S),3(R)-дигидрокси-20(R)-[2(Z)-(3-(2-гидрокси-2-пропил)фенил)винил]-9,10-секопрегна-5(Z),7(Е),10(19)-триен, 1(S),3(R)-дигидрокси-20(S)-[2(Z)-(4-(2-гидрокси-2-пропил)фенил)винил]-9,10-секопрегна-5(Z),7(Е),10(19)-триен, 1(S),3(R)-дигидрокси-20(R)-[2(Z)-(4-(2-гидрокси-2-пропил)фенил)винил]-9,10-секопрегна-5(Z),7(Е),10(19)-триен,
и их гидролизуемые in vivo сложные эфиры с фармацевтически приемлемыми кислотами.
| WO 9847866 A2, 29.10.1998.US 4719205 A, 12.01.1988.US 5373004 A, 13.12.1994.RU 94046458 A1, 10.01.1997.RU 95113157 A1, 20.11.1996. |
Авторы
Даты
2005-09-27—Публикация
2001-01-10—Подача