Настоящее изобретение относится к замещенным 2-тио-3,5-дициано-4-арил-6-аминопиридинам, способу их получения и использованию в качестве активных веществ для лекарственных средств.
Также объектом настоящего изобретения является использование селективных лигандов рецепторов аденозина для профилактики и/или лечения различных заболеваний.
Аденозин, нуклеозид из аденина и Д-рибозы, является эндогенным фактором с клеточно-протективной активностью, особенно в случаях повреждения клеток при ограниченном поступлении кислорода и питательной среды, например, при ишемии в различных органах (например, в сердце и головном мозге).
Аденозин образуется внутри клеток при синтезе аденозин-5'-монофосфата (АМФ) и S-аденозилгомоцистеина в качестве промежуточного продукта, однако он может быть выделен из клетки и затем посредством связывания со специфическими рецепторами выполнять функции веществ, подобных гормонам, или медиатора.
При нормальных условиях концентрация свободного аденозина во внеклеточном пространстве очень низка. Однако внеклеточная концентрация аденозина резко повышается в пораженных органах при ишемии или гипоксии. Так, например, известно, что аденозин тормозит агрегацию тромбоцитов и повышает кровоснабжение в коронарных сосудах сердца. Кроме того, аденозин воздействует на частоту сердечных сокращений, на распределение медиатора и на дифференцирование лимфоцитов.
Благодаря указанной активности аденозина, происходит повышение поступления кислорода или сокращение обмена веществ данных органов, что способствует адаптации обмена веществ органов к кровоснабжению органа при ишемии или гипоксии.
Активности аденозина способствуют специфические рецепторы. До настоящего времени были известны субтипы А1, А2а, А2b и A3. Активности данных рецепторов аденозина внутри клеток способствует информационное вещество цАМФ. В случае связывания аденозина с рецепторами А2а или А2b такое действие происходит через активацию аденилатциклазы с постоянной мембраной до повышения внутриклеточного содержания циклического аденозинмонофосфата (цАМФ), в то время как связывание аденозина с рецепторами А1 или A3 посредством ингибирования аденилатциклазы вызывает сокращение внутриклеточного содержания цАМФ.
В соответствии с настоящим изобретением под «селективными лигандами рецепторов аденозина» понимают такие вещества, которые селективно связаны с одном или несколькими субтипами рецепторов аденозина и причем могут или подражать действию аденозина (агонисты аденозина) или блокировать действие аденозина (антагонисты аденозина).
Возможно распределение селективных лигандов рецепторов аденозина по различным классам в зависимости от селективности своих рецепторов, таким образом, например, на лиганды, которые селективно связаны с А1-или А2-рецепторами аденозина, и также, например, на лиганды, которые селективно связаны с А2а- или А2b-рецепторами аденозина. Также возможны лиганды рецепторов аденозина, которые селективно связаны с несколькими субтипами рецепторов аденозина, таким образом, например, лиганды, которые селективно связаны с А1- или А2-, но не с А3-рецепторами аденозина.
Возможно определение вышеуказанной селективности рецепторов через активность веществ на клеточных линиях, которые по стабильной трансфекции с соответствующим кДНК исследуют соответствующие субтипы рецепторов (см. брошюру М.Е. Olah, H. Ren, J. Ostrowski, K.A. Jacobson, G.L. Stiles, «Cloning, expression, and characterization of the unique bovine A1 adenosine receptor. Studies on the ligand binding site by site by site-directed mutagenesis.» in J. Biol. Chem. 267 (1992) Seiten 10764-10770, которая включена в ссылку в полном объеме).
Определение активности указанных веществ на таких клеточных линиях возможно биохимическим измерением внутриклеточного содержания информационного вещества цАМФ (см. брошюру K.N. Klotz, J. Hessling, J. Hegler, С. Owman, В. Kull, В.В. Fredholm, M.J. Lohse, «Comparative pharmacology of human adenosine receptor subtypes - characterization of stably transfected receptors in CHO cells» in Naunyn Schmiedebergs Arch. Pharmacol. 357 (1998) Seiten 1-9, которая включена в ссылку в полном объеме).
Лигандами, известными из данного уровня техники, которые называют «специфическими лигандами рецептора аденозина», преимущественно называют производные на основе природного аденозина (S.-A. Poulsen und R.J. Quinn, «Adenosine receptors: new opportunities for future drugs» in Bioorganic and Medicinal Chemistry 6 (1998) Seiten 619-641). Однако существенным недостатком лигандов аденозина, известных из данного уровня техники, является то, что они фактически не обладают свойствами специфических рецепторов, менее эффективны, чем природный аденозин, или после орального введения демонстрирует только очень незначительную эффективность. Поэтому на основе вышеназванных недостатков данные лиганды используют преимущественно для экспериментальных целей.
Задачей настоящего изобретения является нахождение или получение соединений, которые демонстрируют широкий терапевтический спектр и могут быть использованы в качестве активных веществ для профилактики и/или лечения различных заболеваний.
Особенно задачей настоящего изобретения является нахождение или получение веществ, которые действуют предпочтительно в качестве селективных лигандов рецепторов аденозина и являются подходящими для профилактики и/или лечения различных заболеваний, особенно заболеваний сердечно-сосудистой системы (кардиососудистых заболеваний) или воспалительных заболеваний, однако также заболеваний мочеполовой системы, дыхательных путей, центральной нервной системы, диабета (особенно сахарного диабета) и раковых заболеваний.
Другой задачей настоящего изобретения является нахождение или получение селективных лигандов рецепторов аденозина с высокой функциональной специфичностью для вышеуказанных целей.
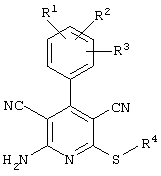
Поэтому настоящее изобретение относится к соединениям общей формулы (I)
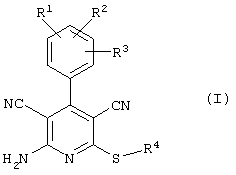
R1, R2, R3 являются одинаковыми или различными и независимо выбраны из группы следующих заместителей:
водорода;
гидрокси;
в случае необходимости, замещенного алкила с 1-8 атомами углерода;
в случае необходимости, замещенного арила с 6-10 атомами углерода;
в случае необходимости, замещенного алкокси с 1-8 атомами углерода;
-O-(CH2)n-CH=CH2, где n=0, 1 или 2;
галогеном;
нитро;
циано;
-C(O)-R5;
-C(O)-NR6R7;
-NR6R7;
-NR6-CO-R8;
-O-C(O)-R8;
-SO2-NR6R7; и
-NR6-SO2R8,
причем:
R5 является:
водородом;
гидрокси;
в случае необходимости, замещенным алкилом с 1-8 атомами углерода;
в случае необходимости, замещенным цикпоалкилом с 3-7 атомами углерода;
в случае необходимости, замещенным алкокси с 1-8 атомами углерода;
в случае необходимости, замещенным арилом с 6-10 атомами углерода;
в случае необходимости, замещенным арилокси с 6-10 атомами углерода; или
-O-(CH2)n-[(С6-С10)-арил], где n=1, 2 или 3,
причем группа арила с 6-10 атомами углерода может быть аннелирована над двумя соседними кольцевыми атомами с, в случае необходимости, замещенным циклоалкилом с 4-7 атомами углерода,
или
R5 является 5-7-членным, насыщенным или ненасыщенным гетероциклом, который, в свою очередь, может быть однократно или многократно замещен
оксогруппой (=O);
галогеном;
в случае необходимости, замещенным алкилом с 1-8 атомами углерода;
нитро;
циано;
гидрокси;
в случае необходимости, замещенным арилом с 6-10 атомами углерода; или алкокси с 1-8 атомами углерода,
или
R5 является, в случае необходимости, замещенным, 5-6-членным гетероарилом, который имеет до 3 гетероатомов из ряда азот, кислород и/или сера,
причем в случае необходимости, гетероцикл и кольцо гетероарила могут быть аннелированы соответственно с двумя соседними кольцевыми атомами с, в случае необходимости, замещенным арилом с 6-10 атомами углерода, или, в случае необходимости, замещенным циклоалкилом с 4-7 атомами углерода,
и
R6 и R7 являются одинаковыми или различными и обозначают водород;
в случае необходимости, замещенный алкил с 1-8 атомами углерода;
в случае необходимости, замещенный арил с 6-10 атомами углерода; или
в случае необходимости, замещенный 5-6-членный гетероарил, который имеет до 3 гетероатомов из ряда азот, кислород и/или сера
или
R6 и R7 вместе с атомом азота, с которым они, в случае необходимости, связаны, образуют 5-7-членный, насыщенный или ненасыщенный гетероцикл, имеющий до 3 гетероатомов из ряда азот, кислород и/или сера, и который, в случае необходимости, может быть однократно или многократно, одинаково или различно замещен
оксогруппой (=O);
галогеном;
алкилом с 1-8 атомами углерода;
нитро;
циано;
гидрокси;
арилом с 6-10 атомами углерода; или
алкокси с 1-6 атомами углерода,
и
R8 является:
гидрокси;
NR6R7, где R6 и R7 такие, как определены выше;
в случае необходимости, замещенным алкилом с 1-8 атомами углерода;
алкокси с 1-8 атомами углерода;
в случае необходимости, замещенным арилом с 6-10 атомами углерода;
арилокси с 6-10 атомами углерода; или
-O-(CH2)n-[(С6-С10)-арил], где n=1, 2 или 3,
и
R4 является неразветвленным или разветвленным алкилом с 1-8 атомами углерода или алкенилом с 2-8 атомами углерода, которые, в случае необходимости, однократно или многократно замещены
гидрокси;
галогеном;
циано;
-C(O)-R5, где R5 такое, как определено выше;
-C(O)-NR6R7, где R6 и R7 такие, как определены выше;
-NR6R7, где R6 и R7 такие, как определены выше;
-NR6-C(O)-R8, где R6 и R8 такие, как определены выше;
-SO2-NR6R7, где R6 и R7 такие, как определены выше;
-NR6-SO2-R8, где R6 и R8 такие, как определены выше;
-C(O)-(CH2)n-C(O)-R8, где n=0-2 и R8 такое, как определено выше;
алкокси с 1-8 атомами углерода;
в случае необходимости, замещенным арилокси с 6-10 атомами углерода;
в случае необходимости, замещенным 5-6-членным гетероарилом, имеющим до 3 гетероатомов из ряда азот, кислород и/или сера;
в случае необходимости, замещенным арилом с 6-10 атомами углерода; или
5-7-членным насыщенным или ненасыщенным гетероциклом, имеющим до 3 гетероатомов из ряда азот, кислород и/или сера и который, в случае необходимости, может быть однократно или многократно, одинаково или различно замещен оксогруппой (=O); галогеном; алкилом с 1-8 атомами углерода; нитро; циано; гидрокси; арилом с 6-10 атомами углерода; или алкокси с 1-8 атомами углерода,
причем, в случае необходимости, гетероцикл и кольцо гетероарила могут быть аннелированы соответственно с двумя соседними кольцевыми атомами с, в случае необходимости, замещенным арилом с 6-10 атомами углерода,
или
R4 является 5-7-членным, насыщенным или ненасыщенным гетероциклом, имеющим до 3 гетероатомов из ряда азот, кислород и/или сера, и который, в случае необходимости, может быть однократно или многократно, одинаково или различно замещен оксогруппой (=O); галогеном; алкилом с 1-8 атомами углерода; нитро; циано; гидрокси; арилом с 6-10 атомами углерода; или алкокси с 1-8 атомами углерода, и
который, в случае необходимости, может быть аннелирован с двумя соседними кольцевыми атомами с, в случае необходимости, замещенным арилом с 6-10 атомами углерода или, в случае необходимости, замещенным циклоалкилом с 4-7 атомами углерода,
и к их таутомерам, а также к их соответствующим солям, гидратам и алкоголятам,
однако исключая следующие соединения общей формулы (I), в которой значения радикалов R1, R2, R3 и R4 следующие:
- R1=R2=водород; R3 = пара-ОН; R4=-CH2-Z, где Z = циано, С(O)-OC2H5, 4-Br-С6Н4-СО, 4-н-бутил-С6Н4-СО, водород, фенил, С(O)-O-CH2-С6Н5, С(O)-OCH3, С(O)-ОН, 2-оксо-бензо-пиранил-3-карбонил, 4-CI-С6Н4-СО, 3-Br-С6Н4-СО, 4-С6Н5-С6Н4-СО, 4-CH3-С6Н4-СО, 3,4-Cl2-С6Н3-СО;
- R1=R2=водород; R3 = мета-ОН; R4=-CH2-Z, где Z=4-Br-С6Н4-NH-СО, 2-оксо-бензо-пиранил-3-карбонил, 4-Cl-С6Н4-СО;
- R1=R2=водород; R3 = пара-O-С(O)-CH3; R4=-CH2-Z, где Z=4-CH3-С6Н4-СО, Н, 2-оксо-бензопиранил-3-карбонил, (CH2)3-CH3, 4-С6Н5-С6Н4;
- R1=R2=R3=водород; R4=-CH2-Z, где Z=CH3, CN, 2-нафтил;
- R1=R2=водород; R3 = пара-бутокси; R4=-CH2-Z, где Z=4-Cl-С6Н5, С(O)-OCH3, С(O)-С6Н5, CH=CH2, C(O)-NH2, Н, 4-Br-С6Н4-СО, 4-Cl-С6Н4-СО, C(O)-OC2H5, С(O)-O-CH2-С6Н5, 2-оксо-бензопиранил-3-карбонил, С(O)-NH-С6Н5, циано;
- R1=R2=водород; R3 = пара-бром; R4=-CH2-Z, где Z=4-Br-С6Н4-СО, 4-Cl-С6Н4-СО, C(O)-NH2, С(O)-OCH3, 4-Cl-С6Н5, 4-Br-С6Н4-NH-СО;
- R1=R2=H; R3 = мета-фтор; R4=-CH2-Z, где Z=4-Br-С6Н4-СО, С(O)-NH2, С(O)-O-CH2-С6Н5, циано;
- R1=R2=водород; R3 = пара-хлор; R4=-CH2-Z, где Z=2-нафтил, метил;
- R1=R2=водород; R3 = пара-OCH3; R4=-CH2-Z, где Z=2-нафтил, метил;
- R1=R2=водород; R3 = мета-NO2; R4=-CH2-Z, где Z = метил.
Вышеуказанные вещества, которые в соответствии с настоящим изобретением могут быть использованы для профилактики и/или лечения заболеваний, отчасти являются новыми, но также отчасти известными в специальной литературе (см. Dyachenko et al., Russian Journal of Chemisrty, Vol. 33, №7, 1997, Seiten 1014-1017 und Vol. 34, №4, 1998, Seiten 557-563; Dyachenko et al., Chemistry of Heterocyclic Compounds, Vol. 34, 1998, Seiten 188-194; EInagdi et al., Zeitschrift für Naturforschung, Vol. 47b, 1992, Seiten 572-578; Riguera et al., Eur. J.Med. Chem. 33, 1998, Seiten 887-897; J. Va-quero, Thesis, University of Alcala de Henares, Madrid, Spanien, 1981). Тем не менее, до настоящего времени в литературе не было описано терапевтическое использование известных соединений. В рамках настоящего изобретения впервые описано терапевтическое использование указанных соединений.
Поэтому объектом настоящего изобретения также является использование вышеуказанных соединений общей формулы (I), а именно включая исключенные выше соединения, для профилактики и/или лечения заболеваний.
Соединения общей формулы (I) в зависимости от заместителей могут иметь стереоизомерные формы, которые являются изображением и зеркальным изображением (энантиомеры) или не являются изображением и зеркальным изображением (диастереомеры). Данное изобретение относится как к энантиомерам или диастереомерам, так и к их соответствующим смесям. Рацемические формы также пригодны для разделения диастереомеров на стереоизомерные гомогенные составляющие известным способом. Равным образом настоящее изобретение также относится к остальным таутомерам соединений формулы (I) и их солям.
Физиологически приемлемыми солями соединений формулы (I) могут являться соли предложенных в соответствии с настоящим изобретением веществ с минеральными кислотами, карбоновыми кислотами или сульфоновыми кислотами. Наиболее предпочтительными, например, являются соли хлористоводородной кислоты, бромистоводородной кислоты, серной кислоты, фосфорной кислоты, метансульфоновой кислоты, этансульфоновой кислоты, толуолсульфоновой кислоты, бензолсульфоновой кислоты, нафталиндисульфоновой кислоты, трифторуксусной кислоты, уксусной кислоты, пропионовой кислоты, молочной кислоты, винной кислоты, лимонной кислоты, фумаровой кислоты, малеиновой кислоты или бензойной кислоты.
Подходящими солями также могут являться соли обычных оснований, например, такие как соли щелочных металлов (например, соли натрия или калия), соли щелочноземельных металлов (например, соли кальция или магния) или соли аммония, производные аммиака или органических аминов, например, такие как диэтиламин, триэтиламин, этилдиизопропиламин, новокаин, дибензиламин, N-метилморфолин, дигидроабиетиламин, 1-эфенамин или метилпиперидин.
Определения в рамках настоящего изобретения
- галоген является обычно фтором, хлором, бромом или йодом, предпочтительно фтором, хлором или бромом, наиболее предпочтительно фтором или хлором.
- алкил с 1-8 атомами углерода, алкил с 1-6 атомами углерода или алкил с 1-4 атомами углерода в рамках настоящего изобретения является неразветвленным или разветвленным алкилом. Примерами являются:
- метил, этил, н-пропил, изо-пропил, н-бутил, изо-бутил, трет-бутил, н-пентил, изо-пентил, н-гексил, изо-гексил, н-гептил и н-октил. Предпочтительным является неразветвленный или разветвленный алкил, имеющий 1-6 томов углерода. Наиболее предпочтительным является неразветвленный или разветвленный алкил, имеющий 1-4 атомов углерода.
- В случае необходимости, замещенный алкил с 1-8 атомами углерода, алкил с 1-6 атомами углерода или алкил с 1-4 атомами углерода, такое определение используют в настоящем изобретении, является вышеопределенным неразветвленным или разветвленным алкилом, который может быть однократно или многократно, одинаково или различно замещен. Причем заместителями могут являться следующие соединения: галоген (фтор, хлор, бром, йод); циано; нитро; карбоксил; гидрокси; неразветвленный или разветвленный алкокси с 1-8 атомами углерода, предпочтительно алкокси с 1-6 атомами углерода, наиболее предпочтительно алкокси с 1-4 атомами углерода, причем алкокси, в случае необходимости, может быть замещен; неразветвленный или разветвленный алкенил с 2-8 атомами углерода, предпочтительно алкенил с 2-6 атомами углерода, наиболее предпочтительно алкенил с 2-4 атомами углерода, причем алкенил, в случае необходимости, может быть замещен; арил с 6-10 атомами углерода, особенно фенил или нафтил, причем арил с 6-10 атомами углерода, в случае необходимости, может быть замещен; (С1-С4)-алкилсульфонилокси, причем (C1-C4)-алкилсульфонилокси, в случае необходимости, может быть замещен; фенилсульфонил или п-толилсульфонил; неразветвленный или разветвленный тиоалкил с 1-6 атомами углерода, причем тиоалкил, в случае необходимости, может быть замещен; неразветвленный или разветвленный моногалоген-(С1-С8)-алкил, дигалоген-(С1-С8)-алкил и/или тригалоген-(С1-С8)-алкил, особенно трифторметил; неразветвленный или разветвленный моногалоген-(С1-С8)-алкокси, дигалоген-(С1-С8)-алкокси и/или тригалоген-(С1-С8)-алкокси, особенно трифторметокси; ацил; амино; N-[(С1-С8)-алкил]-амино и/или N-ди-[(С1-С8)-алкил]-амино, причем алкил, в случае необходимости, может быть замещен; и (C1-C8)-алкоксикарбонил, причем алкоксикарбонил, в случае необходимости, может быть замещен.
- Арил с 6-10 атомами углерода в рамках настоящего изобретения является ароматическим радикалом. Предпочтительными радикалами арила являются фенил и нафтил.
- В случае необходимости, замещенный арил с 6-10 атомами углерода в рамках настоящего изобретения является вышеопределенным ароматическим радикалом, который, в случае необходимости, может быть однократно или многократно, одинаково или различно замещен, предпочтительно галогеном (фтором, хлором, бромом, йодом); циано; нитро; карбоксилом; гидрокси; неразветвленным или разветвленным алкилом с 1-6 атомами углерода, предпочтительно алкилом с 1-6 атомами углерода, наиболее предпочтительно алкилом с 1-4 атомами углерода, причем алкил, в случае необходимости, может быть замещен; неразветвленным или разветвленным алкокси с 1 -8 атомами углерода, предпочтительно алкокси с 1-6 атомами углерода, наиболее предпочтительно алкокси с 1-4 атомами углерода, причем алкокси, в случае необходимости, может быть замещен; неразветвленным или разветвленным алкенилом с 2-8 атомами углерода, предпочтительно алкенилом с 2-6 атомами углерода, наиболее предпочтительно алкенилом с 2-4 атомами углерода, причем алкенил, в случае необходимости, может быть замещен; неразветвленным или разветвленным тиоалкилом с 1-8 атомами углерода, причем тиоалкил, в случае необходимости, может быть замещен; неразветвленным или разветвленным моногалоген-(С1-С8)-алкилом, дигалоген-(С1-С8)-алкилом и/или тригалоген-(С1-С8)-алкилом, особенно трифторметилом; неразветвленным или разветвленным моногалоген-(С1-С8)-алкокси, дигалоген-(С1-С8)-алкокси и/или тригалоген-(С1-С8)-алкокси, особенно трифторметокси; ацилом; амино; N-[(С1-С8)-алкил]-амино и/или N-ди-[(С1-С8)-алкил]-амино, причем алкил, в случае необходимости, может быть замещен; N-[(С1-С6)-алкокси]-алдимино; (С1-С8)-алкоксикарбонилом, причем алкоксикарбонил, в случае необходимости, может быть замещен; и арилом с 6-10 атомами углерода, особенно фенилом или нафтилом, причем арил с 6-10 атомами углерода, в случае необходимости, может быть замещен.
- Арилокси с 6-10 атомами углерода является группой -O-арила с 6-10 атомами углерода, особенно группой -O-фенила или -O-нафтила, причем в остальном возможна ссылка на указанное выше определение арила с 6-10 атомами углерода.
- В случае необходимости, замещенный (С6-С10)-арилокси с 6-10 атомами углерода является определенной выше группой -O-арила с 6-10 атомами углерода, причем относительно заместителей группы арила с 6-10 атомами углерода возможна ссылка на вышеуказанное определение при, в случае необходимости, замещенном ариле с 6-10 атомами углерода.
- Алкокси с 1-8 атомами углерода, алкокси с 1-6 атомами углерода или алкокси с 1-4 атомами углерода, который используют в настоящем изобретении и также в определениях (С1-С8)-алкоксикарбонила, является неразветвленным или разветвленным радикалом алкокси. Примерами являются: метокси, этокси, н-пропокси, изо-пропокси, н-бутокси, изо-бутокси, трет-бутокси, н-пентокси, изо-пентокси, н-гексокси, изо-гексокси, н-гептокси и н-октокси. Предпочтительным является неразветвленный или разветвленный алкокси, имеющий 1-6 атомов углерода. Наиболее предпочтительным является неразветвленный или разветвленный алкокси, имеющий 1-4 атомов углерода.
- В случае необходимости, замещенный алкокси с 1-8 атомами углерода. алкокси с 1-6 атомами углерода или алкокси с 1-4 атомами углерода, в рамках настоящего изобретения является вышеопределенным неразветвленным или разветвленным алкокси, который, в случае необходимости, может быть однократно или многократно, одинаково или различно замещен, предпочтительно следующими заместителями: галогеном (фтором, хлором, бромом, йодом); циано; нитро; карбоксилом; гидрокси; неразветвленным или разветвленным алкенилом с 2-8 атомами углерода, предпочтительно алкенилом с 2-6 атомами углерода, наиболее предпочтительно алкенилом с 2-4 атомами углерода, причем алкенил, в случае необходимости, может быть замещен; неразветвленным или разветвленным тиоалкилом с 1-8 атомами углерода, причем тиоалкил, в случае необходимости, может быть замещен; неразветвленным или разветвленным моногалоген-(С1-С8)-алкилом, дигалоген-(С1-С8)-алкилом и/или тригалоген-(С1-С8)-алкилом, особенно трифторметилом; неразветвленным или разветвленным моногалоген-(С1-С8)-алкокси, дигалоген-(С1-С8)-алкокси и/или тригалоген-(С1-С8)-алкокси, особенно трифторметокси; ацилом; амино; N-[(С1-С8)-алкил]-амино и/или N-ди-[(С1-С8)-алкил]-амино, причем алкил, в случае необходимости, может быть замещен; или (С1-С8)-алкоксикарбонилом, причем алкоксикарбонил, в случае необходимости, может быть замещен.
- Циклоалкил с 3-7 атомами углерода в рамках настоящего изобретения обычно является кольцом углерода, имеющим 3-7 атомов углерода, например, таким как циклопропил, циклобутил, циклопентил, циклогексил или циклогептил.
- В случае необходимости, замещенный циклоалкил с 3-7 атомами углерода в рамках настоящего изобретения обычно является вышеопределенным циклоалкилом с 3-7 атомами углерода, который, в случае необходимости, может быть однократно или многократно, одинаково или различно замещен, особенно алкилом с 1-8 атомами углерода, предпочтительно алкилом с 1-6 атомами углерода, наиболее предпочтительно алкилом с 1-4 атомами углерода, который снова может быть однократно или многократно замещен, как определено выше.
- 5-6-членный ароматический гетероцикл. имеющий до 3 гетероатомов из ряда сера. азот и/или кислород, в рамках настоящего изобретения обычно является моноциклическими гетероароматическими соединениями, которые связаны атомом углерода кольца гетероароматических соединений, в случае необходимости, атомом азота кольца гетероароматических соединений. Примерами являются: фуранил (например, фуран-2-ил, фуран-3-ил), пирролил (например, пиррол-1-ил, пиррол-2-ил, пиррол-3-ил), тиенил, тиазолил, оксазолил, имидазолил, триазолил, пиридил, пиримидил, пиридазинил. Предпочтительными являются пиридил, пиримидил, пиридазинил, фуранил, имидазолил и тиазолил.
- В случае необходимости, замещенный 5-6-членный ароматический гетероцикл, имеющий до 3 гетероатомов из ряда S, N и/или О, в рамках настоящего изобретения обычно является вышеопределенным гетероциклом, который однократно или многократно, одинаково или различно может быть замещен нитро; амино; гуанидино; аминокарбонилом; галогеном, предпочтительно хлором или фтором; в случае необходимости, замещенным алкилом с 1-6 атомами углерода, предпочтительно алкилом с 1-4 атомами углерода, как определено выше; или, в случае необходимости, замещенным арилом с 6-10 атомами углерода.
В рамках настоящего изобретения предпочтительными соединениями являются соединения общей формулы (I),
в которой:
R1, R2, R3 являются одинаковыми или различными и независимо друг от друга выбраны из группы следующих заместителей:
водород;
гидрокси;
в случае необходимости, замещенный алкил с 1-6 атомами углерода;
в случае необходимости, замещенный фенил или нафтил;
в случае необходимости, замещенный алкокси с 1 -6 атомами углерода;
-O-(CH2)n-CH=CH2, где n=1 или 2;
фтор, хлор, бром;
нитро;
циано;
-C(O)-R5;
-C(O)-NR6R7;
-NR6R7;
-NR6-C(O)-R8;
-O-C(O)-R8;
-SO2-NR6R7; и
-NR6-SO2R8,
причем:
R5 является:
водородом;
гидрокси;
в случае необходимости, замещенным алкилом с 1-6 атомами углерода;
в случае необходимости, замещенным циклоалкилом с 3-7 атомами углерода;
в случае необходимости, замещенным алкокси с 1-6 атомами углерода;
в случае необходимости, замещенным фенилом или нафтилом;
в случае необходимости, замещенным фенилокси или нафтилокси; или
-O-(CH2)n-фенилом, где n=1, 2 или 3,
причем группа фенила или нафтила может быть аннелирована с двумя соседними кольцевыми атомами с, в случае необходимости, замещенным циклоалкилом с 4-7 атомами углерода,
или
R5 является 5-7-членным, насыщенным или ненасыщенным гетероциклом, который, в свою очередь, может быть однократно или многократно замещен
оксогруппой (=O);
фтором, хлором, бромом;
в случае необходимости, замещенным алкилом с 1-6 атомами углерода;
нитро;
циано;
гидрокси;
в случае необходимости, замещенным фенилом или нафтилом;
или алкокси с 1-6 атомами углерода,
или
R5 является, в случае необходимости, замещенным, 5-6-членным гетероарилом, имеющим до 3 гетероатомов из ряда азот, кислород и/или сера,
причем, в случае необходимости, гетероцикл и кольцо гетероарила могут быть аннелированы соответственно с двумя соседними кольцевыми атомами с, в случае необходимости, замещенным фенилом или нафтилом, или, в случае необходимости, замещенным циклоалкилом с 4-7 атомами углерода,
и
R6 и R7 являются одинаковыми или различными и обозначают водород;
в случае необходимости, замещенный алкил с 1-6 атомами углерода;
в случае необходимости, замещенный фенил или нафтил; или
в случае необходимости, замещенный 5-6-членный гетероарил,
имеющим до 3 гетероатомов из ряда азот, кислород и/или сера
или
R6 и R7 вместе с атомом азота, с которым они, в случае необходимости, связаны, образуют 5-7-членный насыщенный или ненасыщенный гетероцикл, имеющий до 3 гетероатомов из ряда азот, кислород и/или сера и который, в случае необходимости, может быть однократно или многократно, одинаково или различно замещен
оксогруппой (=O);
фтором, хлором, бромом;
алкилом с 1-6 атомами углерода;
нитро;
циано;
гидрокси;
фенилом или нафтилом; или алкокси с 1 -6 атомами углерода,
и
R8 является:
NR6R7, где R6 и R7 такие, как определены выше;
в случае необходимости, замещенным алкилом с 1-6 атомами углерода;
алкокси с 1 -6 атомами углерода;
в случае необходимости, замещенным фенилом или нафтилом;
фенилокси или нафтилокси; или
-O-(CH2)n-фенилом, где n=1, 2 или 3,
и
R4 является неразветвленным или разветвленным алкилом с 1-6 атомами углерода или алкенилом с 2-6 атомами углерода, которые, в случае необходимости, однократно или многократно замещены
гидрокси;
фтором, хлором, бромом;
циано;
-C(O)-R5, где R5 такое, как определено выше;
-C(O)-NR6R7, где R6 и R7 такие, как определены выше;
-NR6R7, где R6 и R7 такие, как определены выше;
-NR6-C(O)-R8, где R6 и R8 такие, как определены выше;
-SO2-NR6R7, где R6 и R7 такие, как определены выше;
-NR6-SO2-R8, где R6 и R8 такие, как определены выше;
-C(O)-(CH2)n-C(O)-R8, где n = 0-2 и R8 такое, как определено выше;
алкокси с 1-6 атомами углерода;
в случае необходимости, замещенным фенилокси или нафтилокси;
в случае необходимости, замещенным 5-6-членным гетероарилом, имеющим до 3 гетероатомов из ряда азот, кислород и/или сера;
в случае необходимости, замещенным фенилом или нафтилом; или 5-7-членным насыщенным или ненасыщенным гетероциклом, имеющим до 3 гетероатомов из ряда азот, кислород и/или сера и который, в случае необходимости, может быть однократно или многократно, одинаково или различно замещен оксогруппой (=O); фтором, хлором, бромом; алкилом с 1-6 атомами углерода; нитро; циано; гидрокси; фенилом или нафтилом; или алкокси с 1-6 атомами углерода,
причем, в случае необходимости, гетероцикл и кольцо гетероарила могут быть аннелированы соответственно с двумя соседними кольцевыми атомами с, в случае необходимости, замещенным фенилом или нафтилом,
или
R4 является 5-7-членным, насыщенным или ненасыщенным гетероциклом, имеющим до 3 гетероатомов из ряда азот, кислород и/или сера, и который, в случае необходимости, может быть однократно или многократно, одинаково или различно замещен оксогруппой (=O); фтором, хлором, бромом; алкилом с 1-6 атомами углерода; нитро; циано; гидрокси; фенилом или нафтилом; или алкокси с 1-6 атомами углерода, и который, в случае необходимости, может быть аннелирован с двумя соседними кольцевыми атомами с, в случае необходимости, замещенным фенилом или нафтилом или, в случае необходимости, замещенным циклоалкилом с 4-7 атомами углерода,
и их таутомеры, а также их соответствующие соли, гидраты и алкоголяты,
однако исключая следующие соединения общей формулы (I), в которой значения радикалов R1, R2, R3 и R4 следующие:
- R1=R2=водород; R3 = пара-ОН; R4=-Cl2-Z, где Z=CN, С(O)-ОС2Н5, 4-Br-С6Н4-СО, 4-н-бутил-С6Н4-СО, водород, фенил, С(O)-O-CH2-С6Н5, С(O)-OCH3, С(O)-ОН, 2-оксо-бензо-пиранил-3-карбонил, 4-Cl-С6Н4-СО, 3-Br-С6Н4-СО, 4-С6Н5-С6Н4-СО, 4-CH3-С6Н4-СО, 3,4-Cl2-С6Н3-СО;
- R1 = R2 = водород; R3 = мета-ОН; R4 = -CH2-Z, где Z = 4-Br-C6H4-NH-CO, 2-оксо-бензо-пиранил-3-карбонил, 4-CI-C6H4-CO;
- R1 = R2 = h; R3 = пара-O-С(O)-CH3; R4 = -CH2-Z, где Z = 4-CH3-С6Н4-СО, H, 2-оксо-бензопиранил-3-карбонил, (CH2)3-CH3, 4-С6Н5-С6Н4;
- R1 = R2 = R3 = водород; R4 = -CH2-Z, где Z = метил, циано, 2-нафтил;
- R1 = R2 = водород; R3 = пара-бутокси; R4 = -CH2-Z, где Z = 4-Cl-С6Н5, С(O)-OCH3, С(O)-С6Н5, CH = CH2, C(O)-NH2, водород, 4-Br-С6Н4-СО, 4-Cl-С6Н4-СО, С(O)-ОС2Н5, С(O)-O-CH2-С6Н5, 2-оксо-бензопиранил-3-карбонил, C(O)-NH-C6H5, циано;
- R1 = R2 = водород; R3 = пара-бром; R4 = -CH2-Z, где Z =4-Br-С6Н4-СО, 4-Cl-С6Н4-СО, C(O)-NH2, С(O)-OCH3, 4-Cl-С6Н5, 4-Br-С6Н4-NH-СО;
- R1 = R2 = водород; R3 = мета-фтор; R4 = -CH2-Z, где Z =4-Br-С6Н4-СО, С(O)-NH2, С(O)-O-CH2-С6Н5, циано;
- R1 = R2 = водород; R3 = пара-хлор; R4 = -CH2-Z, где Z = 2-нафтил, метил;
- R1 = R2 = водород; R3 = пара-OCH3; R4 = -CH2-Z, где Z = 2-нафтил, метил;
- R1 = R2 = водород; R3 = мета-NO2; R4 = -CH2-Z, где Z = метил.
Наиболее предпочтительными соединениями являются соединения общей формулы (I),
в которой:
R1, R2, R3 являются одинаковыми или различными и независимо друг от друга выбраны из группы следующих заместителей:
водород;
гидрокси;
в случае необходимости, замещенный алкил с 1-4 атомами углерода;
в случае необходимости, замещенный фенил;
в случае необходимости, замещенный алкокси с 1-4 атомами углерода;
-O-(CH2)n-CH=CH2, где n=1;
фтор, хлор;
нитро;
циано;
-C(O)-R5;
-С(O)-NR6R7;
-NR6R7;
-NR6-C(O)-R8;
-O-C(O)-R8;
-SO2-NR6R7; и
-NR6-SO2R8,
причем:
R5 является:
водородом;
гидрокси;
в случае необходимости, замещенным алкилом с 1-4 атомами углерода;
в случае необходимости, замещенным циклоалкилом с 3-7 атомами углерода;
в случае необходимости, замещенным алкокси с 1-4 атомами углерода;
в случае необходимости, замещенным фенилом;
в случае необходимости, замещенным фенилокси; или
-O-(CH2)n-фенилом, где n=1,
причем группа фенила может быть аннелирована с двумя соседними кольцевыми атомами с, в случае необходимости, замещенным циклоалкилом с 5-6 атомами углерода,
или
R5 является 5-7-членным, насыщенным или ненасыщенным гетероциклом, который, в свою очередь, может быть однократно или многократно замещен
оксогруппой (=O);
фтором, хлором;
в случае необходимости, замещенным алкилом с 1-4 атомами углерода;
нитро;
циано;
гидрокси;
в случае необходимости, замещенным фенилом; или
алкокси с 1-4 атомами углерода,
или
R5 является, в случае необходимости, замещенным 5-6-членным гетероарилом, имеющим до 3 гетероатомов из ряда азот, кислород и/или сера, который выбирают из группы фуранил, пирролил, тиенил, тиазолил, оксазолил, имидазолил, триазолил, пиридил, пиримидил и пиридазинил,
причем, в случае необходимости, гетероцикл и кольцо гетероарила могут быть аннелированы соответственно с двумя соседними кольцевыми атомами с, в случае необходимости, замещенным фенилом, или, в случае необходимости, замещенным циклоалкилом с 5-6 атомами углерода,
и
R6 и R7 являются одинаковыми или различными и обозначают водород;
в случае необходимости, замещенный алкил с 1-4 атомами углерода;
в случае необходимости, замещенный фенил, или
в случае необходимости, замещенный 5-6-членный гетероарил, имеющий до 3 гетероатомов из ряда азот, кислород и/или сера, который выбирают из группы фуранил, пирролил, тиенил, тиазолил, оксазолил, имидазолил, триазолил, пиридил, пиримидил и пиридазинил,
или
R6 и R7 вместе с атомом азота, с которым они, в случае необходимости, связаны, образуют 5-7-членный насыщенный или ненасыщенный гетероцикл, имеющий до 3 гетероатомов из ряда азот, кислород и/или сера, и который, в случае необходимости, может быть однократно или многократно, одинаково или различно замещен
оксогруппой (=O);
фтором, хлором;
алкилом с 1-4 атомами углерода;
нитро;
циано;
гидрокси;
фенилом; или
алкокси с 1-4 атомами углерода,
и
R8 является:
NR6R7, где R6 и R7 такие, как определены выше;
в случае необходимости, замещенным алкилом с 1-4 атомами углерода;
алкокси с 1-4 атомами углерода;
в случае необходимости, замещенным фенилом;
фенилокси; или
-O-(CH2)n-фенилом, где n=1,
и
R4 является неразветвленным или разветвленным алкилом с 1-4 атомами углерода или алкенилом с 2-4 атомами углерода, которые, в случае необходимости, однократно или многократно замещены гидрокси;
фтором, хлором;
циано;
-C(O)-R5, где R5 такое, как определено выше;
-C(O)-NR6R7, где R6 и R7 такие, как определены выше;
-NR6R7, где R6 и R7 такие, как определены выше;
-NR6-C(O)-R8, где R6 и R8 такие, как определены выше;
-SO2-NR6R7, где R6 и R7 такие, как определены выше;
-NR6-SO2-R8, где R6 и R8 такие, как определены выше;
-C(O)-(CH2)n-C(O)-R8, где n=0-2 и R8 такое, как определено выше;
(С1-С4)-алкокси;
в случае необходимости, замещенным фенилокси;
в случае необходимости, замещенным 5-6-членным гетероарилом, имеющим до 3 гетероатомов из ряда азот, кислород и/или сера, который выбирают из группы фуранил, пирролил, тиенил, тиазолил, оксазолил, имидазолил, триазолил, пиридил, пиримидил и пиридазинил;
в случае необходимости, замещенным фенилом; или 5-7-членным насыщенным или ненасыщенным гетероциклом, имеющим до 3 гетероатомов из ряда азот, кислород и/или сера и который, в случае необходимости, может быть однократно или многократно, одинаково или различно замещен оксогруппой (=O); фтором, хлором; алкилом с 1-4 атомами углерода; нитро; циано; гидрокси; фенилом; или алкокси с 1-4 атомами углерода,
причем, в случае необходимости, гетероцикл и кольцо гетероарила могут быть аннелированы соответственно с двумя соседними кольцевыми атомами с, в случае необходимости, замещенным фенилом,
или
R4 является 5-7-членным, насыщенным или ненасыщенным гетероциклом, имеющим до 3 гетероатомов из ряда азот, кислород и/или сера, и, в случае необходимости, однократно или многократно, одинаково или различно замещен оксогруппой (=O); фтором, хлором;
алкилом с 1-4 атомами углерода; нитро; циано; гидрокси; фенилом; или алкокси с 1-4 атомами углерода, и
который, в случае необходимости, может быть аннелирован с двумя соседними кольцевыми атомами с, в случае необходимости, замещенным фенилом или, в случае необходимости, замещенным циклоалкилом с 5-6 атомами углерода,
и их таутомеры, а также их соответствующие соли, гидраты и алкоголяты,
однако исключая следующие соединения общей формулы (I), в которой значения радикалов R1, R2, R3 и R4 следующие:
- R1 = R2 = водород; R3 = пара-ОН; R4 = -CH2-Z, где Z = циано, С(O)-OC2H5, 4-Br-С6Н4-СО, 4-н-бутил-С6Н4-СО, водород, фенил, С(O)-O-CH2-C6H5, С(O)-OCH3, С(O)-ОН, 2-оксо-бензо-пиранил-3-карбонил, 4-CI-С6Н4-СО, 3-Br-С6Н4-СО, 4-С6Н5-С6Н4-СО, 4-CH3-С6Н4-СО, 3,4-Cl2-С6Н3-СО;
- R1 = R2 = водород; R3 = мета-ОН; R4 = -CH2-Z, где Z = 4-Br-C6H4-NH-CO, 2-оксо-бензо-пиранил-3-карбонил, 4-Cl-С6Н4-СО;
- R1 = R2 = водород; R3 = пара-O-С(O)-CH3; R4 = -CH2-Z, где Z = 4-CH3-С6Н4-СО, водород, 2-оксо-бензопиранил-3-карбонил, (CH2)3-CH3, 4-С6Н5-С6Н4;
- R1 = R2 = R3 = водород; R4 = -CH2-Z, где Z = CH3, циано;
- R1 = R2 = водород; R3 = пара-бутокси; R4 = -CH2-Z, где Z = 4-Cl-С6Н5, С(O)-OCH3, С(O)-С6Н5, CH = CH2, C(O)-NH2, H, 4-Br-С6Н4-СО, 4-Cl-С6Н4-CO, C(O)-OC2H5, С(O)-O-CH2-С6Н5, 2-оксо-бензопиранил-3-карбонил, С(O)-NH-С6Н5, циано;
- R1 = R2 = водород; R3 = мета-фтор; R4 = -CH2-Z, где Z =4-Br-С6Н4-СО, C(O)-NH2, С(O)-O-CH2-С6Н5, циано;
- R1 = R2 = водород; R3 = пара-хлор; R4 = -CH2-Z, где Z = 2-нафтил, метил;
- R1 = R2 = водород; R3 = пара-OCH3; R4 = -CH2-Z, где Z = 2-нафтил, метил;
- R1 = R2 = водород; R3 = мета-NO2; R4 = -CH2-Z, где Z = метил.
В соответствии с настоящим изобретением особенно предпочтительными являются соединения общей формулы (I),
в которой:
R1, R2, R3 являются одинаковыми или различными и независимо выбраны из группы следующих заместителей:
водород;
гидрокси;
метил;
трифторметил;
метокси;
радикалы формул -O-CH2-CH2-ОН, -O-CH2-СООН или -O-CH2CH=CH2;
фтор, хлор или бром;
нитро;
циано;
-С(O)ОН или -С(O)OCH3;
-C(O)NH2;
амино;
NH-C(O)-CH3
-O-C(O)-CH3 или -O-C(O)-C2H5;
радикалы формул
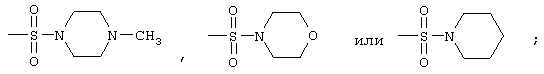
и
-NH-SO2CH3 или -NH-SO2C6H5,
и
R4 является неразветвленным или разветвленным алкилом с 1-4 атомами углерода, который, в случае необходимости, однократно или многократно замещен гидрокси;
амино;
-С(O)OCH3;
-C(O)NH2, -С(O)HNCH3, -C(O)-HNC2H5, или -C(O)-HNC6H5;
-NHC(O)NH2, -NHC(O)NHCH3, -NHC(O)NHC2H5, -NHC(O)OCH3 или
-NHC(O)ОС2Н5;
-SO2-NH2;
-NH-SO2-CH3 или - NH-SO2-C2H5;
метокси;
фенилом, который может быть замещен нитро, циано, фтором, метокси, дифторметокси, метоксикарбонилом или п-толилсульфонилметилом;
пиридилом, фурилом, имидазолилом, бензимидазолилом или тиазолилом, который соответственно однократно или двукратно, одинаково или различно может быть замещен метилом, нитро или хлором; оксадиазолилом, который может быть замещен фенилом или метоксифенилом;
или
радикалом формулы
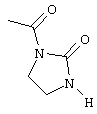
или
R4 является аллилом или 3,3-диметилаллилом,
и их таутомеры, а также их соответствующие соли, гидраты и алкоголяты,
однако исключая следующие соединения общей формулы (I), в которой значения радикалов R1, R2, R3 и R4 следующие:
- R1 = R2 = водород; R3 = пара-OH; R4 = -CH2-Z, где Z = водород, фенил, С(O)-OCH3;
- R1 = R2 = водород; R3 = пара-O-С(O)-CH3; R4 = -CH2-Z, где Z = водород;
- R1 = R2 = R3 = водород; R4 = -CH2-Z, где Z = метил;
- R1 = R2 = водород; R3 = мета-фтор; R4 = -CH2-Z, где Z = С(O)-NH2;
- R1 = R2 = водород; R3 = пара-хлор; R4 = -CH2-Z, где Z = метил;
- R1 = R2 = водород; R3 = пара-OCH3; R4 = -CH2-Z, где Z = метил;
- R1 = R2 = водород; R3 = мета-NO2; R4 = -CH2-Z, где Z = метил.
В соответствии с настоящим изобретением совершенно предпочтительными являются соединения общей формулы (I),
в которой:
R1, R2, R3 являются одинаковыми или различными и независимо выбраны из группы следующих заместителей:
водород;
гидрокси;
метил;
метокси;
радикалы формул -O-CH2-CH2-ОН, -O-CH2-СООН или -O-CH2CH=CH2;
фтор или хлор;
нитро;
циано;
-С(O)ОН или -С(O)OCH3;
-С(O)NH2;
амино;
-NH-С(O)-CH3;
-O-С(O)-CH3 или -O-С(O)-С2Н5;
радикалы формул

и
-NH-SO2CH3 или -NH-SO2C6H5,
и
R4 является неразветвленным или разветвленным алкилом с 1-4 атомами углерода, который, в случае необходимости, однократно или многократно замещен гидрокси;
амино;
-С(O)OCH3;
-С(O)-NH2, -С(O)-HNCH3, -C(O)-HNC2H5, или -С(O)-HNC6Н5;
-NHC(O)NH2, -NHC(O)NHCH3, -NHC(O)NHC2H5, -NHC(O)OCH3 или -NHC(O)OC2H5;
-SO2-NH2;
-NH-SO2-CH3 или - NH-SO2-C2H5;
метокси;
-фенилом;
орто-нитрофенилом; или
радикалами формулы
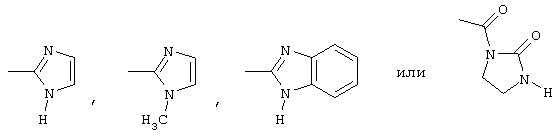
или
R4 является аллилом,
и их таутомеры, а также их соответствующие соли, гидраты и алкоголяты,
однако исключая следующие соединения общей формулы (I), в которой значения радикалов R1, R2, R3 и R4 следующие:
- R1 = R2 = водород; R3 = пара-ОН; R4 = -CH2-Z, где Z = водород, фенил, С(O)-OCH3;
- R1 = R2 = водород; R3 = пара-O-С(O)-CH3; R4 = -CH2-Z, где Z = водород;
- R1 = R2 = R3 = водород; R4 = -CH2-Z, где Z = метил;
- R1 = R2 = водород; R3 = мета-фтор; R4 = -CH2-Z, где Z = С(O)-NH2;
- R1 = R2 = водород; R3 = пара-хлор; R4 = -CH2-Z, где Z = метил;
- R1 = R2 = водород; R3 = пара-OCH3; R4 = -CH2-Z, где Z = метил;
- R1 = R2 = водород; R3 = мета-NO2; R4 = -CH2-Z, где Z = метил.
Объектом настоящего изобретения также является способ получения соединений общей формулы (I).
В соответствии с первым вариантом предложенного способа получение соединений общей формулы (I) проводят способом, по которому
соединения общей формулы (II)
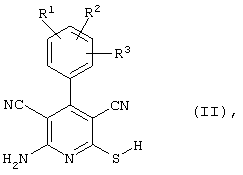
в которой значения радикалом R1, R2 и R3 такие, как указаны выше,
подвергают взаимодействию с соединениями общей формулы (III)
R4-X (III),
в которой значение R4 такое, как указано выше
и
Х является нуклеофильной группой (предпочтительно галогеном, особенно хлором, бромом или йодом, или мезилатом, тозилатом, трифлатом или 1-имидазолилом),
в инертных растворителях, в случае необходимости, в присутствии основания.
Проведение вышеописанного способа показано, например, на следующей схеме реакции:
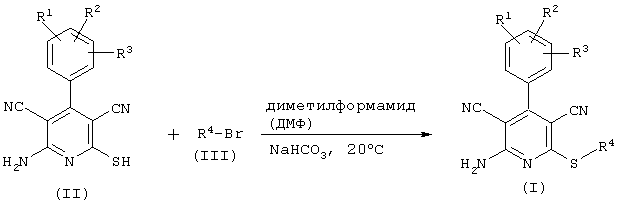
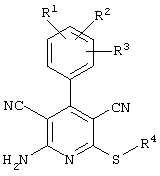
В том случае, если в общей формуле (1) R4 является
алкилом, замещенным радикалами -NR6-С(О)-R8, -NR6-C(O)-NR6R7, -NR6-SO2-R8,
причем значения радикалов R6, R7 и R8 такие, как определены выше
в соответствии со вторым вариантом предложенного способа также возможно альтернативное получение соединений общей формулы (I), отличающееся тем, что вначале соединения общей формулы (II) подвергают взаимодействию с 2-бромэтиламином с получением соединений общей формулы (IV)
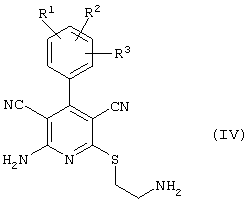
которые затем подвергают взаимодействию с соединениями общей формулы V
R9-Y (V),
в которой
R9 является -C(O)-R8, -C(O)-O-R8, -C(O)-NR6R7, -SO2-R8, где значение R8 такое, как определено выше
и
Y является нуклеофильной группой (предпочтительно галогеном, особенно хлором, бромом или йодом, или мезилатом, тозилатом, трифлатом или 1-имидазолилом),
или
R9 является R6
и
Y является группой O=C=N-,
в инертных растворителях, в случае необходимости, в присутствии основания.
Проведение вышеописанного второго варианта предложенного в соответствии с настоящим изобретением способа показано, например, на следующей схеме реакции:
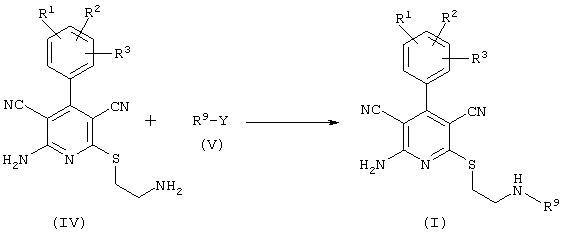
Нуклеофильная группа, иногда обозначаемая как отделяемая или отщепляемая группа, может быть введена в реакцию отдельно или же также генерирована in situ обычными способами, например, с использованием, так называемой реакции Митцунобу.
В предложенных в соответствии с настоящим изобретением способах в качестве растворителя подходящими являются все органические растворители, которые инертны при реакционных условиях. Подходящими растворителями являются спирты, такие как метанол, этанол и изопропанол, кетоны, такие как ацетон и метилэтилкетон, ациклические и циклические простые эфиры, такие как простой диэтиловый эфир и тетрагидрофуран, сложные эфиры, такие как этиловый эфир уксусной кислоты или бутиловый эфир уксусной кислоты, углеводороды, такие как бензол, ксилол, толуол, гексан или циклогексан, диметилформамид, ацетонитрил, пиридин, диметилсульфоксид (ДМСО), хлорированные углеводороды, такие как дихлорметан, хлорбензол или дихлорэтан или триамид гексаметилфосфорной кислоты. Вода также является подходящим растворителем. Наиболее предпочтительным растворителем является диметилформамид. Также возможно использование смесей вышеназванных растворителей.
В качестве оснований подходящими являются обычные неорганические или органические основания. Подходящими основаниями предпочтительно являются гидроксиды щелочи, например, такие как гидроксид натрия или калия, или карбонаты щелочи, такие как карбонат натрия или калия, или гидрокарбонат натрия или калия, или метанолат натрия или калия, или этанолат натрия или калия, или трет-бутилат калия, а также амиды, такие как амид натрия, литий-бис-(триметилсилил)амид или литийдиизопропиламид, или металлорганические соединения, такие как бутиллитий или фениллитий, а также амины, такие как триэтиламин и пиридин. Предпочтительными являются карбонаты и гидрокарбонаты щелочи.
Причем количество используемого основания составляет от 1 до 10 моль, предпочтительно от 1 до 5 моль, особенно от 1 до 4 моль, относительно 1 моль соединений общей формулы (II) или (IV).
Реакцию обычно проводят при температуре от -78°С до температуры флегмы, предпочтительно в области от -78°С до +40°С, особенно при комнатной температуре.
Проведение превращения возможно при нормальном, повышенном или пониженном давлении (например, в области от 0,5 до 5 бар). Обычно работают при нормальном давлении.
Специалисту в данной области известны многочисленные вариации вышеназванных условий, которые находятся на уровне знаний среднего специалиста и не выходят за рамки настоящего изобретения.
Соединения общей формулы (II) также известны специалисту в данной области или могут быть получены обычными, известными в специальной литературе способами. Предпочтительно приводят следующие публикации, которые приведены в качестве ссылки:
- Dyachenko et al., Russian Journal of Chemistry, Vol. 33, №7, 1997, Seiten 1014-1017 und Vol. 34, №4, 1998, Seiten 557-563;
- Dyachenko et al., Chemistry of Heterocyclic Compounds, Vol. 34, №2, 1998, Seiten 188-194;
- Qintela et al., European Journal of Medicinal Chemistry, Vol. 33, 1998, Seiten 887-897;
- Kandeel et al., Zeitschrift fur Naturforschung 42b, 107-111 (1987).
Соединения общей формулы (II) также могут быть получены из соединений общей формулы (VI) путем взаимодействия с сульфидом щелочи. Данный способ получения показан, например, на следующей схеме реакции:
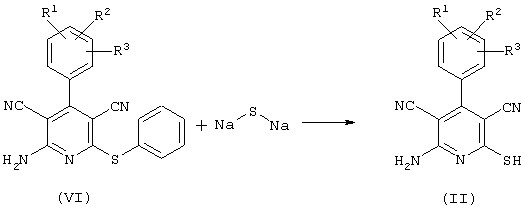
В качестве сульфида щелочи предпочтительно используют сульфид натрия в количестве от 1 до 10 моль, предпочтительно от 1 до 5 моль, особенно от 1 до 4 моль, относительно 1 моль соединений общей формулы (VI).
В качестве растворителя подходящими являются все органические растворители, которые инертны в реакционных условиях. Подходящими растворителями являются N,N-диметилформамид, N-метилпирролидинон, триамид гексаметилфосфорной кислоты, пиридин и ацетонитрил. Наиболее предпочтительным является N,N-диметилформамид. Также возможно использование смесей вышеназванных растворителей.
Реакцию обычно проводят при температуре от +20°С до температуры флегмы, предпочтительно в области от +20°С до +120°С, особенно при +60°С до +100°С.
Проведение взаимодействия возможно при нормальном, повышенном или пониженном давлении (например, в области от 0,5 до 5 бар). Обычно работают при нормальном давлении.
Специалисту в данной области известны многочисленные вариации вышеназванных условий, которые находятся в средних специальных знаниях и не выходят за рамки настоящего изобретения.
Соединения общей формулы (VI) также известны специалисту в данной области или могут быть получены обычными, известными в специальной литературе способами. Предпочтительно указывают на публикацию Kambe et al.. Synthesis, 531 (1981), содержание которой включено в качестве ссылки.
Соединения общих формул (III) или (V) или коммерчески доступны, или известны специалисту в данной области, или могут быть получены в соответствии с обычными способами.
Неожиданно соединения общей формулы (I) демонстрируют непредсказуемый, имеющий важное фармакологическое значение спектр действия и поэтому являются особенно подходящими для профилактики и/или лечения заболеваний.
Таким образом, теперь неожиданно найдено, что вещества вышеуказанной формулы (I) являются подходящими для профилактики и/или лечения целого ряда различных заболеваний, например особенно заболеваний сердечно-сосудистой системы (кардиососудистых заболеваний); заболеваний мочеполовой системы; заболеваний дыхательных путей; воспалительных и нейровоспалительных заболеваний; диабета, особенно сахарного диабета; рака; и также нейродегенеративных заболеваний, например, таких как болезнь Паркинсона, а также болевых синдромов.
Более конкретно в настоящем изобретении под заболеваниями сердечно-сосудистой системы или кардиососудистыми заболеваниями понимают, например, следующие заболевания: коронарную болезнь сердца; гипертонию (повышенное кровяное давление); рестеноз, например рестеноз после баллонной дилатации периферийных кровеносных сосудов; артериосклероз; тахикардию; аритмию; периферийные и кардиальные ангиопатии; стабильную и нестабильную стенокардию; и мерцание предсердий.
Кроме того, соединения общей формулы (I) также являются подходящими для восстановления области миокарда, пораженной инфарктом.
Кроме того, соединения общей формулы (I) также являются подходящими для лечения и профилактики тромбоэмболитических заболеваний и ишемии, например, таких как инфаркт миокарда, кровоизлияние в мозг, временные ишемические приступы.
Другой областью индикации, для которой являются подходящими соединения общей формулы (I), является профилактика и/или терапия заболеваний мочеполовой системы, например, таких как гиперестезия мочевого пузыря, дисфункция эрекции и женские сексуальные дисфункции, кроме того, профилактика и/или лечение воспалительных заболеваний, например, таких как астма и воспалительные дерматозы, нейровоспалительных заболеваний центральной нервной системы, например, такие как состояния после инфаркта мозга, болезнь Альцгеймера, кроме того, также нейродегенеративных заболеваний, таких как болезнь Паркинсона, а также болевых синдромов.
Другой областью индикации являются заболевания дыхательных путей, например, таких как астма, хронический бронхит, эмфизема легких, бронхоэктазия, цистический фиброз (муковисцидоз) и легочная гипертония.
Кроме того, также возможно использование соединений общей формулы (I) для профилактики и/или терапии фиброза печени и цирроза печени.
Наконец, также возможно использование соединений общей формулы (I) для профилактики и/или терапии диабета, особенно сахарного диабета.
Таким образом, настоящее изобретение также относится к использовании веществ общей формулы (I) при получении лекарственных средств и фармацевтических композиций для профилактики и/или лечения вышеназванной картины заболеваний.
Кроме того, настоящее изобретение относится к способу профилактики и/или лечения вышеназванной картины заболеваний с использованием веществ общей формулы (I).
Фармацевтическая активность вышеназванных соединений общей формулы (I) объяCHяется их активностью в качестве селективных лигандов к отдельным или многим субтипам рецепторов аденозина, особенно в качестве селективных лигандов к рецепторам аденозина-А1, аденозина-А2а и/или аденозина-А2b, предпочтительно в качестве селективных лигандов к рецепторам аденозина-А1 и/или аденозина-А2b.
В рамках настоящего изобретения под «селективными» понимают такие лиганды рецептора аденозина, у которых, с одной стороны, наблюдают четкое действие в отношении одного или нескольких субтипов рецептора аденозина, и с другой стороны, не наблюдают или наблюдают незначительное действие в отношении одного или нескольких других субтипов рецептора аденозина, причем относительно методов исследования функциональной селективности ссылка на методы исследования, описанные в разделе А. II.
Вещества общей формулы (I) действуют намного селективное, чем лиганды рецептора аденозина, известные из данного уровня техники. Таким образом, например, соединения общей формулы (I), в которой R4 является алкилом с 1-4 атомами углерода, который замещен группой формулы -C(O)NR6R7, причем R6 и R7 одинаковы или различны и являются водородом или, в случае необходимости, замещенным алкилом с 1-3 атомами углерода, обычно селективно действуют в отношении рецепторов аденозина-А2b.
С другой стороны, соединения общей формулы (I), в которой R4 является алкилом с 1-4 атомами углерода, который замещен одной или несколькими группами гидрокси, обычно селективно действует в отношении рецепторов аденозина-А1.
В свою очередь, соединения общей формулы (I), R4 является алкилом с 1-4 атомами углерода, который замещен имидазолилом или, в случае необходимости, замещенным бензилом, обычно селективно действует в отношении рецепторов аденозина-А1 и аденозина-А2b.
Возможно определение данной селективности рецепторов посредством биохимического измерения внутриклеточного содержания информационного вещества цАМФ в клетках, которые специфически исследуют только один субтип рецепторов аденозина. Причем в случае агонистов наблюдают повышение внутриклеточного содержания цАМФ, а в случае антагонистов наблюдают понижение внутриклеточного содержания цАМФ после предварительной стимуляции аденозином или веществами, подобными аденозину (см. публикации В. Kull, G. Arslan, С. Nilsson, С. Owman, A. Lorenzen, U. Schwabe, В. В. Fredholm, «Differences in the order of potency for agonists but not antagonists at human and rat adenosine A2A receptors», Bio-chem. Pharmacol., 57 (1999) Seiten 65-75; und S.P. Alexander, J. Cooper, J. Shine, S.J. Hill, "Characterization of the human brain putative A2B adenosine receptor expressed in Chinese hamster ovary (CHO.A2B4) cells», Br. J. Pharmacol., 119 (1996) Seiten, содержание которых включено в качестве ссылки).
Поэтому объектом настоящего изобретения также является использование селективных лигандов рецептора аденозина, особенно селективных лигандов рецептора аденозина-А1, аденозина-А2а и/или аденозина-А2b, при получении лекарственных средств и фармацевтических композиций для профилактики и/или лечения заболеваний, например, особенно заболеваний сердечно-сосудистой системы (кардиососудистых заболеваний); заболеваний мочеполовой системы; воспалительных и нейровоспалительных заболеваний; нейродегенеративных заболеваний; заболеваний дыхательных путей; фиброза печени, цирроза печени; рака; и, наконец, диабета, особенно сахарного диабета, причем относительно отдельных областей индикаций ссылка также на вышеуказанное изложение.
Таким образом, соединения общей формулы (I), которые селективно связаны с рецепторами аденозина-А1, являются подходящими предпочтительно для воздействия на миокард и для профилактики и/или лечения тахикардии, предсердной аритмии, сердечной недостаточности, острой почечной недостаточности, диабета, а также болевых синдромов. С другой стороны, соединения общей формулы (I), которые селективно связаны с рецепторами аденозина-А2а, являются подходящими предпочтительно для профилактики и/или лечения тромбоэмболитических заболеваний, нейродегенеративных заболеваний, таких как болезнь Паркинсона, а также для заживления ран. Кроме того, соединения общей формулы (I), которые селективно связаны с рецепторами аденозина-А2b, являются подходящими предпочтительно для профилактики и/или лечения фиброза печени, инфаркта сердца, нейровоспалительных заболеваний, таких как болезнь Альцгеймера, мочеполового недержания, а также заболеваний дыхательных путей, например, таких как астма и хронический бронхит.
Другим объектом настоящего изобретения являются лекарственные средства и фармацевтические препаративные формы, которые содержат, по крайней мере, один селективный лиганд рецептора аденозина и/или аденозина-А2b, предпочтительно, по крайней мере, одно соединение общей формулы (I), вместе с одним или несколькими фармакологически приемлемыми вспомогательными веществами или носителями, а также способ их использования для вышеуказанных целей.
Для введения соединений общей формулы (I) используют все обычные формы использования, то есть оральное применение, парентеральное применение, ингаляцию, носовое применение, подъязычное применение, прямокишечное введение или наружное применение, например, чрескожное применение, наиболее предпочтительно оральное или парентеральное применение. При парентеральном применении предпочтительным является внутривенный, внутримышечный, подкожный способ, например, в качестве подкожного депо. Совершенно предпочтительным является оральный способ применения.
Причем активные вещества могут быть выданы самостоятельно или в форме композиций. Для орального применения в качестве композиций подходящими являются, в частности, таблетки, капсулы, пилюли, драже, грануляты, твердые или жидкие аэрозоли, сиропы, эмульсии, суспензии и растворы. Причем количество активного вещества должно быть оптимальным для достижения терапевтического эффекта. Обычно концентрация активного вещества составляет от 0,1 до 100 мас.%, особенно от 0,5 до 90 мас.%, предпочтительно от 5 до 80 мас.%. Предпочтительная концентрация активного вещества должна составлять от 0,5 до 90 мас.%, то есть количество активного вещества должно быть достаточным для получения указанных возможностей дозировки.
Для данной цели возможно превращение активных веществ известным способом в обычные композиции. Такие превращения проводят с применением инертных, нетоксичных, фармацевтически подходящих носителей, вспомогательных веществ, растворителей, лекарственных основ, эмульгаторов и/или диспергаторов.
В качестве вспомогательных веществ подходящими являются, например, вода, нетоксичные органические растворители, например, такие как парафины, растительные масла (например, кунжутное масло), спирты (например, этанол, глицерин), гликоли (например, полиэтиленгликоль), твердые носители, такие как природные или синтетические порошкообразные вещества из горных пород (например, тальк и силикаты), сахар (например, молочный сахар), эмульгаторы, диспергаторы (например, поливинилпирролидон) и смазки (например, сульфат магния).
В случае орального применения таблетки, разумеется, также могут содержать добавки, например, такие как цитрат натрия, вместе с наполнителями, такими как крахмал, желатин и тому подобные. Кроме того, при оральном применении водные композиции могут быть смешены с добавками для улучшения вкуса или красителями.
Для достижения эффективных результатов при парентеральном применении предпочтительное количество лекарственного средства обычно составляет от около 0,1 до около 10000 мкг/кг, предпочтительно от около 1 до около 1000 мкг/кг, особенно от около 1 до около 100 мкг/кг массы тела. При оральном применении количество лекарственного средства составляет от около 0,1 до около 10 мг/кг, предпочтительно от около 0,5 до 5 мг/кг, особенно от около 1 до около 4 мг/кг веса тела.
Несмотря на вышесказанное, в случае необходимости, возможны отклонения от указанного количества, а именно в зависимости от веса тела, способа применения, индивидуальной реакции на активное вещество, вида композиции и времени или интервала, по которым проводят применение.
Следующие примеры более подробно пояCHяют настоящее изобретение, однако никоим образом не ограничивают его, а только помогают лучше понять данное изобретение.
А. Анализ физиологической активности
I. Подтверждение кардиососудистого действия
Исследование Лангендорфа на сердце крысы
У крыс под наркозом после вскрытия грудной клетки быстро вынимают сердце и помещают его в обычный аппарат Лангендорфа. В коронарных артериях поддерживают постоянный кровоток (10 мл/мин) и полученное перфузийное давление регистрируют с помощью соответствующего датчика давления. В данном исследовании понижение перфузийного давления соответствует релаксации коронарных артерий. Одновременно с помощью баллона, введенного в левый желудочек сердца, и другого датчика давления измеряют давление в желудочке, возникающее во время каждого сокращения. Частоту изолированного бьющегося сердца определяют на основе расчета числа сокращений на единицу времени.
В данном исследовании получают следующие значения коронарного перфузийного давления (указанное в процентах значение относится к процентному понижению коронарного перфузийного давления при соответствующей концентрации):
R3 =пара-CH3
R4 = -CH2-CH(OH)(CH2OH)
(соединение из примера А198)
R3 = пара-CH3
R4 = -CH2-фенил (соединение из примера А189)
R3 = мета-ОН
R4 = -CH2-CH2OH (соединение из примера А 43)
R3 = пара-ОН
R4 = -CH2-CH2OH (соединение из примера А 21)
R3 = пара-ОН
R4 = 2-имидазолилметил (соединение из примера А 379)
Исследуемые вещества в указанных концентрациях не оказывают действия ни на давление в левом желудочке сердца, возникающее во время сокращений, ни на частоту сердечных сокращений. Вследствие этого доказано, что вещества селективно воздействуют только на коронарный кровоток.
II. Подтверждение селективности рецепторов (селективности рецепторов аденозина А1, А2а, А2b и A3)
Клетки перманентной линии CHO (китайского хомячка Ovary) стабильно совмещают с кДНК для субтипов рецепторов аденозина А1, А2а, А2b и A3. Связь веществ с субтипами рецептора А2а или А2b определяют измерением внутриклеточного содержания цАМФ в данных клетках с помощью условного радиоиммунного пробирочного анализа (cAMP-RIA, IBL GmbH, Hamburg, Deutschland).
В случае действия веществ в качестве агонистов происходит связь веществ с понижением внутриклеточного содержания цАМФ. В случае соединения сравнения в данных исследованиях используют соединение аналогичное аденозину NECA (5-N-этилкарбоксамидо-аденозин), которое не селективно, но с высоким сродством связано со всеми субтипами рецепторов аденозина и обладает агонистическим действием (Klotz, K.N., Hessling, J., Hegler, J., Owman, C., Kull, В., Fredholm, B.B., Lohse, M.J., Comparative pharmacology of human adenosine receptor subtypes - characterization of stably transfected receptors in CHO cell, Naunyn Schmiedeberg Arch Pharmacol, 357 (1998), 1-9).
Рецепторы аденозина А1 и A3 связаны с Gi-протеином, то есть стимуляция данных рецепторов приводит к ингибированию аденилатциклазы и вследствие к понижению внутриклеточного уровня цАМФ. Для идентификации агонистов А1/А3-рецетора аденилатциклазу стимулируют форсколином. Однако дополнительная стимуляция А1/А3-рецепторов ингибирует аденилатциклазу, так что агонисты А1/А3-рецептора могут быть определены сравнительно низким содержанием клеток с цАМФ.
Для подтверждения антагонистического действия рецепторов аденозина совмещенные, рекомбинационные клетки предварительно стимулируют NECA и исследуют действие веществ на сокращение внутриклеточного содержания цАМФ. В качестве соединения сравнения в данных исследованиях применяют ХАС (родственный ксантинамину), которое не селективно, но с высоким сродством связано со всеми субтипами рецептора аденозина и обладает антагонистическим действием (Muller, C.E., Stein, В., Adenosine receptor antagonists: structures and potential therapeutic applications, Current Pharmaceutical design, 2 (1996), 501-530).
В нижеследующих исследованиях определяют внутриклеточное содержание цАМФ в клетках CHO, которые совмещают с кДНК для А2b-рецептора. Процентной концентрация цАМФ во всех ячейках углубления плиты для микротитрования указана относительно контрольного значения без воздействия предложенных веществ:
R3 = пара-OH
R4 = -CH2-C(O)NH2 (соединение из примера А1)
R3 = пара-ОН
R4 = -CH2-CH2OH (соединение из примера А 21)
R3 = мета-ОН
R4 = -CH2-CH2OH (соединение из примера А 43)
R3 = мета-ОН
R4 = -CH2-CH(CH2)ОН (соединение из примера А 46)
R3 = водород
R4 = -CH2-CH2OH (соединение из примера А 104)
R3 = пара-ОН
R4 = 2-имидазолилметил (соединение из примера А 379)
В указанных исследованиях действие всех веществ блокировано неселективными, но высокоспецифическими для рецепторов аденозина антагонистами ХАС.
В нижеследующих исследованиях определяют внутриклеточное содержание цАМФ в клетках CHO, которые совмещают с кДНК для А2а-рецептора. Процентная концентрация цАМФ во всех ячейках углубления плиты для микротитрования указана относительно контрольного значения без воздействия предложенных веществ

R3 = пара-OH
R4 = -CH2-C(O)NH2 (соединение из примера А1)
R3 = пара-ОН
R4 = -CH2-CH2OH (соединение из примера А 21)
R3 = мета-ОН
R4 = -CH2-CH2OH (соединение из примера А 43)
R3 = мета-ОН
R4 = -CH2-CH(CH3)ОН (соединение из примера А 46)
R3 = водород
R4 = -CH2-CH2OH (соединение из примера А 104)
R3 = пара-ОН
R4 = 2-имидазолилметил (соединение из примера А 379)
В указанных исследованиях действие всех веществ блокировано неселективными, но высокоспецифическими для рецепторов аденозина антагонистами ХАС.
В следующих исследованиях определяют внутриклеточное содержание цАМФ в клетках CHO, которые совмещают с кДНК для А1-рецептора. Процентная концентрация цАМФ во всех ячейках углубления плиты для микротитрования указана относительно контрольного значения без воздействия предложенных веществ, но после предварительной стимуляции 1 мкМ форсколином в течение 15 мин (для данных измерений содержание цАМФ без предварительной стимуляции форсколином составляет 18%):

R3 = мета-ОН
R4 = -CH2-CH2OH (соединение из примера А 43)
R3 = водород
R4 = -CH2-CH2OH (соединение из примера А 104)
R3 = пара-ОН
R4 = 2-имидазолилметил (соединение из примера А 379)
Таким образом, соединение из примера А1 оказывает четкий агонистический эффект на клетки, которые исследуют рецептор аденозина А2b, и практически никакого эффекта на клетки с А2а-рецептором. Напротив, соединения из примера А 43 и А 104 оказывают четкий агонистический эффект на клетки с А1 -рецептором, практически никакого эффекта на клетки с А2а-рецептором и более слабый эффект на клетки с А2b-рецептором, и, таким образом являются селективными агонистами рецептора аденозина А1. С другой стороны, соединение из примера А 379 демонстрирует четкий агонистический эффект на клетки с А2b-рецептором, практически никакого эффекта на клетки с А2а-рецептором и сравнительно слабый эффект на клетки с А1-рецептором, и, таким образом, является селективным агонистом рецептора аденозина А2b.
В. Примеры синтеза
Пример 1
2-{[6-Амино-3,5-дициано-4-(4-гидроксифенил)-2-пиридинил]сульфанил}-N-метилацетамид
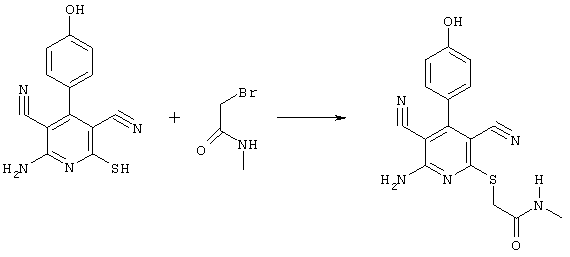
53,6 мг (0,2 ммоль) 2-амино-4-(4-гидроксифенил)-6-сульфанил-3,5-пири-диндикарбонитрила и 45,6 мг (0,3 ммоль) N-метилбромацетамида перемешивают в 0,5 мл диметилформамида (ДМФ) вместе с 33,6 мг (0,4 ммоль) NaHCO3 в течение 4 часов при комнатной температуре (КТ). Тонкослойная хроматография (ТХ) (CH2Cl2/CH3ОН 10:1) показывает полное превращение. Полученный продукт разбавляют водой и сложным эфиром уксусной кислоты (ЕЕ), ЕЕ-фазу сушат MgSO4 и выпаривают в вакууме. Остаток кристаллизуют из метанола.
Выход: 45 мг (66,3% по теории) белых кристаллов.
Масс-спектр: искомая молярная масса: 339, найденная [М+Н]+=340,3.
Пример 2
2-{[6-Амино-3,5-дициано-4-(4-гидроксифенил)-2-пиридинил]сульфанил}-N,N-диэтилацетамид
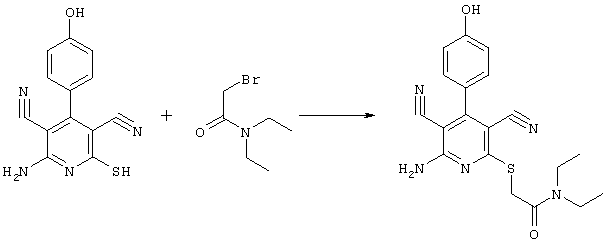
53,6 мг (0,2 ммоль) 2-амино-4-(4-гидроксифенил)-6-сульфанил-3,5-пиридиндикарбонитрила и 58,2 мг (0,3 ммоль) N,N-диэтилбромацетамида перемешивают в 0,5 мл ДМФ вместе с 33,6 мг (0,4 ммоль) NaHCO3 в течение 4 часов при KT. ТХ-контроль (CH2Cl2/CH3ОН 10:1) показывает полное превращение. Полученный продукт разбавляют водой и сложным эфиром уксусной кислоты (ЕЕ), ЕЕ-фазу сушат MgSO4 и выпаривают в вакууме. Остаток кристаллизуют из метанола.
Выход: 50 мг (65,5% по теории) белых кристаллов.
Масс-спектр: искомая молярная масса: 381, найденная [М+Н]+=382.
Пример 3
2{[6-амино-3,5-дициано-4-(4-гидроксифенил)-2-пиридинил]сульфанил}-N-этилацетамид
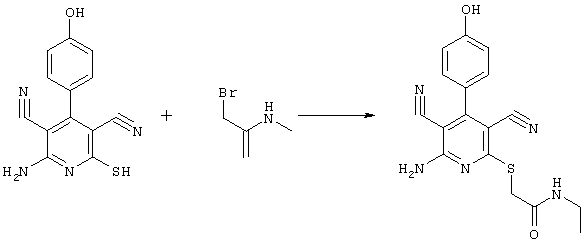
0,76 г (2 ммоль) 2-амино-4-(4-гидроксифенил)-6-сульфанил-3,5-пиридинди-карбонитрила и 0,5 г (3 ммоль) N-этилбромацетамида перемешивают в 5 мл ДМФ вместе с 0,34 г (4 ммоль) NaHCO3 в течение 4 часов при KT. Затем смесь разбавляют водой и экстрагируют сложным эфиром уксусной кислоты, фазу сложного эфира уксусной кислоты сушат MgSO4 и выпаривают в вакууме. После выпаривания твердый остаток перемешивают с метанолом. Кристаллы отделяют и сушат в вакууме.
Выход: 0,49 г (69,5% по теории) кристаллов.
Масс-спектр: искомая молярная масса: 353, найденная [M+H]+=354,2.
Пример 4
2-амино-6-[(2-аминоэтил)сульфанил]-4-(4-гидроксифенил)-3,5-пиридиндикарбонитрил
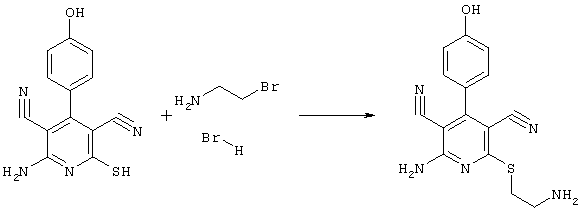
268 мг (1 ммоль) 2-амино-4-(4-гидроксифенил)-6-сульфанил-3,5-пиридин-дикарбонитрила, 105 мг (1 ммоль) 2-бромэтиламин-гидробромида и 168 мг (2 ммоль) NaHCO3 перемешивают в 1 мл ДМФ в течение 1 часа. Полученный продукт разбавляют несколькими миллилитрами 1Н HCI. Кристаллы отделяют и сушат в вакууме.
Выход: 200 мг (64,2% по теории) желтых кристаллов.
Масс-спектр: искомая молярная масса: 311, найденная [M+H]+=312.
Пример 5
N-(2-{[6-амино-3,5-дициано-4-(4-гидроксифенил)-2-пиридинил]-сульфанил}этил)-ацетамид
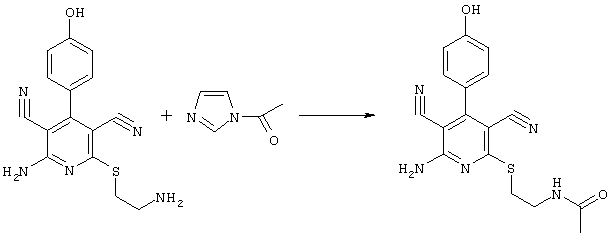
60 мг (0,2 ммоль) 2-амино-6-[(2-аминоэтил)сульфанил]-4-(4-гидроксифенил)-3,5-пиридиндикарбонитрила и 30 мг (0,3 ммоль) N-ацетилимидазола перемешивают в 0,5 мл ДМФ в течение 1 часа при KT. Затем к смеси медленно по каплям добавляют воду, после возникновения легкого помутнения полупродукт выкристаллизовывают, затем отделяют, промывают водой и сушат в вакууме. Получают 53 мг желтых кристаллов. Кристаллы растворяют в 1 мл CH2Cl2/CH3ОН (смесь 1:1) и смешивают с несколькими каплями концентрированного аммиака (удаляют диацилированный пробочный продукт). Смесь перемешивают в течение 5 часов при KT. При концентрировании реакционного раствора продукт выкристаллизовывают, затем отделяют и промывают метанолом.
Выход: 37 мг (52,3% по теории) почти белых кристаллов.
Масс-спектр: искомая молярная масса: 353, найденная [M+H]+=354.
Пример 6
2-{[6-амино-3,5-дициано-4-(4-гидроксифенил)-2-пиридинил]сульфанил}-метил)-карбамат
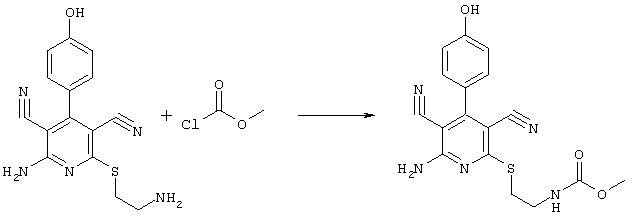
31,1 мг (0,1 ммоль) 2-амино-6-[(2-аминоэтил)сульфанил]-4-(4-гидроксифенил)-3,5-пиридиндикарбонитрила суспендируют в 1-2 мл дихлорметана в присутствии аргона при KT и охлаждают при температуре от -20 до -25°С. Затем к полученной смеси добавляют 30,3 мг (0,3 ммоль) триэтиламина и 28,3 мг (0,3 ммоль) сложного метилового эфира хлормуравьиной кислоты при указанной температуре. Смесь перемешивают дополнительно в течение 30 минут при температуре -20°С, затем позволяют полученной смеси прибывать в течение 1 часа при температуре 0°С. Продукт концентрируют в вакууме, смешивают с 4 мл 2-молярного раствора NH3 в метаноле и перемешивают в течение 1 часа при комнатной температуре. Затем продукт концентрируют, растворяют в 600 мкл ДМСО и очищают препаративной ЖХВР.
Условия ЖХВР:
Колонка: GROM-SIL 120 ODS 4 НЕ 5 мк 50x20 мм
Первичная колонка: GROM-SIL ODS 4 НЕ 5 мк 10x20 мм
Длина волны: 220 нм
Скорость потока: 25 мл/мин
Градиент: А = ацетонитрил +0,1% трифторуксусной кислоты
В = вода +0,1% трифторуксусной кислоты
0 мин: 10% А; 1,75 мин 10% А; 5,5 мин 90% А; 8 мин 90% А; 8,1 мин 10% А; 9 мин 10% А
Объем инъекции: 600 мкл раствора ДМСО
Выход: 21,7 мг (58,7% по теории) продукта
Масс-спектр: искомая молярная масса: 369, найденная [М+Н]+=370,1.
Пример 7
2-{[6-амино-3,5-дициано-4-(4-гидроксифенил)-2-пиридинил]сульфанил}-этил)-карбамат
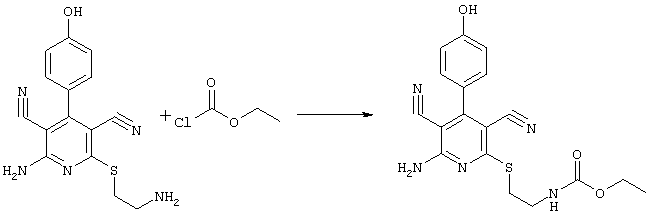
31,1 мг (0,1 ммоль) 2-амино-6-[(2-аминоэтил)сульфанил]-4-(4-гидроксифенил)-3,5-пиридиндикарбонитрила суспендируют в 1-2 мл дихлорметана в присутствии аргона при KT и охлаждают при температуре от -20 до -25°С. Затем к полученной смеси добавляют 30,3 мг (0,3 ммоль) триэтиламина и 32,6 мг (0,3 ммоль) сложного метилового эфира хлормуравьиной кислоты при указанной температуре. Смесь перемешивают дополнительно в течение 30 минут при температуре -20°С, затем позволяют полученной смеси прибывать в течение 1 часа при температуре 0°С. Продукт концентрируют в вакууме, смешивают с 4 мл 2-молярного раствора NH3 в метаноле и перемешивают в течение 1 часа при KT. Затем продукт концентрируют, растворяют в 600 мкл ДМСО и очищают препаративной ЖХВР.
Условия ЖХВР:
Колонка: GROM-SIL 120 ODS 4 НЕ 5 мк 50x20 мм
Первичная колонка: GROM-SIL ODS 4 НЕ 5 мк 10x20 мм
Длина волны: 220 нм
Скорость потока: 25 мл/мин
Градиент: А = ацетонитрил +0,1% трифторуксусной кислоты
В = вода +0,1% трифторуксусной кислоты
0 мин: 10% А; 1,75 мин 10% А; 5,5 мин 90% А; 8 мин 90% А; 8,1 мин 10% А; 9 мин 10% А
Объем инъекции: 600 мкл раствора ДМСО
Выход: 20,5 мг (53,5% по теории) продукта
Масс-спектр: искомая молярная масса: 383, найденная [М+Н]+=384,2.
Пример 8
4-[2-амино-3,5-дициано-6-({2-[(метоксикарбонил)амино]этил}сульфанил)-4-пиридинил]фенил-метилкарбонат
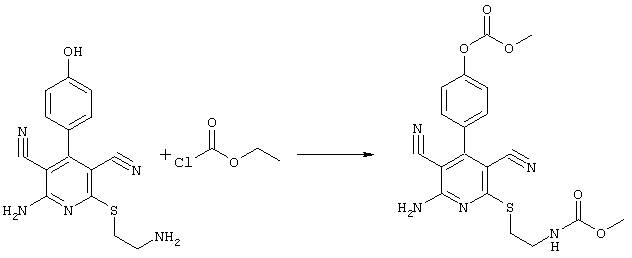
31,1 мг (0,1 ммоль) 2-амино-6-[(2-аминоэтил)сульфанил]-4-(4-гидроксифенил)-3,5-пиридиндикарбонитрила суспендируют в 1-2 мл дихлорметана в присутствии аргона при KT и охлаждают при температуре от -20 до -25°С. Затем к полученной смеси добавляют 10,1 мг (0,1 ммоль) триэтиламина и 9,4 мг (0,1 ммоль) сложного метилового эфира хлормуравьиной кислоты при указанной температуре. Смесь перемешивают дополнительно в течение 30 минут при температуре -20°С, затем позволяют полученной смеси прибывать в течение 1 часа при температуре 0°С. Затем продукт концентрируют, растворяют в 600 мкл ДМСО и очищают препаративной ЖХВР.
Условия ЖХВР:
Колонка: GROM-SIL 120 ODS 4 НЕ 5 мк 50x20 мм
Первичная колонка: GROM-SIL ODS 4 НЕ 15 мк 10x20 мм
Длина волны: 220 нм
Скорость потока: 25 мл/мин
Градиент: А = ацетонитрил +0,1% трифторуксусной кислоты
В = вода +0,1% трифторуксусной кислоты
0 мин: 10% А; 1,75 мин 10% А; 5,5 мин 90% А; 8 мин 90% А; 8,1 мин 10% А; 9 мин 10% А
Объем инъекции: 600 мкл раствора ДМСО
Выход: 11,2 мг (26,2% по теории) продукта
Масс-спектр: искомая молярная масса: 427, найденная [M+H]+=428,2.
Пример 9
4-[2-амино-3,5-дициано-6-({2-[(метоксикарбонил)амино]этил}сульфанил)-4-пиридинил]фенил-этилкарбонат
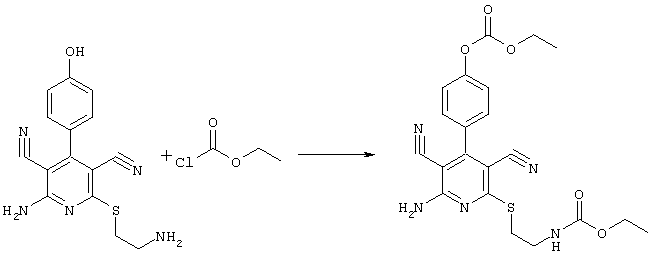
31,1 мг (0,1 ммоль) 2-амино-6-[(2-аминоэтил)сульфанил]-4-(4-гидроксифенил)-3,5-пиридиндикарбонитрила суспендируют в 1-2 мл дихлорметана в присутствии аргона при KT и охлаждают при температуре от -20 до -25°С. Затем к полученной смеси добавляют 10,1 мг (0,1 ммоль) триэтиламина и 10,9 мг (0,1 ммоль) сложного метилового эфира хлормуравьиной кислоты при указанной температуре. Смесь перемешивают дополнительно в течение 30 минут при температуре -20°С, затем позволяют полученной смеси прибывать в течение 1 часа при температуре 0°С. Затем продукт концентрируют, растворяют в 600 мкл ДМСО и очищают препаративной ЖХВР.
Условия ЖХВР:
Колонка: GROM-SIL 120 ODS 4 НЕ 5 мк 50x20 мм
Первичная колонка: GROM-SIL ODS 4 НЕ 15 мк 10x20 мм
Длина волны: 220 нм
Скорость потока: 25 мл/мин
Градиент: А = ацетонитрил +0,1% трифторуксусной кислоты
В = вода + 0,1% трифторуксусной кислоты
0 мин: 10% А; 1,75 мин 10% А; 5,5 мин 90% А; 8 мин 90% А; 8,1 мин 10% А; 9 мин 10% А
Объем инъекции: 600 мкл раствора ДМСО
Выход: 15,2 мг (33,4% по теории) продукта
Масс-спектр: искомая молярная масса: 455, найденная [М+Н]+=456,2.
Пример 10
N-(2{[6-амино-3,5-дициано-4-(4-гидроксифенил)-2-пиридинил]сульфанил}этил)-мочевина
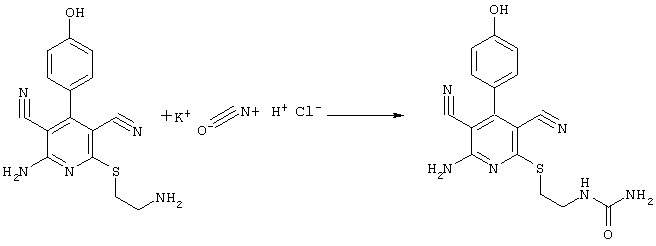
31,1 мг (0,1 ммоль) 2-амино-6-[(2-аминоэтил)сульфанил]-4-(4-гидроксифенил)-3,5-пиридиндикарбонитрила суспендируют в 0,91 мл 1 Н HCI и смешивают с 8,1 мг (0,1 ммоль) цианата калия. К смеси добавляют несколько капель метанола и перемешивают в течение 10 часов при температуре 50°С. Кристаллы отделяют и промывают водой и простым эфиром.
Выход: 16 мг (45,1% по теории) продукта
Масс-спектр: искомая молярная масса: 354, найденная [M+H]+=355,1.
Пример 11
N-(2-{[6-амино-3,5-дициано-4-(4-гидроксифенил)-2-пиридинил]сульфанил}этил)-N'-метилмочевина
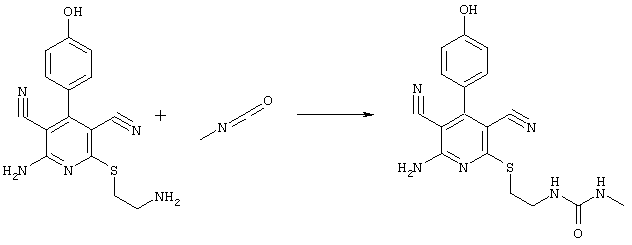
62,2 мг (0,2 ммоль) 2-амино-6-[(2-аминоэтил)сульфанил]-4-(4-гидроксифенил)-3,5-пиридиндикарбонитрила суспендируют в 0,4 мл ДМФ и смешивают с 11,4 мг (0,2 ммоль) метилизоциаката при комнатной температуре. Полученную смесь перемешивают в течение ночи, фильтруют и очищают препаративной ЖХВР.
Условия ЖХВР:
Колонка: GROM-SIL 120 ODS 4 НЕ 5 мк 50x20 мм
Первичная колонка: GROM-SIL ODS 4 НЕ 15 мк 10x20 мм
Длина волны: 220 нм
Скорость потока: 25 мл/мин
Градиент: А = ацетонитрил + 0,1% трифторуксусной кислоты
В = вода +0,1% трифторуксусной кислоты
0 мин: 10% А; 1,75 мин 10% А; 5,5 мин 90% А; 8 мин 90% А; 8,1 мин 10% А; 9 мин 10% А
Объем инъекции: 400 мкл раствора ДМФ
Выход: 45,9 мг (62,3% по теории) продукта
Масс-спектр: искомая молярная масса: 368, найденная [М+Н]+=369,2.
Пример 12
N-(2-{[6-амино-3,5-дициано-4-(4-гидроксифенил)-2-пиридинил]сульфанил}этил)-N'-метилмочевина

62,2 мг (0,2 ммоль) 2-амино-6-[(2-аминоэтил)сульфанил]-4-(4-гидроксифенил)-3,5-пиридиндикарбонитрила суспендируют в 0,4 мл ДМФ и смешивают с 14,2 мг (0,2 ммоль) этилизоцианата при комнатной температуре. Полученную смесь перемешивают в течение ночи, фильтруют и очищают препаративной ЖХВР.
Условия ЖХВР:
Колонка: GROM-SIL 120 ODS 4 НЕ 5 мк 50x20 мм
Первичная колонка: GROM-SIL ODS 4 НЕ 15 мк 10x20 мм
Длина волны: 220 нм
Скорость потока: 25 мл/мин
Градиент: А = ацетонитрил +0,1% трифторуксусной кислоты
В = вода + 0,1% трифторуксусной кислоты
0 мин: 10% А; 1,75 мин 10% А; 5,5 мин 90% А; 8 мин 90% А; 8,1 мин 10% А; 9 мин 10% А
Объем инъекции: 400 мкл раствора ДМФ
Выход: 37,6 мг (49,2% по теории) продукта
Масс-спектр: искомая молярная масса: 382, найденная [М+Н]+=383,2.
Пример 13
3,5-дициано-4-(3,5-дихлор-4-гидроксифенил)-2-карбамоилметил-6-аминопиридин
337,2 мг (1 ммоль) 2-амино-4-(3,5-дихлор-4-гидроксифенил)-6-сульфанил-3,5-пиридиндикарбонитрила и 207 мг (1,5 ммоль) бромацетамида растворяют в 4 мл ДМФ, смешивают с 336 мг (4 ммоль) NaHCO3 и перемешивают в течение 8 часов при KT. Смесь разбавляют водой и промывают сложным этиловым эфиром уксусной кислоты. Водную фазу подкисляют 1Н HCI, полученные кристаллы отделяют и сушат.
Выход: 180 мг (45,7% по теории) продукта
Масс-спектр: искомая молярная масса: 393, найденная [M+H]+=394,1.
Пример 14
2-[(6-амино-3,5-дициано-4-{4-[(4-метилпиперазин)сульфанил]фенил}-2-пиридинил)сульфанил]ацетамид
84 мг (0,163 ммоль) соли 2-амино-4-{4-[(4-метилпиперазино)сульфанил]фенил}-6-сульфанил-3,5-пиридиндикарбонитрил-N-метилморфолиния перемешивают вместе с 53,3 мг (0,244 ммоль) бромацетамида и 54,7 мг (0,65 ммоль) NaHCO3 в 0,5 мл ДМФ в течение ночи. После фильтрации реакционный раствор предварительно очищают препаративной ЖХВР. Изолированную фракцию выпаривают в вакууме, остаток очищают препаративной тонкослойной хроматографией.
Выход: 14 мг (18,2% по теории) продукта
Масс-спектр: искомая молярная масса: 471, найденная [М+Н]+=472,1.
Пример 15
2-[{6-амино-3,5-дициано-4-[-(пиперидинсульфонил)фенил]-2-пиридинил}-сульфанил)ацетамид
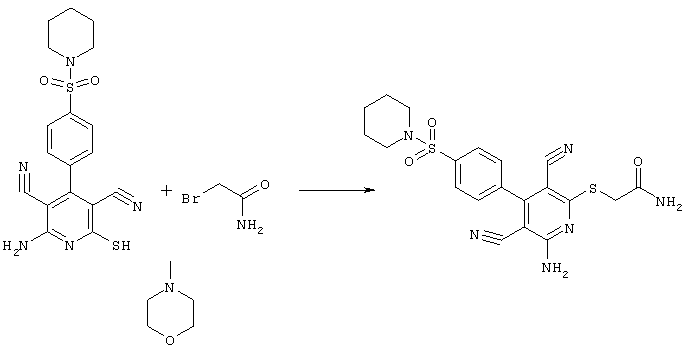
82 мг (0,164 ммоль) соли 2-амино-4-[4-(пиперидинсульфонил)фенил}-6-сульфанил-З.6-пиридиндикарбонитрил-М-метилморфолиния перемешивают вместе с 53,5 мг (0,246 ммоль) бромацетамида и 55 мг (0,65 ммоль) NaHCO3 в 0,5 мл ДМФ в течение ночи. После фильтрации реакционный раствор очищают препаративной ЖХВР.
Условия ЖХВР:
Колонка: GROM-SIL 120 ODS 4 НЕ 5 мк 50x20 мм
Первичная колонка: GROM-SIL ODS 4 НЕ 15 мк 10x20 мм
Длина волны: 220 нм
Скорость потока: 25 мл/мин
Градиент: А = ацетонитрил + 0,1% трифторуксусной кислоты
В = вода + 0,1% трифторуксусной кислоты
0 мин: 10% А; 1,75 мин 10% А; 5,5 мин 90% А; 8 мин 90% А; 8,1 мин 10% А; 9 мин 10% А
Объем инъекции: 400 мкл раствора ДМФ
Выход: 42,8 мг (57,2% по теории) продукта
ЯМР [400 MHz, ДМСО-d6]: 1,4 м (2Н), 1,6 м (4Н), 3,0 т (4Н), 3,9 с (2Н), 7,25 с (1Н), 7,5 с (1Н), 7,8 д (2Н), 7,9 д (2Н), 8,1 д широкий (2Н).
Пример 16
2-[{6-амино-3,5-дициано-4-[-(морфолинсульфонил)фенил]-2-пиридинил}-сульфанил)ацетамид
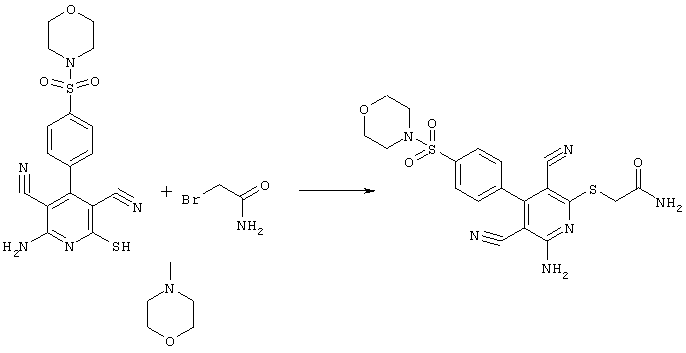
90 мг (0,179 ммоль) соли 2-амино-4-{4-(морфолинсульфонил)фенил}-6-сульфанил-3,5-пиридиндикарбонитрил-N-метилморфолиния перемешивают вместе с 58,5 мг (0,269 ммоль) бромацетамида и 60 мг (0,71 ммоль) NaHCO3 в 0,5 мл ДМФ в течение ночи. После фильтрации реакционный раствор очищают препаративной ЖХВР.
Условия ЖХВР:
Колонка: GROM-SIL 120 ODS 4 НЕ 5 мк 50x20 мм
Первичная колонка: GROM-SIL ODS 4 НЕ 15 мк 10x20 мм
Длина волны: 220 нм
Скорость потока: 25 мл/мин
Градиент: А = ацетонитрил +0,1% трифторуксусной кислоты
В = вода +0,1% трифторуксусной кислоты
0 мин: 10% А; 1,75 мин 10% А; 5,5 мин 90% А; 8 мин 90% А; 8,1 мин 10% А; 9 мин 10% А
Объем инъекции: 400 мкл раствора ДМФ
Выход: 43,7 мг (53,2% по теории) продукта
ЯМР [400 MHz, ДМСО-d6]: 2,9 тр (4Н), 3,65 тр (4Н), 3,9 с (2Н), 7,25 с (1Н), 7,5 с (1Н), 7,85 д (2Н), 7,95 д (2Н), 8,15 д широкий (2Н).
Пример 17
2-(4-{2-амино-6-[(2-амино-2-оксоэтил)сульфанил]-3,5-дициано-4-пиридинил}-фенокси)уксусная кислота
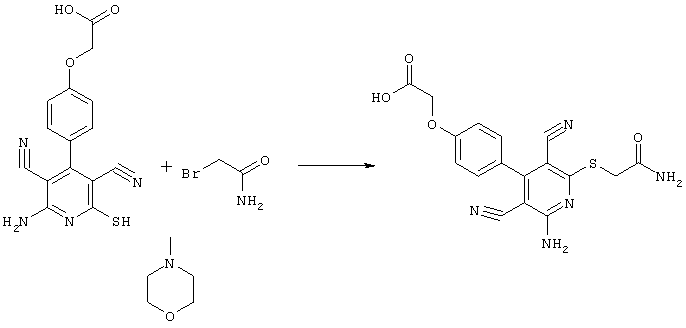
135 мг (0,316 ммоль) соли 2-(4-(2-амино-3,5-дициано-6-сульфанил-4-пиридинил)фенокси]-уксусной кислоты-N-метилморфолиния перемешивают вместе с 103,3 мг (0,474 ммоль) бромацетамида и 106,1 мг (1,263 ммоль) NaHCO3 в 0,5 мл ДМФ в течение ночи. После фильтрации реакционный раствор предварительно очищают препаративной ЖХВР. Изолированную фракцию выпаривают в вакууме, остаток очищают препаративной тонкослойной хроматографией.
Выход: 14 мг (11,6% по теории) продукта
Масс-спектр: искомая молярная масса: 383, найденная [М+Н]+=406,2.
Пример 18
4-{2-амино-6-[(2-амино-2-оксоэтил)сульфанил]-3,5-дициано-4-пиридинил}-бензойная кислота

72 мг (0,18 ммоль) соли 2-[4-(2-амино-3,5-дициано-6-сульфанил-4-пиридинил)фенокси]-уксусной кислоты-N-метилморфолиния перемешивают с 59,2 мг (0,27 ммоль) бромацетамида и 60,9 мг (0,72 ммоль) NaHCO3 в 0,5 мл ДМФ в течение ночи. После фильтрации реакционный раствор предварительно очищают препаративной ЖХВР. Изолированную фракцию выпаривают в вакууме, остаток очищают препаративной тонкослойной хроматографией.
Выход: 11 мг (17,2% по теории) продукта
Масс-спектр: искомая молярная масса: 353, найденная [М+Н]+=353,9.
Пример 19
4-{2-амино-6-[(2-амино-2-оксоэтил)сульфанил]-3,5-дициано-4-пиридинил}-метилбензоат
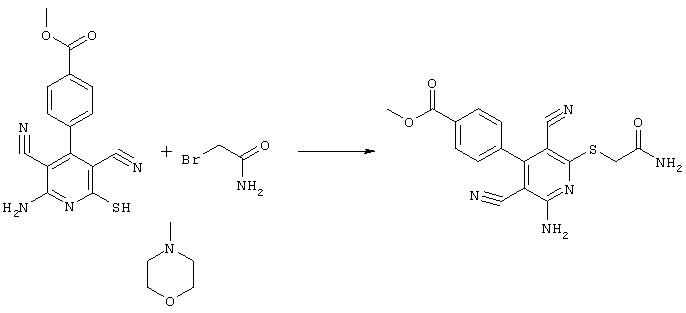
89 мг (0,216 ммоль) соли 4-(2-амино-3,5-дициано-6-сульфанил-4-пиридинил)-сложного метилового эфира бензойной кислоты-N-метилморфолиния перемешивают с 70,7 мг (0,324 ммоль) бромацетамида и 72,7 мг (0,86 ммоль) NaHCO3 в 0,5 мл ДМФ в течение ночи. После фильтрации реакционный раствор очищают препаративной ЖХВР.
Условия ЖХВР:
Колонка: GROM-SIL 120 ODS 4 НЕ 5 мк 50x20 мм
Первичная колонка: GROM-SIL ODS 4 НЕ 15 мк 10x20 мм
Длина волны: 220 нм
Скорость потока: 25 мл/мин
Градиент: А = ацетонитрил +0,1% трифторуксусной кислоты
В = вода + 0,1% трифторуксусной кислоты
0 мин: 10% А; 1,75 мин 10% А; 5,5 мин 90% А; 8 мин 90% А; 8,1 мин 10% А; 9 мин 10% А
Объем инъекции: 400 мкл раствора ДМФ
Выход: 40,4 мг (50,8% по теории) продукта
ЯМР [400 MHz, ДМСО-d6]: 3,9 с (2Н), 7,25 с (1Н), 7,5 с (1Н), 7,7 д (2Н), 8,1 д (2Н),8,1 с широкий (2Н).
Пример 20
2-({4-[4-ацетиламино)фенил]-6-амино-3,5-дициано-2-пиридинил}сульфанил)ацетамид
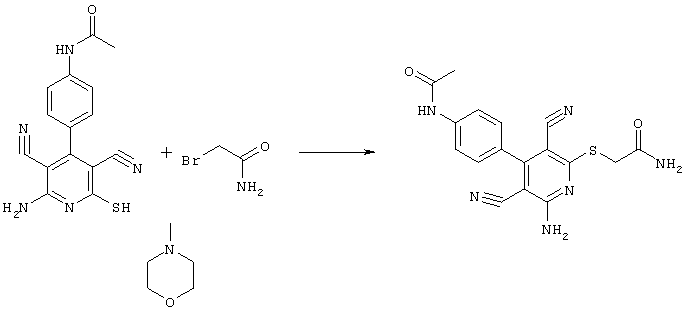
44 мг (0,11 ммоль) соли N-[4-(2-амино-3,5-дициано-6-сульфанил-4-пиридинил)фенил]-ацетамид-N-метилморфолиния перемешивают с 35 мг (0,16 ммоль) бромацетамида и 36 мг (0,43 ммоль) NaHCO3 в 0,5 мл ДМФ в течение ночи. После фильтрации реакционный раствор очищают препаративной ЖХВР.
Условия ЖХВР:
Колонка: GROM-SIL 120 ODS 4 НЕ 5 мк 50x20 мм
Первичная колонка: GROM-SIL ODS 4 НЕ 15 мк 10x20 мм
Длина волны: 220 нм
Скорость потока: 25 мл/мин
Градиент: А = ацетонитрил +0,1% трифторуксусной кислоты
В = вода + 0,1% трифторуксусной кислоты
0 мин: 10% А; 1,75 мин 10% А; 5,5 мин 90% А; 8 мин 90% А; 8,1 мин 10% А; 9 мин 10% А
Объем инъекции: 400 мкл раствора ДМФ
Выход: 18,3 мг (46,6% по теории) продукта
ЯМР [400 MHz, ДМСО-d6]: 2,1 с (3Н), 3,9 с (2Н), 7,25 с (1Н), 7,5 д (3Н), 7,7 д (2Н), 8,0 с широкий (2Н), 10,25 с (1Н).
Пример 21
2-Амино-6-[(2-гидроксиэтил)сульфанил1-4-(4-гидроксифенил)-3,5-пиридиндикарбонитрил
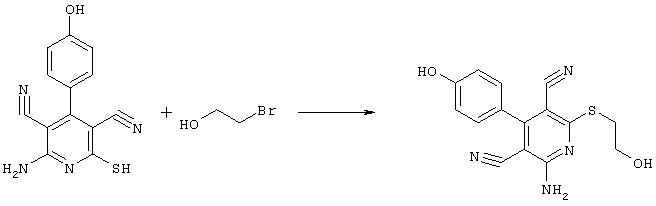
26,8 мг (0,1 ммоль) 2-амино-4-(4-гидроксифенил)-6-сульфанил-3,5-пиридиндикарбонитрила растворяют в 0,2 мл диметилфомамида. Затем к смеси добавляют 20 мг (0,238 ммоль) твердого гидрокарбоната натрия и раствор 18,74 мг (0,15 ммоль) 2-бромметанола в 0,06 мл диметилформамида.
Реакционную смесь взбалтывают в течение ночи, и после фильтрации очищают препаративной ЖХВР.
Условия ЖХВР:
Колонка: GROM-SIL 120 ODS 4 НЕ 5 мк 50x20 мм
Первичная колонка: GROM-SIL ODS 4 НЕ 15 мк 10x20 мм
Длина волны: 220 нм
Скорость потока: 25 мл/мин
Градиент: А = ацетонитрил +0,1% трифторуксусной кислоты
В = вода + 0,1% трифторуксусной кислоты
0 мин: 10% А; 1,75 мин 10% А; 5,5 мин 90% А; 8 мин 90% А; 8,1 мин 10% А; 9 мин 10% А
Объем инъекции: 300 мкл раствора ДМСО
Время удержания: 3,97 мин.
Выход: 14,1 мг (45,1% по теории) продукта
Масс-спектр: искомая молярная масса: 312, найденная [М+Н]+=313.
Пример 22
1. Стадия
N-[4-(2,2-дициановинил)фенил]ацетамид
32,6 г (0,2 моль) 4-ацетаминобензальдегида и 13,74 г (0,208 моль)нитрила малона помещают в 140 мл этанола и смешивают с 24 каплями пиперидина. Смесь перемешивают в течение 30 мин в присутствии флегмы. После охлаждения кристаллы отделяют и сушат.
Выход: 38,6 г (90,6% по теории) продукта
Масс-спектр: искомая молярная масса: 211, найденная [М+Н]+=212.
2. Стадия
N-{4-[2-амино-3,5-дициано-6-(фенилсульфанил)-4-пиридинил]фенил}-ацетамид
19 г (0,09 моль) N-[4-(2,2-дициановинил)фенил]ацетамида, 5,95 г (0,09 моль) нитрила малона и 9,91 г (0,09 моль) тиофенола помещают в 120 мл этанола и смешивают с 0,4 мл триэтиламина. Смесь перемешивают в течение 30 мин в присутствии флегмы, причем происходит кристаллизация. После охлаждения продукт отделяют и сушат в вакууме.
Выход: 10,25 г (29,6% по теории) продукта
Масс-спектр: искомая молярная масса: 385, найденная [М+Н]+=386.
3. Стадия
N-[4-(2-амино-3,5-дициано-6-сульфанил-4-пиридинил)фенил]-ацетамид

1,16 г (3 ммоль) N-{4-[2-амино-3,5-дициано-6-(фенилсульфанил)-4-пиридинил]фенил}-ацетамида растворяют в 10 мл ДМФ в присутствии аргона, добавляют 0,78 г (10 ммоль) сульфида натрия и перемешивают в течение 2 часов при температуре 80°С. Затем смесь смешивают с 20 мл 1Н HCl, полученные в результате кристаллы отделяют и сушат в вакууме.
Выход: 428 мг (46,1% по теории) продукта
Масс-спектр: искомая молярная масса: 309, найденная [M+H]+=310,1.
4. Стадия
Трифторацетат 2-[({4-[4-(ацетиламино)фенил]-6-амино-3,5-дициано-2-пиридинил}сульфанил)-метил]-1Н-имидазолил-1-ия
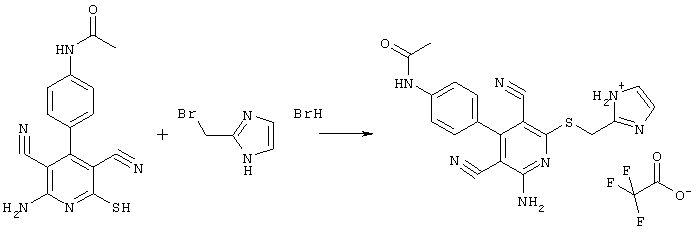
309 мг (1 ммоль) N-[4-(2-амино-3,5-дициано-6-сульфанил-4-пиридинил)-фенил]-ацетамида, 241 мг (1 ммоль) 2-(бромметил)-1Н-имидазол-гидробромида и 336 мг (4 ммоль) NaHCO3 перемешивают в 2 мл ДМФ при KT. Через 2 часа смесь разбавляют 4-5 мл воды, полученные кристаллы бежевого цвета отделяют и сушат в вакууме. Кристаллы (310 мг) растворяют в ДМСО и очищают препаративной ЖХВР в 9 инъекциях. Соответствующую фракцию выпаривают в вакууме, кристаллический остаток суспендируют в воде, отделяют и сушат в вакууме.
Условия ЖХВР:
Колонка: Kromasil 100 С18 5 мкм 50x20 мм
Первичная колонка: GROM-SIL ODS 4 НЕ 15 мк 10x20 мм
Длина волны: 220 нм
Скорость потока: 25 мл/мин
Градиент: А = ацетонитрил +0,1% трифторуксусной кислоты
В = вода + 0,1% трифторуксусной кислоты
0 мин: 10% А; 2 мин 10% А; 6 мин 90% А; 7 мин 90% А; 7,1 мин 10% А; 8 мин 10% А
Объем инъекции: 500 мкл раствора ДМСО
Время удержания: 3,6 мин.
Выход: 234 мг (60% по теории) продукта
Масс-спектр: искомая молярная масса: 389, найденная [М+Н]+=390,1.
1H-ЯМР [300 MHz, ДМСО-d6]: δ=2,1 с (3Н), 4,7 с (1Н), 7,4 д (1Н), 7,55 с (1Н),7,7д(2Н),8,1 с широкий (2Н), 10,25 с (1Н), 14,2 с широкий (1Н).
Соединения, приведенные в нижеследующих таблицах (примеры А 1 - А 377, А 378 - А 413 и В 1 - В 375) получают аналогично вышеописанным способам. Идентичность и чистоту соединений подтверждают ЖХ-МС.
Соединения примеров А 1 - А 413 или изолируют в виде кристаллов или, если они не кристаллизованы непосредственно из реакционного раствора, очищают препаративной ЖХВР.
Соединения примеров В 1 - В 375 получают в масштабе 10 мкмоль аналогично вышеописанным способам. Очистку и идентификацию таких соединений проводят посредством системы ЖХВР-МС.
В следующих таблицах в структурах, содержащих группу -N-, всегда подразумевают группу -NH-, а в структурах, содержащих группу -N, всегда подразумевают группу -NH2.
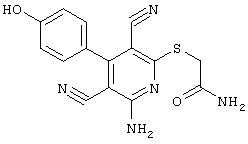
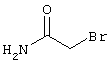
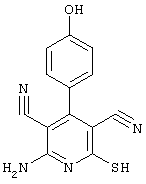
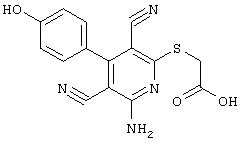
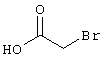

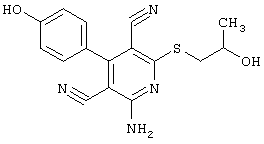
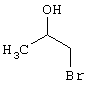

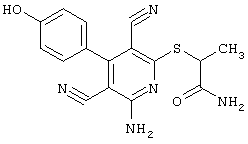
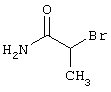

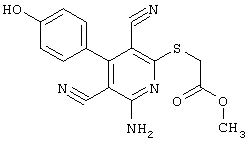
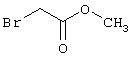

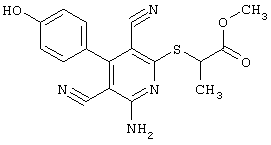


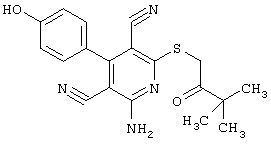
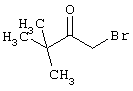

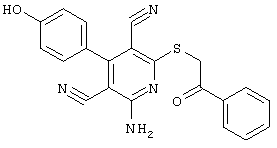

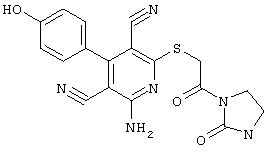

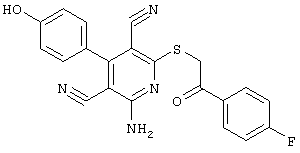



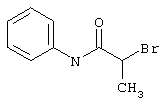

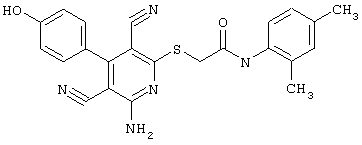
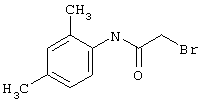

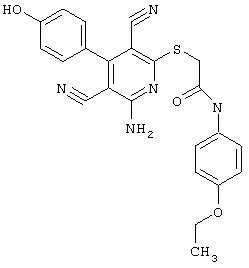
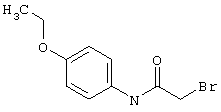

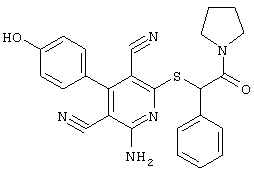


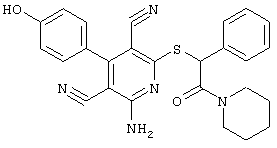
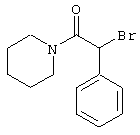


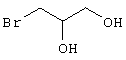

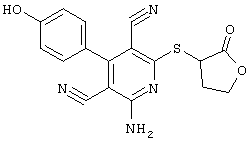
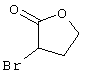

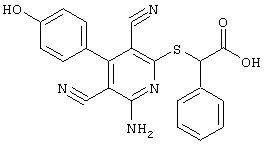
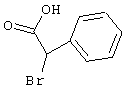

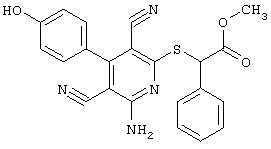
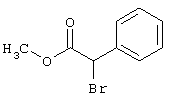

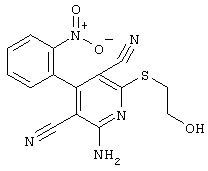

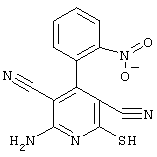

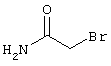

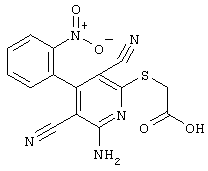
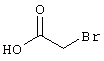

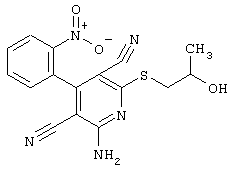
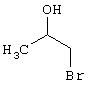



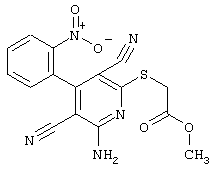
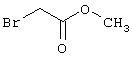

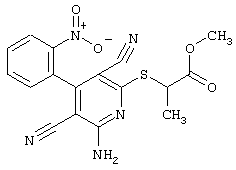
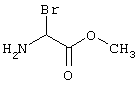

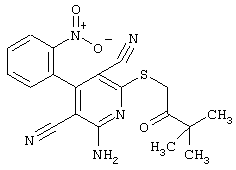
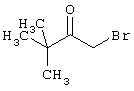

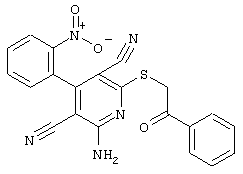
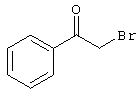

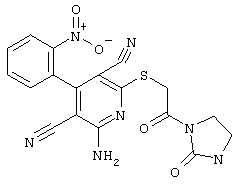
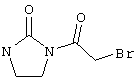
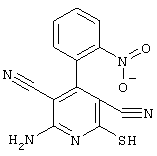
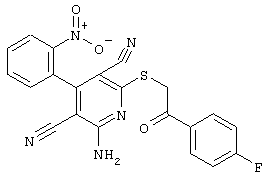
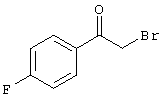

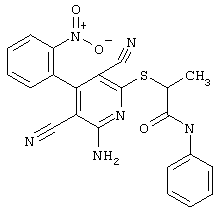
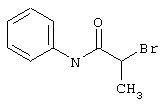

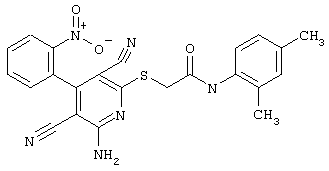


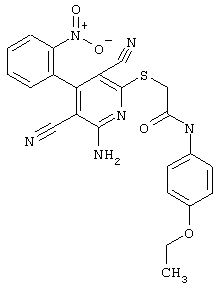


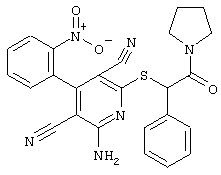
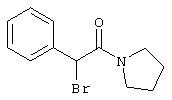

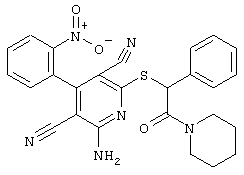
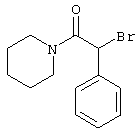

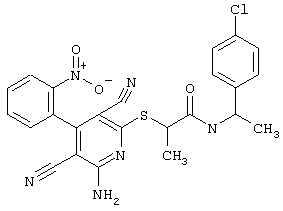
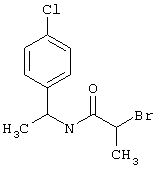

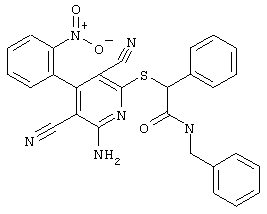
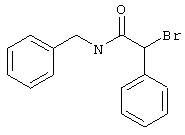

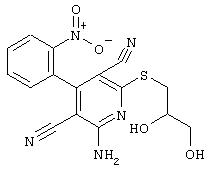
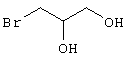

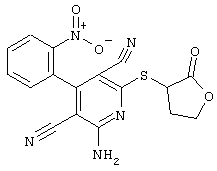
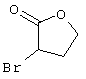

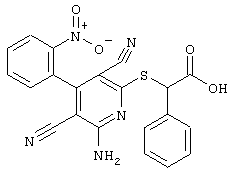
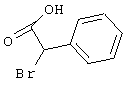

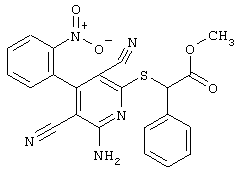
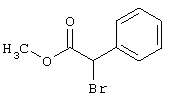

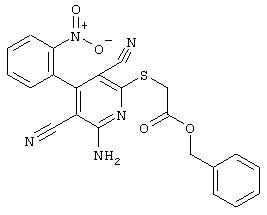



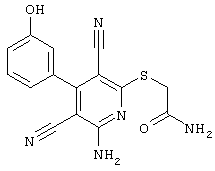
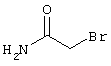

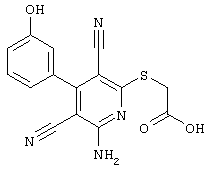
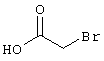

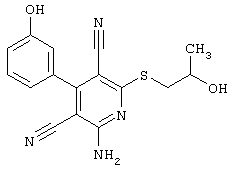
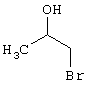

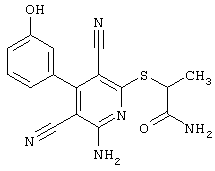
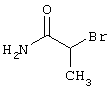

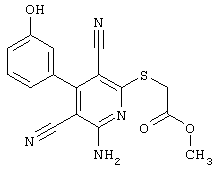
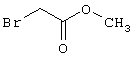

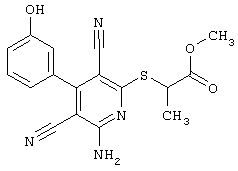
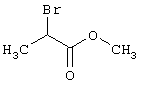

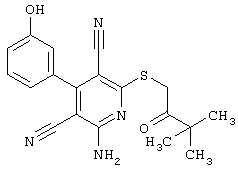


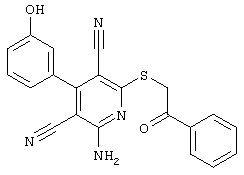


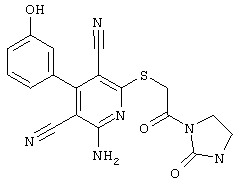


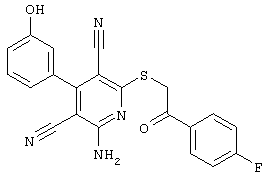





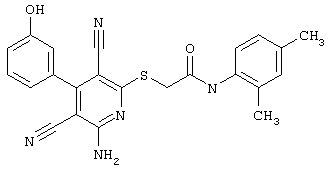


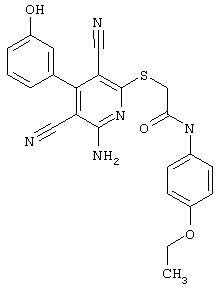





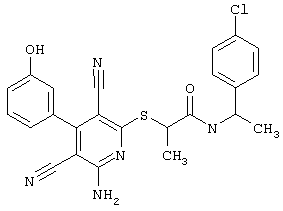


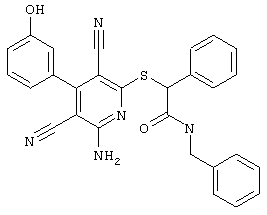


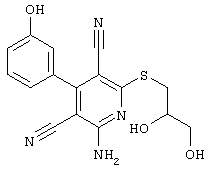


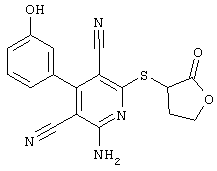


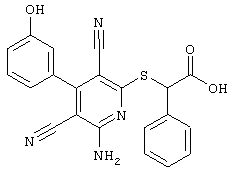


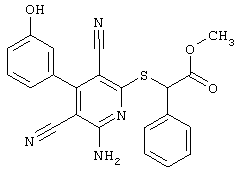





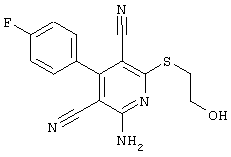


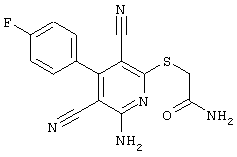


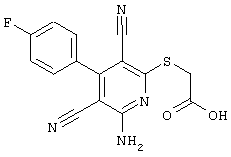


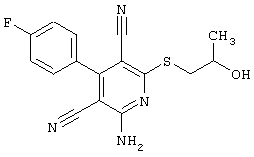


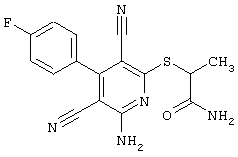


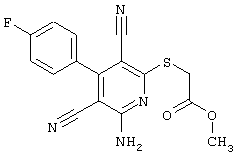


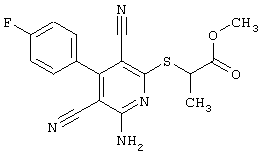


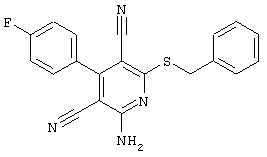
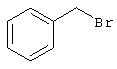

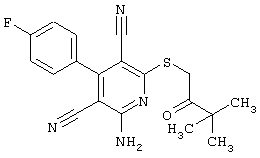


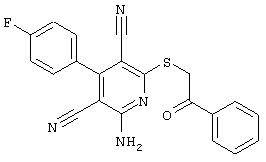


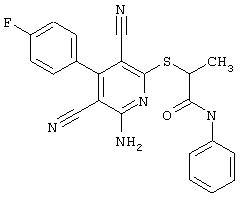


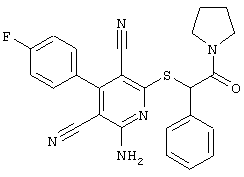


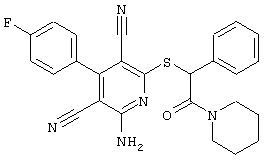
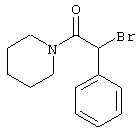

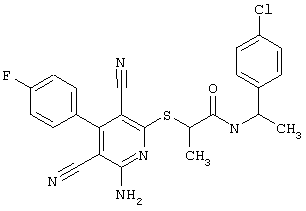


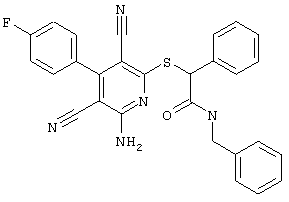


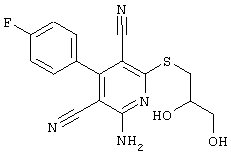


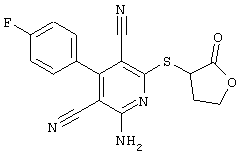


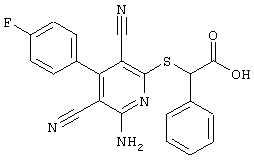


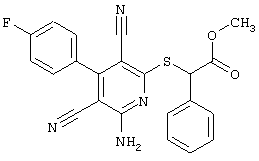

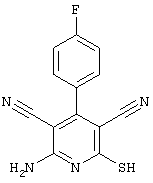



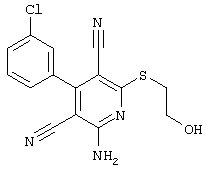

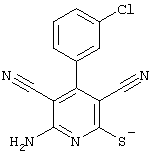
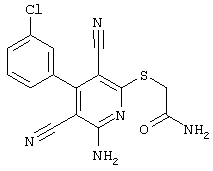


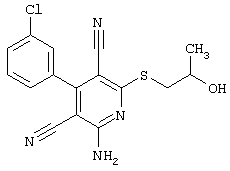


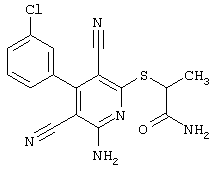






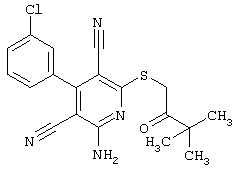





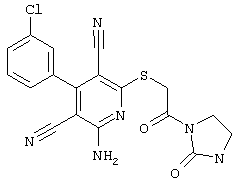


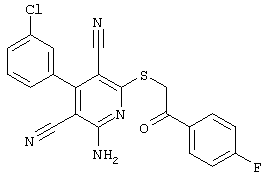


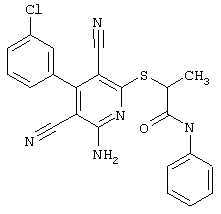


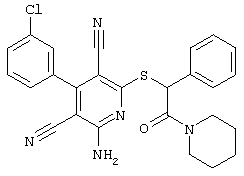


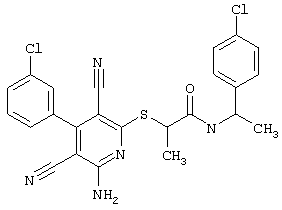


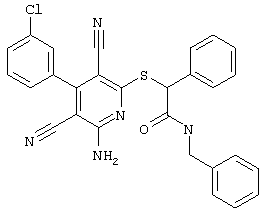


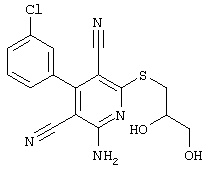


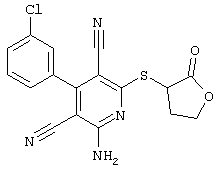


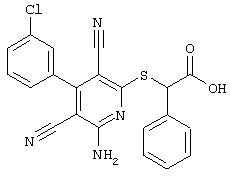


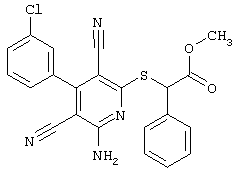


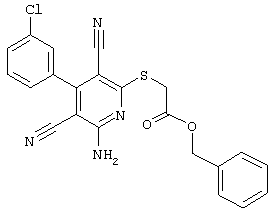


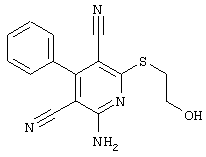





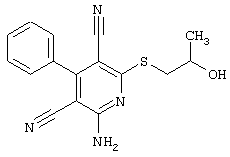


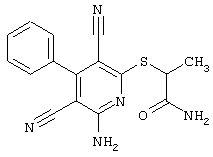




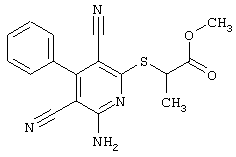


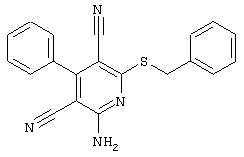


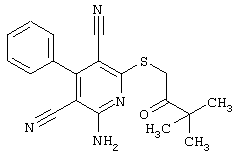


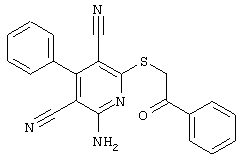


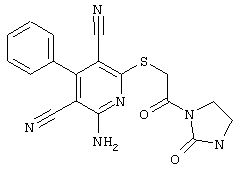


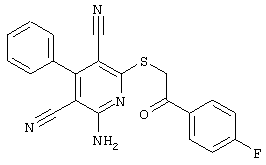


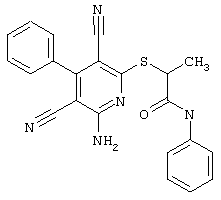


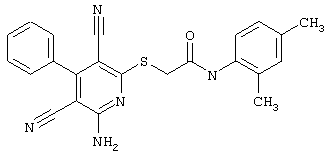


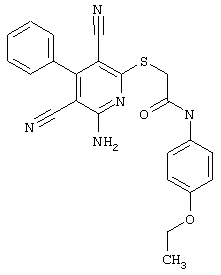





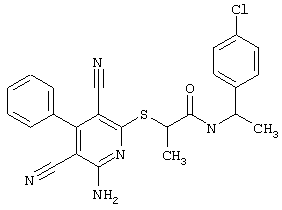


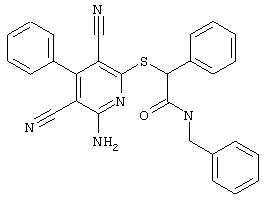


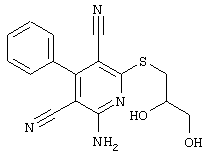


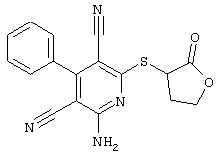


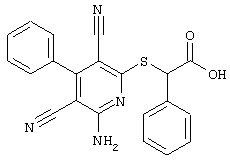


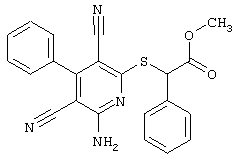


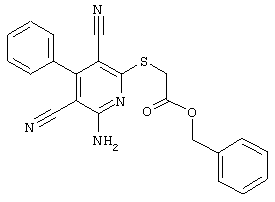


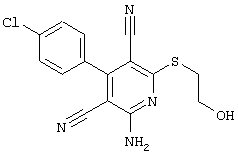

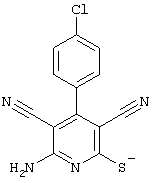
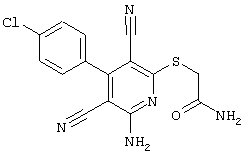


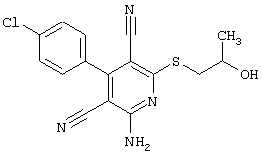


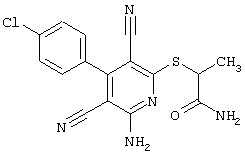


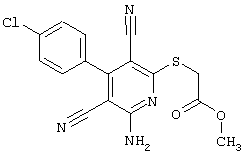


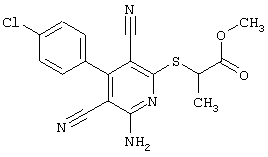





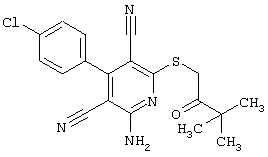


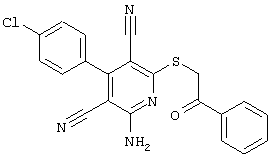


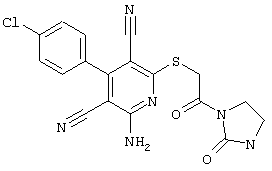





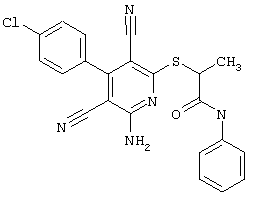


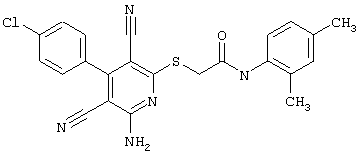


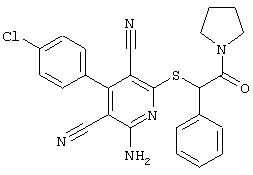


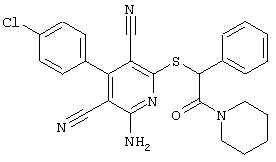


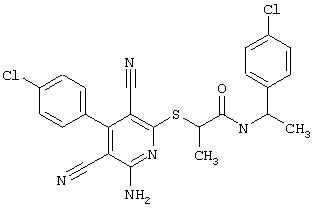


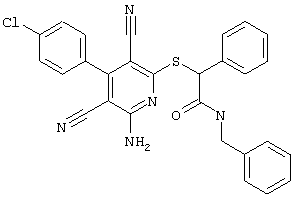


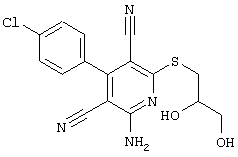


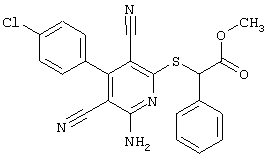


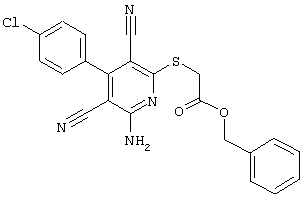


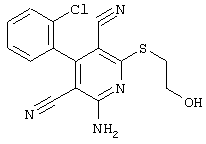


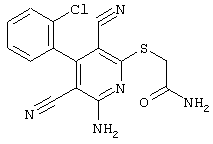


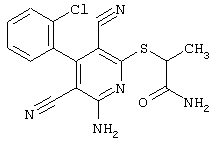


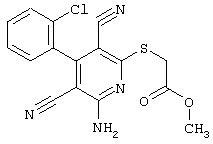


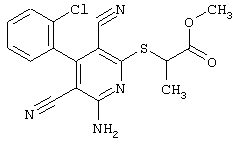


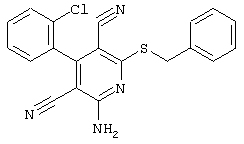


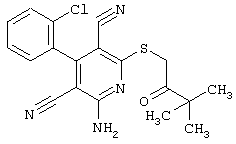


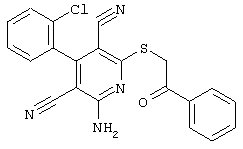


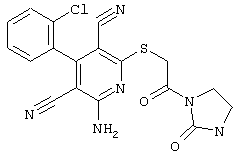


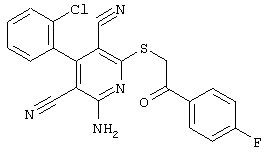





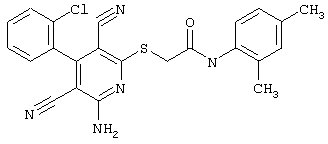


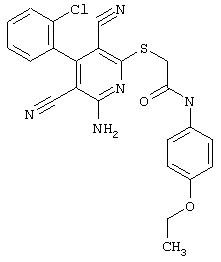


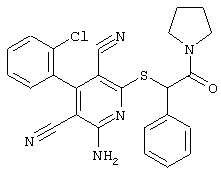


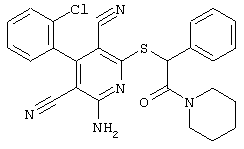





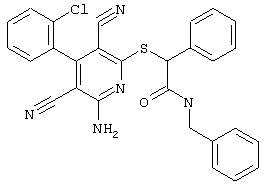


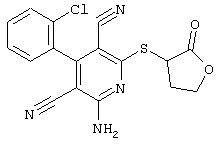
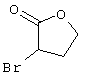

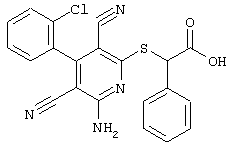
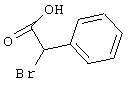

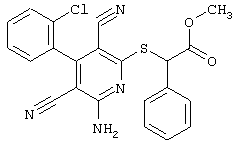
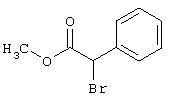

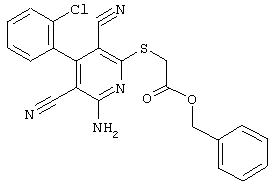
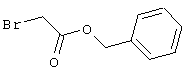

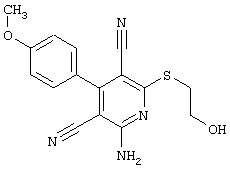
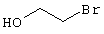
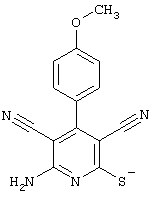
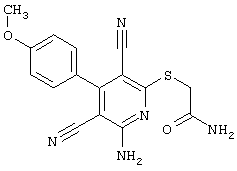
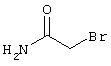

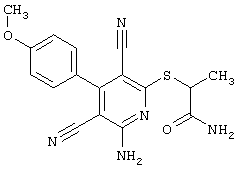
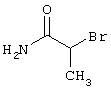

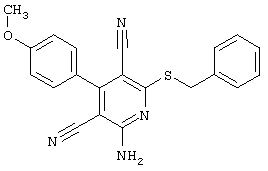
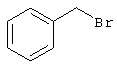

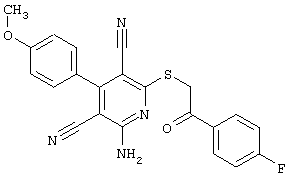
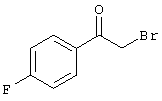

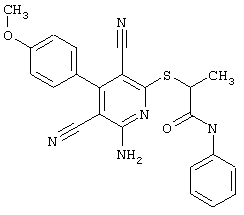
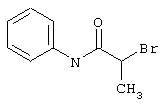

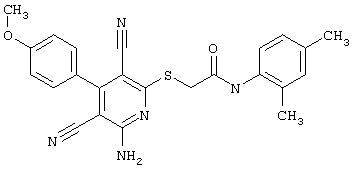


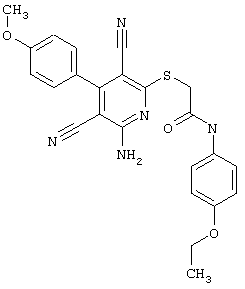


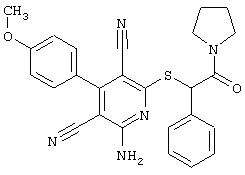
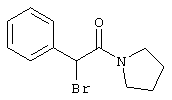

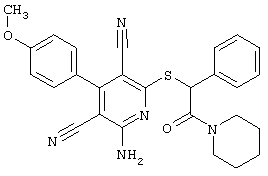
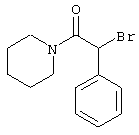

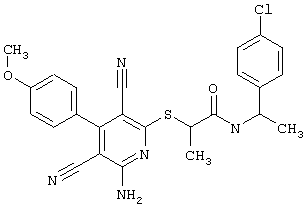
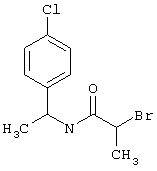

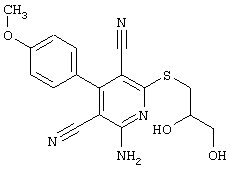
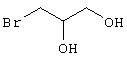

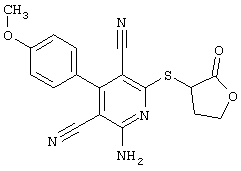


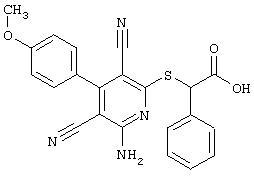


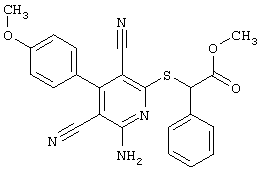


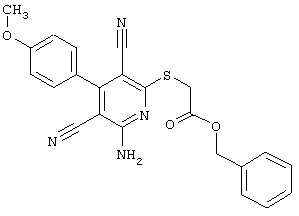



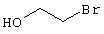
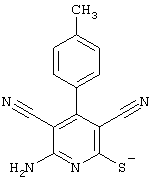
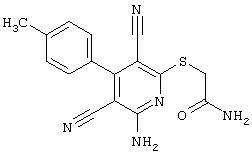
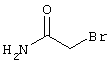

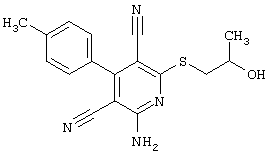
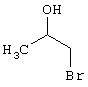

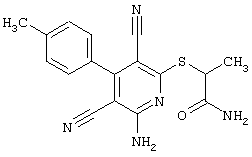
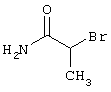

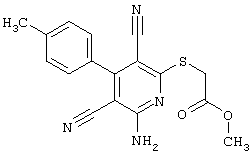
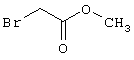

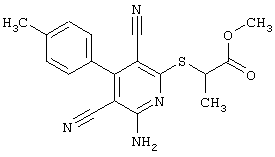
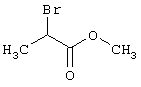

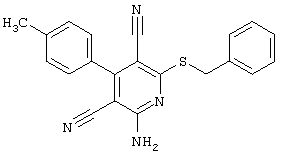


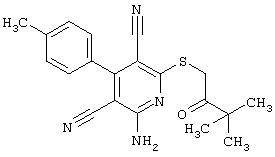
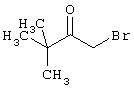

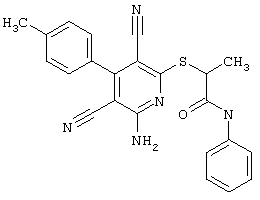


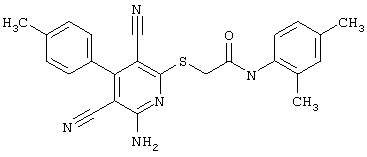


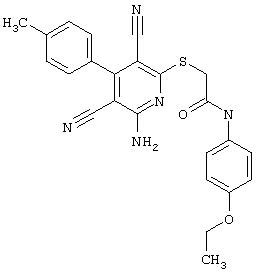


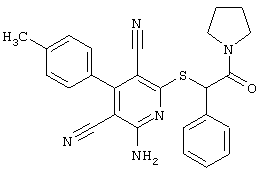


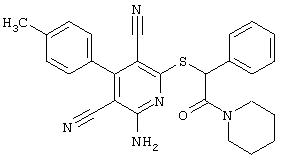





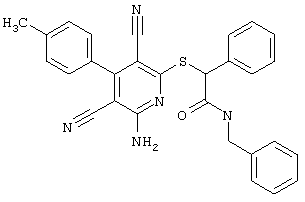
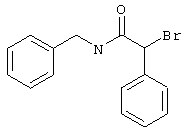

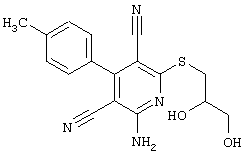


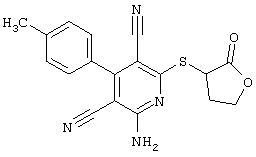
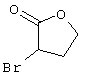

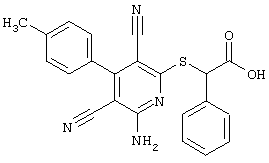
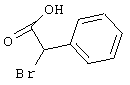

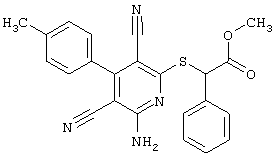
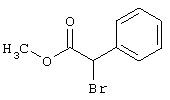

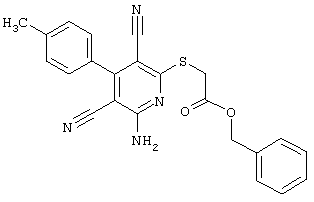


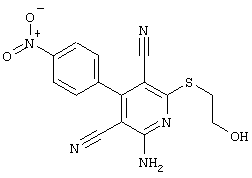

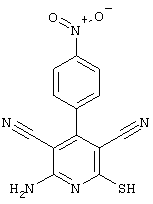
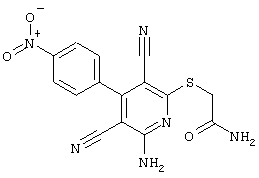


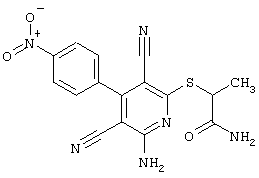


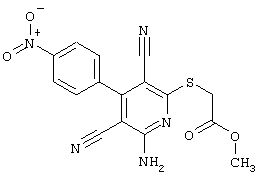


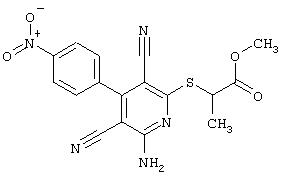


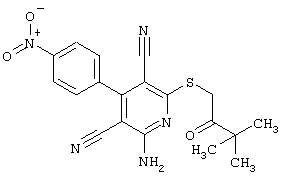


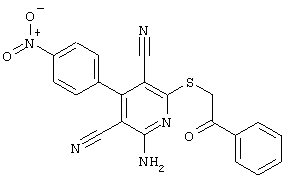
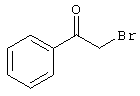

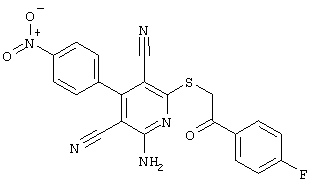
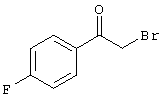

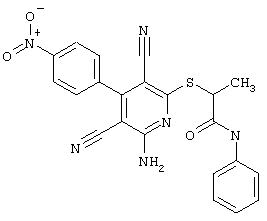


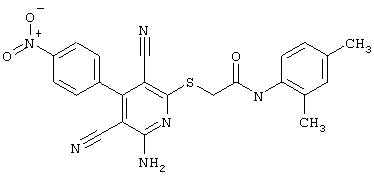


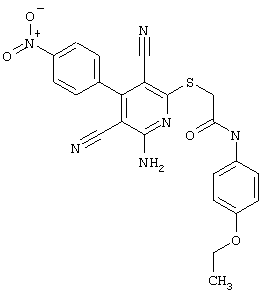


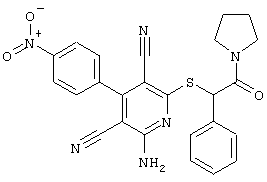


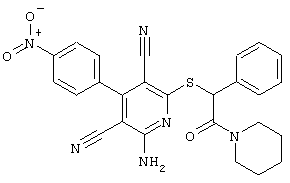


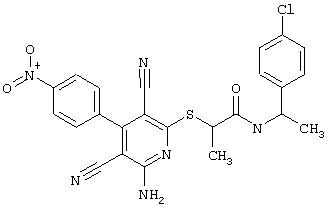





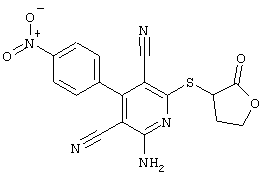


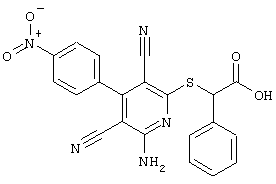


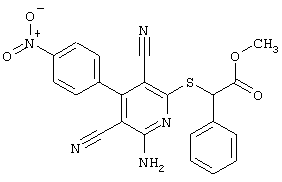


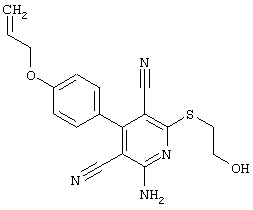


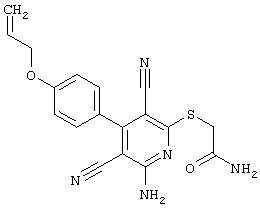


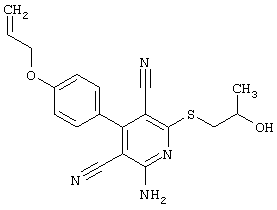





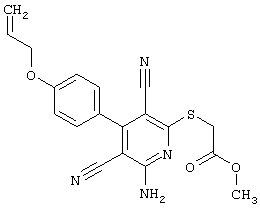


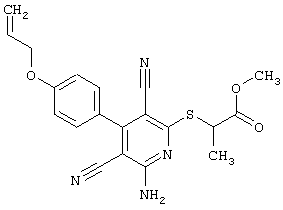


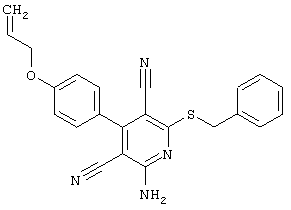


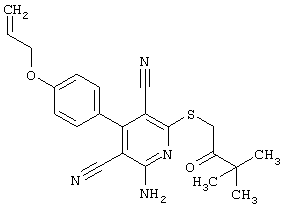


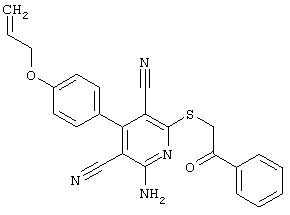


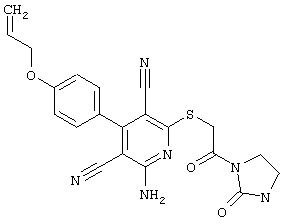
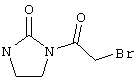

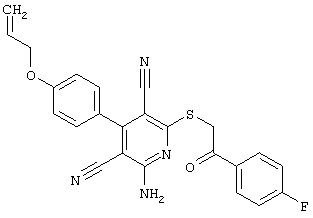


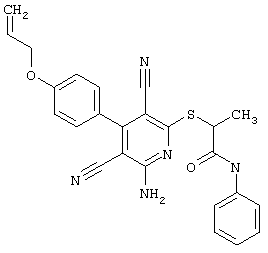


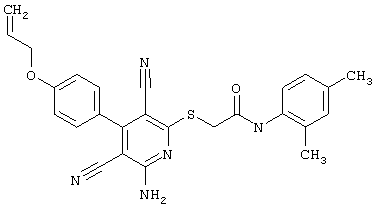


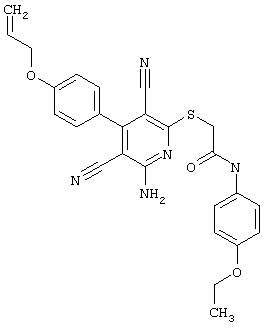


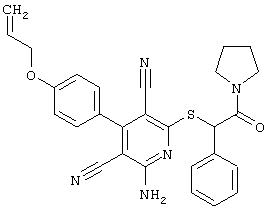


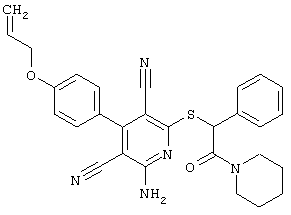


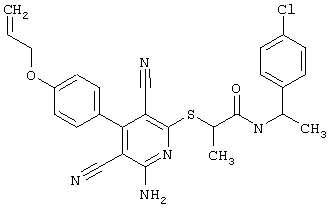


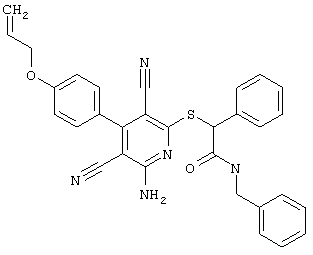


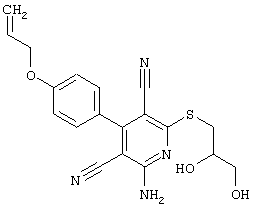
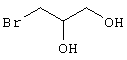

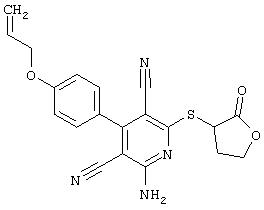





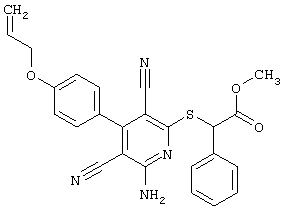


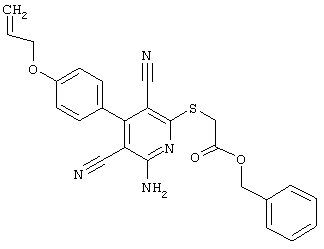


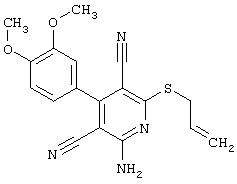

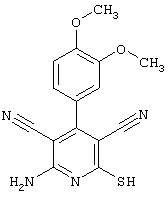
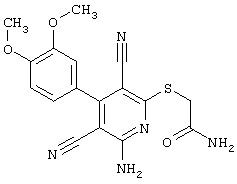


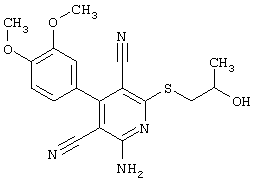


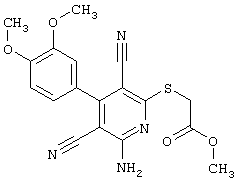


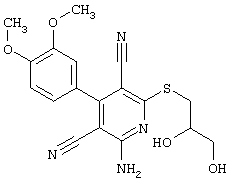


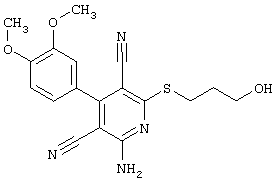
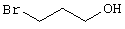





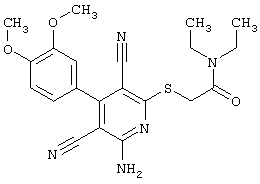
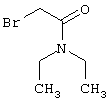

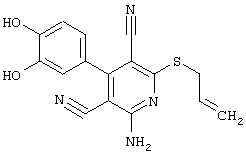

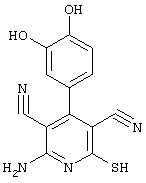
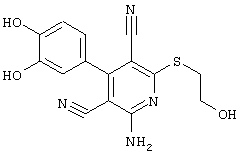

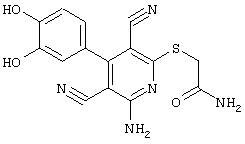


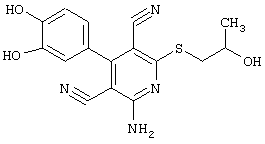


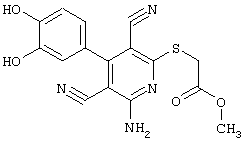


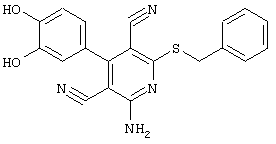


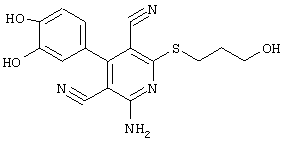


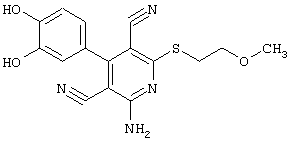


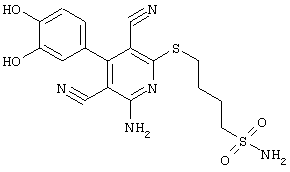


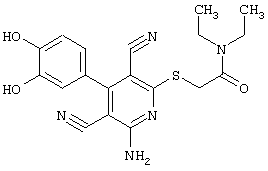


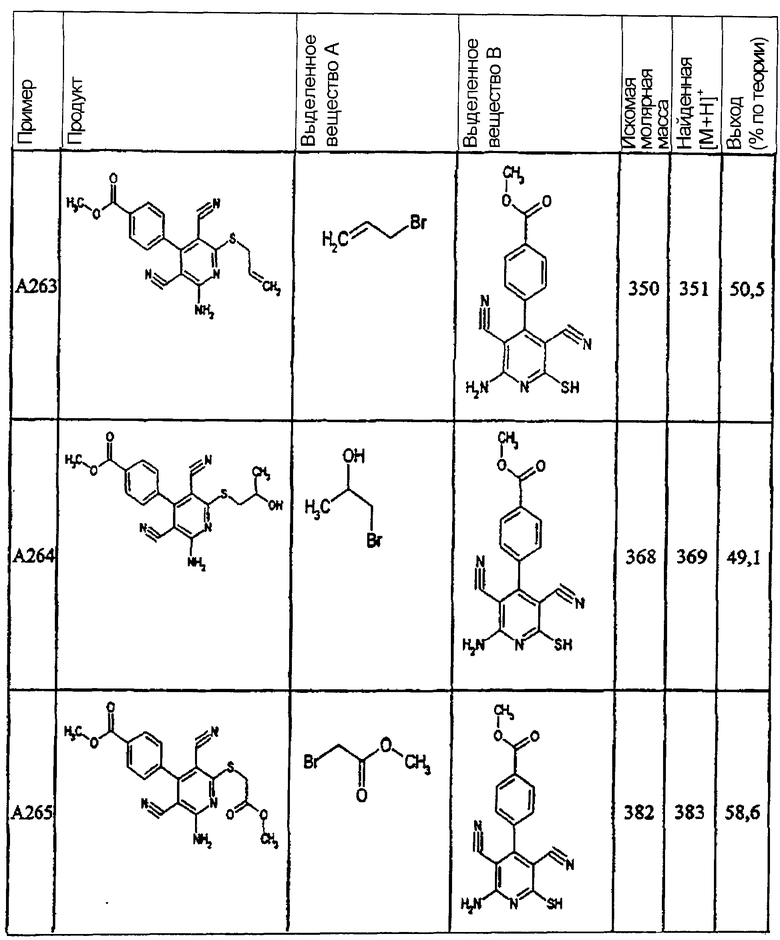
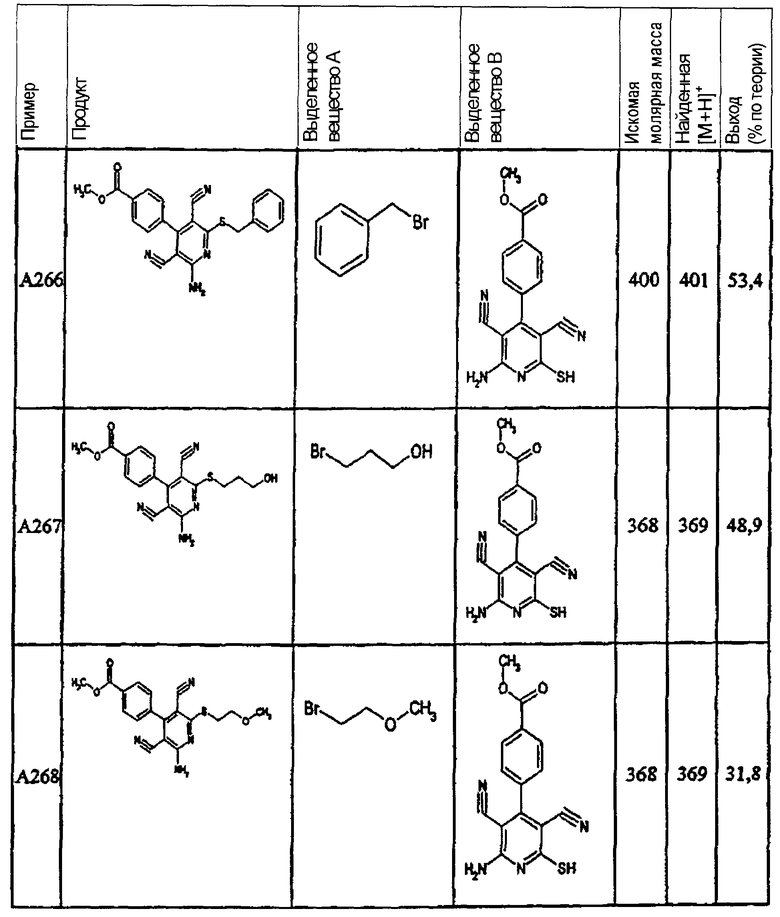
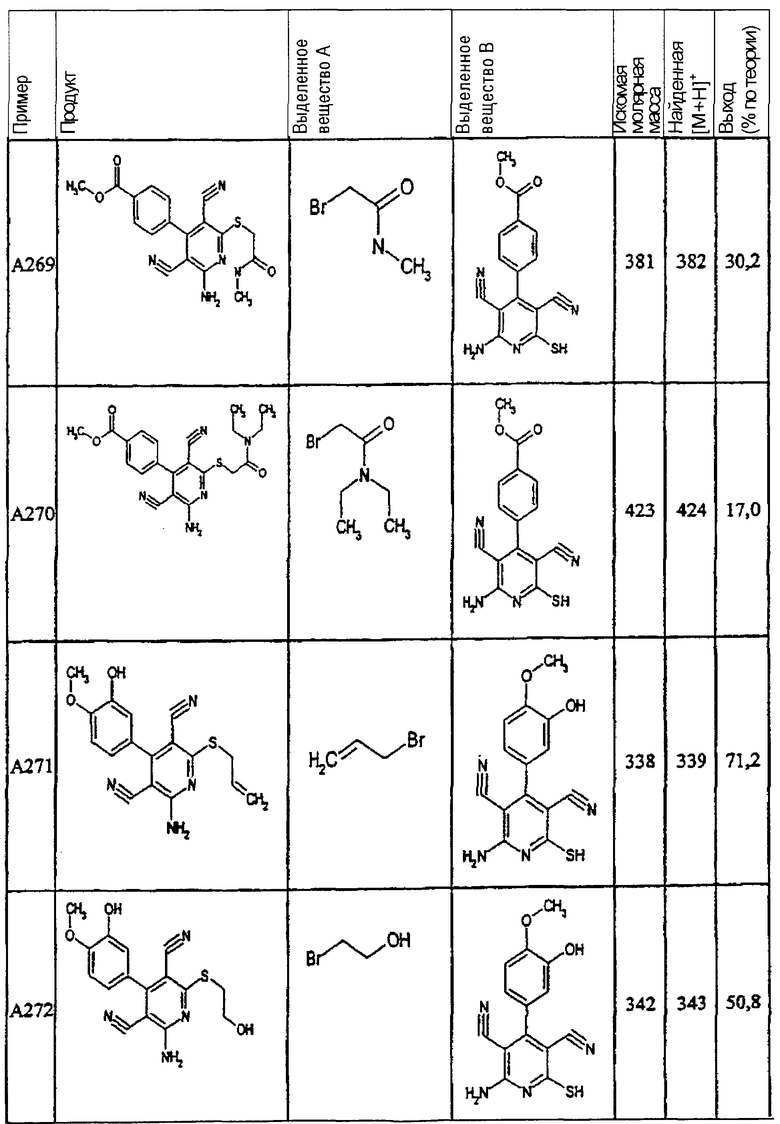

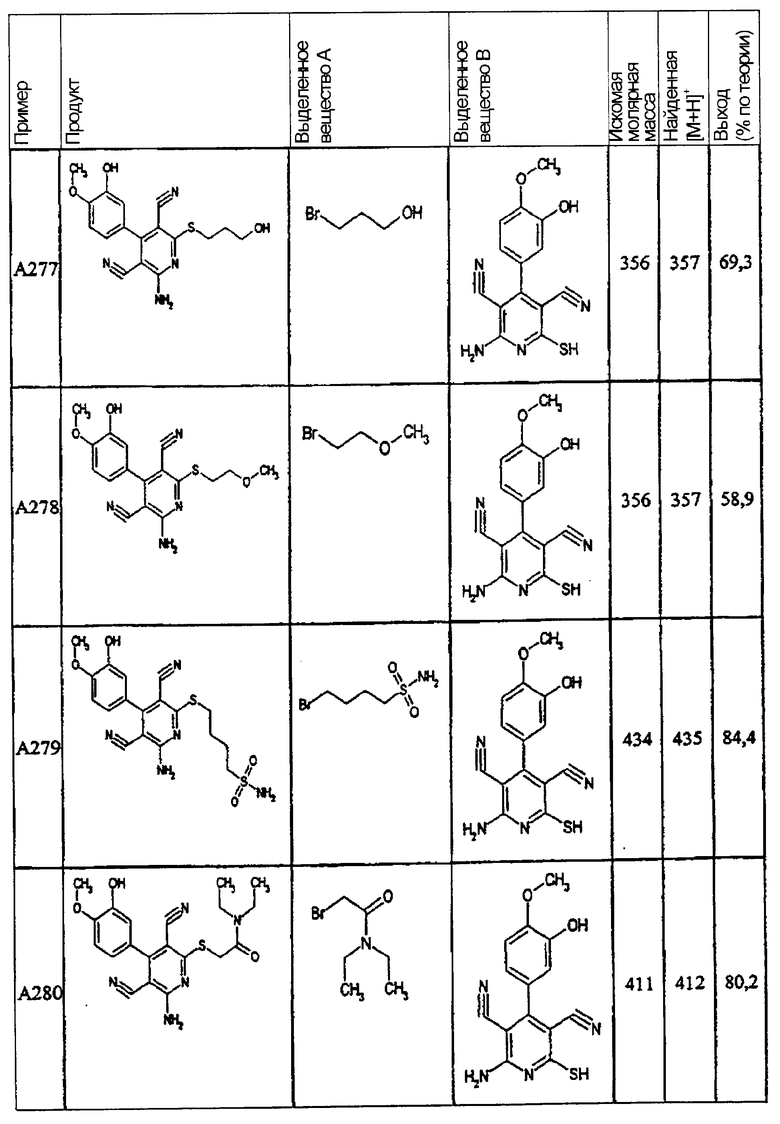
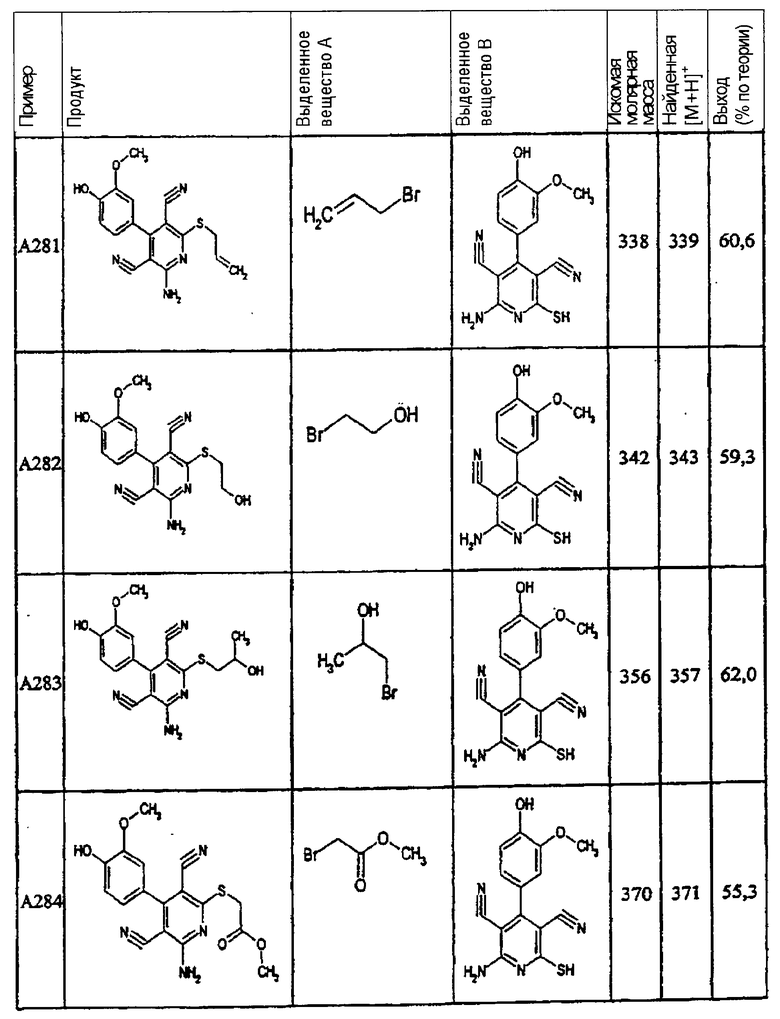
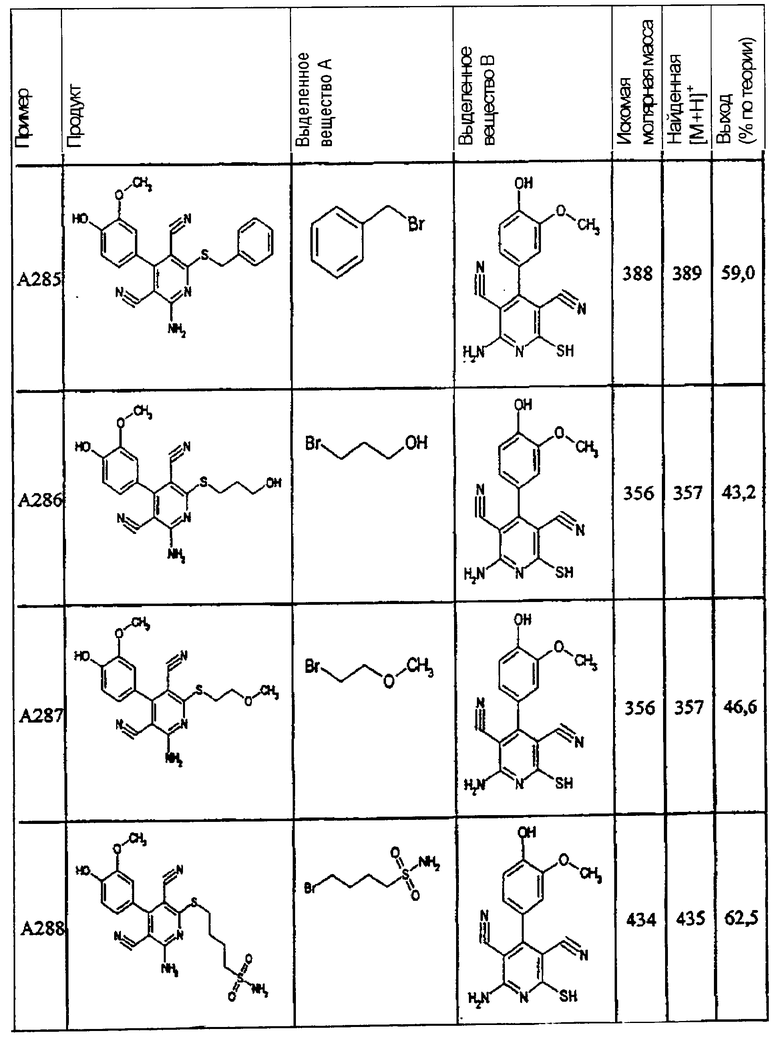
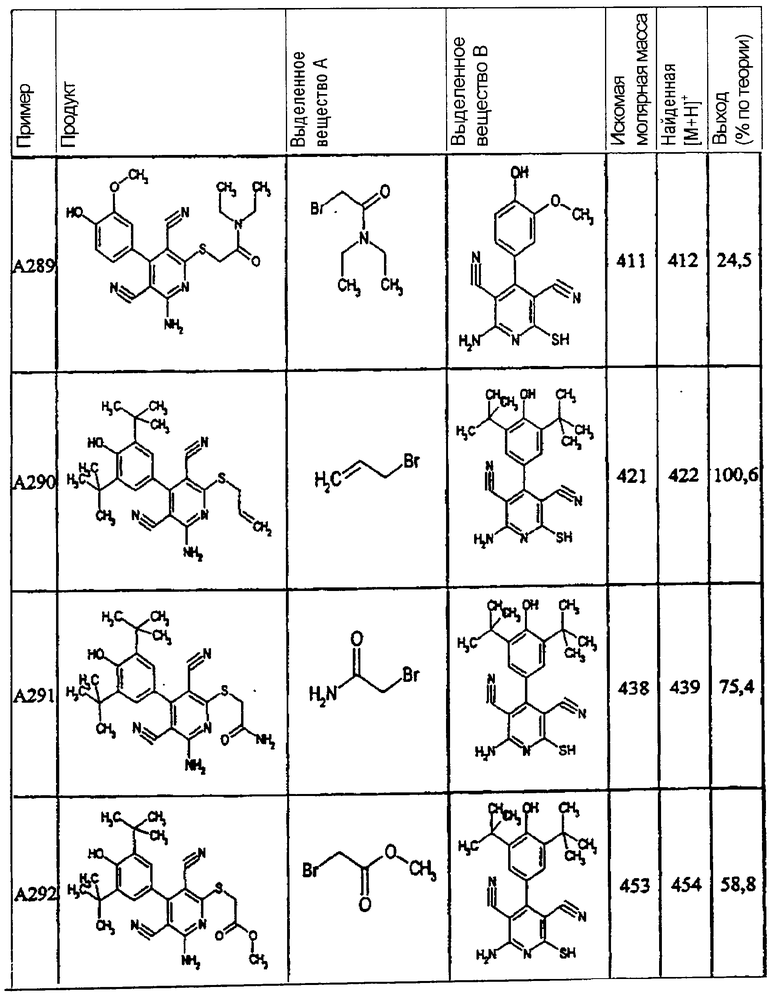
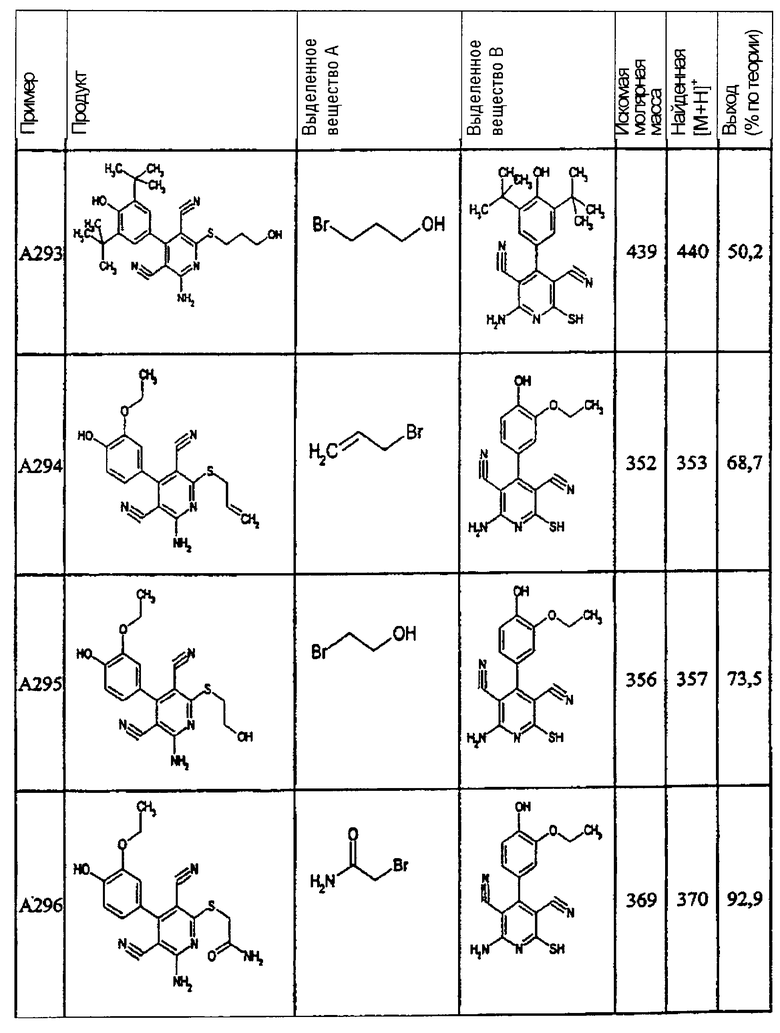
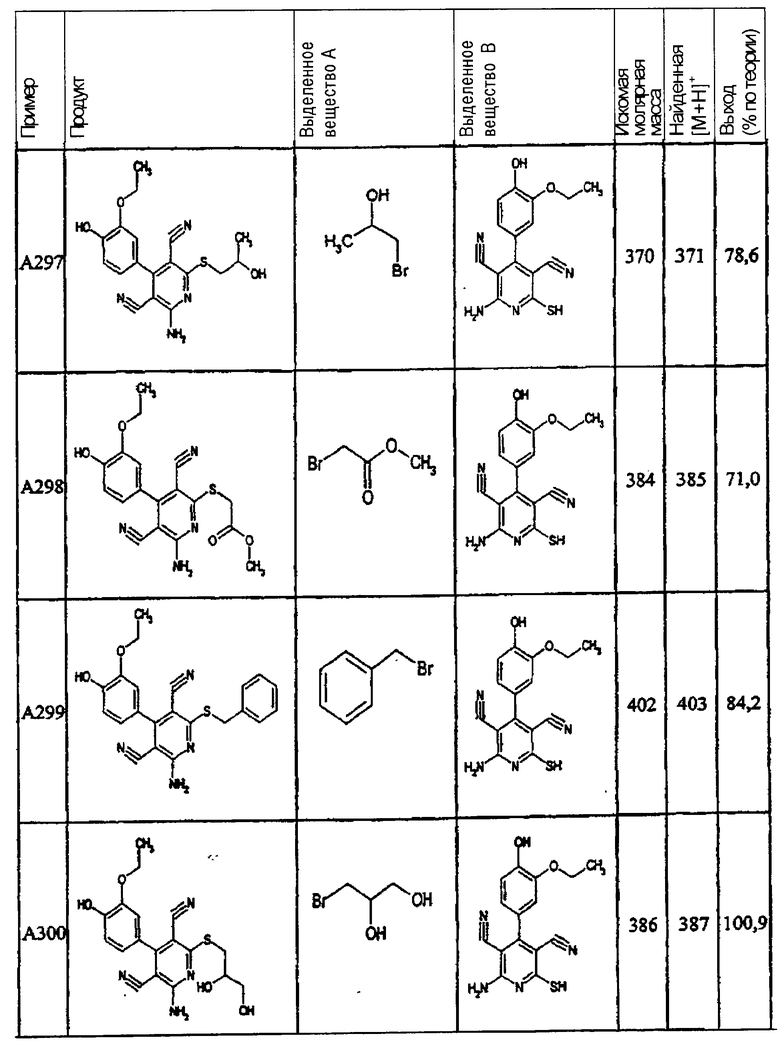
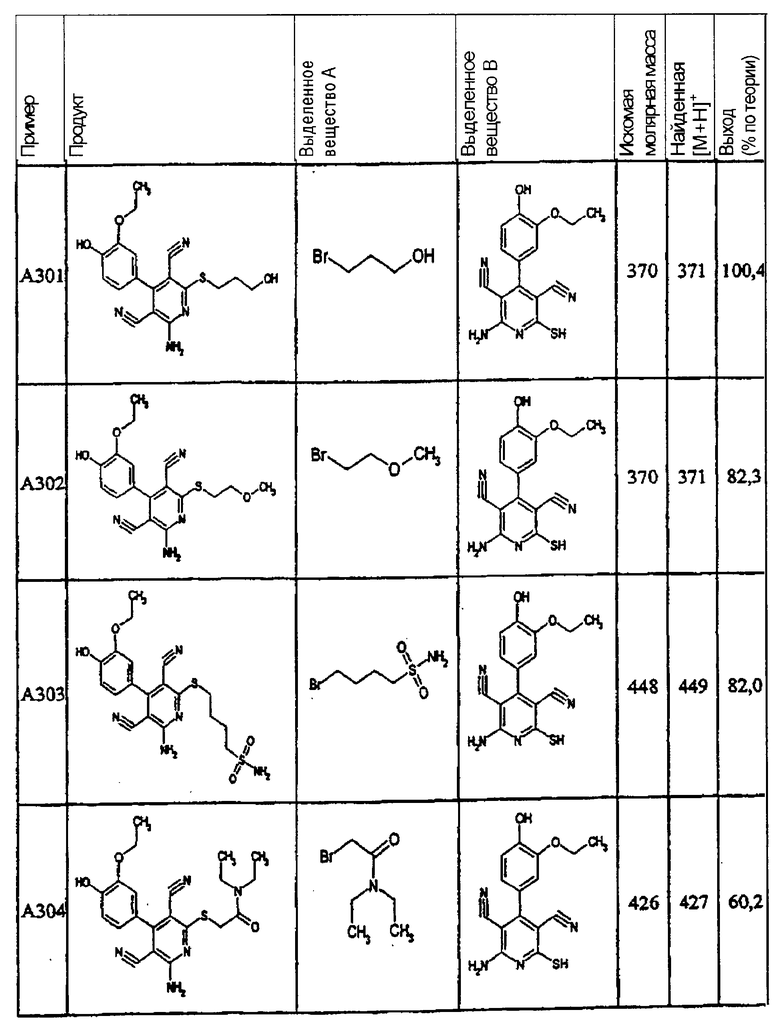
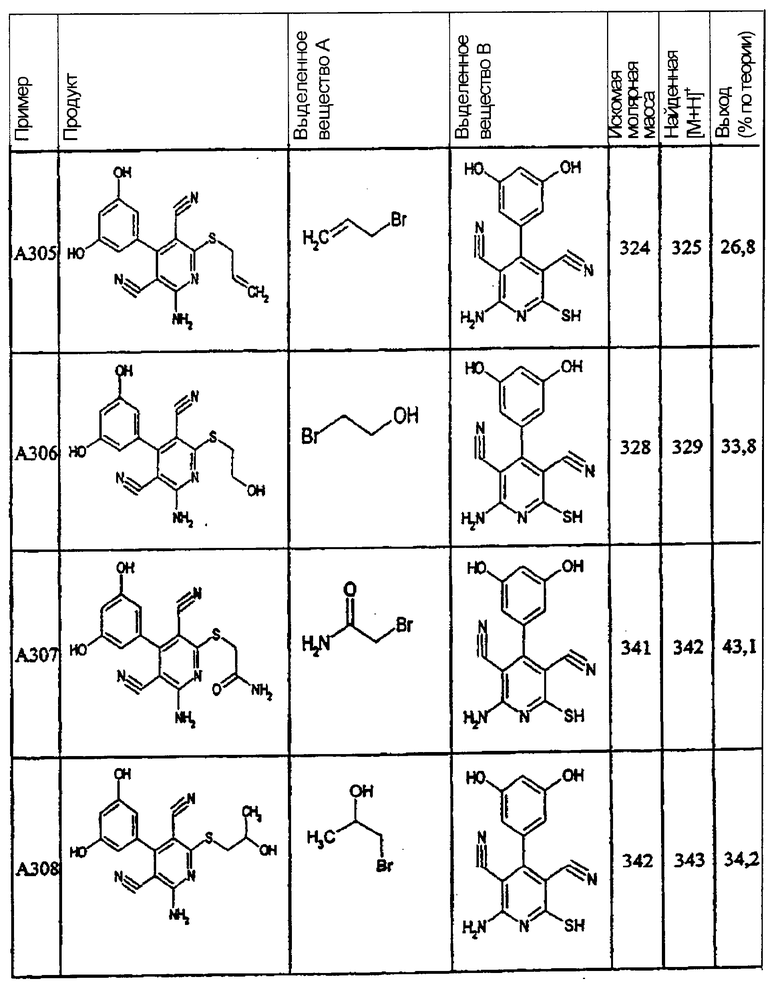
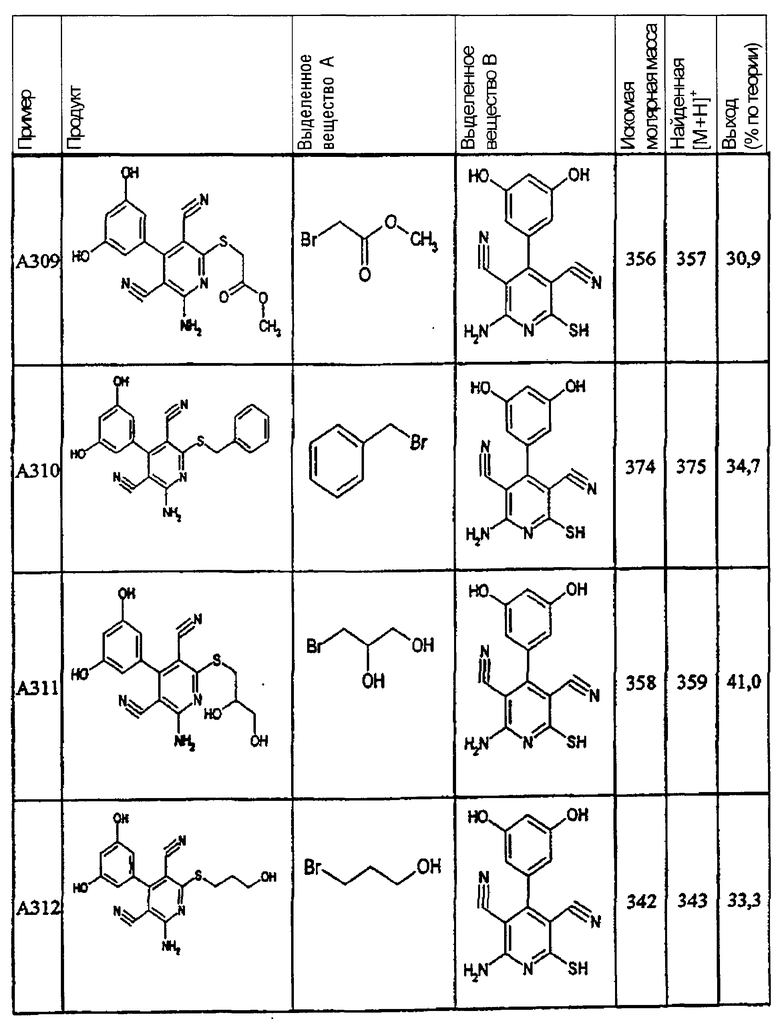
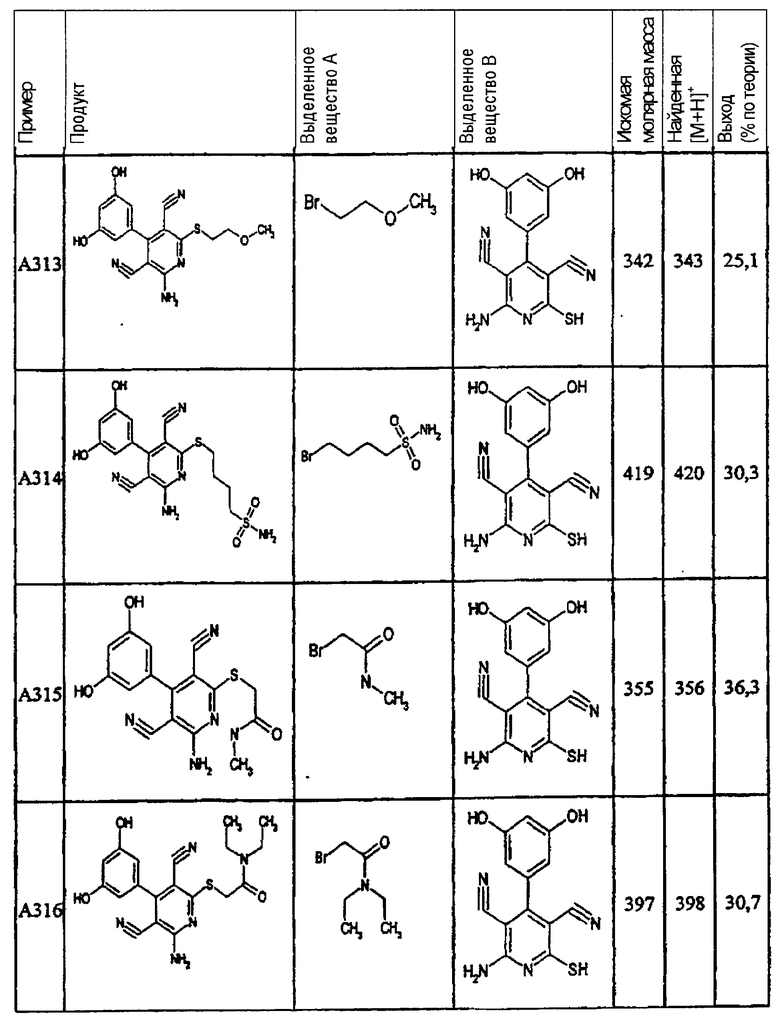
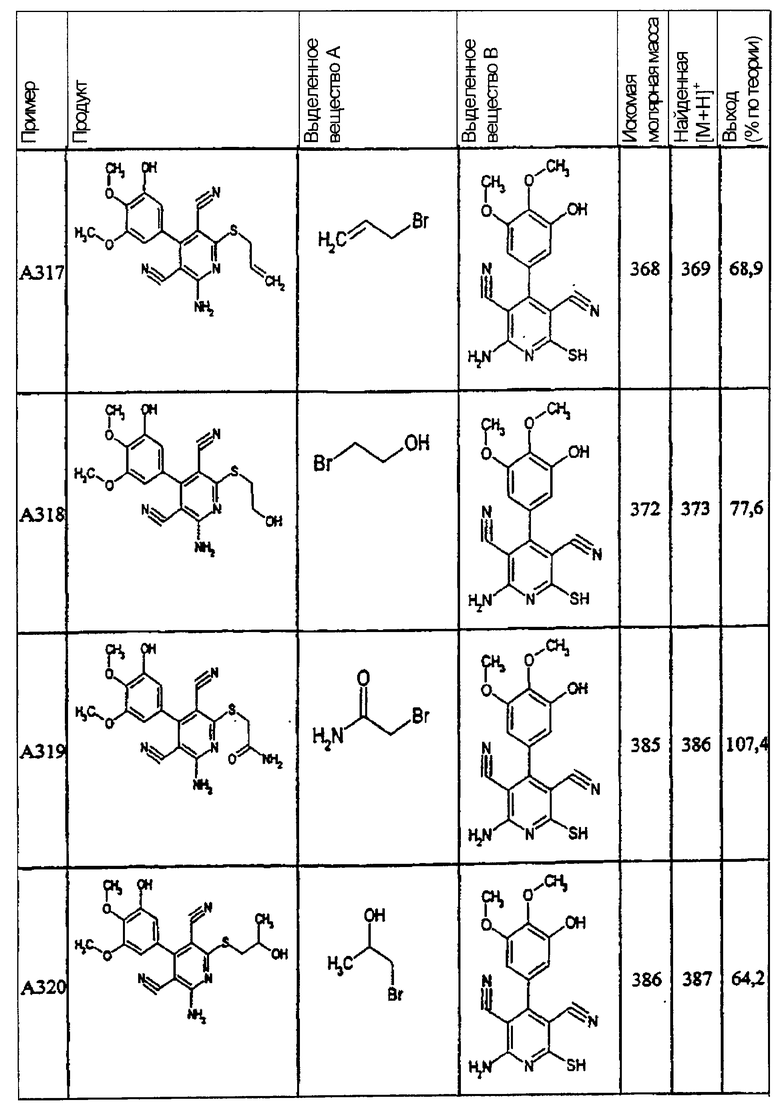

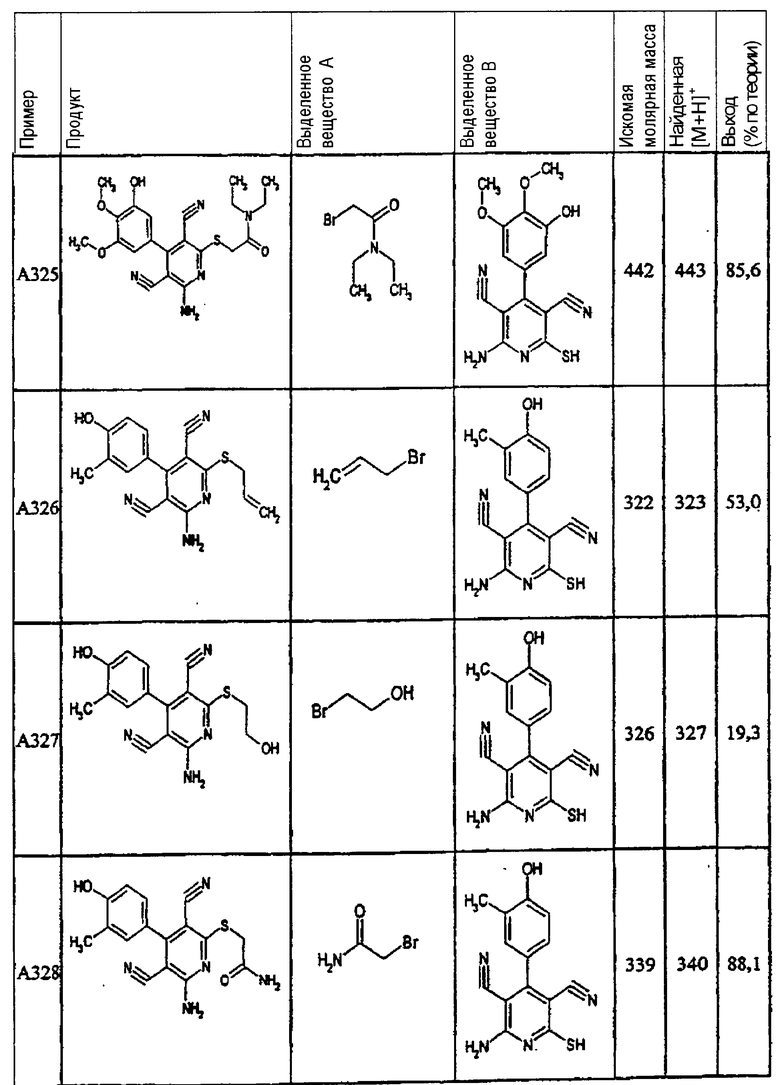
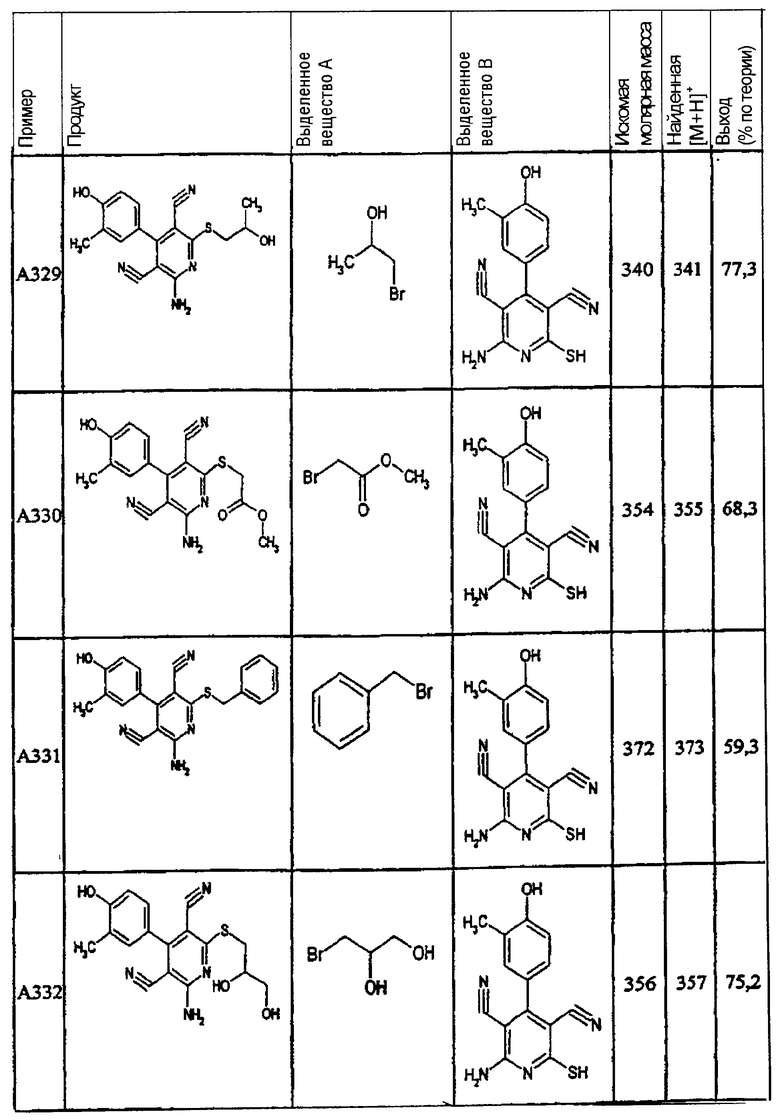
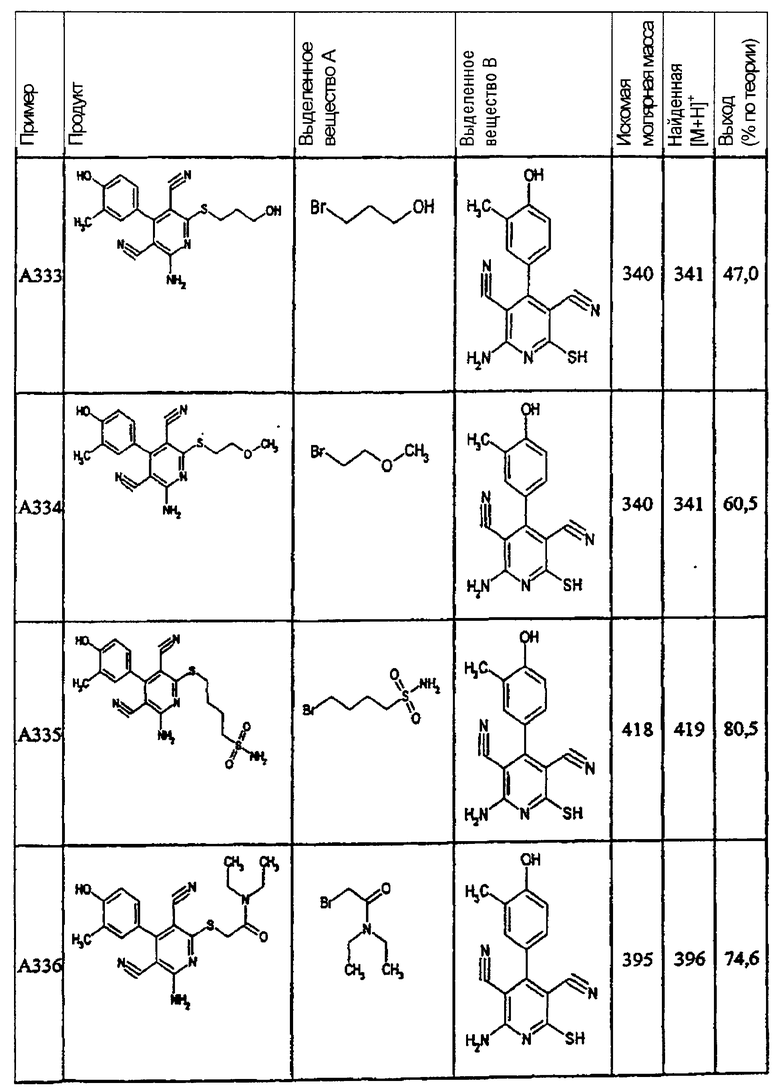
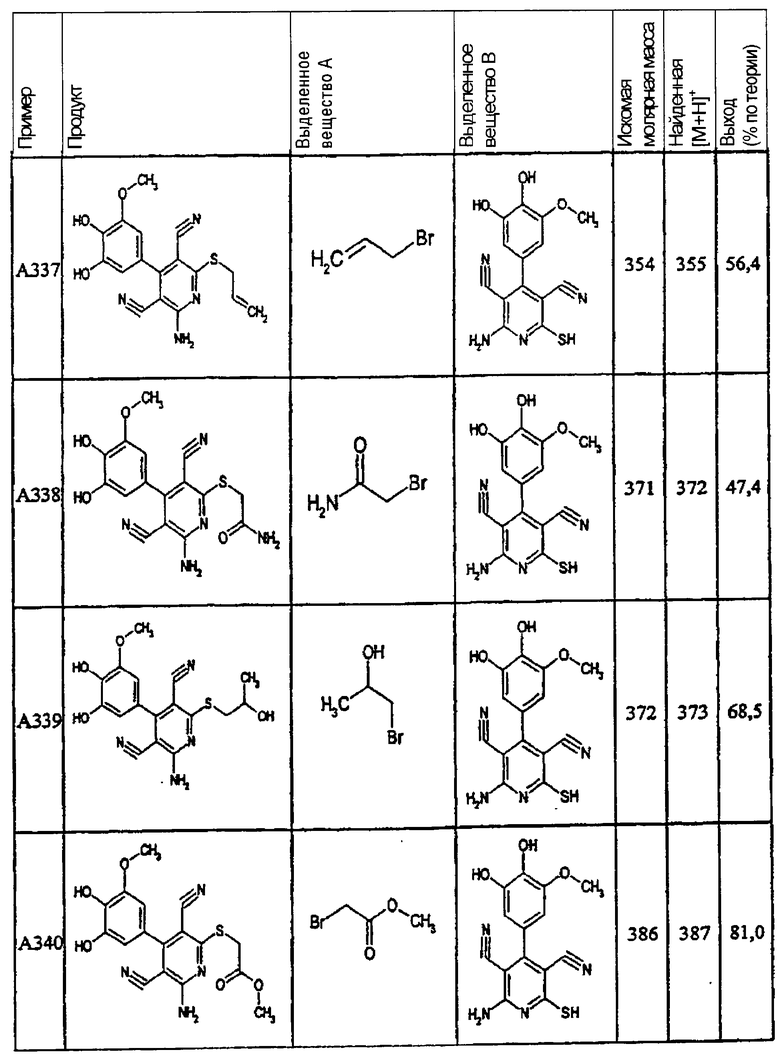
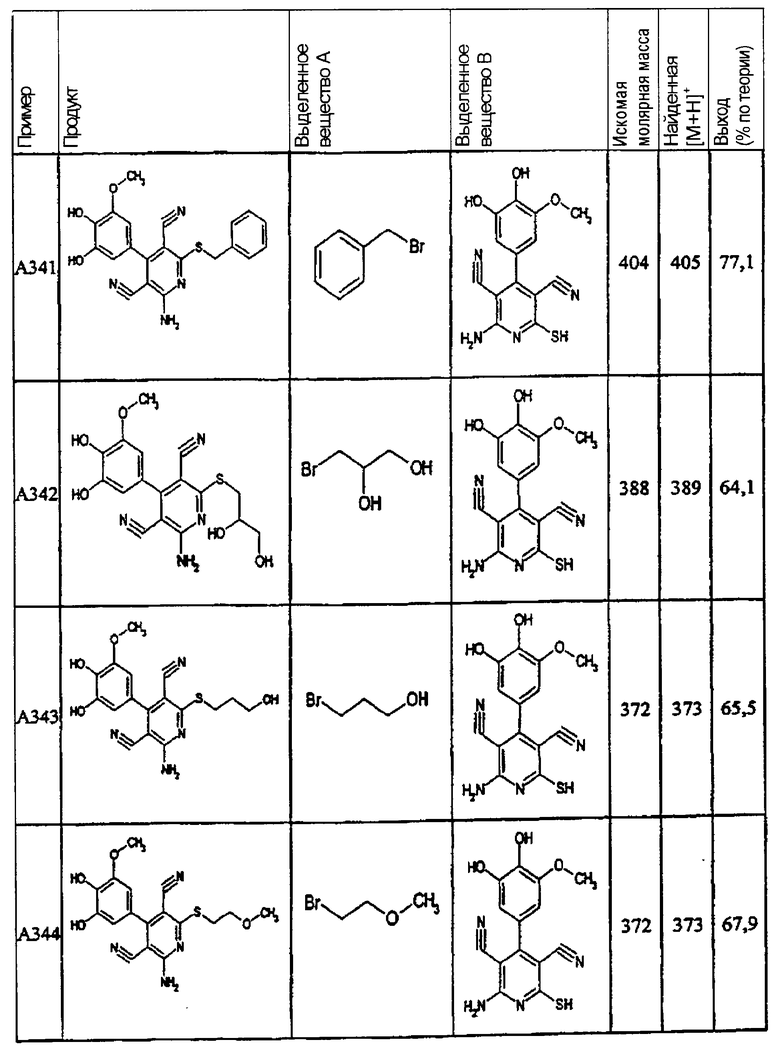
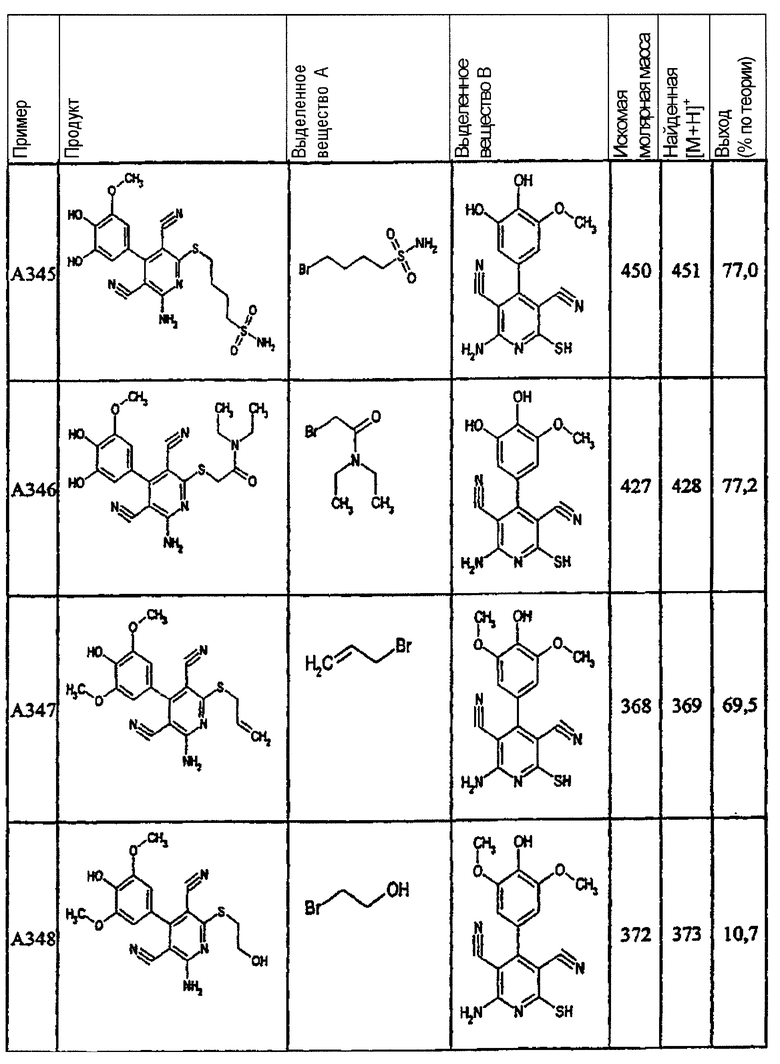
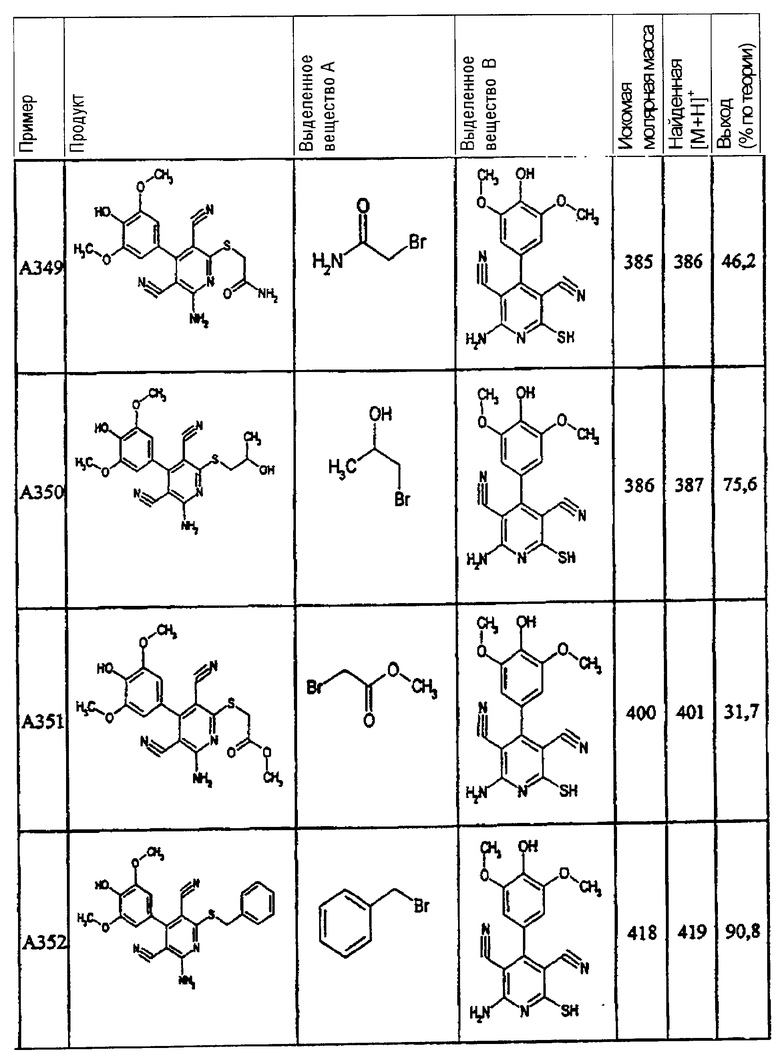
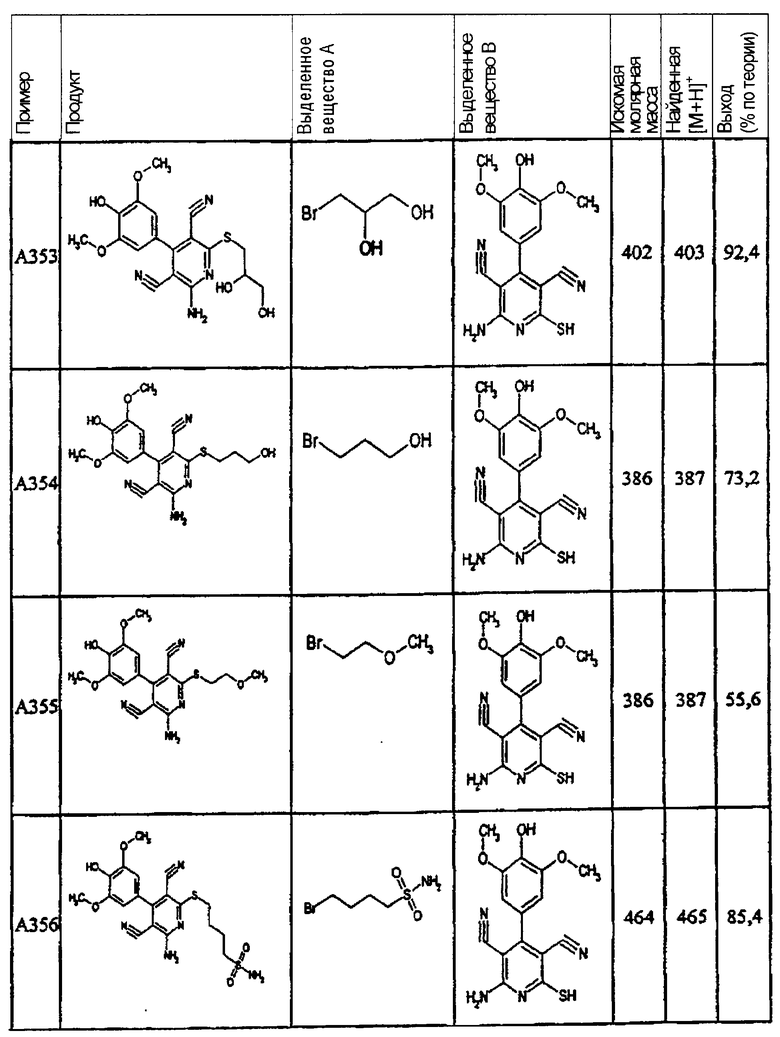
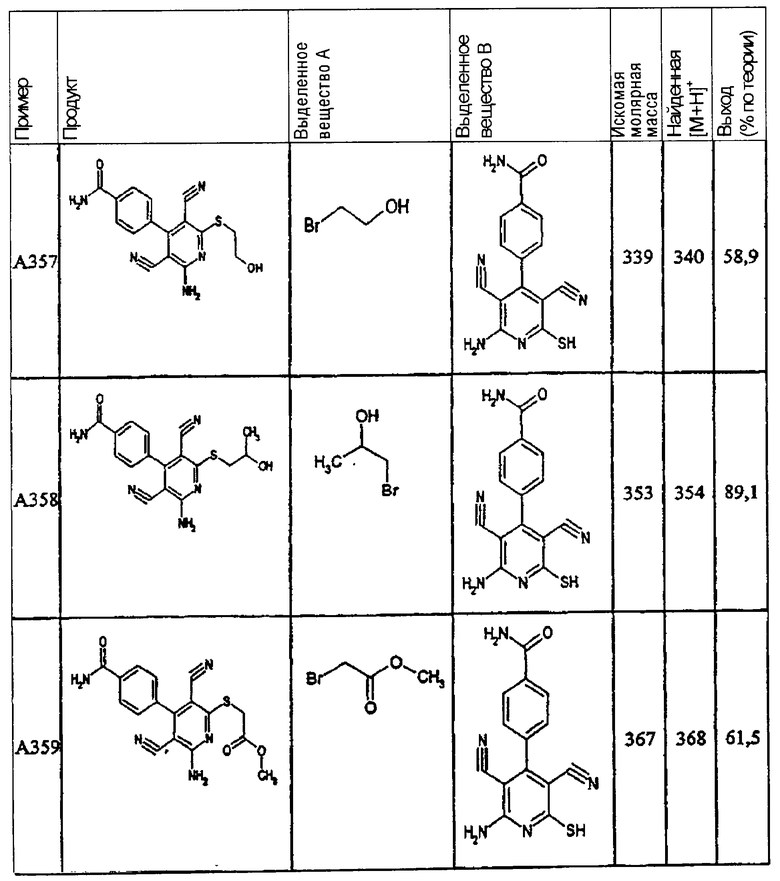
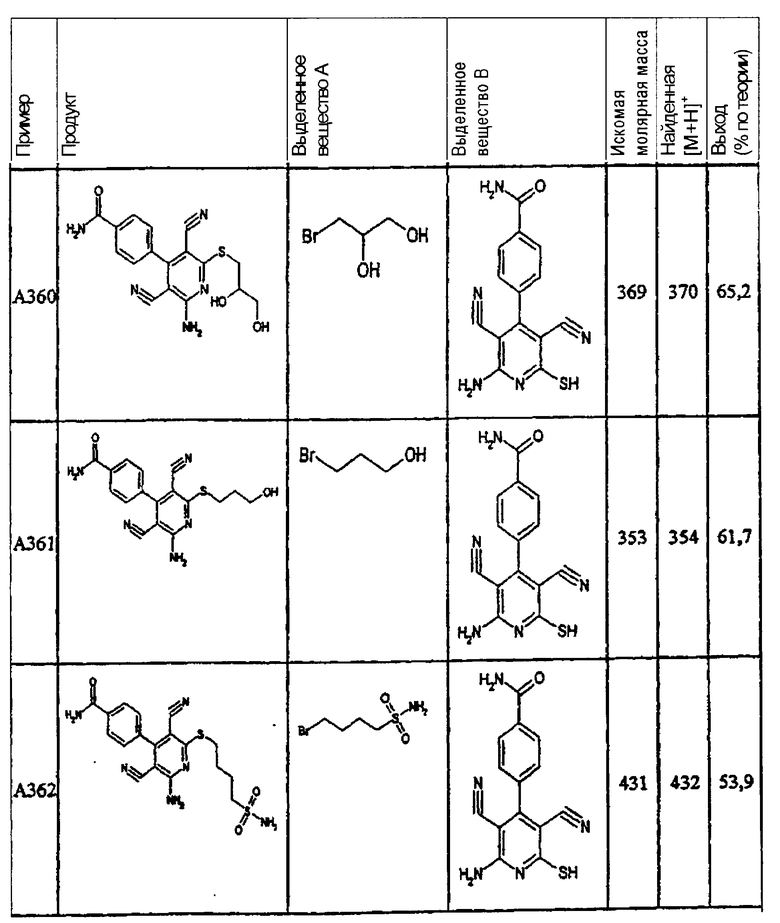
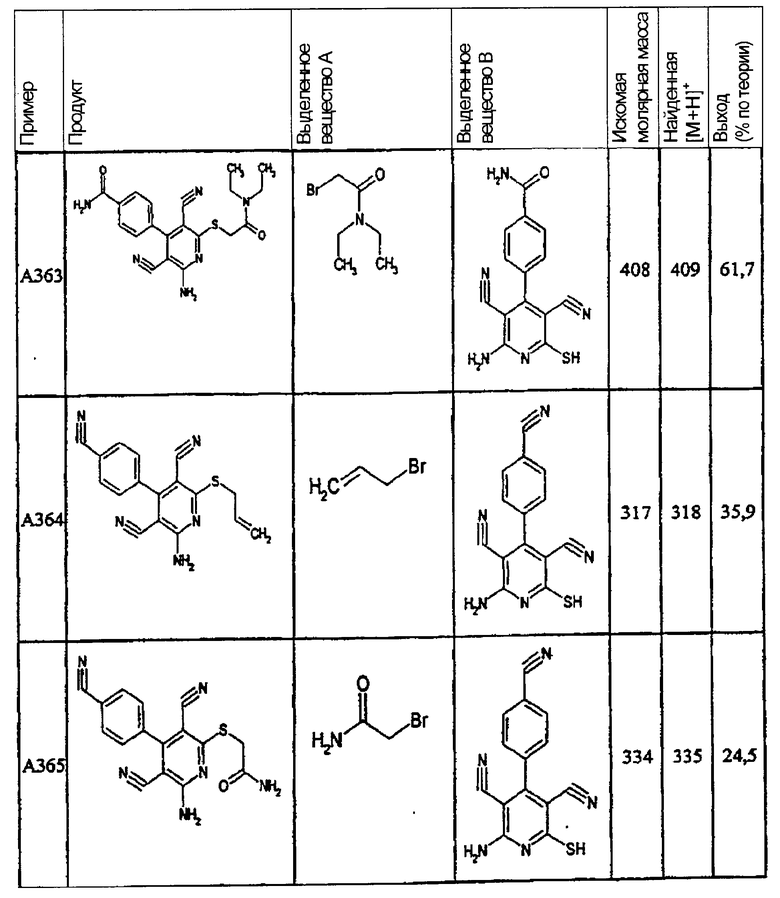
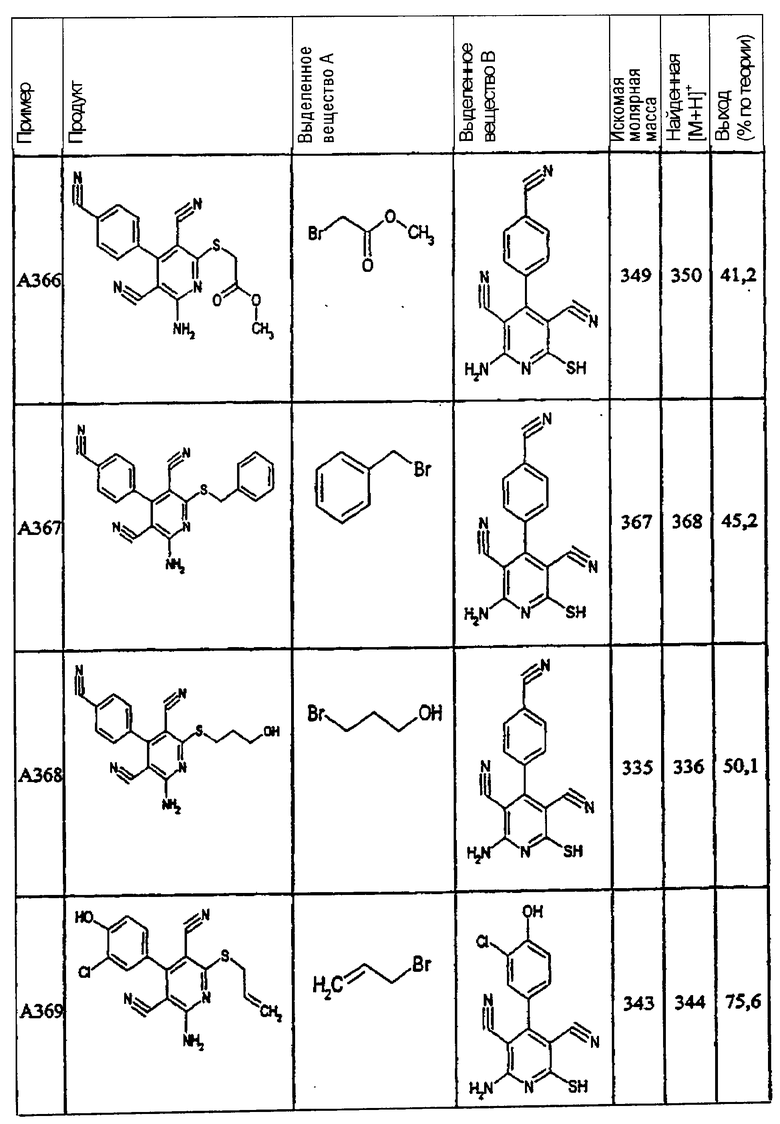
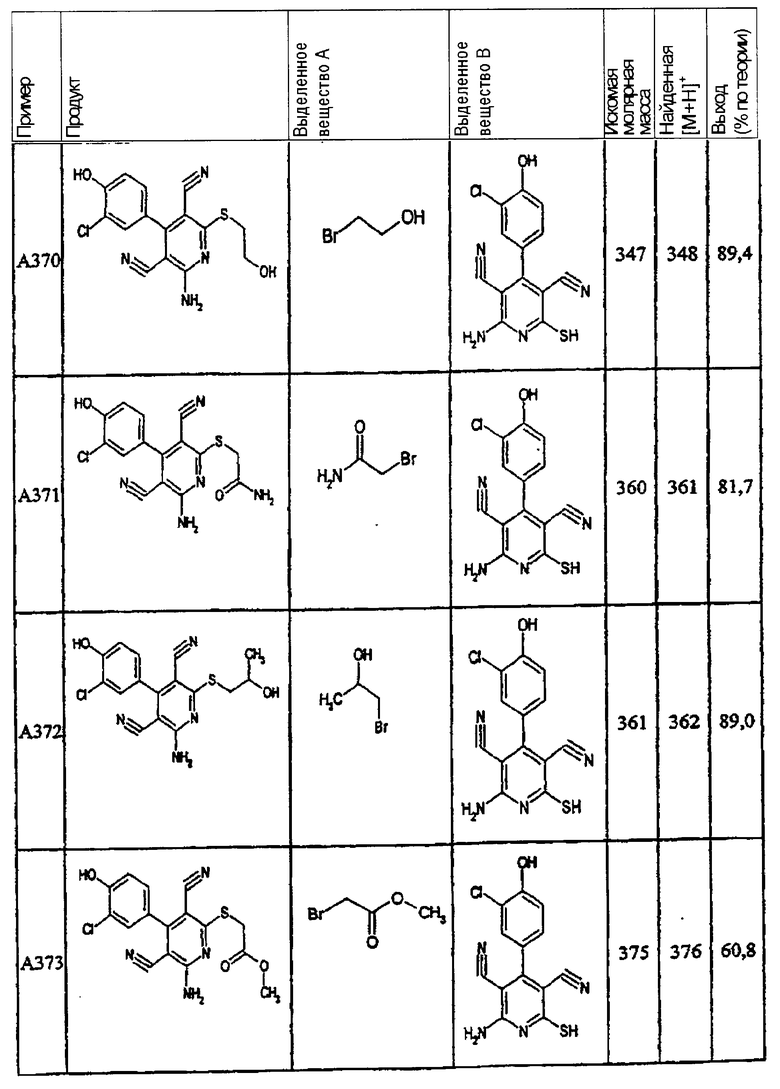
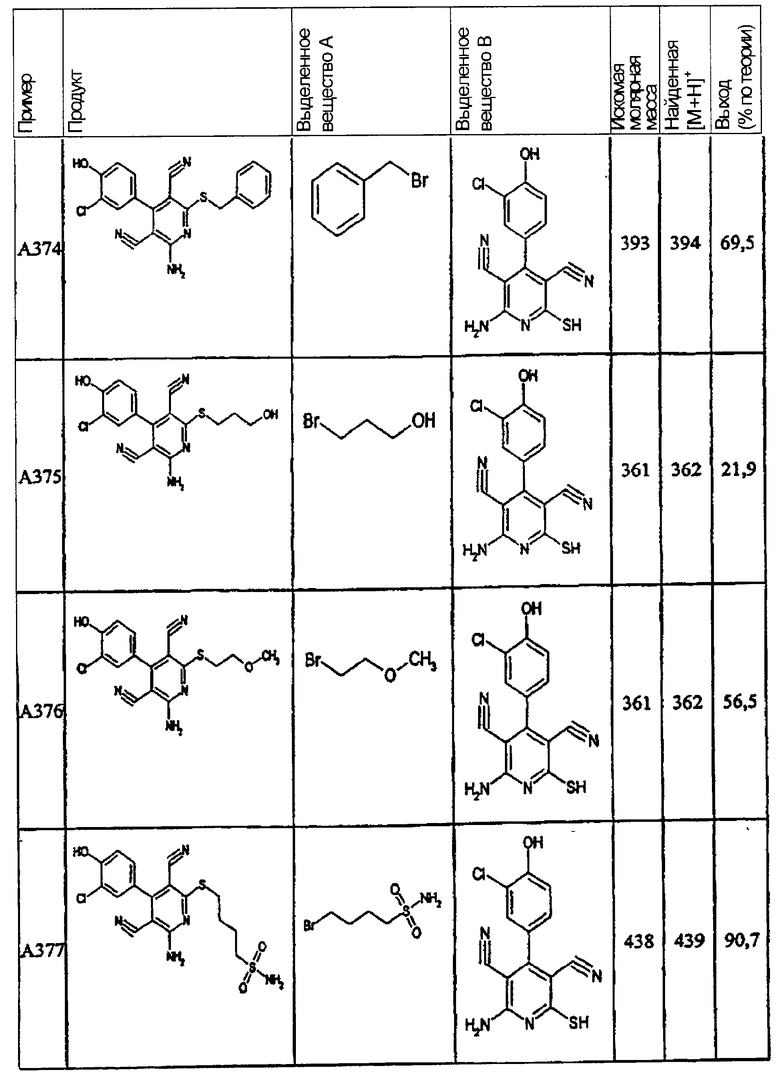
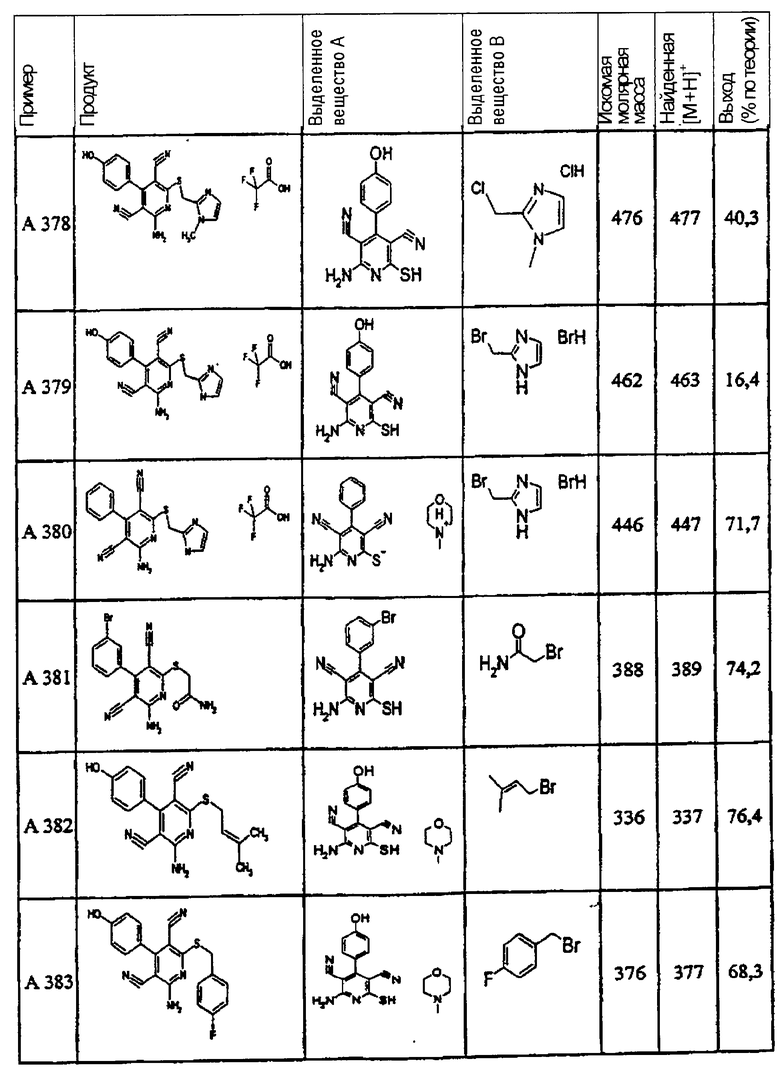
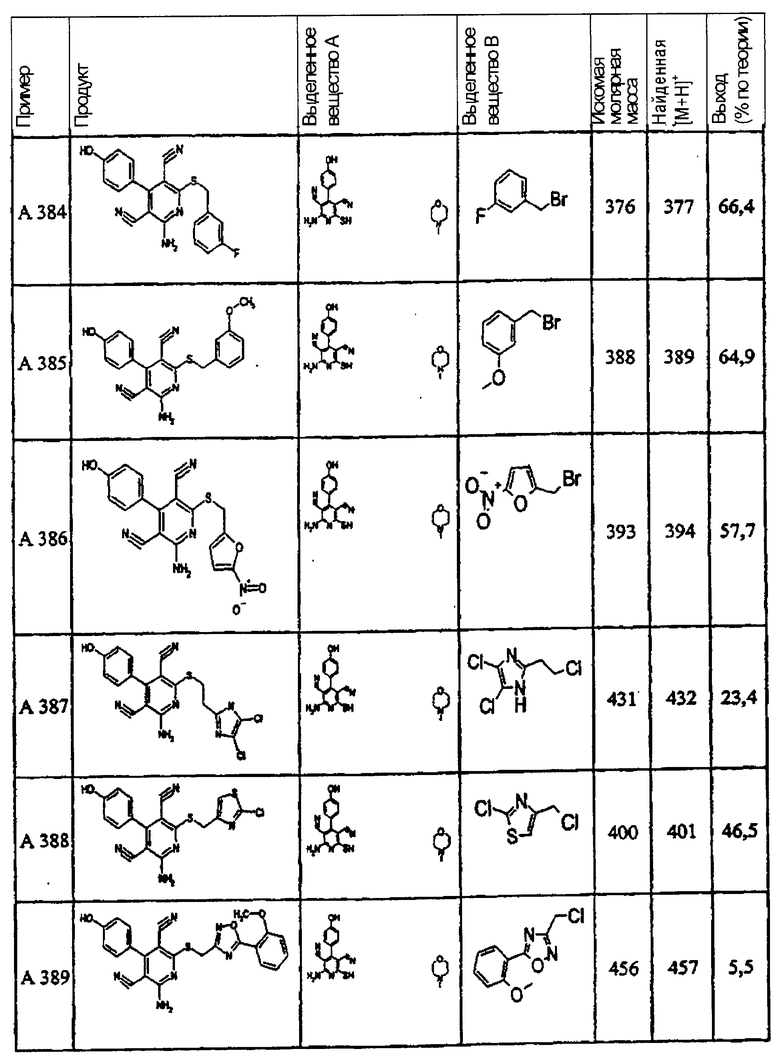
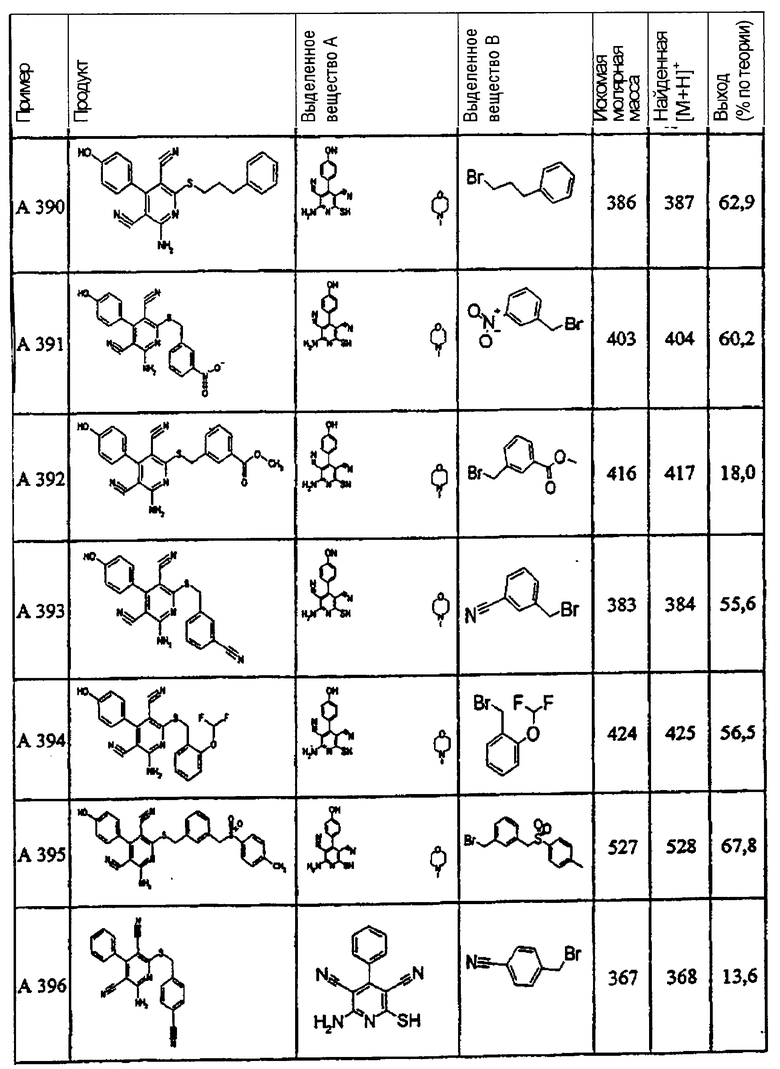
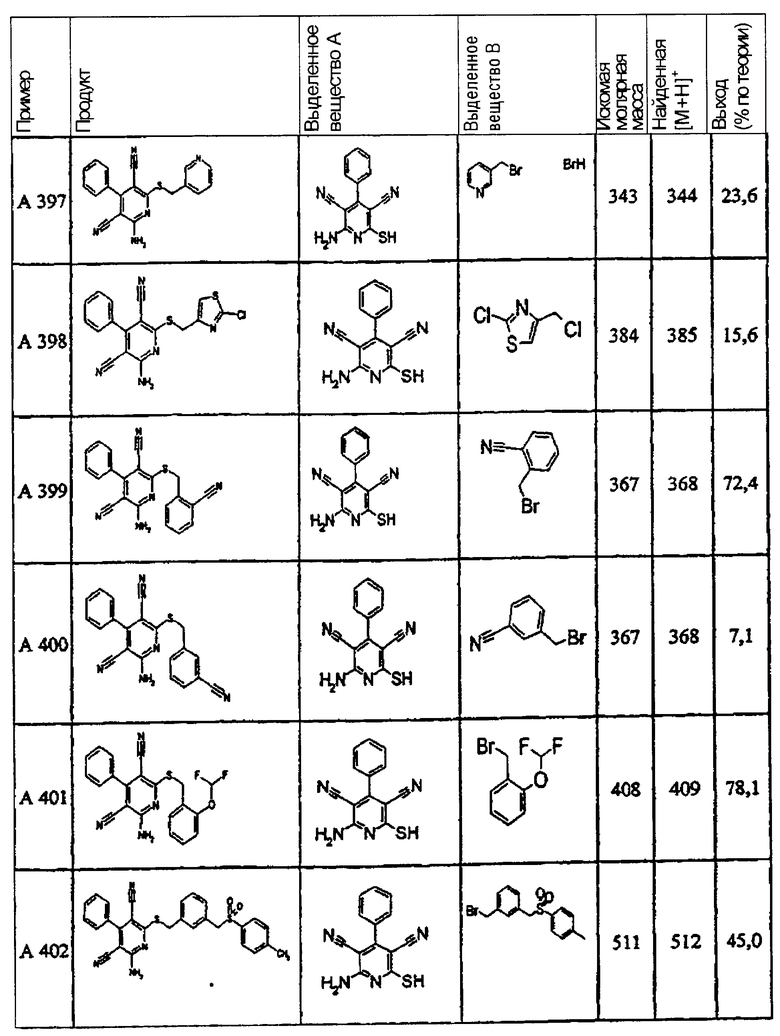

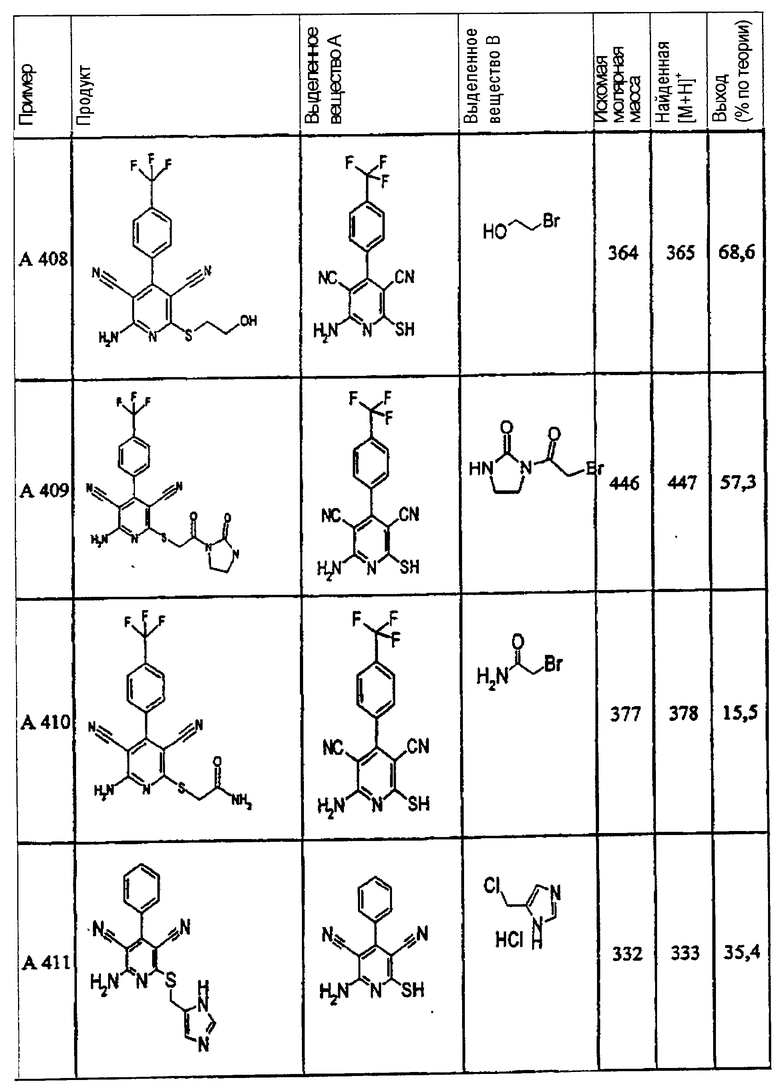
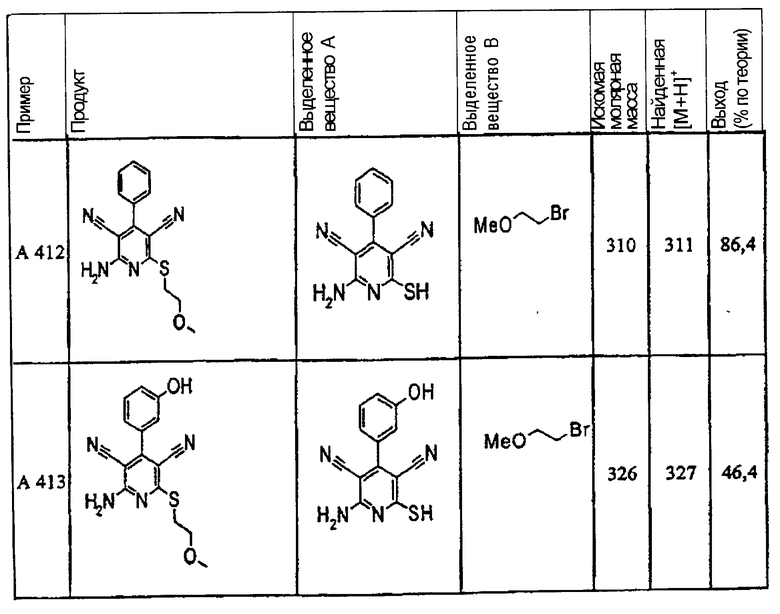
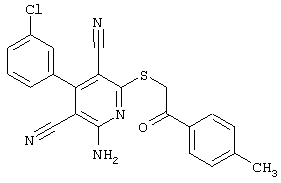
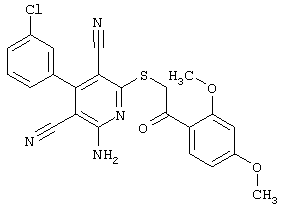
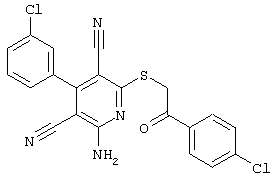

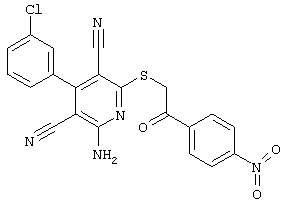
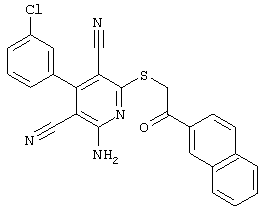

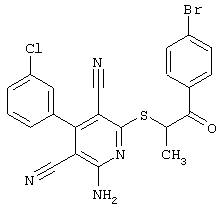

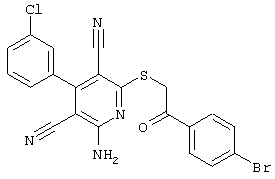
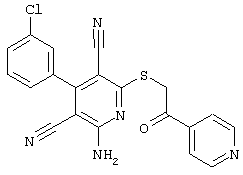
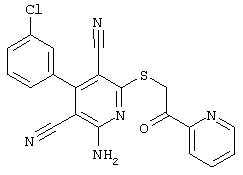

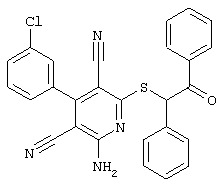
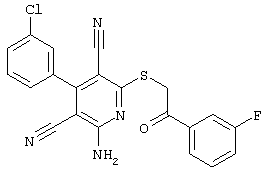
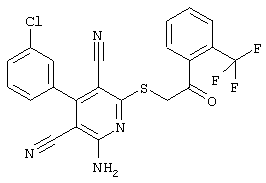

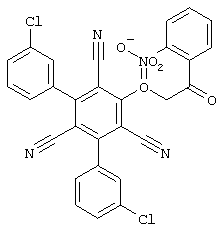
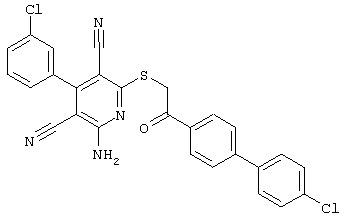
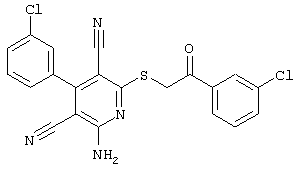
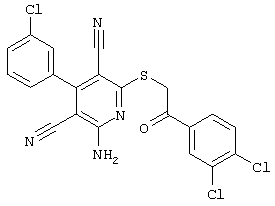
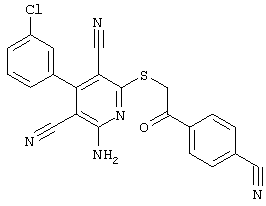
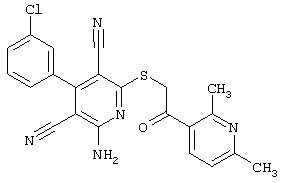
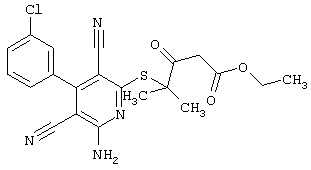

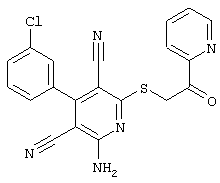
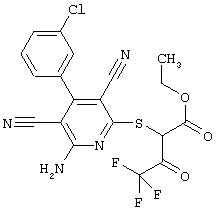
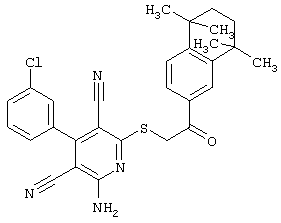
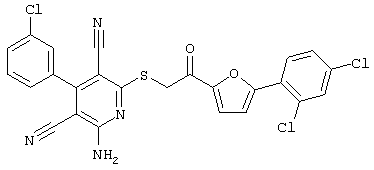
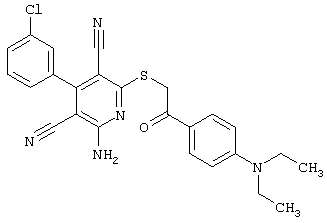
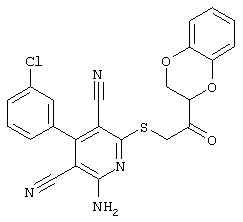

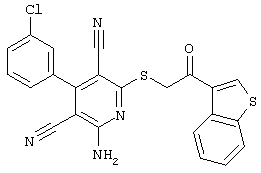
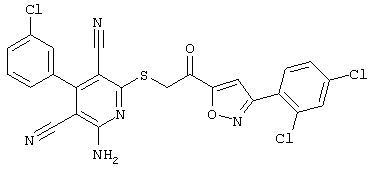
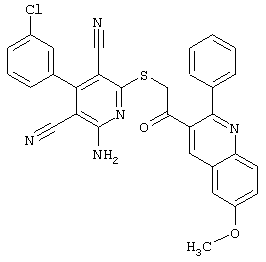
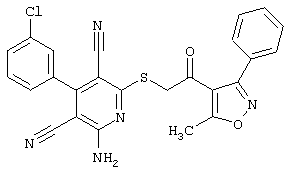
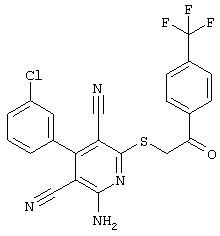
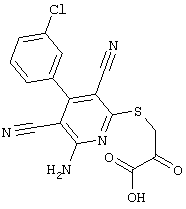
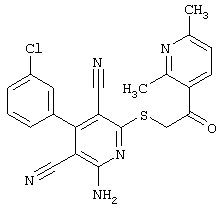
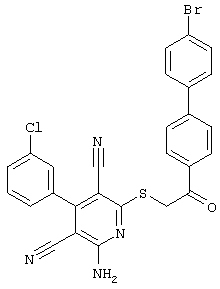

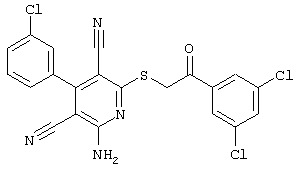
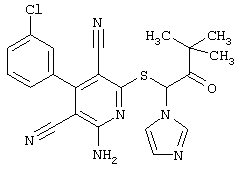
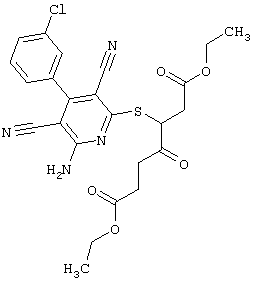
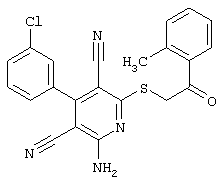
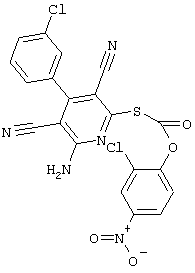
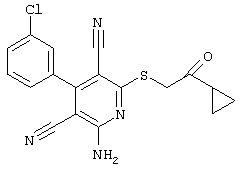
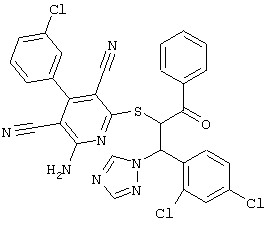
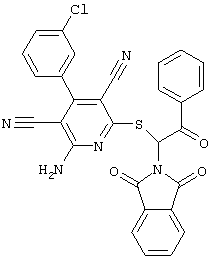
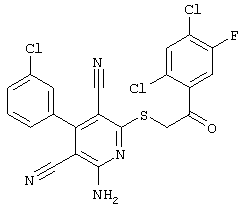
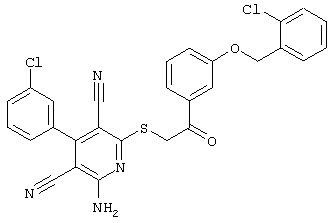
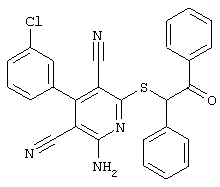
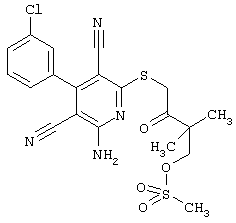
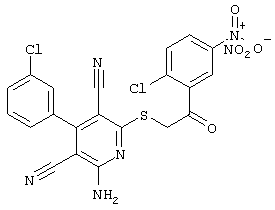


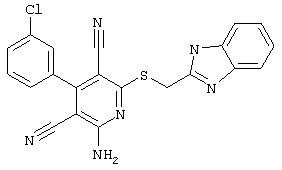
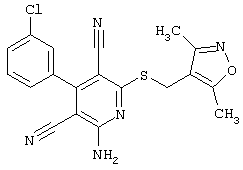
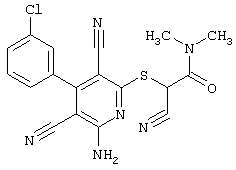
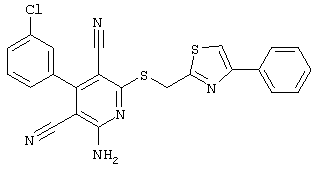
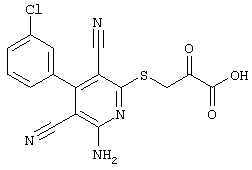
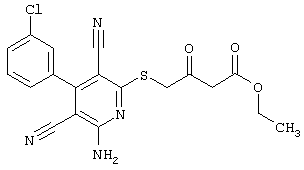
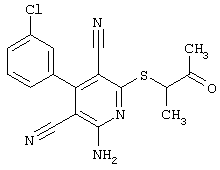
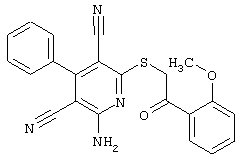
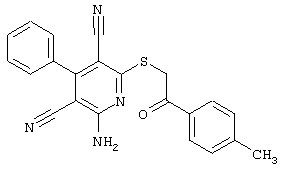
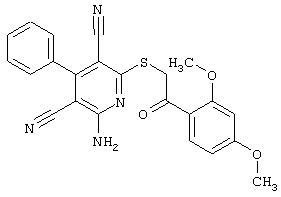
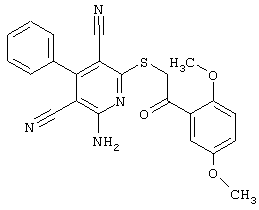
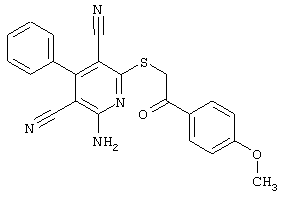
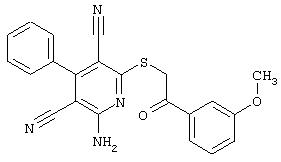
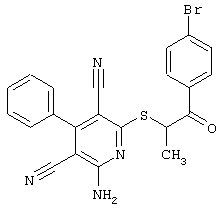
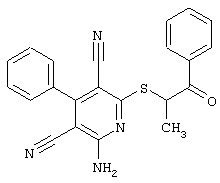
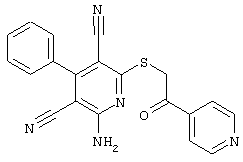
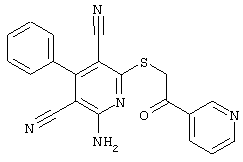

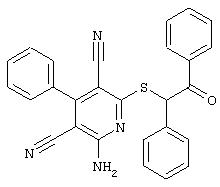

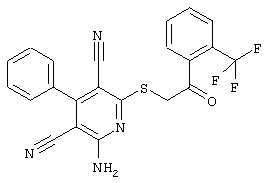
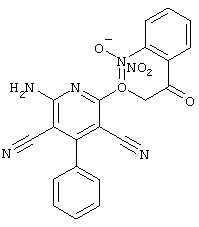
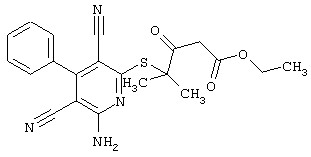
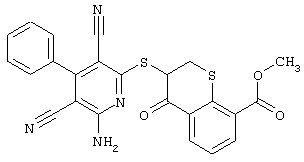
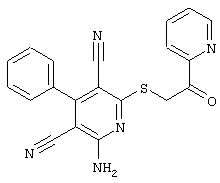
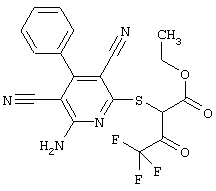

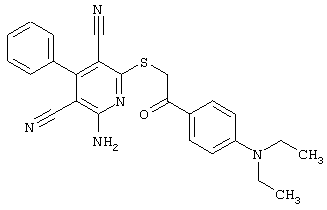
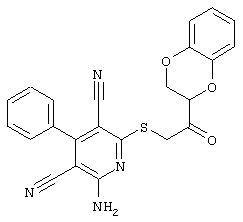
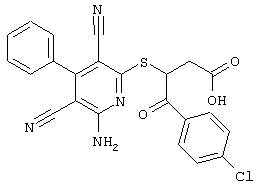
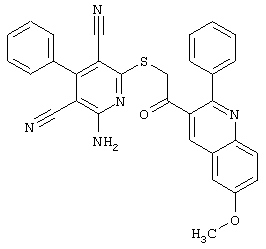
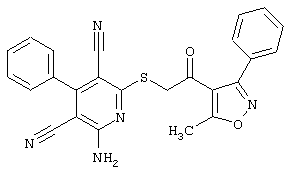
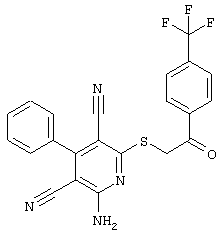
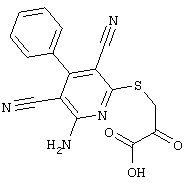
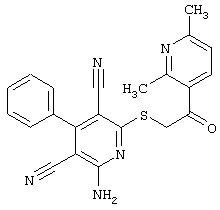
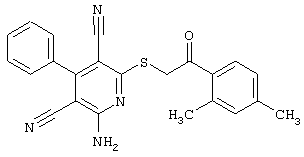
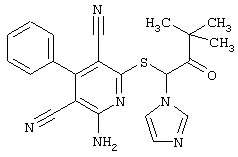
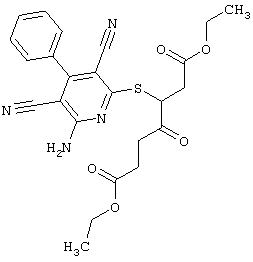
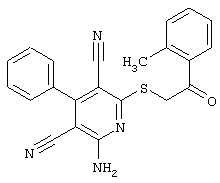
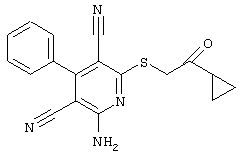
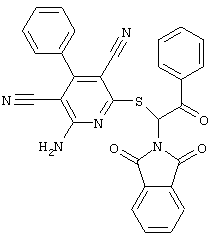
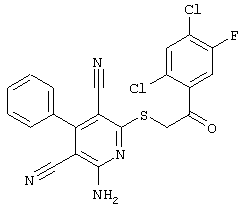
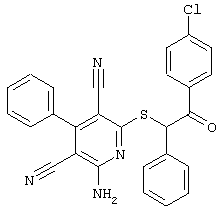

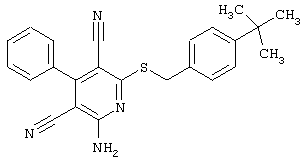
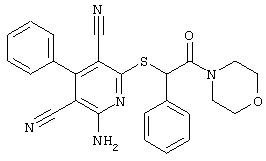
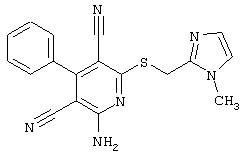

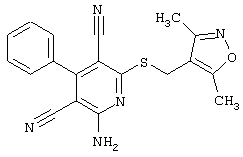
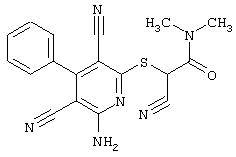
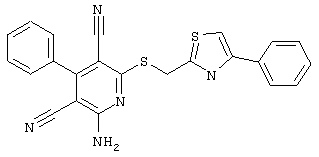

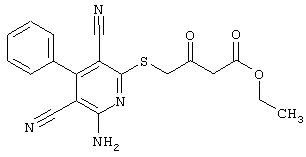

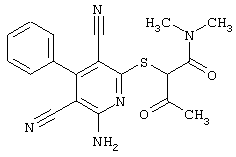
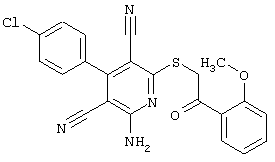
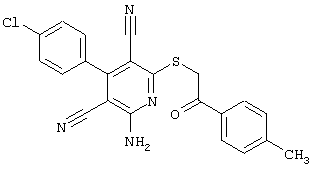
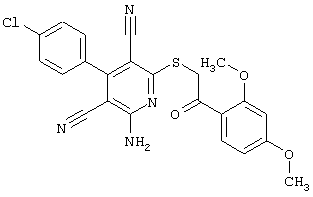
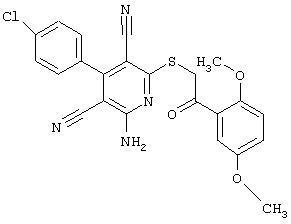

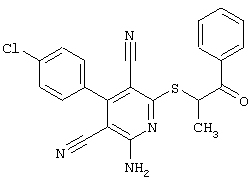
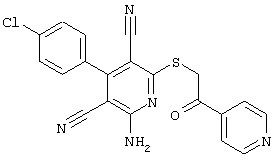
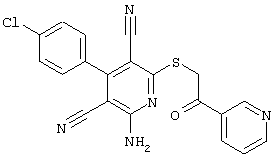
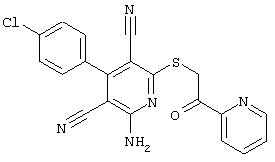
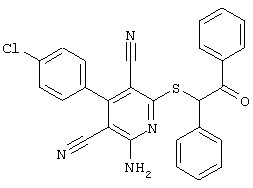
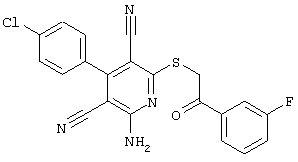
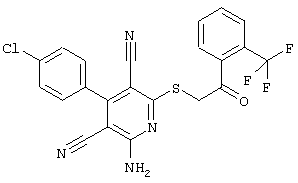
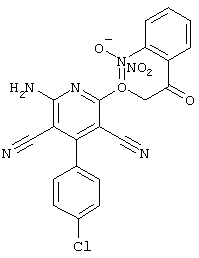
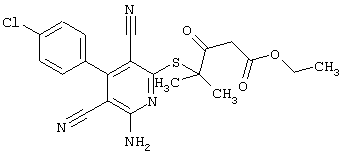
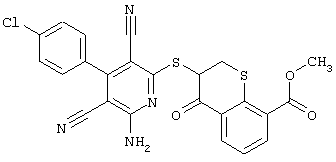
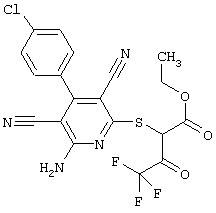
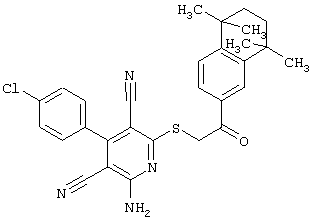
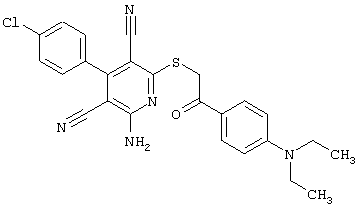
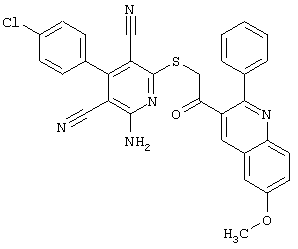
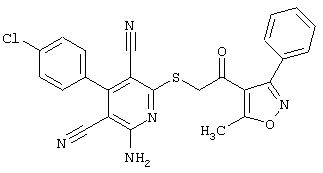
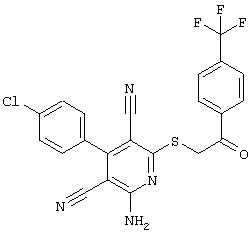
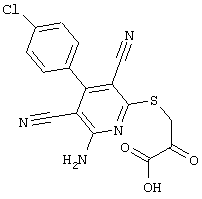
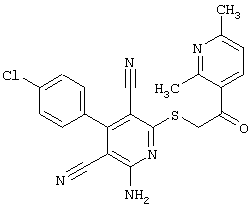
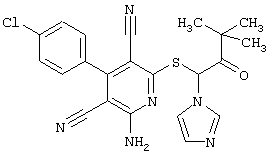


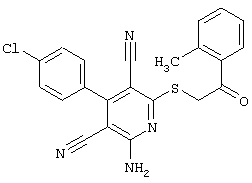
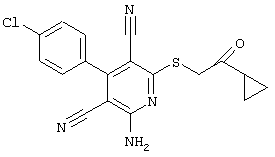
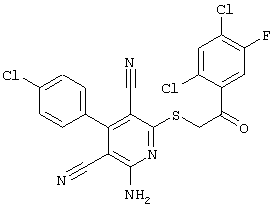
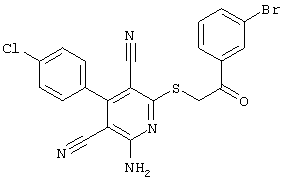
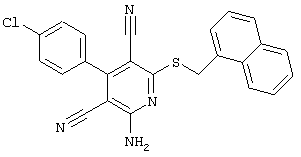
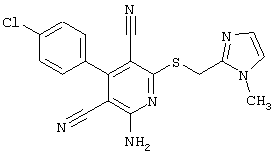
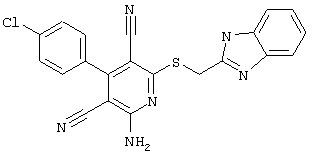
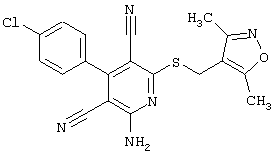
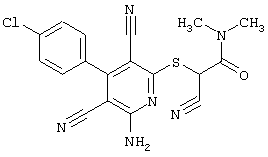
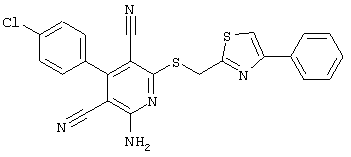
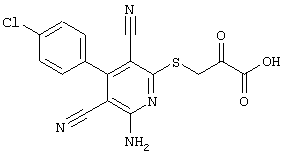
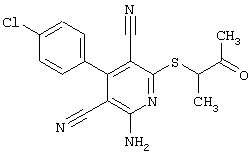
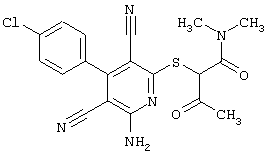
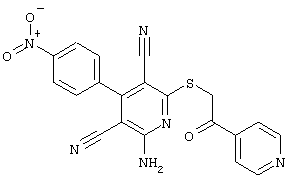
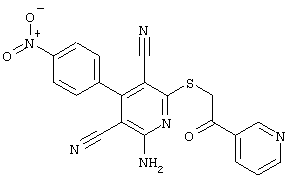
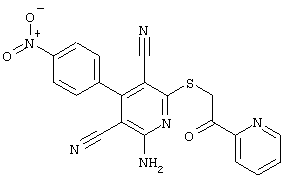
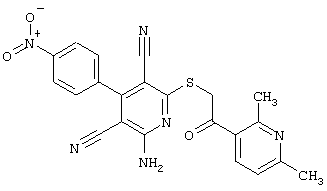
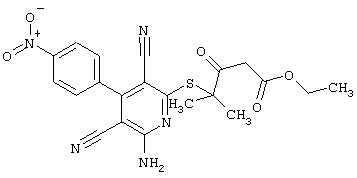
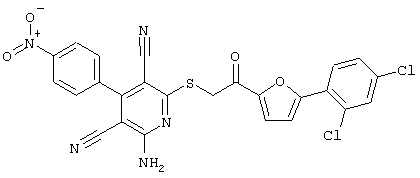

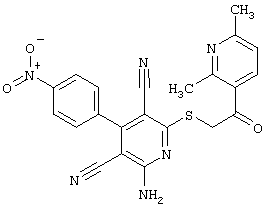
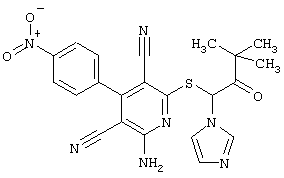
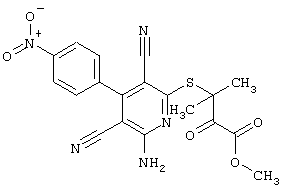
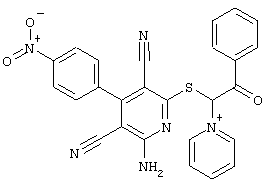
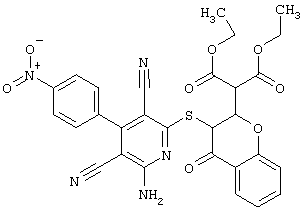
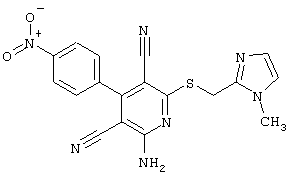
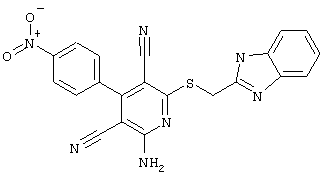
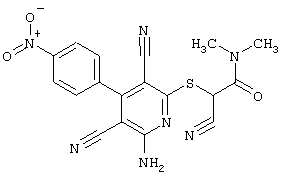
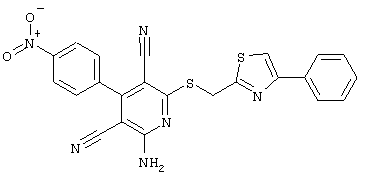
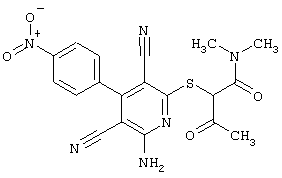
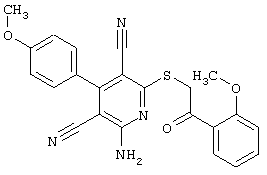
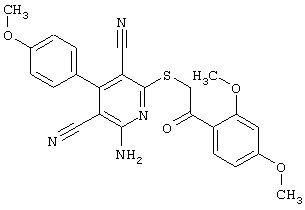
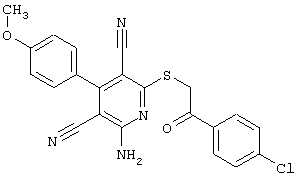

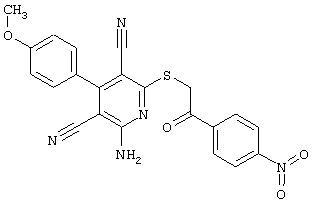
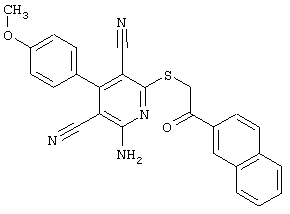

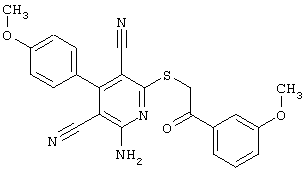
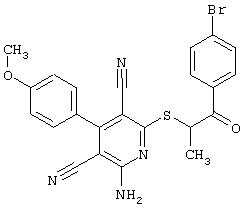
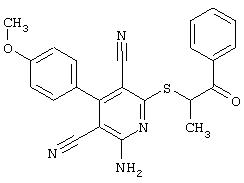
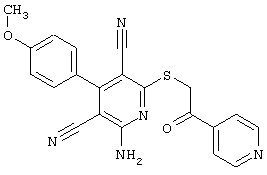
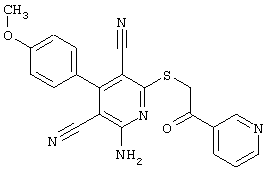
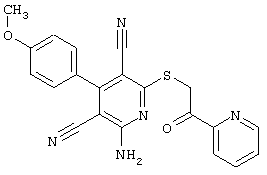
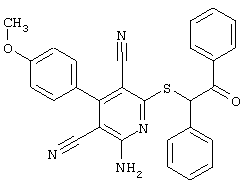
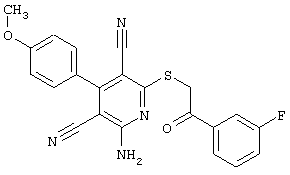
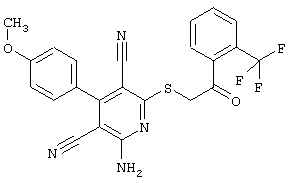
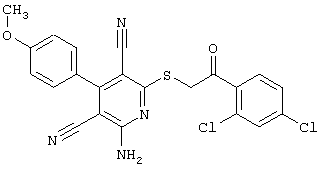
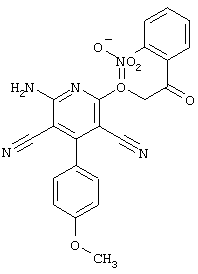
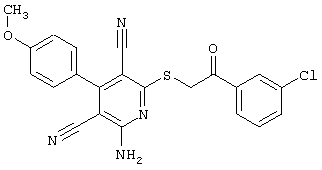

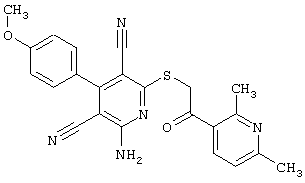
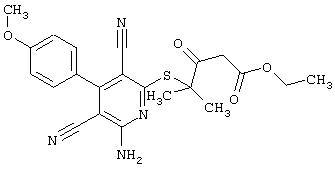
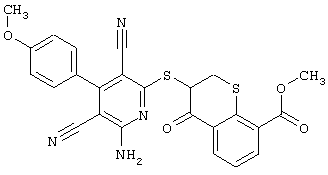
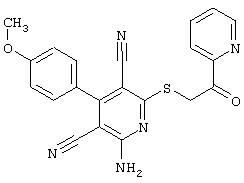
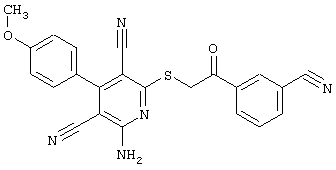
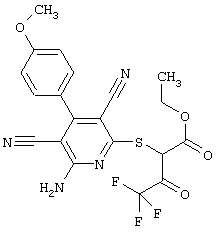
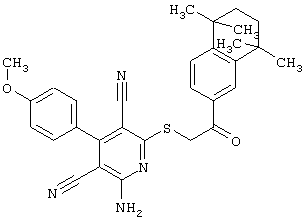
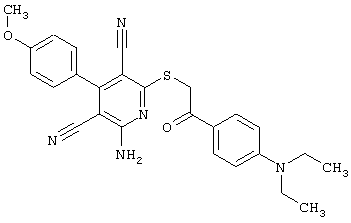
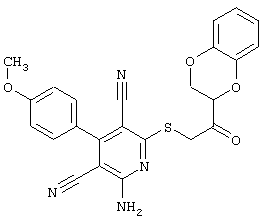
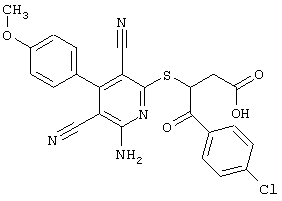
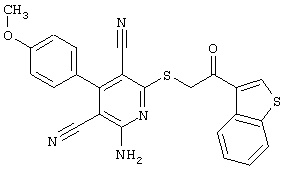
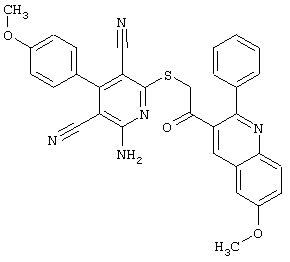
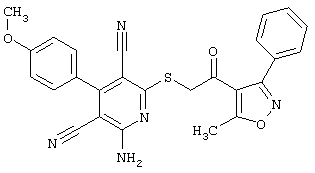
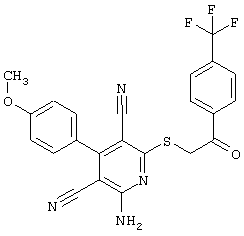

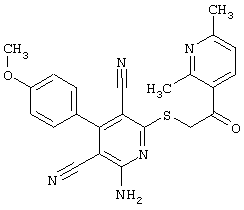
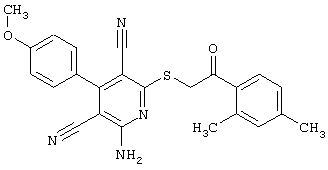
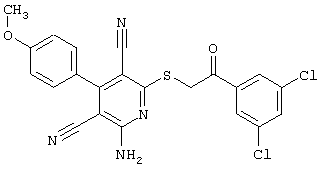
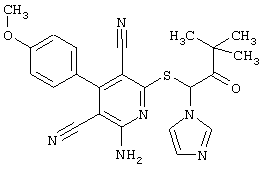
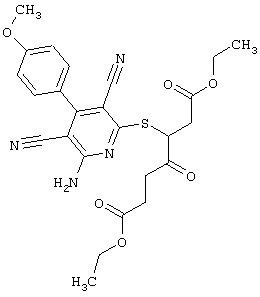

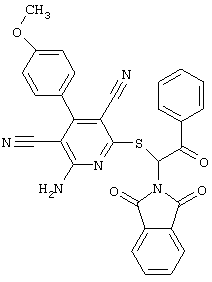
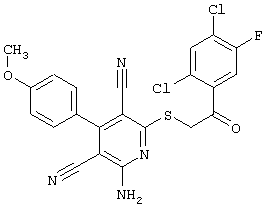
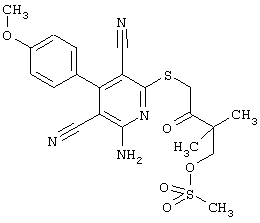
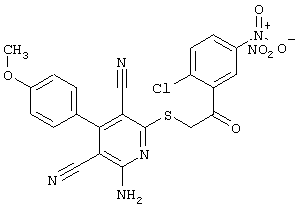
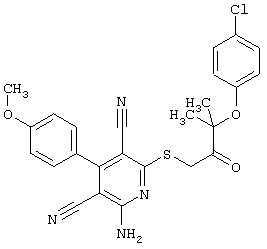

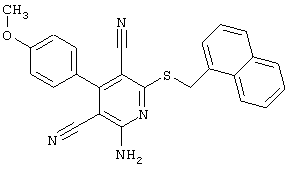
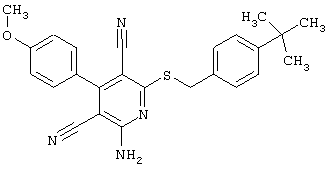
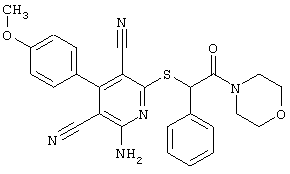
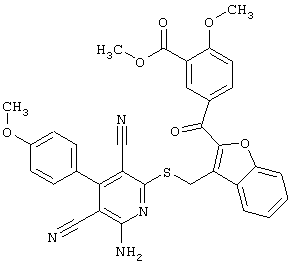

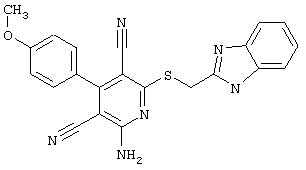
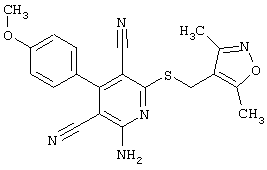
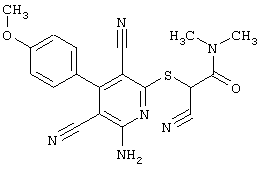

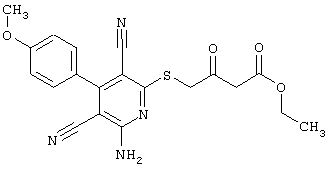
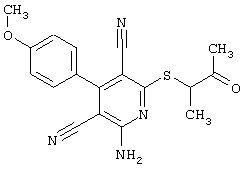
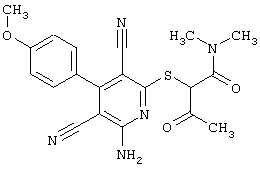
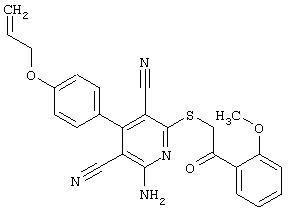
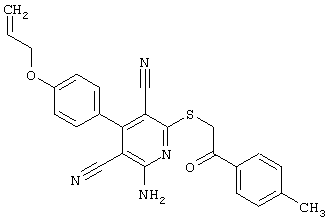
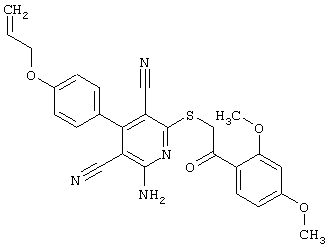
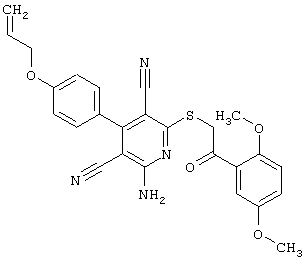
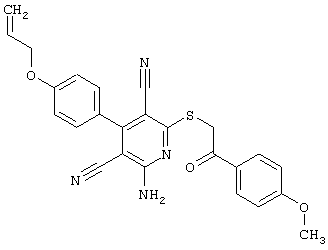
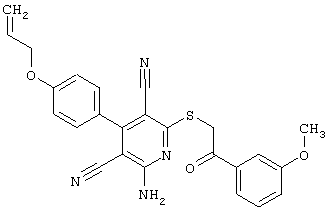
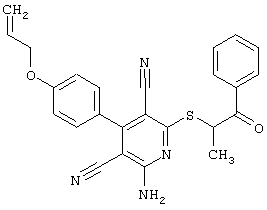
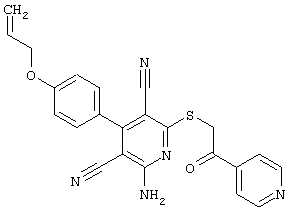
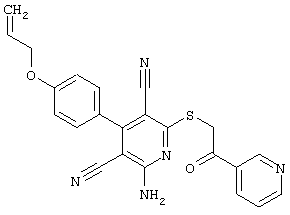
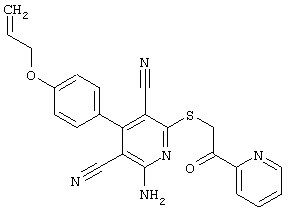
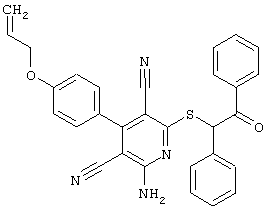
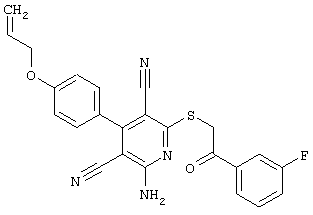
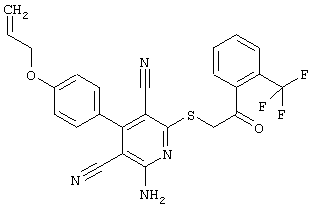
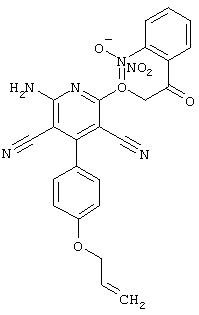
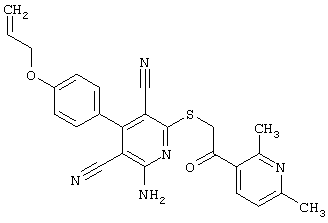
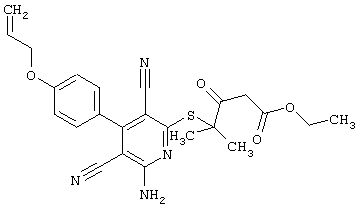
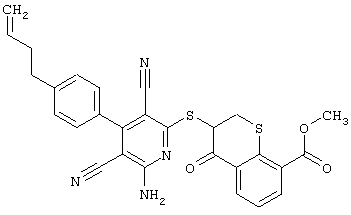
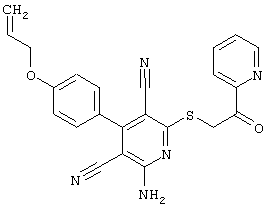

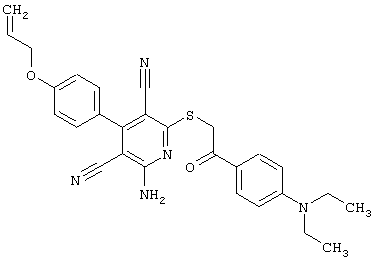
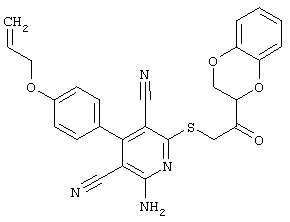
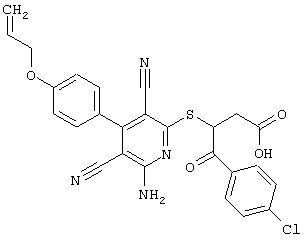
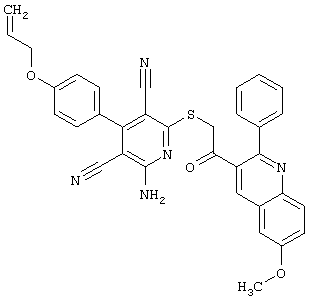
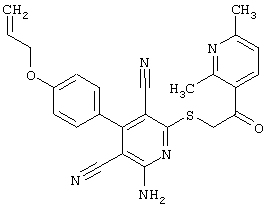
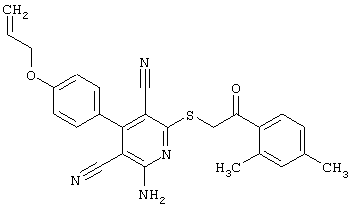
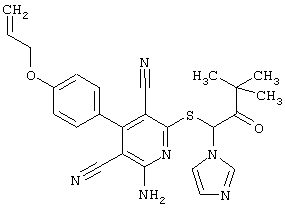
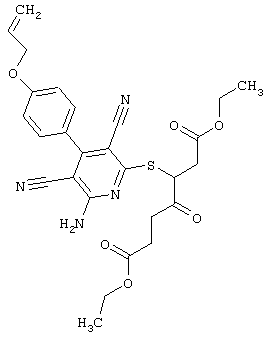
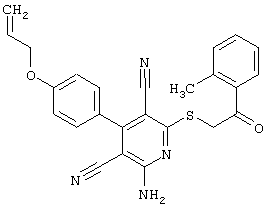

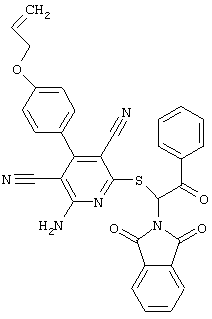
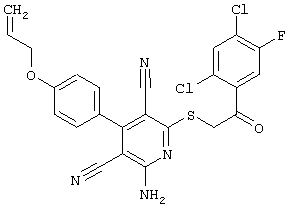
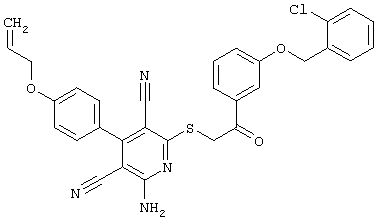
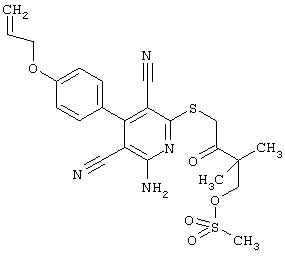

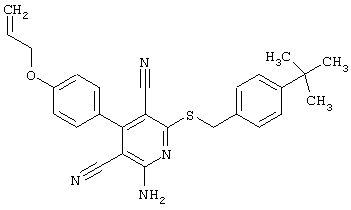
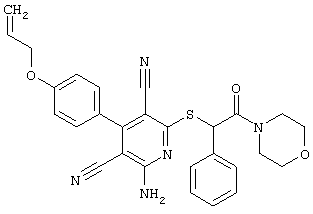
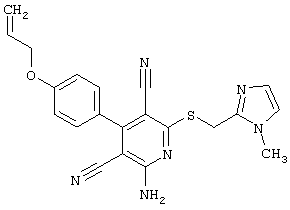
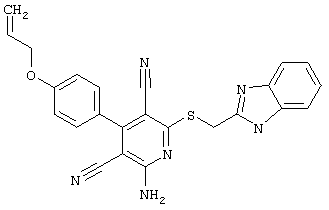
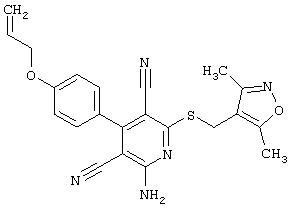
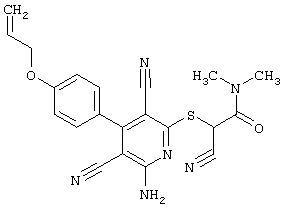
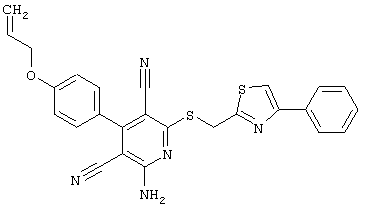
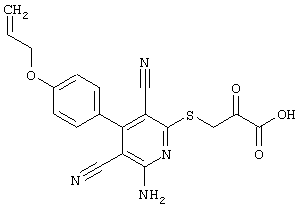
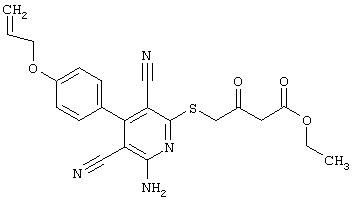
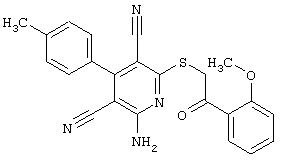
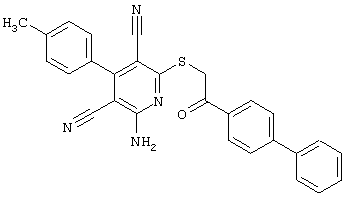
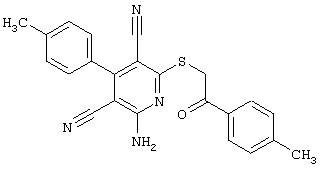
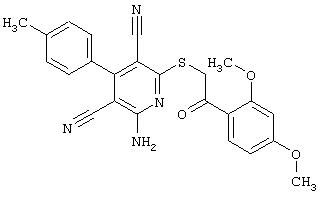
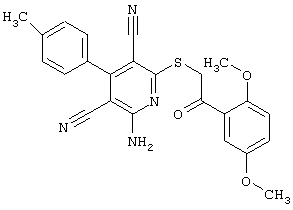
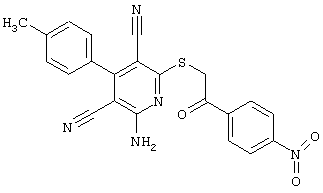
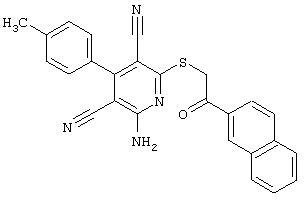
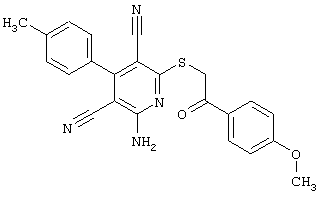

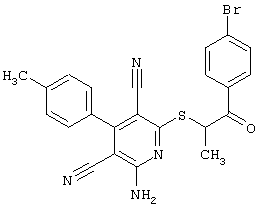
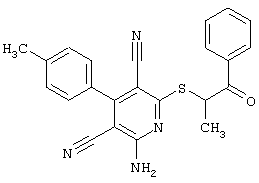
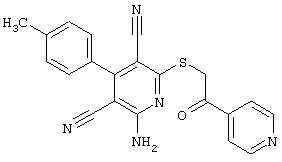
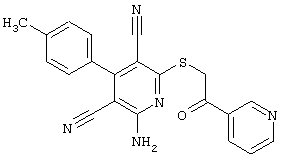
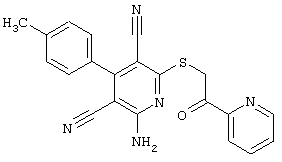
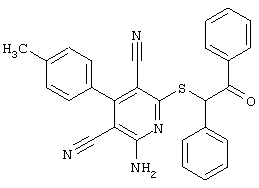
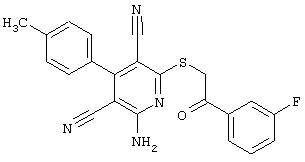
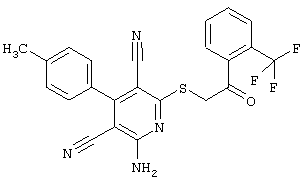
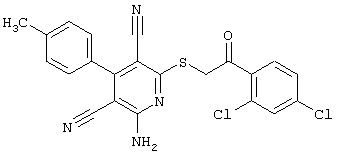
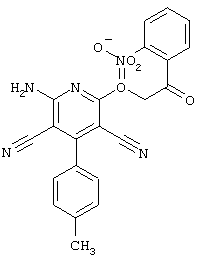
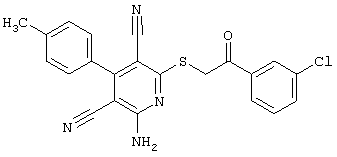
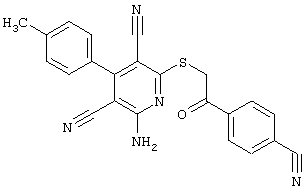
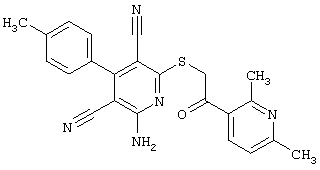
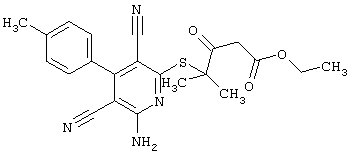
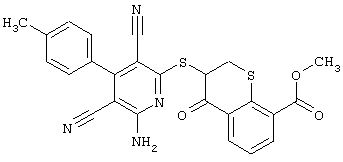
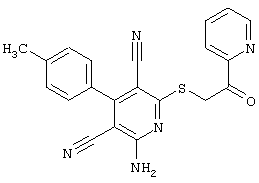
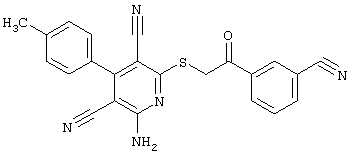
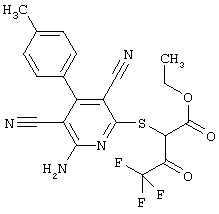
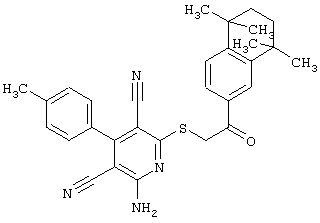
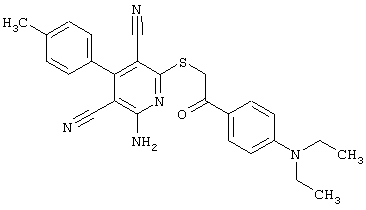
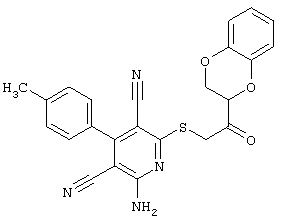
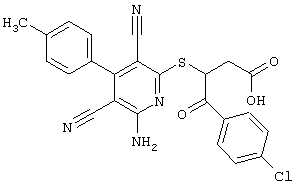
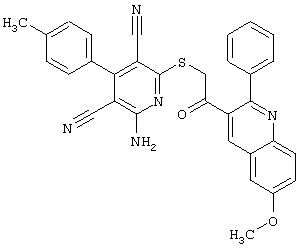
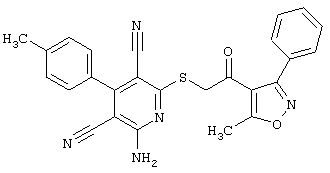
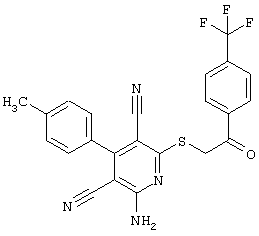
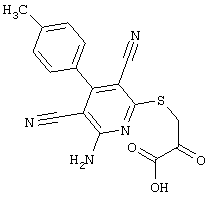
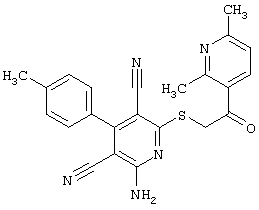
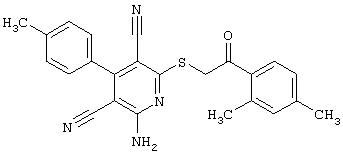
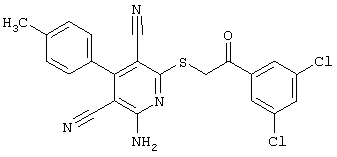
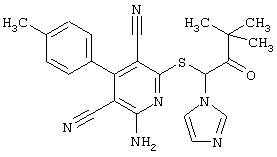
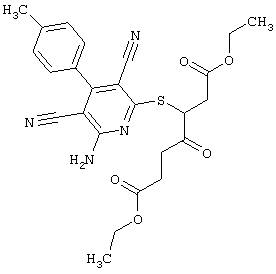
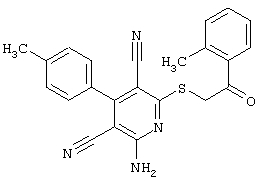
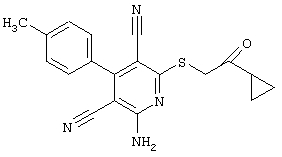
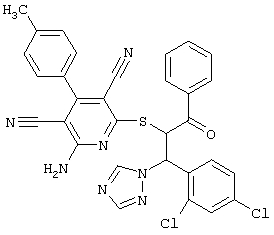
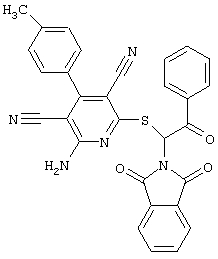
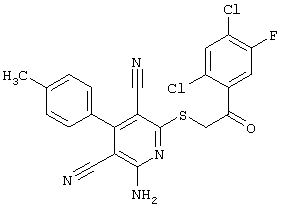
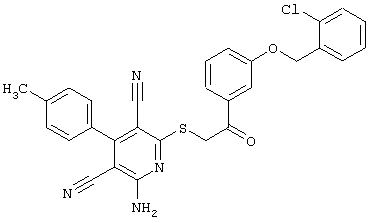
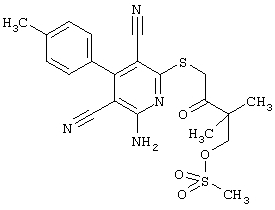
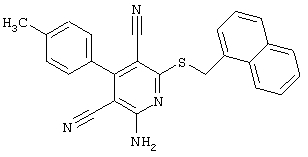
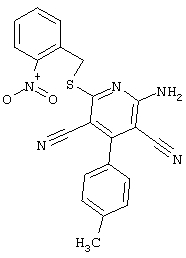
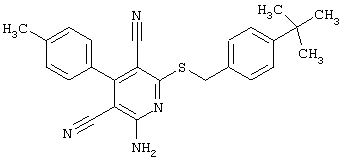
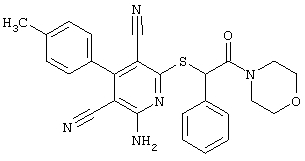
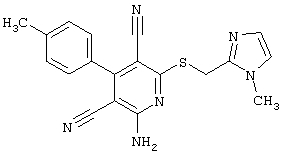
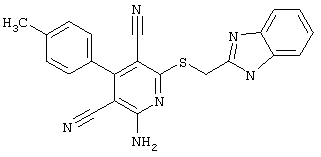
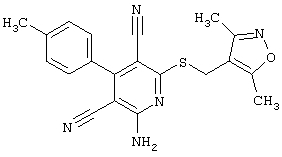
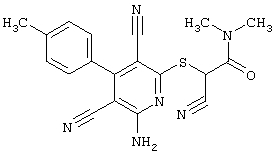
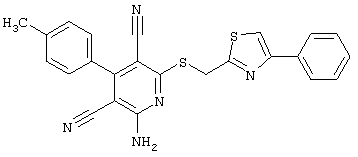
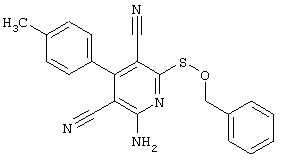
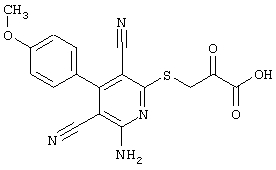
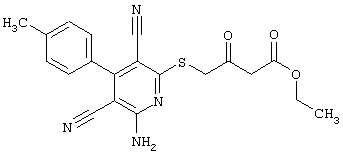
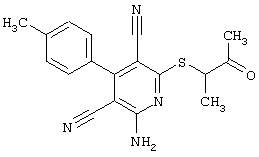
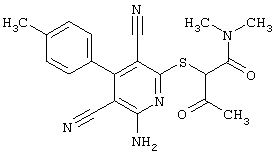

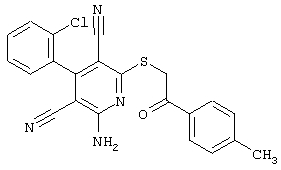
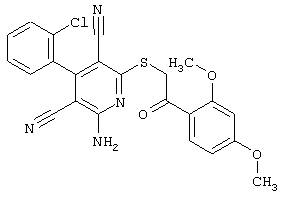
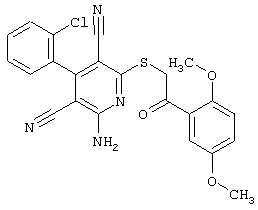
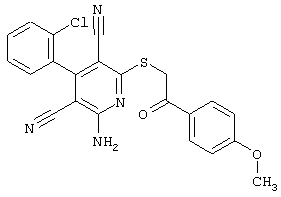
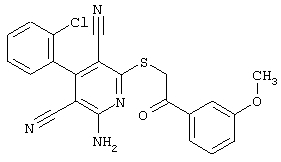
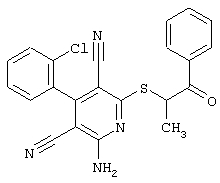
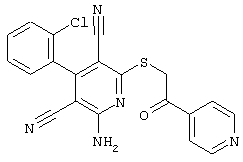

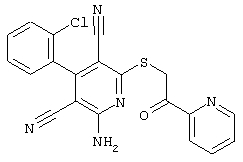
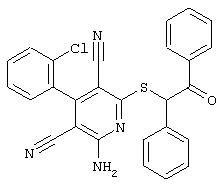
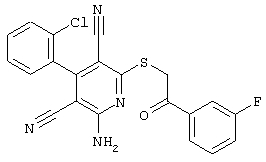
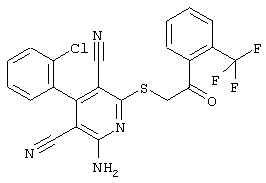
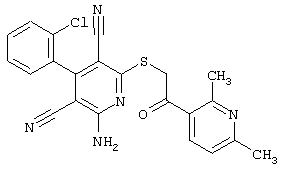
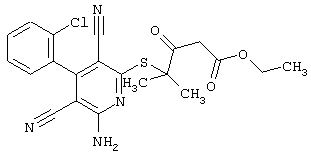
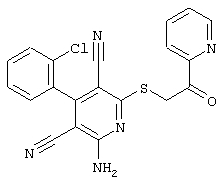
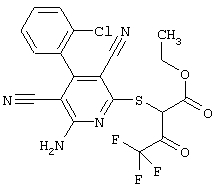
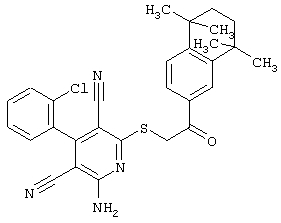
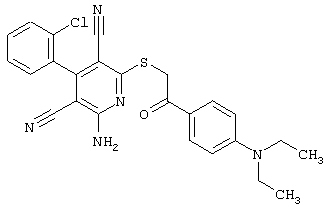
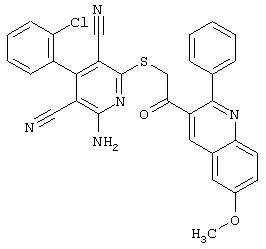
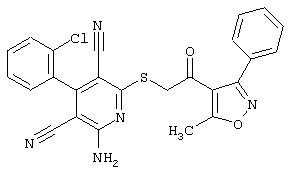
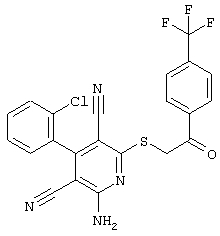
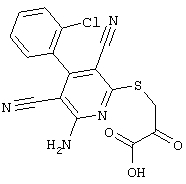
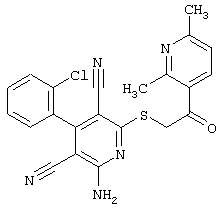
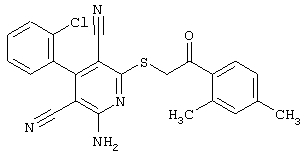
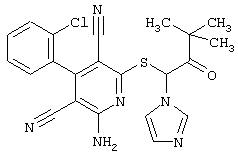
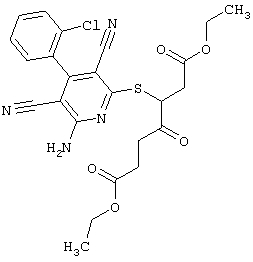
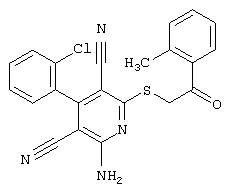
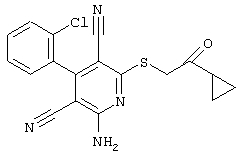
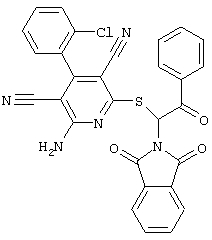
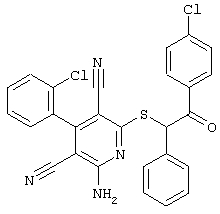
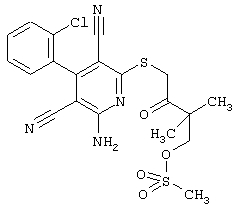
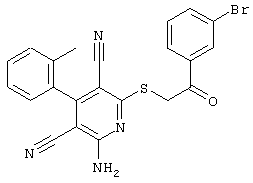
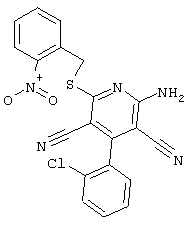
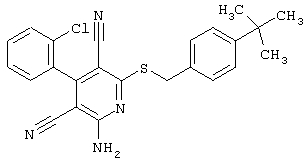
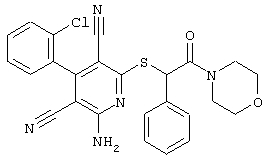
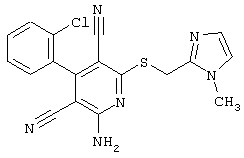
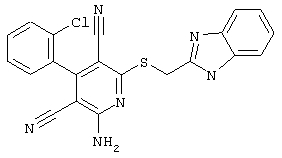
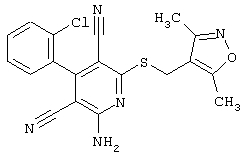
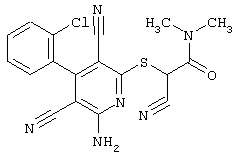
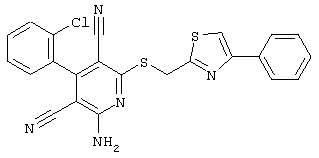
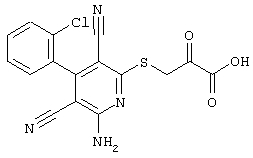
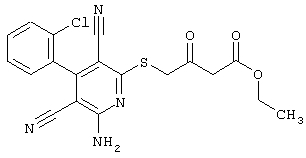
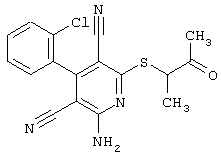
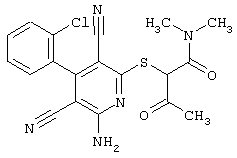
| название | год | авторы | номер документа |
|---|---|---|---|
| 5-СУЛЬФАНИЛ-4Н-1,2,4-ТРИАЗОЛЬНЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО ПРЕПАРАТА | 2002 |
|
RU2367655C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ С УМЕНЬШЕННЫМ ВЫСВОБОЖДЕНИЕМ ФЕНОЛЬНЫХ ОПИОИДОВ | 2009 |
|
RU2562583C2 |
| ЗАМЕЩЕННЫЕ 2-ТИО-3,5-ДИЦИАНО-4-ФЕНИЛ-6-АМИНОПИРИДИНЫ И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 2002 |
|
RU2315757C9 |
| ПРОЛЕКАРСТВА АНТАГОНИСТОВ A РЕЦЕПТОРА АДЕНОЗИНА | 2006 |
|
RU2415858C2 |
| ПРОИЗВОДНЫЕ КСАНТИНА И ИХ ФАРМАКОЛОГИЧЕСКИ ПЕРЕНОСИМЫЕ СОЛИ | 1993 |
|
RU2138500C1 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ПУРИНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 1997 |
|
RU2228335C2 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ РАСЩЕПЛЯЕМЫЕ ФЕРМЕНТАМИ ОПИОИДНЫЕ ПРОЛЕКАРСТВА С МОДИФИЦИРОВАННЫМ КЕТОНОМ И ИХ ДОПОЛНИТЕЛЬНЫЕ ИНГИБИТОРЫ | 2010 |
|
RU2600736C2 |
| ПИРИДО[3,2-Е]ПИРАЗИНОНЫ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, ПРЕПАРАТ НА ИХ ОСНОВЕ И СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА | 1996 |
|
RU2143433C1 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ПИРАЗОЛА И СРЕДСТВО, ОБЛАДАЮЩЕЕ ГЕРБИЦИДНОЙ АКТИВНОСТЬЮ | 1995 |
|
RU2154644C2 |
| БЕНЗОИЛЦИКЛОГЕКСАНДИОНЫ, ГЕРБИЦИДНОЕ СРЕДСТВО И СПОСОБ БОРЬБЫ С НЕЖЕЛАТЕЛЬНЫМИ РАСТЕНИЯМИ НА ИХ ОСНОВЕ | 1999 |
|
RU2237660C2 |
Изобретения относится к соединениям общей формулы (I) и фармацевтической композиции на их основе, обладающей свойствами лиганда, избирательно связывающего с рецепторами аденозина.
Технический результат: получены новые соединения, обладающие полезными биологическими свойствами. 3 н. и 3 з.п.ф-лы.
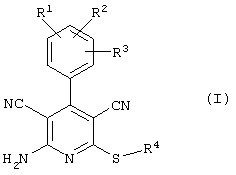
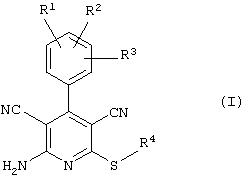
в которой
R1, R2, R3 являются одинаковыми или различными и независимо друг от друга выбраны из группы следующих значений:
водород; гидрокси; метил; трифторметил; метокси; радикалы формул -O-СН2-СН2-ОН, -O-CH2-COOH или -O-СН2-СН=СН2; фтор, хлор или бром; нитро; циано; -С(O)ОН или -С(O)ОСН3; -С(O)NH2; амино; -NH-С(O)-СН3; -O-С(O)-СН3 или -O-С(O)-С2Н5; радикалы формул
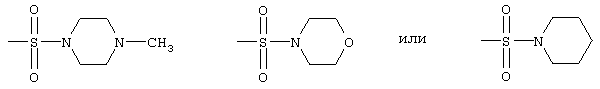
и
-NH-SO2СН3 или -NH-SO2C6H5,
и
R4 является неразветвленным или разветвленным алкилом с 1-4 атомами углерода, который, в случае необходимости, однократно или многократно замещен гидрокси;
амино; -С(O)ОСН3; -С(O)NH2, -С(O)HNCH3, -С(O)-HNC2Н5, или -С(O)-HNC6Н5; -NHC(O)NH2, -NHC(O)NHCH3, -NHC(O)NHC2Н5, -NHC(O)ОСН3 или -NHC(O)OC2Н5; -SO2-NH2; -NH-SO2-СН3 или - NH-SO2-С2Н5; метокси; фенилом, который может быть замещен нитро, циано, фтором, метокси, дифторметокси, метоксикарбонилом или п-толилсульфонилметилом; пиридилом, фурилом, имидазолилом, бензимидазолилом или тиазолилом, который соответственно однократно или двукратно, одинаково или различно может быть замещен метилом, нитро или хлором; оксадиазолилом, который может быть замещен фенилом или метоксифенилом; или радикалом формулы
или
R4 является аллилом или 3,3-диметилаллилом,
при этом соединения общей формулы (I), в которой радикалы R1, R2, R3 и R4 имеют следующие значения, исключены:
R1=R2=водород; R3=пара-ОН; R4=-CH2-Z, где Z=водород, фенил, С(O)-ОСН3, С(O)-NH2;
R1=R2=водород; R3=пара-O-С(O)-СН3; R4=-CH2-Z, где Z=водород, СН3;
R1=R2=R3=водород; R4=-CH2-Z, где Z=метил, С(O)-ОСН3;
R1=R2=водород; R3=мета-фтор; R4=-CH2-Z, где Z=С(O)-NH2;
R1=R2=водород; R3=пара-хлор; R4=-CH2-Z, где Z=метил;
R1=R2=водород; R3=пара-ОСН3; R4=-CH2-Z, где Z=метил;
R1=R2=водород; R3=мета-NO2 ;R4=-CH2-Z, где Z=метил.
водород; гидрокси; метил; метокси; радикалов формул -O-СН2-СН2-ОН, -O-СН2-СООН или -O-СН2-СН=СН2; фтор или хлор; нитро; циано; -С(O)ОН или -С(O)ОСН3; -C(O)NH2; амино; -NH-С(O)-СН3; -O-С(O)-СН3 или -O-С(O)-С2Н5; радикалы формул

и
-NH-SO2СН3 или -NH-SO2C6H5,
R4 является неразветвленным или разветвленным алкилом с 1-4 атомами углерода, который, в случае необходимости, однократно или многократно замещен гидрокси;
амино; -С(O)ОСН3; -С(O)-NH2, -С(O)-HNCH3, -C(O)-HNC2Н5, или -С(O)-HNC6Н5; -NHC(O)NH2, -NHC(O)NHCH3, -NHC(O)NHC2Н5, -NHC(O)ОСН3 или -NHC(O)ОС2Н5; -SO2-NH2; -NH-SO2-СН3 или - NH-SO2-С2Н5; метокси; фенилом; орто-нитрофенилом; или радикалами формулы
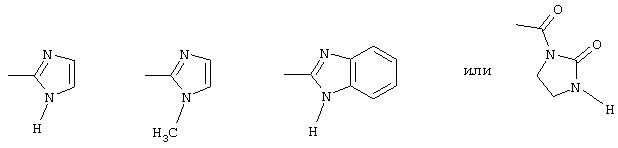
или
R4 является аллилом,
при этом соединения общей формулы (I), в которой радикалы R1, R2, R3 и R4 имеют следующие значения, исключены:
R1=R2=водород; R3=пара-ОН; R4=-CH2-Z, где Z=водород, фенил, С(O)-ОСН3, C(O)-NH2;
R1=R2=водород; R3=пара-O-С(O)-СН3; R4=-CH2-Z, где Z=водород, СН3;
R1=R2=R3=водород; R4=-CH2-Z, где Z=метил, С(O)-ОСН3;
R1=R2=водород; R3=мета-фтор; R4=-CH2-Z, где Z=С(O)-NH2;
R1=R2=водород; R3=пара-хлор; R4=-CH2-Z, где Z=метил;
R1=R2=водород; R3=пара-ОСН3; R4=-CH2-Z, где Z=метил;
R1=R2=водород; R3=мета-NO2 ;R4=-CH2-Z, где Z=метил.
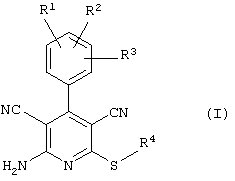
в которой
R1, R2, R3 являются одинаковыми или различными и независимо друг от друга выбраны из группы следующих значений:
водород; гидрокси; метил; трифторметил; метокси; радикалы формул -O-СН2-СН2-ОН, -O-СН2-СООН или -O-СН2-СН=СН2; фтор, хлор или бром; нитро; циано; -С(O)ОН или -С(O)ОСН3; -C(O)NH2; -NH2; -NH-С(O)-СН3; -O-С(O)-СН3 или -O-С(O)-С2Н5; радикалов формул

и
-NH-SO2СН3 или -NH-SO2C6Н5,
R4 является неразветвленным или разветвленным алкилом с 1-4 атомами углерода, который, в случае необходимости, однократно или многократно замещен гидрокси;
амино; -С(O)ОСН3; -С(O)NH2, -С(O)HNCH3, -C(O)-HNC2Н5, или -С(O)-HNC6Н5; -NHC(O)NH2, -NHC(O)NHCH3, -NHC(O)NHC2Н5, -NHC(O)ОСН3 или -NHC(O)OC2Н5; -SO2-NH2; -NH-SO2-СН3 или - NH-SO2-С2Н5; метокси; фенилом, который может быть замещен нитро, циано, фтором, метокси, дифторметокси, метоксикарбонилом или п-толилсульфонилметилом; пиридилом, фурилом, имидазолилом, бензимидазолилом или тиазолилом, который соответственно однократно или двукратно, одинаково или различно может быть замещен метилом, нитро или хлором; оксадиазолилом, который может быть замещен фенилом или метоксифенилом; или радикалом формулы

или
R4 является аллилом или 3,3-диметилаллилом, в качестве средства, обладающего свойствами лиганда, избирательно связывающего с рецепторами аденозина.
водород; гидрокси; метил; метокси; радикалы формул -O-СН2-СН2-ОН, -О-CH2-СООН или -O-СН2-СН=СН2; фтор или хлор; нитро; циано; -С(O)ОН или -С(O)ОСН3; -С(O)NH2; амино; -NH-С(O)-СН3; -O-С(O)-СН3 или -О-С(O)-С2Н5; радикалы формул
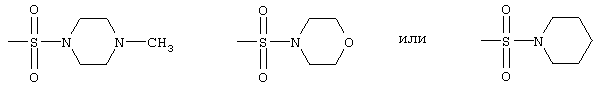
и
-NH-SO2СН3 или -NH-SO2C6Н5,
R4 является неразветвленным или разветвленным алкилом с 1-4 атомами углерода, который, в случае необходимости, однократно или многократно замещен гидрокси;
амино; -С(O)ОСН3; -С(O)NH2, -С(O)HNCH3, -C(O)-HNC2Н5, или -С(O)-HNC6Н5; -NHC(O)NH2, -NHC(O)NHCH3, -NHC(O)NHC2Н5, -NHC(O)ОСН3 или -NHC(O)OC2Н5; -SO2-NH2; -NH-SO2-СН3 или - NH-SO2-С2Н5; метокси; фенилом; орто-нитрофенилом; или радикалами формулы

или
R4 является аллилом,
в качестве средства, обладающего свойствами лиганда, избирательно
связывающего с рецепторами аденозина.
| WO 9921617 A, 06.05.1999.US 5227485 A, 13.07.1993.SU 1620049 A3, 07.01.1991. |
Авторы
Даты
2006-01-10—Публикация
2000-09-19—Подача