Изобретение относится к медицине, а именно к анестезиологии, и может быть использовано при различных хирургических манипуляциях, требующих проведения общей анестезии.
Объективизация адекватности компонентов анестезиологического пособия является одной из первоочередных задач анестезиологии. Повсеместно используемая в клинической практике оценка таких компонентов анестезии как сознание, аналгезия, нейровегетативное торможение основывается на косвенных критериях (изменение параметров гемодинамики, оценка состояния кожных покровов, величины зрачка, слезотечение и т.д.), не гарантирует объективности полученной информации, безопасности и комфортности оперируемого больного. Методы обработки нативной электроэнцефалограммы (SEF 90%, BIS, ИНЭЭГ, АЕР) позволяют с определенной степенью объективности контролировать уровень сознания, а применение кардиоинтервалографии и стимуляционной миографии - обеспечить адекватность оценки вегетативного статуса и миорелаксации.
Однако, сенсорная чувствительность, прежде всего болевая, в процессе анестезии практически не мониторируется, тогда как ее клиническая значимость, особенно при регионарных блокадах, чрезвычайно высока. Оценка чувствительности ограничивается субъективным критерием «pin prick» - покалыванием иглой в зонах возможного распространения регионарного блока и оценки пациентом выраженности болевых ощущений по (остро - тупо - нет ощущений) (см., например, Lanz E., et al.The extent of blockade following various techniques of brachial plexus block. // Anesth. Analg., 1983, V.62, №1, p.55-61). Метод не позволяет оценить глубину сенсорной блокады у пациентов с измененным уровнем сознания, а некоторые больные могут агравировать или испытывают аллодинию, что искажает оценку полученных данных.
Известна возможность использования моносинаптического Н-рефлекса при стимуляционной миографии для объективизации динамики развития регионарной блокады (см., Гнездилов А.В. Диагностика и лечение фантомного и вертеброгенного болевых синдромов // Дисс. докт. мед. наук, Москва, 1999). Метод дает достаточно объективную информацию о развитии глубины сенсорного блока и купировании болевого синдрома, но требует стабильных условий при регистрации миографического ответа и появления в связи с этим различных «наводок». К тому же, метод применим для оценки развития сенсорной блокады только на нижних конечностях.
Использование соматосенсорных вызванных потенциалов также не получило распространения из-за трудности реализации данной методики в условиях операционной (см. Женило В.М. и др. Компьютерный анализ некоторых компонентов общей анестезии // Анестезиология и реаниматология, №3, 2001, с.6-8). Кроме того, с помощью этого метода возможно оценить только выраженность аналгезии.
Существуют и патентные публикации. Так, известна подача звуковых стимулов пациенту, находящемуся в состоянии анестезии, и регистрация отклика посредством электродов, укрепленных на голове. Эффективность анестезии анализируют по амплитудно-частотным характеристикам электрического сигнала, с использованием адаптивной цифровой обработки (US 5891050, 06.04.1999). В изобретении ЕР 1273265, 08.01.2003 описан метод мониторинга по параметрам кардиоваскулярной активности.
Известны способ и устройство для мониторинга и/или контроля нейромышечного блока в процессе анестезии (ЕР 0787506, 06.08.1997). Способ состоит в воздействии стимула - электрического импульса миостимуляции и регистрации отклика на этот стимул посредством измерения давления манжетки стандартного тонометра для мониторинга нейромышечного блока. Устройство содержит средства для генерации стимула - генератор электрического импульса миостимуляции и средства измерения изменения давления манжетки стандартного тонометра, а также средства для мониторинга нейромышечного блока. Однако из анализа изобретения нельзя сделать вывод о том, что в процессе анестезии при регионарных блокадах возможно контролировать сенсорную чувствительность. Известно, однако, что кожно-гальваническая реакция (КГР) является компонентом ориентировочного рефлекса на различные раздражители, причем регистрация КГР может осуществляться посредством обычного электроэнцефалографа (см. Осипова Н.А. Оценка эффекта наркотических, анальгетических и психотропных средств в клинической анестезиологии. Л., Медицина, 1988, с.48-51).
Наиболее близкими по технической сущности и совокупности признаков к патентуемой группе изобретений являются способ и устройство для оценки сенсорной чувствительности в условиях анестезии (US 4570640, 18.02.1986). Стимул в виде импульсов электрического тока прикладывается к коже пациента посредством электродов на один или более участков тела пациента и фиксируется отклик на стимул посредством регистрации электродами кожно-гальванической реакции пациента на участках тела, не подвергавшихся воздействию стимула, по наличию которой судят о сохранении сенсорной чувствительности. Устройство для оценки сенсорной чувствительности в условиях анестезии содержит группу электродов для подачи стимулирующих импульсов и датчики физиологических реакций с соответствующими электродами, подключенные к блоку управления и регистрации, включающему индикатор.
Технический результат изобретений состоит в повышении достоверности определения сенсорной чувствительности путем учета индивидуальных порогов стимулирующего воздействия и оптимизации времени регистрации кожно-гальванической реакции. Дополнительный технический результат - возможность оценки психоэмоционального состояния пациента, в том числе под общей анестезией.
Технический результат достигается тем, что способ оценки сенсорной чувствительности в условиях анестезии состоит в воздействии стимула в виде импульсов электрического тока, прикладываемых к коже пациента посредством электродов, на один или более участков тела пациента и фиксации отклика на стимул посредством регистрации электродами кожно-гальванической реакции пациента на участках тела, не подвергавшихся воздействию стимула, по наличию которой судят о сохранении сенсорной чувствительности. Предварительно, в отсутствие анестезии, для каждого участка кожи пациента, к которому прикладываются импульсы электрического тока, определяют сенсорную и болевую чувствительность путем опроса пациента, и соответствующие им индивидуальный сенсорный и болевой пороги тока для каждого стимулирующего электрода. При этом амплитуду импульса электрического тока выбирают в интервале выше сенсорного порога и ниже порога болевой чувствительности, а кожно-гальваническую реакцию считают откликом на стимул при ее регистрации в течение времени, не превышающего 10 с после подачи стимула.
Устройство для оценки сенсорной чувствительности в условиях анестезии содержит группу электродов для подачи стимулирующих импульсов и датчики физиологических реакций с соответствующими электродами, подключенные к блоку управления и регистрации, включающему индикатор. Электроды для подачи стимулирующих импульсов попарно соединены и подключены к генератору импульсов блока управления и регистрации, при этом выходы блока управления генератором импульсов подключены к первому управляющему входу генератора импульсов и одному из входов блока выделения сигналов кожно-гальванической реакции, к другому входу которого подключен выход блока измерения электрического сопротивления, соединенного входом с электродами датчика кожно-гальванической реакции, выходы блока выделения сигналов кожно-гальванической реакции соединены с вторым управляющим входом генератора импульсов и индикатором, а вход-выход блока выделения сигналов кожно-гальванической реакции подключен к блоку сопряжения с компьютером.
КГР могут регистрироваться в ответ на раздражение сегментов тела человека (висцеральные вызванные потенциалы), которые могут быть обратимо денервированы при применении различных регионарных блокад с использованием местных анестетиков. После выполнения регионарной блокады проводится стимуляция соответствующих сегментов тела человека электрическим током, напряжение которого выбирается предварительно до операции путем определения болевых порогов. Развитие сенсорной блокады соответствует исчезновению кожно-гальванической реакции в ответ на электрическое раздражение. К преимуществам данной методики относится возможность определения развития сенсорного блока у пациентов со сниженным уровнем сознания. Это, в свою очередь, позволяет проводить седацию пациентов до выполнения регионарной блокады, что снижает выраженность психоэмоционального стресса. Проведенные исследования показали, что кожно-гальваническая реакция, зарегистрированная в установленном временном диапазоне в ответ на электрическое раздражение сегментов тела человека, подвергнутых действию регионарной блокады, служит достоверным критерием развития глубины сенсорного блока.
Сущность изобретения поясняется на чертежах, где:
на фиг.1 представлена блок-схема устройства;
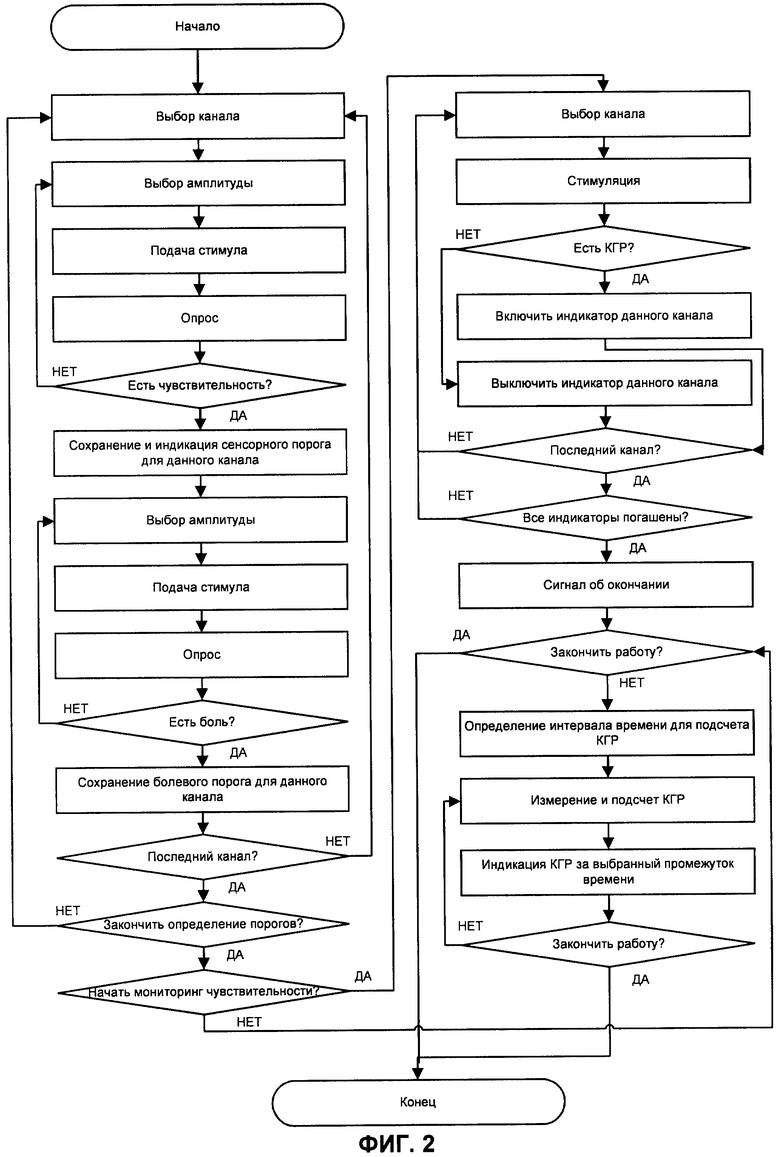
на фиг.2 - алгоритм оценки сенсорной чувствительности;
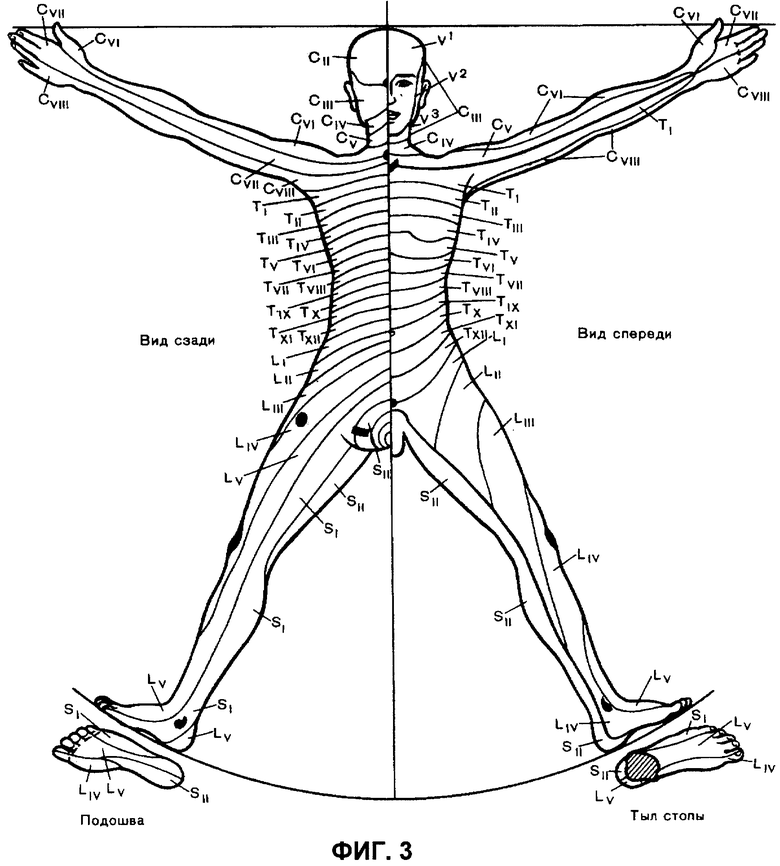
на фиг.3 - схема дерматомов к клиническим примерам.
Устройство для реализации способа включает накладной элемент 10, содержащий одну или более пар электродов 11 для подачи стимулирующих импульсов электрического тока на кожу (стимулирующие электроды). Элемент 10 имеет средства крепления к телу пациента (на фигуре не показаны), а электроды 11 - средства для обеспечения гальванического контакта с кожей. Электроды 11 могут быть наложены на кожу пациента и без использования отдельного накладного элемента 10, например, с помощью индивидуальных средств крепления.
Электроды 11 соединены с блоком 12 управления и регистрации. Блок 12 содержит управляемый генератор 14 импульсов электрического тока, управляющий вход которого подключен к блоку 16 управления генератором. Генератор 14 имеет выходы по числу используемых электродов 11. Блок 16 управления генератором имеет средства для индивидуальной регулировки параметров стимулирующих импульсов, подаваемых на каждую из пар электродов 11.
Датчик 18 КГР представляет два электрода со средствами крепления к коже пациента на участках тела человека, не подвергаемых блокаде. Датчик 18 подключен к блоку 20 измерения электрического сопротивления между электродами упомянутого датчика 18. Блок 20 своим выходом соединен с входом блока 22 выделения сигналов КГР, а выходы блока 22, в свою очередь соединены с входами индикатора 24 и генератора 14. Управляющий вход 22 соединен с другим выходом блока 16 управления. Вход-выход блока 22 соединен с выходом-входом блока 26 сопряжения с компьютером. В состав блока 12 входит блок питания 28, выполненный по стандартам медицинской безопасности и обеспечивающий подачу всех необходимых напряжений для работы блока 12. Блок 22 выделения сигналов КГР реализован на основе установленных критериев (RU 2107430).
Реализация способа при мониторинге развития блокады в условиях регионарной анестезии поясняется на примере устройства, алгоритм функционирования которого представлен на фиг.2.
Перед началом работы электроды 11 устанавливают в зону блокады, а датчик 18 КГР - на участок тела пациента, не подвергаемый блокаде.
На стадии подготовки пациента к операции определяют индивидуальные сенсорную и болевую чувствительности участков кожи под электродами 11 в регионе блокады, в соответствии с алгоритмом. Для этого последовательно на каждую пару стимулирующих электродов 11 от генератора 14 импульсов подают постепенно увеличивающиеся по величине импульсы электрического тока. Пороги чувствительности определяют посредством опроса пациента. Для каждой пары стимулирующих электродов устанавливают индивидуальный сенсорный и болевой пороги тока и фиксируют их нажатием соответствующей кнопки в блоке 16 управления. Фиксированные значения запоминаются в блоке 16 управления генератором (операция «Сохранение и индикация сенсорного порога для данного канала»).
Одновременно блоком 20 проводится регистрация электрического сопротивления кожи, измеряемого датчиком 18, а в блоке 22 - проводится выделение сигналов КГР. В отсутствие блокады сигналы КГР должны сопровождать каждый импульс стимуляции, амплитуда которого удовлетворяет условию: имеет значение выше сенсорного порога, но ниже порога болевой чувствительности.
В ходе проведения анестезии производят проверку чувствительности кожи в тех участках, где наложены электроды 11, местоположение которых фиксировано. Для удобства измерений предусмотрена возможность последовательной во времени подачи импульсов на отдельные электроды группы, то есть обеспечение сканирования - образуется матрица стимуляторов с последовательной стимуляцией.
Проверка развития блокады производится автоматически в соответствии с алгоритмом, заложенным в блоке 16 управления (операция «Есть КГР?» на фиг.2). Отсутствие КГР в течение 10 с в ответ на стимуляцию однозначно свидетельствует о развитии блокады в участке тела, подвергаемом стимуляции. Время ожидания КГР выбрано по результатам статистической обработки времени психофизиологической реакции на стимуляцию и формы сигналов КГР, длительность которых не превышает 10 с в 99,9% случаев.
Патентуемое устройство может быть использовано для контроля адекватности анестезии в условиях хирургического вмешательства. В этом случае осуществляют простой мониторинг сигналов КГР и их подсчет (операция «Измерение и подсчет КГР» на фиг.2). Если число сигналов КГР не превышает 5 единиц за 5 минут, это будет свидетельствовать о том, что пациент пребывает в состоянии психоэмоционального комфорта. Этот критерий является среднестатистическим и верифицирован по стандартным клиническим признакам, используемым анестезиологами при проведении анестезиологического пособия.
Клинический пример 1. Больная Г., 34 лет, проходила лечение в РНЦХ РАМН по поводу «хроническая венозная недостаточность; варикозно - расширенные вены нижних конечностей». Выполнена операция Линтона под сбалансированной анестезией на основе спинально - эпидуральной блокады. Риск анестезии I ст. по ASA.
Больная доставлена в операционную после премедикации S. Dormici 0,1 mg/kg. Уровень сознания - пассивное бодрствование по В.А.Светлову и соавт. Налажен неинвазивный мониторинг (Гарвардский стандарт) - ЭКГ (ритм синусовый), АД (110/60 mmHg), ЧСС (82 в мин-1), SpO2 (99%), tп - (32.6°С). Начата инфузия растворов 6 мл/кг/ч. Для оценки уровня сознания использовался ЭЭГ по Берг-Фурье. Непосредственно определялась SEF 90% (24 Гц). ЭЭГ электроды установлены в отведении F - Т. Для оценки психоэмоционального комфорта установлены электроды для регистрации КГР на указательный и безымянный пальцы правой кисти. Было зарегистрировано 16 КГР за 5 мин, что в соответствии с установленным критерием расценено как психоэмоциональное напряжение. Определены сенсорный и болевой пороги на верхних конечностях по Абрамову Ю.И. (4 мА - сенсорный порог, 16 мА - болевой порог, соответственно, для нижних конечностей; 8 мА - сенсорный порог, 24 мА - болевой порог, соответственно для обеих конечностей). Для подтверждения данных, полученных с помощью КГР в ответ на стимуляцию, использовали оценку чувствительности методом «pin prick». Зон анестезии и аналгезии получено не было. С целью снижения психоэмоционального дискомфорта в/в введено S. Dormici 0,05 mg/kg. ЭКГ - ритм синусовый, АД - 120/90 mmHg, ЧСС - 72 в мин-1, SpO2 - 99%, tп + 32,3°С, уровень сознания - дремота (SEF 90% - 16,25 Гц). Число КГР составило 3 за 5 мин в отсутствие стимуляции, что свидетельствует о сохранении ориентировочной реакции. Произведена спинально-эпидуральная блокада на уровне L3 - L4, с первой попытки, без технических сложностей. Эпидуральный катетер проведен на 5 см краниально. Субарахноидально введено 15 мг S. Marcaini 0,5%. Для исключения появления ориентировочной реакции КГР на раздражения дополнительно в/в введено S. Dormici 0,05 mg/kg. Через 5 мин после начала субарахноидальной анестезии и углубления седации гемодинамика не претерпела существенных изменений, уровень сознания - поверхностный сон (SEF 90% - 15 Гц). КГР в покое - не определяется.
Начато тестирование по кожным дерматомам (см.фиг.3) путем раздражения электрическими импульсами, которое соответствовало предварительно установленным сенсорному и болевому порогам нижних конечностей. Отмечалось отсутствие КГР реакции на стимуляцию L5 - S1 дерматомов, что указывает на развитие сенсорной блокады. В L4 - Тх дерматомах отмечалась единичная КГР, что указывает о наличии аналгезии. Выше Тх отмечалась множественная КГР (первый сигнал зарегистрирован в течение 10 сек после стимуляции и затем 2-4 КГР за 1 мин), что указывает на отсутствие сенсорной блокады данных областей. Показатели гемодинамики не изменялись. Вышеупомянутые КГР на стимуляцию полностью подтверждены методом «pin prick». Оценку чувствительности проводили сразу после определения стимуляционных проб и пробуждения пациентки.
После проведения первичной оценки чувствительности дополнительно вводили S. Dormici 0,05 mg/kg и через 10 мин проводили повторное тестирование сенсорной чувствительности по кожным дерматомам. Отмечено отсутствие КГР на стимуляцию в дерматомах от SII до Тх, что характеризовалось как наличие сенсорной блокады. Выше Тх отмечалась КГР, что указывало на отсутствие сенсорной блокады. Данные анализа сенсорной чувствительности по КГР в ответ на электрическую стимуляцию полностью подтвердились методом «pin prick» после пробуждения пациентки.
В дальнейшем болевой и двигательной реакции на кожный разрез у больной не отмечено. АД - 110/60 mmHg, ЧСС - 64 в мин-1, SpO2 - 99%, tп + 32,3°C, уровень сознания - дремота (SEF 90% - 18,1 Гц), КГР - не определяется ни в покое, ни на электрическую стимуляцию.
Течение оперативного вмешательства без особенностей. Однако, несмотря на проведение седации S. Propofoli 1 mg/kg/h, через 1,5 ч после начала анестезии у пациентки отмечено появление спонтанных единичных КГР до 8 за 5 мин. При этом уровень медикаментозной депрессии сознания оценивался как поверхностный (SEF 90% - 12,2-14 Гц) и глубокий (SEF 90% - 10,3-11,1 Гц) сон. При пробуждении (SEF 90% 20,2 Гц) больная отмечала неприятные ощущения в локтевых сгибах, особенно в области стояния периферического венозного катетера, а также в местах плотного соприкосновения с операционным столом, то есть развития позиционного дискомфорта (ПД) II ст. по В.А.Светлову и соавт. Значимых гемодинамических изменений отмечено не было. Болевой реакции и неприятных ощущений в области оперативного вмешательства отмечено не было.
Данная клиническая симптоматика привела к увеличению дозы седативных препаратов S. Propofoli 2 mg/kg/h, S. Diazepami 0,15 mg/kg/h, что на какое-то время привело к исчезновению КГР. Уровень медикаментозной депрессии сознания оценивался как поверхностный (SEF 90% - 12,2-14 Гц) и глубокий (SEF 90% - 10,3-11,1 Гц) сон.
Через 2,5 ч после начала анестезии у пациентки появилась частая КГР, более 10 за 5 мин, при том же уровне угнетения сознания без значительных изменений гемодинамики. При пробуждении больная самостоятельно предъявляла жалобы на боли в области стояния периферического венозного катетера и в областях тела, которые плотно соприкасались с операционным столом, парестезии в локтевых суставах (ПД - III-IV ст). Это потребовало применения S. Phentanyli 0,03 mcg/kg/h, а затем и увеличения доз S. Propofoli до 4 mg/kg/h, S. Diazepami 0,2 mg/kg/h. Несмотря на высокий уровень медикаментозного угнетения сознания - глубокий сон (SEF 90% - 10-11,4 Гц), отмечалась КГР (до 16-18 за 5 мин), которая пропадала после введения S. Phentanyli и S. Diazepami на 10-15 мин. Болевой реакции и неприятных ощущений в области оперативного вмешательства отмечено не было.
Через 3,5 ч после начала анестезии оперативное вмешательство закончилось. Больная восстановила сознание через 10 мин после окончания инфузии S. Propofoli. При пробуждении отмечались выраженные болевые ощущения в локтевых сгибах и лопатках. При оценке сенсорной блокады методом «pin prick» выявлена анестезия от SII до TIX.
Клинический пример 2. Больной Р., 42 лет, находился на лечении в РНЦХ РАМН по поводу «Разрыв мениска правого коленного сустава». Риск анестезии I ст. по ASA.
Больной доставлен в операционную после премедикации S. Dormici 0,1 mg/kg. Уровень сознания - пассивное бодрствование. ЭКГ (ритм синусовый), АД (130/90 mmHg), ЧСС (96 в мин-1), SpO2 (99%), tп (33,1°C). Начата инфузия растворов 6 мл/кг/ч. SEF 90% (26 Гц). Для оценки психоэмоционального комфорта установлены электроды для регистрации КГР на указательный и безымянный пальцы правой кисти (12 КГР за 5 мин), что расценено как психоэмоциональное напряжение. Определены сенсорный и болевой пороги на верхних конечностях (8 мА - сенсорный порог, 34 мА - болевой порог, соответственно). В дальнейшем определены сенсорный и болевой пороги для нижних конечностей (12 мА - сенсорный порог, 44 мА - болевой порог, соответственно для обеих конечностей). При оценке чувствительности методом «pin prick» и с помощью КГР зон анестезии и аналгезии получено не было. Начата седация S. Dormici 0,05 mg/kg. ЭКГ - ритм синусовый, АД - 120/70 mmHg, ЧСС - 88 в мин-1, SpO2 - 98%, tп + 32,8°С, уровень сознания - дремота (SEF 90% - 18,1 Гц), количество КГР - 4 за 5 мин - ориентировочная реакция. Произведена спинально-эпидуральная блокада на уровне L3 - L4, с первой попытки, без технических сложностей. Субарахноидально введено 15 мг S. Marcaini 0,5%. Дополнительно в/в введено S. Dormici 0,05 mg/kg. Через 5 мин после начала субарахноидальной анестезии и углубления седации показатели гемодинамики без существенной динамики, уровень сознания - поверхностный сон (SEF 90% - 14,1 Гц), КГР в покое - не определяется.
Начато тестирование по кожным дерматомам. Отмечалось отсутствие КГР реакции на стимуляцию S2 - S1 дерматомов, что указывает на развитие сенсорной блокады. В LV дерматоме отмечалась единичная КГР в ответ на раздражение, что указывает о наличии аналгезии. Выше LV отмечалась множественная КГР (3-4 за 1 мин), что указывает на отсутствие сенсорной блокады данных областей. Показатели гемодинамики не изменялись. Данные КГР на стимуляцию полностью подтверждены методом «pin prick». При этом оценку чувствительности проводили сразу после определения стимуляционных проб и пробуждения пациентки.
Через 20 мин состояние сенсорного блока не изменилось, что потребовало перейти на общую анестезию с ИВЛ.
Клинический пример 3. Больной Р., 37 лет, находился на лечении в РНЦХ РАМН по поводу «Вторичный корешковый синдром. Грыжа межпозвонкового диска на уровне LIII - LIV - LV на фоне остеохондроза позвоночника». Риск анестезии I ст. по ASA.
Больной доставлен в операционную после премедикации S. Dormici 0,1 mg/kg для выполнения микродисэктомии. Уровень сознания - оглушение. ЭКГ - ритм синусовый, АД - 100/70 mmHg, ЧСС - 68 в мин-1, SpO2 - 97%, tп - 33,6°С. Начата инфузия кристаллоидных растворов 6 мл/кг/ч. SEF 90% (18,1 Гц) - оглушение, 2 КГР за 5 мин - ориентировочная реакция. Определены сенсорный и болевой пороги на верхних конечностях (6 мА - сенсорный порог, 38 мА - болевой порог, соответственно). Начата вводная анестезия: S. Propofoli 2 mg/kg, S. Phentanyli 6 mcg/kg. ЭКГ - ритм синусовый, АД - 90/50 mmHg, ЧСС - 58 в мин-1, SpO2 - 98%, tп + 33,9°C, уровень сознания - глубокий сон (SEF 90% - 11 Гц), КГР - не определяется. Произведена электрическая стимуляция верхних конечностей - ответа КГР не получено. Выполнена интубация трахеи трубкой №9 с первой попытки, без технических сложностей. АД - 110/70 mmHg, ЧСС - 65 в мин-1, SpO2 - 99%, tп + 33,7°C, уровень сознания - глубокий сон (SEF 90% - 11 Гц), КГР - не определяется, что указывает на отсутствие рефлекторной и вегетативной реакции.
Поддержание анестезии: энфлюран 0,5-1,5 MAC, S. Phentanyli - 4-8 mcg/kg/h. До основного этапа оперативного вмешательства течение анестезии без особенностей. При удалении грыжи диска на уровне LIV - LV у пациента внезапно появились КГР - до 18 за 5 мин. Через 5 мин возникла артериальная гипертензия (АД 140/100 mmHg) и увеличение ЧСС (до 86 в мин-1), что указывает на неадекватность аналгетического компонента анестезии. При этом уровень медикаментозной депрессии сознания оставался не выше поверхностного сна (SEF 90% не выше 16 Гц). Увеличение ингаляции энфлюрана до 2 MAC и введения S. Phentanyli до 12 mcg/kg/h привело к стабилизации параметров гемодинамики (АД 110/80 mmHg, ЧСС до 74 в мин-1), но число КГР оставалось высоким - 10-12 за 5 мин. Уровень медикаментозной депрессии сознания оставался на уровне глубокого сна (SEF 90% не выше 12 Гц). Введение S. Dormici 0,07 mg/kg приводило к кратковременному исчезновению КГР на 5-10 мин. Полное исчезновение КГР наступило только после окончания основного этапа операции и прекращения травматизации корешков спинного мозга.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения болевой чувствительности человека и устройство для его осуществления | 2022 |
|
RU2794809C1 |
| СПОСОБ ИНТРАОПЕРАЦИОННОГО ПРОГНОЗИРОВАНИЯ СИНДРОМА ЦЕРЕБРАЛЬНОЙ ГИПЕРПЕРФУЗИИ | 2009 |
|
RU2402263C1 |
| Система для тренинга адаптационных механизмов личности с биологической обратной связью и сенсомоторной стимуляцией | 2022 |
|
RU2786311C1 |
| СПОСОБ КОРРЕКЦИИ СОСТОЯНИЯ ПАЦИЕНТОВ С НАРУШЕНИЯМИ СНА С ПОМОЩЬЮ ЭЛЕКТРОСТИМУЛЯЦИИ НА ОСНОВЕ РЕГИСТРАЦИИ ЭЛЕКТРОДЕРМАЛЬНОЙ АКТИВНОСТИ | 2010 |
|
RU2431508C1 |
| Способ оценки риска суицидального поведения по показателям электродермальной активности | 2021 |
|
RU2775130C1 |
| СПОСОБ ОЦЕНКИ ОБЕЗБОЛИВАЮЩЕГО ЭФФЕКТА ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ | 1994 |
|
RU2077261C1 |
| Способ персонализированной физической реабилитации больных с двигательными нарушениями лучезапястных суставов и пальцев кисти | 2020 |
|
RU2739699C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ НЕАДЕКВАТНОЙ СЕДАЦИИ ПРИ НЕЙРОАКСИАЛЬНОЙ АНЕСТЕЗИИ | 2007 |
|
RU2340280C1 |
| Способ купирования острой боли в раннем послеоперационном периоде после радикального хирургического лечения онкологических больных | 2019 |
|
RU2705626C1 |
| УСТРОЙСТВО ДЛЯ УЛУЧШЕНИЯ КАЧЕСТВА СНА ПОСРЕДСТВОМ СОЧЕТАННОЙ СТИМУЛЯЦИИ | 2016 |
|
RU2630882C1 |
Изобретение относится к медицине, а именно к анестезиологии, и может быть использовано при различных хирургических манипуляциях, требующих проведения общей анестезии. Способ оценки сенсорной чувствительности в условиях анестезии состоит в воздействии стимула в виде импульсов электрического тока, прикладываемых к коже пациента посредством электродов, на один или более участков тела пациента и фиксации отклика на стимул посредством регистрации электродами кожно-гальванической реакции пациента на участках тела, не подвергавшихся воздействию стимула, по наличию которой судят о сохранении сенсорной чувствительности. Предварительно, в отсутствие анестезии, для каждого участка кожи пациента, к которому прикладываются импульсы электрического тока, определяют сенсорную и болевую чувствительность, путем опроса пациента, и соответствующие им индивидуальный сенсорный и болевой пороги тока для каждого стимулирующего электрода. Амплитуду импульса электрического тока выбирают в интервале выше сенсорного порога и ниже порога болевой чувствительности, а кожно-гальваническую реакцию считают откликом на стимул при ее регистрации в течение времени, не превышающего 10 с после подачи стимула. Устройство для оценки сенсорной чувствительности содержит группу электродов для подачи стимулирующих импульсов и датчики физиологических реакций с соответствующими электродами, подключенные к блоку управления и регистрации, включающему индикатор. Электроды для подачи стимулирующих импульсов попарно соединены и подключены к генератору импульсов блока управления и регистрации, при этом выходы блока управления генератором импульсов подключены к первому управляющему входу генератора импульсов и одному из входов блока выделения сигналов кожно-гальванической реакции, к другому входу которого подключен выход блока измерения электрического сопротивления, соединенного входом с электродами датчика кожно-гальванической реакции, выходы блока выделения сигналов кожно-гальванической реакции соединены с вторым управляющим входом генератора импульсов и индикатором, а вход-выход блока выделения сигналов кожно-гальванической реакции подключен к блоку сопряжения с компьютером. Использование изобретения позволяет повысить достоверность определения сенсорной чувствительности за счет учета индивидуальных порогов стимулирующего воздействия и оптимизации времени регистрации кожно-гальванической реакции. 2 н.п. ф-лы, 3 ил.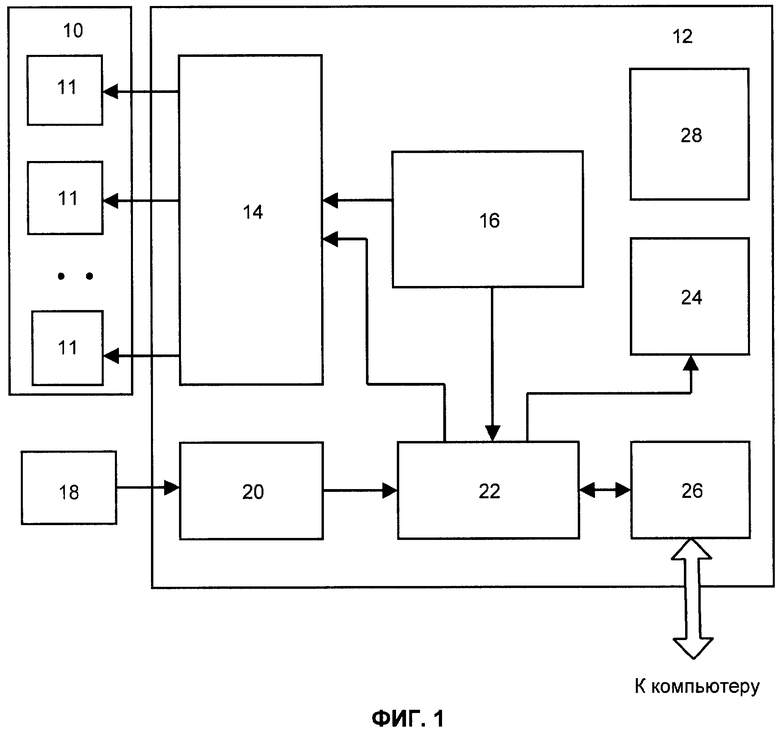
| US 5957860 А, 28.09.1999 | |||
| US 4570640 А, 18.02.1986 | |||
| US 6042548 A, 28.03.2000 | |||
| Хирургический монитор | 1979 |
|
SU824985A1 |
| СПОСОБ КОНТРОЛЯ ГЛУБИНЫ И АДЕКВАТНОСТИ АНЕСТЕЗИИ ПРИ ХИРУРГИЧЕСКИХ ПОСОБИЯХ | 1998 |
|
RU2131213C1 |
| СПОСОБ ОЦЕНКИ АДЕКВАТНОСТИ НАРКОЗА | 1988 |
|
RU2046597C1 |
Авторы
Даты
2006-02-10—Публикация
2004-05-21—Подача