Область изобретения
Настоящее изобретение относится к эффективному способу лечения или облегчения симптомов болезни Паркинсона и к применению чрескожной терапевтической системы (Transdermal Therapeutic System, TTS) для доставки агониста дофаминовых рецепторов ротиготина (международное непатентованное название, International Nonproprietory Name, INN) в достаточном количестве и с достаточной скоростью, чтобы обеспечить терапевтически эффективное лечение или облегчение симптомов болезни Паркинсона.
Предшествующий уровень техники
Полагают, что болезнь Паркинсона главным образом вызвана дегенерацией дофаминергических нейронов в черной субстанции (substantia nigra). Это по сути проявляется в снижении секреции тонического дофамина и связанной с дофамином модуляции нейроннальной активности в хвостатом ядре и, таким образом, приводит к дефициту дофамина в определенных областях головного мозга. Получаемый в результате дисбаланс нейротрансмиттеров ацетилхолина и дофамина в итоге приводит к симптомам заболевания. Обычно рассматриваемая как нарушение моторной системы, болезнь Паркинсона в настоящее время расценивается как более сложное нарушение, в которое вовлечены как моторная, так и немоторная системы. Это изнуряющее заболевание характеризуется основными клиническим признаками, включающими тремор, брадикинезию, ригидность, дискинезию, нарушения походки и нарушения речи. У некоторых пациентов эти симптомы могут сопровождаться деменцией. Вовлечение автономной нервной системы может вызывать ортостатическую гипотензию, пароксизмальный прилив крови к лицу, проблемы с терморегуляцией, запор и потерю контроля над мочевым пузырем и сфинктером. Психологические нарушения, такие как потеря мотивации и депрессия, также могут сопровождать болезнь Паркинсона.
Болезнь Паркинсона представляет собой, главным образом, заболевание среднего возраста и старше, и оно затрагивает в равной степени как мужчин, так и женщин. Наибольший процент появления болезни Паркинсона имеет место в возрастной группе старше 70 лет, где болезнь Паркинсона имеется у 1,5-2,5% этой группы населения. Средний возраст начала заболевания находится между 58 и 62 годами, и у большей части населения болезнь Паркинсона развивается в возрасте от 50 до 79 лет. Только в Соединенных Штатах приблизительно 800000 людей имеют болезнь Паркинсона.
Можно проследить связь ранних нарушений двигательных функций при болезни Паркинсона с начинающейся дегенерацией дофаминвысвобождающих клеток черной субстанции. Эта дегенерация нейронов приводит к дефекту в дофаминергическом пути, который соединяет черную субстанцию с полосатым телом. По мере развития болезни могут развиваться трудноизлечимые двигательные, автономные и умственные нарушения, которые означают, что происходит прогрессирующая дегенерация рецепторных механизмов полосатого тела.
Клиническая диагностика болезни Паркинсона основана на наличии характерных физических признаков. Известно, что это заболевание начинается постепенно, медленно прогрессирует и изменчиво в клиническом проявлении. Данные наводят на мысль, что содержание дофамина в полосатом теле снижается до 20% ниже уровней, определяемых у совпадающих по возрасту контрольных субъектов до появления симптомов.
Болезнь Паркинсона пытались лечить, в числе других, при помощи L-дофа (леводопа), которая является до сих пор золотым стандартом при терапии болезни Паркинсона. Леводопа проходит гематоэнцефалический барьер в виде предшественника дофамина и затем в мозге превращается в дофамин. L-дофа улучшает симптомы болезни Паркинсона, но может вызвать тяжелые побочные эффекты. Кроме того, это лекарственное средство имеет тенденцию терять свою эффективность после первых двух-трех лет лечения. Через 5-6 лет только у 25-50% пациентов сохраняется улучшение.
Кроме того, главным недостатком применяемого в настоящее время терапевтического лечения болезни Паркинсона является возможное проявление "синдрома флуктуации", приводящего к состояниям "все-или-ничего", характеризующимся чередованием периодов "включения" ("on") - подвижности с дискинезиями, и периодов "выключения" ("off") с гипокинезией или акинезией. Пациенты, у которых наблюдается непрогнозируемый или непостоянный феномен "включения-выключения", при пероральной противопаркинсонической терапии имеют предсказуемую благотворную реакцию на внутривенное введение L-дофа и других агонистов дофамина, что позволяет предположить, что флуктуации концентраций лекарственных средств в плазме ответственны за феномен "включения-выключения". Частоту флуктуации "включения-выключения" также улучшали путем длительных инфузий агонистов дофаминовых рецепторов апоморфина и лизурида. Однако этот способ введения неудобен. Следовательно, другие способы введения, обеспечивающие более постоянный уровень в плазме, как например местное введение, являются выгодными и предлагались ранее.
Как указано выше, один подход к лечению болезни Паркинсона вовлекает агонистов дофаминовых рецепторов. Агонисты дофаминовых рецепторов (иногда также упоминаемые как агонисты дофамина) представляют собой вещества, которые, структурно отличаясь от дофамина, связываются с разными подтипами дофаминовых рецепторов и инициируют действие, которое сравнимо с действием дофамина. Благодаря уменьшенным побочным действиям полезно, чтобы вещества селективно связывались с подгруппой дофаминовых рецепторов, то есть D2-рецепторами.
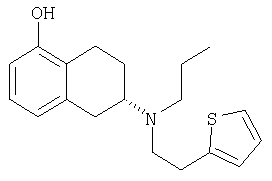
Одним из агонистов дофаминовых рецепторов, использованных для лечения симптомов болезни Паркинсона, является ротиготин. Его главным образом испытывали в форме гидрохлорида. «Ротиготин» является международным непатентованным названием (INN) соединения (-)-5,6,7,8-тетрагидро-6-[пропил-[2-(2-тиенил)этил]-амино]-1-нафталинола, имеющего структуру, изображенную ниже
К настоящему времени описаны различные чрескожные терапевтические системы (TTS) для введения ротиготина. В WO 94/07468 описана чрескожная терапевтическая система, содержащая ротиготина гидрохлорид в качестве активного вещества в двухфазной матрице, которая по существу сформирована из гидрофобного полимерного материала в качестве непрерывной фазы и содержащейся в ней дисперсной гидрофильной фазы, в основном содержащей лекарственное средство и гидратированный диоксид кремния. Диоксид кремния увеличивает максимально возможную загрузку TTS гидрофильной солью. Кроме того, препарат в WO 94/07468 обычно содержит дополнительные гидрофобные растворители, вещества, способствующие проницаемости, диспергирующие агенты, в частности эмульгатор, который требуется для эмульгирования водного раствора действующего начала в липофильной полимерной, фазе. TTS, приготовленные с использованием такой системы, испытывали на здоровых субъектах и на пациентах с паркинсонизмом. Средние уровни лекарственного средства в плазме, полученные при использовании такой системы, составляли приблизительно 0,15 нг/мл для 20 см2 пластыря, содержащего 10 мг ротиготина. Этот уровень следует рассматривать как слишком низкий для достижения действительно эффективного лечения или облегчения симптомов, связанных с болезнью Паркинсона.
Другие различные чрескожные терапевтические системы описаны в WO 99/49852. TTS, применяемые в данной заявке на патент, содержат защитный слой, инертный в отношении составляющих матрицы, самоклеющийся матричный слой, содержащий эффективное количество ротиготина или ротиготина гидрохлорида, и защитную пленку, которую следует удалять перед применением. Матричная система состоит из неводной полимерной адгезивной системы на основе акрилата или силикона, с растворимостью ротиготина по меньшей мере 5% мас./мас. Указанная матрица по существу не содержит частиц неорганических силикатов. В Примерах 1 и 2 и на Фиг.1 в WO 99/49852 сравниваются две чрескожные терапевтические системы. Они основаны на акрилатном и силиконовом адгезивах соответственно. На Фиг.1 в WO 99/49852 показано, что силиконовый пластырь высвобождает приблизительно такое же количество действующего вещества в кожу, что и акрилатный пластырь. На это указывают практически одинаковые скорости выделения в in vitro модели, независимо от применяемой адгезивной тест-системы. Следовательно, ожидалась одинаковая скорость потока через кожу человека.
Следует отметить, что содержание лекарственного средства в силиконовом пластыре в WO 99/49852 было ниже, чем содержание лекарственного средства в акрилатном пластыре. Однако это отражает лишь различие в растворимости лекарственного средства в соответствующих полимерных силиконовом и акрилатном адгезивах, используемых в Примерах 1 и 2 соответственно. TTS, применяемые в обоих примерах, содержат лекарственное средство приблизительно при его растворимости насыщения в соответствующих адгезивных системах. В то время как акрилатная система может растворить больше лекарственного средства чем силиконовая система, силикон, в свою очередь, позволяет получить лучшее высвобождение лекарственного средства в кожу. Так как эти два эффекта компенсируют друг друга, представлялось, что акрилатная и силиконовая системы, такие как применялись в WO 99/49852, почти эквивалентны по достижимым уровням лекарственного средства в плазме и, следовательно, по терапевтической эффективности.
Принимая во внимание достаточно обескураживающие опыты, проведенные с силиконовым препаратом в WO 94/07468, TTS из Примера 1 в WO 99/49852, основанные на акрилате, подвергали клиническим испытаниям (изучение безопасности и фармакокинетики). Средняя постоянная скорость потока через кожу человека in vitro у этой TTS составляла 15,3 мкг/см2/час. Однако оказалось, что уровни в плазме, полученные с использованием этой TTS, были все еще неудовлетворительными и слишком низкими, чтобы сделать возможным действительно эффективное лечение болезни Паркинсона. Пластырь с 30 мг (20 см2) давал в результате среднюю максимальную концентрацию в плазме только 0,12 нг/мл, в то время как 5 см2 пластырь, содержащий 7,5 мг, давал в результате среднюю максимальную концентрацию в плазме 0,068 нг/мл. И снова, такие значения нужно расценивать как слишком низкие для обеспечения действительного успеха в терапевтическом лечении болезни Паркинсона. Таким образом, в заключение, как 20 см2 силиконовый пластырь, описанный в WO 94/07468, так и 20 см2 акрилатный пластырь, описанный в WO 99/49852, не смогли обеспечить достаточные уровни лекарственного средства в плазме для обеспечения удовлетворительной эффективности терапевтического лечения.
Принимая во внимание эти эксперименты, было очень неожиданным, что чрескожная терапевтическая система, содержащая ротиготин в форме свободного основания в силиконовой матрице, могла бы не только обеспечить неожиданно высокие уровни ротиготина в плазме, но также и значительный успех терапии при лечении болезни Паркинсона. В частности, наблюдали, что основанная на силиконе TTS, содержащая ротиготин в форме свободного основания, обеспечивает средние максимальные уровни лекарственного средства в плазме в интервале от почти 0,5 нг/мл для силиконового пластыря с поверхностью 20 см2, содержащего 9 мг ротиготина. Это более чем в три раза выше, чем можно было ожидать на основании предыдущих исследований.
Такие значения в плазме достаточны для обоснованного ожидания того, что может быть предложено эффективное лечение болезни Паркинсона с меньшими побочными действиями. Очевидно, что термин "лечение" в контексте этой заявки означает лечение или улучшение симптомов болезни Паркинсона, а не лечение действительной причины, ведущее к полному излечению.
Краткое изложение сущности изобретения
В соответствии с настоящим изобретением предложено применение чрескожной терапевтической системы на основе силикона, имеющей площадь от 10 до 40 см2 и содержащей от 0,1 до 3,15 мг/см2 ротиготина в качестве активного ингредиента, для приготовления противопаркинсонического лекарства, которое индуцирует среднюю концентрацию ротиготина в плазме в интервале от 0,4 до 2 нг/мл в течение 24 часов после наложения.
Чрескожная терапевтическая система на основе силикона, такая как применяется в настоящем изобретении, должна содержать по меньшей мере одно аминорезистентное силиконовое соединение в качестве основного компонента. Обычно силиконовое соединение представляет собой чувствительный к давлению адгезив или смесь таких адгезивов, и оно формирует матрицу, в которую заключены другие компоненты TTS. Кроме того, адгезив(ы) предпочтительно должен(ны) быть фармацевтически приемлемым(и) в том смысле, что они должны быть биосовместимыми, несенсибилизирующими и нераздражающими кожу. Особенно предпочтительные силиконовые адгезивы для применения в настоящем изобретении должны, кроме того, отвечать следующим требованиям:
- сохранять адгезионные и когезионные свойства в присутствии влаги или пота при обычных колебаниях температуры,
- обладать хорошей совместимостью с ротиготином, а также с другими эксципиентами, используемыми в препарате; в частности, адгезив не должен взаимодействовать с аминогруппой, имеющейся в ротиготине.
Было показано, что чувствительные к давлению адгезивы, образующие растворимую решетку из поликонденсированного полидиметилсилоксана (PDMS)/смолы, где гидроксигруппы на концах закрыты, например, триметилсилильными (TMS) группами, особенно полезны при практическом осуществлении настоящего изобретения. Предпочтительные адгезивы такого типа представляют собой силиконовые чувствительные к давлению адгезивы BIO-PSA, выпускаемые Dow Corning, в частности сорта Q7-4201 и Q7-4301. Однако также можно использовать и другие силиконовые адгезивы.
В дальнейших и предпочтительных аспектах настоящего изобретения также предложена чрескожная терапевтическая система на основе силикона, содержащая два или более силиконовых адгезива в качестве основных адгезивных компонентов для такого применения. Может быть полезным, если такая смесь силиконовых адгезивов содержит по меньшей мере один сильно липкий и по меньшей мере один адгезив средней липкости для обеспечения оптимального баланса между хорошей адгезией и небольшой текучестью в холодном состоянии. Результатом избыточной текучести в холодном состоянии может стать слишком мягкий пластырь, который легко прилипает к упаковке или к одежде пациента. Кроме того, по-видимому, что такая смесь адгезивов особенно полезна для получения высоких уровней в плазме. Показано, что смесь указанных выше Q7-4201 (средняя липкость) и Q7-4301 (сильная липкость) аминорезистентных силиконовых чувствительных к давлению адгезивов в приблизительно равных количествах особенно полезна при практическом осуществлении данного изобретения.
В еще одном предпочтительном воплощении чрескожная терапевтическая система на основе силикона дополнительно включает в себя солюбилизатор. Некоторые поверхностно-активные вещества или амфифильные вещества можно использовать в качестве солюбилизаторов. Они должны быть фармацевтически приемлемыми и одобренными для применения в лекарствах. Особенно предпочтительным примером такого солюбилизатора является растворимый поливинилпирролидон. Поливинилпирролидон имеется в продаже, например, под товарным знаком Kollidon® (Bayer AG). Другие примеры включают в себя сополимеры поливинилпирролидона и винилацетата, полиэтиленгликоль, полипропиленгликоль, глицерин и сложные эфиры жирных кислот и глицерина или сополимеры этилена и винилацетата.
Чрескожная терапевтическая система на основе силикона для применения по настоящему изобретению предпочтительно содержит менее 1 мас.% неорганических силикатов, более предпочтительно она полностью свободна от неорганических силикатов.
Содержание воды в чрескожных терапевтических системах для применения по настоящему изобретению предпочтительно является достаточно низким, так что в процессе приготовления TTS не требуется выпаривать воду. Обычно содержание воды в свежеизготовленном пластыре составляет менее 2%, более предпочтительно 1 мас.% или ниже.
В особенно предпочтительном воплощении по настоящему изобретению чрескожная терапевтическая система имеет площадь поверхности от 10 до 30 см2, более предпочтительно от 20 до 30 см2. Само собой разумеется, что TTS, имеющая площадь поверхности, например, 20 см2, является фармакологически эквивалентной двум пластырям по 10 см2 или четырем пластырям по 5 см2, имеющим то же самое содержание лекарственного средства на см2, и ее можно заменить ими. Таким образом, следует понимать, что площадь поверхности, указанная в данной заявке, относится к суммарной поверхности всех TTS, одновременно применяемых пациентом.
Обеспечение и применение одной или нескольких чрескожных терапевтических систем по изобретению имеет фармакологическое преимущество перед пероральной терапией в том, что лечащий врач может титровать оптимальную дозу для конкретного пациента относительно быстро и точно, например путем простого увеличения числа или размера пластырей, назначаемых пациенту. Так, оптимальную индивидуальную дозировку часто можно определить через промежуток времени всего лишь около 3 недель с незначительными побочными действиями.
Предпочтительное содержание ротиготина на пластырь находится в интервале от 0,1 до 2,0 мг/см2. Еще более предпочтительными являются от 0,4 до 1,5 мг ротиготина на см2. Если желателен 7-суточный пластырь, обычно требуются более высокие содержания лекарственного средства. Обнаружено, что содержание ротиготина в пределах от приблизительно 0,4 до 0,5 мас.% является особенно предпочтительным, так как оно обеспечивает оптимальное использование лекарственного средства, содержащегося в TTS, то есть после введения очень небольшое остаточное количество лекарственного средства присутствует в TTS. Обнаруживаемая доза, вводимая при применении такой TTS, обычно составляет 50% или более, и может составлять 80-90% от исходного количества лекарственного средства, содержавшегося в TTS.
Тот факт, что чрескожная терапевтическая система на основе силикона, описанная в данном изобретении, способна обеспечить значительное терапевтическое действие против симптомов болезни Паркинсона и высокие уровни в плазме - 0,4 нг/мл и более - даже при площади поверхности от 10 до 30 см2, в частности только при 10 или 20 см2, и при низком содержании лекарственного средства от приблизительно 0,4 до 0,5 мг/см2, в частности при приблизительно 0,45 г/см2, следует рассматривать как еще одно конкретное преимущество, обеспечиваемое настоящим изобретением.
Чрескожная терапевтическая система, применяемая в настоящем изобретении, обычно представляет собой пластырь, имеющий непрерывную адгезивную матрицу по меньшей мере в своей центральной части, содержащей лекарственное средство. Однако чрескожные эквиваленты таким пластырям также включены в настоящее изобретение, например воплощение, когда лекарственное средство находится в инертной, но неадгезивной силиконовой матрице в центральной части TTS и окружено адгезивной частью вдоль краев пластыря.
В еще одном аспекте данное изобретение относится к способу лечения болезни Паркинсона путем прикладывания к пациенту, нуждающемуся в этом, чрескожной терапевтической системы на основе силикона, имеющей площадь от 10 до 40 см2 и содержащей от 0,1 до 3,15 мг/см2 ротиготина в качестве активного ингредиента, где указанная чрескожная терапевтическая система индуцирует среднюю концентрацию ротиготина в плазме от 0,4 до 2 нг/мл в течение 24 часов после наложения.
Если ясно не указано иного, любые ссылки на ротиготин в контексте данного изобретения и формулы изобретения данной заявки означают ротиготин в форме его свободного основания. В некоторых случаях в препарате ротиготина могут содержаться следовые количества ротиготина гидрохлорида, но эти следовые количества обычно не превышают 5 мас.%, рассчитанные по количеству свободного основания. Более предпочтительно содержание примесей гидрохлорида должно быть менее 2 мас.%, еще более предпочтительно - менее 1% и наиболее предпочтительно, если ротиготин, применяемый в настоящем изобретении, содержит менее 0,1 мас.% или вообще не содержит примесей гидрохлорида.
В результате настоящего изобретения возможно достичь уровней лекарственного средства в плазме, которые делают возможной постоянную стимуляцию рецепторов дофамина у пациентов с паркинсонизмом. В одном воплощении данного изобретения, применяя один силиконовый пластырь площадью 20 см2, изготовленный в соответствии с примером изготовления, приведенным ниже, и содержащий 9 мг ротиготина, получали среднюю максимальную концентрацию в плазме 0,491±0,151 нг/мл через 23 часа после начала введения. Через 24 часа средняя концентрация в плазме составляла 0,473±0,116 нг/мл. Отдельная измеренная максимальная концентрация в плазме составляла 0,562±0,191 нг/мл и рассчитанное значение AUC (площадь под кривой) (0-t) составляло 11,12±4,05 нг/мл.
Эти параметры определяли в пилотном исследовании, включающем 14 здоровых мужчин, которым вводили либо одну, либо две чрескожные терапевтические системы на основе сидикона, описанные в Примере приготовления, или акриловый чрескожный препарат в соответствии с WO 99/49852 соответственно, в исследовании с одноцентровом открытым, с одинарным введением, тройным перекрестным частично рандомизированным дизайном. Индивидуальные уровни лекарственного средства в плазме определяли путем утвержденного традиционного LC-MS-MS анализа, то есть при помощи системы для жидкостной хроматографии, снабженной цуговым масс-спектрометром с пределом измерения 10 пг/мл. Фармакокинетические переменные представляли собой измеренную максимальную концентрацию (Сmax), время наблюдаемого максимума (tmax) и AUC (0-tz), to есть площадь под кривой концентрация/время, рассчитанную по линейной формуле трапеций до последнего образца с количественно определяемой концентрацией. На основе результатов по отдельным субъектам затем определяли среднюю концентрацию, стандартное отклонение, среднее значение и интервал и использовали их для описательной статистики каждого параметра.
Более того, данное исследование выявило почти линейную зависимость между количеством лекарственного средства, вводимого субъектам, и наблюдаемой средней концентрацией ротиготина в плазме. После применения двух силиконовых пластырей одного вида, как описано выше, концентрации в плазме возрастали приблизительно в 2 раза, до 0,951±0,309 нг/мл в пределах 24 часов.
Это экспериментальное исследование, другие детали которого приведены в Примерах ниже, подтверждает, что это реально - ожидать средние уровни ротиготина в плазме в интервале от 0,4 до 2,0 нг/мл в течение 24 часов после применения чрескожной терапевтической системы на основе силикона, имеющей площадь от 10 до 40 см2 и содержащей от 0,1 до 3,15 г/см2 ротиготина.
Дополнительные клинические исследования на здоровых добровольцах мужского пола показали, что уровни в плазме, которые можно получить в соответствии с настоящим изобретением, в целом поддерживаются in vivo при дополнительном (обычно один раз в сутки) введении той же самой чрескожной терапевтической системы в течение нескольких недель. Например, показано, что средний уровень в плазме, получаемый после 3 месяцев применения пластыря по настоящему изобретению с поверхностью 20 см2, содержащему 9 мг ротиготина, составлял 0,49±0,3 нг/мл. Таким образом, можно считать, что уровни в плазме, такие как указаны в данном описании применительно к разовому применению и измеренные через 24 часа после применения, представляют собой установившиеся значения. Таким образом, получение и поддержание высоких уровней ротиготина в плазме в течение длительного промежутка времени представляет собой еще один аспект настоящего изобретения. Высокая установившаяся концентрация, обеспеченная TTS по настоящему изобретению, эффективна для избежания флуктуаций "включения-выключения", которые обычно сопутствуют пероральному лечению.
Данное изобретение и наилучший способ его осуществления более подробно будут объяснены в следующих неограничивающих примерах.
Пример приготовления
Чрескожную терапевтическую систему с применением комбинации адгезивов силиконового типа, чувствительных к давлению, приготавливали следующим образом.
(-)-5,6,7,8-Тетрагидро-6-[пропил-[2-(2-тиенил)этил]-амино]-1-нафталинола гидрохлорид (ротиготина гидрохлорид, 150 г) добавляли к раствору 17,05 г NaOH в 218 г этанола (96%). Полученную в результате смесь перемешивали в течение приблизительно 10 минут. Затем добавляли 23,7 г натрий-фосфатного буферного раствора (8,35 г Na2HPO4×2H2O и 16,07 г NaH2PO4×2H2O в 90,3 г воды). Нерастворимые или выпавшие в осадок твердые вещества отделяли из смеси фильтрацией. Фильтр промывали 60,4 г этанола (96%) с получением не содержащего частиц этанольного раствора ротиготина в форме свободного основания.
Раствор свободного основания ротиготина (346,4 г) в этаноле (35% мас./мас.) смешивали с 36,2 г этанола (96%). Полученный в результате раствор смешивали до гомогенности со 109 г этанольного раствора, содержащего 25 мас.% поливинилпирролидона (KOLLIDON® 90F), 0,077 мас.% водного раствора дисульфита натрия (10 мас.%), 0,25 мас.% аскорбилпальмитата и 0,63 мас.% DL-альфа-токоферола. К смеси добавляли 817,2 г аминорезистентного сильно липкого силиконового адгезива (BIO-PSA® Q7-4301, изготовленного Dow Corning) (74 мас.% раствор в гептане), 851,8 г аминорезистентного силиконового адгезива средней липкости (BIO-PSA® Q7-4201, изготовленного Dow Corning) (71 мас.% раствор в гептане) и 205,8 г петролейного эфира (гептан), и все компоненты перемешивали до получения гомогенной дисперсии.
Эту дисперсию наносили на подходящую полиэфирную высвобождающую подкладку (SCOTCHPACK® 1022) подходящим ракелем и растворители непрерывно удаляли в сушильном шкафу при температуре до 80°С в течение приблизительно 30 минут с получением содержащей лекарственное средство адгезивной матрицы с массой покрытия 50 г/м2. Сухую матриксную пленку ламинировали пленкой-подложкой полиэфирного типа (SCOTCHPACK® 1109). Отдельные пластыри желаемых размеров (например, 10 см2, 20 см2, 30 см2) вырезали из целого ламината и герметично закрывали в пакетики в атмосфере азота.
В следующей таблице приведен состав, в мг/20 см2, чрескожной терапевтической системы по настоящему изобретению, содержащей комбинацию двух PSA (чувствительных к давлению адгезивов) силиконового типа.
Клинические испытания
Описанную выше чрескожную терапевтическую систему испытывали в фармакокинетическом исследовании на сравнительную биодоступность и дозопропорциональность после одного наложения. В исследование были включены 14 здоровых субъектов мужского пола, которые получали один или два чрескожных препарата ротиготина на основе силикона, или один чрескожный препарат ротиготина на акриловой основе соответственно. Испытание завершили 11 субъектов.
Дизайн исследования включал в себя применение 20 см2 силиконовых пластырей, каждый из которых содержал 9 мг ротиготина. Эту дозировку выбрали на основании более ранних опытов с акрилатной чрескожной терапевтической системой, описанной WO 99/49852, так как ожидались такие же уровни лекарственного средства в плазме, какие были получены с применением этого акрилатного пластыря. Уровень дозировки был санкционирован этическим комитетом Ärztekammer Nordrhein. Субъектов, участвующих в данном клиническом испытании, проинформировали перед введением о том, что в более ранних клинических исследованиях не наблюдалось серьезных побочных действий, которые можно было бы отнести к лечению ротиготином.
Чрескожные терапевтические системы на основе силикона сравнивали с акрилатными TTS из примера 1 из WO 99/49852, включая 20 см2 пластырь, содержащий 30 мг ротиготина. Дизайн исследования представлял собой открытое частично рандомизированное тройное перекрестное исследование, включающее одно наложение согласно следующей схеме:
В данном исследовании не давали плацебо. Случайным образом определяли, включает ли лечение II и III наложение двух силиконовых пластырей или одного акрилатного пластыря.
Индивидуальные уровни лекарственного средства в плазме определяли путем утвержденного традиционного LC-MS-MS анализа, то есть при помощи жидкостной хроматографической системы, оборудованной цуговым масс-спектрометром с пределом количественного определения 10 пг/мл.
Фармакокинетические переменные представляли собой измеренную максимальную концентрацию (Сmax), время наблюдаемого максимума (tmax) и AUC (0-tz), то есть площадь под кривой концентрация/время, рассчитанную по линейной формуле трапеций до последнего образца с количественно определяемой концентрацией. На основании результатов по отдельным субъектам затем определяли среднюю концентрацию, стандартное отклонение, среднее значение и интервал и использовали их для описательной статистики каждого параметра.
Результаты:
При применении одного силиконового пластыря средние уровни в плазме увеличивались до 0,473±0,116 нг/мл в пределах 24 часов. Приблизительное время запаздывания составляло 3 часа. Максимум средней измеренной концентрации в плазме после наложения одного силиконового пластыря составлял 0,491±0,151 нг/мл через 23 часа после начала применения. Отдельная максимальная концентрация в плазме составляла 0,562±0,191 нг/мл и рассчитанная AUC (0-t) составляла 11,12±4,05 нг/мл. Предельное время полужизни после удаления одного силиконового пластыря составляло 5,3±0,7 часа.
После наложения двух силиконовых пластырей концентрация в плазме увеличивалась до 0,951±0,309 нг/мл в пределах 24 часов. Приблизительное время запаздывания составляло 3 часа. Максимум средней измеренной концентрации в плазме после наложения двух силиконовых пластырей составлял 1,076±0,37 нг/мл через 15 часов после начала введения. Отдельная максимальная концентрация в плазме составляла 1,187±0,349 нг/мл, и рассчитанная AUC (0-t) составляла 23,73±8,51 нг/мл·ч. Предельное время полужизни ротиготина после удаления двух силиконовых пластырей составляло 5,1±0,4 часа.
При применении одного акрилового пластыря концентрации в плазме увеличивались до 0,197±0,079 нг/мл в пределах 24 часов. Приблизительное время запаздывания составляло 4 часа. Максимум средней измеренной концентрации ротиготина в плазме после наложения одного акрилового пластыря составлял 0,202±0,095 нг/мл через 23 часа после начала введения. Отдельная максимальная концентрация в плазме составляла 0,228±0,109 нг/мл, и рассчитанная AUC (0-t) составляла 4,15±2,17 нг/мл·ч. Предельное время полужизни ротиготина после удаления одного акрилового пластыря составляло 4,9±1,5 часа.
Обнаруживаемая доза, измеренная (путем определения остаточной концентрации в пластыре после применения) после наложения одного силиконового пластыря, составляла 5,18±1,23 мг. Соответствующие дозы после двух силиконовых пластырей составляли 10,24±2,74 мг, после одного акрилового пластыря - 2,56±1,27 мг для 24 часов. Параметры Сmax или AUL (0-t) продемонстрировали хорошую корреляцию с обнаруживаемой дозой, то есть имеет место почти линейная зависимость между количеством лекарственного средства, вводимого субъектам, и наблюдаемой средней концентрацией ротиготина в плазме.
Из-за кажущейся эквивалентности по проницаемости лекарственного средства через кожу в условиях in vitro 20 см2 силиконовых и акрилатных пластырей, испытанных в WO 99/49852, полученные при применении силиконовых пластырей, применяемых в настоящем исследовании, значительно более высокие концентрации в плазме in vivo нужно рассматривать как неожиданные.
Ожидается, что значительно более высокие уровни в плазме, к котором имеет отношение настоящее изобретение, будут иметь фармакологическую значимость. Это стало очевидным в исследовании, описанном выше, хотя в нем участвовали только здоровые добровольцы, то есть субъекты с нормальными уровнями дофамина, которые по определению не могут извлечь пользу из этого лечения. Наоборот стало очевидным, что здоровые индивидуумы, которых лечили, испытывали гораздо больше побочных эффектов, связанных с лекарственным средством, чем это ожидалось, когда данное исследование разрабатывали. Фактически, каждый доброволец испытал по меньшей мере одно побочное явление, большинство испытывали несколько. Все побочные явления имели интенсивность от легкой до тяжелой и в конце испытания полностью прекращались. Однако у двух из 14 добровольцев побочные явления были причиной преждевременного завершения исследования. Наиболее частыми наблюдаемыми побочными явлениями являлись сонливость, сомнолентность, тошнота, рвота и головная боль.
Если бы было известно заранее, что силиконовый пластырь, применяемый в данном исследовании по настоящему изобретению, может привести или приведет к таким высоким уровням в плазме, которые в конечном счете наблюдались, дозовый режим в приведенном выше исследовании на здоровых добровольцах был бы выбран значительно более низким, чтобы избежать таких побочных действий. С другой стороны, пациенты с паркинсонизмом, которые страдают недостаточными уровнями дофамина, будут, несомненно, толерантными и фактически получат пользу от таких высоких уровней в плазме такого специфического агониста дофаминовых D2-рецепторов, как ротиготин. Следовательно, увеличенный уровень ротиготина в плазме, полученный при применении силиконовой TTS, который составляет основной аспект настоящего изобретения, также имеет терапевтическую значимость. Этот результат был позже подтвержден в клинических испытаниях, включающих пациентов с паркинсонизмом.
| название | год | авторы | номер документа |
|---|---|---|---|
| УЛУЧШЕННАЯ ЧРЕСКОЖНАЯ ТЕРАПЕВТИЧЕСКАЯ СИСТЕМА ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2002 |
|
RU2273477C2 |
| ФОРМА ДЛЯ ТРАНСЭПИКУТАЛЬНОГО ВВЕДЕНИЯ ДЛЯ ЛЕЧЕНИЯ СИНДРОМА УСТАЛЫХ НОГ | 2003 |
|
RU2301063C2 |
| УСТРОЙСТВО ДЛЯ ТРАНСДЕРМАЛЬНОГО ВВЕДЕНИЯ В ОРГАНИЗМ РОТИГОТИНА В ВИДЕ ОСНОВАНИЯ | 2003 |
|
RU2340339C2 |
| ТРАНСДЕРМАЛЬНАЯ ТЕРАПЕВТИЧЕСКАЯ СИСТЕМА | 2006 |
|
RU2450805C2 |
| ТРАНСДЕРМАЛЬНАЯ ТЕРАПЕВТИЧЕСКАЯ СИСТЕМА ДЛЯ ТРАНСДЕРМАЛЬНОГО ВВЕДЕНИЯ ГУАНФАЦИНА, СОДЕРЖАЩАЯ СИЛИКОНОВЫЙ ПОЛИМЕР | 2018 |
|
RU2792822C2 |
| ТРАНСДЕРМАЛЬНАЯ ТЕРАПЕВТИЧЕСКАЯ СИСТЕМА ДЛЯ ТРАНСДЕРМАЛЬНОГО ВВЕДЕНИЯ ГУАНФАЦИНА, СОДЕРЖАЩАЯ ПО МЕНЬШЕЙ МЕРЕ ОДНО ВСПОМОГАТЕЛЬНОЕ ВЕЩЕСТВО | 2018 |
|
RU2812734C2 |
| ИОНОФОРЕТИЧЕСКАЯ ДОСТАВКА РОТИГОТИНА ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2003 |
|
RU2339372C2 |
| ТЕРМОПЛАВКАЯ ТТС ДЛЯ ПРИМЕНЕНИЯ РОТИГОТИНА | 2003 |
|
RU2304434C2 |
| УСТРОЙСТВО ДЛЯ ТРАНСДЕРМАЛЬНОЙ ДОСТАВКИ ДЕКСТРОМЕТОРФАНА | 2018 |
|
RU2795729C2 |
| ИОНОФОРЕТИЧЕСКАЯ ДОСТАВКА РОТИГОТИНА ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ ПАРКИНСОНА | 2008 |
|
RU2478383C2 |
Предложено: применение чрескожной терапевтической системы, индуцирующей высокие уровни ротиготина в плазме для производства противопаркинсонического лекарственного средства и способ лечения болезни Паркинсона. Изобретение отличается тем, что система включает от 0,1 до 3,15 мг/кв.см ротиготина, который имеет форму свободного основания, и силикон, представляющий собой смесь по меньшей мере одного чувствительного к давлению липкого силиконового адгезива (Q7-4301) и по меньшей мере одного чувствительного к давлению силиконового адгезива средней липкости (Q7-4201). Это обеспечивает среднюю концентрацию риготина в плазме крови от 0,4 до 2,0 нг/мл в течение 24 час после наложения. 2 н. и 8 з.п. ф-лы, 2 табл.
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| US 5989586 A 23.11.1999 | |||
| ПЛЕНКООБРАЗУЮЩАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ТРАНСДЕРМАЛЬНОГО ВВЕДЕНИЯ | 1996 |
|
RU2161957C2 |
| ШУЛЬЧИШИНА Е.В | |||
| и др | |||
| Метод оптимизации состава адгезионных гидрофобных композиций для трансдермальных терапевтических систем и аппликационных лекарственных форм | |||
| В: «Проблемы качества лекарственных средств» - М.: НПО «Биотехнология», 1991, с.68-74 | |||
| Л.Е.ХОЛОДОВ и др | |||
| Клиническая фармакокинетика | |||
| - М.: Медицина, 1985, с.191-283. | |||
Авторы
Даты
2006-03-27—Публикация
2002-05-06—Подача