Изобретение относится к области эмбриологии и медицины, а именно к гинекологии и репродуктологии, и может быть использовано для генной терапии в молекулярной медицине в программах экстракорпорального оплодотворения (ЭКО).
Наиболее перспективным методом лечения тяжелых форм бесплодия следует признать вспомогательные репродуктивные технологии (ВРТ). Это стало возможным благодаря внедрению в программу ЭКО усовершенствованных индукторов суперовуляции, позволяющих достичь увеличения количества ооцитов.
Эмбриональное развитие - сложный комплексный процесс формирования полноценного организма из оплодотворенного ооцита. В предзародышевый, доимплантационный и постимплантационный периоды эмбриогенеза возможны нарушения и/или остановки развития. После ЭКО ооцитов человека 70% эмбрионов проходят первые три деления дробления за 3 дня, менее половины эмбрионов вступает в процесс кавитации и лишь треть формирует морфологически нормальные бластоцисты. На протяжении первых 27-28 ч (до середины двухклеточной стадии) эмбрионы во многом зависят от цитоплазматических факторов ооцита, используют белки и мРНК, накопившиеся в цитоплазме в оогенезе. Регуляция макромолекулярных синтезов в этот период идет на посттранскрипционном и посттрансляционном уровнях. В программах лечения бесплодия методами ВРТ созревание большего количества ооцитов индуцируют повышенными дозами гонадотропных гормонов. Многие пациентки имеют нарушения в эндокринной системе, страдают синдромом поликистозных яичников. Эти факторы являются причиной аномальной сверхэкспрессии в ходе оогенеза некоторых генов и излишнего накопления их мРНК в цитоплазме ооцита.
По данным разных центров ЭКО частота наступления беременности после применения метода ЭКО находится в пределах 20-40%. Поэтому очень актуален поиск новых путей, которые бы привели к повышению эффективности программ ВРТ. Одно из направлений по решению данной проблемы состоит в улучшении качества ооцитов.
Из уровня техники известен способ оплодотворения in vitro (US 6641526, А 61 В 17/43, опубликованный 04.11.2003), в котором при оплодотворении в качестве вспомогательной процедуры для повышения качества ооцитов в ооцит посредством инъекций вводят антисмысловые экзогенные нуклеиновые кислоты в составе генетических конструкций, а затем проводят эмбриотрансплантацию.
Достижению требуемого технического результата в указанном изобретении препятствует повреждение мембраны ооцита в результате проведения операции инъекции, что приводит к дальнейшему ухудшению качества ооцита и эмбриона. Кроме того, введение в ооцит инъекцией антисмысловых экзогенных нуклеиновых кислот обеспечивает только их локальный и краткосрочный доступ в клетку, также введение экзогенных нуклеиновых кислот в составе генетической конструкции может привести к модификации генома эмбриона.
Наиболее близким аналогом, принятым за прототип заявленного изобретения, является повышение эффективности оплодотворения ооцитов по изобретению (US5693534, C 12 N 5/00, опубликованное 02.12.1997). Указанное изобретение раскрывает способ культивирования ооцита, включающий отбор ооцита, введение его в композицию для культивирования, культивирование ооцита в композиции, оплодотворение культивированного ооцита сперматозоидами, культивирование эмбриона в композиции и эмбриотрансплантацию. В указанном выше изобретении применяли композицию, содержащую, по меньшей мере, 0,01 нг/мл активина и, по меньшей мере, 0,01 нг/мл ингибина. В указанном выше изобретении применяли композицию с добавлением пептидов, содержащую, по меньшей мере, 0,01 нг/мл активина и, по меньшей мере, 0,01 нг/мл ингибина, т.е. композиция включает только последовательности аминокислот.
С существенными признаками первого объекта заявляемого изобретения совпадают такие признаки прототипа, как помещение, по меньшей мере, одного ооцита, в культуральную среду с последующим культивированием. С существенными признаками второго объекта заявляемого изобретения совпадают такие признаки прототипа, как наличие эффективного действующего вещества и назначение в виде эффективного вещества для добавления в культуральную среду для повышения качества ооцитов при процедуре оплодотворения in vitro.
Получению требуемого технического результата препятствует выбор эффективных веществ в качестве добавки к культу ральной среде, которые не обеспечивают компенсирования интенсивного накопления некоторых факторов роста, а также экспрессии генов программируемой клеточной гибели.
Задачей, на решение которой направлены заявляемые изобретения, является создание способа повышения качества ооцитов при их культивировании на основе применения новой композиции, вводимой в культуральную среду.
Технический результат, достигаемый при осуществлении изобретения, выражается в подавлении аномальной сверхэкспрессии генов в ходе оогенеза, повышении качества и жизнеспособности ооцитов, низкое качество которых обусловлено, например, гормональной стимуляцией или синдромом поликистозных яичников, а также в повышении терапевтической эффективности лечения бесплодия. Дополнительный технический результат выражается в расширении функционального применения антисмысловых олигонуклеотидов в эмбриологии и медицине.
Для достижения вышеуказанного технического результата по первому объекту изобретения в способе управления качеством ооцитов, включающем помещение, по меньшей мере, одного ооцита в культуральную среду и культивирование, в культуральную среду добавляют эффективное количество, по меньшей мере, одного антисмыслового олигонуклеотида длиной 17-30 нк, каждый из которых комплементарен мРНК, по меньшей мере, одного из следующих генов: генов индукторов апоптоза, таких как HRK, FAS, FASL, ВАХ, Caspasa-3, генов ростовых факторов, таких как IGF1, генов рецепторов ростовых факторов, таких как IGF1R, генов регулирующих темпы дробления эмбрионов, таких как HLA-E, HLA-F, HLA-G, генов клеточного стресса, таких как HSF1 и HSF2.
В частном случае выполнения изобретения по первому объекту ооцит/ ооциты могут быть предварительно подвергнуты криоконсервации.
В частном случае выполнения изобретения по первому объекту ооцит/ ооциты после культивирования могут быть подвергнуты криоконсервации.
В частном случае выполнения изобретения по первому объекту производят отбор незрелых ооцитов/ооцита.
В частном случае выполнения изобретения по первому объекту культуральная среда содержит, по меньшей мере, одну из следующих солей: хлорид натрия, хлорид калия, хлорид кальция, гидрокарбонат натрия, пируват натрия, лактат натрия.
В частном случае выполнения изобретения по первому объекту, по меньшей мере, один из антисмысловых олигонуклеотидов, добавляемых в культуральную среду, модифицирован.
В частном случае выполнения изобретения по первому объекту антисмысловой олигонуклеотид выбирают из группы, включающей дуплекс-ДНК, синтетические олигонуклеотиды, антисмысловые РНК.
В частном случае выполнения изобретения по первому объекту оптимальная длина антисмыслового олигонуклеотида составляет 18-21 нк.
В частных случаях выполнения изобретения по первому объекту антисмысловые олигонуклеотиды/олигонуклеотид добавляют в культуральную среду перед помещением ооцита в нее или после помещения ооцита в нее.
В частном случае выполнения изобретения по первому объекту различные антисмысловые олигонуклеотиды последовательно добавляют в культуральную среду после помещения ооцита в нее.
Для достижения вышеуказанного технического результата в качестве второго объекта предложена композиция для добавления в среду культивирования ооцитов, включающая один или более антисмысловой олигонуклеотид длиной 17-30 нк, каждый из которых комплементарен мРНК, по меньшей мере, одного из следующих генов: генов индукторов апоптоза, таких как HRK, FAS, FASL, ВАХ, Caspasa-3, генов ростовых факторов, таких как, IGF1, генов рецепторов ростовых факторов, таких как IGF1R, генов регулирующих темпы дробления эмбрионов, таких как HLA-E, HLA-F, HLA-G, генов клеточного стресса, таких как HSF1 и HSF2, и приемлемый растворитель.
Отличительными от наиболее близкого аналога являются такие признаки, как использование в качестве эффективного вещества, по меньшей мере, одного вышеописанного антисмыслового олигонуклеотида, с длиной 17-30 оснований.
В частных случаях выполнения изобретения по второму объекту, по меньшей мере, один из антисмысловых олигонуклеотидов, добавляемых в культуральную среду, модифицирован.
В частных случаях выполнения изобретения по второму объекту антисмысловой олигонуклеотид выбран из группы, включающей дуплекс-ДНК, синтетические олигонуклеотиды, антисмысловые РНК.
В частных случаях выполнения изобретения по второму объекту длина антисмыслового олигонуклеотида составляет 18-21 нк.
Достижение указанного технического результата обусловлено следующими причинно-следственными связями.
Использование антисмысловых олигонуклеотидных последовательностей в генной терапии для лечения наследственных и вирусных заболеваний обсуждается с конца семидесятых годов прошлого века. Природные олигонуклеотиды обладают идеальными для терапевтического агента свойствами: способностью комплементарно связываться со специфическими последовательностями и индуцировать активность РНК-азы Н, отсутствием токсичности, водорастворимостью, простотой искусственного синтеза. Но нуклеазная лабильность, деградация в биологических жидкостях, низкая проникающая способность через плазматические мембраны (следствие полианионного характера молекул) и трудности, связанные с целенаправленной доставкой олигонуклеотидов во все клетки организма, накладывают большие ограничения на практическое использование олигонуклеотидных последовательностей в медицине. Все эти ограничения относятся к сформированному человеческому организму, но не к доимплантационным эмбрионам. Проникающая способность олигонуклеотидов в ооциты значительно выше, чем в дифференцированные клетки различных тканей и органов. Доступ олигонуклеотидов в ооциты не ограничен биологическими жидкостями и барьерами и лимитирован только концентрацией вещества в культуральной среде. Присутствие олигонуклеотидной последовательности в культуральной среде обеспечивает ее непрерывное поступление в ооцит. Возможность контролируемого доступа олигонуклеотидов в ооциты позволяет избежать использования токсичных химических модификаций в целях повышения нуклеазной устойчивости соединения. Фолликулогенез и оогенез в цикле гормональной индукции суперовуляции по биохимическим и физиологическим параметрам достоверно отличаются от фолликулогенеза и оогенеза в естественном цикле: равновесие смещается в сторону более интенсивного накопления некоторых факторов роста и, как следствие, экспрессии генов программируемой клеточной гибели. Материнские мРНК этих генов синтезируются и накапливаются в цитоплазме на стадии гормонально-зависимого периода роста ооцита. Сверхэкспрессия этих генов в ооцитах пациенток клиник экстракорпорального оплодотворения (ЭКО) в результате гормональной стимуляции, а также у женщин, страдающих синдромом поликистозных яичников, приводит к снижению качества зрелых яйцеклеток, фрагментации эмбрионов и их остановке в развитии. Преимущество подхода антисмыслового ингибирования на посттранскрипционном уровне заключается в том, что в результате воздействия терапевтического агента не затрагивается целостность генома, так как все биохимические процессы протекают вне ядра: в клетку вводится олигонуклеотидная последовательность, идентичная кодирующей части гена-мишени, которая комплементарно связывается с мРНК данного гена в цитоплазме, образуя двуцепочечный комплекс, что препятствует синтезу белка. При культивировании ооцитов человека при ЭКО в среде с добавками антисмысловых олигонуклеотидов к мРНК генов происходит запускание процесса апоптоза в ооцитах или клетках эмбриона. В результате это воздействие компенсирует те апоптозиндуцирующие воздействия, которые накапливаются в период, предшествующий культивированию ооцитов, т.е. еще при гормональной стимуляции пациентки (приводящих к последующей фрагментации бластомеров и гибели эмбрионов из-за процесса апоптоза в его клетках).
На фиг.1 представлены диаграммы, отражающие влияние добавления антисмысловых олигонуклеотидов на повышение качества эмбрионов; на фиг.2 представлены графики по средним значениям и стандартным отклонениям эмбрионов отличного и хорошего качества.
Способ управления качеством ооцитов осуществляется следующим образом. Отбирают ооциты, помещают их для культивации в стандартно разработанную культуральную среду с добавлением композиции антисмысловых олигонуклеотидов. В частном случае выполнения изобретения по первому объекту перед помещением ооцита в культуральную среду в ооцит предварительно вводят генетические конструкции.
Перед помещением ооцитов в культуральную среду с добавлением антисмысловых олигонуклеотидов ооциты могут быть подвергнуты микрохирургическим процедурам, например полярное тельце ооцита может быть изъято микрохирургическими методами.
Перед помещением ооцитов в культуральную среду с добавлением антисмысловых олигонуклеотидов ядра ооцитов могут быть замещены на ядра, полученные из других клеток.
Используемые ооциты могут быть как ооцитами человека, так и ооцитами других млекопитающих.
Антисмысловые олигонуклеотиды могут быть добавлены в среду перед помещением в среду ооцитов и/или после помещения в среду ооцитов.
В способе могут быть использованы ооциты, подвергнутые криоконсервации перед культивированием в среде с добавлением антисмысловых олигонуклеотидов и/или после культивирования в среде с добавлением антисмысловых олигонуклеотидов.
Специфическое связывание экзогенной олигонуклеотидной последовательности с мРНК гена-мишени (гены-индуктор апоптоза, гены ростовых факторов, гены рецепторов ростовых факторов, гены, регулирующие темпы дробления эмбрионов, гены клеточного стресса) снижает уровень его экспрессии на посттранскрипционном уровне, не затрагивая целостности генома. В результате снижения уровня экспрессии равновесие смещается в сторону повышения экспрессии в ооците генов-антогонистов. Таким образом, происходит компенсирование неблагоприятного воздействия на ооцит в результате гормональной стимуляции овуляции и/или вследствие имеющегося у пациентки заболевания. Для обеспечения специфического связывания с мРНК гена-мишени экзогенная олигонуклеотидная последовательность должна иметь длину не менее 17 нуклеотидов, но и не более 30, поскольку при большей длине последовательности возможно формирование вторичных структур, препятствующих связыванию олигонуклеотида с мРНК гена-мишени.
Заявленный способ подтверждается следующими примерами его осуществления.
Ооциты получали методом трансвагинальной пункции яичников. Полученные ооциты немедленно помещали в планшеты для культивирования (Nunc, Дания), заполненные 500 мкл среды для культивирования (например Blast-Assist Medium (MediCult, Дания), IVF Medium (FertiPro, Бельгия), В2 Menezo (Laboratoire C.C.D., Франция) с добавленными антисмысловыми олигонуклеотидами в концентрации 0,1 нмол/мл. Планшеты для культивирования с ооцитами помещали в СО2 инкубатор (37°С, 6% СО2). Через 2-3 часа осуществляли оплодотворение in vitro ооцитов выделенной фракцией прогрессивно подвижных сперматозоидов. Выделение фракции прогрессивно подвижных сперматозоидов осуществляли методом простого центрифугирования в среде Flashing (FertiPro, Бельгия) или Sperm Preparation (MediCult, Дания) (дважды по 6 мин, 300×G) или центрифугирования в градиенте плотности (Supra Sperm (MediCult, Дания), однократно в течение 20 мин (300×G). Сперматозоиды добавляли к ооцитам в концентрации 200 млн/мл. Далее планшеты с ооцитами снова помещали в СО2 инкубатор. Через 4 часа после оплодотворения ооциты методом пипетирования отмывали от сперматозоидов и помещали в чистую среду для культивирования с добавленными в нее антисмысловыми олигонуклеотидами. Через 17 часов после оплодотворения оценивали оплодотворение ооцитов по наличию в цитоплазме двух пронуклеусов. Далее культивирование осуществляли также в планшетах для культивирования, помещенных в СО2 инкубатор, смену среды производили каждые сутки. Трансплантацию эмбрионов осуществляли на 3-5 сутки культивирования. Используемые среды для оплодотворения и культивирования содержат, по меньшей мере, следующие компоненты: хлорид натрия, хлорид калия, хлорид кальция, гидрокарбонат натрия, пируват натрия, лактат натрия.
По меньшей мере, один антисмысловывой олигонуклеотид, комплементарный мРНК одному из представленных в таблице генов, добавлялся в среду для культивирования в концентрации 0.1 нмоль/мл с момента получения ооцитов, и дальнейшее культивирование эмбриона до внутриматочной трансплантации осуществляли в среде Blast-Assist II (MediCult) без антисмысловых олигонуклеотидов.
Первичные последовательности мРНК генов были получены из открытой базы данных NCBI (http://www.ncbi.nlm.nih.gov). Для каждого гена был подобран по крайней мере один антисмысловой олигонуклеотид длиной 17-30 нк, комплементарный к одному из следующих участков мРНК: к 5' участку некодирующей области, к участкам инициации транскрипции (в том числе и к альтернативным участкам инициации транскрипции); к областям экзон-интронных границ, к последовательностям 1-3 экзонов. В качестве антисмысловых олигонуклеотидов могут быть выбраны антисмысловые олигодезоксирибонуклеотиды, олигорибонуклеотиды, модифицированные олигонуклеотиды (в том числе тиомодифицированные, алкилмодифицированные, фосфомодифицированные), дуплекс ДНК.
Вторичные структуры мРНК генов, а также антисмысловые олигонуклеотиды к мРНК каждого гена были подобраны программой «Mmfold» для 37°С. Zuker, 2003 Специфичность подобранного антисмыслового олигонуклеотида была проверена при помощи программы NCBI BLAST 2.2.8 (Basic Local Alignment Search Tool). Синтез олигонуклеотидов был осуществлен на автоматическом синтезаторе амидофосфитным методом, олигонуклеотиды полностью деблокированы, очищены с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии и обессолены.
Пример 1.
Культивирование неоплодотворенных ооцитов в среде с добавлением антисмысловых олигонуклеотидов в группе пациенток с единственным полученным ооцитом.
В группе пациенток (n=30) было получено всего по одному ооциту. У 15 пациенток из этой группы ооцит культивировали в среде Blast-Assist I с добавлением антисмысловых олигонуклеотидов к мРНК гена HRK человека человека (экспериментальная группа) с момента получения и в течение 48 часов после оплодотворения in vitro, дальнейшее культивирование эмбриона до внутриматочной трансплантации осуществляли в среде Blast-Assist II (MediCult) без антисмысловых олигонуклеотидов. Ооцит у пациенток контрольной группы культивировали с момента получения до трансплантации эмбриона в средах Blast-Assist I, без добавления антисмысловых олигонуклеотидов. Культивирование эмбрионов осуществляли в стандартных условиях (Т 37°С, 5% CO2 в воздухе).
При трансплантации единственного эмбриона, полученного в ходе проведения программы ЭКО, пациенткам обеих групп, 4 беременности были получены только в экспериментальной группе пациенток. В группе пациенток, ооцит которых культивировали в среде без добавления антисмысловых олигонуклеотидов, ни одной беременности получено не было.
Пример 2.
Культивирование неоплодотворенных ооцитов в среде с добавлением олигонуклеотидной композиции.
Клинические испытания проводили при культивировании неоплодотворенных ооцитов пациенток, в рамках проведения лечения бесплодия методом ЭКО и переноса эмбрионов в полость матки (ПЭ). В контрольную (контроль) и экспериментальную (опыт) группы были включены пациентки в возрасте от 25 до 38 лет, страдающие бесплодием, с нормоспермией у супруга. Распределение между группами производили случайным образом согласно четности/нечетности номера истории болезни.
У пациенток экспериментальной группы ооциты культивировали в среде Blast-Assist I с добавлением антисмысловых олигонуклеотидов к мРНК гена HRK человека человека с момента получения и в течение 48 часов после оплодотворения in vitro, дальнейшее культивирование эмбриона до внутриматочной трансплантации осуществляли в среде Blast-Assist II (MediCult) без антисмысловых олигонуклеотидов. Ооциты у пациенток контрольной группы культивировали с момента получения до трансплантации эмбриона в средах Blast-Assist I, II без добавления антисмысловых олигонуклеотидов. Культивирование ооцитов осуществляли в стандартных условиях (Т 37°С, 5% СО2 в воздухе).
Результаты воздействия олигонуклеотидной композиции на качество ооцитов оценивали по состоянию полученных эмбрионов на 1-3 дни развития. Основным морфологическим критерием оценки качества развивающихся эмбрионов являлась степень фрагментации бластомеров. Эмбрионы с фрагментацией бластомеров были отнесены к четырем группам, в соответствии со степенью выраженности фрагментации: 1) <10%; 2) 10-25% 3) 25-50% 4) >50%. Кроме того, были подсчитаны индекс нормального оплодотворения и выход эмбрионов отличного и хорошего качества к третьим суткам развития.
Статистическую обработку результатов производили при помощи статистической программы SPSS, версии 11.5. При статистической обработке данных в первую очередь для каждой группы (опытная; контроль) был применен стандартный метод точечного оценивания и получены выборочное среднее и выборочное стандартное отклонение. Далее с помощью критериев Колмогорова-Смирнова и Шапиро-Уилка определили, согласуется ли распределение выборочных данных с теоретическим, нормальным распределением. В соответствии с результатами этого анализа в дальнейшем использовали параметрические или непараметрические критерии.
Хотя средние значения доли эмбрионов с аномалиями в опытной и контрольной группах значимо не отличались на вторые сутки развития, среднее значение доли эмбрионов с аномалиями в опытной группе было достоверно ниже, чем в контрольной группе (U=315; P<0,05, U - тестовая величина, определенная с помощью критерия Манна и Уитни, Р - уровень значимости). Кроме того, в опытной группе, в отличие от контрольной, на вторые сутки развития не было эмбрионов с фрагментацией 25-50% (U=387,5; P<0,01). Средние значения доли эмбрионов со степенью фрагментации 25-50% в опыте и контроле на третьи сутки развития статистически не отличались. В опытной и контрольной группах статистический анализ не выявил значимых различий в средних значениях доли эмбрионов с фрагментацией более 50%. На приведенных диаграммах показаны средние значения долей эмбрионов отличного и хорошего качества (норма), с аномалиями, с различной степенью фрагментации (25-50% фрагментации; больше 50% фрагментации) на вторые и третьи сутки развития в опытной и контрольной группах (фиг.1). Для тех же групп данных представлены и гистограммы, где указаны средние значения долей эмбрионов и стандартное отклонение (фиг.2). Из вышеприведенных результатов исследований можно сделать выводы, что применение антисмысловых олигонуклеотидов для управления качеством ооцитов уменьшает фрагментацию эмбрионов, полученных при оплодотворении этих ооцитов, уменьшает количество аномалий, что в свою очередь повышает вероятность нормального развития эмбриона. Использование указанного способа и композиции в программах экстракорпорального оплодотворения существенно увеличивает эффективность лечения.
Пример 3.
Культивирование неоплодотворенных ооцитов пациентки с предыдущими неэффективными попытками лечения по стандартной методике ЭКО в среде с добавлением антисмысловых олигонуклеотидов.
Ооциты с момента получения и во время оплодотворения in vitro культивировали в среде Blast-Assist I с добавлением антисмысловых олигонуклеотидов к мРНК гена ВАХ и антисмысловых олигонуклеотидов к мРНК гена IGFR1. Культивирование эмбрионов после 48 часов развития и до внутриматочной трансплантации осуществляли в среде Blast-Assist II (MediCult) без антисмысловых олигонуклеотидов. Перенос эмбрионов в полость матки осуществляли на пятые сутки развития эмбрионов. В результате данного лечения наступила беременность.
Пример 4.
Культивирование неоплодотворенных ооцитов пациентки, страдающей синдромом поликистозных яичников, в среде с добавлением антисмысловых олигонуклеотидов.
Ооциты с момента получения и во время оплодотворения in vitro культивировали в среде Blast-Assist I с добавлением антисмысловых олигонуклеотидов к мРНК гена FAS человека и антисмысловых олигонуклеотидов к мРНК гена FASL человека. Культивирование эмбрионов после 48 часов развития и до внутриматочной трансплантации осуществляли в среде Blast-Assist II (MediCult) без антисмысловых олигонуклеотидов. Перенос эмбрионов в полость матки осуществляли на пятые сутки развития эмбрионов. В результате данного лечения наступила беременность.
Пример 5.
Культивирование неоплодотворенных ооцитов пациентки старшей возрастной группы в среде с добавлением антисмысловых олигонуклеотидов.
Ооциты с момента получения и во время оплодотворения in vitro культивировали в среде Blast-Assist I с добавлением антисмысловых олигонуклеотидов к мРНК гена ВАХ человека и антисмысловых олигонуклеотидов к мРНК гена Caspase 3 человека. Культивирование эмбрионов после 48 часов развития и до внутриматочной трансплантации осуществляли в среде Blast-Assist II (MediCult) без антисмысловых олигонуклеотидов. Перенос эмбрионов в полость матки осуществляли на пятые сутки развития эмбрионов. В результате данного лечения наступила беременность.
Пример 6.
Культивирование неоплодотворенных ооцитов пациентки, страдающей эндометриозом, в среде с добавлением антисмысловых олигонуклеотидов.
Ооциты с момента получения и во время оплодотворения in vitro культивировали в среде Blast-Assist I с добавлением антисмысловых олигонуклеотидов к мРНК гена FAS и антисмысловых олигонуклеотидов к мРНК генов HSF1/HSF2. Культивирование эмбрионов после 48 часов развития и до внутриматочной трансплантации осуществляли в среде Blast-Assist II (MediCult) без антисмысловых олигонуклеотидов. Перенос эмбрионов в полость матки осуществляли на пятые сутки развития эмбрионов. В результате данного лечения наступила беременность.
Пример 7.
Культивирование неоплодотворенных ооцитов пациентки, страдающей синдромом поликистозных яичников (СПКЯ) и эндометриозом и с неудачными предыдущими попытками ЭКО в анамнезе, в среде с добавлением антисмысловых олигонуклеотидов.
Ооциты пациентки 35 лет, страдающей СПКЯ и эндометриозом, имеющей в анамнезе 3 неудачные предыдущие попытки лечения по стандартной методике ЭКО, с момента получения и во время оплодотворения in vitro культивировали в среде с добавлением смеси антисмысловых олигонуклеотидов к мРНК гена FASL человека и антисмысловых олигонуклеотидов к мРНК гена HLA-G человека. Культивирование эмбрионов после 48 часов развития и до внутриматочной трансплантации осуществляли в среде без добавления антисмысловых олигонуклеотидов. Перенос эмбрионов в полость матки осуществляли на пятые сутки развития эмбрионов. В результате данного лечения наступила беременность.
Пример 8.
Культивирование неоплодотворенных ооцитов пациентки старшей возрастной группы с истощенным запасом яичников в среде с добавлением антисмысловых олигонуклеотидов.
У пациентки 40 лет с истощенным запасом яичников и страдающей эндометриозом было получено 2 ооцита. Ооциты с момента получения и во время оплодотворения in vitro культивировали в среде с добавлением смеси модифицированной (фосфорилированной) антисмысловых олигонуклеотидов к мРНК гена FASL человека и антисмысловых олигонуклеотидов к мРНК генов HLA-E/HLA-F. Перенос эмбрионов в полость матки осуществляли на пятые сутки развития эмбрионов. В результате данного лечения наступила беременность.
Пример 9.
Культивирование неоплодотворенных ооцитов пациентки с трубноперитонеальным фактором бесплодия и эндометриозом в среде с добавлением антисмысловых олигонуклеотидов.
Ооциты пациентки 28 лет, с трубноперитонеальным фактором бесплодия и эндометриозом, культивировали в среде с добавлением антисмысловых олигонуклеотидов к мРНК IGF1 гена человека и антисмысловых олигонуклеотидов к мРНК гена Вах человека с момента получения и во время оплодотворения in vitro. Перенос эмбрионов в полость матки осуществляли на пятые сутки развития эмбрионов. В результате данного лечения наступила беременность.
Пример 10.
Культивирование неоплодотворенных ооцитов пациентки с трубноперитонеальным фактором бесплодия и синдромом гиперстимуляции яичников в среде с добавлением антисмысловых олигонуклеотидов и пересадка полученных эмбрионов после их криоконсервации.
Ооциты пациентки 26 лет, с трубноперитонеальным фактором бесплодия, культивировали в среде с добавлением антисмысловых олигонуклеотидов к мРНК гена HRK человека и антисмысловых олигонуклеотидов к мРНК гена Вах человека с момента получения и во время оплодотворения in vitro. В этом цикле лечения у пациентки развился синдром гиперстимуляции яичников, перенос эмбрионов был отменен и эмбрионы были криоконсервированы. Через 3 месяца эмбрионы были разморожены и перенесены в полость матки пациентки в естественном цикле овуляции. В результате данного лечения наступила беременность.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КУЛЬТИВИРОВАНИЯ ЗИГОТЫ И/ИЛИ ЭМБРИОНА И КОМПОЗИЦИЯ ДЛЯ ДОБАВЛЕНИЯ В СРЕДУ КУЛЬТИВИРОВАНИЯ ЗИГОТ И/ИЛИ ЭМБРИОНОВ | 2005 |
|
RU2281778C1 |
| ПАРТЕНОГЕНЕТИЧЕСКАЯ АКТИВАЦИЯ ЧЕЛОВЕЧЕСКИХ ООЦИТОВ ДЛЯ ПОЛУЧЕНИЯ ЧЕЛОВЕЧЕСКИХ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК | 2006 |
|
RU2469085C2 |
| СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ ДОИМПЛАНТАЦИОННЫХ ЭМБРИОНОВ КОЗ IN VITRO | 2008 |
|
RU2396344C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ АНЕУПЛОИДИИ ЭМБРИОНОВ В ПРОГРАММЕ ЭКСТРАКОРПОРАЛЬНОГО ОПЛОДОТВОРЕНИЯ У ЖЕНЩИН С ЭНДОМЕТРИОЗ-АССОЦИИРОВАННЫМ БЕСПЛОДИЕМ | 2020 |
|
RU2752783C1 |
| Способ прогнозирования наличия хромосомных аномалий в эмбрионах удовлетворительного и плохого качества на основании оценки транскрипционного профиля в кумулюсных клетках в программе экстракорпорального оплодотворения | 2017 |
|
RU2657769C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ НАСТУПЛЕНИЯ БЕРЕМЕННОСТИ В ПРОГРАММЕ ЭКСТРАКОРПОРАЛЬНОГО ОПЛОДОТВОРЕНИЯ ПРИ СЕЛЕКТИВНОМ ПЕРЕНОСЕ ЭМБРИОНОВ ПУТЕМ ОЦЕНКИ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОГО ПРОФИЛЯ ГАМЕТ С ПОМОЩЬЮ ПЦР-РВ | 2014 |
|
RU2550965C1 |
| СПЕЦИФИЧНЫЕ ДЛЯ ПАЦИЕНТА ЛИНИИ СТВОЛОВЫХ КЛЕТОК, ПОЛУЧЕННЫЕ ИЗ ЧЕЛОВЕЧЕСКИХ ПАРТЕНОГЕНЕТИЧЕСКИХ БЛАСТОЦИСТОВ | 2008 |
|
RU2511418C2 |
| ТРАНСГЕННЫЕ КОПЫТНЫЕ ЖИВОТНЫЕ, ИМЕЮЩИЕ ПОНИЖЕННУЮ АКТИВНОСТЬ ПРИОННОГО БЕЛКА, И ИХ ПРИМЕНЕНИЯ | 2003 |
|
RU2384059C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИНДУЦИРОВАННЫХ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК ИЗ ФИБРОБЛАСТОВ ПАЦИЕНТОВ С БОЛЕЗНЬЮ ХАНГИНГТОНА | 2011 |
|
RU2458983C1 |
| СПОСОБЫ ПРИМЕНЕНИЯ ZSCAN4 ДЛЯ ОМОЛОЖЕНИЯ ЧЕЛОВЕЧЕСКИХ КЛЕТОК | 2014 |
|
RU2801207C2 |

Изобретение относится к области эмбриологии и касается способа управления качеством ооцитов и композиция для добавления в среду культивирования ооцитов. Способ управления качеством ооцитов включает помещение, по меньшей мере, одного ооцита в культуральную среду и культивирование, при этом в культуральную среду добавляют эффективное количество, по меньшей мере, одного антисмыслового олигонуклеотида длиной 17-30 нк, каждый из которых комплементарен мРНК, по меньшей мере, одного из следующих генов: генов индукторов апоптоза, таких как HRK, FAS, FASL, ВАХ, Caspasa-3, генов ростовых факторов, таких как, IGF1, генов рецепторов ростовых факторов, таких как IGF1R, генов регулирующих темпы дробления эмбрионов, таких как HLA-Е, HLA-F, HLA-G генов клеточного стресса, таких как HSF1 и HSF2. Композиция для добавления в культуральную среду включает один или более антисмысловой олигонуклеотид, описанный выше, и приемлемый растворитель. Преимущество изобретения заключается в повышении качества и жизнеспособности ооцитов и повышении терапевтической эффективности лечения бесплодия. 2 н. и 13 з.п. ф-лы, 2 ил., 1 табл.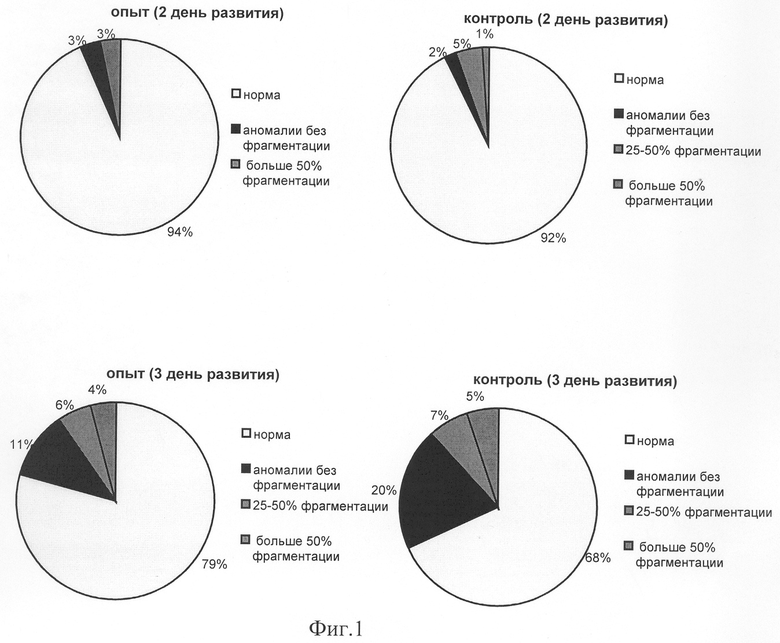
| US 5693534 А, 02.12.1997 | |||
| US 6635802 А, 21.10.2003 | |||
| US 6680199 А, 20.01.2004 | |||
| US 6759244 А, 06.07.2004. |
Авторы
Даты
2006-08-20—Публикация
2005-04-21—Подача