В последние годы в области методов лечения бесплодия были достигнуты большие успехи. Несмотря на постоянное совершенствование методик вспомогательных репродуктивных технологий (ВРТ), эффективность одной попытки экстракорпорального оплодотворения (ЭКО) не превышает 33%, а частота родов живым плодом - 24,8% [1]. Основным фактором, определяющим вероятность наступления клинической беременности и рождения живого здорового ребенка, является качество переносимых в полость матки эмбрионов [2].
В настоящее время выбор эмбрионов для переноса осуществляется, в основном, на основании морфологических критериев оценки качества. Несмотря на то, что в рутинной клинической практике морфологическая оценка качества эмбрионов является простым и неинванизивным методом, данный метод диагностики является субъективным и не позволяет оценить наличие хромосомных аномалий у переносимых эмбрионов, что, в свою очередь, снижает шансы наступления клинической беременности [3, 4, 5, 6].
На сегодняшний день стало возможным проведение предимплантационного генетического скрининга (ПГС) эмбрионов в циклах ЭКО. Данный метод позволяет диагностировать генетическую патологию эмбриона на этапе до переноса в полость матки [5]. И хотя перенос эуплоидного эмбриона не является 100% гарантией наступления клинической беременности, он существенно повышает ее шансы, вплоть до 70-75% [7].
Предимплантационный генетический скрининг в последние годы активно развивается, показания к его проведению постоянно расширяются, однако данное исследование является дорогостоящим, что приводит к ограничению его использования в широкой практике.
Таким образом, развитие точных малоинвазивных объективных методов оценки качества эмбрионов с высоким потенциалом к имплантации и отсутствием хромосомных аномалий является одним из наиболее важных направлений репродуктивной медицины [8].
Достаточно многообещающе выглядят исследования последнего десятилетия, показывающие возможность оценки качества ооцитов по состоянию окружающих его клеток, получаемых при выделении кумулюсооцитарного комплекса после пункции фолликула при лечении в программе ЭКО [9,10, 11].
Кумулюсные клетки находятся в непосредственной близости к ооциту и постоянно реагируют на изменения, происходящие в интра-фолликулярной среде, что обуславливает возможность получения информации о состоянии ооцита посредством обнаружения молекулярно-генетических изменений в кумулюсных клетках. Например, модели экспрессии определенных генов отражают процессы, происходящие в клетке в данный момент времени, в том числе и ответ клеток на различные воздействия окружающей среды. Таким образом, анализ экспрессии генов в кумулюсных клетках может выявить данные об условиях внутри фолликула и качестве полученных ооцитов, определяя их способность к дальнейшему созреванию, успешному оплодотворению и последующему эмбриональному развитию.
В связи с этим, нами было проведено ретроспективное исследование транскрипционной активности в кумулюсных клетках эмбрионов различного качества согласно морфологическим критериям оценки у пациенток, проходивших лечение бесплодия методом ЭКО/ИКСИ с последующим проведением предимплантационного генетического скрининга. Данное исследование позволило охарактеризовать взаимосвязь уровня экспрессии мРНК изучаемых генов в кумулюсных клетках с наличием хромосомных аномалий в эмбрионах удовлетворительного и плохого качества.
Результат изобретения - создание модели предсказания наличия хромосомных аномалий в эмбрионах удовлетворительного и плохого качества на основании анализа транскрипционной активности в кумулюсных клетках у пациенток при лечении бесплодия в программе ЭКО.
После проведения трансвагинальной пункции под контролем стереомикроскопа Nikon клиническим эмбриологом осуществлялся просмотр аспирированной фолликулярной жидкости с целью идентификации ооциткумулюсных комплексов (ОКК). Стерильными иглами проводили отрезание клеток кумулюса от ОКК под контролем стереомикроскопа в культуральной чашке Петри с буферным раствором (COOК, Ирландия). Производили маркировку образцов кумулюсных клеток соответственно ооциту. Во избежание деградации РНК взятие материала (кумулюсные клетки) осуществляли в пробирки с раствором гуанидинтиоционата (лизирующий раствор наборы "Проба НК"), помещали в холодильную камеру на -20°С, а затем отдавали генетику на анализ.
На 5-е сутки культивирования эмбрионам проводилась биопсия клеток трофэктодермы, материал отправляли в лабораторию молекулярно-генетических методов для анализа хромосомных нарушений методом сравнительной геномной гибридизации. После проведения биопсии все эмбрионы витрифицировались.
Сравнительная геномная гибридизация (CGH) генетического материала эмбриона проводилась с использованием оборудования фирмы Agilent (США). Полногеномную амплификацию ДНК исследуемых клеток проводили с помощью набора для проведения WGA-PCR PicoPlex SingleCell WGA Kit (Rubicon Genomics,CШA) и набора для проведения MDA GenetiSure Pre-Screen Amplification and Labeling Kit (Agilent,CШA). Качество и количество полученной в ходе амплификации ДНК контролировали с помощью 1,2% агарозного электрофореза. Мечение ампликонов проводили с помощью набора SureTag DNA labeling Kit Agilent (США) согласно прилагаемой инструкции. Мечение ампликоны наносили на биочип Sure Print G3 8×60 aCGH Agilent (США), гибридизировали 16 часов, после чего проводили отмывку и сканирование на сканере биологических чипов SureScan Microarray Scanner. Интерпретацию полученных результатов проводили с помощью программного продукта Agilent CytoGenomics.
После получения результатов предимплантационного генетического скрининга проводился анализ транскрипционного профиля в кумулюсных клетках. Осаждение РНК проводили изопропанолом в присутствии соосадителя, с последующими отмывками промывочными растворами. В реакции обратной транскрипции использовали смесь специфических олигонуклеотидов всех исследуемых генов. Амплификацию осуществляли в режиме реального времени с измерением уровня флуоресценции по каналу FAM на каждом цикле при температуре отжига праймеров. Реализация «горячего старта» обеспечивалась использованием Taq-полимеразы, активность которой блокировалась антителами и восстанавливалась при прогреве. Реакцию ставили в двух повторах для каждой точки. Уровень экспрессии измеряли в относительных единицах (о.е.) относительно референсных генов ТВР, В2М, GUSB методом сравнения пороговых циклов (ΔCq).
С помощью бинарной логистической регрессии возможно рассчитать вероятность наступления события (в данном случае наличие хромосомных аномалий в эмбрионах удовлетворительного и плохого качества) в зависимости от значений независимой переменной (уровня экспрессии мРНК гена PFKP).
Вероятность наступления события (вероятность наличия хромосомных аномалий в эмбрионах удовлетворительного и плохого качества) (р) рассчитывается по формуле, имеющий общий вид:
p=exp(logit)/(1+exp(logit)
где р - искомая вероятность наступления события.
При значениях р менее 0,5 можно предположить, что измеряемое событие не наступит; в противном случае предполагается наступление события.
Согласно результатам логистической регрессии построено уравнение для предсказания вероятности наличия хромосомных аномалий в эмбрионах удовлетворительного и плохого качества:
logit=-2,59+0,48*PFKP
где PFKP - уровень экспрессии мРНК гена PFKP.
Построенная модель является статистически значимой (χ2=6,99, р=0,008).
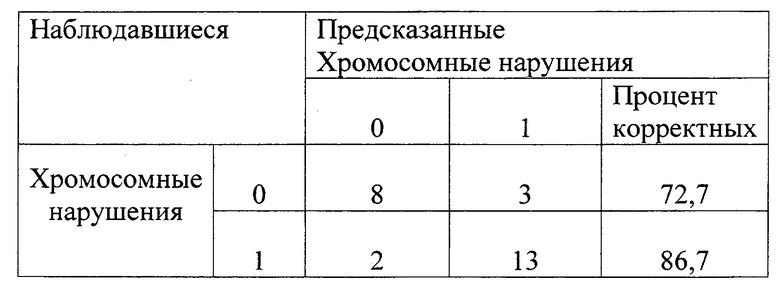
Средняя точность прогнозирования вероятности наличия хромосомных аномалий в эмбрионах удовлетворительного и плохого качества составляет 84,3%, ОШ равно 29,3.
Таким образом, можно оценить вероятность наличия хромосомных аномалий в эмбрионах удовлетворительного и плохого качества в программе ЭКО на основании оценки транскрипционного профиля в кумулюсных клетках (уровня экспрессии мРНК гена PFKP).
Таблица 1.
Классификация предсказания наличия хромосомных аномалий в эмбрионах удовлетворительного и плохого качества в программе ЭКО/ИКСИ
Пример
I. Прогнозирование наличия хромосомных аномалий в эмбрионах провели у пациентки М. 32 лет с трубным фактором бесплодия, обратившейся для проведения программы ЭКО/ИКСИ + ПГС. В анамнезе 3 беременности, две из которых - внематочные, в связи с чем в 2009 и 2011 гг пациентке были выполнены операции в объеме лапароскопии, левосторонней и правосторонней тубэктомии, соответственно. Третья беременность наступила в результате программы ЭКО и ПЭ, завершилась самопроизвольным выкидышем в сроке 8 недель. Кариотип абортуса - мозаичная форма трисомии по хромосоме 13. Данная попытка ЭКО вторая.
Отрезание клеток кумулюса от ОКК проводили после трансвагинальной пункции стерильными иглами под контролем стереомикроскопа в культуральной чашке Петри с буферным раствором.
На 5-е сутки культивирования эмбрионам проводилась биопсия клеток трофэктодермы, материал отправляли в лабораторию молекулярно-генетических методов для анализа хромосомных нарушений методом сравнительной геномной гибридизации.
Анализ транскрипционного профиля в кумулюсных клетках проводился после получения результатов ПГС.
Результат проведенного исследования у пациентки М:
Уровень экспрессии мРНК гена PFKP - 8,77 о.е.
Вероятность (р) наличия хромосомных аномалий у исследуемого эмбриона рассчитывали по вышеописанной формуле:
logit=2,59-0,48* PFKP=2,59-0,48* 8,77=1,62
p=exp(logit)/(1+exp(logit)=0,15
Рассчитанная вероятность р указывает на низкую вероятность наличия хромосомных аномалий у исследуемого эмбриона.
Результат проведения предимплантационного генетического скрининга - N, XX (нормальный женский кариотип).
II. Прогнозирование наличия хромосомных аномалий в эмбрионах провели у пациентки Г. 37 лет с трубно-перитонеальным фактором бесплодия, обратившейся для проведения программы ЭКО/ИКСИ + ПГС. В анамнезе 2 беременности, одна из которых завершилась самопроизвольным выкидышем на малом сроке, вторая - правосторонняя внематочная беременность, в связи с чем пациентке в 2012 году была проведена лапароскопия, правосторонняя тубэктомия. Показанием к проведению предимплантационного генетического скрининга послужил старший репродуктивный возраст супругов (Муж, 42 лет, спермограмма-нормозооспермия). Данная попытка ЭКО первая.
Отрезание клеток кумулюса от ОКК проводили после трансвагинальной пункции стерильными иглами под контролем стереомикроскопа в культуральной чашке Петри с буферным раствором.
На 5-е сутки культивирования эмбрионам проводилась биопсия клеток трофэктодермы, материал отправляли в лабораторию молекулярно-генетических методов для анализа хромосомных нарушений методом сравнительной геномной гибридизации.
Анализ транскрипционного профиля в кумулюсных клетках проводился после получения результатов ПГС.
Результат проведенного исследования у пациентки Г:
Уровень экспрессии мРНК гена PFKP - 0,19 о.е.
Вероятность (р) наличия хромосомных аномалий у исследуемого эмбриона рассчитывали по вышеописанной формуле:
logit=2,59-0,48* PFKP=2,59-0,48* 0,19=2,5
p=exp(logit)/(1+exp(logit)=0,92
Рассчитанная вероятность р указывает на возможность того, что истинное значение результативного показателя попадет в расчетный прогнозируемый исход, в данном случае - на наличие анеуплоидий у исследуемого эмбриона.
Результат проведения предимплантационного генетического скрининга - гетероплоидный эмбрион.
III. Прогнозирование наличия хромосомных аномалий в эмбрионах провели у пациентки Ш. 25 лет с мужским фактором бесплодия, обратившейся для проведения программы ЭКО/ИКСИ + ПГС. Муж, 63 лет, спермограмма: олигоастенотератозооспермия. В анамнезе 3 неудачные попытки ЭКО. Беременности, гинекологические заболевания и оперативные вмешательства на органах малого таза отрицает. Показанием к проведению предимплантационного генетического скрининга послужили множественные неудачные попытки ЭКО в анамнезе и старший репродуктивный возраст супруга. Данная попытка ЭКО четвертая.
Отрезание клеток кумулюса от ОКК проводили после трансвагинальной пункции стерильными иглами под контролем стереомикроскопа в культуральной чашке Петри с буферным раствором.
На 5-е сутки культивирования эмбрионам проводилась биопсия клеток трофэктодермы, материал отправляли в лабораторию молекулярно-генетических методов для анализа хромосомных нарушений методом сравнительной геномной гибридизации.
Анализ транскрипционного профиля в кумулюсных клетках проводился после получения результатов ПГС.
Результат проведенного исследования у пациентки Г:
Уровень экспрессии мРНК гена PFKP - 0,95 о.е.
Вероятность (р) наличия хромосомных аномалий у исследуемого эмбриона рассчитывали по вышеописанной формуле:
logit=2,59-0,48* PFKP=2,59-0,48* 0,95=2,13
p=exp(logit)/(1+exp(logit)=0,89.
Рассчитанная вероятность р указывает на высокую вероятность наличия хромосомных аномалий у исследуемого эмбриона.
Результат проведения предимплантационного генетического скрининга - -17, XX (анеуплоидный эмбрион).
Согласно полученным данным прогноз оценки вероятности наличия хромосомных аномалий в эмбрионах удовлетворительного и плохого качества при проведении программ ЭКО/ИКСИ + ПГС носит достоверный характер. Следовательно, способ прогнозирования наличия анеуплоидий в эмбрионах удовлетворительного и плохого качества с использованием оценки транскрипционного профиля в кумулюсных клетках может быть использован в клинико-лабораторной практике с целью минимизации экономических затрат в процессе лечения в программе ЭКО.
Список использованной литературы
1) Lifestyle factors and reproductive health: taking control of your fertility / R. Sharma [et al.] // Reprod Biol Endocrinol. - 2013. - Vol. 16, №11. - p. 66.
2) Краснощока, O.E. Возможности неинвазивной оценки состояния ооцита и эмбриона при проведении программ ВРТ по профилю экспрессии мРНК факторов роста в фолликулярной жидкости / О.Е. Краснощока, В.Ю. Смольникова, Е.А. Калинина // Журнал Акушерство и Гинекология. - 2014. - №9. - С. 36-43.
3) Correlation between aneuploidy, standard morphology evaluation and morphokinetic development in 1730 biopsied blastocysts: a consecutive case series study / M.G. Minasi [et al.] // Hum Reprod. - 2016. - Vol. 31, №10. - C. 2245-2254.
4) Morphokinetic analysis of cleavage stage embryos and its relationship to aneuploidy in a retrospective time-lapse imaging study / M. Chawla [et al.] // J Assist Reprod Genet. - 2015. - Vol. 32, №1. - C. 69-75.
5) ESHRE PGD consortium best practice guidelines for organization of a PGD centre for PGD/preimplantation genetic screening. / G. Harton [et al.] // Hum. Reprod. - 2011. - Vol. 26, №1. - P. 14-24.
6) Effect of infertility, maternal age, and number of previous miscarriages on the outcome of preimplantation genetic diagnosis for idiopathic recurrent pregnancy loss. / J.G. Garrisi [et al.] // Fertil. Steril. - 2009. - Vol. 92, №1. -P. 288-295.
7) Blastocyst biopsy with comprehensive chromosome screening and fresh embryo transfer significantly increases in vitro fertilization implantation and delivery rates: A randomized controlled trial / R.T. Scott [et al.] // Fertil. Steril. - 2013. - Vol. 100, №3. - P. 697-703.
8) Transcriptomic Analysis and Meta-Analysis of Human Granulosa and Cumulus Cells. / T. Burnik-Papler [et al.] // PLoS One. - 2015. - Vol. 10, №8. - P. e0136473.
9) Human cumulus cell gene expression as a biomarker of pregnancy outcome after single embryo transfer. / K.M. Gebhardt [et al.] // Fertil. Steril. - 2011. -Vol. 96, №l. - P. 47-52.
10) Specific gene expression differences in cumulus cells as potential biomarkers of pregnancy. / T. Burnik-Papler [et al.] // Reprod. Biomed. Online. - 2015. - Vol. 30, №4. - P. 426-433.
11) Alteration of gene expression in human cumulus cells as a potential indicator of oocyte aneuploidy. / E. Fragouli [et al.] // Hum. Reprod. - 2012. - Vol. 27, №8. - P. 2559-2568.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОГНОЗИРОВАНИЯ АНЕУПЛОИДИИ ЭМБРИОНОВ В ПРОГРАММЕ ЭКСТРАКОРПОРАЛЬНОГО ОПЛОДОТВОРЕНИЯ У ЖЕНЩИН С ЭНДОМЕТРИОЗ-АССОЦИИРОВАННЫМ БЕСПЛОДИЕМ | 2020 |
|
RU2752783C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ НАСТУПЛЕНИЯ БЕРЕМЕННОСТИ В ПРОГРАММЕ ЭКСТРАКОРПОРАЛЬНОГО ОПЛОДОТВОРЕНИЯ ПРИ СЕЛЕКТИВНОМ ПЕРЕНОСЕ ЭМБРИОНОВ ПУТЕМ ОЦЕНКИ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКОГО ПРОФИЛЯ ГАМЕТ С ПОМОЩЬЮ ПЦР-РВ | 2014 |
|
RU2550965C1 |
| Способ генетического прогнозирования эффективности экстракорпорального оплодотворения при идиопатическом бесплодии по количеству копий рибосомных генов (генов, кодирующий рибосомную РНК) в геноме женщины | 2021 |
|
RU2768597C1 |
| Способ прогнозирования неразвивающейся беременности при нормальном кариотипе эмбриона | 2021 |
|
RU2766750C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ЭФФЕКТИВНОСТИ ПРОГРАММ ЭКО ПРИ ТРУБНО-ПЕРИТОНЕАЛЬНОМ БЕСПЛОДИИ, АССОЦИИРОВАННОМ С ХРОНИЧЕСКИМ ЭНДОМЕТРИТОМ | 2017 |
|
RU2677467C1 |
| Способ прогнозирования наступления беременности в программе экстракорпорального оплодотворения | 2016 |
|
RU2648839C1 |
| Метод биопсии клеток трофобласта при множественных клетках, не участвующих в компактизации на стадии бластоцисты в программах преимплантационного генетического скрининга эмбрионов человека | 2015 |
|
RU2613788C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ ЗИГОТЫ И/ИЛИ ЭМБРИОНА И КОМПОЗИЦИЯ ДЛЯ ДОБАВЛЕНИЯ В СРЕДУ КУЛЬТИВИРОВАНИЯ ЗИГОТ И/ИЛИ ЭМБРИОНОВ | 2005 |
|
RU2281778C1 |
| Способ диагностики хронического эндометрита в среднюю стадию фазы секреции | 2017 |
|
RU2642621C1 |
| СПОСОБ УПРАВЛЕНИЯ КАЧЕСТВОМ ООЦИТОВ И КОМПОЗИЦИЯ ДЛЯ ДОБАВЛЕНИЯ В СРЕДУ КУЛЬТИВИРОВАНИЯ ООЦИТОВ | 2005 |
|
RU2281777C1 |
Изобретение относится к области медицины и предназначено для прогнозирования наличия хромосомных аномалий в эмбрионах удовлетворительного и плохого качества в программе экстракорпорального оплодотворения (ЭКО). На основании анализа уровня экспрессии мРНК гена PFKP в кумулюсных клетках определяют вероятность наличия анеуплоидий в эмбрионах удовлетворительного и плохого качества по формуле. При значениях р выше 0,5 прогнозируют наличие хромосомных аномалий в данной группе эмбрионов. Изобретение обеспечивает создание модели предсказания наличия хромосомных аномалий в эмбрионах удовлетворительного и плохого качества на основании анализа транскрипционной активности в кумулюсных клетках у пациенток при лечении бесплодия в программе ЭКО. 1 табл., 3 пр.
Способ прогнозирования наличия хромосомных аномалий в эмбрионах удовлетворительного и плохого качества на основании оценки транскрипционного профиля в кумулюсных клетках в программе экстракорпорального оплодотворения, характеризующийся тем, что на основании анализа уровня экспрессии мРНК гена PFKP в кумулюсных клетках определяют вероятность наличия анеуплоидий в эмбрионах удовлетворительного и плохого качества по формуле:
p=exp(logit)/(1+exp(logit),
где logit=-2,59+0,48*PFKP,
где PFKP - уровень экспрессии мРНК гена PFKP;
р - искомая вероятность наличия анеуплоидий в эмбрионах удовлетворительного и плохого качества, и при значениях р выше 0,5 прогнозируют наличие хромосомных аномалий в данной группе эмбрионов.
| FRAGOULI E | |||
| et al | |||
| The transcriptome of follicular cells: biological insights and clinical implications for the treatment of infertility | |||
| Hum Reprod Update | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| КРАСНОЩОКА O.E | |||
| и др | |||
| Возможности неинвазивной оценки состояния ооцита и эмбриона при проведении программ ВРТ по профилю экспрессии мРНК факторов роста в фолликулярной жидкости | |||
| Акушерство и Гинекология | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| WO 2012108920 A1, 16.08.2012. | |||
Авторы
Даты
2018-06-15—Публикация
2017-05-31—Подача