Уровень техники
Настоящее изобретение относится к способу получения индан-1,3-дикарбоновой кислоты и ее производных, которые могут быть использованы в качестве промежуточных соединений для синтеза конденсированных с арилом азаполициклических соединений. Заявка на патент США № 09/514002, поданная 25 февраля 2000 г., описывает синтез выбранных промежуточных соединений, которые могут быть использованы для получения арилконденсированных азаполициклических соединений.
Синтез, состав и способы применения некоторых конденсированных с арилом азаполициклических соединений, проявляющих активность в качестве агентов для лечения неврологических и психических расстройств, описаны в патенте США № 6410550 В1. Вышеуказанная патентная заявка и патент приведены здесь в качестве ссылки во всей своей полноте.
Сущность изобретения
Настоящее изобретение относится к способу получения соединения формулы
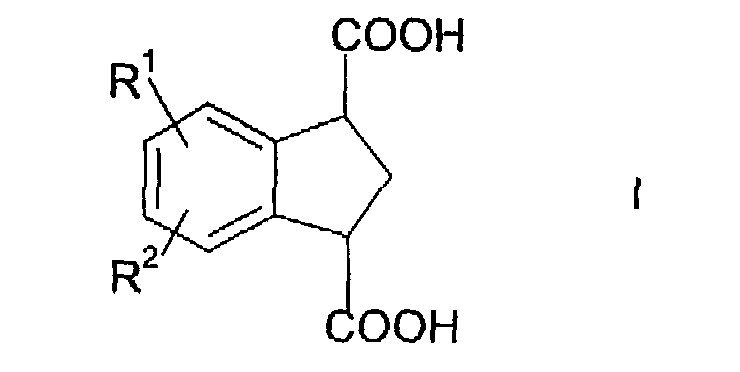
в которой R1 и R2 независимо выбраны из водорода, С1-С5 алкила, С1-С5 алкокси, трифторметила, галогена, сульфонилалкила, алкиламино, амида, сложного эфира, арилалкила, гетероалкила и арилалкокси. Соединения формулы I получают катализируемым кислотой или основанием гидролизом соединения, имеющего формулу
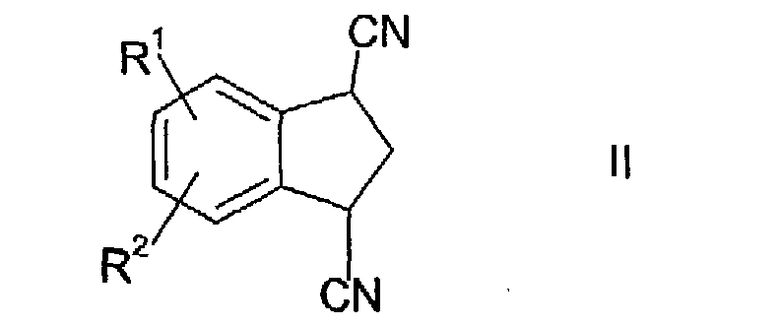
в которой R1 и R2 независимо выбраны из водорода, С1-С5 алкила, С1-С5 алкокси, трифторметила, галогена, сульфонилалкила, алкиламино, амида, сложного эфира, арилалкила, гетероалкила и арилалкокси.
Соединения формулы II могут быть получены гидрированием соединения формулы
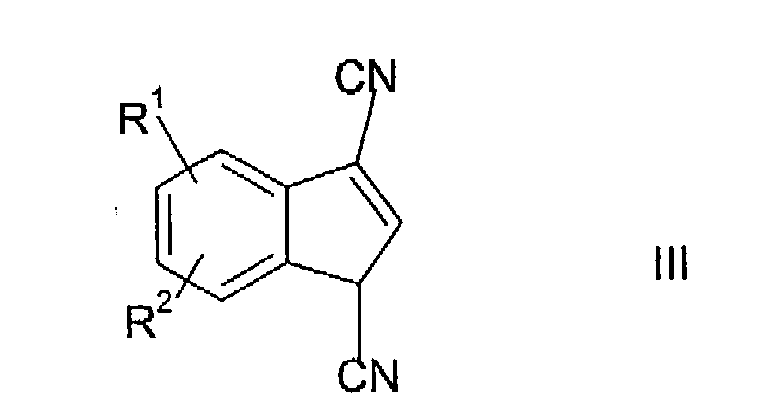
в которой R1 и R2 имеют указанные выше значения, в присутствии подходящего катализатора гидрирования.
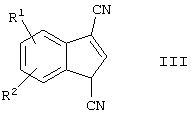
Соединения формулы III могут быть получены взаимодействием соединения формулы
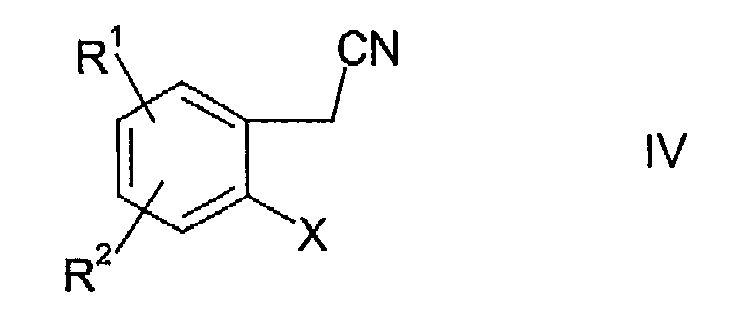
где R1 и R2 имеют указанные выше значения, а Х выбирают из группы, включающей хлор, бром и йод c 3-этоксиакрилонитрилом формулы
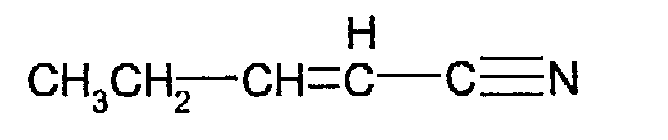
в присутствии ацетата палладия II, трициклогексилфосфина и основания в смешивающемся с водой растворителе.
Гидролиз индана II в соответствующую дикарбоновую кислоту осуществляют в присутствии кислотного или основного катализатора. Кислотный катализатор включает одну кислоту или смесь кислот. Подходящими кислотами являются ледяная уксусная кислота, концентрированная соляная кислота и серная кислота.
Катализатор предпочтительно представляет собой смесь ледяной уксусной кислоты и концентрированной соляной кислоты. Гидролиз осуществляют при температуре в интервале приблизительно от 25 до 100°С в течение приблизительно от 1 до 20 часов.
Температура предпочтительно составляет около 100°С в течение приблизительно 2 часов.
При осуществлении основного гидролиза период времени и температура почти такие же, как и при осуществлении кислотного гидролиза. Подходящие основные катализаторы включают алкоксиды металлов группы I, гидроксид натрия, гидроксид лития и гидроксид калия.
Как хорошо известно специалистам в данной области техники, в реакции гидролиза, как правило, используют соответствующее количество воды.
Гидрирование соединения III может быть осуществлено при давлении водорода, составляющем приблизительно от 14 до 50 фунтов на кв. дюйм. Давление предпочтительно составляет около 40 фунтов на кв. дюйм. Подходящие катализаторы гидрирования включают палладий на углероде, платину на углероде и никель Ренея. Предпочтительным катализатором является 5% палладий на углероде.
Синтез соединения формулы III осуществляют, вначале конденсируя соединение формулы IV с 3-этоксиакрилонитрилом с последующим замыканием кольца in situ путем нагревания. Реакцию осуществляют в присутствии ацетата палладия II, трициклогексилфосфина, основания и смешивающегося с водой растворителя.
В предпочтительном варианте соединение формулы I представляет собой индан-1,3-дикарбоновую кислоту.
Подробное описание изобретения
Настоящее изобретение относится к способу получения индан-1,3-дикарбоновой кислоты и ее производных в соответствии со схемой 1. На первой стадии процесса соединение формулы IV конденсируют с 3-этоксиакрилонитрилом в присутствии ацетата палладия II, трициклогексилфосфина и основания в смешивающемся с водой растворителе. Вначале получают промежуточный динитрил формулы IVa, но не выделяют его. При нагревании динитрил формулы IVa подвергают циклизации до соединения формулы III. Затем полученный индендинитрил (III) подвергают гидрированию до соответствующего соединения II индана. Гидролиз соединения формулы II в присутствии водной кислоты или основного катализатора приводит к получению дикарбоновой кислоты формулы I.
Схема 1
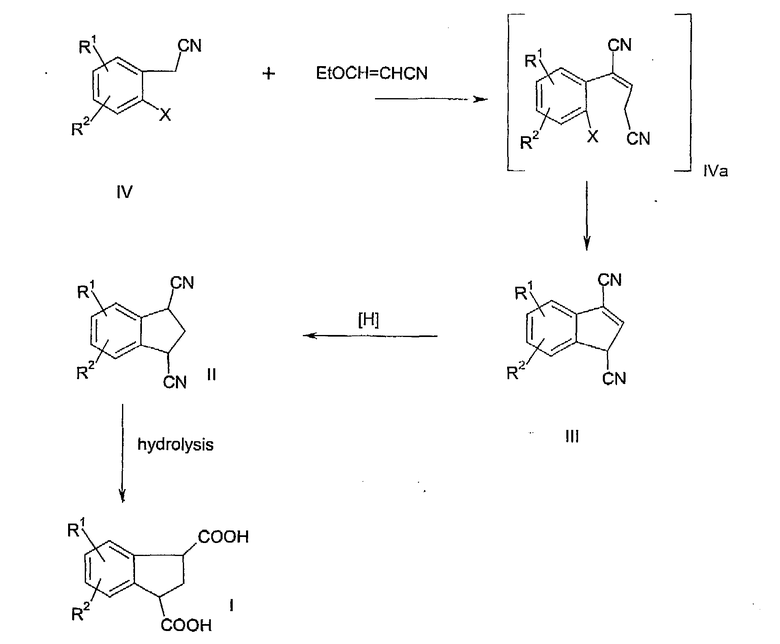
в которой R1 и R2 независимо выбраны из водорода, С1-С5 алкила, С1-С5 алкокси, трифторметила, галогена, сульфонилалкила, алкиламино, амида, сложного эфира, арилалкила, гетероалкила и арилалкокси.
Дикарбоновые кислоты в соответствии с настоящим изобретением представляют собой промежуточные соединения, которые могут быть использованы для синтеза некоторых конденсированных с арилом азаполициклических соединений формулы
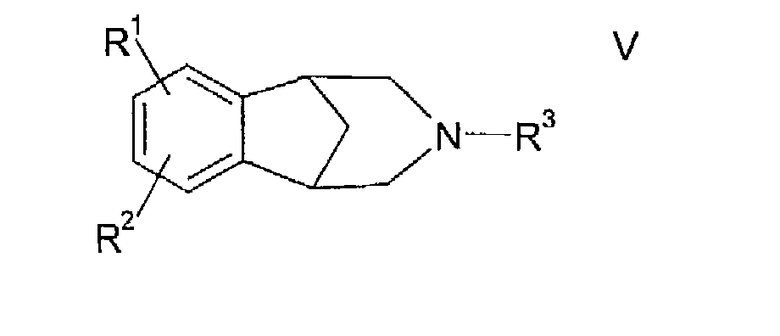
в которой R1 и R2 независимо выбраны из водорода, С1-С5 алкила, С1-С5 алкокси, трифторметила, галогена, сульфонилалкила, алкиламино, амида, сложного эфира, арилалкила, гетероалкила и арилалкокси, и в которой R3 представляет собой С1-С6 алкил. Они описаны в патенте США № 6410551 В1, приводимом здесь в качестве ссылки.
Описываемые здесь индан-1,3-дикарбоновые кислоты могут быть использованы в качестве промежуточных соединений для получения соединений формулы V в соответствии со стадиями реакции, представленными на схеме 2. Предложенный способ, обеспечивающий другой путь получения соединений формулы V, основан на последовательности реакций, описанных Mazzocchi,P.H., Med.Chem. Vol.22, no.4, 455 (1979).
Схема 2
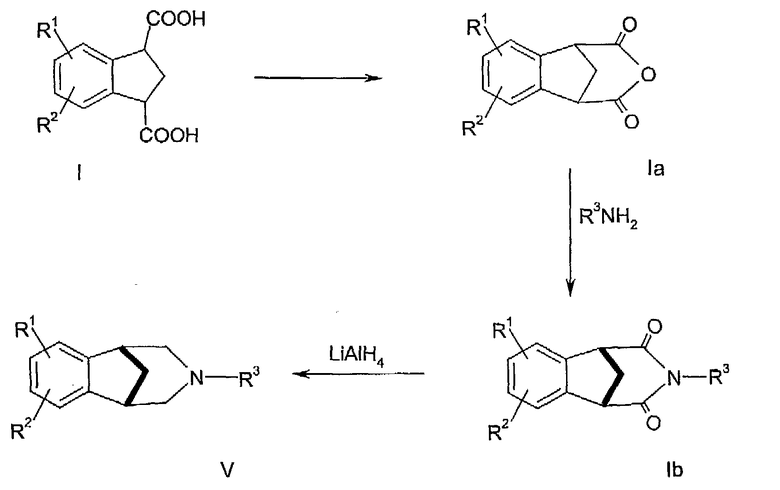
В соответствии со схемой 2, дикарбоновую кислоту, имеющую формулу I, подвергают циклизации до соответствующего ангидрида обрабатывая уксусным ангидридом при температуре 100°С. Ангидрид, имеющий формулу II, превращают в циклический имид III в концентрированном NH4OH. Затем имид III восстанавливают гидридом лития-алюминия до циклического амина формулы V.
Примерами конкретных соединений формулы V являются следующие соединения:
4-этинил-5-хлор-10-аза-трицикло[6,3,02,7]додека-2(7),3,5-триен;
3-трифторметил-10-аза-трицикло[6,3,02,7]додека-2(7),3,5-триен;
4,5-бистрифторметил-10-аза-трицикло[6,3,1,02,7]додека-2(7),3,5-триен;
4-хлор-5-трифторметил-10-аза-трицикло[6,3,1,02,7]додека-2(7),3,5-триен;
4-амино-10-аза-трицикло[6,3,1,02,7]додека-2(7),3,5-триен;
4-нитро-10-аза-трицикло[6,3,02,7]додека-2(7),3,5-триен;
4-метил-10-аза-трицикло[6,3,02,7]додека-2(7),3,5-триен;
4-фтор-10-аза-трицикло[6,3,02,7]додека-2(7),3,5-триен;
4-трифторметил-10-аза-трицикло[6,3,02,7]додека-2(7),3,5-триен;
4,5-дифтор-10-аза-трицикло[6,3,02,7]додека-2(7),3,5-триен; и их фармацевтически приемлемые соли.
Соединения формулы V связываются с сайтами нейронных никотиновых ацетилхолиновых специфических рецепторов и могут быть использованы для модулирования холинергической функции. Такие соединения могут быть использованы для лечения воспалительных заболеваний кишечника (включая, но не ограничиваясь следующими заболеваниями: язвенный колит, ганренозная пиодермия и болезнь Крона), синдрома раздраженного кишечника, спастической дистонии, хронической боли, острой боли, чревной спру, дивертикулит, вазоконстрикции, беспокойства, панического расстройства, депрессии, биполярного расстройства, аутизма, нарушения сна, расстройства циркадного ритма, бокового амиотрофического склероза (ALS), когнитивной дисфункции, гипертензии, булимии, анорексии, ожирения, сердечной аритмии, гиперсекреции желудочной кислоты, язв, феохромоцитомы, прогрессирующего надъядерного паралича, химических зависимостей и привыкания (например, зависимости или привыкания к никотину (и/или изделиям из табака), спирту, бензодиазепинам, барбитуратам, опиоидам или кокаину), головной боли, мигрени, удара, травмы головного мозга (TBI), обессивно-компульсивного расстройства (OCD), психоза, хореи Хантингтона, поздней дискинезии, гиперкинезии, дислексии, шизофрении, мультиинфарктной деменции, связанного с возрастом ухудшения познавательной функции, эпилепсии, включая малые эпилептические припадки, старческой деменции типа Альцгеймера (AD), болезни Паркинсона (PD), дефицита внимания, связанного с гиперактивностью (ADHD) и синдрома Туретта.
Соединения формулы V и их фармацевтически приемлемые соли (в дальнейшем называемые «активные соединения») могут быть введены пероральным, трансдермальным (например, при помощи пластыря), интраназальным, сублингвальным, ректальным, парентеральным или местным способом. Предпочтительным является трансдермальное и пероральное введение. Доза вводимых соединений наиболее желательно составляет приблизительно от 0,01 до 1500 мг в сутки, предпочтительно, приблизительно от 0,1 до 300 мг в сутки в виде разовых или разделенных доз, несмотря на неизбежные изменения в зависимости от массы и состояния подвергаемого лечению субъекта и конкретно выбранного способа введения. Однако наиболее желательной является дозировка в интервале приблизительно от 0,001 до 10 мг на кг массы тела в сутки. Тем не менее, возможны изменения в зависимости от массы и состояния подвергаемых лечению людей и их индивидуальной реакции на указанное лекарственное средство, а также от вида выбранного фармацевтического состава, периода времени и интервала, через который осуществляют введение. В некоторых случаях дозы ниже низшего предела указанного интервала могут оказаться более чем адекватными, в то время как в других случаях могут быть введены еще большие дозы, не вызывающие никакого вредного побочного действия, при условии, что такие большие дозы вначале делят на несколько небольших доз, вводимых в течение суток.
Активные соединения могут быть введены сами по себе, либо в сочетании с фармацевтически приемлемыми носителями или разбавителями любым из нескольких вышеуказанных способов. Более конкретно, активные соединения могут быть введены в виде самых различных лекарственных форм, например, они могут быть объединены с различными фармацевтически приемлемыми инертными носителями в виде таблеток, капсул, трансдермальных пластырей, лепешек, пастилок, леденцов, порошков, аэрозолей, кремов, мазей, суппозиториев, желе, гелей, паст, лосьонов, полутвердых препаратов, водных суспензий, растворов для инъекций, эликсиров, сиропов и т.п. Такие носители включают твердые разбавители или наполнители, стерильные водные среды и различные нетоксичные органические растворители. В целом, активные соединения присутствуют в таких лекарственных формах в количестве приблизительно от 5,0 до 70 мас.%.
Таблетки, предназначенные для перорального введения, могут содержать различные формообразующие вещества, разрыхлители, смазывающие агенты и наполнители. Водные суспензии, предназначенные для перорального введения, могут быть объединены с ароматизаторами, красителями и разбавителями.
Раствор активного соединения, предназначенный для парентерального введения, может быть соответствующим образом забуферен и разбавлен растительным маслом или пропиленгликолем.
Следующие примеры предназначены для дальнейшей иллюстрации и не предназначены для ограничения объема заявленного изобретения.
Пример 1
Инден-1,3-дикарбонитрил
В высушенную пламенем трехгорлую колбу помещают ацетат палладия II (0,175 г, 0,78 ммол) и трициклогексилфосфин (0,328 г, 1,17 ммол). Продувают азотом в течение получаса, затем добавляют 20 мл безводного ТГФ и перемешивают в течение еще 30 минут. Охлаждают до 0°С, затем медленно добавляют трет-бутоксид натрия (9,41 г, 96,5 ммол) и перемешивают в течение часа при температуре 0°С. Воронку заполняют раствором 2-бромбензолцианида (5,06 мл, 39 ммол), 3-этоксиакрилонитрила (4,01 мл, 30 ммол) и 5 мл безводного ТГФ. Очень медленно, по каплям полученный раствор добавляют к раствору палладия. Перемешивают в течение 30 минут при комнатной температуре.
Раствор нагревают на масляной бане до 70°С. Когда температура раствора достигнет 45°С, происходит экзотермическая реакция. Ожидают окончания кипения. Нагревание продолжают до 70°С. Реакция завершается в течение 30 минут. Охлаждают до комнатной температуры.
Добавляют 75 мл воды и 75 мл CH2Cl2. Органический слой отделяют, а водный слой промывают дополнительно 25 мл CH2Cl2. Водным раствором HCl (5M) понижают pH водного слоя до 1. Водный раствор экстрагируют 4х30 мл EtOAc и объединенный экстракт промывают насыщенным солевым раствором. Сушат MgSO4, фильтруют через целит и концентрируют при пониженном давлении, получая коричневую твердую фракцию (13,8 г). В результате перекристаллизации из MeOH получают порошок бежевато-белого цвета (7,062 г, 54,5%).
Анал. Вычислено для C11H6N2: C, 79,44; H, 3,61; N, 16,85. Найдено C, 79,41; Н, 3,61, N, 16,60
Анализ спектров 1Н ЯМР
ПРИМЕР 2
Индан-1,3-дикарбонитрил
В колбу Парра, содержащую Pd/C (10 мас.%), добавляют 1 (5,00 г, 30,08 ммол) и 200 мл EtOAc. Продувают N2 и H2 и подвергают гидрированию под давлением H2, составляющим 40 фунтов на кв. дюйм, при комнатной температуре. Реакция завершается в течение 2 часов. Раствор фильтруют через целит и концентрируют при пониженном давлении, получая коричневую твердую фракцию (5,63 г, 111,2%). В результате перекристаллизации получают бело-розовую твердую фракцию (2,56 г, 50,59%). Фильтрат концентрируют при пониженном давлении и коричневую фракцию вновь подвергают перекристаллизации, получая розово-белую твердую фракцию (0,576 г, 11,38% из общих 61,97%).
Анал. Вычислено для C11H8N2: C, 78,55; H, 4,79; N, 16,66. Найдено C, 78,55; H, 4,55, N, 16,37.
Анализ спектров 1Н ЯМР
8,502
ПРИМЕР 3
Индан-1,3-дикарбоновая кислота
В круглодонную колбу помещают 2 (1,50 г, 9,03 ммол) с ледяной уксусной кислотой (7,5 мл) и концентрированной соляной кислотой (7,5 мл). Нагревают до 100°С. Через 2 часа реакционную смесь охлаждают до комнатной температуры и разбавляют 50 мл воды. Водный слой экстрагируют EtOAc (30,2х20 мл). Органический слой экстрагируют насыщенным раствором бикарбоната (5х30 мл). рН понижают до 1, применяя HCl (5М), и экстрагируют EtOAc (30,2х20 мл). Промывают насыщенным солевым раствором, сушат и концентрируют при пониженном давлении, получая желтую твердую фракцию (1,23 г, 66,1%). Суспендируют желтую твердую фракцию (1,23 г) в 50 мл горячего ксилола (98°С) в течение 2 часов. Охлаждают до 0°С, фильтруют и промывают гексаном, получая бело-желтую твердую фракцию (1,03 г, 55,3%).
Анал. Вычислено для C11H6О4: C, 65,03; H, 3,47; N, 0,0. Найдено C, 6386; H, 4,69, N, 0,37.
Анализ спектров 1Н ЯМР
Изобретение относится к усовершенствованному способу получения индан-1,3-дикарбоновой кислоты, имеющей формулу
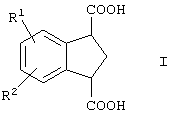
в которой R1 и R2 представляют собой водород, включающему гидролиз соединения формулы
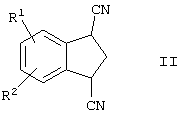
в которой R1 и R2 представляют собой водород, в присутствии кислотного или основного катализатора. Полученное соединение представляет собой промежуточное соединение, которое может быть использовано для синтеза арилконденсированных азаполициклических соединений, применяемых в качестве агентов для лечения неврологических и психических расстройств. 8 з.п. ф-лы.
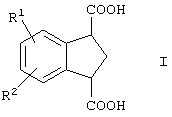
в которой R1 и R2 представляют собой водород,
включающий гидролиз соединения формулы
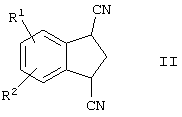
в которой R1и R2 представляют собой водород,
в присутствии кислотного или основного катализатора.
в котором R1 и R2 представляют собой водород,
с водородом в присутствии катализатора гидрирования.
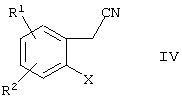
в котором R1 и R2 представляют собой водород, а Х выбирают из группы, включающей хлор, бром и йод,
с 3-этоксиакрилонитрилом в присутствии катализатора, включающего трициклогексилфосфин, ацетат палладия II и основание в смешивающемся с водой органическом растворителе.
| JP 2001114724 A, 24.04.2001 | |||
| P.H.MAZZOCCHI et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Med | |||
| Chem., vol.22, n.4, 1979, pp.455-457 | |||
| Способ получения ароматических кислот и амидов алифатических кислот | 1955 |
|
SU105839A1 |
Авторы
Даты
2006-08-27—Публикация
2003-11-07—Подача